 С)
С)
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень незначительных количествах), в воздухе (азот и кислород) , в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Многообразие неметаллов породило многообразие способов их получения, так водород получают, как лабораторными способами, например, взаимодействием металлов с кислотами (1), так и промышленными способами, например, конверсией метана (2).
Zn +2HCl = ZnCl2 + h3 ↑
Ch5 + h3O = CO + 3h3 ↑ (температура 900  С)
С)
Получение галогенов осуществляют в основном, путем окисления галогеноводородных кислот:
MnO2 +4HCl = MnCl2 + Cl2↑ + 2h3O
K2Cr2O7 +14HCl= 3Cl2↑ + 2KCl +2CrCl3 +7h3O
2KMnO4 +16HCl = 2 MnCl2 +5Cl2↑ +8h3O+ 2KCl
Для получения кислорода используют реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 +O2↑
4K2Cr2O7 = 4K2CrO4 +2Cr2O3 +3O2↑
Серу получают неполным окислением сероводорода (1) или по реакции Вакенродера (2):
h3S + O2 =2S +2h3O (1)
2h3S + SO2 =3S↓ +2h3O (2)
Для получения азота используют реакцию разложения нитрита аммония:
NaNO2 +Nh5Cl = N2↑ + NaCl +2h3O
Основной способ получения фосфора – из фосфата кальция:
Ca3(PO4)2 +3SiO2+5C = 3CaSiO3 +5CO +2P
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
2Na + Cl2 = 2NaCl
Fe + S = FeS
6Li + N2 = 2Li3N
2Ca + O2 = 2CaO
— взаимодействие с другими неметаллами
3h3+ N2= 2Nh4
h3+ Br2= 2HBr
S + O2= SO2
4P + 5O2= 2P2O5
2F2+ O2= 2OF2
S + 3F2= SF6,
C + 2Cl2= CCl4
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
ru.solverbook.com
Тема № 3. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
План
1. Основные химические свойства неметаллов.
2.Оксиды неметаллических элементов.
3.Распространение неметаллических элементов в природе.
4.Применение неметаллов.
1. Основные химические свойства неметаллов
Неметаллы (за исключением инертных газов) химически активные вещества.
В реакциях с металлами атомы неметаллических элементов присоединяют электроны, а в реакциях с неметаллами образуют совместные электронные пары.
Узнать, к какому атому смещаются общие электронные пары, помогает ряд электроотрицательности:
F, O, N, Cl, Br, I, S, C, Se, H, P, As, B, Si
→
электроотрицательность уменьшается
2Mg + O2 = 2MgO (магний оксид)
6Li + N2 = 2Li3N (литий нитрид)
2Al + 3Cl2 = 2AlCl3 (алюминий хлорид)
Ca + h3 = Cah3 (кальций гидрид)
Fe + S = FeS (ферум (II) сульфид)
При взаимодействии неметаллов с металлами образуются бинарные соединения с ионной химической связью.
2. Взаимодействие неметаллов с кислородом:
С + О2 = СО2 (карбон (IV) оксид)
S + O2 = SO2 (cульфур (IV) оксид)
Продуктами взаимодействия неметаллов с кислородом являются бинарные соединения с ковалентной полярной связью оксиды, в которых кислород имеет степень окисления - 2.
3. Взаимодействие неметаллов с водородом:
h3 + Cl2 = 2HCl (гидроген хлорид или хлороводород)
h3 + S = h3S (гидроген сульфид или сероводород)
При взаимодействии неметаллов с водородом образуются летучие (газообразные или жидкие) бинарные соединения с ковалентной полярной связью.
4. Взаимодействие неметаллов с другими неметаллами:
С + 2S = CS2 (карбон (IV) сульфид)
Si + 2Cl2 = SiCl4 (силиций (IV) хлорид)
Продуктами взаимодействия двух неметаллов являются вещества с различным агрегатным состоянием, которые имеют ковалентный тип химической связи.
Оксиды неметаллических элементов делят на:
а) солеобразующие (их большинство) и
б) несолеобразующие (СО, NO, N2O, h3O).
Среди оксидов есть газообразные вещества (СО, СО2, SO2), твердые вещества (Р2О5), жидкости (h3O, Сl2O7).
Во всех без исключения оксидах атомы неметаллических элементов, соединенные с Оксигеном, имеют положительные степени окисления.
Большинство оксидов неметаллических элементов кислотные. Они взаимодействуют:
Неметаллы более распространены в природе, чем металлы.
В состав воздуха входят: азот, кислород, инертные газы.
Месторождения самородной серы в Прикарпатье одни из крупнейших в мире.
Промышленным месторождением графита в Украине является Завальевское месторождение, сырье которого использует Мариупольский графитовый комбинат.
В Житомирской области, на Волыни обнаружены залежи пород, которые могут содержать алмазы, однако промышленные месторождения пока еще не открыты.
Атомы неметаллических элементов образуют различные сложные вещества, среди которых доминируют оксиды, соли.
Кислород:
- процессы дыхания,
- горение,
- обмен веществ и энергии,
- производство металлов.
Водород:
- производство аммиака,
- хлоридной кислоты,
- метанола,
- превращение жидких жиров в твердые,
- сварка и резка тугоплавких металлов,
- восстановление металлов из руд.
Сера:
- получение сульфатной кислоты,
- изготовление резины из каучука,
- производство спичек,
- черного пороха,
- изготовление лекарственных препаратов.
Бор:
- составляющая нейтронопоглощающих материалов ядерных реакторов,
- защита поверхностей стальных изделий от коррозии,
- в полупроводниковой технике,
- изготовление преобразователей тепловой энергии в электрическую.
Азот:
- газообразный:
- для производства аммиака,
- для создания инертной среды при сварке металлов,
- в вакуумных установках,
- электрических лампах,
- жидкий :
- в качестве хладагента в морозильных установках,
- медицине.
Фосфор:
- белый - для производства красного фосфора,
- красный - для производства спичек.
Кремний:
- в электронике и электротехнике для изготовления:
- схем,
- диодов,
- транзисторов,
- фотоэлементов,
- для изготовления сплавов.
Хлор:
- производство хлоридной кислоты,
- органических растворителей,
- лекарств,
- мономеров для производства пластмасс,
- отбеливателей,
- как дезинфицирующее средство.
Углерод:
- алмаз:
- изготовление инструментов для бурения и резки,
- абразивный материал,
- ювелирные украшения,
- графит:
- литейное, металлургическое, радиотехническое производство,
- изготовление аккумуляторов,
- в нефтегазодобывающей промышленности для буровых работ,
- изготовление антикоррозионных покрытий,
- замазок, уменьшающих силу трения,
- адсорбция.
Адсорбция способность некоторых веществ (в частности углерода) удерживать на своей поверхности частицы других веществ (газа или растворенного вещества).
На адсорбционной способности углерода базируется его использование в медицине в лечебных целях это таблетки или капсулы активированного угля. Их применяют внутрь при отравлении.
Чтобы вернуть адсорбенту способность к адсорбции и изъять адсорбированное вещество, достаточно нагрева.
Адсорбционную способность углерода использовал М.Д. Зелинский в изобретенном им в 1915 угольном противогазе средстве индивидуальной защиты органов дыхания, лица и глаз человека от воздействия вредных веществ. В 1916 было налажено промышленный выпуск противогазов, что спасло жизнь сотен тысяч солдат во время Первой мировой войны. Усовершенствованный противогаз применяется и сейчас.
Домашнее задание
Напишите реакции взаимодействия: а) кремния с кислородом; б) кремния с водородом; в) цинка с хлором; г) фосфора с хлором. Назовите полученные соединения.
refleader.ru
Тема: Неметаллы и их соединения в окружающей среде. Природные ресурсы неметаллов в Казахстане. Современные материалы и вещества на основе неметаллов и их соединений. Значение и нахождение соединения неметаллов в живой и неживой природе. Жидкие кристаллы. Понятие о нанохимии. Демонстрация № 2 (2,6)
Класс:9 «Б»
Дата:
Цели:
изучить положение неметаллов в ПС;
изучить особенности строения атомов неметаллов;
рассмотреть ЭО как меру «неметалличности»;
рассмотреть относительность понятий «металл-неметалл»;
изучить водородные соединения неметаллов.
развивать умение делать самостоятельные выводы.
воспитывать культуру умственного труда;
воспитывать дисциплинированность и чувство ответственности.
Оборудование и реактивы: образцы неметаллов - простых веществ
Тип урока: урок усвоения новых знаний.
Ход работы:
I. Организационный момент.
II. Актуализация знаний.
Ответьте на вопросы:
III. Изучение
1. Положение неметаллов в ПС
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат. Самым активным является фтор.
2. Особенности строения атомов неметаллов.
Во внешнем электронном слое атомов неметаллов находится от трёх до восьми электронов.

Для атомов неметаллов, по сравнению с атомами металлов характерны:
меньший атомный радиус;
четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
3. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
газы – h3, O2, O3, N2, F2, Cl2;
жидкость – Br2;
твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
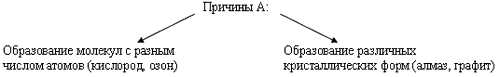
4. Сообщения.
5. Физические свойства неметаллов.
Ковкость отсутствует
Блеска нет
Теплопроводность (только графит)
Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
Электропроводность (только графит и черный Фосфор.)
Агрегатное состояние:
газообразное(h3, O2, Cl2 ,F2, O3)
твердое (Р, С)
жидкое (Br2)
6. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
7. Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.
Летучие водородные соединения неметаллов можно разделить на три группы:1) Хорошо растворимые в воде (HCl, HBr, HJ, h3S, h3Se, Nh4), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
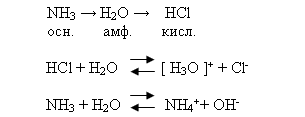
2) Соединения, разлагаемые водой:
Bh4 + 3h3O = h4BO3 + 3h3↑
3) Летучие водородные соединения
Ch5, Ph4, которые не взаимодействуют с водой.
По периоду в ПС химических элементов с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
Sih5 → Ph4 → h3S → HCl
Выводы:
Элементы-неметаллы расположены в главных подгруппах III–VIII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
На внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
IV. Закрепление изученного. Рефлексия.
1) Вставьте слова, пропущенные в тексте.Атомы ____ в отличие от атомов ____ легко принимают наружные электроны, являются ____
2) Вставьте слова , пропущенные в тексте.Неметаллические свойства элементов с увеличением порядкового номера в периодах ____В группах неметаллические свойства элементов ____
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
V. Оценки и домашнее задание.
infourok.ru
Неметаллы – это элементы, значительно отличающиеся физическими и химическими свойствами от металлов. Подробно объяснить причину их различий смогли только в конце XIX века, после открытия электронного строения атома. В чем же особенность неметаллов? Какие качества характерны дня них? Давайте разберемся.
Подход к разделению элементов на металлы и неметаллы давно существует в научной среде. К первым в периодической таблице Менделеева обычно относят 94 элемента. Неметаллы Менделеева включают 22 элемента. В периодической системе они занимают верхний правый угол.
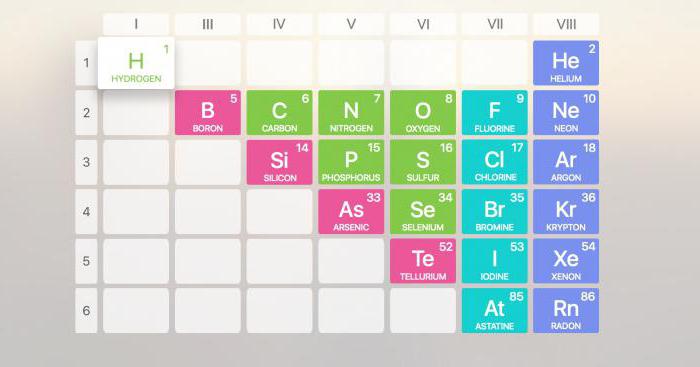
В свободном виде неметаллы – это простые вещества, главной чертой которых является отсутствие характерных металлических свойств. Они могут находиться во всех агрегатных состояниях. Так, йод, фосфор, сера, углерод встречаются в виде твердых веществ. Газообразное состояние характерно для кислорода, азота, фтора и т. д. Жидкостью является только бром.
В природе элементы неметаллы могут существовать как в виде простых веществ, так и в виде соединений. В несвязанном виде встречаются сера, азот, кислород. В соединениях они образуют бораты, фосфаты и т. д. В таком виде они присутствуют в минералах, воде, горных породах.
Неметаллы – это элементы, отличающиеся от металлов внешним видом, строением и химическими свойствами. Они обладают большим числом неспаренных электронов на внешнем уровне, а значит, более активны в окислительных реакциях и легче присоединяют к себе дополнительные электроны.
Характерное различие между элементами наблюдается в строении кристаллической решетки. У металлов она металлическая. У неметаллов она может быть двух видов: атомная и молекулярная. Атомная решетка придает веществам твердость и повышает температуру плавления, она свойственна кремнию, бору, германию. Молекулярной решеткой обладают хлор, сера, кислород. Она придает им летучесть и небольшую твердость.
Внутреннее строение элементов определяет их физические свойства. Металлы имеют характерный блеск, хорошую проводимость тока и тепла. Они твердые, пластичные, поддаются ковке, имеют небольшой цветовой диапазон (черный, оттенки серого, иногда желтоватый цвет).
Неметаллы – это жидкие, газообразные или твердые вещества, не обладающие блеском и ковкостью. Их цвета сильно варьируются и могут быть красными, черными, серыми, желтыми и т. д. Почти все неметаллы плохо проводят ток (кроме углерода) и тепло (кроме черного фосфора и углерода).

В химических реакциях неметаллы могут исполнять роль как окислителей, так и восстановителей. При взаимодействии с металлами они принимают на себя электроны, проявляя таким образом окислительные свойства.
Взаимодействуя с другими неметаллами, они ведут себя по-разному. В таких реакциях менее электроотрицательный элемент проявляет себя как восстановитель, более электроотрицательный выступает окислителем.
С кислородом почти все (кроме фтора) неметаллы проявляют себя восстановителями. При взаимодействии с водородом многие являются окислителями, образуя впоследствии летучие соединения.
Часть элементов неметаллов обладает способностью образовывать несколько простых веществ или модификаций. Это явление называется аллотропией. Например, углерод существует в форме графита, алмаза, карбина и других модификаций. У кислорода их две – озон и собственно кислород. Фосфор бывает красный, черный, белый и металлический.

В разном количестве неметаллы находятся повсюду. Они входят в состав земной коры, являются частью атмосферы, гидросферы, присутствуют во Вселенной и в живых организмах. В космическом пространстве самыми распространенными являются водород и гелий.
В пределах Земли ситуация совсем иная. Наиболее важные составляющие земной коры – кислород и кремний. Они составляют больше 75 % от её массы. А вот наименьшее количество приходится на йод и бром.
В составе морской воды на кислород приходится 85,80 %, а на водород – 10,67 %. Её состав также включает хлор, серу, бор, бром, углерод, фтор и кремний. В составе атмосферы первенство принадлежит азоту (78 %) и кислороду (21 %).

Неметаллы, такие как углерод, водород, фосфор, сера, кислород и азот, представляют собой важные органические вещества. Они поддерживают жизненную активность всех живых существ на нашей планете, в том числе и людей.
fb.ru