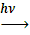 ;Б) С6 Н6 + Вr2
;Б) С6 Н6 + Вr2 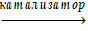 ;В) С6 Н12 + Вr2
;В) С6 Н12 + Вr2 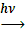 ;Г) С7Н8 + Вr2
;Г) С7Н8 + Вr2 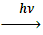 ;
;Контрольная работа
по теме «Основные классы неорганических соединений»Вариант 1
1. К кислотам относится каждое из 2-х веществ:а) h3S, Na2CO3 б) K2SO4, Na2SO4 в) h4PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) сера в) кальций г) магний
6. К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
7. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Формулы веществ | Продукты взаимодействия |
| а) Mg + HCl → | 1) MgCl2 |
| б) Mg(OH)2 + CO2 → | 2) MgCl2 + h3 |
| в) Mg(OH)2 + HCl → | 3) MgCl2 + h3O |
| 4) MgCO3 + h3 | |
| 5) MgCO3 + h3O |
9. Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
б) S → SO2 → SO3 → h3SO4 → ZnSO4
Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Вариант 2
1. К основаниям относится каждое из 2-х веществ:а) h3O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Формулы веществ | Продукты взаимодействия |
| а) Fe + HCl → | 1) FeCl2 |
| б) Fe(OH)2 + CO2 → | 2) FeCl2 + h3 |
| в) Fe(OH)2 + HCl → | 3) FeCl2 + h3O |
| 4) FeCO3 + h3 | |
| 5) FeCO3 + h3O |
9. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
б) C → CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Таблица ответов.
| 1 вариант | 2 вариант |
| 1 в | 1б |
| 2 б | 2 г |
| 3 а | 3 в |
| 4 б | 4 в |
| 5 б | 5 г |
| 6 в | 6 а |
| 7 а | 7 г |
| 8 - 253 | 8 - 253 |
| 10- 87 г | 10 – 46,6 г |
kopilkaurokov.ru
Контрольные работы по химии 8-12 класс вечерней школы (авторы Рудзитис Г.Е., Фельдман Ф.Г.)
8 класс. Контрольная работа № 1 по теме «Первоначальные химические понятия»
1. Речь идет о простом веществе кислород:А) кислород входит в состав оксидов;Б) в молекуле оксида фосфора(V) содержится пять атомов кислорода;В) кислород поддерживает горение;Г) в земной коре содержится 49% кислорода.
2. К химическим явлениям относятся: А) приготовление пищи Б) падение предмета с высоты В) горение бумаги Г) таяние льда
3. Какие из признаков характерны для химических реакций? А) изменение цвета Б) растворение вещества в воде В) образование осадка Г) электропроводность
4. К чистым веществам относятся А) соль, растворенная в воде Б) золото В) минерал кварц Г) сера
5. Наименьшую относительную атомную массу имеет: А) калий Б) водород В) азот Г) магний
6. Выберите формулу оксида:А) NO2;Б) HNO3;В) h3S;Г) K2SO4.
7. Водород собирают способом вытеснения:А) воздуха, держа сосуд вверх дном;Б) воздуха, держа сосуд горизонтально;В) воды, держа сосуд вниз дном;Г) воздуха, держа сосуд вниз дном.
8. Воздух – это:А) газ; Б) смесь газов; В) азот и кислород; Г) смесь газов, водяного пара и пыли. 9.Наличие кислорода в сосуде можно доказать с помощью:
А) цвета газа Б) растворимости в воде В) по плотности Г) тлеющей лучинки
10. Формула оксида азота(II):А) N2O; Б) NO2; В) N2O5; Г) NO.
11. Какая валентность азота в соединении К3 NА) 1 Б) 2 В) 3 Г) 4
12. Какова массовая доля азота в оксиде азота (IV) А) 34 Б) 44 В) 54 Г) 14
13. У какого химического элемента относительная атомная масса большая А) кальция Б) серы В) фтора Г) кислорода
14. Какова молярная масса HNО3, равна (г\моль) А) 112 Б) 98 В) 63 Г) 100
15. Что такое валентность: А) валентность элемента – это способность его атома присоединять молекулы другого вещества Б) валентность элемента – это способность его атома присоединять определенное число атомов другого элемента В) валентность элемента – это способность его атома присоединять атомы других элементов Г) валентность элемента – это способность его атомов отдавать свои атомы другим элементам 16. Закон сохранения массы веществ открыл: А) Д.И. Менделеев Б) М.В. Ломоносов В) Дж. Дальтон Г) А. Авогадро
17. Верны ли следующие суждения о чистых веществах и смесях?
А. Молоко является смесью веществ. Б. Водопроводная вода является чистым веществом. 1) верно только а 3) верны оба суждения 2) верно только б 4) оба суждения неверны
18. Верны ли следующие суждения о способах разделения смесей? А. Железные опилки из смеси можно выделить магнитом. Б. Очистить воду от угольной пыли можно выпариванием. 1) верно только а 3) верны оба суждения 2) верно только б 4) оба суждения неверны
Ответы: 8 класс К.р. №1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
В
А
А;В
Б;Г
Б
А
А
Б
Г
Г
В
А
А
В
Б
Б
4
3
8 класс. Контрольная работа 2 по теме «Кислород. Горение. Водород. Растворы. Вода»
1. Речь идет о простом веществе кислород:А) кислород входит в состав оксидов;Б) в молекуле оксида фосфора(V) содержится пять атомов кислорода;В) кислород поддерживает горение;Г) в земной коре содержится 49% кислорода.
2. Выберите формулу оксида:А) NO2; Б) HNO3; В) h3S; Г) K2SO4.
3. Является реакцией горения:А) СuО + Н2 = Сu + Н2О;Б) Zn + 2HCl = ZnCl2 + h3;В) Zn + S = ZnS;Г) 4Р + 5О2 = 2Р2О5.
4. Кислород собирают способом вытеснения:А) воздуха, держа сосуд вверх дном;Б) воздуха, держа сосуд горизонтально;В) воды, держа сосуд вниз дном;Г) воздуха, держа сосуд вниз дном.
5. Коэффициентами уравнения... Аl + ... O2 = ... Al2O3 являются:А) 1, 2, 3;Б) 4, 2, 3;В) 4, 3, 2;Г) 3, 4, 1.
6. Воздух – это:А) газ;Б) смесь газов;В) азот и кислород;Г) смесь газов, водяного пара и пыли.
7. Массовая доля кислорода в оксиде серы(IV) SO2 равна:А) 0,6;Б) 0,5;В) 0,4;Г) 0,7.
8. Формула оксида азота(II):А) N2O;Б) NO2;В) N2O5;Г) NO.
9. При полном сгорании спирта С2Н5ОН образуются:А) СО2 и Н2; Б) С и Н2О; В) СО2 и Н2О; Г) СО и Н2.
10. Аллотропной модификацией кислорода является:А) азот;Б) озон;В) сера;Г) водород.
11. Экзотермическая реакция:А) СаСО3 = СаО + СО2;Б) СО2 + 394 кДж = С + О2;В) СН4 + 2О2 = СО2 + 2Н2О + 803 кДж;Г) 2Н2О = 2Н2 + О2.
12 Речь идет о простом веществе водород: А) входит в состав живых организмов;Б) водород восстанавливает металлы из их оксидов;В) в молекуле гидрида кальция содержится два атома водорода;Г) основной элемент Вселенной.
13. Самый легкий газ: А) NO;Б) Н2;В) СО2;Г) О2.
14. В лаборатории водород получают при взаимодействии соляной кислоты с: А) Pt;Б) Cu;В) Au;Г) Zn.
15. Когда водород собирают способом вытеснения воздуха, то сосуд держат: А) вверх дном;Б) вниз дном;В) горизонтально;Г) не имеет значения.
16. Относится к реакции восстановления: А) FeО + Н2 = Fe + Н2О;Б) Zn + Cl2 = ZnCl2;В) Zn + S = ZnS;Г) 4Р + 5О2 = 2Р2О5.
17. Выберите формулу гидрида калия: А) KOH;Б) КNO3;В) КH;Г) К2SO4.
Ответы: 8 класс К.р. №2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
В
А
Г
В
В
Б
Б
Г
В
Б
В
Г
Б
Г
А
А
В
8 класс. Контрольная работа 3 по теме «Важнейшие классы неорганических соединений»
1. Формулы только кислот приведены в ряду 1) НСl, NaCl, HNO3 2) h3SO3, h3SO4, h3S 3) Ca(OH)2, h4PO4, Ca 3(PO4)2 4) Na2O, NaNO3, HNO3 2. Формулы только щелочей приведены в ряду 1) Fe(OH)2, KOH, Ва(ОН)2 2) NaOH, Ca(OH)2, Cu(OH)2 3) KOH, NaOH, LiOH 4) Fe(OH)3, Cu(OH)2, NaOH 3. Оксид, который реагирует с гидроксидом натрия, образуя соль,— это 1) Fe2O3 2) К2О 3) SO3 4) BaO 4. Взаимодействие оксида с водой относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения 5. Взаимодействие гидроксида меди(II) с азотной кислотой относится к реакциям 1) соединения 2) разложения 3) замещения 4) обмена 6. Индикатор фенолфталеин в щелочной среде становится 1) бесцветным 2) малиновым 3) красным 4) желтым 7. Свойство, которое является общим для нерастворимых оснований и щелочей,— это 1) взаимодействие с кислотными оксидами 2) взаимодействие с кислотами 3) взаимодействие с солями 4) разложение 8. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит.
1) MgO 2) Н3РО4 3) Аl(ОН)3 4) NaOH
А. кислотыБ. щелочиВ. оксидыГ. нерастворимые основания
1
2
3
4
9. Установите соответствие между исходными веществами и продуктами химических реакций.
1) HgO + HNO32) Al + h3SO43) Na2O + CO2 + h3O4) K2O + h4PO4
A. Al2(SO4)3 + Н2 Б. K3РО4 + Н2О B. Hg(NO3)2+ Н2О Г. Na2CO3 + Н2О
1
2
3
4
10. Формулы только солей приведены в ряду 1) K2СО3, Н2СО3, KOH 2) АlСl3, Al(NO3)3, Al2S3 3) h3S, Ba(NO3)2, BaCl2 4) Cu(OH)2, CuSO4, CuS 11. Формулы только бескислородных кислот приведены в ряду 1) НСl, HNO3, h3S 2) h3SO3, h3S, HNO2 3) Н3РО4, Н2СО3, h3S 4) h3S, HF, HCl 12. Оксид, который реагирует с кислотой, образуя соль, — это 1) Р2О5 2) СuО 3) SO2 4) СО2 13. Получение оксида металла при нагревании гидроксида металла относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения 14. Химическая реакция, уравнение которой K2О + 2HNO3 = 2KNO3 + Н2О, относится к реакциям 1) разложения 2) соединения 3) обмена 4) замещения 15. В каком ряду все основания, формулы которых приведены, разлагаются при нагревании? 1) NaOH, Сr(ОН)2, Са(ОН)2 2) Fe(OH)3, Cu(OH)2, Fe(OH)2 3) Ва(ОН)2, Mg(OH)2, KOH 4) KOH, LiOH, Al(OH)3 16. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3 2) Cu(NO3)2 3) Al2(SO4)34) K2СО3
А. нитрат меди(П) Б. карбонат калия В. хлорид железа(III) Г. нитрит меди(II) Д. сульфат алюминия
1
2
3
4
Ответы: 8 класс К.р. №3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2
3
3
1
4
2
2
1В 2А 3Г 4Б
1В
2А
3Г
4Б
2
4
2
3
3
2
1В
2А
3Д
4Б
8 класс. Контрольная работа 4
по темам «Периодический закон. Химическая связь»
1.Порядковый номер элемента в Периодической системе определяется:
А. Зарядом ядра атома.
Б. Числом электронов в наружном слое атома.
В. Числом электронных слоев в атоме.
Г. Числом нейтронов в атоме. 2. Пара элементов, имеющих сходное строение внешнего энергетического уровня:
А. В и Si. Б. S и Se. В. К и Са. Г. Сr и Fe.
3. S-Элементом является:
А. Барий. Б. Америций. В. Галлий. Г. Ванадий.
4.Амфотерным гидроксидом является вещество, формула которого:
А. Ве(ОН)2. Б. Мg(ОН)2. В. Н2SiO3. Г. Ва(ОН)2.
5.Ряд элементов, расположенных в порядке усиления металлических свойств:
А. Sr — Rb — K. Б. Ве — Li — K. В. Na — K — Ca. Г. Al — Mg — Be.
6.Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А. Э2О. Б. Э2О3. В. ЭО2. Г. Э2О5.
7.Установите соответствие.
Элемент:
I. Бериллий. II. Натрий. III. Хлор. IV. Азот.
Электронная формула:
А. 1s22s2. Б. 1s22s22p3. В. 1s22s22p63s1. Г. 1s22s22p63s23p5.
8.Номер периода в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоев в атоме. Г. Числом электронов в атоме.
9. Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
А. Число протонов в атоме. Б. Число электронов в наружном слое атома.
В. Число электронных слоев в атоме. Г. Число нейтронов в атоме.
10. Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру:
А. Группы. Б. Периода. В. Ряда. Г. Порядковому.
11. f-Элементом является:
А. Германий. Б. Калий. В. Селен. Г. Уран.
12. У какого атома наибольший радиус
А. элемента № 12
Б. элемента №20
В. элемента № 38
Г. элемента №56
13.Какой из указанных металлов является более активным, чем железо?
А. натрий Б. золото В. серебро Г. медь
14.Типичному неметаллу соответствует схема распределения электронов по
электронным слоям:
А. 2,1 Б. 2,8,2 В. 2,8,7 Г. 2,8,1
15.Заряд ядра атома брома
А. +55 Б. +36 В. + 35 Г. + 30
16 Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера б) водород и азот в) калий и кислород г) кремний и водород
17. Атомную кристаллическую решётку имеет:
а) сода б) вода в) алмаз г) парафин
Ответы: 8 класс К.р. №4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
А
Б
А
А
Б
Г
1-А
2-В
3-Г
4-Б
В
Б
Г
Г
Г
А
В
В
В
В
Бланк ответов на контрольные работы по химии 8 класс
Ф.И. уч-ся
Ответы: 8 класс К.р. №1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
В
А
А;В
Б;Г
Б
А
А
Б
Г
Г
В
А
А
В
Б
Б
4
3
Ответы: 8 класс К.р. №2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
В
А
Г
В
В
Б
Б
Г
В
Б
В
Г
Б
Г
А
А
В
Ответы: 8 класс К.р. №3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2
3
3
1
4
2
2
1В 2А 3Г 4Б
1В
2А
3Г
4Б
2
4
2
3
3
2
1В
2А
3Д
4Б
Ответы: 8 класс К.р. №4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
А
Б
А
А
Б
Г
1-А
2-В
3-Г
4-Б
В
Б
Г
Г
Г
А
В
В
В
В
9 класс. Контрольная работа 1
по теме «Электролитическая диссоциация»
1. Среди следующих веществ неэлектролитом является:
А) соляная кислота
Б) гидроксид натрия (раствор)
В) углекислый газ
Г) хлорид натрия (раствор)
2. Вещества, которые при диссоциации в водном растворе образуют в качестве катионов только ионы водорода Н является:
А) средними солями
Б) кислыми солями
В) щелочами
Г) кислотами
3. Реакция между какими электролитами идет до конца в результате образования осадка?
А) гидроксид калия и нитрат натрия
Б) карбонат натрия и соляная кислота
В) нитрат меди (II) и гидроксид натрия
Г) гидроксид меди (II) и серная кислота
4. Суммы всех коэффициентов в полном ионном и сокращенном ионном уравнениях реакции хлорида меди (II) с гидроксидом калия соответственно равны:
А) 10 ; 3
Б) 12 ; 3
В) 10 ; 4
Г) 12 ; 4
5. В уравнении реакции взаимодействия цинка с соляной кислотой коэффициент перед формулой восстановителя равен:
А) 1 Б) 3
В) 2 Г) 4
6. Сколько различных средних солей можно получить, если имеются следующие вещества: гидроксид бария, серная кислота, карбонат бария, оксид бария?
А) 1 Б)2 В)3 Г)4
7. Слабым электролитом является:
А) гидроксид натрия
Б) соляная кислота
В) дистиллированная вода
Г) раствор хлорид натрия 8. Между какими веществами возможна реакция ионного обмена с выделением газа?
А) h3SO4 и Ca3(PO4)2
Б) Al2(SO4)3 и BaCl2
В) Na2CO3 и HCl
Г) HNO3 и KOH
9. Суммы всех коэффициентов в полном ионном и сокращенном ионном уравнениях реакции между хлоридом меди (II) и нитратом серебра соответственно равны:
А) 10 ; 3
Б) 10 ; 6
В) 12 ; 3
Г) 12 ; 6
10. Укажите коэффициент перед формулой восстановителя в уравнении реакции:
HCl + Al → AlCl3 + h3↑
А) 1 Б) 2
В) 3 Г) 4 11. Карбонат кальция можно получить реакцией ионного обмена при взаимодействии:
А) карбоната натрия и гидроксида кальция
Б) сульфата кальция с угольной кислотой
В) хлорида кальция с углекислым газом Г) кальция с оксидом углерода (IV)
12. Электролитом является:А) кислород; Б) дистиллированная вода; В) соляная кислота; Г) оксид серы(VI).13. Какие вещества при диссоциации образуют катионы металла? А) кислоты; Б) оксиды; В) соли; Г) основания.
14. С какими из веществ будет взаимодействовать соляная кислота?А) СО2; Б) Ва(ОН)2; В) K2SO4; Г) К2СО3.
15. C какими из веществ будет взаимодействовать с гидроксид натрия: А) KNO3; Б) НNО3; В) СuCl2; Г) СaO?16. Какие из веществ при диссоциации образуют ион ОН–? а)Bа(ОН)2; б) Zn(OH)2; в) НClO; г) KOН.
17. Какому молекулярному уравнению соответствует сокращенное ионное: Al+ + 3OH– = Al(OH)3 ?А) Al2O3 + НСl ... ;Б) Al2O3 + Н2O ... ;В) АlPO4 + КОН ... ;Г) АlCl3 + КОН ... .
Ответы: 9 класс К.р. №1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
В
Г
Г
Г
А
В
В
В
Г
Б
А
В
Г
Б;Г
Б;В
А;Г
Г
9 класс. Контрольная работа 2
по теме «Неметаллы»
1. Электронная формула атома фосфора: А) 1s22s22p4 Б) 1s22s22p6 В) 1s2 2s22p3 Г)1s22s22p63s23p3 2. Определите вещество, с которым оксид серы (VI) не будет взаимодействовать. А) гидроксид кальция Б) оксид бария В) вода Г) оксид углерода (IV) 3. Выберите формулу аммиака: А) N2 Б) NO2 В) Nh4 Г) HNO3 4. Какое вещество называется “бурый газ”: А) NO Б) Nh4 В) NO2 Г) N2 5. При взаимодействии растворов каких веществ образуется осадок А) LiNO3 и Na2CO3; Б) Al2(SO4)3 и K3PO4 В) Na2CO3 и НNO3; Г) AgNO3 и HF
6. Какова степень окисления азота в азотной кислоте? А) +1 Б) +3 В) + 4 Г) +5 7. Коэффициент перед формулой воды в уравнении реакции, схема которой: Nh4 + О2 = N2 + h3O равен: А) 2 Б) 7 В) 6 Г) 3 8. Гашеная известь имеет формулу: А) NaOH Б) KOH В) Ca(OH)2 Г) Al(OH)3
9. Укажите сумму коэффициентов в полном ионном уравнении реакции: Na2CO3 + h3SO4 А) 11 Б) 12 В) 13 Г) 14
10. Какое вещество называется “известковая вода”: А) CaO Б) CaCO3 В) Ca(OH)2 Г) Ca(HCO3)2 11. При взаимодействии растворов каких веществ образуется газ А) LiNO3 и Na2CO3; Б) Al2(SO4)3 и K3PO4 В) Na2CO3 и НNO3; Г) AgNO3 и HF 12. Какова степень окисления азота в аммиаке? А) -3 Б) +3 В)+ 4 Г) +5
13. Качественная реакция на барий- ион: А) HCl Б) KOН В) AgNO3 Г) Н2SO4
14. Символ элемента, образующегося простое вещество – неметалл:А) Br. Б) Mg. В) Fe. Г) Cu.15. Простое вещество сера взаимодействует с каждым из веществ группы:А) h3SO4, O2, h3O. В) O2, Mg, h3.Б) Ca, O2, NaOH. Г) h3O, N2, KOH.16. Ион СО32- можно обнаружить с помощью раствора, содержащего:А) Катион аммония. В) Гидроксид – ион.Б) Катион водорода. Г) Катион натрия.
Ответы: 9 класс К.р. №2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Г
Г
В
В
Б;В
Г
В
В
А
В
В
А
Г
А
В
Б
9 класс. Контрольная работа 3
по теме «Металлы и их соединения»
1. Электронная формула атома лития:
А. 1S 2 2S 2 Б. 1S22S1. B. 1S2 2S2 2p1. Г. 1S 2 2S 2 2p6 3S1. 2. Электронная формула внешнего энергетического уровня атомов
щелочных металлов:
А. ns 1. Б. ns 2. В. Ns 2 np1. Г. ns2 np2 3. Вид химической связи в простом веществе натрий:
А. Ионная Б. Ковалентная полярная
В. Ковалентная неполярная Г. Металлическая 4. Простое вещество с наиболее ярко выраженными металлическими
свойствами:
А. Алюминий. Б. Бор. В. Галлий. Г. Индий. 5. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически. Б. Не изменяется.
В. Увеличивается. Г. Уменьшается. 6. Атом кальция отличается от иона кальция:
А. Зарядом ядра. В. Числом протонов. Г. Числом нейтронов.
Б. Числом электронов на внешнем энергетическом уровне. 7. Наиболее энергично реагирует с водой:
А. Барий. Б. Кальций. В. Магний. Г. Стронций. 8. С соляной кислотой не взаимодействует:
А. Алюминий. Б. Магний. В. Серебро. Г. Цинк.
9. Гидроксид алюминия взаимодействует с веществом, формула которого:
А. BaSO4. Б. NaOH. B. KCl(p-p). Г. NaNO3 (p-p).
10. Ряд, в котором все вещества реагируют с железом:
А. HCl, CO2, CO. Б. Cl2, CuCl2, HCl.
B. h3, O2, CaO. Г. SiO2, HCl, S. 11. Сталь – это сплав: А. марганца с хлором, Б. никеля с кремнием, В. фосфора с серой, Г. железа с углеродом. 12. Реагирует с водой при комнатной температуре: А. железо, Б. цинк, В. медь, Г. кальций. 13. Широко используется в электротехнике: А. железо, Б. медь, В. литий, Г. кальций. 14. Не реагирует с водой даже при нагревании: А. магний, Б. цинк, В. железо, Г. медь. 15. Металлические свойства в ряду элементов Si, Al, Mg, Na: А. не изменяются, Б. ослабевают, В. усиливаются, Г. изменяются периодически. 16. Бронза – это сплав: А. цинка с оловом, Б. алюминия с марганцем, В. железа с фосфором, Г. меди с оловом.
Ответы: 9 класс К.р. №3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Б
А
Г
А
В
Б
А
В
Б
Б
Г
Г
Б
Г
В
Г
9 класс. Контрольная работа 4
по теме «Органические соединения»
1.Органическим веществом является.
А. Вода. Б. Гидроксид натрия. В. Глюкоза. Г. Серная кислота.
2. Общая формула предельных углеводородов.
А. Cnh3n. Б. CnH 2n- 2. В. Cnh3n+2. Г.Cnh3n+1.
3.Формула ацетиленового углеводорода, содержащего 5 атомов углерода:
А. C5H8. Б. C5h20. В. C5h22. Г. C5h24.
4.Гомологом метана является вещество, формула которого:
A. CH 3-Ch4; Б.Ch3=CH-Ch4; В.Ch3= CН-Ch4 Г.Ch4COOH
5. Объем углекислого газа, образовавшегося при сгорании 2 л пропана:
А. 2 л. Б. 4 л. В. 6 л . Г. 8 л.
6. Ацетилен не взаимодействует с веществом, формула которого:
А. C3H8. Б. Br2. В. h3O. Г. h3.
7.Для ацетилена характерной является реакция:
А. Дегидратации. Б. Дегидрирования. В. Гидратации. Г. Диссоциации.
8.Свойство не характерное для глюкозы:
А.Проводит электрический ток в растворе.
Б. Сладкая на вкус. В.Хорошо растворима в воде. Г.Является твердым веществом.
9. Установите соответствие. Класс соединения:
1. Одноатомные спирты. 2. Карбоновые кислоты. 3. Альдегиды. 4.Предельные углеводороды.
Формула. А. Ch3 -COOH. Б.Ch4-Ch3 -OH В. C5h22 Г. H-C=O
\ H
10.Тип гибридизации атомных орбиталей атомов углерода в молекулах алканов А. sp Б. sp2 В. sp311.Значение валентного угла при С-атоме в алканах А. 120° Б. 180° В. 109°28' Г. 90° 12.Укажите ряд в котором записаны только формулы алканов. А. C2H6, C8h28, C7h24 Б. C2H6, C4H6, C5h22 В. Ch5, C5h20, C3H6 Г. C3H8, C4h20, C6h24 13.Укажите алкан, молекула которого содержит шесть атомов углерода. А. C6h22 Б. C6h23 В. C6h20 Г. C6h24 14. Вещества, имеющие формулы СН3 – О – СН3 и СН3 – СН2 – ОН, являются А. гомологами; Б. изомерами; В. полимерами; Г. пептидами. 15. Продуктом гидратации этилена является: А. спирт; Б. кислота; В. альдегид; Г. алкан. 16 Ацетилен принадлежит к гомологическому ряду: А. алканов; Б. алкинов; В. аренов; Г. Алкенов
Ответы: 9 класс К.р. №4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
В
В
А
А
В
А
В
А
1-Б
2-А
3-Г
4-В
В
В
В
Г
Б
А
Б
Бланк ответов на контрольные работы по химии 9 класс
Ф.И. уч-ся
Ответы: 9 класс К.р. №1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
В
Г
Г
Г
А
В
В
В
Г
Б
А
В
Г
Б; Г
Б; В
А;Г
Г
Ответы: 9 класс К.р. №2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Г
Г
В
В
Б; В
Г
В
В
А
В
В
А
Г
А
В
Б
Ответы: 9 класс К.р. №3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Б
А
Г
А
В
Б
А
В
Б
Б
Г
Г
Б
Г
В
Г
Ответы: 9 класс К.р. №4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
В
В
А
А
В
А
В
А
1-Б
2-А
3-Г
4-В
В
В
В
Г
Б
А
Б
10 класс. Контрольная работа 1
по теме «Предельные и непредельные углеводороды»
1.В какие реакции не вступает метан? А) изомеризации;Б) присоединения;В) замещения;Г) горения;Д) правильного ответа нет. 2.Какие условия необходимы для начала реакции между метаном и хлором?А) охлаждение;Б) нагревание;В) освещение;Г) применение катализатора;Д) правильного ответа нет.3 . Вычислите объем водорода, образующегося при дегидрировании 1 л этана с образованием этилена.А) 1 л; Б) 2 л; В) 3 л; Г) 6 л;д) правильного ответа нет.4.Дополните фразу: «Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разный порядок расположения атомов в молекуле ,т.е. разное строение, а потому и разные свойства, называются: А) гомологами Б) изомерами В) радикалами Г) молекулами5.Дополните фразу: «В углеводородах реализуется …связь».А) неполярная ковалентная Б) полярная ковалентная В) ионная Г) неполярная ковалентная и полярная ковалентная6.Формулы СН3─ (СН2)2─ СН3 ; С 4Н10 ; СН3─ СН2─ СН3 отражают строение А) трех разных веществ Б) двух разных веществВ) одного вещества Г) одного вещества , называемого бутаном7. К классу алканов относится А) С7Н12 Б) С7Н16 В) С7Н6 Г) С7 Н88.Тип гибридизации атомов углерода в молекуле СН3 - СН2 -СН2- СН3 А) sp2 Б) sp3 В) sp 9. Угол между осями углеродного атома для sp3- гибридных орбиталей равен А) 109° 28 ¢ Б)120 ° В) 180°
10. Реакция, уравнение которой СН3 -СН2-ОН - СН2 →СН2 + Н2О,является реакцией А) дегидрирования Б) дегидратации В)дегидрохлорирования 11. Для алканов характерна изомерия А) положения функциональной группы Б) углеродного скелета В) положения двойной связи Г) геометрическая 12. Метан не взаимодействует с веществом , формула которого: А) C3H8. Б) Br2. В) О2. Г) Сl2. 13.Какие реакции обусловлены наличием в алкенах ¶-связи ? А) замещения; Б) разложения; В) присоединения; Г) обмена;14. Этилен не используют:А) для получения этилового спирта;Б) для получения пластмасс;В) в качестве горючего;Г) для получения 1,2-дихлорэтана;Д) правильного ответа нет.15.Гомологическому ряду алкадиенов соответствует общая формула:А) СпН2п; Б) СпН2п+2; В) СпН2п-2; Г) СпН2п; Д) правильного ответа нет.16. Для какого вещества характерны реакции полимеризации: А) этан; Б) пропан; В) этанол; Г) пропилен17.Алкинам соответствует общая формулаА) Сn Н2n+2 Б) Сn Н2n В) Сn Н2n-2 Г) Сn Н2n -6 18. Тип гибридизации ключевых атомов углерода в молекуле СН2 = СН - СН3 А) sp3 Б) sp В) sp2
10 класс Ответы К.р 1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Б
В
Б
Б
В
Б
Б
Б
А
А
Б
А
В
В
В
Г
В
В
10 класс. Контрольная работа 2
по теме «Ароматические углеводороды. Природные источники углеводородов»
1.Основные направления промышленной переработки природного газа
А) топливо, источник энергии Б) получение парафинов
В) получение полимеров Г) получение растворителей.
2.Какой химический метод используют для первичной переработки нефти
А) сжигание Б) разложение
В) фракционная перегонка Г) крекинг.
3.Источником, каких углеводородов является каменноугольная смола?
А) предельных Б) ароматических
В) непредельных Г) циклопарафинов.
4.Почему переработка угля носит название «сухой перегонки»
А) проводится без доступа воздуха Б) без доступа воды
В) осушают продукты Г) перегоняют сухим паром.
5.Главным компонентом природного газа является
А) этан Б) бутан
В) бензол Г) метан.
6.К классу аренов относится углеводород, формула которогоА) С3Н6 Б) С2Н2 В) С6Н6 Г) С5Н8
7.В молекуле бензола атомы углерода связаны:А) тремя простыми и тремя двойными связями; Б) шестью σ -связями;В) шестью σ -связями и шестью π- связями; Г) шестью σ -связями и единой системой из шести π- электронов; Д) правильного ответа нет.8.Бензол, как и предельные углеводороды, вступает в реакции :А) гидрирования; Б) изомеризации; В) замещения водорода на галоген;Г) присоединения галогена; Д) правильного ответа нет.
9. Ароматическое кольцо содержится в молекулеА) гексана Б) циклогексана В) гексена Г) 1,4-диметилбензола.
10. Атомы углерода в молекуле бензола находятся в состоянии гибридизацииА) sp - Б) sp3- В) sp2- Г) sp4 .11. Нефть по своему составу-это А) простое вещество Б) сложное вещество класса алкенов В) смесь углеводородов, основу которой составляют алканы линейного и разветвленного строения Г) смесь алкенов. 12.Перегонка нефти осуществляется с целью получения А) только метана и бензола Б) только бензина и метана В) различных нефтепродуктов Г) только ароматических углеводородов.
13. В какой из перечисленных реакций образуется бромбензол А) С6 Н6 + Вr2 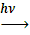 ;Б) С6 Н6 + Вr2
;Б) С6 Н6 + Вr2 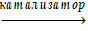 ;В) С6 Н12 + Вr2
;В) С6 Н12 + Вr2 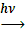 ;Г) С7Н8 + Вr2
;Г) С7Н8 + Вr2 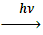 ;
;
Д) правильного ответа нет
14. Крекинг нефтепродуктов-это А) разделение углеводородов нефти на фракции Б) превращение предельных углеводородов нефти в ароматические В) термическое разложение нефтепродуктов, приводящее к образованию углеводородов с меньшим числом атомов углерода в молекуле Г) превращение ароматических углеводородов нефти в предельные
15. Что входит в состав попутного нефтяного газа?
А) этан, пропан, бутан, пентан, гексан
Б) пропан, бутан
В) этан, пропан
Г) метан, этан
16. Каковы продукты пиролиза каменного угля?
А) кокс, коксовый газ
Б) кокс, каменная смола
В) кокс, коксовый газ, каменноугольная смола, раствор аммиака и сероводорода
Г) кокс, коксовый газ, каменноугольная смола
10 класс Ответы К.р 2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
А
В
Г
А
Г
В
Г
В
Г
В
В
В
Б
Б
А
В
10 класс. Контрольная работа 3 по теме «Спирты и фенолы»
1. Общая формула предельных одноатомных спиртов:
А) СnН2n+1ОН. Б) СnН2n-2(ОН)2. В) СnН2n-1ОН. Г) СnН2nО2.
2. Вид изомерии, характерный для предельных одноатомных спиртов:
A) Зеркальная. В) Положения кратной связи.Б) Пространственная (стереоизомерия) Г) Межклассовая.3. Продуктами окисления первичных одноатомных спиртов являются:
А) Альдегиды. Б) Кетоны. В) Простые эфиры. Г) Сложные эфиры.
4. Формула вещества с наиболее ярко выраженными кислотными свойствами:
А) СН3ОН. Б) С2Н5ОН. В) С3Н7ОН. Г) С6Н5ОН.5. Этанол не вступает в реакцию с веществом, формула которого:
A) Na. Б) НВг. В) NaOH. Г) СН3СООН.6. Реактивом для распознавания этиленгликоля является:
А) Бромная вода. В) Гидроксид меди (II).Б) Оксид меди (II) Г) Хлорид железа (III).
7. Вещество, из которого с помощью реакции нитрования А. Нобель изготовил динамит:
А) Глицерин. Б) Глицин. В) Фенол. Г) Этанол
8. «Древесный спирт», впервые полученный путем сухой перегонки древесины, — это:А) Бутанол. В) Пропанол Б) Метанол. Г) Этанол.9. Многоатомным спиртом является:
А) Бутанол-2. Б) Глицерин В) Фенол. Г) Этанол.10. Вещество, применяемое для производства антифризов:
А) Глицерин. Б) Метанол. В) Этанол Г) Этиленгликоль.11. Формула вещества, относящегося к классу предельных многоатомных спиртов:
А) С6Н4(ОН)2 Б) С6Н5ОН. В) С6Н5СН2ОН Г) С2Н4(ОН)2
12. В цепочке превращений
С2Н6 →X → С2Н5ОН
веществом X является:
А) Этаналь Б) Этановая кислота. В) Этен Г) Этин13. Фенол не вступает в реакцию с веществом, формула которого:
A) Na Б) С3Н8 B) NaOH. Г) Вr2(водн. раствор)
14. Вещество, которое впервые применили в качестве антисептика при хирургических операциях:
А) Глицерин. Б) Метанол. В) Фенол. Г) Этанол.15. Пищевой этиловый спирт получают:
A) Брожением глюкозы. Б) Гидратацией этилена.
B) Гидролизом бромэтана. Г) Гидролизом целлюлозы.
16. Формула вещества, относящегося к классу фенолов:
А) С6Н5-СН3. В) С6Н4(ОН)2.
Б) С6Н5—СН2—СН2—ОН Г) С6НПОН.
17. Вещество, выполняющее роль увлажнителя в косметических кремах:
А) Глицерин В) Этанол.
Б) Фенол Г) Этиленгликоль
10 класс Ответы К.р 3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
А
Г
А
Г
Б
В
А
Б
Б
Г
Г
В
Б
Г
А
Г
А
Бланк ответов на контрольные работы по химии 10 класс
Ф.И. уч-ся
10 класс Ответы К.р 1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Б
В
Б
Б
В
Б
Б
Б
А
А
Б
А
В
В
В
Г
В
В
10 класс Ответы К.р 2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
А
В
Г
А
Г
В
Г
В
Г
В
В
В
Б
Б
А
В
10 класс Ответы К.р 3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
А
Г
А
Г
Б
В
А
Б
Б
Г
Г
В
Б
Г
А
Г
А
11 класс. Контрольная работа 1 по теме «Кислородосодержащие органические соединения»
1. Определите формулу карбоновых кислот:
А) С2Н5СОН Б) НСООН В) С2Н5СООСН3 Г) СН3ОН
2. Какое вещество не содержит карбонильной группы:А) муравьиная кислота Б) формальдегид В) этанол Г) уксусный альдегид.
3. Допишите реакцию и укажите её название:CH = CH + h3O-- HgSO4, кислота--
А) реакция Вагнера Б) реакция Зелинского В) реакция Кучеров Г) реакция Вюрца.
4. Какое вещество даёт реакцию «серебряного» зеркала?
А) этаналь Б) этанол В) фенол г) уксусная кислота.
5. Среди перечисленных моносахаридов укажите кетогексозу:
А) глюкоза Б) фруктоза В) рибоза Г) дезоксирибоза.
6. Лактоза относится к группе:
А) моносахаридов Б) дисахаридов В) полисахаридов.
7. Какой из углеводов не подвергается гидролизу?А) сахароза Б) лактоза В) фруктоза Г) крахмал.
8. При гидролизе крахмала образуется:
А) α - глюкоза Б) β – глюкоза В) α – глюкоза и β - фруктоза Г) глюкоза и галактоза.
9. Фруктозу иначе называют:А) молочным сахаром Б) фруктовым сахаром В) инвертным сахаром Г) тростниковым сахаром.
10. Качественной реакцией на глюкозу является реакция с:А) Cu(OH)2 Б ) FeCl3 В) I2(раствор) Г) CuO
11. Общая формула углеводов условно принята:А) Сnh3nOn Б ) Сnh3nOm В) Сnh3mOm Г) Сn (h3O)m
12. Название кислоты с формулой СН3—СН — СН2—СООН:
СН3
А)3-метилбутановая; Б)2-метилбутановая; В) 3-метилбутеновая; Г) 3,3-диметилпропановая.
13 Какой из металлов реагирует с уксусной кислотой с максимальной скоростью?
А) железо; Б) олово; В) цинк; Г) кальций.
14.Взаимодействие пропионовой кислоты с этиловым спиртом называется реакцией:
А) гидратации; Б) этерификации; В) гидрирования; Г) нейтрализации.
15. В состав природных жиров не входит кислота:
А) щавелевая, Б) стеариновая, В) масляная, Г) олеиновая.
16. Жиры можно получить реакцией:
А) этерификации глицерина и высших жирных кислот;
Б) между жирными кислотами и глицерином;
В) дегидратации жирных кислот или глицерина;
Г) гидролизом крахмала.
17.Укажите роль жиров в организме:
А) продуктом питания; Б) источником энергии;
В) мономерами для получения нуклеиновых кислот;
Г) в экстремальных условиях – источником воды.
18. При гидролизе жиров в присутствии щелочей образуются:
А) глицерин; Б) жирные кислоты; В) соли жирных кислот - мыла;
Г) глицерин и соли жирных кислот – мыла; Д) глицерин и жирные кислоты.
11 класс Ответы К.р 1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Б
В
В
А
Б
Б
В
Б
Б
А
Г
А
Г
Б
Б
А
Б.Г
Д
11 класс. Контрольная работа 2 по теме «Азотсодержащие соединения»
1. Амины можно рассматривать как производные:
А) азота Б) метана В) аммиака Г) азотной кислоты.
2. Аминокислоты проявляют свойства:
А) только кислотные Б) только основные В) амфотерные.
3. Какой из типов веществ не относиться к азотосодержащим соединениям:
А) белки Б) аминокислоты В) нуклеиновые кислоты Г) полисахариды.
4. При образовании первичной структуры белка важнейшим видом связи является:
А) водородная Б) пептидная В) дисульфидная Г) ионная.
5. Спиралевидное состояние полипептидной цепи является структурой белка:
А) первичной Б) вторичной В) третичной Г) четвертичной.
6. Белки являются одним из важнейших компонентов пищи. В основе усвоения белка в желудочно-кишечном тракте лежит реакция:
А) окисления Б) этерификации В) гидролиза Г) дегидратация.
7. Для проведения ксантопротеиновой реакции потребуется реагент:
А) HNO3 Б)h3SO4 В) PbS Г) CuSO4.
8. Для обнаружения белка можно использовать реакцию:
А) «серебряного зеркала» Б) биуретовую В) «медного зеркала» Г) реакцию Зинина.
9.Нуклеиновые кислоты принимают участие в биосинтезе:
А) белков Б) аминокислот В) жиров Г) углеводов.
10. Какие вещества не являются составной частью нуклеотида?
А) Пуриновое или пиримидиновое основание,
Б) рибоза или дезоксирибоза,
В) аминокислоты,
Г) фосфорная кислота.
11. Как называется вещество h3N-Ch3- COOH:
А) серин Б) аланин В) глицин Г) аминопропионовая кислота
12 . Амфотерность аминокислот проявляется при его взаимодействии с растворами
А) спиртов Б) кислот и щелочей В) щелочей Г) средних солей
13. Верны ли утверждения: А) аминокислоты входят в состав жиров
Б) Анилин относится к числу ароматических аминов
верно только А
верно только Б
верны оба утверждения
неверно ни одно из утверждений
14. Соединения, в состав которых входит функциональная группа –Nh3, относятся к классу
А) альдегидов Б) нитросоединений В) карбоновых кислот Г) аминов
15. Окраска водного раствора амина в присутствии фенолфталеина
А) малиновая Б) жёлтая В) фиолетовая Г) оранжевая
16. Аминопропановая кислота реагирует с каждым из двух веществ:
А) HСl, KOH Б) NaCl, Nh4 В) C2H5OH, KCl Г) CO2, HNO3
17. Формула аминоуксусной кислоты
А) Ch4 COOH Б) CH 3 Ch3 – COOH В) Nh3 – Ch3 COOН Г) Cl – Ch3 COOH
18. При взаимодействии аминокислот между собой образуется
А) сложный эфир Б) пептид В) новая аминокислота Г) средняя соль
11 класс Ответы К.р 2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
В
В
Г
Б
Б
Г
А
Б
А
В
В
Б
2
Г
А
А
В
Б
Бланк ответов на контрольные работы по химии 11 класс
Ф.И. уч-ся
11 класс Ответы К.р 1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Б
В
В
А
Б
Б
В
Б
Б
А
Г
А
Г
Б
Б
А
Б.Г
Д
11 класс Ответы К.р 2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
В
В
Г
Б
Б
Г
А
Б
А
В
В
Б
2
Г
А
А
В
Б
12 класс. Контрольная работа 1 по теме «Химические реакции. Периодическая система. Строение вещества»
1. Взаимодействие гидроксида натрия с ортофосфорной кислотой относится к реакциям
А) замещения; Б) обмена; В) присоединения; Г) разложения
2. Реакция, уравнение которой 2Na + 2h3O = 2NaOH + h3 + Q, относится к реакциям:
А) замещения, экзотермическим; В) соединения, эндотермическим;
Б) разложения, экзотермическим; Г) обмена, эндотермическим
3. Сокращенное ионное уравнение Са2+ + СО32- = СаСО3 соответствует взаимодействию
А) хлорида кальция и карбоната натрия;
Б) сульфида кальция и углекислого газа;
В) гидроксида кальция и углекислого газа;
Г) ортофосфата кальция и карбоната калия
4. В соответствии с термохимическим уравнением реакции 2СО(г) = СО2(г) + С(т) = 173 кДж выделилось 1730 кДж теплоты. Объем оксида углерода (II), вступившего в реакцию, равен:
А) 112л Б) 224л В) 336л Г) 448л.
5. Скорость прямой реакции N2 + 3h3 = 2Nh4 + Q возрастает при:
А) увеличении концентрации азота; В) увеличении концентрации аммиака;
Б) уменьшении концентрации азота; Г) уменьшении концентрации аммиака
6. Для увеличения скорости реакции железа с соляной кислотой следует:
А) добавить ингибитор; В) повысить давление;
Б) понизить температуру; Г) увеличить концентрацию HCl
7. Химическое равновесие в системе СО(г) + 2Н2(г) = СН3ОН(г) + Q сместится в сторону прямой реакции при:
А) понижении температуры; В) повышении концентрации СН3ОН;
Б) понижении концентрации СО; Г) повышении температуры
8. На состояние динамического равновесия в системе 2SO2 + O2 = 2SO3 +Q не влияет:
А) катализатор; В) изменение температуры;
Б) изменение концентрации Г) изменение давления.
исходных веществ;
9. Какая из солей не подвергается гидролизу?
А) КCl Б) K2CO3 В) FeCl2 Г)ZnSO4
10. Щелочную среду имеет раствор
А) ацетата натрия; Б) нитрата алюминия; В) нитрата бария; Г) сульфата железа (III)
11. Сколько периодов в периодической системе?А) 2 Б) 3 В) 7 Г) 8
12. Сколько рядов в периодической системе?А) 7 Б) 8 В) 9 Г) 10
13. Сколько элементов в шестом периоде?А) 32 Б) 18 В) 8 Г) 2
14. Сколько элементов в главной подгруппе пятой группы?А) 3 Б) 4 В) 5 Г) 8
15. Чему равен порядковый номер элемента, который находится в четвертом периоде, в главной подгруппе второй группы? А) 10 Б) 20 В) 30 Г) 40
16. Чему равна высшая валентность элемента хрома (порядковый номер 24)?А) VI Б) IV В) III Г) II
17. На внешнем электронном уровне атома хлора:А) 5 электронов Б) 1 электрон В) 7 электронов Г) 3 электрона
18Среди химических элементов P, S, Cl, F наиболее ярко свойства неметаллов выражены уА) фосфора Б) сера В) хлор В) фтор
19. Ковалентной полярной связью образованы молекулы веществ:А) h3O, h3, N2O, AlN Б) HCl, h3S, h3O, PCl5В) NaCl, LiF, h3O, CO2 Г) N2, CO, CO2 , h3O
20. Неполярная ковалентная связь возникает между атомами:А) кислорода Б) натрия и фтора В) кислорода и фтора Г) серы и фосфора
21. Формула вещества с ионной связью:А) CCl4 Б) LiCl В) Cl2 Г) Ch5
22. В ядрах атомов углерода, кремния, хлора число протонов соответственно равно: А) 12,28,35 Б) 6,14,17 В) 6,7,17 Г) 12,14,17
23. Атомы натрия и магния имеют:А) одинаковое число электронов Б) одинаковое число электронных уровнейВ) одинаковую степень окисления в оксидахГ) одинаковое число протонов в ядрах
24. Химические элементы расположены в порядке возрастания электроотрицательности в ряду:А) S, P, Si, O, Cl Б) Si, P, Br, Cl, O В) F, O, N, S, P Г) P, S, C, O, Br 12 класс К.р. № 1.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
Б
А
А
Г
А
Г
А
А
А
А
В
Г
А
В
Б
А
В
Г
Б
А
Б
Б
Б
Б
12 класс. Контрольная работа 2 по теме «Неметаллы. Металлы»
1. Пара элементов, между которыми образуется ионная химическая связь:
А) углерод и сера Б) водород и азот В) калий и кислород Г) кремний и водород
2. Аллотропией называется:
А) существование нескольких сложных веществ, молекулы которых имеют одинаковый состав, но различное химическое строение;
Б) существование нескольких простых веществ, образованных атомами одного и того же элемента;
В) существование для атомов одного и того же элемента не скольких устойчивых изотопов;
Г) способность атомов элемента образовывать несколько сложных веществ с атомами другого элемента.
3. Атомную кристаллическую решётку имеет:
А) сода Б) вода В) алмаз Г) парафин
4.Вещество, между атомами которого существует водородная связь:
А) этан Б) фторид натрия В) этанол Г) углекислый газ
5. Атом является структурной частицей в кристаллической решетке
А) метана Б) водорода В) кислорода Г) кремния
6. Простые вещества неметаллы при нормальных условиях имеют агрегатное состояние:
А) газообразное; Б) жидкое; В) твердое; Г) все приведенные выше ответы верны
7. В каком соединении ковалентная связь между атомами образуется по донорно- акцепторному механизму?
А) KCl Б) CCl4 В) Nh5Cl Г) CaCl2
8. Полностью завершенный внешний энергетический уровень имеет элемент:
А) гелий; Б) водород; В) бор; Г) фтор.
9. Соединением с ковалентной неполярной связью является:
А) N2O Б) S8 В) Na2O Г) SO2
10. В каком ряду все вещества имеют ковалентную полярную связь?
А ) HCl, NaCl, Cl2 Б) h3O, Nh4, Ch5 В) O2, h3O, CO2 Г) NaBr, HBr, CO
11 Связь между атомами двух химических элементов, резко отличающихся по электроотрицательности, являются:
А) ковалентной неполярной Б) ионной В) ковалентной полярной Г) металлической
12. Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку
А) хлорид натрия; Б) оксид кремния; В) алмаз; Г) углекислый газ.
13. К веществам с атомной кристаллической решеткой относятся
А) натрий, фтор, оксид серы (IV)
Б) свинец, азотная кислота, оксид магния
В) бор, алмаз, карбид кремния
Г) хлорид калия, белый фосфор, йод.
14. Какая из следующих групп элементов содержит только металлы?
А) Li, Be, B Б) K, Ca, Sr В) H, Li, Na Г) Se, Te, Po.
15. Какие физические свойства являются общими для большинства металлов:
1) электропроводность, 2) теплопроводность, 3) высокая температура плавления
4) металлический блеск
А) 1,2,3,4 Б) 1,3,4 В) 1,2,4 Г) 1,2.
16. Какой из перечисленных металлов наиболее легко подвергается хим. коррозии?
А) никель Б) хром В) железо Г) олово.
17. Исключите лишний элемент с точки зрения возможности образования им
аллотропных модификаций:
А) кислород; Б) азот; В) фосфор; Г) сера.
18. Атом азота проявляет отрицательную степень окисления в веществе с формулой:
А) (Nh5)2CO3; Б) N2; В) Bi(NO3)3; Г) KNO2.
19. При взаимодействии с какими из перечисленных веществ сера проявляет
окислительные свойства?
А) O2; Б) Zn; В) h3SO4; Г) HNO3.
20. Пара формул, в которой кислотный оксид не соответствует кислоте:
А) N2O3 и HNO2; Б) SiO2 и h3SiO3 ; В) SO3 и h3SO3 ;
Г) P2O5 и h4PO4.
12 класс К.р. № 2.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
В
Б
В
В
Г
Г
В
А
Б
Б
Б
Г
В
Б
А
В
Б
А
Б
В
Бланк ответов на контрольные работы по химии 12 класс
Ф.И. уч-ся
12 класс К.р. № 1.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
Б
А
А
Г
А
Г
А
А
А
А
В
Г
А
В
Б
А
В
Г
Б
А
Б
Б
Б
Б
12 класс К.р. № 2.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
В
Б
В
В
Г
Г
В
А
Б
Б
Б
Г
В
Б
А
В
Б
А
Б
В
doc4web.ru
ТЕСТ « Строение вещества» (11 класс)
ВАРИАНТ №1
А1. Ковалентную неполярную связь имеет вещество, формула которого
1) Nh4 2) Br2 3) KCl 4) Ca
А2. Группы –ОН и –СООН являются функциональными соответственно
1) для спиртов и фенолов 3) для спиртов и карбоновых кислот
2) для альдегидов и кетонов 4) для фенолов и альдегидов
А3. Изомерами не являются
1) бутан и метилпропан 3) бутадиен-1,3 и бутин-1
2) пентан и 2-метилпентан 4) диэтиловый эфир и бутанол-2
А4. Молекулярное строение имеет
1)Cl2 2) CaO 3)ZnCl2 4) NaBr
А5. Формула вещества, содержащая π- связь
1) С6Н12 2) С2Н6 3) С5Н11ОН 4) СН3 – О - СН3
В1. Установите соответствие между молекулярной формулой вещества и классом
органических веществ
ФОРМУЛА КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯ СОЕДИНЕНИЙ
1. С4Н10О2 А. алкены
2. С5Н10 Б. арены
3. С8Н10 В. углеводы
4. С4Н10О Г. простые эфиры
Д. многоатомные спирты
В2. Какая масса карбоната натрия потребуется для приготовления 50 л 13% -ного раствора
плотностью 1,13 г/мл? (Ответ запишите с точностью до десятых.)
С1. Найдите молекулярную формулу алкена, массовая доля углерода в котором составляет
85,7%. Относительная плотность этого алкена по азоту равна 2.
_________________________________________________________________
ВАРИАНТ №2
А1. Ионную связь имеет вещество, формула которого
1) О2 2) Аl 3) CaO 4) HBr
А2. Группа – СОО - является функциональной
1) для спиртов 3) для карбоновых кислот
2) для альдегидов 4) для сложных эфиров
А3. Названия пары изомеров
1) пропин-1 и пропан 3) бутаналь и бутанон-2
2) этанол и этан 4) метановая кислота и метаналь
А4. Кристаллическая решетка хлорида натрия
1) ионная 2)молекулярная 3)металлическая 4)атомная
А5. Формула вещества, не содержащая π- связь
1) С4Н9ОН 2) С6Н6 3) С2Н2 4) С2Н5СОН
В1. Установите соответствие между молекулярной формулой вещества и классом
органических веществ
ФОРМУЛА КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯ СОЕДИНЕНИЙ
1. С2Н2 А. карбоновые кислоты
2. С3Н6О2 Б. алкины
3. СН3Nh3 B. альдегиды
4. С3Н8 Г. алканы
Д. амины
В2. К 200г 10%-ного раствора КСl добавили 50г воды. Массовая доля КСl в полученном
растворе равна ______________%.(Запишите число с точностью до целых.)
С1. Найдите молекулярную формулу сложного эфира, содержащего (по массе) 54,4%
углерода, 36,4% кислорода, 9,2% водорода. Относительная плотность его паров по
водороду равна 44.
ВАРИАНТ №3
А1. Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 3) SO2, P4, CaF2
2) NaBr, Na2O, KI 4) h3S, Br2, K2S
А2. Функциональные группы –Nh3 и -COOH входят в состав
1) сложных эфиров 3) спиртов
2) альдегидов 4) аминокислот
А3. Названия пары изомеров
1) пентан и пентадиен 3) этан и ацетилен
2) уксусная кислота и метилформиат 4) этанол и этаналь
А4. Кристаллическая решетка твердого оксида углерода (IV)
1) ионная 2) молекулярная 3) металлическая 4) атомная
А5. Две π- связи содержатся в молекуле
1) этена 2) бутана 3) бутена 4) этина
В1. Установите соответствие между молекулярной формулой вещества и
классом органических веществ
ФОРМУЛА КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯ СОЕДИНЕНИЙ
1. С2Н6О А. углеводы
2. С2Н4 О Б. одноатомные спирты
3. С3Н4 В. алкены
4. С6Н12О6 Г. альдегиды
Д. алкины
В2. Масса соли, которая водится в организм при вливании 353г физиологического раствора,
содержащего 0,85 % по массе поваренной соли, равна _________г. (Запишите число с
точностью до целых.)
С1. Найдите молекулярную форму углеводорода, массовая доля углерода в котором
составляет 83,3%. Относительная плотность паров этого вещества по водороду равна 36.
________________________________________________________________________________
ВАРИАНТ №4
А1. Ковалентную полярную связь имеет формула вещества
1) CCl4 2) Na2S 3) Cu 4) O2
А2. Группы –ОН и –СОН являются функциональными соответственно
1) для спиртов и кетонов 3) для спиртов и альдегидов
2) для альдегидов и спиртов 4) для карбоновых кислот и кетонов
А3. Изомерами являются
1) бензол и толуол 3) пропанол и пропановая кислота
2) этанол и диметиловый эфир 4) этанол и фенол
А4. Молекулярную кристаллическую решетку имеет
1) CaF2 2) CO2 3) SiO2 4) AlF3
А5. Число σ- связей в молекуле этилена равно
1) 1 2) 5 3) 3 4) 4
В1. Установите соответствие между молекулярной формулой вещества и
классом органических веществ
ФОРМУЛА КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯ СОЕДИНЕНИЙ
1. С5Н10 А. простые эфиры
2. С2Н4 О2 Б. сложные эфиры
3. С4Н10О В. алкадиены
4. С6Н10 Г. арены
Д. циклоалканы
В2. Какая масса азотной кислоты содержится в 1л ее 20%-ного раствора плотностью 1,0 г/мл?
(Запишите число с точностью до целых.)
С1. Найдите молекулярную формулу органического вещества, если известно, что массовая
доля углерода в нем составляет 51,89%, водорода 9,73%, хлора 38,38%. Относительная
плотность паров этого вещества по воздуху равна 3,19.
ВАРИАНТ №5
А1. Ковалентной неполярной связью образовано вещество, формула которого
1) С (алмаз) 2) КОН 3) СН4 4) МgO
А2. Группа – СО - является функциональной
1) для карбоновых кислот 3) для кетонов
2) для простых эфиров 4) для альдегидов
А3. Изомером бутановой кислоты является
1) бутанол 3) пентановая кислота
2) бутаналь 4) 2-метилпропановая кислота
А4. Немолекулярное строение имеет
1) Н2О 2) Nh4 3) SiO2 4) CO2
А5. Число π-связей в молекуле ацетилена равно
1) 1 2) 2 3) 3 4) 4
В1. Установите соответствие между молекулярной формулой вещества и классом
органических веществ
ФОРМУЛА КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯ СОЕДИНЕНИЙ
1. СН2О А. арены
2. С3Н8О3 Б. алкадиены
3. С4Н6 В. углеводы
4. С7Н8 Г. многоатомные спирты
Д. альдегиды
В2. Какую массу оксида кальция необходимо взять для приготовления 495 г раствора
гидроксида кальция с массовой долей 1,5%? (Запишите число с точностью до десятых.)
С1. Массовые доли углерода и водорода в углеводороде равны соответственно 92,31% и
7,69%. Плотность его паров по водороду составляет 39. Найдите молекулярную формулу
углеводорода.
_________________________________________________________________
ВАРИАНТ №6
А1. Ионную связь имеет вещество, формула которого
1) CCl4 2) Na2S 3) Cu 4) O2
А2. Группы – СОН и –СО- являются функциональными соответственно
1) для спиртов и фенолов 3) для спиртов и карбоновых кислот
2) для альдегидов и кетонов 4) для фенолов и альдегидов
А3. Названия пары изомеров
1) толуол, бензол 3) ацетальдегид, этаналь
2) ацетилен, метилацетат 4) пентадиен, пентин
А4. Кристаллическая решетка бромида калия
1) ионная 2)молекулярная 3) металлическая 4)атомная
А5. Число σ- связей в молекуле метана равно
1) 1 2) 5 3) 3 4) 4
В1. Установите соответствие между молекулярной формулой вещества и классом
органических веществ
ФОРМУЛА КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЯ СОЕДИНЕНИЙ
1. С2Н4 А. алкины
2. С2Н6 О Б. амины
3. С4Н6 В. алкены
4. С2 Н7 N Г. альдегиды
Д. простые эфиры
В2. Рассчитайте массу нитрата калия и объём воды, необходимые для приготовления 160г
8%-ного раствора нитрата калия.
С1. Найдите молекулярную формулу алкена, массовая доля водорода в котором составляет
14,3%. Относительная плотность этого алкена по водороду 21.
nsportal.ru
РАЗРАБОТКИ
Страница 4
В категории разработок: 63
Фильтр по целевой аудитории
- Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя
 Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 9 класса по теме: «Металлы». Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С. Часть А: Включает тестовые задания, требующие найти один верный ответ. Часть В: В задании №12,14 на установление соответствие к каждой позиции первичного столбца подобрать соответствующую позицию второго и записать выбранные цифры под соответствующими буквами. В задании №13- написать метод электронного баланса, с помощью которого расставить коэффициенты в уравнении.
Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 9 класса по теме: «Металлы». Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С. Часть А: Включает тестовые задания, требующие найти один верный ответ. Часть В: В задании №12,14 на установление соответствие к каждой позиции первичного столбца подобрать соответствующую позицию второго и записать выбранные цифры под соответствующими буквами. В задании №13- написать метод электронного баланса, с помощью которого расставить коэффициенты в уравнении. Часть С: В задании С1 осуществить цепочку превращений и указать тип реакции. В задании С2 решить задачу на выход продукта реакции от теоретически возможного.


Целевая аудитория: для 9 класса
Контрольные работы для 8 – 11 классов составлены для работы с учебниками Габриелян О.С. в объёме школьной программы на основе федерального компонента государственного стандарта общего образования по химии. Контрольные работы служат для итоговой проверки знаний. Они проводятся в заключении раздела или большой темы и рассчитаны на выполнение учащимися в течение 40 минут. Каждая контрольная работа представлена в двух вариантах и составлены из заданий базового уровня В контрольных работах проверяется качество разных знаний, степень усвоения теоретического и фактического учебного материала, делать выводы, представляя признаки и условия реакций.
Целевая аудитория: для 8 класса
Цель: проконтролировать уровень усвоения учащимися знаний и умений по теме: «Углеводороды». Класс: 10,Программа Рудзитис или Габриелян.Форма контроля: письменная, тестовая. Контрольная работа была составлена на основе обязательного минимума содержания курса химии. Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С. Уровень А - тесты выборки Уровень В – тесты сличения Уровень С – тесты напоминания Работа состоит из 4-х вариантов.
Целевая аудитория: для 10 класса
Контрольная работа составлена по теме "Теория строения органических соединений А.М.Бутлерова". Проводится в 10 классе при изучении углеводородов. Эту работу я использую также в 11 классе для подготовки учащихся к ЕГЭ. В целях более качественной подготовки учащихся к Единому Государственному Экзамену контрольная работа составлена по типу ЕГЭ, имеются части А, В, С. Вместо тетрадей для контрольных работ в профильных классах несколько лет работаю с бланками ЕГЭ, так что у учащихся не возникает трудностей психологического характера при заполнении бланков. Ведь не секрет, что учащиеся даже при правильном выполнении задания не всегда могут правильно занести ответ в бланк, что снижает качество знаний учащихся. Надеюсь, работа будет полезна.
Целевая аудитория: для 10 класса
Разноуровневый материал составлен по следующим темам: Предельные и Непредельные углеводороды, Ацетилен, Фенол, Альдегиды, Предельные одноатомные спирты, Карбоновые кислоты. Представлен материал в виде карточек, включающих три задания.
Данный тест может быть использован как для изучения материала, так и для контроля. Эффективен при подготовке к написанию контрольной работы. Учит обобщать, выделять главное, что способствует формированию навыков написания ЕГЭ.
Целевая аудитория: для 11 класса
Контрольная работа для 10 класса на 4 варианта. Базовый уровень преподавания химии.
Целевая аудитория: для 10 класса
Контрольная работа №2 по программе Габриеляна. Рассчитана на 4 варианта, содержит два уровня сложности.
Целевая аудитория: для 8 класса
Контрольная работа дана в четырех вариантах и соответствует программе О.С. Габриеляна.
Целевая аудитория: для 8 класса
Контрольная работа содержит 4 варианта заданий. Выполнена в формате Pdf
Целевая аудитория: для 11 класса
Конкурсы

Диплом и благодарность каждому участнику!

© 2007 - 2017 Сообщество учителей-предметников "Учительский портал"Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.Территория распространения: Российская Федерация, зарубежные страны.Адрес редакции: 352192, г. Гулькевичи, ул. Ленинградская 34-19Учредитель: Никитенко Евгений ИгоревичКонтакты: [email protected]
Использование материалов сайта возможно только с разрешения администрации портала.
Ответственность за разрешение любых спорных вопросов, касающихся опубликованных материалов и их содержания, берут на себя пользователи, разместившие материал на сайте.Администрация портала готова оказать поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
www.uchportal.ru
8 класс
Контрольная работа №1 по теме «Атомы химических элементов»
Вариант 1
а) Расположите химические элементы в порядке возрастания металлических свойств: Rb, Li, K.
б) Расположите химические элементы в порядке возрастания неметаллических свойств: Si, P, Mg.
2. Определить вид химической связи для следующих веществ: О2, Na, KCl, h3S. Составить схемы образования любых двух видов связи.
3. Определите число протонов, нейтронов и электронов для изотопов хлора 37Cl и 35Cl и кислорода 17О и 18О.
4. Назовите химические элементы, а также определите заряды ядер этих атомов, зная распределение электронов по энергетическим уровням:
2, 8, 2
2, 2
2, 8, 6
Определите, к какому типу элементов они относятся (металлы или неметаллы).
5. Напишите названия и символы трёх частиц (1 атом и 2 иона), расположение у которых соответствует ряду чисел:
2, 8, 8.
Вариант 2
а) Расположите химические элементы в порядке возрастания металлических свойств: Al, P, Mg.
б) Расположите химические элементы в порядке возрастания неметаллических свойств: F, I, Br.
2. Определить вид химической связи для следующих веществ: N2, Ca, NaCl, SO2. Составить схемы образования любых двух видов связи.
3. Определите число протонов, нейтронов и электронов для изотопов аргона 39Ar и 40Ar и калия 39К и 40К.
4. Назовите химические элементы, а также определите заряды ядер этих атомов, зная распределение электронов по энергетическим уровням:
2, 8, 5
2
2, 8, 3
Определите, к какому типу элементов они относятся (металлы или неметаллы).
5. Напишите названия и символы трёх частиц (1 атом и 2 иона), расположение у которых соответствует ряду чисел:
2, 8
Контрольная работа №2 по теме «Простые вещества и соединения химических элементов»
Вариант 1
Какое количество вещества оксида кальция имеет массу 140 г?
Рассчитайте массу и объём углекислого газа количеством вещества 2,2 моль.
Положение металлов в ПСХЭ, особенности их электронного строения. Общие физические свойства металлов. Составить электронные формулы кальция, лития и алюминия.
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид фосфора (V) + вода → фосфорная кислота
б) соляная кислота + алюминий → хлорид алюминия + водород
в) нитрат серебра + хлорид железа (III) → хлорид серебра + нитрат железа (III)
г) гидроксид цинка (II) → оксид цинка (II) + вода.
5. Рассчитайте объём углекислого газа (н.у.), полученного при полном сгорании 2,4 г углерода.
Вариант 2
Вычислить массу 8 моль сероводорода h3S.
Рассчитайте массу и объём фтора F2 количеством вещества 1,5 моль.
Положение неметаллов в ПСХЭ, особенности их электронного строения. Физические свойства неметаллов. Аллотропия. Составить электронные формулы азота, серы и аргона.
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид серы (IV) + вода → сернистая кислота
б) серная кислота + цинк→ сульфат цинка + водород
в) азотная кислота + гидроксид хрома (III) → нитрат хрома (III) + вода
г) гидроксид железа (II) → оксид железа (II) + вода.
5. Рассчитайте объём водорода (н.у.), полученного при взаимодействии 48г магния с избытком соляной кислоты.
Контрольная работа №3 по теме «Изменения, происходящие с веществами»
Вариант 1
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид фосфора (V) + вода → фосфорная кислота
б) соляная кислота + алюминий → хлорид алюминия + водород
в) нитрат серебра + хлорид железа (III) → хлорид серебра + нитрат железа (III)
г)гидроксид цинка (II) → оксид цинка (II) + вода
2. Рассчитайте объём углекислого газа (н.у.), полученного при полном сгорании 2,4 г углерода.
3. Какое количество вещества и масса железа потребуется для реакции с 16 г серы? Схема реакции: Fe + S = FeS
Вариант 2
Приведены схемы реакций. Составьте уравнения химических реакций и укажите их тип:
а) оксид серы (IV) + вода → сернистая кислота
б) серная кислота + цинк → сульфат цинка + водород
в) азотная кислота + гидроксид хрома (III) → нитрат хрома (III) + вода
г)гидроксид железа (II) → оксид железа (II) + вода
2. Рассчитайте объём водорода (н.у.), полученного при взаимодействии
48 г магния с избытком соляной кислоты.
3. Вычислите массу натрия, необходимого для получения 10,7 г хлорида натрия в избытке хлора. Схема реакции: 2Na + Cl2 = 2NaCl
Итоговая контрольная работа по химии в 8 классе за учебный год
Вариант 1
1. Расположите, используя Периодическую систему химических элементов Д.И.Менделеева, следующие элементы в порядке увеличения металлических свойств их атомов: К, Са, Мn.
2. Определите тип химической связи в веществах, дать им названия: Fe, КCl, О2, HCl.
3. Рассчитайте число протонов, электронов и нейтронов для атомов следующих изотопов: 37Cl и 35Cl.
4. Дать названия следующим соединениям и определить их класс:
NaOH, CO2, Fe(OH)2, h3SO3, Na2O, К2СО3, HNO3, Cr2О3, NaNO3, Al2(SO4)3.
5. Запишите уравнения диссоциации: KCl, Na(NO3)2, Ca(OH)2, h3SO4.
6. Записать уравнения реакций в соответствии со схемой:
а) гидроксид железа (III) → оксид железа (III) + вода;
б) соляная кислота + алюминий → хлорид алюминия + водород;
в) гидроксид железа (II) + соляная кислота → хлорид железа (II) + вода;
7. Осуществите превращения, записав уравнения для переходов:
С → СO2 → Na2СO3 → СO2.
Вариант 2 8 класс
1. Расположите, используя Периодическую систему химических элементов Д.И.Менделеева, следующие элементы в порядке увеличения металлических свойств их атомов: Nа, Mg, Si.
2. Определите тип химической связи в веществах, дать им названия: Al, MgCl2, h3, h3S.
3. Рассчитайте число протонов, электронов и нейтронов для атомов следующих изотопов: 24Mg и 25Mg.
4. Дать названия следующим соединениям и определить их класс:
KOH, SiO2, Fe(OH)3, h3SO4, HgO, CaCO3, HNO2, CrCl3, Na2S, AlPO4.
5. Запишите уравнения диссоциации: NaCl, Ca(NO3)2, Ba(OH)2, Fe(SO4)3.
6. Записать уравнения реакций в соответствии со схемой:
а) гидроксид железа (II) → оксид железа (II) + вода;
б) соляная кислота + цинк → хлорид цинка + водород;
в) гидроксид железа (III) + соляная кислота → хлорид железа (III) + вода;
7. Осуществите превращения, записав уравнения для переходов:
S → SO2 → Na2SO3 → SO2.
infourok.ru
8 класс
Контрольная работа №1 по теме «Атомы химических элементов»
Вариант 1
б) Расположите химические элементы в порядке возрастания неметаллических свойств: Si, P, Mg.
2. Определить вид химической связи для следующих веществ: О2, Na, KCl, h3S. Составить схемы образования любых двух видов связи.
3. Определите число протонов, нейтронов и электронов для изотопов хлора 37Cl и 35Cl и кислорода 17О и 18О.
4. Назовите химические элементы, а также определите заряды ядер этих атомов, зная распределение электронов по энергетическим уровням:
2, 8, 2
2, 2
2, 8, 6
Определите, к какому типу элементов они относятся (металлы или неметаллы).
5. Напишите названия и символы трёх частиц (1 атом и 2 иона), расположение у которых соответствует ряду чисел:
2, 8, 8.
Вариант 2
б) Расположите химические элементы в порядке возрастания неметаллических свойств: F, I, Br.
2. Определить вид химической связи для следующих веществ: N2, Ca, NaCl, SO2. Составить схемы образования любых двух видов связи.
3. Определите число протонов, нейтронов и электронов для изотопов аргона 39Ar и 40Ar и калия 39К и 40К.
4. Назовите химические элементы, а также определите заряды ядер этих атомов, зная распределение электронов по энергетическим уровням:
2, 8, 5
2
2, 8, 3
Определите, к какому типу элементов они относятся (металлы или неметаллы).
5. Напишите названия и символы трёх частиц (1 атом и 2 иона), расположение у которых соответствует ряду чисел:
2, 8
Контрольная работа №2 по теме «Простые вещества и соединения химических элементов»
Вариант 1
а) оксид фосфора (V) + вода → фосфорная кислота
б) соляная кислота + алюминий → хлорид алюминия + водород
в) нитрат серебра + хлорид железа (III) → хлорид серебра + нитрат железа (III)
г) гидроксид цинка (II) → оксид цинка (II) + вода.
Вариант 2
а) оксид серы (IV) + вода → сернистая кислота
б) серная кислота + цинк→ сульфат цинка + водород
в) азотная кислота + гидроксид хрома (III) → нитрат хрома (III) + вода
г) гидроксид железа (II) → оксид железа (II) + вода.
Контрольная работа №3 по теме «Изменения, происходящие с веществами»
Вариант 1
а) оксид фосфора (V) + вода → фосфорная кислота
б) соляная кислота + алюминий → хлорид алюминия + водород
в) нитрат серебра + хлорид железа (III) → хлорид серебра + нитрат железа (III)
г)гидроксид цинка (II) → оксид цинка (II) + вода
2. Рассчитайте объём углекислого газа (н.у.), полученного при полном сгорании 2,4 г углерода.
3. Какое количество вещества и масса железа потребуется для реакции с 16 г серы? Схема реакции: Fe + S = FeS
Вариант 2
а) оксид серы (IV) + вода → сернистая кислота
б) серная кислота + цинк → сульфат цинка + водород
в) азотная кислота + гидроксид хрома (III) → нитрат хрома (III) + вода
г)гидроксид железа (II) → оксид железа (II) + вода
2. Рассчитайте объём водорода (н.у.), полученного при взаимодействии
48 г магния с избытком соляной кислоты.
3. Вычислите массу натрия, необходимого для получения 10,7 г хлорида натрия в избытке хлора. Схема реакции: 2Na + Cl2 = 2NaCl
Итоговая контрольная работа по химии в 8 классе за учебный год
Вариант 1
1. Расположите, используя Периодическую систему химических элементов Д.И.Менделеева, следующие элементы в порядке увеличения металлических свойств их атомов: К, Са, Мn.
2. Определите тип химической связи в веществах, дать им названия: Fe, КCl, О2, HCl.
3. Рассчитайте число протонов, электронов и нейтронов для атомов следующих изотопов: 37Cl и 35Cl.
4. Дать названия следующим соединениям и определить их класс:
NaOH, CO2, Fe(OH)2, h3SO3, Na2O, К2СО3, HNO3, Cr2О3, NaNO3, Al2(SO4)3.
5. Запишите уравнения диссоциации: KCl, Na(NO3)2, Ca(OH)2, h3SO4.
6. Записать уравнения реакций в соответствии со схемой:
а) гидроксид железа (III) → оксид железа (III) + вода;
б) соляная кислота + алюминий → хлорид алюминия + водород;
в) гидроксид железа (II) + соляная кислота → хлорид железа (II) + вода;
7. Осуществите превращения, записав уравнения для переходов:
С → СO2 → Na2СO3 → СO2.
Вариант 2
8 класс
1. Расположите, используя Периодическую систему химических элементов Д.И.Менделеева, следующие элементы в порядке увеличения металлических свойств их атомов: Nа, Mg, Si.
2. Определите тип химической связи в веществах, дать им названия: Al, MgCl2, h3, h3S.
3. Рассчитайте число протонов, электронов и нейтронов для атомов следующих изотопов: 24Mg и 25Mg.
4. Дать названия следующим соединениям и определить их класс:
KOH, SiO2, Fe(OH)3, h3SO4, HgO, CaCO3, HNO2, CrCl3, Na2S, AlPO4.
5. Запишите уравнения диссоциации: NaCl, Ca(NO3)2, Ba(OH)2, Fe(SO4)3.
6. Записать уравнения реакций в соответствии со схемой:
а) гидроксид железа (II) → оксид железа (II) + вода;
б) соляная кислота + цинк → хлорид цинка + водород;
в) гидроксид железа (III) + соляная кислота → хлорид железа (III) + вода;
7. Осуществите превращения, записав уравнения для переходов:
S → SO2 → Na2SO3 → SO2.
uchkopilka.ru
Итоговая контрольная работа по химии для студентов средних профессиональных образовательных учреждений.
Работа рассчитана на 2 часа.
1 вариант
ЧастьА
А1. Порядковый номер химического элемента всегда равен … в атоме:
числу протонов, числу нейтронов и числу электронов;
числу протонов и числу нейтронов;
числу протонов и числу электронов;
числу электронов и числу нейтронов.
А2. Углерод – это элемент:
главной подгруппы IV группы
побочной подгруппы IV группы
главной подгруппы VII группы
побочной подгруппы VII группы
А3. Сколько стадий электролитической диссоциации имеет h4PO4:
один
две
три
не диссоциирует.
А4. Металлические свойства химических элементов в ряду Na – Mg – Al – Si:
усиливаются
ослабевают
не изменяются
изменяются периодически.
А5. Физический смысл номера периода в том, что он определяет:
число энергетических уровней атома
число протонов в ядре атома
число электронов на внешнем слое атома
число нейтронов в атоме.
А6. Электронная формула атома серы:
1S22S22P6
1S22S22P63S1
1S22S22P63S23P6
1S22S22P63S23P4.
А7. Ядро атома 87Sr содержит:
87p и 38n
38p и 49n
49p и 38n
38p и 87n.
А8. Атомы азота и фосфора имеют:
одинаковое число электронных слоев
одинаковое число электронов внешнего электронного слоя
одинаковое число протонов в ядре
одинаковые радиусы.
А9. В молекуле водорода химическая связь:
ковалентная полярная
ионная
ковалентная неполярная
металлическая.
А10. Вычислите массу пропана количеством вещества 0,25 моль:
11 г.
1,1 г.
15 г.
1,5 г.
А11. К моносахаридам относится:
глюкоза
сахароза
крахмал
клетчатка.
А12. Вещества, имеющие один и тот же состав и одну и ту же молекулярную массу, но различающихся строением молекул называют:
аналогами
гомологами
изомерами
углеводами.
А13. К классу алкенов относится вещество состава:
C2h5
Ch5
C2h3
C2H5OН
А14. Укажите функциональную группу, определяющую свойства альдегидов:
– COH
– OH
– COOH
– Nh3.
А15. Вещества с общей формулой Cnh3n относятся к классу:
алкинов
алканов
алкенов
алкадиенов.
А16. Структурной формуле Ch3=CH- CH=Ch3 соответствует название:
бутилен
бутадиен
бутин
бутан.
Часть В
В1. Установите соответствие между формулами веществ и их принадлежностью к определенным классам неорганических веществ.
Формула веществ классы неорганических веществ
1) NaCl А) кислота
2) h3CO3 Б) основание
3) Al(OH)3 В) основной оксид
4) SO2 Д) кислотный оксид
Е) соль
В2. Установите соответствие между названиями химических элементов и их типами.
Названия элементов типы элементов
1) алюминий А) s-элемент
2) натрий Б) p-элемент
3) железо В) d-элемент
4) иод. Г) f-элемент
В3. Запишите пропущенное слово в нужном по смыслу падеже.
Вещество, в узлах кристаллической решетки которого находятся частицы K+ и Cl- , образовано _______________связью.
В4. Установите соответствие между металлами и неметаллами и их свойствами:
| 1) Проявляют восстановительные свойства | А) Металлы |
| 2) Проявляют и восстановительные и окислительные свойства | Б) Неметаллы |
| 3) Обладают большой электрической проводимостью | |
| 4) Образуют кислотные оксиды | |
| 5) На внешнем электронном слое содержат 4-7 электронов | |
| 6) На внешнем электронном слое содержат 1-3 электрона |
| 1 | 2 | 3 | 4 | 5 | 6 |
В5. Установите соответствие между формулами веществ и их принадлежностью к классам органических соединений.
Формула веществ классы органических веществ
1) Ch4 – COH А) углеводы
2) Nh3 – Ch3 – COOH Б) спирты
3) C2H5OH В) альдегиды
4) Ch4 – COOH Г) аминокислоты
Д) карбоновые кислоты
В6. Выберите между данными углеводородами предельные:
А) C6h24
Б) C5h20
В) C2H6
Г) C3H6
Д) C4h20
Е) C2h3
Ответ:_________________(запишите соответствующие буквы в алфавитном порядке)
Часть С.
С1. Методом электронного баланса подберите коэффициенты в схеме следующей окислительно-восстановительной реакции:
Zn + HNO3 → Zn(NO3)2 + Nh5NO3 + h3O
C2. Какие массы этановой кислоты и этанола потребуются для получения 8,8 г эфира?
С3. Осуществить цепь превращений:
Ch5→C2h3→Ch4COH→Ch4COOH
2 вариант
Часть А
А1. Химическая формула гидрокарбоната натрия:
NaHSO4
NaHCO3
NaHSO3
NaHS.
А2. Марганец – это элемент:
главной подгруппы IV группы
побочной подгруппы IV группы
главной подгруппы VII группы
побочной подгруппы VII группы.
А3. Сколько стадий электролитической диссоциации имеет h3SO4:
один
две
три
не диссоциирует.
А4. Металлические свойства химических элементов в ряду Li – Na – K – Rb:
усиливаются
ослабевают
не изменяются
изменяются периодически.
А5. Физический смысл номера группы в том, что он определяет:
число энергетических уровней атома
число протонов в ядре атома
число электронов на внешнем слое атома
число нейтронов в атоме.
А6. Электронная формула атома натрия:
1S22S22P6
1S22S22P63S1
1S22S22P63S23P6
1S22S22P63S23P4.
А7. Ядро атома 75As содержит:
75p и 33n
33p и 42n
42p и 33n
33p и 75n.
А8. Атомы калия и кальция имеют:
одинаковое число электронных слоев
одинаковое число электронов внешнего электронного слоя
одинаковое число протонов в ядре
одинаковые радиусы.
А9. В молекуле оксида магния химическая связь:
ковалентная полярная
ионная
ковалентная неполярная
металлическая.
А10. Вычислите объем пропана количеством вещества 0,25 моль:
5,6 л.
56 л.
5,6 г.
0,56 л.
А11. К дисахаридам относится:
глюкоза
сахароза
крахмал
клетчатка.
А12. Вещества, сходные по химическим свойствам, состав которых отличается на целое число групп Ch3, называют:
аналогами
гомологами
изомерами
углеводами.
А13. К классу алкинов относится вещество состава:
C2h5
Ch5
C2h3
C2H5OН
А14. Укажите функциональную группу, определяющую свойства спиртов:
– COH
– OH
– COOH
– Nh3.
А15. Вещества с общей формулой Cnh3n-2 относятся к классу:
алкинов
алканов
алкенов
аренов.
А16. Структурной формуле Ch3=CH- Ch3-Ch4 соответствует название:
бутилен
бутадиен
бутин
бутан.
Часть В
В1. Установите соответствие между порядковыми номерами химических элементов и их типами.
Порядковые номера Типы элементов
1) 24; А) s-элемент
2) 34; Б) p-элемент
3) 38; В) d-элемент
4) 54. Г) f-элемент.
В2. Ковалентная полярная связь образуется между атомами в веществах:
А) кислород
Б) аммиак
В) железо
Г) сернистый газ
Д) азот
Е) оксид углерода
Ответ:____________________(Запишите соответствующие буквы в алфавитном порядке)
В3. Установите соответствие между формулами веществ и их принадлежностью к определенным классам неорганических веществ.
Формула веществ классы неорганических веществ
1) K2SO4 А) кислота
2) HCl Б) основание
3) MgO В) основной оксид
4) NaOH Д) кислотный оксид
Е) соль
В4. Запишите пропущенное слово в нужном по смыслу падеже.
Процесс присоединения воды называется реакцией_____________________.
В5. . Установите соответствие между формулами веществ и их принадлежностью к классам органических соединений.
Формула веществ классы органических веществ
1) C6h22O6 А) углеводы
2) Ch4 – COOCh4 Б) спирты
3) C4H9OH В) альдегиды
4) Ch4 – Ch3 – COOH Г) сложные эфиры
Д) карбоновые кислоты
В6. Установите соответствие между аминами и аминокислотами и их свойствами:
| 1) Проявляют кислотные и основные свойства | А) Аминокислоты |
| 2) Проявляют основные свойства | Б) Амины |
| 3) Являются газами, более сложные жидкости | |
| 4) Являются бесцветными кристаллическими веществами | |
| 5) Нерастворимы в органических растворителях | |
| 6) Обладают сходным с аммиаком запахом |
| 1 | 2 | 3 | 4 | 5 | 6 |
Часть С.
С1. Методом электронного баланса подберите коэффициенты в схеме следующей окислительно-восстановительной реакции:
MnO2 + KClO3 + KOH → K2MnO4 + KCl + h3O
C2. Вычислите массу хлора, прореагировавшую с йодидом натрия, если масса полученного йода равна
25,4 г при выходе продукта 95 %.
С3. Осуществить цепь превращений:
C2H5OH → C2h5 → C2H5Br → C2H5OH
Ключи
| Вар1 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | В1 | В 2 | В3 | В4 | В5 | В6 |
| 3 | 1 | 3 | 2 | 1 | 4 | 2 | 2 | 3 | 1 | 1 | 3 | 1 | 1 | 3 | 2 | Е,а,б,д | Б,а,в,б | ионная | А,б,а,б,б,а | В,г,б,д | А,в,д | |
| Вар2 | 2 | 4 | 2 | 1 | 3 | 2 | 2 | 1 | 2 | 1 | 2 | 2 | 3 | 2 | 1 | 1 | В,б,а,б | бге | авб | гидратация | агбд | абабаб |
Критерии оценивания:
За каждый правильный ответ в части А– 1 балл.
За правильный ответ в части В – 1 балл (за каждый правильный ответ)
За правильные ответы в части С – 3 балла (за каждое задание)
Оценка за тестовую работу:
«5»: 90% – 100 %
«4»: 72% - 89 %
«3»: 50% - 71 %.
«2»: менее 50 % ответов
Требования к уровню подготовки студентов
В результате изучения учебной дисциплины «Химия» студент должен:
знать/понимать
--важнейшие химические понятия: вещество, химический элемент, атом, молекула, атомная и молекулярная массы, ион, аллотропия, изотопы, электроотрицательность, валентность, степень окисления, моль, молярная масса и объём, растворы, электролиты, диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
-основные законы: сохранения массы веществ, постоянства состава, периодический закон;
-теории: химической связи, электролитической диссоциации, строения органических соединений;
-вещества и материалы: основные металлы и сплавы, серная, соляная, азотная и уксусная кислоты, щёлочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, целлюлоза, белки, волокна, каучуки, пластмассы.
уметь
называть вещества по тривиальной или международной номенклатуре;
-определять валентность и степень окисления элементов, тип связи, заряд иона, характер среды раствора, окислитель и восстановитель, принадлежность веществ к разным классам;
-характеризовать элементы малых периодов, общие свойства металлов и неметаллов, основных классов органических и неорганических соединений;
-объяснять зависимость свойств веществ от их состава и строения, природу связи, зависимость скорости реакции и положения равновесия от различных факторов;
-выполнять эксперимент по распознаванию веществ;
-проводить поиск информации из разных источников;
- решать расчетные и экспериментальные задачи;
-использовать знания и умения в практической и повседневной жизни.
Перечень материалов, оборудования и информационных источников, используемых в аттестации
1.Барковский Е.В., Врублевский А.И. Тесты по химии. Органическая химия М. 2012.
2. Химия: учеб. для студ. учреждений сред. проф. образования/ Ю.М. Ерохин.- 15 – е издание М.: Издательский центр « Академия», 2015.- 400с.
3. Сборник задач и упражнений по химии (с дидактическим материалом) : учеб. пособие для студ. Средних проф. Учебн. Заведений/ Ю.М. Ерохин, В.И. Фролов.- 5 – е издание М.: Издательский центр «Академия»,2010 .-304с.
xn--j1ahfl.xn--p1ai