

 Входной контроль по химии в 10 профильном классе
Входной контроль по химии в 10 профильном классеВходной контроль
по теме «Повторение курса химии 8 класса»
Вариант 2
Часть А. Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +8 )2 )6 , в Периодической системе занимает положение:
А. 2-й период, главная подгруппа VII группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа VI группы.
Г. 2-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 2s22p1 соответствует атому элемента:
А. Бора. Б. Серы. В. Кремния. Г. Углерода.
3.(2 балла) Элемент с наиболее ярко выраженными металлическими свойствами:
А. Калий Б. Литий В. Натрий Г. Рубидий
4.(2 балла) Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
А. Э2О Б. ЭО В. ЭО2 Г. ЭО3
5.(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 6 в Периодической системе:
А. Амфотерный. Б. Кислотный. В. Основный.
6.(2 балла) Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Алюминия Б. Кремния В. Углерода Г. Фосфора
7.(2 балла) Схема превращения С0 C+4 соответствует химическому уравнению:
А. СО2 + СаО = СаСО3Б. СО2 + Н2О = Н2СО3
В. С + 2СuО = 2Сu + СО2Г. 2С + О2 = 2СО
8.(2 балла) Сокращённое ионное уравнение реакции Н+ + ОН- = Н2О соответствует взаимодействию:
А. Гидроксида меди (II) и раствора серной кислоты.
Б. Гидроксида натрия и раствора азотной кислоты.
В. Оксида меди (II) и соляной кислоты.
Г.Цинка и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с оксидом меди (II):
А. h3O. Б. MgO. В. CaCl2. Г. h3SO4.
10.(2 балла) Элементом Э в схеме превращений Э Э2О5 Н3ЭО4 является:
А. Азот. Б. Сера. В. Углерод. Г. Фосфор.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула гидроксида:
1.h4PO4. 2.Ba(OH)2 . 3. Fe(OH)3 . 4. h3SO4..
Формула оксида:
А. FeO .Б. Fe2O3. В. BaO. Г. SO3. Д. P2O5.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 20 и водородного соединения элемента с порядковым номером 17 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла) Составьте уравнение химической реакции, соответствующей схеме С0 C+4. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений
SO2 SO3 h3SO4 Na2SO4
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции СаСО3 =СаО + СО2
рассчитайте массу оксида кальция, который образуется при разложении 200 г карбоната кальция
Входной контроль
по теме «Повторение курса химии 8 класса»
Вариант 1
Часть А. Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +14 )2 )8 )4 , в Периодической системе занимает положение:
А. 4-й период, главная подгруппа III группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа IV группы.
Г. 3-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 3s23p5 соответствует атому элемента:
А. Магния. Б. Серы. В. Фосфора. Г. Хлора.
3.(2 балла) Элемент с наиболее ярко выраженными неметаллическими свойствами:
А. Кремний. Б. Магний. В. Сера. Г. Фосфор.
4.(2 балла) Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
А. Э2О Б. ЭО В. Э2О3 Г. ЭО3
5.(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
А. Амфотерный Б. Кислотный В. Основный
6.(2 балла) Основные свойства наиболее ярко выражены у высшего гидроксида:
А. Бария. Б.Бериллия. В.Кальция. Г. Магния
7.(2 балла) Схема превращения Сu+2 Cu0 соответствует химическому уравнению:
А. CuO + h3 = Cu + h3O Б. CuO + 2HCl = CuCl2 + h3O
В. Cu + Cl2 = CuCl2 Г. 2Cu + O2 = 2CuO
8.(2 балла) Сокращённое ионное уравнение реакции Ba2+ + SO42- = BaSO4 соответствует взаимодействию:
А. Бария и раствора серной кислоты.
Б. Оксида бария и соляной кислоты.
В. Оксида бария и раствора серной кислоты.
Г. Хлорида бария и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с раствором гидроксида кальция:
А. HCl. Б.CuO. В. h3O. Г. Mg.
10.(2 балла) Элементом Э в схеме превращений Э ЭО2 Н2ЭО3 является:
А. Азот. Б. Магний. В. Алюминий. Г. Углерод.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула оксида:
1. CuO. 2. CO2. 3. Al2O3. 4. SO3.
Формула гидроксида:
А. h3SO4. Б. Al(OH)3 .В. Cu(OH)2. Г. CuOH. Д. h3CO3.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 3 и водородного соединения элемента с порядковым номером 9 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла). Составьте уравнение химической реакции, соответствующей схеме S0 S-2. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений
ВаO Ва(OН)2 ВаСO3 ВаСl2
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции 2Mg + O2 = 2MgO
рассчитайте объем кислорода (н.у.), необходимого для полного сгорания 1,2 г магния.
Система выставления оценок.
Данная контрольная работа является комбинированной, что позволяет проверить у учащихся имеющиеся знания и подготовить их к сдаче единого государственного экзамена.
Работа состоит из двух частей.
Часть А содержит тестовые задания с выбором ответа, предусматривающие выбор одного правильного ответа на каждый вопрос.
На выполнение этой части предоставляется 15 минут.
Часть В и С содержит задания со свободной формой ответа, которые предусматривают установление последовательности, дополнение пропущенного, проведение расчетов по химическим формулам и уравнениям реакций, написание уравнений химических реакций и на соотнесение
Контрольная работа рассчитана на 40 минут и оценивается в 50 баллов.
Выполнение каждого задания теста части А оценивается двумя баллами. Заданий со свободной формой меньше, но они оцениваются гораздо более высоким баллом. В этих заданиях оценивается не только полнота и правильность выполнения, но и отдельные этапы и элементы.
Шкала перевода в пятибалльную систему оценки:
- 88 - 100% - «5»
- 62 – 86% - «4»
- 36 - 61% - «3»
- 0 - 35% - «2»
Ключи
Вариант №1.
Часть А.
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
В
Г
В
Г
Б
А
А
Г
А
Г
Часть В.
В11.(6 баллов)
1 – В, 2 – Д, 3 – Б, 4 – А.
В12.(8 баллов)
LiOH + HF = LiF + h3O обмена, нейтрализации
гидроксид лития + фтороводород = фторид лития + вода.
Часть С
С13. (4 балла).
S0 + h3 = h3S-2
S – окислитель; H – восстановитель.
С14. .(8 баллов) ВаO Ва(OН)2 ВаСO3 ВаСl2
ВаO + Н2О = Ва(OН)2
Ва(OН)2 +СО2 = ВаСO3 + Н2О
ВаСO3 + 2НCl = ВаСl2 + Н2О + СО2
Ba2+ + CO32- + 2H+ + 2Cl-- = Ba2+ + 2Cl-- + Н2О + СО2
Ba2+ + CO32- + 2H+ = Ba2+ + Н2О + СО2
С15. (4 балла)
Дано:
m= 1,2г V– x
m(Mg) = 1,2г
2Mg + O2 = 2MgO
Найти:
n = 2моль n = 1моль
V(O2) – ?
М = 24г/моль VМ = 22,4 л/моль
m = 48г V = 22,4л
1,2/48 = х/22,4
х = 1,2 х 22,4 / 48 = 0,56 л
Ответ: 0,56 л
Вариант №2.
Часть А.
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
Б
А
Г
А
Б
Г
В
Б
Г
Г
Часть В.
В11.
1 – Д, 2 – В, 3 – Б, 4 – Г.
В12.
Са(OH)2 + 2HСl = CaCl2 + 2 h3O обмена, нейтрализации
гидроксид кальция + соляная кислота = хлорид кальция + вода.
Часть С
С13.
С0 + О2 = С+4О2
О – окислитель; С – восстановитель.
С14. SO2 SO3 h3SO4 Na2SO4
2SO2 + О2 = 2SO3
SO3 + Н2О = h3SO4
h3SO4 + 2 NaOH = Na2SO4 + 2Н2О
2H+ + SO42-- + 2Na+ + 2OH-- = 2Na+ + SO42-- + 2Н2О
H+ + OH-- = Н2О
С15.
Дано:
m= 200г m– x
m(CaCO3)= 200г
CaCO3= CaO + CO2
Найти:
n = 1моль n = 1моль
m (CaO) – ?
М = 100г/моль M= 56г/моль
m = 100г m = 56г
200/100 = х/56
х = 200 х 56 / 100 = 112г
Ответ: 112г
infourok.ru


 Входной контроль по химии в 10 профильном классе
Входной контроль по химии в 10 профильном классе
Вариант 1
Часть 1. С одним вариантом ответа ( оценивается по 1 баллу)
1. Укажите заряд ядра атома и число неспаренных электронов у атома фосфора в основном состоянии
1) +5 и 15 2) +15 и 3 3) +15 и 5 4) +15 и 1
2. Какой вид химической связи в молекуле аммиака:
1) ковалентная неполярная 3) ковалентная полярная
2) металлическая 4) ионная
3. К кислотным оксидам относится каждое из двух веществ:
1) СО2, СаО 3) SO2, CO
2) SO2, P2O5 4) P2O5, Al2O3
4. Верны ли следующие суждения об использовании лабораторного оборудования и правила хранения препаратов бытовой химии?
А) Для отбора определенного объема жидкости используют мерный цилиндр
Б) Средства бытовой химии следует хранить отдельно от продуктов питания.
1) верно только А 3) верны оба суждения
2) верно только В 4) оба суждения неверны
5. В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
Nh4 и PCl5 3) N2O3 и Ph4
Nh4 и Ca3P2 4) NaNO2 и P2O5
6. К электролитам относится
1) С2Н5ОН 2) С12Н24 3) Са(ОН)2 4) СО
7. Хлорид-ионы образуются при электролитической диссоциации:
1) KClO4 2) KClO3 3) Ch4Cl 4) KCl
8. Взаимодействие соляной кислоты и едкого натра отвечает краткое ионное уравнение:
1) HCl + OH- = h3O + Cl- 3) H+ + NaOH = h3O + Na+
2) H+ + OH- = h3O 4) H+ + Cl- + OH- = h3O + Cl-
9. Различить растворы соляной и серной кислот можно, если добавить к ним раствор
1) лакмуса 3) фенолфталеина
2) нитрата бария 4) гидроксида калия
10. Массовая доля азота в нитрате алюминия равна
1) 14,0% 2) 19,7% 3) 6,6% 4) 21,3%
Часть 2. При выполнении заданий выберите один или несколько правильных ответов и запишите их в порядке возрастания цифр (за правильный ответ по 2 балла)
11. В ряду химических элементов Li – Be – B
1) увеличивается заряд ядра атома
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
12. Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) HCl + KMnO4 → MnCl2 + KCl + Cl2 + h3O 1) KMnO4
Б) h3S + HClO3 → HCl + S + h3O 2) HCl
В) HCl + Mg → MgCl2 + h3 3) HClO3
4) h3S
5) Mg
13. Установите соответствие между веществом и реагентами, с которыми оно может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ
А) железо 1) Na2O, Mg
Б) оксид углерода (IV) 2) K2SO4, HNO3
В) гидроксид калия 3) HCl, O2
4) CuSO4, Al(OH)3
Часть 3. Для выполнения задания части 3 необходимо записать полное решение и ответ к нему.
14. Дана схема превращений:
CuSO4 → X → Cu(NO3)2 → Cu
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции. (4 балла)
15. Рассчитайте массу осадка, который выпадает при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей 15%. (4 балла)
16. К раствору соли добавили гидроксид натрия при этом выпал осадок голубого цвета, а при добавлении к этому же раствору соли нитрат серебра выпадает осадок белого цвета. Определить исходное вещество. Написать уравнения всех реакций. (4 балла)
Входной контроль по химии в 10 профильном классе
Вариант 2
Часть 1. С одним вариантом ответа ( оценивается по 1 баллу)
1. Укажите заряд ядра атома и число неспаренных электронов у атома серы в основном состоянии.
+6 и 16 2) +16 и 6 3) +16 и 4 4) +16 и 2
2. Ковалентная полярная связь образуется между атомами
натрия и брома 3) водорода
серы и кислорода 4) калия и хлора
3. Только к основным оксидам относится каждое из двух веществ:
1) СО2, СаО
2) SO2, P2O5
3) СаО, Al2O3
4) BaO, Na2O
4. Верны ли следующие суждения о правилах обращения с веществами?
А. Химические вещества нельзя определять по запаху.
Б. Сыпучие вещества следует брать химической ложечкой.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
5. Такую же степень окисления, как и в SO2, сера имеет в соединении
K2SO4 3) h3SO3
(Nh5)2S 4) SO3
6. Не является электролитом
1) NaOH 2) Ch4OH 3) Са(ОН)2 4) HCl
7. Хлорид-ионы образуются при электролитической диссоциации:
1) NaClO4 2) NaCl 3) Ch4Cl 4) NaClO3
8. Взаимодействие азотной кислоты и едкого калия отвечает краткое ионное уравнение:
1) HNO3 + OH- = h3O + NO3- 3) H+ + KOH = h3O + K+
2) H+ + OH- = h3O 4) H+ + NO3- + OH- = h3O + NO3-
9. С помощью соляной кислоты можно распознать:
1) карбонат натрия 3) хлорид натрия
2) сульфат бария 4) нитрат магния
10. Массовая доля кислорода в нитрате алюминия равна
1) 7,5% 2) 22,5% 3) 42,4% 4) 67,6%
Часть 2. При выполнении заданий выберите один или несколько правильных ответов и запишите их в порядке возрастания цифр (за правильный ответ по 2 балла)
11. В ряду химических элементов Be – Mg – Ca
1) уменьшается число электронов на внешнем уровне
2) возрастает высшая степень окисления
3) увеличиваются основные свойства образуемых гидроксидов
4) увеличивается электроотрицательность
5) возрастает атомный радиус
12. Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) h3S + O2 → SO2 + h3O 1) SO2
Б) h3SO4 + Na → Na2SO4 +h3S + h3O 2) h3S
В) SO2 + Br2 + h3O → h3SO4 + HBr 3) Na
4) h3O
5) Br2
13. Установите соответствие между веществом и реагентами, с которыми оно может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ
А) оксид цинка 1) K2O, Fe
Б) углекислый газ 2) SO2, h3O
В) серная кислота (разб.) 3) HCl, Ca(OH)2
4) h3O, C
Часть 3. Для выполнения задания части 3 необходимо записать полное решение и ответ к нему.
14. Дана схема превращений:
CuСl2 → X → Cu(NO3)2 → Cu
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращенное ионное уравнение реакции. (4 балла)
15. В соляной кислоте растворили 1,506 г известняка, содержащего 77% карбоната кальция. Определите объем углекислого газа, выделившегося при этом. (4 балла)
16. К раствору соли добавили гидроксид натрия при этом выпал осадок голубого цвета, а при добавлении к этому же раствору соли хлорида бария выпадает осадок белого цвета. Определить исходное вещество. Написать уравнения всех реакций. (4 балла)
infourok.ru
Входной контроль 11 класс
Вариант 1.
1. Число электронных слоев и число электронов на внешнем электронном слое атомов брома соответственно равны:
1) 7 и 4; 2) 4 и 7; 3) 35 и 7; 4) 4 и 35.
2. Электронная конфигурация атома железа:
1) ls22s22p63s23p6 ;2) 1s22s22p63s23p64s24p 2 ; 3) ls22s22p63s23p63d8 ;
4) 1s22s22p63s23p63d64s2 .
3. Заряд ядра +8 имеют атомы химического элемента:
1) азота; 2) кислорода; 3) серы ; 4) хлора
4. Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Радиус атомов в периоде с увеличением заряда ядра атома увеличивается. Б. Радиус атомов в главной подгруппе с уменьшением заряда ядра атома увеличивается.
1) Верно только А; 2) верны оба суждения; 3) верно только Б; 4) оба суждения неверны.
5. Номер периода элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
6. Элементу, электронная формула атома которого ls22s22p63s23p63d54s2 соответствует высший оксид, формула которого: 1) Вг2О7; 2) MnО2; 3) MnO;
4) Mn2О7.
7. Наибольшую электроотрицательность имеет:
1) фосфор; 2) хлор; 3) кремний; 4) сера.
8. В ряду химических элементов фтор → хлор → бром:
1) усиливаются неметаллические свойства; 2) увеличивается радиус атома;
3) увеличивается степень окисления в летучих водородных соединениях;
4) увеличивается электроотрицательность.
9. Ряд химических элементов, в котором неметаллические свойства усиливаются: 1) фтор → бром → иод; 2) кремний → фосфор → хлор; 3) кислород → сера → селен
10. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2. P4 , CaF2
4) h3S, Br2, K2S
11. Вещества молекулярного строения характеризуются
1) высокой температурой плавления; 2) низкой температурой плавления;
3) твердостью; 4) электропроводностью.
12. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 1 образует с водородом химическую связь
1) ковалентную полярную; 2) ковалентную неполярную ; 3) ионную ;
4) металлическую
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) Сh5 ; 3) СO ; 4) h3O
14. Установите соответствие между формулой вещества и степенью окисления атома хлора в нём.
ФОРМУЛА ВЕЩЕСТВА
A) Ca(OCl)2
Б) KClO3
B) HClO2
Г) FeCl3
СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА
1) +1
2) +3
3) -1
4) +5
15. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней.
УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
А) 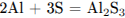 1) от -2 до +4
1) от -2 до +4
Б) 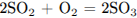 2) от -2 до 0
2) от -2 до 0
В) 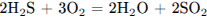 3) от 0 до -2
3) от 0 до -2
Г) 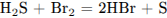 4) от +6 до +4
4) от +6 до +4
5) от +4 до +6
6) от +4 до 0
16. Массовая доля фосфора в фосфате магния равна
1) 23,7%
2) 34,5%
3) 45,2%
4) 55,8%
Входной контроль 11 класс
Вариант 2.
1. Число электронных слоев и число электронов на внешнем электронном слое атомов марганца соответственно равны: 1) 4 и 7; 2) 4 и 2; 3) 7 и 4;
4) 4 и 5.
2. Электронная конфигурация атома ванадия: 1) ls22s22p63s23p63d5 ;
2) ls22s22 p63s23p63d34s2 ; 3) ls22s22p63s23p63d44s1 ; 4) ls 22s22p63s23p64s24p 3
3. Заряд ядра +13 имеют атомы химического элемента:
1) серы ; 2) кислорода ; 3)алюминия ; 4) хлора
4. Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Радиус атома серы больше радиуса атома кислорода.
Б. Радиус атома фосфора меньше радиуса атома серы.
1) верно только А; 2) верны оба суждения; 3) верно только Б;
4) оба суждения неверны.
5. Номер группы элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
6. Наименьшую электроотрицательность имеет:
1) фтор; 3) бром; 2) хлор; 4) иод.
7. В ряду химических элементов барий → кальций → магний:
1) увеличивается радиус атома; 2) усиливаются металлические свойства;
3) уменьшается радиус атома; 4) увеличивается степень окисления в высших оксидах.
8. Ряд химических элементов, в котором металлические свойства ослабевают: 1) литий → бериллий → бор; 2) натрий → магний → алюминий;
3) углерод → кремний → германий
9. Элементу, электронная формула атома которого ls22s22p63s23p4 , соответствует высший оксид, формула которого: 1) SО2; 2) SO3; 3) SeO2;
4) CrО3.
10. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2
2) O2, h3O, CO2
3) h3O.Nh4.Ch5
4) NaB, HBr, CO
11. Молекулярную кристаллическую решетку имеет соединение:
1) сероводород; 2) хлорид натрия; 3) кварц; 4) медь.
12. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 2 образует с кислородом химическую связь
1)ковалентную полярную ; 2) ковалентную неполярную ; 3) ионную
4) металлическую
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) HCl; 3) СO; 4) P2O5
14. Установите соответствие между формулой вещества и степенью окисления атома азота в нём.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
A) Nh5Cl 1) -3
Б) HNO3 2) +3
B) Nh5NO3 3) +5
Г) N2O3 4) -3, +5
15. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления элемента в ней.
Схема изменения степени окисления
А) Fe+3 → Fe+2
Б) S−2 → S+4
В) Fe+3 → Fe0
Г) S+4 → S+6
Уравнение реакции
1) 2Al + Fe2O3 = 2Fe +Аl2O3
2) SO2 + I2 + 2Н2O = h3SO4 + 2HI
3) SO2 + 2NaOH = Na2SO3 + h3O
4) 2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
5) 2h3S + 3O2 = 2SO2 + 2h3O
6) 2Fe(OH)3 = Fe2O3 + 3h3O
16. Массовая доля кислорода в сульфате железа (III) равна
1) 12,2%
2) 20,5%
3) 40,8%
4) 48,0%
Входной контроль 11 класс Вариант 3.
1. Число электронных слоев и число d-электронов в атоме германия соответственно равны: 1) 4 и 10; 2) 4 и 4; 3) 4 и 2; 4) 4 и 0.
2.Электронная конфигурация внешнего электронного слоя ...4s24p3 соответствует атому: 1) мышьяка; 2) фосфора; 3) ванадия; 4) сурьмы
3. Заряд ядра +17 имеют атомы химического элемента:
1) серы ; 2) кислорода; 3)алюминия; 4) хлора
4. Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Электроотрицательность атомов в периоде с уменьшением заряда ядра атома увеличивается. Б. Электроотрицательность атомов в главной подгруппе с увеличением заряда ядра атома увеличивается.
1)Верно только А; 2) верны оба суждения; 3) верно только Б; 4) оба суждения неверны.
5. Наименьший радиус имеет атом: 1) фосфора; 3) мышьяка; 2) азота; 4) сурьмы.
6. Номер периода элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
7. В ряду химических элементов кремний → алюминий → магний: 1)увеличивается степень окисления в высших оксидах и увеличивается радиус атома; 2)уменьшается радиус атома и ослабевают металлические свойства; 3)увеличивается радиус атома и усиливаются металлические свойства; 4)увеличивается электроотрицательность и уменьшается степень окисления в высших оксидах.
8. Ряд химических элементов, в котором металлические свойства ослабевают:
1) германий → олово → свинец; 2) алюминий → магний → натрий; 3) литий → бериллий → бор
9. Химический элемент, в атоме которого электроны по слоям распределены так:
2, 8, 5 образует с магнием химическую связь : 1)ковалентную полярную ;
2) ковалентную неполярную; 3) ионную; 4) металлическую
10. Элементу, электронная формула внешнего электронного слоя атома которого ...3s23p2, соответствует водородное соединение, формула которого: 1) РН3; 2) СН4; 3) Sih5; 4) HI.
11. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CО2 и РС15
12. Вещества атомного строения характеризуются:
1) высокой температурой плавления ; 2) низкой температурой плавления
3) хрупкостью; 4) электропроводностью.
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) h3O ; 3) СO; 4) Ph4
14. Установите соответствие между формулой вещества и степенью окисления углерода в нем.
ФОРМУЛА ВЕЩЕСТВА
СТЕПЕНЬ ОКИСЛЕНИЯ
А) 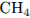
Б) 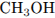
В) 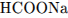
Г) 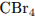
1) -4
2) -2
3) 0
4) +2
5) +4
15. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления азота в ней.
УРАВНЕНИЕ РЕАКЦИИ
ИЗМЕНЕНИЕ СТЕПЕНИ
ОКИСЛЕНИЯ АЗОТА
А) 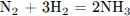
Б) 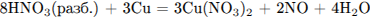
В) 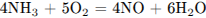
Г) 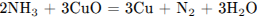
1) от –3 до +2
2) от –3 до 0
3) от 0 до –3
4) от +5 до +2
16. Массовая доля бария в нитрате бария равна
1) 12,9%
2) 20,2%
3) 52,5%
4) 68,8%
Входной контроль 11 класс
Вариант 4.
1. Число электронных слоев и число d-электронов в атоме никеля соответственно равны: 1) 8 и 4; 2) 4 и 2; 3) 4 и 7; 4) 4 и 8.
2.Электронная конфигурация ls22s22p63s23p63d24s2 соответствует атому:
1) скандия; 3) титана; 2) ванадия; 4) германия.
3.Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Электроотрицательность азота больше электроотрицательности фтора.
Б. Электроотрицательность хлора меньше электроотрицательности брома.
1)Верно только А; 2) верны оба суждения; 3)верно только Б; 4) оба суждения неверны.
4. Наибольший радиус имеет атом: 1) бора; 2) кислорода; 3) азота; 4) углерода.
5. Номер группы элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
6. Заряд ядра + 16 имеют атомы химического элемента:
1) неона; 2) кислорода; 3) серы ; 4) хлора
7. Элементу, электронная формула атома которого ls22s22p5 , соответствует водородное соединение, формула которого: 1) HF; 2) НС1; 3) СН4; 4) Nh4
8. В ряду химических элементов азот → кислород → фтор: 1) уменьшается радиус атома и увеличивается электроотрицательность; 2) уменьшается радиус атома и ослабевают неметаллические свойства; 3)увеличивается радиус атома и усиливаются неметаллические свойства; 4) увеличивается радиус атома и ослабевает электроотрицательность,
9. Ряд химических элементов, в котором неметаллические свойства усиливаются: 1) фтор → бром → иод; 2) иод → бром → хлор 3) кислород → сера → селен; 4) бор → углерод → азот.
10. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2) СО, CuO, Ch4Cl
3) BaS, C6H6, h3
4) C6H5NO2, F2, CC14
11. Вещества молекулярного строения характеризуются:
1)высокой температурой плавления; 2) низкой температурой плавления ;
3) твердостью ; 4) электропроводностью.
12. . Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 2 образует с хлором химическую связь:
1)ковалентную полярную; 2) ковалентную неполярную ; 3) ионную;
4) металлическую
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества:
1) СO2 ; 2) Сh5 ; 3) Nh4 ;4) СO
14. Установите соответствие между формулой вещества и степенью окисления азота в нем.
ФОРМУЛА ВЕЩЕСТВА
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
A) 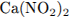
Б) 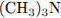
B) 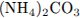
Г) 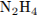
1) -3
2) -2
3) +2
4) +3
5) +4
6) +5
15. Установите соответствие между уравнениями реакций и изменением степени окисления азота.
УРАВНЕНИЕ РЕАКЦИИ
A) 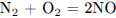
Б) 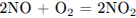
В) 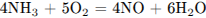
Г) 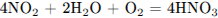
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) от -3 до +2
2) от +4 до +5
3) от 0 до +2
4) от +3 до +2
5) от +2 до +4
16. Массовая доля железа в сульфате железа (III) равна
1) 12,2%
2) 20,5%
3) 28%
4) 48,0%
doc4web.ru
Входная контрольная работа 9 класс 2016
1 вариант
1. Три электрона находятся во внешнем электронном слое атома
1) углерода 2) мышьяка 3) алюминия 4) лития
2. Ковалентную полярную связь имеет каждое из двух веществ
1) оксид натрия и оксид хлора(VII)
2) оксид кремния и вода
3) хлорида лития и кислород
4) сероводород и хлор
3. Низшие степени окисления азота и серы соответственно равны
1) −З и −2 2) +1 и +2 3) +3 и + 2 4) −1 и −2
4. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории и с препаратами бытовой химии?
А. В лаборатории наличие кислоты в растворе определяют на вкус.
Б. При работе с препаратами бытовой химии, содержащими щёлочь, необходимо использовать резиновые перчатки.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
5. На какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната кальция?
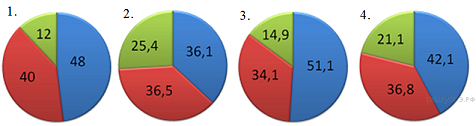
6. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов S →P → Si происходит уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
7. Установите соответствие между формулами и названиями солей.
Формула Название соли
А) KCl 1) сульфат калия
Б) KNO3 2) карбонат калия
В)K2CO3 3) фосфат калия
4) хлорид калия
5) нитрат калия
8. Установите соответствие между уравнением реакции и ее типом.
Уравнение реакции Тип реакции
А) Zn (OH)2= ZnO + h3O 1) обмена
Б) 2Al + 3 S = Al2S3 2) разложения
В)BaO + 2HCl= BaCl2 + h3 О 3) замещения
Г) 2K + 2HCl =2KCl + h3 4) соединения
9. Напишите уравнения реакций, отвечающие следующей цепочке превращений:
калий → оксид калия → гидроксид калия→ сульфат калия
10. Решите задачу.
Какой объем водорода выделится при взаимодействии 11,5 г натрия с серной кислотой?
2 вариант
1. Одинаковое число электронных слоев, содержащих электроны, имеют атомы элементов
1)  и
и  2)
2)  и
и  3)
3)  и
и  4)
4)  и
и 
2. Одинаковую степень окисления атомы серы имеют в соединениях  и
и
1)  2)
2)  3) KS 4) Na SO
3) KS 4) Na SO
3. Какой вид химической связи в оксиде бария?
1) ковалентная неполярная 2) металлическая
3) ковалентная полярная 4) ионная
4. С каким веществом реагирует серная кислота?
1) медь 2) оксид азота (V) 3) оксид меди (II) 4) соляная кислота
5. Верны ли следующие суждения о чистых веществах и смесях и способах их разделения?
А. Чистые вещества имеют постоянный состав.
Б. Смесь поваренной соли с речным песком можно разделить с помощью добавления воды и последующего фильтрования и выпаривания.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
6. На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата железа(II)?
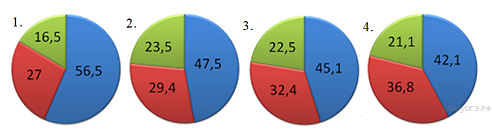
7. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов Al → Mg → Na происходит уменьшение (ослабление)
1) числа электронов на внешнем энергетическом уровне
2) числа электронных слоев в атомах
3) металлических свойств
4) степени окисления в высших оксидах
5) основного характера свойств высших гидроксидов
8. Установите соответствие между уравнением реакции и ее типом.
Уравнение реакции Тип реакции
А) C + O2 = CO2 1) замещения
Б) 2Al(OH)3 = Al2O3 +3 h3O 2) соединения
В)Zn + 2HCl= ZnCl2 + h3 3) обмена
Г) NaOH + HCl =NaCl + h3O 4) разложения
9. Напишите уравнения реакций, отвечающие следующей цепочке превращений:
фосфор → оксид фосфора (V) → фосфорная кислота→ фосфат натрия
10. Решите задачу.
Какую массу оксида можно получить при разложении 10,7 г гидроксида железа (III)?
infourok.ru
Входной контроль 11 класс
Вариант 1.
1. Число электронных слоев и число электронов на внешнем электронном слое атомов брома соответственно равны:
1) 7 и 4; 2) 4 и 7; 3) 35 и 7; 4) 4 и 35.
2. Электронная конфигурация атома железа:
1) ls22s22p63s23p6 ;2) 1s22s22p63s23p64s24p 2 ; 3) ls22s22p63s23p63d8 ;
4) 1s22s22p63s23p63d64s2 .
3. Заряд ядра +8 имеют атомы химического элемента:
1) азота; 2) кислорода; 3) серы ; 4) хлора
4. Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Радиус атомов в периоде с увеличением заряда ядра атома увеличивается. Б. Радиус атомов в главной подгруппе с уменьшением заряда ядра атома увеличивается.
1) Верно только А; 2) верны оба суждения; 3) верно только Б; 4) оба суждения неверны.
5. Номер периода элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
6. Элементу, электронная формула атома которого ls22s22p63s23p63d54s2 соответствует высший оксид, формула которого: 1) Вг2О7; 2) MnО2; 3) MnO;
4) Mn2О7.
7. Наибольшую электроотрицательность имеет:
1) фосфор; 2) хлор; 3) кремний; 4) сера.
8. В ряду химических элементов фтор → хлор → бром:
1) усиливаются неметаллические свойства; 2) увеличивается радиус атома;
3) увеличивается степень окисления в летучих водородных соединениях;
4) увеличивается электроотрицательность.
9. Ряд химических элементов, в котором неметаллические свойства усиливаются: 1) фтор → бром → иод; 2) кремний → фосфор → хлор; 3) кислород → сера → селен
10. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2. P4 , CaF2
4) h3S, Br2, K2S
11. Вещества молекулярного строения характеризуются
1) высокой температурой плавления; 2) низкой температурой плавления;
3) твердостью; 4) электропроводностью.
12. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 1 образует с водородом химическую связь
1) ковалентную полярную; 2) ковалентную неполярную ; 3) ионную ;
4) металлическую
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) Сh5 ; 3) СO ; 4) h3O
14. Установите соответствие между формулой вещества и степенью окисления атома хлора в нём.
ФОРМУЛА ВЕЩЕСТВА
A) Ca(OCl)2
Б) KClO3
B) HClO2
Г) FeCl3
СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА
1) +1
2) +3
3) -1
4) +5
15. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней.
УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
А)  1) от -2 до +4
1) от -2 до +4
Б)  2) от -2 до 0
2) от -2 до 0
В)  3) от 0 до -2
3) от 0 до -2
Г)  4) от +6 до +4
4) от +6 до +4
5) от +4 до +6
6) от +4 до 0
16. Массовая доля фосфора в фосфате магния равна
1) 23,7%
2) 34,5%
3) 45,2%
4) 55,8%
Входной контроль 11 класс
Вариант 2.
1. Число электронных слоев и число электронов на внешнем электронном слое атомов марганца соответственно равны: 1) 4 и 7; 2) 4 и 2; 3) 7 и 4;
4) 4 и 5.
2. Электронная конфигурация атома ванадия: 1) ls22s22p63s23p63d5 ;
2) ls22s22 p63s23p63d34s2 ; 3) ls22s22p63s23p63d44s1 ; 4) ls 22s22p63s23p64s24p 3
3. Заряд ядра +13 имеют атомы химического элемента:
1) серы ; 2) кислорода ; 3)алюминия ; 4) хлора
4. Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Радиус атома серы больше радиуса атома кислорода.
Б. Радиус атома фосфора меньше радиуса атома серы.
1) верно только А; 2) верны оба суждения; 3) верно только Б;
4) оба суждения неверны.
5. Номер группы элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
6. Наименьшую электроотрицательность имеет:
1) фтор; 3) бром; 2) хлор; 4) иод.
7. В ряду химических элементов барий → кальций → магний:
1) увеличивается радиус атома; 2) усиливаются металлические свойства;
3) уменьшается радиус атома; 4) увеличивается степень окисления в высших оксидах.
8. Ряд химических элементов, в котором металлические свойства ослабевают: 1) литий → бериллий → бор; 2) натрий → магний → алюминий;
3) углерод → кремний → германий
9. Элементу, электронная формула атома которого ls22s22p63s23p4 , соответствует высший оксид, формула которого: 1) SО2; 2) SO3; 3) SeO2;
4) CrО3.
10. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2
2) O2, h3O, CO2
3) h3O.Nh4.Ch5
4) NaB, HBr, CO
11. Молекулярную кристаллическую решетку имеет соединение:
1) сероводород; 2) хлорид натрия; 3) кварц; 4) медь.
12. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 2 образует с кислородом химическую связь
1)ковалентную полярную ; 2) ковалентную неполярную ; 3) ионную
4) металлическую
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) HCl; 3) СO; 4) P2O5
14. Установите соответствие между формулой вещества и степенью окисления атома азота в нём.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
A) Nh5Cl 1) -3
Б) HNO3 2) +3
B) Nh5NO3 3) +5
Г) N2O3 4) -3, +5
15. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления элемента в ней.
Схема изменения степени окисления
Входной контроль 11 класс Вариант 3.
1. Число электронных слоев и число d-электронов в атоме германия соответственно равны: 1) 4 и 10; 2) 4 и 4; 3) 4 и 2; 4) 4 и 0.
2.Электронная конфигурация внешнего электронного слоя ...4s24p3 соответствует атому: 1) мышьяка; 2) фосфора; 3) ванадия; 4) сурьмы
3. Заряд ядра +17 имеют атомы химического элемента:
1) серы ; 2) кислорода; 3)алюминия; 4) хлора
4. Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Электроотрицательность атомов в периоде с уменьшением заряда ядра атома увеличивается. Б. Электроотрицательность атомов в главной подгруппе с увеличением заряда ядра атома увеличивается.
1)Верно только А; 2) верны оба суждения; 3) верно только Б; 4) оба суждения неверны.
5. Наименьший радиус имеет атом: 1) фосфора; 3) мышьяка; 2) азота; 4) сурьмы.
6. Номер периода элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
7. В ряду химических элементов кремний → алюминий → магний: 1)увеличивается степень окисления в высших оксидах и увеличивается радиус атома; 2)уменьшается радиус атома и ослабевают металлические свойства; 3)увеличивается радиус атома и усиливаются металлические свойства; 4)увеличивается электроотрицательность и уменьшается степень окисления в высших оксидах.
8. Ряд химических элементов, в котором металлические свойства ослабевают:
1) германий → олово → свинец; 2) алюминий → магний → натрий; 3) литий → бериллий → бор
9. Химический элемент, в атоме которого электроны по слоям распределены так:
2, 8, 5 образует с магнием химическую связь : 1)ковалентную полярную ;
2) ковалентную неполярную; 3) ионную; 4) металлическую
10. Элементу, электронная формула внешнего электронного слоя атома которого ...3s23p2, соответствует водородное соединение, формула которого: 1) РН3; 2) СН4; 3) Sih5; 4) HI.
11. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CО2 и РС15
12. Вещества атомного строения характеризуются:
1) высокой температурой плавления ; 2) низкой температурой плавления
3) хрупкостью; 4) электропроводностью.
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) h3O ; 3) СO; 4) Ph4
14. Установите соответствие между формулой вещества и степенью окисления углерода в нем.
| СТЕПЕНЬ ОКИСЛЕНИЯ | |
| А) Б) В) Г) | 1) -4 2) -2 3) 0 4) +2 5) +4 |
15. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления азота в ней.
|
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА | |
| А) Б) В) Г) |
| 1) от –3 до +2 2) от –3 до 0 3) от 0 до –3 4) от +5 до +2 |
16. Массовая доля бария в нитрате бария равна
1) 12,9%
2) 20,2%
3) 52,5%
4) 68,8%
Входной контроль 11 класс
Вариант 4.
1. Число электронных слоев и число d-электронов в атоме никеля соответственно равны: 1) 8 и 4; 2) 4 и 2; 3) 4 и 7; 4) 4 и 8.
2.Электронная конфигурация ls22s22p63s23p63d24s2 соответствует атому:
1) скандия; 3) титана; 2) ванадия; 4) германия.
3.Верны ли следующие суждения о закономерностях изменения свойств атомов в периодической системе Д. И. Менделеева?
А. Электроотрицательность азота больше электроотрицательности фтора.
Б. Электроотрицательность хлора меньше электроотрицательности брома.
1)Верно только А; 2) верны оба суждения; 3)верно только Б; 4) оба суждения неверны.
4. Наибольший радиус имеет атом: 1) бора; 2) кислорода; 3) азота; 4) углерода.
5. Номер группы элемента в периодической системе соответствует1) заряду ядра атома этого элемента2) числу электронов на валентной оболочке атома этого элемента3) числу электронных уровней атома этого элемента4) среднему значению массовых чисел изотопов этого элемента
6. Заряд ядра + 16 имеют атомы химического элемента:
1) неона; 2) кислорода; 3) серы ; 4) хлора
7. Элементу, электронная формула атома которого ls22s22p5 , соответствует водородное соединение, формула которого: 1) HF; 2) НС1; 3) СН4; 4) Nh4
8. В ряду химических элементов азот → кислород → фтор: 1) уменьшается радиус атома и увеличивается электроотрицательность; 2) уменьшается радиус атома и ослабевают неметаллические свойства; 3)увеличивается радиус атома и усиливаются неметаллические свойства; 4) увеличивается радиус атома и ослабевает электроотрицательность,
9. Ряд химических элементов, в котором неметаллические свойства усиливаются: 1) фтор → бром → иод; 2) иод → бром → хлор 3) кислород → сера → селен; 4) бор → углерод → азот.
10. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2) СО, CuO, Ch4Cl
3) BaS, C6H6, h3
4) C6H5NO2, F2, CC14
11. Вещества молекулярного строения характеризуются:
1)высокой температурой плавления; 2) низкой температурой плавления ;
3) твердостью ; 4) электропроводностью.
12. . Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 2 образует с хлором химическую связь:
1)ковалентную полярную; 2) ковалентную неполярную ; 3) ионную;
4) металлическую
13. Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества:
1) СO2 ; 2) Сh5 ; 3) Nh4 ;4) СO
14. Установите соответствие между формулой вещества и степенью окисления азота в нем.
| СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | |
| A) Б) B) Г) | 1) -3 2) -2 3) +2 4) +3 5) +4 6) +5 |
15. Установите соответствие между уравнениями реакций и изменением степени окисления азота.
УРАВНЕНИЕ РЕАКЦИИ
A) 
Б) 
В) 
Г) 
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) от -3 до +2
2) от +4 до +5
3) от 0 до +2
4) от +3 до +2
5) от +2 до +4
16. Массовая доля железа в сульфате железа (III) равна
1) 12,2%
2) 20,5%
3) 28%
4) 48,0%
globuss24.ru
МБОУ «ООШ села Сплавнуха»
Красноармейского района
Саратовской области
Учитель химии: Кинжигалиева Т.А.
ВХОДЯЩИЙ КОНТРОЛЬ ХИМИЯ 8 КЛАСС.
Первоначальные химические понятия 8 класс
ЧАСТЬ А
1. Выберите вещества:
азот
пробирка
сахароза
уксусная кислота
бензин
2. Выберите утверждения, характеризующие алюминий:
серый, пластичный, не проводит ток, легкий
розового цвета, проводит электрический ток, пластичный
серебристо- белый, ковкий, легкий, не магнитится
бесцветный, магнитится, неэлектропроводный
3. Укажите, где речь идет о химических явлениях:
образование тумана
гниение фруктов
процесс дыхания
растирание кусочков серы в желтый порошок
4. Относительная молекулярная масса веществ, имеющих формулу h3SO3 ; Al (NO2)3 соответственно равна:
49, 76
82, 165
25, 44
96, 342
5. Выберите простые вещества:
азот N2
натрий Na
уксусная кислота Сh4COOH
угарный газ СО
озон O3
6. Элементы одного периода
калий, кальций, медь
водород, литий, калий
натрий, магний, кальций
гелий, неон, аргон
7. Что означают записи 5h3; 3O:
5 молекул водорода и 3 атома кислорода
5 молекул водорода и 6 атомов кислорода
5 атомов водорода и 2 молекулы кислорода
5 атомов водорода и 3 молекулы кислорода
8. Разделить смесь спирта и воды можно методом:
выпаривания
дистилляции
фильтрования
с помощью делительной воронки
9. Элементы главных (А) подгрупп:
кислород, сера, хром
никель, палладий, платина
скандий, титан, ванадий
литий, бериллий, бор
10. Химический элемент, который расположен в IVА группе 5 периода:
олово 3) титан
цирконий 4) германий
ЧАСТЬ Б
1.Найди соответствие элемент ,относительная атомная масса.
А) кислород 1.1
Б) водород 2.14
В) азот 3. 16
2.Найди соответствие элемент, валентность.
А) кислород 1) 1
Б) водород 2) .3,5
В) азот 3.) 2
3. .Найди соответствие элемент, номер группы.
А) кислород 1) 1
Б) водород 2) .5
В) азот 3.) 6
4. .Найди соответствие элемент, период
А) кислород 1) 1
Б) водород 2) .2
В) азот 3.) 2.
5. . .Найди соответствие. Вещество , тело.
А) кислород 1) тело
Б)ручка 2) .Вещество
В) азот 3.) Вещество
ЧАСТЬ С
Напиши определение. Что такое химия ______________________________________
Первоначальные химические понятия 8 класс
2 вариант
1. Выберите тела:
медный купорос
серебряная монета
йод
углекислый газ
медная проволока
2. Выберите утверждения, характеризующие серу
ковкое вещество, не растворяется в воде
желтая летучая жидкость с резким запахом
бесцветное вещество, хорошо проводит электрический ток
хрупкое вещество, не проводит ток
3. Укажите, где речь идет о физических явлениях:
растворение соли в воде
горение лесов
возгонка йода
ржавление железных изделий
замерзание водоемов зимой
4. Молекулярная масса веществ, имеющих формулы MgSO4; Fe(OH)3 соответственно равна:
70; 48
120; 107
142; 99
142; 82
5. Выберите сложные вещества:
h3SO4
O3
S8
C60
FeS
6. Элементы одной группы:
азот, фосфор, ванадий
бериллий, бор, углерод
фосфор, сера, хлор
кальций, медь, цинк
фтор, хлор, бром
7. Что означают записи 3О2; 2N:
3 атома кислорода и 2 молекулы азота
3 молекулы кислорода и 2 атома азота
3 молекулы кислорода и 2 молекулы азота
3 атома кислорода и 1 молекула азота
8. Разделить смесь йода с медными стружками можно методом:
дистилляции
фильтрования
возгонки
с помощью делительной воронки
9. Все элементы побочной (В) подгруппы:
кобальт, никель
медь, калий
гелий, неон
хром, водород
10. Химический элемент, который расположен в 6 периоде III группы, побочной подгруппы:
барий 3) таллий
лантан 4) сера
www.metod-kopilka.ru
ВХОДНАЯ КОНТРОЛЬНАЯ РАБОТА 9 КЛАСС
Вариант 1.
Заряд ядра атома равен числу :
1) протонов ; 2) электронов во внешнем электронном слое ; 3) нейтронов ;
4) энергетических уровней
2. Четыре электрона во внешнем электронном слое находятся у атома :
1) серы 2) кислорода 3) азота 4) кремния
3. Схема распределения электронов по электронным слоям 2, 8, 4 соответствует атому
1) магния; 2) алюминия; 3) кремния; 4) фосфора
4. Наибольшую электроотрицательность имеет:
1) фосфор; 2) хлор; 3) кремний; 4) сера.
5. В ряду химических элементов фтор → хлор → бром:
1) усиливаются неметаллические свойства;
2) увеличивается радиус атома;
3) увеличивается степень окисления в летучих водородных соединениях;
4) увеличивается электроотрицательность.
6. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2. P4 , CaF2
4) h3S, Br2, K2S
7. Какое из указанных веществ имеет ковалентную полярную связь?
1) NaCl ; 2) h3S ; 3) Н2 ; 4) CaCl2
8. Веществами с ионной и ковалентной неполярной связью являются:
1) водород и хлор;
2) хлорид натрия и хлор;
3) бромид цинка и хлороводород
9. Какой вид химической связи в молекуле аммиака (Nh4) ?
1) ковалентная полярная;
2) ковалентная неполярная;
3) ионная;
4) металлическая
10. От основных к амфотерным меняются свойства оксидов в ряду:
1) СаО → SiО2 → SОз;
2) СО2 → А12О3 → MgO;
3) SОз → P2О5 → А12О3 ;
4) Na2О → MgO → А12О3
11. В каких соединениях атомы азота и серы имеют одинаковое значение
степени окисления?
1) NНз и SОз ; 2) Са2N3 и FeS ; 3) NО2 и Н2SО3 ; 4) N2О5 и h3S
12. Значения высшей и низшей степеней окисления хлора соответственно равны:
1) +5 и -l ; 2) +5 и -3 ; 3) +7 и -1 ; 4) +7 и -7
13. Массовая доля фосфора в фосфате магния Mg3(PO4)2 равна :
1) 23,7%
2) 34,5%
3) 45,2%
4) 55,8%
ВХОДНАЯ КОНТРОЛЬНАЯ РАБОТА 9 КЛАСС
Вариант 2.
1. Число протонов в атоме равно
1) числу электронов ; 2) относительной атомной массе ; 3) числу нейтронов;
4) числу заполненных электронных слоев
2. Атомы азота и фтора имеют одинаковое :
1) значение радиусов атомов;
2) значение зарядов ядер атомов;
3) число электронов во внешнем электронном слое;
4) число заполненных электронных слоёв
3. Схема распределения электронов по электронным слоям 2, 8, 7 соответствует атому
1) хлора; 2) фтора; 3) кислорода; 4) серы
4. Наименьшую электроотрицательность имеет:
1) фтор; 3) бром; 2) хлор; 4) иод.
5. Ряд химических элементов, в котором металлические свойства ослабевают:
1) литий → бериллий → бор;
2) натрий → магний → алюминий;
3) углерод → кремний → германий
6 . Массовая доля кислорода в сульфате железа (III) Fe2(SO4)3 равна:
1) 12,2%
2) 20,5%
3) 40,8%
4) 48,0%
7. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых:
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CО2 и РС15
8. Какое из указанных веществ имеет ионную связь?
1) HCl ; 2) Cl2 ; 3) NaCl ; 4) СО2
9. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1) кислород и водород; 2) вода и хлороводород; 3) фосфин и водород ;
4) вода и хлорид натрия
10. Какой вид химической связи в молекуле сероводорода (h3S)?
1) ковалентная полярная; 2) ковалентная неполярная; 3) ионная;
4) металлическая
11. В каких соединениях атомы азота и серы имеют одинаковое значение степени окисления?
1) NНз и Na2SО4 ; 2) Са2N3 и Al2S3 ; 3) NО2 и Н2SО3 4) N2О5 и h3SО4
12. Значения высшей и низшей степени окисления углерода соответственно равны:
1) +2 и -4 2) +4 и -2 3) +2 и -2 4) +4 и -4
Свойства оксидов в ряду А12О3 → SiО2 → P2О5 изменяются от :
1) амфотерных к кислотным; 2) основных к кислотным;
3) амфотерных к основным; 4) кислотных к основным
ВХОДНАЯ КОНТРОЛЬНАЯ РАБОТА 9 КЛАСС
Вариант 3.
Число заполняющихся электронных слоёв в атоме равно:
1) порядковому номеру элемента; 2) номеру группы; 3) заряду ядра атома;
4) номеру периода
Пять электронов во внешнем электронном слое находятся у атома:
1) серы; 2) кислорода; 3) азота; 4) кремния
Схема распределения электронов по электронным слоям 2, 8, 3 соответствует атому :
1) магния; 2) алюминия; 3) кремния; 4) фосфора
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2
2) O2, h3O, CO2
3) h3O.Nh4.Ch5
4) NaB, HBr, CO
5. Какое из указанных веществ имеет ионную связь?
1) СН4 ; 2) NO; 3) О2 ; 4) K2S
6. Веществами с ионной и ковалентной неполярной связью являются:
1) сероводород и водород ; 2) оксид калия и кислород ; 3) аммиак и алюминий ;
4) оксид серы (IV) и хлор
7. Какой вид химической связи в молекуле углекислого газа (CO2)?
1) ковалентная полярная; 2) ковалентная неполярная; 3) ионная;
4) металлическая
8. В ряду химических элементов Rb → К → Na :
1) усиливаются металлические свойства;
2) уменьшаются радиусы атомов;
3) уменьшается электроотрицательность атомов ;
4) возрастает высшая степень окисления в оксидах
9. Свойства оксидов в ряду СО2 → В2О3 → ВеО изменяются от:
1) кислотных к амфотерным ;
2) основных к кислотным ;
3) амфотерных к основным ;
4) основных к амфотерным
В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
1) NНз и РClз ; 2) NНз и СаЗР2 ; 3) NО2 и P2О5 ; 4) NО2 И Р2О3
11. Значения высшей и низшей степени окисления серы соответственно равны:
+2 и -6 ; 2) +6 и -2 ; 3 ) +6 и -3 ; 4) +5 и -2
12. Массовая доля фосфора в фосфате магния Mg3(PO4)2 равна
1) 23,7%
2) 34,5%
3) 45,2%
4) 55,8%
13. В ряду химических элементов натрий → магний → алюминий :
1) увеличивается радиус атома; 2) усиливаются металлические свойства;
3) увеличивается степень окисления в высших оксидах.
ВХОДНАЯ КОНТРОЛЬНАЯ РАБОТА 9 КЛАСС
Вариант 4.
1. Атомы химических элементов одной главной подгруппы имеют:
1) одинаковые радиусы атомов;
2) одинаковые заряды ядер атомов ;
3) одинаковое число валентных электронов;
4) одинаковую электроотрицательность
2. Шесть электронов во внешнем электронном слое находятся у атома:
1) серы ; 2) марганца; 3) азота; 4) кремния
3. Схема распределения электронов по электронным слоям 2, 8, 5 соответствует атому :
1) магния; 2) алюминия; 3) кремния; 4) фосфора
4. В ряду химических элементов барий → кальций → магний:
1) увеличивается радиус атома;
2) усиливаются металлические свойства;
3) уменьшается радиус атома;
4) увеличивается степень окисления в высших оксидах
5. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2. P4 , CaF2
4) h3S, Br2, K2S
6. Какое из указанных веществ имеет ковалентную неполярную связь?
1) BaCl2 ; 2) SО2 ; 3) NНз ; 4) Br2
7. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1) кислород и водород; 2) вода и хлороводород; 3) сероводород и водород;
4) вода и хлорид натрия
8. Какой вид химической связи в молекуле угарного газа (CO)?
1) ковалентная полярная ; 2) ковалентная неполярная; 3) ионная;
4) металлическая
9. Свойства оксидов в ряду А12О3 → SiО2 → P2О5 изменяются от:
1) амфотерных к кислотным;
2) основных к кислотным;
3) амфотерных к основным ;
4) кислотных к основным
10.В каких соединениях атомы азота и серы имеют одинаковое значение степени окисления?
1) NНз и SОз ;2) Nа3N и Fe2S3 ; 3) NО2 и Н2SО3 ; 4) N2О5 и h3S
11. Значения высшей и низшей степеней окисления азота соответственно равны:
1) +5 и-3; 2) +5 и 0; 3) +4 и +1 ; 4) +4 и 0
12.Массовая доля кислорода в сульфате железа (III) равна
1) 12,2%
2) 20,5%
3) 40,8%
4) 48,0%
13. Наименьшую электроотрицательность имеет:
1) фтор; 3) бром; 2) хлор; 4) иод.
doc4web.ru