 Mg + O2 MgO
Mg + O2 MgOВариант №1
1. Составьте схемы расположения электронов по энергетическим уровням в атомах следующих химических элементов хлор, азот.
2. Определите: 1) заряд ядра,
2) число электронов, протонов, нейтронов,
для атома с порядковым номером №24
3. Определите вид химической связи для веществ с формулами:
K ZnCl2 PF3 O2
Объясните свой выбор, записав определение химической связи.
4. Расположите элементы в порядке:
а) увеличения металлических свойств Ba, Mg, Ca
б) увеличения неметаллических свойств P, Si, S
Объясните такое расположение.
5. Определите относительно молекулярную массу вещества, формула которого:
AL2S3
Вариант №2
1. Составьте схемы расположения электронов по энергетическим уровням в атомах следующих химических элементов кислород, кремний.
2. Определите: 1) заряд ядра,
2) число электронов, протонов, нейтронов,
для атома с порядковым номером №33
3. Определите вид химической связи для веществ с формулами:
h3O F2 AlCl3 Be
Объясните свой выбор, записав определение химической связи.
4. Расположите элементы в порядке:
а) увеличения металлических свойств Sn, C, Si
б) увеличения неметаллических свойств Cl, Al, Na
Объясните такое расположение.
5. Определите относительно молекулярную массу вещества, формула которого:
Mg3N2
Вариант №1
Перечислите физические свойства неметаллов. Приведите примеры не менее 5 неметаллов.
Дайте определение аллотропии. Приведите примеры аллотропных видоизменений атома кислорода, перечислите их физические свойства. Чем они отличаются друг от друга?
Найдите массу 7 моль Fe2O3.
Какой объём займут 51г. Nh4?
Вычислить массу 30*1023 молекул C2H6O.
Какой объём они занимают?
Вариант №2
Перечислите физические свойства металлов. Приведите примеры не менее 5 металлов.
Что называется аллотропным видоизмением химического элемента? Приведите примеры аллотропных видоизменений атома углерода, перечислите их физические свойства. Чем они отличаются друг от друга?
Найдите объём 4 моль CO2.
Какую массу имеют 11,2 л C2h3?
Вычислить сколько молекул содержится в 232 г. C4h20.
Какой объём они занимают?
Контрольная работа № 3 (х-8)
по теме « Соединения химических элементов» Вариант№1
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей. Дайте названия.
Na2O; h3SO4; Cu(OH)2; CaCl2; SO3; KOH; h4PO4; Ba(NO3)2.
Определите степени окисления элементов в следующих соединениях: HNO3; FeCl3; Mn2O7; Na2CO3.
Вычислите массу воды и соли , которые необходимо взять для приготовления 600г раствора с массовой долей соли 15%.
Рассчитайте массовую долю фосфора в его оксиде.
Составьте формулы: оксида цинка; хлорида алюминия; гидроксида кальция.
Контрольная работа № 3 (х-8)
по теме « Соединения химических элементов» Вариант№2
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей. Дайте названия.
Li2O; MgSO4; Fe(OH)3; HCl; CO2; NaOH; K3PO4; HNO3.
Определите степени окисления элементов в следующих соединениях: SF6; Na3PO4; Ca3P4; h3SO4.
Вычислите массовую долю сахара в растворе, если для его приготовления взяли 450г воды и 50г сахара.
Рассчитайте массовую долю алюминия в его оксиде.
Составьте формулы: оксида натрия; гидроксида магния; сульфата бария.
Контрольная работа № 4 (х-8)
по теме « Изменения, происходящие с веществами» Вариант№1
1.В приведенных схемах расставьте коэффициенты и определите тип химической реакции. Назовите все вещества.
 Mg + O2 MgO
Mg + O2 MgO
 Al + HCl AlCl3 + h3
Al + HCl AlCl3 + h3
 Ag2O Ag + O2
Ag2O Ag + O2
 KOH + Zn(NO3)2 Zn(OH)2 + HNO3
KOH + Zn(NO3)2 Zn(OH)2 + HNO3
2. Составьте следующие уравнения химических реакций:
а) разложения Н2О
б) соединения Na и Cl2
3. Какая масса соли образуется при взаимодействии серной кислоты (h3SO4) c гидроксидом натрия (NaOH) массой 300г.
содержащего 20% примесей.
Контрольная работа № 4 (х-8)
по теме « Изменения, происходящие с веществами» Вариант№2
1.В приведенных схемах расставьте коэффициенты и определите тип химической реакции. Назовите все вещества.
 Nh4 N2 + h3
Nh4 N2 + h3
 Cr2O3 + h3 Cr + h3O
Cr2O3 + h3 Cr + h3O
 Fe + Cl2 FeCl3
Fe + Cl2 FeCl3
 NaOH + h3SO4 Na2SO4 + h3O
NaOH + h3SO4 Na2SO4 + h3O
2. Составьте следующие уравнения химических реакций:
а) разложения Au2О
б) соединения Cu и O2
3. Какой объем водорода образуется при взаимодействии магния с соляной кислоты (HCl) массой 500г. содержащей 30% примесей.
Контрольная работа № 4 (х-8)
по теме « Изменения, происходящие с веществами» Вариант№1
1.В приведенных схемах расставьте коэффициенты и определите тип химической реакции. Назовите все вещества.
 Mg + O2 MgO
Mg + O2 MgO
 Al + HCl AlCl3 + h3
Al + HCl AlCl3 + h3
 Ag2O Ag + O2
Ag2O Ag + O2
 KOH + Zn(NO3)2 Zn(OH)2 + HNO3
KOH + Zn(NO3)2 Zn(OH)2 + HNO3
2. Составьте следующие уравнения химических реакций:
а) разложения Н2О
б) соединения Na и Cl2
3. Какая масса соли образуется при взаимодействии серной кислоты (h3SO4) c гидроксидом натрия (NaOH) массой 300г.
содержащего 20% примесей.
Контрольная работа № 4 (х-8)
по теме « Изменения, происходящие с веществами» Вариант№2
1.В приведенных схемах расставьте коэффициенты и определите тип химической реакции. Назовите все вещества.
 Nh4 N2 + h3
Nh4 N2 + h3
 Cr2O3 + h3 Cr + h3O
Cr2O3 + h3 Cr + h3O
 Fe + Cl2 FeCl3
Fe + Cl2 FeCl3
 NaOH + h3SO4 Na2SO4 + h3O
NaOH + h3SO4 Na2SO4 + h3O
2. Составьте следующие уравнения химических реакций:
а) разложения Au2О
б) соединения Cu и O2
3. Какой объем водорода образуется при взаимодействии магния с соляной кислоты (HCl) массой 500г. содержащей 30% примесей.
Контрольная работа № 5 (х-8)
по теме « Свойства растворов электролитов»
Вариант№1
1. С какими из перечисленных веществ: Na2O; h3SO4; Ca(OH)2; Mg;
SO3; Au; Zn(NO3)2 будет реагировать а) соляная кислота
б) гидроксид натрия.
2. Напишете уравнение реакции обмена идущей с образованием
а) осадка, б) воды, в) газа. Для каждой реакции составьте полное ионное и сокращенное ионное уравнение
Записать молекулярные уравнения для следующих генетических цепочек, назвать продукты реакций:
А) Zn → ZnO → ZnSO4 → Zn(OH)2 → ZnO
Б) P → P2O5→ h4 PO4 → K3 PO4
Разберите следующие окислительно-восстановительные реакции:
А) Nh4 + CuO → Cu + N2 + h3O
Б) Ca + O2 →
Контрольная работа № 5 (х-8)
по теме « Свойства растворов электролитов»
Вариант№2
1. С какими из перечисленных веществ: CuSO4; Zn; HCl; CO2; NaOH;
Ag; CaO будет реагировать а) серная кислота
б) гидроксид калия.
2. Напишете уравнение реакции обмена идущей с образованием
а) осадка, б) воды, в) газа. Для каждой реакции составьте полное ионное и сокращенное ионное уравнение
3. Записать молекулярные уравнения для следующих генетических
цепочек:
А) Ba → BaO → Ba(OH)2 → Ba(NO)3 → BaSO4
Б) C→ CO2→ h3CO3 → Na2CO3
4. Разберите следующие окислительно-восстановительные реакции:
А) h3SO4 + Mg → MgSO4 + h3S + h3O
Б) h3 + O2 →
Контрольная работа № 5 (х-8)
по теме « Свойства растворов электролитов»
Вариант№1
Дать названия следующим соединениям и определить их класс.
Na2O; h3SO4; Cu(OH)2; CaCl2; SO3; KOH; h4PO4; Zn(NO3)2.
2. Записать уравнения диссоциации следующих веществ:
Ва(OH)2; Na2CO3; MgCl2; Al2(SO4)3; HCl
Назовите образующиеся ионы.
3. Дописать для следующих сокращенных ионных уравнений
реакций, полные ионные и молекулярные уравнения:
Mg2+ + 2ОН- = Mg(OH)2
Ag+ + Cl- = AgCl
Записать молекулярные уравнения для следующих генетических цепочек:
А) Zn → ZnO → ZnSO4 → Zn(OH)2 → ZnO
Б) P → P2O5→ h4 PO4 → K3 PO4
Контрольная работа № 5 (х-8)
по теме « Свойства растворов электролитов»
Вариант№2
Дать названия следующим соединениям и определить их класс.
Li2O; MgSO4; Al(OH)3; HCl; CO2; NaOH; K3PO4; HNO3.
2. Записать уравнения диссоциации следующих веществ:
NaOH; Ca(NO3)2; K2S; Fe2(SO4)3; h3CO3
Назовите образующиеся ионы.
3. Дописать для следующих сокращенных ионных уравнений
реакций, полные ионные и молекулярные уравнения:
Al3+ + 3ОН- = Al(OH)3
H+ + OH- = h3O
4. Записать молекулярные уравнения для следующих генетических
цепочек:
А) Ba → BaO → Ba(OH)2 → Ba(NO)3 → BaSO4
Б) C→ CO2→ h3CO3 → Na2CO3
Контрольная работа № 5 (х-8)
по теме « Свойства растворов электролитов»
Вариант№1
1. С какими из перечисленных веществ: Na2O; h3SO4; Ca(OH)2; Mg;
Au; Zn(NO3)2 будет реагировать соляная кислота
Напишете уравнение реакции обмена идущей с образованием
осадка. Составьте полное ионное и сокращенное ионное уравнение.
Записать молекулярные уравнения для следующей генетической цепочки, назвать продукты реакций:
Zn → ZnO → ZnSO4 → Zn(OH)2 → ZnO
Разберите следующую окислительно-восстановительную реакцию:
Nh4 + CuO → Cu + N2 + h3O
Кислород (O2) массой 64г. прореагировал с алюминием (Al), при этом образовался оксид алюминия. Вычислите массу образовавшегося оксида алюминия (Al2O3)
Контрольная работа № 5 (х-8)
по теме « Свойства растворов электролитов»
Вариант№2
1. С какими из перечисленных веществ: CuSO4; Zn; HCl; CO2; NaOH;
CaO будет реагировать гидроксид калия.
2. Напишете уравнение реакции обмена идущей с образованием
воды. Cоставьте полное ионное и сокращенное ионное уравнение.
3. Записать молекулярные уравнения для следующей генетической
цепочки:
Ba → BaO → Ba(OH)2 → Ba(NO)3 → BaSO4
4. Разберите следующую окислительно-восстановительную реакцию:
h3SO4 + Mg → MgSO4 + h3S + h3O
Азот (N2) массой 28г. прореагировал с натрием (Na), при этом образовался нитрид натрия. Вычислите массу образовавшегося нитрида натрия (Na3N).
infourok.ru
1А. Атомы азота имеют одинаковую степень окисления в соединениях
1) NO и HNO3 2) N2O3 и HNO2 3) Nh4 и N2O 4) Ca3N2 и N2O5
2А. Наличие сульфат-ионов в растворе можно установить с помощью раствора
1) гидроксида натрия 2) нитрата бария 3) метилоранжа 4) хлорида калия
3В. Окислительно-восстановительной является реакция между
1) CaO и HCl 2) CO и h3 3) Cl2O7 и h3O 4) SO2 и h3S 5) P2O5 и h3O
4В. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) SO3 + h3O → 1) h3SO4
Б) Na2SO3 + HCl → 2) SO2↑ + NaCl
В) NaOH + P2O5 → 3) NaCl + SO2↑ + h3O
4) Na3PO4 + h3O
5) Na3PO4 + h3↑
5С. Напишите формулу высшего оксида элемента с порядковым номером 15. Дайте ему название, укажите вид химической связи и степени окисления элементов.
6С. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО → СО2 → К2СО3 → СО2 → CaCO3
Какие из этих реакций являются окислительно-восстановительными? Для одной из них составьте уравнения электронного баланса.
7С. С какими из перечисленных веществ будет взаимодействовать раствор СЕРНОЙ КИСЛОТЫ: хлорид бария, нитрат калия, оксид углерода (IV), оксид меди (II), медь.
Напишите уравнения возможных реакций. Для одной реакции, протекающей в растворе, составьте полные и сокращенные ионные уравнения.
8С. Какой объем (н.у.) оксида углерода (IV) можно получить при взаимодействии 60 г мрамора, содержащего 8% примесей, с избытком раствора азотной кислоты.
9С. Почему во время грозы почва обогащается азотом?
1А. Степени окисления +4 и –2 атомы серы проявляют соответственно в соединениях
1) h3S и SO3 2) Na2SO3 и h3SO4 3) SO2 и K2S 4) SO3 и h3SO3
2А. В лаборатории аммиак получают
1) взаимодействием азота с водородом 3) взаимодействием хлорида аммония с гидроксидом кальция
2) взаимодействием оксида азота(V) и воды 4) разложением азотной кислоты
3В. Оксид кремния вступает в реакцию с
1) водой 2) гидроксидом натрия 3) oксидом фосфора(V) 4) соляной кислотой 5) карбонатом кальция
4В. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) CaO + h3O→ 1) CaCO3↓ + KOH
Б) K2CO3 + Ca(OH)2 → 2) K2SO3 + h3O
В) SO2 + KOH → 3) Ca(OH)2
4) K2SO4 + h3O
5) Ca(OH)2 + h3↑
5С. Покажите схемы строения атома серы S и сульфид-иона S2- . Назовите простые вещества, которые образует химический элемент сера.
6С. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Какие из этих реакций являются окислительно-восстановительными? Для одной из них составьте уравнения электронного баланса.
7С. С какими из перечисленных веществ будет взаимодействовать ОКСИД УГЛЕРОДА (IV): вода, кислород, гидроксид натрия, оксид серы (VI), азотная кислота.
Напишите уравнения возможных реакций. Для одной реакции, протекающей в растворе, составьте полные и сокращенные ионные уравнения.
8С. При сгорании 187,5 г угля образовалось 336 л оксида углерода (IV) (н.у.). Вычислите массовую долю углерода в угле.
9С. Как можно разделить смесь газов, состоящую из кислорода и аммиака?
1А. Атомы азота и углерода имеют одинаковую степень окисления в соединениях
1) NO2 и ССl4 2) Na3N и Ch5 3) Nh4 и CO 4) N2O3 и СО2
2А. Наличие хлорид-ионов в растворе можно установить с помощью раствора
1) нитрата серебра 2) серной кислоты 3) гидроксида бария 4) лакмуса
3В. В группе химических элементов С, N, O
1) наименьший радиус имеет атом углерода 4) наибольшую электроотрицательность имеет кислород
2) высшая степень окисления углерода равна +6 5) низшая степень окисления азота равна –5
3) высшие оксиды углерода и азота проявляют кислотные свойства
4В. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Na2S + ZnSO4 → 1) ZnSO3↓ + Na2O
Б) SO3 + ZnO → 2) ZnS↓ + Na2SO4
В) ZnSO4 + NaOH → 3) Zn + SO2↑
4) Na2SO4 + Zn(OH)2↓
5) ZnSO4
5С. Сравните строение атомов углерода и кремния. У какого из них сильнее выражены неметаллические свойства? Почему?
6С. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
K2SO3 → SO2 → SO3 → h3SO4 → SO2Какие из этих реакций являются окислительно-восстановительными? Для одной из них составьте уравнения электронного баланса.
7С. С какими из перечисленных веществ будет взаимодействовать раствор АЗОТНОЙ КИСЛОТЫ: гидроксид алюминия, оксид фосфора (V), медь, карбонат калия, сульфат натрия. Напишите уравнения возможных реакций. Для одной реакции, протекающей в растворе, составьте полные и сокращенные ионные уравнения.
8С. Какой объем кислорода (н.у.) необходим для полного сгорания 20 л оксида углерода (II), содержащего 5% негорючих примесей?
9С. На каком свойстве основано применение питьевой соды NaHCO3 в медицине для снижения кислотности
желудочного сока?
1А. Низшую степень окисления азот проявляет в соединении, формула которого
1) NCl3 2) Nh4 3) N2O 4) NO
2А. Для установления качественного состава соляной кислоты используют
1) растворы гидроксида натрия и нитрата бария 3) раствор фенолфталеина и известковую воду
2) растворы лакмуса и сульфата калия 4) растворы метилоранжа и нитрата серебра
3В. Окислительно-восстановительной является реакция между
1) CO2 и h3O 2) NO2 и h3O 3) MgO и h3O 4) Na и h3O 5) SO2 и h3O
4В. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Pb(OH)2 1) Fe(OH)3↓ + NaCl
Б) FeCl3 + NaOH → 2) Pb + h3O
В) h3SO4(р-р) + Fe → 3) FeSO4 + h3↑
4) PbO + h3O
5) Fe2 (SO4)3 + h3↑
5С. Запишите схему электронного строения атома с порядковым номером 8. Какие свойства проявляет этот элемент и почему? Напишите формулу его водородного соединения, укажите вид химической связи и степень окисления элементов. Запишите уравнения реакций, характеризующие химические свойства простого вещества, образованного этим элементом.
6С. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Nh4 → Nh5NO3 → Nh4 → NO → NO2 Какие из этих реакций являются окислительно-восстановительными? Для одной из них составьте уравнения электронного баланса.
7С. С какими из перечисленных веществ будет взаимодействовать ОКСИД КРЕМНИЯ (IV): соляная кислота, гидроксид калия, карбонат натрия, вода, оксид серы (VI).
Напишите уравнения возможных реакций. Для одной реакции, протекающей в растворе, составьте полные и сокращенные ионные уравнения.
8С. Какой объем (н.у.) углекислого газа можно получить при термическом разложении 200 г известняка, содержащего 20 % примесей?
9С. Поясните, почему фосфор распространен в природе только в виде соединений, тогда как находящийся с ним в одной группе азот – главным образом в свободном виде?
1А. В каком из соединений степень окисления азота равна –3?
1) Ca(NO3)2 2) N2O3 3) Ca3N2 4) HNO2
2А. В лаборатории имеются растворы следующих веществ: А) карбонат калия Б) хлорид аммония В) фосфат натрия Г) гидроксид бария. С помощью раствора азотной кислоты можно распознать реактив, указанный под буквой:
1) А 2) Б 3) В 4) Г
3В. В ряду химических элементов Ge – Si – C
1) увеличивается радиус атома 4) увеличивается число электронов во внешнем слое
2) ослабевает основный характер их высших оксидов 5) возрастает значение высшей валентности
3) усиливаются неметаллические свойства соответствующих им простых веществ
4В. Установите соответствие между схемой превращения и изменением степени окисления восстановителя в ней.
СХЕМА ПРЕВРАЩЕНИЯ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
A) KNO3 + Nh5Cl → N2O + h3O + KCl 1) Э+3 → Э+5
Б) HNO2 + Cl2 + h3O → HNO3 + HCl 2) Э-3 → Э+1
В) NO2 + SO2 → SO3 + NO 3) Э+4 → Э+2
4) Э0 → Э+6
5) Э+4 → Э+6
5С. Сравните строение атомов азота и фосфора. У какого из них сильнее выражены неметаллические свойства? Почему?
6С. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch5 → СО2 → СаСО3 → Са(НСО3)2 → СО2 . Какие из этих реакций являются окислительно-восстановительными? Для одной из них составьте уравнения электронного баланса.
7С. С какими из перечисленных веществ будет взаимодействовать ОКСИД СЕРЫ (IV): вода, оксид кремния (VI), соляная кислота, гидроксид калия, кислород.Напишите уравнения возможных реакций. Для одной реакции, протекающей в растворе, составьте полные и сокращенные ионные уравнения.
8С. При пропускании 2000 л воздуха (н.у.) через известковую воду образовалось 3 г карбоната кальция. Рассчитайте объемную долю оксида углерода (IV) в воздухе.
9С. В не очень далекие времена иногда между стеклами в двойных оконных рамах на зиму ставили стаканчик с концентрированной серной кислотой. Зачем это делали? Увеличивался или уменьшался к весне объем жидкости в стакане?
1А. Сложным и простым веществами соответственно являются
1) метан и алмаз 2) озон и азот 3) серная кислота и аммиак 4) красный фосфор и цинк
2А. В лаборатории имеются растворы следующих веществ: А) гидроксид калия Б) хлорид натрия
В) хлорид бария Г) нитрат аммония. С помощью раствора серной кислоты можно распознать реактив, указанный под буквой:
1) А 2) Б 3) В 4) Г
3В. Хлор вступает в реакцию с
1) оксидом меди(II) 2) оксидом фосфора(V) 3) сероводородом 4) бромидом калия 5) сульфатом натрия
4В. Установите соответствие между схемой превращения веществ и окислителем в ней.
СХЕМА ПРЕВРАЩЕНИЯ ОКИСЛИТЕЛЬ
A) NO2 + SO2 → SO3 + NO 1) NO2
Б) Nh4 + O2 → NO + h3O 2) SO2
В) KNO3 + Nh5Cl → KCl + N2O + h3O 3) Nh4
4) O2
5) KNO3
5С. Покажите схемы строения атома хлора Cl и хлорид-иона Cl¯. Приведите примеры нейтрального атома,
катиона и аниона, которые имеют такую же электронную конфигурацию, как хлорид-ион Cl¯.
6С. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
SiO2 → Si → SiO2 → Na2SiO3 → Н2SiO3
Какие из этих реакций являются окислительно-восстановительными? Для одной из них составьте уравнения электронного баланса.
7С. С какими из перечисленных веществ будет взаимодействовать раствор ФОСФОРНОЙ КИСЛОТЫ: оксид серы (VI), оксид лития, гидроксид натрия, сульфат калия, медь.
Напишите уравнения возможных реакций. Для одной реакции, протекающей в растворе, составьте полные и сокращенные ионные уравнения.
8С. При взаимодействии 10,8 г твердого карбоната натрия с избытком азотной кислоты получили 2,24 л (н.у.)
оксида углерода (IV). Вычислите содержание примесей в карбонате натрия.
9С. Если углекислый газ пропустить через воду, окрашенную лакмусом в фиолетовый цвет, то окраска переходит в красную; при нагревании окраска вновь становится фиолетовой. Дайте объяснение этим явлениям.
infourok.ru
Контрольная работа № 1
Тема: « Первоначальные химические понятия»

5. Рассчитайте, сколько граммов оксида магния образуется при сго-
рании магния массой 6 г.
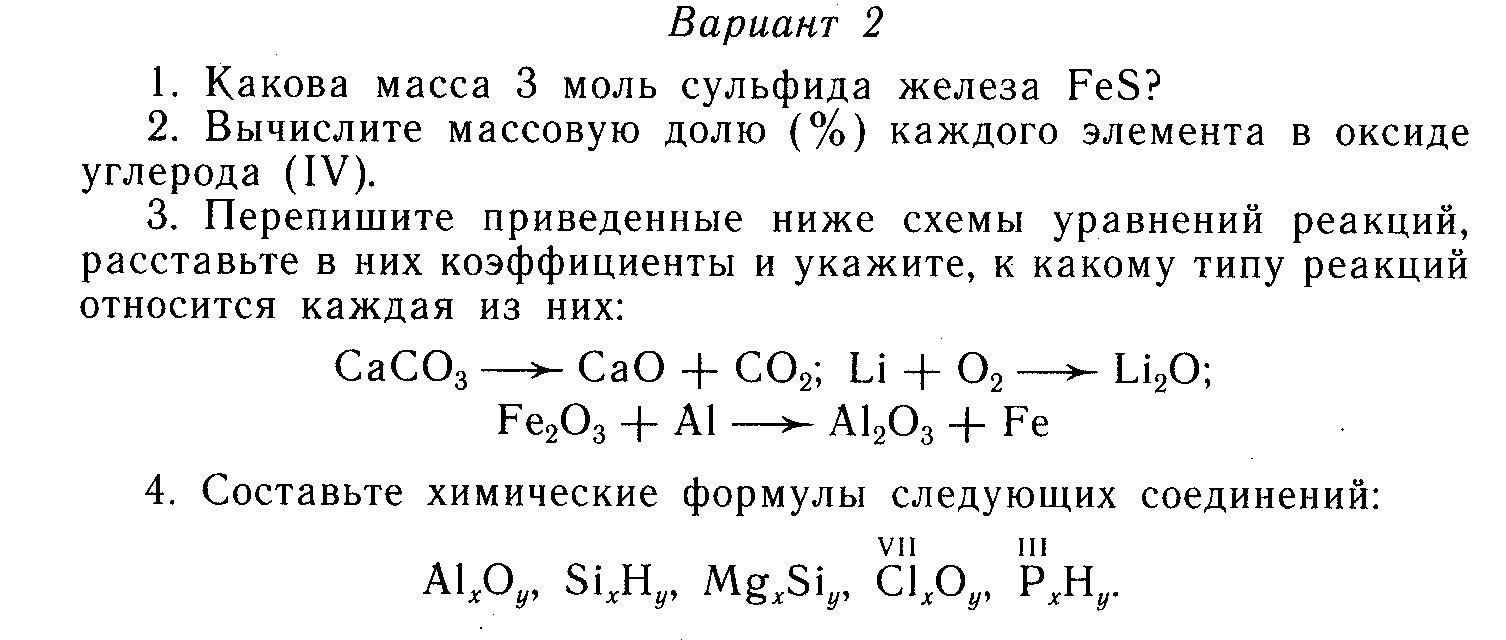
5. Рассчитайте, какую массу кислорода можно получить при разложении
9 г воды.
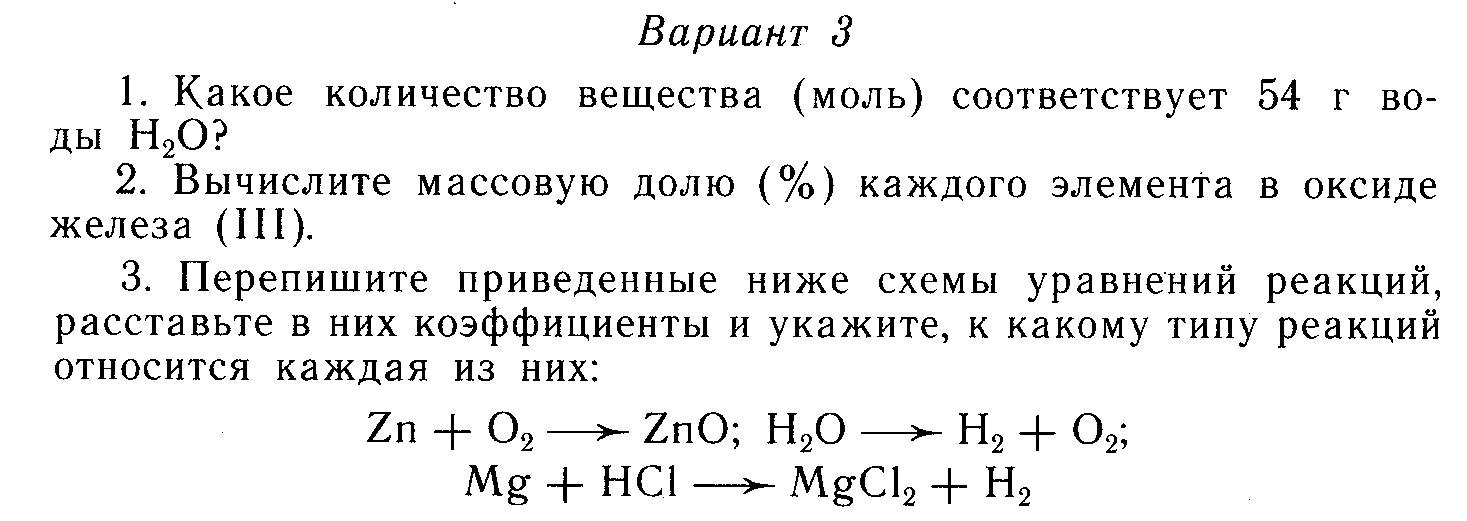
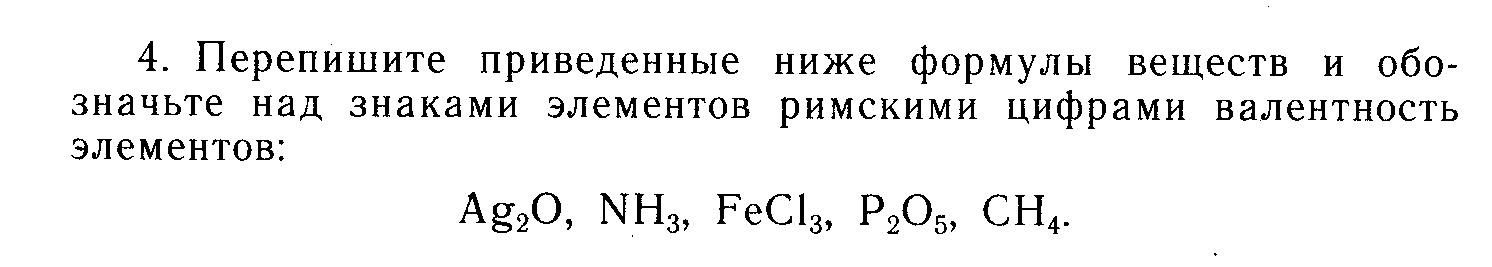
5. Какая масса кислорода затратится на получение 88 г углекислого газа
при горении угля?

5. Какая масса кислорода потребуется для сжигания 24 г угля(С)?
Контрольная работа № 2
Тема: «Строение атома. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Химическая связь».
8класс
Вариант 1
Определите вид химической связи в соединениях, формулы которых приведены: Cl2, Ph4, CaF2, N2, Cu, OF2. На примере Сl2 и РН3 покажите образование химической связи.
Определите тип кристаллической решётки в соединениях: алмаз, NaCl, СО2, Са, SiO2, I2, К2О.
Дайте характеристику химическому элементу с порядковым номером 16.
4. Каков физический смысл номера периода? Расположите данные элементы в порядке ослабления металлических свойств: Nа, Rb, К, Сs, Fr, Li.
5. При взаимодействии цинка с соляной кислотой образовалось 0,5 моль хлорида цинка. Вычислите массу полученной соли.
Вариант 2
1. Определите вид химической связи в соединениях,
формулы которых приведены: Н2, NaCl, Fe, Sih5, F2,
SO3. На примере F2 и Sih5 покажите образование
химической связи.
2. Определите тип кристаллической решётки в
соединениях: Si, НВr, LiF, Zn, AlCl3, Р, графит.
3.Дайте характеристику химическому элементу с
порядковым номером 13.
Каков физический смысл номера группы? Расположите данные элементы в порядке ослабления металлических свойств: О, С, В, Li, Ве, N, F.
5. При взаимодействии оксида кальция с водой
образуется 0,7 моль гидроксида кальция. Рассчи-
тайте массу полученного гидроксида кальция.
 Контрольная работа № 4
Контрольная работа № 4
Тема: « Водород. Окислительно-восстановительные реакции». 8 класс
Вариант 1
Напишите уравнения реакции взаимодействия:
а) цинка с соляной кислотой;
б) кальция с водой;
в) водорода с серой;
г) натрия с водородом;
д) оксида меди (II) с водородом.
Рассчитайте, какой объем водорода (н.у.) образуется при взаимодействии 28 г железа с соляной кислотой.
Определите степени окисления элементов в следующих соединениях: СО2, SiН4, Nh4, Р2О5, Н2S, Н3РО4, КМnO4, Na2CO3.
Составьте уравнения окислительно-восстановительных реакций:
Мn2O3 + Si → SiO2 + Мn
Li + О2 → Li2O
h3S + Br2 → S + HBr
Определите, какая масса серной кислоты необходима для полного растворения 2 моль цинка. Какое количество вещества соли при этом образуется?
Вариант 2
Напишите уравнения реакции взаимодействия:
а) магния с серной кислотой;
б) натрия с водой;
в) водорода с хлором;
г) кальция с водородом;
д) оксида меди (II) с водородом.
Рассчитайте, какой объем водорода (н.у.) образуется при взаимодействии 130 г цинка с соляной кислотой.
Определите степени окисления элементов в следующих соединениях: SО2, CН4, Ph4, Al2О3, Н2O, Н2SО4, КClO3, Na2 SiO4.
Составьте уравнения окислительно-восстановительных реакций:
Fe2O3 + CO → CO2 + Fe
N2 + O2 → NO
h3S + O2 → SO2 + h3O
В реакцию с соляной кислотой вступило 12 г магния. Рассчитайте массу и количество вещества образующегося водорода.
Контрольная работа № 5 по теме «Вода. Растворы. Основания».
Вариант 1
Уровень 1
Выписать отдельно формулы оксидов, оснований, кислот, солей. Назвать их.
Li2O, CuCl2, Ca3(PO)4, KCl, MgO, h3SO4, NaOH, CuO, HCl, FeSO4, Ca(OH)2, h3S, Н2СО3.
Закончите уравнения возможных реакций:
а) Н2О +Na = г) NaOH + h3SO4 =
б) Н2О + CaO = д) КОН + Р2О5 =
в) Н2О + NaН = е) Fe(ОН)3 =
Уровень 2
Найти массовую долю вещества (в%), если известно,
что в сосуд с водой, массой 300г добавили 40г ве-
щества.
Уровень 3
Составьте уравнения реакций, схемы которых даны
ниже. Назовите вещества.
Cu→ CuO → CuCl2 → Cu(OH)2 →CuO
При взаимодействии 49г серной кислоты с магнием
образовалась соль сульфат магния. Вычислите массу и количество полученной соли.
Вариант 2
Уровень 1
Выписать отдельно формулы оксидов, оснований, кислот, солей. Назвать их.
h3SO4, Na2SO3, Na2CO3, HBr, CaO, CuO, Al(NO3)3,
Ca(OH)2, HNO3, FePO4, КОН, Hg(OH)2, h3SiO3.
Закончите уравнения возможных реакций:
а) Н2О + К = г) NaOH + HCl =
б) Н2О + SO3 = д) КОН + Li2O =
в) Н2О + Al = е) NaOH + Zn(NO3)2 =
Уровень 2
Найти массовую долю вещества, если к 700 г воды
добавили 50 г вещества.
Уровень 3
4. Составьте уравнения реакций, схемы которых даны
ниже. Назовите вещества.
Mg →MgO → Mg(OH)2 → MgCl2 → MgSO4
5.При взаимодействии избытка соляной кислоты с 71г
сульфата натрия получена соль хлорид натрия.
Рассчитайте массу, и количество полученной соли.


infourok.ru