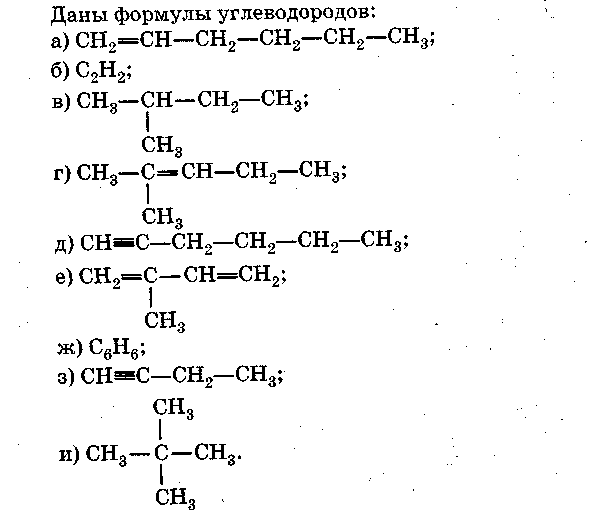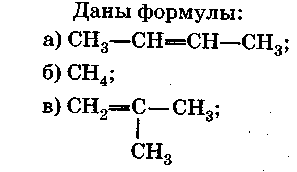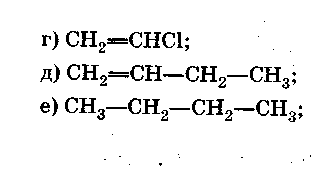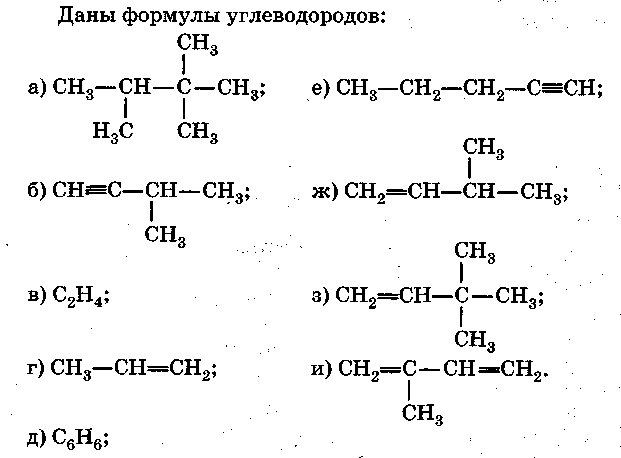Контрольные работы по химии 10 класс с ответами. Контрольная 10 класс химия
Контрольные работы по химии 10 класс страница 3
Часть С.
С1. Рассчитайте объем этилена, который можно получить из 23 г этанола, если объемная доля выхода продукта реакции составляет 60% от теоретически возможного. а) 44,8 л; б) 6,72 л; в) 672 л; г) 156,8 л. Запишите решение задачи.
С2. Для вещества пропаналь составьте структурные формулы одного изомера и одного гомолога и назовите эти вещества.
Ответы к контрольной работе:
Кислородсодержащие органические соединения.
Вариант 1.
Часть А. 1 - а, 2 - г, 3 – а,б,г, 4 - в, 5 - г, 6 - в, 7 – б.
Часть Б. А3, Б1, В2, Г5.
Часть С. С1 - 43 г.
Вариант 2.
Часть А. 1 – г, 2 – в, 3 – г, 4 – в, 5 – в, 6 – б, 7 – в.
Часть В.А5, Б2, В4, Г1.
Часть С. 6,72л.
Критерии оценивания: по 2 балла за правильный ответ в части 1, итого 14 баллов. 3 балла за задание В.
По 3 балла за правильный ответ в части С, итого 6 баллов. Всего – 23 балла
8 – 14 баллов – «3» (35%-60%)
15 – 20 баллов – «4» (61%-85%)
21 – 23 балла – «5»(86%-100%)
КИМ Химия 10 класс.
Контрольная работа 3:
Азотсодержащие органические соединения.
Вариант 1.
Часть 1. Тестовые задания с выбором ответа.
-
В состав аминокислот входят функциональные группы: а)Nh3 и COH б)Nh3 и COOH в)NO2 и COOH г)NH и COOH.
-
Название вещества СН3—СН2—СН(СН3)—СН2-- Nh3: а)1-амино-2-метилбутан; б)2-метил-1аминобутан; в)бутиламин; г)изобутиламин.
-
Окраска лакмуса в растворе вещества, формула которого С6Н5 Nh3: а)красная; б)синяя; в)фиолетовая.
-
Вещество, вступающее в реакцию с метиламином:
а) гидроксид натрия; б) магний; в)оксид магния; г) хлороводород
-
Химическая связь, образующая первичную структуру белка:
а)водородная; б) ионная; в)пептидная; г)ковалентная неполярная.
-
Сколько перечисленных веществ взаимодействует с аминоуксусной кислотой: пропаналь, глицерин, гидроксид натрия, вода, этановая кислота.
а) 1; б) 3; в) 2; г)5.
-
Для аминов характерны свойства: а)кислот; б)оснований; в)амфотерных соединений.
Часть 2. Задания со свободным ответом.
-
Что такое денатурация белков? В чем её сущность, и какие факторы её вызывают? Приведите примеры.
-
Рассчитайте объем кислорода, необходимый для сжигания 20л метиламина.
-
Как химическим путем отличить раствор белка от раствора глицерина?
Контрольная работа 3:
Азотсодержащие органические соединения.
Вариант 2.
Часть 1. Тестовые задания с выбором ответа.
-
Амины – это органические производные: а)аммиака б)азотной кислоты в)воды г)метана.
-
Название вещества СН3—СН(Nh3)—СН2-- СООН: а)1-аминобутановая кислота; б)4-аминобутановая кислота; в)2-аминомасляная кислота; г)3-аминомасляная кислота.
-
Окраска лакмуса в растворе вещества, формула которого СН3 Nh3: а) синяя; б) красная; в)фиолетовая.
-
Вещество, не вступающее в реакцию с этиламином:
а) кислород; б) гидроксид натрия; в)серная кислота; г) хлороводород
-
Химическая связь, образующая вторичную структуру белка:
а)водородная; б) ионная; в)пептидная; г)ковалентная неполярная.
6. Реакция, характерная для белков: а) гидратации; б) гидрирования; в) гидролиза; г)дегидрирования.
7. Для аминокислот характерны свойства: а)кислот; б)оснований; в)амфотерных соединений.
Часть 2. Задания со свободным ответом.
infourok.ru
Контрольные работы по химии - 10 класс - Химия
РАЗРАБОТКИ | 10 класс В категории разработок: 13 Фильтр по целевой аудитории - Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя  На выполнение работы по химии даётся 90 минут. Диагностическая работа включает в себя 17 заданий. В НИКО по химии включены задания, выявляющие владение основополагающими химическими понятиями, теориями, законами и закономерностями, умение использовать химическую терминологию и символику. Рекомендованное время для проведения процедуры исследования: на 2-3 или 3-4 уроках. Во время проведения процедур исследования в каждой аудитории должно находиться не более 15 участников. В архиве находятся файлы с текстом демоверсии диагностической работы и файл с системой оценивания.  
Источник: НИКО Целевая аудитория: для 10 класса Одним из способов, для определения уровня подготовки обучающихся является организация входного контроля, направленного на выявление пробелов в знаниях, затрудняющих усвоение новой информации. Задания для входного контроля тестового типа по химии составлены на основе программы основной школы. Они предназначены для выявления уровня первичной информированности в возможности работы с химическими понятиями обучающихся, поступивших на I курс СПО. Проверочная работа позволяет выявить слабые стороны подготовки обучающихся, разделить их на группы по уровню владения материалом с целью оказания помощи тем обучающимся, у которых этот уровень невысок, позволяет скорректировать учебный процесс с целью повышения эффективности обучения. Целевая аудитория: для 10 класса Контрольная работа предназначена для учащихся 10 класса, где химия изучается на базовом уровне(1 час.) Работа содержит задания А с выбором одного правильного ответа,задания В на соответствие.Здесь необходимо выбрать формулу класса.В задании С решить задачу и записать уравнения реакций. Целевая аудитория: для 10 класса Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 10 профильного класса. Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С. Часть А: Включает тестовые задания, требующие найти один верный ответ. Часть В: на установление соответствие к каждой позиции первичного столбца подобрать соответствующую позицию второго и записать выбранные цифры под соответствующими буквами. Часть С: решение задач. Контрольная работа состоит из 4-х вариантов.Имеется в работе критерии оценивания. Целевая аудитория: для 10 класса Цель: проконтролировать уровень усвоения учащимися знаний и умений по теме: «Углеводороды». Класс: 10,Программа Рудзитис или Габриелян.Форма контроля: письменная, тестовая. Контрольная работа была составлена на основе обязательного минимума содержания курса химии. Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С. Уровень А - тесты выборки Уровень В – тесты сличения Уровень С – тесты напоминания Работа состоит из 4-х вариантов. Целевая аудитория: для 10 класса Контрольная работа составлена по теме "Теория строения органических соединений А.М.Бутлерова". Проводится в 10 классе при изучении углеводородов. Эту работу я использую также в 11 классе для подготовки учащихся к ЕГЭ. В целях более качественной подготовки учащихся к Единому Государственному Экзамену контрольная работа составлена по типу ЕГЭ, имеются части А, В, С. Вместо тетрадей для контрольных работ в профильных классах несколько лет работаю с бланками ЕГЭ, так что у учащихся не возникает трудностей психологического характера при заполнении бланков. Ведь не секрет, что учащиеся даже при правильном выполнении задания не всегда могут правильно занести ответ в бланк, что снижает качество знаний учащихся. Надеюсь, работа будет полезна. Целевая аудитория: для 10 класса Контрольная работа для 10 класса на 4 варианта. Базовый уровень преподавания химии. Целевая аудитория: для 10 класса Работа по теме: "Основные БАЗОВЫЕ понятия органической химии", задания и задачи по теме. Целевая аудитория: для 10 класса Никогда не будет лишним устроить проверку знаний учащихся 10, да хоть и 11 классов, на знание классов органических соединений. Вот тут задания подобраны. Целевая аудитория: для 10 класса Небольшой сборник практических опытов по химии для 10-11 классов, работа предусматривает большую оснащенность лаборатории. Целевая аудитория: для 10 класса | Конкурсы  Диплом и благодарность каждому участнику! | 
© 2007 - 2017 Сообщество учителей-предметников "Учительский портал"Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.Территория распространения: Российская Федерация, зарубежные страны.Адрес редакции: 352192, г. Гулькевичи, ул. Ленинградская 34-19Учредитель: Никитенко Евгений ИгоревичКонтакты: [email protected]
Использование материалов сайта возможно только с разрешения администрации портала.
Ответственность за разрешение любых спорных вопросов, касающихся опубликованных материалов и их содержания, берут на себя пользователи, разместившие материал на сайте.Администрация портала готова оказать поддержку в решении любых вопросов, связанных с работой и содержанием сайта.

www.uchportal.ru
Итоговая контрольная работа по химии, 10 класс
Итоговая контрольная работа по химии 10 класс
Вариант 1
часть А
1. К гомологам относятся
1) пропан и гексан
2) бутан и бутен-1
3) этанол и диметиловый эфир 4) уксусная кислота и уксусный альдегид
2. Изомерами являются 1) бензол и фенол 2) метан и метанол
3) гексан и 2-метилпентан 4) этанол и уксусная кислота
3. Бутаналь и 2-метилпропаналь являются 1) гомологами 2) структурными изомерами 3) геометрическими изомерами 4) одним и тем же веществом
4. Общее число структурных изомерных углеводородов состава С4Н8 равно
1) 2 2) 3 3) 4 4) 5
5. К соединениям, имеющим общую формулу Сnh3nотносится 1) бензол 2) циклогексан 3) гексан 4) гексин
6. Число -связей в молекуле бутадиена равно
1) 1 2) 2 3) 3 4) 4
7. Атомы углерода находятся только в sp2-гибридном состоянии в молекуле
1) гексана 2) гексена 3) циклогексана 4) бензола
8. Число -связей в молекуле бензола равно 1) 2) 6 3) 3 4) 4
9. Число изомерных спиртов состава С5Н11OН, продуктами непол-ного окисления которых являются альдегиды, равно
1) 2 2) 3 3) 4 4) 5
10. Число -связей в молекуле этанола равно 1) 1 2) 5 3) 3 4) 8
11. Функциональная группа — СООН присутствует в молекуле
1) уксусной кислоты 3) формальдегида
2) этилацетата 4) фенола
12. Гидроксильная группа имеется в молекулах каждого из веществ: 1) спиртов и карбоновых кислот 2) альдегидов и простых эфиров
3) аминокислот и сложных эфиров 4) жиров и спиртов
Часть В
1. Согласно термохимическому уравнению реакции
СН4(г)+ 2О2(г) =СО2(г)+ 2Н2O(г) + 802 кДж
количество теплоты, выделившейся при сжигании 48 г метана, равно1) 3208 кДж 2) 2406 кДж 3) 1203 кДж 4) 802 кДж
2. При сгорании пентена в 56 л кислорода (н.у.) по уравнению
2C5Н10(r ) + 15O2(r) = 10CO2(r)+ 10h3O(r)
образовалась вода количеством вещества
1) 17 моль 2) 1,7 моль 3) 54 моль 4) 80 моль
Часть С
1. Какую массу хлорметана можно получить из метана объёмом 89,6 л и необходимого количества хлора?
Ответ______ г (Запишите число с точностью до целых)
II вариант
часть А
1. Гомологами являются
1) этен и метан 3) пропан и бутан 2) циклобутан и бутан 4) этин и этен
2. Вещество состава С4Н10О имеет 1) 7 изомеров 2) 6 изомеров 3) 4 изомера 4) 2 изомера
3. Какое вещество не является изомером бутену-2? 1) циклобутан 3) бутен-1 2) этилциклопропан 4) 2-метилпропен
4. Пропаналь и ацетон являются
1) гомологами
2) геометрическими изомерами
3) структурными изомерами
4) одним и тем же веществом
5. Органическое вещество, молекулярная формула которого С7Н8
относится к гомологическому ряду
1) метана 2) этилена 3) бензола 4) ацетилена
6. В молекуле ацетилена имеются
1) две - и две -связи 3) две - и три -связи
2) три - и одна -связь 4) три - и две -связи
7. Атомы углерода находятся только в sp3-гибридном состоянии в молекуле
1) циклогексана 2) бензола 3) гексена 4) гексина
8. Изомером этанола является
1) этиленгликоль 3) метанол 2) диэтиловый эфир 4) диметиловый эфир
9. Этиловый эфир уксусной кислоты и метилпропионат являются
1) гомологами 3) геометрическими изомерами
2) структурными изомерами 4) одним и тем же веществом
10. Карбоксильную группу содержат молекулы
1) сложных эфиров 3) альдегидов
2) многоатомных спиртов 4) карбоновых кислот
11. Общее число -связей в молекуле олеиновой кислоты равно 1) 2 2)3 3) 4 4) 5
12. Первичным амином является1) (Ch4)2NH 3) (СН3)3N2) С2Н5NН2 4) С6Н5 — NН — СНз
Часть В
1. Согласно термохимическому уравнению реакции окисления глюкозы
С6 Н12О6 + 6O2= 6CO2+ 6Н2О+ 2800 кДж
выделилось 56 кДж теплоты. Масса прореагировавшей глюкозы со-ставляет
1)3,6 г 2) 4,5 г 3) 6,55 г 4) 9 г
2. Объём воздуха (н.у.) (содержит 20% кислорода), необходимый для полного сжигания 100 л метана (н.у.), равен _________л.
1) 1000 2) 400 3) 800 4) 200
Часть С
1. Объём метана (н.у.), полученного из 18 г карбита алюминия, содержащего 20% примесей. равен__________________л. (запишите число с точностью до десятых)
Критерии оценивания
Часть А: 1 правильный ответ – 1 балл
ЧастьВ: 1 правильный ответ – 2 балла
Часть С: 1 правильный ответ – 3 балла
Максимальное число баллов – 17
15-17 баллов – оценка «5»
13-14 баллов – оценка «4»
10-13 баллов – оценка «3»
менее 10 баллов – оценка «2»
Ответы
| I вариант | II вариант |
| часть А | часть А |
| 1 | 1 | 1 | 3 |
| 2 | 3 | 2 | 1 |
| 3 | 2 | 3 | 2 |
| 4 | 4 | 4 | 3 |
| 5 | 2 | 5 | 3 |
| 6 | 2 | 6 | 4 |
| 7 | 4 | 7 | 1 |
| 8 | 1 | 8 | 4 |
| 9 | 3 | 9 | 2 |
| 10 | 4 | 10 | 4 |
| 11 | 1 | 11 | 1 |
| 12 | 1 | 12 | 2 |
| часть В | часть В |
| 1 | 2 | 1 | 1 |
| 2 | 2 | 2 | 1 |
| часть С | часть С |
| 202 г | 6,7 л |
| | | | |
kopilkaurokov.ru
Комбинированные контрольные работы по химии 10 класс. Базовый уровень
Комбинированные контрольные работы
(к учебнику О.С.Габриеляна «Химия.10 класс Базовый уровень»).
Все контрольные работы состоят из двух частей и являются комбинированными.
Часть А каждой работы содержит тестовые задания с выбором одного правильного ответа и задания на установление соответствия.
Часть Б содержит задания со свободной формой ответа и предусматривает написание уравнений реакций, условий их проведения и др.
Некоторые задания в этих вариантах являются заданиями повышенного уровня. Они отмечены звездочкой (*).
Темы
Контрольная работа №1 « Углеводороды и их природные источники».
Контрольная работа №2 « Кислородосодержащие органические соединения и их природные источники».
Итоговая контрольная работа по органической химии.
Контрольная работа №1
Углеводороды и их природные источники
10 класс
I вариант
Часть А. Тестовые задания с выбором ответа
(3 балла). Общая формула алканов:
А. СпН2п+2 В. СпН2п-2
Б. СпН2п Г. СпН2п-6
(3 балла). Название углеводорода, формула которого СН3-СН2-СН2-СН3,
по систематической номенклатуре:
А. Бутин-2 В. Бутан
Б. Бутен-1 Г. Бутин-1
(3 балла). Вещества, формулы которых С6Н6 и С2Н2, являются:
А. Гомологами В. Одним и тем же веществом
Б. Изомерами Г. Веществами разных классов
(3 балла). Последующим гомологом пропена является:
А. Бутан В. Этен
Б. Бутен-1 Г. Бутин-1
(3 балла). Химическая связь между атомами углерода в молекуле этена:
А. Одинарная В. Двойная
Б. Полуторная Г. Тройная
(3 балла). Вещество, для которого характерна реакция полимеризации:
А. Ацетилен В. Пропан
Б. Метан Г. Бутадиен-1,3
(3 балла). Продукт реакции этена с водородом:
А. Этан В. Полиэтилен
Б. Этилен Г. Ацетилен
(3 балла). Вещество Х в цепочке превращений
м
 етан Х бензол
етан Х бензол
является:
А. Этан В. Хлорметан
Б. Ацетилен Г. Этилен
9. (3 балла). Фракция продуктов нефтеперегонки с наименьшей температурой кипения:
А. Лигроин В. Бензин
Б. Керосин Г. Дизельное топливо
(3 балла). Природный газ – это смесь:
А. Предельных углеводородов и неорганических газов
Б. Непредельных углеводородов и неорганических газов
В. Ароматических углеводородов
Г. Предельных и непредельных углеводородов
Часть Б. Задания со свободным ответом
(7 баллов). К автомобильному бензину добавили водный раствор перманганата калия и полученную смесь хорошо перемешали. Объясните, будут ли происходить какие–либо изменения и почему. Можно ли сделать вывод о качестве бензина на основе этого эксперимента?
( 7 баллов). Для вещества, формула которого СН3-СН2-СН-СН3,
7 баллов). Для вещества, формула которого СН3-СН2-СН-СН3,
Ch4
напишите формулу одного изомера и одного гомолога. Назовите все вещества.
(
 6 баллов). Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения: этан 1 этилен 2 полиэтилен.
6 баллов). Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения: этан 1 этилен 2 полиэтилен.
Контрольная работа №1
Углеводороды и их природные источники
10 класс
II вариант
Часть А. Тестовые задания с выбором ответа
(3 балла). Общая формула алкенов:
А. СпН2п+2 В. СпН2п-2
Б. СпН2п Г. СпН2п-6
(3 балла). Углеводород состава С6Н6 относится к классу:
А. Алканов В. Алкинов
Б. Алкенов Г. Аренов
(3 балла). Вещества, формулы которых СН2==СН2 и СН2==СН---СН3, являются:
А. Гомологами В. Одним и тем же веществом
Б. Изомерами Г. Веществами разных классов
(3 балла). Название углеводорода, формула которого СН==С----СН2----СН3:
А. Пропин В. Бутен-2
Б. Бутин-2 Г. Бутин-1
(3 балла). Химическая связь между атомами углерода в молекуле этилена:
А. Одинарная В. Полуторная
Б. Двойная Г. Тройная
(3 балла). Вещество, для которого неосуществима реакция замещения:
А. Метан В. Бензол
Б. Этан Г. Этен
(3 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. С2Н6 и О2 В. СН4 и НCl
Б. С2Н4 и СН4 Г. С3Н8 и Н2
(3 балла). Вещество Х в цепочке превращений
С
 3Н8Pt, t СН2== CH---Ch4+HCl Х
3Н8Pt, t СН2== CH---Ch4+HCl Х
является:
А. 1,2-Дихлорэтан В. 2-Хлорпропан
Б. 2,2-Дихлорпропан Г. 1-Хлорпропан
(3 балла). Природный источник углеводородов, основным компонентом которого является метан:
А. Нефть В. Попутный нефтяной газ
Б. Природный газ Г. Каменный уголь
(3 балла). Сырье для получения синтетического каучука:
А. Картофель
Б. Млечный сок дерева гевеи
В. Продукты переработки нефти
Г. Продукты переработки каменного угля
Часть Б. Задания со свободным ответом
(7 баллов). В лаборатории для определения качества бензина в исследуемый образец помещают кусочек металлического натрия. С какой целью это делается и какие примеси в бензине обнаруживают этим способом?
(7 баллов). Для вещества, формула которого СН2==СН---СН2----СН2---СН3,
напишите формулу одного изомера и одного гомолога. Назовите все вещества.
(
 6 баллов). Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения: карбид кальция 1 ацетилен 2 бензол.
6 баллов). Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения: карбид кальция 1 ацетилен 2 бензол.
Контрольная работа №1
Углеводороды и их природные источники
10 класс
III вариант
Часть А. Тестовые задания с выбором ответа
(3 балла). Общая формула алкинов:
А. СпН2п+2 В. СпН2п-2
Б. СпН2п Г. СпН2п-6
( 3 балла). Название углеводорода, формула которого СН3---СН---СН3,
3 балла). Название углеводорода, формула которого СН3---СН---СН3,
СН3
по систематической номенклатуре:
А. Пропан В. Бутан
Б. 2-Метилпропан Г. 2-Метилбутан
(3 балла). Метан и ацетилен являются:
А. Гомологами В. Одним и тем же веществом
Б. Изомерами Г. Веществами разных классов
(3 балла). Ацетилен отличается от этилена:
А. Качественным составом молекул В. Продуктами полного сгорания
Б. Характерным типом химических реакций Г. Количественным составом молекул
(3 балла). Химическая связь между атомами углерода в молекуле этана:
А. Одинарная В. Двойная
Б. Полуторная Г. Тройная
(3 балла). Вещество, для которого нехарактерны реакции присоединения:
А. Этилен В. Этан
Б. Ацетилен Г. Пропен
(3 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. СН4 и НCl В. С6Н6 и Н2О
Б. С3Н6 и Cl2 Г. С2Н6 и Н2
(3 балла). Вещество, из которого в лаборатории можно получить этилен:
А. Этан В. Метан
Б. Этанол Г. Метанол
(3 балла). Процесс расщепления молекул углеводородов с большим числом атомов углерода:
А.Гидрирование В. Крекинг
Б. Ректификация Г. Риформинг
(3 балла). Вещество, не являющееся продуктом переработки метана в промышленности:
А. Технический углерод (сажа)
Б. Метанол
В. Этанол
Г. Ацетилен
Часть Б. Задания со свободным ответом
(7 баллов). Опишите, какие негативные экологические последствия могут быть связаны с транспортировкой и переработкой нефти?
( 7 баллов). Для вещества, формула которого СН3---СН---СН2---СН3,
7 баллов). Для вещества, формула которого СН3---СН---СН2---СН3,
Ch4
напишите формулу одного изомера и одного гомолога. Назовите все вещества.
(6 баллов). Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения: этанол 1 этилен 2 полиэтилен.


Контрольная работа №1
Углеводороды и их природные источники
10 класс
IV вариант
Часть А. Тестовые задания с выбором ответа
1. (3 балла). Класс веществ, соответствующих общей формуле СпН2п-2:
А. Алканы В. Арены
Б. Алкены Г. Алкины
(3 балла). Гомологом вещества бутен-1 является:
А. Бутан В. Бутен-2
Б. Пропен Г. Бутадиен-1,3
( 3 балла). Название углеводорода, формула которого СН3---СН---СН2---С----СН, по
3 балла). Название углеводорода, формула которого СН3---СН---СН2---С----СН, по
СН3
систематической номенклатуре:
А. 2-Метилпентин-4 В.2-Метилбутин-1
Б. 4-Метилпентин-1 Г. 2-Метилпентан
(3 балла). Вещества, являющиеся изомерами:
А. Пропан, бутан, 2-метилпропан В. Этин, пропин, пропадиен
Б. Бензол, метилбензол, ацетилен Г. Бутен-1, 2-метилпропен, метилциклопропан
(3 балла). Суффикс радикала:
А. -ан В. -ен
Б. -ил Г. -ин
(3 балла). Вещество, не вступающее в реакцию полимеризации:
А. Пропен В. 2,2-Диметилбутан
Б. Этен Г. Бутадиен-1,3
(3 балла). Вещество, для которого нехарактерна реакция замещения:
А. Ацетилен В. Этан
Б. Этилен Г. Циклогексан
(3 балла). Вещества Х, Y, Z в цепочке превращений


 С2Н5ОН t, h3SO4X +HClY +NaZ:
С2Н5ОН t, h3SO4X +HClY +NaZ:
А. Этен, дихлорэтан, этиленгликоль В. Диэтиловый эфир, хлорэтан, бутан
Б. Этен, хлорэтан, бутан Г. Углекислый газ, угольная кислота, карбонат натрия
(3 балла). Продукт взаимодействия 2-хлорпропана с водным раствором гидроксида калия:
А. Пропен В. Пропанол-2
Б. Пропанол-1 Г. Пропанон
(3 балла). Число различных углеводородов, которые могут образоваться при действии металлического натрия на смесь бромэтана и 2-бромпропана в определенных условиях:
А. 2
Б. 3
В. 4
Г. 5
Часть Б. Задания со свободным ответом
(6 баллов). Предложите не менее трех способов, при помощи которых можно отличить в лаборатории этилен от этана. Напишите возможные уравнения реакций.
(

 10 баллов). Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: С4Н10t, AlCl3 Х +Cl2 Y +KOH(спирт)Z.
10 баллов). Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: С4Н10t, AlCl3 Х +Cl2 Y +KOH(спирт)Z.
Назовите все вещества.
(4 балла). Алкен массой 4,2 г способен присоединить 12 г брома. Установите молекулярную формулу алкена.
Контрольная работа №2
Кислородсодержащие органические соединения и их природные источники
10 класс
I вариант
Часть А. Тестовые задания с выбором ответа и на установление соответствия
(3 балла). Общая формула предельных одноатомных спиртов:
O
А. R---ОН В. R-С
О OH
Б. R-С Г. СП(Н2О)m
О---R
(3 балла). Названиефункциональной группы
O
–С :
OH
А. Карбонильная В. Карбоксильная
Б. Гидроксильная Г. Нитрогруппа
(3 балла). Формула этаналя:
O O
А. H C В. Ch4C
OH H
O
Б. Ch4 C Г. Ch4 Ch3OH
OH
(3 балла). Изомер бутанола-1:
А. Бутановая кислота В. Диэтиловый эфир
Б. Бутаналь Г. 2-Метилбутанол-1
(3 балла). Предыдущим гомологом вещества, формула которого
O
СН3---СН2---С ,
OH
является:
O
А. H C
OH
O
Б. Ch4 C
OH
O
В. Ch4 Ch3 Ch3 C
OH
O
Г. Ch4 Ch3 Ch3 Ch3 C
OH
(3 балла). Вещество Х в цепочке превращений
С
 2Н6 Х С2Н5--ОН:
2Н6 Х С2Н5--ОН:
А. Хлорэтан В. 2,2-Дихлорэтан
Б. 1,1-Дихлорэтан Г. Этаналь
(3 балла). Формула вещества, вступающего в реакцию с этанолом:
А. NaCl В. КОН
Б. НNО3 Г. Вr2 (водный р-р)
(3 балла). Реактив для распознавания карбоновых кислот:
А. Перманганата калия В. Бромная вода
Б. Хлорид железа (III) Г. Лакмус
(3 балла). Сложный эфир можно получить реакцией:
А.Галогенирования В. Гидролиза
Б. Гидрирования Г. Этерификации
(3 балла). Вещество, используемое в косметической промышленности:
А. Уксусная кислота
Б. Муравьиный альдегид
В. Этиленгликоль
Г. Глицерин
(6 баллов). Установите соответствие:
Формула вещества:
O
I. H C
H
O
II. Ch4Ch3C
OH
III. Ch4OH
Класс соединений:
1. Альдегиды
2. Одноатомные спирты
3. Карбоновые кислоты
4. Сложные эфиры
Название вещества:
А. Диэтиловый эфир
Б. Пропановая кислота
В. Метанол
Г. Метаналь
Часть Б. Задания со свободным ответом
(9 баллов). Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме: O O


 С2Н41 СН3---СН2---ОН 2 СН3---С 3 СН3---С .
С2Н41 СН3---СН2---ОН 2 СН3---С 3 СН3---С .
H OH
Укажите условия осуществления реакций. Дайте название каждого вещества.
(5 баллов). Во время практической работы при неосторожности обращении опрокинулась спиртовка, горящий спирт разлился по столу. Предложите способы тушения огня.
Контрольная работа №2
Кислородсодержащие органические соединения и их природные источники
10 класс
II вариант
Часть А. Тестовые задания с выбором ответа и на установление соответствия
(3 балла). Сложным эфиром является вещество, формула которого:
А. СН3СООН В. СН3-О-СН3
O
Б. С2Н5-ОН Г. СН3-С
O C2H5
(3 балла). Функциональная группа, входящая в состав альдегидов:
А. ---ОН В. C==O
O O
Б. ---С Г. ---C
H O---
(3 балла). Формула пропановой кислоты:
А. СН3-СН2-СН2-ОН В. СН3-СН2-О-СН3
O O
Б. СН3-СН2-С Г. СН3-СН2-С
OH H
(3 балла). Изомером вещества, формула которого
O
С Н3-СН-С ,
Н3-СН-С ,
OH
является: Ch4
O
А . СН3-СН2-СН2-СН2-ОН В. Ch4 CH Ch3 C
. СН3-СН2-СН2-СН2-ОН В. Ch4 CH Ch3 C
OH
Ch4
O O
Б. СН3-СН2-СН2-С Г. СН3-СН2-СН2-С
OH H
(3 балла). Гомологом этилового спирта не является:
А. Метанол В. Бутанол-1
Б. Бутанол-2 Г. Пентанол-1
(3 балла). В цепочке превращений
С
 2Н5ОН Х СН3СООН
2Н5ОН Х СН3СООН
веществом Х является:
А. Этаналь В. Этилен
Б. Этанол Г. Этан
(3 балла). Уксусный альдегид взаимодействует с веществом, формула которого:
А. CuО В. СН3ОН
Б. Ag2О Г. NаОН
(3 балла). Реактив для распознавания одноатомных спиртов:
А. Раствор перманганата калия В. Оксид меди (II)
Б. Аммиачный раствор оксида серебра Г. Раствор хлорида железа (III)
(3 балла). Превращение, которое нельзя осуществить в одну стадию:
А
 . С2Н6 С2Н5ОН В. СН3ОН СН3ОNа
. С2Н6 С2Н5ОН В. СН3ОН СН3ОNа
O O O
Б
 . Ch4---C Ch4---C Г. H---C СН3ОН
. Ch4---C Ch4---C Г. H---C СН3ОН
H OH H
(3 балла). Вещество, применяемое для производства антифризов:
А. Глицерин В. Фенол
Б. Этиленгликоль Г. Метанол
(6 баллов). Установите соответствие:
Формула вещества:
O
I. H---C
OH O
II.Ch4---Ch3---C
H
III. C2H5OH
Класс соединений:
1. Одноатомные спирты
2. Альдегиды
3. Карбоновые кислоты
4. Многоатомные спирты
Название вещества:
А. Этанол
Б. Метановая кислота
В. Этаналь
Г. Пропаналь
Часть Б. Задания со свободным ответом
(9 баллов). Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме: O O
С

 2Н5---Cl 1 СН3---СН2---ОН 2 СН3---С СН3---С .
2Н5---Cl 1 СН3---СН2---ОН 2 СН3---С СН3---С .
H OH
Укажите условия осуществления реакций. Дайте название каждого вещества.
( 5 баллов). При выполнении практической работы «Получение этилена» лопнула пробирка со смесью этилового спирта и концентрированной серной кислоты. Опишите ваши действия.
5 баллов). При выполнении практической работы «Получение этилена» лопнула пробирка со смесью этилового спирта и концентрированной серной кислоты. Опишите ваши действия.
Контрольная работа №2
Кислородсодержащие органические соединения и их природные источники
10 класс
III вариант
Часть А. Тестовые задания с выбором ответа и на установление соответствия
(3 балла). Альдегидом является:
А. Метанол В. Пропанон
Б. Пропаналь Г. Этилацетат
(3 балла). Молекулы карбоновых кислот содержат функциональную группу, формула которой:
O O
А. ---C В. ---C
H OH
O
Б. ---OH Г. ---C
O---
(3 балла). Название вещества, формула которого
С Н3---СН---СН3:
Н3---СН---СН3:
OH
А. Пропанон В. Пропанол-1
Б. Пропаналь Г. Пропанол-2
(3 балла). Изомерами являются:
А. Стеариновая и олеиновая кислоты В. Метанол и метаналь
Б. Этанол и метанол Г. Этанол и диметиловый эфир
(3 балла). Гомологом этанола является вещество, формула которого:
O
А. H---C В. СН3ОН
H
O
Б. Ch4---C Г. С17Н35---СООН
H
(3 балла). Веществами Х и Y в цепочке превращений
С
 2Н4+h3O, h4PO4 Х CuO, tY
2Н4+h3O, h4PO4 Х CuO, tY
соответственно являются:
А. Этаналь и уксусная кислота В. Этанол и этаналь
Б. Этаналь и метанол Г. Ацетилен и метаналь
(3 балла). Уксусно-этиловый эфир вступает в реакцию:
А. Гидратации В. Гидрирования
Б. Гидролиза Г. Дегидратации
(3 балла). Реактив для распознавания фенола:
А. Раствор хлорида железа (III) В. Аммиачный раствор оксида серебра
Б. Лакмус Г. Раствор перманганата калия
(3 балла). Ученый, разработавший промышленный способ получения уксусного альдегида:
А. А. Вюрц В. Н. Зинин
Б. М. Кучеров Г. С. Лебедев
(3 балла). Вещество, используемое для протравливания семян:
А. Этанол В. Борная кислота
Б. Уксусная кислота Г. Формальдегид
(6 баллов). Установите соответствие:
Формула вещества:
I. C3H7COOH
II. Ch4 Ch3 Ch3 OH
III. C6h22O6
Класс соединений:
1. Углеводы
2. Спирты
3. Карбоновые кислоты
4. Альдегиды
Название вещества:
А. Бутановая кислота
Б. Гексаналь
В. Пропанол-1
Г. Глюкоза
Часть Б. Задания со свободным ответом
(9 баллов). Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме: O O O
С

 2Н21 . Ch4---C 2 Ch4---C 3 Ch4---C
2Н21 . Ch4---C 2 Ch4---C 3 Ch4---C
H OH O---C2H5
Укажите условия осуществления реакций. Дайте название каждого вещества.
(5 баллов). Перечислите основные правила обращения с химическими веществами-ядохимикатами, используемые на даче или приусадебном участке. Приведите названия известных вам препаратов.
Контрольная работа №2
Кислородсодержащие органические соединения и их природные источники
10 класс
IV вариант
Часть А. Тестовые задания с выбором ответа
(3 балла). Общая формула сложных эфиров:
.
А. R-ОН В. R-СНО
O
Б. R1---С Г. R1-О- R2
OR2
(3 балла). Ряд формул веществ, относящихся к одному классу соединений:
А. СН3ОН, НСООН, СН3СНО В. С15Н31СООН, НСООН, С2Н5СООН
Б. СН3СООСН3, С2Н5ОН, СН3СООН Г. С6Н5ОН, НСНО, НСОООН
(3 балла). Название солей муравьиной кислоты:
А. Ацетаты В. Формиаты
Б. Глицераты Г. Фталаты
(3 балла). Кислота, содержащаяся в спелых ягодах брусники и клюквы:
А. Уксусная В. Лимонная
Б. Муравьиная Г. Бензойная
(3 балла). Вещество, вступающее в реакцию с этиловым спиртом:
А. Оксид меди (II) В. Уксусная кислота
Б. Натрий Г. Все ответы верны
(3 балла). Реакция, обратная реакции этерификации:
А. Дегидратация В. Гидрирование
Б. Дегидрирование Г. Гидролиз
(3 баллы). Формулы веществ, взаимодействие которых соответствует сокращенному ионному уравнению
2Н+ + СО32- = СО2+ Н2О
А. (СН3СОО) 2Cа и Н2SО4 В. НСООН и MgСО3
Б. Nа2СО3 и СН3СООН Г. CаСО3 и НCI
(3 балла). Окраска смеси глицерина с гидроксидом меди (II):
А. Голубая В. Красная
Б. Синяя Г. Фиолетовая
(3 балла). Вещество Х в цепочке превращений
А
 лкен Х сложный эфир:
лкен Х сложный эфир:
А. Алкан В. Одноатомный спирт
Б. Альдегид Г. Карбоновая кислота
(3 балла). Уравнение реакции этерификации:
А . СН3СООСН3 + Н2О СН3СООН + СН3ОН
. СН3СООСН3 + Н2О СН3СООН + СН3ОН
Б . НСООН + КОН НСООК + Н2О
. НСООН + КОН НСООК + Н2О
В . СН3ОН + НОС2Н5 СН3С2Н5 + Н2О
. СН3ОН + НОС2Н5 СН3С2Н5 + Н2О
Г . С3Н7СООН + С2Н5ОН С3Н7СООС2Н5 + Н2О
. С3Н7СООН + С2Н5ОН С3Н7СООС2Н5 + Н2О
Часть Б. Задания со свободным ответом
11. (10 баллов). Рассчитайте массу эфира, полученного при взаимодействии этанола массой 9,2 г с уксусной кислотой массой 6 г. Выход продукта реакции составляет 80% от теоретически возможного.
(6 баллов). Определите формулы веществ Х, Y, Z в цепочке превращений:
С

 2Н5ОН +CuO Х +Cu(OH)2, tY +Ch4OHZ.
2Н5ОН +CuO Х +Cu(OH)2, tY +Ch4OHZ.
Напишите уравнения реакций. Дайте названия веществ.
13. (4 балла). Одним из ядовитых веществ, содержащихся в фальсифицированных спиртных напитках, является уксусный альдегид. Предложите химические способы его обнаружения.
Итоговая контрольная работа по органической химии
I вариант
10 класс
Часть А. Тестовые задания с выбором ответа
(3 балла). Общая формула алканов:
А. СпН2п В. СпН2п-2
Б. СпН2п+2 Г. СпН2п-6
(3 балла). Название вещества, формула которого
СН2---СН---С---СН:


Ch4Ch4
А. Гексин-1 В. 2,3-Диметилбутин-1
Б. 3-Метилпентин-1 Г. 3-Метилпентин-4
(3 балла). Вещество, в котором отсутствует связь:
А. Гексин В. Пропанол-1
Б. 2-Метилпропен Г. 2-Метилпентен-1
(3 балла). Изомером вещества, формула которого
С Н3---СН---СН3
Н3---СН---СН3
Ch4
является:
А.Бутан В. 3-Метилпропан
Б. 2-Метилбутан Г. Пентан
(3 балла). Число возможных структурных изомеров для вещества, формула которого
С Н3----СН---СООН:
Н3----СН---СООН:
Nh3
А. 1 В. 3
Б. 2 Г. 4
(3 балла). Вещество, для которого возможно реакция дегидратации:
А. Бутадиен-1,3 В. Этанол
Б. Этаналь Г. Хлорэтан
(3 балла). Окраска смеси глюкозы с гидроксидом меди (II) при нагревании:
А. Голубая В. Красная
Б. Синяя Г. Фиолетовая
(3 балла). Вещество Y в цепочке превращений
С
 2Н5ОН +CuO Х +Ag2O(ам. р-р)Y
2Н5ОН +CuO Х +Ag2O(ам. р-р)Y
относится к классу:
А. Алкенов В. Карбоновых кислот
Б. Альдегидов Г. Спиртов
(3 балла). Формула реактива для распознавания глицерина:
А. Аg2О (ам. р-р) В. I2 (спирт. р-р)
Б. FеCI3 (р-р) Г. Cu (ОН)2
(3 балла). Кислота, на нейтрализацию 32г которой расходуется 0,5моль гидроксида калия:
А. Масляная В. Пропионовая
Б. Муравьиная Г. Уксусная
Часть Б. Задания со свободным ответом
(10 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
C


 аC21 С2Н2 2 С6Н6 3 С6Н5NО2 4 С6Н5NН2
аC21 С2Н2 2 С6Н6 3 С6Н5NО2 4 С6Н5NН2
Дайте названия каждого вещества.
(4 балла). Какую пластмассу называют целлулоидом? Как и из чего ее получают? Укажите недостаток этого полимера. Перечислите области применения целлулоида.
(6 баллов). Составьте схему получения этанола из крахмала. Над стрелками переходов укажите условия осуществления реакций и формулы необходимых для этого веществ.
Итоговая контрольная работа по органической химии
II вариант
10 класс
Часть А. Тестовые задания с выбором ответа
(3 балла). Общая формула алкенов:
А. СпН2п В. СпН2п-2
Б. СпН2п+2 Г. СпН2п-6
(3 балла). Название вещества, формула которого
O
СН3---СН2---СН2---СН2--- С :
H
А. Пентановая кислота В. Пентаналь
Б. Пентанол Г. Пентен-1
(3 балла). Вещество, в молекуле которого имеется пи- связь:
А. Этан В. Метан
Б. Этин Г. Пропан
(3 балла). Вид изомерии, характерный для алканов:
А. Положения функциональной группы В. Углеродного скелета
Б. Положения кратной связи Г. Межклассовая
(3 балла). Предыдущим гомологом бутина-1 является:
А. Бутин-2 В. Пентин-2
Б. Пентин-1 Г. Пропин
(3 балла). Вещество, для которого характерна реакция полимеризации:
А. Бутадиен-1,3 В. Бензол
Б. Бутан Г. Бутанол-1
(3 балла). Формула вещества Х в цепочке превращений

 СН4t Х +h3, Ni С2Н4:
СН4t Х +h3, Ni С2Н4:
А. СО2 В. С3Н8
Б. С2Н2 Г. С2Н6
(3 балла). Окраска смеси белка с гидроксидом меди (II) при нагревании:
А. Голубая В. Красная
Б. Синяя Г. Фиолетовая
(3 балла). Реактив для распознавания альдегидов:
А. Лакмус В. Спиртовой раствор иода
Б. Раствор хлорида железа (III) Г. Гидроксид меди (II)
(3 балла). Углеводород, 13г которого способны присоединить 1моль брома:
А. Ацетилен В. Бутен-2
Б. Бутадиен-1,3 Г. Пропин
Часть Б. Задания со свободным ответом
(10 баллов). Составьте уравнения реакций по схеме:
C


 6Н12О6 1 С2Н5ОН 2 СН3СООС2Н5 3 СН3СООН 4 СН2CIСООН.
6Н12О6 1 С2Н5ОН 2 СН3СООС2Н5 3 СН3СООН 4 СН2CIСООН.
Укажите условия их осуществления. Дайте названия каждого вещества.
(4 балла). Почему при повышении температуры в организме человека свыше 390 С ферменты перестают «работать»? Что с ними при этом происходит?
(6 баллов). Восстановите левые части уравнений:
А
 . ... 450 C, AlCl3 СН3---СН----СН3
. ... 450 C, AlCl3 СН3---СН----СН3
Ch4
Б . … +… СН2CI---СН2CI.
. … +… СН2CI---СН2CI.
Укажите типы реакций.
infourok.ru
контрольные работы по химии 10 класс с ответами
10 класс. Контрольная работа 1
по теме «Предельные и непредельные углеводороды»
1.В какие реакции не вступает метан?
А) изомеризации;
Б) присоединения;
В) замещения;
Г) горения;
Д) правильного ответа нет. 2.Какие условия необходимы для начала реакции между метаном и хлором?
А) охлаждение;
Б) нагревание;
В) освещение;
Г) применение катализатора;
Д) правильного ответа нет.
3 . Вычислите объем водорода, образующегося при дегидрировании 1 л этана с образованием этилена.
А) 1 л; Б) 2 л; В) 3 л; Г) 6 л;
д) правильного ответа нет.
4.Дополните фразу: «Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разный порядок расположения атомов в молекуле ,т.е. разное строение, а потому и разные свойства, называются: А) гомологами Б) изомерами В) радикалами Г) молекулами
5.Дополните фразу: «В углеводородах реализуется …связь».
А) неполярная ковалентная Б) полярная ковалентная В) ионная Г) неполярная ковалентная и полярная ковалентная
6.Формулы СН3? (СН2)2? СН3 ; С 4Н10 ; СН3? СН2? СН3 отражают строение А) трех разных веществ Б) двух разных веществ
В) одного вещества Г) одного вещества , называемого бутаном
7. К классу алканов относится А) С7Н12 Б) С7Н16 В) С7Н6 Г) С7 Н88.Тип гибридизации атомов углерода в молекуле СН3 - СН2 -СН2- СН3 А) sp2 Б) sp3 В) sp 9. Угол между осями углеродного атома для sp3- гибридных орбиталей равен А) 109° 28 ¢ Б)120 ° В) 180°
10. Реакция, уравнение которой СН3 -СН2-ОН - СН2 →СН2 + Н2О,является реакцией А) дегидрирования Б) дегидратации В)дегидрохлорирования 11. Для алканов характерна изомерия А) положения функциональной группы Б) углеродного скелета В) положения двойной связи Г) геометрическая 12. Метан не взаимодействует с веществом , формула которого: А)C3H8. Б) Br2. В) О2. Г) Сl2. 13.Какие реакции обусловлены наличием в алкенах ¶-связи ? А) замещения; Б) разложения; В) присоединения; Г) обмена;
14. Этилен не используют:
А) для получения этилового спирта;
Б) для получения пластмасс;
В) в качестве горючего;
Г) для получения 1,2-дихлорэтана;
Д) правильного ответа нет.
15.Гомологическому ряду алкадиенов соответствует общая формула:
А) СпН2п; Б) СпН2п+2; В) СпН2п-2; Г) СпН2п; Д) правильного ответа нет.
16. Для какого вещества характерны реакции полимеризации: А) этан; Б) пропан; В) этанол; Г) пропилен
17.Алкинам соответствует общая формула
А) Сn Н2n+2 Б) Сn Н2n В) Сn Н2n-2 Г) Сn Н2n -6
18. Тип гибридизации ключевых атомов углерода в молекуле СН2 = СН - СН3 А) sp3
Б) sp В) sp2 10 класс Ответы К.р 1
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
|
|
Б
|
В
|
Б
|
Б
|
В
|
Б
|
Б
|
Б
|
А
|
А
|
Б
|
А
|
В
|
В
|
В
|
Г
|
В
|
В
|
1
multiurok.ru
Контрольные работы химия 10 класс
Контрольная работа №1.
Углеводороды.
Вариант 1.
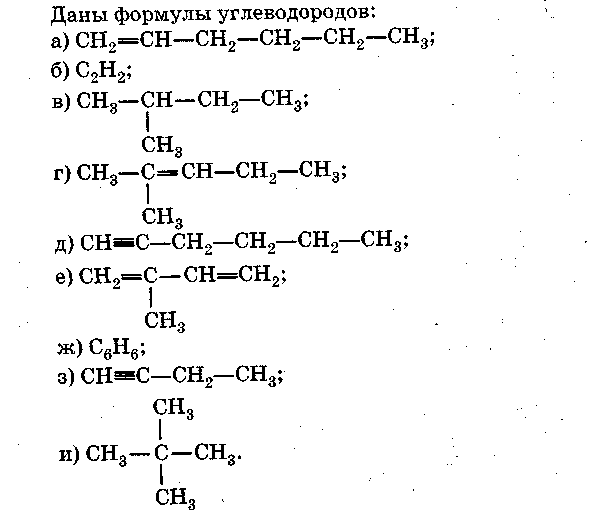
Часть А
Выберите правильный ответ (ответы).
1. Формулы алканов.
2 Формулы непредельных углеводородов.
3Формулы веществ, состав которых соответствует общей формуле СnН2n-2.
-
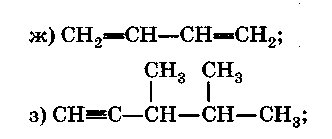
Формула гомолога вещества с формулой з).
-
Формула изомера вещества с формулой и).
-
Формулы веществ, вступающих в реакции замещения.
-
Формулы веществ, обесцвечивающих бромную воду.
-
Формула вещества, при полимеризации которого образуется каучук.
-
Формула вещества, которая пропущена в цепочке превращений:
СН4→…→ С6Нб.
10. Формула газообразного вещества, используемого для резки и сварки металлов.
Часть Б
Допишите фразу.
-
Вещество, формула которого ж), относят к классу ... .
-
Название вещества, формула которого и), — ... .
-
Название вещества, формула которого е), — ....
-
Формула гомолога вещества, формула которого в), - ... .
-
Формула изомера положения двойной связи для вещества, формула которого г), — ....
-
Уравнение реакции вещества, формула которого б), с бромом — ....
-
Уравнение реакции вещества, формула которого б), с водой — ....
-
Уравнение реакции лабораторного способа получения вещества, формула которого б), — ....
Контрольная работа №1.
Углеводороды.
Вариант 2.
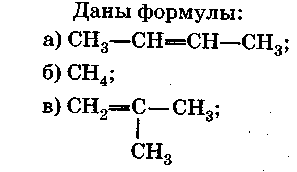
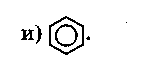
Часть А
Выберите правильный ответ (ответы).
-
Формулы алкенов.
-
Формулы непредельных углеводородов.
-
Формула вещества, состав которого соответствует общей формуле СnН2n-6.
-
Формула гомолога вещества с формулой б).
-
Формулы изомеров вещества с формулой д).
-
Формулы веществ, вступающих в реакции замещения.
-
Формулы веществ, обесцвечивающих бромную воду.
-
Формула вещества, при полимеризации которого образуется каучук.
-
Формула вещества, которая пропущена в цепочке превращений:
С2Н2→ …→ (СН2-СНС1-)n.
10. Формула газообразного вещества, используемого как сырье для получения ацетилена.
Часть Б
Допишите фразу.
-
Вещество, формула которого г), относят к классу … .
-
Название вещества, формула которого з), — ... .
-
Название вещества, формула которого ж), — ....
-
Формула гомолога вещества, формула которого д),-....
-
Формула изомера углеродного скелета для вещества, формула которого в), — ... .
-
Уравнение реакции вещества, формула которого д), с бромом — ....
-
Уравнение реакции вещества, формула которого б), с кислородом — ....
8. Уравнение реакции получения в промышленности вещества, формула которого ж), — ... .
Контрольная работа №1.
Углеводороды.
Вариант 3.
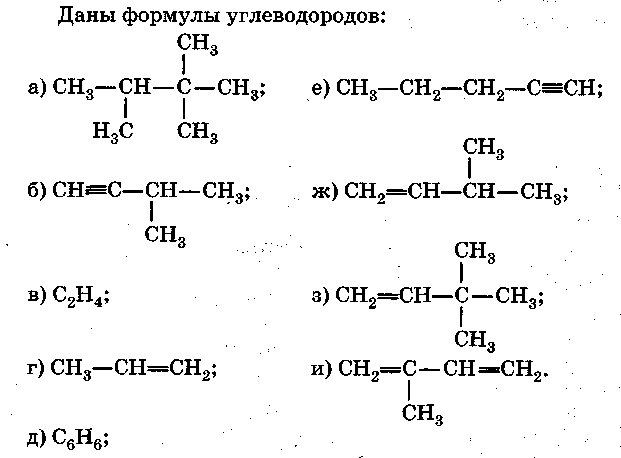
Часть А
Выберите правильный ответ (ответы).
-
Формулы алкинов.
-
Формулы непредельных углеводородов.
-
Формулы веществ, состав которых соответствует общей формуле СnН2n.
-
Формула гомолога вещества с формулой в).
-
Формулы изомеров вещества с формулой и).
-
Формулы веществ, вступающих в реакции замещения.
-
Формулы веществ, обесцвечивающих бромную воду.
-
Формула вещества, при полимеризации которого образуется каучук.
-
Формула вещества, которая пропущена в цепочке превращений:
С2Н5ОН →…→ (СН2-СН2-)n.
10. Формула газообразного вещества, используемого для получения полиэтилена.
Часть Б
Допишите фразу.
-
Вещество, формула которого а), относят к классу ... .
-
Название вещества, формула которого а), — ... .
-
Название вещества, формула которого з), — ....
-
Формула гомолога вещества, формула которого е),-... .
-
Формула изомера углеродного скелета для вещества, формула которого з), — ... .
-
Уравнение реакции вещества, формула которого е), с бромом — ....
-
Уравнение реакции вещества, формула которого в), с водой — ....
-
Уравнение реакции лабораторного способа получения вещества, формула которого в), — ....
infourok.ru
контрольная работа по химии за 10 класс
Аксенюк Вера Викторовна Прииртышская ОСШ имени Т.П. Праслова.
Павлодарская область Железинский район
Контрольная работа
Тема: контрольная работа по химии за 10 класс
Цель: Объективная оценка уровня овладения учебными достижениями учащихся в соответствии с государственными общеобязательными стандартами по химии
Документы, определяющие содержание тестовых заданий:
Государственый общеобязательный стандарт начального, основного среднего, общего среднего образования РК, утвержденного приказом МОН РК от 23августа 2012 года, № 1080.
Типовые учебные планы начального, основного среднего, общего среднего образования (Приказ МОН РК от 23августа 2012 года, № 1080)
Типовые образовательные учебные программы начального образования (Приложение 2 к Приказу МОН РК от 23августа 2012 года, № 1080)
Типовые образовательные учебные программы основного среднего образования (Приложение 3 к Приказу МОН РК от 23августа 2012 года, № 1080)
Типовые образовательные учебные программы общего среднего образования. Общественно-гуманитарный и естественно-математический направления обучения (Приложение 4,5 к Приказу МОН РК от 23августа 2012 года, № 1080)
План и структура тестовых заданий:
В качестве измерителя знаний и умений учащихся по химии используются тестовые задания. Работа состоит из 25 заданий. Они расположены по нарастанию трудности и разделены на 2 блока.
Блок А содержит 20 заданий, к каждому из которых даны варианты ответов. При выполнении этих заданий требуется из предложенных вариантов выбрать правильные ответы.
Блок Б содержит 5 заданий, при выполнении которых требуется записать решение.
Тест имеет следующую структуру:
Раздел «ПЗ и ПСХЭ в свете теории строения атома» включает 6 заданий, проверяющих знание о строение атома, изменении радиусов атома их влияние на валентность и окислительно-востановительные свойства.
Раздел «Химическая связь и строение вещества» включает 4 задания, проверяющих знания о виде химической связи, механизме образования химической связи.
Раздел «Закономерности протекания химических реакций» включает 4 задания, проверяющих знание о сущности химической реакции.
Раздел «Теория электролитической диссоциации» включает 6 заданий, проверяющих диссоциацию веществ на ионы, степень диссоциации, составление уравнений в молекулярном, полном и сокращенном ионном виде
Решение задач
Блок А
Блок Б
Содержательные
линии
Воспроизвдение
Знаний
Примение
знаний
Интеграция знаний
ПЗ и ПСХЭ в свете теории строения атома
3
3
Химическая связь и строение вещества
2
2
Закономерности протекания химических реакций
2
2
Электроитическая диссоциация
3
3
Задачи
5
40%
40%
20%
Спецификация теста.
Проверяемый элемент
Блок А
Электронная формула атома
Металл, неметалл
Определение валентности, степени окисления атомов химических элементов
Определение относительнойй молекулярной массы
Вычисление массовых долей
Определение степени окисления в соединениях
Периодически изменяющиеся свойства элементов
Типы химической связи
Типы химической связи
Гибридизация атомных орбиталей и геометрия молекул
Химические реакции, особенности их протекания
Закон сохранения массы и энергии
Химическое равновесие
Скорость химической реакции
Электролит неэлектролит
Диссоциация кислот
Диссоциация солей
Сильный, слабый электролит
Определение среды раствора по действию индикатора
Сумма коэффициентов в полном ионном уравнении
Блок Б
Вычисление относительной плотности газов
Вычисление скорости химической реакции
Вычисление константы равновесия
Вычисление массовой доли выхода продукта реакции по сравнению с теоретически возможным
Вычисление объема газа по уравнению реакции, если одно из исходных веществ дано в избытке
1вариант
Блок А
1.Число электронных уровней у атома элемента с номером 56:
А) 5B) 6C) 3D) 4 E) 2
2.Щелочные металлы находятся в главной подгруппе группы номер:
А) 3B) 2C) 7D) 1 E) 5
3.Степень окисления и валентность кислорода не совпадают по абсолютной величине
А) CaO B) h3O2 C) SO3 D)N2O5 E) CO2
4. Степень диссоциации определяется по формуле:
А)α = N\n В) α = n\N С)α =n*ND)α=N-nЕ) α=n-N
5. Сумма всех коэффициентов в полном ионном уравнении реакции Ca(NO3)2 + K2CO3 =
А) 3 B) 11 С) 9 D) 12 E) 15
6. Сокращённое ионное уравнение: 2H+ + CO3 2- = h3O + CO2 соответствует взаимодействию
А) карбоната кальция и соляной кислоты
В) карбоната натрия и кремниевой кислоты
С) силиката натрия и соляной кислоты
D) карбоната натрия и соляной кислоты
Е) карбоната натрия и воды
7. В растворе соляной кислоты фиолетовый лакмус становится
А) Синим B) Желтым С) Красным
D) Бесцветным E) Оранжевым
8. Элемент имеющий конфигурацию …..6s2
А) Mo В) At С) Ba D) Ag Е) Po
A) h3S B) SO2 C) h3SO3 D) S E) SO3
10. При диссоциации соли Al2(SO4)3 образуются частицы
А) Al3+ + SO42- B) 2 Al +3 SO4 C) 2Al3- +3SO42+
D) 2Al3+ +3SO42- E) 2Al2+ +3SO43-
11. При увеличении концентрации исходных веществ в 3 раза скорость реакции
h3+ Cl2 = 2HCl возрастет в:
A) 16раз B) 4 раза C) 64 раза D) 9 раз E) 12 раз
12.Объем метана, на сжигание которого израсходовано 88л кислорода
A) 34л B) 24л C) 44л D) 26л E) 22л
13. Формула гидроксида, характерного для азота:
A) HRO2 B) h3RO3 C) HRO3 D) h3RO4 Е) Н2RO4
A) 6 B) 4 C) 9 D) 7 E) 13
15.Термохимическое уравнение реакции горения магния 2Mg+O2=MgO +1127кДж при сгорании 3 г магния выделится теплоты
A) 11,27 кДж B) 28,175 кДж C) 56,35кДж D) 112,70 кДж E) 90,50 кДж
16. Атому элемента фосфора отвечает электронная формула
A) 1s22s22p63s23p1 B) 1s22s22p63s23p2 C) 1s22s22p63s23p3
D) 1s22s22p63s23p4 E) 1s22s22p63s23p5
17. Вещества Х1 иХ2 в схеме превращений P à X1 à Н3ЭО4 à X2
+O2 +3h3O +3NaOH
А) Х1- P2O3, Х2- Na3PO4 В) Х1-P2O5, Х2- Nah3PO4 С) Х1-P2O5, Х2- Na3PO4
D) Х1- Ph4, Х2- Na2HPO4 Е) Х1- PCl5, Х2- Na3PO4
18.Условие сдвига равновесия химической реакции 2SO2+ O2—2SO3+Q:
A)Повышение концентрации реагирующих веществ B) Повышение давленияC) Понижение температурыD) Повышение температурыE) Введение катализатора
19. Относительная молекулярная масса сероводорода
А) 32 В) 31 С) 34 D) 64 Е) 68
20. Массовая доля кислорода в оксиде серы (VI)
А) 50% В) 25% С) 40% D) 80% Е) 60%
Блок Б
21. Относительная плотность аммиака по водороду
А) 8,5 B) 11,5 С) 9,5 D) 12,5 E) 15,5
22. Для получения 11,2 л аммиака (Nh4) необходим азот количеством вещества
A) 1 моль B) 2 моль C) 0,5 моль D) 0,25 моль E) 5 моль.
23. При взаимодействии 11,2л водорода и 12,8г серы образуется сероводород массой
А) 10,7г В) 19,4г С) 13,6г D) 17г Е) 8,5г
24. Объем хлороводорода (н.у.), который можно получить из 6,5г поваренной соли, содержащей 10% примесей равен (в л) А) 1,12 В) 0,56 С) 2,49 D) 5,6 Е) 2,24
25. При взаимодействии 32г меди с разбавленным раствором, содержащим 31,5г азотной кислоты, выделился газ объёмом (н.у.)
А) 22,4л В) 5,6л С) 2,8л D) 11,2л Е) 33,6л
2вариант
Блок А
1.Число полностью заполненных орбиталей в основном состоянии атома кремния
А) 5 В) 4 С) 8 D) 7 Е) 6
2.Металлическая связь образуется в
А) Сероводороде В) Железе С) Сульфате железа D) Хлориде калия Е) Кислороде
3.В авторской формулировке ПЗХЭ имеется выражение «простое тело», которое на современном химическом языке означает:
А) физическое тело В) простое вещество С) неодушевленное тело D) химический элемент Е) неорганическое вещество
4.Химические свойства элемента определяются прежде всего
А) зарядом ядра атома В) положением элемента в ПСХЭ С) атомной массой D) строением внешнего электронного уровня Е)количеством электронов
5.Химический элемент водород помещают в первой и седьмой группах ПСЭ в связи с:
А)особенностью строения атома водорода В) особенностью строения иона водорода С) тем, что водород при высокой температуре обладает свойствами галогена D) тем, что водород- самый легкий газ Е) тем, что он в твердом состоянии имеет металлическую кристаллическую решетку
6. Химический элемент 107 по химическим свойствам должен обладать сходством с химическим элементом:
А) 106 В) 75 С) 85 D) 117 Е) 96
7. Ковалентная связь осуществляется за счет:
А) электронных облаков В) валентных электронов С) двух общих электронов или электронной пары D) электростатистических сил притяжения Е) взаимодействия ионов
8.В молекуле хлорида бериллия(II) осуществляется:
А) s- гибридизация В) sp- гибридизация С) sp2- гибридизация D) sp3- гибридизация Е)p2- гибридизация
9.Связь образованная по донорно-акцепторному механизму в
А)h3O В) h4O+ С) O2D) h3O2 Е) h3
10. Наименьшим значением электроотрицательности обладает:
А)Na В) Ca С) Rb D) F Е) Li
11. Примером реакции без изменения степени окисления элементов является:
А)действие хлорида натрия на нитрат серебра В) Взаимодействие меди с хлором С) растворение цинка в кислоте D) разложение азотной кислоты Е) взаимодействие калия с серной кислотой
12. Примером ОВР является:
А)разложение известняка В) разложение азотной кислоты С) нейтрализация азотной кислоты D) взаимодействие известняка с азотной кислотой Е) взаимодействие гидроксида натрия с азотной кислотой.
13. Степень окисления марганца в перманганате калия равна:
А)+7 В) -7 С) +6 D) -5 Е) +10
14. В уравнение Fe+3 +1ё -> Fe+2
А)восстановления В) растворения С) разложения D) окисления Е) нейтрализации
15. Скорость химической реакции определяется уравнением:
А




 )V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
)V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
16.Катализатор- вещество которое:
А)увеличивает скорость реакции В) изменяет скорость реакции, формально учавствуя в ней С) вначале увеличивает скорость, а затем уменьшает D) замедляет скорость химической реакции Е) не влияет на реакцию в газовой фазе
17. Электролит
А) h3SO4 B) Ch5 C) O2 D) C2H5OH E) CO2
18. В одну ступень диссоциирует:
А) HCl В) h4PO4 С) h3SO4 D) NaHSO4 Е) h3CO3
19. Сумма всех коэффициентов в ионном полном уравнении реакции AlCl3+ NaOH =
А) 3 B) 11 C) 17 D) 12 E) 14
20. Сокращённое ионное уравнение: Fe2+ + 2OH- = Fe (OH)2соответствует взаимодействию
А) FeCO3 + 2NaOH В) Fe(NO3)2 + 2NaOH С) FeSiO3 + LiOH
D) FeCl2 + Cu(OH)2 Е) FeS+ 2KOH
Блок Б
21. Вычислите среднюю скорость химических реакции А+2В=2С, если начальная концентрация вещества А= 0,25 моль\л, а через 10с-0,10 моль\л:
А) 0,30 B) 1, 5*10-3 С) 0,23 D) 1,5*10-2E) 0,15
22. При разложении некоторого количества калийной селитры масса твердого осадка составила 17г. Объем выделившегося при этом газа (н.у) был равен:
A) 2,24л B) 3,36л C) 5,6л D) 6,72л E) 11,2л
23. При взаимодействии 3,42 л щелочного металла с водой выделяется 448 см3 водорода (н.у). Этот щелочной металл:
А) литий В) натрий С) калий D) рубидий Е) цезий
24. Объем хлороводорода (н.у.), который можно получить из 9г поваренной соли, содержащей 10% примесей равен (в л) А) 3,1 В) 5,56 С) 2,49 D) 5,6 Е) 2,24
25. При электролизе 200г 11,7%-ного раствора хлорида натрия масса продукта, находящегося в растворе
А) 16г В) 8,8г С) 40г D) 24,6г Е)46г
3 вариант
Блок А
1.Число полностью заполненных орбиталей в основном состоянии атома кремния
А) 5 В) 4 С) 8 D) 7 Е) 6
2.Металлическая связь образуется в
А) Сероводороде В) Железе С) Сульфате железа D) Хлориде калия Е) Кислороде
3.В авторской формулировке ПЗХЭ имеется выражение «простое тело», которое на современном химическом языке означает:
А) физическое тело В) простое вещество С) неодушевленное тело D) химический элемент Е) неорганическое вещество
4.Химические свойства элемента определяются прежде всего
А) зарядом ядра атома В) положением элемента в ПСХЭ С) атомной массой D) строением внешнего электронного уровня Е)количеством электронов
5.Химический элемент водород помещают в первой и седьмой группах ПСЭ в связи с:
А)особенностью строения атома водорода В) особенностью строения иона водорода С) тем, что водород при высокой температуре обладает свойствами галогена D) тем, что водород- самый легкий газ Е) тем, что он в твердом состоянии имеет металлическую кристаллическую решетку
6. Химический элемент 107 по химическим свойствам должен обладать сходством с химическим элементом:
А) 106 В) 75 С) 85 D) 117 Е) 96
7. Наименьшим значением электроотрицательности обладает:
А) Na В) Ca С)Rb D) F Е) Li
8. Валентность и степень окисления азота в азотной кислоте:
А)IV и +5 В) IV и +3 С)V и +5 D) V и +3 Е) V и -3
9.Гибридизация валентных орбиталей при образовании ковалентных связей характеризуется:
А)образованием электронных орбиталей одинаковой формы и энергии
В) выравниванием всех электронных облаков С) образованием тетраэдрической формы молекулы вещества D) приобретением электронных облаков одинаковой конфигурации Е) образованием линейной формы молекулы
10.Взаимодействие между протоном одной молекулы и электроотрицательным элементом другой молекулы приводит к образованию:
А) межмолекулярной водородной связи В) донорно-акцепторной связи
С) ассоциированных агрегатов в органических веществах D) веществ с молекулярной кристаллической решеткой Е) внутримолекулярной водородной связи
11. При окислении происходит:
А) взаимодействие с кислородом В) перемещение электронной пары С) присоединение электронов D) отдача электронов атомов, молекулой или ионом Е) отщепление электронов
12.В уравнении окислительной реакции h3S+KMnO4+h3SO4=h3O+S+MnSO4+K2SO4
А) 3,2,5 В) 5,2,3 С) 2,2, 5 D)5,2,4 Е) 4,3,5
13. . Степень окисления фосфора в ортофосфорной кислоте равна:
А)+7 В) -5 С) +6 D)+5 Е) +3
14. В уравнение Fe+3 +3ё -> Fe0
А)восстановления В) растворения С) разложения D) окисления Е) нейтрализации
15.Единицей измерения скорости химической реакции может быть:
А) моль\л*с В) моль\ч С) г\моль*л D) м\моль*ч Е) моль\литр
15.Гомогенная реакция с участием газов А+В=С, при увеличении концентрации в 2 раза и увеличении давления в 3 раза скорость увеличится в:
А) 4 и 9 В) 4 и 27 С) 3 и18 D) 8 и 9 Е) 7 и 43
16. Объем выделившегося ацетилена, если кусочек карбида кальция массой 10 г разбить на 10 частей:
А) возрастет примерно в 10 раз В) возрастет примерно в 100 раз С) увеличится примерно в 1000 раз D) не изменится Е) возрастет в 5 раз
17. При диссоциации соли Fe2(SO4)3 образуются частицы
А) Fe3+ + SO42- B) 2 Fe +3 SO4 C) 2 Fe 3- +3SO42+
D) 2 Fe 3+ +3SO42- E) 2 Fe 2+ +3SO43-
18.Сильный электролит
А) KCl В) Zn(OH)2 С) HNO3 D) h3CO3 Е) Ва(OH)2
19. Сумма всех коэффициентов в полном ионном уравнении реакции Ca(NO3)2 + K2CO3 =
А) 3 B) 11 С) 9 D) 12 E) 15
20. В растворе cерной кислоты фиолетовый лакмус становится
А) Синим B) Желтым С) Красным
D) Бесцветным E) Оранжевым
Блок Б
21. Для сжигания кремния количеством вещества 0,5 моль потребуется кислород объемом (н.у.)
А) 0,5л B) 1,12л С) 11,2л D) 5л E) 112л
22. Средняя скорость реакции А+В=2С, если начальная концентрация А равна 0,15 моль\л, а через 10 секунд 0,05 моль\л
А) 0,035моль\л*с B) 0,0005моль\л*с С) 0,01моль\л*с D) 0,02моль\л*с E)0,022моль\л*с
23. При горении 15г этана(С2Н6) выделилось 770кДж теплоты, то тепловой эффект реакции
А) 3080кДж В) 4080кДж С) 5080кДж D) 2080кДж Е) 1080кДж
24. Объем хлороводорода (н.у.), который можно получить из 10г поваренной соли, содержащей 10% примесей равен (в л) А) 3,4 В) 3,56 С) 2,49 D) 2,6 Е) 2,24
25. При электролизе 200г 15%-ного раствора хлорида натрия масса продукта, находящегося в растворе
А) 16г В) 8,8г С) 30г D) 24,6г Е)26г
4 вариант
Блок А
1.Квантовое число характеризующее размер электронного облака
А) главное В) магнитное С) орбитальное D) спиновое Е) орбитально-спиновое
2.Металлическая связь образуется в
А) Сероводороде В) Магнии С) Сульфате железа D) Хлориде калия Е) Кислороде
3.Число нейтронов в атоме химического жлемента можно вычислить по формуле
А) А =Z+N В) N= А-Z С) Z=A-N D) N=Z+A Е) N=A+Z
4.Электронная формула 1s22s22p63s2 отражает строение атома
А) скандия В) натрия С) цинка D) магния Е) итрия
5.Максимальное число электронов на энергетическом уровне можно подсчитать по формуле:
А)N=2n2 В) N=2n\2 С) N=4n D) N=2\n2 Е) N=4n2
6. Химический элемент,атомное ядро которое содержит 33 протона и 42 нейтрона:
А) молибден В) мышьяк С)рений D) иттрий Е) ртуть
7. Cоединения с ионной связью:
А) NaСL,BaCl В) O2, h3O С)I2, h3D) C2H5OH, Ch4COOH Е) Fe, CuO
8. В молекуле хлорида бериллия(III) осуществляется:
А)s-гибридизация В) sp-гибридизация С) sp2-гибридизация D) p2-гибридизация Е) sp3-гибридизация
9.Разница в электроотрицательности элементов меньше всего в соединениях:
А)с ковалентной неполярной связью В) с ковалентной полярной связью С)с металлической связью D) с ионной связью Е) с водородной связью
10.Степень окисления азота в ионе аммония:
А)+5 В) -3 С) -4 D) +3 Е) +4
11. Не вступает в реакцию с серой:
А) аргон В) кислород С) натрий D) водород Е) железо
12.Реакция, которая идет без изменения степеней окисления элементов
А) Cl2+h3O= В) P+O2= С) Ca(OH)2+HCl= D)Fe+h3SO4= Е) SO2+O2=
13. . Степень окисления серы в серной кислоте равна:
А)+7 В) -5 С) +6 D)+5 Е) +3
14. В уравнение Ga+3 +3ё -> Ga0
А)восстановления В) растворения С) разложения D) окисления Е) нейтрализации
15.Формула определения скорости гомогенной реакции:
А




 )V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
)V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
15.Сумма коэффициентов в уравнении реакции обжига пирита:
А) 22 В) 21 С) 24 D) 26 Е) 25
16.Гидролизуется по катиону:
А)хлорид калия В) хлорид меди(II) С) карбонат натрия D) силикат натрия Е) сульфит лития
17.При диссоциации сульфатов образуется ион:
А)Н- В) SO42- С) ОН- D) Сl- Е) Br -
18. В две ступени диссоциирует
А) HCl В) h4PO4 С) HNO3D) NaHSO4 Е) Na2CO3
19. При диссоциации соли FeCl3 образуются частицы
А) Fe2+ +3Cl- B) Fe +Cl C) 2Fe3+ +3Cl3- D) Fe3+ +3Cl- E) Fe3+ +3Cl+
20. Слабый электролит
А) HNO3 B) h3CO3 C) h3SO4 D) HCl E) BaCl2
Блок Б
21. Масса меди(г), которая образуется при взаимодействии 0,1 моль железа с 75г 20%-ного сульфата меди(II)
А) 6,8 B) 8,9 С) 6 D) 25,6 E) 24
22. Углеводород, имеющий в составе 83,7% углерода, 16,3% водорода,относительную плотность по воздуху равную 2, 96
A) С6Н14B) С7Н14C) С5Н12D) С7Н16E) С6Н12
23. Для получения 560г негашеной извести по уравнению СаСО3---СаО+СО2
А) 1800кДЖ В) 360кДЖ С) 36кДЖ D) 180кДЖ Е) 540кДЖ
24. Галагеноводород имеет массовую долю водорода 1,234%. Химическая формула галагеноводорода: А) HBr В) HF С) HI D) Hat Е) HCl
25. При электролизе 200г 5%-ного раствора хлорида натрия масса продукта, находящегося в растворе
А) 16г В) 8,8г С) 10г D) 24,6г Е)26г
Ответы
1вариант
Блок А
1.Число электронных уровней у атома элемента с номером 56:
А) 5B) 6C) 3D) 4 E) 2
2.Щелочные металлы находятся в главной подгруппе группы номер:
А) 3B) 2C) 7D) 1 E) 5
3.Степень окисления и валентность кислорода не совпадают по абсолютной величине
А) CaO B) h3O2 C) SO3 D)N2O5 E) CO2
4. Степень диссоциации определяется по формуле:
А)α = N\n В) α = n\N С)α =n*ND)α=N-nЕ) α=n-N
5. Сумма всех коэффициентов в полном ионном уравнении реакции Ca(NO3)2 + K2CO3 =
А) 3 B) 11 С) 9 D) 12 E) 15
6. Сокращённое ионное уравнение: 2H+ + CO3 2- = h3O + CO2 соответствует взаимодействию
А) карбоната кальция и соляной кислоты
В) карбоната натрия и кремниевой кислоты
С) силиката натрия и соляной кислоты
D) карбоната натрия и соляной кислоты
Е) карбоната натрия и воды
7. В растворе соляной кислоты фиолетовый лакмус становится
А) Синим B) Желтым С) Красным D) Бесцветным E) Оранжевым
8. Элемент имеющий конфигурацию …..6s2
А) Mo В) At С) Ba D) Ag Е) Po
A) h3S B) SO2 C) h3SO3 D) S E) SO3
10. При диссоциации соли Al2(SO4)3 образуются частицы
А) Al3+ + SO42- B) 2 Al +3 SO4 C) 2Al3- +3SO42+
D) 2Al3+ +3SO42-E) 2Al2+ +3SO43-
11. При увеличении концентрации исходных веществ в 3 раза скорость реакции
h3+ Cl2 = 2HCl возрастет в:
A) 16раз B) 4 раза C) 64 раза D) 9 раз E) 12 раз
12.Объем метана, на сжигание которого израсходовано 88л кислорода
A) 34л B) 24л C) 44л D) 26л E) 22л
13. Формула гидроксида, характерного для азота:
A) HRO2 B) h3RO3 C) HRO3 D) h3RO4 Е) Н2RO4
A) 6 B) 4 C) 9 D) 7 E) 13
15.Термохимическое уравнение реакции горения магния 2Mg+O2=MgO +1127кДж при сгорании 3г магния выделится теплоты
A) 11,27 кДж B) 28,175 кДж C) 56,35кДж D) 112,70 кДж E) 70,44 кДж
16. Атому элемента фосфора отвечает электронная формула
A) 1s22s22p63s23p1 B) 1s22s22p63s23p2 C) 1s22s22p63s23p3
D) 1s22s22p63s23p4 E) 1s22s22p63s23p5
17. Вещества Х1 иХ2 в схеме превращений P à X1 à Н3ЭО4 à X2
+O2 +3h3O +3NaOH
А) Х1- P2O3, Х2- Na3PO4 В) Х1-P2O5, Х2- Nah3PO4 С) Х1-P2O5, Х2- Na3PO4
D) Х1- Ph4, Х2- Na2HPO4 Е) Х1- PCl5, Х2- Na3PO4
18.Условие сдвига равновесия химической реакции 2SO2+ O2—2SO3+Q:
A)Повышение концентрации реагирующих веществ B) Повышение давленияC) Понижение температурыD) Повышение температурыE) Введение катализатора
19. Относительная молекулярная масса сероводорода
А) 32 В) 31 С) 34 D) 64 Е) 68
20. Массовая доля кислорода в оксиде серы (VI)
А) 50% В) 25% С) 40% D) 80% Е) 60%
Блок Б
21. Относительная плотность аммиака по водороду D= Nh4 \ h3 =17\2=8,5
А) 8,5 B) 11,5 С) 9,5 D) 12,5 E) 15,5
22. Для получения 11,2 л аммиака (Nh4) необходим азот количеством вещества 3N2+3h3= 2Nh4 v=V\ VM =11,2\2*11,2=0,5
A) 1 моль B) 2 моль C) 0,5 моль D) 0,25 моль E) 5 моль.
23. При взаимодействии 11,2л водорода и 12,8г серы образуется сероводород массой
h3+ S=h3S v(H)=V\ VM=11,2\11,2=1 v(S)=m\ M=12,8г\32=0,4 расчет ведется по наименьшему. m(h3S)=v*M(h3S)= 0,4*34=13,6г
А) 10,7г В) 19,4г С) 13,6г D) 17г Е) 8,5г
24. Объем хлороводорода (н.у.), который можно получить из 6,5г поваренной соли, содержащей 10% примесей равен (в л) А) 1,12 В) 0,56 С) 2,49 D) 5,6 Е) 2,24
25. При взаимодействии 32г меди с разбавленным раствором, содержащим 31,5г азотной кислоты, выделился газ объёмом (н.у.)
А) 22,4л В) 5,6л С) 2,8л D) 11,2л Е) 33,6л
2вариант
Блок А
1.Число полностью заполненных орбиталей в основном состоянии атома кремния
А) 5 В) 4 С) 8 D) 7 Е) 6
2.Металлическая связь образуется в
А) Сероводороде В) Железе С) Сульфате железа D) Хлориде калия Е) Кислороде
3.В авторской формулировке ПЗХЭ имеется выражение «простое тело», которое на современном химическом языке означает:
А) физическое тело В) простое вещество С) неодушевленное тело D) химический элемент Е) неорганическое вещество
4.Химические свойства элемента определяются прежде всего
А) зарядом ядра атома В) положением элемента в ПСХЭ С) атомной массой D) строением внешнего электронного уровня Е)количеством электронов
5.Химический элемент водород помещают в первой и седьмой группах ПСЭ в связи с:
А)особенностью строения атома водорода В) особенностью строения иона водорода С) тем, что водород при высокой температуре обладает свойствами галогена D) тем, что водород- самый легкий газ Е) тем, что он в твердом состоянии имеет металлическую кристаллическую решетку
6. Химический элемент 107 по химическим свойствам должен обладать сходством с химическим элементом:
А) 106 В) 75 С) 85 D) 117 Е) 96
7. Ковалентная связь осуществляется за счет:
А) электронных облаков В) валентных электронов С) двух общих электронов или электронной пары D) электростатистических сил притяжения Е) взаимодействия ионов
8.В молекуле хлорида бериллия(II) осуществляется:
А) s- гибридизация В) sp- гибридизация С) sp2- гибридизация D) sp3- гибридизация Е)p2- гибридизация
9.Связь образованная по донорно-акцепторному механизму в
А)h3O В) h4O+ С) O2D) h3O2 Е) h3
10. Наименьшим значением электроотрицательности обладает:
А)Na В) Ca С) Rb D) F Е) Li
11. Примером реакции без изменения степени окисления элементов является:
А)действие хлорида натрия на нитрат серебра В) Взаимодействие меди с хлором С) растворение цинка в кислоте D) разложение азотной кислоты Е) взаимодействие калия с серной кислотой
12. Примером ОВР является:
А)разложение известняка В) разложение азотной кислоты С) нейтрализация азотной кислоты D) взаимодействие известняка с азотной кислотой Е) взаимодействие гидроксида натрия с азотной кислотой.
13. Степень окисления марганца в перманганате калия равна:
А)+7 В) -7 С) +6 D) -5 Е) +10
14. В уравнение Fe+3 +1ё -> Fe+2
А)восстановления В) растворения С) разложения D) окисления Е) нейтрализации
15. Скорость химической реакции определяется уравнением:
А




 )V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
)V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
16.Катализатор- вещество которое:
А)увеличивает скорость реакции В) изменяет скорость реакции, формально учавствуя в ней С) вначале увеличивает скорость, а затем уменьшает D) замедляет скорость химической реакции Е) не влияет на реакцию в газовой фазе
17. Электролит
А) h3SO4B) Ch5 C) O2 D) C2H5OH E) CO2
18. В одну ступень диссоциирует
А) HCl В) h4PO4 С) h3SO4 D) NaHSO4 Е) h3CO3
19. Сумма всех коэффициентов в ионном полном уравнении реакции AlCl3+ NaOH =
А) 3 B) 11 C) 17 D) 12 E) 14
20. Сокращённое ионное уравнение: Fe2+ + 2OH- = Fe (OH)2соответствует взаимодействию
А) FeCO3 + 2NaOH В) Fe(NO3)2 + 2NaOH С) FeSiO3 + LiOH
D) FeCl2 + Cu(OH)2 Е) FeS+ 2KOH
Блок Б
21. Вычислите среднюю скорость химических реакции А+2В=2С, если начальная концентрация вещества А= 0,25 моль\л, а через 20с-0,10 моль\л:
А) 0,30 B) 0,35*10-2 С) 0,23 D) 7,5*10-3E) 0,15
22. При разложении некоторого количества калийной селитры масса твердого осадка составила 17г. Объем выделившегося при этом газа (н.у) был равен:
A) 2,24л B) 3,36л C) 5,6л D) 6,72л E) 11,2л
23. При взаимодействии 3,42 л щелочного металла с водой выделяется 448 см3 водорода (н.у). Этот щелочной металл:
А) литий В) натрий С) калий D) рубидий Е) цезий
24. Объем хлороводорода (н.у.), который можно получить из 9г поваренной соли, содержащей 10% примесей равен (в л) А) 3,1 В) 5,56 С) 2,49 D) 5,6 Е) 2,24
25. При электролизе 200г 11,7%-ного раствора хлорида натрия масса продукта, находящегося в растворе
А) 16г В) 8,8г С) 40г D) 24,6г Е)46г
3 вариант
Блок А
1.Число полностью заполненных орбиталей в основном состоянии атома кремния
А) 5 В) 4 С) 8 D) 7 Е) 6
2.Металлическая связь образуется в
А) Сероводороде В) Железе С) Сульфате железа D) Хлориде калия Е) Кислороде
3.В авторской формулировке ПЗХЭ имеется выражение «простое тело», которое на современном химическом языке означает:
А) физическое тело В) простое вещество С) неодушевленное тело D) химический элемент Е) неорганическое вещество
4.Химические свойства элемента определяются прежде всего
А) зарядом ядра атома В) положением элемента в ПСХЭ С) атомной массой D) строением внешнего электронного уровня Е)количеством электронов
5.Химический элемент водород помещают в первой и седьмой группах ПСЭ в связи с:
А)особенностью строения атома водорода В) особенностью строения иона водорода С) тем, что водород при высокой температуре обладает свойствами галогена D) тем, что водород- самый легкий газ Е) тем, что он в твердом состоянии имеет металлическую кристаллическую решетку
6. Химический элемент 107 по химическим свойствам должен обладать сходством с химическим элементом:
А) 106 В) 75 С) 85 D) 117 Е) 96
7. Наименьшим значением электроотрицательности обладает:
А) Na В) Ca С)Rb D) F Е) Li
8. Валентность и степень окисления азота в азотной кислоте:
А)IV и +5 В) IV и +3 С)V и +5 D) V и +3 Е) V и -3
9.Гибридизация валентных орбиталей при образовании ковалентных связей характеризуется:
А)образованием электронных орбиталей одинаковой формы и энергии
В) выравниванием всех электронных облаков С) образованием тетраэдрической формы молекулы вещества D) приобретением электронных облаков одинаковой конфигурации Е) образованием линейной формы молекулы
10.Взаимодействие между протоном одной молекулы и электроотрицательным элементом другой молекулы приводит к образованию:
А) межмолекулярной водородной связи В) донорно-акцепторной связи
С) ассоциированных агрегатов в органических веществах D) веществ с молекулярной кристаллической решеткой Е) внутримолекулярной водородной связи
11. При окислении происходит:
А) взаимодействие с кислородом В) перемещение электронной пары С) присоединение электронов D) отдача электронов атомов, молекулой или ионом Е) отщепление электронов
12.В уравнении окислительной реакции h3S+KMnO4+h3SO4=h3O+S+MnSO4+K2SO4
А) 3,2,5 В) 5,2,3 С) 2,2, 5 D)5,2,4 Е) 4,3,5
13. . Степень окисления фосфора в ортофосфорной кислоте равна:
А)+7 В) -5 С) +6 D)+5 Е) +3
14. В уравнение Fe+3 +3ё -> Fe0
А)восстановления В) растворения С) разложения D) окисления Е) нейтрализации
15.Единицей измерения скорости химической реакции может быть:
А) моль\л*с В) моль\ч С) г\моль*л D) м\моль*ч Е) моль\литр
15.Гомогенная реакция с участием газов А+В=С, при увеличении концентрации в 2 раза и увеличении давления в 3 раза скорость увеличится в:
А) 4 и 9 В) 4 и 27 С) 3 и18 D) 8 и 9 Е) 7 и 43
16. Объем выделившегося ацетилена, если кусочек карбида кальция массой 10 г разбить на 10 частей:
А) возрастет примерно в 10 раз В) возрастет примерно в 100 раз С) увеличится примерно в 1000 раз D) не изменится Е) возрастет в 5 раз
17. При диссоциации соли Fe2(SO4)3 образуются частицы
А) Fe3+ + SO42- B) 2 Fe +3 SO4 C) 2 Fe 3- +3SO42+
D) 2 Fe 3+ +3SO42-E) 2 Fe 2+ +3SO43-
18.Сильный электролит
А) KCl В) Zn(OH)2С) HNO3D) h3CO3 Е) Ва(OH)2
19. Сумма всех коэффициентов в полном ионном уравнении реакции Ca(NO3)2 + K2CO3 =
А) 3 B) 11 С) 9 D) 12 E) 15
20. В растворе cерной кислоты фиолетовый лакмус становится
А) Синим B) Желтым С) Красным
D) Бесцветным E) Оранжевым
Блок Б
21. Для сжигания кремния количеством вещества 0,5 моль потребуется кислород объемом (н.у.)
А) 0,5л B) 1,12л С) 11,2л D) 5л E) 112л
22. Средняя скорость реакции А+В=2С, если начальная концентрация А равна 0,15 моль\л, а через 10 секунд 0,05 моль\л
А) 0,035моль\л*с B) 0,0005моль\л*с С) 0,01моль\л*с D) 0,02моль\л*с E)0,022моль\л*с
23. При горении 15г этана(С2Н6) выделилось 770кДж теплоты, то тепловой эффект реакции
А) 3080кДж В) 4080кДж С) 5080кДж D) 2080кДж Е) 1080кДж
24. Объем хлороводорода (н.у.), который можно получить из 10г поваренной соли, содержащей 10% примесей равен (в л) А) 3,4 В) 3,56 С) 2,49 D) 2,6 Е) 2,24
25. При электролизе 200г 15%-ного раствора хлорида натрия масса продукта, находящегося в растворе
А) 16г В) 8,8г С) 30г D) 24,6г Е)26г
4 вариант
Блок А
1.Квантовое число характеризующее размер электронного облака
А) главное В) магнитное С) орбитальное D) спиновое Е) орбитально-спиновое
2.Металлическая связь образуется в
А) Сероводороде В) Магнии С) Сульфате железа D) Хлориде калия Е) Кислороде
3.Число нейтронов в атоме химического жлемента можно вычислить по формуле
А) А =Z+N В) N= А-Z С) Z=A-N D) N=Z+A Е) N=A+Z
4.Электронная формула 1s22s22p63s2 отражает строение атома
А) скандия В) натрия С) цинка D) магния Е) итрия
5.Максимальное число электронов на энергетическом уровне можно подсчитать по формуле:
А)N=2n2 В) N=2n\2 С) N=4n D) N=2\n2 Е) N=4n2
6. Химический элемент,атомное ядро которое содержит 33 протона и 42 нейтрона:
А) молибден В) мышьяк С)рений D) иттрий Е) ртуть
7. Cоединения с ионной связью:
А) NaСL,BaCl В) O2, h3O С)I2, h3D) C2H5OH, Ch4COOH Е) Fe, CuO
8. В молекуле хлорида бериллия(III) осуществляется:
А)s-гибридизация В) sp-гибридизация С) sp2-гибридизация D) p2-гибридизация Е) sp3-гибридизация
9.Разница в электроотрицательности элементов меньше всего в соединениях:
А)с ковалентной неполярной связью
В) с ковалентной полярной связью С)с металлической связью D) с ионной связью Е) с водородной связью
10.Степень окисления азота в ионе аммония:
А)+5 В) -3 С) -4 D) +3 Е) +4
11. Не вступает в реакцию с серой:
А) аргон В) кислород С) натрий D) водород Е) железо
12.Реакция, которая идет без изменения степеней окисления элементов
А) Cl2+h3O= В) P+O2= С) Ca(OH)2+HCl= D)Fe+h3SO4= Е) SO2+O2=
13. . Степень окисления серы в серной кислоте равна:
А)+7 В) -5 С) +6 D)+5 Е) +3
14. В уравнение Ga+3 +3ё -> Ga0
А)восстановления В) растворения С) разложения D) окисления Е) нейтрализации
15.Формула определения скорости гомогенной реакции:
А




 )V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
)V= t\ c В) V= c - t С) V=(c2 - c1 ) D) V=(t2 - t1 ) Е) V= c \ t
15.Сумма коэффициентов в уравнении реакции обжига пирита:
А) 22 В) 21 С) 24 D) 26 Е) 25
16.Гидролизуется по катиону:
А)хлорид калия В) хлорид меди(II) С) карбонат натрия D) силикат натрия Е) сульфит лития
17.При диссоциации сульфатов образуется ион:
А)Н- В) SO42- С) ОН- D) Сl- Е) Br -
18. В две ступени диссоциирует
А) HCl В) h4PO4 С) HNO3D) NaHSO4 Е) Na2CO3
19. При диссоциации соли FeCl3 образуются частицы
А) Fe2+ +3Cl- B) Fe +Cl C) 2Fe3+ +3Cl3- D) Fe3+ +3Cl- E) Fe3+ +3Cl+
20. Слабый электролит
А) HNO3 B) h3CO3C) h3SO4 D) HCl E) BaCl2
Блок Б
21. Масса меди(г), которая образуется при взаимодействии 0,1 моль железа с 75г 20%-ного сульфата меди(II)
А) 6,8 B) 8,9 С) 6 D) 25,6 E) 24
22. Углеводород, имеющий в составе 83,7% углерода, 16,3% водорода,относительную плотность по воздуху равную 2, 96
A) С6Н14B) С7Н14C) С5Н12D) С7Н16E) С6Н12
23. Для получения 560г негашеной извести по уравнению СаСО3---СаО+СО2
А) 1800кДЖ В) 360кДЖ С) 36кДЖ D) 180кДЖ Е) 540кДЖ
24. Галагеноводород имеет массовую долю водорода 1,234%. Химическая формула галагеноводорода: А) HBr В) HF С) HI D) Hat Е) HCl
25. При электролизе 200г 5%-ного раствора хлорида натрия масса продукта, находящегося в растворе
А) 16г В) 8,8г С) 10г D) 24,6г Е)26г
Литература:
1. Н.Б. Алистратова. Справочник школьника. Издательство «Арман-ПВ»,2007
2.Н.Н. Нурахметов. Химия 10 класс. Алматы «Мектеп» 2014
3.Сборник тестов по химии\Учебно-методическое пособие. Астана: РГКП «Национальный центр государственных стандартов образования и тестирования», 2007.
4. Сборник тестов по химии\Учебно-методическое пособие. Астана: РГКП «Национальный центр государственных стандартов образования и тестирования», 2008.
infourok.ru






 7 баллов). Для вещества, формула которого СН3-СН2-СН-СН3,
7 баллов). Для вещества, формула которого СН3-СН2-СН-СН3, С2Н5ОН t, h3SO4X +HClY +NaZ:
С2Н5ОН t, h3SO4X +HClY +NaZ:
 10 баллов). Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: С4Н10t, AlCl3 Х +Cl2 Y +KOH(спирт)Z.
10 баллов). Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: С4Н10t, AlCl3 Х +Cl2 Y +KOH(спирт)Z.  Н3-СН-С ,
Н3-СН-С ,