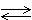 2Nh4 + Q
2Nh4 + QКонтрольная работа №1 по разделу «Теоретические основы химии»
ВАРИАНТ 1
ЧАСТЬ А
При выполнении заданий этой части (А1- А13) выберите только один из четырёх предложенных вариантов ответа.
А 1. Укажите номер периода и группы, в которых расположен кремний
1) II, IV 2)III, IV 3) V, II 4) II, III
А 2.Общее количество электронов в атоме хлора
1) 8 2) 7 3) 35 4) 17
А 3.Заряд ядра атома магния и его относительная атомная масса:
1) +39; 12 2) + 12; 24 3) 24; + 19 4) 2; + 24 + 12; 24
А4. Неметаллические свойства у элементов А групп усиливаются
1)
слева направо и в группах сверху вниз 2) справа налево и в группах сверху вниз
3)
справа налево и в группах снизу вверх 4) слева направо и в группах снизу вверх
А5. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1)
Na, Mg, Al, Si 2) Li, Be, B, C 3) P, S, Cl, Ar 4) F, O, N, C
А6. Число нейтронов в ядре атома 39K равно
1)
19
2)
20
3)
39
4)
58
А7. В каком ряду находятся только неметаллы:
1) S, O, N, Mg 2) N, O, F, Н 3) Fe, Cu, Na, H 4) Na, K, Cu, Ca
А8. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1)
Cl2, Nh4, HCl 2) HBr, NO, Br2 3) h3S, h3O, S8 4) HI, h3O, Ph4
А9. Кристаллическую структуру, подобную структуре алмаза, имеет
1)
кремнезем SiО2 2) оксид натрия Na2O 3) оксид углерода (II) CO 4) белый фосфор Р4
А10. Какие из утверждений о диссоциации оснований в водных растворах верны?
А. Основания в воде диссоциируют на катионы металла (или подобный им катион Nh5+) и гидроксид анионы OH –.
Б. Никаких других анионов, кроме OH–, основания не образуют.
1)
верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
А11. Какая из приведенных реакций не относится к реакциям ионного обмена?
1)
Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
2)
KOH + HCl = KCl + h3O
3)
2KMnO4 = K2MnO4 + MnO2 + O2
4)
Li2SO3 + 2HNO3 = 2LiNO3 + h3O + SO2
А12. Только окислительные свойства проявляет
1)
сульфид натрия 2) сера 3) серная кислота 4) сульфит калия
А13. На смещение химического равновесия в системе N2 + 3h3 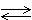 2Nh4 + Q
2Nh4 + Q
не оказывает влияния
1)
понижение температуры 2) повышение давления
3)
удаление аммиака из зоны реакции 4) применение катализатора
Часть В
Ответом к заданиям части В является набор цифр или число
В заданиях В1-В4 на установление соответствия к каждой позиции первого столбца подберите соответствующую позицию второго. (Цифры в ответе могут повторяться).
В1. Установите соответствие между названием химического соединения и видом связи атомов в этом соединении.
НАЗВАНИЕ СОЕДИНЕНИЯ
ВИД СВЯЗИ
А)
цинк
Б)
азот
В)
аммиак
Г)
хлорид кальция
1)
ионная
2)
металлическая
3)
ковалентная полярная
4)
ковалентная неполярная
В2. 50 г сахара растворили в 100 г воды. Массовая доля сахара в полученном растворе равна _____________ %. (Ответ запишите с точностью до целых).
В3. Установите соответствие между уравнением реакции и веществом-окислителем, участвующим в данной реакции.
УРАВНЕНИЕ РЕАКЦИИ
ОКИСЛИТЕЛЬ
А)
2NO + 2h3 = N2 + 2h3O
Б)
2Nh4 + 2Na = 2NaNh3 + h3
В)
h3 + 2Na = 2NaH
Г)
4Nh4 + 6NO = 5N2 + 6h3O
1)
h3
2)
NO
3)
N2
4)
Nh4
В4.
Установите соответствие между солью и реакцией среды в ее водном растворе.
СОЛЬ
РЕАКЦИЯ СРЕДЫ
А)
нитрат бария
Б)
хлорид железа (III)
В)
сульфат аммония
Г)
ацетат калия
1)
кислая
2)
нейтральная
3)
щелочная
Часть С
( ответ запишите с полным объяснением)
Что такое скорость химической реакции, от каких факторов она зависит, приведите примеры из жизни( ПРИРОДНЫХ ЯВЛЕНИЙ, БЫТА ЛЮДЕЙ, ПРОМЫШЛЕННОСТИ).
Оценивание:
Часть А – правильный ответ 1 балл
Часть В– В1,В3,В4 – 2 балла без ошибки. 1балл – 1ошибка
В2 – 1 балл
Часть С – 3 балла
Максимальное количество баллов: 23
23-22балла – «5»
21- 16 – «4»
15 -11-«3»
Менее 10 – «2»
Контрольная работа №1 по разделу «Теоретические основы химии»
ВАРИАНТ 2
ЧАСТЬ А
При выполнении заданий этой части (А1- А13) выберите только один из четырёх предложенных вариантов ответа.
А 1. Укажите номер периода и группы, в которых расположен германий
1) II, IV 2)III, IV 3) IV, IV 4) IV, III
А 2.Общее количество электронов в атоме мышьяка
1) 33 2) 5 3) 75 4) 41
А 3.Заряд ядра атома фосфора и его относительная атомная масса:
1) +31; 15 2) + 15; 31 3) 30; + 15 4) 3; + 31 + 15; 31
А4 В ряду Mg → Ca → Sr → Ba способность металлов отдавать электроны
1)
ослабевает 2) возрастает 3) не изменяется 4) изменяется периодически
А5. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1)
Na, K, Rb, Cs 2) Li, Be, B, C 3) O, S, Cl, Ar 4) F, O, N, C
А6 Число нейтронов в ядре атома 16S равно
16 2) 32 3) 12 4) 24
А7. В каком ряду находятся только металлы:
1) S, O, N, Mg 2) N, O, F, Н 3) Fe, Cu, Na, Ni 4) Na, K, Cu, C
А8 Ковалентная неполярная связь реализуется в соединении
1)
CrO3 2) P2O5 3) SO2 4) F2
А9 Молекулярную кристаллическую решетку имеет каждое из двух веществ:
1)
графит и алмаз 2) кремний и иод
3)
хлор и оксид углерода (IV) 4) хлорид бария и оксид бария
А10 Какие из утверждений о диссоциации кислот в водных растворах верны?
А. Кислоты в воде диссоциируют на катионы водорода Н + и гидроксид анионы OH –.
Б. Никаких других катионов, кроме Н+ , кислоты не образуют.
1)
верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
А11 Реакция, уравнение которой CaCO3 + CO2 + h3O = Ca(HCO3)2, является реакцией
1)
обмена 2) соединения 3) разложения 4) замещения
А12 Как окислитель сера выступает в реакции с
1)
хлором 2) кислородом 3) бромом 4) железом
А13 Равновесие реакции СаСО3 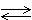 СаО + СО2 – Q смещается вправо при
СаО + СО2 – Q смещается вправо при
1)
уменьшении температуры и увеличении давления
2)
увеличении температуры и уменьшении давления
3)
увеличении температуры и увеличении давления
4)
уменьшении температуры и уменьшении давления
Часть В
Ответом к заданиям части В является набор цифр или число
В заданиях В1-В4 на установление соответствия к каждой позиции первого столбца подберите соответствующую позицию второго. (Цифры в ответе могут повторяться).
В1 В1. Установите соответствие между названием химического соединения и видом связи атомов в этом соединении.
НАЗВАНИЕ СОЕДИНЕНИЯ
ВИД СВЯЗИ
А)
медь
Б)
бром
В)
этанол
Г)
Д)
хлорид кальция
вода
1)
ионная
2)
металлическая
3)
ковалентная полярная
4)
ковалентная неполярная
В2 12 г соли растворили в 100 г воды. Массовая доля соли в полученном растворе равна _____________ %. (Ответ запишите с точностью до целых).
В3 Установите соответствие между уравнением реакции и формулой вещества, которое в данной реакции является окислителем.
УРАВНЕНИЕ РЕАКЦИИ
ОКИСЛИТЕЛЬ
А)
h3S + I2 = S + 2HI
Б)
2S + С = СS2
В)
2SO3 + 2KI = I2 + SO2 + K2SO4
Г)
S + 3NO2 = SO3 + 3NO
1)
NO2
2)
h3S
3)
HI
4)
S
5)
SO3
6)
I2
В4. Установите соответствие между названием вещества и средой его водного раствора
НАЗВАНИЕ ВЕЩЕСТВА
СРЕДА РАСТВОРА
А)
сульфат цинка
Б)
нитрат рубидия
В)
фторид калия
Г)
гидрофосфат натрия
1)
кислотная
2)
нейтральная
3)
щелочная
Часть С
( ответ запишите с полным объяснением)
Что такое скорость химической реакции, от каких факторов она зависит, приведите примеры из жизни( ПРИРОДНЫХ ЯВЛЕНИЙ, БЫТА ЛЮДЕЙ, ПРОМЫШЛЕННОСТИ).
Оценивание:
Часть А – правильный ответ 1 балл
Часть В– В1,В3,В4 – 2 балла без ошибки. 1балл – 1ошибка
В2 – 1 балл
Часть С – 3 балла
Максимальное количество баллов: 23
23-22балла – «5» 21- 16 – «4» 15 -11-«3» Менее 10 – «2»
ОТВЕТЫ:
№
Вариант 1
Вариант 2
А1
2
3
А2
4
1
А3
2
2
А4
4
2
А5
4
1
А6
2
1
А7
2
3
А8
4
4
А9
1
3
А10
3
2
А11
3
2
А12
3
4
А13
4
2
В1
2431
24313
В2
33
11
В3
2412
2451
В4
2113
1233
С
1.Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объема.
2.Скорость зависит от:
Природы реагирующих веществ;
Концентрации реагирующих веществ
Температуры
Катализаторов/ингибиторов
3.Примеры
infourok.ru
Вариант 1.
Часть А. Тестированные задания с одним правильным ответом
А1. Электронная формула 1S22S22p63S23p2 соответствует
1) Мg 2) Al 3) Si 4) P
А2. В порядке увеличения атомного радиуса химические элементы расположены в ряду
1) Be, B, C, N 3) O, S, Se, Te
2) Rb, K, Na, Li 4) Mg, Al, Si, P
A 3. Амфотерным оксидом является
1) Na2O 2) SO2 3) ZnO 4) NO
A4. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 3) Ca, Mg, Be
2) Al, Mg, Na 4) Mg, Be, Ca
A5. Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует с металлами
Б. Хлор не растворяется в воде
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Азотная кислота реагирует с каждым веществом
1) кислород и гидроксид натрия
2) медь и гидроксид натрия
3) медь и оксид серы (VI)
4) кислород и соляная кислота
А7. Веществом «Х» в реакции NaNO3 → NaNO2 + X является
1) О2 2) N2 3) Na 4) NО2
А8. Окислителем в уравнении реакции Mg + 2НCI→ MgCI2 + Н2 является
1) Mg0 2) Mg+2 3) Н+ 4) Н02
А9. Изомером пентана является
1) пентин – 2 3) 2 – метилбутан
2) бутан 4) пентен – 2
А10. Для пропилена характерна реакция
1) присоединения 2) замещения 3) Вюрца 4) Кучерова
А11. Бутановая кислота взаимодействует с
1) соляной кислотой 3) этанолом
2) водой 4) этаналем
А12. Наркотическое действие на человека оказывает
1) этанол 3) метанол
2) формалин 4) уксусная кислота
Часть В. Сложные тесты
В 1. Установите соответствие между соединением и его изомером
| Соединение А) циклопропан Б) бутадиен – 1,2 В) гексин - 1 Г) 2,3 – диметилбутин - 1 | Изомер 1) 3 – метилпентин - 1 2) пропилен 3) бутан 4) пентадиен – 1,2 5) бутадиен – 1,3 |
В2. Установите соответствие между веществом и видом химической связи в нем
Вещество Вид связи
А) бронза 1) ионная связь
Б) хлорид натрия 2) ковалентная полярная
В) оксид серы (VI) 3) металлическая
Г) алюминий 4) ковалентная неполярная
В3. Установите соответствие между уравнением и типом реакции
Уравнение реакции Тип реакции
А) Nh5CI → Nh4 ↑ + НCI 1) обмен
Б) Na2O + CO2 → Na2CO3 2) разложения
В) ВаСI2 + Н2SО4 → ВаSО4 + 2 НCI 3) замещения
Г) Mg + Н2SО4 → MgSО4 + Н2 4) соединения
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Вещества Продукты
А) Fe + СI2 → 1) FeSО4 + SО2 + Н2О
Б) Fe + НCI → 2) FeСI2 + Н2
В) Fe + Н2SО4(конц.) → 3) FeSО4 + Сu
Г) Fe + СuSО4 → 4) FeСI3 + Н2
5) FeСI3
6) FeСI2
В5.Установите соответствие между исходными веществами и продуктами реакции
| Исходные вещества А) СН2 = СН– СН3 + НCl → Б) СН3 – СН2 – СН3 + Cl2 → В) C6H6 + HNO3 → Г) СН3 – СН2 – Cl + Na → | Продукты реакции 1) СН3 – СН2 – СН2 – СН3 2) СН3 – СНCl – СН3 3) СН2Cl – СН2 – СН3 4) C6H5 – NO2 5) C6H5 – OН 6) СН3 – СН2 – СН3 |
В6. Для смещения химического равновесия в реакции необходимо
2SО2 + О2 ↔ SО3 + Q
1) понизить температуру
2) повысить температуру
3) увеличить концентрацию SО2
4) увеличить концентрацию SО3
5) увеличить давление
6) уменьшить давление
В7. Кальций взаимодействует с
1) железом
2) водой
3) хлором
4) соляной кислотой
5) карбонатом кальция
6) гидроксидом калия
В8. Толуол взаимодействует с
1) Н2О
2) Н2
3) О2
4) НCl
5) KMnO4
Часть С. Задания со свободной и полной записью ответа
С1. Расставить коэффициенты методом электронного баланса в уравнении
Са + Н3РО4 → Са3(РО4)2 + Н2
Определить окислитель и восстановитель
С2 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Хлорэтан → этен → ацетилен → бензол → хлорбензол
С3. На 300г известняка, содержащего 25% примесей и 75% чистого СаСО3, подействовали избытком соляной кислоты. Вычислите объем (при н.у.) выделившегося газа.
С4. Относительная плотность паров углеводорода по кислороду равна 2,125. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода.
Вариант 2.
Часть А. Тестированные задания с одним правильным ответом
А1. На внешнем электронном уровне серы число электронов равно
1) 2 2) 4 3) 6 4) 5
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) F, О, N, С 3) Si, Р, СI, S
2) СI, S, N, С 4) С, N, О, F
А3. Кислотным оксидом является
1) Al2O3 2) K2O 3) CO 4) CO2
А4. В каком ряду химические элементы расположены в порядке уменьшения неметаллических свойств
1) Rb, K, Li, Na 3) Sb, As, P, N
2) F, Cl, Br, I 4) I, Br, Cl, F
А5. Верны ли следующие суждения о свойствах железа?
А. Железо не взаимодействует с концентрированной серной кислотой.
Б. Железо реагирует с раствором сульфата меди (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Гидроксид алюминия взаимодействует с каждым веществом
1) кальций и кислород 3) кислород и сера
2) оксид натрия и хлорид натрия 4) соляная кислота и гидроксид натрия
А7. При взаимодействии железа с водой в присутствии кислорода образуется
1) FеО 2) Fе(ОН)2 3) FеН2 4) Fе(ОН)3
А8. Восстановителем в реакции КNО3 → КNО2 + О2 является
1) О-2 2) N+5 3) О20 4) К+
А9. Гомологом бутина – 2 является
1) бутин – 1 2) пентин – 2
3) 2- метилпентин - 2 4) 2- метилбутин – 2
А10. Для алкенов не характерна реакция
1) радикального замещения 3) гидратации
2) галогенирования 4) горения
А11. В схеме превращений
h3O h3O, HgSO4
CaC2 ———→ X1 ————→ X2
веществом X2 является
1) этаналь 3) 1,2 – этандиол
2) метилацетат 4) этанол
А12. К биологически активным соединениям относятся
углеводы 3) витамины
жиры 4) белки
Часть В. Сложные тесты
В1. Установите соответствие между соединением и классом углеводородов
| Соединение А) пентен-2 Б) пропилен В) толуол Г) циклобутан | Класс углеводородов 1) циклоалканы 2) алканы 3) алкены 4) алкины 5) ароматические углеводороды |
В2. Установите соответствие между веществом и видом химической связи в нем
Вещества Вид связи
А) бромид калия 1) ковалентная неполярная
Б) бромоводород 2) ковалентная полярная
В) серная кислота 3) ионная
Г) кислород 4) металлическая
В3. Установите соответствие между уравнением и типом реакции
Уравнения реакции Тип реакции
А) Fе + СuСl2 → Сu + FеСl2 1) соединение
Б) Na2СО3 → Na2О + СО2 2) разложение
В) 4 Fе + 6 Н2О + 3 О2 → 4 Fе(ОН)3 3) обмен
Г) АgNО3 + НСl → АgСl↓ + НNО3 4) замещение
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Исходные вещества Продукты
А) Сl2 + Н2 → 1) НСl + НСlО
Б) Сl2 + Сu → 2) СuSО4 + SО2 + Н2О
В) Сl2 + Н2О → 3) НСlО
Г) Сu + Н2SО4 (к) → 4) СuСl2
5) НСl
В5. Установите соответствие между реагентом качественной реакции и веществом, которое можно определить с его помощью
| Реагент А) KMnO4 Б) O2 В) Br2 Г) AgNO3 (Nh5OH) | Вещество 1) бутан 2) бензол 3) бутин - 1 4) толуол 5) бутен - 1 |
В6. На увеличение скорости химических реакций влияют факторы:
1) увеличение температуры
2) площадь поверхностного соприкосновения
3) уменьшение давления
4) природа реагирующих веществ
5) добавление ингибитора
6) увеличение давления
В7. Сера взаимодействует с
1) водой
2) соляной кислотой
3) углекислым газом
4) кислородом
5) железом
6) водородом
В8. Пропилен взаимодействует с
1) СО2
2) Н2
3) О2
4) НCl
5) KMnO4
Часть С. Задания со свободной и полной записью ответа
С1. Даны вещества: серная кислота, нитрат бария, гидроксид натрия.
Напишите возможные реакции обмена между этими веществами в молекулярном, полном и сокращенном ионном виде.
С2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
метан → ацетилен → этан→ хлорэтан → бутан
С3. Сколько грамм оксида фосфора (V) потребуется для получения фосфорной кислоты массой 252, если выход продукта реакции составил 96%?
С4.Плотность паров органического соединения по неону равна 4,1. При сжигании 8,2 г этого вещества образуется 26,4 г оксида углерода (IV) и 9 г воды. Выведите молекулярную формулу органического вещества.
Вариант 3.
Часть А. Тестированные задания с одним правильным ответом
А1. Электронная формула 1S22S22p63S23p1 соответствует
1) Мg 2) Al 3) Si 4) P
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) N, C, B, Be 3) O, S, Se, Te
2) Rb, K, Na, Li 4) Mg, Al, Si, P
A 3. Кислотообразующим оксидом является
1) Na2O 2) SO2 3) ZnO 4) NO
A4. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 3) Al, Mg, Na
2) Ca, Mg, Be 4) Mg, Be, Ca
А5. Верны ли следующие суждения о свойствах натрия?
А. Натрий взаимодействует с водой при обычных условиях
Б. Натрий является щелочно-земельным металлом
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Оксид алюминия взаимодействует с каждым веществом
1) кальций и кислород 3) кислород и сера
2) оксид натрия и хлорид натрия 4) соляная кислота и гидроксид натрия
А7. В реакции Са + Н2О → Х + Н2 веществом «Х» является
1) Са(ОН)2 2) СаО 3) СаН2 4) СаСО3
А8. Окислителем в уравнении реакции Fe + 2НCI→ FeCI2 + Н2 является
1) Н02 2) Fe +2 3) Н+ 4) Fe 0
А9. Изомером 2- метилпентана является
1) пентин – 2 3) 2 – метилбутан
2) пентен – 2 4) 3- метилпентан
А10. Для пропина характерна реакция
1) отщепления 2) замещения 3) Вюрца 4) Кучерова
А11. Пропаналь при восстановлении водородом образует
1) пропанон 3) пропанол-1
2) пропен 4) пропанол-2
А12. Антисептическими свойствами обладает
1) уксусная кислота 3) аскорбиновая кислота
2) раствор фенола 4) аминоуксусная кислота
Часть В. Сложные тесты
В 1. Установите соответствие между соединением и классом органических веществ
| Соединение А) пропаналь Б) бутен-1 В) пропанон Г) бутин-2 | Класс органических веществ 1) алкан 2) спирт 3) кетон 4) алкен 5) альдегид 6) алкин |
В2. Установите соответствие между веществом и видом химической связи в нем
Вещество Вид связи
А) оксид углерода (IV) 1) ионная связь
Б) хлорид калия 2) ковалентная полярная
В) азот 3) металлическая
Г) алюминий 4) ковалентная неполярная
В3. Установите соответствие между уравнением и типом реакции
Уравнение реакции Тип реакции
А) Nh5CI → Nh4 ↑ + НCI 1) обмен
Б) Na2O + CO2 → Na2CO3 2) разложения
В) ВаСI2 + Н2SО4 → ВаSО4 + 2 НCI 3) замещения
Г) Mg + Н2SО4 → MgSО4 + Н2 4) соединения
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Исходные вещества Продукты реакции
А) S + СI2 → 1) FeSО4 + SО2 + Н2О
Б) S + O2 → 2) SCl4
В) S + Н2SО4(конц.) → 3) SО2
Г) S + Fe → 4) SО3
5) FeS
В5. Бутан взаимодействует с
1) Н2
2) О2
3) KMnO4
4) Cl2
5) НNО3
В6.Установите соответствие между исходными веществами и продуктами реакции
| Исходные вещества А) C6H6 + СН3 J→ Б) СН3 – СН2 – СН3 + Cl2 → В) СН2 = СН– СН3 + НCl → Г) СН3 – СН2 – Cl + Na → | Продукты реакции 1) СН3 – СН2 – СН3 2) СН3 – СНCl – СН3 3) C6H5 – J 4) C6H5 –СН3 5) СН3 – СН2 – СН2 – СН3 |
В7. При увеличении скорости химических реакций учитывают такие факторы, как
1) уменьшение давления
2) увеличение температуры
3) площадь поверхностного соприкосновения
4) природа реагирующих веществ
5) увеличение давления
6) добавление ингибитора
В8. Серная кислота взаимодействует с
1) водой
2) гидроксидом натрия
3) углекислым газом
4) соляной кислотой
5) цинком
6) хлоридом бария
Часть С. Задания со свободной и полной записью ответа
С1. Расставить коэффициенты методом электронного баланса в уравнении реакции
Cu + НNО3 (разбав) → Сu(NО3)2 + NO + Н2O
Определить окислитель и восстановитель
С2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Этанол → этен → вромэтан → бутан → 2-хлорбутан
С3. Какой объем углекислого газа (н.у.) выделится при сжигании угля, содержащего 15% негорючих примесей?
С4. Относительная плотность паров углеводорода по азоту равна 3,5. Массовая доля углерода в нем равна 85,71%. Определите молекулярную формулу данного углеводорода.
Вариант 4.
Часть А. Тестированные задания с одним правильным ответом
А1. На внешнем электронном уровне хлора число электронов равно
1) 2 2) 4 3) 5 4) 7
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) F, О, N, С 3) Si, Р, СI, S
2) СI, S, N, С 4) С, N, О, F
А3. Основным оксидом является
1) Al2O3 2) K2O 3) CO 4) CO2
А4. В каком ряду химические элементы расположены в порядке уменьшения неметаллических свойств
1) Li, Na, K, Rb 3) Sb, As, P, N
2) F, Cl, Br, I 4) I, Br, Cl, F
A5. Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует с металлами
Б. Хлор не растворяется в воде
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Азотная кислота реагирует с каждым веществом
1) кислород и гидроксид натрия
2) медь и гидроксид натрия
3) медь и оксид серы (VI)
4) кислород и соляная кислота
А7. Веществом «Х» в реакции NaNO3 → NaNO2 + X является
1) О2 2) N2 3) Na 4) NО2
А8. Восстановителем в реакции Аl + KOH → KАlО2+ Н2 является
1) Сl2 2) К+ 3) Аl 4) Н2
А9. Общая формула Сnh3n – 2 характерна для
1) алканов 2) алкенов 3) алкинов 4) циклоалканов
А10. Из этилового спирта реакцией дегидратации получают
1) этан 2) этилен 3) ацетилен 4) бензол
А11. Многоатомный спирт ои одноатомного можно отличить при помощи
1) CuO 3) Ag2O
2) Cu(OH)2 4) CuSO4
А12. Резина получается при вулканизации
1) каучука 3) целлюлозы
2) пластмассы 4) волокна
Часть В. Сложные тесты
В1. Установите соответствие между соединением и классом органических веществ
| Соединение А) бутанол Б) пропилен В) гексаналь Г) толуол | Класс органических соединений 1) альдегид 2) алкан 3) алкен 4) спирт 5) ароматические углеводороды |
В2. Установите соответствие между веществом и видом химической связи в нем
Вещества Вид связи
А) бромид калия 1) ковалентная неполярная
Б) бромоводород 2) ковалентная полярная
В) серная кислота 3) ионная
Г) кислород 4) металлическая
5)водородная
В3. Установите соответствие между уравнением и типом реакции
Уравнения реакции Тип реакции
А) Fе + СuСl2 → Сu + FеСl2 1) соединение
Б) Na2СО3 → Na2О + СО2 2) разложение
В) 4 Fе + 6 Н2О + 3 О2 → 4 Fе(ОН)3 3) обмен
Г) АgNО3 + НСl → АgСl↓ + НNО3 4) замещение
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Вещества Продукты
А) Fe + СI2 → 1) FeSО4 + SО2 + Н2О
Б) Fe + НCI → 2) FeСI2 + Н2
В) Fe + Н2SО4(конц.) → 3) FeSО4 + Сu
Г) Fe + СuSО4 → 4) FeСI3 + Н2
5) FeСI3
6) FeСI2
В5. Установите соответствие между исходными веществами и продуктами реакции
| Исходные вещества А) СН2 = СН– СН3 + НCl → Б) СН3 – СН2 – СН3 + Cl2 → В) C6H6 + HNO3 → Г) СН3 – СН2 – Cl + Na → | Продукт реакции 1) СН3 – СН2 – СН2 – СН3 2) СН3 – СНCl – СН3 3) СН2Cl – СН2 – СН3 4) C6H5 – NO2 5) C6H5 – OН 6) СН3 – СН2 – СН3 |
В6. Для смещения химического равновесия в реакции необходимо
2SО2 + О2 ↔ SО3 + Q
1) понизить температуру
2) повысить температуру
3) увеличить концентрацию SО2
4) увеличить концентрацию SО3
5) увеличить давление
6) уменьшить давление
В7.Соляная кислота взаимодействует с
1) гидроксидом натрия
2) водой
3) углекислым газом
4) нитратом серебра
5) железом
6) азотной кислотой
В8. Циклобутан взаимодействует с
1) KMnO4
2) О2
3) Н2
4) НCl
5) Н2О
Часть С. Задания со свободной и полной записью ответа
С1. Даны вещества: серная кислота, нитрат бария, гидроксид натрия.
Напишите возможные реакции обмена между этими веществами в молекулярном, полном и сокращенном ионном виде.
С2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Этанол → этен → вромэтан → бутан → 2-хлорбутан
С3. На 300г известняка, содержащего 25% примесей и 75% чистого СаСО3, подействовали избытком соляной кислоты. Вычислите объем (при н.у.) выделившегося газа.
С4. Относительная плотность паров углеводорода по кислороду равна 2,125. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода.
Вариант 5.
Часть А. Тестированные задания с одним правильным ответом
А1. Электронная формула 1S22S22p23S23p1 соответствует
1) Мg 2) Al 3) Si 4) P
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) N, C, B, Be 3) O, S, Se, Te
2) Rb, K, Na, Li 4) Mg, Al, Si, P
A 3. Амфотерным оксидом является
1) Na2O 2) SO2 3) ZnO 4) NO
A4. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 3) Ca, Mg, Be
2) Al, Mg, Na 4) Mg, Be, Ca
A5. Верны ли следующие суждения о свойствах углерода?
А. Углерод реагирует с металлами
Б. Углерод не растворяется в воде
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Азотная кислота реагирует с каждым веществом
1) кислород и гидроксид натрия
2) медь и гидроксид натрия
3) медь и оксид серы (VI)
4) кислород и соляная кислота
А7. Восстановителем в реакции КNО3 → КNО2 + О2 является
1) О-2 2) О20 3) N+5 4) К+
А8. Окислителем в уравнении реакции Fe + 2НCI→ FeCI2 + Н2 является
1) Н02 2) Н+ 3) Fe +2 4) Fe 0
А9. Изомером пентана является
1) пентин – 2 3) 2 – метилбутан
2) бутан 4) пентен – 2
А10. Для пентена характерна реакция
1) присоединения 2) замещения 3) Вюрца 4) Кучерова
А11. Бутаналь образуется при неполном окислении
1) бутина-1 3) бутина-2
2) бутанола-1 4) бутанола-2
А12. Ядовитое действие на человека оказывает
1) этанол 3) метанол
2) глицин 4) уксусная кислота
Часть В. Сложные тесты
В 1. Установите соответствие между соединением и его изомером
| Соединение А) 2,3 – диметилбутин - 1 Б) бутадиен – 1,2 В) гексин - 1 Г) циклопропан | Изомер 1) 3 – метилпентин - 1 2) пропилен 3) бутан 4) пентадиен – 1,2 5) бутадиен – 1,3 |
В2. Установите соответствие между веществом и видом химической связи в нем
Вещество Вид связи
А) бронза 1) ионная связь
Б) хлорид натрия 2) ковалентная полярная
В) оксид серы (VI) 3) металлическая
Г) алюминий 4) ковалентная неполярная
В3. Установите соответствие между уравнением и типом реакции
Уравнения реакции Тип реакции
А) Fе + СuСl2 → Сu + FеСl2 1) соединение
Б) Na2СО3 → Na2О + СО2 2) разложение
В) 4 Fе + 6 Н2О + 3 О2 → 4 Fе(ОН)3 3) обмен
Г) АgNО3 + НСl → АgСl↓ + НNО3 4) замещение
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Исходные вещества Продукты
А) Сl2 + Н2 → 1) НСl
Б) Сl2 + Сu → 2) СuSО4 + SО2 + Н2О
В) Сl2 + Н2О → 3) НСlО
Г) Сu + Н2SО4 (к) → 4) СuСl2
5) НСl + НСlО
В5. Установите соответствие между исходными веществами и продуктами реакции
| Исходные вещества А) СН2 = СН– СН3 + НCl → Б) C6H6 + HNO3 → В) СН3 – СН2 – Cl + Na → Г) ) СН3 – СН2 – СН3 + Cl2 → | Продукты реакции 1) C6H5 – NO2 2) СН3 – СНCl – СН3 3) СН2Cl – СН2 – СН3 4) СН3 – СН2 – СН2 – СН3 5) C6H5 – OН 6) СН3 – СН2 – СН3 |
В6. При увеличении скорости химических реакций учитывают такие факторы, как
1) уменьшение давления
2) увеличение температуры
3) площадь поверхностного соприкосновения
4) природа реагирующих веществ
5) увеличение давления
6) концентрация реагирующих веществ
В7. Кальций взаимодействует с
1) железом
2) водой
3) хлором
4) соляной кислотой
5) карбонатом кальция
6) гидроксидом калия
В8. Бензол не взаимодействует с
1) Н2О
2) Н2
3) О2
4) СН3Cl
5) KMnO4
Часть С. Задания со свободной и полной записью ответа
С1. Даны вещества: соляная кислота, нитрат серебра, гидроксид натрия.
Напишите возможные реакции обмена между этими веществами в молекулярном, полном и сокращенном ионном виде.
С2 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Хлорэтан → этен → ацетилен → бензол → хлорбензол
С3. Какой объем углекислого газа (н.у.) выделится при сжигании угля, содержащего 15% негорючих примесей?
С4. Массовая доля углерода в углеводороде равна 88,24%, а относительная плотность его паров по кислороду равна 2,125. Выведите молекулярную формулу этого углеводорода.
Вариант 6.
Часть А. Тестированные задания с одним правильным ответом
А1. Электронная формула 1S22S22p23S23p3 соответствует
1) Мg 2) Al 3) Si 4) P
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) N, C, B, Be 3) O, S, Se, Te
2) Rb, K, Na, Li 4) Mg, Al, Si, P
А3. Кислотным оксидом является
1) SO3 2) K2O 3) CO 4) Al2O3
А4. В каком ряду химические элементы расположены в порядке уменьшения неметаллических свойств
1) Li, Na, K, Rb 3) Sb, As, P, N
2) F, Cl, Br, I 4) I, Br, Cl, F
A5. Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует с металлами
Б. Хлор не растворяется в воде
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Азотная кислота реагирует с каждым веществом
1) кислород и гидроксид натрия
2) медь и гидроксид натрия
3) медь и оксид серы (VI)
4) кислород и соляная кислота
А7. В реакции Са + Н2О → Х + Н2 веществом «Х» является
1) СаСО3 2) СаО 3) СаН2 4) Са(ОН)2
А8. Окислителем в уравнении реакции Fe + 2НCI→ FeCI2 + Н2 является
1) Н02 2) Fe +2 3) Fe 0 4) Н+
А9. Для 2- метилпентана изомером будет
1) 2 – метилбутан 3) пентин – 2
2) 3- метилпентан 4) пентен – 2
А10. Для пропина характерна реакция
1) отщепления 2) Вюрца 3) замещения 4) Кучерова
А11. Из пропанона при восстановлении водородом образуется
1) пропанон 3) пропанол-1
2) пропен 4) пропанол-2
А12. Антисептиком является
1) уксусная кислота 3) аскорбиновая кислота
2) аминоуксусная кислота 4) раствор фенола
Часть В. Сложные тесты
В1. Установите соответствие между соединением и классом углеводородов
| Соединение А) пентен-2 Б) пропилен В) толуол Г) циклобутан | Класс углеводородов 1) циклоалканы 2) алканы 3) алкены 4) алкины 5) ароматические углеводороды |
В2. Установите соответствие между веществом и видом химической связи в нем
Вещества Вид связи
А) бромид калия 1) ионная
Б) бромоводород 2) ковалентная полярная
В) серная кислота 3) ковалентная неполярная
Г) кислород 4) металлическая
В3. Установите соответствие между уравнением и типом реакции
Уравнение реакции Тип реакции
А) Nh5CI → Nh4 ↑ + НCI 1) обмен
Б) Na2O + CO2 → Na2CO3 2) разложения
В) ВаСI2 + Н2SО4 → ВаSО4 + 2 НCI 3) замещения
Г) Mg + Н2SО4 → MgSО4 + Н2 4) соединения
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Вещества Продукты
А) Fe + СI2 → 1) FeSО4 + SО2 + Н2О
Б) Fe + НCI → 2) FeСI2 + Н2
В) Fe + Н2SО4(конц.) → 3) FeSО4 + Сu
Г) Fe + СuSО4 → 4) FeСI3 + Н2
5) FeСI3
6) FeСI2
В5. Установите соответствие между реагентом качественной реакции и веществом, которое можно определить с его помощью
| Реагент А) O2 Б) KMnO4 В) Br2 Г) AgNO3 (Nh5OH) | Вещество 1) бутин - 1 2) толуол 3) бутан 4) бензол 5) бутен - 1 |
В6. Для смещения химического равновесия в реакции необходимо
2SО2 + О2 ↔ SО3 + Q
1) понизить температуру
2) увеличить концентрацию SО3
3) увеличить концентрацию SО2
4) повысить температуру
5) увеличить давление
6) уменьшить давление
В7. Гидроксид натрия взаимодействует с
1) азотной кислотой
2) водой
3) углекислым газом
4) хлоридом алюминия
5) железом
6) кислородом
В8. Пентен взаимодействует с
1) СО2
2) Н2
3) О2
4) НCl
5) KMnO4
Часть С. Задания со свободной и полной записью ответа
С1. Расставить коэффициенты методом электронного баланса в уравнении
Са + Н3РО4 → Са3(РО4)2 + Н2
Определить окислитель и восстановитель
С2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
метан → ацетилен → этан→ хлорэтан → бутан
С3. Сколько грамм оксида фосфора (V) потребуется для получения фосфорной кислоты массой 320, если выход продукта реакции составил 90%?
С4. Плотность паров органического соединения по неону равна 4,1. При сжигании 8,2 г этого вещества образуется 26,4 г оксида углерода (IV) и 9 г воды. Выведите молекулярную формулу органического вещества.
Вариант 7.
Часть А. Тестированные задания с одним правильным ответом
А1. На внешнем электронном уровне хлора число электронов равно
1) 2 2) 4 3) 5 4) 7
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) F, О, N, С 3) Si, Р, СI, S
2) СI, S, N, С 4) С, N, О, F
A 3. Кислотообразующим оксидом является
1) Na2O 2) SO2 3) ZnO 4) NO
A4. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 3) Al, Mg, Na
2) Ca, Mg, Be 4) Mg, Be, Ca
А5. Верны ли следующие суждения о свойствах натрия?
А. Натрий является амфотерным металлом
Б. Натрий взаимодействует с водой при обычных условиях
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Азотная кислота реагирует с каждым веществом
1) кислород и гидроксид натрия
2) медь и гидроксид натрия
3) медь и оксид серы (VI)
4) кислород и соляная кислота
А7. Веществом «Х» в реакции NaNO3 → NaNO2 + X является
1) О2 2) N2 3) Na 4) NО2
А8. Восстановителем в реакции Аl + KOH → KАl О2+ Н2 является
1) Сl2 2) К+
А9. В схеме превращений SO2 →t Х → CaSO4 веществом «Х» является
1) Са 2) SO3 3) h3SO4 4) СаО
А10. Реакция взаимодействия соляной кислоты HCl с перманганатом калия KMnO4 используется для лабораторного получения
1) Н2 2) Сl2 3) Н2О 4) О2
Часть В. Сложные тесты
Задания В1 – В4 тесты на установление соответствия
В 1. Установите соответствие между формулой вещества и названием
Формула Название
А) Nh5OH 1) соляная кислота
Б) СаСО3 2) плавиковая кислота
В) НF 3) гашеная известь
Г) Са(ОН)2 4) известняк
5) нашатырный спирт
В2. Установите соответствие между веществом и видом химической связи в нем
Вещество Вид связи
А) водород 1) ионная связь
Б) хлорид натрия 2) ковалентная полярная
В) оксид серы (VI) 3) металлическая
Г) алюминий 4) ковалентная неполярная
В3. Установите соответствие между уравнением и типом реакции
Уравнение реакции Тип реакции
А) Nh5CI → Nh4 ↑ + НCI 1) замещения
Б) Na2O + CO2 → Na2CO3 2) разложения
В) ВаСI2 + Н2SО4 → ВаSО4 + 2 НCI 3) обмен
Г) Mg + Н2SО4 → MgSО4 + Н2 4) соединения
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Исходные вещества Продукты реакции
А) S + СI2 → 1) FeS
Б) S + O2 → 2) SCl4
В) S + Н2SО4(конц.) → 3) SО3
Г) S + Fe → 4) SО2 5) FeSО4 + SО2 + Н2О
6) SО2 + h3O
Задания В5 – В6 тесты, в которых ответы находятся в определенной последовательности
В5. При увеличении скорости химических реакций учитывают такие факторы, как
1) уменьшение давления
2) увеличение температуры
3) увеличение давления
4) природа реагирующих веществ
5) площадь поверхностного соприкосновения
6) концентрация реагирующих веществ
В6. Сера взаимодействует с
1) железом
2) соляной кислотой
3) углекислым газом
4) кислородом
5) водой
6) водородом
Часть С. Задания со свободной и полной записью ответа
С1. Даны вещества: гидроксид натрия, нитрат бария, серная кислота.
Напишите возможные реакции обмена между этими веществами в молекулярном, полном и сокращенном ионном виде.
С2. Вычислите объем (н.у.) и массу оксида серы (IV), порция которого содержит 1,8 ∙ 1024 молекул.
С3. Какой объем углекислого газа (н.у.) выделится при сжигании угля, содержащего 15% негорючих примесей?
Вариант 8.
Часть А. Тестированные задания с одним правильным ответом
А1. На внешнем электронном уровне азота число электронов равно
1) 2 2) 4 3) 5 4) 7
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) F, О, N, С 3) Si, Р, СI, S
2) СI, S, N, С 4) С, N, О, F
А3. Основным оксидом является
1) Al2O3 2) K2O 3) CO 4) CO2
А4. В каком ряду химические элементы расположены в порядке уменьшения неметаллических свойств
1) Li, Na, K, Rb 3) Sb, As, P, N
2) F, Cl, Br, I 4) I, Br, Cl, F
A5. Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует с металлами
Б. Хлор взаимодействует с водой
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Гидроксид алюминия взаимодействует с каждым веществом
1) кальций и кислород 3) кислород и сера
2) оксид натрия и хлорид натрия 4) соляная кислота и гидроксид натрия
А7. При взаимодействии железа с водой в присутствии кислорода образуется
1) FеО 2) Fе(ОН)2 3) FеН2 4) Fе(ОН)3
А8. Окислителем в уравнении реакции Fe + 2НCI→ FeCI2 + Н2 является
1) Н02 2) Fe +2 3) Fe 0 4) Н+
А9. В схеме превращений СаСО3 →t Х → Са(ОН)2 веществом «Х» является
1) Са 2) Са(НСО3)2 3) СО2 4) СаО
А10. При производстве серной кислоты в качестве исходного сырья применяют
1) Н2S 2) FeS2 3) Н2SО3 4) SО2
Часть В. Сложные тесты
Задания В1 – В4 тесты на установление соответствия
В 1. Установите соответствие между формулой вещества и названием
Формула Название
А) NaHCO3 1) известняк
Б) Са(ОН)2 2) известковая вода
В) Na2CO3 3) пищевая сода
Г) СаСО3 4) стиральная сода
В2. Установите соответствие между веществом и видом химической связи в нем
Вещества Вид связи
А) бромид калия 1) ковалентная неполярная
Б) бромоводород 2) ковалентная полярная
В) серная кислота 3) ионная
Г) кислород 4) металлическая
В3. Установите соответствие между уравнением и типом реакции
Уравнения реакции Тип реакции
А) Fе + СuСl2 → Сu + FеСl2 1) соединение
Б) Na2СО3 → Na2О + СО2 2) разложение
В) 4 Fе + 6 Н2О + 3 О2 → 4 Fе(ОН)3 3) обмен
Г) АgNО3 + НСl → АgСl↓ + НNО3 4) замещение
5) нашатырный спирт
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Исходные вещества Продукты
А) Сl2 + Н2 → 1) НСl + НСlО
Б) Сl2 + Сu → 2) СuSО4 + SО2 + Н2О
В) Сl2 + Н2О → 3) НСlО
Г) Сu + Н2SО4 (к) → 4) СuСl2
Задания В5 – В6 тесты, в которых ответы находятся в определенной последовательности
В5. При увеличении скорости химических реакций учитывают такие факторы, как
1) уменьшение давления
2) увеличение давления
3) площадь поверхностного соприкосновения
4) природа реагирующих веществ
5) увеличение температуры
6) концентрация реагирующих веществ
В6. Серная кислота взаимодействует с
1) водой
2) гидроксидом натрия
3) углекислым газом
4) хлоридом бария
5) цинком
6) соляной кислотой
Часть С. Задания со свободной и полной записью ответа
С1. Расставить коэффициенты методом электронного баланса в уравнении реакции
Cu + НNО3 (конц) → Сu(NО3)2 + NO2 + Н2O
Определить окислитель и восстановитель
С2. Сколько грамм соли потребуется для приготовления 60 г раствора с массовой долей растворенного вещества 25%?.
С3. На 300г известняка, содержащего 25% примесей и 75% чистого СаСО3, подействовали избытком соляной кислоты. Вычислите объем (при н.у.) выделившегося газа.
Вариант 9.
Часть А. Тестированные задания с одним правильным ответом
А1. Электронная формула 1S22S22p23S23p1 соответствует
1) Мg 2) Al 3) Si 4) P
А2. В порядке увеличения электроотрицательности химические элементы расположены в ряду
1) N, C, B, Be 3) O, S, Se, Te
2) Rb, K, Na, Li 4) Mg, Al, Si, P
A 3. Амфотерным оксидом является
1) Na2O 2) SO2 3) ZnO 4) NO
A4. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 3) Ca, Mg, Be
2) Al, Mg, Na 4) Mg, Be, Ca
A5. Верны ли следующие суждения о свойствах углерода?
А. Углерод реагирует с металлами
Б. Углерод не растворяется в воде
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
А6. Гидроксид алюминия взаимодействует с каждым веществом
1) соляная кислота и гидроксид натрия 3) кислород и сера
2) оксид натрия и хлорид натрия 4) кальций и кислород
А7. При взаимодействии железа с водой в присутствии кислорода образуется
1) FеО 2) Fе(ОН)2 3) FеН2 4) Fе(ОН)3
А8. Восстановителем в реакции КNО3 → КNО2 + О2 является
1) О-2 2) N+5 3) О20 4) К+
А9. В схеме превращений С → Х → К2СО3 веществом «Х» является
1) СО2 2) Н2СО3 3) Н2О 4) К2О
А10. Реакция термического разложения перманганата калия KMnO4 используется для лабораторного получения
1) К 2) О2 3) Mn 4) К2О
Часть В. Сложные тесты
Задания В1 – В4 тесты на установление соответствия
В 1. Установите соответствие между формулой вещества и названием
Формула Название
А) Nh5OH 1) известняк
Б) Са(ОН)2 2) плавиковая кислота
В) НF 3) гашеная известь
Г) СаСО3 4) соляная кислота
5) нашатырный спирт
В2. Установите соответствие между веществом и видом химической связи в нем
Вещество Вид связи
А) бронза 1) ионная связь
Б) хлорид натрия 2) ковалентная полярная
В) оксид серы (VI) 3) металлическая
Г) алюминий 4) ковалентная неполярная
В3. Установите соответствие между уравнением и типом реакции
Уравнения реакции Тип реакции
А) Fе + СuСl2 → Сu + FеСl2 1) соединение
Б) Na2СО3 → Na2О + СО2 2) разложение
В) 4 Fе + 6 Н2О + 3 О2 → 4 Fе(ОН)3 3) обмен
Г) АgNО3 + НСl → АgСl↓ + НNО3 4) замещение
В4. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Исходные вещества Продукты
А) Сl2 + Н2 → 1) НСl + НСlО
Б) Сl2 + Сu → 2) СuSО4 + SО2 + Н2О
В) Сl2 + Н2О → 3) НСlО
Г) Сu + Н2SО4 (к) → 4) СuСl2
Задания В5 – В6 тесты, в которых ответы находятся в определенной последовательности
В5. При увеличении скорости химических реакций учитывают такие факторы, как
1) уменьшение давления
2) увеличение температуры
3) площадь поверхностного соприкосновения
4) природа реагирующих веществ
5) увеличение давления
6) концентрация реагирующих веществ
В6. Соляная кислота взаимодействует с
1) гидроксидом натрия
2) водой
3) углекислым газом
4) нитратом серебра
5) железом
6) азотной кислотой
Часть С. Задания со свободной и полной записью ответа
С1. Даны вещества: серная кислота, нитрат бария, гидроксид натрия.
Напишите возможные реакции обмена между этими веществами в молекулярном, полном и сокращенном ионном виде.
С2. Вычислите объем (н.у.) и массу хлора, порция которого содержит 1,2 ∙ 1023 молекул
С3. Вычислите объем газа (при н.у.) выделившегося при взаимодействии 60г известняка, содержащего 25% примесей с избытком соляной кислоты.
multiurok.ru
ТЕСТОВАЯ КОНТРОЛЬНАЯ РАБОТА № 2 (11 класс)
Вариант 2
ЧАСТЬ 1
При выполнении заданий этой части для каждого задания (1 – 10) запишите цифру, которая соответствует номеру выбранного вами ответа.
Задание 1.
Реакция, уравнение которой
CaCO3 (к)→ CaO(к) + CO2 (г) – Q, относится к реакциям
1) соединения, экзотермическим
2) разложения, эндотермическим
3) соединения, эндотермическим
4) разложения, экзотермическим
Задание 2.
Для увеличения скорости химической реакции
Fe(тв) + 2H+ = Fe2+ + Н2 (г), необходимо
1) увеличить концентрацию ионов железа
2) добавить несколько кусочков железа
3) уменьшить температуру
4) увеличить концентрацию кислоты
Задание 3.
Согласно термохимическому уравнению
C2h5 + h3 → C2H6 + 311,4 кДж ,можно утверждать, что при образовании 2 моль этана
1) выделяется 311,4 кДж теплоты
2) поглощается 311,4 кДж теплоты
3) выделяется 622,8 кДж теплоты
4) поглощается 622,8 кДж теплоты
Задание 4.
Химическое равновесие в системе
CO2 (г) + C (тв) →2CO (г) – Q , сместится вправо
1) при повышении давления
2) при понижении температуры
3) при повышении концентрации СO
4) при повышении температуры
Задание 5.
Уравнением электролитической диссоциации является:
1) CaCO3→ CaO + CO2
2) Ch4COONa + h3O →CН3COOH + NaOH
3) Nh5Cl →Nh4 + HCl
4) h4PO4→ H+ + h3PO4–
Задание 6.
Слабым электролитом является
1) хлороводородная кислота
2) сульфат натрия
3) сероводородная кислота
4) гидроксид лития
Задание 7.
Только сильные электролиты перечислены в ряду:
1) KOH, HNO3, h3SO4
2) h3S, h3SO3, h3SO4
3) MgCl2, Ch4COOH, NaOH
4) h3S, Ch4COOH, h3SO3
Задание 8.
Реакцией ионного обмена, идущей в водном растворе до конца, является взаимодействие
1) сульфата аммония и хлорида бария
2) серной кислоты и нитрата натрия
3) сульфата натрия и соляной кислоты
4) нитрата калия и сульфата натрия
Задание 9.
В реакции магния с разбавленной азотной кислотой восстановителем является:
1) Mg2+;
2) H+;
3) Mg0;
4) NO3-.
Задание 10.
Коэффициент перед формулой окислителя в уравнении реакции, схема которой
h3S + I2 → S + HI, равен
1) 1
2) 2
3) 3
4) 4
Ответом к заданиям 11-12 является набор чисел и букв, которые следует записать как соответствия, например: 1-А, 2-Д, 3-Г, 4-В.
Задание 11.
Установите соответствие между реагентами и ионно-молекулярным уравнением реакции.
РЕАГЕНТЫ
ИОННО-МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ
1)
NaOH + HNO3
А)
CaCO3 + 2H+ = Ca2+ +h3O + CO2
2)
Na2CO3 + HCl
Б)
CO32– + h3O = HCO3– + OH–
3)
Na2CO3 + CO2 + h3O
В)
OH– + H+ = h3O
4)
CaCO3 + HCl
Г)
CO32– + 2H+ = CO2 + h3O
Д)
CO32– + CO2 + h3O = 2HCO3–
Задание 12.
Установите соответствие между солью и реакцией среды в ее водном растворе.
СОЛЬ
РЕАКЦИЯ СРЕДЫ
1)
нитрат бария
А)
кислая
2)
хлорид железа (III)
Б)
нейтральная
3)
сульфат аммония
В)
щелочная
4)
ацетат калия
ЧАСТЬ 2
При ответе на задания этой части запишите полный ответ.
Задание 13.
Напишите уравнение реакции взаимодействия цинка с концентрированной серной кислотой при нагревании. Расставьте коэффициенты с помощью метода электронного баланса. Определите окислитель и восстановитель.
Zn + h3SO4 (конц.)→ ZnSO4+ h3S↑ + …
Задание 14.
Имеются растворы гидроксида натрия, хлорида железа (III), азотной кислоты, карбоната натрия. Напишите 4 уравнения реакций, протекающих между ними.
Примерное распределение времени, отводимое на выполнение отдельных заданий составляет:
для каждого задания части 1–1-2 минуты;
для каждого задания части 2 – 5-7 минут;
для каждого задания части 3 – до 10-12 минут.
ОТВЕТЫ (Вариант 2):
№
Вариант ответа
Оценка
1
2
1
2
4
1
3
3
1
4
4
1
5
4
1
6
3
1
7
1
1
8
1
1
9
3
1
10
1
1
11
ВГДА
2
12
БААВ
2
13
4Zn + 5h3SO4 (конц.)→ 4ZnSO4+ h3S↑ + 4h3О
Zn0-2е→ Zn+2 2 4 восст-ль, пр. окис-я
8
S+6+8е→ S-2 8 1 окис-ль, пр. восс-я
3
14
1) Nа2СO3 + 2HNO3 = 2 NаNO3 + h3O + СO2↑
2) 2 FeCl3 + 2Nа2СO3 + 2h3O = 2Fe (ОH)3↓+3СO2↑+ +6NаCl
3) NaOH + HNO3 = NаNO3 + h3O
4) FeCl3 + 3NaOH= Fe (ОH)3↓+3NаCl
или FeCl3+ 2HNO3= Fe (NO3)3+3НCl
4
Оценивание выполненных тестов рассчитано из следующих норм:
при выполнении 85% работы и более – оценка «5»,
при выполнении менее 85% , но более 70% работы – оценка «4»
при выполнении менее 70% , но более 50% работы – оценка «3».
Оценки за тестовый вариант контрольной работы:
10 - 13 баллов – оценка «3».
14-17 баллов – оценка «4»
18-21 балл – оценка «5».
infourok.ru