
 .Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок поставь - , если выделяется в виде газа поставь
.Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок поставь - , если выделяется в виде газа поставь Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 1 1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
К2О Аl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 h4PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 ® CuO Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать оксид натрия: HCl, CaO, CO2, h3O, Ba(OH)2. Напишите уравнения осуществимых реакций.
4. Оксид углерода (IV) прореагировал с оксидом кальция массой 504 грамма. Найдите массу образовавшейся соли.
---------------------------------------------------------------------------------------------------------------------------------------------------------
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 2
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
h3S Al(NO3)3 h3СО3 Ca(OH)2 Fe(OH)3 NaCl Fe2O3 h3SiO3 CO CaCO3 h3O Mg(OH)2 P2O5
2. Дана схема превращений. Составьте уравнения реакций.
Ba ® BaO → Ba(OH)2 ® BaCl2 ® Ba(NO3)2
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: Mg(OH)2, h3O, Fe, Ba(NO3)2, MgO. Напишите уравнения осуществимых реакций.
4. 655 граммoв oксида углерода (IV) прореагировалo с оксидом кальция. Найдите массу образовавшейся соли. -------------------------------------------------------------------------------------------------------------------------------------------------------Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 3
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
N2O5 h3SO3 CuOH Ca(OH)2 SO3 h4PO4 Mg(NO3)2 NaOH Na3PO4 FeCl3 Na2O h3SO4 h3S
2. Дана схема превращений. Составьте уравнения реакций.Zn ® ZnO → ZnCl2 ®Zn(OH)2 ® ZnO
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать гидроксид бария: HCl, CO2, CaO, Na2SO4, h3O. Напишите уравнения осуществимых реакций.
4. 504 грамма оксида углерода(IV) прореагировало с оксидом кальция. Найдите массу образовавшейся соли.
--------------------------------------------------------------------------------------------------------------------------------------------------------
Контрольная работа №3 «Основные классы неорганических веществ» (8 класс)
Вариант № 4
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
FeO Ba(OH)2 SO2 Ca(OH)2 HCl Cu(OH)2 h3S Na2SO4 h3CO3 Cu Cl2 NaNO3 K3PO4 P2O3
2. Дана схема превращений. Составьте уравнения реакций.Fe ® FeCl2 ® Fe(NO3)2 → Fe (OH)2 ® FeO
Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать хлорид бария: h3SO4, Na2СО3, AgNO3, Fe, NaOH.
Напишите уравнения осуществимых реакций
4. Оксид углерода (IV) прореагировал с оксидом кальция массой 655 грамма. На
nsportal.ru
Контрольная работа по теме «Основные классы неорганических соединений» Вариант 1
А-1. Формулы только кислот приведены в ряду
1) НСl, NaCl, HNO3
2) h3SO3, h3SO4, h3S
3) Ca(OH)2, h4PO4, Ca3(PO4)2
4) Na2O, NaNO3, HNO3
А-2. Формулы только щелочей приведены в ряду
1) Fe(OH)2, KOH, Ва(ОН)2
2) NaOH, Ca(OH)2, Cu(OH)2
3) KOH, NaOH, LiOH
4) Fe(OH)3, Cu(OH)2, NaOH
A-3. Оксид, который реагирует с гидроксидом натрия, образуя соль:
1) Fe2O3 2) К2О
3) SO3 4) BaO
A-4. Взаимодействие оксида с водой относится к реакциям
1) соединения 2) обмена
3) разложения 4) замещения
А-5. Свойство, которое является общим для нерастворимых оснований и щелочей,— это:
1) взаимодействие с кислотными оксидами
2) взаимодействие с кислотами
3) взаимодействие с солями
4) разложение
В-1. Даны формулы веществ:
FeO, K2O, CO2, MgO, CrO, CrO3, SO2, Р2О5
Выпишите формулы только основных оксидов.
В-2. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит. 1) MgO А. кислоты
2) Н3РО4 Б. щелочи
3) Аl(ОН)3 В. оксиды
4) NaOH Г. нерастворимые основания
B-3. Назовите следующие соединения:
CaCl2 _________________________________________
Na3PO4 _______________________________________
h3SO4 ________________________________________
C-1. Допишите правую или левую часть уравнения химических реакций
1) ... + ... → MgCl2 + Н2
2) LiОН + SO3 →
C-2 Распределите вещества по классам:
Mg(OH)2, CaCl2, BaO, h4PO4, Fe(OH)2, SiO2, HCl, Na2O, KOH, CO2, h3SO4, HgO,SO2,Na3PO4, HNO3
Оксиды
Основания
Кислоты
Соли
С-3 Осуществите цепочку превращений
Mg→MgO→Mg(OH)2→MgCl2
Контрольная работа по теме «Основные классы неорганических соединений» Вариант 2
А-1. Формулы только солей приведены в ряду
1) K2СО3, Н2СО3, KOH
2) АlСl3, Al(NO3)3, Al2S3
3) h3S, Ba(NO3)2, BaCl2
4) Cu(OH)2, CuSO4, CuS
A-2. Формулы только бескислородных кислот приведены в ряду
1) НСl, HNO3, h3S
2) h3SO3, h3S, HNO2
3) Н3РО4, Н2СО3, h3S
4) h3S, HF, HCl
A-3. Оксид, который реагирует с кислотой, образуя соль, — это
1) Р2О5 2) СuО
3) SO2 4) СО2
А-4. Химическая реакция, уравнение которой
K2О + 2HNO3 = 2KNO3 + Н2О, относится к реакциям
1) разложения 2) соединения
3) обмена 4) замещения
А-5. Реакция между кислотой и основанием называется:
1) реакцией соединения 2) реакцией разложения
3) реакцией нейтрализации 4) реакцией гидратации
В-1. Даны формулы веществ:
СО2, Na2O, СаО, МnО, Мn2О7, Сl2О7, Li2O, P2O5
Выпишите формулы только кислотных оксидов.
В-2. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3 А. нитрат меди(П)
2) Cu(NO3)2 Б. карбонат калия
3) Al2(SO4)3 В. хлорид железа(III)
4) K2СО3 Г. нитрит меди(II)
Д. сульфат алюминия
B-3. Назовите следующие соединения:
Fe(OH)3 _________________________________________
CO2 ____________________________________________
h3SiO3 __________________________________________
С-1. Допишите правую или левую часть уравнения химических реакций
1) ... + KOH → Fe(OH)3 + ...
2) Ва(ОН)2 + SO2 →
C-2 Распределите вещества по классам:
HCl, Na2O, KOH, h3SO4,HCl,CO2,Al2(SO4)3, HgO,SO2,Na3PO4, Fe(OH)3,h3SiO3, Fe(NO3)3, Fe(OH)2, SiO2,
Оксиды
Основания
Кислоты
Соли
С-3 Осуществите цепочку превращений
S →SO2 → h3SO3→Na2SO3
doc4web.ru
Контрольная работа №3 по теме «Основные классы неорганических соединений» Вариант 1 8 класс
1. К кислотам относится каждое из 2-х веществ:а) h3S, Na2CO3 б) K2SO4, Na2SO4 в) h4PO4, HNO3 г) KOH, HCl
2. Расставьте коэффициенты, определи тип каждой реакции – соединение, разложение, замещение, обмена :
1) Fe(OH)3 = Fe2O3 + h3O; 2)Mg(OH)2 + HCl = MgCl2 + h3O; 3)ZnO+ Н2 → Zn + h3O; 4)N2 + O2 = NO.
3
 .Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок поставь - , если выделяется в виде газа поставь
.Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок поставь - , если выделяется в виде газа поставь
1) Карбонат кальция взаимодействует с соляной кислотой, образуя хлорид кальция, воду и оксид углерода (IV) 2)Нитрат серебра взаимодействует с хлоридом калия, образуя хлорид серебра и нитрат калия
4. Осуществите цепочку следующих превращений:
а) S → SO2 → SO3 → h3SO4 → ZnSO4
5. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Контрольная работа №3 по теме «Основные классы неорганических соединений» Вариант 2 8 класс
1. К основаниям относится каждое из 2-х веществ:а) h3O, Na2O; б) KOH, NaOH; в) HPO3, HNO3 ; г) KOH, NaCl.
2. Расставьте коэффициенты, определи тип каждой реакции – соединение, разложение, замещение, обмена. 1)NaOH + HI = NaI + h3O 2)K + O2 = K2O 3)HgO→ Hg + O2 4)Fe2O3 + h3 = Fe +h3O
3
 .Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок – поставь- если выделяется в виде газа - .
.Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок – поставь- если выделяется в виде газа - .
1) Карбонат натрия взаимодействует хлоридом кальция, при этом образуются карбонат кальция и хлорид натрия 2) Железо взаимодействует с соляной кислотой, при этом выделяется водород и образуется хлорид железа (II)
4. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
5. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Контрольная работа №3 по теме «Основные классы неорганических соединений» Вариант 1 8 класс
1. К кислотам относится каждое из 2-х веществ:а) h3S, Na2CO3 б) K2SO4, Na2SO4 в) h4PO4, HNO3 г) KOH, HCl
2. Расставьте коэффициенты, определи тип каждой реакции – соединение, разложение, замещение, обмена :
1) Fe(OH)3 = Fe2O3 + h3O; 2)Mg(OH)2 + HCl = MgCl2 + h3O; 3)ZnO+ Н2 → Zn + h3O; 4)N2 + O2 = NO.
3
 .Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок поставь - , если выделяется в виде газа поставь -
.Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок поставь - , если выделяется в виде газа поставь -
1) Карбонат кальция взаимодействует с соляной кислотой, образуя хлорид кальция, воду и оксид углерода (IV) 2)Нитрат серебра взаимодействует с хлоридом калия, образуя хлорид серебра и нитрат калия
4. Осуществите цепочку следующих превращений: а) S → SO2 → SO3 → h3SO4 → ZnSO4
5. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Контрольная работа №3 по теме «Основные классы неорганических соединений» Вариант 2 8 класс
1. К основаниям относится каждое из 2-х веществ:а) h3O, Na2O; б) KOH, NaOH; в) HPO3, HNO3 ; г) KOH, NaCl.
2. Расставьте коэффициенты, определи тип каждой реакции – соединение, разложение, замещение, обмена. 1)NaOH + HI = NaI + h3O 2)K + O2 = K2O 3)HgO→ Hg + O2 4)Fe2O3 + h3 = Fe +h3O
3
 .Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок – поставь- если выделяется в виде газа - .
.Составьте уравнение реакции по описанию, не забудь поставить коэффициенты. Если один из продуктов реакции выпадает в осадок – поставь- если выделяется в виде газа - .
1) Карбонат натрия взаимодействует хлоридом кальция, при этом образуются карбонат кальция и хлорид натрия 2) Железо взаимодействует с соляной кислотой, при этом выделяется водород и образуется хлорид железа (II)
4. Осуществите цепочку следующих превращений: а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
5. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Таблица ответов.
| 1 вариант | 2 вариант |
| 1 в | 1б |
| 2 б | 2 г |
| 3 а | 3 в |
| 4 б | 4 в |
| 5 б | 5 г |
| 6 в | 6 а |
| 7 а | 7 г |
| 8 - 253 | 8 - 253 |
| 10- 87 г | 10 – 46,6 г |
videouroki.net
Контрольная работа
по теме «Основные классы неорганических соединений»Вариант 1
1. К кислотам относится каждое из 2-х веществ:а) h3S, Na2CO3 б) K2SO4, Na2SO4 в) h4PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) сера в) кальций г) магний
6. К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
7. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ
Продукты взаимодействия
а) Mg + HCl →
1) MgCl2
б) Mg(OH)2 + CO2 →
2) MgCl2 + h3
в) Mg(OH)2 + HCl →
3) MgCl2 + h3O
4) MgCO3 + h3
5) MgCO3 + h3O
9. Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
б) S → SO2 → SO3 → h3SO4 → ZnSO4
Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Вариант 2
1. К основаниям относится каждое из 2-х веществ:а) h3O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ
Продукты взаимодействия
а) Fe + HCl →
1) FeCl2
б) Fe(OH)2 + CO2 →
2) FeCl2 + h3
в) Fe(OH)2 + HCl →
3) FeCl2 + h3O
4) FeCO3 + h3
5) FeCO3 + h3O
9. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2→ MgO
б) C → CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Таблица ответов.
1 вариант
2 вариант
1 в
1б
2 б
2 г
3 а
3 в
4 б
4 в
5 б
5 г
6 в
6 а
7 а
7 г
8 - 253
8 - 253
10- 87 г
10 – 46,6 г
doc4web.ru
Контрольная работа
по теме «Основные классы неорганических соединений»Вариант 1
1. К кислотам относится каждое из 2-х веществ:а) h3S, Na2CO3 б) K2SO4, Na2SO4 в) h4PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) сера в) кальций г) магний
6. К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
7. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Продукты взаимодействия | |
| а) Mg + HCl → | 1) MgCl2 |
| б) Mg(OH)2 + CO2 → | 2) MgCl2 + h3 |
| в) Mg(OH)2 + HCl → | 3) MgCl2 + h3O |
| 4) MgCO3 + h3 | |
| 5) MgCO3 + h3O |
9. Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
б) S → SO2 → SO3 → h3SO4 → ZnSO4
Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Вариант 2
1. К основаниям относится каждое из 2-х веществ:а) h3O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Продукты взаимодействия | |
| а) Fe + HCl → | 1) FeCl2 |
| б) Fe(OH)2 + CO2 → | 2) FeCl2 + h3 |
| в) Fe(OH)2 + HCl → | 3) FeCl2 + h3O |
| 4) FeCO3 + h3 | |
| 5) FeCO3 + h3O |
9. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2→ MgO
б) C → CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Таблица ответов.
| 2 вариант | |
| 1 в | 1б |
| 2 б | 2 г |
| 3 а | 3 в |
| 4 б | 4 в |
| 5 б | 5 г |
| 6 в | 6 а |
| 7 а | 7 г |
| 8 - 253 | 8 - 253 |
| 10- 87 г | 10 – 46,6 г |
globuss24.ru
Из приведенного перечня выпишите отдельно формулы и укажите названия: а) оксидов, б) оснований, в) кислот, г) солей.
Ca(OH)2, Na2O, HNO3, ZnS, SiO2, MgCO3, CO2, LiOH, BaSO4,
Na2HPO4, Nh5NO3, HCN, KCl, Nh4, AlPO4.
Один из технических способов получения сажи состоит в нагревании оксида углерода (II) под давлением в присутствии катализаторов. Составьте уравнение происходящей при этом реакции, зная, что образующийся наряду с сажей газ может поглощаться раствором щелочи.
Какие из перечисленных веществ будут взаимодействовать с СаО:
h3О, НCl, NaOH, CuO, S, HNO3, O2, h3, SiO2.
Напишите уравнения соответствующих реакций.
4) У каких солей валентность основного остатка равна I ?
а) AlOHSO4 в) (CuOH)2CO3
б) KAl(SO4)2 г) BiOH(NO3)2
5) К раствору, содержащему 8,5 г нитрата серебра, прибавили 3,9 г хлорида бария. Определите массу вещества, оставшуюся в растворе после образования осадка.
Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, ортофосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, перманганата натрия, гидрокарбоната магния, дигидрофосфата калия.
Хлорид цинка получают на производстве, исходя либо из цинка, либо из его оксида. Чем нужно обработать эти вещества, чтобы получить хлорид цинка? Напишите уравнения соответствующих реакций.
Напишите уравнения химических превращений, протекающих по схеме:
Fe2O3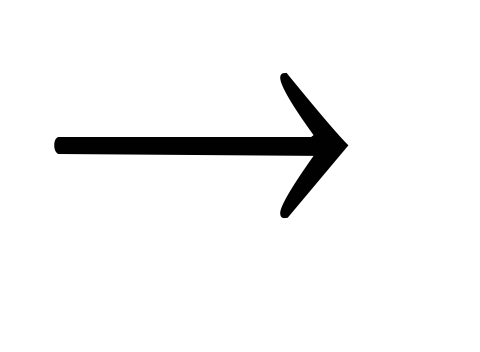 Fe(OH)3
Fe(OH)3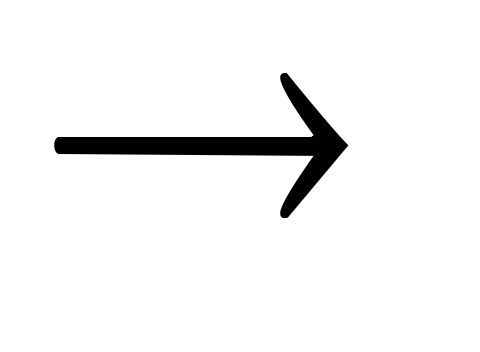 FeCl3
FeCl3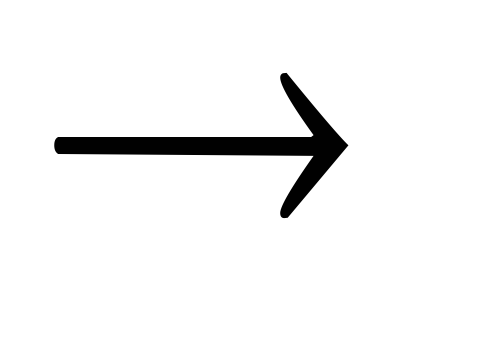 Fe(NO3)3
Fe(NO3)3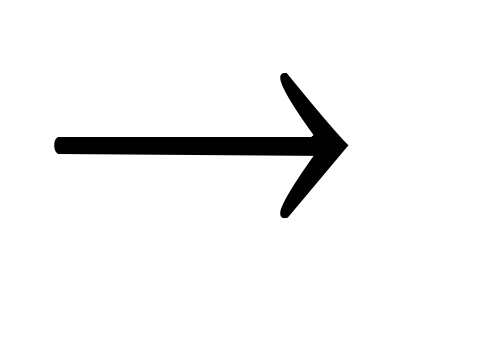 Fe2O3
Fe2O3
В каких соединениях, степень окисления элемента, входящего в состав кислотного остатка, равна +4.
1. СaHPO4 4. K2SO3
2. NaNO2 5. Mg(HS)2
3. Al2(SO4)3 6. SrCO3
Сколько граммов металлической меди образовалось, если в реакцию с алюминием вступило 3 г оксида меди (II)?
Составьте названия следующих солей: СuBr2, Ca(NO3)2, FeCl2, Mg(HCO3)2, Na2SiO3, K2Cr2O7, Fe(OH)SO4, (CuOH)2CO3, KClO3, Al2(SO4)3, KMnO4, FeS.
Как из негашеной извести СаО получить хлорид кальция и нитрат кальция? Напишите уравнения реакций.
Напишите уравнения химических превращений, протекающих по схеме:
Na 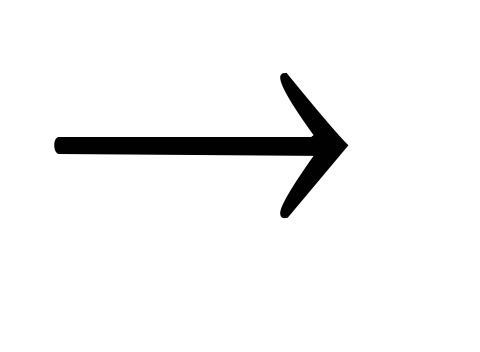 NaOH
NaOH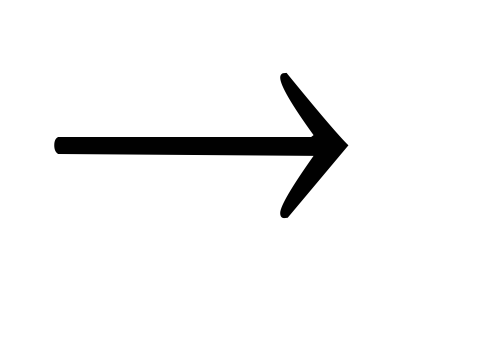 Na2SO4
Na2SO4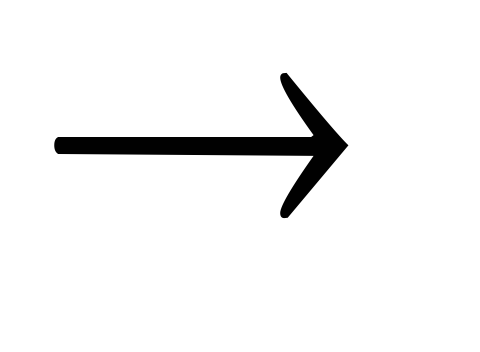 NaNO3
NaNO3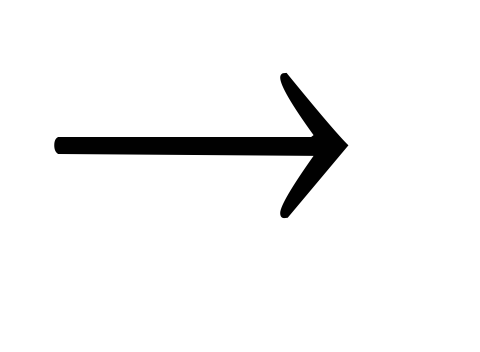 NaNO2
NaNO2
В каких соединениях, степень окисления элемента, входящего в состав кислотного остатка, равна +5.
1. Na2Cr2O7 4. Ag3PO4
2. HNO2 5. ZrSO3
3. K2CO3 6. Ca(ClO3)2
При паянии употребляют так называемую травленую кислоту. Приготовляют ее действием цинка на соляную кислоту до прекращения реакции. Напишите уравнение и рассчитайте, сколько граммов цинка пойдет на травление кислоты, содержащей 12 г HCl.
studfiles.net
ВАРИАНТ I
1. В состав оксидов входит два элемента, один из которых: а) гидроген; б) оксиген; в) сульфур.
2. Дайте определение кислотам. Приведите примеры кислот.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CaO, h3SO4, SiO2, NaOH, KCl, Ca(OH)2, Al2(SO4)3, Cu(OH)2, K2O, NaCl, Cl2O7, Ba(OH)2, P2O3. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: P(III), Ba. Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 481023 молекул Ch5.
7. Какое количество вещества соответствует 111 г манган (VII) оксиду?
ВАРИАНТ II
1. Формула натрий оксида: а) Na2O; б) NaOH; в) HCl.
2. Какие меры предосторожности необходимо соблюдать при работе с щелочами? Приведите примеры щелочей.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CO2, CuCl2, NaOH, h3SO4, K2SiO3, AlPO4, SnO2, PbI2, CuO, CaO, SiO2, Na2O, CaCl2, Ba(OH)2, P2O3. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: C(II), Mn(III). Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 181023 молекул CO.
7. Какова масса калий оксида количеством вещества 0,5 моль?
ВАРИАНТ III
1. Физические свойства воды: а) при обычных условиях – жидкость, не имеет цвета, вкуса и запаха, хороший растворитель; б) при обычных условиях – газ бурого цвета; в) при обычных – твердое вещество, имеет температуру кипения – 150 С.
2. Дайте определение индикаторам. Как они изменяют свою окраску в растворах щелочей.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CO2, Na2SO4, CuO, K2O, Cl2O5, BaO, P2O5, CaCl2, Li2SO4, CaSiO2, NaCl, Cl2O7, Ba(OH)2, P2O3. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: N(II), K. Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 301023 молекул C3H8.
7. Какое количество вещества соответствует 55 г фосфор (III) оксида?
ВАРИАНТ IV
1. В формулах кислот на первом месте стоит атом: а) гидрогена; б) оксигена; в) сульфура.
2. Дайте определение солей. Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: NaOH, Mn(OH)2, KCl, Ca(OH)2, Al2(SO4)3, Cu(OH)2, K2O, CO2, CuCl2, NaOH, h3SO4, K2SiO3, AlPO4, SnO2, PbI2, CuCl2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Sn(IV), Na. Назовите их.
5. Составьте формулы солей: цинк сульфида, натрий сульфита, калий сульфата, феррум (ІІІ) нитрата.
6. Определите объем, массу и количество вещества (н. у.) 61023 молекул Snh5.
7. Какова масса аурум (І) оксида количеством вещества 1,5 моль?
ВАРИАНТ V
1. Лакмус изменяет свой цвет в присутствии кислот: а) на синий; б) на красный; в) на фиолетовый.
2. Какие оксиды наиболее широко распространены в природе? Какие природные вещества они образуют?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: HCl, NaCl, h3O, h3SO4, CuO, HNO3, CO, FeO, Li2SO4, Al2(SO3)3, h3SO4, SO3, CuOH, SnSO4, h4PO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Cr(III), Li. Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 151023 молекул NO2.
7. Какое количество вещества соответствует 79 г манган (III) оксиду?
ВАРИАНТ VI
1. Щелочами называют: а) нерастворимые основания; б) растворимые основания; в) любые основания.
2. Что такое кислоты? Как классифицируются кислоты? Приведите примеры.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Mg(OH)2, Cu(OН)2, KOH, h3SO4, Zn(OH)2, P2O5, h3O, FeCl3, СrCl3, NaOH, ZnSO4, FePO4, Na2O. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: P(V), Al. Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 91023 молекул C2h3.
7. Какова масса аргентум (І) оксида количеством вещества 2 моль?
ВАРИАНТ VII
1. Формула карбон (II) оксида: а) СО; б) СО2; в) СаО.
2. Какие меры предосторожности необходимо соблюдать при работе с кислотами? Почему?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: K2O, NaOH, SO2, LiOH, Fe(OH)2, Zn(OH)2, MgO, CaCO3, Сa2SO4, Cu(OH)2, Cl2O5, BaCl2, P2O5. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Ba, Mn(IV). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 121023 молекул HI.
7. Какое количество вещества соответствует 88 г нитроген (I) оксида?
ВАРИАНТ VIII
1. При разбавлении кислот следует вливать: а) воду в кислоту; в) кислоту в воду.
2. Какие вещества называются индикаторами? Какие индикаторы вы знаете? Как они изменяют свою окраску в растворах кислот?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Pb(OH)2, KOH, NO2, CaCl2, Li2SO4, CaSiO2, NaCl, Cl2O7, Ba(OH)2, P2O3, Zn(OH)2, KMnO4, SO3, Sn(OH)2, SiO2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Cr(II), S(VI). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 361023 молекул N2O5.
7. Какова масса сульфур (VI) оксида количеством вещества 3,5 моль?
ВАРИАНТ IX
1. В состав оснований обязательно входит: а) гидроксогруппа; б) кислотный остаток; в) неметалл.
2. Охарактеризуйте физические свойства солей. Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CO2, CuCl2, NaOH, h3SO4, K2SiO3, AlPO4, SnO2, FeO, Na2SO4, Al2(SO4)3, K2SO4, BaSO3, CuOH, CaSO4, PbI2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: N(I), Br(VII). Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 421023 молекул C2H6.
7. Какое количество вещества соответствует 71 г манган (IІ) оксиду?
ВАРИАНТ X
1. При нормальных условиях оксиды – это вещества: а) только газообразные; б) только жидкие; в) только твердые; г) газообразные, жидкие и твердые.
2. Дайте определение основаниям. Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: K2O, NaOH, SO2, Na2O, Al(OH)3, P2O5, Вe(OH)2, NaОН, Zn(OH)2, LiOH, h4PO4, FeO, Zn(OH)2, MgO. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Fe(III), Ba. Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 211023 молекул HBr.
7. Какова масса нитроген (V) оксида количеством вещества 1,5 моль?
ВАРИАНТ XI
1. Фенолфталеин в присутствии кислот изменяет свой цвет на: а) красный; б) малиновый; в) остается неизменным.
2. Какие основания называют щелочами? Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: KOH, ZnO, HCl, Na2O, SO3, FeCl3, Fe2O3, BaCl2, Mg(OH)2, CuO, KOH, h3SO4, Zn(OH)2, P2O5, h3O. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Ni(III), Cr(II). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 31023 молекул Pbh5.
7. Какое количество вещества соответствует 284 г фосфор (V) оксида?
ВАРИАНТ XII
1. Формула натрий гидроксида: а) h3SO4; б) Na2SO4; в) NaOH.
2. Какие классы веществ вам известны? Приведите примеры.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Na2O, SO3, KCl, Cl2O7, h3SO4, NaOH, P2O5, CaCO3, Na2SO4, Cu(OH)2, K2O, Cl2O5, BaCl2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Mg, S(VI). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 421023 молекул N2O.
7. Какова масса барий оксида количеством вещества 0,5 моль?
ВАРИАНТ XIII
1. Формула силиций (IV) оксида – основной составляющей части песка: а) SiO2; б) SO2; в) Sih5.
2. Каковы физические свойства кислот?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: MgSO4, P2O5, Ag2O, CaO, FeCl3, HCl, NaOH, ZnSO4, FePO4, Na2O, BaO, Fe(NO3)3, CO2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: N(V), Mg. Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 151023 молекул SO3.
7. Какое количество вещества соответствует 31 г натрий оксида?
ВАРИАНТ XIV
1. Валентность кислотного остатка равна: а) числу атомов оксигена в молекуле; б) числу атомов гидрогена в молекуле; в) общему числу атомов в молекуле.
2. Каковы физические свойства оксидов?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: FeO, KOH, NO2, KMnO4, SO3, ZnCl2, Si2O, LiCl, NaCl, h3O, K2SO4, CuO, Al(NO3)3, CO, Na3PO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Cu(II), Zn. Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 301023 молекул Sih5.
7. Какова масса сульфур (IV) оксида количеством вещества 3 моль?
ВАРИАНТ XV
1. Оксиды – это: а) сложные вещества; б) простые вещества; в) и простые и сложные вещества.
2. Как классифицируются основания. Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Cu2O, h3S, B2O3, KOH, ZnSO4, KCl, Na2O, MgSO3, FeCl3, Fe(OH)3, BaCl2, h3SO3, HNO3, CuS. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Ca, Mn(V). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 91023 молекул N2O5.
7. Какое количество вещества соответствует 261 г манган (IV) оксиду?
ВАРИАНТ XVI
1. Вещества, которые изменяют свою окраску под действием кислот или щелочей, называются: а) ингибиторами; б) индикаторами; в) катализаторами.
2. Каковы физические свойства воды?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Na2O, SO3, KCl, Cl2O7, h3SO4, NaOH, Al(OH)3, P2O5, NaCl, Fe(OH)2, LiOH, h4PO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Pb(II), Cl(I). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 361023 молекул C2h3.
7. Какова масса нитроген (III) оксида количеством вещества 4 моль?
ВАРИАНТ XVII
1. Формула натрий сульфата: а) h3SO4; б) Na2SO4; в) NaOH.
2. Дайте определение солей. Как они распространены в природе?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CO, CaO, O2, Mn2O3, HCl, K2O, NaOH, SO2, LiOH, Fe(OH)2, Zn(OH)2, MgO, Al2O3, NO2, NaOH. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Zn, S(IV). Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 121023 молекул NO.
7. Какое количество вещества соответствует 32 г купрум (ІІ) оксида?
ВАРИАНТ XVIII
1. Формула воды: а) НСl; б) Н2О; в) Н2О2.
2. Какова роль солей в природе и хозяйственной деятельности человека?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: K2O, NaOH, SO2, LiOH, Fe(OH)2, Zn(OH)2, MgO, CaCO3, Сa2SO4, Cu(OH)2, Cl2O5, BaCl2, P2O5. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: N(III), Na. Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 241023 молекул h3S.
7. Какова масса силиций (IV) оксида количеством вещества 2 моль?
ВАРИАНТ XIX
1. Вещества, формулы которых KOH, Fe(OH)2, NaOH, называются: а) солями; б) кислотами; в) основаниями.
2. На какие группы делятся неорганические вещества? Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: FeO, Na2SO4, Al2(SO4)3, h3SO4, SO3, Na2СO3, SO3, KCl, Cl2O7, К2SO4, NaOH, FePO3, CuOH, CaSO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: K, Mn(VII). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 361023 молекул Ph4.
7. Какое количество вещества соответствует 9,4 г калий оксида?
ВАРИАНТ XX
1. Соли образованы: а) атомами металлов и кислотными остатками; б) атомами металлов и гидроксогруппами; в) атомами водорода и кислотнами остатками.
2. Каковы физические свойства оснований? Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Cu2O, h3SO4, SiO2, NaCl, Cl2O5, Mg(OH)2, h3CO3, SO2, h3SiO3, KNO2, NaOH, Be(OH)2, Ni(OH)2, Ba(OH)2, P2O5. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Co(II), Mg. Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 61023 молекул HCl.
7. Какова масса кальций оксида количеством вещества 2,5 моль?
ВАРИАНТ XXI
1. Формула хлоридной кислоты: а) HCl; б) KCl; в) Mg(OH)2.
2. Как кислоты распространены в природе?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: MgO, P2O3, Ag2O, BaO, Fe(NO3)3, CO, FeO, Na2SO4, Al2(SO4)3, h3SO4, SO3, CuOH, CaSO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Cu(I), Cl(VII). Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 121023 молекул SO2.
7. Какое количество вещества соответствует 14,4 г феррум (ІІ) оксида?
ВАРИАНТ XXII
1. При нормальных условиях кислоты – это вещества: а) газообразные; б) жидкие; в) твердые.
2. Какие вещества называются сложными? На какие классы подразделяются сложные неорганические вещества? Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Mg(OH)2, CuO, KOH, h3SO4, Zn(OH)2, P2O5, h3O, Mg(OH)2, HMnO4, Cu(NO3)2, h3O, K2S, Fe2(SO4)3, AgCl. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Ni(II), Li. Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 421023 молекул C2h5.
7. Какова масса нитроген (II) оксида количеством вещества 0,5 моль?
ВАРИАНТ XXIII
1. По составу кислоты делятся на: а) одно-, двух- и трехосновные; б) кислородсодержащие и бескислородные; в) простые и сложные.
2. Опишите физические свойства гидроген оксида.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: KOH, CaO, HCl, N2O, SO2, FeCl3, MgSO4, P2O5, AgOH, CaO, Ba(OH)2, Fe(OH)3, CO2, FeO, BaCl2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Pb(IV), Ca. Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 31023 молекул Sih5.
7. Какое количество вещества соответствует 15,3 г барий оксида?
ВАРИАНТ XXIV
1. Индикатором на кислоты не является: а) метиловый оранжевый; б) фенолфталеин; в) лакмус.
2. Охарактеризуйте физические свойства натрий хлорида.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: h3S, NaCl, h3O, h3SO4, CuO, HNO3, CO, Ca(NO3)2, O2, MnCO3, HCl, Al2(SO3)3, KNO2, NaOH , HPO3. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Na, Cl(V). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 181023 молекул HBr.
7. Какова масса цинк оксида количеством вещества 0,4 моль?
ВАРИАНТ XXV
1. Формула нитратной кислоты: а) HCl; б) HNO3; в) h3S.
2. Что такое основания? Какой состав и названия они имеют? По какому признаку их подразделяют на группы?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: KOH, BaO, HCl, K2O, SO3, FeCl3, Co2O3, Fe(OH)2, KOH, NO2, KMnO4, SO3, Sn(OH)2, SiO2, BaCl2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Sn(II), S(II). Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 151023 молекул NO2.
7. Какое количество вещества соответствует 288 г купрум (I) оксида?
ВАРИАНТ XXVI
1. Индикатор фенолфталеин в растворах щелочей изменяет бесцветную окраску: а) на желтую; б) на фиолетовую; в) на малиновую.
2. Какие вещества относят к солям? Какие свойства они имеют?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: HCl, NaCl, h3O, h3SO4, CuO, HNO3, CO, Cu2O, Ca2S, B2O3, Li2SO3, Al(NO3)3, CuS, h4PO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Fe(II), Ag. Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 91023 молекул h3S.
7. Какова масса гидроген (II) оксида количеством вещества 5 моль?
ВАРИАНТ XXVII
1. h3SO4 – это: а) трехосновная кислота; б) двухосновная кислота; в) семиосновная кислота.
2. Чем является лакмус? Каково его значение?
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CO2, Na2SO4, CuO, K2O, Cl2O5, BaO, P2O5, CaCl2, Li2SO4, CaSiO2, NaCl, Cl2O7, Ba(OH)2, P2O3. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Al, Rb(I). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 361023 молекул N2O.
7. Какое количество вещества соответствует 11,2 г кальций оксида?
ВАРИАНТ XXVIII
1. Вещества, формулы которых KNO3, FeCl2, Na2SO4, называются: а) солями; б) кислотами; в) основаниями.
2. Какие вещества называются оксидами? Приведите примеры.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: Cu2O, h3S, B2O3, h3SO3, HNO3, CuS, h3SO4, Al(OH)3, P2O5, NaOH, Fe(OH)2, LiOH, h4PO4, KOH. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: C(IV), B(III). Назовите их.
5. Составьте формулы солей: барий нитрата, цинк хлорида, алюминий сульфата, калий силиката.
6. Определите объем, массу и количество вещества (н. у.) 121023 молекул Ph4.
7. Какова масса 5 моль феррум (II) оксида?
ВАРИАНТ XXIX
1. Формула сульфатной кислоты: а) НCl; б) h3SO4; в) h3SO3.
2. Какие вещества называют простыми? На какие группы они подразделяются? Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: CO2, CuCl2, NaOH, h3SO4, K2SiO3, AlPO4, SnO2, FeO, Na2SO4, Al2(SO4)3, K2SO4, BaSO3, CuOH, CaSO4, PbI2. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Co(III), Mn(II). Назовите их.
5. Составьте формулы солей: цинк хлорида, алюминий нитрата, натрий фосфата, магний карбоната.
6. Определите объем, массу и количество вещества (н. у.) 61023 молекул SO2.
7. Какое количество вещества соответствует 80 г магний оксида.
ВАРИАНТ XXX
1. Сложные вещества, состоящие из двух элементов одним из которых является оксиген, называются: а) кислотами; б) оксидами; в) основаниями.
2. На какие группы делятся вещества? Приведите примеры и назовите их.
3. Из приведенного списка выпишите отдельно формулы оксидов, кислот, оснований, солей: HNO2, h3S, B2O3, h3SO3, HNO3, Mg(OH)2, HMnO4, Cu(NO3)2, h3O, K2S, Fe2(SO4)3, AgCl, HCl, КОН, Н3РО4, HClO4. Назовите их. Укажите растворимость кислот, оснований и солей в воде.
4. Составить формулы оксидов элементов: Li, Cr(IV). Назовите их.
5. Составьте формулы солей: магний сульфата, кальций хлорида, цинк нитрата, аргентум (І) карбоната.
6. Определите объем, массу и количество вещества (н. у.) 31023 молекул Ch5.
7. Какова масса кальций оксида количеством вещества 0,6 моль?
infourok.ru