Как написать контрольную по химии? Химия контрольные
Контрольные работы по химии - Химия
РАЗРАБОТКИ | В категории разработок: 63 Фильтр по целевой аудитории - Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя  Образец Всероссийской проверочной работы по химии для 11 класса включает в себя 15 заданий. В их числе: 11 заданий базового уровня сложности с кратким и развёрнутым ответами (1–8, 11, 12, 15), 4 задания с развёрнутым ответом повышенного уровня сложности (9, 10, 13, 14) На выполнение работы по химии отводится 1 час 30 минут (90 минут). Всероссийская проверочная работа (ВПР) предназначена для итоговой оценки образовательных достижений выпускников средней школы, изучавших химию на базовом уровне. Источник: ФИПИ  
Целевая аудитория: для 11 класса На выполнение работы по химии даётся 90 минут. Диагностическая работа включает в себя 17 заданий. В НИКО по химии включены задания, выявляющие владение основополагающими химическими понятиями, теориями, законами и закономерностями, умение использовать химическую терминологию и символику. Рекомендованное время для проведения процедуры исследования: на 2-3 или 3-4 уроках. Во время проведения процедур исследования в каждой аудитории должно находиться не более 15 участников. В архиве находятся файлы с текстом демоверсии диагностической работы и файл с системой оценивания.  
Источник: НИКО Целевая аудитория: для 10 класса Одним из способов, для определения уровня подготовки обучающихся является организация входного контроля, направленного на выявление пробелов в знаниях, затрудняющих усвоение новой информации. Задания для входного контроля тестового типа по химии составлены на основе программы основной школы. Они предназначены для выявления уровня первичной информированности в возможности работы с химическими понятиями обучающихся, поступивших на I курс СПО. Проверочная работа позволяет выявить слабые стороны подготовки обучающихся, разделить их на группы по уровню владения материалом с целью оказания помощи тем обучающимся, у которых этот уровень невысок, позволяет скорректировать учебный процесс с целью повышения эффективности обучения. Целевая аудитория: для 10 класса Вариант ВПР по химии содержит 15 заданий различных типов и уровней сложности. В вариантах представлены задания различного формата. Данные задания имеют различия по требуемой форме записи ответа. В работе содержится 4 задания повышенного уровня сложности (их порядковые номера: 9, 10, 13, 14). Источник: ФИПИ  
Целевая аудитория: для 11 класса Контрольная работа составлена для итогового контроля по химии для учащихся 8 класса, которые изучают химию по учебнику Кузнецовой Н.Е.. 2 варианта, есть таблица ответов. Данная работа может быть использована на входном контроле в 9 классе. Целевая аудитория: для 8 класса Чтобы развивать ключевые компетентности в рамках школьной программы, преподавателю необходим инструмент. Таким инструментом являются компетентностно-ориентированные задания.Под ключевыми компетенциями применительно к школьному образованию понимается способность учащихся самостоятельно действовать в ситуации неопределённости при решении актуальных для них проблем. Выделяются три ключевые компетентности: компетентность разрешения проблем, информационную и коммуникативную компетентности. Целевая аудитория: для 8 класса Контрольная работа предназначен для контроля знаний учащихся 8 класса по теме «Важнейшие классы неорганических соединений». Контрольная работа состоит из трех вариантов, каждый из которых состоит из 10 вопросов. Контрольная работа включает в себя тестовые вопросы и задания с открытой формой ответа. Целевая аудитория: для 8 класса Данная контрольная работа является итоговой контрольной после изучения главы «Строение атома. Периодический закон и ПСХЭ Д.И. Менделеева. Химическая связь". Контрольная работа составлена на основе Государственного общеобязательного стандарта среднего образования и учебных программ. По уровню сложности контрольная работа двухуровневая. I уровень содержит задания базового уровня сложности, задания II уровня позволяют проверить, насколько учащиеся поняли и научились применять новые знания, умения в измененной ситуации. Многие задания носят личностно-ориентированный характер, прослеживается межпредметная связь с науками естественно-математического цикла. Целевая аудитория: для учителя Данная контрольная работа является итоговой контрольной после изучения главы «Первоначальные химические понятия».. Контрольная работа составлена на основе Государственного общеобязательного стандарта среднего образования и учебных программ. По уровню сложности контрольная работа двухуровневая. I уровень содержит задания базового уровня сложности, задания II уровня позволяют проверить, насколько учащиеся поняли и научились применять новые знания, умения в измененной ситуации. Многие задания носят личностно-ориентированный характер, прослеживается межпредметная связь с науками естественно-математического цикла. Целевая аудитория: для учителя Данная контрольная работа является итоговой контрольной после изучения главы «Водород. Окислительно-восстановительные реакции». Контрольная работа составлена на основе Государственного общеобязательного стандарта среднего образования и учебных программ. По уровню сложности контрольная работа двухуровневая. I уровень содержит задания базового уровня сложности, задания II уровня позволяют проверить, насколько учащиеся поняли и научились применять новые знания, умения в измененной ситуации. Многие задания носят личностно-ориентированный характер, прослеживается межпредметная связь с науками естественно-математического цикла. Целевая аудитория: для учителя | Конкурсы  Диплом и благодарность каждому участнику! | 
© 2007 - 2017 Сообщество учителей-предметников "Учительский портал"Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.Территория распространения: Российская Федерация, зарубежные страны.Адрес редакции: 352192, г. Гулькевичи, ул. Ленинградская 34-19Учредитель: Никитенко Евгений ИгоревичКонтакты: [email protected]
Использование материалов сайта возможно только с разрешения администрации портала.
Ответственность за разрешение любых спорных вопросов, касающихся опубликованных материалов и их содержания, берут на себя пользователи, разместившие материал на сайте.Администрация портала готова оказать поддержку в решении любых вопросов, связанных с работой и содержанием сайта.

www.uchportal.ru
Контрольные работы по химии - Химия - Учительский портал
РАЗРАБОТКИ | Страница 3 В категории разработок: 63 Фильтр по целевой аудитории - Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя  контрольная работа по теме химические реакции. для учащихся 8 класса Целевая аудитория: для 8 класса Предлагаю три варианта контрольной работы разработанных с учетом обязательного минимума по теме: "Первоначальные химические понятия". Работа может использоваться для учащихся занимающихся по программе О. С. Габриеляна и подходит к авторской программе Г. Е. Рудзитиса и Ф.Г. Фельдмана. Целевая аудитория: для 8 класса Контрольная работа составлена по теме"Химические реакции".Проводится в 11 классе. Цель:проконтролировать уровень усвоения учащимися знаний и умений по данной теме. Контрольная работа составлена на основе обязвтельного минимума содержания курса химии. Целевая аудитория: для 11 класса Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 10 профильного класса. Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С. Часть А: Включает тестовые задания, требующие найти один верный ответ. Часть В: на установление соответствие к каждой позиции первичного столбца подобрать соответствующую позицию второго и записать выбранные цифры под соответствующими буквами. Часть С: решение задач. Контрольная работа состоит из 4-х вариантов.Имеется в работе критерии оценивания. Целевая аудитория: для 10 класса Как быстро проверить готовность учеников к уроку ? Для этого я использую химические графические диктанты. Данные диктанты позволяют оперативно проверить выполнение домашних заданий, понимания учащимися основных вопросов темы предыдущего занятия, в яркой и доступной форме оценить качество подготовки по материалу урока, сэкономить время для работы на уроке.  Целевая аудитория: для 11 класса Как быстро проверить готовность учеников к уроку ? Для этого я использую химические графические диктанты. Данные диктанты позволяют оперативно проверить выполнение домашних заданий, понимания учащимися основных вопросов темы предыдущего занятия, в яркой и доступной форме оценить качество подготовки по материалу урока, сэкономить время для работы на уроке.  Целевая аудитория: для 8 класса Как быстро проверить готовность учеников к уроку ? Для этого я использую химические графические диктанты. Данные диктанты позволяют оперативно проверить выполнение домашних заданий, понимания учащимися основных вопросов темы предыдущего занятия, в яркой и доступной форме оценить качество подготовки по материалу урока, сэкономить время для работы на уроке.  Целевая аудитория: для 8 класса Работа предназначена для учащихся 11 класса, занимающихся по программе и учебнику Кузнецовой Н.Е. Работа составлена по типу ЕГЭ, содержит 10 заданий части А, 3 задания части В и 2 задания части С. Цель контрольной работы- проверить знания учащихся по вопросам теории электролитической диссоциации, гидролизу солей, окислительно-восстановительным реакциям. Целевая аудитория: для 11 класса Предлагаю небольшую самостоятельную работу по теме: "Химическое равновесие и условия его смещения".Самостоятельная работа содержит несколько вариантов. В каждом варианте необходимо выполнить 2 задания по данной теме. Данную работу можно использовать после изучения аналогичной темы для контроля ее усвоения. Предлагаю небольшую самостоятельную работу по теме: "Первоначальные химические понятие. Строение атома". Работа состоит из 6 вариантов. Предназначена для учащихся 8 класса. Целевая аудитория: для 8 класса | Конкурсы  Диплом и благодарность каждому участнику! | 
© 2007 - 2017 Сообщество учителей-предметников "Учительский портал"Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.Территория распространения: Российская Федерация, зарубежные страны.Адрес редакции: 352192, г. Гулькевичи, ул. Ленинградская 34-19Учредитель: Никитенко Евгений ИгоревичКонтакты: [email protected]
Использование материалов сайта возможно только с разрешения администрации портала.
Ответственность за разрешение любых спорных вопросов, касающихся опубликованных материалов и их содержания, берут на себя пользователи, разместившие материал на сайте.Администрация портала готова оказать поддержку в решении любых вопросов, связанных с работой и содержанием сайта.

www.uchportal.ru
Контрольные работы по химии 8 класс




















Контрольные работы
ХИМИЯ
К учебнику О. С. Габриеляна «Химия – 8»
8 класс
г. Орск, 2015
Содержание:
Контрольная работа № 1 «Атомы химических элементов»………………………………..
5
Вариант 1………………………………………………………………………….....
5
Вариант 2…………………………………………………………………………….
7
Вариант 3…………………………………………………………………………….
9
Вариант 4…………………………………………………………………………….
11
Контрольная работа № 2 «Простые вещества. Количественные соотношения»…………
13
Вариант 1…………………………………………………………………………….
13
Вариант 2…………………………………………………………………………….
15
Вариант 3…………………………………………………………………………….
17
Вариант 4…………………………………………………………………………….
19
Контрольная работа № 3 «Соединения химических элементов»………………………….
21
Вариант 1…………………………………………………………………………….
21
Вариант 2…………………………………………………………………………….
23
Вариант 3…………………………………………………………………………….
25
Вариант 4…………………………………………………………………………….
27
Контрольная работа № 4 «Изменения, происходящие с веществами»……………………
29
Вариант 1…………………………………………………………………………….
29
Вариант 2…………………………………………………………………………….
31
Вариант 3…………………………………………………………………………….
33
Вариант 4…………………………………………………………………………….
35
Контрольная работа № 5 «Классы неорганических соединений»…………………………
37
Вариант 1…………………………………………………………………………….
37
Вариант 2…………………………………………………………………………….
39
Вариант 3…………………………………………………………………………….
41
Вариант 4…………………………………………………………………………….
43
Контрольная работа № 6 «Итоговая контрольная работа за курс 8 класса»……………...
45
Вариант 1…………………………………………………………………………….
45
Вариант 2…………………………………………………………………………….
47
Вариант 3…………………………………………………………………………….
49
Вариант 4…………………………………………………………………………….
51
Приложение……………………………………………………………………………………
53
Ответы…………………………………………………………………………………………
57
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент третьего периода главной подгруппы III группы ПСХЭ - это:
1) алюминий
3) магний
2) бериллий
4) бор
А2. Обозначение изотопа, в ядре которого содержится 8 протонов и 10 нейтронов:
1) 
3) 
2) 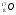
4) 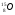
А3. Атом химического элемента, электронная оболочка которого содержит 17 электронов:
1) кислород
3) хлор
2) сера
4) фтор
А4. Два электронных слоя (энергетических уровня) имеет атом:
1) азота
3) калия
2) магния
4) гелия
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 5 электронов:
1) P и С
3) Si и Са
2) С и Si
4) N и P
А6. Верны ли следующие высказывания?
А. В периоде металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В периоде металлические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) Ca
1) 2е, 8е, 8е, 2е
Б) Al3+
2) 2е, 8е, 2е
В) N3-
3) 2е, 5е
Г) N
4) 2е, 8е, 3е
5) 2е, 8е,18е,4е
6) 2е, 8е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ионной связью являются:
1) Nh4
3) BaCl2
5) ZnS
2) CO2
4) Al I3
6) O2
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса хлорида бария BaCl2 равна __________.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 11 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона Na+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент второго периода главной подгруппы III группы ПСХЭ - это:
1) литий
3) кальций
2) бор
4) магний
А2. Обозначение изотопа, в ядре которого содержится 26 протонов и 30 нейтронов:
1) 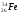
3)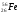
2)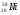
4)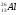
А3. Атом химического элемента, ядро которого содержит 14 протонов - это:
1) азот
3) калий
2) кремний
4) цинк
А4. Три электронных слоя (энергетических уровня) имеет атом:
1) бора
3) фтора
2) кальция
4) серы
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 3 электрона:
1) Mg и Al
3) N и S
2) O и S
4) B и Al
А6. Верны ли следующие высказывания?
А. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) Mg
1) 2е, 8е, 7е
Б) K
2) 2е, 8е, 2е
В) Na+
3) 2е, 7е
Г) Cl -
4) 2е, 8е, 8е
5) 2е, 8е
6) 2е, 8е, 8е,1е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ковалентной полярной связью являются:
1) Nh4
3) BaCl2
5) O2
2) CO2
4) h3S
6) ZnS
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса оксида алюминия Al2O3 равна _______.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 16 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона S2-.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент третьего периода главной подгруппы V группы ПСХЭ - это:
1) азот
3) фосфор
2) алюминий
4) углерод
А2. Атом химического элемента, имеющий в своем составе 9 протонов, 10 нейтронов, 9 электронов:
1) бор
3) фтор
2) бериллий
4) калий
А3. Атом химического элемента, электронная оболочка которого содержит 10 электронов:
1) кальций
3) неон
2) фтор
4) бор
А4. Четыре электронных слоя (энергетических уровня) имеет атом:
1) железа
3) углерода
2) бария
4) аргона
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 4 электрона:
1) углерод и кремний
3) азот и углерод
2) азот и фосфор
4) калий и кальций
А6. Верны ли следующие высказывания?
А. В периоде неметаллические свойства атомов элементов с увеличением порядкового номера не изменяются.
Б. В периоде неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) C4+
1) 2е, 6е
Б) Li
2) 2е, 1е
В) O
3) 2е, 8е, 3е
Г) S2-
4) 2е, 8е, 8е,1е
5) 2е, 8е, 8е
6) 2е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ионной связью являются:
1) NaCl
3) K
5) Al2O3
2) h3
4) ZnI2
6) HCl
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса нитрата калия KNO3 равна __________.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 14 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона Si 4+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент четвертого периода главной подгруппы II группы ПСХЭ - это:
1) натрий
3) калий
2) кальций
4) углерод
А2. Атом химического элемента, имеющий в своем составе 15 протонов, 16 нейтронов, 15 электронов:
1) кислород
3) фтор
2) цинк
4) фосфор
А3. Атом химического элемента, ядро которого содержит 24 протона - это:
1) хром
3) медь
2) магний
4) криптон
А4. Пять электронных слоев (энергетических уровней) имеет атом:
1) брома
3) мышьяка
2) йода
4) бора
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 7 электронов:
1) кремний и фосфор
3) хлор и йод
2) азот и фосфор
4) серебро и кадмий
А6. Верны ли следующие высказывания?
А. В главной подгруппе металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе электроотрицательность атомов элементов с увеличением порядкового номера ослабевает.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) S
1) 2е, 8е, 7е
Б) Ca2+
2) 2е, 8е, 4е
В) О2-
3) 2е, 8е
Г) Si
4) 2е, 8е, 6е
5) 2е
6) 2е, 8е, 8е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ковалентной неполярной связью являются:
1) h3
3) Cl2
5) KCl
2) SO2
4) Na
6) C
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса сульфата натрия Na2SO4 равна _________.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 20 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона Ca 2+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Больше металлических свойств проявляет:
1) магний
3) алюминий
2) натрий
4) железо
А2. Аллотропная модификация кислорода:
1) графит
3) озон
2) белый фосфор
4) алмаз
А3. Атому элемента, образующему простое вещество - металл, соответствует электронная схема:
1) +18)2)8)8
3) +3)2)1
2) +15)2)8)5
4) +8)2)6
А4. Запись 3О2 означает:
1) 2 молекулы кислорода
3) 5 атомов кислорода
2) 3 молекулы кислорода
4) 6 атомов кислорода
А5. Масса 3 моль сероводорода Н2S равна:
1) 33 г
3) 34 г
2) 99 г
4) 102 г
А6. Верны ли следующие высказывания?
А. При нормальных условиях ртуть жидкая.
Б. При нормальных условиях ртуть твердая.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между типом химической связи и химической формулой вещества:
Тип химической связи:
Химическая формула вещества:
А) Ионная
1) C12
Б) Ковалентная полярная
2) NaCl
В) Металлическая
3) Fe
Г) Ковалентная неполярная
4) Nh4
А
Б
В
Г
Ответом к заданиям В2, В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В2. Количество вещества углекислого газа СO2, в котором содержится 36•1023 молекул, равно_____ моль. (Запишите число с точностью до десятых).
В3. Объем, который занимает 2 моль газообразного вещества с формулой SO2 (н.у.) равен ____л. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объем для 160 г кислорода O2.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Больше неметаллических свойств проявляет:
1) углерод
3) фтор
2) азот
4) кислород
А2. Аллотропная модификация углерода:
1) озон
3) красный фосфор
2) сера кристаллическая
4) алмаз
А3. Атому элемента, образующему простое вещество - неметалл, соответствует электронная схема:
1) +11)2)8)1
3) +12)2)8)2
2) +8)2)6
4) +4)2)2
А4. Запись 5N2 означает:
1) 2 молекулы азота
3) 7 атомов азота
2) 5 молекул азота
4) 10 атомов азота
А5. Масса 2 ммоль углекислого газа СО2 равна:
1) 28 мг
3) 56 мг
2) 44 мг
4) 88 мг
А6. Верны ли следующие высказывания?
А. При нормальных условиях озон жидкий.
Б. При нормальных условиях озон твердый.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между типом химической связи и химической формулой вещества:
Тип химической связи:
Химическая формула вещества:
А) Ионная
1) Н2О
Б) Ковалентная полярная
2) KCl
В) Металлическая
3) Сu
Г) Ковалентная неполярная
4) О2
А
Б
В
Г
Ответом к заданиям В2, В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В2. Масса 2 ммоль воды равна ______ мг. (Запишите число с точностью до десятых).
В3. 3 моль кислорода О2 (н.у.) занимают объем ____л. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объем для 140 кг азота N2 (н.у.).
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Больше металлических свойств проявляет:
1) литий
3) калий
2) рубидий
4) натрий
А2. Аллотропная модификация фосфора:
1) кислород
3) красный фосфор
2) алмаз
4) карбин
А3. Атому элемента, образующему простое вещество - металл, соответствует электронная схема:
1) +16)2)8)6
3) +12)2)8)2
2) +14)2)8)4
4) + 10)2)8
А4. Запись 4N означает:
1) 4 молекулы азота
3) 4 атома азота
2) 2 молекулы азота
4) 4 атома натрия
А5. Масса 3 кмоль воды равна:
1) 27 кг
3) 60 г
2) 54 кг
4) 54 г
А6. Верны ли следующие высказывания?
А. При нормальных условиях сера твердая.
Б. При нормальных условиях сера газообразная.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между типом химической связи и химической формулой вещества:
Тип химической связи:
Химическая формула вещества:
А) Ионная
1) SO3
Б) Ковалентная полярная
2) h3
В) Металлическая
3) Mg
Г) Ковалентная неполярная
4) CaF2
А
Б
В
Г
Ответом к заданиям В2, В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В2. Масса углекислого газа СО2 количеством вещества 1,5 моль равна ____г. (Запишите число с точностью до десятых).
В3. 4 кмоль хлора C12 (н.у.) занимают объем _____м3. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объем для 20 г водорода (н. у.).
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Больше неметаллических свойств проявляет:
1) азот
3) мышьяк
2) фосфор
4) кремний
А2. Аллотропная модификация олова:
1) графит
3) озон
2) алмаз
4) серое олово
А3. Атому элемента, образующему простое вещество - неметалл, соответствует электронная схема:
1) +13)2)8)3
3) +9)2)7
2) +12)2)8)2
4) + 3)2)1
А4. Запись 6Н означает:
1) 6 молекул водорода
3) 6 атомов водорода
2) 3 молекулы водорода
4) 6 атомов гелия
А5. Масса 5 моль аммиака NН3 равна:
1) 50 г
3) 75 г
2) 68 г
4) 85 г
А6. Верны ли следующие высказывания?
А. При нормальных условиях азот твердый.
Б. При нормальных условиях азот газообразный.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между типом химической связи и химической формулой вещества:
Тип химической связи:
Химическая формула вещества:
А) Ионная
1) Ag
Б) Ковалентная полярная
2) N2
В) Металлическая
3) MgCl2
Г) Ковалентная неполярная
4) CO2
А
Б
В
Г
Ответом к заданию В2 является число. Запишите это число в бланк ответов без указания единиц измерения.
В2. Количество вещества сернистого газа SO2, в котором содержится 3•1023 молекул, равно _____моль. (Запишите число с точностью до десятых).
В3. 2 кмоль газа метана СН4 занимают объем (н.у.)_____м3. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объем сероводорода h3S (н.у.), массой 6,8 г.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Смесью веществ в отличие от чистого вещества является:
1) алюминий
3) магний
2) водопроводная вода
4) углекислый газ
А2. Ряд формул, в котором все вещества – оксиды:
1) SO3, MgO, CuO
3) ZnO, ZnCl2, h3O
2) KOH, K2O, MgO
4) h3SO4, Al2O3, HCl
А3. Азот проявляет наибольшую степень окисления в соединении с формулой:
1) NO2
3) Nh4
2) NO
4) N2O5
А4. Формула сульфата железа (III):
1) FeS
3) Fe2 (SO4)3
2) FeSO4
4) Fe2(SO3)3
А5. В 80 г воды растворили 20 г соли. Массовая доля соли в полученном растворе равна:
1) 40 %
3) 50 %
2) 25 %
4) 20 %
А6. Верны ли следующие высказывания?
А. В состав оснований входит ион металла.
Б. В состав оснований входит кислотный остаток.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между названием вещества и формулой соединения:
Название вещества:
Формула соединения:
А) Оксид алюминия
1) Al(OH)3
Б) Серная кислота
2) Al2 (SO4)3
В) Гидроксид алюминия
3) AlО
Г) Сульфат алюминия
4) Al2O3
5) h3SO4
6) h3SO3
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. К кислотам относятся:
1) h3CO3
3) h3SiO3
5) HCl
2) Fe(OH)2
4) Hg(NO3)2
6) SO2
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Массовая доля (%) кислорода в серной кислоте равна ______. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объем кислорода, полученного из 200 л воздуха, если известно, что объемная доля кислорода в воздухе составляет 21 %?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы.
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Чистое вещество в отличие от смеси - это:
1) морская вода
3) кислород
2) воздух
4) молоко
А2. Ряд формул, в котором все вещества – основания:
1) СuOH, CuCl2, NaOH
3) Ca(OH)2, Mg(OH)2, MgOHCl
2) K2O, HCl, Ca(OH)2
4) KOH, Ba(OH)2, Cu(OH)2
A3. Углерод проявляет наименьшую степень окисления в соединении с формулой:
1) СаСО3
3) СO2
2) Сh5
4) СO
А4. Формула хлорида меди (II):
1) CuCl
3) CuCl2
2) Cu(NO3)2
4) CuSO4
А5. В 180 г воды растворили 20 г хлорида натрия. Массовая доля соли в полученном растворе равна:
1) 15 %
3) 30 %
2) 20 %
4) 10 %
А6. Верны ли следующие высказывания?
А. В состав кислот входит ион водорода.
Б. В состав кислот входит кислотный остаток.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между названием вещества и формулой соединения:
Название вещества:
Формула соединения:
А) Оксид магния
1) MnCl2
Б) Соляная кислота
2) Mg(OH)2
В) Гидроксид магния
3) HF
Г) Хлорид магния
4) HCl
5) MgCl2
6) MgO
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. К солям относятся:
1) h3CO3
3) Ba(OH)2
5) Na2S
2) KNO3
4) SO2
6) CaCO3
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
B3. Массовая доля (%) кислорода в оксиде алюминия равна ______. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение.
C1. Рассчитайте объём воздуха, необходимого для получения 39 л азота, если известно, что объёмная доля азота в воздухе составляет 78 %?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Смесью веществ не является:
1) речная вода
3) воздух
2) дистиллированная вода
4) почва
A2. Ряд формул, в котором все вещества – кислоты:
1) HCl, CaCl2, h3SO4
3) HNO3, h3SO3 , h4PO4
2) NaOH, h3CO3, h3S
4) CaO, Na2CO3, h3S
A3. Cера проявляет наибольшую степень окисления в соединении с формулой:
1) h3 S
3) Na 2S
2) SO2
4) SO3
A4. Формула сульфита хрома (III):
1) Cr2S3
3) CrSO4
2) Cr2(SO4)3
4) Cr2(SO3)3
A5. В 120 г воды растворили 30 г соли. Массовая доля соли в полученном растворе равна:
1) 20 %
3) 30 %
2) 25 %
4) 10 %
А6. Верны ли следующие высказывания?
А. В состав солей входит ион металла.
Б. В состав солей входит кислотный остаток.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между названием вещества и формулой соединения:
Название вещества:
Формула соединения:
А) Оксид меди (II)
1) Cu2O
Б) Нитрат меди (II)
2) HNO3
В) Азотная кислота
3) Cu(OH)2
Г) Гидроксид меди (II)
4) Cu(NO3)2
5) h4PO4
6) CuO
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. К оксидам относятся:
1) NaOH
3) BaSO4
5) SO2
2) MgO
4) K2O
6) OF2
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
B3. Массовая доля (%) кислорода в азотной кислоте равна ______. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объём газа метана СН4, полученного из 500 л природного газа, если известно, что объёмная доля метана в природном газе составляет 95 %?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
A1. Смесью веществ, в отличие от чистого вещества, является:
1) алюминий
3) азот
2) воздух
4) золото
А2. Ряд формул, в котором все вещества – соли:
1) NaCl, BaSO4, KNO3
3) MgSO3, CaO, AlCl3
2) CaSO4 ,Na2CO3 , h3CO3
4) ZnS, CaI2, Al2O3
A3. Фосфор проявляет наименьшую степень окисления в соединении с формулой:
1) Р2O5
3) РН3
2) Р2O3
4) Н3РО4
А4. Формула нитрата железа (II):
1) Fe(NO3)2
3) Fe(NO3)3
2) Fe3N2
4) Fe(NO2)2
А5. В 450 г воды растворили 50 г соли. Массовая доля соли в полученном растворе равна:
1) 9 %
3) 14 %
2) 10 %
4) 11 %
А6. Верны ли следующие высказывания?
А. Оксиды состоят из двух элементов.
Б. Степень окисления кислорода в оксидах +2.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между названием вещества и формулой соединения:
Название вещества:
Формула соединения:
А) Сернистая кислота
1) h3SO4
Б) Гидроксид бария
2) BaSO3
В) Сульфат бария
3) BaO
Г) Оксид бария
4) BaSO4
5) Ва(OH)2
6) h3 SO3
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. К основаниям относятся:
1) h3SO3
3) MgO
5) K2S
2) NaOH
4) Fe(OH)2
6) Ba(OH)2
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
B3. Массовая доля (%) углерода в карбонате кальция равна ______. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объём воздуха, необходимого для получения 50 л кислорода, если известно, что объёмная доля кислорода в воздухе составляет 21 %?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 9 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 2 заданий повышенного уровня (В1-В2), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 13 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-9 баллов – «3»
10-11 баллов – «4»
12-13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Физическое явление - это:
1) ржавление железа
3) скисание молока
2) горение древесины
4) плавление свинца
А2. Сумма всех коэффициентов в уравнении реакции, схема которой Al + Cl2 AlCl3, равна:
1) 4
3) 8
2) 5
4) 7
А3. Схема, являющаяся уравнением химической реакции:
1) h3 + Cl2 HCl
3) Zn +HCl ZnCl2+h3
2) 2Ca + O2 2CaO
4) h3 + О2 h3О
А4. Вещество «Х» в схеме: Х + 2HCl = FeCl2 + h3.
1) железо
3) хлор
2) оксид железа
4) гидроксид железа
А5. Объём водорода, который полностью прореагирует по уравнению реакции 2h3 + O2 = 2h3O с 1 моль кислорода, равен:
1) 8,96 л
3) 44,8 л
2) 22,4 л
4) 67,2 л
А6. Верны ли следующие высказывания?
А. Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции соединения.
Б. Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции разложения.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между левой и правой частями уравнений:
Левая часть:
Правая часть:
А) CuO + h3SO4=
1) CuSO4 + h3O
Б) CuCl2 + 2NaOH =
2) CuSO4 + 2h3O
В) Cu(OН2) +2HCl =
3) CuCl2 + h3O
Г) Cu(OН2) + h3SO4=
4) Cu(OH)2 + NaCl
5) CuCl2 + 2h3O
6) Cu(OH)2 + 2NaCl
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Уравнения реакции обмена:
1) CaO + SiO2 = CaSiO3
4) Fe2O3 + 2Al = Al2O3 + 2Fe
2) FeS + 2HCl = FeCl2 + h3S
5) LiСl + AgNO3 = LiNO3 + AgCl
3) 2KClO3 = 2KCl + 3O2
6) 2Ca + O2 = 2CaO
Часть 3
Запишите номер задания и полное решение
C1. По уравнению реакции Cu (OH)2 = CuO + h3O найдите массу оксида меди (II), образовавшегося при разложении 39,2 г гидроксида меди (II).
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 9 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 2 заданий повышенного уровня (В1-В2), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 13 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-9 баллов – «3»
10-11 баллов – «4»
12-13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Химическое явление - это:
1) горение свечи
3) испарение бензина
2) плавление льда
4) образование льда
А2. Сумма вcех коэффициентов в уравнении реакции, схема которой Ca + HCl CaCl2 + h3, равна:
1) 6
3) 3
2) 5
4) 4
А3. Схема, являющаяся уравнением химической реакции:
1) CaCO3 CaO + CO2
3) Ca + O2 CaO
2) Mg + HCl MgCl2 + h3
4) CO + O2 CO2
А4. Вещество «Х» в схеме: Fe2O3 + 3h3 2Х + 3h3O
1) железо
3) водород
2) оксид железа
4) гидроксид железа
А5. Объём водорода, который полностью прореагирует по уравнению реакции h3 + Cl2 = 2HCl с 2 моль хлора (н.у.), равен:
1) 4,48 л
3) 44,8 л
2) 22,4 л
4) 67,2 л
А6. Верны ли следующие высказывания?
А. Из одного сложного вещества образуются два или более новых веществ в реакции
соединения.
Б. Из одного сложного вещества образуются два или более новых веществ в реакции
замещения.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между левой и правой частями уравнений
Левая часть:
Правая часть:
А) Na2O + h3SO4=
1) Fe(OH)2 + KCl
Б) FeCl2 + 2KOH =
2) Fe(NO3)2 + 2h3O
В) Fe(OН)2 + 2HNO3 =
3) FeNO3 + 2h3O
Г) 2NaOН + h3SO4=
4) Fe(OH)2 + 2KCl
5) Na2SO4 + 2h3O
6) Na2SO4 + h3O
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Уравнения реакции разложения:
1) CaO + SiO2 = CaSiO3
4) Fe2O3 + 2Al = Al2O3 + 2Fe
2) FeS + 2HCl = FeCl2 + h3S
5) NaСl + AgNO3 = NaNO3 + AgCl
3) 2KNO3 = 2KNO2 + O2
6) 2Al(OH)3 = Al2O3 + 3h3O
Часть 3
Запишите номер задания и полное решение
C1. По уравнению реакции Zn(OH)2 = Zn O + h3O определите массу оксида цинка, который образуется при разложении 198 г исходного вещества.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 9 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 2 заданий повышенного уровня (В1-В2), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 13 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-9 баллов – «3»
10-11 баллов – «4»
12-13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Физическое явление - это:
1) испарение воды
3) горение керосина
2) скисание молока
4) появление ржавчины
А2. Сумма всех коэффициентов в уравнении реакции, схема которой Al + O2 Al2O3 равна:
1) 6
3) 9
2) 3
4) 4
А3. Схема, являющаяся уравнением химической реакции:
1) Cu + O2 CuO
3) 2HgO 2Hg + O2
2) KClO3 KCl + O2
4) HCl + Zn h3 + ZnCl2
А4. Вещество «Х» в схеме: Х +h3SO4 = ZnSO4 + h3
1) цинк
3) оксид цинка
2) гидроксид цинка
4) вода
А5. Объём кислорода, который потребуется для получения 0,5 моль углекислого газа по уравнению реакции C+O2=CO2, равен:
1) 5,6 л
3) 44,8 л
2) 11,2 л
4) 22,4 л
А6. Верны ли следующие высказывания?
А. Атомы простого вещества замещают атомы одного из химических элементов в составе сложного вещества в реакции обмена.
Б. Атомы простого вещества замещают атомы одного из химических элементов в составе сложного вещества в реакции замещения.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между левой и правой частями уравнений:
Левая часть:
Правая часть:
А) ZnO + 2HCl =
1) ZnCl2 + 2h3O
Б) Zn(OH)2 + 2HCl =
2) ZnCl2 + h3O
В) Zn + 2HCl =
3) Zn(OH)2 + 2KCl
Г) ZnCl2 + 2KOH =
4) ZnCl2 + h3
5) ZnOH + 2KCl
6) ZnCl2 + 2h3
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Уравнения реакции замещения:
1) BaO + h3O = Ba(OH)2
4) Ca(OH)2 + 2HCl = CaCl2+2h3O
2) CuO + h3 = Cu + h3O
5) 2Nh4 = N2 + 3h3
3) 3KOH + h4PO4 = K3PO4 + 3h3O
6) Mg + 2HCl = MgCl2 + h3
Часть 3
Запишите номер задания и полное решение
C1. По уравнению реакции Fe(OH)2 = FeO + h3O определите массу оксида железа (II), образовавшегося при разложении 45 г исходного вещества.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 9 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 2 заданий повышенного уровня (В1-В2), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 13 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-9 баллов – «3»
10-11 баллов – «4»
12-13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Химическое явление - это:
1) плавление олова
3) горения магния
2) замерзания воды
4) образование тумана
А2. Сумма вcех коэффициентов в уравнении реакции, схема которой N2 + h3 Nh4 равна:
1) 6
3) 4
2) 3
4) 5
А3. Схема, являющаяся уравнением химической реакции:
1) 3Fe + 2O2 Fe3O4
3) HgO Hg + O2
2) 2Al + O2 Al2O3
4) Ca + HCl CaCl2 + h3
А4. Формула вещества «Х» в схеме: 2Na + Х 2NаCl.
1) Cl
3) Cl2
2) HCl
4) Cl2O7
А5. Объём водорода, который потребуется для получения 1 моль метана по уравнению реакции C+2h3 = Ch5, равен:
1) 67,2 л
3) 44,8 л
2) 11,2 л
4) 22,4 л
А6. Верны ли следующие высказывания?
А. Из двух сложных веществ образуется два новых сложных вещества в реакции обмена.
Б. Из двух сложных веществ образуется два новых сложных вещества в реакции соединения.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между левой и правой частями уравнений:
Левая часть:
Правая часть:
А) Mg(NO3)2 + 2KOH =
1) Mg(NO3)2 + 2h3O
Б) Mg(OH)2 + 2HNO3 =
2) MgNO3 + 2h3O
В) Mg + 2HCl =
3) Mg(OH)2 + 2KNO3
Г) MgO + 2HCl =
4) MgCl2+ h3
5) MgCl2+ h3O
6) Mg(OH)2 + KNO3
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Уравнения реакции соединения:
1) BaO + h3O = Ba(OH)2
4) Ca(OH)2 + 2HCl = CaCl2+2h3O
2) CuO + h3 = Cu + h3O
5) 2Nh4= N2 + 3h3
3) N2 + O2 = 2NO
6) Mg + 2HCl = MgCl2 + h3
Часть 3
Запишите номер задания и полное решение
C1. По уравнению реакции CaО + h3OCa (OH)2 определите массу гидроксида кальция, образовавшегося при взаимодействии 112 г оксида кальция с водой.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 5
Классы неорганических соединений
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Группа формул веществ, включающая формулы основания, кислоты, соли и кислотного оксида:
1) CuO, Zn(OH)2, AlCl3, K2S
3) SO2, h3SO4, NaCl, CuO
2) Cu(OH)2, HCl, NaNO3, SO3
4) Zn(OH)2 ,HCl, K2S, Na2O
А2. Формула сульфата натрия:
1) Na2SO4
3) Na2S
2) Na2SO3
4) Na2SiO3
А3. Изменение свойств оксидов от кислотных к основным происходит в ряду веществ с формулами:
1) Li2O — BeO — B2O3
3) NO2 — CO2 — SO2
2) P2O5 — SiO2 — Al2O3
4) P2O5 — CаO — SO3
А4. Пара формул веществ, реагирующих с оксидом серы (IV):
1) Ca (OH)2, h3O
3) h3O, NaCl
2) Na2O, Na
4) SO3, h3SO4
А 5. Металл, реагирующий с водным раствором хлорида меди (II):
1) золото
3) ртуть
2) железо
4) серебро
А6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + HCl = NaCl + h3O веществом Х является вещество с формулой Na.
Б. В уравнении реакции: Х + HCl = NaCl + h3O веществом Х является вещество с формулой NaOH.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой оксида и соответствующего ему гидроксида:
Формула оксида
Формула гидроксида
А) Cu2O
1) h3SO4
Б) CO2
2) Al (OH)3
В) Al2O3
3) Cu (OH)2
Г) SO3
4) h3CO3
5) CuOH
6) h3SO3
А
Б
В
Г
Ответом к заданиям В2, В3 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Металлы, реагирующие с раствором соляной кислоты:
1) Ca
3) Zn
5) Ag
2) Mg
4) Cu
6) Fe
В3. Вещества, реагирующие с раствором гидроксида натрия:
1) соляная кислота
4) хлорид натрия
2) нитрат меди
5) углекислый газ
3) вода
6) оксид калия
Часть 3
Запишите номер задания и полное решение
С1. Предложите два способа получения сульфата магния. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 5
Классы неорганических соединений
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Группа формул веществ, включающая формулы основания, кислоты, соли и основного оксида:
1) BaO, AlCl3, h4PO4, Pb(NO3)2
3) FeSO4 , SO2 , h3CO3, Fe(OH)2
2) CuO, h3SO3, KNO3, Ba(OH)2
4) Ca(OH)2 ,NaCl, Na2S, Na2O
А2. Формула хлорида хрома (III):
1) CrClO3
3) CrCl3
2) CrOHCl2
4) CrCl2
А3. Изменение свойств оксидов от основных к кислотным происходит в ряду веществ с формулами:
1) SO3 — MgO —Al2O3
3) P2O5 — Li2O — SiO2
2) MgO — Al2O3 — SiO2
4) Li2O — P2O5 — CаO
А4. Пара формул веществ, реагирующих с оксидом кальция:
1) Ca (OH)2, h3O
3) HCl, NaOH
2) NaCl, K 2O
4) CO2, HCl
А5. Металл, реагирующий с водным раствором сульфата меди (II):
1) цинк
3) ртуть
2) платина
4) серебро
А6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + 2HNO3 = 2KNO3 + h3O веществом Х является вещество с формулой K2O.
Б. В уравнении реакции: Х + 2HNO3 = 2KNO3 + h3O веществом Х является вещество с формулой K.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой гидроксида и соответствующего ему оксида:
Формула гидроксида
Формула оксида
А) h4PO4
1) SO2
Б) Fe(OH)3
2) FeO
В) h3SO4
3) Fe2O3
Г) Ba(OH)2
4) BaO
5) P2O5
6) SO3
А
Б
В
Г
Ответом к заданиям В2, В3 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Вещества, реагирующие с раствором серной кислоты:
1) Zn
3) CO2
5) Cu
2) Ba(OH)2
4) NaOH
6) MgO
В3. Вещества, реагирующие с раствором гидроксида бария:
1) соляная кислота
4) оксид меди (II)
2) сульфат калия
5) оксид серы (IV)
3) гидроксид калия
6) нитрат натрия
Часть 3
Запишите номер задания и полное решение
С1. Предложите два способа получения хлорида цинка. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 5
Классы неорганических соединений
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Группа формул веществ, включающая формулы основания, кислоты, соли и основного оксида:
1) HCl , SO3 , NaNO3, Ca(OH)2
3) CuCl2, К2О, NaNO3, Ca(OH)2
2) CuCl2, h4PO4, KOH, CO2
4) HNO3, FeS, Cu(OH)2, FeO
А2.Формула сульфита железа (II):
1) FeCl2
3) FeSO3
2) FeSO4
4) FeOHCl
А3. Изменение свойств оксидов от кислотных к основным происходит в ряду веществ с формулами:
1) P2O5 — Al2O3 — MgO
3) Al2O3— SiO2 — MgO
2) CaO — CO2 — Al2 O3
4) P2O5 — MgO — SiO2
А4. Пара формул веществ, реагирующих с оксидом углерода (IV):
1) h3O, P2O5
3) К2О, О2
2) NaOH, h3O
4) Ca(OH)2, h3SO4
А5. Металл, реагирующий с водным раствором нитрата железа (II):
1) алюминий
3) медь
2) золото
4) платина
А6. Верны ли следующие высказывания?
А. В уравнении реакции: CaO + X = CaSO4 + h3O веществом Х является вещество с формулой h3SO3.
Б. В уравнении реакции: CaO + X = CaSO4 + h3O веществом Х является вещество с формулой h3SO4.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой оксида и соответствующего ему гидроксида.
Формула оксида
Формула гидроксида
А) Fe2O3
1) Н2СО3
Б) CO2
2) Fe(OН)3
В) CaO
3) Fe(OH)2
Г) P2O5
4) Ca(OH)2
5) h4PO4
6) HPO2
А
Б
В
Г
Ответом к заданиям В2, В3 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Металлы, реагирующие с раствором серной кислоты:
1) Mg
3) Ag
5) Cu
2) Zn
4) Al
6) Fe
В3. Вещества, реагирующие с раствором гидроксида калия:
1) серная кислота
4) нитрат натрия
2) гидроксид магния
5) хлорид меди (II)
3) оксид фосфора (V)
6) оксид железа (II)
Часть 3
Запишите номер задания и полное решение
С1. Предложите два способа получения фосфата натрия. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 5
Классы неорганических соединений
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Группа формул веществ, включающая формулы представителей четырех классов неорганических соединений:
1) HNO3, CaO, Na2S, KOH
3) MgO, HCl, Cu(OH)2, CO2
2) Al2O3, h3SO4, LiOH, HBr
4) HCl , CaSO3 , NaNO3, Ca(OH)2
А2.Формула сульфида меди (II):
1) CuCl2
3) CuCl
2) CuS
4) CuI2
А3. Изменение свойств оксидов от основных к кислотным происходит в ряду веществ с формулами:
1) SiO2 —MgO — P2O5
3) MgO — SiO2 —P2O5
2) P2 O5 — MgO — Li2 O
4) CaO — CO2 — Al2 O3
А4. Пара формул веществ, реагирующих с оксидом лития:
1) h3O, CaO
3) NaOH, HCl
2) NaOH, h3O
4) CO2, h3SO4
А5. Металл, реагирующий с водным раствором хлорида железа (II):
1) платина
3) цинк
2) серебро
4) медь
А6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + h3SO4 = CuSO4 + h3O веществом Х является вещество с формулой CuO.
Б. В уравнении реакции: Х + h3SO4 = CuSO4 + h3O веществом Х является вещество с формулой Cu2O.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой гидроксида и соответствующего ему оксида.
Формула гидроксида
Формула оксида
А) KOH
1) KO
Б) Cu(OH)2
2) CrO3
В) Cr(OH)3
3) Cr2O3
Г) h3CrO4
4) CuO
5) K2O
6) Cu2O
А
Б
В
Г
Ответом к заданиям В2, В3 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Вещества, реагирующие с разбавленной соляной кислотой:
1) HgO
3) Mg
5) NaOH
2) HNO3
4) CO2
6) AgNO3
В3. Вещества, реагирующие с раствором гидроксида кальция:
1) вода
4) оксид серы (IV)
2) азотная кислота
5) угарный газ
3) оксид магния
6) сульфат меди
Часть 3
Запишите номер задания и полное решение
С1. Предложите два способа получения нитрата кальция. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 6
Итоговая контрольная работа за курс 8 класса
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Число атомов всех химических элементов в молекуле серной кислоты равно:
1) 3
3) 7
2) 4
4) 6
А2. Число протонов, нейтронов и электронов в атоме фтора 
1) p+ – 9; n0 – 10; ē – 19
3) p+ – 9; n0 – 10; ē - 9
2) p+ – 10; n0 – 9; ē – 10
4) p+ – 9; n0 – 9; ē - 19
А3. Группа формул веществ с ковалентным типом связи:
1) h3S, P4, CO2
3) HCl, NaCl, h3O
2) h3, Na, CuO
4) CaO, SO2, Ch5
А4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) гидроксид натрия
3) хлорид серебра
2) сульфат калия
4) нитрат алюминия
А5. Одновременно могут находиться в растворе ионы:
1) Na+, H+, Ba2+, OH-
3) Mg2+, K+, NO3-, SO42 -
2) Fe2+, Na+, OH- , SO42-
4) Ca2+, H+, CO32-, Cl -
А6. Верны ли следующие высказывания?
А. Оксид фосфора (V) - кислотный оксид.
Б. Соляная кислота - одноосновная кислота.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества:
Класс соединения:
А) Н3РО4
1) соль
Б) SO3
2) основный оксид
В) Сu(OH)2
3) нерастворимое основание
Г) CaCl2
4) кислотный оксид
5) кислота
6) растворимое основание
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. С раствором гидроксида натрия реагируют:
1) сульфат меди (II)
4) азотная кислота
2) оксид меди (II)
5) магний
3) гидроксид калия
6) оксид углерода (IV)
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Масса соли, содержащейся в 150 г 5 %-ного раствора соли, равна _____г. (Запиши число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме:
Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2. Назовите все сложные вещества, укажите тип реакции.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 6
Итоговая контрольная работа за курс 8 класса
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Число атомов всех химических элементов в молекуле фосфорной кислоты равно:
1) 3
3) 10
2) 6
4) 8
А2. Число протонов, нейтронов и электронов в атоме хлора 
1) p+ – 18; n0 – 18; ē – 18
3) p+ – 17; n0 – 18; ē - 18
2) p+ – 17; n0 – 17; ē – 17
4) p+ – 17; n0 – 18; ē - 17
А3. Группа формул веществ с ионным типом химической связи:
1) Na2S, KCl, HF
3) CO2, BaCl2, NaOH
2) K2O, NaH, NaF
4) Ca, O2, AlCl3
А4. Вещество, которое в водном растворе полностью диссоциирует:
1) оксид меди
3) сульфат бария
2) нитрат калия
4) гидроксид железа (III)
А5. Одновременно не могут находиться в растворе ионы:
1) H+, Ba2+, OH- , NO3-
3) Zn2+, K+, Cl -, SO42 -
2) Fe2+, Na+, NO3 - , SO42-
4) K+, Na+, OH-, Cl -
А6. Верны ли следующие высказывания?
А. Серная кислота – двухосновная.
Б. Оксид калия – основный оксид.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества:
Класс соединения:
А) LiOH
1) соль
Б) SO2
2) основный оксид
В) HNO3
3) нерастворимое основание
Г) CaCO3
4) кислотный оксид
5) кислота
6) растворимое основание
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. В реакцию с раствором соляной кислоты вступают:
1) ртуть
4) карбонат натрия
2) гидроксид магния
5) хлорид бария
3) оксид натрия
6) оксид серы (VI)
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. В 450 г воды растворили 50 г соли. Массовая доля соли в полученном растворе равна_____%. (Запиши число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение.
C1. Составьте уравнения химических реакций согласно схеме
Na → NaOH → Cu(OH)2 → CuO → Cu. Назовите все сложные вещества, укажите тип реакции.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 6
Итоговая контрольная работа за курс 8 класса
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Число атомов всех химических элементов в молекуле азотной кислоты равно:
1) 3
3) 7
2) 4
4) 5
А2. Число протонов, нейтронов и электронов в атоме калия 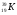 :
:
1) p+ – 19; n0 – 20; ē – 19
3) p+ – 20; n0 – 19; ē - 20
2) p+ – 19; n0 – 20; ē – 39
4) p+ – 19; n0 – 19; ē - 19
А3. Группа формул веществ с ковалентным типом связи:
1) BaCl2, Cl2, SO3
3) NaOH, Nh4, HF
2) h3, Ca, ZnCl2
4) N2, h3O, SO2
А4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) гидроксид меди (II)
3) нитрат цинка
2) серная кислота
4) хлорид магния
А5. Одновременно могут находиться в растворе ионы:
1) К+, Cl-, Сa2+, CO32-
3) Mg2+, H+, NO3-, CO32 -
2) Al3+, Na+, NO3 - , SO42-
4) Fe3+, H+, OH-, Cl -
А6. Верны ли следующие высказывания?
А. Азотная кислота – кислородсодержащая.
Б. Соляная кислота – кислородсодержащая.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества:
Класс соединения:
А) Zn(OH)2
1) соль
Б) h3SO3
2) основный оксид
В) NaCl
3) нерастворимое основание
Г) CaO
4) кислотный оксид
5) кислота
6) растворимое основание
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. С раствором гидроксида кальция реагируют:
1) серная кислота
4) медь
2) оксид углерода (IV)
5) хлорид натрия
3) карбонат натрия
6) оксид калия
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Масса соли, содержащейся в 300 г 3 %-ного раствора соли, равна______г. (Запиши число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме:
HCl → ZnCl2 → Zn(OH)2 → Zn(NO3)2
ZnO
Назовите все сложные вещества, укажите тип реакции.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-14 баллов – «4»
15-16 баллов – «5»
Контрольная работа № 6
Итоговая контрольная работа за курс 8 класса
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Число атомов всех химических элементов в молекуле сернистой кислоты
1) 3
3) 5
2) 7
4) 6
А2. Число протонов, нейтронов и электронов в атоме натрия 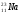
1) p+ – 11; n0 – 12; ē – 23
3) p+ – 11; n0 – 11; ē - 11
2) p+ – 12; n0 – 11; ē – 12
4) p+ – 11; n0 – 12; ē - 11
А3. Группа формул веществ с ионным типом связи:
1) ВаО, Na2S, MgCl2
3) BaS, SO2, CaF2
2) Na2O, NaCl, HCl
4) BaO, ZnO, HCl
А4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) нитрат бария
3) серная кислота
2) хлорид серебра
4) сульфат железа (II)
А5. Одновременно не могут находиться в растворе ионы:
1) K+, Al3+, Cl-, NO3-
3) Na+, Ba2+, Cl-, CO32 -
2) H+, Mg2+, NO3- , SO42-
4) Ca2+, H+, NO3-, Cl -
А6. Верны ли следующие высказывания?
А. Оксид углерода (IV) – кислотный оксид.
Б. Оксид натрия – основный оксид.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества:
Класс соединения:
А) MgO
1) соль
Б) h3SO4
2) основный оксид
В) KOH
3) нерастворимое основание
Г) Ba(NO3)2
4) кислотный оксид
5) кислота
6) растворимое основание
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. В реакцию с раствором серной кислоты вступают:
1) медь
4) магний
2) оксид меди (II)
5) хлорид натрия
3) гидроксид натрия
6) оксид серы (IV)
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. В 180 г воды растворили 20 г соли. Массовая доля соли в полученном растворе равна _____%. (Запиши число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций в молекулярном и ионном видах согласно схеме
Fe → FeCl2 → Fe(OH)2 → FeO → Fe. Назовите все вещества, укажите тип реакции.
Приложение 1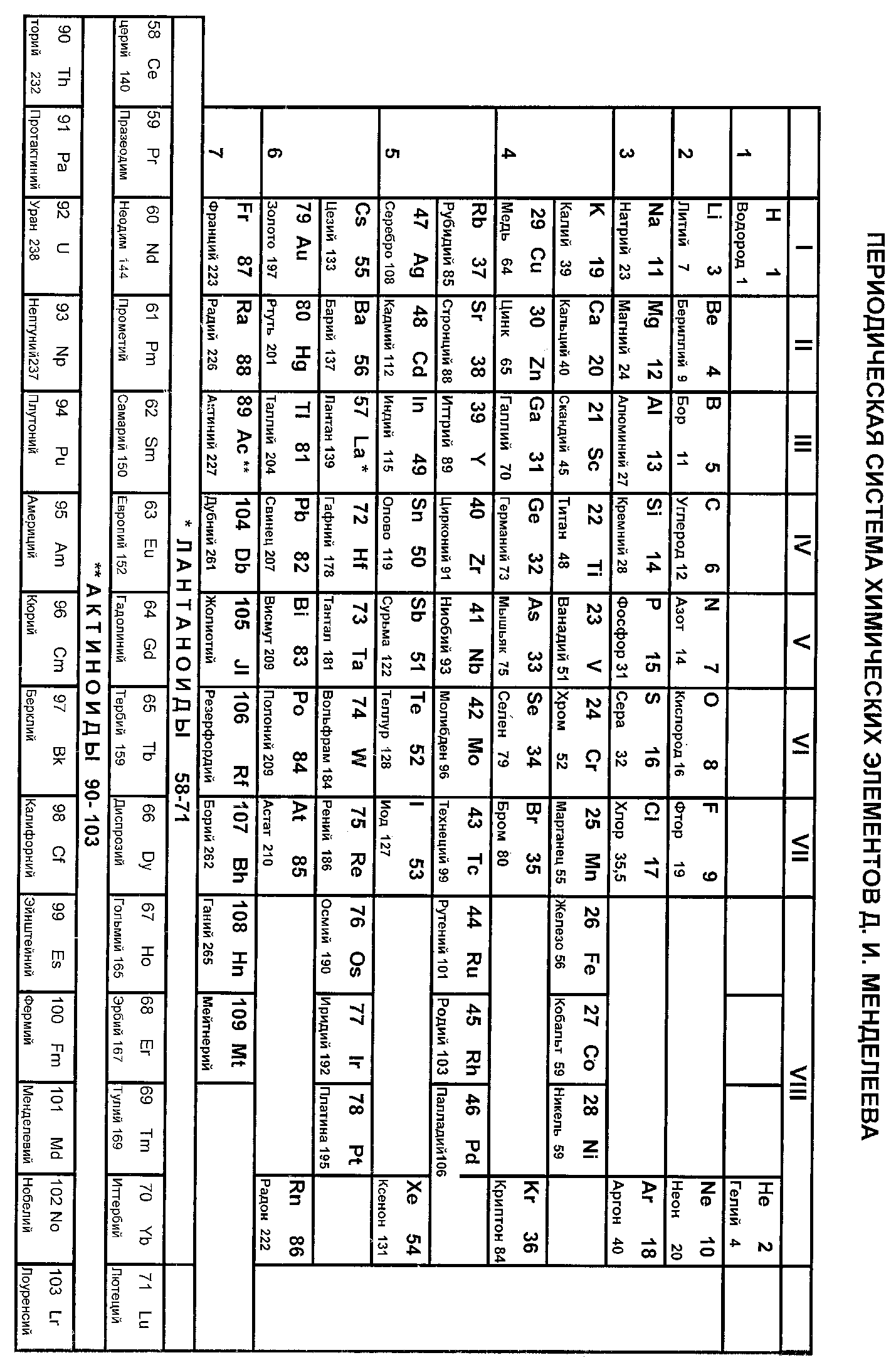
Приложение 2
Приложение 3
План характеристики химического элемента
по периодической системе Д. И. Менделеева
I. Положение элемента в периодической системе:
1. Порядковый номер, название.
2. Период (большой, малый).
3. Ряд.
4. Группа, подгруппа.
5. Относительная атомная масса.
II. Строение атома элемента:
1. Заряд ядра атома.
2. Формула состава атома (количество р+; n0; е- ).
3. Схема строения атома.
4. Формула электронной конфигурации.
5. Квантовые ячейки.
6. Число е- на последнем уровне.
7. Металл или неметалл.
III. Формулы соединений:
1. Летучего водородного соединения (для неметаллов).
2. Оксида.
3. Гидроксида (основания или кислоты).
IV. Химический характер соединений, его доказательство:
1. Кислотный: кислотный оксид + щелочь; кислота + основание.
2. Основный: основный оксид + кислота; основание + кислота.
3. Амфотерный: (1 и 2).
V. Сравнение металлических и неметаллических свойств с соседями:
1. По периоду.
2. По группе.
(Металлы с неметаллами не сравнивать)
Приложение 4

ОТВЕТЫ
Контрольная работа № 1
Атомы химических элементов
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
1
3
3
1
4
3
Вариант 2
2
3
2
4
4
3
Вариант 3
3
3
3
1
1
4
Вариант 4
2
4
1
2
3
2
Часть 2
В1
В2
В3
Вариант 1
1663
345
208
Вариант 2
2654
124
102
Вариант 3
6215
145
101
Вариант 4
4632
136
142
Часть 3
План характеристики
Вариант 1
Вариант 2
Вариант 3
Вариант 4
I. Положение
элемента
в периодической
системе:
1. порядковый номер, название
Z = 11
Z = 16
Z = 14
Z = 20
2. период
(большой, малый)
3, малый
3, малый
3, малый
4, большой
3. ряд
3
3
3
3
4. группа, подгруппа
1, главная
6, главная
4, главная
2, главная
5. относительная
атомная масса
Ar = 23
Ar = 32
Ar = 28
Ar = 40
II. Строение
атома элемента
1. заряд ядра атома
+q = + 11
+q = + 16
+q = + 14
+q = + 20
2. формула
состава атома
(количество р; n; е- )
Na (11p;12n;) 11 е-
S (16p; 16n;) 16 е-
Si (14p;14n;) 14е-
Ca (20p;20n;)
20 е-
3. схема
строения атома
+11 Na ) ) )
2 8 1
+16 S ) ) )
2 8 6
+14 Si ) ) )
2 8 4
+20 Ca ) ) ) )
2 8 8 2
4. формула
электронной
конфигурации
1s2 2s2 2p6 3s1
1s2 2s2 2p6 3s23p4
1s2 2s2 2p6 3s23p2
1s2 2s2 2p6 3s23p64s2
5. число е-
на последнем уровне,
металл или неметалл
1, металл
6, неметалл
4, неметалл
2, металл
III. Сравнение
металлических и неметаллических свойств с соседями:
1. по периоду
Na >Mg
S >P
S < Cl
Si < C
Ca >Sc
Ca < K
2. по группе (металл с неметаллом
не сравнивать)
Na >Li
Na < K
S > Se
S < O
Si < P
Ca >Mg
Ca < Sr
Схема строения
иона
+11 Na+ ) )
2 8
+16 S2- ) ) )
2 8 8
+14 Si4+ ) )
2 8
+20 Ca2+ ) ) )
2 8 8
Контрольная работа № 2
Простые вещества. Количественные соотношения
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
2
3
3
2
4
1
Вариант 2
3
4
2
2
4
4
Вариант 3
2
3
3
3
2
1
Вариант 4
1
4
3
3
4
3
Часть 2
В1
В2
В3
Вариант 1
2431
6,0
44,8
Вариант 2
2134
36,0
67,2
Вариант 3
4132
66,0
89,6
Вариант 4
3412
0,5
44,8
Часть 3
Вар-т
Содержание верного ответа и указания по оцениванию
Баллы
Элементы ответа:
1. Записано краткое условие задачи
2. Приведены формулы для нахождения объема и количества вещества.
3. Рассчитаны количество вещества и объем углекислого газа; записан ответ
Ответ правильный и полный
3
В ответе допущена ошибка в одном элементе
2
В ответе допущена ошибка в двух элементах
1
Все элементы ответа записаны неверно
0
1
Решение
Дано: V = Vm • n n = 160 г /32 г/моль n = 5 моль
m (О2 ) = 160 г n = m / M V = 22,4 л/моль • 5 моль V = 112 л
V (О2) = X л
Ответ: объем кислорода 112 л
2
Решение
Дано: V = Vm • n n = 140 кг /28 кг/кмоль n = 5 кмоль
m (N2 ) = 140 кг n = m / M V = 22,4 м3/кмоль • 5 кмоль V = 112 м3
V (N2) = X м3
Ответ: объем азота 112 м3
3
Решение
Дано: V = Vm • n n = 20 г /2 г/моль n = 10 моль
m (Н2 ) = 20 г n = m / M V = 22,4 л/моль • 10 моль V = 224 л
V (Н2 ) = X л
Ответ: объем водорода 224 л
4
Решение
Дано: V = Vm • n n = 6,8 г /34 г/моль n = 0,2 моль
m (h3S ) = 6,8 г n = m / M V = 22,4 л/моль • 0,2 моль V = 4,48 л
V (h3S) = X л
Ответ: объем сероводорода 4,48 л
Контрольная работа № 3
Соединения химических элементов
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
2
1
4
3
4
1
Вариант 2
3
4
2
3
4
2
Вариант 3
2
3
4
4
1
2
Вариант 4
2
1
3
1
2
1
Часть 2
В1
В2
В3
Вариант 1
4512
135
65,3
Вариант 2
6425
256
47,1
Вариант 3
6423
245
76,2
Вариант 4
6543
246
12,0
Часть 3
Вар-т
Содержание верного ответа и указания по оцениванию
Баллы
Элементы ответа:
1. Записано краткое условие задачи
2. Приведены формулы для нахождения объема и количества вещества.
3. Рассчитаны количество вещества и объем углекислого газа; записан ответ
Ответ правильный и полный
3
В ответе допущена ошибка в одном элементе
2
В ответе допущена ошибка в двух элементах
1
Все элементы ответа записаны неверно
0
1
Решение
Дано: V (О2) = Vвоз • φ (О2) V (О2) =
Vвоз • φ (О2) V (О2) = 200 • 21 %
200 • 21 %
Vвоз. = 200 л 100 % 100 %
φ (О2) = 21 %
V (О2) = X л V (О2) = 42 л
42 л
Ответ: объем кислорода 42 л
2
Решение
Дано: Vвоз. = V(N2) • 100 % Vвоз. =
V(N2) • 100 % Vвоз. = 39 • 100 %
39 • 100 %
V(N2). = 39 л φ (N2) 78 %
φ (N2) = 78 %
V воз. = X л V воз. =50 л
Ответ: объем воздуха 50 л
3
Решение
Дано: V (СН4) = Vвоз • φ (СН4) V (Ch5) =
Vвоз • φ (СН4) V (Ch5) = 500 • 95 %
500 • 95 %
Vпр.газа. = 500 л 100 % 100 %
φ (СН4) = 95 %
V (СН4) = X л V (Ch5) = 475 л
475 л
Ответ: объем метана 475 л
4
Решение
Дано: Vвоз. = V(О2) • 100 % Vвоз. =
V(О2) • 100 % Vвоз. = 50 • 100 %
50 • 100 %
V(О2). = 50 л φ (О2) 21 %
φ (О2) = 21 %
V воз. = X л V воз. = 238,1 л
238,1 л
Ответ: объем воздуха 238,1 л
Контрольная работа № 4
Изменения, происходящие с веществами
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
4
4
2
1
3
1
Вариант 2
1
2
1
1
3
4
Вариант 3
1
3
3
1
2
3
Вариант 4
3
1
1
3
3
1
Часть 2
В1
В2
Вариант 1
1652
25
Вариант 2
6425
36
Вариант 3
2143
26
Вариант 4
3145
13
Часть 3
Вар-т
Содержание верного ответа и указания по оцениванию
Баллы
Элементы ответа:
1. Записано краткое условие задачи
2. В уравнении химической реакции записаны необходимые данные.
3. Составлена и решена пропорция, записан ответ
Ответ правильный и полный
3
В ответе допущена ошибка в одном элементе
2
В ответе допущена ошибка в двух элементах
1
Все элементы ответа записаны неверно
0
1
Дано: 39,2 г Х г
m (Cu(OH)2) = 39,2 г Cu(OH)2 = CuO + h3O
m (CuO) = Х г 1 моль 1 моль
98 г/моль 80 г/моль
98 г 80 г
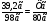
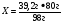
Х = 32 г
Ответ: образуется 32 г оксида меди
2
Дано: 198 г Х г
m (Zn(OH)2) = 198 г Zn(OH)2 = ZnO + h3O
m (ZnO) = Х г 1моль 1 моль
99 г/моль 81 г/моль
99 г 81 г
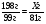
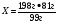
Х = 162г
Ответ: образуется 162 г оксида цинка
3
Дано: 45 г Х г
m (Fe(OH)2) = 45 г Fe(OH)2 = FeO + h3O
m (FeO) = Х г 1 моль 1 моль
90 г/моль 72 г/моль
90 г 72 г
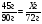
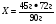
Х = 36 г
Ответ: образуется 36 г оксида железа
4
Дано: 112 г Х г
m (CаО) = 112 г CаO + h3O = Са(ОН)2
m (Cа(ОН)2 ) = Х г 1 моль 1 моль
56 г/моль 74 г/моль
56 г 74 г
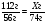
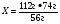
Х = 148 г
Ответ: образуется 148 г гидроксида кальция
Контрольная работа № 5
Классы неорганических соединений
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
2
1
2
1
2
3
Вариант 2
2
3
2
4
1
1
Вариант 3
4
3
1
2
1
3
Вариант 4
1
2
3
4
3
1
Часть 2
В1
В2
В3
Вариант 1
5421
1236
125
Вариант 2
5364
1246
125
Вариант 3
2145
1246
135
Вариант 4
5432
1356
246
Часть 3 (возможный вариант ответа)
Вар-т
Содержание верного ответа и указания по оцениванию
Баллы
Элементы ответа:
1. Записано уравнение реакции в молекулярном виде, указан тип реакции.
2. Записано полное и сокращенное ионное уравнение
Правильно записаны два уравнения в молекулярном виде и два уравнения в ионном виде, указан тип реакции
4
В ответе допущена ошибка в одном уравнении реакции
3
В ответе допущена ошибка в двух уравнениях реакций
2
В ответе допущена ошибка в трех уравнениях реакций
1
Все элементы ответа записаны неверно
0
1
1) h3SO4 + MgO = MgSO4 + h3O – реакция обмена
2H+ + SO + MgO = Mg2+ + SO
+ MgO = Mg2+ + SO + h3O
+ h3O
2H+ + MgO = Mg2+ + h3O
2) h3SO4 + Mg(OH)2 = MgSO4 + 2h3O – реакция обмена
2H+ + SO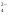 + Mg(OH)2 = Mg2+ + SO
+ Mg(OH)2 = Mg2+ + SO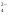 + 2h3O
+ 2h3O
2H+ + Mg(OH)2 = Mg2+ + 2h3O
2
1) 2HCl + Zn(OH)2 = ZnCl2 + 2h3O – реакция обмена
2H+ + 2Cl + Zn(OH)2 = Zn2+ + 2Cl
+ Zn(OH)2 = Zn2+ + 2Cl + 2h3O
+ 2h3O
2H+ + Zn(OH)2 = Zn2+ + 2h3O
2) 2HCl + Zn = ZnCl2 + h3 – реакция замещения
2H+ + 2Cl + Zn = Zn2+ + 2Cl
+ Zn = Zn2+ + 2Cl + h3
+ h3
2H+ + Zn = Zn2+ + h3
3
1) h4PO4 + 3NaOH = Na3PO4 + 3h3O – реакция обмена
3H+ + PO + 3Na+ + 3OH
+ 3Na+ + 3OH = 3Na+ + РO
= 3Na+ + РO + 3h3O
+ 3h3O
H+ + OH = h3O
= h3O
2) 2h4PO4 + 3Na2O = 2Na3PO4 + 3h3O – реакция обмена
6H+ + 2PO + 3Na2O = 6Na+ + 2PO
+ 3Na2O = 6Na+ + 2PO + 3h3O
+ 3h3O
2H+ + Na2O = 2Na+ + h3O
4
1) 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2h3O – реакция обмена
2H+ + 2NO + Ca2+ + 2OH
+ Ca2+ + 2OH = Ca2+ + 2NO
= Ca2+ + 2NO + 2h3O
+ 2h3O
H+ + OH = h3O
= h3O
2) N2O5 + Ca(OH)2 = Ca(NO3)2 + h3O – реакция обмена
N2O5 + Ca2+ + 2OH = Ca2+ + 2NO
= Ca2+ + 2NO + h3O
+ h3O
N2O5 + 2OH = 2NO
= 2NO + h3O
+ h3O
Контрольная работа № 6
Итоговая контрольная работа за курс 8 класса
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
3
3
1
3
3
2
Вариант 2
4
4
2
2
1
2
Вариант 3
4
1
4
1
2
1
Вариант 4
4
4
1
2
3
2
Часть 2
В1
В2
В3
Вариант 1
5431
146
7,5
Вариант 2
6451
234
10,0
Вариант 3
3512
123
9,0
Вариант 4
2561
234
10,0
Часть 3 (возможный вариант ответа)
Вар-т
Содержание верного ответа и указания по оцениванию
Баллы
Правильно записаны 4 уравнения в молекулярном виде, указан тип реакции, названы сложные вещества
4
В одном уравнении реакции допущена ошибка или ответ неполный
3
В двух уравнениях реакций допущена ошибка или ответ неполный
2
В трех уравнениях реакций допущена ошибка или ответ неполный
1
Все элементы ответа записаны неверно
0
1
1) 2Fe(OH)3 = Fe2O3 + 3h3O – реакция разложения
гидроксид оксид вода
железа(III) железа(III)
2) Fe2O3 + 3Н2 = 2Fe + 3Н2О – реакция замещения
3) Fe + h3SO4 = FeSO4 + h3 – реакция замещения
серная сульфат
кислота железа(II)
4) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 – реакция обмена
гидроксид гидроксид сульфат
натрия железа (II) натрия
2
1) 2Na + 2h3O = 2NaOH + h3 - реакция замещения
вода гидроксид
натрия
2) 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl – реакция обмена
хлорид гидроксид хлорид
меди (II) меди (II) натрия
3) Cu(OH)2 = CuO + h3O– реакция разложения
оксид
меди(II)
4) CuO + h3 = Cu + h3O– реакция замещения
3
1) Zn + 2HCl = ZnCl2 + h3 - реакция замещения
соляная хлорид
кислота цинка
2) ZnCl2+ 2NaOH = Zn(OH)2 + 2NaCl – реакция обмена
гидроксид гидроксид хлорид
натрия цинка натрия
3) Zn(OH)2 + 2HNO3= Zn(NO3)2 + 2h3O – реакция обмена
азотная нитрат вода
кислота цинка
4) Zn(OH)2 = ZnO + h3O– реакция разложения
оксид
цинка
4
1) Fe + 2HСl = FeCl2 + h3 – реакция замещения
соляная хлорид
кислота железа (II)
2) FeCl2+ 2NaOH = Fe(OH)2 + 2NaCl – реакция обмена
гидроксид гидроксид хлорид
натрия железа (II) натрия
3) Fe(OH)2 = FeO + h3O – реакция разложения
гидроксид оксид вода
железа(II) железа(II)
4) FeO + 3Н2 = 2Fe + 3Н2О – реакция замещения
infourok.ru
Химия 8 класс. Тематические и итоговые контрольные работы. | Контрольные работы по Химии
Химия 8 класс. Тематические и итоговые контрольные работы.
03.11.2014 38764 0 Контрольная работа №1.
Первоначальные химические понятия
Вариант №1
Задание №1
Определите, из какого числа атомов состоят молекулы, сколько молекул веществ, формулы которых приведены ниже:
5O3, N2, 2h3O, Al, P2O5, 3h3SO4.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Р + О2 = Р2О5
Б) WO3 + h3 = W + h3O
В) Cu(OH)2 = CuO + h3O
Г) AlCl3 + KOH = Al(OH)3 + KCl
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
Mn2O3, Mn2O7 , MnO.
Задание №4
Выпишите, какая масса железа входит в состав оксида железа (III) массой 60 грамм.
Вариант №2
Задание №1
Определите, из какого числа атомов состоят молекулы, сколько молекул веществ, формулы которых приведены ниже:
SiO2, 3h4PO4, Mg, h3, 4SO3, 2Br2
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Ch5 = C + h3
Б) Al + Cl2 = AlCl3
В) Na + h3SO4 = Na2SO4 + h3
Г) Fe2O3 + h3SO4 = Fe2(SO4)3 + h3O
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
SO, SO2, SO3.
Задание №4
В какой массе оксида алюминия Al2O3 содержится 27кг. алюминия.
Вариант №3
Задание №1
Определите, из какого числа атомов состоят молекулы, сколько молекул веществ, формулы которых приведены ниже:
2Al2O3, Cu, 2h3CO3, Cl2, Ch4COOH, 5NaCl.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Fe + CuSO4 = FeSO4 + Cu
Б) CaCO3 = CaO + CO2
В) Na2SO4 + BaCl2 = NaCl + BaSO4
Г) Li + O2 = Li2O
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
Fe2O3, FeO, Fe3O4.
Задание №4
Сколько граммов натрия содержит в 400г чистой поваренной соли?
Вариант №4
Задание №1
Из приведённых ниже формул веществ распределите отдельно простые и сложные вещества.
Озон – О3, вода – Н2О, сероводород – Н2S, азот – N2, алмаз – С, метан – СН4, медный купорос – CuSO4, сера – S8, этиловый спирт – C2H5OH, углекислый газ – CO2, медь – Cu, аммиак – Nh4.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Al + O2 = Al2O3
Б) Fe(OH)3 = Fe2O3 + h3O
В) CuO + h3 = Cu + h3O
Г) CuCl2 + NaOH = Cu(OH)2 + NaCl
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
CrO3, Cr2O3, CrO.
Задание №4
Вычислите массу углерода, содержащегося в 176г. углекислого газа (CO2)
Вариант №5
Задание №1
Поваренная соль- NaCl, кислород –O2, железо- Fe, уксусная кислота- Ch4COOH, графит- С, золото- Au, марганцовка-KMnO4, кремнезём – SiO2, пирит – FeS, вода – h3O, фосфор – Р, угарный газ – СО.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А)KClO3 = KCl + O2
Б) Na + O2 = Na2O
В) Al2O3 + h3SO4 = Al2(SO4)3 + h3O
Г) Fe + HCl = FeCl3 + h3
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
N2O, NO, N2O3.
Задание №4
Выпишите массу железа в 66г. сульфата железа (II) FeS.
Вариант №6
Задание №1
Приведите три примера простых веществ, молекулы которых состоят из двух атомов и два примера сложных веществ, молекулы которых состоят из двух атомов.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) (Cu OH)2CO3 = CuO + CO2 + h3O
Б) Ca + h4PO4 = Ca3(PO4)2 + h3
В) K2O + P2O5 = K3 PO4
Г) CaCO3 + Na3PO4 = Na2CO3 + Ca3(PO4)2
Задание №3
Определите массовую долю хлорида калия в сильвините (KCl * NaCl), если в нём имеется 10% примесей.
Задание №4
В какой массе медного купороса CuSO4 * 5h3O содержится 90г. воды?
Контрольная работа №2
«Кислород. Оксиды. Горение»
Вариант №1
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Al + …= Al2O3
Б) Ca + O2 = …
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
Ch5 + O2 =
Задание №3
Даны следующие вещества: h3O и h3O2 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды: h3O, MgCl2, h3SO4, SO3, h3S, P2O5, Na2SiO3, Al2O3, KOH, Mn2O7.
Вариант №2
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) С + … = СО2
Б) К + О2 = …
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
С2Н6 + О2 =
Задание №3
Даны следующие вещества: h3O и KMnO4 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды: h3CO3, SO2, Al(OH)3, Cr2O7, h4PO4, Mn2O3, BaO, NaNO3, CuO.
Вариант №3
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Fe + … = Fe2O3
Б) … + О2 = MgO
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
С3Н8 + О2 =
Задание №3
Даны следующие вещества: KClO3 и h3O рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды
Cu2O, K2SO4, WO3, HCl, h3O2, HNO3, N2O5, BaCl2, FeO, Zn(OH)2.
Вариант №4
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Cu +… = CuO
Б) N2…+ O2=
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
C2h5 + O2 =
Задание №3
Даны следующие вещества: KClO3 и h3O2 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды
MgO, CaCO3, Fe3O4, CuCl2, SO2, Nh4, N2O5, h3SO3, NaOH, K2O.
Вариант №5
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Hg + … =HgO
Б) … + O2 = SO3
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
C2h3 + O2 =
Задание №3
Даны следующие вещества: KClO3 и KMnO4 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды: Ag2O, Ca(OH)2, BaO, h3SO4, N2O3, CuCl2, h3O, Al2(SO4)3, CO2.
Вариант №6
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) SO2 + … = SO3
Б) h3S + …= h3O + SO2
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
C4h20 + O2 =
Задание №3
Известно, что в организме человека большую часть составляет кислород ( массовая доля кислорода составляет приблизительно 65%). Рассчитайте массу кислорода в организме человека массой 50кг. Найдите массу кислорода в вашем организме.
Задание №4
Выпишите из приведённых ниже формул формулы:
а) оксидов металлов, б) оксидов неметаллов, дайте названия:
SiO2, Nh4, h3CO3, CaO, KOH, Ch5, Cr2O3, BaS, PbO2, HClO3, HF, V2O5, NO.
Контрольная работа №3
Водород. Кислоты. Соли.
Вариант №1
Задание №1
Составьте уравнения реакций взаимодействия водорода с а) кислородам, б) оксидом ртути (II), в) натрием.
Задание №2
С какими из данных веществ реагирует серная кислота Са, О2, СuO, CO2, K2O, напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность. h3O, Mg(NO3)2, HCl, SO3, CaCO3, h4PO4, NaOH, BaSO4, HNO3, Cl2.
Задание №4
Вычислите количество вещества и массу цинка, который может полностью прореагировать с 980 грамм серной кислоты.
Вариант №2
Задание №1
Составьте уравнения реакций взаимодействия водорода с а) бромом, б) оксидом свинца, в) магнием.
Задание №2
С какими из данных веществ реагирует фосфорная кислота Na, О2, MgO, CO2, ZnO, напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность.
BaCl2, Al(OH)3, HNO3, Nh4, CuSO4, h3SiO3, Br2, Na2S, HCl.
Задание №4
Вычислите количество вещества и массу оксида меди (II) вступившего в реакцию с водородом, если в результате было получено 192 грамма меди.
Вариант №3
Задание №1
Составьте уравнения реакций взаимодействия водорода с а) хлором, б) оксидом вольфрама, в) калием.
Задание №2
С какими из данных веществ реагирует соляная кислота Mg, Cu, P2O5, Al2O3, CaO напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность.
CO2, MgCl2, h3CO3, KOH, h3S, h3O2, Na2, SO3, P, Ca3(PO4)2, h3SO4.
Задание №4
Вычислите количество вещества и массу оксида меди (II), который полностью прореагировал с серной кислотой, если известно, что сульфаты меди получено в этой реакции 48 грамм.
Вариант №4
Задание №1
Составьте уравнения реакций взаимодействия водорода с
а) оксидом железа (III), б) серой, в) азотом.
Задание №2
С какими из данных веществ реагирует азотная кислота Ba, Ag, SO2, K2O, Al2O3. напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность. NaNO3, P2O5, h3SO4, S, HBr, K2SiO3, FeCl3, h4PO4.
Задание №4
Вычислите количество вещества и массу водорода, который образуется при взаимодействии 8 моль Al с соляной кислотой.
Вариант №5
Задание №1
Запишите реакции получения водорода в результате взаимодействия цинка с кислотами а) соляной; б) серной; в) фосфорной.
Задание №2
В приведённых схемах вставьте формулы неизвестных веществ, напишите уравнения реакций, дайте названия реагирующих веществ и продуктов реакций:
а) X+h3SO4 →ZnSO4+Y
б) MgO+X→Y+h3O
в) X+Y→Ca3(PO4)2+h3O
Задание №3
Какие оксиды соответствуют следующим кислотам, запишите их формулы: h3SO4, h4PO4, h4PO3, h4BO3, h3SiO3.
Задание №4
Вычислите, в каком из приведенных случаев водорода образуется больше в реакциях соляной кислоты HCl с:
а) 3,2г алюминия
б) 3,2г цинка
Вариант №6
Задание №1
Приведите примеры реакций: а) разложения; б) замещения, в которых водород выделяется в качестве продукта реакции.
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Al2O3→Al→ Al2O3→ Al2(SO4)3
Задание №3
В приведенных формулах солей Na2S, Na3PO4, AlCl3, Fe2(SO4)3, Na2CrO4, CaI2 выделите кислотные остатки, определите их валентность, приведите формулы соответствующих кислот.
Задание №4
Сожгли 6 молей фосфора. Полученный оксид растворили в воде. Определите массу оксида фосфора, образовавшегося при сжигании.
О – срез знаний по химии 9 класс
Задание №1
Запишите реакции получения водорода в результате взаимодействия цинка с кислотами а) соляной; б) серной; в) фосфорной.
Задание №2
В приведённых схемах вставьте формулы неизвестных веществ, напишите уравнения реакций, дайте названия реагирующих веществ и продуктов реакций:
а) X+h3SO4 →ZnSO4+Y
б) MgO+X→Y+h3O
в) X+Y→Ca3(PO4)2+h3O
Задание №3
Какие оксиды соответствуют следующим кислотам, запишите их формулы: h3SO4, h4PO4, h4PO3, h4BO3, h3SiO3.
Задание №4
Вычислите, в каком из приведенных случаев водорода образуется больше в реакциях соляной кислоты HCl с:
а) 3,2г алюминия
б) 3,2г цинка
Задание №5
Приведите примеры реакций: а) разложения; б) замещения, в которых водород выделяется в качестве продукта реакции.
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Al2O3→Al→ Al2O3→ Al2(SO4)3
Задание №7
В приведенных формулах солей Na2S, Na3PO4, AlCl3, Fe2(SO4)3, Na2CrO4, CaI2 выделите кислотные остатки, определите их валентность, приведите формулы соответствующих кислот.
Задание №8
Сожгли 6 молей фосфора. Полученный оксид растворили в воде. Определите массу оксида фосфора, образовавшегося при сжигании.
tak-to-ent.net
Контрольные работы по химии - Химия - Учительский портал
РАЗРАБОТКИ | Страница 2 В категории разработок: 63 Фильтр по целевой аудитории - Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя  Я учитель химии КШИ г. Бугульмы . Предлагаю Вашему вниманию разработанную мною небольшую диагностическую работу по теме " Классы неорганических веществ в 3-х вариантах.Удобно использовать для текущего контроля усвоения материала в 8 классе 2 четверть. (Автор учебника О,С, Габриелян) Целевая аудитория: для учителя Контрольная работа(тестирование) была составлена на основе обязательного минимума содержания курса химии для 9 класса по теме «Металлы». Задания составлены согласно требованиям стандарта образования. Контрольная работа состоит из 2-х вариантов по 10 вопросов в каждом. Тестовые задания содержат теоретические вопросы и задачи. Целевая аудитория: для 9 класса Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 9 класса по теме: «Металлы».Тест в двух вариантах по 20 вопросов в каждом. Тестовые задания содержат теоретические вопросы и задачи, решение которых позволит школьникам более глубоко усвоить знания по химии. Целевая аудитория: для 9 класса Пособие состоит из текстов контрольных работ в тестовой форме в параметрах ЕГЭ, соответствующих программе химии для 8 класса О. С. Габриеляна и приложений: периодическая система химических элементов, таблица растворимости, бланк для ответов. Пособие предназначено учителям для проведения на уроках тематического и итогового контроля по основным темам курса. Целевая аудитория: для 8 класса Контрольная работа предназначена для учащихся 10 класса, где химия изучается на базовом уровне(1 час.) Работа содержит задания А с выбором одного правильного ответа,задания В на соответствие.Здесь необходимо выбрать формулу класса.В задании С решить задачу и записать уравнения реакций. Целевая аудитория: для 10 класса Контрольная работа по данной теме построена по типу ГИА.Даны задания с выбором одного ответа.Есть возможность проверить умения решать расчётные задачи, знание свойств.Можно как и в работе ГИА увидеть умение составлять ионные уравнения и переход на сокращённое ионное.Для определения ретинга учащихся можно каждый шаг в решении оценить по однобаллной системе. Целевая аудитория: для 9 класса Данная контрольная работа содержит 6 вариантов, каждый итз которых разработан на трёх уровнях сложности. Направлена работа на проверку знаний об ионных уравнений и овр и умений составлять ионные уравнения и электронный баланс к овр, а так же проверяет умения вести расчёт по уравнениям реакций, сли одно из реагирующих веществ дано в избытке. Можно использовать как входящий мониторинг остаточных знаний в 9 классе после уроков повторения по УМК Габриеляна Целевая аудитория: для 9 класса Контрольная работа разработана к УМК О.С.Габриеляна 8 класс. Содержит 14 вариантов, проверяет следующие элементы: определение типа химической реакции по уравнению, дописать уравнения определённого химического типа, произвести расчёт по уравнению реакции, ответить на теоретический вопрос, содержащий основное понятие данной темы Целевая аудитория: для 8 класса Работа предназначена для учащихся 11 класса, занимающихся по программе и учебнику О.С.Габриеляна «Химия.11 класс. Базовый уровень». Составлена по типу ЕГЭ, содержит 11 заданий уровня А, 2 задания уровня B, 1 задание уровня С, 3 варианта. Целевая аудитория: для 11 класса Контрольная работа составлена в тестовой форме в 2-х вариантах. Соответствует учебнику Рудзитиса и Фельдмана. Итоговый контроль по теме. Целевая аудитория: для 8 класса | Конкурсы  Диплом и благодарность каждому участнику! | 
© 2007 - 2017 Сообщество учителей-предметников "Учительский портал"Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.Территория распространения: Российская Федерация, зарубежные страны.Адрес редакции: 352192, г. Гулькевичи, ул. Ленинградская 34-19Учредитель: Никитенко Евгений ИгоревичКонтакты: [email protected]
Использование материалов сайта возможно только с разрешения администрации портала.
Ответственность за разрешение любых спорных вопросов, касающихся опубликованных материалов и их содержания, берут на себя пользователи, разместившие материал на сайте.Администрация портала готова оказать поддержку в решении любых вопросов, связанных с работой и содержанием сайта.

www.uchportal.ru
📝Как правильно написать контрольную работу по химии?
Казалось бы, ничего сложного – есть учебник, где все разложено по полочкам, есть задачники и решебники, есть пособия по практикуму, есть, наконец, лекции преподавателя. Да и сам учитель не прочь помочь, если школьник (студент) заинтересован в получении хорошей оценки за контрольную работу.
Весь фокус в том, что химия относится к предметам, где учебного материала много, и некоторые вещи надо просто принимать на веру, их нельзя потрогать руками. Почему происходит именно так в конкретной химической реакции – это объяснить можно, но понять предмет могут не все учащиеся. Это особенность химии, как учебного предмета, поэтому все проверочные работы, к которым относятся и контрольные работы, требуют отдельной подготовки.

Виды контрольных работ по химии
- Теоретические контрольные работы требуют глубокого знания материала, умения логично обосновать гипотезу и доказать ее, используя химические законы. Несмотря на сложность таких контрольных работ, большинство студентов справляются с написанием самостоятельно. Однако затем может последовать череда доработок по требованиям преподавателя: по содержанию, по оформлению, по доказательности выводов и прочее.
Часть контрольных работ проходит в кратком варианте, как проверочные тесты. Здесь нужны прочные знания, внимательность и умение вчитываться в текст задания. Не надо торопиться, только вдумчивое прочтение задания обеспечивает успех. И, конечно, знания по предмету, то есть посещение лекций. Но порой написать контрольную легче, чем постоянно ходить на лекции, поэтому к контрольным надо готовиться специально.

Поскольку это лишь проверочные контрольные заботы, переписать их не составит труда, тем более в очной форме обучения. Труднее придется студентам-заочникам, у которых нет лишнего времени на переписывание работы и исправление ошибок. В этом случае, можно обратиться к специалистам нашего сайта, которые помогут правильно написать контрольную работу за любой курс химии. Заочникам не повезло еще и в том, что нужные пособия не всегда можно найти в магазинах учебной книги, преподаватели любят использовать свои наработки. Но наши специалисты знают химию не хуже преподавателей ВУЗов, обращайтесь и вам помогут разобраться в трудных вопросах.
Чтобы заказать контрольную по химии переходите по ссылке //matemonline.com/reshenie-kontrolnyh-rabot-po-himii/, по другим предметам: русский язык — //matemonline.com/napisanie-kontrolnyh-rabot-po-russkomu-jazyku/, экономика — //matemonline.com/reshenie-kontrolnyh-rabot-po-ekonomike/, аудит — //matemonline.com/reshenie-kontrolnyh-rabot-po-auditu/
- Контрольные работы с решением задач по химии – это проблема, которую можно решить только действительно понимая смысл химических реакций. Желательно, конечно, посещать какой-либо факультатив по решению задач, но иногда достаточно постоянной работы с решебником. Задачи по химии могут быть невероятно просты по содержанию и сложны для решения, и если затруднения самостоятельно преодолеть не удается, то лучше обратиться к специалистам, которые не только помогут решить задачи, но и дадут объяснения, почему решение должно быть именно такое.

- Краткие контрольные работы по химии – это по сути те же проверочные тесты, только проводятся они при завершении изучения определенной темы. К ним надо быть готовыми всегда, поскольку такие контрольные работы не даются на дом, их проводят в течение уроков (учебных пар). Как правило, преподаватели пользуются готовыми вариантами кратких тестов, поэтому достаточно иметь при себе сборник тестов по химии, и с контрольной работой вы справитесь самостоятельно. Если же при проверке будет запрещено пользоваться учебными пособиями, то помогут только знания.
Материалы по теме:
Поделиться с друзьями:
 Загрузка...
Загрузка... matemonline.com
ХИМИЯ КОНТРОЛЬНЫЕ РАБОТЫ
Для студентов I курса медико-биологического факультета, профиль «Биология»
Основные понятия термодинамики: система, процесс, параметры, функции.
Первое начало термодинамики. Энтальпия.
Закон Гесса и следствия из него.
Второе начало термодинамики. Энтропия.
Энергия Гиббса. Критерии самопроизвольности процессов: энтальпийный и энтропийный факторы.
Биоэнергетика.
Обратимые и необратимые реакции. Условия обратимости реакции. Приведите примеры.
Химическое и термодинамическое равновесия.
Константа химического равновесия и факторы, влияющие на ее величину.
Принцип Ле Шателье. Влияние температуры, давления и концентрации на равновесие.
Связь свободной энергии Гиббса с константой равновесия.
Основные понятия и предмет химической кинетики.
Скорость гомогенной реакции. Методы определения скорости реакции.
Зависимость скорости химических реакций от концентрации (закон действующих масс).
Молекулярность реакции. Кинетические уравнения для реакций нулевого, первого и второго порядка.
Зависимость скорости реакции от температуры по Вант-Гоффу.
Понятие об энергии активации. Уравнение Аррениуса. Расчет энергии активации.
Теория активных соударений и переходного комплекса.
Скорость гетерогенных реакций и факторы на неё влияющие.
Сложные химические реакции и их типы.
Фотохимические реакции и факторы, влияющие на их протекание.
Гомогенный и гетерогенный катализ. Понятие о катализаторах.
Механизм гомогенного катализа и стадии гетерогенного.
Теории катализа.
Ферментативный катализ и его особенности. Уравнение Михаэлиса-Ментен.
Понятие о химическом эквиваленте и факторе эквивалентности.
Определение эквивалента вещества в реакциях обмена и окислительно-восстановительных реакциях.
Способы выражения состава раствора: массовая доля, мольная доля, молярная и моляльная концентрация, молярная концентрация эквивалента (нормальная концентрация), титр
Основной закон титриметрического анализа. Объемно-аналитические расчеты.
Объемный, или титриметрический анализ, его сущность и методы.
Требования, предъявляемые к реакциям, используемым в объемном анализе.
Правила пользования мерной посудой (мерные колбы, пипетки).
Кислотно-основное титрование:
Ионное произведение воды и водородный показатель (рН).
Реакция среды в растворах слабых кислот и оснований.
Понятие об активной, потенциальной и общей кислотности.
Буферные системы, их классификация и механизм действия.
Основное уравнение теории буферного действия: уравнение Гендерсона – Гассельбаха.
Буферная емкость и ее определение.
Буферные системы и регуляции кислотно-основного равновесия в организме.
Давление насыщенного пара над жидкостью и факторы, от которых оно зависит.
Относительное понижение давления насыщенного пара. Закон Рауля.
Криоскопическая и эбулиоскопическая зависимости. Физический смысл их постоянных.
Осмос, его механизм. Осмотическое давление с точки зрения термодинамики. Закон Вант-Гоффа.
Дать сравнительную характеристику осмотических свойств разбавленных растворов электролитов и неэлектролитов.
Рассмотреть изучаемые растворы с точки зрения их биологической значимости (плазмолиз, гемолиз, гипо-, гипер- и изотонические растворы) и практического применения в медицине.
Для студентов I курса медико-биологического факультета, профиль «Биология»
Понятие об окислительно-восстановительных реакциях, их видах.
Расчет эквивалентов окислителя и восстановителя.
Применение методов оксидимéтрии в медицинской практике.
Понятие об электрохимических явлениях и причинах их возникновения.
Электродные потенциалы и механизм их возникновения. Уравнение Нернста для электродного потенциала.
Диффузионный и мембранный потенциалы и механизм их возникновения. Диффузионный и мембранный потенциалы в создании биопотенциалов
Основные положения квантовой механики. Понятие о волновой функции, электронном облаке и атомной орбитали.
Уравнение Де-Бройля, Шрёдингера и принцип неопределенности Вернера Хáйзенберга. Квантово-механическая модель атома.
Характеристика энергетического состояния электрона в системе квантовых чисел.
Принцип Пáули, минимума энергии, правило Хунда, правило Клечковского и их использование для объяснения последовательности заполнения электронных оболочек атома.
Понятие о химической связи и механизме её образования. Ковалентная связь и её свойства: энергия, длина, насыщаемость, направленность, полярность.
Метод валентных связей. Валентность атома, его координационно-, валентно-насыщенное и валентно-ненасыщенное состояние.
Дипольный момент связи и её поляризуемость. Ионная связь.
Понятие о гибридизации атомных орбиталей и виды гибридных состояний атома.
Понятие о методе молекулярных орбиталей: основные положения и построение энергетических схем простых молекул.
Водородная связь, механизм образования и её роль в процессах ассоциации.
Понятие о поверхностной энергии и поверхностном натяжении.
Адсорбция, её основные понятия и виды. Уравнение адсорбции Гиббса.
Изотерма поверхностного натяжения. Поверхностная активность. Понятие о поверхностно-активных и неактивных веществах. Правило Дюкло-Траубе.
Ориентация молекул в поверхностном слое. Понятие о липосомах. Структура биологических мембран.
Физическая и химическая адсорбция и их особенности.
Понятие о дисперсных системах и их классификация.
Понятие об аэрозолях, суспензиях и эмульсиях. Особенности получения и очистки.
Строение коллоидных частиц, правила их записи.
Применение дисперсных систем в биологии и медицине.
Вопросы к контрольной итоговой работе №3 по Химии
для студентов I курса медико-биологического факультета, отделение «Биология»
Учение Вернадского о биосфере. Классификация элементов. Понятие о биотиках. Микроэлементозы. Общие закономерности распределения веществ в организме. Факторы, влияющие на распределение. Взаимодействия между макро- и микроэлементами. Биохимические провинции.
Общая характеристика s-элементов. Особенности положения в ПСЭ.
Водород. Общая характеристика. Взаимодействие водорода с кислородом, галогенами, активными металлами и оксидами. Бинарные соединения водорода.
Вода. Физические и химические свойства. Аквакомплексы и кристаллогидраты. Минеральные воды. Жесткость воды и меры её устранения. Апирогенная вода.
Пероксид водорода. Природа связей и химические свойства. Окислительно-восстановительная двойственность. Радикально-ионный механизм разложения в присутствии ионов железа(II). Применение в медицине и фармации.
Общая характеристика элементов IА группы. Химические свойства. Биологическая роль в минеральном балансе организма. Применение соединений лития, натрия и калия в медицине и фармации.
Общая характеристика элементов IIА группы. Химические свойства, Сравнительная характеристика IА и IIА групп. Химические основы применения соединений магния, кальция и бария в медицине и в фармации.
Общая характеристика элементов IIIА группы. Химическая активность бора и алюминия. Антисептические свойства борной кислоты и буры. Применение алюминия в медицине и фармации.
Общая характеристика элементов IVА группы. «Оловянная чума». Химические свойства. Биологическая роль. Применение в медицине фармации.
Общая характеристика элементов VА группы, Химические свойства. Окислительно-восстановительные и кислотно-основные свойства азота, фосфора, мышьяка. Биологическая роль азота, фосфора, мышьяка. Химические основы применения в медицине и фармации аммиака, оксида азота(I), нитрата натрия, оксидов и солей мышьяка, сурьмы и висмута.
Общая характеристика элементов VIА. Кислород. Химическая активность молекулярного кислорода. Классификация кислородных соединений и их общие свойства (оксиды, пероксиды, надпероксиды, озониды). Биологическая роль кислорода. Химические основы применения озона и кислорода, а также соединений кислорода в медицине и фармации.
Сера. Общая характеристика. Физические и химические свойства. Кислотно-основные и окислительно-восстановительные свойства соединений серы. Химические основы применения соединений серы её соединений в медицине и фармации.
Общая характеристика галогенов. Химические свойства. Кислотные и окислительно-восстановительные свойства. Биологическая роль соединений галогенов. Понятие о химизме бактерицидного действия хлора и йода. Применение в медицине, санитарии и фармации соединений галогенов.
Общая характеристика элементов VIВ группы. Хром. Физические и химические свойства. Кислотно-основные и окислительно-восстановительные свойства соединений хрома. Биологическое значение хрома и молибдена в организмах, Химические основы применения соединений хрома и молибдена в фармацевтическом анализе.
Общая характеристика элементов VIIВ группы. Mapганец. Химические свойства. Кислотно-основные и окислительно-восстановительные свойства. Использование перманганата калия как антисептического средства и в фармацевтическом анализе.
Общая характеристика элементов VIIIВ группы. Железо. Химическая активность. Окислительно-восстановительные свойства. Гемоглобин и железосодержащие ферменты. Химическая сущность их действия.
Кобальт и никель. Важнейшие соединения кобальта (II), кобальта (Ш) и никеля (П), Образование комплексных соединений. Кофермент В12.
Общая характеристика элементов IВ группы. Химическая активность. Кислотно-основные и окислительно-восстановительные свойства. Комплексные соединения. Химические основы применения серебра в качестве лечебных препаратов («серебряная марля», колларгол, протаргол и др.)и в фармацевтическом анализе.
Общая характеристика элементов IIВ группы. Химическая активность цинка и ртути. Химизм действия цинкосодержащих ферментов. Химические основы использования соединений цинка и ртути в качестве фармпрепаратов.
studfiles.net
















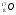
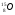
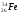
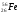
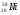
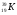 :
: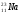





 Vвоз • φ (О2) V (О2) =
Vвоз • φ (О2) V (О2) =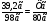
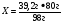
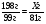
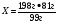
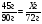
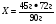
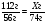
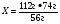
 + MgO = Mg2+ + SO
+ MgO = Mg2+ + SO + Zn(OH)2 = Zn2+ + 2Cl
+ Zn(OH)2 = Zn2+ + 2Cl + 3Na+ + 3OH
+ 3Na+ + 3OH + Ca2+ + 2OH
+ Ca2+ + 2OH


 Загрузка...
Загрузка... 






