|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Уравнение состояния идеального газа. Реферат уравнение менделеева клапейрона
Реферат Уравнение Клапейрона Менделеева
скачатьРеферат на тему:
| Уравнение состояния идеального газа |
| Уравнение Ван-дер-Ваальса |
| Уравнение Дитеричи |
| Уравнение состояния Редлиха — Квонга |
| Уравнение состояния Барнера — Адлера |
| Уравнение состояния Суги — Лю |
| Уравнение состояния Бенедикта — Вебба — Рубина |
| Уравнение состояния Ли — Эрбара — Эдмистера |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где
— давление,
— молярный объём,
— универсальная газовая постоянная
— абсолютная температура,К
Так как , где
— количество вещества, а
, где
— масса,
— молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где — показатель адиабаты,
— внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение
увеличивается.
Литература
- Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А. Г. Стромберга. — 7-е изд., стер. — М.: Высш. шк., 2009. — 527 с. — ISBN 978-5-06-006161-1
wreferat.baza-referat.ru
Уравнение Клапейрона — Менделеева | Бесплатные курсовые, рефераты и дипломные работы
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением
f (p, V, T) = 0 ,
где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1, имеет давление p1 и находится при температуре Т1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами p2, V2, Т2 (рис.63). Переход из состояния 1 в состояние 2 осуществляется в … виде двух процессов:
1) изотермического (изотерма 1 — 1/),
2) изохорного (изохора 1/ — 2).

В соответствии с законами Бойля — Мариотта (41.1) и Гей-Люссака (41.5) запишем:
 (42.1)
(42.1)
 (42.2)
(42.2)
Исключив из уравнений (42.1) и (42.2)  , получим
, получим

Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа
 . (42.3)
. (42.3)
Выражение (42.3) является уравнением Клапейрона, в котором В — газовая постоянная, различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объем Vm . Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению
 (42.4)
(42.4)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона — Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (42.4), полагая, что моль газа находится при нормальных условиях (  = 1,013×105 Па,
= 1,013×105 Па,  = 273,15 K,
= 273,15 K,  = 22,41×10-3 м3/моль): R = 8,31 Дж/(моль×К).
= 22,41×10-3 м3/моль): R = 8,31 Дж/(моль×К).
От уравнения (42.4) для моля газа можно перейти к уравнению Клапейрона — Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm, то при тех же условиях масса m газа займет объем V = (m/M) Vm, где М — молярная масса (масса одного моля вещества). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы m газа
 (42.5)
(42.5)
где  = m/M — количество вещества.
= m/M — количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:  = 1,38×10-23 Дж/К.
= 1,38×10-23 Дж/К.
Исходя из этого, уравнение состояния (42.4) запишем в виде

где  — концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
— концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
 (42.6)
(42.6)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта (И. Лошмидт (1821—1895) — австрийский химик и физик):  2,68×1025 м-3.
2,68×1025 м-3.
refac.ru
Реферат Уравнение Клапейрона
скачатьРеферат на тему:
| Уравнение состояния идеального газа |
| Уравнение Ван-дер-Ваальса |
| Уравнение Дитеричи |
| Уравнение состояния Редлиха — Квонга |
| Уравнение состояния Барнера — Адлера |
| Уравнение состояния Суги — Лю |
| Уравнение состояния Бенедикта — Вебба — Рубина |
| Уравнение состояния Ли — Эрбара — Эдмистера |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где
— давление,
— молярный объём,
— универсальная газовая постоянная
— абсолютная температура,К
Так как , где
— количество вещества, а
, где
— масса,
— молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где — показатель адиабаты,
— внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение
увеличивается.
Литература
- Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А. Г. Стромберга. — 7-е изд., стер. — М.: Высш. шк., 2009. — 527 с. — ISBN 978-5-06-006161-1
wreferat.baza-referat.ru
Реферат Уравнение Клапейрона Менделеева
скачатьРеферат на тему:
| Уравнение состояния идеального газа |
| Уравнение Ван-дер-Ваальса |
| Уравнение Дитеричи |
| Уравнение состояния Редлиха — Квонга |
| Уравнение состояния Барнера — Адлера |
| Уравнение состояния Суги — Лю |
| Уравнение состояния Бенедикта — Вебба — Рубина |
| Уравнение состояния Ли — Эрбара — Эдмистера |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где
— давление,
— молярный объём,
— универсальная газовая постоянная
— абсолютная температура,К
Так как , где
— количество вещества, а
, где
— масса,
— молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где — показатель адиабаты,
— внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение
увеличивается.
Литература
- Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А. Г. Стромберга. — 7-е изд., стер. — М.: Высш. шк., 2009. — 527 с. — ISBN 978-5-06-006161-1
www.wreferat.baza-referat.ru
Уравнение Клапейрона — Менделеева
Количество просмотров публикации Уравнение Клапейрона — Менделеева - 326
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объёмом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, ĸᴏᴛᴏᴩᴏᴇ в общем виде дается выражением
f (p, V, T) = 0 ,
где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объём V1, имеет давление p1 и находится при температуре Т1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами p2, V2, Т2 (рис.63). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов:
1) изотермического (изотерма 1 — 1/),
2) изохорного (изохора 1/ — 2).
В соответствии с законами Бойля — Мариотта (41.1) и Гей-Люссака (41.5) запишем:
(42.1)
(42.2)
Исключив из уравнений (42.1) и (42.2) , получим
Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа
. (42.3)
Выражение (42.3) является уравнением Клапейрона, в котором В — газовая постоянная, различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объём Vm . На основании закона Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объём Vm, в связи с этим постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и принято называть молярной газовой постоянной. Уравнению
(42.4)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона — Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (42.4), полагая, что моль газа находится при нормальных условиях ( = 1,013×105 Па,
= 273,15 K,
= 22,41×10-3 м3/моль): R = 8,31 Дж/(моль×К).
От уравнения (42.4) для моля газа можно перейти к уравнению Клапейрона — Менделеева для произвольной массы газа. В случае если при некоторых заданных давлении и температуре один моль газа занимает молярный объём Vm, то при тех же условиях масса m газа займет объём V = (m/M) Vm, где М — молярная масса (масса одного моля вещества). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы m газа
(42.5)
где = m/M — количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана: = 1,38×10-23 Дж/К.
Исходя из этого, уравнение состояния (42.4) запишем в виде
где — концентрация молекул (число молекул в единице объёма). Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, из уравнения
(42.6)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объёма одинаковое число молекул. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, принято называть числом Лошмидта (И. Лошмидт (1821—1895) — австрийский химик и физик): 2,68×1025 м-3.
referatwork.ru
Уравнение состояния идеального газа Менделеева-Клапейрона с выводом
Уравнение состояния идеального газа показывает корреляцию его основных макропараметров, а именно: объема V, давления P, а также температуры T.

P – давление [Па]
V- объем [м3]
ν - количество вещества [моль]
R – универсальная газовая постоянная, 8,31 [Дж/(моль · К)]
T – температура [K]
Данную формулу также называют уравнением Менделеева-Клапейрона для идеального газа в честь двух ученых впервые получившего (Бенуа Клапейрон (1799 – 1864)) и применившего (Дмитрий Иванович Менделеев (1834 – 1907)) его.
Вывод уравнения Менделеева-Клапейрона
Давление идеального газа зависит от концентрации частиц и температуры тела:
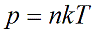
n - концентрация частиц [м-3]
k – константа Больцмана k = 1,38 · 10-23 [Дж/К]
Т – абсолютная температура, в кельвинах [К]
Возьмем основное уравнение МКТ, выведенное через кинетическую энергию:
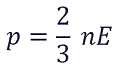
Подставим nkT вместо давления и выразим кинетическую энергию:
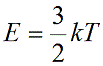
Концентрация частиц газа n равна:
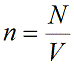
N – число молекул газа в емкости объемом V [м3]. N также можно представить как произведение количества вещества ν и числа Авогадро NA:
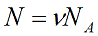
Подставим эти величины в уравнение давления идеального газа (p=nkT):

Произведение числа Авогадро NA и константы Больцмана k дает универсальную газовую постоянную R, которая равна 8,31 [Дж/(моль · К)]. Используя это, упростим уравнение давления и получим искомое уравнение состояния идеального газа:

Учитывая, что количество вещества ν также можно определить, если известны масса вещества m и его молярная масса M:
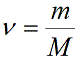
можно привести уравнение к следующему виду:
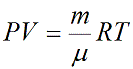
Частными случаями уравнения являются газовые законы, описывающие изопроцессы в идеальных газах, т.е. процессы, при которых один из макропараметров (T, P, V) в закрытой изолированной системе постоянный. Всего этих частных случаев 3.
Закон Бойля-Мариотта - изотермический процесс
Проходит при постоянной температуре: T= const.
P·V = const, то есть для конкретного вещества произведение давления на объем остается постоянным:
P1·V1 = P2·V2.
Закон Гей-Люссака - изобарный процесс
Проходит при постоянном давлении: P = const.
V/T = const, то есть для конкретного вещества отношение объема и температуры остается постоянным:
V1/T1 = V2/T2.
Закон Шарля - изобарный процесс
Проходит при постоянном объеме: V = const.
P/T = const, то есть для конкретного вещества отношение давления и температуры остается постоянным:
P1/T1 = P2/T2.

Понравилась статья, расскажите о ней друзьям:
Скорее всего, Вам будет интересно:
people-ask.ru
1.2. Уравнение Клапейрона-Менделеева
Как уже указывалось, состояние некоторой массы определяется тремя термодинамическими параметрами: давлением р , объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния.
Французский физик Б.Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта и Гей-Люссака.
|
Рис. 49 | Пусть некоторая масса газа занимает объем V1, имеет давление p1 и находится при температуре T1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р2, V2, T2 (рис. 49). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: |
1) изотермического (изотерма 1-1),
2) изохорного (изохора 1-2).
В соответствии с законами Бойля-Мариотта (1.1) и Гей-Люссака (1.4) запишем:
 (1.5)
(1.5)
 . (1.6)
. (1.6)
Исключив из уравнений (1.5) и (1.6) p1' , получим

Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина  остается постоянной, т.е.
остается постоянной, т.е.
 . (1.7) Выражение (1.7) является уравнением Клапейрона, в котором В - газовая постоянная, различная для разных газов.
. (1.7) Выражение (1.7) является уравнением Клапейрона, в котором В - газовая постоянная, различная для разных газов.
Русский ученый Д.И.Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (1.7) к одному молю, использовав молярный объем Vm. Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем Vm, поэтому постоянная В будет одинакова для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной. Уравнению
PVm=RT (1.8)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Менделеева-Клапейрона.
Числовое значение молярной газовой постоянной определим из формулы (1.8), полагая, что моль газа находится при нормальных условиях (р0=1,013105 Па, Т0=273,15 К, Vm=22,4110-3 м3 /моль): R=8,31 Дж/(моль К).
От уравнения (1.8) для моля газа можно перейти к уравнению Клапейрона-Менделеева для произвольной массы газа. Если при некотором заданном давлении и температуре один моль газа занимает объем Vm, то при тех же условиях масса m газа займет объем  , где М - молярная масса (масса одного моля вещества). Единица молярной массы - килограмм на моль (кг/моль). Уравнение Клапейрона-Менделеева для массы m газа
, где М - молярная масса (масса одного моля вещества). Единица молярной массы - килограмм на моль (кг/моль). Уравнение Клапейрона-Менделеева для массы m газа
 , (1.9)
, (1.9)
где  - количество вещества.
- количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
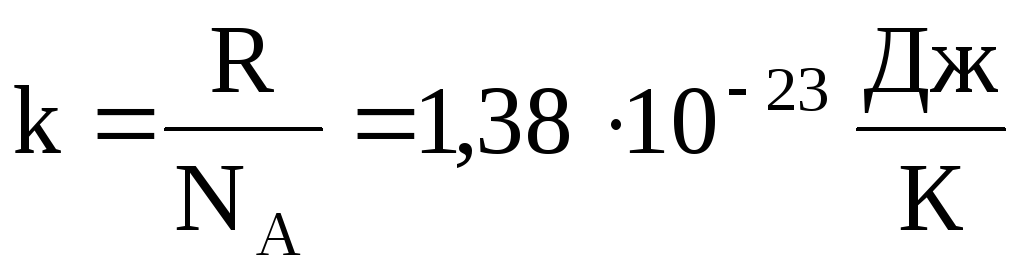 .
.
Исходя из этого, уравнение состояния (1.8) запишем в виде
 ,
,
где  - концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
- концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
р=nkT (1.10) следует, что давление идеального газа при данной температуре прямо пропор-ционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта:
 .
.
studfiles.net
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|



