Вариант 1
Явление радиоактивности, открытое Беккерелем, свидетельствует о том, что…
А. Все вещества состоят из неделимых частиц-атомов.
Б. В состав атома входят электроны.
В. Атом имеет сложную структуру.
Г. Это явление характерно только для урана.
Кто предложил ядерную модель строения атома?
А. Беккерель. Б. Гейзенберг. В. Томсон. Г. Резерфорд.
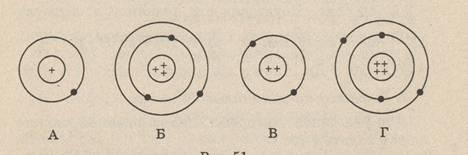
На рисунке изображены схемы четырёх атомов. Чёрные точки – электроны. Какая схема соответствует атому 24Не?

В состав атома входят следующие частицы:
А. Только протоны.
Б. нуклоны и электроны.
В. протоны и нейтроны.
Г. Нейтроны и электроны.
Чему равно массовое число ядра атома марганца 2555Мn?
А. 25. Б. 80. В. 30. Г. 55.
В каких из следующих реакций нарушен закон сохранения заряда?
А. 815О→11Н+ 814О.
Б. 36Li + 11Н→24Не + 23Не.
В. 23Не + 23Не→ 24Не + 11Н + 11Н.
Г. 37Li + 24Не → 510В + 01n.
Атомное ядро состоит из протонов и нейтронов. Между какими парами частиц внутри ядра действуют ядерные силы?
А. Протон – протон
Б. Протон – нейтрон.
В. Нейтрон – нейтрон.
Г. Во всех парах А – В.
Массы протона и нейтрона…
А. Относятся как 1836:1.
Б. Приблизительно одинаковы.
В. Относятся как 1:1836.
Г. Приблизительно равны нулю.
В ядре атома кальция 2040Са содержится…
А. 20 нейтронов и 40 протонов.
Б. 40 нейтронов и 20 электронов.
В. 20 протонов и 40 электронов.
Г. 20 протонов и 20 нейтронов.
В каком приборе след движения быстрой заряженной частицы в газе делается видимым ( в результате конденсации пересыщенного пара на ионах)?
А. В счетчике Гейгера.
Б. В камере Вильсона.
В. В сцинцилляционном счетчике.
Г. В пузырьковой камере.
Определить второй продукт Х в ядерной реакции: 1327Al + 01n →1124Na+Х.
А. Альфа – частица. Б. нейтрон. В. протон. Г. электрон
Атомное ядро состоит из Z протонов и N нейтронов. Масса свободного нейтрона mn, свободного протона mp. Какое из приведенных ниже условий выполняется для массы ядра mg?
А. m g =Zmp + Nmn
Б. m g < Zmp+ Nmn.
В. m g > Zmp + Nmn.
Г. Для стабильных ядер условие А, для радиоактивных ядер условие В.
Рассчитать ∆ m (дефект масс) ядра атома 37Li ( в а. е.м.).
mp =1,00728; mn =1,00866;m = 7,01601.
А. ∆m ≈ 0,04. Б. ∆m ≈ –0,04. В. ∆m =0. Г. ∆m ≈ 0,2.
14 В каких единицах должно быть выражено значение массы при вычислении энергии связи атомных ядер с использованием формулы ∆Е= ∆m*c2 ?
А. В килограммах.
Б. В граммах.
В. В атомных единицах массы.
Г. В джоулях.
Что называется критической массой в урановом ядерном реакторе?
А. Масса урана в реакторе, при которой он может работать без взрыва.
Б. Минимальная масса урана, при которой в реакторе может быть осуществлена цепная реакция.
В. Дополнительная масса урана, вносимая в реактор для его запуска.
Г. Дополнительная масса вещества, вносимого в реактор для его остановки в критических случаях.
Какой вид радиоактивного излучения наиболее опасен при внешнем облучении человека?
А. Бета – излучение.
Б. гамма – излучение.
В. Альфа – излучение.
Г. Все три вида излучения: альфа, бета, гамма.
Дополнительное задание.
Все химические элементы существуют в виде двух или большего количества изотопов. Определите отличие в составе ядер изотопов 1735Cl и 1737Cl.
А. изотоп 1735Cl имеет в ядре на 2 протона больше, чем 1737Cl.
Б. изотоп 1737Cl имеет в ядре на 2 протона меньше, чем 1735Cl.
В. изотоп 1737Cl имеет в ядре на 2 нейтрона больше, чем 1735Cl.
Г. изотоп 1737Cl имеет в ядре на 2 нейтрона меньше, чем 1735Cl.
18. При альфа – распаде атомных ядер…
А. Масса ядра остается практически неизменной, поэтому массовое число сохраняется, а заряд увеличивается на единицу.
Б. Массовое число уменьшается на 4, а заряд остается неизменным.
В. Массовое число уменьшается на 4, а заряд увеличивается на 2.
Г. Массовое число уменьшается на 4, заряд также уменьшается на 2.
19. Выделяется или поглощается энергия в ядерной реакции. 36Li + 11Н→24Не + 23Не? Массы ядер и частиц в а. м. соответственно равны: m36Li=6,01513, m11Н= 1,00728, m24Не= 4,00260, m23Не =3,01602.
А. Поглощается, т. к. ∆m< 0.
Б. Выделяется, т. к. ∆m< 0.
В. Поглощается, т. к. ∆m> 0.
Г. Выделяется, т. к. ∆m> 0.
20. При бомбардировке изотопа 510В нейтронами из образовавшегося ядра выбрасывается альфа – частица. Пользуясь законами сохранения массового числа и заряда, а также периодической системой элементов, запишите ядерную реакцию.
Контрольная работа № 5
по теме «Строение атома и атомного ядра»
1. В состав радиоактивного излучения могут входить…
А. Только электроны.
Б. Только нейтроны.
В. Только альфа-частицы.
Г. Бета – частицы, альфа-частицы, гамма-кванты.
2. С помощью опытов Резерфорд установил, что…
А. Положительный заряд распределён равномерно по всему объёму атома.
Б. Положительный заряд сосредоточен в центре атома и занимает очень малый объём.
В. В состав атома входят электроны.
Г. Атом не имеет внутренней структуры.
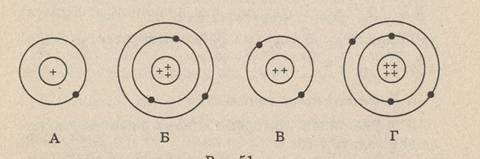
3. На рисунке изображены схемы четырёх атомов. Электроны изображены в виде чёрных точек.
Какая схема соответствует атому 73 Li?
4. В состав ядра входят следующие частицы:
А. Только протоны.
Б. Протоны и электроны.
В. Протоны и нейтроны
Г. Нейтроны и электроны.
5. Чему равен заряд ядра атома стронция 3888Sr?
А. 88 Б. 38 В. 50 Г. 126.
5. В каком из приведённых ниже уравнений ядерных реакций нарушен закон сохранения массового числа?
А. 49Ве +24Не →612С +01Н
Б. 714N + 24Не → 817О + 11Н
В. 714N + 11Н → 511В + 24Не
Г. 92239U → 93239Np + -10е
6. Ядерные силы, действующие между нуклонами …
А. Во много раз превосходят гравитационные силы и действуют между заряжёнными частицами.
Б. Во много раз превосходят все виды сил и действуют на любых расстояниях.
В. Во много раз превосходят все другие виды сил, но действуют только на расстояниях, сравнимых с размерами ядра.
Г. Во много раз превосходят гравитационные силы и действуют между любыми частицами.
7. Массы протона и электрона…
А. Относятся как 1836 : 1.
Б. Приблизительно одинаковы.
В. Относятся как 1 : 1836.
Г. Приблизительно равно нулю.
8. В ядре атома железа 2656Fe содержится:
А. 26 нейтронов и 56 протонов.
Б. 56 нейтронов и 26 протонов.
В. 26 протонов и 56 электронов.
Г. 26 протонов и 30 нейтронов.
9. В каком приборе происхождение ионизирующей частицы регистрируется по возникновению импульса электрического тока в результате возникновения самостоятельного разряда в газе?
А. В камере Вильсона.
Б. В счётчике Гейгера.
В. В сцинцилляционном счетчике.
Г. В пузырьковой камере.
10. Определите второй продукт Х ядерной реакции:
1327Al + 24Не 1530Р + Х
А. Альфа-частица ( 24Не).
Б. Нейтрон.
В. Протон.
Г. Электрон.
12. Атомное ядро состоит из Z протонов и N нейтронов. Масса свободного нейтрона mn, свободного протона mp. Какое из приведённых ниже условий выполняется для массы ядра mя?
А. mя< Z*mp + N*mn; Б. mя > Z*mp + mn; В. mя = Z*mp+ N*mn
Г. Для стабильных ядер условие А, для радиоактивных – условие Б.
13. Рассчитать дефект масс ( ∆ m ) в а. е. м. Ядра атома 23Не. Массы частиц и ядра, выраженные в а. е. м., соответственно равны: mn= 1,00866; mp = 1,00728;
mя = 3,01602.
А. ∆ m ≈ 0,072 Б. ∆ m ≈ 0,0072 В. ∆ m ≈ -0,0072 Г.∆ m ≈ 0
14. В каких единицах будет получено значение энергии при вычислении энергии связи атомных ядер с использованием формулы ∆E=m*c2 ?
А. В электрон-вольтах ( эВ).
Б. В мегаэлектрон-вольтах (МэВ)
В. В джоулях.
Г. В а. е. м.
15. В ядерном реакторе в качестве так называемых замедлителей используются такие вещества, как графит или вода. Что они должны замедлять и зачем?
А. Замедляют нейтроны для уменьшения вероятности осуществления ядерной реакции деления.
Б. Замедляют нейтроны для увеличения вероятности осуществления ядерной реакции деления.
В. Замедляют осуществление цепной реакции деления, чтобы легче было управлять реактором.
Г. Замедляют осколки ядер, образовавшихся в результате деления урана, для практического использования их кинетической энергии.
16. Какой вид радиоактивного излучения наиболее опасен при внутреннем облучении человека?
А. Бета-излучение.
Б. Гамма-излучение.
В. Альфа-излучение.
Г. Все три вида излучения: альфа, бета, гамма.
Дополнительное задание.
Все химические элементы существуют в виде двух или большего количества изотопов. Определите отличие в составе ядер изотопов 1020Ne и 1022 Ne
А. изотоп 1020Ne имеет в ядре на 2 протона больше, чем 1022 Ne
Б. изотоп 1020Ne имеет в ядре на 2 протона меньше, чем 1022 Ne
В. изотоп 1022 Ne имеет в ядре на 2 нейтрона больше, чем 1020Ne
Г. изотоп 1022 Ne имеет в ядре на 2 нейтрона меньше, чем 1020Ne
18.При бетта – распаде атомных ядер…
А. Масса ядра остается практически неизменной, поэтому массовое число сохраняется, а заряд увеличивается.
Б. Массовое число увеличивается на 1, а заряд уменьшается на 1.
В. Массовое число сохраняется, а заряд уменьшается на 1.
Г. Массовое число уменьшается на 1, заряд сохраняется.
19. Выделяется или поглощается энергия в ядерной реакции 714N + 24Не → 817О + 11Н? Массы ядер и частиц( в а. м.) соответственно равны: m714N= 14,00307, m24Не = 4,00260, m 817О=16,99913, m 11Н =1,00728.
А. Поглощается, т. к. ∆m< 0.
Б. Выделяется, т. к. ∆m< 0.
В. Поглощается, т. к. ∆m> 0.
Г. Выделяется, т. к. ∆m> 0.
20. Пользуясь законами сохранения массового числа и заряда, а также периодической системой элементов, написать ядерную реакцию, происходящую при бомбардировке 511В альфа – частицами и сопровождаемую выбиванием нейтронов
Бланк ответов
к контрольной работе № 5
по теме «Строение атома и атомного ядра»
Дата: ___________________20__г.
Класс _____________
Вариант _______
| № зад. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| Ответ | ||||||||||||||||
| № дополнит. задания | 17 | 18 | 19 | 20 |
| |||||||||||
| Ответ |
| |||||||||||||||
Бланк ответов
к контрольной работе № 5
по теме «Строение атома и атомного ядра»
Дата: ___________________20__г.
Класс _____________
Вариант _______
| № зад. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| Ответ | ||||||||||||||||
| № дополнит. задания | 17 | 18 | 19 | 20 |
| |||||||||||
| Ответ |
| |||||||||||||||
Коды правильных ответов.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| В1 | В | Г | В | Б | Г | А | Г | Б | Г | Б | А | Б | А | А | Б | В | В | Г | Б |
| В2 | Г | Б | В | В | Б | В | В | А | Г | Б | Б | А | А | В | В | В | В | А | Б |
№20 510В + 01n. → 37Li + 24Не (1 ВАРИАНТ)
511В + 24Не→ 714N + 11Н (2 ВАРИАНТ)
Таблица перевода числа правильных ответов на обязательные вопросы в оценку по пятибалльной шкале.
| Число правильных ответов | 0-6 | 7-10 | 11-13 | 14-15 | 16-20 |
| Оценка в баллах | 1 | 2 | 3 | 4 | 5 |
pandia.ru
1. Явление радиоактивности, открытое Беккерелем, свидетельствует о том, что…
А. Все вещества состоят из неделимых частиц-атомов
Б. В состав атома входят электроны. В. Атом имеет сложную структуру
Г. Это явление характерно только для урана.
2. Кто предложил ядерную модель строения атома?
А. Беккерель Б. Гейзенберг В. Томсон Г. Резерфорд
3
 . На рис. схемы четырех атомов. Какая из них соответствует атому 42 Не ?
. На рис. схемы четырех атомов. Какая из них соответствует атому 42 Не ?








А. Б. В. Г.
4. В состав атома входят следующие частицы:
А. Только протоны. Б. Нуклоны и электроны. В. Протоны и нейтроны.
5. Чему равно массовое число 5525Mn ?
А. 25 Б. 80 В. 30 Г. 55
6. В каких из следующих реакциях нарушен закон сохранения заряда?
А. 158 O → 11 H + 148O Б. 63 Li + 11 H→ 42 He + 32 He
B. 32 He + 32 He → 42 He + 11 H + 11 H Г. 73 Li + 42 He → 105 B + 10 n
7. Между какими парами частиц внутри ядра действуют ядерные силы?
А. Протон-протон. Б. Протон-нейтрон. В. Нейтрон-нейтрон. Г. Во всех парах.
8. Массы протона и нейтрона…
А. Относятся как 1836:1 Б. Приблизительно одинаковы.
В. Относятся как 1:1836 Г. Приблизительно равны нулю.
9. В ядре атома кальция 4020 Са содержится…
А. 20 нейтронов и 40 протонов Б. 40 нейтронов и 20 электронов.
В. 20 протонов и 40 электронов. Г. 20 протонов и 20 нейтронов.
10. В каком приборе след движения заряженной частицы становится видимым
в результате конденсации перенасыщенного пара?
А. В счетчике Гейгера Б. В камере Вильсона
В. В сцинтилляционном счетчике. Г. В пузырьковой камере.
11. Определите второй продукт в ядерной реакции: 2713Al + 10 n → 2411Na + X
(запишите реакцию)
А. Альфа-частица. Б. Нейтрон. В. Протон. Г. Электрон.
12. Какое из приведенных ниже условий выполняется для массы ядра?
А. Мя = Z mp + N mn Б. Мя < Z mp + N mn В. Мя > Z mp + N mn
13. Рассчитать дефект масс ядра атома 73Li
mp = 1, 00728 а.е.м. mn = 1,00866 а.е.м. MLi = 7,01601 а.е.м.
А. 0,04 а.е.м. Б. – 0,04 а.е.м. В. 0 а.е.м. Г. 0,2 а.е.м.
14. Что называется критической массой урана?
А. Масса урана в реакторе, при которой он может работать без взрыва.
Б. Минимальная масса урана, при которой может осуществляться цепная
реакция. В. Дополнительная масса урана, вносимая в реактор для его запуска.
Г. Дополнительная масса вещества, вносимого в реактор для его остановки в
критических случаях.
15. Какой вид радиоактивного излучения наиболее опасен при внешнем
облучении?
А. Бета-излучение. Б. Гамма-излучение. В. Альфа-излучение. Г.Все виды.
16. Все химические элементы имеют изотопы. Определите отличие в составе
ядер изотопов 3517Cl и 3717Cl.
А. Первый изотоп имеет в ядре на 2 протона больше.
Б. Второй изотоп имеет в ядре на 2 протона больше.
В. Второй изотоп имеет в ядре на 2 нейтрона больше.
Г. Первый изотоп имеет в ядре на 2 нейтрона больше.
17. При альфа-распаде атомных ядер…
А. Массовое число не меняется, а заряд увеличивается на 1.
Б. Массовое число увеличивается на 4, а заряд остается неизменным.
В. Массовое число уменьшается на 4, а зарядовое увеличивается на 2.
Г. массовое число уменьшается на 4, а зарядовое уменьшается на 2.
18. При бомбардировке изотопа 105 В нейтронами выбрасывается альфа-частица.
Запишите ядерную реакцию.
19. В качестве ядерного горючего в ядерных реакторах используется…
А. Уран-238. Б. Уран-235. В. Уран-239. Г. радий-226.
20. Бериллиевая оболочка ядерного реактора…
А. Задерживает гамма-кванты. Б. Отражает нейтроны.
В. Является замедлителем. Г. Является теплоносителем.
Вариант-2.
1. В состав радиоактивного излучения могут входить..
А. только электроны. Б. Только нейтроны.
В. Только альфа-частицы. Г. Бета-частицы, альфа-частицы, гамма-кванты.
2. С помощью опытов Резерфорд установил, что…
А. Положительный заряд распределён равномерно по всему объему атома.
Б. Положительный заряд сосредоточен в центре атома и занимает
маленький объем.
В. В состав атома входят электроны. Г. Атом не имеет внутренней структуры.
3. . На рис. схемы четырех атомов. Какая из них соответствует атому 73 Li ?









А . Б. В. Г.
. Б. В. Г.
4. В состав ядра атома входят следующие частицы…
А. Только протоны. Б. Протоны и электроны.
В. Протоны и нейтроны. Г. Нейтроны и электроны.
5. Чему равен заряд ядра атома 8838Sr ?
А. 88. Б. 38. В. 50. Г. 126.
6. В каком из приведенных ниже уравнений нарушен закон сохранения массового числа?
А. 94 Be+42 He→ 126 C+ 10 n Б. 147 N+ 42 He →178 O+ 11 H
B. 157 N + 11 H → 125 B + 42 He Г. 23992 U →23993 Np + 0-1 e
7. Ядерные силы, действующие между нуклонами…
А. Во много раз превосходят гравитационные силы и действуют между заряженными частицами.
Б. Во много раз превосходят все виды сил и действуют на любых расстояниях.
В. Во много раз превосходят все виды сил, но действуют только на расстояниях, сравнимых с размерами ядра.
Г. Во много раз превосходят гравитационные силы и действуют между любыми частицами.
8. Массы протона и электрона…
А. Относятся как 1836:1 Б. Приблизительно одинаковы.
В. Относятся как 1:1836 Г. Приблизительно равны нулю.
9. В ядре атома железа 5626Fe содержится…
А. 26 нейтронов и 56 протонов. Б. 56 нейтронов и 26 протонов.
В. 26 протонов и 56 электронов. Г. 26 протонов и 30 нейтронов.
10. В каком приборе прохождение частицы регистрируется по возникновению импульса электрического тока?
А. В счетчике Гейгера Б. В камере Вильсона
В. В сцинтилляционном счетчике. Г. В пузырьковой камере.
11.Определите второй продукт ядерной реакции (запишите реакцию):
2713Al+42He → 3015P+X
А. Альфа-частица. Б. Нейтрон. В. Протон. Г. Электрон.
12. . Какое из приведенных ниже условий выполняется для массы ядра?
А. Мя < Z mp + N mn Б. Мя > Z mp + N mn В. Мя = Z mp + N mn
13. Рассчитать дефект масс ядра атома 32 Не
mp = 1, 00728 а.е.м. mn = 1,00866 а.е.м. Mне = 3,01602 а.е.м.
А. 0,072 а.е.м. Б. 0,0072 а.е.м. В. -0,0072 а.е.м. Г. 0 а.е.м.
14. В ядерном реакторе в качестве замедлителя используется графит или вода. Что они должны замедлять?
А. Нейтроны Б. Протоны.
В. Осколки ядер. Г. Осуществление цепной реакции.
15. Какой вид радиоактивного излучения наиболее опасен при внутреннем облучении?
А. Бета-излучение. Б. Гамма-излучение. В. Альфа-излучение. Г.Все виды.
16. Все химические элементы имеют изотопы. Определите отличие в составе
ядер изотопов 2010Ne и 2210Ne
А. Первый изотоп имеет в ядре на 2 протона меньше.
Б. Второй изотоп имеет в ядре на 2 протона больше.
В. Второй изотоп имеет в ядре на 2 нейтрона больше.
Г. Первый изотоп имеет в ядре на 2 нейтрона больше.
17. При бета-распаде атомных ядер…
А. Масса ядра не изменяется, а заряд увеличивается на 1.
Б. Массовое число сохраняется, а заряд уменьшается на 1.
В. Массовое число увеличивается на 1, а зарядовое уменьшается на 1.
Г. Массовое число уменьшается на 1, а зарядовое сохраняется.
18. Запишите ядерную реакцию, происходящую при бомбардировке 115 В альфа-частицами и сопровождаемую выбиванием нейтрона.
19. Что называют термоядерной реакцией?
А. Реакция деления ядер урана под действием нейтронов.
Б. Реакцию слияния легких ядер при высокой температуре.
В. Химическую реакцию с выделением огромного количества энергии.
Г. Самопроизвольный распад ядер радиоактивных элементов.
20. В каких единицах измеряется поглощенная доза радиации?
А. Зивертах. Б. Грейях. В. Беллах. Г. Джоулях.
infourok.ru
Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращенийсуществует целый ряд процессов, в которых атомы выступают как сложные объекты,состоящие из положительно заряженной части — ядра и отрицательно заряженныхэлектронов, суммарный заряд которых в точности компенсирует заряд ядра. Врезультате работ английского физика Дж. Дж. Томсона и американского физика Р.С.Малликена было установлено, что электрон имеет массу 9,1•1031 кг,или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основнаямасса атома сосредоточена в ядре, которое занимает очень малую часть его объема:диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4диаметра атома. Наглядно это соотношение размеров можно представить себе, еслиувеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместитсявнутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят изположительно заряженных частиц — протонов и незаряженных частиц — нейтронов. Протонимеет заряд, равный заряду электрона, но со знаком плюс, его масса практическиравна массе нейтрона. Отметим, что в химии принято выражать заряды ионов вединицах заряда электрона с соответствующим знаком, например Н+, Mg2+, СГ.
/>
Таким образом, число протонов в ядре определяет его заряд ипорядковый номер, а сумма чисел протонов и нейтронов — округленную общую массуядра в атомных единицах, или массовое число атома. Очевидно, что вэлектронейтральном атоме число протонов в атомном ядре равно числу электронов вэлектронной оболочке атома.
2. Атомный номер элемента. изотопыПорядковый номер элемента принято называть его атомнымномером и обозначать буквой Z. Атомный номер лежит воснове систематизации химических элементов и определяет их положение впериодической системе.
При определенном атомном номере, т.е. при определенном числепротонов, в ядре могут находиться разные числа нейтронов, поэтому могутсуществовать отличающиеся по массе разновидности атомов одного и того жеэлемента — изотопы.
Например, природный водород представляет собой смесьизотопов с массовыми числами 1 и 2, а.
/>
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке- 92 электрона
В периодической таблице, элементы расположены в порядкеувеличения заряда ядра, а в отдельных клеточках таблицы принято приводитьсредневзвешенные атомные массы, поэтому они часто сильно отличаются отцелочисленных.
/>
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электроннойпушки (2). Заряженные пластины (3) и (4) разгоняют поток полученныхположительных ионов, который проходит через щель в пластине (4) и попадает вполе магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд:масса. За второй щелью (в) расположен детектор (7), который регистрирует числочастиц, прошедших через щель. Меняя напряженность магнитного поля, можнопоследовательно регистрировать относительное количество ионов с различноймассой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показаначасть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2. Отдельныеполосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений массатомов и разделение изотопов стало возможным в результате созданиямасс-спектрометрии — метода, основанного на воздействии магнитного поля нанаправленные пучки заряженных частиц.
3. Ядерная модель атомаПервая модель атома была предложена в начале XX века Э. Резерфордом,новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся сбольшой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношениюк Солнцу. По представлениям классической электромагнитной теории в таком атомеэлектрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Черезкороткое время электрон неизбежно должен упасть на ядро. Это очевидноенесоответствие фактам было не единственным недостатком модели Резерфорда: плавноеизменение энергии электронов в атоме не согласовывалось с появившимисянаблюдениями над спектрами атомов. Одним из достижений второй половины XIX векабыла разработка атомного спектрального анализа — точного и чувствительногометода, сыгравшего важнейшую роль в открытии новых элементов и послужившегоэкспериментальной основой изучения строения атомов. Метод основан на испусканиисвета свободными атомами, получающимися при сильном нагреваний вещества; приэтом атомы переходят из основного состояния с минимальной энергией ввозбужденные состояния с более высокими энергиями.
/>
Возвращаясь в основное состояние, атомы излучают свет. Оказалось,что атомные спектры излучения состоят из отдельных линий, отвечающих толькоопределенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров иустойчивость атомов, знаменитый датский физик Нильс Бор предложил двапостулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зренияклассической механики, допустимы лишь определенные орбиты, по которым электрондвижется не излучая.
Частота поглощаемого или испускаемого атомом излучения припереходе из одного разрешенного состояния в другое определяется разностьюэнергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантованииэнергии. Планк установил, что, хотя свет, испускаемый раскаленным телом,кажется сплошным, световая энергия поглощается или излучается отдельнымипорциями — квантами Е = hv, пропорциональными частоте световогоэлектромагнитного колебания. Коэффициент пропорциональности h= 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образомв науку было введено понятие кванта света, или некоторого светового пакета — фотона,отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергииатома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснениянаблюдаемых энергетических характеристик атомов с двумя и более электронами; главныйже ее недостаток заключался в том, что она не давала логического обоснованияприроды квантования и устойчивости не меняющихся во времени состояний атома. Однако,несмотря на эти недостатки, сами идеи Бора о квантовании и стационарныхсостояниях легли в основу современного описания строения атома с позицийквантовой механики.
4. Волновые свойства электрона/>
Вскоре после 1920 г. был сделан следующий важный шаг впознании микромира: было установлено, что не только световые кванты, но и любыемикрочастицы, в том числе электроны, обладают двойственной природой — частицыкак таковой и волны.
Например, электрону при скорости3 • 10е м/с отвечает длина волны
/>
В частности, удалось обнаружить дифракцию электронов напериодической решетке кристаллов и на молекулах газов. Частице с массой покоят, движущейся со скоростью v, соответствует длина волныX, которая может быть найдена из уравнения де Бройля: сопоставимая с размерамиатома. В то же время можно говорить и об импульсе и даже о массе движущегосяфотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельствосущественным образом влияет на характер информации, которую дает спектроскопия.При столкновении фотона с электроном меняются импульс фотона и частота света,тем самым давая экспериментатору информацию об импульсе электрона. Однако,поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульсэлектрона, который надо определить. Ситуация в какой-то степени подобна попыткеизмерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи сразбега. Математически эти соображения описываются принципом неопределенностиГейзенберга, согласно которому возможность одновременного определения положениямикрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, вчастности, означает, что если мы хотим определить с большой точностью энергиюэлектрона в атоме, то мы не сможем столь же точно определить его положение поотношению к ядру.
5. Квантово-механическая модель атомаПредставления о стационарных состояниях атома и двойственнойприроде электрона, а также требования принципа неопределенности былииспользованы австрийским физиком Эрвином Шредингером, который в 1926 г. предложилмодель, описывающую электрон в атоме как своего рода стоячую волну, причемвместо точного положения электрона в пространстве рассматривалась вероятностьего пребывания в определенном месте.
Для того чтобы представить себе электрон в виде трехмернойстоячей волны, остановимся сначала на более простой одномерной модели стоячейволны, в качестве которой можно взять струну, закрепленную на концах. Струнаспособна издавать звуки только определенных частот, так как на ее длине можетуложиться лишь целое число полуволн — это и есть квантование энергии колебанийструны. Для описания характера стоячих волн одномерной системы достаточноодного числа п, которое однозначно определяет длину волны и число узловыхточек, в которых струна неподвижна, как и на закрепленных концах.
Моделью двумерной системы, испытывающей стационарныеколебания, может служить круглая мембрана, закрепленная по периметру, например,в телефонной трубке. Здесь также возможны лишь определенные, квантованныеколебания, для описания которых необходимы уже два числа.
Теперь очевидно, что для описания пространственного движенияэлектрона в атоме как трехмерной стоячей волны необходимы и достаточны тричисла, получившие название квантовых чисел. Квантово-механическое описаниеатома не требует никаких дополнительных постулатов, квантование энергии электронаестественным образом возникает из природы самого атома или так называемыхграничных условий, которые сводятся к тому, что электрон не покидает атом испособен двигаться с конечной скоростью.
/>
В волновой механике электрон, как и любая микрочастица,описывается с помощью волновой функции. Его движение определяется уравнением,предложенным Шредингером, — знаменитым уравнением Шредингера. Решением этогоуравнения является волновая функция \|/, которая соответствует разрешеннойэнергии электрона и описывает зависимость амплитуды стационарной волны,соответствующей электрону, от трех его пространственных координат. Квадратволновой функции определяет вероятность пребывания электрона в некоторойпространственной области. Здесь мы как раз встречаемся со случаем точногознания энергии электрона и вероятностного описания его положения в пространстве.Во многих случаях удобно рассматривать электрон как размытое в пространствеоблако отрицательного заряда. Плотность такого электронного облака в любойточке пропорциональна V) /2. Модель электронного облака наглядноописывает распределения электронной плотности в пространстве, хотя онафизически несовершенна, так как одноименно заряженные части облака должныотталкиваться друг от друга, вызывая его рассеивание. На самом же деле электронне отталкивается «сам от себя». Это обстоятельство несколькоограничивает аналогию между электроном и облаком, но не мешает нам говорить обэлектронных облаках во всех случаях, когда мы не интересуемся деталями,связанными с их потенциальной энергией. Представлением об электронных облакахмы будем широко пользоваться в этой книге.
6. Одноэлектронный атом. квантовые числаВ случае атома водорода и одноэлектронных ионов уравнениеШредингера может быть решено точно.
/>
Таким образом может быть получен набор волновых функцийэлектрона или атомных орбиталей. Словом «орбиталь», в отличие от«орбиты», подчеркивается волновая природа электрона. Каждая АОзависит от трех пространственных координат электрона и характеризуетсяопределенными значениями трех квантовых чисел п, I, т.д.ля описанияодноэлектронного атома, в котором электрон принимает участие в единственномвзаимодействии — с ядром, обладающим сферически-симметричным электростатическимполем, удобно использовать не декартову систему координат с переменными х, у,г, а сферическую с переменными.
Для наших целей нет необходимости заниматься математическойстороной решения сложного дифференциального уравнения Шредингера, однако длядальнейших химических выводов важно, что в сферических координатах возможноразделение переменных, и само его решение \j/n приобретает более удобный для дальнейшего анализа вид:
/>
Здесь Rnt — радиальнаясоставляющая волновой функции, зависящая от единственной переменной г — расстоянияэлектрон — ядро и характеризуемая только двумя квантовыми числами п и I, а Ylm — угловаясоставляющая волновой функции, описывающая зависимость распределенияэлектронной плотности от углов 9 и ф, т.е. форму и ориентацию АО, ихарактеризуемая квантовыми числами I и т. Рассмотрим последовательно физическийсмысл квантовых чисел п, I, ти характер различных АО.
Квантовое число п называется главным квантовым числом. Величинап определяет номер электронного слоя: чем меньше п, тем прочнее электрон связанс ядром и тем ближе, в среднем, он находится к ядру. Главное квантовое числоможет принимать целочисленные положительные значения 1, 2, 3 и т.д. Набор АО содинаковым п составляет слой. Основному состоянию атома водорода соответствуетп = 1, при этом Е1 = — 1312 кДж. Такое количество энергии выделится приобразовании одного моля атомов водорода из протонов и электронов, находящихсяна бесконечном удалении друг от друга. В одноэлектронном атоме или водноэлектронном ионе с зарядом ядра Z главное квантовоечисло однозначно определяет энергию электрона Еп:
Еп = — Rtf/a2
Здесь R — постоянный множитель,равный 1312 кДж, если энергия отнесена к 1 молю атомов и заряд Z измеряется в единицах заряда электрона.
Второе квантовое число I называется орбитальным, оноопределяет возможные квантованные величины орбитального момента количествадвижения электрона. Число I может принимать целочисленные значения от 0 до п — 1.
/>
/>
По традиции, сложившейся в процессе изучения атомныхспектров, значения I обычно обозначают буквами: s, р, d, f и далее по английскому алфавитувместо 0, 1, 2, 3 и т.д. Для нас самое главное то, что при описании электрона ввиде облака число I определяет его форму. Так, s-электроныимеют шарообразные, сферически симметричные облака, лишь в этом случае волноваяфункция \|/ не зависит от углов Э и ф; р-электроны {I =1) имеют гантелеобразные облака, d-электроны образуютоблака еще более сложной формы.
Вернемся к уравнению, в котором при RM стоят индексы nl. Как ужеотмечалось, это значит, что первое и второе квантовые числа вместе полностьюопределяют характер радиальной части волновой функции. Рассмотрим, как меняетсяплотность электронного облака с расстоянием от ядра. На рис.2.10 по оси ординатотложена вероятность нахождения электрона в пространстве, заключенном междусферами с радиусами г и г + dr. Из рисунка видно, чтовсе эти кривые, которые называются кривыми радиального распределенияэлектронной плотности, проходят через один или несколько максимумов. Еслимаксимумов несколько, то они разделены узловыми точками, в которых плотностьравна нулю. Последний от ядра максимум — самый большой, главный. Числомаксимумов равно п — I, число узловых точек равно — 1. Таким образом, с учетомуглового и радиального распределения облако, соответствующее ls-электрону,можно представить себе как диффузный шар переменной плотности, имеющей одинмаксимум и постепенно сходящей на нет при удалении от центра. Облако 2"-электронаподобно сфере с двумя сгущениями плотности и т.д.
/>
Видно, что среднее расстояние электрона от ядра существенноразлично для разных атомных орбиталей: оно растет с увеличением п, а при равныхп — с уменьшением I. Чем меньше I при одинаковых п, тем дальше от ядра и темниже главный максимум и тем большая часть электронной плотности находится ближек ядру за счет внутренних максимумов.
Третье квантовое число т — магнитное — определяетнаправление орбитального момента электрона, а с точки зрения моделиэлектронного облака — ориентацию его в пространстве. Магнитное квантовое числоможет принимать целочисленные значения от — I до +1, что соответствует разрешеннымквантовой механикой значениям проекции орбитального момента на заданноенаправление в пространстве. Следует отметить, что определенное направлениеможет быть задано внешним полем — электрическим или магнитным. В отсутствиевнешнего поля все разрешенные ориентации электронного облака равновероятны.
Поскольку облако s-электроновсферически симметрично, вопрос о его ориентации просто не имеет смысла. Вслучае р-электронов возможны три значения магнитного квантового числа — 1,0 и+1 и, соответственно, разрешены три взаимно перпендикулярные ориентациигантелеобразного облака. У d-электронов возможны пятьзначений т, у /электронов — семь.
Итак, три квантовых числа — главное, орбитальное и магнитное- позволяют задать атомную орбиталъ и достаточно подробно охарактеризовать одноэлектронныйатом: мы точно знаем энергию электрона и можем качественно описать электронноеоблако — его форму, ориентацию в присутствии внешнего поля, число сгущенийэлектронной плотности и число внутренних узловых поверхностей, где плотностьсходит к нулю.
Однако тремя квантовыми числами не исчерпываются данные,необходимые для полного описания состояния электрона в атоме. Детальноеисследование атомных спектров показало, что электрон обладает собственныммоментом количества движения, который получил название спинового момента илиспина. При вероятностном описании электрона как стоячей волны или какэлектронного облака спин не имеет классических аналогий — это просто свойствомикрочастиц.
Спин электрона характеризуется спиновым квантовым числом ms, которое может иметь два значения +1/2 и — 1/2,т.е. спин может иметь два противоположных направления.
Таким образом, для полной характеристики состояния электронав атоме необходимы четыре квантовых числа. Первые три из них определяютраспределение его плотности в пространстве, а четвертое — его спин. Знаниесмысла и возможных значений квантовых чисел имеет исключительное значение дляхимика, поэтому ниже мы приводим краткую сводку важнейших сведений такого рода.
/>
Решение уравнения Шредингера для атома водорода позволяет, впринципе, рассчитать его основные характеристики с любой точностью, дажеточнее, чем их дает эксперимент. Наиболее важными экспериментальнымихарактеристиками любых атомов являются энергии отрыва и присоедниенияэлектронов. Энергию отрыва электрона от атома, молекулы или иона не совсемправильно принято называть потенциалом ионизации. Потенциал ионизацииобозначают обычно буквой / и измеряют в электрон-вольтах. Экспериментальноизмеренный потенциал ионизации водорода равен 13,6 эВ* или как раз 1312 кДж.
Другой важной энергетической характеристикой атома являетсясродство к электрону — энергия, которая выделяется при присоединении к немудополнительного электрона. Сродство обычно обозначают буквой А с указаниемчастицы, например для водорода Ан = 73 кДж/моль. Знак «плюс»здесь говорит о том, что атом водорода приобретает второй электрон с выделениемэнергии, образуя ион Н.
7. Многоэлектронные атомыПри переходе от одноэлектронного атома к многоэлектронному вдополнение к взаимодействию электрон — ядро появляется новый тип взаимодействий- электронов друг с другом. Взаимодействие любого электрона с остальнымизависит от состояния каждого электрона и не может быть точно учтено, еслинеизвестны волновые функции всех остальных электронов, которые, в свою очередь,не могут быть рассчитаны, если неизвестно взаимодействие данного электрона состальными. Получается замкнутый круг, который принципиально не дает возможноститочно решить уравнение Шредингера для многоэлектронного атома. Эта трудность, ксчастью, может быть преодолена посредством приближенного решения, суть которогозаключается в следующем. Каждый электрон рассматривается отдельно такимобразом, как будто он находится в одноэлектронном атоме, заряд ядра которогочастично экранирован усредненным сферически-симметричным полем остальныхэлектронов. Отдельный электрон при этом испытывает только кулоновскоепритяжение центра, состоящего из ядра и остальных электронов, т.е. действиенекоторого центрально-симметричного положительного эффективного заряда,меньшего, чем заряд ядра. При таком подходе для многоэлектронных атомовсохраняют смысл понятия атомной орбитали и четырех квантовых чисел, толькоистинный заряд ядра заменяется эффективным.
Рассмотрим для примера с этой точки зрения атом гелия восновном состоянии. Если бы в нем совсем не было межэлектронноговзаимодействия, то оба электрона находились бы на орбитали с п = 1 в полезаряда Z = +2 и по формуле имели бы энергию Е = = — 13,6• 4 = — 54,4 эВ, равную экспериментально определенному потенциалу ионизацииодноэлектронного иона Не+. Другой крайний вариант — идеальноеэкранирование заряда ядра одним электроном по отношению к другому, которыйтогда испытывал бы действие заряда ядра, уменьшенного ровно на единицу, т.е. ядрас Z = +1. Тогда мы получаем точно такую же ситуацию,как в атоме водорода, и потенциал ионизации должен быть равен 13,6 эВ.
Для реального атома гелия истина лежит где-то между этимикрайностями, действительно, его потенциал ионизации составляет 24,6 эВ. Поформуле можно подсчитать заряд Z*, который должениспытывать на себе электрон с этой энергией в одноэлектронном атоме: Z* = ^24,6/13,6 = 1,34. Это и есть тот самый эффективныйзаряд, который действует на каждый электрон в атоме гелия.
В общем случае эффективный заряд ядра Z*- это положительный заряд, который «чувствует» электрон вмногоэлектронном атоме на заданной АО. Пользуясь эффективными зарядами ядер, мыможем оценивать энергию атомных орбиталей в многоэлектронном атоме.
8. Электронная конфигурация атомаРаспределение электронов по АО называют электроннойконфигурацией атома. Порядок заполнения АО электронами определяется двумяважнейшими принципами.
Согласно принципу минимума энергии наиболее устойчивому состояниюатома отвечает размещение электронов на орбиталях с наименьшей энергией, т.е. обеспечиваетсяминимум потенциальной энергии системы, состоящей из электронов с ядром.
Согласно принципу Паули любые два электрона в атоме воизбежание бесконечно большого взаимного отталкивания должны отличаться друг отдруга хотя бы одним квантовым числом. Так, если два электрона находятся наодной АО, то они должны иметь противоположные спины.
В соответствии с указанными принципами атом гелия в основномсостоянии имеет электронную конфигурацию Is2,при которой оба электрона находятся на ls-орбитали иимеют противоположные спины. Суммарный спин атома равен нулю. Схематически этуситуацию можно изобразить в виде ячейки с двумя стрелками:
/>
/>
Атом лития, следующий за гелием в периодической системе,содержит три электрона. По принципу минимума энергии два из них расположатся,как и в атоме гелия, на ls-орбитали. Третий электрон всоответствии с принципом Паули должен располагаться на АО с п = 2. Однако такихвозможностей две — 2s — и 2р-орбитали, и электрон будетиметь меньшую энергию на той из них, где он будет испытывать действие болеевысокого эффективного заряда. Рассмотрим с этой точки зрения кривые распределенияэлектронной плотности в атоме лития в зависимости от расстояния от ядра. Изэтих кривых хорошо видно, что замкнутый слой Isрасположен гораздо ближе к ядру, чем основная плотность 2s- или 2р-электрона. Однако внутренний максимум 2в-электрона практическиполностью проникает в ls-электронную плотность вблизкой к ядру области, и определенная часть его плотности «чувствует»на себе почти полный заряд ядра Z=+3. Единственныймаксимум 2р-электрона далек от ядра, а в области сосредоточения ls-электронов находится лишь незначительная его часть. Следовательно,в атоме лития электрон на 2в-орбитали испытывает на себе действие несколькоболее высокого эффективного заряда, он несколько хуже экранирован от ядра ls-электронами, чем электрон на 2р-орбитали, и прочнее связанс ядром. Соответственно, в основном состоянии атом лития будет иметьэлектронную конфигурацию ls22s1, а конфигурация ls22p1 отвечает возбужденному состоянию.
Рассматривая одноэлектронный атом, мы пришли к заключению,что при одинаковых п за счет внутренних максимумов ближе к ядру находитсябольшая часть плотности того электрона, который расположен на орбитали сменьшим значением I. Это в основном и определяет тот важнейший для всей химиифакт, что в одном слое s-электроны испытывают на себесамый большой эффективный заряд, р-электроны — меньший, d-электроны- еще меньше и т.д.
Другими словами, res-электронынаиболее прочно связаны с ядром и находятся на наиболее низком энергетическомуровне, далее следуют яр-электроны, а затем — red-электроны.Таким образом, энергия электронов в многоэлектронных атомах зависит не толькоот п, но и от I; при равных п она возрастает в порядке увеличения I. Порядокзаполнения АО для любого атома описывается эмпирическими правилами Клечковского:
/>
АО заполняются в порядке увеличения суммы п + I. Приодинаковых значениях суммы п + I АО заполняются в порядке увеличения п.
Отметим, что одному и тому же Сочетанию значений п и I могутотвечать несколько атомных орбиталей, различающихся значениями магнитногоквантового числа т. Например, 2р-электрон может находиться в любой из трехячеек с т, равным — 1, 0 или +1:
/>
Во всех этих трех случаях электрон будет иметь одну и ту жеэнергию, но разные волновые функции. В таких случаях говорят, что состояниеэлектрона вырождено.
В данном случае оно трижды вырождено, т.е. три состояния имеютодинаковую энергию. Если в атоме появляется второй р-электрон, гомежэлектронное отталкивание будет минимальным, когда оба электрона находятся вразных ячейках и имеют одинаковые спины.
/>
В общем случае при определении электронной конфигурации основногосостояния атома удобно пользоваться правилом Хунда: минимальной энергииотвечает максимальный суммарный спин.
Например, основному состоянию атома азота отвечаетэлектронная конфигурация:
/>
Указанные принципы позволяют легко определить электроннуюконфигурацию любого атома; для основных состояний электронные конфигурацииатомов приведены в табл.2.1
Энергия электронов, находящихся на различных орбиталяхатома, которую для краткости принято называть энергией атомных орбиталей,показана на рис. в зависимости от атомного номера. При Z= 1 число энергетических уровней соответствует числу значений п. При Z > 1 уровни расщепляются на подуровни с разнымизначениями I, причем энергия подуровней увеличивается в порядке возрастания I. Хотяход отдельных кривых довольно сложен, но в целом он разумно объясняется втерминах эффективных зарядов таким же образом, как и различие 2s — и 2р — подуровней.
Электронные конфигурации атомов восновном состоянии
/>
Возвращаясь к литию, отметим, что этот элемент в какой-тостепени аналогичен водороду из-за того, что его атом содержит один 2в-электрон,и литий легко образует ион Li+. Однакопервый потенциал ионизации лития /i = 5,39 эВсущественно меньше, чем у водорода, здесь уже сказывается рост главногоквантового числа). Поэтому литий легко реагирует с большинством неметаллов,хорошо растворяется в кислотах, теряя электрон и переходя в ион Li*, т.е. проявляет свойства типичного активного металла.
Второй потенциал ионизации лития I2= 75,7 эВ очень велик, так как его ls-электронырасположены гораздо ближе к ядру, чем 2в-электрон. На этом примере хорошо видно,что электроны внутренних замкнутых слоев не распространяются на периферию атомаи настолько прочно связаны с ядром, что, как правило, непосредственно незатрагиваются в химических процессах. В химии оказывается очень полезнымразделение электронов на внешние, или валентные, и внутренние, или основные.«Химическая» роль последних сводится к участию в формированииэффективного заряда, действующего на валентные электроны.
/>
9 ЭлектроотрицательностьИдея эффективного заряда лежит в основе оценки ряда полезныххарактеристик атомов, которыми мы будем широко пользоваться в этой книге. Срединих особенно важна электроотрицательность, которая представляет собойобобщенную характеристику элемента, связанную не с электронами на отдельныхорбиталях, а с внешними электронами вообще. Под электроотрицательностьюпонимают усредненную характеристику способности атома, находящегося всоединении, притягивать электрон. При этом пренебрегают разницей в состоянияхатомов в различных соединениях. В отличие от потенциала ионизации и сродства кэлектрону, электроотрицательность — не строго определенная физическая величина,а полезная условная характеристика.
В табл.2.2 приведены значения электроотрицательности элементовпо шкале Олреда — Рохова, основанной на вычислении силы кулоновскогопритяжения, действующей на внешний электрон. Отметим, что весь диапазонзначений ЭО элементов заключен между 0,9 для наименее электроотрицательныхметаллов 1-й и 2-й групп и 4,1 для наиболее электроотрицательного фтора.
www.ronl.ru
В А Р И А Н Т 1
Начальный уровень
1. В ядре атома химического элемента 16 протонов и 22 нейтрона. Выберите правильное утверждение.
А. Этот химический элемент — стронций.
Б. Этот химический элемент — сера.
В. Этот химический элемент — титан.
2. Полное превращение элементов впервые наблюдалось в реакции 37Li + 11H = ? в результате которой появилось два одинаковых атома. Что это за атомы? Выберите правильный ответ.
А. Водород. Б. Гелий. В. Бериллий. 3. Что называется критической массой в ядерном реакторе?
Выберите правильное утверждение.
А. Минимальная масса ядерного топлива, при которой в реакторе может быть осуществлена цепная реакция.
Б. Масса ядерного топлива в реакторе, при которой он может работать без взрыва.
В. Дополнительная масса ядерного топлива, вносимая в реактор для его запуска.
Средний уровень
1. Изменяется ли химическая природа элемента при испускании гамма-лучей его ядрами?
2. Назвать химический элемент, в атомном ядре которого содержится нуклонов: а) 6р + 6n;
б) 54р + 77n; в) 88р + 138n.
3. Какие преимущества имеют атомные электростанции перед тепловыми станциями? Почему? Достаточный уровень
1. Как повлияет на состав электронной оболочки атома внутриядерное превращение нейтрона в протон? Протона в нейтрон?
2. Ядро урана 92235U поглощает один нейтрон и делится на два осколка и четыре нейтрона. Один из осколков — ядро атома цезия 55137Cs. Ядром какого изотопа является второй осколок? Напишите уравнение реакции.
3. Суммарная масса покоя продуктов ядерной реакции оказалась на 0,025 а. е. м. больше, чем суммарная масса покоя вступивших в реакцию ядер и частиц. Каков энергетический выход данной ядерной реакции?
Высокий уровень 1. Бомбардируя ядра одного химического элемента ядрами другого (соответствующим образом подобранного), можно получить (в принципе) любой элемент. Почему это открытие не используют для промышленного получения золота или платины?2. При бомбардировке альфа-частицами алюминия образуются новое ядро и нейтрон. Записать ядерную реакцию и определить, ядро какого элемента при этом образуется.
3. При обстреле ядер фтора 919F протонами образуется кислород 816O. Сколько энергии освобождается при этой реакции, и какие еще ядра образуются?
Контрольная работа по теме: «Строение атома и атомного ядра»
В А Р И А Н Т 2
Начальный уровень
1. Элемент ZAX испытал бета-распад. Какой заряд и массовое число будет у нового элемента Y? Выберите правильный ответ.

2. В каких из следующих реакции нарушен закон сохранения заряда? Выберите правильный ответ.

3. В ядерном реакторе в качестве замедлителей используют графит или воду. Что они должны замедлять и зачем? Выберите правильное утверждение.
А. Замедляют осколки ядер, образовавшихся в результате деления урана, для практического использования их кинетической энергии.
Б. Замедляют осуществление цепной реакции деления, чтобы легче было управлять реактором.
В. Замедляют нейтроны для увеличения вероятности осуществления ядерной реакции деления.
Средний уровень
3. Как вы считаете: переход от химической энергетики к ядерной упростит или осложнит борьбу за сохранение природы?
Достаточный уровень
1. И атом водорода, и нейтрон могут распадаться на протон и электрон. Почему же атом водорода не считают элементарной частицей, а нейтрон причисляют к ним?
2. При естественном радиоактивном распаде радия из ядра испускается альфа-частица. Напишите ядерную реакцию для этого случая. В ядро какого элемента превращается при этом ядро атома радия?
3. Для плавления льда массой 1 кг при температуре 0 °С необходимо ему сообщить количества теплоты, равное 332,4 кДж. На сколько при этом возрастает масса воды?
Высокий уровень 1. Почему летящий протон оставляет в камере Вильсона видимый след, а летящий нейтрон не оставляет?
2. При облучении изотопа меди 2963Cu протонами реакция может идти несколькими путями: с выделением одного нейтрона; с выделением двух нейтронов; с выделением протона и нейтрона. Ядра каких элементов образуются в каждом случае? Написать ядерные реакции.
3. При облучении изотопа азота 715N протонами образуется углерод и альфа-частица. Найти полезный энергетический выход ядерной реакции, если для ее осуществления энергия протона должна быть 1,2 МэВ.
скачатьnenuda.ru