
Для облегчения понимания межатомного взаимодействия мы будем рассматривать типы химической связи в несколько упрощенном виде, а именно, рассмотрим: а) гомеополярную, или ковалентную связь, б) гетерополярную, или ионную связь, в) металлическую связь и г) поляризационную связь, или связь Ван-дер-Ваальса.
Ковалентная связь. Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками. Из квантовой химии следует, что система из положительно заряженного ядра и отрицательно заряженных электронных оболочек имеет минимальную энергию в том случае, когда электронные оболочки заполнены полностью. Поэтому атомы с наполовину заполненными электронными оболочками обмениваются электронами. При этом образуются пары электронов с противоположно направленными спиновыми магнитными моментами, причем эти пары принадлежат обоим соседним атомам.

Рис. 3. Схема образования ковалентной связи
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь направленна.Отношение размера положительно заряженного ядра к размеру валентной электронной оболочки чрезвычайно мало, поэтому при анализе силы притяжения можно считать, что взаимодействуют точечные заряды, то есть сила притяжения описывается простейшим видом кулоновского закона: сила притяжения обратно пропорциональна квадрату расстояния между зарядами. При сближении атомов начинается взаимное отталкивание внутренних электронных оболочек, и отталкивание атомов описывается более сложным законом: сила отталкивания обратно пропорциональна расстоянию между атомами в степени n, где n >2.
Увеличение порядкового номера элемента ведет к росту количества электронных оболочек, экранирующих взаимодействие положительно заряженных ядер с валентными электронами. Поэтому снижается сила взаимного притяжения и уменьшается глубина потенциальной ямы. В результате, с ростом порядкового номера элемента падает температура плавления, растет коэффициент теплового расширения, уменьшается модуль упругости.

Рис. 3. Схема образования ионной связи
Ионная связь. Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. В результате образуются положительно и отрицательно заряженные ионы, взаимно притягивающиеся электростатическими силами. Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направлена, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуру плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.

Рис. 5. Схема образования металлической связи.
Металлическая связь образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).Каждый из положительно заряженных ионов притягивается к свободным электронам, и, тем самым, ионы притягиваются друг к другу. Металлическая связь ненаправленна и ненасыщенна, и число ближайших соседей у иона определяется в основном геометрическим и энергетическими факторами. Следовательно, кристаллические решетки металлов упакованы плотно. Под действием электрического поля не связанные с ионами электроны перемещаются, то есть металлы обладают высокой электропроводностью. Свободные электроны могут легко ускоряться и замедляться, то есть менять свою кинетическую энергию. Вследствие этого металлические материалы поглощают кванты электромагнитного поля любой энергии, то есть металлы непрозрачны для радио- и световых волн в широком диапазоне частот. Поглотив квант электромагнитного поля, свободный электрон возбуждается, и, переходя в стационарное состояние, испускает аналогичный квант. Иначе говоря, металлические материалы отражают радио- и световые волны. Несколько позже докажем, что плотно упакованная решетка металлов является причиной их высокой пластичности. По определению М.В. Ломоносова: «Металлы суть светлые тела кои ковать можно".
Поляризационная связь, или связь Ван-дер-Ваальса. Образуется при сближении молекул или атомов инертных газов. Рассмотрим возникновение поляризационной связи на примере инертных атомов.
У одиночного атома электронная оболочка симметрична. При сближении двух атомов их электронные оболочки электрически взаимодействуют и деформируются (см. рис. 6). В итоге атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек, а следовательно, связь валентных электронов с ядром ослабевает, и деформировать ее становится легче. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.

Рис. 6 Схема образования диполей при сближении нейтральных атомов
Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.Важно иметь в виду, что в одном и том же материале одновременно могут реализовываться несколько типов химических связей. Так, внутри молекулы полиэтилена связь ковалентная, а между молекулами поляризационная. В алмазе атомы углерода связаны ковалентной связью, а у графита три электрона образуют ковалентную связь, один электрон идет на образование металлической связи, и образующиеся плоские молекулы связаны поляризационной связью.
В ряде случаев наблюдается изменение типа связи при изменении внешних условий. Так, олово является элементом четвертой группы, и в нем должна реализовываться ковалентная связь, но у олова пять электронных оболочек, и валентные электроны слабо связаны с ядром. Поэтому при термическом возбуждении электроны отрываются от атомов, и связь становится металлической. До температуры 13°С межатомная связь в олове ковалентная, и он является типичным полупроводником«серое» олово. Выше 13°С связь становится металлической, и олово ведет себя как типичный металл – «белое» олово. Важно отметить, что превращение белого олова в серое олово не может произойти строго при 13°С. Это вызвано существенным различием в плотности упаковки атомов. При перестройке кристаллических решеток в материале появляются упругие напряжения, которые повышают энергию системы. Поэтому превращение начинается при существенном переохлаждении. Упругие напряжения, возникающие при превращении, разрушают материал, поэтому серое олово существует в виде порошка. Превращение белого олова в серое было причиной гибели экспедиции Роберта Скотта. Поскольку канистры с горючим были пропаяны оловом, то при охлаждении белое олово превратилось в серое и горючее вытекло.
studfiles.net
Ионная связь - электростатическое притяжение между ионами, образованными путём практически полного смещения электронной пары к одному из атомов. Этот тип связи образуется, если разность электроотрицательностей атомов велика. Связи такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т.е. состоящими из одного атома (например, катионы Na+, K+, анионы F-, Cl-), или сложными, т.е. состоящими из двух или более атомов, (например, катион Nh5+, анионы OH-, NO3-,SO4 2-). Ионная связь - предельный случай полярной ковалентной связи. Но в отличие от ковалентной связи, ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Металлическая связь - связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. . В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов . Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». В случае металлов невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу равномерно. Этим и объясняется, например, пластичность металлов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи. Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь). Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи.
Межмолекулярная и внутримолекулярная водородная связь
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений. Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца.
Влияние водородной связи на физико-химические свойства веществ.
Было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов анной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают. Это объяснятся усилением взаимного притяжения молекул, что связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними.
Водородная связь служит причиной некоторых особенностей воды - вещества, играющего огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты.
studfiles.net
Как проявляется влияние типа химической связи в оксидах, боридах, карбидах и силицидах на свойства этих соединений [c.15]
Состав, структура и свойства отдельных соединений и фаз, в виде которых силикаты и другие тугоплавкие соединения участвуют в процессах синтеза и присутствуют в готовых технических продуктах, оказывают большое влияние на свойства этих продуктов. Свойства соединений решающим образом зависят от особенностей их строения на атомном уровне, типа реализуемой в них химической связи, степени дефектности и характера дефектов решетки кристаллических тел. Для многих силикатов и других тугоплавких соединений характерен полиморфизм, оказывающий нередко большое влияние как на процесс синтеза, так и на конечные свойства технических продуктов. [c.5]
Настоящий учебник состоит из теоретического курса и лабораторного практикума, взаимно связанных и дополняющих друг друга В нем рассмотрены теоретические понятия представления об электронном строении атома углерода и его химических связей, взаимное влияние атомов в молекуле, основные типы и механизмы органических реакций, вопросы стереохимии. Материал по важнейшим классам органических соединений изложен по функциональному принципу. Такой подход позволяет при экономном изложении сформировать более глубокие знания и умения творческого сопоставления свойств соединений отдельных классов В самостоятельный раздел выделены гетероциклические соединения, биополимеры и другие природные соединения. Отбор фактического материала произведен с учетом профессиональной направленности, В качестве представителен классов приводятся, как правило, вещества, являю-ш иеся либо лекарственными средствами, либо полупродуктами в их синтезе, а также использующ еся в качестве вспомогательных веществ при изготовлении лекарственных форм [c.14]В настоящее время не вызывает сомнения утверждение, что катализ — явление химическое. Поэтому, в общем случае, следует ожидать соответствия между каталитическими и химическими свойствами веществ. Определяющим звеном в катализе является локальное взаимодействие активных участков катализатора с молекулами реагентов. Активация реагирующих молекул или их определенных связей, образование промежуточных соединений, переходных комплексов зависит от химических свойств катализатора. Сказанное не отрицает, конечно, влияния на каталитические свойства контактов данного химического состава типа и параметров кристаллической решетки, ее дефектности, положения уровня Ферми, ширины запрещенной зоны и других параметров, характеризующих коллективные свойства катализаторов. При постоянном химическом составе эти свойства могут существенно влиять на активность и селективность катализаторов, приводя к изменению не только предэкспоненциального множителя и энергии активации, но и вида кинетического уравнения. [c.6]
Давление пара, температуры кипения и азеотропы. Взаимодействие между молекулами в растворах может быть выявлено при построении зависимости давления пара или температур кипения от состава раствора. Отклонения от идеального поведения приводят к появлению на соответствующих кривых максимумов или минимумов. Точнее, положительные отклонения дают максимумы на кривых давления пара, минимумы на кривых температур кипения и азеотропы с минимальными температурами кипения при условии, что разница в температурах кипения компонентов раствора мала по сравнению с величиной отклонения или что разница в параметрах растворимости б достаточно велика. Противоположные закономерности наблюдаются при Отрицательных отклонениях. Смеси соединений, способных к образованию Н-связи, могут давать как положительные, так и отрицательные отклонения от закона Рауля в зависимости от относительной силы Н-связи между одинаковыми и неодинаковыми молекулами в растворе. Например, смесь ацетона с хлороформом дает азеотроп с максимумом температуры кипения, в то время как в случае смеси ацетона с водой было показано, что азеотроп либо вообще отсутствует, либо имеет весьма незначительно пониженную температуру кипения [959]. В первом случае в чистых компонентах Н-связь отсутствует и образуется только после смешения. Это ведет к отрицательным отклонениям от закона Рауля и появлению азеотропа с максимумом температуры кипения. Во втором случае ассоциация воды приводит к конкуренции между двумя типами равновесий. По-видимому, переход от связей вода — вода к связям вода — ацетон вызывает лишь малое суммарное изменение и отклонения, по существу, отсутствуют. Обзор проблемы межмолекулярных сил и обсуждение влияния Н-связи на свойства растворов были даны Роулинсоном [1751, стр. 187]. [c.41]
Оптические свойства. Самым наглядным проявлением внутримолекулярной Н-связи в оптических свойствах является ее влияние на цвет химических соединений. В разд. 4.2.1. рассматривались соединения, в частности красители, у которых влияние Н-связи обнаруживается в спектральном интервале, лежащем вне видимой области. Можно сформулировать следующие общие выводы образование Н-связи приводит к сдвигу электронных полос к большим или меньшим длинам волн при этом направление сдвига обычно можно предсказать, зная тип электронного перехода. Некоторые цветные реакции позволяют обнаружить Н-связь и различить ее внутри- и межмолекулярную форму [1689, 1610]. Однако эти реакции следует использовать с осторожностью, поскольку их характерность надежно не доказана. [c.160]
Когда с помощью Н-связей образуются не просто димеры, а более сложные системы — цепочки, двумерные и пространственные решетки, то свойства соединений заметно изменяются. Прежде всего следует отметить неаддитивность свойств в таких образованиях. Однако квантовомеханическое изучение систем, содержащих большое число молекул, сталкивается с серьезными вычислительными трудностями как вследствие увеличения числа электронов в системе, так и вследствие увеличения числа измерений функции потенциальной энергии. Перед теоретическими расчетами стоят задачи двух типов определение отклонений от аддитивности в энергии связи, что важно, например, для статистической механики жидкости, и определение влияния большого числа взаимодействующих Н-связей па геометрические и спектроскопические свойства. [c.26]
Оценивая электрические свойства клеев, можно сказать, что лучшими диэлектриками являются эпоксидные соединения, электроизоляционные свойства которых зависят от типа олигомера, природы отвердителя, наполнителя и пластифицирующих добавок [15, 16]. Фенолокаучуковые сополимеры имеют низкие показатели диэлектрических свойств, что связано, по-видимому, с наличием в них сажи и других наполнителей. Введение в клеевые композиции пластифицирующих добавок, как правило, ухудшает их диэлектрические свойства. Тип наполнителя оказывает значительное влияние на электроизоляционные свойства. Так, введение титанита кальция позволяет получить составы с заданной диэлектрической проницаемостью, введение металлических наполнителей (например, порошкообразного серебра) дает возможность получить электропроводящие системы. [c.250]
В отличие от низкомолекулярных соединений, свойства и, соответственно, области применения полимеров определяются не только, а в ряде случаев и не столько их химическим составом и строением, сколько рядом показателей, специфических для этих соединений, в частности—молекулярным весом, формой макромолекул, типом связей между ними, наличием разветвлений в макромолекулах, полидисперсностью и т. д. Ниже рассмотрено влияние этих факторов на свойства высокомолекулярных соединений. [c.623]
Характер инициатора, применяемого при полимеризации в эмульсии, не влияет на соотношение этих типов связей. Температура полимеризации оказывает существенное влияние на степень разветвленности макромолекул. Чем ниже температура, тем меньше (при прочих равных условиях) степень разветвленности, тем больше звеньев, соединенных в положении 1 —4, и лучше свойства получаемого каучука. [c.733]
Так как в мостиках сера связана достаточно прочно, соединения такого типа не оказывают существенного влияния на противозадирные свойства масел, будучи добавлены к ним даже в значительном количестве. [c.32]
Примером свойства, которое в силу явно выраженного конститутивного характера совершенно непригодно для раскрытия типа связи атомов, может быть вращение плоскости поляризации. В значительной мере это следует приписать многообразному взаимному влиянию связей. Хотя и здесь внутри некоторых классов соединений были установлены аддитивные черты, но эти правила оптической суперпозиции представляют собой закономерности, справедливые лишь в узком диапазоне, что можно обосновать и теоретически . [c.32]
Теоретические представления о механизме возникновения в системе внутренних напряжений в результате взаимодействия на границе раздела полимер — наполнитель были разработаны Зубовым [329—331]. Наблюдалось сильное влияние типа подложки на величины внутренних напряжений [331—334]. Особый интерес представляет влияние наполнителей на адгезионные свойства покрытий [335, 336]. Исследование внутренних напряжений на границе со стеклом при формировании пленок полиэфирмалеината с разными наполнителями показало, что с увеличением содержания наполнителя в покрытии внутренние напряжения- и адгезия к подложке увеличиваются. Увеличение напряжений зависит от прочности связей между связующим и частицами наполнителя. С увеличением содержания активного наполнителя внутренние напряжения и адгезия возрастают. Снижение внутренних напряжений может быть достигнуто модификацией поверхности наполнителя поверхностноактивными веществами, способствующими/ул1еньшению прочности связи между частицами наполнителя и связующим. Существенно, что внутренние напряжения в клеевых соединениях во много раз больше, чем в покрытиях той же толщины [337]. Это связано с увеличением площади контакта связующего с подложкой (числа центров структурообразования). Внутренние напряжения в клеевых соединениях зависят, в свою очередь, от прочности связи между склеиваемыми поверхностями и клеем. [c.180]
Влияние структуры на свойства веществ проявляется, например, при полиморфных превращениях вследствие зависимости свойств веществ от особенностей модификаций, в которых они существуют. Особенно отчетливо выражено это влияние в случае алмаза — графита. Здесь изменение структуры сопровождается существенным изменением типа связи (см. ниже). Значительное влияние типа связи на свойства иллюстрируется примером иодид цезия — -латунь (Zn u). Оба соединения обладают совершенно одинаковой структурой, но в свойствах у них нет ничего общего. Сравнительно простые соотношения между структурой и свойствами могут быть установлены для силикатов (ср. стр. 479). [c.294]
Большие размеры многих органических молекул и различные типы связей в них делают важными волрос о взаимном влиянии атомов, пространственно разделенных в пределах молекулы и, соответственно, вопрос о влиянии конфигурации молекулы на это взаимодействие. Длинные цепи атомов, соединенных ст-связями (например, — С —С —С —С —С—), в определенной мере изолируют группы, находящиеся на концах цепи. Если эти группы химически активны, отличаются специфическими свойствами, содержат системы л-электронов, характеризуются типичным для данных связей спектром, то их относят к функциональным группам. Это, например, группы ОН, СООН, ЫНг, СНО, СЫ, СО и др. В инфракрасной области им соответствуют характерные полосы поглощения. [c.166]
Наиболее распространенными типами водородной связи являются О—И...О при наличии гидроксильной группы (такого рода межмолеку-лярную связь образуют вода, фенол, спирты) О—Н...0 связь при наличии карбоксильной группы, которая склонна к образованию водородных связей через кислород (с водородом других, молекул), что наблюдается в карбоновых кислотах 14—Н...О образуют соединения NHз, КНз, N11 при растворении в воде. Три атома, участвующие в водородной связи, стремятся к образованию прямой линии. С практической точки зрения стереохимические следствия из водородной связи проявляются в трех главных областях в клешневидных (хелатированных) соединениях, кристаллических структурах и макромолекулах. Водородная связь рассматривается как наиболее важная из сил, способных определять расположение молекул в кристалле, где молекулы располагаются так, чтобы получить небольшое возможное число водородных связей. Водородная связь, допуская явления ассощ1ации, оказывает большое влияние на физические свойства ассоциированных соединений (вязкость, растворимость, летучесть, ИК-спектр и др.). Образующиеся [c.394]
Постепенный переход типа углерод-углеродн ой связи от этилгпового типа связи к циклопропановому приводит к тому, что некоторые особенности этиленовой связи сохраняются и в циклопропановом кольце. Это положение находит аналогию среди циклических эфиров. Наличие алкильных групп у атома углерода, связанного двойной связью в олефине, как известно, оказывает влияние на свойства этой двойной связи (это явление называют иногда гиперконъюгацией [5]). Подобный эффект распространяется и на свойства циклической системы в замещенном циклопропане и, очевидно, проявляется также в трехчленных гетероциклах [6]. В окисях этиленов это заметно ска-, зывается на скорости их образования. Трехчленное кольцо, подобно олефино-вой связи или карбонильной группе, может быть сопряжено с двойной связью-, или арильной группой [7, 8]. В ряде исследований было отмечено сходства адсорбционных спектров конъюгированных молекул, имеющих а-окисное-кольцо, со спектрами молекул, где окисное кольцо заменено этиленовой связью или карбонильной группой. Эти измерения проведены на примере соединений IV [9] и V [8] [c.5]
Нельзя не сознаться, что такое объяснение представляется искусственным и маловероятным (особенно для реакции распадения). По моему мнению, результаты, полученные Иёргенсеном, решительно говорят против цепеобразного расположения частиц аммиака в платиновых солях. Так как порядок вступления аминов ке оказывает влияния на свойства соединений одинакового ряда (например, а или Р), то мы должны заключить, что в соединениях типа Р1С12-4А все частицы аммиака и аминов находятся в одинаковом положении по отношению к группе Р1С1г, причем, вероятно, каждая из них вступает в непосредственную связь с платиной и хлором. [c.32]
Эти выводы о влиянии прочности связи металл—кислород на активность окисного катализатора качественно подтверждаются опытами по частичному восстановлению поверхности при последовательном импульсном вводе проб бутена нри отсутствии в газовой фазе кислорода. Естественно, что нри этом должно происходить обеднение поверхностных слоев кислородом, т. е. уменьшение концентрации ионов 0 . При этом должна расти величина Так, например, при переходе МнОа в МпаОд ( о = 17, а при переходе Мп Оз в МП3О4 ( о = 34. В результате увеличе-ния 0 катализатор должен становиться менее активным в отношении реакции глубокого окисления. На рис. 1.15 приведены результаты с МнОа- Видно, что с увеличением числа импульсов конверсия бутена-1 уменьшается с 60 до 40%, главным образом, за счет уменьшения образования СО2 (с 30 до 8%). Происходит увеличение выхода бутадиена с 4 до 10%. Согласно работам [53, 28], восстановление поверхности в результате протекания реакции окислительного дегидрирования сильнее всего уменьшает скорость глубокого окисления. Скорость реакций образования кислородсодержаш их соединений уменьшается не так значительно. На реакции окислительного дегидрирования и изомеризации восстановление поверхности оказывает лишь слабое влияние. Это уменьшает убедительность указанной корреляции. Но ее самая слабая сторона— резкая разнородность сравниваемых систем. Действительно, сопоставляются окислы типа МеО, МваОд, МеОа, образованные как переходными металлами Сг, Ее, N1, Мо, так и непереходными Хп, Зп, В1. У этих окислов различные типы кристаллических решеток, не тождественные типы связей при частичной потере кислорода Опи образуют также мало похожие промежуточные формы. Поэтому, если искать корреляцию термохимических и термодинамических характеристик окислов с их каталитическими свойствами, то в основу следовало бы скорее брать дифференциальные теплоты и свободные энергии частичного восстановления в условиях катализа каждой конкретной оксидной системы. Несмотря на то что очень высокие Qg исключают катализ, а очень малые могут быть невыгодными, более вероятно все же, что не только селективность, но и активность при глубоком окислении в первую очередь определяется кинетическими, а не термохимическими величинами. Поэтому нет оснований искать далеко идуш,ие корреляции между термохимическими свойствами окислов и их каталитической активностью. [c.291]
В предыдущих разделах этой главы были рассмотрены некоторые характерные свойства ковалентных связей было указано, что при наличии примерно одинакового взаимного влияния атомов в молекулах такие свойства ковалентных связей, как энергия образования, полярность, ноляризуемостьт могут быть охарактеризованы некоторыми постоянными величинами. Если в молекуле имеются связи только такого типа, эти свойства молекулы в целом можно рассматривать как аддитивные, примерно равные сумме значений для отдельных связей, имеющихся в молекуле, и расхождение между вычисленными и найденными величинами оказывается незначительным. Длина связей в этих случаях может быть вычислена как сумма ковалентных радиусов. Однако, как показало физико-химическое исследование разнообразных органических соединений, во многих случаях наблюдаются отклонения от аддитивности этих свойств. Так, в некоторых (сравнительно многочисленных) случаях наблюдается изменение межъядерных расстояний по сравнению с обычными для основных типов ковалентных связей. Для некоторых соединений было обнаружено также существенное различие между экспериментально найденными и вычисленными (на основании принципа приближенной аддитивности) величинами энергии образования, теплоты сгорания, дипольного момента и молекулярной рефракции. При рассмотрении [c.106]
Многие свойства азиридинов являются яркой иллюстрацией мезомер-ного характера связей между гетерофрагментом и этиленовым фрагментом цикла, вытекающего из модели. Так, заместители +-Ё -типа при атоме азота оказывают незначительное, а при атоме углерода — очень сильное влияние на основность соединения. Специфическая сольватация атома азота в азиридинах, как и в оксиранах, приводит к резкому увеличению скорости реакции с нуклеофилами и оказывает сильное влияние на порядок раскрытия цикла асимметричных соединений. Реакционную способность азиридинов можно считать мерой эффектов стабилизации р -гиб-ридного состояния атома азота. Эти и многие другие особенности свойств соединений с азиридиновым циклом закономерно вытекают из модели трехчленного гетероцикла. [c.329]
Если в органическом соединении имеется несколько кратных связей, поведение их при химических процессах зависит от их взаимного положения. В том случае, когда кратные связи разобш,ены не менее чем двумя простыми связями, они в общем ведут себя автономно, как обычные кратные связи, и их взаимное влияние изменяет свойства каждой из них только в количественном отношении, например сказывается на скоростях реакций присоединения . Если же кратные связи разобщены только одной простой связью, т. е. являются сопряженными, их взаимное влияние настолько велико, что они уже характеризуются новыми качественными отличиями. При этом следует в свою очередь различать сопряженные углерод-углерод кратные связи в соединениях типа дивинила (I) и его алкилзамещенных гомологов и сопряженные связи, в системе [c.399]
Рассматривая строение простых ацетиленидов Сп , AgI и Аи , мы видим, что на тройную связь в этих соединениях оказывают влияние два типа связей — комплексная (донорно-акцепторная и дативная связи) и металлоорганическая а- и йз1—ря-сшш). Используя данные по ИК-спектрам ацетиленидов и этинильных комплексов ряда металлов (табл. 6), можно ориентировочно рассмотреть вопрос о связи между акцепторными и донорными свойствами металлов и эффектом воздействия их на тройную связь в этих соединениях (эффект изменения тс=с)-Значения А о=с (Av == =v s н—V =oм) падают в ряду Си > Ап > Ag. Акцепторные свойства указанных ионов, характеризуемые, в первом приближении, значениями сродства к электрону, электроотрицательности или стандартного окислительного потенциала, падают в ряду Au >Ag > u . В этом же ряду резко растет устойчивость ацетиленидов по отношению к реакции [c.87]
Приведенные данные о реакциях ГАОС с протонодонорными соединениями, и прежде всего с водой, открывают ранее не известную область комплексообразования в этих системах. Отличительными особенностями образования донорно-акцепторных комплексов подобного типа являются сохранение металлоорганической функции (согласно представлениям координационной химии непереходных элементов [75] вследствие взаимного влияния лигандов связь А1—С должна даже усиливаться) и их слабая бренстедовская кислотность. Последний из названных признаков отличает рассматриваемую группу комплексов, особенно комплексов ГАОС с водой, от традиционных кислот Бренстеда и Льюиса. Очевидно, не последнюю роль в проявлении кислых свойств комплексов играет нуклеофильность оснований (мономера), с чем и связано появление таких свойств, как селективность действия. Помимо дальнейшего всестороннего изучения явления комплексообразования ГАОС полученные результаты стимулировали широкое использование комплексов в промышленном электрофильном катализе. Актуальность подобных работ, имея в виду ограниченные возможности AI I3 и возрастающий дефицит в нем, несомненна. Ряд удачных решений (разработка технологии получения бутилкаучука и полиизобутнленов и неплохие перспективы в синтезе алкилпроизводных ароматических углеводородов и т. д.) вселяют надежды на плодотворность дальнейших усилий по внедрению новых катализаторов в промышленность. [c.12]
Грей и сотр. [179], измерив скорости аннигиляции с отрывом приблизительно в 200 органических жидкостях, обнаружили корреляцию между временем жизни триплетного позитрония и молеку лярной структурой жидкости. В случае групп соединений одного типа, например н-алканов, неразветвленных первичных спиртов или 1-хлор-н-алканов, сечение тушения позитрония изменялось линейно с числом углеродных атомов. Удалось также установить вклады в сечение отдельных атомных группировок, причем эти вклады зависели не только от природы атомов, образующих эти группировки, но и от типов связи между ними. Были установлены корреляции и с другими молекулярными свойствами, например с поляризуемостью молекул. Влияние различных факторов на аннигиляцию с отрывом изучалось также и в смесях расгворителей. [c.165]
То, что примеси играют большую роль при получении монокристаллов, широко известно и довольно широко изучается. Что же касается влияния примесей на физические свойства поликристаллических продуктов, то его исследование пока проводится слабо. Вместе с тем и в данном случае зависимость физических свойств от содержания примесей очень интересна и в теоретическом, и в практическом плане. Достаточно вспомнить, что именно при помош,и примесей достигаются известные положительные результаты по снижению слеживаемости и гигроскопичности [36—38]. Основным в изучении связи между физическими свойствами и содержанием примесей является учет местоположения последних. Другими словами, характер влияния примеси на свойства зависит от того, образует ли она твердый раствор, адсорбируется на гранях или образует механические включения. Проблема установления связи между содержанием примеси и физическими свойствами имеет первостепенное значение для получения как высокочистых соединений, так и веществ с наперед заданными свойствами. Решение ее требует организации широких экспериментальных исследований различного типа. Они же в свою очередь требуют разработки специальной аппаратуры и методик. Вопрос об изучении влияния примесей на огранку кристаллов следует рассмотреть особо. Работ в этом направлении выполнено очень много [39—41], но полученный экспериментальный материал до сих пор не позволил разобраться в 1грироде наблюдаемого явления. Очевидно, для ее установления требуются более тщательные и целенаправленные эксперименты. Следует только отметить, что осо-эенно ярко выражено влияние органических примесей [40]. [c.15]
Обычно при рассмотрении диэлектрических и других свойств соединений двойных окислов типа ВаТс 0 и изменений этих свойств под влиянием различных внешних факторов гетеродесмичноеть их структуры учитывается лишь косвенно в рамках ионной модели атих кристаллов. Такой подход не позволяет судить об относительной прочности конкретных связей. Облучение оказалось чувствительным и перспективным методом изучения именно этой стороны вопроса, имеющей прямое отношение к природе сегнетоэлектрических свойств кристаллов со структурой типа перовскита. [c.73]
В настоящем разделе рассматриваются следующие классы соединений простые эфиры типов ROR, ArOR и Gh3 = HOR или СН s OR 1,2-эпоксиэтан алканолы и фенолы. Алканолы и диалкилэфиры являются изомерами, имеющими одну и ту же суммарную формулу Сп,Й2 +2, где п 2. Рассмотрение всех этих классов соединений ограничивается в настоящем разделе изложением свойств связи С — О, атома кислорода и влияния, оказываемого OR- или ОН-группой на реакционную способность углеводородного остатка, с которым она связана свойства О — Н-связи будут рассмотрены позднее. Охватываемый при этом материал излагается в следующей последовательности (А) реакции нуклеофильного замещения (Б) реакции нуклеофильного присоединения (В) реакции элиминирования (Г) реакции электрофильного присоединения и замещения. [c.331]
Связь 81—81 может образоваться при обработке соединений, содержащих 81—СЬгрупиы, металлическим натрием (Бигден, Киппинг и д ).). Подобно связи 81—Н, связь 81—81 способна гидролизоваться и окисляться. Под влиянием А1С1з связь 81—81 расщепляется, образуя снова связь 81—С1. Связь 81—81 расщепляется также металлами, в особенности Ь1 в тетрогидрофуране при этом возникает связь 81—металл [91]. Хотя сама по себе связь 81—81 с химической точки зрения мало интересна, ее физические свойства в последние годы были подробно изучены. Недавно синтезированы макромолекулы [9] типа [c.187]
С другой стороны, именно циклическая связь сильнее, чем какая-либо другая черта конституции, влияет и на физические свойства, и на химическую природу вещества. Так, она оказывает резкое влияние на удельный вес и, следовательно, на молекулярный объем (кажущийся объемом частицы) соединения, на скорость прохождения через него световых и электрических волн (коэффициент преломления и диэлектрическая константа), а затем и на истинный объем частицы, далее на величину магнитного вращения плоскости поляризации, на способность к избирательному поглощению лучей света, на степень устойчивости химических соединений, на их электрохимическую природу и способность вступать в соединение с другими телами, на появление своеобразных форм (геометрической) изомерии и пр. Во всех этих особенностях циклической связи больше всего обращает на себя внимание то обстоятельство, что столь разнообразные свойства и признаки проявляются в соединениях, построенных из одних и тех же элементов, нередко в одинаковых стехиометрических отношениях. Можно сказать, что основной принцип изомерии (различие в свойствах при одинаковом материале) получает здесь особенно яркое и многостороннее выражение. Специально относительно гидроароматцческих и вообще полиметиленовых соединений к сказанному следует еще добавить, что вещества, относящиеся к этой последней категории, представляют несомненный интерес еще и потому, что изучение их особенно подчеркивает и оттеняет своеобразный, так называемый ароматичный характер дериватов бензола и его аналогов. Благодаря классическим исследованиям Байера [1] мы знаем, что тот загадочный способ комбинации атомов, который мы имеем в ароматических соединениях, сразу теряется при частичном даже гидрировании их и переходе к полиме-тиленовому типу. Сопоставление полиметиленовых соединений с ароматическими и их взаимные переходы скорее всего могут привести нас к разгадке бензольной проблемы. Как известно, многое в этом отношении уже сделано остальное составит предмет будущих исследований. [c.18]
chem21.info
Строение и свойство материалов. Кристаллическое строение. Анизотропия. Влияние типа связи на структуру и свойства кристаллов
Строение вещества определяется не только взаимным расположением атомов в химических частицах, но и расположением этих химических частиц в пространстве. Наиболее упорядочено размещение атомов, молекул и ионов в кристаллах(от греческого «кристаллос» – лед), где химические частицы (атомы, молекулы, ионы) расположены в определенном порядке, образуя в пространстве кристаллическую решетку. При определенных условиях образования они могут иметь естественную форму правильных симметричных многогранников. Кристаллическое состояние характеризуется наличием дальнего порядка в расположении частиц и симметрией кристаллической решетки.
Для аморфного состояния характерно наличие только ближнего порядка. Структуры аморфных веществ напоминают жидкости, однако обладают гораздо меньшей текучестью. Аморфное состояние обычно неустойчиво. Под действием механических нагрузок или при изменении температуры аморфные тела могут закристаллизоваться. Реакционная способность веществ в аморфном состоянии значительно выше, чем в кристаллическом.
Аморфные вещества
Главный признак аморфного(от греческого «аморфос» – бесформенный) состояние вещества – отсутствие атомной или молекулярной решетки, то есть трехмерной периодичности структуры, характерной для кристаллического состояния.
При охлаждении жидкого вещества не всегда происходит его кристаллизация. при определенных условиях может образоваться неравновесное твердое аморфное (стеклообразное) состояние. В стеклообразном состоянии могут находиться простые вещества (углерод, фосфор мышьяк, сера, селен), оксиды (например, бора, кремния, фосфора), галогениды, халькогениды, многие органические полимеры.
В этом состоянии вещество может быть устойчиво в течение длительного промежутка времени, например, возраст некоторых вулканических стекол исчисляется миллионами лет. Физические и химические свойства вещества в стеклообразном аморфном состоянии могут существенно отличаться от свойств кристаллического вещества. Например, стеклообразный диоксид германия химически более активен, чем кристаллический. Различия в свойствах жидкого и твердого аморфного состояния определятся характером теплового движения частиц: в аморфном состоянии частицы способны лишь к колебательным и вращательным движениям, но не могут перемещаться в толще вещества.
Существуют вещества, которые в твердом виде могут находиться только в аморфном состоянии. Это относится к полимерам с нерегулярной последовательностью звеньев.
Аморфные тела изотропны, то есть их механические, оптические, электрические и другие свойства не зависят от направления. У аморфных тел нет фиксированной температуры плавления: плавление происходит в некотором температурном интервале. Переход аморфного вещества из твердого состояния в жидкое не сопровождается скачкообразным изменением свойств. Физическая модель аморфного состояния до сих пор не создана.
Кристаллические вещества
Твердые кристаллы– трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Геометрически правильная форма кристаллов обусловлена, прежде всего, их строго закономерным внутренним строением. Если вместо атомов, ионов или молекул в кристалле изобразить точки как центры тяжести этих частиц, то получится трехмерное регулярное распределение таких точек, называемое кристаллической решеткой. Сами точки называют узламикристаллической решетки.
Типы кристаллических решеток
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов.
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
Ионные кристаллы могут состоять из одноатомныхионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция. В образовании ионных кристаллов многих солей участвуют одноатомные катионы металлов и многоатомные анионы, например, нитрат-ион NO3−, сульфат-ион SO42−, карбонат-ион CO32−.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Большинство ионных соединений кристаллизуется по одному из структурных типов, которые отличаются друг от друга значением координационного числа, то есть числом соседей вокруг данного иона (4, 6 или 8). Для ионных соединений с равным числом катионов и анионов известно четыре основных типа кристаллических решеток: хлорида натрия (координационное число обоих ионов равно 6), хлорида цезия (координационное число обоих ионов равно 8), сфалерита и вюрцита (оба структурных типа характеризуются координационном числом катиона и аниона, равным 4). Если число катионов вдвое меньше числа анионов, то координационное число катионов должно быть вдвое больше координационного числа анионов. В этом случае реализуются структурные типы флюорита (координационные числа 8 и 4), рутила (координационные числа 6 и 3), кристобалита (координационные числа 4 и 2).
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Высокая растворимость в полярных растворителях, сопровождающаяся электролитической диссоциацией обусловлена тем, что в среде растворителя с высокой диэлектрической проницаемостью εуменьшается энергия притяжения между ионами. Диэлектрическая проницаемость воды в 82 раза выше, чем вакуума (условно существующего в ионном кристалле), во столько же раз уменьшается притяжение между ионами в водном растворе. Эффект усиливается за счет сольватации ионов.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Межмолекулярные силы возникают за счет электростатического взаимодействия отрицательно заряженных электронов одной молекулы с положительно заряженными ядрами соседних молекул. На силу межмолекулярного взаимодействия влияет много факторов. Важнейшими среди них является наличие полярных связей, то есть смещения электронной плотности от одних атомов к другим. Кроме того, межмолекулярное взаимодействие проявляется сильнее между молекулами с большим числом электронов.
Большинство неметаллов в виде простых веществ (например, иодI2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам – ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графитавнутри каждого слоя связи ковалентно-металлические, а между слоями – межмолекулярные.
--PAGE_BREAK--Изоморфизм и полиморфизм
Многие кристаллические вещества имеют одинаковые структуры. В то же время одно и то же вещество может образовывать разные кристаллические структуры. Это находит отражение в явлениях изоморфизмаи полиморфизма.
Изоморфизмзаключается в способности атомов, ионов или молекул замещать друг друга в кристаллических структурах. Этот термин (от греческих «изос» – равный и «морфе» – форма) был предложен Э. Мичерлихом в 1819 г. Закон изоморфизма бы сформулирован Э. Мичерлихом в 1821 г. таким образом: «Одинаковые количества атомов, соединенные одинаковым способом, дают одинаковые кристаллические формы; при этом кристаллическая форма не зависит от химической природы атомов, а определяется только их числом и относительным положением».
Работая в химической лаборатории Берлинского университета, Мичерлих обратил внимание на полное сходство кристаллов сульфатов свинца, бария и стронция и близость кристаллических форм многих других веществ. Его наблюдения привлекли внимание известного шведского химика Й.-Я. Берцелиуса, который предложил Мичерлиху подтвердить замеченные закономерности на примере соединений фосфорной и мышьяковой кислот. В результате проведенного исследования был сделан вывод, что «две серии солей различаются лишь тем, что в одной в качестве радикала кислоты присутствует мышьяк, а в другой – фосфор». Открытие Мичерлиха очень скоро привлекло внимание минералогов, начавших исследования по проблеме изоморфного замещения элементов в минералах.
При совместной кристаллизации веществ, склонных к изоморфизму (изоморфныхвеществ), образуются смешанные кристаллы (изоморфные смеси). Это возможно лишь в том случае, если замещающие друг друга частицы мало различаются по размерам (не более 15%). Кроме того, изоморфные вещества должны иметь сходное пространственное расположение атомов или ионов и, значит, сходные по внешней форме кристаллы. К таким веществам относятся, например, квасцы. В кристаллах алюмокалиевых квасцов KAl(SO4)2. 12h3O катионы калия могут быть частично или полностью заменены катионами рубидия или аммония, а катионы алюминия – катионами хрома (III) или железа (III).
Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава. Например, в минерале сфалерите ZnS до 20% атомов цинка могут быть замещены атомами железа (при этом ZnS и FeS имеют разные кристаллические структуры). С изоморфизмом связано геохимическое поведение редких и рассеянных элементов, их распространение в горных породах и рудах, где они содержатся в виде изоморфных примесей.
Изоморфное замещение определяет многие полезные свойства искусственных материалов современной техники – полупроводников, ферромагнетиков, лазерных материалов.
Многие вещества могут образовывать кристаллические формы, имеющие различные структуру и свойства, но одинаковый состав (полиморфныемодификации). Полиморфизм– способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и свойствами при одном и том же химическом составе. Это слово происходит от греческого «полиморфос» – многообразный. Явление полиморфизма было открыто М. Клапротом, который в 1798 г. обнаружил, что два разных минерала – кальцит и арагонит – имеют одинаковый химический состав СаСО3.
Полиморфизм простых веществ обычно называют аллотропией, в то же время понятие полиморфизма не относится к некристаллическим аллотропным формам (например, газообразным О2и О3). Типичный пример полиморфных форм – модификации углерода (алмаз, лонсдейлит, графит, карбины и фуллерены), которые резко различаются по свойствам. Наиболее стабильной формой существования углерода является графит, однако и другие его модификации при обычных условиях могут сохраняться сколь угодно долго. При высоких температурах они переходят в графит. В случае алмаза это происходит при нагревании выше 1000oС в отсутствие кислорода. Обратный переход осуществить гораздо труднее. Необходима не только высокая температура (1200–1600oС), но и гигантское давление – до 100 тысяч атмосфер. Превращение графита в алмаз проходит легче в присутствии расплавленных металлов (железа, кобальта, хрома и других).
В случае молекулярных кристаллов полиморфизм проявляется в различной упаковке молекул в кристалле или в изменении формы молекул, а в ионных кристаллах – в различном взаимном расположении катионов и анионов. Некоторые простые и сложные вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция – шесть, нитрат аммония – четыре. Полиморфные модификации принято обозначать греческими буквами α, β, γ, δ, ε,… начиная с модификаций, устойчивых при низких температурах.
При кристаллизации из пара, раствора или расплава вещества, имеющего несколько полиморфных модификаций, сначала образуется модификация, менее устойчивая в данных условиях, которая затем превращается в более устойчивую. Например, при конденсации пара фосфора образуется белый фосфор, который в обычных условиях медленно, а при нагревании быстрее превращается в красный фосфор. При обезвоживании гидроксида свинца вначале (около 70oС) образуется менее устойчивый при низких температурах желтый β-PbO, около 100oС он превращается в красный α-PbO, а при 540oС – снова в β-PbO.
Переход одной полиморфной модификации в другую называется полиморфными превращениями. Эти переходы происходят при изменении температуры или давления и сопровождаются скачкообразным изменением свойств.
Процесс перехода одной модификации в другую может быть обратимым или необратимым. Так, при нагревании белого мягкого графитоподобного вещества состава BN (нитрид бора) при 1500–1800oС и давлении в несколько десятков атмосфер образуется его высокотемпературная модификация – боразон, по твердости близкий к алмазу. При понижении температуры и давления до значений, отвечающих обычным условиям, боразон сохраняет свою структуру. Примером обратимого перехода может служить взаимные превращения двух модификаций серы (ромбической и моноклинной) при 95oС.
Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует, например, при переходе α-Fe в β-Fe при 769oС структура железа не меняется, однако исчезают его ферромагнитные свойства.
Химико-термической обработкой (ХТО) называется термическая обработка, заключающаяся в сочетании термического и химического воздействия с целью изменения состава, структуры и свойств поверхностного слоя стали.
Химико-термическая обработка является одним из наиболее распространенных видов обработки материалов с целью придания им эксплуатационных свойств. Наиболее широко используются методы насыщения поверхностного слоя стали углеродом и азотом как порознь, так и совместно. Это процессы цементации (науглероживания) поверхности, азотирования – насыщения поверхности стали азотом, нитроцементации и цианирования – совместного введения в поверхностные слои стали углерода и азота. Насыщение поверхностных слоев стали иными элементами (хромом – диффузионное хромирование, бором – борирование, кремнием – силицирование и алюминием – алитирование), применяются значительно реже. Процесс диффузионного насыщения поверхности детали цинком называется цинкованием, а титаном – титанированием.
Процесс химико-термической обработки представляет собой многоступенчатый процесс, который включает в себя три последовательные стадии:
1. Образование активных атомов в насыщающей среде вблизи поверхности или непосредственно на поверхности металла. Мощность диффузионного потока, т.е. количество образующихся в единицу времени активных атомов, зависит от состава и агрегатного состояния насыщающей среды, которая может быть твердой, жидкой или газообразной, взаимодействия отдельных составляющих между собой, температуры, давления и химического состава стали.
2. Адсорбция (сорбция) образовавшихся активных атомов поверхностью насыщения. Адсорбция является сложным процессом, который протекает на поверхности насыщения нестационарным образом. Различают физическую (обратимую) адсорбцию и химическую адсорбцию (хемосорбцию). При химико-термической обработке эти типы адсорбции накладываются друг на друга. Физическая адсорбция приводит к сцеплению адсорбированных атомов насыщающего элемента (адсорбата) с образовываемой поверхностью (адсорбентом) благодаря действию Ван-дер-Ваальсовых сил притяжения, и для нее характерна легкая обратимость процесса адсорбции – десорбция. При хемосорбции происходит взаимодействие между атомами адсорбата и адсорбента, которое по своему характеру и силе близко к химическому.
3. Диффузия – перемещение адсорбированных атомов в решетке обрабатываемого металла. Процесс диффузии возможен только при наличии растворимости диффундирующего элемента в обрабатываемом материале и достаточно высокой температуре, обеспечивающей энергию необходимую для протекания процесса. Толщина диффузионного слоя, а следовательно и толщина упрочненного слоя поверхности изделия, является наиболее важной характеристикой химико-термической обработки. Толщина слоя определяется рядом таких факторов, как температура насыщения, продолжительность процесса насыщения, состав стали, т.е. содержание в ней тех или иных легирующих элементов, градиент концентраций насыщаемого элемента между поверхностью изделия и в глубине насыщаемого слоя.
Режущий инструмент работает в условиях длительного контакта и трения с обрабатываемым металлом. В процессе эксплуатации должны сохраняться неизменными конфигурации и свойства режущей кромки. Материал для изготовления режущего инструмента должен обладать высокой твердостью (ИКС 60–62) и износостойкостью, т.е. способностью длительное время сохранять режущие свойства кромки в условиях трения.
Чем больше твердость обрабатываемых материалов, толще стружка и выше скорость резания, тем больше энергия, затрачиваемая на процесс обработки резанием. Механическая энергия переходит в тепловую. Выделяющееся тепло нагревает резец, деталь, стружку и частично рассеивается. Поэтому основным требованием, предъявляемым к инструментальным материалам, является высокая теплостойкость, т.е. способность сохранять твердость и режущие свойства при длительном нагреве в процессе работы. По теплостойкости различают три группы инструментальных сталей для режущего инструмента: нетеплостойкие, полутеплостойкие и теплостойкие.
При нагреве до 200–300°С нетеплостойких сталей в процессе резания углерод выделяется из мартенсита закалки и начинается коагуляция карбидов цементитного типа. Это приводит к потере твердости и износостойкости режущего инструмента. К нетеплостойким относятся углеродистые и низколегированные стали. Полутеплостойкие стали, к которым относятся некоторые средне-легированные стали, например 9Х5ВФ, сохраняют твердость до температур 300–500°С. Теплостойкие стали сохраняют твердость и износостойкость при нагреве до температур 600°С.
Углеродистые и низколегированные стали имеют сравнительно низкую теплостойкость и невысокую прокаливаемость, поэтому их используют для более легких условий работы при малых скоростях резания. Быстрорежущие стали, имеющие более высокую теплостойкость и прокаливаемость, применяют для более тяжелых условий работы. Еще более высокие скорости резания допускают твердые сплавы и керамические материалы. Из существующих материалов наибольшей теплостойкостью обладает нитрид бора – эльбор, Эльбор позволяет обрабатывать материалы высокой твердости, например закаленную сталь, при высоких скоростях.
Список литературы
1. Кочергин А.И. и др. Металлообрабатывающие станки, линии и инструменты. Минск, 2007
2. Власов С.Н. и др. Устройство, наладка и обслуживание металлорежущих станков и автоматических линий. М., 2008
www.ronl.ru
Химическая связь в простых веществах (элементах) может быть металлической или ковалентной. В соединениях она может быть ионной или ковалентной. Однако, как было показано выше (см. рис. 2.11), чисто ионная или чисто ковалентная связь-это только предельные случаи. Поэтому делать какие-либо обобщения, касающиеся зависимости между типом химической связи, структурой и физическими свойствами, довольно рискованно. И все же существуют некоторые очевидные и важные закономерности, заслуживающие упоминания.

Начнем с рассмотрения табл. 2.11, из которой видно, что металлы и ионные соединения существуют в виде кристаллов с каркасной решеткой из одинаковых химических связей. (Подробное обсуждение кристаллической структуры проводится в следующей главе.) Простые вещества (элементы) и соединения с ковалентным типом связи существуют в виде молекулярных кристаллов, где молекулы связаны между собой слабыми межмолекулярными силами, либо в виде каркасных ковалентных кристаллов, которые можно рассматривать как гигантские молекулы макромолекулы.
Не все простые вещества (элементы) и соединения имеют структуру одного из простейших типов, показанных в табл. 2.11. Например, графит существует в форме кристаллов, состоящих из слабо связанных слоев углеродных атомов. В пределах одного слоя атомы углерода связаны между собой прочными ковалентными связями, а соседние слои связаны друг с другом слабыми вандерваальсовыми силами. Другим примером является иодид кадмия. Он тоже имеет слоистую структуру, хотя связи между атомами в каждом слое имеют промежуточный характер между ионными и ковалентными.
Обратимся теперь к различным физическим свойствам, которые определяются типом химической связи.
Физическое состояние вещества. Все металлические элементы, за исключением ртути, при комнатной температуре находятся в твердом состоянии. Неметаллические элементы при нормальных условиях находятся в твердом либо в газообразном состоянии, за единственным исключением: бром представляет собой жидкость.
Ионные соединения при комнатной температуре находятся в твердом состоянии.Исключение составляют только минеральные кислоты, которые являются жидкостями. Однако они представляют собой ионные соединения не в чистом виде, а в растворе в полярных растворителях (см. ниже).
Простые вещества (элементы) и соединения с ковалентным типом связи, состоящие из простых молекул, существуют в газообразном, жидком либо твердом состояния; в последнем случае они образуют молекулярные кристаллы, для которых характерны невысокие температуры плавления
Молекулы алмаза можно увидеть невооруженным глазом. Алмаз представляет собой гигантскую молекулу (макромолекулу). Он имеет кристаллическую структуру, в которой атомы углерода связаны между собой ковалентными связями в гигантский трехмерный каркас.
. Простые вещества (элементы) и соединения с ковалентной связью, существующие в форме кристаллов с каркасной структурой, имеют очень высокую температуру плавления.
Летучесть. Элементы и соединения с каркасной кристаллической структурой характеризуются высокими температурами плавления и кипения, а также большими энтальпиями плавления и испарения (табл. 2.11). Поэтому они считаются нелетучими. При нормальных условиях они существуют в твердом состоянии. Простые молекулярные соединения летучи. Они имеют невысокие температуры плавления и кипения, а также небольшие энтальпии плавления и испарения. Как мы уже знаем, они могут существовать в газообразном, жидком либо твердом состояниях.
Твердость. Элементы и соединения с каркасной кристаллической структурой, как правило, обнаруживают большую твердость. Характерными свойствами металлов являются ковкость и тягучесть; это означает, что они поддаются расплющиванию в тонкие листы под ударами молота и могут вытягиваться в тонкую проволоку, если нх протягивают (волокут) через узкое отверстие. Ионные и молекулярные соединения, как правило, хрупкие.
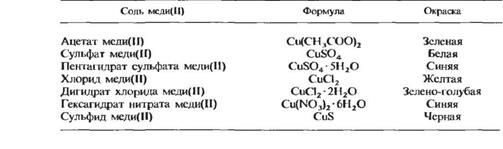
Окраска. Металлы имеют серовато-черную или коричневато-желтую окраску. Ионы в большинстве случаев бесцветны, но некоторые из них имеют вполне определенную окраску. Например, манганат(\Т1)-анион MnO4 имеет фиолетовую окраску. Катионы переходных металлов чаще всего окрашены. Окраска солей зависит от электронного взаимодействия между катионом и анионом. Соль может иметь окраску, даже если она содержит бесцветный анион. Хорошим примером этого являются соли двухвалентной меди. Они имеют самую разнообразную окраску, несмотря на то что анион в каждом случае бесцветен (табл. 2.12).
Ковалентные соединения (в том числе и элементные) могут быть окрашенными либо бесцветными. Например, вода и аммиак бесцветны, а диоксид азота имеет коричневую окраску. Все галогены имеют окраску. Органические соединения окрашены главным образом только в том случае, если они содержат хромофор.
Электропроводность и сопротивление.Все металлы как в твердом, так и в жидком состоянии являются хорошими проводниками электричества. Твердые ионные соединения плохо проводят электрический ток. Однако в расплавленном состоянии или в водных растворах, вследствие того что их кристаллическая решетка разрушена и ионы могут перемещаться свободно, ионные соединения становятся хорошими проводниками электричества. Их называют электролитами, поскольку при пропускании электрического тока они подвергаются химическому разложению - электролизу (подробнее об этом см. в гл. 10). Ковалентные соединения не являются проводниками, хотя, реагируя с водой, некоторые из них образуют электролиты. Примерами подобных соединений являются хлороводород HCl и аммиак Nh4. Как обычно, имеются и исключения. Например, графит является хорошим проводником электричества, хотя представляет собой ковалентное соединение. Такая особенность графита объясняется его слоистой структурой (подробнее об этом см. в следующей главе).
Электрическое сопротивление металла зависит от нескольких факторов-его природы, температуры, а также от длины и поперечного сечения проводника. Рассмотрим эти факторы подробнее.
Природа металла. Сопротивление электрическому току, по-видимому, обусловлено колебаниями ионов металла относительно их равновесных положений в кристаллической решетке. Эти колебания затрудняют движение электронов, что и вызывает сопротивление электрическому току.
Температура металла. По мере повышения температуры колебания ионов в кристаллической решетке металла усиливаются. Поэтому сопротивление металлов увеличивается с повышением температуры. Отсюда следует, что металлы являются тем лучшими проводниками, чем ниже температура.
Длина металлического проводника и площадь его поперечного сечения. Зависимость электрического сопротивления от этих факторов подробно рассмотрена в гл. 10.
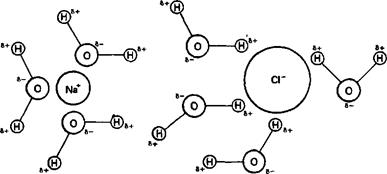
Растворимость. Металлы не растворяются ни в полярных, ни в неполярных растворителях. Однако они растворимы в жидких металлах. Ионные соединения растворяются в полярных растворителях, подобных воде, но не растворяются в неполярных растворителях, как, например, тетрахлорометан CCl4. Когда ионные соединения растворяются в полярных растворителях, например в воде, происходит разрушение их кристаллической решетки и сольватация ионов молекулами растворителя (рис. 2.24). Это означает, что молекулы полярного растворителя определенным образом ориентируются вокруг ионов. Молекулярные соединения с каркасной структурой нерастворимы ни в каких растворителях. Молекулярные соединения, как правило, не растворяются в полярных растворителях, но растворяются в неполярных растворителях.
cyberpedia.su