|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Истоки теории электролитической диссоциации. Возникновение теории растворов. Вклад отечественных ученых в развитие теории электролитической диссоциации реферат
Вклад русских химиков | Электричество в мире химии
В 1891 г. в Московском университете была защищена докторская диссертация «Современная теория растворов (Вант-Гоффа и Аррениуса) в связи с учением о химическом равновесии». Защищал ее тридцатичетырехлетний химик Иван Алексеевич Каблуков (1857-1942), ученик В. В. Марковникова, А. М. Бутлерова и Аррениуса, у которого он перед тем проработал год. Каблуков внес существенное усовершенствование в теорию электролитической диссоциации.
В те же годы многие химики, а не одни лишь профессора в Упсале высказывали возражения против теории Аррениуса. Она не давала ясного ответа, почему молекулы распадаются на ионы, каков механизм их образования. Это смущало Д. И. Менделеева и Н. Н. Бекетова, и они новую теорию не признавали. Противниками теории электролитической диссоциации были почти все французские химики во главе с Бертло, в Германии - Траубе и Видеман, в Ирландии - Фитцжеральд. Некоторые даже считали, что теорию электролитической диссоциации ждет судьба флогистона.
«Я никогда не забуду, - вспоминал Каблуков, - те горячие споры, которые происходили по поводу теории электролитической диссоциации в нашем химическом отделении Общества любителей естествознания, антропологии и этнографии, а также во время съездов русских естествоиспытателей и врачей. В этих прениях принимали участие такие видные представители русской науки, как академик Н. Н. Бекетов, мой учитель В. В. Марковников, профессор Казанского университета Ф. М. Флавицкий...» Добавим к этому имена Д. П. Коновалова и И. Ф. Шредера, много сделавших для развития теории растворов.
Дмитрий Петрович Коновалов (1856-1929), испытавший счастливое влияние Менделеева и Бутлерова, был и блестящим организатором, и талантливым ученым. Его деятельность в качестве товарища министра торговли и промышленности, а также ректора Горного института в Петербурге снискала ему огромное уважение у соотечественников. Оппонентом как магистерской, так и докторской диссертаций у Коновалова был сам Менделеев. Коновалов полагал, что между химическими соединениями и растворами нет границы. Одной только физической стороной явления не исчерпываются свойства растворов, утверждал другой крупный русский ученый Иван Федорович Шредер (1858-1918). Возражения, сделанные Менделеевым и его коллегами сторонникам теории электролитической диссоциации, оказались во многом справедливыми и были учтены при дальнейшем исследовании растворов.
В своей докторской диссертации Каблуков сделал блистательное дополнение к теории электролитической диссоциации. Он ввел представление о взаимодействии ионов с молекулами растворителя. В молекуле между ионами существуют силы притяжения. Как только молекула попадает в воду, около каждого иона за счет электрического взаимодействия начинают группироваться диполи воды. Это ослабляет силы притяжения между ионами, и энергии молекулярного движения оказывается в конце концов достаточно для того, чтобы отделить ионы друг от друга. Молекула приобретает ионизированную структуру. Процесс этот получил название гидратации ионов. Сам Каблуков писал так: «Молекулы воды, можно сказать, вторглись внутрь молекулы хлористого водорода, расшатали связь между атомами хлора и водорода настолько, что приобрели такую же свободу движения, которой обладают молекулы сахара в водном растворе... Вода, разлагая молекулы растворенного тела, входит с ионами в непрочные соединения, находящиеся в состоянии диссоциации».
Таким образом, химическое взаимодействие - вот причина распада молекул, причина диссоциации электролитов. Каблуков тем самым сделал необходимое дополнение к теории Аррениуса: диссоциация на ионы - следствие химического взаимодействия между растворенным веществом и растворителем. В теорию растворов был сделан крупнейший вклад.
Столь же весомый увклад в теорию растворов внес другой русский химик Владимир Александрович Кистяковский (1865-1952). Независимо от Каблукова он ввел в науку представление о сольватации ионов, которое и послужило основой для объединения химической теории растворов Менделеева с физической теорией растворов Вант-Гоффа - Аррениуса. «Откуда берется огромная энергия, долженствующая способствовать разложению электролитов на ионы? - говорил Кистяковский. - Если принять теорию Аррениуса так, как она сформулирована ее основателем, то ей неоткуда взяться». Ответ на заданный им же самим вопрос Кистяковский дал исчерпывающий.
Научная деятельность Кистяковского была обширной и разносторонней. Он основал Институт физической химии АН СССР, его работы в области коллоидной химии и электрохимии стали классическими, поставленные им проблемы развиваются и в настоящее время.
electrohistory.ru
Истоки теории электролитической диссоциации. Возникновение теории растворов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ГОУ ВПО ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
Реферат по истории химии
Истоки теории электролитической диссоциации. Возникновение теории растворов.
Выполнили:
Ильина Н.В.
Селина Т.Ю.
ТВЕРЬ 2012
ОГЛАВЛЕНИЕ
Введение 3
1 Истоки теории электролитической диссоциации
1.1 Основоположник ТЭД – С.Аррениус 4
1.2 Новые представления о солях, кислотах и основаниях 6
1.3 Дальнейшее развитие ТЭД 7
2 Борьба за признание ТЭД
2.1 ТЭД и Д.И.Менделеев 11
2.2 ТЭД В России 13
3 Теория растворов
3.1 Химическая теория растворов Д.И.Менделеева 16
3.2 Осмотическая теория Вант-Гоффа 18
3.3 Неводные растворы 19
3.4 Дальнейшее развитие теории растворов 24
Заключение 25
Список литературы 26
ВВЕДЕНИЕ
Для двух ребят подарков груз
Ион взвалил себе на спину:
Для Кати Он несет свой плюс,
Для Ани Он несет свой минус.
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток.
Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион». Электролит – вещество, раствор которого проводит электрический ток. Происходит это в результате движения в растворе заряженных частиц – ионов. Однако причина появления в растворах заряженных частиц была совершенно непонятной.
В 1887 году шведский физик-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду. Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет.
Многие ученые – современники Аррениуса, вначале не приняли его теорию. У многих из них в то время еще не было четкого понимания, чем ионы отличаются от нейтральных атомов. В результате диссертация Аррениуса получила ряд отрицательных отзывов. К числу самых непримиримых противников Аррениуса принадлежал и Д.И.Менделеев, создавший «химическую» теорию растворов, в отличие от «физической» теории Аррениуса. Однако последующие успехи новой теории были столь впечатляющи, а признание ее (пусть и не всеобщее) таким воодушевленным, что на этом фоне забылись все сомнения. Теория электролитической диссоциации убедительно объяснила многие факты, которые были известны давно и тем не менее оставались непонятными [7].
К середине 19 века возрастает интерес ученых к природе растворов. Становится все очевиднее, что без знания природы растворов невозможно изучать многие явления и проникнуть в сущность различных производственных процессов. В связи с развитием химических производств появилась острая необходимость в изучении свойств и состава различных растворов. Многие ученые того периода рассматривали растворы как механические смеси определенных соединений растворенного вещества с молекулами растворителя. Наибольшее развитие учение о растворах получило в фундаментальных работах Д.И.Менделеева [1].
- ИСТОКИ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
1.1 ОСНОВОПОЛОЖНИК ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ - С.АРРЕНИУС
История возникновения теории электролитической диссоциации связана с именем шведского физика-химика Сванте Аррениуса (1859— 1927). Его перу принадлежит 200 научных работ в области химии, физики, геофизики, метеорологии, биологии, физиологии.
АРРЕНИУС (Arrhenius), Сванте Август. Шведский физикохимик Сванте Август Аррениус родился в имении Вейк, недалеко от Упсалы. Он был вторым сыном Каролины Кристины (Тунберг) и Сванте Густава Аррениуса, управляющего имением. Предки Аррениуса были фермерами. Через год после рождения сына семья переехала в Упсалу, где С.Г.Аррениус вошел в состав совета инспекторов Упсальского университета. Посещая кафедральное училище в Упсале, Аррениус проявил исключительные способности к биологии, физике и математике.
В 1876г. Аррениус поступил в Упсальский университет, где изучал физику, химию и математику. В 1878г. ему была присвоена степень бакалавра естественных наук. Однако он продолжал изучение физики в Упсальском университете в течение трех последующих лет, а в 1881г. уехал в Стокгольм, в Шведскую королевскую академию наук, чтобы продолжать исследования в области электричества под руководством Эрика Эдлунда.
В 1884г. Аррениус защищает докторскую диссертацию в Упсальском университете. А в 1886г. Аррениус становится стипендиатом Шведской королевской академии наук, что позволило ему работать и проводить исследования за рубежом. В течение следующих пяти лет он работал в Риге с Оствальдом, в Вюрцбурге с Фридрихом Кольраушем (здесь он встретился с Вальтером Нернстом), в Грацком университете с Людвигом Больцманом и в Амстердамском – с Якобом Вант-Гоффом. Вернувшись в Стокгольм в 1891г., Аррениус начинает читать лекции по физике в Стокгольмском университете, а в 1895г. получает там должность профессора. В 1897г. он занимает пост ректора университета.
В 1903г. Аррениусу была присуждена Нобелевская премия по химии, «как факт признания особого значения его теории электролитической диссоциации для развития химии». Выступая от имени Шведской королевской академии наук, X.Р.Тернеблад подчеркнул, что теория ионов Аррениуса заложила качественную основу электрохимии, «позволив применять к ней математический подход». «Одним из наиболее важных результатов теории Аррениуса, – сказал Тернеблад, – является завершение колоссального обобщения, за которое первая Нобелевская премия по химии была присуждена Вант-Гоффу».
Аррениус получил много наград и титулов. Среди них: медаль Дэви Лондонского королевского общества (1902), первая медаль Уилларда Гиббса Американского химического общества (1911), медаль Фарадея Британского химического общества (1914). Он был членом Шведской королевской академии наук, иностранным членом Лондонского королевского общества и Германского химического общества. Аррениус был удостоен почетных степеней многих университетов, в т. ч. Бирмингемского, Эдинбургского, Гейдельбергского, Лейпцигского, Оксфордского и Кембриджского [6].
Интересно, что идея, ставшая основой этой теории, возникла на основе опытов, поставленных для решения совершенно иной проблемы.
Как рассказывает Ю.И. Соловьев, «еще студентом Упсальского университета С. Аррениус, слушая лекции своего учителя профессора П.Т. Клеве, узнал, что определить молекулярную массу таких веществ, которые, подобно тростниковому сахару, не переходят в газообразное состояние, невозможно. Чтобы принести химии «большую пользу», молодой ученый принимает решение определить электропроводность солей в растворах, содержащих наряду с водой большое количество неэлектролитов. При этом он исходил из принципа, что сопротивление раствора электролита тем больше, чем больше молекулярная масса растворителя. Таков был первоначальный план работы.
Но в результате первых наблюдений С. Аррениус теряет интерес к задуманной теме. Его увлекает новая мысль. Что происходит с молекулой электролита в растворе? Молодой ученый сознавал, что успешное решение этого вопроса позволит пролить яркий свет на темную область растворов. Так вместо определения молекулярной массы растворенного неэлектролита С.Аррениус начинает интенсивно изучать состояние молекулы электролита в растворе.
Работа в новом направлении уже вскоре дала прекрасные результаты. Данные, полученные при измерении электропроводности водных растворов электролитов различной концентрации, позволили С.Аррениусу сделать смелый вывод: молекулы электролита диссоциируют на ионы без воздействия тока, причем степень диссоциации растет с разбавлением. Как сейчас нам представляется, это был, казалось бы, очевидный и простой вывод из экспериментальных данных. Но совершенно не простым он был для С. Аррениуса, ибо этот вывод разрушал твердые, «как гранит», традиционные представления о состоянии молекул солей, кислот и оснований в растворе» [1].
С. Аррениус побоялся даже высказать свою мысль в категорической форме, усложнив основные положения своей теории не очень понятными терминами. Дело в том, что он не представлял, откуда берется энергия, необходимая для разрыва молекул (или кристаллов) электролитов на ионы. А энергия эта немалая. Если, например, взять один моль поваренной соли и «разбросать» его на ионы, то потребуется 800 кДж энергии. Такая большая энергия нужна за тем, чтобы преодолеть кулоновское притяжение между разноименно заряженными ионами в кристаллах или молекулах электролита.
И все же опыты С.Аррениуса, да и других ученых, упорно приводили к выводу, что в растворах электролитов действительно существуют ионы, независимо от того, действует на них электрическое поле или нет. И это придавало С.Аррениусу уверенность в своей правоте. Встретили теорию Аррениуса по-разному: одни ученые с воодушевлением, другие – в штыки. Это и понятно. Она имела много плюсов, но не меньше и минусов [3].
1.2 НОВЫЕ ПРЕДСТАВЛЕНИЯ О СОЛЯХ, КИСЛОТАХ И ОСНОВАНИЯХ
С.Аррениус создал фактически новые представления о кислотах, основаниях и солях. Кислотой он считал соединение, диссоциирующее в водном растворе с отщиплением ионов водорода. Например:
HCl « H+ + Cl-
h3SO4 « 2H+ + SO42-
Отсюда стало ясно, почему кислоты имеют ряд общих свойств. Кислый вкус, одинаковая окраска индикатора, выделение водорода при действии активных металлов – за все эти свойства отвечали ионы водорода, образующиеся при диссоциации кислот.
Основанием он считал соединение, диссоциирующее в водном растворе с образованием гидроксид-ионов:
KOH « K+ + OH-
Ca(OH)2 « Ca2+ + 2OH-
Тогда стали понятны общие свойства оснований. Горький вкус, ощущение мылкости, одинаковая реакция на индикаторы – это все «дело рук» ионов OH-.
Разную электрическую проводимость кислот и оснований С.Аррениус объяснил их различной способностью к диссоциации. Хорошо диссоциирующие кислоты или основания, дающие в растворах много ионов, он назвал сильными, а плохо диссоциирующие, образующие мало ионов, - слабыми. Для характеристики «силы» электролитов С. Аррениус ввел новое понятие – степень электролитической диссоциации. Теперь стало понятно, почему раствор уксусной кислоты проводит электрический ток хуже, чем такой же по концентрации раствор серной кислоты [3].
1.3 ДАЛЬНЕЙШЕЕ РАЗВИТИЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Большое значение для дальнейшего развития теории диссоциации имела известная работа Вант-Гоффа «Химическое равновесие в системах газов и разбавленных растворов» (1885), в которой было установлено, что реальное понижение температуры плавления, давления пара и осмотического давления солей, кислот и оснований меньше, чем рассчитанное теоретически по закону Рауля. Эти несоответствия подтверждали положения теории диссоциации, согласно которым электролит в водном растворе распадается на свободно перемещающиеся ионы [2].
ВАНТ-ГОФФ (van't Hoff), Якоб Генрик. Нидерландский химик Якоб Генрик Вант-Гофф родился в Роттердаме, в семье врача Якоба Генрика Вант-Гоффа. По настоянию родителей Вант-Гофф начал изучать инженерное дело в Политехнической школе в Дельфте. В ней Вант-Гофф за два года прошел трехлетнюю программу обучения и лучше всех сдал выпускной экзамен.
В 1871 г. Вант-Гофф стал студентом естественно-математического факультета Лейденского университета. На следующий год он перешел в Боннский университет, чтобы изучать химию под руководством Фридриха Августа Кекуле. Два года спустя Вант-Гофф продолжил свои занятия в Парижском университете, где и завершил работу над диссертацией. Вернувшись в Нидерланды, он представил ее к защите в Утрехтском университете.
freepapers.ru
Теория электролитической диссоциации — одна из основных в химии :: SYL.ru
Вещества-электролиты при растворении в воде распадаются на заряженные частицы — ионы. Обратное явление — моляризация, или ассоциация. Образование ионов объясняет теория электролитической диссоциации (Аррениус, 1887). На механизм распада химических соединений при расплавлении и растворении влияют особенности типов химических связей, строение и характер растворителя.
Электролиты и непроводники
В растворах и расплавах происходит разрушение кристаллических решеток и молекул — электролитическая диссоциация (ЭД). Распад веществ сопровождается образованием ионов, появлением такого свойства, как электропроводность. Не каждое соединение способно диссоциировать, а только вещества, которые изначально состоят из ионов либо сильно полярных частиц. Присутствием свободных ионов объясняется свойство электролитов проводить ток. Обладают такой способностью основания, соли, многие неорганические и некоторые органические кислоты. Непроводники состоят из малополярных или неполяризованных молекул. Они не распадаются на ионы, являясь неэлектролитами (многие органические соединения). Переносчики зарядов — положительные и отрицательные ионы (катионы и анионы).
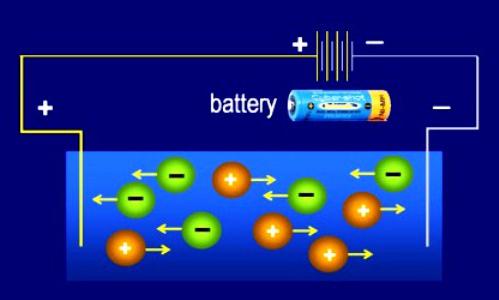
Роль С. Аррениуса и других химиков в изучении диссоциации
Теория электролитической диссоциации обоснована в 1887 году ученым из Швеции С. Аррениусом. Но первые обширные исследования свойств растворов были проведены еще русским ученым М. Ломоносовым. Внесли вклад в изучение заряженных частиц, возникающих при растворении веществ, Т. Гротгус и М. Фарадей, Р. Ленц. Аррениус доказал, что электролитами являются многие неорганические и некоторые органические соединения. Шведский ученый объяснил электропроводность растворов распадом вещества на ионы. Теория электролитической диссоциации Аррениуса не придавала значения непосредственному участию молекул воды в этом процессе. Русские ученые Менделеев, Каблуков, Коновалов и другие считали, что происходит сольватация — взаимодействие растворителя и растворенного вещества. Когда идет речь о водных системах, то применяется название «гидратация». Это сложный физико-химический процесс, о чем свидетельствует образование гидратов, тепловые явления, изменение цвета вещества и появление осадка.

Основные положения теории электролитической диссоциации (ТЭД)
Многие ученые работали над уточнением теории С. Аррениуса. Потребовалось ее усовершенствование с учетом современных данных о строении атома, химической связи. Сформулированы основные положения ТЭД, отличающиеся от классических тезисов конца XIX века:
- Процесс расплавления либо растворения сопровождается диссоциацией электролита на ионы. Так (по предложению Фарадея) называют частицы, обладающие зарядом («+» или «–») Они отличаются от нейтральных атомов строением валентных оболочек и устойчивостью, бывают окрашенными и бесцветными. Ионы могут быть простыми: Na+, Cl-, S2-, Al3+. Есть заряженные частицы, состоящие из групп атомов: CO2-, Nh5+. С греческого языка название «ион» переводится как «странствующий», что указывает на хаотичность распространения этих частиц.
- Воздействие внешнего электрического поля приводит ионы в упорядоченное движение внутри пространства электролита. Каждая отрицательная частица направляется к аноду (положительному электроду). Ионы со знаком "+" начинают движение в сторону катода (отрицательного электрода).
- Одновременно в растворах происходит распад на ионы и соединение этих частиц, поэтому диссоциация относится к обратимым физико-химическим процессам.
Происходящие явления необходимо учитывать при составлении уравнений: применить специальный знак обратимого процесса, подсчитать отрицательные и положительные заряды: они в сумме должны совпадать.
Механизм ЭД ионных веществ
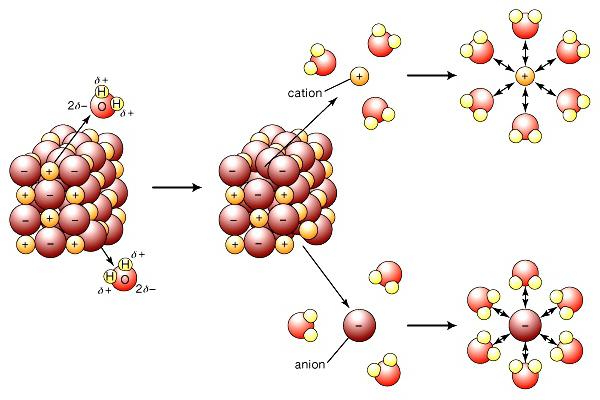
Современная теория электролитической диссоциации учитывает строение веществ-электролитов и растворителей. При растворении связи между разноименно заряженными частицами в ионных кристаллах разрушаются под воздействием полярных молекул воды. Они буквально «вытягивают» ионы из общей массы в раствор. Распад сопровождается образованием вокруг ионов сольватной (в воде — гидратной) оболочки. Кроме воды, повышенной диэлектрической проницаемостью обладают кетоны, низшие спирты. При диссоциации хлорида натрия на ионы Na+ и Cl- регистрируется начальная стадия, которая сопровождается ориентацией диполей воды относительно поверхностных ионов в кристалле. На заключительном этапе гидратированные ионы освобождаются и диффундируют в жидкость.
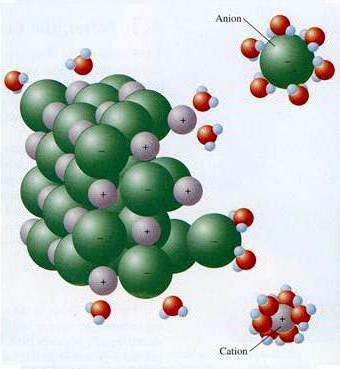
Механизм ЭД соединений с ковалентной сильнополярной связью
Молекулы растворителя влияют на элементы кристаллического строения неионных веществ. Например, воздействие диполей воды на хлороводородную кислоту приводит к изменению типа связи в молекуле с ковалентной полярной на ионную. Вещество диссоциирует, в раствор поступают гидратированные ионы водорода и хлора. Этот пример доказывает важность тех процессов, которые возникают между частицами растворителя и растворенного соединения. Именно это взаимодействие приводит к образованию ионов электролита.
Теория электролитической диссоциации и основные классы неорганических соединений
В свете основных положений ТЭД кислотой можно назвать электролит, при распаде которого из положительных ионов можно обнаружить только протон Н+. Диссоциация основания сопровождается образованием или освобождением из кристаллической решетки только аниона ОН- и катиона металла. Нормальная соль при растворении дает положительный ион металла и отрицательный — остатка кислоты. Основная соль отличается наличием двух видов анионов: ОН-группы и кислотного остатка. В кислой соли из катионов присутствуют только водород и металл.
Сила электролитов
Для характеристики состояния вещества в растворе используется физическая величина — степень диссоциации (α). Находят ее значение из отношения количества распавшихся молекул к общему их числу в растворе. Глубину диссоциации определяют разные условия. Важны диэлектрические показатели растворителя, структура растворенного соединения. Обычно степень диссоциации понижается с ростом концентрации и увеличивается при повышении температуры. Зачастую степень диссоциации конкретного вещества выражают в долях от единицы.
Классификация электролитов
Теория электролитической диссоциации в конце XIX века не содержала положения о взаимодействии ионов в растворе. Несущественным казалось Аррениусу влияние молекул воды на распределение катионов и анионов. Представления Аррениуса о сильных и слабых электролитах были формальными. Исходя из классических положений, можно получить значение α = 0,75–0,95 для сильных электролитов. В экспериментах доказана необратимость их диссоциации (α →1). Практически полностью распадаются на ионы растворимые соли, серная и соляная кислоты, щелочи. Частично диссоциируют сернистая, азотистая, плавиковая, ортофосфорная кислоты. Слабыми электролитами считаются кремниевая, уксусная, сероводородная и угольная кислоты, гидроксид аммония, нерастворимые основания. Воду также относят к слабым электролитам. Диссоциирует небольшая часть молекул Н2О, одновременно происходит моляризация ионов.
www.syl.ru
Теория электролитической диссоциации и развитие электрохимии
Большую роль в развитии электрохимии сыграли открытие М. Фарадеем количественных законов электрохимии, создание Св. Аррениусом теории электролитической диссоциации, В. Нернстом — теории гальванических элементов. Значительный вклад в развитие электрохимии принадлежит русскому ученому Б. С. Якоби, который создал электрохимический метод изготовления точных металлических копий рельефных пред- [c.312] Развитие отечественной электрохимии началось с выдающихся исследований В. В. Петрова по электролитическому разложению воды и других жидкостей (1801 г.). Он же впервые получил металлы электролизом их окислов. Вскоре (1805 г.) Ф. Ф. Гротгус разработал теорию электропроводности растворов (переход протонов от ионов к молекулам воды). Наряду с этим он заметил, что ... расщепление молекул. .. происходит до всякого действия электрического тока (1818 г.). В этом предположении содержится предвидение основных идей теории электролитической диссоциации. [c.7]ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ И РАЗВИТИЕ ЭЛЕКТРОХИМИИ [c.420]
Теория электролитической диссоциации и развитие электрохимии 423 [c.423]
Основные научные работы посвящены учению о растворах, химической термодинамике, электрохимии, развитию методов защиты металлов от коррозии. Одним из первых выдвинул (1888) идеи объединения химической теории растворов Менделеева и физической теории электролитической диссоциации Аррениуса Независимо от И. А. Каблукова ввел (1889— 1891) в науку представление о сольватации ионов. Открыл (1904) правило, выражающее зависимость высоты капиллярного поднятия жидкости при температуре кипения от молекулярной массы (правило Кистяковского), и вывел формулу, связывающую упругость пара в капиллярах с поверхностным натяжением и молекулярной массой жидкости. Установил соотношения а) между молекулярной теплотой испарения и объемом пара при температуре кипения (1916) б) между коэффициентом сжимаемости жидкостей и внутренним давлением (1918) в) между теплотой испарения неассоциированной жидкости и температурой ее кипения (1922) г) между теплотой плавления и числом атомов в молекуле [c.236]
В 1805 г. в России была разработана Ч>. Гротгусом первая теория механизма электролиза, оказавщая большое влияние на последующее развитие теоретической электрохимии. Гротгус же в 1819 г. первый высказал идеи электролитической диссоциации, впоследствии лишь более подробно развитые Аррениусом. [c.9]
Смысл коэффициента i был вскоре раскрыт Аррениусом в его теории электролитической диссоциации. Эта теория была как бы завершением определенного этапа в совместном развитии двух направлений физической химии учения о растворах и электрохимии. Ее основная идея сводится к гипотезе о распаде в растворе молекулы электролита на ионы. [c.141]
Возникновение электрохимии как науки относится к рубежу XVni и XIX вв. и связано с работами Л. Гальвани, А. Вольта, В. В. Петрова, Г. Дэви. В 1833 г. М. Фарадеем были открыты законы электролиза — основные законы электрохимии. Теория электролитической диссоциации С. Аррениуса (1887) оказалась весьма плодотворной для развития учения о механизме электродных. процессов и прохождения тока через электролиты. В 1890 г. Нернстом предложена первая теория возникновения электродного потенциала, которая позднее была усовершенствована Л. В. Писаржевским,, Н. А. Изгарышевым, Герни. В XX столетии развивались теория растворов электролитов (работы П. Дебая, Э. Хюккеля, Л. Онза- [c.454]
В основе электрохимии водных растворов и расплавов лежит теория электролитической диссоциации, базирующаяся на классических работах С. Аррениуса, развитых для разбавленных растворов. В связи с тем, [c.119]
Значительное место в развитии физической химии принадлежит также крупным зарубежным ученым Я. Вант-Гофф, В. Оствальд разработали ряд положений теории растворов С. Аррениус создал теорию электролитической диссоциации В. Нернст установил ряд закономерностей в области электрохимии и др. [c.6]
В развитии отдельных направлений физической химии большую роль сыграли исследования и зарубежных ученых. В первую очередь следует назвать работы В. Гиббса, составляющие основу учения о равновесиях в гетерогенных системах, В. Нернста, установившего весьма важные закономерности в области химической термодинамики и электрохимии, Вант-Гоффа, разработавшего количественную теорию разбавленных растворов и плодотворно изучавшего химические равновесия и кинетику химических реакций, С, Аррениуса — автора теории электролитической диссоциации. [c.10]
Быстрому развитию электрохимии в конце XIX и в XX вв. способствовала созданная в 1887 г. теория электролитической диссоциации С. Аррениуса. Теорию Аррениуса в дальнейшем развили Дебай и Гюк-кель, а также другие исследователи электролитов. В последние десятилетия в СССР и за рубежом достигнут большой прогресс в развитии электрохимии, в частности электрохимической кинетики, перенапряжения при выделении водорода и металлов, коррозии металлов и т. д. Особенно значительный вклад в электрохимию в СССР внесли школы А. Н. Фрумкина, В. А. Кистяковского, Н. А. Изгарышева, [c.133]
Осп. работы посвящены учению о растворах, хим. термодинамике, электрохимии, развитию методов защиты металлов от коррозии. Одним из первых выдвинул (1888) идеи объединения хим. теории р-ров Менделеева и физ. теории электролитической диссоциации Аррениуса. Независимо от И. А. Каблукова ввел (1889—1891) в науку представление о сольватации ионов. [c.205]
Возникновение электрохимии как науки связано с именами Гальвани, Вольта и Петрова, которые на рубеже XVHI и XIX веков открыли и исследовали электрохимические (гальванические) элементы. Деви и Фарадей в первые десятилетия XIX века изучали электролиз. Быстрое развитие электрохимии в конце XIX века связано с появлением теории электролитической диссоциации Аррениуса (1887) и с работами Нернста по термодинамике электродных процессов. Теория Аррениуса развита Дебаем и Гюккелем (1923), которые разработали электростатическую теорию. [c.384]
В 1881 г., за два года до Аррениуса, Н. Н. Каяндер в Журнале Русского физико-химического общества высказал идеи, предвосхитившие некоторые положения теории электролитической диссоциации. В 1853 г. один из основателей русской теоретической электрохимии А. С. Савельев пришел к выводу, что проводимость жидкостей (растворов) происходит вследствие их разложения (диссоциации), с которой она неразрывно связана [И. И. Искольдскии, Забытые русские электрохимики-физики XIX века. Природа, № 1, 1950]. Для дальнейшего развития теории Аррениуса большое значение имели работы И. А. Каблукова, Л. В. Писаржевского, В. А. Кистяков-ского и других русских ученых. (Прим. ред.) [c.34]
Аррениус в 1887 г. ггредложил другой метод определения а с помощью измерений электропроводности (см. стр. 75) и показал, что результаты, полученные обоими методами, прекрасно совпадают. Это совпадение было воспринято как убедительное доказательство правильности теории электролитической диссоциации, которая сыграла столь важную роль в развитии электрохимии. [c.36]
Из его многочисленных исследований и работ, носвягценных развитию и пропаганде теории электролитической диссоциации, следует назвать курсы Электрохимия в трех выпусках (1912— 1916), Прикладная физическая химия (1926) и ряд статей . Еще в 1901 г. В. А. Кистяковский выступил на XI съезде русских естествоиспытателей и врачей с докладом Разбор возражений на теорию электролитической диссоциации . [c.429]
chem21.info
Истоки теории электролитической диссоциации. Возникновение теории растворов
СЛЕДСТВИЯ ИЗ ПРОТОННОЙ ТЕОРИИ
Теория Бренстеда резко расширила круг кислот и оснований. Но гораздо важнее то, что она заставила пересмотреть представление о роли растворителя в процессе растворения. Разберем это подробнее.
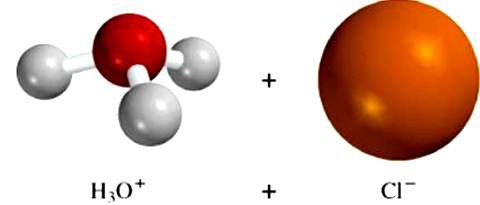
Молекула хлороводорода HCl довольно прочная, при обычных условиях на ионы не распадается. Поэтому газообразный и жидкий хлороводород при обычных условиях электрического тока практически не проводит. Но при попадании хлороводорода в воду из его молекул почти мгновенно вырываются протоны H+. Причем свободными они не остаются. В растворе обнаруживаются ионы H+×h3O. А это, согласно протонной теории, означает, что вода – сильное основание.
Таким образом, вода, которую Аррениус считал инертной средой, на самом деле вовсе не инертна. И если вещество, попав в воду диссоциирует с отщиплением H+, то это результат воздействия на него воды. Само по себе ни одно вещество не распадается на ионы в заметной степени, так как на разрыв связей требуется большая энергия.
Конечно в разных молекулах протоны удерживаются по разному. От одних молекул (HCl, HclO4, HNO3, h3SO4 и т.д.) оторвать протоны нетрудно, и потому они практически нацело диссоциированы в разбавленных водных растворах. Их считают сильными электролитами. От других молекул (h3S, HCN, HclO) отрыв протона затруднен, и молекулам воды удается разорвать лишь небольшую часть этих молекул. Такие вещества относят к слабым электролитам.
Естественно возникает вопрос: откуда берется энергия, необходимая для отрыва протонов? Оказывается, все просто. Ведь молекула воды – диполь. Из-за сдвига электронной плотности на атоме кислорода возникает значительный отрицательный заряд, а на атомах водорода возникают положительные заряды. Такие заряды на атомах называются эффективными зарядами. Протон также имеет положительный заряд, причем в отличие от других ионов он резко отличается по своим размерам. Если у других ионов диаметры составляют ~ 10-8 см, то у H+, полностью лишенного электронной оболочки, диаметр равен ~ 10-13 см. Из-за такого необычно малого размера протон имеет весьма высокую напряженность положительного электрического поля, и потому он буквально вонзается в отрицательные концы молекул воды, образуя с ними очень прочные соединения. При этом выделяется немалая энергия. Именно она и покрывает расход энергии, идущей на отрыв протона.
Однако вода способна выступать основанием не всегда, т.е. не всегда она вырывает протоны. Например, при растворении аммиака в воде, донорами протонов являются именно молекулы воды. Здесь вода проявляет кислотные свойства. Такая же картина наблюдается и при растворении аминов [3].
ЭЛЕКТРОННАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ
Эту теорию сформулировал в 1923 году американский химик Г.Н.Льюис. Кислотно-основное взаимодействие он тоже связывал с переходом элементарных частиц, но не протонов, как это было у И.Н.Бренстеда, а электронов.
Льюис,Гилберт Ньютон — выдающийся американский физикохимик. Основные научные работы в области химической термодинамики, фотохимии, химии изотопов, ядерной физики.
В первые годы жизни родители Льюиса занимались его домашним обучением, он научился читать уже в три года. В девять лет мальчик пошёл в школу в Линькольне, штат Небраска, в четырнадцать лет поступил в университет штата Небраска, через три года перевёлся в Гарвардский университет, который закончил в 1896, получив степень бакалавра. Далее он писал диссертацию под руководством Теодора Ричардса, которую и защитил в 1899. В это время (1898) он опубликовал свою первую научную статью, посвящённую термохимическим и электрохимическим свойствам амальгам. В 1890 начал преподавать в Гарвардском университете, затем стажировался в Европе у Вильгельма Оствальда и Вальтера Нернста.
В 1907 Льюис становится доцентом, в 1908— адъюнкт-профессором, в 1911 — профессором. В 1908 он публикует несколько статей по теории относительности, в которых он другим способом, отличным от способа Альберта Эйнштейна, выводит взаимосвязь массы и энергии. В 1912 он переезжает в Беркли, получив должность руководителя химического факультета и декана в Калифорнийском университете (на этой должности он и оставался до конца своей жизни).
Научные достижения Льюиса очень велики, его называют одним из самых выдающихся американских физхимиков (и химиков), он интересовался очень широким спектром научных проблем.
В 1919, изучая магнитные свойства растворов кислорода в жидком азоте.
В 1923 он сформулировал одну из основных современных теорий кислот и оснований — электронную (её второе название — теория Льюиса).
В 1926 Льюис предложил термин фотон для обозначения мельчайшей единицы излучения.
В 1933 он выделил в чистом виде тяжёлую воду (оксид дейтерия) (совместно с Г.К.Юри, (Harold C. Urey), своим учеником.
Льюис предложил новую формулировку третьего начала термодинамики.
В последние годы жизни он интересовался фотохимией, в частности, люминесценцией органических молекул.
В 1913 Льюис стал членом Национальной академии наук в Вашингтоне (однако в 1934 прекратил членство в этой организации из-за несогласия с внутренней политикой этой организации). В 1930 был награждён медалью Общества искусств и наук как «выдающийся американский химик». С 1942 почётный член Академии наук СССР. Более тридцати раз номинировался на Нобелевскую премию [5].
Г.Н. Льюис – один из создателей теории ковалентной связи. Именно он объяснил химическую связь между атомами образованием общих электронных пар. Он же указал два возможных способа образования этих пар: классический, или обменный, и донорно-акцепторный. По этому способу один из соединяющихся атомов отдается на образование связи свою электронную пару, а другой атом предоставляет свою свободную электронную ячейку. Первый атом называют донором электронов, а другой атом акцептором электронов.
Пытаясь найти самый общий признак, объединяющий все кислотно-основные реакции, Г.П.Льюис заметил, что при этих реакциях всегда происходит донорно-акцепторное взаимодействие. Причем реагент, отдающий электронную пару (донор электронов), проявляет как правило, основные свойства, а реагент, присоединяющий электронную пару (акцептор электронов), проявляет обычно кислотные свойства.
В соответствие с этим Льюис сформулировал новое представление о кислотах и основаниях. Основаниями он считал те реагенты, которые выступают донорами электронных пар, а кислотами те реагенты, которые являются акцепторами этих пар [3].
3.4 ДАЛЬНЕЙШЕЕ РАЗВИТИЕ ТЕОРИИ РАСТВОРОВ
Последующее развитие теории растворов проходило весьма своеобразно. Химики разделились на две группы. Одни считали, что протон – особая частица с исключительными свойствами, и потому поддерживали «культ» протона, развивая представления Бренстеда. Другие, как и Льюис, протестовали против такого «культа» и пытались найти новые принципы классификации кислот и оснований. Аргументы у тех и у других были вескими.
Одним из самых последовательных защитников протонной теории был наш советский химик А.И. Шатенштейн. Он решительно настаивал на выделении Н-кислот в особый класс и кислотно-основные свойства веществ связывал только с переходом протонов. Протон, как уже отмечалось выше, обладает очень малыми размерами, и за счет этого способен с легкостью вступать во взаимодействие с другими частицами. Еще одной важной особенностью протона является то, что его перенос в химических реакциях обычно протекает без существенных перестроек электронных оболочек взаимодействующих атомов. Такая простота переноса протона приводит к легкости и удивительной быстроте протекания кислотно-основных реакций.
Доводы Шатенштейна были подкреплены интересными исследованиями различных углеводородов. Оказалось, что углеводороды при действии раплавленных щелочных и щелочноземельных металлов выделяют водород, а при растворении в сильноосновных средах отщепляют протоны, т.е. ведут себя как кислоты. Таким образом, в число кислот и оснований были включены сотни тысяч новых соединений – углеводородов. Этот обширный класс стали называть СН-кислотами, поскольку их кислотные свойства были обусловлены разрывом связей С-Н.
Шатенштейн также подчеркивал, что существуют вещества, не содержащие протонов, но имеющие свойства, сходные с протонными кислотами. Такие вещества он выделил в особый класс и назвал кислотоподобными, подчеркнув тем самым их сходство с Н-кислотами [3].
Возвращаясь к вопросу о влиянии природы растворителя на электропроводность, следует отметить исследования Д.П.Коновалова. Он систематически стал изучать двойные системы, образованные ароматическими аминами и жирными кислотами. В результате Коновалов открыл новый класс электролитов – сольвоэлектролиты, которые почти или совсем не проводят электрический ток; в смеси же, имеющей состав, близкий к молекулярному соотношению, наблюдается максимум проводимости, который возникает в результате кислотно-основного взаимодействия компонентов системы.
Также в конце XIX века ученые стали заниматься вопросом влияния неводных растворителей на скорость химического превращения. Одним из первых этим вопросом стал заниматься Н.А.Меншуткин [1].
ЗАКЛЮЧЕНИЕ
Едва ли не в XVIII в. Естествоиспытатели установили, что все растворы можно разделить на две большие группы – на те, которые не проводят электрический, ток, и на растворы-проводники, или проводящие растворы. Но почему проводящие растворы проводят электрический ток – ученые не знали.
Собственно, в теориях, объясняющих тот странный факт, что растворы одних веществ обладают способностью проводить электрический ток, а растворы других веществ этой способностью не обладают, недостатка не было. Но это был тот самый случай, когда избыток теорий свидетельствовал только о том, что все эти теории плохи. Потому что если имеется одна правильная теория, то надобность в остальных отпадает. А такой теории не было. Во всяком случае до 80-х годов XIX века, когда изучением проводящих растворов занялся Сванте Аррениус.
Сегодня кажется, что теорию, в основе которой лежит столь очевидная предпосылка, ничего не стоило создать. А тогда, в 1884 году, Аррениус, по правде говоря, поостерегся высказывать столь категорически основную идею своей теории – у него были все основания предполагать, что эта идея будет коллегами раскритикована начисто. Поэтому Аррениус в первой публикации, посвященной теории электролитической диссоциации, предпочел затемнить наиболее острые положения не очень вразумительной терминологией. Аррениус знал, по какому пункту будут его критиковать оппоненты, знал и боялся этой критики, потому что ответа на эти возражения он не имел. И что хуже всего – Аррениус не имел даже приблизительных представлений о том, почему электролиты при растворении распадаются на ионы, что заставляет оторваться друг от друга положительно заряженный катион и отрицательно заряженный анион. Но, с другой стороны, все эксперименты, которые он провел, да и эксперименты нескольких предшествующих поколений экспериментаторов, очень обширный круг физических и химических свойств растворов электролитов – все это закономерно приводило к выводу, что в растворах электролитов действительно существуют ионы.
Однако последующие успехи новой теории были столь впечатляющи, а признание ее (пусть и не всеобщее) таким воодушевленным, что на этом фоне забылись все сомнения. Теория электролитической диссоциации убедительно объяснила многие факты, которые были известны давно и тем не менее оставались непонятными. Так очень логично были объяснены закономерности изменения электропроводности растворов, которое происходит с изменением концентрации электролитов. Различие свойств растворов разных электролитов было разумно пояснено тем, что электролиты подразделяются на сильные – те, которые в растворе полностью распадаются на ионы, и слабые – те, которые распадаются на ионы лишь частично. Это в свою очередь пояснило и криоскопическое поведение растворов электролитов.
Таким образом, теория электролитической диссоциации многое объяснила, многое предсказала, убедительно и естественно соединила многие разрозненные факты.
А химическая теория растворов получила огромное практическое применение, помогла в изучении многих природных явлений. Огромный вклад в развитие этой теории внес Д.И.Менделеев, который говорил об определяющей роли сольватации при растворении веществ.
В настоящее время выяснилось, что обе теории были в равной степени правы и сейчас процесс растворения рассматривается как физико-химический процесс, а растворы – как физико-химические системы [10].
СПИСОК ЛИТЕРАТУРЫ
- Соловьев Ю.И. История химии: Развитие химии с древнейших времен до конца XIX в. Пособие для учителей. - 2-е изд., перераб. - М.:Просвещение, 1983. - 368с.
- Фигуровский Н.А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. – М.:Просвещение, 1979. - 311с.
- Мартыненко Б.В. Кислоты – основания: кн. для учащихся сред. шк. – М.:Просвещение, 1988. – 160с.
- Волков В.А., Вонский Е.В., Кузнецова Г.И. Выдающиеся химики мира. – М.:ВШ, 1991. – 656с.
- Биографии великих химиков. перевод с нем. под. ред. Быкова Г.В. – М.:Мир, 1981. – 320с.
- Лауреаты Нобелевской премии: Энциклопедия. пер. с англ. – М.:Прогресс, 1992.
- Энциклопедия Кругосвет // универсальная научно-популярная онлайн-энциклопедия: [сайт]. – URL: http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/ELEKTROLITICHESKAYA_DISSOTSIATSIYA_ELEKTROLITI.html (дата обращения: 9.04.2012).
- Самин Д. Теория электролитической диссоциации: [сайт]. – URL: http://www.bibliotekar.ru/100otkr/28.htm (дата обращения: 9.04.2012).
- Менделеев Д.И.: Об электролитической диссоциации: [сайт]. – URL: http://www.famhist.ru/famhist/hal/003b05df.htm (дата обращения: 9.04.2012).
freepapers.ru
Истоки теории электролитической диссоциации. Возникновение теории растворов
Вант-Гофф распространил концепцию тетраэдрического атома углерода и на соединения, содержащие углерод-углеродные двойные связи (два тетраэдра с общим ребром) и тройные связи (два тетраэдра с общей гранью). Вант-Гофф не решился представить свою теорию в качестве докторской диссертации. Вместо этого он написал диссертацию о цианоуксусной и малоновой кислотах и в 1874 г. получил докторскую степень по химии.
Становление научной карьеры Вант-Гоффа шло медленно. Вначале ему приходилось давать частные уроки химии и физики, и только в 1876 г. он получил должность лектора физики в Королевской ветеринарной школе в Утрехте. В следующем году он становится лектором (а позднее профессором) теоретической и физической химии Амстердамского университета. Здесь в течение последующих 18 лет он каждую неделю читал по пять лекций по органической химии и по одной лекции по минералогии, кристаллографии, геологии и палеонтологии, а также руководил химической лабораторией.
В 1901 г. Вант-Гофф стал первым лауреатом Нобелевской премии по химии, которая была ему присуждена «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах». Представляя Вант-Гоффа от имени Шведской королевской академии наук, С.Т. Однер назвал ученого основателем стереохимии и одним из создателей учения о химической динамике, а также подчеркнул, что исследования Вант-Гоффа «внесли значительный вклад в замечательные достижения физической химии».
Помимо Нобелевской премии, Вант-Гофф был награжден медалью Дэви Лондонского королевского общества (1893) и медалью Гельмгольца Прусской академии наук (1911). Он был членом Нидерландской королевской и Прусской академий наук, Британского и Американского химических обществ, американской Национальной академии наук и Французской академии наук. Вант-Гоффу были присвоены почетные степени Чикагского, Гарвардского и Йельского университетов [6].
Весной 1887 года Аррениус работал в Вюрцбурге у Ф. Кольрауша. «Незадолго до того как я покинул Вюрцбург (март 1887 года), - вспоминал Аррениус, - я получил напечатанную Шведской Академией наук работу Вант-Гоффа. Я просмотрел ее в один вечер, закончив ежедневную работу в институте. Мне сразу стало ясно, что отклонение электролитов в водном растворе от законов Вант-Гоффа - Рауля о понижении точки замерзания является самым веским доказательством их распада на ионы. Теперь передо мной было два пути для вычисления степени диссоциации: с одной стороны, посредством понижения точки замерзания, с другой — из проводимости. Оба они в подавляющем большинстве случаев дали один и тот же результат, и я мог открыто говорить о диссоциации электролитов».
В письме к Вант-Гоффу в марте 1887 года шведский ученый писал: «Обе теории находятся еще в самом начале своего развития, и я надеюсь живейшим образом, что в ближайшем будущем между обеими областями будет перекинут не один, а несколько мостов». Так и случилось. В 1887 году в первом томе организованного В.Оствальдом «Журнала физической химии» появилась знаменитая статья Аррениуса «О диссоциации растворенных в воде веществ». Здесь автор уже смело и открыто заявил, что молекулы электролитов (соли, кислоты, основания) распадаются в растворе на электрически заряженные ионы.
После 1887 года исследования С.Аррениуса, В.Оствальда, Н.Нернста, М.Леблана и других ученых не только подтвердили справедливость основных положений теории электролитической диссоциации, но и значительно расширили число отдельных фактов, которые можно обосновать теорией.
В 1888 году Вальтер Фридрих Нернст (1864—1941), профессор физической химии в Геттингене и Берлине, лауреат Нобелевской премии по химии 1920 года за открытие третьего закона термодинамики, сравнив скорость диффузии ионов со скоростью движения ионов при электролизе, показал, что эти числа совпадают. В 1889 году на основе теории осмотического давления и теории электролитической диссоциации Нернст разработал осмотическую теорию возникновения гальванического тока [1].
В 1884-1886 году В. Оствальду удалось найти много данных, подтверждающих параллелизм между химической активностью веществ и их электропроводностью. В 1888 году он предложил способ определения основности кислот по величине электропроводности их растворов и показал, что скорость химической реакции в растворах зависит только от диссоциированной части растворенного вещества.
ОСТВАЛЬД (Ostwald), Фридрих Вильгельм. Немецкий химик Фридрих Вильгельм Оствальд родился в Риге (Латвия). Он был вторым сыном Готфрида Оствальда, искусного бондаря, и Элизабет (Лойкель) Оствальд. Занимаясь в рижской реальной гимназии, Оствальд проявил себя хорошим учеником с необычайно широким диапазоном интересов. Он увлекался физикой, химией, литературой и рисованием, а также играл на альте и фортепьяно. Несмотря на то, что отец посоветовал ему изучать инженерное дело, Оствальд увлекся химией и в 1872 г. стал студентом химического факультета Дерптского (ныне Тартуского) университета. Четыре года спустя он получил степень бакалавра и остался в Дерпте в аспирантуре, занимая одновременно должность приват-доцента (внештатного преподавателя).
В 1878 г. ему была присвоена докторская степень за диссертацию об оптическом коэффициенте преломления кислотно-основных реакций. Работая в качестве ассистента у физика Артура фон Эттингена и ведя преподавание физики и химии в местной школе, Оствальд продолжал заниматься изучением приложения физических характеристик к анализу химических реакций. В 1881 г. он был избран профессором химии Рижского политехнического института. В последующие годы написал несколько учебников, которые сыграли важную роль в утверждении физической химии в качестве самостоятельной дисциплины.
В 1884 г. Оствальд получил текст вызвавшей горячие споры докторской диссертации Сванте Аррениуса, которая была представлена к защите в Упсальском университете. В своей диссертации Аррениус предложил теорию, объясняющую диссоциацию кислот и оснований в водных растворах на электрически заряженные ионы. Поскольку в те времена преобладали убеждения, что в растворе не могут сосуществовать противоположно заряженные частицы, работа Аррениуса получила низкий рейтинг в Упсальском университете. Оствальд, однако, счел его идеи достойными внимания и немедленно применил их для проверки результатов своих собственных исследований сродства кислот. «Воспользовавшись магазином сопротивлений, позаимствованным на несколько дней на телеграфе (дольше там без него не могли обойтись)… я вскоре провел опыты со всеми имевшимися под рукой кислотами, которые мне предоставили другие исследователи, – вспоминал позднее Оствальд – со все возрастающим волнением я обнаруживал, что результаты один за другим подтверждали предсказания и ожидания».
В 1909 г. Оствальду была присуждена Нобелевская премия по химии «в знак признания проделанной им работы по катализу, а также за исследования основных принципов управления химическим равновесием и скоростями реакции». Представляя его от имени Шведской королевской академии наук, Ханс Хильдебранд указал на ценность открытий Оствальда не только для развития теории, но и для их практического применения, такого, как производство серной кислоты и синтез красителей на основе индиго. Хильдебранд также предсказал, что химия катализа во многом поможет понять функцию фермента. В последние годы жизни Оствальд включился в различные просветительские, культурные и реформистские движения, в т. ч. Интернационалистическое, пацифистское и движение за сохранение природных ресурсов. Он активно участвовал в работе многочисленных международных научных обществ, включая Международную комиссию по атомным весам и Международную ассоциацию химических обществ. Оствальд занимался также вопросами государственного образования и подготовки ученых [6].
Также в 1888 году В.Оствальд нашел закономерность, связывающую степень диссоциации электролита с его концентрацией. В 1884—1886 он годах установил, что электропроводность кислот увеличивается с разбавлением — асимптотически приближается к некоторой предельной величине. Им было найдено, что для растворов слабых кислот (янтарной и др.) и оснований увеличение молекулярной электропроводности с разбавлением гораздо заметнее, чем для кислот сильных, например серной и др. В одной из работ, написанной в 1888 году, В. Оствальд дал математическую формулировку закона разбавления. Он сравнивал электропроводность электролита с предельной для бесконечно большого разбавления [2].
Новый закон стал основным для химии водных растворов. «Закон разбавления В. Оствальда, — пишет Ю.И. Соловьев, — подтверждал теорию электролитической диссоциации и позволял определять зависимость степени диссоциации молекул электролита от концентрации раствора. В дальнейшем этот закон подвергался неоднократно проверке. Было найдено, что для сильных электролитов и концентрированных растворов он неприменим. Потребовались многочисленные исследования ученых конца XIX и начала XX века, чтобы объяснить причину неподчинения сильных электролитов закону разбавления. Плодотворность теории электролитической диссоциации особенно ярко проявилась в том, что она с успехом была использована для объяснения механизма многих химических реакций и природы различных соединений, например комплексных».
Теория электролитической диссоциации смогла объединить и теорию растворов, и электрохимическую теорию. Как и предполагал Аррениус, оба потока слились в единый. «После основания механической теории теплоты, — писал Оствальд в 1889 году, — в физических науках не было ни одного столь многообъемлющего ряда идей, как теория растворов Вант-Гоффа и Аррениуса».
Теория электролитической диссоциации впоследствии была усовершенствована благодаря работам, прежде всего, Н. Бьеррума, П. Дебая и Э. Хюккеля. Они развили высказанные ранее И. Ван Лааром представления, что необычное поведение сильных электролитов можно объяснить действием кулоновских сил [8].
- БОРЬБА ЗА ПРИЗНАНИЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Борьба за признание теории электролитической диссоциации – это не просто исторический эпизод. Она вскрывает глубокие противоречия, накопившиеся в физике и химии в последние десятилетия 19 века, когда происходила ломка старых представлений. Борьба между сторонниками химической и физической теорий растворов не ограничивалась разногласиями научного характера. При этом выявились и серьезные расхождения в философских воззрениях.
В борьбу были вовлечены почти все крупные физико-химики того времени. Это привело к изучению ряда новых вопросов, выдвинутых в процессе обсуждения спорных моментов. Дискусия носила строго научный принципиальный, творческий характер. Ее девизом было – никаких голословных утверждений и пустых деклараций. Ученые выступали вооруженные экспериментальными фактами, новыми гипотезами. Этим и объясняется плодотворность такой борьбы, давшей толчок движению науки вперед [1].
В процессе длительной полемики как перед химической, так и перед физической теорией растворов были поставлены самые сложные, запутанные вопросы, требовавшие кардинального решения. Это заставляло участников полемики глубоко продумывать отдельные положения, ставить новые эксперименты
В чем же причина того, что теория электролитической диссоциации вызвала почти тотальную оппозицию химиков? Основная причина заключалась в том, что новая теория находилась в глубоком противоречии с господствующими тогда теоретическими концепциями и опытными данными. У большинства химиков сложилось «незыблемое» убеждение, что разложение электролита в растворе происходит только под влиянием электрического тока. Также широко был принят ничем не доказанный факт, что, например, в водном растворе хлорида натрия содержатся только его молекулы. Так думали потому, что при испарении раствора получается тот же самый хлорид натрия, который был взят до растворения.
В. Оствальд вспоминал, с каким удивлением П.Клеве, учитель Аррениуса, известный химик, спрашивал его, указывая на стакан с водным раствором хлорида калия: «Но ведь это бессмыслица – допустить вместе с Аррениусом, что в растворенном хлориде калия хлор и калий отделены друг от друга?»
Английский ученый Т.Фитцпатрик, например, в 1888 году не мог предположить существование в растворе «свободных» атомов, так как, если бы в растворе находились свободные атомы хлора, раствор должен был бы обладать некоторыми свойствами хлорного раствора. Теория Аррениуса на этот вопрос отвечала просто. В процессе электролитической диссоциации, например, поваренной соли, образуются не атомы натрия и хлора, а ионы, которые обладают в связи с электрическим зарядом особыми свойствами, резко отличными от свойств электрически нейтральных атомов [1].
Оставалось, однако, неясным, какие причины обуславливают появление свободных заряженных ионов, каковы условия их существование в растворах? Откуда берется энергия на разложение прочных соединений при растворении? Ответа на эти вопросы С.Аррениус дать не мог. Дело в том, что растворитель –воду- он рассматривал как инертную среду, не вступающую во взаимодействие с ионами. А ведь это совершенно неверно. И первым, кто догадался о химическом взаимодействии между растворяемым веществом и растворителем был Дмитрий Иванович Менделеев [3].
2.1 ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ И Д.И.МЕНДЕЛЕЕВ
Д. И. Менделеев пристально наблюдал за развитием этой новой теории, однако воздерживался от какой-либо категорической её оценки. Он обстоятельно рассматривает некоторые доводы, к которым обращаются сторонники теории электролитической диссоциации при доказательстве самого факта разложения солей на ионы, в том числе понижения температуры замерзания и других факторов, определяющихся свойствами растворов. Этим и другим вопросам, связанным с пониманием данной теории, посвящена его «Заметка о диссоциации растворённых веществ».
freepapers.ru
Истоки теории электролитической диссоциации. Возникновение теории растворов
В 1864 г. Менделеев был избран профессором химии Петербургского технологического института. В 1865 г. он защитил докторскую диссертацию «О соединении спирта с водой» (тема диссертации часто используется для обоснования легенды об изобретении им 40-градусной водки). В том же году Менделеев был утверждён профессором технической химии Петербургского университета, а через два года возглавил кафедру неорганической химии.
Учение о периодичности Менделеев развивал до конца жизни. Среди других научных работ Менделеева можно отметить цикл работ по изучению растворов и разработку гидратной теории растворов (1865–1887 гг.). В 1872г. он начал изучение упругости газов, результатом которого стало предложенное в 1874г. обобщённое уравнение состояния идеального газа (уравнение Клайперона – Менделеева). В 1880–1885 гг. Менделеев занимался проблемами переработки нефти, предложил принцип её дробной перегонки.
Менделеев был одним из основателей Русского химического общества (1868 г.) и неоднократно избирался его президентом. В 1876 г. Менделеев стал членом-корреспондентом Петербургской АН, но кандидатура Менделеева в академики была в 1880 г. отвергнута.
Д.И.Менделеев был членом более 90 академий наук, научных обществ, университетов разных стран. Имя Менделеева носит химический элемент № 101 (менделевий), подводный горный хребет и кратер на обратной стороне Луны, ряд учебных заведений и научных институтов. В 1962 г. АН СССР учредила премию и Золотую медаль им. Менделеева за лучшие работы по химии и химической технологии, в 1964 г. имя Менделеева было занесено на доску почёта Бриджпортского университета в США наряду с именами Евклида, Архимеда, Н.Коперника, Г.Галилея, И.Ньютона, А.Лавуазье [5].
В 1865-1867 годах Д.И.Менделеев отмечал, что процесс растворения делится на две стадии: растворенное вещество вместе с одной частью жидкости образует определенное химическое соединение, и это последнее растворяется в остальной части той же жидкости. Каждая стадия при этом обусловлена действием химических сил, но разной интенсивности. После долгих исканий он пришел к мысли, что это взаимодействие носит характер обмена частиц соединения с частицами избытка растворителя. Менделеев считал, что растворы можно согласовать с атомистической теорией, если ввести понятия «ассоциация» и «диссоциация», если рассматривать растворы как самый общий случай химического взаимодействия, когда проявляются слабые силы химического сродства.
Основные положения учения о растворах, о взаимодействии веществ, составляющих раствор, об образовании определенных соединений, которые находятся в состоянии диссоциации и подвижного равновесия, подчиненного закону действующих масс, были развиты Менделеевым в 1883-1887 годах. Он собрал и систематизировал большой фактический материал, который изложил в фундаментальной монографии «Исследование водных растворов по удельному весу»(1887г.).
Изучая двухкомпонентные системы, Д.И.Менделеев рассмотрел зависимость плотности от состава для 233 веществ. Он изучил зависимость плотности от состава для водных растворов щелочей, азотной кислоты, кислорода, азота, угольной кислоты, растворов различных органический соединений при различных температурах и концентрациях.
Менделеев изучал такие растворы, в которых свойства веществ, образующих раствор, сильно изменяются. Без признания взаимодействия компонентов раствора, по мнению Менделеева, нельзя объяснить изменения свойств при изменении состава растворов.
«Теперь мне ясно и уже несомненно, - писал Д.И.Менделеев, - что растворы управляются обычными законами химического воздействия, что в них сокрыты те же определенные соединения, которыми так сильна химия» [1].
3.2 ОСМОТИЧЕСКАЯ ТЕОРИЯ ВАНТ-ГОФФА
В 1886 году Вант-Гофф поставил перед собой задачу измерить силу притяжения между растворенным веществом и растворителем.
«С этим вопросом на устах, выходя из лаборатории, я встретил, - вспоминает Я.Вант-Гофф, - своего коллегу Г.де Фриза», который как раз в это время занимался опытами над явлениями осмоса. Он посоветовал Вант-Гоффу ознакомиться с исследованиями немецкого ученого В.Пфеффера.
Пфеффер установил, что растворитель протекает через полупроницаемую перегородку в раствор до тех пор, пока между раствором и растворителем не устанавливается определенная разность давления, которую легко измерить манометром. Ее значение зависит как от концентрации раствора, так и от температуры. Осмотическое давление направлено от растворителя к раствору, и действует до тех пор, пока противоположное давление в растворе его не уравновесит. В.Пфеффер, однако, не устанавливал взаимосвязи между осмотическим давлением, концентрацией и температурой раствора [2].
В 1882 году Г.де Фриз, изучая поведение растительных клеток в растворах различной концентрации, показал, что в клетках существует осмотическое давление и что это давление имеет значение для жизни растений.
В наблюдениях и опытах, проведенных Пфеффером и де Фризом над осмотическим давлением, Вант-Гофф увидел прекрасный пример процессов, без которых не удавалось построить стройное здание учения о химическом равновесии.
«Я установил, - писал Вант-Гофф, - для слабых растворов законы, аналогичные законам Бойля и Гей-Люссака для газов… Если просто сравнивать вещество в газообразном состоянии с состоянием его в растворах, то, за исключением однородности, нельзя заметить никакого сходства. Но дело примет совершенно иной оборот, когда мы представим себе растворенное тело заключенным в сосуд с полупроницаемыми стенками, погруженный в растворитель. В этом случае раствор приобретает характерную особенность газового состояния».
В 1887 году была опубликована обобщающая статья Вант-Гоффа «Роль осмотического давления в аналогии между раствором и газом». В ней он отметил, что «в ходе исследования, имевшего своей главной целью отыскание законов химического равновесия, постепенно выяснялось, что существует глубокая аналогия, и даже почти тождество между растворами и газами, если только мы заменим в случае растворов обыкновенное газовое давление осмотическим давлением» [1].
Показав, что законы идеальных газов целиком справедливы и для сильно разведенных растворов, Вант-Гофф связал осмотическое давление с экспериментальными данными Ф.М.Рауля о понижении давления пара, повышении температуры кипения и понижения температуры замерзания растворов.
Еще в 1878 году Ф. Рауль установил, что между понижением давления пара водных растворов, понижением их температур замерзания и молекулярными массами растворенных веществ существует тесная связь. Я Вант-Гофф, используя результаты работ Рауля, установил зависимость между осмотическим давлением растворов и понижением давления их пара, температурой из замерзания и повышением температуры кипения. Таким образом, был найден еще один удобный способ определения молекулярной массы изучаемого вещества.
Однако теория Вант-Гоффа уже с самого начала своего возникновения встретилась с рядом фактов, которые она не могла объяснить. Многочисленные измерения давления пара водных растворов, проведенные различными исследователями показали, что все вещества могут быть разделены на две группы. К первой группе принадлежат те вещества, растворы которых будут оказывать нормальное осмотическое давление. Ко второй группе относятся растворы электролитов, осмотическое давление которых и все связанные с ним величины оказываются больше, чем можно было ожидать по теории Вант-Гоффа. Желая примерить эти противоречия со своими воззрениями на растовры Я.Вант-Гофф ввел коэффициент i для упомянутых исключений [2].
В своей речи «Как произошла теория растворов», произнесенной 19 декабря 1893 года на заседании Берлинского химического общества, Я. Вант-Гофф представил главнейшие моменты развития своей теории [1].
3.3 НЕВОДНЫЕ РАСТВОРЫ
Теория Аррениуса с поправками И.А.Каблукова неплохо описывала процесс растворения веществ и поведения растворов. Но каких растворов? Оказалось, что только водных. Вода, конечно важнейший растворитель на Земле. Но не единственный. Есть много других растворителей.
В 1889 – 1891годах появились работы И.А.Каблукова, посвященные измерению электропроводности растворов электролитов в органических растворителях. Заинтересовавшись вопросом, как влияет природа растворителя на химические свойства кислот, он исследовал электропроводность хлороводорода в различных растворителях. Им было найдено, что электропроводность хлороводорода в эфире уменьшается с разведением. «Явление, - писал Каблуков,- неожиданное, так как для большинства водных растворов наблюдается обратное». Открытие аномальной электропроводности показала, что чисто физическая трактовка растворов недостаточна и что химизм своеобразного взаимодействия между растворенным веществом и растворителем накладывает яркий отпечаток на их физико-химические свойства [1].
Таким образом появились различные теории, объясняющие поведение веществ по отношению к растворителю с точки зрения кислотно-основного взаимодействия, электронного; появились различные определения кислот и оснований.
Например Е.Франклин в 1905 г обнаружил глубокую аналогию между реакциями электролитов в жидкой воде и в жидком аммиаке.
Жидкая вода и жидкий аммиак сами по себе имеют много сходного. Например, чистая вода хоть и плохо, но все же проводит электрический ток. Мизерная часть ее молекул подвергается диссоциации:
h3O «H+ + OH-
Полученные ионы практически мгновенно соединяются с водой, образуя гидраты. Образовавшиеся ионы обеспечивают электрическую проводимость воды.
В жидком аммиаке наблюдается аналогичная картина. Аммиак тоже слабо проводит электрический ток:
Nh4 « H+ + Nh3-
Таким образом вода и аммиак в чистом состоянии обнаруживают сходные свойства. Но еще большее сходство выявил Е.Франклин, проводя различные реакции в этих растворителях.
Если взять, к примеру, взаимодействие со щелочными металлами, то получим:
2K + 2h3O ® 2KOH + h3
Полученный раствор гидроксида калия хорошо проводит электрический ток, так как гидроксид практически полностью распадается на ионы.
В жидком аммиаке происходят практически те же процессы. Калий легко растворяется с образованием водорода:
2K + 2Nh4 ® 2KNh3 + h3
Полученный раствор амида калия так же хорошо проводит электрический ток, так как амид легко распадается на ионы K+ + Nh3.
Это сходство проявляется и в реакциях нейтрализации кислот щелочами.
В водной среде:
HCl + NaOH ® NaCl + h3O
или
H+ + OH-
Если в жидком аммиаке растворить NaNh3 и пропустить затем ток хлороводорода, произойдет аналогичная реакция:
HCl + NaNh3 ® NaCl + Nh4
или
H+ + Nh3- ® Nh4
Таким образом, вода и аммиак как растворители проявляют много общего. А детальные исследования показали, что подобных растворителей, у которых наблюдается более или менее глубокая аналогия с водой не так мало. Поэтому чтобы охватить любые растворы, нужна была более общая теория. И вскоре она появилась [3].
ПРОТОННАЯ (ПРОТОЛИТИЧЕСКАЯ) ТЕОРИЯ
Эту теорию разработали многие химики, но больше всех потрудился здесь датчанин И.Н.Бренстед. Сформулирована теория в 1923 году.
БРЁНСТЕД (Brønsted), Йоханнес Николаус. Датский физикохимик Йоханнес Николаус Брёнстед родился в Варде. В 1897 г. поступил в Копенгагенский университет; в 1899 г. сдал экзамен на звание инженера, в 1902 г. стал магистром, а в 1908 г. – доктором наук. С 1905 г. работал в Копенгагенском университете (с 1908 г. – профессор), в 1930-1947 гг. директор Физико-химического института Высшей технической школы в Копенгагене.
Основные работы Брёнстеда посвящены химической кинетике, катализу и термодинамике растворов. Изучал каталитические реакции, кинетические свойства ионов в растворах. Выдвинул (1923) представления о солевых эффектах в кислотно-основном катализе (воздействие нейтральных солей на скорость кислотно-основных реакций) и установил (1923-1925) их причины. Ввёл в науку понятие «критический комплекс» (в известном смысле ставшее предшественником «активированного комплекса»). На основании своих обширных исследований свойств растворов солей Брёнстед в 1923-1929 гг. сформулировал основные положения «общей», или «расширенной», теории кислот и оснований.
Брёнстед также установил количественное соотношение между силой кислот и оснований и их каталитической активностью. Развил (1929) теорию кислотно-основного катализа. В 1920-хгг. Совместно с Г.Хевеши работал над разделением изотопов при помощи фракционной перегонки. В 1912г. Брёнстед принимал участие в написании «Учебника физической химии», в 1916г. были опубликованы его «Основы неорганической химии».
Член Датского королевского общества наук (с 1914), Американской Академии искусств и наук (с 1829). Награждён медалью Эрстеда (1928) [5].
Прежде чем рассмотреть ее, нужно уточнить некоторые детали. По Аррениусу основанием считалось соединение, диссоциирующее в водном растворе с отщеплением ионов OH-. Некоторые вещества, например, щелочи, действительно имели в своем составе OH- при диссоциации отщепляли эти частицы. Но гораздо больше было таких соединений, которые в своем составе ионов OH- не имели и тем не менее при растворении в воде основные свойства проявляли весьма заметно. Таковыми оказались аммиак, амины, пиридин и другие вещества. При растворении их в воде индикаторами обнаруживались гидроксид-ионы. Оказывается, аммиак и подобные ему соединения, попадая в воду, отбирали у нее протоны, после чего в растворе появлялись гидроксид-ионы.
Nh4 + HOH ® Nh5+ + OH-
В итоге сложилось новое представление об основаниях, как о веществах, способных присоединять к себе протоны. И щелочи этому представлению также не противоречили.
Новое представление об основаниях помогло И.Н.Бренстеду увидеть тот самый главный процесс, который происходит при любом кислотно-основном взаимодействии: переход электронов от кислоты к основанию. Скорее всего Бренстед использовал здесь аналогию с окислительно-восстановительными реакциями, в которых происходит переход электронов от восстановителя к окислителю. Он представил дело так, что в основе всех кислотно-основных реакций тоже лежат переходы, но не электронов, а протонов. Те вещества, которые при кислотно-основном взаимодействии отдавали протоны, он назвал кислотами, а те вещества, которые присоединяли протоны к себе – основаниями. Для веществ, обменивающихся протонами, он ввел название – протолиты. Отсюда и название теории – протолитическая [3].
freepapers.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


