|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Фтор. Реферат фтор
Реферат - Фтор - Химия
Министерство образования и науки РФ
РЕФЕРАТ
НА ТЕМУ
«ФТОР»
Выполнил:
Проверил:
-2007-
ФТОР (лат. Fluorum), F, химическийэлемент с атомным номером 9, атомная масса 18,998403. Природный фтор состоит изодного стабильного нуклида 19F. Конфигурация внешнего электронного слоя 2s2p5.В соединениях проявляет только степень окисления –1 (валентность I). Фторрасположен во втором периоде в группе VIIА периодической системы элементовМенделеева, относится к галогенам.
1.Общая характеристика.
Радиус нейтрального атома фтора0,064 нм, радиус иона F– 0,115 (2), 0,116 (3), 0,117 (4) и 0,119 (6)нм (в скобках указано значение координационного числа). Энергиипоследовательной ионизации нейтрального атома фтора равны, соответственно,17,422, 34,987, 62,66, 87,2 и 114,2 эВ. Сродство к электрону 3,448 эВ (самоебольшое среди атомов всех элементов). По шкале Полинга электроотрицательностьфтора 4 (самое высокое значение среди всех элементов). Фтор — самый активныйнеметалл.
2.Свойства.
При обычных условиях фтор — газ(плотность 1,693 кг/м3) с резким запахом. Температура кипения–188,14°C, температура плавления –219,62°C. В твердом состоянии образует двемодификации: a-форму, существующую от температуры плавления до –227,60°C, иb-форму, устойчивую при температурах, более низких, чем –227,60°C.
Как и другие галогены, фторсуществует в виде двухатомных молекул F2. Межъядерное расстояние в молекуле0,14165 нм. Молекулу F2 характеризует аномально низкая энергия диссоциации наатомы (158 кДж/моль), что, в частности, обусловливает высокую реакционнуюспособность фтора.
Химическая активность фтора чрезвычайновелика. Из всех элементов со фтором не образуют фторидов только три легкихинертных газа — гелий, неон и аргон. Во всех соединениях фтор проявляет толькоодну степень окисления –1.
Со многими простыми и сложнымивеществами фтор реагирует напрямую. Так, при контакте с водой фтор реагирует сней (часто говорят, что «вода горит во фторе»):
2F2 + 2h3O =4HF + O2.
Фтор реагирует со взрывом припростом контакте с водородом (H):
h3 + F2 = 2HF.
При этом образуется газ фтороводородHF, неограниченно растворимый в воде с образованием сравнительно слабойплавиковой кислоты.
Фтор вступает во взаимодействие сбольшинством неметаллов. Так, при реакции фтора с графитом образуютсясоединения общей формулы CFx, при реакции фтора с кремнием (Si) —фторид SiF4, с бором — трифторид BF3. При взаимодействиифтора с серой (S) образуются соединения SF6 и SF4 и т. д.
Известно большое число соединенийфтора с другими галогенами, например, BrF3, IF7, ClF, ClF3и другие, причем бром (Br) и иод (I) воспламеняются в атмосфере фтора приобычной температуре, а хлор (Cl) взаимодействует с фтором при нагревании до200-250°С.
Не реагируют со фторомнепосредственно, кроме указанных инертных газов, также азот (N), кислород (O),алмаз, углекислый и угарный газы.
Косвеным путем получен трифторидазота NF3 и фториды кислорода О2F2 и OF2,в которых кислород имеет необычные степени окисления +1 и +2.
При взаимодействии фтора суглеводородами происходит их деструкция, сопровождающаяся получениемфторуглеводородов различного состава.
При небольшом нагревании (100-250°C)фтор реагирует с серебром (Ag), ванадием (V), рением (Re) и осмием (Os). Сзолотом (Au), титаном (Ti), ниобием (Nb), хромом (Cr) и некоторыми другимиметаллами реакция с участием фтора начинает протекать при температуре выше 300-350°C.С теми металлами, фториды которых нелетучи (алюминий (Al)железо (Fe), медь (Cu)и др.), фтор с заметной скоростью реагирует при температуре выше 400-500°C.
Некоторые высшие фториды металлов,например, гексафторид урана UF6, получают действуя фтором или такимфторирующим агентом, как BrF3, на низшие галогениды, например:
UF4 + F2 = UF6
Следует отметить, что ужеупоминавшейся плавиковой кислоте HF соответствуют не только средние фторидытипа NaF или СаF2, но и кислые фториды — гидрофториды типа NaHF2и КНF2.
Синтезировано также большое числоразличных фторорганических соединений, в том числе и знаменитый тефлон —материал, представляющий собой полимер тетрафторэтилена.
История открытия:
История открытия фтора связана сминералом флюоритом, или плавиковым шпатом. Состав этого минерала, как сейчасизвестно, отвечает формуле CaF2, и он представляет собой первоесодержащее фтор вещество, которое начал использовать человек. В давние временабыло отмечено, что если флюорит добавить при выплавке металла к руде, тотемпература плавления руды и шлаков понижается, что значительно облегчаетпроведение процесса (отсюда название минерала — от лат. fluo — теку).
В 1771 году обработкой флюоритасерной кислотой шведский химик К. Шееле приготовил кислоту, которую он назвал«плавиковой». Французский ученый А. Лавуазье предположил, что в состав этойкислоты входит новый химический элемент, который он предложил назвать «флуорем»(Лавуазье считал, что плавиковая кислота — это соединение флуория с кислородом,ведь, по мнению Лавуазье, все кислоты должны содержать кислород). Однаковыделить новый элемент он не смог.
За новым элементом укрепилосьназвание «флюор», которое отражено и в его латинском названии. Но длительныепопытки выделить этот элемент в свободном виде успеха не имели. Многие ученые,пытавшиеся получить его в свободном виде, погибли при проведении таких опытовили стали инвалидами. Это и английские химики братья Т. и Г. Ноксы, и французыЖ.-Л. Гей-Люссак и Л. Ж. Тенар, и многие другие. Сам Г. Дэви, первым получившийв свободном виде натрий (Na), hкалий (K), кальций (Ca) и другие элементы, врезультате экспериментов по получению фтора электролизом отравился и тяжелозаболел. Вероятно, под впечатлением всех этих неудач в 1816 году для новогоэлемента было предложено хотя и сходное по звучанию, но совершенно другое посмыслу название — фтор (от греч. phtoros — разрушение, гибель). Это названиеэлемента принято только в русском языке, французы и немцы продолжают называтьфтор fluor, англичане — fluorine.
Получить фтор в свободном виде несмог и такой выдающийся ученый, как М. Фарадей. Только в 1886 году французскийхимик А. Муассан, используя электролиз жидкого фтороводорода HF, охлажденногодо температуры –23°C (в жидкости должно содержаться немного фторида калия KF,который обеспечивает ее электропроводимость), смог на аноде получить первуюпорцию нового, чрезвычайно реакционноспособного газа. В первых опытах дляполучения фтора Муассан использовал очень дорогой электролизер, изготовленныйиз платины (Pt) и иридия (Ir). При этом каждый грамм полученного фтора «съедал»до 6 г платины. Позднее Муассан стал использовать значительно более дешевыймедный электролизер. Фтор реагирует с медью (Cu), но при реакции образуетсятончайшая пленка фторида, которая препятствует дальнейшему разрушению металла.
3.Получение.
На первой стадии получения фторавыделяют фтороводород HF. Приготовление фтороводорода и фтористоводородной(плавиковой) кислоты происходит, как правило, попутно с переработкойфторапатита на фосфорные удобрения. Образующийся при сернокислотной обработкефторапатита газообразный фтороводород далее собирают, сжижают и используют дляпроведения электролиза. Электролизу можно подвергать как жидкую смесь HF и KF(процесс осуществляется при температуре 15-20°C), так и расплав Kh3F3(при температуре 70-120°C) или расплав КНF2 (при температуре245-310°C). В лаборатории для приготовления небольших количеств свободногофтора можно использовать или нагревание MnF4, при котором происходитотщепление фтора, или нагревание смеси K2MnF6 и SbF5:
2K2MnF6+ 4SbF5 = 4KSbF6 + 2MnF3 + F2.
Нахождение в природе: содержаниефтора в земной коре довольно велико и составляет 0,095% по массе (значительнобольше, чем ближайшего аналога фтора по группе — хлора (Cl)). Из-за высокойхимической активности фтор в свободном виде, разумеется, не встречается.Важнейшие минералы фтора — это флюорит (плавиковый шпат), а также фторапатит3Са3(РО4)2·СaF2 и криолит Na3AlF6.Фтор как примесь входит в состав многих минералов, содержится в подземных водах;в морской воде 1,3·10–4% фтора.
Применение: фтор широко применяюткак фторирующий агент при получении различных фторидов (SF6, BF3,WF6 и других), в том числе и соединений инертных газов >ксенона(Xe) и криптона (Kr). Гексафторид урана UF6 применяется дляразделения изотопов урана (U). Фтор используют в производстве тефлона, другихфторопластов, фторкаучуков, фторсодержащих органических веществ и материалов,которые широко применяют в технике, особенно в тех случаях, когда требуетсяустойчивость к агрессивным средам, высокой температуре и т.п.
4.Биологическая роль:
В качестве микроэлемента фтор входитв состав всех организмов. У животных и человека фтор присутствует в костнойткани (у человека — 0,2-1,2%) и, особенно, в дентине и эмали зубов. В организмесреднего человека (масса тела 70 кг) содержится 2,6 г фтора; суточнаяпотребность составляет 2-3 мг и удовлетворяется, главным образом, с питьевойводой. Недостаток фтора приводит к кариесу зубов. Поэтому соединения фторадобавляют в зубные пасты, иногда вводят в состав питьевой воды. Избыток фтора вводе, однако, тоже вреден для здоровья. Он приводит к флюорозу — изменениюструктуры эмали и костной ткани, деформации костей. ПДК для содержания в водефторид-ионов составляет 0,7 мг/л. ПДК газообразного фтора в воздухе 0,03 мг/м3.Роль фтора в растениях неясна.
www.ronl.ru
Реферат Фтор
скачатьРеферат на тему:
План:
- Введение
- 1 История
- 1.1 Происхождение названия
- 2 Распространение в природе
- 3 Изотопный состав
- 3.1 Ядерные свойства изотопов фтора
- 3.2 Магнитные свойства ядер
- 4 Электронное строение
- 4.1 Строение молекулы
- 5 Кристаллическая решётка
- 6 Получение
- 6.1 Лабораторный метод
- 6.2 Промышленный метод
- 7 Физические свойства
- 8 Химические свойства
- 9 Хранение
- 10 Применение
- 10.1 Применение в химии
- 10.2 Ракетная техника
- 10.3 Применение в медицине
- 11 Биологическая и физиологическая роль ЛитератураПримечания
Введение
Фтор — элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 9. Обозначается символом F (лат. Fluorum). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Очень ядовит.
1. История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
1.1. Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
2. Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека[3] | 0,01 |
В природе значимые скопления фтора содержатся в основном в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F.
Относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
3. Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
3.1. Ядерные свойства изотопов фтора
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
3.2. Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
4. Электронное строение
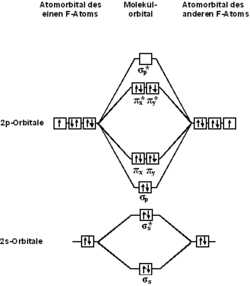
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2
4.1. Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
5. Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре меньше 45,6 K, кристаллическая решетка моноклинная, пространственная группа C 2/c, параметры a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4[4][5].
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубическая, параметры a = 0,667 нм, Z = 8.
6. Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
6.1. Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[6]:
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
6.2. Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
7. Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[7].
8. Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2h3O → 4HF + O2К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
2CoF3 → 2CoF2 + F2 MnF4 → MnF3 + 1/2 F2Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[8].
9. Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов[9]).
10. Применение
10.1. Применение в химии
Газообразный фтор используется для получения:
- гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
- трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
- шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
- фреонов — хороших хладагентов
- тефлонов — химически инертных полимеров
- гексафтороалюмината натрия — для последующего получения алюминия электролизом
- различных соединений фтора
10.2. Ракетная техника
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
10.3. Применение в медицине
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств содержащих фтор в структуре (фторотан, фторурацил и др.).
11. Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно[10].
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фтора [11] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. англ. — Подробней о кристаллической структуре фтора
Примечания
- http://www.xumuk.ru/nekrasov/vii-01.html - www.xumuk.ru/nekrasov/vii-01.html
- Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т.. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 198.
- Главным образом в эмали зубов
- Journal of Solid State Chemistry, Vol. 2, Issue 2, 1970, P. 225—227.
- J. Chem. Phys. 49, 1902 (1968)
- Гринвуд Н., Эрншо А. «Химия элементов» т.2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- Ахметов Н. С. «Общая и неорганическая химия».
- Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- Фтор в Популярной библиотеке химических элементов - n-t.ru/ri/ps/pb009.htm
- По данным National Toxicology Program
- в виде фторидов и фторорганических соединений
wreferat.baza-referat.ru
Курсовая работа - Фтор - Химия
Министерство образования и науки РФ
РЕФЕРАТ
НА ТЕМУ
«ФТОР»
Выполнил:
Проверил:
-2007-
ФТОР (лат. Fluorum), F, химическийэлемент с атомным номером 9, атомная масса 18,998403. Природный фтор состоит изодного стабильного нуклида 19F. Конфигурация внешнего электронного слоя 2s2p5.В соединениях проявляет только степень окисления –1 (валентность I). Фторрасположен во втором периоде в группе VIIА периодической системы элементовМенделеева, относится к галогенам.
1.Общая характеристика.
Радиус нейтрального атома фтора0,064 нм, радиус иона F– 0,115 (2), 0,116 (3), 0,117 (4) и 0,119 (6)нм (в скобках указано значение координационного числа). Энергиипоследовательной ионизации нейтрального атома фтора равны, соответственно,17,422, 34,987, 62,66, 87,2 и 114,2 эВ. Сродство к электрону 3,448 эВ (самоебольшое среди атомов всех элементов). По шкале Полинга электроотрицательностьфтора 4 (самое высокое значение среди всех элементов). Фтор — самый активныйнеметалл.
2.Свойства.
При обычных условиях фтор — газ(плотность 1,693 кг/м3) с резким запахом. Температура кипения–188,14°C, температура плавления –219,62°C. В твердом состоянии образует двемодификации: a-форму, существующую от температуры плавления до –227,60°C, иb-форму, устойчивую при температурах, более низких, чем –227,60°C.
Как и другие галогены, фторсуществует в виде двухатомных молекул F2. Межъядерное расстояние в молекуле0,14165 нм. Молекулу F2 характеризует аномально низкая энергия диссоциации наатомы (158 кДж/моль), что, в частности, обусловливает высокую реакционнуюспособность фтора.
Химическая активность фтора чрезвычайновелика. Из всех элементов со фтором не образуют фторидов только три легкихинертных газа — гелий, неон и аргон. Во всех соединениях фтор проявляет толькоодну степень окисления –1.
Со многими простыми и сложнымивеществами фтор реагирует напрямую. Так, при контакте с водой фтор реагирует сней (часто говорят, что «вода горит во фторе»):
2F2 + 2h3O =4HF + O2.
Фтор реагирует со взрывом припростом контакте с водородом (H):
h3 + F2 = 2HF.
При этом образуется газ фтороводородHF, неограниченно растворимый в воде с образованием сравнительно слабойплавиковой кислоты.
Фтор вступает во взаимодействие сбольшинством неметаллов. Так, при реакции фтора с графитом образуютсясоединения общей формулы CFx, при реакции фтора с кремнием (Si) —фторид SiF4, с бором — трифторид BF3. При взаимодействиифтора с серой (S) образуются соединения SF6 и SF4 и т. д.
Известно большое число соединенийфтора с другими галогенами, например, BrF3, IF7, ClF, ClF3и другие, причем бром (Br) и иод (I) воспламеняются в атмосфере фтора приобычной температуре, а хлор (Cl) взаимодействует с фтором при нагревании до200-250°С.
Не реагируют со фторомнепосредственно, кроме указанных инертных газов, также азот (N), кислород (O),алмаз, углекислый и угарный газы.
Косвеным путем получен трифторидазота NF3 и фториды кислорода О2F2 и OF2,в которых кислород имеет необычные степени окисления +1 и +2.
При взаимодействии фтора суглеводородами происходит их деструкция, сопровождающаяся получениемфторуглеводородов различного состава.
При небольшом нагревании (100-250°C)фтор реагирует с серебром (Ag), ванадием (V), рением (Re) и осмием (Os). Сзолотом (Au), титаном (Ti), ниобием (Nb), хромом (Cr) и некоторыми другимиметаллами реакция с участием фтора начинает протекать при температуре выше 300-350°C.С теми металлами, фториды которых нелетучи (алюминий (Al)железо (Fe), медь (Cu)и др.), фтор с заметной скоростью реагирует при температуре выше 400-500°C.
Некоторые высшие фториды металлов,например, гексафторид урана UF6, получают действуя фтором или такимфторирующим агентом, как BrF3, на низшие галогениды, например:
UF4 + F2 = UF6
Следует отметить, что ужеупоминавшейся плавиковой кислоте HF соответствуют не только средние фторидытипа NaF или СаF2, но и кислые фториды — гидрофториды типа NaHF2и КНF2.
Синтезировано также большое числоразличных фторорганических соединений, в том числе и знаменитый тефлон —материал, представляющий собой полимер тетрафторэтилена.
История открытия:
История открытия фтора связана сминералом флюоритом, или плавиковым шпатом. Состав этого минерала, как сейчасизвестно, отвечает формуле CaF2, и он представляет собой первоесодержащее фтор вещество, которое начал использовать человек. В давние временабыло отмечено, что если флюорит добавить при выплавке металла к руде, тотемпература плавления руды и шлаков понижается, что значительно облегчаетпроведение процесса (отсюда название минерала — от лат. fluo — теку).
В 1771 году обработкой флюоритасерной кислотой шведский химик К. Шееле приготовил кислоту, которую он назвал«плавиковой». Французский ученый А. Лавуазье предположил, что в состав этойкислоты входит новый химический элемент, который он предложил назвать «флуорем»(Лавуазье считал, что плавиковая кислота — это соединение флуория с кислородом,ведь, по мнению Лавуазье, все кислоты должны содержать кислород). Однаковыделить новый элемент он не смог.
За новым элементом укрепилосьназвание «флюор», которое отражено и в его латинском названии. Но длительныепопытки выделить этот элемент в свободном виде успеха не имели. Многие ученые,пытавшиеся получить его в свободном виде, погибли при проведении таких опытовили стали инвалидами. Это и английские химики братья Т. и Г. Ноксы, и французыЖ.-Л. Гей-Люссак и Л. Ж. Тенар, и многие другие. Сам Г. Дэви, первым получившийв свободном виде натрий (Na), hкалий (K), кальций (Ca) и другие элементы, врезультате экспериментов по получению фтора электролизом отравился и тяжелозаболел. Вероятно, под впечатлением всех этих неудач в 1816 году для новогоэлемента было предложено хотя и сходное по звучанию, но совершенно другое посмыслу название — фтор (от греч. phtoros — разрушение, гибель). Это названиеэлемента принято только в русском языке, французы и немцы продолжают называтьфтор fluor, англичане — fluorine.
Получить фтор в свободном виде несмог и такой выдающийся ученый, как М. Фарадей. Только в 1886 году французскийхимик А. Муассан, используя электролиз жидкого фтороводорода HF, охлажденногодо температуры –23°C (в жидкости должно содержаться немного фторида калия KF,который обеспечивает ее электропроводимость), смог на аноде получить первуюпорцию нового, чрезвычайно реакционноспособного газа. В первых опытах дляполучения фтора Муассан использовал очень дорогой электролизер, изготовленныйиз платины (Pt) и иридия (Ir). При этом каждый грамм полученного фтора «съедал»до 6 г платины. Позднее Муассан стал использовать значительно более дешевыймедный электролизер. Фтор реагирует с медью (Cu), но при реакции образуетсятончайшая пленка фторида, которая препятствует дальнейшему разрушению металла.
3.Получение.
На первой стадии получения фторавыделяют фтороводород HF. Приготовление фтороводорода и фтористоводородной(плавиковой) кислоты происходит, как правило, попутно с переработкойфторапатита на фосфорные удобрения. Образующийся при сернокислотной обработкефторапатита газообразный фтороводород далее собирают, сжижают и используют дляпроведения электролиза. Электролизу можно подвергать как жидкую смесь HF и KF(процесс осуществляется при температуре 15-20°C), так и расплав Kh3F3(при температуре 70-120°C) или расплав КНF2 (при температуре245-310°C). В лаборатории для приготовления небольших количеств свободногофтора можно использовать или нагревание MnF4, при котором происходитотщепление фтора, или нагревание смеси K2MnF6 и SbF5:
2K2MnF6+ 4SbF5 = 4KSbF6 + 2MnF3 + F2.
Нахождение в природе: содержаниефтора в земной коре довольно велико и составляет 0,095% по массе (значительнобольше, чем ближайшего аналога фтора по группе — хлора (Cl)). Из-за высокойхимической активности фтор в свободном виде, разумеется, не встречается.Важнейшие минералы фтора — это флюорит (плавиковый шпат), а также фторапатит3Са3(РО4)2·СaF2 и криолит Na3AlF6.Фтор как примесь входит в состав многих минералов, содержится в подземных водах;в морской воде 1,3·10–4% фтора.
Применение: фтор широко применяюткак фторирующий агент при получении различных фторидов (SF6, BF3,WF6 и других), в том числе и соединений инертных газов >ксенона(Xe) и криптона (Kr). Гексафторид урана UF6 применяется дляразделения изотопов урана (U). Фтор используют в производстве тефлона, другихфторопластов, фторкаучуков, фторсодержащих органических веществ и материалов,которые широко применяют в технике, особенно в тех случаях, когда требуетсяустойчивость к агрессивным средам, высокой температуре и т.п.
4.Биологическая роль:
В качестве микроэлемента фтор входитв состав всех организмов. У животных и человека фтор присутствует в костнойткани (у человека — 0,2-1,2%) и, особенно, в дентине и эмали зубов. В организмесреднего человека (масса тела 70 кг) содержится 2,6 г фтора; суточнаяпотребность составляет 2-3 мг и удовлетворяется, главным образом, с питьевойводой. Недостаток фтора приводит к кариесу зубов. Поэтому соединения фторадобавляют в зубные пасты, иногда вводят в состав питьевой воды. Избыток фтора вводе, однако, тоже вреден для здоровья. Он приводит к флюорозу — изменениюструктуры эмали и костной ткани, деформации костей. ПДК для содержания в водефторид-ионов составляет 0,7 мг/л. ПДК газообразного фтора в воздухе 0,03 мг/м3.Роль фтора в растениях неясна.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|