|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат на тему Кремний. Реферат кремний
Доклад - Кремний - Химия
Коробецкая Анастасия 10А класс
КРЕМНИЙ
Научныйруководитель: Сукачева Т.А.
/> /> Кремний – второй по распространенности (после кислорода) элемент земной коры. Вверхних осадочных слоях он содержится в виде глин, кварца и других соединений исоставляет 27,6% состава земной коры… Под осадочным находится слой базальтов игранитов, в состав которых также входит кремний. Эти слои образуют земную коруи находятся на глубине до 35 км. В верхних слоях мантии (до 900 км) преобладаютсиликаты железа и магния. Ядро и нижняя мантия, по предположениям ученых, такжесостоят в основном из силикатов (рис.1).В чистом видекремний в природе не встречается. Наиболее распространен оксид кремния исиликаты. Первый встречается в виде минерала кварца (кремнезем, кремень). Вприроде из этого соединения сложены целые горы. Попадаются очень крупные, до 40т кристаллы кварца. Обычный песок состоит из мелкого кварца с различнымипримесями. Горный хрусталь – совершенно прозрачные кристаллы кварца. Взависимости от примесей он может приобретать различную окраску. Так, оксидымарганца и железа дают фиолетовый оттенок. Это аметист. Желтоватый хрусталь –цитрин, дымчатый – раухтопаз. В нем могут находится и различные включения.Кошачий глаз включает в себя волокнистые материалы, «стрелы Амура» — включенияоксида титана.
Анализ лунногогрунта показал присутствие оксида кремния (IV) вколичестве более 40%. В составе каменных метеоритов содержание кремниядостигает 20%.
Оксид кремния– кремень – сыграл важную роль в истории развития человечества. Именно скремневых наконечников копий, ножей и топориков начинается истории большинстванародов. Позже кремень стал источником огня – путешественники никуда неотправлялись без огнива. А глиняные дома, посуда, предметы быта! Трудносказать, как бы развивался мир без стекла.
В наши дни всеболее необходим становится чистый кремний, как полупроводник. Так называемые«девять девяток чистоты» — 99,9999999% чистого кремния – первое требование кполупроводнику. Ни один из современных компьютеров не существовал бы безкремния. Тоже можно сказать и о ряде других технических средств. Великозначение различных веществ, основой которых являются соединения кремния. Этобетон, керамики, стекло.
В искусствекремний тоже играл большую роль. Большинство драгоценных и полудрагоценныхкамней – соединения того же кремния. И опять же вспоминаются стеклянные,хрустальные и глиняные изделия.
Многое всоединениях кремния остается не до конца понятным. Продолжаются исследования,выдвигаются новые гипотезы. Но многое уже известно. Попробуем разобраться вэтом.
Простое вещество и элементкремний
/> Кремний – второй элемент в IV группе Периодическойтаблицы Д.И. Менделеева. Он находится прямо под углеродом и, следовательно,имеет сходные с ним свойства. На внешнем электронном слое у него четыреэлектрона, из которых в обычном состоянии два не спаренных. У кремниясуществуют соответствующие этому состоянию двухвалентные соединения, например SiO. Но гораздо более естественным при обычных температурахдля кремния является четырехвалентное состояние, при котором один из электронов«перепрыгивает» с s-подуровня на p-подуровень(рис.2).
Внешний электронныйслой у кремния находится дальше от ядра, чем у углерода, сила притяжениявалентных электронов к нему меньше, поэтому свойства кремния ближе кметаллическим. Кристаллический кремний обладает металлическим блеском, являетсяполупроводником. Последнее его свойство объясняется малой прочностьюковалентных связей, существующих между атомами кремния. Они начинаютразрушаться уже при комнатной температуре. При дальнейшем ее повышениивысвобождается большое количество свободных электронов. Полагают, что приабсолютном нуле идеально чистый и правильный кремний должен быть идеальнымэлектроизолятором. Но идеальная чистота и абсолютный нуль недостижимы, поэтомумы обладаем хорошим полупроводником.
В природесуществует три изотопа кремния с массовыми числами 28, 29 и 30. Преобладает(92,27%) легкий изотоп – кремний-28. Известны также несколько радиоактивныхизотопов.
Кремний –активный элемент. В природе он не встречается в свободном виде, и большинствоего соединений очень устойчивы. Несмотря на распространенность кремния вприроде, открыт он был сравнительно поздно. В 1825г. выдающийся шведский химики минералог Якоб Берцелиус сумел в двух реакциях выделить не очень чистыйкремний. Это был аморфный серый порошок. Для этого он восстановил калиемгазообразный тетрафторид кремния SiF4. Новый элементбыл назван силицием (от латинского silex – камень).Русское название появилось спустя девять лет и сохранилось до наших дней.
Кремний, как иуглерод, образует различные аллотропные модификации. Кристаллический кремнийтак же мало похож на аморфный, как алмаз на графит. Это твердое веществосеро-стального цвета с металлическим блеском и гранецентрированнойкристаллической решеткой того же типа, что и у алмаза.
Техническичистый кремний (95-98%) сейчас получают главным образом восстановлениемкремнезема в электрической дуге между графитовыми электродами. Используетсятакже способ восстановления кремнезема коксом в электрических печах. Такойкремний используют в металлургии как раскислитель, связывающий и удаляющий из металлакислород, и как легирующую добавку, повышающую прочность и коррозийнуюстойкость сталей и многих сплавов на основе цветных металлов. В сплавы егодобавляют в небольших количествах: избыток кремния приводит к хрупкости.
Один изспособов получения высокочистого полупроводникового кремния был разработан вовторой половине XIX века русским химиком Н.Н. Бекетовыми был одним из первых способов получения кремния в промышленности. Он основанна реакции между парами цинка и тетрахлорида кремния. Для реакции берутвысокочистые реагенты и проводят ее при 950°С в трубчатом реакторе,изготовленном из плавленого кварца. Элементарный кремний образуется в видеигольчатых кристаллов, которые потом измельчают и промывают соляной кислотой,тоже весьма чистой. Затем следует еще одна ступень отчистки – зонная плавка, илишь после нее поликристаллическую кремниевую массу превращают в монокристаллы.
Есть и другиереакции, в которых получают высокочистый полупроводниковый кремний. Этовосстановление водородом трихлорсилана SiHCl3или четыреххлористого кремния SiCl4 итермическое разложения моносилана, гидрида кремния Sih5или тетраиодида SiI4. В последнем случаеразложение соединения происходит на разогретой до 1000°С танталовой ленте.Дополнительная очистка зонной плавкой следует после каждой из этих реакций.
Соединения кремния
Кремний дает два типа оксидов – оксид кремния (IV) и оксид кремния (II). Оксидкремния (IV) наиболее прочный, не разлагается привысоких температурах и выше 223°С переходит в парообразное состояние. Невосстанавливает его и водород. Более того: сам кремний иногда применяется вкачестве восстановителя, например при получении молибдена:
2MoO3+3Si 3SiO2+2Mo
Поскольку при окислении кремния выделяется громадноеколичество теплоты, оксид кремния (IV) и молибденполучаются в расплавленном состоянии.
В оксиде кремния (IV) молекулнет, так как за счет химической вязи Si—О—Si образуется своеобразный пространственный каркас. Такимобразом, кусок кварца представляет как бы одну гигантскую молекулу. Кварцпредставляет собой неорганический полимер, и его формула (SiO2)n.
Чистый оксид кремния (IV)находится в природе в виде горного хрусталя, кристаллы которого достигаютиногда больших размеров. Самый крупный кристалл, найденный в Казахстане, весил70 т.
В больших количествах в промышленности готовятсиликагель – частично гидратированный оксид кремния (IV).Для его получения на раствор жидкого стекла действуют соляной кислотой:
Na2SiO3+2HCl 2NaCl ´ nh3SiO3
Выпавшую в осадок метакремниевую кислоту отмывают отхлорида натрия водой и высушивают при 170 -180 °С. При этом образуется аморфныйоксид кремния, содержащий небольшое количество химически связанной воды. Поэтомусиликагелю придают условную формулу SiO2 ´ nh3O. Высушенный силикагель может адсорбировать значительноеколичество паров воды, его применяют для осушки газов.
Широко применяется оксид кремния (IV)в промышленности и при научных исследованиях. В виде кварцевого песка егоиспользуют в стекольной промышленности; SiO2– главный компонент силикатных стекол. Кварцевый песок – важнейший строительныйматериал. Кварцевый песок идет в больших количествах для изготовления одного излучших огнеупоров – динаса. Его получают спеканием кварцевого песка, к которомудобавлено 2-2,5% извести. Динас размягчается только при 1700°С, он служит длявыкладки мартеновских печей и различных печей для получения цветных металлов.
Плавленый кварц (SiO2)n дает кварцевое стекло, обладающее интереснымсвойством: оно имеет самый низкий температурный коэффициент расширения, т. е.при нагревании кварцевое стекло практически не расширяется. Поэтому при резкомнагревании или охлаждении посуда из кварцевого стекла не растрескивается.Применяют кварцевую посуду в химических лабораториях. Ее широкомураспространению мешает большая хрупкость и значительные трудности визготовлении (очень высокая температура плавления кварца).
Кремний дает и оксид SiO,который получается взаимодействием оксида кремния (IV)с кремнием:
SiO2+Si2SiO
Оксид кремния SiO – серый порошок,какого-либо применения он не находит. Интересно отметить, что при нагреванииэтот оксид довольно быстро распадается:
2SiO Si + SiO2
Этоуказывает на то, что двухвалентное состояние для кремния не столь характерно,как четырехвалентное.
Соединения кремния с водородом называютсякремневодородами или силанами. Их состав отвечает общей формуле Sinh3n+2 аналогичной общей формуле углеводородов предельногоряда. Простейший представитель этого класса — силан Sih5 — впервые получен немецким химиком Д. Вёлером в 1857 г. Силан и егогомологи (h4Si — Sih4 — дисилан, h4Si — Sih3 — Sih4 — трисилан и т. д.) имеют строение, подобноеметану, этану и пропану. Непредельные силаны, соответствующие по строениюуглеводородам этиленового и ацетиленового рядов, в виде индивидуальныхсоединений пока не выделены. Наиболее просто силаны получаются по методу, разработанномув 1883 г. русскими учеными Н. Н. Бекетовым и А. Д. Чириковым. Метод заключаетсяв разложении силицидов металлов минеральными кислотами:
Mg2Si+4HCl → 2MgCl2+ Sih5
Силан и дисилан — газы с неприятным запахом. Трисилан Si3H8,тетрасилан Si4h20,пентасилан Si5h22и последующие гомологи – при комнатной температуре летучие жидкости снеприятным запахом. Кремневодороды очень ядовиты. В отличие от углеводородовсиланы – неустойчивые соединения. Они самовоспламеняются, иногда взрываются навоздухе, легко разлагаются щелочами и водой в присутствии следов кислот ищелочей:
Sih5 + 2h3O →SiO2+4h3
Кремневодороды термически мало устойчивы и разлагаются накремний и водород уже при 400 °С:
Sih5 → Si + 2h3
Приэтом получается особо чистый кремний.
Неустойчивость кремневодородов подтверждается тем, чтогомологов выше октасилана Si8h28 выделить в свободном состоянии пока неудалось. Силаны являются сильными восстановителями и энергично окисляютсякислородом:
Sih5 + 2O2 → SiO2+ 2h3O
При взаимодействии силанов с галогенами все атомы водородамгновенно (со взрывом) замещаются атомами галогена. Хлор- и бромпроизводныесиланов образуются и при каталитической обработке их хлороводородом илибромоводородом:
Sih5 + HCl → Sih4Cl + h3
Sih4Cl+ HCl → Sih3Cl2 + h3
Sih3Cl+ HCl → SiHCl2+ h3
SiHCl3 + HCl → SiCl4+h3
Для гомологического ряда предельных углеводородов аналогичнаяреакция с НСl или НВг неизвестна. Соединения кремния сводородом представляют большой научный и практический интерес для химиикремнийорганических соединений. Галогениды кремния получают принепосредственном соединении кремния с галогенами, или галогенированием оксидовв присутствии угля:
SiO2 + 2C + 2Cl2 →SiCl4 + 2CO
В лаборатории хлорирование кремния можно проводить встеклянных трубках, имеющих перетяжки. Реакция идет при небольшом нагревании.Жидкий конденсат собирается в колене трубки. Для очистки конденсат нагреваниемперегоняют в следующее колено трубки.
Бромирование и йодирование можно также проводить в стеклянныхтрубках с перетяжками, но для переноса брома или йода используют газ-носитель,например аргон, азот, оксид углерода (IV). Полученныегалогениды гигроскопичны и легко гидролизуются под действием влаги воздуха,поэтому их запаивают в одном из колен трубки.
Нитридами называют химические соединения азота с различнымиэлементами. Для IV группы характерны нитриды и сковалентной связью, и образованные внедрением атомов азота в кристаллическуюрешетку элемента. Нитриды элементов главной подгруппы очень тугоплавкиевещества, обладающие большой твердостью и теплопроводностью. Нитриды довольнотермостойки при нагревании и обладают относительной химической устойчивостью.
Кремний образует нитрид с кристаллической решеткой, в которойатомы азота связаны с атомами кремния ковалентными связями. Такой нитрид имеетформулу, отвечающую обычной валентности элемента, и может рассматриваться какпроизводное аммиака, в котором атомы водорода замещены на кремний – Si3N4.
Общим способам получения нитридов является непосредственноевзаимодействие веществ с азотом или аммиаком:
3Si + 2N2→ Si3N4
3Si + 4Nh4→ Si3N4 +6h3
Реакциюосуществляют при 1000-1200 °С в электрических печах. Применяемые для реакцииазот и аммиак не должны содержать паров воды и кислорода во избежаниезагрязнения нитрида оксидами соответствующих элементов.
Высокая жаропрочность и жаростойкость нитрида кремнияиспользуется при создании сплавов с высокой жаропрочностью для техники высокихтемператур, энергетики и других отраслей. Его исключительная стойкость квоздействию химических реагентов, даже таких, как плавиковая кислота, расплавыщелочей и металлов, в сочетании с огнеупорностью используется в химическойпромышленности. Из него изготовляют футеровку ванн для получения металловэлектролизом расплавленных солей, футерованную арматуру, сопла для распылениярасплавленных металлов, тигли для плавки сверхчистых металлов и т. д.
Метакремниевая кислота h3SiO3 и ортокремниевая кислота h5SiO4 – наиболее распространенные из кислоткремния. Метакремниевая кислота получается взаимодействием силикатов с солянойкислотой или хлоридом аммония:
Na2SiO3 + 2HCl →h3SiO3 + 2NaCl
Na2SiO3 + 2Nh5Cl→ h3SiO3 + 2NaCl + 2Nh4
Свободная метакремниевая кислота известна в виде несколькихформ с переменным содержанием воды. Эта кислота более слабая, чем угольная, онанерастворима в воде, но легко образует коллоидные растворы – золи.Метакремниевая кислота термически неустойчива и при нагревании разлагается:
h3SiO3→ h3O + SiO2
Отщепление воды от нескольких молекул метакремниевой кислотыпроисходит в водном растворе и при комнатной температуре с образованиемпрозрачной студенистой массы – геля кремниевой кислоты. Высушенный гелькремниевой кислоты называют силикагелем.
Силикагель обладает очень большой поверхностью – на 1 гсиликагеля приходится до 400 м2 поверхности – и высокойадсорбционной способностью. Он изготовляется в промышленном масштабе и находитширокое применение для извлечения летучих и пахучих веществ из паров и газов,очистки минеральных масел и нефти, обесцвечивания жидких органическихпродуктов. Силикагель жадно поглощает воду, и это свойство используется присушке газов и жидкостей. Высококачественные сорта силикагеля, не содержащиепримесей, находят применение в медицинской практике. Свободный от примесейсиликагель получают гидролизом силана Sih5,тетрахлорида кремния SiCl4 икремнийорганических соединений – тетраэтоксисилана Si(OC2H5)4и др. Используется силикагель также в качестве носителя катализатора. Введениемзолей кремниевой кислоты в целлюлозные материалы достигается прочность,водонепроницаемость и огнестойкость изделия.
Ортокремниевая кислота получается при гидролизететрахлорида кремния:
SiCl4+4h3O →Si(OH)4+4HCl
По структуре ортокремниевая кислота близка кварцу:атом кремния окружен тетраэдром из четырех атомов кислорода с присоединенным ккислороду водородом. Соли ортокремниевой кислоты также носят названиесиликатов. Соли щелочных металлов кремниевых кислот растворимы в воде, силикатыдругих элементов нерастворимы. Молекулярная масса свежевыделенной кремниевойкислоты (формула Si(OH)4)около 100 у. е. Через несколько дней молекулярная масса кислоты достигнет 1000у. е. и более. Это объясняется чрезвычайной легкостью самоконденсации кислоты,сопровождающейся выделением воды.
Кремний образует кислотные, амфотерные и основныегидроксиды. Все они нерастворимы в воде. Оксид кремния (IV)и оксиды его аналогов с водой практически не реагируют, поэтому получитькислоты этим способом нельзя.
Силикаты – тугоплавкие и пассивные вещества.Большинство их нерастворимо в воде. Они существуют в газообразном, жидком итвердом виде, а также образуют высокодисперсные, или коллоидные, системы сразмером частиц силикатов от 10 – 6 до 10 – 9 м.Коллоидные системы похожи на растворы, но в отличии от них имеют поверхностьраздела между частицами силикатов дисперсионной средой, т. е. средой в которойрастворено вещество. Примерами коллоидных систем являются халцедоны и опалы.Спектр состава силикатов чрезвычайно широк (алюмосиликаты, гидросиликаты и др.)
Для силикатных минералов нет систематических названий,поэтому названия отражают их внешний вид и свойства. Плагиоклаз в переводе сдревнегреческого «косо раскалывающийся», пироксен — «тугоплавкий». Названиятакже даются по именам людей, открывших эти минералы.
В разное время представления о строении силикатов былиразными. Первой научной теорией была поликремниевая. Она играла важную роль всередине XIX в. – 1920-х гг. Согласно этой теориисиликаты есть соли кремниевых кислот. Все кремниевые кислоты можно задатьформулой n SiO2´ m h3O. Примерами служатметакремниевая кислотаh3SiO3(n=1, m=1), ортокремниевая кислота h5SiO4 (n=1, m=2), дикремниевая кислота h3Si2O5 (n=2 m=1), пирокремниевая кислота H6Si2O7 (n=2, m=2).Соответствующие названия силикаты носят и сейчас, хотя поликремниевая теорияуже не пользуется популярностью.
Из-за коллоидного характера силикатов, их нельзяполучить в чистом виде. Поэтому встает вопрос о солеобразной природе силикатов.Но это не все. Рассмотрим два сходных по строению силиката: жадеит Na Al[Si2O6] и лейцитK Al[Si2O6]. Пополикремниевой теории они являются солями метакремниевой кислоты, а,следовательно, должны обладать сходными свойствами. Но по своей природе это двасовершенно разных вещества. Данная теория не объясняет зависимости междусоставом и свойствами веществ, хотя это является основной ее задачей.
Еще Д.И. Менделеев отмечал недостатки этой теории. Онпредполагал изоморфизм в кристаллах силикатов, т.е. способность атомов замещатьдруг друга в кристаллических структурах. Причем это могут быть атомы не толькоодного типа, но и разных. Так, он проявляется в кристаллах алюмосиликатов, хотяалюминий и кремний – разные по типу атомы. Д.И. Менделеев называл подобныекристаллы «неопределенными соединениями», схожими со сплавами, но это сплавы непростых веществ, а близких оксидов. Полимерные соли кремния существуют не из-засуществования полимерных кислот, а из-за полимеризации соединений кремния.Исследования Д.И. Менделеева сыграли важную роль в формировании взглядов на этупроблему.
/>В 1925-1931гг. У.Л.Брегг исследовал кристаллы алюмосиликатов, в том числе и с помощью рентгена. Онпредложил структурную классификацию силикатов. По его мнению, силикатыпредставляли собой полимерные структуры, состоящие из тетраэдров – оксидовкремния, атомов заместивших его. Соединяются они с помощью атомов кислорода,ставших «общими» для двух тетраэдров. Такие атомы кислорода называютсямостиковыми, а те, что не участвуют в образовании таких связей – немостиковыми. Таким образом, создаются связи Si –- O –- Si или Si–- O – Al. Многообразиесиликатов объясняется различными способами соединения этих тетраэдров.
Брегг предлагал классифицировать силикаты по типамкремнекислородных радикалов:
1. Ортосиликаты [SiO4]4 – Уэтого радикала все атомы кислорода являются немостиковыми.
2. Островные [Si2O7]6–, [Si3O8]6–, [Si4O12]8–. Два кислорода в каждом тетраэдре служат для образования кольца, а двадругих являются не мостиковыми.
3. Изолированные [SiO2]2 – и сдвоенные[Si4O11]6– радикалы образуют бесконечные цепочки
4. Слоистые структуры с радикалами [Si2O5]2 –
5. Каркасные структуры
Рассмотрим строение ортосиликата натрия. Его формула 2Na2O ´ SiO2. Данный ортосиликат относится к первойгруппе. В нем тетраэдры [SiO4]4 – соединенымежду собой ионами натрия.
Представителями силикатов третьей группы являются пироксены сформулой LiAl[Si2O6]. В них один атом кремния из трех заместился наатом алюминия. Пироксены образуют бесконечные цепочки разного строения (рис.3).Строение цепочки определяет свойства пироксена.
Области применениясоединений кремнияСоли кремниевых кислот чрезвычайно распространены вприроде в виде руд и минералов. Важнейшими силикатами являются алюмосиликаты,на долю которых приходится более половины массы земной коры. Природные силикатыисчисляются многими сотнями представителей. К ним относят кварц, граниты,полевые шпаты, кристаллические сланцы (слюды), асбест.
Кварц – пьезоэлектрик. Где только не находиттехническое применение кристалл кварца в виде пластинки! Например, кварцевыечасы высокой точности служат для «хранения» точного времени, определяемогоастрономическими методами. Точность суточного хода кварцевых часов ±0,001 с.Основной деталью пьезо-кварцевых стабилизаторов длины радиоволн (частоты),преобразователей давления в электрическую величину с точностью ±1,5%,преобразователей электрической энергии в звуковую (громкоговорители и др.) имеханическую (микрофоны, шумопеленгаторы, ультразвуковая механика) являетсяпластинка из кварца.
Характерная особенность кварцевого стекла – высокаятермическая устойчивость. Такое стекло можно сильно нагреть и сейчас жеохладить в холодной воде. Это объясняется тем, что у кварцевого стеклакоэффициент объемного расширения в 25 раз меньше, чем у обычного стекла.Кварцевое стекло прозрачно как для видимого света, так и для ультрафиолетового.Поэтому из кварцевого стекла изготавливают баллоны кварцевых ламп – источникаультрафиолетовых лучей. Специальные медицинские кварцевые лампы применяют дляоблучения ультрафиолетовыми лучами для профилактики гриппа, лечения рахита идругих заболеваний.
Граниты – одна из самых распространенных пород вземной коре – прекрасный строительный и облицовочный материал. Незаменим гранити для монументальной скульптуры. Отполированный до зеркального блеска, онсоздает неповторимую игру вкраплений, а необработанная, шершавая поверхностьсоздает особую выразительность, поглощая свет.
Полевые шпаты – сырье для керамической, фарфоровой,стекольной, цементной и других отраслей промышленности. В строительстве ихприменяют в качестве поделочных материалов. Кристаллические сланцы (слюды)обладают высокой термостойкостью и высокими электроизоляционными свойствами инаходят применение в электротехнике, радиотехнике. Они также используются какзвуко- и теплоизоляционные материалы. Асбест – минерал с волокнистой структурой– теплоизоляционный и огнеупорный материал. Широкое применение находят слоистыеминералы – слюды, тальк, каолинит. Драгоценные и полудрагоценные камни –изумруд, топаз, аквамарин – хорошо образованные кристаллы природных силикатов,окрашенные различными оксидами.
Искусственные силикаты также играют важную роль вжизни человека. Знакомство человека со стеклом – первым искусственным силикатом– произошло за 3500 лет до н. э.
Основной состав оконного стекла Na2´CaO´6SiO2.Однако частичная замена натрия, кальция или кремния на другие элементыпозволяет получать разнообразные сорта стекла. Кварцевое, хрустальное, бутылочное,посудное, электроламповое, зеркальное, пористое (пеностекло), защитное,архитектурно-строительное, светотехническое, стекло для световодов истеклосфер, оптическое, лабораторное – вот далеко не полный их перечень.Вводя внутрь стеклянного листа металлическую сетку, получают армированноестекло. Трехслойное стекло (триплекс) изготавливают склейкой листа пленки сдвумя листами стекла.
Издавна человек научился применять химическиесоединения для окрашивания стекла. В древности было известно, что стекло взависимости от примесей может иметь различный цвет: синий (от оксида кобальтаСоО), зеленый (от оксида хрома Сг2O3или оксида меди СuО), фиолетовый (от оксида марганца Мn2O3), розовый(от селена). Применялись и «глушители» (соединения фосфора, мышьяка, сурьмы),придававшие стеклу матовую белизну. Молочное стекло, например, получали,добавляя в стеклянную массу касситерит (оксид олова). Рецепты соединений,интенсивно окрашивающих стекло, сохранялись в строжайшей тайне и передавалисьпо наследству из поколения в поколение.
Цветные стекла не утратили своего значения и в нашидни. Рецептура получения цветных стекол непрерывно расширяется.
В начале XX в. сталиприменяться соединения селена, которые окрашивают стекло в красные, розовые иоранжевые тона. После внедрения в 30-х гг. оксидов редкоземельных элементов впромышленности палитра художественного стекла значительно расширилась – былаполучена недостижимая ранее полутоновая окраска всех цветов спектра.
При фотографических работах требуется красное освещение,поэтому применяют стекла, содержащие ничтожное количество мелкодисперсногозолота. При медленном охлаждении стекла, мельчайшие частицы золота равномернораспределяются по всей массе расплава. Вкрапленные частицы неразличимы даже вмикроскоп, но окрашивают стекло в интенсивно красный цвет. Такое стекло носитназвание рубинового. Из рубинового стекла сделаны пятиконечные звезды Кремля.Площадь остекления каждой звезды составляет около 6 м2. Интересно отметить,что поверхность звезды состоит из трех слоев: стекла: рубинового, хрустальногои молочно-белого. Верхний слой – рубиновое стекло разных оттенков. Этопозволяет оттенить лучистую форму звезд. Внутренний слой – молочно-белоестекло. В дневное время красное стекло, освещенное снаружи, а не на просвет,кажется почти черным. Прослойка молочного стекла отражает большую частьдневного света, смягчая темноту рубинового стекла. Кроме того, молочно-белоестекло хорошо рассеивает свет ламп накаливания, размещенных внутри звезды.Промежуточный слой – хрустальное стекло – придает остеклению прочность. Ведь навысоте башен Московского Кремля очень сложные атмосферные условия: град,ураганный ветер и т. д.
Введение в стекло оксида алюминия А12О3вместо оксида кремния (IV) придает стеклу повышеннуюмеханическую прочность. Из такого стекла изготавливают специальные бутылки длянасыщенных углекислым газом напитков (шипучих). Они могут выдерживать давлениедо 2´106-3´106 Па. В 1926-1928гг. при разработке промышленного способа получения синтетического каучукасоветский химик С.В.Лебедев исследовал реакцию полимеризации бутадиена СН2= СН—СН = СН2 под давлением. В эти годы в Советском Союзе ощущаласьнехватка в химическом лабораторном оборудовании. В качестве реактораС.В.Лебедев использовал бутылки из-под шампанских вин.
Стекла, защищающие от инфракрасных, ультрафиолетовыхи чрезмерно ярких видимых лучей, получают, вводя различные красители. Такиестекла применяют как защитные приспособления при сварочных работах, вметаллургии и пр. В некоторых случаях ставится противоположная задача – надо непоглощать, а, наоборот, хорошо пропускать те или иные лучи. С этой цельюприменяются увиолевые стекла. Они свободно пропускают ультрафиолетовые лучи,которые поглощаются обычными стеклами. Такими стеклами остекляют окна больниц,санаториев, оранжерей. Из них изготавливают лабораторное оборудование. Дляполучения увиолевого стекла используют известково-натриевые составы. Оксидовжелеза в стекле должно быть не более 0,01%.
Специальные стекла, устойчивые к различного родарадиоактивным излучениям и потокам медленных нейтронов, получают, вводя в ихсостав элементы с высоким порядковым номером – свинец, висмут, вольфрам и др.Стекло, в котором практически отсутствует отражение (невидимое стекло), создалипольские специалисты из г. Зелена Гура. Такие стекла необходимы как в науке итехнике, так и в быту. Например, световые блики и отражения часто мешаютпрочесть надпись за стеклом шкалы прибора, рассмотреть картину и т. д.
Много затрачено сил, времени и средств учеными всего мира длясоздания световодов – стеклянного волокна высокой прозрачности, отражающеголучи света от внутренней поверхности. Луч света, проходя по такому волокну, невыходит за его пределы и может быть использован для передачи информации. Наоснове оптического волокна выпускаются детали приборов для радиоэлектронной,приборостроительной и других отраслей промышленности. Трудно оценитьперспективу использования световодов. Световой жгут для телефонной связиобеспечит 2000 телефонных переговоров одновременно. Можно транслироватьодновременно две цветные телепередачи. С помощью световодов стало возможнымпроводить ранее недоступные медицинские исследования внутренних поверхностейорганов, моделировать нервную систему высших животных и человека. Изстекловодов делают «иглы», используемые для световых микроуколов ядра живойклетки.
Весьма перспективны работы по применению волоконнойоптики в электронно-вычислительных устройствах. Их назвали ОВМ (оптическиевычислительные машины) в отличие от обычных ЭВМ. Благодаря им появиласьвозможность введения в ОВМ прямой информации – речи, изображения, текста и пр.
Кремнийорганические соединения
Химия кремнийорганических соединений представляет собойбольшой раздел современной науки. К числу важнейших химических продуктов,необходимых для народного хозяйства (смазки, смолы, лаки, каучуки и т. д.),относятся мономерные и полимерные кремнийорганические соединения. Первое кремнийорганическоесоединение было получено в 1845 г. французским химиком Ж. Эбельменом.Взаимодействием тетрахлорида кремния и этилового спирта он получил этиловыйэфир ортокремниевой кислоты (тетраэтоксисилан, этилсиликат Si(ОС2Н5)4).Далее были получены четырехзамещенные органические соединения кремния с общейформулой SiR4 и другие соединения.
/>Средиученых господствовало представление о полном сходстве соединений кремния иуглерода. Считалось, что замена атомов углерода в органических соединенияхатомами кремния не приводит к существенному изменению свойств органическихсоединений кремния. В этот период Д.И. Менделеев опубликовал несколько работ похимии кремния и кремнийорганических соединений. Его диссертация на званиеприват-доцента, не утратившая своей ценности до настоящего времени, называлась«О строении кремнеземистых соединений» (1856 г.). Д.И. Менделеев первым изхимиков показал, что кремний в отличие от углерода способен образовывать скислородом продукты полимерной структуры (рис.4). Такие полимеры содержат всвоем составе чередующиеся связи кремний — кислород (силоксановые связи).
Д.И. Менделеев заложил основы химии кремнийорганическихсоединений. Он детально изучил открытую ранее Ж. Эбельменом реакцию образованиятетраэтоксисилана, установил правильное строение этого соединения ичетырехвалентность кремния, а также определил ряд физических констант. Уделяябольшое внимание химии кремнийорганических соединений. Взглядов Д.И. Менделеевана строение кислородных соединений кремния придерживались А.М. Бутлеров,Н.А.Меншуткин и другие русские химики. За рубежом работы Д.И. Менделеева этогопериода были или неизвестны, или непоняты.
В истории развития химии кремнийорганических соединенийведущая роль принадлежит нашей отечественной науке. Началом современногоразвития химии высокомолекулярных кремнийорганических соединений являетсяразработка академиком К.А. Андрияновым с сотрудниками способа синтезакремнийорганических смол (1937 г.) и освоение промышленного производствакремнийорганических полимеров. Сразу резко возрос интерес кэлементоорганическим соединениям этого класса. В настоящее время синтезированонесколько тысяч кремнийорганических соединений, изучены их физико-химическиесвойства, методы синтеза и области их практического применения.
Все кремнийорганические соединения условно разделенына две большие группы — низкомолекулярные и высокомолекулярные соединения. Изних практическое значение получили не кремнийорганические соединения c цепями кремний – кремний (силаны), а соединения, содержащиецепи кремний — кислород (силоксаны). Чем объяснить преимуществакремнийорганических соединений, содержащих силоксановые цепи?
Связь кремния с кремнием в кремнийорганических соединенияхтермически неустойчива. Нагревание соединений, содержащих эту связь, до 200-250°С приводит к их полному разложению. Силоксановая связь отличается высокойтермической стойкостью. В зависимости от состава и строения кремнийорганическихсоединений их термическая стабильность находится в пределах 300-500 °С. Вхимическом отношении связь кремний — кислород значительно устойчивее связикремний — кремний. Она разрушается только при взаимодействии с фтором, сернойкислотой и крепкими щелочами при нагревании.
Кремнийорганические мономерные соединения являются важнейшимиполупродуктами для синтеза кремнийорганических полимеров. Исходным доступнымсырьем для получения кремнийорганических мономерных соединений являютсякремний, кремнезем, кокс, хлор, хлороводород и т. д. Наибольшее распространениеполучили методы получения кремнийорганических мономеров из кремнезема черезтетрахлорид кремния и из кремнезема через элементарный кремний. Структуракремнийорганических полимеров аналогична структуре кварца и силикатов, онитакже обладают большой термической стойкостью. Разница в структурах – наличиеорганических радикалов у кремнийоргакических полимеров, которые придают высокуюэластичность молекуле полимера. Оксид кремния (IV) исиликаты также имеют полимерное строение.
Кремнийорганические мономеры в основном используют дляполучения полимеров, но они находят также и самостоятельное применение. Из нихосновное промышленное значение имеет этиловый эфир ортокремниевой кислоты Si(OC2H5)4(этил-силикат) – связующее вещество при получении цементов, керамики, красящихвеществ. После пропитки этилсиликатом тканей, кож, ваты, бумаги, дерева,асбеста, гипса, бетона и т. д. эти материалы становятся водонепроницаемыми именее горючими. Этилсиликат применяют также для приготовления специальныхклеев. Этиловый эфир ортокремниевой кислоты используют для полученияжаростойких литейных форм в производстве точного литья.
Кремнийорганические жидкости могут быть получены с широкимдиапазоном температур кипения и вязкости. Их вязкость очень мало изменяется винтервале температур от –70 до +250 °С.
Температура замерзания большинства кремнийорганическихжидкостей около –70 °С (иногда –130 °С и ниже), в то время как у нефтяных маселс той же температурой кипения она составляет от –20 до –40 °С.
Полиорганосилоксановые жидкости термически стабильны. Они неизменяют цвета и практически не окисляются кислородом воздуха при длительномнагревании до 200 °С. В атмосфере инертных газов, а также на воздухе вприсутствии ингибиторов они устойчивы и при более высоких температурах.
Кремнийорганические смолы – бесцветные или от желтого докоричневого цвета продукты. Они хорошо растворимы во многих органическихрастворителях, и их растворы используются как лаки. Кремнийорганические смолыобладают исключительно высокой термической устойчивостью и стойкостью кокислению.
Ранее использовали различные способы повышения водостойкостиматериалов путем нанесения на их поверхность защитных покрытий или пропиток.Однако подавляющее большинство предложенных составов имели существенныенедостатки: одни изменяли внешний вид обрабатываемой поверхности, другиеухудшали физико-химические и механические свойства обрабатываемого материалаили значительно увеличивали его массу; пористые материалы становились воздухонепроницаемымии т. д.
В настоящее время найдена лишенная этих недостатковвозможность повышения водостойкости материалов, заключающаяся в обработкепоследних различными кремнийорганическими соединениями. Обработанныекремнийорганическими соединениями материалы не смачиваются ни водой, ни воднымирастворами. Пористые материалы после обработки кремнийорганическнмисоединениями перестают впитывать в себя воду, а их воздухопроницаемость приэтом практически не изменяется. Такое действие кремнийорганических соединенийобусловлено появлением на поверхности обработанного материала тончайшейполимерной пленки толщиной 3´10–6 см.
Водоотталкивающие свойства можно придать бумаге введениемкремннйорганической жидкости непосредственно в бумажную массу передизготовлением из нее бумаги (проклейка бумаги). Такая бумага удерживает наповерхности чернильные штрихи без пропускания чернил на оборотную сторону и безрастекания их по ее поверхности. Текстильные ткани, пропитанные кремнийорганическимижидкостями, становятся непромокаемыми, к ним не пристают чернила и другиежидкости. Вода на поверхности такой ткани собирается в виде шариков и стекает снее. Даже струя воды не смачивает обработанную кремнийорганикой ткань.
Широко применяют кремнийорганические жидкости в качествесмазок самого различного назначения. Они обеспечивают длительную работу машин имеханизмов как при низкой (до –70°С), так и при высокой (до +260 °C) температуре. Замечательной особенностьюкремнийорганических соединений – масел – является постоянство вязкости вшироком интервале температур. Испытания кремнийорганических жидкостей наподопытных животных, а затем и на людях показали, что они безвредны. Поэтомукремнийорганические жидкости стали использовать для приготовления кремов, мазейи других косметических препаратов. В литературе имеются указания на возможностьиспользования кремнийорганических жидкостей в качестве растворителей, лекарств,применяемых для внутримышечного вливания, и в качестве среды для стерилизациихирургических инструментов. В последнем случае инструмент во время стерилизацииодновременно и смазывается.
Интенсивно расширяется сфера применения кремнийорганическихсмол, лаков и каучуков. Высокая теплостойкость кремнийорганических смол,устойчивость к действию влаги, кислорода, озона, солнечного света, а такжевысокие защитные свойства и диэлектрические характеристики кремнийорганическихлаковых пленок обеспечили их широкое применение в хозяйстве. Из каучуковспециального назначения большой интерес представляют кремнийорганическиекаучуки, ставшие незаменимыми во многих областях современной техники.Характерными свойствами, выгодно отличающими полиоргано-силоксановые каучуки отуглеводородных, являются термо- и морозостойкость, высокие изоляционные идиэлектрические свойства, химическая стойкость и многие другие.
Кремнийорганические каучуки нашли также применение в качестветермостойких клеев для склеивания стекла, стали, алюминия, латуни и т. п., атакже для склеивания каучуков и резин друг с другом. Синтетическийкремнийорганический клей при сборке крупных металлических сооружений заменяетзаклепки, позволяет обходиться без сварки деталей. В городе Брно (Чехословакия)построен мост, детали которого скреплены с помощью этого клея. В настоящеевремя разработаны новые виды кремнийорганических каучуков сбензомаслостойкостью, сохраняющие эти свойства как при низких, так и привысоких температурах.
В человеческом организме кремний содержится повсеместно, нобольше всего – в костях, коже, соединительной ткани, а также в некоторыхжелезах. При переломах костей содержание кремния в месте перелома повышаетсяпочти в 50 раз. Минеральные воды с высоким содержанием кремния оказываютблаготворное влияние на здоровье людей, особенно пожилых. С возрастомсодержание кремния в организме существенно уменьшается, поэтому у пожилых людеймедленнее срастаются сломанные кости.
Но, с другой стороны, давно известно серьезное заболевание –силикоз, вызываемое длительным вдыханием пыли, содержащей свободную двуокиськремния. Некоторые кремнийорганические соединения оказались токсичными для всехтеплокровных организмов.
Кремниевая жизнь
Еще нескольколет тому назад американский профессор астрономии Том Голд высказал убеждение втом, что внутри Земли могла зародиться жизнь, основанная на кремнии и неимеющая ничего общего с привычными нам формами организмов. Научный мир отнессяк его гипотезе прохладно. А сегодня уже открыто и абсолютно доказаносуществование на Земле кремниевой формы жизни.
Уникальныйматериал, подтверждающий наличие кремниевой формы жизни на Земле, которую автороткрытия назвал Крей, опубликован А.А. Боковиковым. Его открытие было изучено вТомском отделении минералогического общества РАН (ТОМО РАН) и получилоположительное заключение. К докладу прилагались 24 цветные фотографии, накоторых можно было видеть различные этапы развития агатов и даже «рождение»маленького агатика.
В течение семилет А. Боковиков собирал и исследовал агаты – не мертвые камни, а, как былодоказано им, живые организмы со многими признаками, свойственными белковойформе жизни, в частности:
Ø Четко выраженная анатомия кремниевых организмов
Ø Наличие полов
Ø Размножение семенами и отпочкованием
Ø Внутрикаменное развитие зародыша
Ø Наличие кожи
Ø Линька кожи
Ø Регенерация кожи
Ø Залечивание ран, трещин, сколов
Ø Кристаллическое тело – хранилище наследственной информации
Чрезвычайноинтересны наблюдения автора. Агат имеет четко выраженную анатомию: на цветныхфотографиях, сделанных в ходе исследований, хорошо видно кожу, полосатое тело,кристаллическое тело. В данном случае кожей названа внешняя оболочка; полосатоетело – это мужское тело, а кристаллическое – женское. Последние — это, поутверждению автора, гены агатов. Причем наличие полов в крее определеноисследователем с большой достоверностью. Так, возникновение и развитиезародышей агата происходит только в кристаллическом теле и никогда полосатом.Автор предположил, что вокруг яйцеклетки, как и других биологических структур,существует биополе. Одна из разновидностей биополя – лазерное поле, способноеизлучать не только свет, Нои звук. На акустические колебания клетка накладываетгенетическую информацию, которая может осуществить партеногенез, т. е. половоеразмножение без оплодотворения яйцеклетки. Способностью звука переноситьгенетическую информацию объясняется и появление зародышей кремниевых организмоввнутри целого и монолитного куска базальта. При повреждении поверхности агатапоявившиеся царапины и трещины вскоре затягиваются, сколы разравниваются, хотяот них остаются следы.
Другиеисследования показали, что глины тоже обладают признаками жизни. Л. Койн изКалифорнийского университета в Сан-Хосе нашла, что каолинитовые глины могутсобирать энергию, которая выделяется при радиоактивном распаде, из окружающейсреды, сохранять ее и высвобождать в тех случаях, когда структура глинынарушается определенным образом, например при ее смачивании или высушивании.
Но это не все.Были обнаружены морские губки, образующие колонии на большой глубине. Их основа– кремниевые полимеры. Эти губки растут, питаются и размножаются без привычныхдля нас белковых структур. То, что эти организмы развивались на глубине, т. е.под давлением, и практически без света, доказывает особенность кремниевойжизни. Для других морских организмов – радиолярий, диатомей, морских звезд –диоксид кремния составляет основу скелета. Растениям кремний придает прочность,так как входит в состав механической ткани. Чем жестче стебель растения, тембольше кремния находят в его золе.
Встает вопрос:а имеет ли крей перспективу развития на Земле? Ведь существующие кремниевыеформы жизни находятся на сравнительно низкой ступени эволюции, в то время какнаша планета заселена развитыми белковыми существами. Я считаю, что этовозможно, так как крей имеет другие состав и структуру, и, следовательно, кремниеваяжизнь вообще не будет конкурировать с белковой. У них будут разные местаобитания, пища. Но, возможно, крей не сможет развиваться в земных условиях, итогда вопрос о конкурентоспособности отпадает.
www.ronl.ru
Реферат на тему “Кремний, его свойства и применение в современной микроэлектронике”
Содержание
Введение1. Кремний2. Получение кремния для подложек интегральных схем3. Физические и химические свойства4. Физика и химия полупроводников5. Применение кремния в современной микроэлектроникеЗаключениеСписок использованных источников
Введение
“…Кремний вырисовывается в мироздании как, элемент, обладающий исключительным значением”, – В. И. Вернадский.
Начиная с конца 1950-х гг., кремний становится ведущим полупроводниковым материалом благодаря успешному развитию методов зонной плавки для очистки полупроводников. По распространенности он второй элемент после кислорода. Кремний является основным компонентом ИС, транзисторов.
Чистый кремний (примесей может быть меньше 10%) — важнейший полупроводник, основа современной микроэлектроники, так как обладает уникальными свойствами: кремний технологичен, инертен в обычных условиях, выдерживает высокие температуры, сопровождающие процесс изготовления приборов и интегральных схем. Для создания диэлектрических слоев нет необходимости специально искать диэлектрические материалы – собственный окисел SiO2, формируемый на кремнии, выполняет Изолирующие и маскирующие функции. Его запасы практически безграничны.
1. Кремний
Кремний (лат. Silicium)
Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. В природе элемент представлен тремя стабильными изотопами: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%).
Нужна помощь в написании?
Историческая справка. Соединения К., широко распространённые на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений К., связанное с их переработкой, — изготовление стекла — началось около 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение К. — двуокись SiO2 (кремнезём). В 18 в. кремнезём считали простым телом и относили к «землям» (что и отражено в его названии). Сложность состава кремнезёма установил И. Я. Берцелиус. Он же впервые, в 1825, получил элементарный К. из фтористого кремния SiF4, восстанавливая последний металлическим калием. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название ввёл Г. И. Гесс в 1834.
Чаще всего в природе кремний встречается в виде кремнезёма – соединений на основе кремния SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния – это песок, кварц, полевые шпаты. Вторую по распространенности в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Кремний никогда не встречается в свободном состоянии в виде простого вещества, он всегда связан с кислородом и, за несколькими исключениями, всегда имеет координационное число 4. Структурные единицы {Si04} могут существовать в виде отдельных частиц или соединяться, образуя цепи, ленты, кольца, слои или трехмерные каркасы
2. Получение кремния для подложек ИС
Существуют поли- и монокристаллы кремния. Поликристалл состоит из множества монокристаллических зёрен с разной ориентацией, тесно примыкающих друг к другу. В поликристалле отсутствует регулярность структуры (анизотропия свойств). Монокристалл кремния представляет собой сплошную упорядоченную структуру с анизотропными свойствами (анизотропные свойства – это зависимость электрических, механических и химических свойств от направления кристаллической решётки).
Технология изготовления монокристаллов полупроводникового кремния состоит из следующих этапов:
- Получение технического кремния;
- Превращение кремния в легколетучее соединение, которое после очистки может быть легко восстановлено;
- Очистки и восстановления соединения, получения кремния в виде поликристаллических стержней;
- Конечной очистки кремния методом кристаллизации;
- Выращивания легированных монокристаллов кремния.
Сырьем для получения кремния служит чистый диоксид кремния, который восстанавливают углеродом в печах при температуре около 1700 °С. Однако чаще кремний получают в виде сплава с железом (ферросилиций) или магнием. Ввиду того, что очи-стка технического кремния очень сложна, его обычно переводят в легколе-тучие производные (SiCl4; SiHCl3, Sih5), которые подвергают глубокой ректификационной очистке. Из указанных соединений получают кремний сырец. Соответственно существуют три способа его получения.
В печи происходит ряд промежуточных реакций. Результирующая реакция может быть представлена в виде
SiC(тв) + SiO2(тв)→Si(тв) + SiO2(газ) + CO(газ)
Технический кремний содержит 98. . .99% Si, 1. . .2% Fe, Au, B, P, Ca, Cr, Mg, Ni, Ti, V, Zn и др.
Современная технология производства поликристаллического кремния основана на процессе водородного восстановления трихлорсилана, восстановления тетрахлорида кремния цинком и пиролиза моносилана. Большую часть кремния (около 80%) получают путём водородного восстановления трихлорсилана (ТХС). Достоинства этого процесса – лёгкость и экономичность ТХС, эффективность очистки ТХС, высокое извлечение и большая скорость охлаждения кремния (извлечение кремния при использовании тетрахлорида кремния составляет 15%, а ТХС – не менее 30%), меньшая себестоимость продукции. ТХС обычно добывают путём гидрохлорирования кремния: взаимодействиятехнического кремния с хлористым водородом или со смесью газов, содержащих хлористый водород, при температуре 260…400ºС. ТХС содержит большое количество примесей, очистка от которых представляет сложную задачу.
Технически и экономически конкурентоспособным по сравнению с рассмотренным является метод получения поликристаллического кремния путём разложения силана Sih5 высокой частоты. Путём сплавления технического кремния и магния в водороде при 550 ºС получают силицид магния Mg2Si, который затем разлагают хлоридом аммония по реакции Mg2Si + 4Nh5Cl → Sih5 +2MgCl2 + 4Nh4 в среде жидкого аммиака при температуре 30 ºС. Отделяемый моносилан далее поступает на ректификационную очистку, в результате которой содержание примесей снижается до уровня менее 10-8…10-7%.
Очищенный ТХС восстанавливают и в результате получают поликристаллический кремний в атмосфере водорода на поверхности разогретых кремниевых стержней – основа диаметром 4. . .8 мм (иногда 30 мм):
SiHCl3(г) + h3(г) → Si(г) + 3HCl(г)
Получение поликристаллических стержней кремния путем термического разложения моносилана Sih5 производится по аналогичной методике при температурах 1000 °С. Образующийся при разложении водород Sih5(Г) → Si(T) + 2Н2(Г) обладает высокой степенью чистоты и используется в сопутствующем производстве. В результате поликремний обладает более высокой степенью чистоты, чем кремний, получаемый восстановлением ТХС.
Далее методом Чохральского получают монокристаллы кремния, из которых основная часть используется для производства интегральных микросхем; незначительная часть (около 2%) идет на изготовление солнечных элементов. Метод эффективен для изготовления приборов, не требующих высоких значений удельного сопротивления (до 25 Ом · см) из-за загрязнения кремния кислородом и другими примесями.
3. Физические и химические свойства
Физические свойства кремния
Кремний, как и германий, образует твёрдые ковалентные кристаллы со структурой алмаза. Температура плавления кремния 1421 ºС. Постоянная решётки а = 0,543 нм, плотность кристаллов 2320 кг/м3. Кремний значительно легче германия, а также несколько темнее и прочнее. Подвижность электронов и дырок в монокристаллическом кремнии при комнатной температуре составляет μn=1500 см2/В с; μp=480 см2/В с. Как и в германии, в кремнии существуют два типа дырок: лёгкие с mл* = 0,16m и тяжёлых mт*=0,49m. Ввиду сравнительно большого значения ширины запрещённой зоны, удельное сопротивление чистого кремния, обладающего собственной проводимостью, составляет около 105 ом см. Такой кремний должен содержать примесей не более чем 108 см-3.
Кремний является пьезоэлементом, и для него характерен как прямой, так и обратный пьезоэффект.
Прямой пьезоэффект – это процесс образования равных, но противоположных по знаку электрических зарядов на противоположных гранях некоторых кристаллических тел, называемых пьезоэлектриками, при давлении на эти тела.
Обратный пьезоэффект – это процесс сжатия или расширения пьезоэлектрика под действием электрического поля в зависимости от направления вектора напряженности поля. На этом физическом явление основан принцип работы кварцевых часов, кварцевый резонатор и др.
Химические свойства кремния
При комнатной температуре кристаллический кремний обладает малой реакционной способностью и реагирует только со фтором:
Si + 2F2 = SiF4.
Взаимодействие с другими элементами, в том числе с кислородом и галогенами, протекает только при нагревании до 500-600 ºС:
Si + 2Cl2 = SiCl4.
Образование диоксида SiO2 является экзотермической реакцией и сопровождается выделением значительного количества теплоты:
Si + O2 = SiO2; ΔHº = -911 кДж
Кремний при высоких температурах обладает большим сродством к кислороду и к кислородсодержащим соединениям проявляет сильные восстановительные свойства. Например:
2h3O(г) + Si(кр) = SiO2(кр) + 2h3(г), ΔHº = -427 кДж, ΔSº = -98 Дж/K,
Кремний по отношению к оксидам – гораздо более сильный восстановитель, чем водород.
С водными растворами обычных кислот кремний не реагирует, а кислоты-окислители пассивируют его, поскольку слой диоксида кремния не растворяется в кислотах. Однако кремний реагирует со смесью азотной и плавиковой кислот, так как согласно по принципу Пирсона объединяет “жёсткую” кислоту (Si4+) и “жёсткое” основание (F–).
3Si +4HNO3 +18HF = 3h3[SiF6] +4NO↑ +8h3O
В щелочах диоксид растворим, и в присутствии ионов гидроксида кремний легко реагирует с водой даже, если pH раствора равен всего 8-9. В этих условиях реакция идёт фактически с образование SiO2, а анионы OH– играют роль катализатора, препятствующего образованию плотной плёнки на поверхности:
2h3O + Si = SiO2 + 2h3↑
В более концентрированных щелочах при pH = 11 – 14 происходит растворение SiO2 и реакция идёт иначе:
h3O + Si + 2NaOH = Na2SiO3 + 2h3↑
4. Физика и химия кремния
В сверхчистом (полупроводниковом) кремнии между высшими занятыми энергетическими уровнями (валентная зона) и низшими свободными (зона проводимости) существует запрещенная зона. Валентная зона полностью занята, зона проводимости свободна, уровень Ферми EF (энергетический уровень, вероятность заполнения которого равна 1/2) располагается приблизительно посередине между ними, и вещество при комнатной температуре является изолятором. Если кремний легирован элементом 15-й группы (Р, As или Sb), каждый атом легирующей добавки вносит «избыточный» электрон; эти электроны могут быть переведены в зону проводимости посредством термического возбуждения или за счет поглощения фотонов: вещество является полупроводником n-типа с энергией активации ΔЕn (n обозначает носители отрицательного заряда, т.е. электроны). Напротив, легирование элементами 13-й группы (В, Аl или Ga) приводит к появлению акцепторных уровней, которые могут служить ловушками для возбужденных электронов из заполненной валентной зоны: вещество является полупроводником р-типа, носителями заряда служат положительные дырки в валентной зоне.
Если полупроводник n-типа на основе Si соединить с полупроводником р-типа, то образующийся p-n-переход имеет общий уровень Ферми: электроны начинают переходить от п- к р-образцу, а дырки в обратную сторону, и таким образом из-за пространственного разделения зарядов возникает разность потенциалов V0. следовательно, р-п-переход может действовать как диод для выпрямления переменного тока, так как ток в одном направлении проходит легче, чем в другом. На практике большие p-n-переходы могут достигать 10 мм2, в то время как в интегральных схемах их площадь не превышает 10 мм2 (т.е. квадрат со стороной 10 мкм).
Транзистор, или n-p-n-переход состоит из двух частей n-полупроводника на основе Si, разделенных тонким слоем слабого р-полупроводника. Если эмиттер смещен на небольшой потенциал в прямом направлении, а коллектор на больший потенциал в обратном направлении, это устройство работает как триод-усилитель.
Промышленное производство мельчайших, устойчивых в работе транзисторов на основе монокристаллов — это триумф методов твердотельного химического синтеза.
- Маленькую пластинку монокристаллического кремния n-типа окисляют путем нагревания в О2 или парах Н2О, при этом на поверхности образуется тонкий слой SiO2.
- Этот оксидный слой покрывают фоточувствительной пленкой, называемой фоторезистом.
- На фоторезист помещают маску и подвергают его облучению ультрафиолетом, при этом облучению подвергается только открытая часть фоторезиста; облученный фоторезист затем удаляют действием кислоты, в результате остается требуемая часть прочного оксидного покрытия.
- Незащищенные участки Si подвергают травлению плавиковой кислотой (HF), оставшийся фоторезист также удаляется.
- Поверхность обрабатывают парами элемента 13-й группы, примесные атомы диффундируют в незащищенные участки и образуют слой Si р-типа.
- Стадии 1-5 повторяют с другой маской, и новые участки обрабатывают парами элемента 15-й группы, при этом образуется слой Si n-типа.
- Наконец, поверхность подвергается повторному окислению с новой маской и затем повторному травлению, на образующиеся открытые участки осаждают металл, чтобы соединить п- и р-участки в интегральную схему.
Этим методом можно производить невероятно маленькие p-n-диоды и n-p-n-транзисторы. Например, в запоминающих устройствах компьютеров микрочип может хранить свыше 105 бит информации.
5. Применение кремния в современной микроэлектронике
Кремний основной материал современной электронной техники. Он идёт на изготовление практически всех существующих в настоящее время полупроводниковых приборов (транзисторов, тиристоров, диодов и др.) и изделий микроэлектроники – интегральных устройств. Интегральные микросхемы (ИМС) – основное изделие в использовании кремния в настоящее время. Кремниевые ИМС и микропроцессоры являются основными компонентами вычислительной техники и автоматики. Кремний активно используется в солнечных батареях, непосредственно трансформирующих излучение солнца в электричество. Так же используется в кварцевых резонаторах, кварцевых часах и во многих других приборах.
Список использованных источников
1. Химическая энциклопедия: в 5-ти тт. / Редкол.:Кнунянц И. Л. (гл. ред.). — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 508. — 671 с. — 100 000 экз.2. Химия элементов : в 2 томах. / Н. Гринвуд, А. Эрншо ; пер. с агл. – М. : БИНОМ. Лаборатория знаний, 2008. – (Лучший зарубежный учебник), 607 с. : ил.3. Кремний — элемент жизни. Экология и медицина. – СПб.: «Издательство «ДИЛЯ», 2008. – 448 с. Серия «Исцелит тебя Надежда!»4. Общая химия: Учебник для вузов. – 4-е изд., исправл. – СПб: Химиздат, 2000. – 624 с.: ил.5. Общая и неорганическая химия : учеб. для вузов : в 2 т. / под редакцией А. Ф. Воробьёва – 544 с.: ил.6. Ежовский Ю. К. Введение в технологию материалов электронной техники: учебное пособие. – СПб.: СПбГТИ (ТУ), 2012. – 108c.7. Технологические основы производства полупро-водниковых интегральных схем: учебное пособие / М.Ф. Жаркой; Балт. гос. техн. ун-т. – СПб., 2016. – 123 с.8. Жидкий кремний: новая перспектива микроэлектроники // Портал: ZOOM CNews – [Электронный ресурс]. URL http://zoom.cnews.ru/rnd/news/top/zhidkij_kremnij_novaya_perspektiva_mikroelektroniki (Дата обращения 10.11.2016)
nauchniestati.ru
Реферат на тему Кремний
Коробецкая Анастасия 10А класс КРЕМНИЙНаучный руководитель: Сукачева Т.А.| Ядро: возможна большая доля силикатов |
| Земная кора: глины, граниты, базальты, полевые шпаты. |
| Верхняя мантия: силикаты железа и магния (около 90%) |
| Нижняя мантия: предполагается силикатный состав |
| Рис.1 Содержание кремния в различных слоях Земли |
 |
| Si +14 2) 8) 4) |
| Рис.2 Электронное строение атома углерода и его внешнего электронного слоя с валентностью равной: а) двум; б) четырем |
| Рис.3 Схемы строения пироксиновых цепочек |
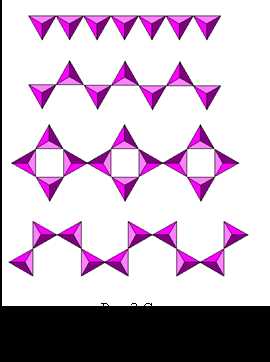 В 1925-1931гг. У.Л. Брегг исследовал кристаллы алюмосиликатов, в том числе и с помощью рентгена. Он предложил структурную классификацию силикатов. По его мнению, силикаты представляли собой полимерные структуры, состоящие из тетраэдров – оксидов кремния, атомов заместивших его. Соединяются они с помощью атомов кислорода, ставших «общими» для двух тетраэдров. Такие атомы кислорода называются мостиковыми, а те, что не участвуют в образовании таких связей – не мостиковыми. Таким образом, создаются связи Si –- O –- Si или Si –- O – Al. Многообразие силикатов объясняется различными способами соединения этих тетраэдров. Брегг предлагал классифицировать силикаты по типам кремнекислородных радикалов: 1. Ортосиликаты [SiO4]4 – У этого радикала все атомы кислорода являются немостиковыми. 2. Островные [Si2O7]6 –, [Si3O8]6 –, [Si4O12]8 –. Два кислорода в каждом тетраэдре служат для образования кольца, а два других являются не мостиковыми. 3. Изолированные [SiO2]2 – и сдвоенные [Si4O11]6 – радикалы образуют бесконечные цепочки 4. Слоистые структуры с радикалами [Si2O5]2 – 5. Каркасные структуры Рассмотрим строение ортосиликата натрия. Его формула 2Na2O ´ SiO2. Данный ортосиликат относится к первой группе. В нем тетраэдры [SiO4]4 – соединены между собой ионами натрия. Представителями силикатов третьей группы являются пироксены с формулой LiAl[Si2O6]. В них один атом кремния из трех заместился на атом алюминия. Пироксены образуют бесконечные цепочки разного строения (рис.3). Строение цепочки определяет свойства пироксена.
В 1925-1931гг. У.Л. Брегг исследовал кристаллы алюмосиликатов, в том числе и с помощью рентгена. Он предложил структурную классификацию силикатов. По его мнению, силикаты представляли собой полимерные структуры, состоящие из тетраэдров – оксидов кремния, атомов заместивших его. Соединяются они с помощью атомов кислорода, ставших «общими» для двух тетраэдров. Такие атомы кислорода называются мостиковыми, а те, что не участвуют в образовании таких связей – не мостиковыми. Таким образом, создаются связи Si –- O –- Si или Si –- O – Al. Многообразие силикатов объясняется различными способами соединения этих тетраэдров. Брегг предлагал классифицировать силикаты по типам кремнекислородных радикалов: 1. Ортосиликаты [SiO4]4 – У этого радикала все атомы кислорода являются немостиковыми. 2. Островные [Si2O7]6 –, [Si3O8]6 –, [Si4O12]8 –. Два кислорода в каждом тетраэдре служат для образования кольца, а два других являются не мостиковыми. 3. Изолированные [SiO2]2 – и сдвоенные [Si4O11]6 – радикалы образуют бесконечные цепочки 4. Слоистые структуры с радикалами [Si2O5]2 – 5. Каркасные структуры Рассмотрим строение ортосиликата натрия. Его формула 2Na2O ´ SiO2. Данный ортосиликат относится к первой группе. В нем тетраэдры [SiO4]4 – соединены между собой ионами натрия. Представителями силикатов третьей группы являются пироксены с формулой LiAl[Si2O6]. В них один атом кремния из трех заместился на атом алюминия. Пироксены образуют бесконечные цепочки разного строения (рис.3). Строение цепочки определяет свойства пироксена.Области применения соединений кремния
Соли кремниевых кислот чрезвычайно распространены в природе в виде руд и минералов. Важнейшими силикатами являются алюмосиликаты, на долю которых приходится более половины массы земной коры. Природные силикаты исчисляются многими сотнями представителей. К ним относят кварц, граниты, полевые шпаты, кристаллические сланцы (слюды), асбест. Кварц – пьезоэлектрик. Где только не находит техническое применение кристалл кварца в виде пластинки! Например, кварцевые часы высокой точности служат для «хранения» точного времени, определяемого астрономическими методами. Точность суточного хода кварцевых часов ±0,001 с. Основной деталью пьезо-кварцевых стабилизаторов длины радиоволн (частоты), преобразователей давления в электрическую величину с точностью ±1,5%, преобразователей электрической энергии в звуковую (громкоговорители и др.) и механическую (микрофоны, шумопеленгаторы, ультразвуковая механика) является пластинка из кварца. Характерная особенность кварцевого стекла – высокая термическая устойчивость. Такое стекло можно сильно нагреть и сейчас же охладить в холодной воде. Это объясняется тем, что у кварцевого стекла коэффициент объемного расширения в 25 раз меньше, чем у обычного стекла. Кварцевое стекло прозрачно как для видимого света, так и для ультрафиолетового. Поэтому из кварцевого стекла изготавливают баллоны кварцевых ламп – источника ультрафиолетовых лучей. Специальные медицинские кварцевые лампы применяют для облучения ультрафиолетовыми лучами для профилактики гриппа, лечения рахита и других заболеваний. Граниты – одна из самых распространенных пород в земной коре – прекрасный строительный и облицовочный материал. Незаменим гранит и для монументальной скульптуры. Отполированный до зеркального блеска, он создает неповторимую игру вкраплений, а необработанная, шершавая поверхность создает особую выразительность, поглощая свет. Полевые шпаты – сырье для керамической, фарфоровой, стекольной, цементной и других отраслей промышленности. В строительстве их применяют в качестве поделочных материалов. Кристаллические сланцы (слюды) обладают высокой термостойкостью и высокими электроизоляционными свойствами и находят применение в электротехнике, радиотехнике. Они также используются как звуко- и теплоизоляционные материалы. Асбест – минерал с волокнистой структурой – теплоизоляционный и огнеупорный материал. Широкое применение находят слоистые минералы – слюды, тальк, каолинит. Драгоценные и полудрагоценные камни – изумруд, топаз, аквамарин – хорошо образованные кристаллы природных силикатов, окрашенные различными оксидами. Искусственные силикаты также играют важную роль в жизни человека. Знакомство человека со стеклом – первым искусственным силикатом – произошло за 3500 лет до н. э. Основной состав оконного стекла Na2´CaO´6SiO2. Однако частичная замена натрия, кальция или кремния на другие элементы позволяет получать разнообразные сорта стекла. Кварцевое, хрустальное, бутылочное, посудное, электроламповое, зеркальное, пористое (пеностекло), защитное, архитектурно-строительное, светотехническое, стекло для световодов и стеклосфер, оптическое, лабораторное – вот далеко не полный их перечень. Вводя внутрь стеклянного листа металлическую сетку, получают армированное стекло. Трехслойное стекло (триплекс) изготавливают склейкой листа пленки с двумя листами стекла. Издавна человек научился применять химические соединения для окрашивания стекла. В древности было известно, что стекло в зависимости от примесей может иметь различный цвет: синий (от оксида кобальта СоО), зеленый (от оксида хрома Сг2O3 или оксида меди СuО), фиолетовый (от оксида марганца Мn2O3), розовый (от селена). Применялись и «глушители» (соединения фосфора, мышьяка, сурьмы), придававшие стеклу матовую белизну. Молочное стекло, например, получали, добавляя в стеклянную массу касситерит (оксид олова). Рецепты соединений, интенсивно окрашивающих стекло, сохранялись в строжайшей тайне и передавались по наследству из поколения в поколение. Цветные стекла не утратили своего значения и в наши дни. Рецептура получения цветных стекол непрерывно расширяется. В начале XX в. стали применяться соединения селена, которые окрашивают стекло в красные, розовые и оранжевые тона. После внедрения в 30-х гг. оксидов редкоземельных элементов в промышленности палитра художественного стекла значительно расширилась – была получена недостижимая ранее полутоновая окраска всех цветов спектра. При фотографических работах требуется красное освещение, поэтому применяют стекла, содержащие ничтожное количество мелкодисперсного золота. При медленном охлаждении стекла, мельчайшие частицы золота равномерно распределяются по всей массе расплава. Вкрапленные частицы неразличимы даже в микроскоп, но окрашивают стекло в интенсивно красный цвет. Такое стекло носит название рубинового. Из рубинового стекла сделаны пятиконечные звезды Кремля. Площадь остекления каждой звезды составляет около 6 м2. Интересно отметить, что поверхность звезды состоит из трех слоев: стекла: рубинового, хрустального и молочно-белого. Верхний слой – рубиновое стекло разных оттенков. Это позволяет оттенить лучистую форму звезд. Внутренний слой – молочно-белое стекло. В дневное время красное стекло, освещенное снаружи, а не на просвет, кажется почти черным. Прослойка молочного стекла отражает большую часть дневного света, смягчая темноту рубинового стекла. Кроме того, молочно-белое стекло хорошо рассеивает свет ламп накаливания, размещенных внутри звезды. Промежуточный слой – хрустальное стекло – придает остеклению прочность. Ведь на высоте башен Московского Кремля очень сложные атмосферные условия: град, ураганный ветер и т. д. Введение в стекло оксида алюминия А12О3 вместо оксида кремния (IV) придает стеклу повышенную механическую прочность. Из такого стекла изготавливают специальные бутылки для насыщенных углекислым газом напитков (шипучих). Они могут выдерживать давление до 2´106-3´106 Па. В 1926-1928 гг. при разработке промышленного способа получения синтетического каучука советский химик С.В.Лебедев исследовал реакцию полимеризации бутадиена СН2 = СН—СН = СН2 под давлением. В эти годы в Советском Союзе ощущалась нехватка в химическом лабораторном оборудовании. В качестве реактора С.В.Лебедев использовал бутылки из-под шампанских вин. Стекла, защищающие от инфракрасных, ультрафиолетовых и чрезмерно ярких видимых лучей, получают, вводя различные красители. Такие стекла применяют как защитные приспособления при сварочных работах, в металлургии и пр. В некоторых случаях ставится противоположная задача – надо не поглощать, а, наоборот, хорошо пропускать те или иные лучи. С этой целью применяются увиолевые стекла. Они свободно пропускают ультрафиолетовые лучи, которые поглощаются обычными стеклами. Такими стеклами остекляют окна больниц, санаториев, оранжерей. Из них изготавливают лабораторное оборудование. Для получения увиолевого стекла используют известково-натриевые составы. Оксидов железа в стекле должно быть не более 0,01%. Специальные стекла, устойчивые к различного рода радиоактивным излучениям и потокам медленных нейтронов, получают, вводя в их состав элементы с высоким порядковым номером – свинец, висмут, вольфрам и др. Стекло, в котором практически отсутствует отражение (невидимое стекло), создали польские специалисты из г. Зелена Гура. Такие стекла необходимы как в науке и технике, так и в быту. Например, световые блики и отражения часто мешают прочесть надпись за стеклом шкалы прибора, рассмотреть картину и т. д. Много затрачено сил, времени и средств учеными всего мира для создания световодов – стеклянного волокна высокой прозрачности, отражающего лучи света от внутренней поверхности. Луч света, проходя по такому волокну, не выходит за его пределы и может быть использован для передачи информации. На основе оптического волокна выпускаются детали приборов для радиоэлектронной, приборостроительной и других отраслей промышленности. Трудно оценить перспективу использования световодов. Световой жгут для телефонной связи обеспечит 2000 телефонных переговоров одновременно. Можно транслировать одновременно две цветные телепередачи. С помощью световодов стало возможным проводить ранее недоступные медицинские исследования внутренних поверхностей органов, моделировать нервную систему высших животных и человека. Из стекловодов делают «иглы», используемые для световых микроуколов ядра живой клетки. Весьма перспективны работы по применению волоконной оптики в электронно-вычислительных устройствах. Их назвали ОВМ (оптические вычислительные машины) в отличие от обычных ЭВМ. Благодаря им появилась возможность введения в ОВМ прямой информации – речи, изображения, текста и пр. Кремнийорганические соединения Химия кремнийорганических соединений представляет собой большой раздел современной науки. К числу важнейших химических продуктов, необходимых для народного хозяйства (смазки, смолы, лаки, каучуки и т. д.), относятся мономерные и полимерные кремнийорганические соединения. Первое кремнийорганическое соединение было получено в 1845 г. французским химиком Ж. Эбельменом. Взаимодействием тетрахлорида кремния и этилового спирта он получил этиловый эфир ортокремниевой кислоты (тетраэтоксисилан, этилсиликат Si(ОС2Н5)4). Далее были получены четырехзамещенные органические соединения кремния с общей формулой SiR4 и другие соединения.| | | – Si – O – Si – O – | |Рис.4 Силоксановые связи |
bukvasha.ru
Реферат - Кремний - Химия
Коробецкая Анастасия 10А класс
КРЕМНИЙ
Научныйруководитель: Сукачева Т.А.
/> /> Кремний – второй по распространенности (после кислорода) элемент земной коры. Вверхних осадочных слоях он содержится в виде глин, кварца и других соединений исоставляет 27,6% состава земной коры… Под осадочным находится слой базальтов игранитов, в состав которых также входит кремний. Эти слои образуют земную коруи находятся на глубине до 35 км. В верхних слоях мантии (до 900 км) преобладаютсиликаты железа и магния. Ядро и нижняя мантия, по предположениям ученых, такжесостоят в основном из силикатов (рис.1).В чистом видекремний в природе не встречается. Наиболее распространен оксид кремния исиликаты. Первый встречается в виде минерала кварца (кремнезем, кремень). Вприроде из этого соединения сложены целые горы. Попадаются очень крупные, до 40т кристаллы кварца. Обычный песок состоит из мелкого кварца с различнымипримесями. Горный хрусталь – совершенно прозрачные кристаллы кварца. Взависимости от примесей он может приобретать различную окраску. Так, оксидымарганца и железа дают фиолетовый оттенок. Это аметист. Желтоватый хрусталь –цитрин, дымчатый – раухтопаз. В нем могут находится и различные включения.Кошачий глаз включает в себя волокнистые материалы, «стрелы Амура» — включенияоксида титана.
Анализ лунногогрунта показал присутствие оксида кремния (IV) вколичестве более 40%. В составе каменных метеоритов содержание кремниядостигает 20%.
Оксид кремния– кремень – сыграл важную роль в истории развития человечества. Именно скремневых наконечников копий, ножей и топориков начинается истории большинстванародов. Позже кремень стал источником огня – путешественники никуда неотправлялись без огнива. А глиняные дома, посуда, предметы быта! Трудносказать, как бы развивался мир без стекла.
В наши дни всеболее необходим становится чистый кремний, как полупроводник. Так называемые«девять девяток чистоты» — 99,9999999% чистого кремния – первое требование кполупроводнику. Ни один из современных компьютеров не существовал бы безкремния. Тоже можно сказать и о ряде других технических средств. Великозначение различных веществ, основой которых являются соединения кремния. Этобетон, керамики, стекло.
В искусствекремний тоже играл большую роль. Большинство драгоценных и полудрагоценныхкамней – соединения того же кремния. И опять же вспоминаются стеклянные,хрустальные и глиняные изделия.
Многое всоединениях кремния остается не до конца понятным. Продолжаются исследования,выдвигаются новые гипотезы. Но многое уже известно. Попробуем разобраться вэтом.
Простое вещество и элементкремний
/> Кремний – второй элемент в IV группе Периодическойтаблицы Д.И. Менделеева. Он находится прямо под углеродом и, следовательно,имеет сходные с ним свойства. На внешнем электронном слое у него четыреэлектрона, из которых в обычном состоянии два не спаренных. У кремниясуществуют соответствующие этому состоянию двухвалентные соединения, например SiO. Но гораздо более естественным при обычных температурахдля кремния является четырехвалентное состояние, при котором один из электронов«перепрыгивает» с s-подуровня на p-подуровень(рис.2).
Внешний электронныйслой у кремния находится дальше от ядра, чем у углерода, сила притяжениявалентных электронов к нему меньше, поэтому свойства кремния ближе кметаллическим. Кристаллический кремний обладает металлическим блеском, являетсяполупроводником. Последнее его свойство объясняется малой прочностьюковалентных связей, существующих между атомами кремния. Они начинаютразрушаться уже при комнатной температуре. При дальнейшем ее повышениивысвобождается большое количество свободных электронов. Полагают, что приабсолютном нуле идеально чистый и правильный кремний должен быть идеальнымэлектроизолятором. Но идеальная чистота и абсолютный нуль недостижимы, поэтомумы обладаем хорошим полупроводником.
В природесуществует три изотопа кремния с массовыми числами 28, 29 и 30. Преобладает(92,27%) легкий изотоп – кремний-28. Известны также несколько радиоактивныхизотопов.
Кремний –активный элемент. В природе он не встречается в свободном виде, и большинствоего соединений очень устойчивы. Несмотря на распространенность кремния вприроде, открыт он был сравнительно поздно. В 1825г. выдающийся шведский химики минералог Якоб Берцелиус сумел в двух реакциях выделить не очень чистыйкремний. Это был аморфный серый порошок. Для этого он восстановил калиемгазообразный тетрафторид кремния SiF4. Новый элементбыл назван силицием (от латинского silex – камень).Русское название появилось спустя девять лет и сохранилось до наших дней.
Кремний, как иуглерод, образует различные аллотропные модификации. Кристаллический кремнийтак же мало похож на аморфный, как алмаз на графит. Это твердое веществосеро-стального цвета с металлическим блеском и гранецентрированнойкристаллической решеткой того же типа, что и у алмаза.
Техническичистый кремний (95-98%) сейчас получают главным образом восстановлениемкремнезема в электрической дуге между графитовыми электродами. Используетсятакже способ восстановления кремнезема коксом в электрических печах. Такойкремний используют в металлургии как раскислитель, связывающий и удаляющий из металлакислород, и как легирующую добавку, повышающую прочность и коррозийнуюстойкость сталей и многих сплавов на основе цветных металлов. В сплавы егодобавляют в небольших количествах: избыток кремния приводит к хрупкости.
Один изспособов получения высокочистого полупроводникового кремния был разработан вовторой половине XIX века русским химиком Н.Н. Бекетовыми был одним из первых способов получения кремния в промышленности. Он основанна реакции между парами цинка и тетрахлорида кремния. Для реакции берутвысокочистые реагенты и проводят ее при 950°С в трубчатом реакторе,изготовленном из плавленого кварца. Элементарный кремний образуется в видеигольчатых кристаллов, которые потом измельчают и промывают соляной кислотой,тоже весьма чистой. Затем следует еще одна ступень отчистки – зонная плавка, илишь после нее поликристаллическую кремниевую массу превращают в монокристаллы.
Есть и другиереакции, в которых получают высокочистый полупроводниковый кремний. Этовосстановление водородом трихлорсилана SiHCl3или четыреххлористого кремния SiCl4 итермическое разложения моносилана, гидрида кремния Sih5или тетраиодида SiI4. В последнем случаеразложение соединения происходит на разогретой до 1000°С танталовой ленте.Дополнительная очистка зонной плавкой следует после каждой из этих реакций.
Соединения кремния
Кремний дает два типа оксидов – оксид кремния (IV) и оксид кремния (II). Оксидкремния (IV) наиболее прочный, не разлагается привысоких температурах и выше 223°С переходит в парообразное состояние. Невосстанавливает его и водород. Более того: сам кремний иногда применяется вкачестве восстановителя, например при получении молибдена:
2MoO3+3Si 3SiO2+2Mo
Поскольку при окислении кремния выделяется громадноеколичество теплоты, оксид кремния (IV) и молибденполучаются в расплавленном состоянии.
В оксиде кремния (IV) молекулнет, так как за счет химической вязи Si—О—Si образуется своеобразный пространственный каркас. Такимобразом, кусок кварца представляет как бы одну гигантскую молекулу. Кварцпредставляет собой неорганический полимер, и его формула (SiO2)n.
Чистый оксид кремния (IV)находится в природе в виде горного хрусталя, кристаллы которого достигаютиногда больших размеров. Самый крупный кристалл, найденный в Казахстане, весил70 т.
В больших количествах в промышленности готовятсиликагель – частично гидратированный оксид кремния (IV).Для его получения на раствор жидкого стекла действуют соляной кислотой:
Na2SiO3+2HCl 2NaCl ´ nh3SiO3
Выпавшую в осадок метакремниевую кислоту отмывают отхлорида натрия водой и высушивают при 170 -180 °С. При этом образуется аморфныйоксид кремния, содержащий небольшое количество химически связанной воды. Поэтомусиликагелю придают условную формулу SiO2 ´ nh3O. Высушенный силикагель может адсорбировать значительноеколичество паров воды, его применяют для осушки газов.
Широко применяется оксид кремния (IV)в промышленности и при научных исследованиях. В виде кварцевого песка егоиспользуют в стекольной промышленности; SiO2– главный компонент силикатных стекол. Кварцевый песок – важнейший строительныйматериал. Кварцевый песок идет в больших количествах для изготовления одного излучших огнеупоров – динаса. Его получают спеканием кварцевого песка, к которомудобавлено 2-2,5% извести. Динас размягчается только при 1700°С, он служит длявыкладки мартеновских печей и различных печей для получения цветных металлов.
Плавленый кварц (SiO2)n дает кварцевое стекло, обладающее интереснымсвойством: оно имеет самый низкий температурный коэффициент расширения, т. е.при нагревании кварцевое стекло практически не расширяется. Поэтому при резкомнагревании или охлаждении посуда из кварцевого стекла не растрескивается.Применяют кварцевую посуду в химических лабораториях. Ее широкомураспространению мешает большая хрупкость и значительные трудности визготовлении (очень высокая температура плавления кварца).
Кремний дает и оксид SiO,который получается взаимодействием оксида кремния (IV)с кремнием:
SiO2+Si2SiO
Оксид кремния SiO – серый порошок,какого-либо применения он не находит. Интересно отметить, что при нагреванииэтот оксид довольно быстро распадается:
2SiO Si + SiO2
Этоуказывает на то, что двухвалентное состояние для кремния не столь характерно,как четырехвалентное.
Соединения кремния с водородом называютсякремневодородами или силанами. Их состав отвечает общей формуле Sinh3n+2 аналогичной общей формуле углеводородов предельногоряда. Простейший представитель этого класса — силан Sih5 — впервые получен немецким химиком Д. Вёлером в 1857 г. Силан и егогомологи (h4Si — Sih4 — дисилан, h4Si — Sih3 — Sih4 — трисилан и т. д.) имеют строение, подобноеметану, этану и пропану. Непредельные силаны, соответствующие по строениюуглеводородам этиленового и ацетиленового рядов, в виде индивидуальныхсоединений пока не выделены. Наиболее просто силаны получаются по методу, разработанномув 1883 г. русскими учеными Н. Н. Бекетовым и А. Д. Чириковым. Метод заключаетсяв разложении силицидов металлов минеральными кислотами:
Mg2Si+4HCl → 2MgCl2+ Sih5
Силан и дисилан — газы с неприятным запахом. Трисилан Si3H8,тетрасилан Si4h20,пентасилан Si5h22и последующие гомологи – при комнатной температуре летучие жидкости снеприятным запахом. Кремневодороды очень ядовиты. В отличие от углеводородовсиланы – неустойчивые соединения. Они самовоспламеняются, иногда взрываются навоздухе, легко разлагаются щелочами и водой в присутствии следов кислот ищелочей:
Sih5 + 2h3O →SiO2+4h3
Кремневодороды термически мало устойчивы и разлагаются накремний и водород уже при 400 °С:
Sih5 → Si + 2h3
Приэтом получается особо чистый кремний.
Неустойчивость кремневодородов подтверждается тем, чтогомологов выше октасилана Si8h28 выделить в свободном состоянии пока неудалось. Силаны являются сильными восстановителями и энергично окисляютсякислородом:
Sih5 + 2O2 → SiO2+ 2h3O
При взаимодействии силанов с галогенами все атомы водородамгновенно (со взрывом) замещаются атомами галогена. Хлор- и бромпроизводныесиланов образуются и при каталитической обработке их хлороводородом илибромоводородом:
Sih5 + HCl → Sih4Cl + h3
Sih4Cl+ HCl → Sih3Cl2 + h3
Sih3Cl+ HCl → SiHCl2+ h3
SiHCl3 + HCl → SiCl4+h3
Для гомологического ряда предельных углеводородов аналогичнаяреакция с НСl или НВг неизвестна. Соединения кремния сводородом представляют большой научный и практический интерес для химиикремнийорганических соединений. Галогениды кремния получают принепосредственном соединении кремния с галогенами, или галогенированием оксидовв присутствии угля:
SiO2 + 2C + 2Cl2 →SiCl4 + 2CO
В лаборатории хлорирование кремния можно проводить встеклянных трубках, имеющих перетяжки. Реакция идет при небольшом нагревании.Жидкий конденсат собирается в колене трубки. Для очистки конденсат нагреваниемперегоняют в следующее колено трубки.
Бромирование и йодирование можно также проводить в стеклянныхтрубках с перетяжками, но для переноса брома или йода используют газ-носитель,например аргон, азот, оксид углерода (IV). Полученныегалогениды гигроскопичны и легко гидролизуются под действием влаги воздуха,поэтому их запаивают в одном из колен трубки.
Нитридами называют химические соединения азота с различнымиэлементами. Для IV группы характерны нитриды и сковалентной связью, и образованные внедрением атомов азота в кристаллическуюрешетку элемента. Нитриды элементов главной подгруппы очень тугоплавкиевещества, обладающие большой твердостью и теплопроводностью. Нитриды довольнотермостойки при нагревании и обладают относительной химической устойчивостью.
Кремний образует нитрид с кристаллической решеткой, в которойатомы азота связаны с атомами кремния ковалентными связями. Такой нитрид имеетформулу, отвечающую обычной валентности элемента, и может рассматриваться какпроизводное аммиака, в котором атомы водорода замещены на кремний – Si3N4.
Общим способам получения нитридов является непосредственноевзаимодействие веществ с азотом или аммиаком:
3Si + 2N2→ Si3N4
3Si + 4Nh4→ Si3N4 +6h3
Реакциюосуществляют при 1000-1200 °С в электрических печах. Применяемые для реакцииазот и аммиак не должны содержать паров воды и кислорода во избежаниезагрязнения нитрида оксидами соответствующих элементов.
Высокая жаропрочность и жаростойкость нитрида кремнияиспользуется при создании сплавов с высокой жаропрочностью для техники высокихтемператур, энергетики и других отраслей. Его исключительная стойкость квоздействию химических реагентов, даже таких, как плавиковая кислота, расплавыщелочей и металлов, в сочетании с огнеупорностью используется в химическойпромышленности. Из него изготовляют футеровку ванн для получения металловэлектролизом расплавленных солей, футерованную арматуру, сопла для распылениярасплавленных металлов, тигли для плавки сверхчистых металлов и т. д.
Метакремниевая кислота h3SiO3 и ортокремниевая кислота h5SiO4 – наиболее распространенные из кислоткремния. Метакремниевая кислота получается взаимодействием силикатов с солянойкислотой или хлоридом аммония:
Na2SiO3 + 2HCl →h3SiO3 + 2NaCl
Na2SiO3 + 2Nh5Cl→ h3SiO3 + 2NaCl + 2Nh4
Свободная метакремниевая кислота известна в виде несколькихформ с переменным содержанием воды. Эта кислота более слабая, чем угольная, онанерастворима в воде, но легко образует коллоидные растворы – золи.Метакремниевая кислота термически неустойчива и при нагревании разлагается:
h3SiO3→ h3O + SiO2
Отщепление воды от нескольких молекул метакремниевой кислотыпроисходит в водном растворе и при комнатной температуре с образованиемпрозрачной студенистой массы – геля кремниевой кислоты. Высушенный гелькремниевой кислоты называют силикагелем.
Силикагель обладает очень большой поверхностью – на 1 гсиликагеля приходится до 400 м2 поверхности – и высокойадсорбционной способностью. Он изготовляется в промышленном масштабе и находитширокое применение для извлечения летучих и пахучих веществ из паров и газов,очистки минеральных масел и нефти, обесцвечивания жидких органическихпродуктов. Силикагель жадно поглощает воду, и это свойство используется присушке газов и жидкостей. Высококачественные сорта силикагеля, не содержащиепримесей, находят применение в медицинской практике. Свободный от примесейсиликагель получают гидролизом силана Sih5,тетрахлорида кремния SiCl4 икремнийорганических соединений – тетраэтоксисилана Si(OC2H5)4и др. Используется силикагель также в качестве носителя катализатора. Введениемзолей кремниевой кислоты в целлюлозные материалы достигается прочность,водонепроницаемость и огнестойкость изделия.
Ортокремниевая кислота получается при гидролизететрахлорида кремния:
SiCl4+4h3O →Si(OH)4+4HCl
По структуре ортокремниевая кислота близка кварцу:атом кремния окружен тетраэдром из четырех атомов кислорода с присоединенным ккислороду водородом. Соли ортокремниевой кислоты также носят названиесиликатов. Соли щелочных металлов кремниевых кислот растворимы в воде, силикатыдругих элементов нерастворимы. Молекулярная масса свежевыделенной кремниевойкислоты (формула Si(OH)4)около 100 у. е. Через несколько дней молекулярная масса кислоты достигнет 1000у. е. и более. Это объясняется чрезвычайной легкостью самоконденсации кислоты,сопровождающейся выделением воды.
Кремний образует кислотные, амфотерные и основныегидроксиды. Все они нерастворимы в воде. Оксид кремния (IV)и оксиды его аналогов с водой практически не реагируют, поэтому получитькислоты этим способом нельзя.
Силикаты – тугоплавкие и пассивные вещества.Большинство их нерастворимо в воде. Они существуют в газообразном, жидком итвердом виде, а также образуют высокодисперсные, или коллоидные, системы сразмером частиц силикатов от 10 – 6 до 10 – 9 м.Коллоидные системы похожи на растворы, но в отличии от них имеют поверхностьраздела между частицами силикатов дисперсионной средой, т. е. средой в которойрастворено вещество. Примерами коллоидных систем являются халцедоны и опалы.Спектр состава силикатов чрезвычайно широк (алюмосиликаты, гидросиликаты и др.)
Для силикатных минералов нет систематических названий,поэтому названия отражают их внешний вид и свойства. Плагиоклаз в переводе сдревнегреческого «косо раскалывающийся», пироксен — «тугоплавкий». Названиятакже даются по именам людей, открывших эти минералы.
В разное время представления о строении силикатов былиразными. Первой научной теорией была поликремниевая. Она играла важную роль всередине XIX в. – 1920-х гг. Согласно этой теориисиликаты есть соли кремниевых кислот. Все кремниевые кислоты можно задатьформулой n SiO2´ m h3O. Примерами служатметакремниевая кислотаh3SiO3(n=1, m=1), ортокремниевая кислота h5SiO4 (n=1, m=2), дикремниевая кислота h3Si2O5 (n=2 m=1), пирокремниевая кислота H6Si2O7 (n=2, m=2).Соответствующие названия силикаты носят и сейчас, хотя поликремниевая теорияуже не пользуется популярностью.
Из-за коллоидного характера силикатов, их нельзяполучить в чистом виде. Поэтому встает вопрос о солеобразной природе силикатов.Но это не все. Рассмотрим два сходных по строению силиката: жадеит Na Al[Si2O6] и лейцитK Al[Si2O6]. Пополикремниевой теории они являются солями метакремниевой кислоты, а,следовательно, должны обладать сходными свойствами. Но по своей природе это двасовершенно разных вещества. Данная теория не объясняет зависимости междусоставом и свойствами веществ, хотя это является основной ее задачей.
Еще Д.И. Менделеев отмечал недостатки этой теории. Онпредполагал изоморфизм в кристаллах силикатов, т.е. способность атомов замещатьдруг друга в кристаллических структурах. Причем это могут быть атомы не толькоодного типа, но и разных. Так, он проявляется в кристаллах алюмосиликатов, хотяалюминий и кремний – разные по типу атомы. Д.И. Менделеев называл подобныекристаллы «неопределенными соединениями», схожими со сплавами, но это сплавы непростых веществ, а близких оксидов. Полимерные соли кремния существуют не из-засуществования полимерных кислот, а из-за полимеризации соединений кремния.Исследования Д.И. Менделеева сыграли важную роль в формировании взглядов на этупроблему.
/>В 1925-1931гг. У.Л.Брегг исследовал кристаллы алюмосиликатов, в том числе и с помощью рентгена. Онпредложил структурную классификацию силикатов. По его мнению, силикатыпредставляли собой полимерные структуры, состоящие из тетраэдров – оксидовкремния, атомов заместивших его. Соединяются они с помощью атомов кислорода,ставших «общими» для двух тетраэдров. Такие атомы кислорода называютсямостиковыми, а те, что не участвуют в образовании таких связей – немостиковыми. Таким образом, создаются связи Si –- O –- Si или Si–- O – Al. Многообразиесиликатов объясняется различными способами соединения этих тетраэдров.
Брегг предлагал классифицировать силикаты по типамкремнекислородных радикалов:
1. Ортосиликаты [SiO4]4 – Уэтого радикала все атомы кислорода являются немостиковыми.
2. Островные [Si2O7]6–, [Si3O8]6–, [Si4O12]8–. Два кислорода в каждом тетраэдре служат для образования кольца, а двадругих являются не мостиковыми.
3. Изолированные [SiO2]2 – и сдвоенные[Si4O11]6– радикалы образуют бесконечные цепочки
4. Слоистые структуры с радикалами [Si2O5]2 –
5. Каркасные структуры
Рассмотрим строение ортосиликата натрия. Его формула 2Na2O ´ SiO2. Данный ортосиликат относится к первойгруппе. В нем тетраэдры [SiO4]4 – соединенымежду собой ионами натрия.
Представителями силикатов третьей группы являются пироксены сформулой LiAl[Si2O6]. В них один атом кремния из трех заместился наатом алюминия. Пироксены образуют бесконечные цепочки разного строения (рис.3).Строение цепочки определяет свойства пироксена.
Области применениясоединений кремнияСоли кремниевых кислот чрезвычайно распространены вприроде в виде руд и минералов. Важнейшими силикатами являются алюмосиликаты,на долю которых приходится более половины массы земной коры. Природные силикатыисчисляются многими сотнями представителей. К ним относят кварц, граниты,полевые шпаты, кристаллические сланцы (слюды), асбест.
Кварц – пьезоэлектрик. Где только не находиттехническое применение кристалл кварца в виде пластинки! Например, кварцевыечасы высокой точности служат для «хранения» точного времени, определяемогоастрономическими методами. Точность суточного хода кварцевых часов ±0,001 с.Основной деталью пьезо-кварцевых стабилизаторов длины радиоволн (частоты),преобразователей давления в электрическую величину с точностью ±1,5%,преобразователей электрической энергии в звуковую (громкоговорители и др.) имеханическую (микрофоны, шумопеленгаторы, ультразвуковая механика) являетсяпластинка из кварца.
Характерная особенность кварцевого стекла – высокаятермическая устойчивость. Такое стекло можно сильно нагреть и сейчас жеохладить в холодной воде. Это объясняется тем, что у кварцевого стеклакоэффициент объемного расширения в 25 раз меньше, чем у обычного стекла.Кварцевое стекло прозрачно как для видимого света, так и для ультрафиолетового.Поэтому из кварцевого стекла изготавливают баллоны кварцевых ламп – источникаультрафиолетовых лучей. Специальные медицинские кварцевые лампы применяют дляоблучения ультрафиолетовыми лучами для профилактики гриппа, лечения рахита идругих заболеваний.
Граниты – одна из самых распространенных пород вземной коре – прекрасный строительный и облицовочный материал. Незаменим гранити для монументальной скульптуры. Отполированный до зеркального блеска, онсоздает неповторимую игру вкраплений, а необработанная, шершавая поверхностьсоздает особую выразительность, поглощая свет.
Полевые шпаты – сырье для керамической, фарфоровой,стекольной, цементной и других отраслей промышленности. В строительстве ихприменяют в качестве поделочных материалов. Кристаллические сланцы (слюды)обладают высокой термостойкостью и высокими электроизоляционными свойствами инаходят применение в электротехнике, радиотехнике. Они также используются какзвуко- и теплоизоляционные материалы. Асбест – минерал с волокнистой структурой– теплоизоляционный и огнеупорный материал. Широкое применение находят слоистыеминералы – слюды, тальк, каолинит. Драгоценные и полудрагоценные камни –изумруд, топаз, аквамарин – хорошо образованные кристаллы природных силикатов,окрашенные различными оксидами.
Искусственные силикаты также играют важную роль вжизни человека. Знакомство человека со стеклом – первым искусственным силикатом– произошло за 3500 лет до н. э.
Основной состав оконного стекла Na2´CaO´6SiO2.Однако частичная замена натрия, кальция или кремния на другие элементыпозволяет получать разнообразные сорта стекла. Кварцевое, хрустальное, бутылочное,посудное, электроламповое, зеркальное, пористое (пеностекло), защитное,архитектурно-строительное, светотехническое, стекло для световодов истеклосфер, оптическое, лабораторное – вот далеко не полный их перечень.Вводя внутрь стеклянного листа металлическую сетку, получают армированноестекло. Трехслойное стекло (триплекс) изготавливают склейкой листа пленки сдвумя листами стекла.
Издавна человек научился применять химическиесоединения для окрашивания стекла. В древности было известно, что стекло взависимости от примесей может иметь различный цвет: синий (от оксида кобальтаСоО), зеленый (от оксида хрома Сг2O3или оксида меди СuО), фиолетовый (от оксида марганца Мn2O3), розовый(от селена). Применялись и «глушители» (соединения фосфора, мышьяка, сурьмы),придававшие стеклу матовую белизну. Молочное стекло, например, получали,добавляя в стеклянную массу касситерит (оксид олова). Рецепты соединений,интенсивно окрашивающих стекло, сохранялись в строжайшей тайне и передавалисьпо наследству из поколения в поколение.
Цветные стекла не утратили своего значения и в нашидни. Рецептура получения цветных стекол непрерывно расширяется.
В начале XX в. сталиприменяться соединения селена, которые окрашивают стекло в красные, розовые иоранжевые тона. После внедрения в 30-х гг. оксидов редкоземельных элементов впромышленности палитра художественного стекла значительно расширилась – былаполучена недостижимая ранее полутоновая окраска всех цветов спектра.
При фотографических работах требуется красное освещение,поэтому применяют стекла, содержащие ничтожное количество мелкодисперсногозолота. При медленном охлаждении стекла, мельчайшие частицы золота равномернораспределяются по всей массе расплава. Вкрапленные частицы неразличимы даже вмикроскоп, но окрашивают стекло в интенсивно красный цвет. Такое стекло носитназвание рубинового. Из рубинового стекла сделаны пятиконечные звезды Кремля.Площадь остекления каждой звезды составляет около 6 м2. Интересно отметить,что поверхность звезды состоит из трех слоев: стекла: рубинового, хрустальногои молочно-белого. Верхний слой – рубиновое стекло разных оттенков. Этопозволяет оттенить лучистую форму звезд. Внутренний слой – молочно-белоестекло. В дневное время красное стекло, освещенное снаружи, а не на просвет,кажется почти черным. Прослойка молочного стекла отражает большую частьдневного света, смягчая темноту рубинового стекла. Кроме того, молочно-белоестекло хорошо рассеивает свет ламп накаливания, размещенных внутри звезды.Промежуточный слой – хрустальное стекло – придает остеклению прочность. Ведь навысоте башен Московского Кремля очень сложные атмосферные условия: град,ураганный ветер и т. д.
Введение в стекло оксида алюминия А12О3вместо оксида кремния (IV) придает стеклу повышеннуюмеханическую прочность. Из такого стекла изготавливают специальные бутылки длянасыщенных углекислым газом напитков (шипучих). Они могут выдерживать давлениедо 2´106-3´106 Па. В 1926-1928гг. при разработке промышленного способа получения синтетического каучукасоветский химик С.В.Лебедев исследовал реакцию полимеризации бутадиена СН2= СН—СН = СН2 под давлением. В эти годы в Советском Союзе ощущаласьнехватка в химическом лабораторном оборудовании. В качестве реактораС.В.Лебедев использовал бутылки из-под шампанских вин.
Стекла, защищающие от инфракрасных, ультрафиолетовыхи чрезмерно ярких видимых лучей, получают, вводя различные красители. Такиестекла применяют как защитные приспособления при сварочных работах, вметаллургии и пр. В некоторых случаях ставится противоположная задача – надо непоглощать, а, наоборот, хорошо пропускать те или иные лучи. С этой цельюприменяются увиолевые стекла. Они свободно пропускают ультрафиолетовые лучи,которые поглощаются обычными стеклами. Такими стеклами остекляют окна больниц,санаториев, оранжерей. Из них изготавливают лабораторное оборудование. Дляполучения увиолевого стекла используют известково-натриевые составы. Оксидовжелеза в стекле должно быть не более 0,01%.
Специальные стекла, устойчивые к различного родарадиоактивным излучениям и потокам медленных нейтронов, получают, вводя в ихсостав элементы с высоким порядковым номером – свинец, висмут, вольфрам и др.Стекло, в котором практически отсутствует отражение (невидимое стекло), создалипольские специалисты из г. Зелена Гура. Такие стекла необходимы как в науке итехнике, так и в быту. Например, световые блики и отражения часто мешаютпрочесть надпись за стеклом шкалы прибора, рассмотреть картину и т. д.
Много затрачено сил, времени и средств учеными всего мира длясоздания световодов – стеклянного волокна высокой прозрачности, отражающеголучи света от внутренней поверхности. Луч света, проходя по такому волокну, невыходит за его пределы и может быть использован для передачи информации. Наоснове оптического волокна выпускаются детали приборов для радиоэлектронной,приборостроительной и других отраслей промышленности. Трудно оценитьперспективу использования световодов. Световой жгут для телефонной связиобеспечит 2000 телефонных переговоров одновременно. Можно транслироватьодновременно две цветные телепередачи. С помощью световодов стало возможнымпроводить ранее недоступные медицинские исследования внутренних поверхностейорганов, моделировать нервную систему высших животных и человека. Изстекловодов делают «иглы», используемые для световых микроуколов ядра живойклетки.
Весьма перспективны работы по применению волоконнойоптики в электронно-вычислительных устройствах. Их назвали ОВМ (оптическиевычислительные машины) в отличие от обычных ЭВМ. Благодаря им появиласьвозможность введения в ОВМ прямой информации – речи, изображения, текста и пр.
Кремнийорганические соединения
Химия кремнийорганических соединений представляет собойбольшой раздел современной науки. К числу важнейших химических продуктов,необходимых для народного хозяйства (смазки, смолы, лаки, каучуки и т. д.),относятся мономерные и полимерные кремнийорганические соединения. Первое кремнийорганическоесоединение было получено в 1845 г. французским химиком Ж. Эбельменом.Взаимодействием тетрахлорида кремния и этилового спирта он получил этиловыйэфир ортокремниевой кислоты (тетраэтоксисилан, этилсиликат Si(ОС2Н5)4).Далее были получены четырехзамещенные органические соединения кремния с общейформулой SiR4 и другие соединения.
/>Средиученых господствовало представление о полном сходстве соединений кремния иуглерода. Считалось, что замена атомов углерода в органических соединенияхатомами кремния не приводит к существенному изменению свойств органическихсоединений кремния. В этот период Д.И. Менделеев опубликовал несколько работ похимии кремния и кремнийорганических соединений. Его диссертация на званиеприват-доцента, не утратившая своей ценности до настоящего времени, называлась«О строении кремнеземистых соединений» (1856 г.). Д.И. Менделеев первым изхимиков показал, что кремний в отличие от углерода способен образовывать скислородом продукты полимерной структуры (рис.4). Такие полимеры содержат всвоем составе чередующиеся связи кремний — кислород (силоксановые связи).
Д.И. Менделеев заложил основы химии кремнийорганическихсоединений. Он детально изучил открытую ранее Ж. Эбельменом реакцию образованиятетраэтоксисилана, установил правильное строение этого соединения ичетырехвалентность кремния, а также определил ряд физических констант. Уделяябольшое внимание химии кремнийорганических соединений. Взглядов Д.И. Менделеевана строение кислородных соединений кремния придерживались А.М. Бутлеров,Н.А.Меншуткин и другие русские химики. За рубежом работы Д.И. Менделеева этогопериода были или неизвестны, или непоняты.
В истории развития химии кремнийорганических соединенийведущая роль принадлежит нашей отечественной науке. Началом современногоразвития химии высокомолекулярных кремнийорганических соединений являетсяразработка академиком К.А. Андрияновым с сотрудниками способа синтезакремнийорганических смол (1937 г.) и освоение промышленного производствакремнийорганических полимеров. Сразу резко возрос интерес кэлементоорганическим соединениям этого класса. В настоящее время синтезированонесколько тысяч кремнийорганических соединений, изучены их физико-химическиесвойства, методы синтеза и области их практического применения.
Все кремнийорганические соединения условно разделенына две большие группы — низкомолекулярные и высокомолекулярные соединения. Изних практическое значение получили не кремнийорганические соединения c цепями кремний – кремний (силаны), а соединения, содержащиецепи кремний — кислород (силоксаны). Чем объяснить преимуществакремнийорганических соединений, содержащих силоксановые цепи?
Связь кремния с кремнием в кремнийорганических соединенияхтермически неустойчива. Нагревание соединений, содержащих эту связь, до 200-250°С приводит к их полному разложению. Силоксановая связь отличается высокойтермической стойкостью. В зависимости от состава и строения кремнийорганическихсоединений их термическая стабильность находится в пределах 300-500 °С. Вхимическом отношении связь кремний — кислород значительно устойчивее связикремний — кремний. Она разрушается только при взаимодействии с фтором, сернойкислотой и крепкими щелочами при нагревании.
Кремнийорганические мономерные соединения являются важнейшимиполупродуктами для синтеза кремнийорганических полимеров. Исходным доступнымсырьем для получения кремнийорганических мономерных соединений являютсякремний, кремнезем, кокс, хлор, хлороводород и т. д. Наибольшее распространениеполучили методы получения кремнийорганических мономеров из кремнезема черезтетрахлорид кремния и из кремнезема через элементарный кремний. Структуракремнийорганических полимеров аналогична структуре кварца и силикатов, онитакже обладают большой термической стойкостью. Разница в структурах – наличиеорганических радикалов у кремнийоргакических полимеров, которые придают высокуюэластичность молекуле полимера. Оксид кремния (IV) исиликаты также имеют полимерное строение.
Кремнийорганические мономеры в основном используют дляполучения полимеров, но они находят также и самостоятельное применение. Из нихосновное промышленное значение имеет этиловый эфир ортокремниевой кислоты Si(OC2H5)4(этил-силикат) – связующее вещество при получении цементов, керамики, красящихвеществ. После пропитки этилсиликатом тканей, кож, ваты, бумаги, дерева,асбеста, гипса, бетона и т. д. эти материалы становятся водонепроницаемыми именее горючими. Этилсиликат применяют также для приготовления специальныхклеев. Этиловый эфир ортокремниевой кислоты используют для полученияжаростойких литейных форм в производстве точного литья.
Кремнийорганические жидкости могут быть получены с широкимдиапазоном температур кипения и вязкости. Их вязкость очень мало изменяется винтервале температур от –70 до +250 °С.
Температура замерзания большинства кремнийорганическихжидкостей около –70 °С (иногда –130 °С и ниже), в то время как у нефтяных маселс той же температурой кипения она составляет от –20 до –40 °С.
Полиорганосилоксановые жидкости термически стабильны. Они неизменяют цвета и практически не окисляются кислородом воздуха при длительномнагревании до 200 °С. В атмосфере инертных газов, а также на воздухе вприсутствии ингибиторов они устойчивы и при более высоких температурах.
Кремнийорганические смолы – бесцветные или от желтого докоричневого цвета продукты. Они хорошо растворимы во многих органическихрастворителях, и их растворы используются как лаки. Кремнийорганические смолыобладают исключительно высокой термической устойчивостью и стойкостью кокислению.
Ранее использовали различные способы повышения водостойкостиматериалов путем нанесения на их поверхность защитных покрытий или пропиток.Однако подавляющее большинство предложенных составов имели существенныенедостатки: одни изменяли внешний вид обрабатываемой поверхности, другиеухудшали физико-химические и механические свойства обрабатываемого материалаили значительно увеличивали его массу; пористые материалы становились воздухонепроницаемымии т. д.
В настоящее время найдена лишенная этих недостатковвозможность повышения водостойкости материалов, заключающаяся в обработкепоследних различными кремнийорганическими соединениями. Обработанныекремнийорганическими соединениями материалы не смачиваются ни водой, ни воднымирастворами. Пористые материалы после обработки кремнийорганическнмисоединениями перестают впитывать в себя воду, а их воздухопроницаемость приэтом практически не изменяется. Такое действие кремнийорганических соединенийобусловлено появлением на поверхности обработанного материала тончайшейполимерной пленки толщиной 3´10–6 см.
Водоотталкивающие свойства можно придать бумаге введениемкремннйорганической жидкости непосредственно в бумажную массу передизготовлением из нее бумаги (проклейка бумаги). Такая бумага удерживает наповерхности чернильные штрихи без пропускания чернил на оборотную сторону и безрастекания их по ее поверхности. Текстильные ткани, пропитанные кремнийорганическимижидкостями, становятся непромокаемыми, к ним не пристают чернила и другиежидкости. Вода на поверхности такой ткани собирается в виде шариков и стекает снее. Даже струя воды не смачивает обработанную кремнийорганикой ткань.
Широко применяют кремнийорганические жидкости в качествесмазок самого различного назначения. Они обеспечивают длительную работу машин имеханизмов как при низкой (до –70°С), так и при высокой (до +260 °C) температуре. Замечательной особенностьюкремнийорганических соединений – масел – является постоянство вязкости вшироком интервале температур. Испытания кремнийорганических жидкостей наподопытных животных, а затем и на людях показали, что они безвредны. Поэтомукремнийорганические жидкости стали использовать для приготовления кремов, мазейи других косметических препаратов. В литературе имеются указания на возможностьиспользования кремнийорганических жидкостей в качестве растворителей, лекарств,применяемых для внутримышечного вливания, и в качестве среды для стерилизациихирургических инструментов. В последнем случае инструмент во время стерилизацииодновременно и смазывается.
Интенсивно расширяется сфера применения кремнийорганическихсмол, лаков и каучуков. Высокая теплостойкость кремнийорганических смол,устойчивость к действию влаги, кислорода, озона, солнечного света, а такжевысокие защитные свойства и диэлектрические характеристики кремнийорганическихлаковых пленок обеспечили их широкое применение в хозяйстве. Из каучуковспециального назначения большой интерес представляют кремнийорганическиекаучуки, ставшие незаменимыми во многих областях современной техники.Характерными свойствами, выгодно отличающими полиоргано-силоксановые каучуки отуглеводородных, являются термо- и морозостойкость, высокие изоляционные идиэлектрические свойства, химическая стойкость и многие другие.
Кремнийорганические каучуки нашли также применение в качестветермостойких клеев для склеивания стекла, стали, алюминия, латуни и т. п., атакже для склеивания каучуков и резин друг с другом. Синтетическийкремнийорганический клей при сборке крупных металлических сооружений заменяетзаклепки, позволяет обходиться без сварки деталей. В городе Брно (Чехословакия)построен мост, детали которого скреплены с помощью этого клея. В настоящеевремя разработаны новые виды кремнийорганических каучуков сбензомаслостойкостью, сохраняющие эти свойства как при низких, так и привысоких температурах.
В человеческом организме кремний содержится повсеместно, нобольше всего – в костях, коже, соединительной ткани, а также в некоторыхжелезах. При переломах костей содержание кремния в месте перелома повышаетсяпочти в 50 раз. Минеральные воды с высоким содержанием кремния оказываютблаготворное влияние на здоровье людей, особенно пожилых. С возрастомсодержание кремния в организме существенно уменьшается, поэтому у пожилых людеймедленнее срастаются сломанные кости.
Но, с другой стороны, давно известно серьезное заболевание –силикоз, вызываемое длительным вдыханием пыли, содержащей свободную двуокиськремния. Некоторые кремнийорганические соединения оказались токсичными для всехтеплокровных организмов.
Кремниевая жизнь
Еще нескольколет тому назад американский профессор астрономии Том Голд высказал убеждение втом, что внутри Земли могла зародиться жизнь, основанная на кремнии и неимеющая ничего общего с привычными нам формами организмов. Научный мир отнессяк его гипотезе прохладно. А сегодня уже открыто и абсолютно доказаносуществование на Земле кремниевой формы жизни.
Уникальныйматериал, подтверждающий наличие кремниевой формы жизни на Земле, которую автороткрытия назвал Крей, опубликован А.А. Боковиковым. Его открытие было изучено вТомском отделении минералогического общества РАН (ТОМО РАН) и получилоположительное заключение. К докладу прилагались 24 цветные фотографии, накоторых можно было видеть различные этапы развития агатов и даже «рождение»маленького агатика.
В течение семилет А. Боковиков собирал и исследовал агаты – не мертвые камни, а, как былодоказано им, живые организмы со многими признаками, свойственными белковойформе жизни, в частности:
Ø Четко выраженная анатомия кремниевых организмов
Ø Наличие полов
Ø Размножение семенами и отпочкованием
Ø Внутрикаменное развитие зародыша
Ø Наличие кожи
Ø Линька кожи
Ø Регенерация кожи
Ø Залечивание ран, трещин, сколов
Ø Кристаллическое тело – хранилище наследственной информации
Чрезвычайноинтересны наблюдения автора. Агат имеет четко выраженную анатомию: на цветныхфотографиях, сделанных в ходе исследований, хорошо видно кожу, полосатое тело,кристаллическое тело. В данном случае кожей названа внешняя оболочка; полосатоетело – это мужское тело, а кристаллическое – женское. Последние — это, поутверждению автора, гены агатов. Причем наличие полов в крее определеноисследователем с большой достоверностью. Так, возникновение и развитиезародышей агата происходит только в кристаллическом теле и никогда полосатом.Автор предположил, что вокруг яйцеклетки, как и других биологических структур,существует биополе. Одна из разновидностей биополя – лазерное поле, способноеизлучать не только свет, Нои звук. На акустические колебания клетка накладываетгенетическую информацию, которая может осуществить партеногенез, т. е. половоеразмножение без оплодотворения яйцеклетки. Способностью звука переноситьгенетическую информацию объясняется и появление зародышей кремниевых организмоввнутри целого и монолитного куска базальта. При повреждении поверхности агатапоявившиеся царапины и трещины вскоре затягиваются, сколы разравниваются, хотяот них остаются следы.
Другиеисследования показали, что глины тоже обладают признаками жизни. Л. Койн изКалифорнийского университета в Сан-Хосе нашла, что каолинитовые глины могутсобирать энергию, которая выделяется при радиоактивном распаде, из окружающейсреды, сохранять ее и высвобождать в тех случаях, когда структура глинынарушается определенным образом, например при ее смачивании или высушивании.
Но это не все.Были обнаружены морские губки, образующие колонии на большой глубине. Их основа– кремниевые полимеры. Эти губки растут, питаются и размножаются без привычныхдля нас белковых структур. То, что эти организмы развивались на глубине, т. е.под давлением, и практически без света, доказывает особенность кремниевойжизни. Для других морских организмов – радиолярий, диатомей, морских звезд –диоксид кремния составляет основу скелета. Растениям кремний придает прочность,так как входит в состав механической ткани. Чем жестче стебель растения, тембольше кремния находят в его золе.
Встает вопрос:а имеет ли крей перспективу развития на Земле? Ведь существующие кремниевыеформы жизни находятся на сравнительно низкой ступени эволюции, в то время какнаша планета заселена развитыми белковыми существами. Я считаю, что этовозможно, так как крей имеет другие состав и структуру, и, следовательно, кремниеваяжизнь вообще не будет конкурировать с белковой. У них будут разные местаобитания, пища. Но, возможно, крей не сможет развиваться в земных условиях, итогда вопрос о конкурентоспособности отпадает.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|