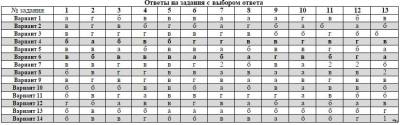
Задача №4062
Не можешь составить уравнение реакции или найти массовую долю химического элемента. Ты пришел по адресу, здесь ты найдешь решение к задаче Итоговая контрольная работа Химия 8 класс ответы, если твой ответ не сходится с представленным, просьба прислать свое решение в комментарии и наша команда постарается помочь вам разобраться в решении.Решение задачи:
Уважаемые посетители сайта, если вы не согласны с той информацией которая представлена на данной странице или считаете ее не правильной, не стоит попросту тратить свое время на написание негативных высказываний, вы можете помочь друг другу, для этого присылайте в комментарии свое "правильное" решение и мы его скорее всего опубликуем.


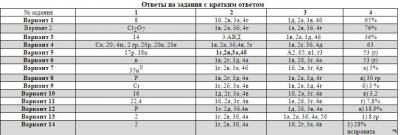
Ответы на задания с развернутым ответом
1 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 2Cu + O2 = 2CuO | 1 |
| CuO + h3SO4= CuSO4 +h3O | 1 |
| CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Cu2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Cu(OH)2↓ Cu2+ + 2OH- = Cu(OH)2↓ | 1 1 1 |
| Названия всех веществ и типы реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) или решение через пропорции | Баллы |
| CuO + h3SO4= CuSO4 +h3O М (CuO) = 80 г/моль, М(h3SO4) = 98 гр/моль Ответ: m (CuO) =204 гр | |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
2 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 2Mg + O2 = 2MgO | 1 |
| MgO + Н2SО4 = MgSО4 + Н2O | 1 |
| MgSО4 + 2NaOH = Mg(OH)2↓ + Na2SО4 Mg2+ + SO42- + 2Na+ + 2OH- = Mg(OH)2↓+2Na+ + SO42- Mg2+ + 2OH- = Mg(OH)2↓ | 1 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| CaCO3 = CaO + CO2 M(CaCO3) = 100г/моль V(CO2) = 45л | 1 1 1 |
| m(CaCO3) = 200,89гр | |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
3 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| Zn + Н2SО4 = ZnSO4 + h3 | 1 |
| ZnSO4 + 2NaOH = Zn(OH)2 ↓+ Na2SО4 Zn2+ + SO42- + 2 Na+ + 2 OH- = Zn(OH)2 ↓+ 2 Na+ + SO42- Zn2+ +2 OH- = Zn(OH)2 ↓ | 1 1 1 |
| Zn(OH)2 ↓= ZnO + h3O | 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| K2CO3 + Ba(NO3)2 = BaCO3↓ + 2KNO3 | 1 |
| M(Ba(NO3)2) = 261 г/моль M(BaCO3) = 197 г/моль | 1 |
| Ответ: m (BaCO3) =128 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
4 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. Na + Cl2 = 2. Na2O + h3O = 3. NaOH + h3SO4 = в ионном виде – 3 балла | 1 1 3 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| HNO3 + Ca(OH)2 = Ca(NO3)2 + h3O | 1 |
| M(HNO3) = 63 г/моль M(Ca(OH)2) = 74 г/моль | 1 |
| Ответ: m (Ca(OH)2) = 14,8 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
5 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. Ba(OH)2 + NaNO3 = дополнительные баллы за ионные уравнения 2. LiOH + CuSO4 = 3. Al + O2 = | 1 3 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| HNO3 + NaOH = NaNO3 + h3O | 1 |
| M(HNO3) = 63 г/моль M(NaNO3) = 74 г/моль | 1 |
| Ответ: m (NaNO3) = 62,3 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
6 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. Ca(OH)2↓ + HCl = дополнительные баллы за ионное уравнение 2. KOH + FeCl3 = 3. Zn + O2 = | 1 3 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| h3SO4 + NaOH → Na2SO4 + h3O | 1 |
| m(h3SO4) = 32гр M(h3SO4) = 98 г/моль M(Na2SO4) = 142 г/моль | 1 |
| Ответ: m (Na2SO4) = 46,4 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
7 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. KOH + FeCl3 = 2. Ba(OH)2 + NaNO3 = 3. Zn + O2 = 4.Al + HCl = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| К2СО3 + Са(NO3)2 → CaCO3 + KNO3 | 1 |
| m(К2СО3) = 110,4 гр M(К2СО3) = 138 г/моль M(CaCO3) = 100 г/моль | 1 |
| Ответ: m (Na2SO4) = 80 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
8 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. Zn + O2 = 2. NaOH + Cu(NO3)2 = 3. S + O2 = | 1 3 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| CuSO4 + NaOH = Na2SO4 + Cu(OH)2 | 1 |
| m(NaOH) = 170 гр M(NaOH) = 40 г/моль M(Cu(OH)2) = 98 г/моль | 1 |
| Ответ: m (Cu(OH)2) = 208,25 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
9 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. NaOH + FeCl2 = 2. P + O2 = 3. Zn + CuCl2 = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| КI + Pb(NO3)2 = PbI2 + KNO3 | 1 |
| m(КI) = 500 гр M(КI) = 166 г/моль M(PbI2) = 461 г/моль | 1 |
| Ответ: m (PbI) = 694 гр | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
10 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. KOH + HCl = 2. Zn + O2 = 3. Al + HCl = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| Zn + HCl = ZnCl2 + h3 | 1 |
| m(HCl) = 200 гр M(HCl) = 36,5 г/моль | 1 |
| Ответ: V (h3) = 61,4л | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
11 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. Сu(OH)2 + HCl = 2. BaСl2 + NaNO3 = 3. Al + O2 = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| h3SO4 + Fe = FeSO4 + h3 | 1 |
| m(h3SO4) = 400 гр M(h3SO4) = 98 г/моль | 1 |
| Ответ: V (h3) = 91,4 л | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
12 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. Zn(OH)2 + h3SO4 = 2. BaNO3 + NaCl = 3. Na2O + h3O = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| Zn + HCl = ZnCl2 + h3 | 1 |
| m(HCl) = 173 гр M(HCl) = 36,5 г/моль | 1 |
| Ответ: V (h3) = 53 л | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
13 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. HCl + NaOH = 2. BaO + CO2 = 3. P2O5 + h3O = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| СН4 + 2О2 → СО2 + Н2О | 1 |
| V (СН4) = 11,2 л | 1 |
| Ответ: V (СО2) = 22,4 л (2) | 1 |
| Максимальный балл | 3 |
Ответы на задания с развернутым ответом
14 вариант
Задание С1
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 1. HNO3 + KOH = 2. CaO + SO2 = 3. P2O5 + h3O = | 3 1 1 |
| Названия веществ, типы химических реакций | 1 |
| Максимальный балл | 6 |
Задание С2
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| Zn + 2HCl → ZnCl2 + h3↑ | 1 |
| V (h3) = 20 л | 1 |
| Ответ: m(Zn) = 58 гр (2) | 1 |
| Максимальный балл | 3 |
I вариант
Часть А
А1. Четыре энергетических уровня содержит электронная оболочка атома:
а) калия
б) бериллия
в) кремния
г) гелия
А2. Шесть электронов находятся на внешнем энергетическом уровне атома:
а) золота
б) углерода
в) хром
г) кислорода
А3. Выберите соединение с ковалентной полярной связью:
а) h3
б) h3S
в) NaI
г) N2
А4. Выберите формулу соединения серы, в котором она проявляет степень окисления -2
а) SO2
б) SO3
в) MgS
г) SF6
А5. Выберите формулу оксида железа (III):
а) FeO
б) FeCl3
в) Fe2O3
г) ОF2
А6. Выберите ряд формул, в котором все вещества являются основаниями:
а) Fe2O3, ZnO, Cu(OH)2
б) Ba(NO3)2, Ba(OН)2, Н2SО4
в) КОН, Fe(OH)3, NaОН
г) Zn(OН)2, НCl, h3O
А7. Оксид кальция СаО реагирует с:
а) HNO3
б) Li2O
в) Cu
г)MgSO4
А8. Смесью веществ, в отличие от чистого вещества, является:
а) водопроводная вода
б) углекислый газ
в) кислород
г) медь
А9. Уравнение реакции замещения:
а) Zn + 2HCl = ZnCl2 + h3
б) ZnO + h3SO4 = ZnSO4 + h3O
в) Cu(OH)2 = CuO + h3O
г) Fe + S = FeS
А10. Выберите уравнение электролитической диссоциации для Ba(NO3)2:
а) Ba(NO3)2 = Ba2+ + NO3-
б) Ba(NO3)2 = Ba + 2 NO3
в) Ba(NO3)2 = Ba2+ + 6 NO-
г) Ba(NO3)2 = Ba2+ + 2 NO3-
А11. Выберите краткое ионное уравнение для реакции
2КОН + Н2SО4 = К2SО4 + 2Н2О
а) ОН- + Н+= Н2О
б) 2КОН + 2 Н+= 2К++ 2Н2О
в) 2ОН- + 2Н+= 2Н2О
г) 2К++ 2ОН-+ 2 Н++ SО42-= 2К++SО42-+2Н2О
А12. Выберите свойства, характеризующие графит:
а) твердый, режет стекло
б) мягкий, оставляет следы на бумаге
в) бесцветный, прозрачный
г) жидкий, проводит электричество
А13. Какой объем при н.у. занимает 2 моль водорода Н2 :
а) 11,2 л
б) 22,4 л
в) 44,8 л
г) 8 9,6 л
Часть В
В задании В1 ответом является цифра или формула.
В заданиях В2 и В3 на установление соответствия запишите в бланк для ответов напротив цифр буквы (одну или несколько) выбранных вами ответов.
В задании В4 – решение + ответ – цифра.
В1. Ядро атома 15N содержит 7 протонов и … нейтронов.
В2. Установите соответствие между формулой вещества и его принадлежностью к определенному классу неорганических соединений.
Класс веществ: Формула вещества:
В3. Установите соответствие между реагентами и названием продуктов реакции
Реагенты Продукты реакции
1) BaCl2 + Na2SO4 = а) = хлорид бария + вода
2) BaO + HCl = б) = нитрат бария + вода
3) Ba + h3O = в) = гидроксид бария + водород
4) Ba(OH)2 + HNO3 = г) = сульфат бария + вода
д) = сульфат бария + хлорид натрия
В4. Массовая доля кислорода в серной кислоте h3SO4 равна …%
Часть С
При записи ответов к заданиям части С запишите сначала номер ответа, а затем полное решение. Ответы записывайте четко и разборчиво.
С1. Напишите уравнения практически осуществимых химических реакций. Укажите типы химических реакций. Выберите реакцию обмена и запишите ее в молекулярном и ионном виде. Назовите вещества по их формулам.
1. Cu + O2 =
2. CuO + h3O =
3. CuO + h3SO4 =
4. CuSO4 + NaOH =
С2. Вычислите массу оксида меди, вступившей в реакцию с 250 г серной кислоты.
2 вариант
Часть А
А1. Элемент третьего периода главной подгруппы II группы Периодической системы химических элементов Д. И. Менделеева:
а) алюминий
б) бериллий
в) магний
г) натрий
А2. Число электронов, протонов и нейтронов в атоме фтора F:
а) p+—9, n0—10, e—19
б) p+—10, n0—9, e- —10
в) p+—10, n0—9, e- —9
г) p+—9, n0—10, e- —9
А3. При помощи металлической химической связи образовано вещество:
а) кислород
б) поваренная соль
в) медь
г) вода
А4. Вещество, в котором сера проявляет степень окисления +4, имеет формулу:
а) h3S
б) SO2
в) SO3
г) Na 2S
А5. Вещество, имеющее формулу NaNO3, называется:
а) карбонат натрия
б) нитрит натрия
в) хлорид натрия
г) нитрат натрия
А6. Ряд формул, в котором все вещества являются оксидами:
а) ZnO, ZnCl2 , HCl
б) SO3 , MgO, CuO
в) KOH, K 2O, MgO
г) HNO3 , P2O5 , NaCl
А7. Общая формула основания выражена условной записью:
а) Ме(OH)n
б) HAc
в)MeAc
г) HOH
А8. Укажите правильную последовательность действий при разделении смеси поваренной соли и речного песка:
а) выпаривание, фильтрование, растворение в воде
б) фильтрование, выпаривание, растворение в воде
в) растворение в воде, выпаривание, фильтрование
г) растворение в воде, фильтрование, выпаривание
А9. Уравнение реакции обмена:
а) CaO+SiO2= CaSiO3
б) FeS+ 2HCl= FeCl 2+h3 S
в) 2 KClO3 = 2KCl+ 3O2
г) Mg+ 2HCl= MgCl 2+ h3
А10. С раствором гидроксида натрия NaOH взаимодействует вещество, формула которого:
а) HCl
б) MgO
в) KOH
г) Mg
А11. Какие ионы образует при электролитической диссоциации вещество h3 SO4:
а) H+ и SO42-
б) 2 H+ и SO42-
в) 2H0 и SO42-
г) 2H+ и S 2- и 4O2-
А12. Какое краткое ионное уравнение отображает сущность процесса
NaOH + HCl = NaCl + h3O
а) H+ + OH-= H 2O
б) NaOH + H+ = Na+ + H 2O
в) 2H++ 2OH- = 2 h3 O
г) OH- + HCl = Cl-+ H 2O
А13. Количество вещества n, соответствующее 36 г воды h3O:
а)1 моль
б) 2 моль
в) 3 моль
г) 5 моль
Часть В
В заданиях В1 ответом является цифра или формула.
В заданиях В2 и В3 на установление соответствия запишите в бланк для ответов напротив цифр буквы(одну или несколько) выбранных вами ответов.
В задании В4 – решение + ответ – цифра.
В1. Схема распределения электронов по слоям атома химического элемента – 2,8,7. Химическая формула высшего оксида этого элемента …
В2. Установите соответствие между формулой вещества и его принадлежностью к определенномуклассу неорганических соединений.
Класс веществ: Формула вещества:
1) оксиды а) NaOH г) NaNO3
2) основания б) HCl д) h3
3) кислоты в) CaO
4) соли
В3. Установите соответствие между фрагментами молекулярных уравнений в левом столбике и краткими ионными уравнениями в правом:
Фрагмент уравнения Краткое ионное уравнение
1) CaCl 2+ K2 CO3 → а) Ca2+ + CO32- → CaCO3
2) SO3 + NaOH → б) 2H+ + 2OH-→ 2h3O
3) NaOH + h3 SO4 → в) SO3 + 2OH-→ SO42- + h3O
4) K2 CO3 + HCl → г) 2 H+ + CO32- → CO2+ h3O
В4. Массовая доля кислорода в азотной кислоте HNO3 равна …%
Часть С
При записи ответов к заданиям части С запишите сначала номер ответа, а затем полное решение. Ответы записывайте четко и разборчиво.
С1. Напишите уравнения практически осуществимых реакций. Укажите типы химических реакций. Запишите реакцию ионного обмена в молекулярном и ионном виде. Назовите вещества по их формулам.
1. Mg + O2 =
2. MgO + h3SO4 =
3. MgSO4 + NaOH =
4. Cu + HCl =
С2. Определите массу карбоната кальция CaCO3, используя уравнение химической реакции:
СаСО3 = СаО + СО2,
если при его термическом разложении выделяется 45 литров углекислого газа СО2.
Вариант 3
Часть А
А1. В атоме химического элемента, расположенного в 3 периоде, V группе, главной подгруппе, общее число электронов равно:
а) 3
б) 5
в) 15
г)31
А2. Элемент, в ядре атома которого содержится 9 протонов:
а) кислород
б) углерод
в) бериллий
г) фтор
А3. Ковалентную полярную связь имеет
а) S8
б) O3
в) K2S
г) h3S
А4. Степень окисления серы в соединении +6, имеет формулу:
а) h3S
б) SO2
в) CaS
г) SO3
А5. Вещества, формулы которых Fe2O3 и FeCl2, являются соответственно:
а) основным оксидом и основанием
б) амфотерным оксидом и кислотой
в) амфотерным оксидом и солью
г) кислотой и амфотерным гидроксидом
А6. Неправильно написана формула основания:
а) Ca(OH)2
б) NaOH
в) Li(OH)2
г) Ba(OH)2
А7. Оксид фосфора (V) Р2О5 реагирует с:
а) натрием
б) оксидом серы (IV)
в) cерной кислотой
г) гидроксидом натрия
А8. Выберите неправильное суждение:
а) кислород – газ без цвета
б) озон имеет бледно-фиолетовый цвет
в) кислород имеет голубоватый цвет
г) озон имеет «запах грозы»
А9. Схема реакции замещения:
а) Cu + O2 → CuO
б) CuSO4 + Zn → ZnSO4 + Cu
в) KOH + HCl → KCl + h3O
г) CaCO3 → CaO = CO2
А10. К химическим явлениям относится:
а) плавление парафина
б) горение бензина
в) горение электрической лампы
г) засахаривание варенья
А11. Какие ионы образуются при электролитической диссоциации сернистой кислоты h3SO3:
а) 2H+ и S2-
б) H+ и SO32-
в) 2H+ и 4SO2-
г) 2H+ и SO32-
А12. Выберите краткое ионное уравнение для реакции:
h3SO4 + BaCl2 → BaSO4↓ + HCl
а) H+ + SO42- → BaSO4 + H+
б) Ba2+ + SO42- → BaSO4↓
в) BaCl2 + 2H+ → Ba2+ + 2HCl
г) Ba2+ + 2Cl- → BaCl2
А13. Число молекул N в 1 моль СО2:
а) 12∙1023
б) 6∙1023
в) 42∙1023
г) 6∙1013
Часть В
В заданиях В1, В2 ответом является цифра или формула.
В задании В2 ответом служит последовательность четырех цифр, которыми обозначены элементы в задании.
В задании В3 на установление соответствия запишите в бланк для ответов напротив цифр буквы выбранных вами ответов.
В задании В4 – решение + ответ – цифра.
В1. Элемент, схема строения электронной оболочки которого 2е, 8е, 4е в составе атома имеет нейтронов п0 - ….
В2. В перечне веществ, формулы которых
А. Na2SiO3
Б. h3SiO3
В. KCl
Г. CaO
Д. MgSO4
Е. NaOH
к солям относятся:
1) АВЕ
2) БГЕ
3) АВД
4) ВДЕ
Формула какой соли соответствует названию – хлорид калия?
В3. Установите соответствие между исходными веществами и продуктами реакции:
Исходные вещества Продукты реакции
1) соляная кислота + гидроксид натрия→ А. … → h3S
2) сера + водород→ Б. … → P2O5
3) Na2S + CuCl2 → В. … → NaCl + h3O
4) кислород + фосфор → Г. …→ CuSO3 + NaCl
Д. … → CuS + NaCl
В4. Массовая доля кремния в кремниевой кислоте …%.
Часть С
При записи ответов к заданиям части С запишите сначала номер ответа, а затем полное решение. Ответы записывайте четко и разборчиво.
С1. Напишите уравнения практически осуществимых химических реакций. Укажите типы химических реакций. Выберите реакцию обмена и запишите ее в молекулярном и ионном виде. Назовите вещества по их формулам.
1. Zn + h3SO4 =
2. ZnSO4 + NaOH =
3. Na2O + KOH =
4. Zn(OH)2↓ = … + …
С2. Вычислите массу осадка, выпавшего при взаимодействии карбоната калия К2СО3 со 170 г раствора нитрата бария Ва(NO3)2 . Уравнение реакции (не забудьте расставить коэффициенты, перед тем, как решать задачу):
K2CO3 + Ba(NO3)2 = BaCO3 + KNO3
Вариант 4
Часть А
А1. В атоме химического элемента, расположенного во 2 периоде, V группе, главной подгруппе, число электроновна последнем уровне равно:
а) 3
б) 5
в) 7
г)14
А2. На электронных уровнях атома магния электроны распределяются следующим образом:
а) 2е, 8е, 2е
б) 1е, 10е, 1е
в) 2е,2е,8е
г) 2е, 10е
А3. Ковалентную полярную связь имеет:
а) О2
б) SO3
в) Сu
г) К2S
А4. Связь в металлах и сплавах называется:
а) ионной
б) ковалентной полярной
в) металлической
г) ковалентной неполярной
А5. Формула азотной кислоты:
а) h3S
б) HNO3
в) h4PO4
г) h3SO4
А6. Вещества, формулы которых CO2 и Fe(OH)3 являются соответственно:
а) основным оксидом и основанием в) амфотерным оксидом и основанием,
б) амфотерным оксидом и солью, г) кислотным оксидом и амфотерным гидроксидом
А7. Источниками загрязнения окружающей среды являются:
а) тепловые электростанции и металлургические предприятия
б) химические заводы и заводы по сжиганию мусора
в) автомобильный и авиационный транспорт
г) все перечисленные области деятельности человека
А8. Серная кислота не реагирует:
а) Zn
б) NaOH
в) HCl
г) CuCl2
А9. Признаком химической реакции не является:
а) образование газа
б) выпадение осадка
в) испарение жидкости
г) изменение цвета
А10. Выберите уравнение электролитической диссоциации для сульфата хрома (3) Cr2(SO4)3:
а) Cr2(SO4)3 = Cr3+2 + (SO4)32-
б) Cr2(SO4)3 = 2Cr3+ + SO42-
в) Cr2(SO4)3 = Cr3++ 3SO42-
г) Cr2(SO4)3 = 2Cr3+ + 3SO42-
А11. В соответствии с сокращенным ионным уравнением
H+ + OH- = h3O
могут взаимодействовать вещества, формулы которых:
а) K3PO4 + Na2SO4
б) Na2O + HCl
в) HCl + NaOH
г) h4PO4 + Al(OH)3
А12. Какое уравнение соответствует реакции разложения?
а) MgO + CO2→MgCO3
б) FeCl3 + 3NaOH→3NaCl + Fe(OH)3
в) 2NaI + Br2→2NaBr + I2
г) 2AgBr→ 2Ag + Br2
А13. Определите массовую долю соли в растворе, полученном растворением 25 гр соли в 100 гр воды:
а) 0,25 (25%)
б) 0,22 (22%)
в) 0,20 (20%)
г) 0,18 (18%)
Часть В
В1. Запишите химический знак, порядковый номер, номер периода и группы, рассчитайте количество протонов, нейтронов и электронов для элемента, атому которого соответствует схема строения электронной оболочки: 2е, 8е, 8е,2е.
В2. Установите соответствие между формулой вещества и его принадлежностью к определенному классу неорганических соединений.
Формула вещества Класс соединений
1. Cu(OH)2 а) оксиды
2. Na2O б) кислоты
3. HNO2 в) основания
4. Mg(OH)2 г) соли
5. CaSO4
В3. Установите соответствие между реагентами и продуктами реакции:
Реагенты: Продукты реакции:
1. Al + HCl → а) → LiOH
2. KOH + h3SO4 → б) → Cu(OH)2 + Na2SO4
3. CuSO4 + NaOH → в) → AlCl3 + h3
4. Mg + O2 → г) → K2SO4 + h3O
д) → MgO
В4. Определите массу в граммах 3,5 моль воды. Ответ дайте в виде целого числа.
Часть С
С1. Напишите уравнения практически осуществимых реакций. Укажите типы химических реакций. Выберите реакцию обмена и запишите ее в молекулярном и ионном виде. Назовите вещества по их формулам.
1. Na + Cl2 =
2. Na2O + h3O =
3. NaOH + h3SO4 =
4. Ag + h3SO4 =
C2. По уравнению реакции (не забудьте расставить коэффициенты)
HNO3 + Ca(OH)2 = Ca(NO3)2 + h3O
рассчитайте массу гидроксида кальция Ca(OH)2, необходимого для реакции с 12,6 гр азотной кислоты.
xn----ftbdmba1cp9d.xn--p1ai
РАЗРАБОТКИ
В категории разработок: 15
Фильтр по целевой аудитории
- Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя

Контрольная работа составлена для итогового контроля по химии для учащихся 8 класса, которые изучают химию по учебнику Кузнецовой Н.Е.. 2 варианта, есть таблица ответов. Данная работа может быть использована на входном контроле в 9 классе.
Целевая аудитория: для 8 класса
Чтобы развивать ключевые компетентности в рамках школьной программы, преподавателю необходим инструмент. Таким инструментом являются компетентностно-ориентированные задания.Под ключевыми компетенциями применительно к школьному образованию понимается способность учащихся самостоятельно действовать в ситуации неопределённости при решении актуальных для них проблем. Выделяются три ключевые компетентности: компетентность разрешения проблем, информационную и коммуникативную компетентности.
Целевая аудитория: для 8 класса
Контрольная работа предназначен для контроля знаний учащихся 8 класса по теме «Важнейшие классы неорганических соединений». Контрольная работа состоит из трех вариантов, каждый из которых состоит из 10 вопросов. Контрольная работа включает в себя тестовые вопросы и задания с открытой формой ответа.
Целевая аудитория: для 8 класса
Пособие состоит из текстов контрольных работ в тестовой форме в параметрах ЕГЭ, соответствующих программе химии для 8 класса О. С. Габриеляна и приложений: периодическая система химических элементов, таблица растворимости, бланк для ответов. Пособие предназначено учителям для проведения на уроках тематического и итогового контроля по основным темам курса.
Целевая аудитория: для 8 класса
Контрольная работа разработана к УМК О.С.Габриеляна 8 класс. Содержит 14 вариантов, проверяет следующие элементы: определение типа химической реакции по уравнению, дописать уравнения определённого химического типа, произвести расчёт по уравнению реакции, ответить на теоретический вопрос, содержащий основное понятие данной темы
Целевая аудитория: для 8 класса
Контрольная работа составлена в тестовой форме в 2-х вариантах. Соответствует учебнику Рудзитиса и Фельдмана. Итоговый контроль по теме.
Целевая аудитория: для 8 класса
контрольная работа по теме химические реакции. для учащихся 8 класса
Целевая аудитория: для 8 класса
Предлагаю три варианта контрольной работы разработанных с учетом обязательного минимума по теме: "Первоначальные химические понятия". Работа может использоваться для учащихся занимающихся по программе О. С. Габриеляна и подходит к авторской программе Г. Е. Рудзитиса и Ф.Г. Фельдмана.
Целевая аудитория: для 8 класса
Как быстро проверить готовность учеников к уроку ? Для этого я использую химические графические диктанты. Данные диктанты позволяют оперативно проверить выполнение домашних заданий, понимания учащимися основных вопросов темы предыдущего занятия, в яркой и доступной форме оценить качество подготовки по материалу урока, сэкономить время для работы на уроке.
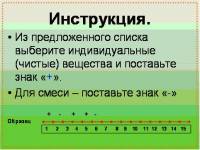
Целевая аудитория: для 8 класса
Как быстро проверить готовность учеников к уроку ? Для этого я использую химические графические диктанты. Данные диктанты позволяют оперативно проверить выполнение домашних заданий, понимания учащимися основных вопросов темы предыдущего занятия, в яркой и доступной форме оценить качество подготовки по материалу урока, сэкономить время для работы на уроке.

Целевая аудитория: для 8 класса
Конкурсы

Диплом и благодарность каждому участнику!

© 2007 - 2017 Сообщество учителей-предметников "Учительский портал"Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.Территория распространения: Российская Федерация, зарубежные страны.Адрес редакции: 352192, г. Гулькевичи, ул. Ленинградская 34-19Учредитель: Никитенко Евгений ИгоревичКонтакты: [email protected]
Использование материалов сайта возможно только с разрешения администрации портала.
Ответственность за разрешение любых спорных вопросов, касающихся опубликованных материалов и их содержания, берут на себя пользователи, разместившие материал на сайте.Администрация портала готова оказать поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
www.uchportal.ru
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 3 частей и включает 12 заданий.
Часть 1 включает 7 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. за выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 2 наиболее сложных и объемных задание С1, выполнение которых предполагает написание полного, развёрнутого ответа, включающего необходимые уравнения реакций и расчёты. За выполнение задания ты можешь получить: 4 балла – С1, 3 балла – С2.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 20 баллов.
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и калькулятором.
Желаю успеха!
Форма контрольной работы: тестирование
Система оценивания работы:
| 0-8 баллов – «2» | 9-13 баллов – «3» |
| 14- 17 баллов – «4» | 18-20 баллов – «5» |
ВАРИАНТ-1
Часть 1
| При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа. |
А1. Три молекулы кислорода означает запись:
| 1) О3 | 3) 2О3 |
| 2) 3О2 | 4) 3О3 |
А2. Число протонов, нейтронов и электронов в атоме калия 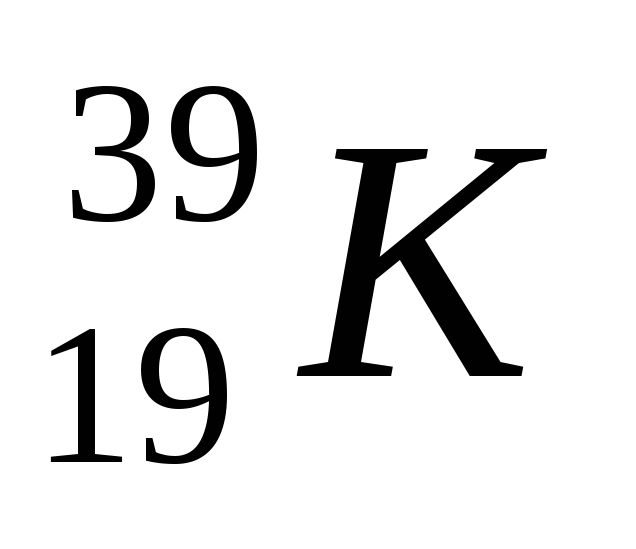 :
:
| 1) p+ – 19; n0 – 20; ē – 19 | 3) p+ – 20; n0 – 19; ē - 20 |
| 2) p+ – 19; n0 – 20; ē – 39 | 4) p+ – 19; n0 – 19; ē - 19 |
А3. Веществами с ковалентной неполярной и металлической связью являются соответственно:
| 1) h3 и S | 3) CaCl2 и CO |
| 2) SO2 и Na2 | 4) N2 и Pb |
А4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
| 1) гидроксид меди (II) | 3) нитрат цинка |
| 2) серная кислота | 4) хлорид магния |
А5. Образование слабого электролита-воды происходит в результате взаимодействия растворов
| 1) | хлорида алюминия и гидроксида натрия |
| 2) | гидроксида бария и азотной кислоты |
| 3) | сульфида калия и серной кислоты |
| 4) | сульфата цинка и гидроксида кальция |
А6. Экзотермической является реакция
| 1) | Cu(OH)2 = CuO + h3O |
| 2) | CaCO3 = CaO + CO2 |
| 3) | 2CO + O2 = 2CO2 |
| 4) | 2h3O = 2h3 + O2 |
А7.Сумма коэффициентов в уравнении реакции, схема которой
SO2+ O2 → SO3
1) 4 2) 5 3) 6 4) 7
Часть 2
| В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться). |
В1. Установите соответствие между формулой вещества и классом соединения:
| Формула вещества: | Класс соединения: |
| А) СO | 1) гидроксид |
| Б) KOH | 2) средняя соль |
| В) CaCl2 | 3) несолеобразующий оксид |
| 4) кислота |
| Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов. |
В2. Оксид серы (IV) взаимодействует с веществами:
| 1) | кислородом |
| 2) | водородом |
| 3) | азотом |
| 4) | водой |
| 5) | гидроксидом калия |
| 6) | серебром |
| Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения. |
В3. Масса соли, содержащейся в 300 г 3 %-ного раствора соли, равна______г. (Запиши число с точностью до десятых).
Часть 3
| Запишите номер задания и полное решение |
C1. Составьте уравнения химических реакций согласно схеме:
HCl → FeCl2 → Fe(OH)2 → Fe(NO3)2
¯
FeO
Назовите все сложные вещества, укажите тип реакции.
С2 .При взаимодействии алюминия с соляной кислотой было получено 13,44 л водорода и 400 г раствора соли. Определите массовую долю в полученном растворе.
Итоговая контрольная работа за курс 8 класса
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 3 частей и включает 12 заданий.
Часть 1 включает 7 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. за выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 2 наиболее сложных и объемных задание С1, выполнение которых предполагает написание полного, развёрнутого ответа, включающего необходимые уравнения реакций и расчёты. За выполнение задания ты можешь получить: 4 балла – С1, 3 балла – С2.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 20 баллов.
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и калькулятором.
Желаю успеха!
Форма контрольной работы: тестирование
Система оценивания работы:
| 0-8 баллов – «2» | 9-13 баллов – «3» |
| 14- 17 баллов – «4» | 18-20 баллов – «5» |
ВАРИАНТ-2
Часть 1
| При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа. |
А1. Сколько атомов водорода содержится в пяти молекулах кремневой кислоты
А2. Число протонов, нейтронов и электронов в атоме натрия 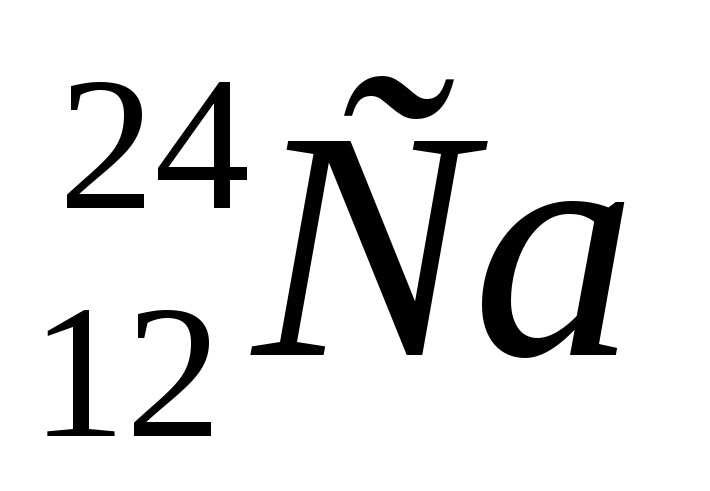
| 1) p+ – 11; n0 – 12; ē – 24 | 3) p+ – 12; n0 – 11; ē - 11 |
| 2) p+ – 12; n0 – 12; ē – 12 | 4) p+ – 11; n0 – 11; ē - 24 |
А3. Ковалентная неполярная связь реализуется в:
| 1) молекуле оксида углерода(IV) | 3) молекуле S8 |
| 2) кристаллическом льде | 4) молекуле Nh4 |
А4. Хорошо растворимым в воде сильным электролитом является каждое из двух веществ:
| 1) гидроксид меди (II) и бромид меди (II) | 3) сульфид меди (II) и нитрат меди (II) |
| 2) хлорид меди (II) и сульфат меди (II) | 4) оксид меди (II) и фосфат меди (II) |
А5. Выделение газа наблюдается при сливании растворов
| 1) | сульфата натрия и гидроксида бария |
| 2) | гидроксида натрия и соляной кислоты |
| 3) | карбоната калия и азотной кислоты |
| 4) | гидроксида меди (II) и азотной кислоты |
А6. Эндотермической является реакция
| 1) | 2Fe(OH)3 = Fe2O3 + 3h3O |
| 2) | 2SO2 + O2 = 2SO3 |
| 3) | CaO + CO2 = CaCO3 |
| 4) | BaO + h3O = Ba(OH)2 |
А7. Сумма коэффициентов в уравнении реакции, схема которой
Mg + O2 → MgO
1) 4 2) 5 3) 6 4) 7
Часть 2
| В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться). |
В1. Установите соответствие между формулой вещества и классом соединения:
| Формула вещества: | Класс соединения: |
| А) НCl | 1) кислая соль |
| Б) Na2SiO3 | 2) кислота |
| В) Li2O | 3) средняя соль |
| 4) основный оксид |
| Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов. |
В2. Оксид серы (VI) взаимодействует с веществами:
| 1) | хлоридом натрия (р-р) |
| 2) | водой |
| 3) | кислородом |
| 4) | гидроксидом кальция (р-р) |
| 5) | азотной кислотой (р-р) |
| 6) | оксидом кальция |
| Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения. |
В3. Объем (н.у.)водорода, выделившегося при взаимодействии 280 г железа с избытком раствора серной кислоты, равен ________ л. (Запиши число с точностью до десятых).
Часть 3
| Запишите номер задания и полное решение |
C1. Составьте уравнения химических реакций в молекулярном и ионном видах согласно схеме
Cu → CuCl2 → Cu(OH)2 → CuO → Cu. Назовите все вещества, укажите тип реакции.
С2.К 27 г раствора с массовой долей хлорида меди (II) 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
Приложение
Спецификация теста
| № задания | Контролируемые элементы знаний | Кол-во баллов за правильный ответ |
| А1 | Химический элемент и химические формулы | 1 |
| А2 | Периодическая система химических элементов Д. И. Менделеева и физический смысл порядкового номера. Строение атома элемента. | 1 |
| А3 | Типы химической связи | 1 |
| А4 | Теория электролитической диссоциации | 1 |
| А5 | Теория электролитической диссоциации. Ионные уравнения | 1 |
| А6 | Закономерности протекания химических реакций. | 1 |
| А7 | Расстановка коэффициентов в уравнениях химических реакций | 1 |
| В1 | Классификация неорганических веществ по основным классам | 2 |
| В2 | Химические свойства неорганических веществ | 2 |
| В3 | Расчетная задача по определению массовой доли растворенного вещества. | 2 |
| С1 | Взаимосвязь неорганических веществ. | 4 |
| С2 | Расчетная задача по уравнению реакции. | 3 |
| Итого | 20 | |
Ключи к итоговой контрольной работе за курс 8 класса
Ответы к заданиям с выбором ответа
Часть 1
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | |
| Вариант 1 | 2 | 1 | 4 | 1 | 2 | 3 | 2 |
| Вариант 2 | 1 | 2 | 3 | 2 | 3 | 1 | 2 |
Ответы к заданиям с кратким ответом
Часть 2
| В1 | В2 | В3 | |
| Вариант 1 | 312 | 145 | 9,0 |
| Вариант 2 | 234 | 234 | 112,0 |
Критерии оценивания заданий с развернутым ответом
Часть 3 (возможный вариант ответа)
С1
| Вар-т | Содержание верного ответа и указания по оцениванию | Баллы |
| Правильно записаны 4 уравнения в молекулярном виде, указан тип реакции, названы сложные вещества | 4 | |
| В одном уравнении реакции допущена ошибка или ответ неполный | 3 | |
| В двух уравнениях реакций допущена ошибка или ответ неполный | 2 | |
| В трех уравнениях реакций допущена ошибка или ответ неполный | 1 | |
| Все элементы ответа записаны неверно | 0 | |
| 3 | 1) Fe + 2HCl = FeCl2 + h3 - реакция замещения соляная хлорид кислота железа(II) 2) FeCl2+ 2NaOH = Fe(OH)2 + 2NaCl – реакция обмена гидроксид гидроксид хлорид натрия железа(II) натрия 3) Fe(OH)2 + 2HNO3= Fe(NO3)2 + 2h3O – реакция обмена азотная нитрат вода кислота железа(II) 4) Fe(OH)2 = FeO + h3O – реакция разложения оксид железа(II) | |
| 4 | 1) Cu + 2HСl = CuCl2 + h3 – реакция замещения соляная хлорид кислота меди (II) 2) CuCl2+ 2NaOH = Cu(OH)2 + 2NaCl – реакция обмена гидроксид гидроксид хлорид натрия меди (II) натрия 3) Cu(OH)2 = CuO + h3O – реакция разложения гидроксид оксид вода меди(II) меди(II) 4) CuO + 3Н2 = 2Cu + 3Н2О – реакция замещения | |
С2
| Критерии оценивания | Балл |
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1‑й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
Вариант 1
Элементы ответа:
1) Составлено уравнение реакции:
2Al+6HCl=2AlCl3+3h3↑
2) Рассчитано количество вещества водорода, образующего в реакции:
n(h3)= V/Vm=13,44л/22,4 л/моль=0,6 моль 22,4л/моль - молярный объем газов (Vm)
3) Определены количество и масса хлорида алюминия, рассчитана массовая доля соли в растворе:
По уравнению реакции:
n(h3)/n(AlCl3)=3/2, следовательно n(AlCl3)=n(h3) • 2/3=0,4 моль
m(AlCl3)=0,4 моль • 133,5=53,4г
ω(AlCl3)=53,4г/400г=0,1335(13,35%)
Ответ:13,35%
Вариант 2
Элементы ответа:
1) Составлено уравнение реакции:
CuCl2 + Na2S = CuS↓ + 2NaCl
2) Рассчитана масса и количество вещества нитрата серебра, содержащегося в растворе:
m (CuCl2) = m(p-pа) • ω/100 = 27 • 0,1 = 2,7 г
n (CuCl2) = m (CuCl2)/ M (CuCl2) = 2,7 : 135 = 0,02 моль
3) Определена масса вещества, выпавшего в осадок:
по уравнению реакции:
n (CuCl2) = n (CuS ) = 0,02 моль
m (CuS ) = n (CuS) • M(CuS) = 0,02• 96 = 1,92г
Ответ: 1,92 г
Используемая литература:
Кузнецова Н.Е. Задачник по химии: 8 класс: [для учащихся общеобразовательных учреждений] /Н.Е. Кузнецова, А.Н. Левкин. – М.: Вентана-Граф, 2011. -128 с. 6 ил.
Корощенко А.С. Химия 8-9 классы. Тематические тестовые задания /А.С. Корощенко, А.В. Яшукова. – М.: Дрофа, 2011. -172 с.- (ЕГЭ шаг за шагом).
xn--j1ahfl.xn--p1ai