Реферат по теме «Вода растворитель». Вода универсальный растворитель реферат
Реферат по теме «Вода растворитель»
Р еферат по теме «Вода – растворитель»
еферат по теме «Вода – растворитель»ученика 3 Б класса МБОУ лицея №7 г.Красный Сулин Ростовской области Питкова Даниила
Замечательным и важным свойством воды надо считать ее способность растворять разнообразные вещества, это самый сильный природный растворитель: в воде растворяются в той или иной мере почти все вещества. Молекулы воды "растаскивают" частицы или ионы веществ, сила притяжения между которыми ослаблена – это обеспечивает высокую растворимость веществ в воде. Это же обеспечивает "прилипание" и высокую способность к смачиванию. Поверхности тел, погруженных в воду, становятся менее прочными. Вещество в воде начинает растворяться, либо распадаясь на отдельные молекулы, как сахар в стакане чая, либо на заряженные ионы, как поваренная соль.
Опыт. Что происходит с сахаром, когда мы кладем его в чай и размешиваем ложкой. Сахар исчезает. Совсем исчезает? Но ведь чай был несладкий, а стал сладкий. Сахар не исчезает, он растворяется, распадается на крошечные, невидимые глазу частички и распределяется по всему стакану. Но все ли вещества будут точно также растворяться в воде?
Д ля того чтобы убедиться, что растворенное вещество действительно никуда не исчезает, проведем еще один опыт. В столовую ложку наберем немного жидкости из стакана, куда мы насыпали соли. Подержим ложку над огнем до тех пор, пока вода не испарится. В ложке остался белый порошок. Что это такое? Если остудить ложку и попробовать порошок на вкус. Мы легко определим, что это соль.
ля того чтобы убедиться, что растворенное вещество действительно никуда не исчезает, проведем еще один опыт. В столовую ложку наберем немного жидкости из стакана, куда мы насыпали соли. Подержим ложку над огнем до тех пор, пока вода не испарится. В ложке остался белый порошок. Что это такое? Если остудить ложку и попробовать порошок на вкус. Мы легко определим, что это соль.
А если насыпать в стакан с водой песок и мешать его, он не раствориться, а песчинки осядут на дно. Вещества, которые не растворяются – это глина, песок, мел.
^
Но такую воду можно очистить с помощью фильтра.

В воде всегда растворены, наверное, сотни, а может быть, и тысячи различных соединений всех элементов таблицы Менделеева. Растворенные вещества тоже влияют на структуру воды, а, следовательно - на ее свойства.

Для живых организмов вода незаменима, так как это инертный растворитель, который обычно не вступает в реакцию с растворенным веществом. Это свойство исключительно важно из-за того, что в живых системах вода служит инертным носителем разнообразных жизненно важных веществ.
Интересные факты о воде.
1 . Мантия Земли содержит в своем составе в 10-12 раз большее количество воды, чем весь Мировой океан.
. Мантия Земли содержит в своем составе в 10-12 раз большее количество воды, чем весь Мировой океан.
2. Из всего объема воды, содержащейся на Земле, всего лишь 3% является пресной. Также интересен тот факт, что основная часть пресной воды находится в ледниках и только 1.1% водных ресурсов Земли пригодны для питья.
3. Вода в океане имеет синий цвет, благодаря избирательному рассеянию и поглощению света в ней.
4. Разные состояния воды отражают свет по разному. Так снег отражает около 85% солнечных лучей, в то время как вода всего лишь 5%. При этом под океанские льды попадает лишь 2% света.
5. В разных частях света лед имеет различную температуру. Так самый холодный лед находится в Антарктике и имеет температуру - 60 градусов. В то время как в Гренландии температура льда всего – 28 градусов, а Альпийский лед и вовсе имеет температуру 0 градусов.
6. Один грамм снега обладает площадью снежинок в сумме равной 0,06 – 0,37 метра в квадрате.
7. Вопреки общеизвестному мнению о существовании 3 различных состояний воды, таких как газообразное, жидкое и твердое, ученые выделяют только в жидкой фазе воды не менее 5 состояний и 14 состояний в твердом виде.
8. Общеизвестная формула воды h30 существует только на бумаге. В природе воды такой чистоты просто не бывает, так как вода является универсальным растворителем, растворяющем в себе множество самых различных примесей.Вода в природе различается по происхождению. По данному критерию вода может быть почвенной, талой, из свежего снега и т.д. Также воду различают и по количеству веществ, растворенных в ней. Таким образом получается, что в природе известно где-то 1330 видов воды.
9. В мировом океане средняя температура на поверхности воды равна 17,4 град. Для сравнения средняя температура в нижнем слое воздуха над поверхностью мирового океана находится на отметке 14,4 град.
10. Один кубический см морской воды содержит 1,5 гр. белка, а также множество других питательных веществ. Согласно расчетам ученых питательность Атлантического океана равна 20 тыс. урожаев, которые собирают в год на суше по всей Земле.
11. Океан занимает 3/4 от всей поверхности Земли, при этом он является мощным смягчителем Земного климата, постоянно обогревая нижние атмосферные слои.
12. Каждый день с поверхности Земли испаряется триллион тонн воды, для наглядности эта цифра выглядит следующим образом 1 000 000 000 000.
13. В одном стакане воды находится около 8 септилионов молекул. Чтобы было более понятно в цифровом выражении это выглядит так 8 000 000 000 000 000 000 000 000.
14. Тихий океан содержит 46% от общего количества воды на Земле, тогда как Атлантический океан в районе 23,9%. Индийский океан вмещает 20,3% всей воды Земли, а Северно-Ледовитый всего лишь 3,7%.

fs.nashaucheba.ru
Реферат по теме «Вода растворитель»
Реферат по теме Вода – растворитель ученика 3 Б класса МБОУ лицея №7 г. Красный Сулин Ростовской области Питкова Даниила Замечательным и важным свойством воды надо считать ее способность растворять разнообразные вещества, это самый сильный природный растворитель: в воде растворяются в той или иной мере почти все вещества. Молекулы воды "растаскивают" частицы или ионы веществ, сила притяжения между которыми ослаблена – это обеспечивает высокую растворимость веществ в воде. Это же обеспечивает "прилипание" и высокую способность к смачиванию. Поверхности тел, погруженных в воду, становятся менее прочными. Вещество в воде начинает растворяться, либо распадаясь на отдельные молекулы, как сахар в стакане чая, либо на заряженные ионы, как поваренная соль. Опыт. Что происходит с сахаром, когда мы кладем его в чай и размешиваем ложкой. Сахар исчезает. Совсем исчезает? Но ведь чай был несладкий, а стал сладкий. Сахар не исчезает, он растворяется, распадается на крошечные, невидимые глазу частички и распределяется по всему стакану. Но все ли вещества будут точно также растворяться в воде? Для того чтобы убедиться, что растворенное вещество действительно никуда не исчезает, проведем еще один опыт. В столовую ложку наберем немного жидкости из стакана, куда мы насыпали соли. Подержим ложку над огнем до тех пор, пока вода не испарится. В ложке остался белый порошок. Что это такое? Если остудить ложку и попробовать порошок на вкус. Мы легко определим, что это соль. А если насыпать в стакан с водой песок и мешать его, он не раствориться, а песчинки осядут на дно. Вещества, которые не растворяются – это глина, песок, мел. Мутную воду пить нельзя! Но такую воду можно очистить с помощью фильтра. В воде всегда растворены, наверное, сотни, а может быть, и тысячи различных соединений всех элементов таблицы Менделеева. Растворенные вещества тоже влияют на структуру воды, а, следовательно - на ее свойства. Для живых организмов вода незаменима, так как это инертный растворитель, который обычно не вступает в реакцию с растворенным веществом. Это свойство исключительно важно из-за того, что в живых системах вода служит инертным носителем разнообразных жизненно важных веществ.Интересные факты о воде.
1. Мантия Земли содержит в своем составе в 10-12 раз большее количество воды, чем весь Мировой океан.2. Из всего объема воды, содержащейся на Земле, всего лишь 3% является пресной. Также интересен тот факт, что основная часть пресной воды находится в ледниках и только 1.1% водных ресурсов Земли пригодны для питья.3.Вода в океане имеет синий цвет, благодаря избирательному рассеянию и поглощению света в ней.4. Разные состояния воды отражают свет по разному. Так снег отражает около 85% солнечных лучей, в то время как вода всего лишь 5%. При этом под океанские льды попадает лишь 2% света.5. В разных частях света лед имеет различную температуру. Так самый холодный лед находится в Антарктике и имеет температуру - 60 градусов. В то время как в Гренландии температура льда всего – 28 градусов, а Альпийский лед и вовсе имеет температуру 0 градусов.6. Один грамм снега обладает площадью снежинок в сумме равной 0,06 – 0,37 метра в квадрате.7. Вопреки общеизвестному мнению о существовании 3 различных состояний воды, таких как газообразное, жидкое и твердое, ученые выделяют только в жидкой фазе воды не менее 5 состояний и 14 состояний в твердом виде.8. Общеизвестная формула воды h30 существует только на бумаге. В природе воды такой чистоты просто не бывает, так как вода является универсальным растворителем, растворяющем в себе множество самых различных примесей.Вода в природе различается по происхождению. По данному критерию вода может быть почвенной, талой, из свежего снега и т.д. Также воду различают и по количеству веществ, растворенных в ней. Таким образом получается, что в природе известно где-то 1330 видов воды.9. В мировом океане средняя температура на поверхности воды равна 17,4 град. Для сравнения средняя температура в нижнем слое воздуха над поверхностью мирового океана находится на отметке 14,4 град.10. Один кубический см морской воды содержит 1,5 гр. белка, а также множество других питательных веществ. Согласно расчетам ученых питательность Атлантического океана равна 20 тыс. урожаев, которые собирают в год на суше по всей Земле.11. Океан занимает 3/4 от всей поверхности Земли, при этом он является мощным смягчителем Земного климата, постоянно обогревая нижние атмосферные слои.12. Каждый день с поверхности Земли испаряется триллион тонн воды, для наглядности эта цифра выглядит следующим образом 1000000000000.13. В одном стакане воды находится около 8 септилионов молекул. Чтобы было более понятно в цифровом выражении это выглядит так 8000000000000000000000000.14. Тихий океан содержит 46% от общего количества воды на Земле, тогда как Атлантический океан в районе 23,9%. Индийский океан вмещает 20,3% всей воды Земли, а Северно-Ледовитый всего лишь 3,7%.
freedocs.xyz
Исследовательская работа на тему "Вода - растворитель"
МБОУ СОШ №8 имени героя Советского Союза Будника Г.Д.
Город Лобня, Московской области
Исследовательская работа на тему: «Вода – растворитель».
Авторы работы: Климова Яна, Саввина Ангелина,
Папава Гванца, Гриценко Ирина
ученица 8 класса
Руководитель: Кудинова Н.Ф.,
к.п.н.,учитель химии высшей
квалификационной категории
2012
Введение.
Вода — одно из самых распространенных соединений на Земле. Она есть не только в реках и морях; во всех живых организмах тоже присутствует вода. Без нее невозможна жизнь. Вода — хороший растворитель (в ней легко растворяются разные вещества). Кровь животных и сок растений состоят преимущественно из воды. Вода существует вечно; она постоянно переходит из почвы в атмосферу и организмы и обратно. Более 70% земной поверхности покрыто водой.
Есть у воды одно важное свойство: она может легко растворять в себе многие вещества: твердые вещества, жидкости и газы. Поэтому в природе редко встречается чистая вода. Именно растворенный в воде кислород обеспечивает жизнь водных организмов. А сероводород, образующийся при разложении остатков организмов, делает водоем безжизненным, как, например, в глубинах Черного моря.
«Нельзя сказать, что вода необходима для жизни: она и есть жизнь»,- так сказал Сент-Экзюпери об этой жидкости. Наш организм на 60-70% состоит из воды. Вода доставляет в клетки организма питательные вещества (витамины, минеральные соли и др.) и уносит отходы жизнедеятельности. Необходимо пить, как минимум, 1,5 литра воды в день, чтобы обеспечить организму достаточную термическую стабильность и не терять более 15% содержащейся в нем воды: иначе организму грозит обезвоживание. Ведь человек чрезвычайно остро ощущает изменение содержа ния воды в своем организме и может прожить без нее всего несколько суток.
Помимо питья, человек использует воду в лечебных, гигиенических и хозяйственных целях, широко используются также лечебные минеральные воды.
Задачи исследования:
- Собрать и обобщить информацию по теме «Вода – растворитель».
- Познакомиться с явлениями диффузии и осмоса.
- Провести опыт «Силикатный сад». Сделать выводы.
Вода и ее особенности.
В молекуле воды электрические заряды слегка разделены, так как атомы водорода располагаются с одной стороны молекулы. Из-за этого ионные соединения (соединения, состоящие из ионов) так легко растворяются в ней. Ионы заряжены, и молекулы воды притягивают их.
Вода, как и все растворители, может растворить только ограниченное количество вещества. Раствор называется насыщенным, когда растворитель не может растворить дополнительную порцию вещества. Обычно количество вещества, которое способен растворить растворитель, возрастает при нагревании. В горячей коде сахар растворяется легче, чем в холодной. Шипучие напитки — это водные растворы углекислого газа. Чем выше давление, тем большее количество газа способен поглотить раствор. Поэтому когда мы открываем банку с напитком и тем самым, уменьшаем давление, из напитка вырывается углекислый газ. При нагревании растворимость газов уменьшается. В 1 литре речной и морской воды обычно растворено около 0,04 грамма кислорода. Этого хватит водорослям, рыбам и другим обитателям морей и рек.
Растворенные в воде минеральные вещества являются важнейшими питательными компонентами растений на Земле. Там, где воды мало – образуются пустыни, полупустыни, саваны.
Пышная растительность образуется там, где воды много, т.е. много питательных веществ, растворенных в воде.
Питьевая вода из разных источников может иметь различный химический состав, что сказывается на ее вкусе.
Морская вода — это раствор 44 химических элементов. Важную роль играют соли. Если всю морскую соль в сухом виде распределить по поверхности суши, то ее слой составит почти 150 м.Вода океанов содержит около 35 г/л растворенных веществ, главным образом солей, в том числе «соленого» хлорида натрия.
По составу солей Мертвое море резко отличается от всех других морей планеты. Соленость Мертвого моря в 8 раз превышает соленость Атлантического океана и 40 раз Балтийского моря. В то время как в водах других морей содержание хлорида натрия составляет 77% от всего солевого состава, в водах Мертвого моря его доля составляет 25-30%, а на долю солей магния приходится до 50%, содержание брома рекордно: в 80 раз выше, чем в Атлантическом океане.
Из-за того, что вода способна растворять другие вещества , она никогда не бывает чистой.
Растворение.
Если смешаем воду и другое вещество, то в зависимости от природы веществ и условий может быть:
- Химическая реакция.
Взаимодействие воды с металлами.
Активные металлы (щелочные, щелочноземельные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода:
2Nа + 2Н2О == 2NаОН + Н2
Са + 2Н2О = Са(ОН)2 + Н2
Взаимодействие воды с оксидами неметаллов.
N205 + Н20 = 2HN03
S02 + h30 = h3S03
Соединения оксидов неметаллов с водой относят к кислотам.
Взаимодействие воды с оксидами металлов.
Оксиды меди, железа и цинка в воде не растворяются и не соединяются с ней. Иначе ведет себя оксид кальция, или негашеная известь.
При обливании кусков негашеной извести водой наблюдается такое сильное разогревание, что часть воды превращается в пар, а куски негашеной извести, рассыпаясь, превращаются в сухой рыхлый порошок — гашеную известь, или гидроксид кальция Ca(OH)2 :
СаО + Н20 = Са(ОН)2
Подобно оксиду кальция, соединяются с водой оксиды натрия и калия:
Na20 + h30 = 2NaOH
К20+Н20 = 2КОН
При этих реакциях образуются гидроксид натрия NaOH и гидроксид калия КОН.
Таким образом, одни оксиды металлов не реагируют с водой (их большинство) другие (оксид калия, оксид натрия, оксид кальция, оксид бария и др.) соединяются с ней, образуя гидроксиды, которые относятся к основаниям.
2.Образуется раствор - система, образованная несколькими веществами, между которыми нет границ раздела. Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества . При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
Диффузия и осмос.
Как известно, при температуре выше абсолютного нуля все молекулы находятся в постоянном беспорядочном движении. Это показывает, что они обладают определенной кинетической энергией. Благодаря постоянному движению при смешении двух жидкостей или двух газов их молекулы равномерно распределяются по всему доступному объему.
Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя. Как всякое движение, диффузия требует энергии. Диффузия всегда направлена от большей концентрации данного вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной энергией. Свободной энергией называется часть внутренней энергии системы, которая может быть превращена в работу. Свободная энергия, отнесенная к 1 молю вещества, носит название химического потенциала. Таким образом, химический потенциал — это мера энергии, которую данное вещество использует на реакции или движение. Химический потенциал — функция концентрации. Скорость диффузии зависит от температуры, природы вещества и разности концентраций. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Диффузионное передвижение вещества всегда идет от большего к меньшему химическому потенциалу. Наибольший химический потенциал у чистой воды. Добавление к воде молекул растворенного вещества приводит к возникновению связи между молекулами воды и растворенного вещества, что уменьшает ее активность, ее свободную энергию, ее химический потенциал. В том случае, если диффундирующие вещества встречают на своем пути мембрану, движение замедляется, а в некоторых случаях прекращается. Диффузия воды по направлению от своего большего к меньшему химическому потенциалу через мембрану носит название осмоса. Иначе говоря, осмос — это диффузия воды или другого растворителя через полупроницаемую перепонку, вызванная разностью концентраций или разностью химических потенциалов.
Описание опыта «Силикатный сад».
Наливаем в стеклянный стакан разбавленный примерно в два раза силикатный клей (раствор силиката натрия Na2SiO3). Вносим в раствор кристаллики различных растворимых в воде солей: хлорид кобальта СоСl2∙6Н2O, хлорид никеля NiС12∙6Н2O , хлорид железа (ІІІ) FеС13∙6Н2O, сульфат алюминия А12(SO4)3∙18Н2O, хлорид марганца МnС12∙4Н2O.
Через несколько минут из кристалликов начинают вырастать очень красивые разноцветные «водоросли». Соли кобальта, никеля, железа (II), железа (III), марганца образуют «растения» соответственно розового, изумрудно-зеленого, темно-зеленого, бурого, телесного цвета, из алюминия - бесцветные «водоросли».
Вывод:
Из кристалла опущенной соли вытягивается тоненькая полая трубочка, стенки которой состоят из образующегося осадка. Осадок имеет свойство полупроницаемой пленки: она пропускает воду только в направлении до кристаллика. Далее растворение кристаллика продолжается в своеобразном мешочке из полупроницаемых стенок. Стенки этого мешочка под давлением жидкости разрываются (в разных местах) и образуется новая пленка-осадок. Кристаллик соли будто превращается в «кустик».
Наблюдается осмос – одностороннее перемещение вещества через полупроницаемую мембрану.
Вода – это, на первый бесхитростный взгляд, простое химическое соединение водорода и кислорода. Но на самом деле, вода – необычайно интересное вещество, обладающее уникальными свойствами.
nsportal.ru
Вода - химия жизни
 В.И.
Прилуцкий
В.И.
Прилуцкий
Вода -
химия жизни
Когда
мы пытаемся
определить,
есть ли жизнь
на Марсе или
других
планетах,
специалисты
в первую
очередь
пытаются
установить,
имеется ли
там вода.
Почему?
Потому что на
Земле жизнь
полностью
зависит от
воды.
Большая
часть живого,
как растений,
так и животных,
основано на
воде. Вся
жизнь на
Земле, как
полагают,
возникла из
воды. Тела
всех живых
организмов
состоят в
основном из
воды. От 70 до 90
процентов
всей
органической
материи - это
вода.
Химические
реакции во
всех
растениях и
животных,
которые
поддерживают
жизнь, происходят
в водной
среде. Вода
не только
обеспечивает
среду,
которая
делает
возможными эти
поддерживающие
жизнь
реакции, но
вода сама по
себе часто
является
важным
реагентом
или
продуктом
этих реакций.
Короче, химия
жизни - это
химия воды.
Продолжение
следует...
Вода
-
универсальный
растворитель
Вода
является
универсальным,
прекрасным растворителем
из-за заметной
полярности
молекулы
воды и ее тенденции
к
формированию
водородных
связей с
другими
молекулами.
Одна
молекула
воды, обозначаемая
химическим
символом Н2О,
состоит из 2
атомов
водорода и 1
атома кислорода.
 Одиночный
атом
водорода
содержит
один положительно
заряженный
протон в
центре и один
отрицательно
заряженный
электрон,
вращающийся
вокруг него
по
трехмерной
оболочке. С
другой
стороны,
кислород
содержит 8 протонов
в своем ядре
и 8
электронов,
вращающихся
вокруг него.
В химическом
обозначении это
часто
изображается,
как буква
О,
окруженная
восьмью
точками,
представляющими
4 набора
спаренных
электронов.
Одиночный
атом
водорода
содержит
один положительно
заряженный
протон в
центре и один
отрицательно
заряженный
электрон,
вращающийся
вокруг него
по
трехмерной
оболочке. С
другой
стороны,
кислород
содержит 8 протонов
в своем ядре
и 8
электронов,
вращающихся
вокруг него.
В химическом
обозначении это
часто
изображается,
как буква
О,
окруженная
восьмью
точками,
представляющими
4 набора
спаренных
электронов.
Единственный
электрон
водорода и 8
электронов
кислорода -
это ключ к
химии жизни,
потому что
именно здесь
атомы
водорода и
кислорода
соединяются,
чтобы
образовать
молекулу
воды или
расщепиться,
чтобы
образовать
ионы.
Водород
стремится
ионизироваться
путем потери
своего
единственного
электрона и образования
одиночных
ионов Н+,
которые
являются
просто
изолированным
протонами,
поскольку
атом
водорода не
содержит
нейтронов.
Водородная
связь образуется,
когда
электрон
одиночного
атома
водорода
делится с
другим
электроотрицательным
атомом, таким
как кислород,
у которого не
достает
электрона.
Полярность
молекул воды
 В
молекуле
воды два
атома
водорода ковалентно
связаны с
атомом
кислорода.
Поскольку
атом
кислорода
больше, чем
атомы
водорода, его
притяжение
для атомов
водорода
соответственно
больше, так
что
электроны
втягиваются
ближе в
оболочку
более
крупного
атома кислорода
из оболочек
водорода. Это
означает,
что, хотя
молекула
воды в целом
стабильна,
большая
масса ядра
водорода
стремится
захватить
все
электроны
молекулы, включая
электроны,
которые он
делит с
водородом,
придавая
кислородной
части
молекулы небольшой
отрицательный
заряд.
В
молекуле
воды два
атома
водорода ковалентно
связаны с
атомом
кислорода.
Поскольку
атом
кислорода
больше, чем
атомы
водорода, его
притяжение
для атомов
водорода
соответственно
больше, так
что
электроны
втягиваются
ближе в
оболочку
более
крупного
атома кислорода
из оболочек
водорода. Это
означает,
что, хотя
молекула
воды в целом
стабильна,
большая
масса ядра
водорода
стремится
захватить
все
электроны
молекулы, включая
электроны,
которые он
делит с
водородом,
придавая
кислородной
части
молекулы небольшой
отрицательный
заряд.
Оболочки
атомов
водорода,
из-за того,
что их
электроны
ближе к
кислороду,
приобретают
слегка
положительный
заряд. Это
означает, что
молекулы воды
стремятся к
образованию
слабых
связей с
молекулами
воды,
поскольку
кислородный конец
молекулы
отрицателен,
а водородный конец
-
положителен.
Атом
водорода,
оставаясь ковалентно
связанным с
кислородом
собственной
молекулы,
может
образовывать
слабую связь
с кислородом
другой
молекулы.
Точно так же
кислородный
конец
молекулы
может
образовывать
слабое
притяжение с
водородными
концами
других
молекул.
Поскольку
молекулы воды
обладают
такой
полярностью,
вода является
непрерывной
химической
сущностью.
Эти
слабые связи
играют
решающую
роль в стабилизации
формы многих
больших
молекул, обнаруживаемых
в живой
материи.
Поскольку
эти связи
слабы, они
готовы
порваться и
снова образовываться
в ходе
нормальных
физиологических
реакций.
Разрыв и
восстановление
таких слабых
связей
является
сутью химии
жизни.
Чтобы
проиллюстрировать
способность
воды
разрушать
другие
вещества,
рассмотрим простой
пример, когда
небольшое
количество
поваренной
соли
помещается в
стакан
водопроводной
воды. У сухой
соли (NaCl)
притяжение
между
положительными
атомами
натрия (Na+)
и
отрицательными
атомами
хлора (Cl-)
соли очень
сильно до тех
пор, пока ее
не поместят в
воду. После
того, как
соль
помещена в
воду, притяжение
отрицательного
кислорода
молекулы воды
в отношении
положительно
заряженных
ионов натрия,
и
одновременно
притяжение положительного
водородного
конца молекулы
воды в
отношении
отрицательно
заряженных
ионов хлора
оказывается
больше, чем
взаимное притяжение
между ионами Na+ и Cl-.
В воде ионные
связи в
молекуле
хлористого натрия
легко рвутся
из-за
конкурирующего
действия
многочисленных
молекул воды.



Как
видно из
этого
простого
примера, даже
хрупкая
конфигурация
отдельных
молекул воды
позволяет им
разорвать
относительно
более
сильные
связи
"общими
усилиями".
Вот почему мы
зовем воду
универсальным
растворителем.
Естественное
растворение
рвет связи в
более
крупных и
комплексных
молекулах.
Это и есть
химия жизни
на Земле, в
воде и на суше.
Окислительно-восстановительные
реакции
В
основном
восстановление
означает
добавление
электрона (е-), а его
противоположность,
окисление
означает
отбор
электрона.
Добавление
электрона,
восстановление,
накапливает
энергию в восстановленном
соединении.
Отбор электрона,
окисление,
высвобождает
энергию из
окисляемого
соединения.
Когда одно
вещество
восстанавливается,
другое - окисляется.
Чтобы
пояснить
термины,
рассмотрим
две молекулы,
например, А и
В. Когда
молекулы А и
В приходят в
соприкосновение,
вот что
получается:
В
захватывает
электрон из
молекулы А.
Молекула А
окисляется,
поскольку
она потеряла
электрон.
Чистый заряд В был
восстановлен
(уменьшен),
поскольку
она получила
отрицательный
электрон (е-).
В
биологических
системах
отбор или
добавление
электрона
составляет
наиболее распространенный
механизм
окислительно-восстановительных
реакций. Эти
окислительно-восстановительные
реакции
часто
называют ОВР.
Кислоты
и основания
Кислота
- это
вещество,
которое
увеличивает
концентрацию
ионов
водорода (Н+)
в воде.
Основание -
это вещество,
которое уменьшает
концентрацию
ионов
водорода,
увеличивая
концентрацию
гидроксидных
ионов ОН+.
Степень
кислотности
или
щелочности
раствора
измеряется в
терминах
величины,
известной,
как рН,
которая
является
отрицательным
логарифмом
концентрации ионов
водорода:
pH = 1/log[H+] = -log[H+]
Что
такое рН?
По
шкале рН,
которая
имеет
диапазон от 0
на кислотном
конце до 14 на
щелочном
конце,
раствор
является
нейтральным,
если его рН
равно 7. При рН 7 вода
содержит
равные
концентрации
ионов Н+ и ОН-.
Вещества с рН меньше 7
являются
кислотами,
поскольку
они содержат более
высокую
концентрацию
ионов Н+.
Вещества с рН более 7
являются
щелочами,
поскольку
они содержат
более
высокую
концентрацию
ОН-, чем Н+.
Шкала рН
является
логарифмической
шкалой,
поэтому
изменение рН на
единицу означает
десятикратное
изменение
концентрации
ионов
водорода.
Важность
балансирования
рН
Все
живое
чрезвычайно
чувствительно
к рН и
функционирует
наилучшим
образом (за
некоторыми
исключениями,
такими как
определенные
отделы
пищеварительного
тракта), когда
растворы
близки к
нейтральным.
Большая
часть
внутренней
живой
материи (за
исключением
ядер клеток)
имеет рН
около 6,8.

Плазма
крови и
другие
жидкости,
окружающие
клетки в
теле, имеет рН от 7,2 до 7,3.
Многочисленные
специальные
механизмы
помогают
стабилизировать
эти жидкости,
так чтобы
клетки не
подвергались
ощутимым
флуктуациям рН.
Вещества,
которые
служат в
качестве
механизма
стабилизации
рН,
называются
буферами.
Буферы
обладают способностью
связывать
ионы и
удалять из из
раствора,
когда их
концентрация
начинает расти.
Соответственно,
буферы могут
высвобождать
ионы, когда
их
концентрация
начинает
падать. Таким
образом,
буферы
помогают
минимизировать
флуктуации рН. Это
важная
функция,
поскольку
многие биохимические
реакции,
нормально
протекающие
в живых
организмах,
или
высвобождают,
или используют
ионы.
Кислород:
слишком
много
хорошего?
 Кислород
очень важен
для жизни. В
воздухе он
относительно
стабилен, но,
будучи в
слишком
больших
количествах
поглощен
телом, он
может стать
активным и
нестабильным,
и имеет
тенденцию
прикреплять
себя к
биологическим
молекулам, включая
молекулы
здоровых
клеток.
Химическая
активность
таких
свободных
радикалов
обусловлена
одной или
более пар
несвязанных
электронов.
Кислород
очень важен
для жизни. В
воздухе он
относительно
стабилен, но,
будучи в
слишком
больших
количествах
поглощен
телом, он
может стать
активным и
нестабильным,
и имеет
тенденцию
прикреплять
себя к
биологическим
молекулам, включая
молекулы
здоровых
клеток.
Химическая
активность
таких
свободных
радикалов
обусловлена
одной или
более пар
несвязанных
электронов.
Около 2%
кислорода,
которым мы
обычно дышим,
становятся
активным
кислородом, и
это количество
возрастает
примерно до 20%
при занятиях
аэробикой.
ПЕРЕХОД НА
ГЛАВНУЮ СТРАНИЦУ
prof80d.narod.ru
О роли воды в организмах. Вода как растворитель
Вода в организме человека выполняет роль пластического материала, универсального растворителя, транспортного средства и, наконец, химического реактива в множестве реакций, составляющих обмен веществ. [c.181] Воду часто называют уникальной жидкостью, что вполне справедливо, если иметь в виду уникальность той роли, которую играет вода в процессах протекающих в живых организмах (жизнь на Земле первоначально возникла именно в воде), а также в технике и быту. Огромные усилия затрачиваются учеными на то, чтобы раскрыть тайну воды, объяснить, почему именно вода заняла исключительное место среди всех жидкостей. Некоторые детали строения и свойств воды к настоящему времени надежно установлены, но очень многие вопросы до сих пор остаются без ответа. Одно бесспорно особое значение воды и как растворителя, и как среды для протекания биохимических реакций,— прямой результат необычных свойств этой самой распространенной на Земле жидкости. Именно в структуре и свойствах чистой воды следует искать причину появления комплекса специфических свойств, заметно отличающих водные растворы неэлектролитов от неводных. Мы специально говорим здесь о растворах неэлектролитов не только потому, что именно они составляют предмет рассмотрения в этой книге, но и потому, что при сопоставлении свойств водных и неводных растворов электролитов возникает трудность, связанная с различиями в ионизирующей способности, а это приводит, как известно, к ассоциации ионов в малополярных растворителях и делает сравнение малополезным. [c.5]
О роли воды в организмах. Вода как растворитель [c.102] Из всех жидкостей, рассматриваемых в качестве растворителя, наибольшее значение имеет вода вследствие ее распространенности в природе и той особой роли, какую она играет в жизни всех организмов. Вода является главной составной частью всех клеток и тканей. Организм взрослого человека содержит в среднем 65% воды, организм новорожденного — 70%. В нормальных условиях организм взрослого человека потребляет в сутки около 2,5 л воды. Часть этого количества вводится в организм извне, остальное образуется внутри организма в результате окисления веществ, содержащих водород (углеводы, жиры, белки). [c.15]
Объем газа, растворенного в одном объеме растворителя, приведенный к нормальным условиям, называется коэффициентом поглощения газа. Как видно из приведенных данных в табл. 27, растворимость кислорода в воде больше растворимости азота почти в два раза. Это играет большую роль для организмов, живущих в воде. [c.114]
Хитин является пленко- и волокнообразующим полимером. Хитиновые оболочки кроме опорной функции выполняют также роль полупроницаемых мембран, регулирующих водообмен организмов насекомых с окружающей средой. Хитин нерастворим в воде, спиртах, кетонах, в других органических растворителях. Он способен медленно растворяться в безводной НСООН. [c.330]
Вода, состоящая из молекул ВгО и называемая окисью дейтерия, или тяжелой водой, получила применение в качестве замедлителя в ядерных котлах (стр. 419). Ее содержание в обычной воде составляет 0,02%. Она медленнее подвергается электролизу, чем обычная вода. Этим пользуются для ее выделения. Особенность тяжелой воды как растворителя та, что в ней сильно снижена активность ферментов. Благодаря этому она как бы подавляет процессы в живых организмах, выступая в роли своеобразного яда. [c.98]
Для правильной оценки роли воды следует учесть, что химические и физико-химические реакции в животном организме протекают в водной среде. Вода не просто индифферентный растворитель реагирующих веществ, она сама по себе является активным участником многих реакций обмена. К таким реакциям относятся не только все реакции гидролиза, где вода непосредственно участвует в реакции, но также многочисленные ракции окисления, реакции гидратации, набухания коллоидов и многие другие. [c.385]
Такое высокое содержание воды в организмах с несомненностью говорит об очень значительной роли ее в процессах жизнедеятельности. Вода является растворителем разнообразнейших органических и неорганических веществ в организме. Кровь, лимфа, спинномозговая жидкость у высокоорганизованных животных, соки, идущие по [c.102]
Обрисовав схематично общее значение воды в жизнедеятельности организмов, перейдем к детальному рассмотрению роли воды как растворителя, а также к изучению растворов. [c.105]
Вода служит основным средством вывода и передвижения различных веществ от одного органа к другому во всех организмах, так как является растворителем для многих веществ, присутствующих или реагирующих в живых клетках. Невозможно найти жидкость, которая могла бы сравниться по своим свойствам растворителя с водой. Вода выступает в то же время в качестве конечного продукта биологического окисления органических веществ и играет важную роль при гидролитическом распаде и многих других химических реакциях. [c.57]
Хотя вода может проникать через такую полупроницаемую перегородку в обе стороны, но скорость ее прохождения из наружного сосуда во внутренний будет больше, чем в обратном направлении. Это явление — самопроизвольный переход растворителя в раствор, отделенный от него полупроницаемой перепонкой, — называется осмосом. Оно играет важную роль в жизнедеятельности растительных и животных организмов. [c.359]
Свободная вода составляв основу многих биологических жидкостей крови, лимфы, слюны, мочи и т. д. Она участвует в обмене веществ между клетками тела и внешней средой, в доставке питательных веществ, удалении продуктов внутриклеточного обмена, в поддержании температуры тела, а также выполняет механическую роль, способствуя скольжению трущихся поверхностей суставов. Кроме того, оиа проявляет свойства уникального растворителя веществ. При задержке в организме свободная вода собирается под кожей и образует отеки. При ее потере уменьшается объем плазмы крови, кровоснабжение тканей, а следовательно, доставка к ним кислорода и питательных веществ, что влияет на деятельность мозга. сердечно-сосудистой системы и скелетных мышц. [c.64]
Жизненные процессы у растений, как и у других организмов, протекают в водной среде. Вода необходима для поддержания структурной целостности биологических молекул и, следовательно, целостности клеток, тканей и всего организма. Она играет также важнейшую роль как растворитель минеральные и прочие питательные вещества перемещаются в растении в виде растворов. В отличие от того, что наблюдается у наземных животных, у всех нормально вегетирующих растений жидкая фаза воды непрерывна на всем протяжении от влаги, содержащейся в почве, до поверхности раздела жидкость — газ в листьях, где происходит испарение. Быстрый рост корней в почве обеспечивает обширную всасывающую поверхность, через которую проходят практически вся вода и все минеральные вещества, используемые растением. [c.11]
До недавнего времени говорить о структурной перестройке и кооперативных процессах в воде было не принято, а вопросы о структурированной воде и связанных с ней физиологических эффектах рассматривались как нечто апокрифическое. Вода как в свободном виде, так и в составе биологических организмов считалась пассивной и ей отводилась роль механического растворителя или простого аккумулятора тепловой энергии, в котором происходят многочисленные активные превращения веществ. [c.4]
ХОЛЕСТЕРИН С2,Н4( 0—одноатомный полициклический спирт, из группы стери-пов, пластинки с перламутровым блеском, жирные на ощупь, т. пл. 149 С нерастворим в воде, малорастворим в органических растворителях. В свободном состоянии и в виде сложных эфиров содержится в животных организмах. Особенно много X. в тканях нервной системы, кожном жире, желче, а больше всего в мозге, печени, почках. Из пищевых продуктов X. больше всего в животных жирах, желтках яиц и др. Многие вещества, играющие важную роль в организме,— производные X. (витамины, половые гормоны и др.). Нарушение обмена X. в организме вызывает ряд заболеваний (атеросклероз, холецистит и др.). X. впервые выделен из желчного камня, почти целиком состоящего из X. Нормальное содержание X. в крови человека составляет 160—200 мг в 100 мл. X. получают из спинного мозга животных, из жира, получаемого при промывке овечьей шерсти (ланолина) и др. [c.279]
Липидами называют жиры и жироподобные вещества растительного и животного происхождения, близкие по своим физико-химическим свойствам, но различающиеся по биохимической роли в организмах. Все липиды гидрофобны, т. е. нераствори.мы в воде, однако в ряде органических растворителей— эфире, ацетоне, бензоле, хлороформе они растворяются довольно хорошо. [c.304]
Наш организм почти па три четверти состоит из воды. Конечно, вода — прежде всего растворитель, в среде которого протекают все элементарные, молекулярные акты жизнедеятельности. Принципиальна роль воды как продукта и субстрата энергетичелкого метаболизма в живой клетке. Образно говоря, вода — это арейа, на которой разыгрывается действие жизни, и участник основных биохимических превращений. [c.9]
Это явление было открыто в 1748 г. французским священником Нолле. Он поместил раствор сахара в воде в закрытую снизу полупроницаемой перегородкой стеклянную трубку, которую погрузил в сосуд с чистой водой (рис. VI.3). Такая перегородка, например из бычьего пузыря, пропускает молекулы воды и не пропускает молекулы сахара. Нолле наблюдал засасывание воды в раствор, приводившее к повышению уровня в трубке. Избыточное давление, определяемое разностью высот уровней к жидкости в трубке и в сосуде, называется осмотическим давлением я. Это есть давление, которое необходимо приложить к раствору, чтобы растворитель не проникал в этот раствор через полупроницаемую перегородку. Осмотическое давление в растворе не существует, оно возникает лишь, если отделить раствор от растворителя полупроницаемой перегородкой. Осмотические явления широко распространены в природе. Оболочки растительных клеток являются перегородками, пропускающими воду и не пропускающими растворенные вещества. Поэтому клетки засасывают воду. Подобные мембранные явления играют большую роль и в организмах животных, например они регулируют концентрации солей в крови. [c.70]
В предыдущих главах мы уже рассмо- трели такие важные компоненты клетки, как вода, белки, ферменты, коферменты и углеводы. Перед тем как перейти к изучению метаболических процессов в клетках, следует рассмотреть еще одну группу биомолекул-лшмЭы. Липиды представляют собой нерастворимые в воде маслянистые или жирные вещества, которые могут быть экстрагированы из клеток неполярными растворителями, такими, как эфир или хлороформ. Наиболее распространенные липиды-жиры или триащлглицеролы, играют роль топлива для больщинства организмов. Именно в них запасается ббльшая часть энергии, ьщеляющейся в результате химических реакций. [c.325]
Какие же требования предъявляются к полимерам, используемым в фармакологии Прежде всего — это отсутствие у полимера и продуктов его деструкции токсичности. Токсическая и терапевтическая дозы должны заметно различаться. Полимер должен полностью выводиться из организма. Поскольку высокомолекулярные фракции могут накапливаться в печени, почках и других органах, необходимо знать молекулярно-весовое распределение полимера. Полимеры, как правило, должны хорошо растворяться в воде, в физиологическом растворе, в крови. Так, наличие в макромолекулах групп СООН, ОН, NHa, NH, SO3H, РО3Н, N->0, (-О-СН -— Hg—) и др. обусловливает их растворимость в воде. Важную роль играют концевые группы полимера, поскольку они могут проявлять собственную физиологическую активность например, бактерицидные свойства проявляет высокомолекулярный поливиниловый спирт, имеющий на конце остатки тг-амипосалициловой кислоты Кроме того, в полимере должны отсутствовать низкомолекулярные продукты растворители, катализаторы, стабилизаторы, пластификаторы, красители и др. Полимер должен быть устойчивым при хранении. [c.303]
Все волокнообразующие белки, например фиброин шелка и коллаген, построены преимущественно из бифункциональных аминокислот это практически линейные, хорошо кристаллизующиеся полипептидные цепи (см. ниже). Они обладают высокой разрывной прочностью при сравнительно низком удлинении. Нерастворимость шелка обусловлена кристаллизацией фиброина после выделения раствора из желез шелковичного червя. Растворение белка, так же как и растворение целлюлозы, затрудняется вследствие образования большого числа водородных связей между пептидными группами (растворители для целлюлозы, см, стр. 142—143, пригодны также для шелка из этих растворов белок люжет быть высажен добавлением раствора соли). Коллаген, по-видимому, имеет слабо выраженную сетчатую структуру, которая разрушается при гидролизе (образование желатины). Молекулярный вес коллагена превышает 1-10 (установлено путем измерения вязкости в 0,1%-ном растворе моно-хлоруксусной кислоты в воде). Очень высокий молекулярный вес этих полимеров вполне вероятен, очевидно, этим объясняется неудача попыток Грассмэна обнаружить концевые группы.. Эластин представляет собой высокоэластичное вещество с изотропной структурой, которая при вытягивании превращается в анизотропную. Поэтому эластин при вытягивании ведет себя как натуральный каучук. Его молекула также состоит преимущественно из бифункциональных аминокислот, которые вследствие своего строения затрудняют кристаллизацию (валин, пролин, фенилаланин) наличие некоторого числа химических связей между макромолекулами обусловливает абсолютную нерастворимость эластина. Эластин чрезвычайно устойчив к гидролизу (устойчивее, чем коллаген). Роль, выполняемая эластином в животных организмах, находится в соответствии с его аминокислотным составом больпюе количество [c.101]
Рассмотренные соотношения лежат в основе обшей теории кислот, оснований и индикаторов в водной среде. Концентрация водородных ионов играет большую роль в целом ряде самых различных явлений и процессов—в жизнедеятельности растворитель-ных и животных организмов и организма человека, в производственных процессах пищевой, кожевенной, текстильной и многих других отраслей промышленности она сильно влияет на свойства природных вод и на возможность применения их для той или дглг-" гой""целй . ...................................................... ..................... ................. -.......-. .......... [c.383]
Вода как растворитель. Вода давно является важнейшим растворителем, применяемым в технике, и такую же роль играет в природе. В ней растворяется огромное число веществ. Вода растворяет электролиты (кислоты, основания и соли), образуя растворы, в которых эти вещества содержатся в виде ионов. Она также растворяет многие неионизирующиеся соединения, как органические, так и неорганические. В водном растворе происходит большое число химических реакций. Из них особое значение имеют биохимические реакции, происходящие в живых организмах с участием органических веществ, например сахаров и белков (брожение, окисление и т. д.). [c.332]
Вода — важнейшая составная часть всех организмов. Она выступает в организме в роли растворителя различных веществ в водной среде происходят различные химические реакции, с участием воды идут реакции гидролиза сложных органических веществ, вода образуется как продукт реакций окисления органических веществ. Большинство химических пре-врап1,ений, лежащих в основе жизнедеятельности организма, в той или иной мере связано с участием воды. Отсюда понятно, что жизнь без воды невозможна. Организм взрослого человека на 65% состоит из воды. Еще больше воды содержится в сочных частях растений и в микроорганизмах. [c.203]
Липиды представляют собою большую группу органических веществ, различных по химической структуре и обладающих одним общим для них свойством — нерастворимостью в воде и растворимостью в различных органических растворителях. Вполне попят1ю, что путь превращения различных по своей структуре липидов, их распад и синтез ие люгут быть одинаковыми. Различной должна быть и роль их в организме. Ниже мы остановимся на обмене жиров, фосфатидов и стеридов. О роли липовита-минов и стеринов уже сообщалось (стр. 118 и 50). [c.303]
Как изменение структуры гйдратных комплексов II формы связи молекул воды в них повлияет на ход биохимических процессов в пашем организме, на наше самочувствие и поведение По теории Полинга, изменение свойств гйдратных комплексов под влиянием анестетиков приводит к наркозу. Анализ основных за-коиомерностей действия анестетиков, а также нервных и мышечных (паралитических) ядов, наркотиков и галлюциногенов показывает, что во всех этих случаях именно реакция расслоения является универсальным механизмом выключения активного функционирования клеток. Иными словами, вода внутри клеток нашего организма — не пассивный растворитель, и закономерности ее связывания биологически активными веществами могут быть использованы для объяснения некоторых биохимических механизмов регулирования и саморегулирования не. только в патологических состояниях, но и в нормальной работе систем организма, в том числе гормональной. Эта сторона роли связанной воды представляется наиболее существенной в работе живой клетки, ей мы посвятим первую часть нашей книги. [c.10]
Огромная роль углеводов и в частности дисахаридов в функционировании живых организмов общеизвестна. Именно поэтому свойства водных растворов этих биоактивных веществ интенсивно изучаются. Однако, несмотря на многочисленные экспериментальные исследования и результаты машинного моделирования, мнения по поводу конформационного состояния молекул дисахаридов в воде весьма противоречивы. Некоторые авторы считают, что, например, конформация сахарозы [ 1, 2] в водном растворе подобна кристаллической, т.е. близка к сферической и является достаточно жесткой, но при растворении возможна потеря одной внутримолекулярной водородной связи [2]. Интерпретируя рентгеновские данные и рамановские спектры, авторы [3,4] полагают, что число внутримолекулярных водородных связей зависит от концентрации сахарозы, а при низких концентрациях их нет вообще. Однако на основании результатов ЯМР исследований машинного моделирования авторы [5] пришли к выводу о том, что в водных растворах сахарозы в отличие от мальтозы и целлобиозы водородная связь не является определяющей в формировании конформаций. Нил и Горинг [6], объясняя кажущиеся удельные расширяемости мальтозы в водном растворе, предположили, что два остатка глюкозы в молекуле В-мальтозы складьшаются за счет внутримолекулярной гидрофобной связи, перекрывая доступ растворителя к гидрофобным поверхностям. Авторы [7] также считают, что конформации мальтозы и сахарозы могут претерпевать большие изменения. Однако неизвестно, зависят ли эти конформационные изменения от концентрации. По мнению этих авторов, конформация лактозы не допускает сильных внутримолекулярных взаимодействий. [c.135]
chem21.info
Универсальный растворитель
ОМАГНИЧЕННАЯ ВОДА
Вода является наилучшим растворителем: в ней в той или иной степени растворяются почти все неорганические вещества и немало органических.
В морях и океанах находятся в растворенном состоянии свыше 60 элементов периодической системы. Так, золота в Мировом океане содержится столько, что если его полностью извлечь, то на каждого жителя Земли достанется по 3 килограмма. Казалось бы, много. В предыдущем разделе мы указывали, сколько воды содержит мировой океан. Если поделить все золото на объем воды в океане, то получим концентрацию 0,01 мг/м3 воды. При такой концентрации и нынешнем уровне техники добывать золото из океана нерационально. Для сравнения приведем другую цифру: уран добывают при концентрации свыше 2 мг/м3 раствора.
Водопровод в Древнем Риме был выложен изнутри свинцом. Протяженность водопровода составляла 443 км. Расход воды, как мы уже указывали,— до 3 л на каждого жителя ежедневно. В этой воде, конечно, понемногу растворялся свинец, и жители Вечного Города получали с пищей избыточное количество этого тяжелого и ядовитого металла. Как показали археологические раскопки, кости древних римлян, действительно, имеют повышенное содержание свинца. Возможно, отравление свинцом было причиной смерти многих жителей Древнего Рима.
Вода легко поглощает газы, в том числе и такие, которые при соединении с водой образуют кислоты, а кислая вода обладает повышенной растворяющей способностью. В кислотах, например, растворяются (правильнее сказать: с кислотами взаимодействуют) металлы.
На некоторых металлургических и химических предприятиях, где плохо ведется газоочистка, из труб идет цветной дым. Дым рыжего цвета в обиходе называют «лисьим хвостом» — это газ NO2 (вместе с несгорев - шими частицами). Соединяясь с парами воды, оксид азота(IV) образует в атмосфере смесь кислот:
2N02 + h30 = HN03 + HN02.
Потом с росой или дождем азотная HNO3 и азотистая HNO2 кислоты попадают на землю, вызывая повышенную коррозию металлических изделий.
В газовых выбросах ряда предприятий содержится оксид серы(IV), который с парами воды образует сернистую кислоту:
S02 + h30 = h3S03.
Выпадающий в городе дождь содержит некоторое количество сернистой кислоты, а также серной, образующейся из оксида серы(VI). Дождь может быть и радиоактивным, если облако встретит на своем пути радиоактивные газовые выбросы. Наконец, дождевая вода содержит и растворенные соли в количестве до З мг на 1 дм3 воды. Таким образом, дождь и снег не могут быть примером чистого вещества.
В чистой воде водородный показатель рН должен быть равен 7,0. Именно таким мы вправе его ожидать в дистиллированной воде. Однако в действительности вода реагирует с СОо, содержащимся в воздухе:
С02 + Н20 = Н2С03.
Наличие угольной кислоты Н2СО3 обусловливает слабокислую реакцию дистиллированной воды: рН = = 6,54-6,0.
| 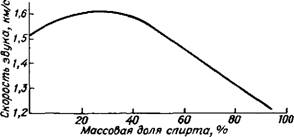
Рис. I. Изменение скорости звука в водных растворах этилового спирта с повышением концентрации |
Но если вода хотя бы частично растворяет стенки сосуда, в котором она находится, то даже дистиллированная вода может считаться чистой лишь в самом первом приближении. Гораздо чище дважды дистиллированная вода (бидистиллят), еще чище — трижды дистиллированная (тридистиллят). В 1894 г. Ф. Коль - рауш получил воду, которая до настоящего времени является рекордно чистой: он проводил дистилляцию 42 раза подряд, причем держал воду в сосуде, с которым работал до этого в течение 10 лет и из которого, таким образом, перешло в воду максимум возможного. Степень чистоты определяют по электрической проводимости; вода, полученная Кольраушем, имела проводимость в 100 раз меньше, чем обычная дистиллированная.
Вода, в которой растворено какое-то вещество, естественно, отличается по своим свойствам от чистой воды. Известно, например, что этиловый спирт хорошо растворяется в воде. При этом некоторые свойства воды изменяются незначительно: она остается прозрачной, маловязкой жидкостью. Зато изменяются запах, вкус, плотность, температура затвердевания и многие другие свойства. На рис. 1 показано, как изменяется такая характеристика, как скорость звука и. По мере добавления спирта к воде величина а — начиная с 20 % спирта — линейно уменьшается. Это кажется вполне естественным, так как для воды « = 1485 м/с, для спирта «=1173 м/с.
Если же добавлять к воде поваренную соль (хлорид натрия), то величина и начнет возрастать, и это
| 
Рис. 2. Изменение скорости звука в водных растворах бромидов щелочных металлов с повышением концентрации |
Тоже кажется вполне естественным, ибо для монокристалла соли « = 4500 м/с. Однако, если сравнить разные соли, например группу бромидов щелочных металлов (рис. 2), то обнаружим странное явление: добавление некоторых солей вызывает понижение скорости звука. В монокристаллах таких солей (их известно более двух десятков) скорость звука выше, чем в воде, но меньше, чем во льду (для льда ы = 3800 м/с). Во всех остальных случаях скорость звука в кристаллах растворенных солей больше, чем во льду. Поэтому мы должны сделать вывод, что при растворении солей в воде существенное значение имеет лед, который, следовательно, присутствует в виде обособленной фазы.
Расскажем о процессе, который изучали более всего и о котором, естественно, было более всего споров. Сейчас, когда у нас есть хотя бы приблизительное представление о механизме магнитной обработки, недавние дискуссии …
Эта фраза принята в радиоразговоре. Абонент, находящийся, возможно, на большом удалении, должен ответить: «Вас понял! Прием!» Этим он подтверждает, что понял текст и свое дальнейшее поведение будет соотносить с полученной …
Весьма странной выглядит сезонность многих результатов магнитной обработки: изменения тех или иных свойств, которые надежно отмечаются летом, осенью и зимой, непонятным образом исчезают в апреле—мае. Взволнованные сообщения об этом поступали …
msd.com.ua
 ля того чтобы убедиться, что растворенное вещество действительно никуда не исчезает, проведем еще один опыт. В столовую ложку наберем немного жидкости из стакана, куда мы насыпали соли. Подержим ложку над огнем до тех пор, пока вода не испарится. В ложке остался белый порошок. Что это такое? Если остудить ложку и попробовать порошок на вкус. Мы легко определим, что это соль.
ля того чтобы убедиться, что растворенное вещество действительно никуда не исчезает, проведем еще один опыт. В столовую ложку наберем немного жидкости из стакана, куда мы насыпали соли. Подержим ложку над огнем до тех пор, пока вода не испарится. В ложке остался белый порошок. Что это такое? Если остудить ложку и попробовать порошок на вкус. Мы легко определим, что это соль. еферат по теме «Вода – растворитель»
еферат по теме «Вода – растворитель»

 . Мантия Земли содержит в своем составе в 10-12 раз большее количество воды, чем весь Мировой океан.
. Мантия Земли содержит в своем составе в 10-12 раз большее количество воды, чем весь Мировой океан.
 В.И.
Прилуцкий
В.И.
Прилуцкий Одиночный
атом
водорода
содержит
один положительно
заряженный
протон в
центре и один
отрицательно
заряженный
электрон,
вращающийся
вокруг него
по
трехмерной
оболочке. С
другой
стороны,
кислород
содержит 8 протонов
в своем ядре
и 8
электронов,
вращающихся
вокруг него.
В химическом
обозначении это
часто
изображается,
как буква
О,
окруженная
восьмью
точками,
представляющими
4 набора
спаренных
электронов.
Одиночный
атом
водорода
содержит
один положительно
заряженный
протон в
центре и один
отрицательно
заряженный
электрон,
вращающийся
вокруг него
по
трехмерной
оболочке. С
другой
стороны,
кислород
содержит 8 протонов
в своем ядре
и 8
электронов,
вращающихся
вокруг него.
В химическом
обозначении это
часто
изображается,
как буква
О,
окруженная
восьмью
точками,
представляющими
4 набора
спаренных
электронов. В
молекуле
воды два
атома
водорода ковалентно
связаны с
атомом
кислорода.
Поскольку
атом
кислорода
больше, чем
атомы
водорода, его
притяжение
для атомов
водорода
соответственно
больше, так
что
электроны
втягиваются
ближе в
оболочку
более
крупного
атома кислорода
из оболочек
водорода. Это
означает,
что, хотя
молекула
воды в целом
стабильна,
большая
масса ядра
водорода
стремится
захватить
все
электроны
молекулы, включая
электроны,
которые он
делит с
водородом,
придавая
кислородной
части
молекулы небольшой
отрицательный
заряд.
В
молекуле
воды два
атома
водорода ковалентно
связаны с
атомом
кислорода.
Поскольку
атом
кислорода
больше, чем
атомы
водорода, его
притяжение
для атомов
водорода
соответственно
больше, так
что
электроны
втягиваются
ближе в
оболочку
более
крупного
атома кислорода
из оболочек
водорода. Это
означает,
что, хотя
молекула
воды в целом
стабильна,
большая
масса ядра
водорода
стремится
захватить
все
электроны
молекулы, включая
электроны,
которые он
делит с
водородом,
придавая
кислородной
части
молекулы небольшой
отрицательный
заряд.



 Кислород
очень важен
для жизни. В
воздухе он
относительно
стабилен, но,
будучи в
слишком
больших
количествах
поглощен
телом, он
может стать
активным и
нестабильным,
и имеет
тенденцию
прикреплять
себя к
биологическим
молекулам, включая
молекулы
здоровых
клеток.
Химическая
активность
таких
свободных
радикалов
обусловлена
одной или
более пар
несвязанных
электронов.
Кислород
очень важен
для жизни. В
воздухе он
относительно
стабилен, но,
будучи в
слишком
больших
количествах
поглощен
телом, он
может стать
активным и
нестабильным,
и имеет
тенденцию
прикреплять
себя к
биологическим
молекулам, включая
молекулы
здоровых
клеток.
Химическая
активность
таких
свободных
радикалов
обусловлена
одной или
более пар
несвязанных
электронов.

