
К числу сильных окислителей, широко используемых на практике, относятся галогены (Fe2, Cl2, Br2, I2), оксид марганца Mn+4O2, перманганат калия KMn+7O4, манганат калия K2Mn+6O4, оксид хрома (хромовый ангидрид) Cr+6O3, хромат калия K2Cr+6O4, бихромат калия K2Cr2+6O7, азотная кислота HN+5O3 и ее соли, кислород О2, озон О3, перекись водорода Н2О2, концентрированная серная кислота Н2S+6О4, оксид меди (II) Сu+2О, оксид серебра Ag2+1O, оксид свинца Рb+4О2, гипохлориты (например, NaCl-1O) и другие соединения.
Щелочные и щелочноземельные металлы являются сильными восстановителями. К числу других восстановителей относятся: водород, углерод, оксид углерода С+2О, сероводород Н2S-2, оксид серы S+4О2, сернистая кислота Н2S+4О3 и ее соли, галогенводороды (кроме HF), хлорид олова (II) Sn+2Cl2, сульфат железа (II) Fe+2SO4.
Различают три типа окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные и реакции самоокисления–самовосстановления.
Межмолекулярные – это такие реакции, в которых молекулы, атомы или ионы элементов, входящие в состав одного вещества и являющиеся окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2h3O.
Во внутримолекулярных реакциях изменяется СО элементов одного и того же вещества таким образом, что одни из них окисляются, а другие - восстанавливаются. К таким реакциям относится, например, разложение бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
2Hg+2O-2 = 2Hg0 + O20.
В реакциях самоокисления–самовосстановления (диспропорционирования) атомы одного и того же вещества так взаимодействуют друг с другом, что одни отдают электроны (окисляются), а другие их присоединяют (восстанавливаются). Например, растворение хлора в воде:
Cl20 + h3O = HCl+1O + HCl-1 или
(Cl0Cl0 + h3O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное от деления молярной массы вещества на число приобретаемых (или теряемых) электронов. Так, в реакции
5h3S + 2KMnO4 + 3h4SO4 = 5S + 2MnSO4 + K2SO4 + 8h3O
для KMnO4 окислительный эквивалент равен 158,15/5, а для сероводорода восстановительный эквивалент – половине его молярной массы.
С точки зрения электронной теории окислительно–восстановительными реакциями называются такие реакции, при протекании которых происходит переход электронов от одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно–восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных восстановителем всегда равно числу электронов, принятых окислителем. Это положение называется принципом электронного баланса и лежит в основе нахождения коэффициентов в уравнениях окислительно–восстановительных реакций.
Согласно этому принципу число молекул окислителя и число молекул восстановителя в уравнении окислительно-восстановительных реакций должны быть такими, чтобы количество принимаемых и отдаваемых электронов было одинаковым.
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных примерах.
При каталитическом окислении аммиака Nh4 кислородом О2 образуется оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
Nh4 + O2 NO + h3O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3h4 + O20 N+2O-2 + h3O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород – окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до -2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные процессы в виде схемы:
| N-3 - 5ē N+2 5 20 O20 + 4ē 2O-2 4 | 4 окисление – восстановитель 5 восстановление - окислитель |
Согласно принципу электронного баланса количества молекул окислителя и восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были равными. Для этого находится общее кратное, а затем делится на число отдаваемых или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы Nh4 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4Nh4 + 5O2 NO + h3O.
Все остальное уравнивается в соответствии с их величиной:
4Nh4 + 5O2 4NO + 6h3O.
При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая кислота h4AsO4, серная h3SO4 и оксид азота NO.
Составим схему реакции, указывая СО над символами тех элементов, у которых в процессе реакции они изменяются:
As2+3S3-2+ HN+5O3 h4As+5O4 + h3S+6O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в виде схемы:
| As2+3S3-2 - 28ē = 2As+5 + 3S+6 (окисление) 84 N+5 + 3ē = N2+ (восстановление) | 3 28 |
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6h4AsO4 + 9h3SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода добавлением молекул воды приводит к автоматическому уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ, то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6h4AsO4+ 9h3SO4 + 28NO.
Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:

| | 8 24 6 | 4 3 | (восстановление) (окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3h3S = 4HCl + 3h3SO4.
Электронный баланс в данном случае  .
.
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:

|
| 3 3 1 | 6 2 | (окисление) (восстановление) |
6FeSO4 + 2HNO3 + 3h3SO4 = 3Fe2(SO4)3 + 2NO + 4h3O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул h3SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:

|
| 1 3 группы по два иона хлора, всего шесть ионов хлора | (восстановление) (окисление) |
K 2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
K
 2Cr2O7 + 6HCl + 8HCl 2CrCl3 + 3Cl2 + 2KCl.
2Cr2O7 + 6HCl + 8HCl 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды h3O, и получим окончательно:
K2Cr2O7 + 14HCl 2CrCl3 + 3Cl2 + 2KCl + 7h3O.
6. 
|
| 8 2 | 4 1 | (окисление) (восстановление) |
Основные коэффициенты 4 и 1:
4 Сa + HNO3 4Ca(NО3)2 + Nh5NO3.
Сa + HNO3 4Ca(NО3)2 + Nh5NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:
4

 Сa + HNO3 + 9HNO3 4Ca(NО3)2 + Nh5NO3 + 3h3O.
Сa + HNO3 + 9HNO3 4Ca(NО3)2 + Nh5NO3 + 3h3O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:

| 24 | 4 6 | 2 3 | (окисление) (восстановление) |
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются реакциями диспропорционирования. В этом случае, так же как и в предыдущем, электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
| S+6 + 2ē = S+4 12 S-2- 6ē = S+4 | 6 2 | 3 (восстановление) 1 (окисление) |
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных реакциях не является единственным. Существуют и другие способы. Однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса.
Литература:
Глинка Н.Л. Общая химия. – М.: Химия, 1978. - С. 261-270.
Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. - С. 90-106.
Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. - С. 14-32.
Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. - С. 4-9, 65-75.
studfiles.net
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных примерах.
При каталитическом окислении аммиака Nh4 кислородом О2 образуется оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
Nh4 + O2 ® NO + h3O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3h4 + O20 ® N+2O-2 + h3O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород – окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до -2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные процессы в виде схемы:
N-3 - 5з ® N+2 5 20 O20 + 4з ® 2O-2 4 | 4 окисление – восстановитель 5 восстановление - окислитель |
Согласно принципу электронного баланса количества молекул окислителя и восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были равными. Для этого находится общее кратное, а затем делится на число отдаваемых или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы Nh4 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4Nh4 + 5O2 ® NO + h3O.
Все остальное уравнивается в соответствии с их величиной:
4Nh4 + 5O2 ® 4NO + 6h3O.
При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая кислота h4AsO4, серная h3SO4 и оксид азота NO.
Составим схему реакции, указывая СО над символами тех элементов, у которых в процессе реакции они изменяются:
As2+3S3-2 + HN+5O3 ® h4As+5O4 + h3S+6O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в виде схемы:
As2+3S3-2 - 28з = 2As+5 + 3S+6 (окисление) 84 N+5 + 3з = N2+ (восстановление) | 3 28 |
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6h4AsO4 + 9h3SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода добавлением молекул воды приводит к автоматическому уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ, то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6h4AsO4+ 9h3SO4 + 28NO.
Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:
8 24 6 | 4 3 | (восстановление) (окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3h3S = 4HCl + 3h3SO4.
Электронный баланс в данном случае .
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:
3 3 1 | 6 2 | (окисление) (восстановление) |
6FeSO4 + 2HNO3 + 3h3SO4 = 3Fe2(SO4)3 + 2NO + 4h3O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул h3SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:
1 3 группы по два иона хлора, всего шесть ионов хлора | (восстановление) (окисление) |
K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
K2Cr2O7 + 6HCl + 8HCl ® 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды h3O, и получим окончательно:
K2Cr2O7 + 14HCl ® 2CrCl3 + 3Cl2 + 2KCl + 7h3O.
6.
8 2 | 4 1 | (окисление) (восстановление) |
Основные коэффициенты 4 и 1:
4Сa + HNO3 4Ca(NО3)2 + Nh5NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:
4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + Nh5NO3 + 3h3O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:
6 24 4 | 4 6 | 2 3 | (окисление) (восстановление) |
Основные коэффициенты 2 и 3 ставятся в правой части уравнения, левая часть уравнивается по правой части:
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются реакциями диспропорционирования. В этом случае, так же как и в предыдущем, электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
S+6 + 2з = S+4 12 S-2 - 6з = S+4 | 6 2 | 3 (восстановление) 1 (окисление) |
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных реакциях не является единственным. Существуют и другие способы. Однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса.
6. Особые случаи составления уравнений окислительно-востановительных реакций.
Если в реакции участвуют вещества, для которых сложно подсчитать степень окисления (например, В5Н11, FeAsS, органические вещества ) можно использовать метод схематического (формального) электронного баланса, суть которого заключается в том, что алгебраическая сумма зарядов в левой части уравнения реакции окисления или восстановления должна быть равна сумме зарядов в правой части этого же уравнения. Пример 1. Дана схема реакции В2Н6 + KclO3 ----- KCl + h4BO3 Определяем восстановитель и окислитель, составляем уравнение для процессов окисления и восстановления: В2Н6 – 12е + 6Н2О ----- 2Н3ВО3 + 12Н Восстановителем в этой реакции являются молекулы В2Н6, которые окисляются до борной кислоты : В2Н6 + 6Н2О ----- 2Н3ВО3 + 12Н Недостающие ионы кислорода для образования борной кислоты можно получить из молекул воды, при этом образуются ионы Н . Как нетрудно видеть, в левой части данной схемы процесса окисления имеется 0 зарядов, а в правой части – 12 положительных зарядов. Для уравнивания зарядов в обеих частях необходимо в левой части схемы отнять 12 электронов. Окислителем являются анионы ClO3 , которые превращаются в ионы Cl , принимая 6 электронов :ClO3 + 6e + 3h3O ----- Cl + 6OH . При этом освобождающиеся ионы кислорода соединяются с молекулами воды ( реакция происходит в водной среде ) , образуя ионы ОН . Затем производим балансирование уравнений процессов окисления и восстановления : 1 В2Н6 – 12е + 6Н2О ----- 2Н3ВО3 + 12Н 2 ClO3 + 6e + 3h3O ----- Cl + 6OH B2H6 + 6h3O + 2ClO3 + 6h3O ----- 2h4BO3 + 12H + 12OH + 2Cl B2H6 + 2KClO3 == 2h4BO3 + 2KCl 12h3O
Цифры таблицы получены при температуре 25 С. С изменением температуры они мало изменяются, поэтому ими можно пользоваться для определения направления реакции в обычных условиях. Цифры таблицы действительны для случаев, когда концентрация ( или, точнее активность ) растворов в гальванической цепи равна единице ( т. е. 1 моль/л ).
Необходимо иметь в виду следующее : 1. Увеличение концентрации ионов, в которые переходит окисляющийся атом или ион, понижает э. д. с. реакции, а уменьшение – повышает. 2. Увеличение концентрации окисляющихся атомов или ионов повышает э. д. с. реакции, а уменьшение понижает. 3. Правила пользования таблицами для определения направления окисления – восстановления. В таблицах реакций представлены величины нормальных потенциалов окисления ( Еокисл ) и восстановления ( Евосст ) важнейших процессов. Таблицы соответственно разделены на две группы : “ Окисление “ и “ Восстановление “ . Знак “ + “ у Еокисл (или Евосст ) и у соответствующего lgKокисл (или lgKвосст) показывает, что процесс идёт преимущественно слева направо, а знак “ – “ у этих же величин – справа налево.
Для определения направления той или иной реакции окисления-восстановления берут данные разделов “ Окисление “ и “ Восстановление “, распологая в одну строку уравнение рассматриваемого процесса окисления с уравнением заданного процесса восстановления. При этом получают несбалансированное общее ионное уравнение возможной окислительно-восстановительной реакции.
Алгебраическая сумма Еокисл + Евосст рассматриваемых процессов может быть величиной положительной, и тогда данная реакция ( при условии аокисл = авосст = 1 и определённом значении рН ) идёт, а если эта величина окажется отрицательной, то реаакция ( при тех же условиях ) невозможна.
Пример. Пойдёт ли реакция между I - ионами и Fe ионами с образованием свободного йода ?
Решение. На таблице “Окисление “ ( в группе реакций “Йод“ ) находят уравнение 2I – 2e I2, по таблице “Восстановление “ ( в группе реакций “Железо” ) находят уравнение Fe + e Fe и записывают их в одну строчку, складывая величины Еокисл + Евосст;
:lgKокисл :Еокисл :Евосст :lgKвосст:
2I - 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
Алгебраическая сумма ( - 0,5345 ) + ( +0,771 ) = + 0,2365 –величина положительная : следовательно, реакция 2 I + 2 Fe ----- I2 + 2Fe будет протекать при определённых условиях.
С помощью указанных в этих же монограммах логарифмов констант равновесия можно также вычислить константы равновесия разнообразных реакций окисления-восстановления.
Анализируя таблицу определения направления реакции окисления-восстановления, можно сделать следующие выводы :
1. Ионы “ благородных “ металлов – сильные окислители. Например : Cr + Ag----- Cr + Ag э. д. с. = + 0,7995- - 0,4 = 1,209 в. Fe + Au---- Fe + Au э. д. с. = + 1,68- + 0,77 = 0,91 в.
2. Наиболее сильные восстановители – атомы щелочных и щелочно –земельных металлов. Наиболее слабые восстановители – “благородные” металлы и ионы галогенов ( за исключением иона йода ).
3. Наиболее сильные окислители – нейтральные атомы галогенов, высокоположительные ионы металлов, а также ионы “благородных” металлов. Наиболее слабые окислители – ионы щелочных и щелочноземельных металлов.
7. Перенос электронов в дыхательной цепи.
referat911.ru
К числу сильных окислителей, широко используемых на практике, относятся галогены (Fe2, Cl2, Br2, I2), оксид марганца Mn+4O2, перманганат калия KMn+7O4, манганат калия K2Mn+6O4, оксид хрома (хромовый ангидрид) Cr+6O3, хромат калия K2Cr+6O4, бихромат калия K2Cr2+6O7, азотная кислота HN+5O3 и ее соли, кислород О2, озон О3, перекись водорода Н2О2, концентрированная серная кислота Н2S+6О4, оксид меди (II) Сu+2О, оксид серебра Ag2+1O, оксид свинца Рb+4О2, гипохлориты (например, NaCl-1O) и другие соединения.
Щелочные и щелочноземельные металлы являются сильными восстановителями. К числу других восстановителей относятся: водород, углерод, оксид углерода С+2О, сероводород Н2S-2, оксид серы S+4О2, сернистая кислота Н2S+4О3 и ее соли, галогенводороды (кроме HF), хлорид олова (II) Sn+2Cl2, сульфат железа (II) Fe+2SO4.
Различают три типа окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные и реакции самоокисления–самовосстановления.
Межмолекулярные – это такие реакции, в которых молекулы, атомы или ионы элементов, входящие в состав одного вещества и являющиеся окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2h3O.
Во внутримолекулярных реакциях изменяется СО элементов одного и того же вещества таким образом, что одни из них окисляются, а другие - восстанавливаются. К таким реакциям относится, например, разложение бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
2Hg+2O-2 = 2Hg0 + O20.
В реакциях самоокисления–самовосстановления (диспропорционирования) атомы одного и того же вещества так взаимодействуют друг с другом, что одни отдают электроны (окисляются), а другие их присоединяют (восстанавливаются). Например, растворение хлора в воде:
Cl20 + h3O = HCl+1O + HCl-1 или
(Cl0Cl0 + h3O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное от деления молярной массы вещества на число приобретаемых (или теряемых) электронов. Так, в реакции
5h3S + 2KMnO4 + 3h4SO4 = 5S + 2MnSO4 + K2SO4 + 8h3O
для KMnO4 окислительный эквивалент равен 158,15/5, а для сероводорода восстановительный эквивалент – половине его молярной массы.
С точки зрения электронной теории окислительно–восстановительными реакциями называются такие реакции, при протекании которых происходит переход электронов от одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно–восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных восстановителем всегда равно числу электронов, принятых окислителем. Это положение называется принципом электронного баланса и лежит в основе нахождения коэффициентов в уравнениях окислительно–восстановительных реакций.
Согласно этому принципу число молекул окислителя и число молекул восстановителя в уравнении окислительно-восстановительных реакций должны быть такими, чтобы количество принимаемых и отдаваемых электронов было одинаковым.
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных примерах.
При каталитическом окислении аммиака Nh4 кислородом О2 образуется оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
Nh4 + O2 NO + h3O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3h4 + O20 N+2O-2 + h3O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород – окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до -2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные процессы в виде схемы:
| N-3 - 5ē N+2 5 20 O20 + 4ē 2O-2 4 | 4 окисление – восстановитель 5 восстановление - окислитель |
Согласно принципу электронного баланса количества молекул окислителя и восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были равными. Для этого находится общее кратное, а затем делится на число отдаваемых или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы Nh4 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4Nh4 + 5O2 NO + h3O.
Все остальное уравнивается в соответствии с их величиной:
4Nh4 + 5O2 4NO + 6h3O.
При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая кислота h4AsO4, серная h3SO4 и оксид азота NO.
Составим схему реакции, указывая СО над символами тех элементов, у которых в процессе реакции они изменяются:
As2+3S3-2+ HN+5O3 h4As+5O4 + h3S+6O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в виде схемы:
| As2+3S3-2 - 28ē = 2As+5 + 3S+6 (окисление) 84 N+5 + 3ē = N2+ (восстановление) | 3 28 |
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6h4AsO4 + 9h3SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода добавлением молекул воды приводит к автоматическому уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ, то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6h4AsO4+ 9h3SO4 + 28NO.
Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:

| | 8 24 6 | 4 3 | (восстановление) (окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3h3S = 4HCl + 3h3SO4.
Электронный баланс в данном случае  .
.
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:
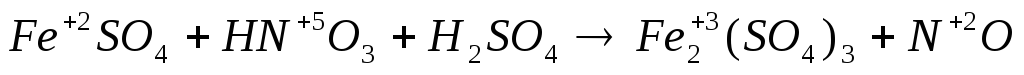
|
| 3 3 1 | 6 2 | (окисление) (восстановление) |
6FeSO4 + 2HNO3 + 3h3SO4 = 3Fe2(SO4)3 + 2NO + 4h3O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул h3SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:

|
| 1 3 группы по два иона хлора, всего шесть ионов хлора | (восстановление) (окисление) |
K 2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
K
 2Cr2O7 + 6HCl + 8HCl 2CrCl3 + 3Cl2 + 2KCl.
2Cr2O7 + 6HCl + 8HCl 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды h3O, и получим окончательно:
K2Cr2O7 + 14HCl 2CrCl3 + 3Cl2 + 2KCl + 7h3O.
6. 
|
| 8 2 | 4 1 | (окисление) (восстановление) |
Основные коэффициенты 4 и 1:
4 Сa + HNO3 4Ca(NО3)2 + Nh5NO3.
Сa + HNO3 4Ca(NО3)2 + Nh5NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:
4

 Сa + HNO3 + 9HNO3 4Ca(NО3)2 + Nh5NO3 + 3h3O.
Сa + HNO3 + 9HNO3 4Ca(NО3)2 + Nh5NO3 + 3h3O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:

| 24 | 4 6 | 2 3 | (окисление) (восстановление) |
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются реакциями диспропорционирования. В этом случае, так же как и в предыдущем, электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
| S+6 + 2ē = S+4 12 S-2- 6ē = S+4 | 6 2 | 3 (восстановление) 1 (окисление) |
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных реакциях не является единственным. Существуют и другие способы. Однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса.
Литература:
Глинка Н.Л. Общая химия. – М.: Химия, 1978. - С. 261-270.
Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. - С. 90-106.
Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. - С. 14-32.
Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. - С. 4-9, 65-75.
* Диэлектрическая проницаемость характеризует поляризацию диэлектриков под действием электрического поля Е.
50
studfiles.net
 РАЗДЕЛ 5 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ Химические реакции, протекающие с изменением степеней окисления атомов нескольких элементов реагирующих веществ, называются окислительно-восстановительными.
РАЗДЕЛ 5 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ Химические реакции, протекающие с изменением степеней окисления атомов нескольких элементов реагирующих веществ, называются окислительно-восстановительными.
 ЗАДАНИЕ 2 Примеры решения задач Пример 1. Укажите, какие химические процессы лежат в основе получения фосфорной кислоты. Напишите уравнения реакций получения H 3 РO 4. Термический способ получения фосфорной
ЗАДАНИЕ 2 Примеры решения задач Пример 1. Укажите, какие химические процессы лежат в основе получения фосфорной кислоты. Напишите уравнения реакций получения H 3 РO 4. Термический способ получения фосфорной
 Министерство образования Российской Федерации Саратовский государственный технический университет ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Методические указания к выполнению лабораторных работ по общей химии
Министерство образования Российской Федерации Саратовский государственный технический университет ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Методические указания к выполнению лабораторных работ по общей химии
 Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
 Подготовка к ЕГЭ по химии Окислительновосстановительные реакции МБОУ гимназия «Лаборатория Салахова» О.Г. Степаненко Место окислительно восстановительных реакций в КИМ ЕГЭ 2015 года по ХИМИИ 1 Часть1 Строение
Подготовка к ЕГЭ по химии Окислительновосстановительные реакции МБОУ гимназия «Лаборатория Салахова» О.Г. Степаненко Место окислительно восстановительных реакций в КИМ ЕГЭ 2015 года по ХИМИИ 1 Часть1 Строение
 ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
 ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е. АЛЕКСЕЕВА Кафедра "Общая
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е. АЛЕКСЕЕВА Кафедра "Общая
 5. Классификация неорганических веществ Оксиды сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды получаются обычно при взаимодействии простых
5. Классификация неорганических веществ Оксиды сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды получаются обычно при взаимодействии простых
 МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ухтинский государственный технический университет» (УГТУ) Химия Окислительно-восстановительные
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ухтинский государственный технический университет» (УГТУ) Химия Окислительно-восстановительные
 Муниципальное образовательное учреждение открытая (сменная) общеобразовательная школа 94 Химия 9 класс Программные вопросы Внимание! Тренировочные работы и задания из учебника выполняются в отдельной тетради
Муниципальное образовательное учреждение открытая (сменная) общеобразовательная школа 94 Химия 9 класс Программные вопросы Внимание! Тренировочные работы и задания из учебника выполняются в отдельной тетради
 1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: - химические уравнения; Вам необходимо
1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: - химические уравнения; Вам необходимо
 МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ (МАДИ) С.Е. МОСЮРОВ, Л.С. САМОЙЛИК МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО КУРСУ ОБЩЕЙ ХИМИИ ДЛЯ СТУДЕНТОВ-ИНОСТРАНЦЕВ ПОДГОТОВИТЕЛЬНОГО ФАКУЛЬТЕТА
МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ (МАДИ) С.Е. МОСЮРОВ, Л.С. САМОЙЛИК МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО КУРСУ ОБЩЕЙ ХИМИИ ДЛЯ СТУДЕНТОВ-ИНОСТРАНЦЕВ ПОДГОТОВИТЕЛЬНОГО ФАКУЛЬТЕТА
 ХИМИЯ МЕТАЛЛОВ 1. Какая из электронных формул отражает строение атома натрия: 1. 1s 2 2s 2 2p 6 3s 1 ; 2. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ; 3. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ; 4. 1s 2 2s 1. 2. Какие
ХИМИЯ МЕТАЛЛОВ 1. Какая из электронных формул отражает строение атома натрия: 1. 1s 2 2s 2 2p 6 3s 1 ; 2. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ; 3. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ; 4. 1s 2 2s 1. 2. Какие
 ТЕСТ ДЛЯ ИТОГОВОГО КОНТРОЛЯ II семестр Раздел 1. Электронные формулы элементов... Раздел. s, p, d, f-элементы. Периодическое изменение свойств элементов... Раздел. Металлы и неметаллы... Раздел. Нахождение
ТЕСТ ДЛЯ ИТОГОВОГО КОНТРОЛЯ II семестр Раздел 1. Электронные формулы элементов... Раздел. s, p, d, f-элементы. Периодическое изменение свойств элементов... Раздел. Металлы и неметаллы... Раздел. Нахождение
 Вариант 1. 1. Определите степени окисления: марганца в K 2 MnO 4, хрома в СаCrO 4, фосфора в Н 3 PО 3. 2. Составьте формулы соединений, образованных следующими ионами: Ag + и SO 4 ; Sr 2+ и SO 3 ; Fe 2+
Вариант 1. 1. Определите степени окисления: марганца в K 2 MnO 4, хрома в СаCrO 4, фосфора в Н 3 PО 3. 2. Составьте формулы соединений, образованных следующими ионами: Ag + и SO 4 ; Sr 2+ и SO 3 ; Fe 2+
 Девятый класс Задача 9-1 (автор Жиров А. И.) 1. Пусть было 100 г концентрированного раствора. (Содержание «купоросной водки» серной кислоты 98 г) Тогда масса добавленной воды составит 400 г. Общая масса
Девятый класс Задача 9-1 (автор Жиров А. И.) 1. Пусть было 100 г концентрированного раствора. (Содержание «купоросной водки» серной кислоты 98 г) Тогда масса добавленной воды составит 400 г. Общая масса
 ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ ЛЕСОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра общей и неорганической химии С.В. Целищева Л.В. Демидова Б.П. Середа Т.Б. Голубева О.М. Подковыркина ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ ЛЕСОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра общей и неорганической химии С.В. Целищева Л.В. Демидова Б.П. Середа Т.Б. Голубева О.М. Подковыркина ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ
 18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
 Задания С2 по химии 1. Даны вещества: фосфор, хлор, водные растворы серной кислоты и гидроксида калия. 1. 2. 3. 4. 2. Даны: бромоводородная кислота, перманганат натрия, гидроксид натрия и бром. Записаны
Задания С2 по химии 1. Даны вещества: фосфор, хлор, водные растворы серной кислоты и гидроксида калия. 1. 2. 3. 4. 2. Даны: бромоводородная кислота, перманганат натрия, гидроксид натрия и бром. Записаны
 МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ухтинский государственный технический университет» (УГТУ) Металлы (олово, свинец,
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ухтинский государственный технический университет» (УГТУ) Металлы (олово, свинец,
 Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Ухтинский государственный технический университет КАЧЕСТВЕННЫЕ РЕАКЦИИ АНИОНОВ Методические
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Ухтинский государственный технический университет КАЧЕСТВЕННЫЕ РЕАКЦИИ АНИОНОВ Методические
 Химия. 9 класс. I Используется с бланками ответов - 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по
Химия. 9 класс. I Используется с бланками ответов - 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по
 Химия 9 класс 1. Для получения сернистого газа иногда используют смесь серы и нитрата калия. Эта смесь горит без доступа воздуха с образованием сернистого газа, азота и сульфида калия. Напишите уравнение
Химия 9 класс 1. Для получения сернистого газа иногда используют смесь серы и нитрата калия. Эта смесь горит без доступа воздуха с образованием сернистого газа, азота и сульфида калия. Напишите уравнение
 Пример 1 Примеры решения задач Исходя из степени окисления брома в соединениях: КBr, Br, BrF, BrO, HBrO, определите, какое из веществ может быть только окислителем, какое только восстановителем, а какое
Пример 1 Примеры решения задач Исходя из степени окисления брома в соединениях: КBr, Br, BrF, BrO, HBrO, определите, какое из веществ может быть только окислителем, какое только восстановителем, а какое
 Химия. 9 класс 2 Демонстрационный вариант контрольных измерительных материалов для проведения в 2012 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные
Химия. 9 класс 2 Демонстрационный вариант контрольных измерительных материалов для проведения в 2012 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные
docplayer.ru