|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Строение молекул воды, их связи и свойства. Влияние внешних физических воздействий на молекулы воды? Реферат пространственное строение молекул
Пространственное строение молекул неорганических и органических веществ
Пространственное строение молекул неорганических и органических веществ имеет большое значение при описании их химических и физических свойств. Если рассматривать вещество как набор буковок и цифр на бумаге, не всегда можно прийти к правильным выводам. Чтобы описать многие явления, особенно связанные с органической химией, необходимо знать стереометрическое строение молекулы.
Что такое стереометрия
Стереометрия – это раздел химии, который объясняет свойства молекул вещества исходя из его строения. Причем пространственное представление молекул играет здесь большую роль, т.к. оно является ключом к разгадке многих биоорганических явлений.
Стереометрия представляет собой комплекс основных правил, по которым почти любую молекулу можно представить в объемной форме. Недостатком брутто-формулы, написанной на обычном листке бумаги, является неспособность ее раскрыть полный перечень свойств исследуемого вещества.
Примером может случить фумаровая кислота, которая относится к классу двухосновных. Она плохо растворима в воде, не ядовита и может встречаться в природе. Однако, если изменить пространственное расположение СООН-групп, можно получить совершенно другое вещество – малеиновую кислоту. Она хорошо растворима в воде, может быть получена только искусственно, представляет собой опасность для человека из-за токсичных свойств.
Стереохимическая теория Вант-Гоффа
В 19 веке представления М.Бутлерова о плоском строении любой молекулы не могли объяснить многих свойств веществ, особенно органики. Это послужило толчком к написанию Вант-Гоффом работы «Химия в пространстве», в которой он дополнил теорию М.Бутлерова своими исследованиями в этой области. Он ввел понятие пространственного строения молекул, а также пояснил важность своего открытия для химической науки.
Так было доказано существование трех видов молочной кислоты: мясо-молочной, правовращающей и молочной кислоты брожения. На листе бумаги для каждого из этих веществ структурная формула будет одна и та же, однако пространственное строение молекул объясняет это явление.
Следствием стереохимической теории Вант-Гоффа стало доказательство того факта, что углеродный атом не является плоским, т.к. его четыре валентные связи обращены к вершинам воображаемого тетраэдра.
Пирамидальное пространственное строение органических молекул
Исходя их выводов Вант-Гоффа и его исследований, каждый углерод в скелете органического вещества можно представить в виде тетраэдра. Так мы можем рассмотреть 4 возможных случая образования С-С связей и объяснить строение таких молекул.
Первый случай - когда молекула представляет собой один атом углерода, который образует 4 связи с протонами водорода. Пространственное строение молекул метана практически полностью повторяет очертания тетраэдра, однако валентный угол немного изменен вследствие взаимодействия атомов водорода.
Образование одной химической С-С связи можно представить в виде двух пирамид, которые соединены между собой общей вершиной. Из такого построения молекулы видно, что эти тетраэдры могут вращаться вокруг своей оси и свободно менять положение. Если рассматривать эту систему на примере молекулы этана, углероды в скелете действительно способны вращаться. Однако из двух характерных положений предпочтение отдается энергетически выгодному, когда водороды в проекции Ньюмана не перекрываются.
Пространственное строение молекулы этилена служит примером третьего варианта образования С-С связей, когда два тетраэдра имеют одну общую грань, т.е. пересекаются по двум смежным вершинам. Становится понятно, что из-за такого стереометрического положения молекулы движение атомов углерода относительно своей оси затруднено, т.к. требует разрыва одной из связей. Зато становится возможным образование цис- и трансизомеров веществ, т.к. два свободных радикала от каждого углерода могут располагаться либо зеркально, либо крест-накрест.
Цис- и трансположение молекулы объясняет существование фумаровой и малеиновой кислот. Между атомами углерода в этих молекулах образовано две связи, и на каждый из них приходится по одному атому водорода и СООН-группе.
Последний случай, характеризующий пространственное строение молекул, может быть представлен двумя пирамидами, которые имеют одну общую грань и соединены между собой тремя вершинами. Примером является молекула ацетилена.
Во-первых, такие молекулы не имеют цис- или транс-изомеров. Во-вторых, атомы углерода не способны вращаться вокруг своей оси. И в-третьих, все атомы и их радикалы располагаются на одной оси, а валентный угол составляет 180 градусов.
Безусловно, описанные случаи могут применяться к веществам, скелет которых содержит более двух атомов водорода. Принцип стереометрического построения таких молекул сохраняется.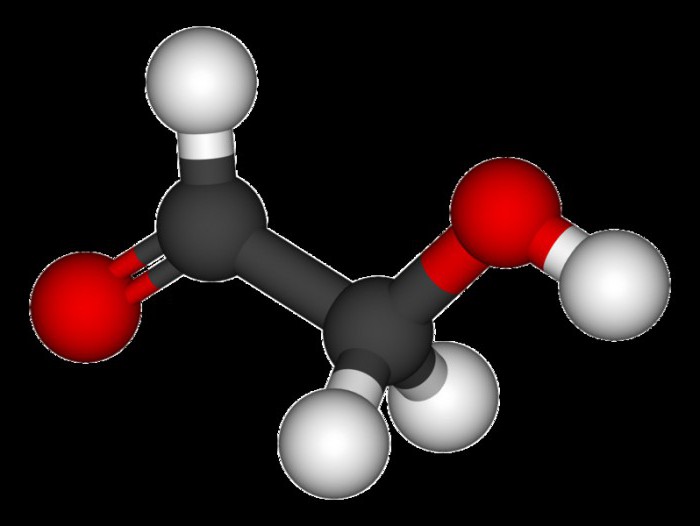
Пространственное строение молекул неорганических веществ
Образование ковалентных связей в неорганических соединениях сходно по механизму с таковым у органических веществ. Для образования связи необходимо наличие неподеленных электронных пар у двух атомов, которые образуют общее электронное облако.
Перекрывание орбиталей при образовании ковалентной связи происходит по одной линии ядер атомов. Если атом образует две и более связи, то расстояние между ними характеризуется величиной валентного угла.
Если рассматривать молекулу воды, которая образована одним атомом кислорода и двумя атомами водорода, валентный угол в идеале должен был бы составить 90 градусов. Однако экспериментальные исследования доказали, что эта величина составляет 104,5 градусов. Пространственное строение молекул отличается от теоретически предсказанного из-за наличия сил взаимодействия между атомами водорода. Они отталкиваются друг от друга, тем самым увеличивая валентный угол между ними.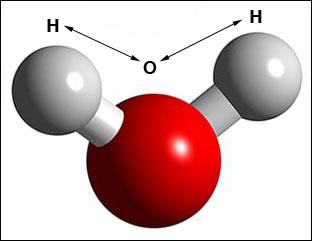
Sp-гибридизация
Гибридизация – это теория образования одинаковых гибридных орбиталей молекулы. Происходит это явление из-за наличия у центрального атома неподеленных электронных пар на разных энергетических уровнях.
Для примера рассмотрим образование ковалентных связей молекулы BeCl2. У Бериллия неподеленные электронные пары находятся на s и p уровнях, что в теории должно послужить причиной образования неровной угловой молекулы. Однако на практике они линейные, а валентный угол составляет 180 градусов.
Sp-гибридизация используется при формировании двух ковалентных связей. Однако существуют и другие виды образования гибридных орбиталей.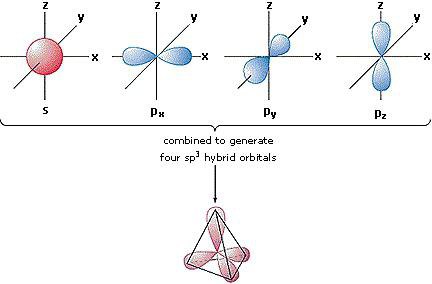
Sp2-гибридизация
Этот тип гибридизации отвечает за пространственное строение молекул с тремя ковалентными связями. Примером является молекула BCl3. Центральный атом бария имеет три неподеленные электронные пары: две на p-уровне и одну на s-уровне.
Три ковалентные связи образуют молекулу, которая располагается в одной плоскости, а ее валентный угол составляет 120 градусов.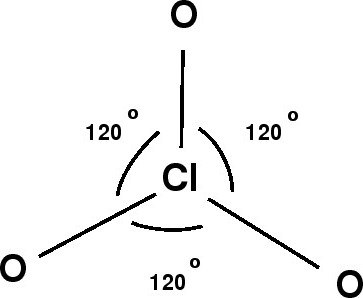
Sp3-гибридизация
Еще один вариант формирования гибридных орбиталей, когда центральный атом имеет 4 неподеленные электронные пары: 3 на p-уровне и 1 на s-уровне. Пример такого вещества – метан. Пространственное строение молекул метана представляет собой тетраэрд, валентный угол в котором составляет 109,5 градусов. Изменение величины угла характеризуется взаимодействием атомов водорода между собой.
fb.ru
Пространственная структура молекул
Количество просмотров публикации Пространственная структура молекул - 580
Пространственная структура молекул зависит от пространственной направленности перекрывания электронных облаков числом атомов в молекуле и числом электронных пар связей за счёт неподеленных электронов. Существует несколько типов связи. Связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов, принято называть σ-связью. Сигма-связь может возникать при перекрывании s-орбиталей, s и р-орбиталей, d-орбиталей, а также d и s-орбиталей, d и p-орбиталей и f-орбиталей друг с другом и другими орбиталями. Сигма-связь обычно охватывает два атома и не простирается за их пределы, в связи с этим является локализованной двухцентровой связью. Она имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, ᴛ.ᴇ. той воображаемой линии, которая проходит через ядра химически связанных атомов. Это исключает возможность образования пространственных изомеров.
После образования между двумя атомами σ-связи, для остальных электронных облаков той же формы и с тем же главным квантовым числом остается только возможность бокового перекрывания по обе стороны от линии связи, через которую в данном случае проходит одна узловая плоскость. Связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), принято называть p-связью. Пи-связь может образовываться при перекрывании р и р-орбиталей, р и d-орбиталей, d и d-орбиталей, а также f и p- , f и f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, принято называть δ-связью (дельта-связь). Соответственно s-элементы могут образовывать только σ-связи; р-элементы – σ и p-связи, d-элементы – δ, p и σ-связи, а f-элементы – δ-, p-, σ- и еще более сложные связи. В связи с меньшим перекрыванием атомных орбиталей прочность у p- и δ-связей ниже, чем у σ-связей.
При наложении p-связи на σ-связь образуется двойная связь, к примеру в молекулах кислорода (О = О), этилена (СН2 = СН2), диоксида углерода (0 = С = 0). Хотя энергия p-связи меньше, чем энергия σ–связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи.
При наложении двух p-связей на σ-связь возникает тройная связь, к примеру в молекулах азота (N ≡ N) и ацетилена (СН ≡ СН). Энергия тройной связи выше, а длина связи меньше, чем энергии и длины простой и двойной связей. Число связей между атомами принято называть кратностью связи. Каждая кратная связь всегда содержит только одну σ-связь. Число σ-связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. К примеру, в молекуле Nh4 и ионе Nh5+ для атома азота оно равно трем и четырем соответственно.
Образование σ-связей фиксирует пространственное положение атомов относительно друг друга, в связи с этим число σ-связей и углы между линиями связи, которые называют валентными, определяют пространственную геометрическую конфигурацию молекул и комплексных ионов, что находит отражение в соответствующих моделях.
Связи, образованные атомом за счёт орбиталей с различным значением орбитального квантового числа, должны быть энергетически неравноценными, что, однако, не подтверждается экспериментом. Противоречие устраняется идеей гибридизации, предложенной Л. Полингом (1901). Гибридизацииейназывают образование одинаковых по энергии и форме орбиталей атома в результате сложения различных по энергии и форме орбиталей при возбуждении этого атома. При этом орбитали разной симметрии смешиваются и переходят в гибридные атомные орбиталиодинаковой формы и одинаковой усредненной энергии, что обеспечивает равноценность образуемых ими связей.
Возможность гибридизации определяют три условия:
1) Небольшая разница в энергии исходных атомных орбиталей, с увеличением этой разницы уменьшается устойчивость их гибридного состояния и прочность образуемых ими связей.
2) Достаточная плотность электродных облаков, что определяется значением главного квантового числа.
3) Достаточная степень перекрывания атомных орбиталей с огрбиталями других атомов при образовании связей, что закрепляет гибридное состояние и делает его более устойчивым.
Число гибридных орбиталей равно числу исходных. При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°.
| | ¾® | |
Две sp-орбитали могут образовывать две s-связи (Beh3, ZnCl2). Еще две s-связи могут образоваться, в случае если на двух p-орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2h3). Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию.
При смешении s- и двух р-орбиталей образуется три sp2-гибридные орбитали, угол между осями которых равен 120°.
| | ––® | |
Три sp2-орбитали могут образовывать три s-связи (BF3, AlCl3). Еще одна связь (s-связь) может образоваться, в случае если на p-орбитали, не участвующей в гибридизации, находится электрон (этилен C2h5). Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию.
При смешении s и трех р-орбиталей – четыреsp3-гибридных орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (Ch5, Nh4).
| | ––® | |
Форма гибридных атомных орбиталей отличается от формы исходных. В гибридной атомной орбитали электронная плотность смещается в одну сторону от ядра, в связи с этим при взаимодействии ее с атомной орбиталью другого атома происходит максимальное перекрывание, ĸᴏᴛᴏᴩᴏᴇ приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями прочнее, а полученная молекула – более устойчива.
Геометрическая конфигурация молекул полностью определяется типом гибридных орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. В случае если хотя бы на одной из них остается неподеленная электронная пара, то конфигурация, определяемая типом гибридизации, реализуется не полностью (табл. 2).
Линейной конфигурацией обладают молекулы, образованные или двумя атомами (независимо от типа гибридизации, к примеру, КВr), или центральный атом которых обладает sp-гибридизацией (ZnCl2, BeF2). Угол между связями в данном случае составляет 1800.
Таблица 2.
Возможная геометрическая конфигурация
молекул при sp3-гибридизации
| Число неподеленных пар | Число σ-связей | Геометрическая конфигурация | Примеры |
| Тетраэдр | СН4 | ||
| Тригональная пирамида | NН3 | ||
| Угловая | Н2О | ||
| Линейная | КВr |
В случае, когда центральный атом имеет два неспаренных р-электрона, то происходит sp2- или dp2- гибридизация. При условии, что все гибридные атомные орбитали участвуют в образовании связи конфигурация молекулы – плоская тригональная, а угол между атомами 1200 (BCl3, AlF3). В случае если одна гибридная орбиталь не участвует в образовании связи (h3S, h3O), то конфигурация молекулы не меняется, а угол между связями уменьшается в h3S до 920, а в h3O до 1050, что связано с отталкиванием неподеленной пары центрального атома (серы или кислорода) от двух гибридных орбиталей, перекрытых s-орбиталями водорода.
При sp3-гибридизации участие четырех гибридных атомных орбиталей в связи приводит к образованию молекулы с конфигурацией тетраэдра и углом между связями – 1090 28¢ (СН4, CCl4, SiН4). В случае если в образовании связи одна гибридная орбиталь участия не принимает, то образуется молекула в виде тригональной пирамиды с углом между связями 1080 (NН3).
Более сложные виды гибридизации приводят к образованию более сложной пространственной конфигурации молекул. К примеру, у серы возможна sp3d2-гибридизация, которая приводит к октаэдрической конфигурации молекул.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, пространственная структура молекул зависит от типа гибридизации центрального атома и числа неподеленных пар. Размещено на реф.рфОбразование p-связей стабилизирует состояние молекулы.
referatwork.ru
Урок №10. Пространственное строение молекул неорганических и органических веществ
Повторите!
Электронная природа химических связей в органических соединениях
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях (например, s – и р – орбитали). Несмотря на это, связи оказываются равноценными и расположены симметрично, что обеспечено гибридизацией атомных орбиталей.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле.
Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
| Орбитали участвующие в гибридизации | Тип гибридизации | Пространственная форма молекулы | Примеры |
| s, p | sp – гибридизация  | Линейная  | BeCl2 CO2 C2h3 ZnCl2 Beh3 Две sp - орбитали могут образовывать две σ - связи (Beh3, ZnCl2). Еще две p- связи могут образоваться, если на двух p - орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2h3). |
| s, p, p | sp2 – гибридизация  | Треугольная (плоская тригональная)  | Bh4 BF3 C2h5 AlCl3 Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2h5). |
| s, p, p, p | sp3 – гибридизация  | Тетраэдрическая  | Сh5 Nh5+ PO43- BF4- |
На практике вначале экспериментально устанавливают геометрическую структуру молекулы, после чего описывают тип и форму атомных орбиталей, участвующих в её образовании. Например, пространственная структура молекул аммиака и воды близка к тетраэдрической, но угол между связями в молекуле воды равен 104,5˚, а в молекуле Nh4 – 107,3˚.
Чем это можно объяснить?
| Аммиак Nh4 |
 Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая sp3 - гибридная орбиталь занята неподеленной электронной парой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония Nh5+, а также является причиной отклонения от тетраэдрического угла в строении |
| Вода h3O |
 Молекула воды имеет угловое строение: представляет собой равнобедренный треугольник с углом при вершине 104,5°. Атом кислорода находится в sp3- гибридном состоянии; из четырех гибридных орбиталей кислорода две участвуют в образовании одинарных связей О–H, а две другие sp3 - гибридные орбитали заняты неподеленными электронными парами, их действие является причиной уменьшения угла от 109,28˚ до 104,5°. |
sites.google.com
Vvedenie_v_bioorganicheskuyu_khimiyu
Введение в биоорганическую химию.
Пространственное строение органических молекул.
Биоорганическая химия возникла на стыке наук, таких как:
Органическая химия
Биологическая химия
Биология
Молекулярная генетика, однако, базируется она в основном на материале органической химии, используя ее теоретические представления и весь арсенал ее методов исследования.
Главная цель изучения биоорганической химии заключается в формировании системных знаний о структуре и закономерностях в химическом поведении основных классов природных органических соединений, лежащих в основе как строения живых объектов, так и всех процессов жизнедеятельности.
Основные понятия органической химии
Химический состав молекулы – представляет собой количество атомов отдельных химических элементов, входящих в данную молекулу. Выражается в виде молекулярной формулы, например, для молочной кислоты. С3Н6О3
Химическое строение вещества – устойчивый порядок соединения атомов в молекуле с учетом характера связей между ними.
Химическое строение вещества может быть представлено в виде структурной формулы или формулы строения, например, для молочной кислоты:
СН3-СН(ОН)-СООН
Конфигурация – фиксированное пространственное расположение атомов или атомных групп в молекуле относительно друг друга.
Конфигурация может быть представлена или в виде стереохимических формул или в виде проекционных формул Фишера. Для лактата:

Конформациями называют различные энергетически неравноценные геометрические формы молекулы соединения, переходящие друг в друга за счет вращения отдельных частей молекулы вокруг одинарных связей. Конформации могут быть представлены или в виде стереохимических формул, или в виде проекционных формул Ньюмена.
Внутренняя энергия молекулы – энергия взаимодействия входящих в нее атомов и кинетическая энергия, обусловленная движением молекулы. Энергия атомных взаимодействий в молекуле может быть подразделен на:
Энергию химических связей между атомами
Энергию так называемых несвязных взаимодействий (конформационная энергия).
Химический состав молекулы может быть установлен в ходе качественного и количественного элементарного анализа химического соединения, а на основании изучения свойств соединения может быть установлено его химическое строение.
Возможность выяснения химического строения соединения на основе изучения его свойств является краеугольным камнем теории химического строения, предложенного А. И. Бутлеровым.
Именно А. И. Бутлеров впервые обратил внимание на то, что различный порядок соединения одних и тех же атомов может дать различные вещества, тем самым он дал объяснение широко распространенному в мире органических соединений явлению изомерии. Этот вид изомерии получил название структурной изомерии.

Вместе с тем, во второй половине 19 века выяснилось, что существуют вещества, имеющие одинаковый порядок соединения атомов в молекуле, но отличающиеся друг от друга по некоторым свойствам, таким, например, как способность вращать в разные стороны плоскость поляризованного луча света или способность кристаллизоваться в виде кристаллов, похожих друг на друга как предмет и его зеркальное изображение.
Необходимость объяснения этих различий привела к формированию новой области химии – стереохимии, т.е. учения о трехмерной структуре.
В основе стереохимии органических соединений лежит идея тетраэдричности насыщенного атома углерода.
При изображении строения органической молекулы все связи между атомами располагают в одной плоскости, предполагая тем самым, что и молекулы плоские, двумерные.
Вант Гофф и Лебель были первыми, кто указал на ошибочность такого рода представлений.
В реальном трехмерном пространстве валентные связи атома углерода располагаются не в одной плоскости, а под углом друг к другу. Если по всем четырем валентностям атом углерода связан с одинаковыми атомами или группами атомов, то угол между валентными связями составляет 109.5 градусов, а валентные связи будут направлены к вершинам тетраэдра. И тогда молекула становится трехмерной.
При изображении на бумаге такого тетраэдрического атома углерода поступают следующим образом:
Связи, лежащие в плоскости бумаги изображают обычными линиями;
Связи, идущие к наблюдателю, изображают в виде зачерненного клина;
Связи, уходящие за плоскость бумаги – пунктиром или заштрихованным клином

Молекула метана симметрична, поскольку атом углерода является центром ее симметрии. Если заменить атом водорода на какой-либо другой атом или группировку, молекула не потеряет симметричности, т.к. будет иметь ось симметрии:

Замена еще одного атома водорода на какую-либо другую группировку также не приведет к потере симметрии, т.к. сохранится плоскость симметрии.

При замене третьего атома водорода на группировку не идентичную двум другим, молекула теряет все элементы симметрии.
Такие молекулы получили название хиральных молекул.

Хиральные молекулы
Хиральные молекулы могут существовать в двух пространственных формах, похожих друг на друга как предмет и его изображение в зеркале («хирон» - рука). Эти молекулы не идентичны, поскольку попытки совместить одну молекулу с другой безуспешны.
Данные молекулы – изомеры, отличающиеся друг от друга не порядком соединения атомов в молекуле, а их фиксированным расположением.
Изомерия, связанная с различным пространственным расположением атомов в молекуле, называется пространственной или стереоизомерией.
В виду того, что порядок соединения атомов в молекулах рассматриваемых изомеров одинаков, они чрезвычайно сходны друг с другом по химическим свойствам. Тем не менее их можно различить по некоторым физическим свойствам, например, по способности вращать плоскость поляризованного луча света (один из них вращает влево, другой – вправо).
Такие стереоизомеры получили название оптических (зеркальных) изомеров.
Оптической активностью обладают только хиральные молекулы; молекулы, имеющие те или иные элементы симметрии (ахиральные), оптической активностью не обладают.
Все хиральные молекулы содержат в своей структуре атом углерода, связанный по всем четырем валентностям с разными атомами или атомными группировками – хиральный атом, в качестве которого обычно находится атом углерода в состоянии sp-3 гибридизации.
В качестве хиральных атомов могут быть атомы серы, азота, фосфора.
Оптические изомеры, являющиеся зеркальными изомерами, называются энантиомерами.
Энантиомер, вращающий плоскость поляризованного луча вправо, обозначается как /+/, а вращающий плоскость луча поляризованного луча влево, обозначается как /-/.
Эквимолекулярные смеси энантиомеров, содержащих равные количества право- и левовращающих изомеров, называются рацемическими смесями (рацематами).
Рацематы оптической активностью не обладают.
D и L стереохимические ряды
Конфигурация асимметрического атома углерода в соединении может быть описана тем или иным способом. Наиболее широко применяются правила Фишера, использующие обозначения D и L и правила Кана-Ингольда-Прелога, использующие обозначения R и S.
Правила Фишера связывают расположение атомов и атомных групп у асимметрического атома углерода рассматриваемого соединения со стандартом, в качестве которого был избран глицериновый альдегид /+/.
Этому энантиомеру глицеринового альдегида была произвольно приписана определенная конфигурация, которую обозначили как D.
Левовращающему глицериновому альдегиду приписали зеркальную конфигурацию, которую обозначили буквой L.

Конфигурация хиральной молекулы обозначается D или L в зависимости от того, аналогична ли она конфигурации D или L глицеринового альдегида.

В молекуле может присутствовать несколько асимметрических атомов углерода. В таком случае количество стереоизомеров возрастает. Часть из них будет зеркальными изомерами (энантиомерами).
Остальные стереоизомеры, не являющиеся энантиомерами, называются диастереомерами.
Общее число стереоизомеров можно рассчитать по формуле 2n, где n – число асимметрических центров в молекуле.
Диастереомеры отличаются друг от друга по физическим и химическим свойствам.

1,2; 3,4 – энантиомеры
1,3; 1,4; 2,3; 2,4 – диастереомеры
Связь пространственного строения с биологической активностью
Большинство метаболитов являются хиральными молекулами. При взаимодействии одних хиральных молекул с другими хиральными молекулами появляются различия в их химических свойствах. Такие молекулы обычно реагируют одновременно несколькими реакционными центрами и характер их взаимодействия будет зависеть от их взаимной ориентации.
В процессе обмена в клетке участвует L-яблочная кислота, L-молочная кислота, L-аминокислоты, D-сахара.
Хиральными молекулами являются белки, построенные из L-аминокислот, фосфолипиды, витамины, гормоны и т.д.
Стереоизомерия лежит в основе специфичности взимодействия субстрат – фермент, гормон – рецептор, антиген – антитело и др.
Фармакологическое действие ряда лекарственных веществ обусловлено их взаимодействием с рецепторами клетки.
При создании новых лекарственных веществ, имеющих хиральные центры, следует иметь в виду, что различные энантиомеры могут обладать различным и даже противоположным действием, биодействием.
Например, препарат талидомид (+)R-изомер – хороший транквилизатор и снотворное, а(-)S-энантиомер – является тератогеном (оказывает токсическое действие на плод).
Левовращающий энантиомер кокаина почти в 2 раза более активен в качестве местного анастетика, чем его правовращающий оптический антипод.
Из двух энантиомеров адреналина наибольшую фармакологическую активность имеет R(-) адреналин; S(+) адреналин биологической активностью не обладает.
Причиной такой специфичности взаимодействия является комплементарность – взаимное соответствие дополняющих друг друга структур (макромолекул, коферментов, субстратов, радикалов и др.), определяемое их пространственной структурой и химическими свойствами (способностью образовывать водородные и другие связи).
Аналогичная картина характерна и для ряда других лекарственных средств. Так, правовращающий изопропиладреналин (изодрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.
Лекарственное средство противоопухлевого действия саркозилин является левовращающим энантиомером; правовращающий сарколизин не активен.
studfiles.net
Реферат - Строение молекул - 1.doc
Реферат - Строение молекулскачать (55.5 kb.)Доступные файлы (1):
1.doc
Реклама MarketGid: I. Строение молекулы метана. Молекулярная формула метана Ch5.Так как атом углерода имеет большую электроотрицательность (2,5), чем водород (2,1), то в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода.
Однако такая формула не отражает пространственного строения молекулы. Чтобы это показать, необходимо вспомнить о формулах электронных облаков и размещении электронов по энергетическим уровням и подуровням. Например, строение атома углерода изображают следующей схемой:
2P
) ) 2S
С +6 2 4 S
) ) 1S2 2S2 2P2Так как на втором энергетическом уровне р-подуровне имеется свободная орбиталь, то на нее может перейти один из 2S2 – электронов:
) )
С +6 2 4 ) )
S Sp
В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырехвалентным.
Чтобы понять, как происходит образование химических связей в молекуле метана перекрыванием электронных облаков и почему молекула метана имеет тетраэдрическое строение, нужно знать то, что эти облака после гибридизации распространяется в пространстве так, что их оси оказываются направленными к вершинам тетраэдры. При образовании молекул метана вершины этих гибридных облаков перекрываются с облаками электронов атомов водорода.
Так как в этом случае в гибридизации участвует один S-электрон и три p-электрона, то такой ее вид называется SP3- гибридизацией.Химическая формула и строение молекул этилена.
Молекулярная формула этилена C2h5.
Если между двумя взаимно связанными атомами углерода разместить четыре атома водорода, то структурную формулу этилена следовало бы изобразить так:
H H
| |
H – C – C – H
| |
Однако свободных связей в молекуле не должно быть. Поэтому в структурной формуле этилена изображают двойную связь:
H H
| |
H – C = C – H
Следовательно, в отличие от предельных углеводородов, в молекулах которых между атомами углерода имеется ординарная связь, в молекулах углеводородов ряда этилена между атомами углерода имеется одна двойная связь.
В молекуле этилена подвергаются гибридизации одно S- и два p – электронных облака атомов углерода. Таким образом каждый атом углерода имеет по три (всего шесть) гибридных электронных облака и по одному (всего два) негибридному p – облаку. Два из гибридных электронных облаков атомов углерода взаимно перекрываются и образуют между атомами углерода ? (сигма) – связь. Остальные четыре гибридных электронных облака атомов углерода перекрываются в той же плоскости с четыремя S – электронными облаками атомов водорода и также образуют четыре ? – связи. Негибридные два p-облака атомов углерода взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости ? – связи, т.е. образуется одна П-связь. Следовательно, в молекуле этилена между атомами имеется одна ? и одна П – связь. В углеродных соединениях П – связь значительно слабее, чем ? – связь. Под воздействием респектов П – связь легко разрывается.
Легко понять, что в молекулах предельных углеводов атомы углерода могут свободно вращаться вокруг ? – связи. Если же между атомами углерода существует не только ? – связь, но и П – связь, то такое вращение без разрыва последней невозможно.
II.
1.Изомерия цепи атомов углерода в различных органических соединениях
Впервые с этим видом изомерии мы встретились при изучении предельных углеводородов. Например, молекулярной формуле C5h22 соответствуют три вещества:
Ch4 – Ch3 - Ch3 - Ch3 - Ch4
Пентан
Ch4
|
Ch4 – CH – Ch3 – Ch4 Ch4 – C - Ch4
| |
Ch4 Ch4
2-метилбутан 2,2 диметилпропан
Этот вид изомерии встречается не только у предельных углеводородов, но и у других классов органических соединений. Так, например, в зависимости от строения углеродной цепи одной и той же молекулярной формуле С4Н90Н соответствуют два спирта:
Ch4
4 3 2 1 3 2| 1
Ch4 - Ch3 - Ch3 - Ch3 - ОH Ch4 - CH – Ch3 - ОH
1-бутанол 2-метил-1-пропанол
Другой пример. Одной и той же молекулярной формуле C4H9O2в зависимости от строения углеродной цепи соответствуют две аминокислоты:
O Ch4 O
4 3 2 1// 3 2| 1//
Ch4 – Ch3 – CH – C Ch4 – C – C
| | \
Nh3 Nh3 OH
2-аминобутановая кислота 2-амино-2-метил-пропановая кислота
2. Изомерия положения двойной или тройной связи в молекуле
С этим видом изомерии мы встретились при изучении непредельных углеводородов. Так, например, молекулярной формуле C4H6 в зависимости от места расположения тройной связи соответствуют два вещества:
Ch4 – Ch3 – C ? CH Ch4 – C ? С - Ch4
1- бутин 2-бутин
Другой пример. Одной и той же молекулярной формуле С4Н602 в зависимости от места двойной связи соответствуют две непредельные карбоновые кислоты:
O O
// //
Ch3 = CH – Ch3 - C Ch4 - CH = CH - C
\ \
ОН ОН
Винилуксусная кислота Кротоновая кислота
3. Изомерия положения функциональной группы или отдельных атомов в молекуле.
С этим видом изомерии мы ознакомились при изучении спиртов, аминокислот, а также галогенопроизводных углеводородов. Рассмотрим несколько примеров.
Молекулярной формуле С3Н7ОН в зависимости от положения гид роке ильной группы в молекуле соответствуют два вещества:
Ch4 - CH – Ch4
Ch4 - Ch3 - Ch3 - ОH |
ОH
1-пропанол 2-пропанол
Молекулярной формуле С3Н7О2N в зависимости от положения аминогруппы —Nh3 в молекуле соответствуют два вещества:
O O
3 2 // //
Nh3 - Ch3 – Ch3 - C Ch4 - CH – C
\ \
ОН ОН
3-аминопропановая кислота 2-аминопропановая кислота
Молекулярной формуле С3Н7Сl в зависимости от положения атома хлора в молекуле тоже соответствуют два вещества:Ch4 – Ch3 – Ch3 - Cl Ch4 – CНCl - Ch4
1-хлорпропан 2-хлорпропан4. Пространственная, или стереоизомерия. Этот вид изомерии встречается у непредельных углеводородов, в составе которых имеются разные атомы или группы атомов, способные занимать различные положения в пространстве. Например, олеиновая кислота С17Н33СООН существует в двух изомерных формах:Н Н Ch4 – (Ch3)7 Н
\ / \ /
С = С С = С
/ \ / \
Ch4 – (Ch3)7 (Ch3)7 - СООН Н (Ch3)7 - СООН
Цис-изомер транс-изомер
Этим же видом изометрии обусловлена стереорегулярность и стереонерегулярность различных полимеров. Характерным примером регулярного строения является дивиниловый каучук
H H
\ /
C = C
/ \
-Ch3 Ch3- n
А примером нерегулярного строения-бутадиеновый каучук
H Ch3-
\ /
C = C
/ \
-Ch3 H n
которые существенно отличаются по свойствам.
5. Изомерия, характерная для органических соединений, в молекулах которых имеется бензольное кольцо.
Этот вид изомерии возможен при наличии двух заместителей в бензольном кольце. В зависимости от расположения заместителей в бензольном кольце различают орто-, мета- и пара-изомерию. Так, например, если в бензольном кольце имеется два заместителя — радикал метил и гидроксильная группа, то такое вещество называется крезолом. И в зависимости от расположения этих групп в бензольном кольце существует три различных вещества:
C-Ch4 HC C-OH HC CH CH C-Ch4 HC CH HC C-OH CH C-Ch4 HC CH HC CH C-OH
о-крезол м-крезол n-крезол
Следует учесть, что многие соединения, имеющие одну и ту же молекулярную формулу, могут отличаться между собой различными видами изомерии, например:
Ch4 O O
| // //
Ch4 – C – C Nh3 – Ch3 – CН – C
| \ | \
Nh3 OH Ch4 OH
2-амино-2метилпропановая кислота 3-амино-2-метилпропановая кислота
Ch4 – Ch3 – CH – CООН
|
Nh3
2-аминобутановая кислота
Эти изомерные вещества отличаются одновременно изометрией углеродной цепи и изометрией положения функциональной группы – Nh3.
III. Например, из молекулы этанола натрий вытесняет только один атом водорода. Следовательно, этот атом водорода более подвижен.
Отсюда можно вывести структурную формулу этанола:
H H
| |
H – C – C – H
| |
H H
Наоборот, зная структурную формулу этанола, можно предвидеть, что натрий будет вытеснять только один атом водорода, который связан с атомом кислорода.
Изучая свойства глюкозы, мы убедились, что в ее молекуле пять групп – он и одна альдегидная группа. Наоборот, зная структурную формулу глюкозы, можно предвидеть, что глюкоза будет проявлять свойства альдегидов и спиртов.
IV. Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензального ядра, которые взаимно влияют друг на друга. Наличие гидроксильной группы предопределяет сходство фенола со спиртами:
1. Сходство, сходное со свойствами спиртов:
2C6H5OH + 2 Na ? 2C6H5ONa + h3 ?
2. Свойство, отличающееся от свойств спиртов:
C6H5OH + NaOH ? C6H5ONa + h3O
3. Реакция бромирования
4.
5. Реакция нитрования
Влияние бензольного ядра на гидроксильную группу обуславливает большую подвижность ее водородного атома. Поэтому фенол, в отличие от спиртов, реагирует со щелочами, т.е. обладает свойствами слабых кислот. Его иногда называют карболовой кислотой. Это объясняется тем, что бензольное ядро оттягивает к себе электроны кислородного атома гидроксильной группы. Чтобы компенсировать это, атом кислорода сильнее притягивает к себе электронную плотность от атома водорода. Вследствие этого кавалентная связь между атомами кислорода и водорода становится более полярной, а атом водорода – более подвижным. Гидроксильная группа в свою очередь придает атомам водорода большую подвижность в положении 2, 4, 6. Это один из многих примеров, подтверждающих тезис теории А.М. Бутлерова о взаимном влиянии атомов в молекулах.
Химические свойства анилина обусловлены наличием в его молекуле аминогруппы - Nh3 и бензольного ядра. Анилин более слабое основание. Чтобы ответить на этот вопрос, нужно вспомнить о взаимном влиянии атомов и атомных групп в молекулах. Как и в молекулах фенола (об этом говорилось раньше) бензольное ядро несколько оттягивает свободную электронную пару от атома азота аминогруппы. Вследствие этого электронная плотность на атоме азота в молекуле анилина уменьшается и он слабее притягивает к себе протоны, т.е. основные свойства анилина ослабляются. Важнейшие свойства анилина:
1. Реагирует с кислотами с образованием солей:
C6H5 – Nh3 + HCl ? C6H5 Nh4 Cl
2. Образовавшиеся соли реагируют со щелочами и снова выделяются анилин:
C6H5 – Nh4 Cl+ NaOH ? C6H5 Nh3 + Na Cl + h3O
3. Энергично участвует в реакциях замещения, например реагирует с бромной водой с образованием 2, 4, 6 – триброманилина:
Взаимное влияние атомов в молекулах галогенопроизводных углеводород.
Самое характерное химическое свойство предельных углеводородов – реакции замещения. Примером такой реакции является взаимодействие предельных углеводородов с галогенами. Аналогично с галогенами реагируют и другие предельные углеводороды:
Ch4-Ch4+Cl2 ? Ch4-Ch3-Cl+HCl
Галогенопроизводные углеводороды обладают некоторыми особенностями. Согласно теории А.М. Бутлерова, это объясняется взаимным влиянием атомов и атомных групп в химических соединениях. С точки зрения современных представлений об электронных облаках и их взаимном перекрывании, с учетом электроотрицательности химических элементов взаимное влияние атомов и атомных групп, например в метилхиориде, объясняется так. У атомов хлора электроотрицательность больше, чем у атомов углерода. Поэтому электронная плотность связи смещена от атома углерода в сторону атома хлора. Вследствие этого атом хлора приобретает частичный отрицательный заряд, а атом углерода – частичный положительный заряд. Приобретаемые частичные заряды обозначаются ?+ и ?- :
H H
\ ?+ ?- ?
H- C ? Cl или H ? C ? Cl
/ ?
H H
Влияние атома хлора распространяется не только на атом углерода, но и на атомы водорода. Из-за этого электронная плотность атомов водорода смещается в сторону атома углерода и химические связи между атомами водорода и углерода становится более полярными. В результате атомы водорода в молекуле метилхлорида оказываются менее прочно связанными с атомом углерода и легче замещаются на хлор, чем первый атом водорода в молекуле метана. Из-за смещения электронных плотностей от атома водорода к атому углерода значение положительного заряда последнего уменьшается. Поэтому ковалентная связь между атомами углерода и хлора становится менее полярной и более прочной.
С точки зрения ионного механизма сущность правила В.В. Марковникова при взаимодействии пропилена с бромоводородом объясняется следующим образом: в молекуле пропилена в результате сдвига электронной плотности второй атом углерода, который связан с метилрадикалом заряжен более положительно, чем первый.
Значение электроотрицательности у атомов углерода больше, чем у атомов водорода. Поэтому третий атом углерода метильной группы в результате сдвига электронной плотности от трех атомов водорода приобретает относительно больший отрицательный заряд, чем другие атомы углерода. Этот избыточный отрицательный заряд в свою очередь смещает подвижные П-электронные облака от второго к первому атому углерода. В результате такого сдвига первый атом углерода приобретает больший отрицательный заряд, а второй становится более положительным. В результате атом водорода (+) присоединяется к атому углерода (-), а галоген (-) – к атому углерода (+).
Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко.
1. При действии энергичных окислителей (K Mn O4) на гомолоне бензола окислению подвергаются только боковые цепи. Если, например, в пробирку налить 2-3 мл толуола, затем добавить к нему раствор перманганата калия и нагреть, то можно заметить, что фиолетовая окраска раствора постепенно обесцвечивается. Это происходит потому, что по действием перманганата калия метильная группа толуола окисляется и превращается в группу
O
//
- C
\
OH
O
//
C6H5-Ch4+3O ? C6H5-C + h3O
\
OH
Известно, что метан и другие предельные углеводороды весьма устойчивы к действию окислителей. Однако метильная группа в молекуле толуола окисляется сравнительно легко. Это объясняется влиянием бензольного кольца. Из приведенных примеров реакций замещения и окисления следует, что не только метильная группа влияет на бензольное кольцо, но и бензольное кольцо влияет на метильную группу, т.е. их влияние зависимо.
Скачать файл (55.5 kb.)gendocs.ru
Строение молекул воды, их связи и свойства
Перейти к оглавлению сайта
Ячейка Мэйера
Вода вместо бензина Как работает ячейка Мэйера Резонансный контур молекул воды Строение молекул воды, свойства Разрыв молекул воды и закон Ома Выбор типа СВЧ-колебаний Разрыв молекул воды и ЗСИ Модели молекул воды, водорода и кислорода Плазмо- электролитический реактор Канарёва Электролиз обыкновенной воды Анализ патентов Ячейки Мэйера Импульсный генератор для ячейки Мэйера Производительность ячейки Мэйера
Забежав немного вперёд напишу:
Задача, выполняемая Ячейкой Мэйера - «лёгкое» разложение молекул воды под действием электрического тока, сопровождаемого электромагнитным излучением.
Для её решения разберёмся, что же вода из себя представляет? Каково строение молекул воды? Что известно о молекулах воды и их связях? В статье, я использовал различные публикации, имеющиеся в достаточном количестве в Интернете, но они размножены в большом количестве, поэтому, кто их автор, мне не понятно и ссылаться на источник с моей стороны глупо. Мало того, эти публикации «запутаны» до безобразия, что затрудняет восприятие, и значительно увеличивает время изучения. Анализируя статьи, я извлёк то, что может направить Вас на понимание того, с чем мы будем иметь дело в процессе добычи дешёвой энергии, а точнее в процессе разрыва молекул воды на составляющие – водород и кислород.
Итак, рассмотрим наиболее весомые понятия о строении молекул воды!

Вода - вещество, основной структурной единицей которого является молекула h3O, состоящая из одного атома кислорода и двух атомов водорода.
Молекула воды имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений. Геометрия молекулы воды и её электронные орбиты изображены на рисунке.
Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах. Если "свободную" молекулу воды - не связанную с другими молекулами, поместить в электрическое поле, то она "повернётся" отрицательными полюсами в сторону положительной пластины электрического поля, а положительными полюсами в сторону отрицательной пластины. Именно этот процесс изображён на рисунке 1, позиция - 3В, поясняющем работу Ячейки Мэйера в статье "Вода вместо бензина".
 Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр. Таково строение самой молекулы воды.
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр. Таково строение самой молекулы воды.
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Именно такое упорядоченное состояние молекул воды можно назвать «структурой». Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28', направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру.
 Когда лёд плавится, его тетрагональная структура разрушается и образуется смесь полимеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды.
Когда лёд плавится, его тетрагональная структура разрушается и образуется смесь полимеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды.
В жидком состоянии вода – неупорядоченная жидкость. Эти водородные связи - спонтанные, короткоживущие, быстро рвутся и образуются вновь.
Группируясь, тетраэдры молекул воды образуют разнообразные пространственные и плоскостные структуры.
И из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо.
 Такой тип структуры характерен для льда, снега и талой воды, которую из-за наличия такой структуры, называют "Структурированной водой". О полезных свойствах структурированной воды пишут много, но не это тема нашей статьи. Логично будет, что структурированная вода - образующая гексагональные структуры является наихудшим вариантом структуры воды, которую возможно использовать для разложения на водород и кислород. Поясню почему: Молекулы воды, группируясь по шесть в гексамер, имеют электронейтральный состав - у гексамеров нет положительных и отрицательных полюсов. Если поместить гексамер структурированной воды в электрическое поле, то он не будет никак на него реагировать. Поэтому логически можно заключить, что необходимо, чтобы в воде было как можно меньше организованных структур. На самом деле, всё наоборот, гексамер - это не завершённая структура, есть ещё более интересное понятие - кластер.
Такой тип структуры характерен для льда, снега и талой воды, которую из-за наличия такой структуры, называют "Структурированной водой". О полезных свойствах структурированной воды пишут много, но не это тема нашей статьи. Логично будет, что структурированная вода - образующая гексагональные структуры является наихудшим вариантом структуры воды, которую возможно использовать для разложения на водород и кислород. Поясню почему: Молекулы воды, группируясь по шесть в гексамер, имеют электронейтральный состав - у гексамеров нет положительных и отрицательных полюсов. Если поместить гексамер структурированной воды в электрическое поле, то он не будет никак на него реагировать. Поэтому логически можно заключить, что необходимо, чтобы в воде было как можно меньше организованных структур. На самом деле, всё наоборот, гексамер - это не завершённая структура, есть ещё более интересное понятие - кластер.
Структуры объединённых молекул воды называют кластерами, а отдельные молекулы воды - квантами. Кластер - объёмное соединение молекул воды, в том числе гексамеров, у которого имеются и положительные и отрицательные полюса.
В дистиллированной воде кластеры практически электронейтральны, потому что в результате испарения, произошло разрушение кластеров, а в результате конденсации, сильные связи между молекулами воды не появились.
Однако, их электропроводность можно изменить. Если дистиллированную воду помешать магнитной мешалкой, связи между элементами кластеров будут частично восстановлены и электропроводность воды изменится. Другими словами, дистиллированная вода – это вода, у которой минимальное количество связей между молекулами. В ней диполи молекул находятся в разориентированном состоянии, поэтому диэлектрическая проницаемость дистиллированной воды очень высока, и она плохо проводит электрический ток. В то же время, для повышения управляемости кластерами воды, в неё добавляют кислоты или щёлочи, которые участвуя в молекулярных связях, не позволяют молекулам воды образовывать гексагональные структуры, образуя при этом электролиты. Дистиллированная вода является противоположностью структурированной воде, в которой связей между молекулами воды в кластеры огромное количество.На моём сайте имеются, и будут появляться статьи, которые, на первый взгляд «отдельные» и не имеют никакого отношения к другим статьям. На самом деле, большинство статей сайта имеет взаимосвязь в одно целое. В данном случае, описывая свойства дистиллированной воды, я использую Дипольную теорию электрического тока, это альтернативное понятие об электрическом токе, которое подтверждается и наукой и практикой лучше, чем классическое понятие.
При воздействии энергии источника электрического тока, все диполи атомов воды (как проводника) поворачиваются, ориентируясь своими одноимёнными полюсами в одном направлении. Если молекулы воды до появления внешнего электрического поля создавали кластерную (взаимно ориентированную) структуру, то для ориентации во внешнем электрическом поле потребуется минимальное количество энергии источника электрического тока. Если же структура была не организованной (как у дистиллированной воды), то потребуется большое количество энергии.
Заметьте, «в народе» бытует мнение, что дистиллированная вода и талая вода должны обладать одинаковыми электропроводными свойствами, ведь что у одной, что у другой отсутствуют химические примеси (как правило – соли), их химический состав одинаков, да и строение молекул воды что в талой воде, что в дистиллированной одинаково.
На самом деле всё выглядит наоборот, отсутствие примесей совсем не говорит о свойствах электропроводности воды. Не понимая этого, некоторые люди, «убивают» аккумуляторные батареи ещё на этапе их заправки электролитом, подменяя дистиллированную воду на талую, или просто очищенную через угольный фильтр. Как правило, заправленный аккумулятор, который куплен на автомобильном рынке служит меньше, чем тот, который вы купили сухозаряженным и разбавив серную кислоту дистиллированной водой, заправили его сами. Это лишь потому, что «готовый» электролит, или заправленный аккумулятор – это в наше время средство заработка, а чтобы определить какая вода использовалась, надо провести дорогую экспертизу, никто этим не заморачивается. Торгашу не важно, сколько прослужит аккумулятор на твоём авто, а Вам тоже, возиться с кислотой не очень хочется. Зато, я Вас уверяю, аккумулятор, над которым попотеете Вы, при минусовых температурах будет намного бодрее, чем заправленный из уже готового бутылочного электролита.
Продолжим!
В воде кластеры периодически разрушаются и образуются снова. Время перескока составляет 10-12 секунд.
Так как, строение молекулы воды несимметрично, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса - положительный и отрицательный, создающие, как магнит, молекулярные силовые поля. Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах: p = l·e
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м.
Кластеры воды на границах раздела фаз (жидкость-воздух) выстраиваются в определенном порядке, при этом все кластеры колеблются с одинаковой частотой, приобретая одну общую частоту. При таком движении кластеров, учитывая, что входящие в кластер молекулы воды являются полярными, то есть, имеют большой дипольный момент, следует ожидать появления электромагнитного излучения. Это излучение отличается от излучения свободных диполей, так как диполи являются связанными и колеблются совместно в кластерной структуре.
Частота колебаний кластеров воды и соответственно, частота электромагнитных колебаний может быть определена по следующей формуле:
 где a - поверхностное натяжение воды при заданной температуре; М
- масса кластера.
где a - поверхностное натяжение воды при заданной температуре; М
- масса кластера.
 где V - объем кластера.
где V - объем кластера.
Объем кластера определяется с учетом размеров фрактальной замкнутой структуры кластера или по аналогии с размерами домена белка. При комнатной температуре 18°С частота колебаний кластера f равна 6,79·109 Гц, то есть длина волны в свободном пространстве должна составлять λ = 14,18 мм.
 Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R0 до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R0 до R2).
Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R0 до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R0 до R2).
Но, поскольку молекулы воды имеют большой дипольный момент, то в случае внешнего электромагнитного поля, они будут совершать колебательные движения (например, от R1 до R2). При этом в силу приведенной зависимости приложенное электромагнитное поле будет больше способствовать притяжению молекул и тем самым организованности системы в целом, т.е. образованию гексагональной структуры.
При наличии же примесей в водной среде, они покрываются гидратной оболочкой таким образом, что общая энергия системы стремится принять минимальное значение. И если общий дипольный момент гексагональной структуры равен нулю, то в присутствие примесей гексагональная структура вблизи них нарушается таким образом, чтобы система приняла минимальное значение, в ряде случаев шестиугольники преобразуются в пятиугольники, и гидратная оболочка имеет форму близкую к шару. Примеси (например, ионы Na+) могут стабилизировать структуру, делать ее более устойчивой к разрушению.
Самоорганизованная система воды при воздействии электромагнитного излучения не будет перемещаться как единое целое, но каждый элемент гексагональной, а в случае примесей локально и другого вида, структуры будет смещаться, т.е. будет происходить искажение геометрии структуры, т.е. возникать напряжения. Такое свойство воды очень напоминает полимеры. Но полимерные структуры обладают большими временами релаксации, которые составляют не 10-11–10-12 с, а минуты и больше. Поэтому энергия квантов электромагнитного излучения, переходя во внутреннюю энергию организованной водной структуры в результате её искажений, будет накапливаться ею, пока не достигнет энергии водородной связи, которая в 500–1000 раз больше энергии электромагнитного поля. При достижении этой величины происходит разрыв водородной связи, и структура разрушается.
Это можно сравнить со снежной лавиной, когда происходит постепенное, медленное накапливание массы, а затем стремительный обвал. В случае с водой происходит разрыв не только слабой связи между кластерами, но и более сильных связей - в строении молекул воды. В результате этого разрыва могут образовываться Н+, ОН–, и гидратированный электрон е–. Голубой цвет чистой воды обязан наличию именно этих электронов, а не только рассеянию естественного света.
Заключение
Таким образом, при воздействии электромагнитного излучения с водой происходит накапливание энергии в кластерной структуре до некоторого критического значения, затем происходит разрыв связей как между кластерами, так и других, происходит лавинообразное освобождение энергии, которая может затем трансформироваться в другие типы.
В следующей статье"Разрыв молекул воды на водород и кислород. Закон Ома и Ячейка Мэйера", мы определимся с условиями разрыва молекул воды и разберёмся, как Закон Ома препятствует "нашим желаниям".







Что такое электрический ток?
Графическое обозначение радиоэлементов на схеме. Основные элементы
Выбор сечения кабеля проводки электрической сети
Биполярный транзистор, расчёт транзисторного каскада
Простые стабилизаторы напряжения и их расчёт
Самое новое на сайтеТехнический шпионаж. Часть 3.
Технический шпионаж. Часть 2.
Технический шпионаж
Отчёт о деятельности за 2017 годwww.meanders.ru
конфигурация, конформация; способы изображения; примеры.

Обратная связь
ПОЗНАВАТЕЛЬНОЕ
Сила воли ведет к действию, а позитивные действия формируют позитивное отношение
Как определить диапазон голоса - ваш вокал
Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими
Целительная привычка
Как самому избавиться от обидчивости
Противоречивые взгляды на качества, присущие мужчинам
Тренинг уверенности в себе
Вкуснейший "Салат из свеклы с чесноком"
Натюрморт и его изобразительные возможности
Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д.
Как научиться брать на себя ответственность
Зачем нужны границы в отношениях с детьми?
Световозвращающие элементы на детской одежде
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Как слышать голос Бога
Классификация ожирения по ИМТ (ВОЗ)
Глава 3. Завет мужчины с женщиной

Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
 Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
 Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Конфигурация молекул, в стереохимии характеризует пространственное расположение атомов или групп атомов у асимметрического атома, у несимметрично замещенной двойной связи, у малого (жёсткого) цикла, у центрального атома в комплексах. Различия между конфигурациями молекул обусловливают существование двух видов устойчивых стереоизомеров — геометрических и оптических. Конфигурация молекулы не меняется при изменении её конформации, т. е. при повороте вокруг простых связей отдельных частей молекулы относительно друг друга.
Конформация определяется как любое относительное положение атомных ядер в молекуле, при котором сохраняется ее целостность (т. е. конфигурация). Конформационные изомеры, или конформации, неотделимы друг от друга и сосуществуют в едином множестве геометрических форм, возникающих в результате перемещения ядер атомов в молекуле относительно друг друга.
Деление стереоизомеров на конфигурационные и конформационные весьма условно. Дело в том, что до сих пор не выработано четкого критерия, позволяющего дифференцировать эти два фундаментальных стереохимических понятия. В одних условиях соединение может быть конфигурационно устойчивым, т. е. его можно считать конфигурационным стереоизомером, тогда как в другом температурном интервале оно же быстро превращается в другой стереоизомер и эту пару изомеров следует уже считать конформациями. Однако существуют конфигурационно устойчивые стереоизомеры, которые в традиционном понимании следовало бы считать конформерами.
Таким образом, можно привести в виде схемы обобщенную классификацию стереоизомеров, на которой показана четкая граница между понятиями «энантиомерия» и «диастереомерия» и нечеткое, размытое разделение понятий конфигурационных и конформационных стереоизомеров.
Для изображения пространственного строения молекул на плоскости применяют различные стереохимические и проекционные формулы. При работе с молекулярными моделями, передающими относительное расположение атомов в пространстве с помощью условных символов, достигается наибольшая наглядность представления о пространственном расположении атомов или атомных групп в молекулах. Существует несколько типов молекулярных моделей.
Шаростержневые модели. Модели этого типа собирают из цветных шариков, обозначающих входящие в состав молекул атомы. Шарики соединяют стержнями, символизирующими химические связи. С помощью шаростержневых моделей довольно точно воспроизводятся валентные углы в молекуле, но межъядерные расстояния отражаются лишь приблизительно, поскольку длины стержней, соединяющих шарики, не пропорциональны длинам связей. Существенный недостаток шаростержневых моделей заключается также в том, что они не создают картину заполнения межъядерного пространства электронной плотностью.
Модели Дрейдннга. Такие модели достаточно точно передают валентные углы и соотношение длин связей в молекулах. Ядра атомов в них, в отличие от шаростержневых моделей, обозначаются не шариками, а точками соединения стержней.
Полусферические модели. Эти модели, называемые также моделями Стюарта-Бриглеба, собирают из шаров со срезанными сегментами. Модели атомов соединяют между собой плоскостями срезов с помощью кнопок. Радиусы полусфер, соответствующие определенным атомам, пропорциональны их ван-дер-ваальсовым радиусам. Ван-дер-ваальсов радиус определяет пространство, которое в основном занимают валентные электроны. Кратчайшие расстояния от центров шаров до плоскостей срезов пропорциональны ковалентным радиусам r2 соответствующих атомов. Полусферические модели точно передают как соотношение длин связей и валентных углов, так и заполненность межъядерного пространства в молекулах. Однако эта заполненность не всегда позволяет получить наглядное представление о взаимном расположении ядер атомов в молекуле.

Стереохимические формулы. Их используют для изображения молекул, содержащих тетраэдрические и тригональные 12C, т. е. в sp3- и sp2-гибридном. При этом связи, располагающиеся в пространстве перед плоскостью чертежа, изображают утолщенными или клиновидными линиями, а связи, располагающиеся за плоскостью чертежа, — штриховыми линиями. Связи, которые находятся в плоскости чертежа, изображают сплошными линиями.

Проекционные формулы Ньюмена. Эти формулы применяют для изображения двухуглеродных фрагментов молекул. При построении проекции Ньюмена узловые атомы двухатомного (в частности, двухуглеродного) фрагмента располагают в пространстве так, чтобы они находились на одной линии с глазом наблюдателя, после чего ближний атом обозначают на бумаге точкой, а удаленный от наблюдателя атом — окружностью. Остальные связи изображают сплошными линиями под углом 120°.
Проекционные формулы Ньюмена можно использовать также применительно к многоатомным молекулам и циклическим структурам.

Перспективные формулы. Для изображения двухуглеродных фрагментов молекул используют также формулы типа лесопильных козел, представляющие собой перспективное изображение молекулярной модели с непропорционально удлиненной центральной связью.

Проекционные формулы Фишера. С помощью этих формул изображают молекулы, имеющие в своем составе асимметрические атомы углерода. Для построения проекции Фишера молекулярную модель располагают так, чтобы связи, направленные к наблюдателю, образовывали на проекции горизонтальную линию. Тогда две другие связи будут удалены от наблюдателя и на проекции будут образовывать вертикальную линию. Это иллюстрируется примером построения проекционной формулы молочной кислоты: Аналогичным образом строят проекционные формулы молекул, имеющих более одного асимметрического атома углерода, как это видно на примере построения проекции Фишера для одного из стереоизомеров винной кислоты.


Иногда на проекционных формулах вертикальные линии изображают штриховой линией, что символизирует их положение за плоскостью. Когда приходится изменять положение проекционной формулы на плоскости, во избежание искажения стереохимического смысла преобразования проводят с соблюдением определенных правил:
· в проекционной формуле можно менять местами два любых заместителя у одного и того же асимметрического атома углерода четное число раз.
· проекционную формулу можно поворачивать в плоскости на 180°.
Несоблюдение этого порядка преобразований приводит к изменению стереохимического смысла проекционных формул (нечетное число перестановок приводит к формуле с противоположной конфигурацией).
megapredmet.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


