сульфиты
Хромовая

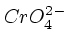
Na2 CrO4
хромат натрия
Двухромовая


Na2 Cr2 O7
Бихромат натрия
Содержание. 2
Введение. 3
Графическое изображение формул солей. 6
Названия солей. 4
Классификация солей. 7
1. Кислые соли . 7
2. Средние соли . 7
3. Основные соли . 8
4. Двойные соли . 9
5. Комплексные соли ………………………………………………… ...10
Получение солей. 10
1. Реакция нейтрализации. 10
2. Реакция кислот с основными оксидами. 11
3. Реакция оснований с кислотными оксидами . 11
4. Реакция основных и кислотных оксидов между собой: 11
5. Реакция кислот с солями. 11
6. Реакция оснований с солями. 11
7. Реакция двух различных солей. 11
8. Реакция металлов с кислотами. 12
9. Реакция металлов с неметаллами. 12
10. Реакция металлов с солями. 12
Физические свойства. 12
Химические свойства солей. 14
1. Окислительно-восстановительные реакции солей. 14
2. Обменные реакции солей. 15
3. Разложение твердых солей…………………………………………..16
4. Гидролиз солей ………………………………………………………...16
Применение солей. 16
Список литературы………………………………………………………………19
Мой реферат называется “Мир солей “.Так что же такое соль? С точки зрения химии, соль — это вещество, образовавшееся в результате взаимодействия кислоты и щелочи. С точки зрения геологии — это образовавшиеся в результате геологических процессов мощные (часто многокилометровые) залежи эвапоритов (галита, сильвинита). С точки зрения почвоведения — это высолы, прожилки, а иногда даже поверхностные корки в почвах засушливых зон — солонцах и солончаках, практически непригодных для сельскохозяйственного использования. Для биохимика и медика — это раствор, циркулирующий в организме человека, без которого невозможны определенные биохимические реакции и соответственно, невозможно нормальное функционирование органов.
Без обычной соли, так называемой поваренной — NaCl, большинство животных, как травоядных, так и плотоядных испытывают так называемое солевое голодание. Плотоядные животные, обеспечивают свой организмом солью, поступающей с мясом и кровью добычи, травоядные — ищут выступы соли, соленые почвы, лижут их, тем самым, обеспечивая солью организм.
Для человека соль также необходима. Недаром в древности соль служила своеобразной валютой, многие племена и народности вынуждены были покупать или обменивать соль у тех племен, на территории которых были залежи солей. (Даже в настоящее время многие племена, в основном в сельве Южной Америке и горных джунглях Новой Гвинеи испытывают солевой дефицит, соль там до сих пор считается одной из главных видов “валюты”, часто вместо соли используется зола сожженных растений определенного вида, способных накапливать соль.) В те времена соль ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли — нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
Но соль может оказывать и отрицательное воздействие, в больших количествах поваренная соль (да и другие легкорастворимые соли) вредны — они затрудняют работу печени и почек, способствуют отложению солей в сосудах, заболеванию артритом.
Так же начало применения соли в качестве антигололедного компонента было положено в конце 50-х начале 60-х годов уже прошлого века. Таким образом, улицы Москвы “солят” уже без малого полвека. В качестве реагентов используют смеси различного состава, на основе галита, калийной соли — сильвина, ангидрита (сульфата кальция), глауберита (смеси сульфата натрия и кальция), сульфата натрия (глауберова соль). Антигололедные средства оказывают неблагоприятное воздействие на окружающую среду, природу, наносят вред жизнедеятельности человека. (нарушения электроизоляции в троллейбусах, сильная коррозия кузовов автомобилей, порча обуви и т.д.)
Соль широко используется в различных сферах деятельности человека.(в медицине, строительстве, сельском хозяйстве и т.д.)
В настоящее время мы не представляем нашу жизнь без соли, поэтому, я считаю, что тема моего реферата является очень актуальной.
В моей работе рассказывается о получении, классификации, химических и физических свойствах и применении солей.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы Nh5+ . Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2 SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(Nh5 )2 SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+ Cl– – хлорид натрия
Ca2+ SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 1.
Таблица 1. Построение названий солей.
В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
| Соль какой кислоты | Кислотный остаток | Валентность остатка | Название солей | Примеры |
| АзотнаяHNO3 | NO3- | I | нитраты | Ca(NO3 )2 нитрат кальция |
| Кремниевая h3 SiO3 | SiO32- | II | силикаты | Na2 SiO3 силикат натрия |
| Сернаяh3 SO4 | SO42- | II | сульфаты | PbSO4 сульфат свинца |
| Угольнаяh3 CO3 | CO32- | II | карбонаты | Na2 CO3 карбонат натрия |
| Фосфорная h4 PO4 | PO43- | III | фосфаты | AlPO4 фосфат алюминия |
| СернистаяH 2 SO 3 | SO32- | II | сульфиты | Na2 SO3 сульфит натрия |
| Марганцовая HMnO 4 | MnO4- | I | перманганаты | KMnO4 перманганат калия |
Хромовая
| 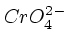 | II | хроматы | Na2 CrO4 хромат натрия |
Двухромовая
|  | II | бихроматы | Na2 Cr2 O7 Бихромат натрия |
| Бромоводородная HBr | Br- | I | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I- | I | иодиды | KI иодид калия |
| Сероводородная h3 S | S2- | II | сульфиды | FeS сульфид железа (II) |
| Соляная HCl | Cl- | I | хлориды | Nh5 Cl хлорид аммония |
| Фтороводородная HF | F- | I | фториды | CaF2 фторид кальция |
Из таблицы 1 видно, что названия кислородсодержащих солей имеют окончания "ат ", а названия бескислородных солей – окончания "ид ".
В некоторых случаях для кислородсодержащих солей может использоваться окончание "ит ". Например, Na2 SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (h3 SO4 ) и сернистой кислоты (h3 SO3 ) и в других таких же случаях.
В таблице 2 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение.
Таблица 2. Международные, русские и традиционные названия некоторых важных солей.
| Соль | Международное название | Русское название | Традиционное название |
| Na2 CO3 | Карбонат натрия | Натрий углекислый | Сода |
| NaHCO3 | Гидрокарбонат натрия | Натрий углекислый кислый | Питьевая сода |
| K2 CO3 | Карбонат калия | Калий углекислый | Поташ |
| Na2 SO4 | Сульфат натрия | Натрий сернокислый | Глауберова соль |
| MgSO4 | Сульфат магния | Магний сернокислый | Английская соль |
| KClO3 | Хлорат калия | Калий хлорноватокислый | Бертолетова соль |

Любую соль можно представить как продукт взаимодействия основания и кислоты, то есть как продукт замещения атомов водорода в молекуле кислоты на атом металла или гидроксильных групп в молекуле основания на соответствующие кислотные остатки. В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные.
Кислые соли — представляют собой продукты неполного замещения атомов водорода атомами металла. Кислые соли — продукт неполной нейтрализации многоосновных кислот основаниями.
От двухосновных кислот (H 2 SO 4 , H 2 CO 3 , H 2 S и т.д.) производится только один тип кислых солей — однозамещенные (атом металла замещает только один атом водорода кислоты).
Например:
H 2 SO 4 при неполной нейтрализации едким натром образует только одну кислую соль — NaHSO 4 .
От трехосновных кислот можно получить уже два типа кислых солей: однозамещенные и двухзамещенные.
Например:
при нейтрализации H 3 PO 4 едким натром можно получить однозамещенную соль NaH 2 PO 4 :
h4 PO4 + NaOH = Nah3 PO4 + h3 O
и двухзамещенную сольNa2 HPO4 :
h4 PO4 + 2 NaOH = Na2 HPO4 + 2h3 O
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2 HPO4 – гидрофосфат калия,
Kh3 PO4 – дигидрофосфат калия.
Диссоциация :
При диссоциации соли дают катионы металла (Nh5+ ), ионы водорода и анионы кислотного остатка.
NaHCO3 « Na+ + HCO3- « Na+ + H+ + CO32-
Средние соли можно рассматривать, как продукт полного замещения атомов водорода атомами металла:
| 2NaOH |  | h3 SO4 |  | Na 2 SO 4 |  | 2 h3 O |
| О снование | кислота | средняя соль |
Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 1 являются средними солями.
Диссоциация :
При диссоциации соли дают катионы металла (или Nh5+ ) и анионы кислотного остатка.
Na2 SO4 « 2Na+ +SO42-
Основные соли можно рассматривать как продукт неполного замещения гидроксильных групп основания или амфотерного гидроксида на кислотные остатки. Основные соли — продукт неполной нейтрализации многокислотного основания кислотой.
Основные соли могут давать только многокислотные основания, причем двухкислотные основания образуют только один тип основных солей, а трехкислотные — два.
Например:
Mg ( OH )2 — двухкислотное основание
| Mg(OH)2 + HNO3 = | MgOHNO3 | + h3 O , |
| основная соль |
при дальнейшей нейтрализации образуется средняя соль:
| MgOHNO3 + HNO3 = | Mg(NO3 )2 | + h3 O , |
| средняя соль |
Al( OH)3 — трехкислотное основание
| Al(OH) 3 + HCl = | Al(OH) 2 Cl | + h3 O , |
| Al(OH) 2 Cl + HCl = | AlOH Cl 2 | + h3 O , |
| основная соль |
при дальнейшей нейтрализации — средняя соль:
| AlOH Cl 2 + HCl = | Al Cl 3 | + H 2 O , |
| средняя соль |
Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
| Mg(OH)2 | + | 2 HCl | = | MgCl2 | + | 2 h3 O |
| хлорид магния (средняя соль) |
| Mg(OH)2 | + | HCl | = | Mg(OH)Cl | + | h3 O |
| гидроксохлорид магния (основная соль) |
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
Диссоциация:
При диссоциации соли дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl« [Zn(OH)]+ + Cl- «Zn2+ + OH- + Cl-
Двойные соли можно рассматривать как продукт замещения атомов водорода многоосновной кислоты на атомы разных металлов, или как продукт замещения гидроксильных групп многокислотного основания на кислотные остатки разных кислот.
Например:
KAl ( SO 4 )2 -алюмокалиевые квасцы, сульфат алюминия-калия, KCr ( SO 4 )2 -хромовокалиевые квасцы, сульфат хрома — калия, CaCl 2 O — известь
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
| h3 SO3 | + | 2 NaOH | = | Na2 SO3 | + | 2 h3 O |
| сульфит натрия (средняя соль) |
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуетсякислая соль – гидросульфит натрия:
| h3 SO3 | + | NaOH | = | NaHSO3 | + | h3 O |
| гидросульфит натрия (кислая соль) |
Диссоциация:
При диссоциации соли дают два катиона металлов и один анион кислотного остатка.
KAl(SO4 )2 « K+ + Al3+ + 2SO42-
| K4 [Fe(CN)6 ] | |
| K4 [Fe(CN)6 ] | – Внешняя сфера |
| K4[Fe(CN)6 ] | – Внутренняя сфера |
| K4 [Fe (CN)6 ] | – Комплексообразователь (центральный атом) |
| K4 [Fe(CN)6 ] | – Координационное число |
| K4 [Fe(CN )6 ] | – Лиганд |
Диссоциация:
При диссоциации отщепляются сложные ионы, которые затем подвергаются вторичной диссоциации.
[ Fe(CN)6 ]4- « Fe2+ + 6 CN-
Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль.
Например:
| h3 SO4 | + | 2 KOH | = | K2 SO4 | + | 2 h3 O |
| сульфат калия |
Это вариант реакции нейтрализации.
Например:
| h3 SO4 | + | CuO | = | CuSO4 | + | h3 O |
| сульфат меди |
Это также вариант реакции нейтрализации:
| Ca(OH)2 | + | CO2 | = | CaCO3 | + | h3 O |
| карбонаткальция |
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
Например:
| h3 S | + | CuCl2 | = | CuS ( осадок ) | + | 2 HCl |
| сульфид меди |
Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью.
Например:
| 3 NaOH | + | FeCl3 | = | Fe(OH)3 | + | 3 NaCl |
| (осадок) | хлорид натрия |
Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
Например:
| AgNO3 | + | KCl | = | AgCl (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор выпаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl - + K+ + Br -
Если такой раствор выпарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
В способах 1-7 имели дело с реакциями обмена (только способ 4 – реакция соединения). Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов, вытесняют из кислот водород и сами соединяются с ними, образуя соли:
| Fe | + | h3 SO4 ( разб .) | = | FeSO4 | + | h3 |
| сульфат железа II |
Эта реакция внешне напоминает горение. Металл «сгорает» в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый «дым»:
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 |
| порошок меди | сульфат цинка |
Соли представляют собой твердые кристаллические вещества. Соли имеют широкий диапазон температур плавления и термического разложения.
По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды, многие кислые соли.
Растворимость солей в воде при комнатной температуре
Кати- оны | Анионы | |||||||||
| F- | Cl- | Br- | I- | S2- | NO3- | CO32- | SiO32- | SO42- | PO43- | |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Nh5+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Р | Р | Р | - | - | Р | Г | Н | Р | РК |
| Co2+ | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | М | Р | Р | - | Н | Р | Г | Н | Р | Н |
| Zn2+ | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Условные обозначения:
Р — вещество хорошо растворимо в воде; М — малорастворимо; Н — практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах; РК — нерастворимо в воде и растворяется только в сильных неорганических кислотах; НК — нерастворимо ни в воде, ни в кислотах; Г — полностью гидролизуется при растворении и не существует в контакте с водой. Прочерк означает, что такое вещество вообще не существует.
В водных растворах соли полностью или частично диссоциируют на ионы. Соли слабых кислот и (или) слабых оснований подвергаются при этом гидролизу. Водные растворы солей содержат гидратированные ионы, ионные пары и более сложные химические формы, включающие продукты гидролиза и др. Ряд солей растворимы также в спиртах, ацетоне, амидах кислот и др. органических растворителях.
Из водных растворов соли могут кристаллизоваться в виде кристаллогидратов, из неводных — в виде кристаллосольватов, например СаВг2 • ЗС2Н5ОН.
Данные о различных процессах, протекающих в водносолевых системах, о растворимости солей при их совместном присутствии в зависимости от температуры, давления и концентрации, о составе твердых и жидких фаз могут быть получены при изучении диаграмм растворимости водно-солевых систем.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла .
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
| Hg2+ SO4 | + | Sn0 | = | Hg0 | + | Sn2+ SO4 |
| соль менее активного металла (окислитель) | более активный металл (восстановитель) |
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее, являются более активными.
б) Реакции за счет кислотного остатка .
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками.
Например:
| Na2 S–2 | + | Br20 | = | S0 | + | 2 NaBr–1 |
| соль сероводородной кислоты | сера |
| 2 KI–1 | + | h3 O2–1 | + | h3 SO4 | = | I20 | + | K2 SO4 | + | 2 h3 O–2 |
| соль иодоводородной кислоты | иод |
| 2 KMn+7 O4 | + | 16 HCl–1 | = | 5 Cl20 | + | 2 KCl | + | 2 Mn+2 Cl2 | + | 8 h3 O |
| соль марганцевой кислоты | хлорид марганца |
| 2 Pb(N+5 O3–2 )2 | = | 2 PbO | + | 4 N+4 O2 | + | O20 |
| соль азотной кислоты | при нагревании |
Такие реакции могут происходить, когда соли реагируют:
а) с кислотами;
б) с щелочами:
в) с другими солями.
При проведении обменных реакций берут растворы солей. Общим требованием для таких реакций является образование малорастворимого продукта, который удаляется из раствора в виде осадка. Например:
а) CuSO4 + h3 S = CuS (осадок) + h3 SO4
AgNO3 + HCl = AgCl (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3 (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2 ( осадок ) + K2 SO4
в) BaCl2 + K2 SO4 = BaSO4 ( осадок ) + 2 KCl
CaCl2 + Na2 CO3 = CaCO3 ( осадок ) + 2NaCl
Если хотя бы один продукт таких обменных реакций не уходит из сферы реакции в виде осадка (иногда – в виде газа), то при смешивании растворов образуется только смесь ионов, на которые при растворении распадаются исходная соль и реагент. Таким образом, обменная реакция произойти не может.
 СаО + СО2
СаО + СО2 Ca(HCO3 )2 ®CaCO3 ¯ + CO2 + h3 O
Вода — слабый электролит. В чистой воде концентрации ионов водорода и гидроксид-ионов равны. В растворах солей это равновесие нарушается, если соль образована слабым основанием или слабой кислотой.
Взаимодействие ионов растворимой соли с водой, приводящее к образованию слабого электролита и смещению ионного равновесия воды, называется гидролизом.
Гидролизу подвергаются лишь те соли, в составе которых есть ион слабого основания (гидролиз по катиону) или слабой кислоты (гидролиз по аниону), так как только при этом условии образуется слабый электролит, «несвязанные» ионы воды создают в растворах солей либо кислую, либо щелочную среду.
1.Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону. Это обратимый процесс. Краткое ионное уравнение (в общем виде) отражает взаимодействие одного аниона слабой кислоты с одной молекулой воды, приводящее к присоединению протона и образованию одной молекулы слабой одноосновной кислоты или одного гидроаниона слабой многоосновной кислоты. Реакция среды в растворе такой соли щелочная.
Na2 CO3 + h3 O «NaOH+ NaHCO3
2Nh5 SO4 +2 h3 O« 2Nh5 OH+ h3 SO4
Al2 S3 + h3 O «3h3 S+2 Al(OH)3
Ряд солей являются соединениями, необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов (соли натрия, калия, кальция, а также соли, содержащие элементы азот и фосфор). Ниже, на примерах отдельных солей, показаны области применения представителей данного класса неорганических соединений.
NaCl — хлорид натрия. О широте использования этой соли говорит тот факт, что мировая добыча этого вещества составляет 200 млн. т.
Эта соль находит широкое применение в пищевой промышленности, служит сырьем для получения хлора, соляной кислоты, гидроксида натрия, соды (Na 2 CO 3 ). Эта соль находит разнообразное применение в нефтяной промышленности, например, как добавка в буровые растворы для предупреждения образования каверн при бурении скважин, как регулятор сроков схватывания цементных тампонирующих составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
KCl — хлорид калия. Входит в состав буровых растворов, способствующих сохранению устойчивости стенок скважин в глинистых породах, является распространенным калийным удобрением.
Na 2 CO 3 — карбонат натрия, сода. Входит в состав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к использованию (например, в котлах), широко используется для очистки природного газа от сероводорода и для производства реагентов для буровых и тампонажных растворов.
Al 2 ( SO 4 )3 — сульфат алюминия. Компонент буровых растворов, коагулянт для очистки воды от взвешенных частиц, компонент вязкоупругих смесей для изоляции зон поглощения в нефтяных и газовых скважинах.
Na 2 B 4 O 7 — тетраборат натрия, бура. Является эффективным реагентом — замедлителем схватывания цементных растворов, ингибитором термоокислительной деструкции защитных реагентов на основе эфиров целлюлозы.
BaSO 4 — сульфат бария, барит, тяжелый шпат. Используется в качестве утяжелителя буровых и тампонажных растворов.
FeSO 4 - cульфат железа (II), железный купорос. Используется для приготовления феррохромлигносульфоната — реагента-стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе.
FeCl 3 — хлорид железа (III). В сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачки в сероводородсодержащие пласты с целью снижения их проницаемости, как добавка к цементам с целью повышения их сероводородостойкости, для очистки воды от взвешенных частиц.
CaCO 3 — карбонат кальция в виде мела, известняка. Является сырьем для производства негашеной известиCaO , используется в металлургии. Применяется в бурении в качестве утяжелителя и наполнителя буровых растворов.
CaSO 4 — сульфат кальция. В виде алебастра (2 CaSO 4* H 2 O ) широко используется в строительстве, входит в состав быстротвердеющих вяжущих средств для изоляции зон поглощений. При добавке к буровым растворам в виде ангидрита (CaSO 4 ) или гипса (CaSO 4* 2 H 2 O ) придает устойчивость разбуриваемым глинистым породам.
CaCl 2 — хлорид кальция. Используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород. Сильно снижает температуру замерзания растворов (антифриз). Применяется для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
NaSiO 3 — силикат натрия. Используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощений, ингибитор коррозии металлов, компонент некоторых буровых тампонажных и буферных растворов.
AgNO 3 — нитрат серебра. Используется для химического анализа, в том числе пластовых вод, фильтратов буровых растворов на содержание ионов хлора.
Na 2 SO 3 — сульфит натрия. Используется для химического удаления кислорода (деаэрация) из воды в целях борьбы с коррозией при закачке сточных вод.
Na 2 Cr 2 O 7 — бихромат натрия. Используется в нефтяной промышленности в качестве высокотемпературного понизителя вязкости буровых растворов, ингибитора коррозии алюминия, для приготовления ряда реагентов.
1. Гл. редактор И.Л. Кнунянц. Большой энциклопедический словарь Химия. Москва 1998
2. Гл. редактор И.Л. Кнунянц. Химическая энциклопедия. Москва1998
3. Н. Я. Логинов, А. Г. Воскресенский, И. С. Солодин. Аналитическая химия. Москва 1979
4. Р. А. Лидин. Справочник по общей и неорганической химии. Москва 1997
5. Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. Москва 1997
6. А. В. Суворов, А. А. Карцафа и др. Увлекательный мир химических превращений. Санкт-Петербург 1998
7. Н.Л. Глинка. Общая химия. Ленинград 1987
8. Э.Н. Рэмсден. Начала современной химии. Ленинград 1989
www.ronl.ru
Содержание. 2
Введение. 3
Графическое изображение формул солей. 6
Названия солей. 4
Классификация солей. 7
1. Кислые соли . 7
2. Средние соли . 7
3. Основные соли . 8
4. Двойные соли . 9
5. Комплексные соли ………………………………………………… ...10
Получение солей. 10
1. Реакция нейтрализации. 10
2. Реакция кислот с основными оксидами. 11
3. Реакция оснований с кислотными оксидами . 11
4. Реакция основных и кислотных оксидов между собой: 11
5. Реакция кислот с солями. 11
6. Реакция оснований с солями. 11
7. Реакция двух различных солей. 11
8. Реакция металлов с кислотами. 12
9. Реакция металлов с неметаллами. 12
10. Реакция металлов с солями. 12
Физические свойства. 12
Химические свойства солей. 14
1. Окислительно-восстановительные реакции солей. 14
2. Обменные реакции солей. 15
3. Разложение твердых солей…………………………………………..16
4. Гидролиз солей ………………………………………………………...16
Применение солей. 16
Список литературы………………………………………………………………19
Мой реферат называется “Мир солей “.Так что же такое соль? С точки зрения химии, соль — это вещество, образовавшееся в результате взаимодействия кислоты и щелочи. С точки зрения геологии — это образовавшиеся в результате геологических процессов мощные (часто многокилометровые) залежи эвапоритов (галита, сильвинита). С точки зрения почвоведения — это высолы, прожилки, а иногда даже поверхностные корки в почвах засушливых зон — солонцах и солончаках, практически непригодных для сельскохозяйственного использования. Для биохимика и медика — это раствор, циркулирующий в организме человека, без которого невозможны определенные биохимические реакции и соответственно, невозможно нормальное функционирование органов.
Без обычной соли, так называемой поваренной — NaCl, большинство животных, как травоядных, так и плотоядных испытывают так называемое солевое голодание. Плотоядные животные, обеспечивают свой организмом солью, поступающей с мясом и кровью добычи, травоядные — ищут выступы соли, соленые почвы, лижут их, тем самым, обеспечивая солью организм.
Для человека соль также необходима. Недаром в древности соль служила своеобразной валютой, многие племена и народности вынуждены были покупать или обменивать соль у тех племен, на территории которых были залежи солей. (Даже в настоящее время многие племена, в основном в сельве Южной Америке и горных джунглях Новой Гвинеи испытывают солевой дефицит, соль там до сих пор считается одной из главных видов “валюты”, часто вместо соли используется зола сожженных растений определенного вида, способных накапливать соль.) В те времена соль ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли — нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
Но соль может оказывать и отрицательное воздействие, в больших количествах поваренная соль (да и другие легкорастворимые соли) вредны — они затрудняют работу печени и почек, способствуют отложению солей в сосудах, заболеванию артритом.
Так же начало применения соли в качестве антигололедного компонента было положено в конце 50-х начале 60-х годов уже прошлого века. Таким образом, улицы Москвы “солят” уже без малого полвека. В качестве реагентов используют смеси различного состава, на основе галита, калийной соли — сильвина, ангидрита (сульфата кальция), глауберита (смеси сульфата натрия и кальция), сульфата натрия (глауберова соль). Антигололедные средства оказывают неблагоприятное воздействие на окружающую среду, природу, наносят вред жизнедеятельности человека. (нарушения электроизоляции в троллейбусах, сильная коррозия кузовов автомобилей, порча обуви и т.д.)
Соль широко используется в различных сферах деятельности человека.(в медицине, строительстве, сельском хозяйстве и т.д.)
В настоящее время мы не представляем нашу жизнь без соли, поэтому, я считаю, что тема моего реферата является очень актуальной.
В моей работе рассказывается о получении, классификации, химических и физических свойствах и применении солей.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы Nh5+ . Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2 SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(Nh5 )2 SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+ Cl– – хлорид натрия
Ca2+ SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 1.
Таблица 1. Построение названий солей.
В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
| Соль какой кислоты | Кислотный остаток | Валентность остатка | Название солей | Примеры |
| АзотнаяHNO3 | NO3- | I | нитраты | Ca(NO3 )2 нитрат кальция |
| Кремниевая h3 SiO3 | SiO32- | II | силикаты | Na2 SiO3 силикат натрия |
| Сернаяh3 SO4 | SO42- | II | сульфаты | PbSO4 сульфат свинца |
| Угольнаяh3 CO3 | CO32- | II | карбонаты | Na2 CO3 карбонат натрия |
| Фосфорная h4 PO4 | PO43- | III | фосфаты | AlPO4 фосфат алюминия |
| СернистаяH 2 SO 3 | SO32- | II | сульфиты | Na2 SO3 сульфит натрия |
| Марганцовая HMnO 4 | MnO4- | I | перманганаты | KMnO4 перманганат калия |
Хромовая
| 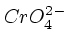 | II | хроматы | Na2 CrO4 хромат натрия |
Двухромовая
|  | II | бихроматы | Na2 Cr2 O7 Бихромат натрия |
| Бромоводородная HBr | Br- | I | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I- | I | иодиды | KI иодид калия |
| Сероводородная h3 S | S2- | II | сульфиды | FeS сульфид железа (II) |
| Соляная HCl | Cl- | I | хлориды | Nh5 Cl хлорид аммония |
| Фтороводородная HF | F- | I | фториды | CaF2 фторид кальция |
Из таблицы 1 видно, что названия кислородсодержащих солей имеют окончания "ат ", а названия бескислородных солей – окончания "ид ".
В некоторых случаях для кислородсодержащих солей может использоваться окончание "ит ". Например, Na2 SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (h3 SO4 ) и сернистой кислоты (h3 SO3 ) и в других таких же случаях.
В таблице 2 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение.
Таблица 2. Международные, русские и традиционные названия некоторых важных солей.
| Соль | Международное название | Русское название | Традиционное название |
| Na2 CO3 | Карбонат натрия | Натрий углекислый | Сода |
| NaHCO3 | Гидрокарбонат натрия | Натрий углекислый кислый | Питьевая сода |
| K2 CO3 | Карбонат калия | Калий углекислый | Поташ |
| Na2 SO4 | Сульфат натрия | Натрий сернокислый | Глауберова соль |
| MgSO4 | Сульфат магния | Магний сернокислый | Английская соль |
| KClO3 | Хлорат калия | Калий хлорноватокислый | Бертолетова соль |

Любую соль можно представить как продукт взаимодействия основания и кислоты, то есть как продукт замещения атомов водорода в молекуле кислоты на атом металла или гидроксильных групп в молекуле основания на соответствующие кислотные остатки. В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные.
Кислые соли — представляют собой продукты неполного замещения атомов водорода атомами металла. Кислые соли — продукт неполной нейтрализации многоосновных кислот основаниями.
От двухосновных кислот (H 2 SO 4 , H 2 CO 3 , H 2 S и т.д.) производится только один тип кислых солей — однозамещенные (атом металла замещает только один атом водорода кислоты).
Например:
H 2 SO 4 при неполной нейтрализации едким натром образует только одну кислую соль — NaHSO 4 .
От трехосновных кислот можно получить уже два типа кислых солей: однозамещенные и двухзамещенные.
Например:
при нейтрализации H 3 PO 4 едким натром можно получить однозамещенную соль NaH 2 PO 4 :
h4 PO4 + NaOH = Nah3 PO4 + h3 O
и двухзамещенную сольNa2 HPO4 :
h4 PO4 + 2 NaOH = Na2 HPO4 + 2h3 O
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2 HPO4 – гидрофосфат калия,
Kh3 PO4 – дигидрофосфат калия.
Диссоциация :
При диссоциации соли дают катионы металла (Nh5+ ), ионы водорода и анионы кислотного остатка.
NaHCO3 « Na+ + HCO3- « Na+ + H+ + CO32-
Средние соли можно рассматривать, как продукт полного замещения атомов водорода атомами металла:
| 2NaOH |  | h3 SO4 |  | Na 2 SO 4 |  | 2 h3 O |
| О снование | кислота | средняя соль |
Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 1 являются средними солями.
Диссоциация :
При диссоциации соли дают катионы металла (или Nh5+ ) и анионы кислотного остатка.
Na2 SO4 « 2Na+ +SO42-
Основные соли можно рассматривать как продукт неполного замещения гидроксильных групп основания или амфотерного гидроксида на кислотные остатки. Основные соли — продукт неполной нейтрализации многокислотного основания кислотой.
Основные соли могут давать только многокислотные основания, причем двухкислотные основания образуют только один тип основных солей, а трехкислотные — два.
Например:
Mg ( OH )2 — двухкислотное основание
| Mg(OH)2 + HNO3 = | MgOHNO3 | + h3 O , |
| основная соль |
при дальнейшей нейтрализации образуется средняя соль:
| MgOHNO3 + HNO3 = | Mg(NO3 )2 | + h3 O , |
| средняя соль |
Al( OH)3 — трехкислотное основание
| Al(OH) 3 + HCl = | Al(OH) 2 Cl | + h3 O , |
| Al(OH) 2 Cl + HCl = | AlOH Cl 2 | + h3 O , |
| основная соль |
при дальнейшей нейтрализации — средняя соль:
| AlOH Cl 2 + HCl = | Al Cl 3 | + H 2 O , |
| средняя соль |
Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
| Mg(OH)2 | + | 2 HCl | = | MgCl2 | + | 2 h3 O |
| хлорид магния (средняя соль) |
| Mg(OH)2 | + | HCl | = | Mg(OH)Cl | + | h3 O |
| гидроксохлорид магния (основная соль) |
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
Диссоциация:
При диссоциации соли дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl« [Zn(OH)]+ + Cl- «Zn2+ + OH- + Cl-
Двойные соли можно рассматривать как продукт замещения атомов водорода многоосновной кислоты на атомы разных металлов, или как продукт замещения гидроксильных групп многокислотного основания на кислотные остатки разных кислот.
Например:
KAl ( SO 4 )2 -алюмокалиевые квасцы, сульфат алюминия-калия, KCr ( SO 4 )2 -хромовокалиевые квасцы, сульфат хрома — калия, CaCl 2 O — известь
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
| h3 SO3 | + | 2 NaOH | = | Na2 SO3 | + | 2 h3 O |
| сульфит натрия (средняя соль) |
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуетсякислая соль – гидросульфит натрия:
| h3 SO3 | + | NaOH | = | NaHSO3 | + | h3 O |
| гидросульфит натрия (кислая соль) |
Диссоциация:
При диссоциации соли дают два катиона металлов и один анион кислотного остатка.
KAl(SO4 )2 « K+ + Al3+ + 2SO42-
| K4 [Fe(CN)6 ] | |
| K4 [Fe(CN)6 ] | – Внешняя сфера |
| K4[Fe(CN)6 ] | – Внутренняя сфера |
| K4 [Fe (CN)6 ] | – Комплексообразователь (центральный атом) |
| K4 [Fe(CN)6 ] | – Координационное число |
| K4 [Fe(CN )6 ] | – Лиганд |
Диссоциация:
При диссоциации отщепляются сложные ионы, которые затем подвергаются вторичной диссоциации.
[ Fe(CN)6 ]4- « Fe2+ + 6 CN-
Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль.
Например:
| h3 SO4 | + | 2 KOH | = | K2 SO4 | + | 2 h3 O |
| сульфат калия |
Это вариант реакции нейтрализации.
Например:
| h3 SO4 | + | CuO | = | CuSO4 | + | h3 O |
| сульфат меди |
Это также вариант реакции нейтрализации:
| Ca(OH)2 | + | CO2 | = | CaCO3 | + | h3 O |
| карбонаткальция |
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
Например:
| h3 S | + | CuCl2 | = | CuS ( осадок ) | + | 2 HCl |
| сульфид меди |
Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью.
Например:
| 3 NaOH | + | FeCl3 | = | Fe(OH)3 | + | 3 NaCl |
| (осадок) | хлорид натрия |
Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
Например:
| AgNO3 | + | KCl | = | AgCl (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор выпаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl - + K+ + Br -
Если такой раствор выпарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
В способах 1-7 имели дело с реакциями обмена (только способ 4 – реакция соединения). Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов, вытесняют из кислот водород и сами соединяются с ними, образуя соли:
| Fe | + | h3 SO4 ( разб .) | = | FeSO4 | + | h3 |
| сульфат железа II |
Эта реакция внешне напоминает горение. Металл «сгорает» в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый «дым»:
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 |
| порошок меди | сульфат цинка |
Соли представляют собой твердые кристаллические вещества. Соли имеют широкий диапазон температур плавления и термического разложения.
По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды, многие кислые соли.
Растворимость солей в воде при комнатной температуре
Кати- оны | Анионы | |||||||||
| F- | Cl- | Br- | I- | S2- | NO3- | CO32- | SiO32- | SO42- | PO43- | |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Nh5+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Р | Р | Р | - | - | Р | Г | Н | Р | РК |
| Co2+ | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | М | Р | Р | - | Н | Р | Г | Н | Р | Н |
| Zn2+ | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Условные обозначения:
Р — вещество хорошо растворимо в воде; М — малорастворимо; Н — практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах; РК — нерастворимо в воде и растворяется только в сильных неорганических кислотах; НК — нерастворимо ни в воде, ни в кислотах; Г — полностью гидролизуется при растворении и не существует в контакте с водой. Прочерк означает, что такое вещество вообще не существует.
В водных растворах соли полностью или частично диссоциируют на ионы. Соли слабых кислот и (или) слабых оснований подвергаются при этом гидролизу. Водные растворы солей содержат гидратированные ионы, ионные пары и более сложные химические формы, включающие продукты гидролиза и др. Ряд солей растворимы также в спиртах, ацетоне, амидах кислот и др. органических растворителях.
Из водных растворов соли могут кристаллизоваться в виде кристаллогидратов, из неводных — в виде кристаллосольватов, например СаВг2 • ЗС2Н5ОН.
Данные о различных процессах, протекающих в водносолевых системах, о растворимости солей при их совместном присутствии в зависимости от температуры, давления и концентрации, о составе твердых и жидких фаз могут быть получены при изучении диаграмм растворимости водно-солевых систем.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла .
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
| Hg2+ SO4 | + | Sn0 | = | Hg0 | + | Sn2+ SO4 |
| соль менее активного металла (окислитель) | более активный металл (восстановитель) |
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее, являются более активными.
б) Реакции за счет кислотного остатка .
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками.
Например:
| Na2 S–2 | + | Br20 | = | S0 | + | 2 NaBr–1 |
| соль сероводородной кислоты | сера |
| 2 KI–1 | + | h3 O2–1 | + | h3 SO4 | = | I20 | + | K2 SO4 | + | 2 h3 O–2 |
| соль иодоводородной кислоты | иод |
| 2 KMn+7 O4 | + | 16 HCl–1 | = | 5 Cl20 | + | 2 KCl | + | 2 Mn+2 Cl2 | + | 8 h3 O |
| соль марганцевой кислоты | хлорид марганца |
| 2 Pb(N+5 O3–2 )2 | = | 2 PbO | + | 4 N+4 O2 | + | O20 |
| соль азотной кислоты | при нагревании |
Такие реакции могут происходить, когда соли реагируют:
а) с кислотами;
б) с щелочами:
в) с другими солями.
При проведении обменных реакций берут растворы солей. Общим требованием для таких реакций является образование малорастворимого продукта, который удаляется из раствора в виде осадка. Например:
а) CuSO4 + h3 S = CuS (осадок) + h3 SO4
AgNO3 + HCl = AgCl (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3 (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2 ( осадок ) + K2 SO4
в) BaCl2 + K2 SO4 = BaSO4 ( осадок ) + 2 KCl
CaCl2 + Na2 CO3 = CaCO3 ( осадок ) + 2NaCl
Если хотя бы один продукт таких обменных реакций не уходит из сферы реакции в виде осадка (иногда – в виде газа), то при смешивании растворов образуется только смесь ионов, на которые при растворении распадаются исходная соль и реагент. Таким образом, обменная реакция произойти не может.
 СаО + СО2
СаО + СО2 Ca(HCO3 )2 ®CaCO3 ¯ + CO2 + h3 O
Вода — слабый электролит. В чистой воде концентрации ионов водорода и гидроксид-ионов равны. В растворах солей это равновесие нарушается, если соль образована слабым основанием или слабой кислотой.
Взаимодействие ионов растворимой соли с водой, приводящее к образованию слабого электролита и смещению ионного равновесия воды, называется гидролизом.
Гидролизу подвергаются лишь те соли, в составе которых есть ион слабого основания (гидролиз по катиону) или слабой кислоты (гидролиз по аниону), так как только при этом условии образуется слабый электролит, «несвязанные» ионы воды создают в растворах солей либо кислую, либо щелочную среду.
1.Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону. Это обратимый процесс. Краткое ионное уравнение (в общем виде) отражает взаимодействие одного аниона слабой кислоты с одной молекулой воды, приводящее к присоединению протона и образованию одной молекулы слабой одноосновной кислоты или одного гидроаниона слабой многоосновной кислоты. Реакция среды в растворе такой соли щелочная.
Na2 CO3 + h3 O «NaOH+ NaHCO3
2Nh5 SO4 +2 h3 O« 2Nh5 OH+ h3 SO4
Al2 S3 + h3 O «3h3 S+2 Al(OH)3
Ряд солей являются соединениями, необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов (соли натрия, калия, кальция, а также соли, содержащие элементы азот и фосфор). Ниже, на примерах отдельных солей, показаны области применения представителей данного класса неорганических соединений.
NaCl — хлорид натрия. О широте использования этой соли говорит тот факт, что мировая добыча этого вещества составляет 200 млн. т.
Эта соль находит широкое применение в пищевой промышленности, служит сырьем для получения хлора, соляной кислоты, гидроксида натрия, соды (Na 2 CO 3 ). Эта соль находит разнообразное применение в нефтяной промышленности, например, как добавка в буровые растворы для предупреждения образования каверн при бурении скважин, как регулятор сроков схватывания цементных тампонирующих составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
KCl — хлорид калия. Входит в состав буровых растворов, способствующих сохранению устойчивости стенок скважин в глинистых породах, является распространенным калийным удобрением.
Na 2 CO 3 — карбонат натрия, сода. Входит в состав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к использованию (например, в котлах), широко используется для очистки природного газа от сероводорода и для производства реагентов для буровых и тампонажных растворов.
Al 2 ( SO 4 )3 — сульфат алюминия. Компонент буровых растворов, коагулянт для очистки воды от взвешенных частиц, компонент вязкоупругих смесей для изоляции зон поглощения в нефтяных и газовых скважинах.
Na 2 B 4 O 7 — тетраборат натрия, бура. Является эффективным реагентом — замедлителем схватывания цементных растворов, ингибитором термоокислительной деструкции защитных реагентов на основе эфиров целлюлозы.
BaSO 4 — сульфат бария, барит, тяжелый шпат. Используется в качестве утяжелителя буровых и тампонажных растворов.
FeSO 4 - cульфат железа (II), железный купорос. Используется для приготовления феррохромлигносульфоната — реагента-стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе.
FeCl 3 — хлорид железа (III). В сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачки в сероводородсодержащие пласты с целью снижения их проницаемости, как добавка к цементам с целью повышения их сероводородостойкости, для очистки воды от взвешенных частиц.
CaCO 3 — карбонат кальция в виде мела, известняка. Является сырьем для производства негашеной известиCaO , используется в металлургии. Применяется в бурении в качестве утяжелителя и наполнителя буровых растворов.
CaSO 4 — сульфат кальция. В виде алебастра (2 CaSO 4* H 2 O ) широко используется в строительстве, входит в состав быстротвердеющих вяжущих средств для изоляции зон поглощений. При добавке к буровым растворам в виде ангидрита (CaSO 4 ) или гипса (CaSO 4* 2 H 2 O ) придает устойчивость разбуриваемым глинистым породам.
CaCl 2 — хлорид кальция. Используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород. Сильно снижает температуру замерзания растворов (антифриз). Применяется для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
NaSiO 3 — силикат натрия. Используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощений, ингибитор коррозии металлов, компонент некоторых буровых тампонажных и буферных растворов.
AgNO 3 — нитрат серебра. Используется для химического анализа, в том числе пластовых вод, фильтратов буровых растворов на содержание ионов хлора.
Na 2 SO 3 — сульфит натрия. Используется для химического удаления кислорода (деаэрация) из воды в целях борьбы с коррозией при закачке сточных вод.
Na 2 Cr 2 O 7 — бихромат натрия. Используется в нефтяной промышленности в качестве высокотемпературного понизителя вязкости буровых растворов, ингибитора коррозии алюминия, для приготовления ряда реагентов.
1. Гл. редактор И.Л. Кнунянц. Большой энциклопедический словарь Химия. Москва 1998
2. Гл. редактор И.Л. Кнунянц. Химическая энциклопедия. Москва1998
3. Н. Я. Логинов, А. Г. Воскресенский, И. С. Солодин. Аналитическая химия. Москва 1979
4. Р. А. Лидин. Справочник по общей и неорганической химии. Москва 1997
5. Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. Москва 1997
6. А. В. Суворов, А. А. Карцафа и др. Увлекательный мир химических превращений. Санкт-Петербург 1998
7. Н.Л. Глинка. Общая химия. Ленинград 1987
8. Э.Н. Рэмсден. Начала современной химии. Ленинград 1989
www.ronl.ru
Содержание. 2
Введение. 3
Графическое изображение формул солей. 6
Названия солей. 4
Классификация солей. 7
1. Кислые соли . 7
2. Средние соли . 7
3. Основные соли . 8
4. Двойные соли . 9
5. Комплексные соли ………………………………………………… ...10
Получение солей. 10
1. Реакция нейтрализации. 10
2. Реакция кислот с основными оксидами. 11
3. Реакция оснований с кислотными оксидами . 11
4. Реакция основных и кислотных оксидов между собой: 11
5. Реакция кислот с солями. 11
6. Реакция оснований с солями. 11
7. Реакция двух различных солей. 11
8. Реакция металлов с кислотами. 12
9. Реакция металлов с неметаллами. 12
10. Реакция металлов с солями. 12
Физические свойства. 12
Химические свойства солей. 14
1. Окислительно-восстановительные реакции солей. 14
2. Обменные реакции солей. 15
3. Разложение твердых солей…………………………………………..16
4. Гидролиз солей ………………………………………………………...16
Применение солей. 16
Список литературы………………………………………………………………19
Мой реферат называется “Мир солей “.Так что же такое соль? С точки зрения химии, соль — это вещество, образовавшееся в результате взаимодействия кислоты и щелочи. С точки зрения геологии — это образовавшиеся в результате геологических процессов мощные (часто многокилометровые) залежи эвапоритов (галита, сильвинита). С точки зрения почвоведения — это высолы, прожилки, а иногда даже поверхностные корки в почвах засушливых зон — солонцах и солончаках, практически непригодных для сельскохозяйственного использования. Для биохимика и медика — это раствор, циркулирующий в организме человека, без которого невозможны определенные биохимические реакции и соответственно, невозможно нормальное функционирование органов.
Без обычной соли, так называемой поваренной — NaCl, большинство животных, как травоядных, так и плотоядных испытывают так называемое солевое голодание. Плотоядные животные, обеспечивают свой организмом солью, поступающей с мясом и кровью добычи, травоядные — ищут выступы соли, соленые почвы, лижут их, тем самым, обеспечивая солью организм.
Для человека соль также необходима. Недаром в древности соль служила своеобразной валютой, многие племена и народности вынуждены были покупать или обменивать соль у тех племен, на территории которых были залежи солей. (Даже в настоящее время многие племена, в основном в сельве Южной Америке и горных джунглях Новой Гвинеи испытывают солевой дефицит, соль там до сих пор считается одной из главных видов “валюты”, часто вместо соли используется зола сожженных растений определенного вида, способных накапливать соль.) В те времена соль ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли — нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
Но соль может оказывать и отрицательное воздействие, в больших количествах поваренная соль (да и другие легкорастворимые соли) вредны — они затрудняют работу печени и почек, способствуют отложению солей в сосудах, заболеванию артритом.
Так же начало применения соли в качестве антигололедного компонента было положено в конце 50-х начале 60-х годов уже прошлого века. Таким образом, улицы Москвы “солят” уже без малого полвека. В качестве реагентов используют смеси различного состава, на основе галита, калийной соли — сильвина, ангидрита (сульфата кальция), глауберита (смеси сульфата натрия и кальция), сульфата натрия (глауберова соль). Антигололедные средства оказывают неблагоприятное воздействие на окружающую среду, природу, наносят вред жизнедеятельности человека. (нарушения электроизоляции в троллейбусах, сильная коррозия кузовов автомобилей, порча обуви и т.д.)
Соль широко используется в различных сферах деятельности человека.(в медицине, строительстве, сельском хозяйстве и т.д.)
В настоящее время мы не представляем нашу жизнь без соли, поэтому, я считаю, что тема моего реферата является очень актуальной.
В моей работе рассказывается о получении, классификации, химических и физических свойствах и применении солей.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы Nh5+ . Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2 SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(Nh5 )2 SO4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+ Cl– – хлорид натрия
Ca2+ SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 1.
Таблица 1. Построение названий солей.
В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
| Соль какой кислоты | Кислотный остаток | Валентность остатка | Название солей | Примеры |
| АзотнаяHNO3 | NO3- | I | нитраты | Ca(NO3 )2 нитрат кальция |
| Кремниевая h3 SiO3 | SiO32- | II | силикаты | Na2 SiO3 силикат натрия |
| Сернаяh3 SO4 | SO42- | II | сульфаты | PbSO4 сульфат свинца |
| Угольнаяh3 CO3 | CO32- | II | карбонаты | Na2 CO3 карбонат натрия |
| Фосфорная h4 PO4 | PO43- | III | фосфаты | AlPO4 фосфат алюминия |
| СернистаяH 2 SO 3 | SO32- | II | сульфиты | Na2 SO3 сульфит натрия |
| Марганцовая HMnO 4 | MnO4- | I | перманганаты | KMnO4 перманганат калия |
Хромовая
| 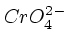 | II | хроматы | Na2 CrO4 хромат натрия |
Двухромовая
|  | II | бихроматы | Na2 Cr2 O7 Бихромат натрия |
| Бромоводородная HBr | Br- | I | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I- | I | иодиды | KI иодид калия |
| Сероводородная h3 S | S2- | II | сульфиды | FeS сульфид железа (II) |
| Соляная HCl | Cl- | I | хлориды | Nh5 Cl хлорид аммония |
| Фтороводородная HF | F- | I | фториды | CaF2 фторид кальция |
Из таблицы 1 видно, что названия кислородсодержащих солей имеют окончания "ат ", а названия бескислородных солей – окончания "ид ".
В некоторых случаях для кислородсодержащих солей может использоваться окончание "ит ". Например, Na2 SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (h3 SO4 ) и сернистой кислоты (h3 SO3 ) и в других таких же случаях.
В таблице 2 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение.
Таблица 2. Международные, русские и традиционные названия некоторых важных солей.
| Соль | Международное название | Русское название | Традиционное название |
| Na2 CO3 | Карбонат натрия | Натрий углекислый | Сода |
| NaHCO3 | Гидрокарбонат натрия | Натрий углекислый кислый | Питьевая сода |
| K2 CO3 | Карбонат калия | Калий углекислый | Поташ |
| Na2 SO4 | Сульфат натрия | Натрий сернокислый | Глауберова соль |
| MgSO4 | Сульфат магния | Магний сернокислый | Английская соль |
| KClO3 | Хлорат калия | Калий хлорноватокислый | Бертолетова соль |

Любую соль можно представить как продукт взаимодействия основания и кислоты, то есть как продукт замещения атомов водорода в молекуле кислоты на атом металла или гидроксильных групп в молекуле основания на соответствующие кислотные остатки. В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные.
Кислые соли — представляют собой продукты неполного замещения атомов водорода атомами металла. Кислые соли — продукт неполной нейтрализации многоосновных кислот основаниями.
От двухосновных кислот (H 2 SO 4 , H 2 CO 3 , H 2 S и т.д.) производится только один тип кислых солей — однозамещенные (атом металла замещает только один атом водорода кислоты).
Например:
H 2 SO 4 при неполной нейтрализации едким натром образует только одну кислую соль — NaHSO 4 .
От трехосновных кислот можно получить уже два типа кислых солей: однозамещенные и двухзамещенные.
Например:
при нейтрализации H 3 PO 4 едким натром можно получить однозамещенную соль NaH 2 PO 4 :
h4 PO4 + NaOH = Nah3 PO4 + h3 O
и двухзамещенную сольNa2 HPO4 :
h4 PO4 + 2 NaOH = Na2 HPO4 + 2h3 O
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2 HPO4 – гидрофосфат калия,
Kh3 PO4 – дигидрофосфат калия.
Диссоциация :
При диссоциации соли дают катионы металла (Nh5+ ), ионы водорода и анионы кислотного остатка.
NaHCO3 « Na+ + HCO3- « Na+ + H+ + CO32-
Средние соли можно рассматривать, как продукт полного замещения атомов водорода атомами металла:
| 2NaOH |  | h3 SO4 |  | Na 2 SO 4 |  | 2 h3 O |
| О снование | кислота | средняя соль |
Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 1 являются средними солями.
Диссоциация :
При диссоциации соли дают катионы металла (или Nh5+ ) и анионы кислотного остатка.
Na2 SO4 « 2Na+ +SO42-
Основные соли можно рассматривать как продукт неполного замещения гидроксильных групп основания или амфотерного гидроксида на кислотные остатки. Основные соли — продукт неполной нейтрализации многокислотного основания кислотой.
Основные соли могут давать только многокислотные основания, причем двухкислотные основания образуют только один тип основных солей, а трехкислотные — два.
Например:
Mg ( OH )2 — двухкислотное основание
| Mg(OH)2 + HNO3 = | MgOHNO3 | + h3 O , |
| основная соль |
при дальнейшей нейтрализации образуется средняя соль:
| MgOHNO3 + HNO3 = | Mg(NO3 )2 | + h3 O , |
| средняя соль |
Al( OH)3 — трехкислотное основание
| Al(OH) 3 + HCl = | Al(OH) 2 Cl | + h3 O , |
| Al(OH) 2 Cl + HCl = | AlOH Cl 2 | + h3 O , |
| основная соль |
при дальнейшей нейтрализации — средняя соль:
| AlOH Cl 2 + HCl = | Al Cl 3 | + H 2 O , |
| средняя соль |
Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
| Mg(OH)2 | + | 2 HCl | = | MgCl2 | + | 2 h3 O |
| хлорид магния (средняя соль) |
| Mg(OH)2 | + | HCl | = | Mg(OH)Cl | + | h3 O |
| гидроксохлорид магния (основная соль) |
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
Диссоциация:
При диссоциации соли дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl« [Zn(OH)]+ + Cl- «Zn2+ + OH- + Cl-
Двойные соли можно рассматривать как продукт замещения атомов водорода многоосновной кислоты на атомы разных металлов, или как продукт замещения гидроксильных групп многокислотного основания на кислотные остатки разных кислот.
Например:
KAl ( SO 4 )2 -алюмокалиевые квасцы, сульфат алюминия-калия, KCr ( SO 4 )2 -хромовокалиевые квасцы, сульфат хрома — калия, CaCl 2 O — известь
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
| h3 SO3 | + | 2 NaOH | = | Na2 SO3 | + | 2 h3 O |
| сульфит натрия (средняя соль) |
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуетсякислая соль – гидросульфит натрия:
| h3 SO3 | + | NaOH | = | NaHSO3 | + | h3 O |
| гидросульфит натрия (кислая соль) |
Диссоциация:
При диссоциации соли дают два катиона металлов и один анион кислотного остатка.
KAl(SO4 )2 « K+ + Al3+ + 2SO42-
| K4 [Fe(CN)6 ] | |
| K4 [Fe(CN)6 ] | – Внешняя сфера |
| K4[Fe(CN)6 ] | – Внутренняя сфера |
| K4 [Fe (CN)6 ] | – Комплексообразователь (центральный атом) |
| K4 [Fe(CN)6 ] | – Координационное число |
| K4 [Fe(CN )6 ] | – Лиганд |
Диссоциация:
При диссоциации отщепляются сложные ионы, которые затем подвергаются вторичной диссоциации.
[ Fe(CN)6 ]4- « Fe2+ + 6 CN-
Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль.
Например:
| h3 SO4 | + | 2 KOH | = | K2 SO4 | + | 2 h3 O |
| сульфат калия |
Это вариант реакции нейтрализации.
Например:
| h3 SO4 | + | CuO | = | CuSO4 | + | h3 O |
| сульфат меди |
Это также вариант реакции нейтрализации:
| Ca(OH)2 | + | CO2 | = | CaCO3 | + | h3 O |
| карбонаткальция |
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
Например:
| h3 S | + | CuCl2 | = | CuS ( осадок ) | + | 2 HCl |
| сульфид меди |
Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью.
Например:
| 3 NaOH | + | FeCl3 | = | Fe(OH)3 | + | 3 NaCl |
| (осадок) | хлорид натрия |
Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
Например:
| AgNO3 | + | KCl | = | AgCl (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор выпаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl - + K+ + Br -
Если такой раствор выпарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
В способах 1-7 имели дело с реакциями обмена (только способ 4 – реакция соединения). Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов, вытесняют из кислот водород и сами соединяются с ними, образуя соли:
| Fe | + | h3 SO4 ( разб .) | = | FeSO4 | + | h3 |
| сульфат железа II |
Эта реакция внешне напоминает горение. Металл «сгорает» в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый «дым»:
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 |
| порошок меди | сульфат цинка |
Соли представляют собой твердые кристаллические вещества. Соли имеют широкий диапазон температур плавления и термического разложения.
По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды, многие кислые соли.
Растворимость солей в воде при комнатной температуре
Кати- оны | Анионы | |||||||||
| F- | Cl- | Br- | I- | S2- | NO3- | CO32- | SiO32- | SO42- | PO43- | |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Nh5+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Р | Р | Р | - | - | Р | Г | Н | Р | РК |
| Co2+ | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | М | Р | Р | - | Н | Р | Г | Н | Р | Н |
| Zn2+ | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Условные обозначения:
Р — вещество хорошо растворимо в воде; М — малорастворимо; Н — практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах; РК — нерастворимо в воде и растворяется только в сильных неорганических кислотах; НК — нерастворимо ни в воде, ни в кислотах; Г — полностью гидролизуется при растворении и не существует в контакте с водой. Прочерк означает, что такое вещество вообще не существует.
В водных растворах соли полностью или частично диссоциируют на ионы. Соли слабых кислот и (или) слабых оснований подвергаются при этом гидролизу. Водные растворы солей содержат гидратированные ионы, ионные пары и более сложные химические формы, включающие продукты гидролиза и др. Ряд солей растворимы также в спиртах, ацетоне, амидах кислот и др. органических растворителях.
Из водных растворов соли могут кристаллизоваться в виде кристаллогидратов, из неводных — в виде кристаллосольватов, например СаВг2 • ЗС2Н5ОН.
Данные о различных процессах, протекающих в водносолевых системах, о растворимости солей при их совместном присутствии в зависимости от температуры, давления и концентрации, о составе твердых и жидких фаз могут быть получены при изучении диаграмм растворимости водно-солевых систем.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла .
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
| Hg2+ SO4 | + | Sn0 | = | Hg0 | + | Sn2+ SO4 |
| соль менее активного металла (окислитель) | более активный металл (восстановитель) |
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее, являются более активными.
б) Реакции за счет кислотного остатка .
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками.
Например:
| Na2 S–2 | + | Br20 | = | S0 | + | 2 NaBr–1 |
| соль сероводородной кислоты | сера |
| 2 KI–1 | + | h3 O2–1 | + | h3 SO4 | = | I20 | + | K2 SO4 | + | 2 h3 O–2 |
| соль иодоводородной кислоты | иод |
| 2 KMn+7 O4 | + | 16 HCl–1 | = | 5 Cl20 | + | 2 KCl | + | 2 Mn+2 Cl2 | + | 8 h3 O |
| соль марганцевой кислоты | хлорид марганца |
| 2 Pb(N+5 O3–2 )2 | = | 2 PbO | + | 4 N+4 O2 | + | O20 |
| соль азотной кислоты | при нагревании |
Такие реакции могут происходить, когда соли реагируют:
а) с кислотами;
б) с щелочами:
в) с другими солями.
При проведении обменных реакций берут растворы солей. Общим требованием для таких реакций является образование малорастворимого продукта, который удаляется из раствора в виде осадка. Например:
а) CuSO4 + h3 S = CuS (осадок) + h3 SO4
AgNO3 + HCl = AgCl (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3 (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2 ( осадок ) + K2 SO4
в) BaCl2 + K2 SO4 = BaSO4 ( осадок ) + 2 KCl
CaCl2 + Na2 CO3 = CaCO3 ( осадок ) + 2NaCl
Если хотя бы один продукт таких обменных реакций не уходит из сферы реакции в виде осадка (иногда – в виде газа), то при смешивании растворов образуется только смесь ионов, на которые при растворении распадаются исходная соль и реагент. Таким образом, обменная реакция произойти не может.
 СаО + СО2
СаО + СО2 Ca(HCO3 )2 ®CaCO3 ¯ + CO2 + h3 O
Вода — слабый электролит. В чистой воде концентрации ионов водорода и гидроксид-ионов равны. В растворах солей это равновесие нарушается, если соль образована слабым основанием или слабой кислотой.
Взаимодействие ионов растворимой соли с водой, приводящее к образованию слабого электролита и смещению ионного равновесия воды, называется гидролизом.
Гидролизу подвергаются лишь те соли, в составе которых есть ион слабого основания (гидролиз по катиону) или слабой кислоты (гидролиз по аниону), так как только при этом условии образуется слабый электролит, «несвязанные» ионы воды создают в растворах солей либо кислую, либо щелочную среду.
1.Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону. Это обратимый процесс. Краткое ионное уравнение (в общем виде) отражает взаимодействие одного аниона слабой кислоты с одной молекулой воды, приводящее к присоединению протона и образованию одной молекулы слабой одноосновной кислоты или одного гидроаниона слабой многоосновной кислоты. Реакция среды в растворе такой соли щелочная.
Na2 CO3 + h3 O «NaOH+ NaHCO3
2Nh5 SO4 +2 h3 O« 2Nh5 OH+ h3 SO4
Al2 S3 + h3 O «3h3 S+2 Al(OH)3
Ряд солей являются соединениями, необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов (соли натрия, калия, кальция, а также соли, содержащие элементы азот и фосфор). Ниже, на примерах отдельных солей, показаны области применения представителей данного класса неорганических соединений.
NaCl — хлорид натрия. О широте использования этой соли говорит тот факт, что мировая добыча этого вещества составляет 200 млн. т.
Эта соль находит широкое применение в пищевой промышленности, служит сырьем для получения хлора, соляной кислоты, гидроксида натрия, соды (Na 2 CO 3 ). Эта соль находит разнообразное применение в нефтяной промышленности, например, как добавка в буровые растворы для предупреждения образования каверн при бурении скважин, как регулятор сроков схватывания цементных тампонирующих составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
KCl — хлорид калия. Входит в состав буровых растворов, способствующих сохранению устойчивости стенок скважин в глинистых породах, является распространенным калийным удобрением.
Na 2 CO 3 — карбонат натрия, сода. Входит в состав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к использованию (например, в котлах), широко используется для очистки природного газа от сероводорода и для производства реагентов для буровых и тампонажных растворов.
Al 2 ( SO 4 )3 — сульфат алюминия. Компонент буровых растворов, коагулянт для очистки воды от взвешенных частиц, компонент вязкоупругих смесей для изоляции зон поглощения в нефтяных и газовых скважинах.
Na 2 B 4 O 7 — тетраборат натрия, бура. Является эффективным реагентом — замедлителем схватывания цементных растворов, ингибитором термоокислительной деструкции защитных реагентов на основе эфиров целлюлозы.
BaSO 4 — сульфат бария, барит, тяжелый шпат. Используется в качестве утяжелителя буровых и тампонажных растворов.
FeSO 4 - cульфат железа (II), железный купорос. Используется для приготовления феррохромлигносульфоната — реагента-стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе.
FeCl 3 — хлорид железа (III). В сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачки в сероводородсодержащие пласты с целью снижения их проницаемости, как добавка к цементам с целью повышения их сероводородостойкости, для очистки воды от взвешенных частиц.
CaCO 3 — карбонат кальция в виде мела, известняка. Является сырьем для производства негашеной известиCaO , используется в металлургии. Применяется в бурении в качестве утяжелителя и наполнителя буровых растворов.
CaSO 4 — сульфат кальция. В виде алебастра (2 CaSO 4* H 2 O ) широко используется в строительстве, входит в состав быстротвердеющих вяжущих средств для изоляции зон поглощений. При добавке к буровым растворам в виде ангидрита (CaSO 4 ) или гипса (CaSO 4* 2 H 2 O ) придает устойчивость разбуриваемым глинистым породам.
CaCl 2 — хлорид кальция. Используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород. Сильно снижает температуру замерзания растворов (антифриз). Применяется для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
NaSiO 3 — силикат натрия. Используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощений, ингибитор коррозии металлов, компонент некоторых буровых тампонажных и буферных растворов.
AgNO 3 — нитрат серебра. Используется для химического анализа, в том числе пластовых вод, фильтратов буровых растворов на содержание ионов хлора.
Na 2 SO 3 — сульфит натрия. Используется для химического удаления кислорода (деаэрация) из воды в целях борьбы с коррозией при закачке сточных вод.
Na 2 Cr 2 O 7 — бихромат натрия. Используется в нефтяной промышленности в качестве высокотемпературного понизителя вязкости буровых растворов, ингибитора коррозии алюминия, для приготовления ряда реагентов.
1. Гл. редактор И.Л. Кнунянц. Большой энциклопедический словарь Химия. Москва 1998
2. Гл. редактор И.Л. Кнунянц. Химическая энциклопедия. Москва1998
3. Н. Я. Логинов, А. Г. Воскресенский, И. С. Солодин. Аналитическая химия. Москва 1979
4. Р. А. Лидин. Справочник по общей и неорганической химии. Москва 1997
5. Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. Москва 1997
6. А. В. Суворов, А. А. Карцафа и др. Увлекательный мир химических превращений. Санкт-Петербург 1998
7. Н.Л. Глинка. Общая химия. Ленинград 1987
8. Э.Н. Рэмсден. Начала современной химии. Ленинград 1989
www.ronl.ru
Гидролиз солей Опыт показывает, что растворы солей могут иметь нейтральную, кислую или щелочную реакцию среды. Объяснение этому факту следует искать во взаимодействии солей с водой. Взаимодействие ионов соли с водой, приводящее к образованию слабого электролита, называется гидролизом соли. Любую соль можно рассматривать как продукт взаимодействия кислоты и основания. Сильные: 1. Щелочи 2. Кислоты: HCL, HBr, HJ, HNO3, h3SO4
Электролиты Слабые: 1. Нерастворимые основания и Nh5OH 2. Кислоты: HF, h3CO3, h3SO3, h3SiO3, h4PO4, h3S. Так, хлорид натрия NaCl образован сильным основанием NaOH и сильной кислотой HCl, хлорид аммония Nh5Cl - слабым основанием Nh5OH и сильной кислотой HCl, K2CO3 -сильным основанием KOH и слабой кислотой h3CO3, Al2S3 - слабым основанием Al(OH)3 и слабой кислотой h3S. Таким образом, существует четыре варианта гидролиза солей. 1). Соли образованные сильным основанием и сильной кислотой (например Na2SO4, KBr, BaCl2): Na2SO4 2Na+ = SO42- Na+ + HOH → SO42- + HOH→ Гидролиз не идет, среда остается нейтральной. 2). Соли, образованные сильным основанием и слабой кислотой (например, Na2CO3, Ca3(PO4)2, K2S): реакция раствора соли щелочная, в результате реакции гидролиза образуется слабый электролит - кислота. KSiO3 2K+ + SiO32- I. SiO32- + HOH HSiO3- + OH- - краткое ионное уравнение SiO32- + HOH + 2K+ HSiO3- + OH-+ 2K+ - полное ионное уравнение K2SiO3 + h3O KHSiO3 + KOH - молекулярное уравнение II. HSiO3- + HOH h3SiO3 + OH-HSiO3- + HOH + K+ h3SiO3 + OH- + K+ KHSiO3 + h3O h3SiO3 + KOH Гидролиз идет не до конца, среда щелочная. Гидролиз практически ограничивается первой ступенью, т. к. ионы HSiO3- диссоциируют гораздо труднее, чем молекулы h3SiO3 ; тем более, что образование молекул h3SiO3 в щелочной среде мало вероятно. 3). Соли, образованные слабым основанием и сильной кислотой (например, FeSO4, CuCl2, AlCl3): FeCl3 Fe3+ + 3Cl- I. Fe3+ + HOH FeOh3+ + H+ Fe3+ + HOH + 3Cl- FeOh3+ + H+ + 3Cl- FeCl3 + h3O FeOHCl2 + HCl II. FeOh3+ + HOH Fe(OH)2+ + H+ FeOh3+ + HOH + 2Cl- Fe(OH)2+ + H+ + 3Cl- FeOHCl2 + h3O Fe(OH)2Cl + HCl III. Fe(OH)2 + + HOH Fe(OH)3↓ + H+ Fe(OH)2 + + HOH + Cl- Fe(OH)3↓ + H+ + 3Cl- Fe(OH)2Cl + h3O Fe(OH)3↓ + HCl Гидролиз идет не до конца, среда кислая. В обычных условиях гидролиз практически ограничивается первой стадией, т. к. в кислой среде образование осадка Fe(OH)3↓ маловероятно. 4). Соли, образованные слабым основанием и слабой кислотой (например, Al2S3, Cr2S3 , Ch4 COONh5): а). Растворимые соли: Ch4COONh5 + h3O Ch4COOH + Nh5OH Ch4COO- + Nh5+h3O Ch4COOH + Nh5OH Реакция среды в этом случае зависит от сравнительной силы основания и кислоты. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию среды. Все зависит от констант диссоциации образующихся кислот и оснований. Если константа диссоциации основания < константы диссоциации кислоты, то среда кислая, если константа диссоциации основания > константы диссоциации кислоты, то среда щелочная В случае гидролиза Ch4COONh5: K дисс.(Nh5OH) = 6,3 • 10-5 > K дисс.(Ch4COOH) = 1,8 • 10-5 , значит реакция среды будет слабощелочной. б). Неустойчивые и разлагающиеся водой соли: Al2S3 + 6h3O 2Al(OH)3↓ + 3h3S↑ Продукты гидролиза уходят из сферы реакции, гидролиз необратимый: 2AlCl3 + 3NaCl + 6h3O = 2Al(OH)3↓ + 3h3S↑ + 6NaCl Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например 2Al + 3S == Al2S3 Качественные реакции на катионы
| Катион | Воздействие или реактив | Наблюдаемая реакция |
| Li | Пламя | Красное окрашивание |
| Na | Пламя | Желтое окрашивание |
| K | Пламя | Фиолетовое окрашивание |
| Ca | 1). Пламя 2). CO3 | 1). Кирпично-красное окрашивание 2). Ca + CO3 = CaCO3↓ |
| Ba | 1). Пламя 2). SO4 | 1).Желто-зеленое окрашивание 2). Белый (мелкокристаллический) осадок SO4 +Ba = BaSO4↓ |
| Cu | 1). Пламя 2). Вода 3). Щелочь | 1). Зеленое окрашивание 2). Гидратированные ионы Cu имеют голубую окраску 3). Синий осадок Cu + 2OH = Cu(OH)2↓ |
| Ag | Cl | Белый (творожистый) осадок Cl + Ag = AgCl↓ |
| Al | Щелочь OH (амфотерные свойства гидроксида) | Желеобразный осадок белого цвета, растворяющийся в избытке щелочи Al + 3OH = Al(OH)3↓ |
| Nh5 | Щелочь OH | Выделение газа с резким запахом Nh5 + OH = Nh4↑+ h3O |
| Fe | 1). Щелочь OH 2).Красная кровяная соль K3[Fe(CN)6] | 1). Зеленоватый осадок, буреет на воздухе Fe + 2OH = Fe(OH)2↓ 2). Синий осадок (турнбулева синь) 3Fe+2[Fe(CN)6]= Fe3[Fe(CN)6]2↓ |
| Fe | 1). Щелочь OH 2).Роданид аммония Nh5SCN 3).Желтая кровяная соль K4[Fe (CN)6] | 1). Бурый осадок Fe + 3OH = Fe(OH)3↓ 2). Кроваво-красный осадок Fe + 3SCN = Fe(SCN)3↓ 3). Темно-синий осадок "Берлинская лазурь" 4Fe+3[Fe(CN)6]= Fe4[Fe(CN)6]3↓ |
| Анион | Реактив | Результат реакции |
| SO4 | Соли бария Ba | Белый осадок SO4 +Ba = BaSO4↓ |
| NO3 | h3SO4 (конц.) и Cu | Выделение бурого газа Cu+NO3+2H=Cu+NO2↑+h3O |
| PO4 | Нитрат серебра Ag | Ярко-желтый осадок PO4 + 3Ag = AgPO4↓ |
| CrO4 | Соли бария Ba | Желтый осадок Ba + CrO4 = BaCrO4↓ |
| S | Соли свинца Pb | Черный осадок Pb + S = PbS↓ |
| CO3 | Растворы кислот H Ca(OH)2 | Выделение газа без запаха, вызывающее помутнение известковой воды CO3 + 2H = h3O + CO2↑ CO2+ Ca+OH= CaCO3↓+h3O |
| Cl | Нитрат серебра Ag | Белый (творожистый) осадок Cl + Ag = AgCl↓ |
| Br | Нитрат серебра Ag | Желтоватый осадок Br + Ag = AgBr↓ |
| I | Нитрат серебра Ag | Желтый осадок J + Ag = AgJ↓ |
www.coolreferat.com
Определение и классификация
СОЛИ - это электролиты, при диссоциации которых образуются катионы (положительно заряженные ионы) металлов и анионы, отрицательно заряженные ионы кислотных остатков:
Na2SO4 2Na+ = SO42-
Nh5Cl Nh5+ + Cl-
Kh3PO4 K+ + h3PO4-
Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток.
Диссоциация - полный или частичный распад молекул растворенного вещества на ионы в результате взаимодействия с растворителем.
Катионы - положительно заряженные ионы.
Анионы - отрицательно заряженные ионы.
Любую соль можно рассматривать как продукт взаимодействия основания и кислоты, т.е. реакции нейтрализации.
Продуктами полного замещения атомов воды на атомы металлов являются средние соли, например. Na2SO4.Диссоциацию средней соли можно записать так: Na2SO4 2Na+ = SO42-
Если кислота или кислотный оксид взяты в избытке, то при упаривании будут выпадать кристаллы кислой соли: KOH + h4SO4 = KHSO4 + h4O Диссоциацию кислой соли можно записать так: Kh4PO4 K+ + h4PO4- Анион кислой соли подвергается вторичной диссоциации, как слабый электролит: HSO4- H+ + SO42-. Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Основные соли можно представить как продукт неполного замещения гидроксогрупп основания на кислотные остатки: Mg(OH)2 + HCl = MgOHCl + h4O Диссоциацию основной соли можно выразить уравнением: MgOHCl MgOH+ + Cl- Катион основной соли в незначительной степени подвергается дальнейшей диссоциации: MgOH+ Mg2+ + OH- Основные соли образуются многокислотными основаниями. Однокислотные основания основных солей не образуют. Существуют также двойные и комплексные соли.
Получение
Соли образуются в результате реакций:
1). Основания с кислотой (реакция нейтрализации):
3KOH + h4PO4 =K3PO4 +3h4O
2KOH + h4PO4 =K2HPO4 +2h4O
KOH + h4PO4 =Kh4PO4 +h4O
Mg(OH)2 + 2HCl = MgCl2 + 2h4O
Mg(OH)2 + HCl = MgOHCl + h4O
2). Кислоты с основным или амфотерным оксидами:
CuO + h4SO4= CuSO4 + h4O
3). Кислоты с солью:
MgCO3 + 2HCl = MgCl2 + h4O + CO2↑
4). Растворов двух солей
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
5). Щелочи с кислотным оксидом
6KOH + P2O5 = 2K3PO4 +3h4O
4KOH + P2O5 = 2K2HPO4 + h4O
h4O + 2KOH + P2O5 = 2Kh4PO4
6). Щелочи с солью:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
7). Основного оксида с кислотным оксидом:
MgO + SO3 = MgSO4
CaO + SiO2 = CaSiO3
8). Металла с неметаллом:
2Na + Cl2 = 2NaCl
9). Металла с кислотой:
Zn + 2HCl = ZnCl2 + h4
10). Металла с солью менее активного металла:
Fe + CuSO4 = FeSO4 + Cu
Существуют и другие способы получения солей.
Химические свойства солей
1). Более активный металл вытесняет из соли менее активный (кроме металлов до магния):
Fe + CuSO4 = FeSO4 + Cu
2). Растворимые соли реагируют со щелочами, если выделяется осадок или газ:
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2h4O
3). Две растворимые соли реагируют между собой, если выделяется осадок:
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl
4). Более сильная и менее летучая кислота вытесняет из соли более слабую и более летучую, если выделяется осадок или газ:
AgNO3 + HCl = AgCl↓ + HNO3
Na2CO3 + h4SO4 = Na2SO4 + h4O + CO2↑
5). Многие соли устойчивы при нагревании. Однако соли аммония, некоторые соли малоактивных металлов и слабых кислот при нагревании разлагаются:
CaCO3 = CaO + CO2↑
Nh5Cl = Nh4↑ + HCl
Ca(HCO3)2 = CaCO3 + CO2↑+ h4O
(CuOH)2CO3 = 2CuO + CO2↑ + h4O
Гидролиз солей
Опыт показывает, что растворы солей могут иметь нейтральную, кислую или щелочную реакцию среды. Объяснение этому факту следует искать во взаимодействии солей с водой.
Взаимодействие ионов соли с водой, приводящее к образованию слабого электролита, называется гидролизом соли.
Любую соль можно рассматривать как продукт взаимодействия кислоты и основания.
С ильные: 1. Щелочи
ильные: 1. Щелочи
2. Кислоты: HCL, HBr, HJ, HNO3, h3SO4
Э лектролиты
лектролиты
Слабые: 1. Нерастворимые основания и Nh5OH
2. Кислоты: HF, h4CO3, h4SO3, h4SiO3, h4PO4, h4S.
Так, хлорид натрия NaCl образован сильным основанием NaOH и сильной кислотой HCl, хлорид аммония Nh5Cl - слабым основанием Nh5OH и сильной кислотой HCl, K2CO3 -сильным основанием KOH и слабой кислотой h4CO3, Al2S3 - слабым основанием Al(OH)3 и слабой кислотой h4S.
Таким образом, существует четыре варианта гидролиза солей.
1). Соли образованные сильным основанием и сильной кислотой (например Na2SO4, KBr, BaCl2):
Na2SO4 2Na+ = SO42-
Na+ + HOH →
SO42- + HOH→
Гидролиз не идет, среда остается нейтральной.
2). Соли, образованные сильным основанием и слабой кислотой (например, Na2CO3, Ca3(PO4)2, K2S): реакция раствора соли щелочная, в результате реакции гидролиза образуется слабый электролит - кислота.
KSiO3 2K+ + SiO32-
I. SiO32- + HOH HSiO3- + OH- - краткое ионное уравнение
SiO32- + HOH + 2K+ HSiO3- + OH-+ 2K+ - полное ионное уравнение
K2SiO3 + h4O KHSiO3 + KOH - молекулярное уравнение
II. HSiO3- + HOH h4SiO3 + OH-
HSiO3- + HOH + K+ h4SiO3 + OH- + K+
KHSiO3 + h4O h4SiO3 + KOH
Гидролиз идет не до конца, среда щелочная. Гидролиз практически ограничивается первой ступенью, т. к. ионы HSiO3- диссоциируют гораздо труднее, чем молекулы h4SiO3 ; тем более, что образование молекул h4SiO3 в щелочной среде мало вероятно.
3). Соли, образованные слабым основанием и сильной кислотой (например, FeSO4, CuCl2, AlCl3):
FeCl3 Fe3+ + 3Cl-
I. Fe3+ + HOH FeOh4+ + H+
Fe3+ + HOH + 3Cl- FeOh4+ + H+ + 3Cl-
FeCl3 + h4O FeOHCl2 + HCl
II. FeOh4+ + HOH Fe(OH)2+ + H+
FeOh4+ + HOH + 2Cl- Fe(OH)2+ + H+ + 3Cl-
FeOHCl2 + h4O Fe(OH)2Cl + HCl
III. Fe(OH)2 + + HOH Fe(OH)3↓ + H+
Fe(OH)2 + + HOH + Cl- Fe(OH)3↓ + H+ + 3Cl-
Fe(OH)2Cl + h4O Fe(OH)3↓ + HCl
Гидролиз идет не до конца, среда кислая. В обычных условиях гидролиз практически ограничивается первой стадией, т. к. в кислой среде образование осадка Fe(OH)3↓ маловероятно.
4). Соли, образованные слабым основанием и слабой кислотой (например, Al2S3, Cr2S3 , Ch4 COONh5):
а). Растворимые соли:
Ch4COONh5 + h4O Ch4COOH + Nh5OH
Ch4COO- + Nh5+h4O Ch4COOH + Nh5OH
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию среды. Все зависит от констант диссоциации образующихся кислот и оснований. Если константа диссоциации основания < константы диссоциации кислоты, то среда кислая, если константа диссоциации основания > константы диссоциации кислоты, то среда щелочная
В случае гидролиза Ch4COONh5:
K дисс.(Nh5OH) = 6,3 • 10-5 > K дисс.(Ch4COOH) = 1,8 • 10-5 , значит реакция среды будет слабощелочной.
б). Неустойчивые и разлагающиеся водой соли:
Al2S3 + 6h4O 2Al(OH)3↓ + 3h4S↑
Продукты гидролиза уходят из сферы реакции, гидролиз необратимый:
2AlCl3 + 3NaCl + 6h4O = 2Al(OH)3↓ + 3h4S↑ + 6NaCl
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например 2Al + 3S == Al2S3
Качественные реакции на катионы
| Катион | Воздействие или реактив | Наблюдаемая реакция |
| Li | Пламя | Красное окрашивание |
| Na | Пламя | Желтое окрашивание |
| K | Пламя | Фиолетовое окрашивание |
| Ca | 1). Пламя 2). CO3 | 1). Кирпично-красное окрашивание 2). Ca + CO3 = CaCO3↓ |
| Ba | 1). Пламя 2). SO4 | 1).Желто-зеленое окрашивание 2). Белый (мелкокристаллический) осадок SO4 +Ba = BaSO4↓ |
| Cu | 1). Пламя 2). Вода 3). Щелочь | 1). Зеленое окрашивание 2). Гидратированные ионы Cu имеют голубую окраску 3). Синий осадок Cu + 2OH = Cu(OH)2↓ |
| Ag | Cl | Белый (творожистый) осадок Cl + Ag = AgCl↓ |
| Al | Щелочь OH (амфотерные свойства гидроксида) | Желеобразный осадок белого цвета, растворяющийся в избытке щелочи Al + 3OH = Al(OH)3↓ |
| Nh5 | Щелочь OH | Выделение газа с резким запахом Nh5 + OH = Nh4↑+ h4O |
| Fe | 1). Щелочь OH 2).Красная кровяная соль K3[Fe(CN)6] | 1). Зеленоватый осадок, буреет на воздухе Fe + 2OH = Fe(OH)2↓ 2). Синий осадок (турнбулева синь) 3Fe+2[Fe(CN)6]= Fe3[Fe(CN)6]2↓ |
| Fe | 1). Щелочь OH 2).Роданид аммония Nh5SCN 3).Желтая кровяная соль K4[Fe (CN)6] | 1). Бурый осадок Fe + 3OH = Fe(OH)3↓ 2). Кроваво-красный осадок Fe + 3SCN = Fe(SCN)3↓ 3). Темно-синий осадок "Берлинская лазурь" 4Fe+3[Fe(CN)6]= Fe4[Fe(CN)6]3↓ |
Качественные реакции на анионы
| Анион | Реактив | Результат реакции |
| SO4 | Соли бария Ba | Белый осадок SO4 +Ba = BaSO4↓ |
| NO3 | h4SO4 (конц.) и Cu | Выделение бурого газа Cu+NO3+2H=Cu+NO2↑+h4O |
| PO4 | Нитрат серебра Ag | Ярко-желтый осадок PO4 + 3Ag = AgPO4↓ |
| CrO4 | Соли бария Ba | Желтый осадок Ba + CrO4 = BaCrO4↓ |
| S | Соли свинца Pb | Черный осадок Pb + S = PbS↓ |
| CO3 | Растворы кислот H Ca(OH)2 | Выделение газа без запаха, вызывающее помутнение известковой воды CO3 + 2H = h4O + CO2↑ CO2+ Ca+OH= CaCO3↓+h4O |
| Cl | Нитрат серебра Ag | Белый (творожистый) осадок Cl + Ag = AgCl↓ |
| Br | Нитрат серебра Ag | Желтоватый осадок Br + Ag = AgBr↓ |
| I | Нитрат серебра Ag | Желтый осадок J + Ag = AgJ↓ |
Список использованной литературы
Ковалевская Н.Б. Химия . 8 класс (в таблицах). М., 1997.
Ковалевская Н.Б. Химия . 9 класс (в таблицах). М., 1996.
Гузей Л.С., Сорокин В.В. Основные классы неорганических соединений. М., 1992.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. М.,2000.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии, I том. М., 1997
Хомченко Г.П., Химия для поступающх в вузы. М., 1985.
Большая Энциклопедия Кирилла и Мефодия. М., 2000.
topref.ru