МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНЖЕНЕРНОЙ ЭКОЛОГИИ
Реферат на тему:
Циркон
Студент: Карлов В.В.
Группа И-31
Преподаватель: Буланов С.А.
МОСКВА, 2005
Введение 2
1. Происхождение циркона. 3
2. Химический состав, кристаллическая решётка. 3
3. Форма нахождения циркона в природе. 4
4. Свойства циркона: 5
4.1. Цвет.
4.2. Цвет в порошке (цвет черты).
4.3. Блеск.
4.4. Прозрачность.
4.5. Твердость
4.6. Плотность.
4.7. Спайность.
4.8. Излом.
4.9. Характерные свойства.
5. Характерная горная порода. 6
6. Распространение циркона. 7
7. Применение циркона. 8
8. История открытия циркона. 9
9. Мифы и легенды о цирконе. 9
10. Разновидности циркона. 10
11. Искусственные аналоги циркона. 10
12. Подделки циркона. 10
13. Имитации циркона. 11
14. Искусственное изменение свойств циркона. 11
15. Способы добычи и первичной переработки. 12
16. Экологические последствия добычи циркона. 12
Заключение. 13
Список литературы. 14
Приложения. 15
Введение.
Минерал – это однородное природное тело, обладающее определенными физическими свойствами и относительно постоянным химическим составом, образовавшееся в результате геологических процессов.
В настоящее время известно более 3 тысяч минералов, однако большинство из них встречается крайне редко. Широкое распространение имеет всего несколько сотен минералов.
Силикаты и алюмосиликаты- это важнейший класс минералов, представители которой вместе с кварцем составляют 95% от массы земной коры. Одна третья часть известных минералов относится к классу силикатов и алюмосиликатов. Все магматические и многие метаморфические горные породы в основном сложены минералами этой группы. Ранее силикаты рассматривались как соли гипотетических кремниевых кислот; впоследствие выяснилось, что силикаты не могут классифицироваться на основании состава анионной части, поскольку имеют не молекулярную, а ионную структуру. Одним из немногочисленных представителей этого класса минералов и является ЦИРКОН.
Происхождение минерала.
Часть магмы, затвердевающая в последнюю очередь и обогащенная парами и газами, образует пегматиты. Структура пегматитов чрезвычайно неравномерна, нередко в них присутствуют гигантские кристаллы массой в несколько тонн и длиной в десятки метров. Пегматиты с драгоценными камнями приурочены к кислым изверженным породам, богатым кремнеземом. В природных условиях, при охлаждении расплавленной силикатной магмы, происходит выделение циркона из более кислого расплава[14,с.13].Минерал претерпевает изменения на всех стадиях формирования кристаллической решетки. После «полного» формирования, могут происходить и обратимые изменения ( изменение цвета под действием температуры: некоторые примеси удаляются или замещаются), либо необратимые (образование прозрачного циркона, при высоких температурах). Также изменения происходят при метамиктном распаде, под воздействием излучения испускаемого радиоактивными элементами, часто замещающими цирконий в составе минерала [10].
2. Химический состав, кристаллическая решётка.
Циркон – силикат циркония с формулой Zr[Si04].
Химический состав: ZrО2-67,12%; SiО2-32,88% (по массе).
В состав минерала часто входят примеси, такие как: гафний, иттрий, церий, фосфор, ниобий, тантал, торий, уран [1,2,13], а также железо, медь, цинк, кальций, титан [2,4,13], в чистом виде или в виде различных окислов [11]. Кристалл находится в тетрагональной сингонии, дитетрагонально-бипирамидальном классе симметрии [6,10]. Очень часто встречается в прекрасно образованных кристаллах двух типов: призматический и пирамидальный[11].
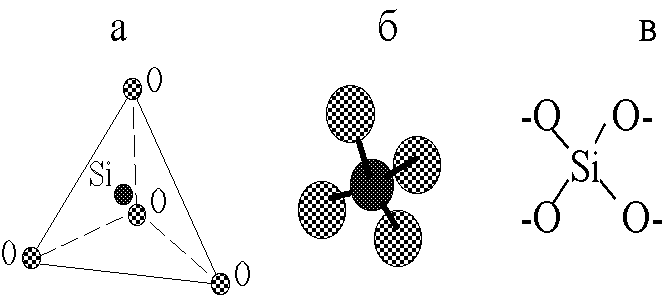
Минерал отнесён к подгруппе островных силикатов, так как тетраэдры (рис.1) состава SiО44- не связаны друг с другом [12].

Рис. 1. Кремнекислородный тетраэдр.
В некоторых кристаллах ионы циркония, кремния и кислорода имеют упорядоченное и правильное расположение, характерное для кристаллической структуры (рис.2).
Рис. 2. Типичная форма кристалла
(габитус- короткостолбчатый[17,с.51]).
Структура такова, что каждый ион циркония окружен восемью ближайшими ионами кислорода, но такое расположение ионов не отличается высокой стабильностью, и во многих кристаллах упорядоченное расположение ионов частично или полностью нарушено. Подобное изменение, совершающееся без изменения химического состава, носит название метамиктного распада. Нарушение первичной кристаллической структуры обусловлено альфа - частицами, испускаемыми радиоактивными элементами, присутствующими в кристалле[1,13].
studfiles.net
Реферат по химии
«Цирконий»
студент группы 1-ПГ
Ямалтдинов Д.С.
Цирко́ний (лат. Zirconium; обозначается символом Zr) — элемент побочной подгруппы четвёртой группы пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 40. Простое вещество цирконий (CAS-номер: 7440-67-7) — блестящий металл серебристо-серого цвета. Обладает высокой пластичностью, устойчив к коррозии. Существует в двух кристаллических модификациях: α-Zr с гексагональной решёткой типа магния, β-Zr с кубической объёмноцентрированной решёткой типа α-Fe, температура перехода α↔β 863 °C
История и происхождение названия
Цирко́ний в виде двуокиси впервые был выделен в 1789 году немецким химиком М. Г. Клапротом в результате анализа минерала циркона.
Происхождение самого слова циркон неясно. Возможно, оно происходит от арабского zarkûn (киноварь) или от персидского zargun (золотистый цвет).
Как получали и получают цирконий
Выделенное Клапротом вещество не было новым элементом, но было окислом нового элемента, который впоследствии занял в таблице Д.И. Менделеева сороковую клетку. Пользуясь современными символами, формулу вещества, полученного Клапротом, записывают так: ZrO2.
Через 35 лет после опытов Клапрота известнейшему шведскому химику Йенсу Якобу Берцелиусу удалось получить металлический цирконий. Берцелиус восстановил фторцирконат калия металлическим натрием:
К2[ZrF6] + 4Na → Zr + 2KF + 2NaF
и получил серебристо-серый металл.
Цирконий, образовавшийся в результате этой реакции, был хрупким из-за значительного содержания примесей. Металл не поддавался обработке и не смог найти практического применения. Но можно было предположить, что очищенный цирконий, подобно многим другим металлам, окажется достаточно пластичным.
В XIX и начале XX в. многие ученые пытались получить чистый цирконий, но все попытки долгое время заканчивались неудачей. Не помог испытанный алюмотермический метод, не привели к цели опыты, авторы которых стремились получить металлический цирконий из растворов его солей. Последнее объясняется в первую очередь высоким химическим сродством циркония к кислороду.
Для того чтобы можно было получить какой-либо металл электролизом из раствора его соли, этот металл должен образовывать одноатомные ионы. А цирконий таких ионов не образует. Сульфат циркония Zr(SO4)2, например, существует только в концентрированной серной кислоте, а при разбавлении начинаются реакции гидролиза и комплексообразования. В конечном счете получается:
Zr(SO4)2 + Н2О → (ZrO)SO4 + h3SO4.
В водном растворе гидролизуется и хлористый цирконий:
ZrCl4 + Н2О → ZrOCl2 + 2HCl.
Некоторые исследователи считали, что им удалось-таки получить цирконий электролизом растворов, но они были введены в заблуждение видом продуктов, осевших на электродах. В одних случаях это были действительно металлы, но не цирконий, а никель или медь, примеси которых содержались в циркониевом сырье; в других – внешне похожая на металл гидроокись циркония.
Лишь в 20-х годах нашего столетия (через 100 лет после того, как Берцелиус получил первые образцы циркония!) был разработан первый промышленный способ получения этого металла.
Это метод «наращивания», разработанный голландскими учеными ван Аркелем и де Буром. Суть его заключается в том, что летучее соединение (в данном случае тетрайодид циркония ZrI4) подвергается термическому распаду в вакууме и на раскаленной нити вольфрама откладывается чистый металл.
Этим способом был получен металлический цирконий, поддающийся обработке – ковке, вальцовке, прокатке – примерно так же легко, как медь.
Позже металлурги обнаружили, что пластические свойства циркония зависят главным образом от содержания в нем кислорода. Если в расплавленный цирконий проникнет свыше 0,7% кислорода, то металл будет хрупким из-за образования твердых растворов кислорода в цирконии, свойства которых сильно отличаются от свойств чистого металла.
Метод наращивания получил сначала некоторое распространение, но высокая стоимость циркония, полученного этим методом, сильно ограничивала области его применения. А свойства циркония оказались интересными. (О них ниже.) Назрела необходимость в разработке нового, более дешевого способа получения циркония. Таким методом стал усовершенствованный метод Кролля.
Метод Кролля позволяет получать цирконий при вдвое меньших затратах, чем по методу наращивания. Схема этого производства предусматривает две основные стадии: двуокись циркония хлорируется, а полученный четыреххлористый цирконий восстанавливается металлическим магнием под слоем расплавленного металла. Конечный продукт – циркониевая губка переплавляется в прутки и в таком виде направляется потребителю.
Месторождения
Наиболее крупные месторождения циркония расположены на территории США, Австралии, Бразилии, Индии. [4]
В России, на долю которой приходится 10% мировых запасов циркония (3 место в мире после Австралии и ЮАР), основными месторождениями являются: Ковдорское коренное бадделит-апатит-магнетитовое в Мурманской области, Туганское россыпное циркон-рутил-ильменитовое в Томской области, Центральное россыпное циркон-рутил-ильменитовое в Тамбовской области, Лукояновское россыпное циркон-рутил-ильменитовое в Нижегородской области, Катугинское коренное циркон-пирохлор-криолитовое в Читинской области и Улуг-Танзекское коренное циркон-пирохлор-колумбитовое
Стоимость
Стоимость циркония в конце 1990-х — 20-26$ за килограмм.[источник не указан 394 дня].
Применение циркония и его соединений
В промышленности цирконий стал применяться с 30-х годов XX века. Из-за высокой стоимости его применение ограничено. Единственным предприятием, специализирующемся на производстве циркония в России (и на территории бывшего СССР), является Чепецкий механический завод (Глазов, Удмуртия).
Медицина
Цирконий обладает высокой стойкостью к воздействию биологических сред, даже более высокой, чем титан, и отличной биосовместимостью, благодаря чему применяется для создания костных, суставных и зубных протезов, а также хирургического инструмента.
Быт
Цирконий применяется для изготовления разнообразной посуды, обладающей отличными гигиеническими свойствами благодаря высокой химической стойкости.
Соединения
Диоксид циркония (т. пл. 2700 °C). Область применения — производство огнеупоров-бакоров (бакор — бадделеит-корундовая керамика). Применяется в качестве заменителя шамота, так как в 3—4 раза увеличивает кампанию в печах для варки стекла и алюминия. Огнеупоры на основе стабилизированной двуокиси применяются в металлургической промышленности для желобов, стаканов при непрерывной разливке сталей, тиглей для плавки редкоземельных элементов. Также применяется в керметах — керамикометаллических покрытиях, которые обладают высокой твёрдостью и устойчивостью ко многим химическим реагентам, выдерживают кратковременные нагревания до 2750 °C. Двуокись — глушитель эмалей, придает им белый и непрозрачный цвет. На основе кубической модификации двуокиси циркония, стабилизированной скандием, иттрием, редкими землями, получают материал — фианит (от ФИАНа где он был впервые получен), фианит применяется в качестве оптического материала с большим коэффициентом преломления (линзы плоские), в медицине (хирургический инструмент), в качестве синтетического ювелирного камня (дисперсия, показатель преломления и игра цвета больше, чем у бриллианта), при получении синтетических волокон, и производстве некоторых видов проволоки (волочение). При нагревании диоксид циркония проводит ток, что иногда используется для получения нагревательных элементов устойчивых на воздухе при очень высокой температуре. Нагретый цирконий способен проводить ионы кислорода как твердый электролит. Это свойство используется в промышленных анализаторах кислорода.
Диборид циркония ZrB2 — кермет. В различных смесях с нитридом тантала и карбидом кремния является материалом для производства резцов.
Карбид циркония (температура плавления 3530 °C) — теоретически важнейший конструкционный материал для твердофазных ядерных реактивных двигателей[источник не указан 582 дня]. Бериллид циркония чрезвычайно твёрд и устойчив к окислению на воздухе до 1650 °C, применяется в авиакосмической технике в качестве двигателей, сопел, реакторов и радиоизотопных электрогенераторов[источник не указан 582 дня].
Гидрид циркония применяется в качестве компонента ракетного топлива[источник не указан 582 дня], в атомной технике как весьма эффективный замедлитель нейтронов. Также гидрид циркония служит для покрытия цирконием в виде тонких плёнок с помощью термического разложения его на различных поверхностях.
Нитрид циркония материал для керамических покрытий, температура плавления около 2990 °C , гидролизуется в царской водке. Нашёл применение в качестве покрытий в стоматологии и ювелирном деле.
Биологическая роль и физиологическое действие
Цирконий не играет биологической роли в организме. Жителям России памятны пресловутые циркониевые браслеты, рекламируемые В.Кикабидзе, якобы снижающие артериальное давление, но не оказывающие реального терапевтического действия[7].
О воздействии соединений циркония на организм ничего не известно. Пыль циркония представляет собой вещество с большой пожаро- и взрывоопасностью, поскольку может самовоспламениться на воздухе.
yaneuch.ru
СОДЕРЖАНИЕ
Введение
2 Электронное строение атома
3 Получение циркония
4 Проблема циркония «реакторной чистоты»
В 1789 г. член Берлинской академии наук Мартин Генрих Клапрот опубликовал результаты анализа драгоценного камня, привезенного с берегов Цейлона. В ходе этого анализа было выделено вещество, которое Клапрот назвал цирконовой землей. Происхождение этого названия объясняют по разному. Одни находят его истоки в арабском слове «заркун», что значит минерал, другие считают, что слово «цирконий» произошло от двух персидских слов «цар» – золото и «гун» – цвет (из-за золотистой окраски драгоценной разновидности циркона – гиацинта). Выделенное Клапротом вещество не было новым элементом, но было окислом нового элемента, который впоследствии занял в таблице Д.И. Менделеева сороковую клетку. Пользуясь современными символами, формулу вещества, полученного Клапротом, записывают так: ZrO2. Чистый цирконий удалось получить лишь спустя 35 лет.
1 Физические свойства циркония
Физические и химические свойства циркония. Компактный металлический цирконий внешне очень похож на сталь. Он ничем не проявляет своей химической активности и в обычных условиях по отношению к атмосферным газам ведет себя исключительно инертно. Кажущаяся химическая пассивность циркония объясняется довольно традиционно: на его поверхности всегда есть невидимая окисная пленка, предохраняющая металл от дальнейшего окисления. Чтобы полностью окислить цирконий, надо повысить температуру до 700°C. Только тогда окисная пленка частично разрушится, а частично растворится в металле.
Итак, 700°C — тот температурный предел, за которым кончается химическая стойкость циркония. К сожалению, и эта цифра слишком оптимистична. Уже при 300°C цирконий начинает более активно взаимодействовать с кислородом и другими компонентами атмосферы: водяными парами (образуя двуокись и гидрид), с углекислым газом (образуя карбид и двуокись), с азотом (продукт реакции — нитрид циркония). Но при температурах ниже 300°C окисная пленка — надежный щит, гарантирующий высокую химическую стойкость циркония.
Иначе, чем компактный металлический цирконий, ведут себя на воздухе его порошок и стружка. Это пирофорные вещества, которые легко самовозгораются на воздухе даже при комнатной температуре. При этом выделяется много тепла. Циркониевая пыль в смеси с воздухом способна даже взрываться.
Интересно отношение циркония к воде. Явные признаки взаимодействия металла с водой долгое время не видны. Но на поверхности смоченного водой циркония происходит не совсем обычный для металлов процесс. Как известно, многие металлы под действием воды подвергаются гальванической коррозии, которая заключается в переходе их катионов в воду. Цирконий же и под действием воды окисляется и покрывается защитной пленкой, которая в воде не растворяется и предотвращает дальнейшее окисление металла.
Перевести ионы циркония в воду проще всего растворением некоторых его солей. Химическое поведение четырехвалентного иона циркония в водных растворах очень сложно. Оно зависит от множества химических факторов и процессов, протекающих в водных растворах.
2 Электронное строение атома
Электронная формула циркония имеет вид:
+40 Zr 1s22s22p63s23p63d104s24 p64 d25s2
Порядковый номер циркония Zr: Z=40, следовательно, количество протонов равно: p=40.
Количество электронов в атоме равно количеству протонов: p = е- = 40.
Количество нейтронов равно разности атомной массы и порядкового номера элемента: n = Ar- Z = 91-40= 51.
Цирконий расположен:
- в 5 периоде (имеет пять энергетических слоев),
- VI ряду,
- IV группе,
- группе Б (у него происходит заполнение 4d-подслоя двумя электронами).
При переходе от атома циркония к атому ниобия наблюдается электронный проскок - количество электронов на d-подслое увеличивается не на один, а на два за счет проскока одного из электронов с 5s- на 4d - подслой, что связано с более устойчивой конфигурацией энергетического слоя.
В атоме циркония последним заполняется 4d-подслой, в связи с этим, валентными у него будут являться электроны 4d- и 5s-подслоя. Также этим явлением объясняется его принадлежность к d-элементам. Строение внешних электронных оболочек циркония имеет вид: 4d25s2
Так как электрон имеет четыре степени свободы, то для характеристики его поведения в атоме требуется четыре квантовых числа.
Главное квантовое число n определяет удаленность атомной орбитали от ядра и характеризует общий запас энергии электрона на данном энергетическом уровне. n принимает целочисленные значения от единицы до бесконечности. В зависимости от цифровых значений главного квантового числа приняты буквенные обозначения квантовых уровней n=1, 2, 3, 4, обозначение К, L, M, N,
Чем больше n, тем слабее электрон связан с ядром и более емким становится квантовый уровень. Числовые значения n определяют также и количество подуровней, содержащееся на данном квантовом уровне (то есть числовые значения n определяют емкость квантового уровня). Так, если n=3, то это значит, что имеем третий квантовый уровень, который состоит из трех подуровней.
Орбитальное квантовое число l характеризует момент количества движения электрона относительно центра орбитали. Наличие такого движения приводит к делению квантового уровня на подуровни. Орбитальное квантовое число характеризует так же пространственную форму электронного облака.
3 Получение циркония
Через 35 лет после опытов первооткрывателя металла Клапрота, известнейшему шведскому химику Йенсу Якобу Берцелиусу удалось получить металлический цирконий. Берцелиус восстановил фторцирконат калия металлическим натрием:
К2[ZrF6] + 4Na → Zr + 2KF + 2NaF
и получил серебристо-серый металл.
Цирконий, образовавшийся в результате этой реакции, был хрупким из-за значительного содержания примесей. Металл не поддавался обработке и не смог найти практического применения. Но можно было предположить, что очищенный цирконий, подобно многим другим металлам, окажется достаточно пластичным.
В XIX и начале XX в. многие ученые пытались получить чистый цирконий, но все попытки долгое время заканчивались неудачей. Не помог испытанный алюмотермический метод, не привели к цели опыты, авторы которых стремились получить металлический цирконий из растворов его солей. Последнее объясняется в первую очередь высоким химическим сродством циркония к кислороду.
Для того чтобы можно было получить какой-либо металл электролизом из раствора его соли, этот металл должен образовывать одноатомные ионы. А цирконий таких ионов не образует. Сульфат циркония Zr(SO4)2, например, существует только в концентрированной серной кислоте, а при разбавлении начинаются реакции гидролиза и комплексообразования. В конечном счете получается:
Zr(SO4)2 + Н2О → (ZrO)SO4 + h3SO4.
В водном растворе гидролизуется и хлористый цирконий:
ZrCl4 + Н2О → ZrOCl2 + 2HCl.
Некоторые исследователи считали, что им удалось-таки получить цирконий электролизом растворов, но они были введены в заблуждение видом продуктов, осевших на электродах. В одних случаях это были действительно металлы, но не цирконий, а никель или медь, примеси которых содержались в циркониевом сырье; в других — внешне похожая на металл гидроокись циркония.
Лишь в 20-х годах нашего столетия (через 100 лет после того, как Берцелиус получил первые образцы циркония!) был разработан первый промышленный способ получения этого металла.
Это метод «наращивания», разработанный голландскими учеными ван Аркелем и де Буром. Суть его заключается в том, что летучее соединение (в данном случае тетрайодид циркония ZrI4) подвергается термическому распаду в вакууме и на раскаленной нити вольфрама откладывается чистый металл. Этим способом был получен металлический цирконий, поддающийся обработке — ковке, вальцовке, прокатке — примерно так же легко, как медь.
Позже металлурги обнаружили, что пластические свойства циркония зависят главным образом от содержания в нем кислорода. Если в расплавленный цирконий проникнет свыше 0,7% кислорода, то металл будет хрупким из-за образования твердых растворов кислорода в цирконии, свойства которых сильно отличаются от свойств чистого металла.
Метод наращивания получил сначала некоторое распространение, но высокая стоимость циркония, полученного этим методом, сильно ограничивала области его применения. А свойства циркония оказались интересными. (О них ниже.) Назрела необходимость в разработке нового, более дешевого способа получения циркония. Таким методом стал усовершенствованный метод Кролля.
Метод Кролля позволяет получать цирконий при вдвое меньших затратах, чем по методу наращивания. Схема этого производства предусматривает две основные стадии: двуокись циркония хлорируется, а полученный четыреххлористый цирконий восстанавливается металлическим магнием под слоем расплавленного металла. Конечный продукт — циркониевая губка переплавляется в прутки и в таком виде направляется потребителю.
4 Проблема циркония «реакторной чистоты»
Огромные количества циркония потребовались ядерной энергетике.
В ядерную технику цирконий пришел не сразу. Для того чтобы стать полезным в этой отрасли, металл должен обладать определенным комплексом свойств. (Особенно, если он претендует на роль конструкционного материала при строительстве реакторов.) Главное из этих свойств – малое сечение захвата тепловых нейтронов. В принципе эту характеристику можно определить как способность материала задерживать, поглощать нейтроны и тем самым препятствовать распространению цепной реакции.
Величина сечения захвата нейтронов измеряется в барнах. Чем больше эта величина, тем больше нейтронов поглощает материал и тем сильнее препятствует развитию цепной реакции. Естественно, что для реакционной зоны реакторов выбираются материалы с минимальным сечением захвата.
У чистого металлического циркония эта величина равна 0,18 барна. Многие более дешевые металлы имеют сечениа захвата такого же порядка: у олова, например, оно равно 0,65 барна, у алюминия – 0,22 барна, а у магния – всего 0,06 барна. Но и олово, и магний, и алюминий легкоплавки и нежаропрочны; цирконий же плавится лишь при 1860°C.
Казалось, единственное ограничение – довольно высокая цена элемента №40 (хотя для этой отрасли денег жалеть не приходится), но возникло другое осложнение.
В земной коре цирконию всегда сопутствует гафний. В циркониевых рудах, например, его содержание обычно составляет от 0,5 до 2,0%. Химический аналог циркония (в менделеевской таблице гафний стоит непосредственно под цирконием) захватывает тепловые нейтроны в 500 раз интенсивнее циркония. Даже незначительные примеси гафния сильно сказываются на ходе реакции. Например, 1,5%-ная примесь гафния в 20 раз повышает сечение захвата циркония.
Перед техникой встала проблема – полностью разделить цирконий и гафний. Если индивидуальные свойства обоих металлов весьма привлекательны, то их совместное присутствие делает материал абсолютно непригодным для атомной техники.
Проблема разделения гафния и циркония оказалась очень сложной – химические свойства их почти одинаковы из-за чрезвычайного сходства в строении атомов. Для их разделения применяют сложную многоступенчатую очистку: ионный обмен, многократное осаждение, экстракцию.
Все эти операции значительно удорожают цирконий, а он и без того дорог: пластичный металл (99,7% Zr) во много раз дороже концентрата. Проблема экономичного разделения циркония и гафния еще ждет своего решения.
Об этом, в частности, свидетельствуют такие факты. На первой американской атомной подводной лодке «Наутилус» был установлен реактор из циркония. Позже выяснилось, что выгоднее делать из циркония оболочки топливных элементов, а не стационарные детали активной зоны реактора.
Тем не менее производство этого металла увеличивается из года в год, и темпы этого роста необыкновенно высоки. Достаточно сказать, что за десятилетие, с 1949 по 1959 г., мировое производство циркония выросло в 100 раз! По американским данным, в 1975 г. мировое производство циркония составило около 3000 т.
turboreferat.ru
КУРСОВАЯ РАБОТА
Металлургия циркония
Введение
Цирконий - тугоплавкий металл. Среднее содержание циркония в земной коре составляет 0,02 % (по массе). По распространенности он превосходит такие металлы, как медь, цинк, олово, никель и свинец.
Известно около 30 минералов циркония. Среди них два минерала - циркон ZrSiО4 и бадделеит ZrО2 - служат основными промышленными источниками циркония.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями. От кварца циркон отделяют на концентрационных столах. Ильменит и гранат выделяют магнитной сепарацией с применением слабых полей. Монацит отделяют магнитной сепарацией в сильных полях. Рутил и циркон разделяют электростатическими методами или флотацией. Выпускаемые концентраты должны содержать не менее 65 % ZrО2.
Цирконовые концентраты служат исходным сырьем для получения металлического циркония, а также для выплавки ферросплавов и производства химических соединений (сульфатоцирконаты, основной хлорид, основной карбонат). Кроме того, при переработке цирконовых концентратов получают гафний и его соединения.
Минерал циркон, составляющий основу цирконовых концентратов, практически не разлагается соляной, азотной и серной кислотами. Концентрированная серная кислота не реагирует с цирконом даже при 250 -300С. Растворы едкого натра при 285 - 300С (в автоклавах) реагируют с цирконом с образованием растворимых в кислотах цирконосиликатов. Способ, однако, не используют вследствие трудностей практической реализации. Все применяемые в промышленности способы разложения относятся к пирометаллургическим. Самые распространенные из них - это спекание с известью, спекание или сплавление с содой или щелочью, спекание и сплавление с фторсиликатом калия K2SiF6, хлорирование.
Следует отметить, что все пиропроцессы сочетаются с последующим гидрометаллургическим разложением полученных продуктов.
1. ОБЩИЕ СВЕДЕНИЯ
Элемент цирконий открыт - в 1789г. Клапротом, который получил диоксид циркония из минерала циркона. Чистый ковкий цирконий был получен лишь в 1925г. (спустя 136 лет после открытия элемента) термической диссоциацией иодида циркония по методу Ван-Аркеля и де Бура.
Применение циркония в виде их химических соединений и присадок в сплавах началось в первые десятилетия XX в. Промышленное производство ковких титана и циркония возникло в начале 50-х годов в связи с потребностями в новых конструкционных материалах для реактивной авиации, ракетной техники и атомной энергетики.
.1 ФИЗИКО - ХИМИЧЕСКИЕ СВОЙСТВА
1.1.1 Физические свойства циркония
Цирконий - элемент IV побочной группы периодической системы. По внешнему виду он напоминает сталь. Чистый металл ковкий и хорошо поддается механической обработке давлением.
Некоторые физико-механические свойства циркония приведены ниже:
Атомный номер……………….40
Атомная масса………………...91,22
Кристаллическая структура:
-модификация………………ГПУ (до 862 С),
а = 0,3223 нм,
с = 0,5123 нм,
-модификация……………….ОЦК,
а = 0,361 нм,
Плотность, г/см3 (-
модификация)…………………6,52
Температура, С:
Плавления……………………..185210
Кипения………………………..около 3600
Температурный коэффициент линейного расширения
• 106,С-1……………..8,9
Физические и особенно механические свойства циркония сильно зависят от чистоты металлов. Характерное свойство металла - способность растворять кислород, водород, азот и углерод. Примеси этих элементов делают цирконий хрупким.
1.1.2 Химические свойства
На воздухе металл устойчив. При нагревании до 400-600С он покрывается оксидной пленкой, затрудняющей дальнейшее окисление. При более высокой температуре одновременно с увеличением скорости окисления наблюдается растворение кислорода, что сильно понижает пластичность металла.
Активное поглощение водорода цирконием наблюдается при 300-400С с образованием твердых растворов и гидридов Zrh2,54 -163. В отличие от кислорода и азота водород можно удалить из циркония нагреванием в вакууме при 800-1000 С. Выше 800-900С металл быстро поглощает азот и активно взаимодействуют с углеродсодержащими газами (СО, СН4). С азотом и углеродом он образуют твердые и тугоплавкие соединения - нитриды и карбиды. Ниже приведены температура плавления Тпл и микротвердость Н0 ряда нитрида и карбида:
ZrC ZrN*1
Tпл,С………………3420 2982
H МПа...................28500 15000
Цирконий при повышенных температурах реагирует с серой и сероводородом с образованием дисульфидов. С галогенами металл взаимодействует при 100-200С с образованием низкокипящих или легковозгоняющихся хлоридов, фторидов и иодидов.
По антикоррозионной стойкости цирконий превосходит титан и приближаются к танталу и ниобию. При температурах до 100С он не корродирует в соляной и азотной кислотах любой концентрации и серной кислоте концентрации до 50 %. Металл устойчив на холоду в царской водке, растворяются при нагревании в плавиковой и концентрированно серной кислотах .Металл не корродирует в растворах щелочей при температуре кипения.
В важнейших и наиболее устойчивых соединениях цирконий находится в высшей степени окисления 4. Известны соединения, соответствующие степеням окисления 2 и 3. До низших степеней окисления цирконий трудн
geum.ru
КУРСОВАЯ РАБОТА
Металлургия циркония
Введение
Цирконий - тугоплавкий металл. Среднее содержание циркония в земной коре составляет 0,02 % (по массе). По распространенности он превосходит такие металлы, как медь, цинк, олово, никель и свинец.
Известно около 30 минералов циркония. Среди них два минерала - циркон ZrSiО4 и бадделеит ZrО2 - служат основными промышленными источниками циркония.
Руды, содержащие циркон, обогащают гравитационными методами в сочетании с магнитной и электростатической сепарациями. От кварца циркон отделяют на концентрационных столах. Ильменит и гранат выделяют магнитной сепарацией с применением слабых полей. Монацит отделяют магнитной сепарацией в сильных полях. Рутил и циркон разделяют электростатическими методами или флотацией. Выпускаемые концентраты должны содержать не менее 65 % ZrО2.
Цирконовые концентраты служат исходным сырьем для получения металлического циркония, а также для выплавки ферросплавов и производства химических соединений (сульфатоцирконаты, основной хлорид, основной карбонат). Кроме того, при переработке цирконовых концентратов получают гафний и его соединения.
Минерал циркон, составляющий основу цирконовых концентратов, практически не разлагается соляной, азотной и серной кислотами. Концентрированная серная кислота не реагирует с цирконом даже при 250 -300С. Растворы едкого натра при 285 - 300С (в автоклавах) реагируют с цирконом с образованием растворимых в кислотах цирконосиликатов. Способ, однако, не используют вследствие трудностей практической реализации. Все применяемые в промышленности способы разложения относятся к пирометаллургическим. Самые распространенные из них - это спекание с известью, спекание или сплавление с содой или щелочью, спекание и сплавление с фторсиликатом калия K2SiF6, хлорирование.
Следует отметить, что все пиропроцессы сочетаются с последующим гидрометаллургическим разложением полученных продуктов.
1. ОБЩИЕ СВЕДЕНИЯ
Элемент цирконий открыт - в 1789г. Клапротом, который получил диоксид циркония из минерала циркона. Чистый ковкий цирконий был получен лишь в 1925г. (спустя 136 лет после открытия элемента) термической диссоциацией иодида циркония по методу Ван-Аркеля и де Бура.
Применение циркония в виде их химических соединений и присадок в сплавах началось в первые десятилетия XX в. Промышленное производство ковких титана и циркония возникло в начале 50-х годов в связи с потребностями в новых конструкционных материалах для реактивной авиации, ракетной техники и атомной энергетики.
.1 ФИЗИКО - ХИМИЧЕСКИЕ СВОЙСТВА
1.1.1 Физические свойства циркония
Цирконий - элемент IV побочной группы периодической системы. По внешнему виду он напоминает сталь. Чистый металл ковкий и хорошо поддается механической обработке давлением.
Некоторые физико-механические свойства циркония приведены ниже:
Атомный номер……………….40
Атомная масса………………...91,22
Кристаллическая структура:
-модификация………………ГПУ (до 862 С),
а = 0,3223 нм,
с = 0,5123 нм,
-модификация……………….ОЦК,
а = 0,361 нм,
Плотность, г/см3 (-
модификация)…………………6,52
Температура, С:
Плавления……………………..185210
Кипения………………………..около 3600
Температурный коэффициент линейного расширения
∙ 106,С-1……………..8,9
Физические и особенно механические свойства циркония сильно зависят от чистоты металлов. Характерное свойство металла - способность растворять кислород, водород, азот и углерод. Примеси этих элементов делают цирконий хрупким.
1.1.2 Химические свойства
На воздухе металл устойчив. При нагревании до 400-600С он покрывается оксидной пленкой, затрудняющей дальнейшее окисление. При более высокой температуре одновременно с увеличением скорости окисления наблюдается растворение кислорода, что сильно понижает пластичность металла.
Активное поглощение водорода цирконием наблюдается при 300-400С с образованием твердых растворов и гидридов Zrh2,54 -163. В отличие от кислорода и азота водород можно удалить из циркония нагреванием в вакууме при 800-1000 С. Выше 800-900С металл быстро поглощает азот и активно взаимодействуют с углеродсодержащими газами (СО, СН4). С азотом и углеродом он образуют твердые и тугоплавкие соединения - нитриды и карбиды. Ниже приведены температура плавления Тпл и микротвердость Н0 ряда нитрида и карбида:
ZrC ZrN*1
Tпл,С………………3420 2982
H МПа...................28500 15000
Цирконий при повышенных температурах реагирует с серой и сероводородом с образованием дисульфидов. С галогенами металл взаимодействует при 100-200С с образованием низкокипящих или легковозгоняющихся хлоридов, фторидов и иодидов.
По антикоррозионной стойкости цирконий превосходит титан и приближаются к танталу и ниобию. При температурах до 100С он не корродирует в соляной и азотной кислотах любой концентрации и серной кислоте концентрации до 50 %. Металл устойчив на холоду в царской водке, растворяются при нагревании в плавиковой и концентрированно серной кислотах .Металл не корродирует в растворах щелочей при температуре кипения.
В важнейших и наиболее устойчивых соединениях цирконий находится в высшей степени окисления 4. Известны соединения, соответствующие степеням окисления 2 и 3. До низших степеней окисления цирконий трудн
www.studsell.com