|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Болезнь Ниманна-Пика тип с глазами матери, медицинской сестры, врача. Реферат болезнь ниманна пика
"Болезнь Ниманна-Пика тип С. Клинические примеры"
Выдержка из работы
Редкие болезниС.В. Михайлова1, Е.Ю. Захарова2, Т.М. Букина2, Д.А. Савин1, С.В. Пилия1, А.С. Петрухин11 Российская детская клиническая больница, Москва2 Медико-генетический научный центр, МоскваБолезнь Ниманна-Пика тип С. Клинические примерыКонтактная информация:Михайлова Светлана Витальевна, кандидат медицинских наук, врач-невролог отделения психоневрологии № 2 РДКБ Адрес: 117 513, Москва, Ленинский проспект, д. 117, тел.: (495) 936−94−29 Статья поступила: 14. 03. 2010 г., принята к печати: 14. 09. 2010 г.Болезнь Ниманна-Пика тип С (НПС) — наследственное прогрессирующее заболевание нервной системы из группы лизосомных болезней накопления, возникающее в результате нарушения внутриклеточного распределения липидов, что приводит к накоплению холестерина и гликосфинголипидов в головном мозге и других тканях организма. Клиническая картина болезни многообразна и проявляется в виде прогрессирующих мозжечковых когнитивных нарушений, вертикального офтальмопареза, нередко сочетается с поражением печени, селезенки и легких. В данной статье изложены основные механизмы патогенеза болезни Ниманна-Пика тип С, ведущие клинические проявления в зависимости от сроков манифестации заболевания и основные подходы терапии. Авторами описывается два случая этого заболевания, выявленных в России. Приводится сравнительная клиническая характеристика течения болезни у этих пациентов с проявлениями болезни, опубликованными ранее в литературе. В настоящее время разработано патогенетическое лечение, поэтому своевременное выявление данной патологии имеет важное значение для семьи, в которой есть ребенок с болезнью НПС.Ключевые слова: нейродегенеративные заболевания, болезнь Ниманна-Пика тип С, судороги, атаксия, вертикальный офтальмопарез, утрата приобретенных навыков, дифференциальная диагностика, дети.Среди лизосомных болезней накопления болезнь Ниманна-Пика тип С (НПС) является уникальной нозологической формой. В отличие от других заболеваний из этой группы, которые в основном связаны с нарушением активности фермента, при НПС происходит нарушение сортировки («sorting») молекул внутри клетки [1]. НПС относится к мультисистемной патологии, при которой в патологический процесс вовлекаются нервная система, печень, селезенка и легкие. Клиническаякартина НПС довольно сильно различается у отдельных больных по набору основных симптомов и динамике формирования клинического фенотипа [2−4]. НПС часто протекает под масками подострого склерозирующе-го панэнцефалита, внутриутробной инфекции, онкологических и дегенеративных заболеваний нервной системы. Понимание основных механизмов патогенеза болезни, клинической картины и нейрорадиологических данных позволяет избежать диагностических ошибок.S.V. Mikhailova1, E. Yu. Zakharova2, T.M. Bukina2, D.A. Savin1, S.V. Piliya1, A.S. Petrukhin11 Russian Children'-s Clinical Hospital, Moscow2 State Institution Medical Genetic Research Center, MoscowNimann-Pick type C disease. Clinical case studiesNimann-Pick Type C Disease is a hereditary progressive disease of the nervous system from the group of lysosomal accumulation diseases resulting from abnormal subcellular lipid distribution, which leads to the accumulation of cholesterol and glycosphingolipid in the brain and other body tissues. Clinical presentation of the disease is varied and manifested as progressive cerebellar, cognitive disorders, vertical ophthalmoparesis, frequently combined with disorders of the liver, spleen and lungs. This article outlines the key mechanisms of Nimann-Pick type C disease pathogenesis, leading clinical presentations depending on the time the disease manifested itself and key therapy approaches. We described two cases of this disease registered in Russia. It provides a comparative clinical analysis with already published data. To date, a pathogenetic treatment course has been developed for this disease, a timely detection of this pathology is, therefore, important to the burdened family. This representative article on modern data on diagnostics and treatment of NPC is intended for neurologists, pediatricians, psychiatrists and geneticists.Key words: neurodegenerative disease, Nimann-Pick type C disease, convulsions, ataxia, vertical ophthalmoparesis, loss of acquired skills.Хотелось бы подчеркнуть, что НПС относится к той группе наследственных заболеваний, для которых разработаны специфические методы терапии, однако, эффективность лечения во многом зависит от сроков установления правильного диагноза и времени назначения патогенетической терапии.Историческая справкаВ 1961 г. впервые Crocker разделил болезнь Ниманна-Пика на 4 клинических фенотипа (типы А, В, С, D). До открытия молекулярно-генетического дефекта считалось, что все они обусловлены мутациями в гене сфин-гомиелиназы. В конце 1990-х годов были картированы гены NPC1 и NPC2, мутации, которые приводят к болезни Ниманна-Пика тип С (НПС) [5].Этиология и патогенезБолезнь Ниманна-Пика тип С — генетически гетерогенное аутосомно-рецессивное заболевание из группы лизосомных болезней накопления, обусловленное мутациями генов NPC1 и NPC2. Показано, что в 95% случаев болезнь НПС связана с мутациями гена NPC1 (локус 18q11-q12), около 4% случаев — с мутациями гена NPC2 (локус 14q24), в 1% - молекулярногенетический дефект идентифицировать не удается [5]. Ген NPC1 кодирует мембранный, стерол-чувствительный белок, содержащий 13 трансмембранных доменов. Этот белок локализован в эндосомах [6]. Про функции этого белка известно мало, но совершенно очевидно, что он играет важную роль в сортировке (распределении) холестерина и некоторых гликосфинголипидов внутри клетки [5, 7]. Для выполнения своих функций он тесно взаимодействует с NPC2 — небольшим белком, который имеет очень высокое сродство к холестерину [8]. Этот «тандем» белков, вероятнее всего, распределяет холестерин посредством челночного механизма. При мутациях в генах NPC1 и NPC2 происходит накопление неэстерифицированного холестерина, GM2 и GM3 ган-глиозидов, глюкозилцерамида и других гликосфинголипидов [9]. При этом холестерин накапливается в лизо-сомах в очень больших концентрациях, что, вероятно, приводит к нарушению его встраивания в мембраны клетки, следствием чего является нарушение их функции, что и запускает процессы апоптотической гибели клетки [10]. Кроме того, внутрилизосомное накопление холестерина ингибирует активность сфингомиелиназы (до 20% от нормы) и приводит к накоплению сфинго-миелина в клетках паренхиматозных органов (печени, селезенки, почках) и нервной системе. При микроскопическом исследовании во всех органах выявляют «пенистые» клетки — так называемые клетки Ниманна-Пика. При использовании специфических окрасок цитоплазма гистиоцитов приобретает цвет морской волны («sea-blue histiocytes») из-за отложения липопигмента или цероида. Однако, эти клетки не так типичны для болезни Ниманна-Пика тип С, как для типов, А и В [5].КлассификацияК настоящему моменту на основании молекулярногенетического дефекта выделяют два типа заболевания: болезнь Ниманна-Пика тип С 1-го типа и болезнь Ниманна-Пика тип С 2-го типа. Первоначально выделяли в отдельную форму болезнь Ниманна-Пика тип D — заболевание, выявляемое в изолятах Новой Шотландии, но в дальнейшем было показано, что причиной этой формы заболевания также являются мутации гена NPC1 [1, 11].ЭпидемиологияНПС относится к числу редких наследственных болезней обмена веществ. Заболевание распространено повсеместно. Частота заболевания 1: 120 000−1: 150 000 живых новорожденных. Высокая частота болезни НПС 1-го типа отмечена среди некоторых генетических изолятов: французской колонии Акадия (Новая Шотландия), групп бедуинов в Израиле, испанских поселений в Колорадо и Нью-Мексико (США), что связано с эффектом основателя [5].Клинические проявления болезни Ниманна-Пика тип СЗаболевание может проявиться в любом возрасте — от внутриутробного до шестого десятилетия жизни, с пиком манифестации в детстве. В зависимости от возраста дебюта НПС различают несколько форм болезни, различающихся по типу течения и продолжительности жизни пациента: неонатальная, младенческая, поздняя младенческая, юношеская и взрослая формы [5]. Неонатальная форма. В неонатальном периоде НПС нередко дебютирует внутриутробной водянкой плода. У большинства больных основными и ведущими симптомами являются мышечная гипотония и задержка психомоторного развития. В половине случаев у таких пациентов отмечается поражение печени с развитием внутрипеченочного холестаза и гепатоспленомега-лии. Редко заболевание имеет молниеносное течение с развитием тяжелой формы холестатической желтухи и неблагоприятным исходом на первом полугодии жизни от печеночной недостаточности. Выраженность клинической картины и отдельных симптомов меняется с возрастом. Так, у большинства пациентов желтуха и гепато-спленомегалия с возрастом исчезают почти полностью, но прогрессируют задержка психомоторного развития и интеллектуальные нарушения. Редко у таких пациентов развивается дыхательная недостаточность [2, 5]. Младенческая форма. Основные клинические симптомы НПС появляются на первом году жизни. В таких случаях обычно выявляют гепатоспленомегалию, задержку психомоторного развития, мышечную гипотонию. Большинство пациентов никогда не приобретает навыки самостоятельной ходьбы. Интеллектуальное развитие обычно не страдает. По мере прогрессирования заболевания происходит вовлечение в патологический процесс пирамидной системы и происходит постепенное снижение когнитивных функций [5].Поздняя младенческая форма. НПС в 60−70% случаев обычно манифестирует в позднем младенческом и юношеском возрасте. Первыми клиническими симптомами этой формы являются мозжечковые расстройства (шаткость при ходьбе, дизартрия, дисметрия), которые обычно проявляются в возрасте 3−5 лет. Практически у всех пациентов наблюдается гепатоспленомегалия различной степени выраженности, но в 10% случаев данный симптом может отсутствовать. Как при поздней младенческой, так и при юношеской формах заболевания, по мере развития болезни практически у всех пациентов развивается вертикальный супрануклеарный офтальмопарез [12]. На начальных этапах болезни происходит замедление движения глазных яблок по вертикали, постепенно прогрессирующее до полного ограничения вертикального, а иногда горизонтального взора. Нередко отмечается задержка речевого развития. По мере прогрессирования болезни происходит постепенная утрата ранее приобретенных двигательных навыков, становятся заметными интеллектуальные нарушения, появляются дисфагия и дизартрия. Иногда развивается демиелинизирущая периферическая полиневропатия [13]. НеблагоприятныйПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2010/ ТОМ 7/ № 5Редкие болезниисход при поздней младенческой форме обычно наступает в первую декаду жизни.Юношеская форма. При юношеской форме НПС начальные симптомы обычно появляются в возрасте от 6 до 15 лет. Первыми симптомами являются нарушения усвоения школьного материала, письма, снижение внимания, памяти, гиперактивное поведение, что приводит к установлению неправильного диагноза. В некоторых случаях заболевание манифестирует с психиатрических нарушений, таких как нарушение поведения, шизофре-ноподобный синдром, депрессия [11]. В 20% случаев наблюдается геластическая катаплексия, которая характеризуется кратковременной приступообразной утратой мышечного тонуса, приводящей к падению больного без потери сознания и нередко возникает на фоне сильных эмоциональных реакций (часто во время смеха) [14]. Со временем прогрессируют мозжечковые расстройства, появляется дисфагия, дизартрия и ухудшается интеллектуальное развитие. Частыми симптомами НПС являются экстрапирамидные расстройства в виде различных дисто-нических гиперкинезов. В половине случаев развиваются фокальные и/или генерализованные эпилептические приступы, трудно поддающиеся адекватной антиэпилепти-ческой терапии. На поздних стадиях НПС нарастают пирамидные нарушения в виде повышения мышечного тонуса, оживления сухожильных рефлексов, появления патологических рефлексов, бульбарно-псевдобульбарного синдрома, развиваются деменция, децеребрационная или декортикационная ригидность. Обычно гепатоспленоме-галия не наблюдается. Неблагоприятный исход обычно развивается в конце второго — на третьем десятилетии жизни, обычно от интеркуррентных инфекций [5]. Взрослая форма. Манифестные симптомы НПС появляются в возрасте старше 50 лет [5]. У таких пациентов отмечается медленно-прогрессирующее течение болезни. Постепенно развиваются мозжечковые расстройства (атаксия, дизартрия, дисметрия), мышечная дистония, различной степени выраженности интеллектуальные расстройства. Нередко у взрослых болезнь НПС манифестирует с развития биполярных расстройств [15]. При этой форме редко развиваются эпилептические приступы, обычно не наблюдаются увеличение селезенки и вертикальный надъядерный офтальмопарез.Дополнительные методы исследованияКак правило, при МРТ головного мозга на начальных стадиях патологического процесса патология не обнаруживается. По мере прогрессирования заболевания обычно наблюдают кортикальную и субкортикальную атрофию, атрофию мозжечка и перивентрикулярную лейкопатию [12, 16].При компьютерной электроэнцефалографии регистрируют диффузное замедление биоэлектрической активности, эпилептическую активность [2, 5].Лабораторная диагностикаЛабораторная диагностика НПС вызывает большие сложности. Специфичный гистохимический признак болезни Ниманна-Пика — накопление неэстерифицированного холестерина в лизосомах (нагрузочный тест с филипи-ном). При окрашивании культуры клеток филипином наблюдаются интенсивные флюоресцирующие области, сконцентрированные вокруг ядра клетки, которые соответствуют накоплению неэстерифицированного холестерина. Именно на его обнаружении в клетках крови плода, ворсинах хориона или амниотических клетках основана биохимическая диагностика заболевания.Дополнительными биохимическими маркерами могут быть: снижение активности сфингомиелиназы в лейкоцитах крови (20−30% от нормы), повышение активности маркерного фермента лизосом — хитотриозидазы в плазме крови. ДНК-диагностика является наиболее предпочтительным методом верификации диагноза. Описано несколько относительно распространенных мутаций в гене N901, которые локализованы в 20−22 экзонах гена N901, но в большинстве случаев требуется полное секвенирование генов N901 и N902 для выявления мутаций. Информативность такого тестирования составляет около 94% [2].Генно-фенотипические корреляцииВ гене N901 описано более 200 мутаций, при этом анализ генно-фенотипических корреляций затруднителен, поскольку подавляющее большинство больных являются компаунд-гетерозиготами, но у репрезентативных выборок пациентов некоторые закономерности выявить удалось. Например, показано, что при инфантильной форме заболевания характерны нонсенс-мутации (приводящие к появлению стоп-кодона), мутации в области стерол-чувствительного домена и замена р. А1а1054ТИг, а мутация р. Ие1061ТИг никогда не встречается у пациентов с этой формой болезни [17]. При молекулярно-генетическом тетстировании 40 пациентов испанского происхождения выявлено, что аллель р. Сув177Туг в гомозиготном состоянии приводит к поздней форме болезни с классическими неврологическими проявлениями. Для гена N902 провести такой анализ не представляется возможным, поскольку описаны единичные больные с мутациями в данном гене. Неонатальная и младенческая формы заболевания были описаны у пациентов, имеющих нонсенс-мутации р^!п45Х, р. Сув47Х в гомозиготном состоянии, взрослая форма болезни — при мутациях р^а!39Ме1 и р^ег67Рго в гомозиготном состоянии [18−20].Дифференциальная диагностикаВ связи с выраженным клиническим полиморфизмом и неспецифичностью ранних проявлений дифференциальную диагностику необходимо проводить с большим числом заболеваний как наследственной, так и ненаследственной природы. При манифестации болезни в раннем возрасте дифференциальный диагноз проводится с атре-зией желчевыводящих путей, внутриутробными инфекциями, наследственными болезнями обмена веществ (тирозинемией, недостаточностью альфа 1 антитрипсина, болезнью Гоше, болезнью Ниманна-Пика тип А/В, митохондриальными гепатопатиями), онкологическими заболеваниями (лимфомой, гистиоцитозом) [21]. При поздней манифестации НПС дифференциацию следует проводить с объемным образованием головного мозга, лизосомны-ми болезнями накопленият2 ганглиозидозом, болезнью Гоше), идиопатической формой торсионной дистонии, болезнью Вильсона-Коновалова, митохондриальными и психиатрическими заболеваниями.ЛечениеПри болезни НПС многочисленные попытки симптоматической медикаментозной и диетической коррекции липидного обмена, а также трансплантация гемопоэти-ческих стволовых клеток или печени не привели к значительному успеху. В последнее время появились данные о положительном эффекте субстрат-редуцирующей терапии препаратом миглустат (Завеска, Актелион, Швейцария). Данный препарат ингибирует гликозилце-рамидсинтазу — фермент, который катализирует первуюстадию синтеза гликосфинголипидов и тем самым может препятствовать их накоплению. Важным достоинством миглустата является способность проникать через гема-тоэнцефалический барьер. Препарат назначают перорально, и он разрешен к применению с 4-летнего возраста. Рекомендуемая доза для взрослых и детей старше 12 лет составляет 200 мг 3 раза в день. Детям в возрасте от 4 до 11 лет доза рассчитывается в соответствии с площадью поверхности тела [22−23].Всем пациентам показано проведение симптоматической терапии. При катаплексии назначают трициклические антидепрессанты, при дистонии — антихолинэргические препараты, при эпилептических приступах — антиэпилеп-тические средства.Результаты собственных наблюденийЗа период 2009—2010 гг. нами было обследовано 11 пациентов с подозрением на НПС в возрасте от 2 до 15 лет. Критериями включения в исследование были прогрессирующие неврологические нарушения в сочетании с поражением внутренних органов или без таковых, а также повышение активности маркерного фермента лизосом — хитотриозидазы в плазме крови. Всем пациентам, включенным в исследование, был проведен полный анализ гена NPC1 методом прямого секве-нирования. У двух пациентов были обнаружены мутации в гене NPC1, что позволило подтвердить предполагаемый диагноз.Один пациент находился на стационарном лечении и прошел тщательное клиническое и лабораторное обследование- второй больной обследовался амбулаторно, а представленные с места жительства выписки о развитии болезни были недостаточно информативны. В связи с редкой встречаемостью данной патологии, каждый случай этого заболевания важен для более полного представления о клиническом разнообразии этой наследственной патологии.Клинические примерыБольной Б., 9 лет, поступил в стационар с жалобами на шаткость походки, частые падения, прихрамывание при ходьбе («тянет левую ногу»), нарушение мелкой моторики, появление атетоидных гиперкинезов в конечностях, нарушение речи, снижение памяти и утомляемость. Из анамнеза известно, что ребенок от нормально протекавшей беременности, родов в срок путем кесарева сечения. Физическое развитие в раннем возрасте соответствовало средним значениям. Наследственность не отягощена. Профилактические прививки проводились по календарю. В возрасте 5 лет на фоне полного здоровья у мальчика появились жалобы на приступы головокружений. В 7 лет родители стали обращать внимание на присоединение неуверенной походки с тенденцией к пошатыванию и падению влево, общую вялость, нарастающее снижение памяти, заикание. Стали появляться трудности в учебе («плохие дни»). Обследовался по месту жительства. По данным МРТ головного мозга — диффузные субатрофические корко-подкорковые изменения вещества мозга. Желудочковая система умеренно вторично расширена, S = D. Ликвородинамика компенсирована. В перивентрикулярном белом веществе, преимущественно теменных регионов отмечаются зоны повышения МР сигнала на Т2 ВИ и режиме FLAIR, характерные для лейкопатии. При проведении МР венографии с внутривенным контрастным усилением синусы проходимы, однако можно отметить некоторое сужение просвета левого поперечного синуса. Данные компьютернойэлектроэнцефалографии (КЭЭГ) выраженных изменений не выявили. Курсами проводилась метаболическая, ноо-тропная терапия с некоторой положительной динамикой в виде улучшения координаторных функций, уменьшения вестибулярных нарушений. По окончании курса лечения родители отмечали быстрый регресс положительной динамики, нарастание координаторных и речевых нарушений, появление прихрамывания на левую ногу.При осмотре на момент поступления: гиперстеническое телосложение, повышенное питание. Кожные покровы бледные, видимые слизистые оболочки чистые. В легких везикулярное дыхание проводится во все отделы, хрипов нет. Тоны сердца ясные, ритм правильный. Живот мягкий, безболезненный. Печень, селезенка — не увеличены. Стул, диурез не нарушены.Неврологический статус: ребенок в сознании, ориентирован, несколько негативен к осмотру, плаксив, инструкции выполняет, правильно отвечает на вопросы. Общемозговых, менингеальных симптомов не выявляется. Обоняние сохранено, зрение не исследовано. Глазные щели асимметричны (справа шире), нарушения движения глазных яблок в виде ограничения по вертикали, проявляющиеся только при спонтанных движениях, а не при слежении за неврологическим молоточком, точки выхода тройничного нерва безболезненные. Лицо симметричное. Выявляется горизонтальный мелкоамплитудный нистагм в крайнем левом отведении. Небная занавеска подвижна. Мозжечковая дизартрия. Дисфонии, дисфагии — нет. Небный и глоточный рефлексы повышены. Повороты головы в полном объеме. Язык по средней линии.При исследовании рефлекторно-двигательной сферы отмечается изменение походки, элементы гемипареза. Мышечная дистония с 2-х сторон, сухожильные рефлексы высокие, без четкой разницы сторон. Сила мышц снижена до 4-х баллов. Положительный симптом Бабинского с двух сторон, больше слева.Координаторная сфера: в позе Ромберга пошатывается. Пальце-носовую, пальце-молоточковую пробы выполняет с интенцией, гиперметрией. Чувствительных нарушений не выявлено. Тазовых, вегетативных расстройств не отмечается.Высшие корковые функции: объем навыков, знаний представляется сниженным.Лабораторные исследованияВ общих анализах крови и мочи патология не выявлена. Биохимический анализ крови: АСТ-55 (норма10−42) Ед/л, Са (ионизированный) — 1,17 (норма 0,98−1,13) моль/л. В цереброспинальной жидкости: цитоз 2,7Х103, белок 0,3 (норма 0,08−0,42) г/л, глюкоза 2,86 (норма 3,33−4,44) ммоль/л, в цитопрепарате — 74 сохранные клетки: моноциты (23) + макрофаги (51). Иммунологлобулины крови в пределах возрастной нормы. Анализ крови на а-фетопротеин — 1,4 МЕ/мл (норма 0−9,5). Лактат сыворотки крови натощак и после нагрузки: 2,4 ммоль/л и 1,6 ммоль/л, соответственно. Анализ ликвора на лактат после нагрузки: 1,5 ммоль/л. Магнитно-резонансная томография (МРТ) головного мозга: на представленных МР изображениях в сравнении с ранее проведенным исследованием можно отметить некоторое повышение МР сигнала на Т2 ВИ и режиме FLAIR от перивентрикулярного белого вещества с утрированием ранее выявленных зон лейкопатии в теменных областях. Степень атрофических изменений и вентрикулярная геометрия остаются прежними.По данным КЭЭГ, в конвекситальных отделах полушарий регистрируются диффузные общемозговые измененияПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2010/ ТОМ 7/ № 5Редкие болезнибиоэлектрической активности, проявляющиеся в виде дизритмии и дезорганизации корковой ритмики, отсутствия регулярного основного а-ритма в задних отделах полушарий, доминировании медленных форм активности тета-диапазона по всем отделам конвекса, усиливающихся при выполнении HV пробы. РФС: фотопароксизмаль-ной реакции в коре больших полушарий не выявляется. Ультразвуковое исследование брюшной полости: печень не увеличена, контуры ровные, паренхима однородная, эхогенность обычная, подчеркнут сосудистый рисунок, хвостатая доля не изменена- поджелудочная железа умеренно увеличена в хвосте, 18x7x22 мм, контуры ровные, паренхима умеренно неоднородная, вирсунгов проток не расширен- желчный пузырь обычной формы, в просвете пристеночный осадок, стенки плотные, холедох не расширен- селезенка соответствует возрасту, структура зернистая- почки расположены обычно, контуры ровные, размеры соответствуют возрастной норме, паренхима — дифференцировка и васкуляризация сохранены, чашечно-лоханочная система не расширена, стенки уплотнены.Исследование зрительных вызванных потенциалов: на реверсивный паттерн регистрируются признаки дисфункции проведения возбуждения в центральных отделах зрительной афферентной системы с двух сторон, больше слева, проявляющиеся увеличением латентности основного компонента Р100 при стимуляции левого глаза до 115 мс, при стимуляции правого глаза — до 109 мс по сравнению с нормой.На рентгенограмме легких в прямой проекции легочные поля одинаковой прозрачности, легкие вздуты. Легочный рисунок не изменен, корни структурны, не расширены, не уплотнены, рисунок их не изменен. Тень средостения не расширена, расположена срединно. Тень сердца не изменена, не расширена. Костальная плевра не изменена. Плевральные синусы свободны. Диафрагма с четкими, ровными контурами, расположена обычно.Данный клинический случай НПС, безусловно, классический с дебютом в детском возрасте (поздняя младенческая форма). Учитывая возраст начала болезни (5 лет), прогредиентное течение, данные клинического осмотра: мозжечковый синдром, левосторонний гемипарез, полиневропатию- данные дополнительных исследований — МРТ головного мозга (корково-подкорковая субатрофия полушарий большого мозга, субатрофия мозжечка, негрубая лейкопатия) дифференциальный диагноз проводился с наследственными нейродегенеративными заболеваниями, такими как Gm2 ганглиозидоз, болезнь Фридрейха, атаксия-окуломоторная апраксия, синдромом Луи-Бар, а также с митохондриальными болезнями.Так же, как и в данном случае, при болезни Фридрейха и Gm2 ганглиозидозе первым симптомом болезни является расстройство походки — неустойчивость, неловкость при быстрой ходьбе и беге. Постепенно к нарушению ходьбы и неустойчивости в позе Ромберга присоединяется интенционный тремор, дискоординация в руках. Расстройства речи возникают рано и носят сложный мозжечково-дизартрический характер. При классической форме атаксии Фридрейха, в отличие от болезни НПС, часто развивается сухожильная арефлексия, которая является ранним и специфическим симптомом болезни- возникает нарушение суставно-мышечной и вибрационной чувствительности. Данных симптомов у пациента отмечено не было. Болезнь Фридрейха так же, как и НПС, относится к мультисистемной патологии, однако набор клинических проявлений при этих заболеваниях значительно отличается. Характерным для болезни Фридрейхаявляется вовлечение в патологический процесс костной системы с формированием так называемой «стопы Фридрейха" — нередко отмечаются кифосколиоз, кардио-миопатия и различные эндокринные нарушения. По данным литературы, при поздних формах 0т2 ганглиозидоза обычно развиваются различные типы эпилептических приступов (генерализованные тонико-клонические, мио-клонические), резистентные к антиэпилептической терапии, что не было зарегистрировано в нашем случае [2]. Неврологически неотличимыми от НПС заболеваниями являются атаксия-окуломоторная апраксия и синдром Луи-Бар. Также, как и НПС, атаксия-окуломоторная апраксия дебютирует в раннем детском возрасте. Начальными симптомами атаксии-окуломоторной апраксии являются мозжечковые расстройства, со временем присоединяется апраксия глазодвигательной мускулатуры, часто развивается полиневропатия. В отличие от НПС при синдроме Луи-Бар обнаруживают повышение уровня а-фетопротеина и изменения иммуноглобулинов основных классов [24].Дифференциальный диагноз проводился также с митохондриальной патологией, в частности с синдромом прогрессирующей наружной офтальмоплегии, при которой помимо появления глазодвигательных нарушений (как у нашего пациента) наблюдаются птоз, мышечная слабость в проксимальных отделах конечностей, повышение уровня лактата в крови и цереброспинальной жидкости. Одна из мутаций, выявленных у нашего пациента — замена цитозина на тимин в положении 2861 приводит к замене аминокислоты Ser954Leu и относится к числу мутаций, значительно нарушающих функции белка. Второй мутантный аллель — с. 3614с1еЮ является новой мутацией, но, можно предположить, что он также существенно влияет на функцию белка, поскольку приводит к сдвигу рамки считывания.Таким образом, в данном случае тщательный сбор анамнеза, выявление последовательности появления основных симптомов стали основными критериями, на основании которых появилась возможность предположить клинический диагноз.Больная Б., 5 лет. Родители обратились в поликлиническое отделение с жалобами на задержку психомоторного развития и увеличение размеров печени и селезенки.Из анамнеза известно, что ребенок от второй беременности, протекавшей без особенностей, вторых срочных самостоятельных родов. Наследственность не отягощена. Профилактические прививки проведены по календарю. На первом году жизни наблюдалась у ортопеда по поводу дисплазии тазобедренных суставов. Со слов родителей, к возрасту полутора лет стала заметна задержка психомоторного развития, при обследовании по месту жительства ребенку был установлен диагноз: детский церебральный паралич. Девочке проводилась реабилитационная терапия без явного положительного эффекта. В возрасте 3 лет при проведении ультразвукового исследования органов брюшной полости было обнаружено увеличение размеров печени и селезенки, в связи с чем ребенок проходил обследование и лечение в гематологическом отделении. С диагностической целью была проведена пункция костного мозга, в которой были выявлены клетки Гоше, что позволило заподозрить заболевание из группы лизосомных болезней накопления.При осмотре на момент поступления состояние очень тяжелое. Кожные покровы сухие, чистые. Сердечные тоны приглушены, отмечается систолический шум в V точ-ке. Аускультативно в легких дыхание жесткое, проводится во все отделы. Печень увеличена: + 3 см, +4 см, +4 см из-под края реберной дуги, край плотный, селезенка +6 см из-под края реберной дуги, край эластичный. Стул, диурез не нарушены.В неврологическом статусе: общемозговых и менинге-альных симптомов нет. Взор фиксирует и прослеживает, движения глазных яблок в полном объеме, лицо симметричное, глоточные и небные рефлексы снижены, дис-фагия и дисфония. Голову не держит, не сидит, не ходит. Мышечная гипотония. Контрактуры крупных суставов. В сознании, задержка психомоторного развития, не говорит, окружающим не интересуется.Лабораторные исследования: в общем анализе крови — гемоглобин 98 г/л, эритроциты 3,6×1012/л, цветовой показатель 0,81, тромбоциты 198×109/л, лейкоциты 5,0×109/л, палочкоядерные 1%, сегментоядерные 45%, эозинофилы 1%, лимфоциты 44%, моноциты 8%, СОЭ 12 мм/ч. В биохимическом анализе крови: АСТ — 55 (10−42) Ед/л, Са (ионизированный) — 1,17 (0,98−1,13) ммоль/л.Данный клинический случай иллюстрирует сложности дифференциальной диагностики НПС. Учитывая раннюю манифестацию болезни (на первом году жизни), прогрессирующее течение болезни, данные клинического осмотра (гепатолиенальный синдром, задержка психомоторного развития), дополнительных данных (наличие клеток Гоше в пунктате костного мозга), дифференциальныйдиагноз, в первую очередь, проводился с заболеваниями из группы лизосомных болезней накопления, протекающими с гепатоспленомегалией и неврологическими нарушениями (болезнью Гоше, болезнью Ниманна-Пика тип А/В, ганглиозидозами). При проведении исследований был выявлен высокий уровень хитотриозидазы (950 ммоль/мл в ч, при норме до 198 ммоль/мл в ч). Именно эта находка и послужила основанием для поиска причин болезни среди других, более редких форм лизо-сомных болезней накопления. Интересно, что у пациента Б., также была выявлена мутация Ser954Leu в гетерозиготном состоянии, второй мутации мы не обнаружили (вероятно, в связи с недостаточным количеством биологического материала пробанда.ЗаключениеКлиническая диагностика нейродегенеративных болезней представляет значительные трудности, связанные с чрезвычайной редкой встречаемостью отдельных форм, дебютом в любом возрасте, выраженным клиническим полиморфизмом, возможностью атипичного течения. Приоритетную роль в диагностике играют биохимические и молекулярно-генетические методы исследования. В настоящее время для данного заболевания разработано патогенетическое лечение и возможно проведение пренатальной диагностики. Своевременное выявление патологии играет ключевую роль в дальнейшем прогнозе болезни.СПИСОК ЛИТЕРАТУРЫ1. Carstea E. D., Morris J. A., Coleman K. G. et al. Niemann-Pick C1 disease gene: homology to mediators of cholesterol homeostasis // Science. — 1997- 277: 228−312. Краснопольская К. Д. Наследственные болезни обмена веществ. Справочное пособие для врачей. — М.: Москва,2005. — 364 с.: ил.3. Millard E. E., Gale S. E., Dudley N. et al. The sterol-sensing domain of the Niemann-Pick C1 (NPC1) protein regulates trafficking of low density lipoprotein cholesterol // J. Biol. Chem. — 2005- 280: 28 581−90.4. Zervas M., Somers K. L., Thrall M. A. et al. Critical role for glycosphingolipids in Niemann-Pick disease type C // Curr. Biol. — 2001- 11: 1283−7.5. Scriver C. R. et al. (eds). The Metabolic and Molecular Bases of Inherited Diseases (McGraw-Hill). — New York, 2005.6. Strauss J. F., Liu P., Christenson L.K. et al. Sterols andintracellular vesicular trafficking: lessons from the study of NPC1 // Steroids. — 2002- 67: 947−51.7. Greer W. L., Dobson M. J., Girouard G. S. et al. Mutations in NPC1 highlight a conserved NPC1-specific cysteine-rich domain // Am. J. Hum. Genet. — 1999- 65: 1252−60.8. Vanier M. T., Millat G. Structure and function of theNPC2 protein // Biochim. Biophys. Acta. — 2004- 1685: 14−21.9. Millat G., Marcais C., Rafi M. A. et al. Niemann-Pick C1disease: the I1061T substitution is a frequent mutant allelein patients of Western European descent and correlates with a classic juvenile phenotype // Am. J. Hum. Genet. — 1999- 65: 1321−9.10. Millat G., Marcais C., Tomasetto C. et al Lipid and cholesterol trafficking in NPC // Biochim. Biophys. Acta. — 2004- 1685: 28−37.11. Imrie J., Vijayaraghaven S., Whitehouse C. et al. Niemann-Pick disease type C in adults // J. Inherit. Metab. Dis. — 2002- 25: 491−500.12. Tedeschi G., Bonavita S., Barton N. W. et al. Proton magnetic resonance spectroscopic imaging in the clinical evaluation of patients with Niemann-Pick type C disease // J. Neurol. Neurosurg. Psychiatry. — 1998- 65: 72−9.13. Zafeiriou D. I., Triantafyllou P, Gombakis N. P et al. Niemann-Pick type C disease associated with peripheral neuropathy // Pediatr. Neurol. — 2003- 29: 242−4.14. Kanbayashi T., Abe M., Fujimoto S. et al. Hypocretin deficiency in niemann-pick type C with cataplexy // Neuropediatrics. — 2003- 34: 52−3.15. Sullivan D., Walterfang M., Velakoulis D. Bipolar disorder and Niemann-Pick disease type C // Am. J. Psychiatry. — 2005- 162: 1021−2.16. Grau A. J., Brandt T., Weisbrod M. et al. Adult Niemann-Pick disease type C mimicking features of multiple sclerosis // J. Neurol. Neurosurg. Psychiatry. — 1997- 63: 552.17. Millat G., Chikh K., Naureckiene S. et al. Niemann-Pick disease type C: spectrum of HE1 mutations and genotype/phenotype correlations in the NPC2 group // Am. J. Hum. Genet. — 2001- 69: 1013−21.18. Chikh K., Rodriguez C., Vey S. et al. Niemann-Pick type C disease: subcellular location and functional characterization of NPC2 proteins with naturally occurring missense mutations // Hum. Mutat. — 2005- 26: 20−8.19. Fernandez-Valero E. M., Ballart A., Iturriaga C. et al. Identification of 25 new mutations in 40 unrelated Spanish Niemann-Pick type C patients: genotype-phenotype correlations // Clin. Genet. — 2005- 68: 245−54.20. Park W. D., O'-Brien J. F., Lundquist P A. et al. Identification of 58 novel mutations in Niemann-Pick disease type C: correlation with biochemical phenotype and importance of PTC1-like domains in NPC1 // Hum Mutat. — 2003- 22: 313−25.21. Yerushalmi B., Sokol R. J., Narkewicz M. R. et al. Niemann-pick disease type C in neonatal cholestasis at a North American Center // J. Pediatr. Gastroenterol. Nutr. — 2002- 35: 44−50.22. Patterson M. C., Platt F. Therapy of Niemann-Pick disease, type C // Biochim. Biophys. Acta. — 2004- 1685: 77−82.23. Patterson M. C., Vecchio D., Prady H. et al. Miglustat for treatment of Niemann-Pick C disease: a randomised controlled study // Lancet Neurol. — 2007- 6: 765−72.24. Иллариошкин С. Н., Руденская Г. Е., Иванова-Смоленская И. А. Наследственные атаксии и параплегии. — М: МЕД пресс-информ,2006. — 416 с.ПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2010/ ТОМ 7/ № 5
Показать Свернутьreferat.bookap.info
Болезнь Нимана - Пика — доклад
Болезнь Нимана - Пика (сфингомиелиноз) (ранняя детская форма). Частота заболевания составляет 1 случай на 100 000 детей. В 1914 году Niemann впервые представил описание основных симптомов данного заболевания, а в 1922 году Pick опубликовал детальную характеристику всех особенностей данной патологии.
Патогенез:
Болезнь Нимана-Пика обусловлена мутационными поражениями гена сфингомиелиназы. Продукт данного гена - кислая сфингомиелиназа. При наследственном дефекте этого фермента происходит отложение сфингомиелина, холестерола и родственных фосфолипидов внутри лизосом в клетках различных тканей, преимущественно в клетках паренхиматозных органов (печени, селезенки, почках) и головного мозга. Заболевание наследуется по аутосомно-рецессивному типу. Ген сфингомиелиназы локализуется на 11 хромосоме человека.
Симптомы:
Заболевание начинается в возрасте 3-5 мес с анорексии, рвоты, раздражительности, затем наступает апатия. Происходит увеличение печени, селезенки и лимфатических узлов. Они становятся плотными, болезненными. Вначале отмечается остановка общего развития, затем утрата моторных навыков. Теряется интерес к окружающему. Выявляются также гипертонус, реже гипотония мускулатуры, эпилептические припадки, уменьшение болевой чувствительности. У больных снижается острота зрения, затем наступают слепота и глухота. У 20-60 % больных обнаруживается вишневое пятно на глазном дне.
Выделяют три основных типа болезни Ниманна - Пика - А, В и С.
Тип А (классическая инфантильная форма) наблюдается наиболее часто. Заболевание проявляется после рождения и характеризуется поражением внутренних органов и ц.н.с. Уже с 3 месяца отмечаются трудности вскармливания, гипотрофия(расстройство в питании). Как правило, печень увеличивается раньше, чем селезенка. Дети истощены, характерны большой выступающий живот и тонкие конечности. Из неврологических нарушений отмечаются мышечная гипотония, угнетение сухожильных рефлексов, отсутствие реакции на окружающее, остановка моторного развития, затем утрата уже приобретенных навыков. Рано снижается слух. Кожа приобретает коричневато-желтую окраску из-за нарушения обмена сфингомиелина. Примерно в 50% случаев выявляется вишнево-красное пятно в области желтого пятна сетчатки. Также описаны помутнение роговицы, коричневое прокрашивание передней капсулы хрусталика. Больные дети умирают обычно на третьем году жизни. При типе В (висцеральная форма, хроническая форма без вовлечения нервной системы) основные клинические проявления развиваются позже, чем при типе А. Спленомегалия(увеличение селезёнки) появляется в возрасте 2-6 лет, позднее поражаются печень и легкие (больные подвержены частым инфекциям дыхательных путей). Симптоматика поражения ц.н.с. отсутствует, напротив, в ряде случаев отмечены высокие интеллектуальные способности. Продолжительность жизни не снижена. Тип С (подострая, юношеская форма, хроническая нейропатическая форма) проявляется в 1-2 года и характеризуется нейровисцеральными нарушениями. Сначала появляется гепатоспленомегалия (менее выражена по сравнению с типами А и В), может наблюдаться холестаз (уменьшением поступления желчи в двенадцатиперстную кишку). Неврологические симптомы развиваются на фоне поражения внутренних органов, отмечаются мышечная гипотония, повышение глубоких сухожильных рефлексов, которые сменяются спастическим параличом, а также умеренная атаксия (нарушение согласованности движений различных мышц при условии отсутствия мышечной слабости; одно из часто наблюдаемых расстройств моторики), судороги. Большинство больных погибает в возрасте 5-15 лет.
Диагностика
Подтвердить диагноз позволяет определение уровня активности сфингомиелиназы в фибробластах и лейкоцитах. Пункция костного мозга даёт возможность выявить типичные клетки Нимана-Пика (так называемые пенистые).
Биохимическое исследование крови позволяет выявить повышенные концентрации жирных кислот, несколько повышенный уровень холестерина, повышенную активность щелочной фосфатазы, высокие концентрации фосфолипидов.
Лечение
Специфическое лечение при данной патологии не разработано, проводится симптоматическое лечение, направленное на повышение качества жизни и увеличение её продолжительности. Был получен положительный эффект от применения прегландола (препарата, содержащего гормоны передней доли гипофиза). Показаны витаминотерапия, применение биологически активных веществ.
Прогноз:
Прогноз зависит от сроков проявления клинических симптомов и от типа патологии. У тех детей, которые являются гомозиготами по патологическому гену, прогноз неблагоприятный, продолжительность жизни ограничивается тремя годами.
При гетерозиготном положении дефектного гена патологические симптомы проявляются в более поздние сроки или даже после совершеннолетия.
yaneuch.ru
Болезнь Ниманна Пика Болезнь Нимана-Пика
 Болезнь Ниманна. Пика
Болезнь Ниманна. Пика
 Болезнь Нимана-Пика. • • Заболевание описали A. Niemann в 1914 г. и в 1922 г. L. Pick. При болезни Нимана—Пика происходит нарушение обмена липидов, что ведет к накоплению в органах и тканях организма такого вещества, как сфингомиелин, вследствие снижения активности фермента сфингомиелиназы. Частота заболевания 1: 100 000.
Болезнь Нимана-Пика. • • Заболевание описали A. Niemann в 1914 г. и в 1922 г. L. Pick. При болезни Нимана—Пика происходит нарушение обмена липидов, что ведет к накоплению в органах и тканях организма такого вещества, как сфингомиелин, вследствие снижения активности фермента сфингомиелиназы. Частота заболевания 1: 100 000.
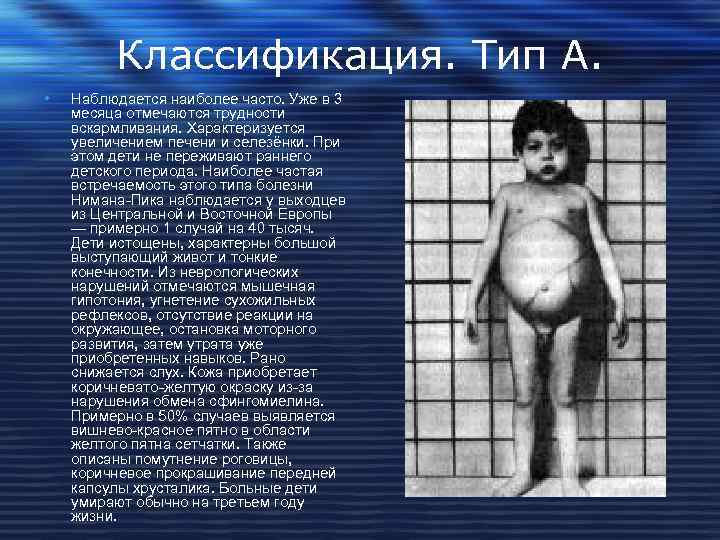 Классификация. Тип А. • Наблюдается наиболее часто. Уже в 3 месяца отмечаются трудности вскармливания. Характеризуется увеличением печени и селезёнки. При этом дети не переживают раннего детского периода. Наиболее частая встречаемость этого типа болезни Нимана-Пика наблюдается у выходцев из Центральной и Восточной Европы — примерно 1 случай на 40 тысяч. Дети истощены, характерны большой выступающий живот и тонкие конечности. Из неврологических нарушений отмечаются мышечная гипотония, угнетение сухожильных рефлексов, отсутствие реакции на окружающее, остановка моторного развития, затем утрата уже приобретенных навыков. Рано снижается слух. Кожа приобретает коричневато-желтую окраску из-за нарушения обмена сфингомиелина. Примерно в 50% случаев выявляется вишнево-красное пятно в области желтого пятна сетчатки. Также описаны помутнение роговицы, коричневое прокрашивание передней капсулы хрусталика. Больные дети умирают обычно на третьем году жизни.
Классификация. Тип А. • Наблюдается наиболее часто. Уже в 3 месяца отмечаются трудности вскармливания. Характеризуется увеличением печени и селезёнки. При этом дети не переживают раннего детского периода. Наиболее частая встречаемость этого типа болезни Нимана-Пика наблюдается у выходцев из Центральной и Восточной Европы — примерно 1 случай на 40 тысяч. Дети истощены, характерны большой выступающий живот и тонкие конечности. Из неврологических нарушений отмечаются мышечная гипотония, угнетение сухожильных рефлексов, отсутствие реакции на окружающее, остановка моторного развития, затем утрата уже приобретенных навыков. Рано снижается слух. Кожа приобретает коричневато-желтую окраску из-за нарушения обмена сфингомиелина. Примерно в 50% случаев выявляется вишнево-красное пятно в области желтого пятна сетчатки. Также описаны помутнение роговицы, коричневое прокрашивание передней капсулы хрусталика. Больные дети умирают обычно на третьем году жизни.
 Тип B. • Более умеренный тип. Основные клинические проявления развиваются позже, чем при типе А. Спленомегалия появляется в возрасте 2 -6 лет, позднее поражаются печень и легкие (больные подвержены частым инфекциям дыхательных путей). Симптоматика поражения ц. н. с. отсутствует, напротив, в ряде случаев отмечены высокие интеллектуальные способности. Продолжительность жизни не снижена.
Тип B. • Более умеренный тип. Основные клинические проявления развиваются позже, чем при типе А. Спленомегалия появляется в возрасте 2 -6 лет, позднее поражаются печень и легкие (больные подвержены частым инфекциям дыхательных путей). Симптоматика поражения ц. н. с. отсутствует, напротив, в ряде случаев отмечены высокие интеллектуальные способности. Продолжительность жизни не снижена.
 Тип С. • Проявляется в детстве, хотя возможно начало в грудном возрасте или у взрослых. Симптомы включают тяжёлые печёночные нарушения, проблемы с дыханием, задержку в развитии, припадки, повышенный мышечный тонус (дистония), нарушение координации движения, питания и движения глаз в вертикальной плоскости. Большинство больных погибает в возрасте 5 -15 лет.
Тип С. • Проявляется в детстве, хотя возможно начало в грудном возрасте или у взрослых. Симптомы включают тяжёлые печёночные нарушения, проблемы с дыханием, задержку в развитии, припадки, повышенный мышечный тонус (дистония), нарушение координации движения, питания и движения глаз в вертикальной плоскости. Большинство больных погибает в возрасте 5 -15 лет.
 Диагностика. Лечение. Профилактика. • Лабораторная диагностика основана на обнаружении в биопсийном материале лимфатического узла, печени или селезенки сфингомиелина. В лейкоцитах и культуре фибробластов находят снижение содержания или отсутствие фермента. • Лечение симптоматическое. Некоторая стабилизация процесса и улучшение общего состояния наблюдаются при назначении витаминов, переливании крови, плазмы, введении тканевых экстрактов. Стоит отметить, что операции по трансплантации органов, пока не очень успешны. В будущем ученые рассчитывают на то, что для лечения этого заболевания можно будет применять технологии ферментной замены и генную терапию. • Профилактика болезни Ниманна - Пика заключается в проведении медикогенетического консультирования и обследования в специализированных клиниках с целью выявления гетерозигот по аутосомно-рецессивному гену. Проводится также пренатальная диагностика: определяют активность сфингомиелиназы в культуре амниотических клеток.
Диагностика. Лечение. Профилактика. • Лабораторная диагностика основана на обнаружении в биопсийном материале лимфатического узла, печени или селезенки сфингомиелина. В лейкоцитах и культуре фибробластов находят снижение содержания или отсутствие фермента. • Лечение симптоматическое. Некоторая стабилизация процесса и улучшение общего состояния наблюдаются при назначении витаминов, переливании крови, плазмы, введении тканевых экстрактов. Стоит отметить, что операции по трансплантации органов, пока не очень успешны. В будущем ученые рассчитывают на то, что для лечения этого заболевания можно будет применять технологии ферментной замены и генную терапию. • Профилактика болезни Ниманна - Пика заключается в проведении медикогенетического консультирования и обследования в специализированных клиниках с целью выявления гетерозигот по аутосомно-рецессивному гену. Проводится также пренатальная диагностика: определяют активность сфингомиелиназы в культуре амниотических клеток.
 • Исследователи из Университета Техасской Юго-Западной медицинской школы обнаружили, что при введении мышам (инфицированным болезнью Нимана-Пика типа C) CYCLO (2 гидроксипропил-β-циклодекстрин или HPBCD), через семь дней, у них наблюдалось существенное улучшения функций печени, несколько меньше восстанавливались нейродегенеративные функции, в результате у этих животных повышалась продолжительность жизни. То есть, согласно этим результатам, 2 -гидроксипропил-βциклодекстрин - решает проблему накопления липидов, которая вызывается болезнью Нимана-Пика типа С.
• Исследователи из Университета Техасской Юго-Западной медицинской школы обнаружили, что при введении мышам (инфицированным болезнью Нимана-Пика типа C) CYCLO (2 гидроксипропил-β-циклодекстрин или HPBCD), через семь дней, у них наблюдалось существенное улучшения функций печени, несколько меньше восстанавливались нейродегенеративные функции, в результате у этих животных повышалась продолжительность жизни. То есть, согласно этим результатам, 2 -гидроксипропил-βциклодекстрин - решает проблему накопления липидов, которая вызывается болезнью Нимана-Пика типа С.
 Спасибо за внимание!
Спасибо за внимание!
present5.com
симптомы, причины, лечение. Болезнь Ниманна-Пика :: SYL.ru
Болезнь Пика представляет собой тяжелое заболевание, которое, к счастью, в современной медицине встречается сравнительно редко. Тем не менее информация о причинах и симптомах болезни будет интересна многим читателям. Ведь, как и в любом другом случае, ранняя диагностика повышает шансы успешного лечения.
Что представляет собой заболевание?

Сегодня многие люди интересуются вопросами о том, что же представляет собой болезнь Пика, симптомы, причины, лечение и прогнозы для пациентов. Сразу же стоит отметить, что это прогрессирующее заболевание центральной нервной системы, для которого характерно поражение височных и лобных долей коры головного мозга.
Чаще всего болезнь проявляется в возрасте 50 – 60 лет. Более раннее развитие возможно, но встречается редко. Согласно статистическим данным, женщины более подвержены болезни, чем мужчины.
Болезнь Пика сопровождается постепенным отмиранием нейронов, что приводит к истончению коры головного мозга и увеличению желудочков. На фоне данных процессов у пациента развивается слабоумие, которое нарастает по мере развития заболевания.
Болезнь Пика: причины возникновения
К сожалению, на сегодняшний день точные причины развития подобного заболевания остаются неизвестными. Тем не менее исследования по механизму развития недуга активно ведутся — их результаты позволили выделить несколько основных факторов риска:
- В первую очередь ученые отмечают наследственную предрасположенность к данному заболеванию. Особенно часто болезнь Пика развивается у людей, родственники которых страдали от тех или иных форм деменции.
- К факторам риска можно отнести и тяжелые травмы головы, которые провоцируют отмирание нервных клеток.
- Вероятность развития данной болезни повышается в том случае, если на организм человека постоянно воздействуют те или иные вредные химические вещества.
- К перечню возможных причин медики также относят некоторые психические заболевания, в частности, депрессивный психоз.
Болезнь Пика: симптомы начальной стадии

Сразу же стоит отметить, что данное заболевание развивается постепенно — соответственно, признаки расстройств появляются со временем. Как правило, на начальных этапах болезнь Пика трудно диагностировать. Тем не менее есть некоторые изменения, на которые обязательно стоит обратить внимание.
Для начала у пациента исчезает критическое отношение к окружающему миру. В дальнейшем можно отметить снижение уровня эмоциональности, а также уменьшение продуктивности мышления и изменение подвижности. Нередко у человека изменяются вкусовые пристрастия, повышается интерес к сексу. Иногда на фоне нарастающего слабоумия может развиваться депрессия. Что же касается физических симптомов, то некоторые люди жалуются на слабость, головокружения и головные боли, хотя эти симптомы могут отсутствовать.
Дальнейшие изменения зависят от того, какая именно зона коры была затронута. Например, если поражены базальные части, то можно заметить, что больные становятся более подвижными и суетливыми. Они могут терять чувство такта, нередко пристают к прохожим с неуместными замечаниями и т.д. Если процесс отмирания нейронов локализован в лобных долях, то у человека, наоборот, развивается вялость, апатия, исчезает мотивация к совершению тех или иных действий. В том случае, если процесс затрагивает лобно-височные доли, у пациента отмечаются некоторые речевые расстройства.
Какими симптомами сопровождается дальнейшее развитие болезни?

По мере развития болезни симптомы становятся все более выраженными. Нередко у человека наблюдаются расстройства речи — словарный запас становится более скудным и со временем сводится к нескольким фразам, которые пациент повторяет постоянно. Естественно, подобное сказывается и на письме. К признакам болезни Пика можно отнести афазию, алексию, аграфию и т.д.
Кроме того, в некоторых случаях заболевание сопровождается появлением гипокинезов, потерей мышечного тонуса и т.д. Довольно часто пациенты с подобным диагнозом страдают от ожирения, а также отказываются соблюдать правила личной гигиены.
В любом случае на более поздних этапах пациенту необходима помощь — человек больше не в состоянии сам о себе заботиться.
Современные методы диагностики

При наличии тех или иных симптомов подобной болезни пациенту рекомендуют сразу же обратиться к врачу — как правило, людей с вышеописанными жалобами сначала обследует психиатр. Во время осмотра врач собирает максимальное количество информации, выясняет наличие генетической предрасположенности, оценивает нервно-психическое состояние. В дальнейшем пациенту рекомендуется пройти несколько исследований.
В частности, довольно информативной является электроэнцефалография, которая позволяет уловить электрические импульсы, вырабатываемые головным мозгом человека при тех или иных процессах. Поскольку кора мозга значительно истощена, а количество нейронов постепенно уменьшается, то и процессов становится меньше — это отображается на электроэнцефалограмме.
Кроме того, пациенту назначают компьютерную и магнитно-резонансную томографию. Эти исследования позволяют получить изображение головного мозга, а также оценить функциональную активность тех или иных участков. Результаты этих тестов дают врачу возможность определить место локализации процесса, а также стадию его развития.
Существует ли эффективное лечение?
Какой терапии требует болезнь Пика? Лечение на сегодняшний день сводится к попыткам приостановить дальнейшее прогрессирование заболевания. В первую очередь больным необходима заместительная терапия — пациентам назначают прием тех веществ, синтез которых в организме не происходит из-за атрофии нервных тканей (например, ингибиторы ацетилхолинестеразы). В некоторых случаях необходим дополнительный прием противовоспалительных веществ.
Крайне важной частью терапии является и прием нейропротекторов, которые стимулируют процесс жизнедеятельности нейронов. При наличии психических расстройств используются соответственные препараты, которые помогают ослабить симптомы, например, устранить агрессию. Иногда необходим прием антидепрессантов.
Безусловно, важной частью лечения является психологическая поддержка. Пациентам рекомендуют регулярно посещать специальные занятия и тренинги, которые помогают приостановить процесс психических и эмоциональных изменений.
Каковы прогнозы?

К сожалению, прогнозы для пациентов с подобным диагнозом неутешительные. Болезнь Пика — проблема крайне серьезная, и на сегодняшний день не существует способов остановить разрушение нейронов. Тем не менее использование подходящих препаратов, качественная реабилитация помогают замедлить процесс, сохраняя качество жизни пациента.
Но, согласно статистике, в течение 5 – 10 лет болезнь приводит к психическому и моральному разложению личности — у пациентов развивается слабоумие, маразм, кахексия и т.д. Такие больные должны находиться под постоянным присмотром, желательно — в специализированных клиниках, где за ними будут постоянно следить медицинские сотрудники.
Синдром Нимана – Пика и его отличия

Современной медицине известно и еще один недуг со схожим названием — болезнь Нимана – Пика. На самом деле это разные заболевание, которые не стоит путать. Если синдром Пика возникает в пожилом возрасте и связан с расстройствами в работе нервной системы, то болезнь Нимана, наоборот, встречается с детском возрасте и связана с нарушением нормального обмена липидов в организме.
Это заболевание носит наследственный характер. Сбой в метаболизме приводит к тому, что липиды начинают накапливаться в таких органах, как печень, костный мозг, селезенка, легкие, а иногда и головной мозг.
Основные формы болезни Нимана – Пика
Болезнь Нимана – Пика, как правило, диагностируется на первом году жизни. Подобный недуг может протекать по-разному и в современной медицине выделяют три основных формы:
- Тип А — это острая нейропатическая форма заболевания, которая, как правило, проявляется в раннем детстве. При этом липиды скапливаются во внутренних органах и нервной системе, что приводит к ряду тяжелых расстройств. Например, уже спустя несколько месяцев после рождения у ребенка можно отметить трудности с кормлением, гипотрофию, значительно увеличение печени и селезенки. Дети истощены. Можно заметить характерно выступающий живот. Постепенно проявляются и реакции со стороны нервной системы — отсутствие нормальных рефлексов, остановка моторного развития, мышечная гипотония, потеря интереса к окружаемому миру. Как правило, больные дети не доживают до трехлетнего возраста.
- Тип В характеризуется более смазанной картиной. При такой форме заболевания поражение нервной системы отсутствует — липиды скапливаются в основном в печени, селезенке и тканях легких. Из-за этого у детей наблюдается задержка развития органов дыхательной системы, а также склонность к различным воспалительным и инфекционным заболеваниям дыхательных путей. Тем не менее пациенты при правильном лечении доживают до взрослого возраста. Именно так выглядит болезнь Нимана – Пика.
- Тип С в отличие от остальных, может диагностироваться как в детском, так и в зрелом возрасте. При данной форме заболевания также наблюдается поражение висцеральных органов и нервной системы.
Методы лечения синдрома Нимана – Пика

Для начала стоит отметить, что подобное заболевание носит наследственный характер и связано с генетической мутацией. К сожалению, эффективные методы терапии на сегодняшний день не разработаны. Болезнь Нимана – Пика у детей лечат с помощью переливания крови, внутривенного введения белковых растворов, а также приема мультивитаминных комплексов. Подобная терапия позволяет добиться некоторых улучшений, но не нормализирует метаболизм и сопряженные с болезнью изменения.
Прогноз для больных неутешительный – сначала ребенок регрессирует и уже не в состоянии сам позаботиться о себе. Пациенты, как правило, умирают по достижении 15 – 17-летнего возраста. Некоторые больные доживают до 30 лет, но подобное встречается редко.
www.syl.ru
"Болезнь Ниманна-Пика тип С. Клинические примеры"
Выдержка из работы
Редкие болезниС.В. Михайлова1, Е.Ю. Захарова2, Т.М. Букина2, Д.А. Савин1, С.В. Пилия1, А.С. Петрухин11 Российская детская клиническая больница, Москва2 Медико-генетический научный центр, МоскваБолезнь Ниманна-Пика тип С. Клинические примерыКонтактная информация:Михайлова Светлана Витальевна, кандидат медицинских наук, врач-невролог отделения психоневрологии № 2 РДКБ Адрес: 117 513, Москва, Ленинский проспект, д. 117, тел.: (495) 936−94−29 Статья поступила: 14. 03. 2010 г., принята к печати: 14. 09. 2010 г.Болезнь Ниманна-Пика тип С (НПС) — наследственное прогрессирующее заболевание нервной системы из группы лизосомных болезней накопления, возникающее в результате нарушения внутриклеточного распределения липидов, что приводит к накоплению холестерина и гликосфинголипидов в головном мозге и других тканях организма. Клиническая картина болезни многообразна и проявляется в виде прогрессирующих мозжечковых когнитивных нарушений, вертикального офтальмопареза, нередко сочетается с поражением печени, селезенки и легких. В данной статье изложены основные механизмы патогенеза болезни Ниманна-Пика тип С, ведущие клинические проявления в зависимости от сроков манифестации заболевания и основные подходы терапии. Авторами описывается два случая этого заболевания, выявленных в России. Приводится сравнительная клиническая характеристика течения болезни у этих пациентов с проявлениями болезни, опубликованными ранее в литературе. В настоящее время разработано патогенетическое лечение, поэтому своевременное выявление данной патологии имеет важное значение для семьи, в которой есть ребенок с болезнью НПС.Ключевые слова: нейродегенеративные заболевания, болезнь Ниманна-Пика тип С, судороги, атаксия, вертикальный офтальмопарез, утрата приобретенных навыков, дифференциальная диагностика, дети.Среди лизосомных болезней накопления болезнь Ниманна-Пика тип С (НПС) является уникальной нозологической формой. В отличие от других заболеваний из этой группы, которые в основном связаны с нарушением активности фермента, при НПС происходит нарушение сортировки («sorting») молекул внутри клетки [1]. НПС относится к мультисистемной патологии, при которой в патологический процесс вовлекаются нервная система, печень, селезенка и легкие. Клиническаякартина НПС довольно сильно различается у отдельных больных по набору основных симптомов и динамике формирования клинического фенотипа [2−4]. НПС часто протекает под масками подострого склерозирующе-го панэнцефалита, внутриутробной инфекции, онкологических и дегенеративных заболеваний нервной системы. Понимание основных механизмов патогенеза болезни, клинической картины и нейрорадиологических данных позволяет избежать диагностических ошибок.S.V. Mikhailova1, E. Yu. Zakharova2, T.M. Bukina2, D.A. Savin1, S.V. Piliya1, A.S. Petrukhin11 Russian Children'-s Clinical Hospital, Moscow2 State Institution Medical Genetic Research Center, MoscowNimann-Pick type C disease. Clinical case studiesNimann-Pick Type C Disease is a hereditary progressive disease of the nervous system from the group of lysosomal accumulation diseases resulting from abnormal subcellular lipid distribution, which leads to the accumulation of cholesterol and glycosphingolipid in the brain and other body tissues. Clinical presentation of the disease is varied and manifested as progressive cerebellar, cognitive disorders, vertical ophthalmoparesis, frequently combined with disorders of the liver, spleen and lungs. This article outlines the key mechanisms of Nimann-Pick type C disease pathogenesis, leading clinical presentations depending on the time the disease manifested itself and key therapy approaches. We described two cases of this disease registered in Russia. It provides a comparative clinical analysis with already published data. To date, a pathogenetic treatment course has been developed for this disease, a timely detection of this pathology is, therefore, important to the burdened family. This representative article on modern data on diagnostics and treatment of NPC is intended for neurologists, pediatricians, psychiatrists and geneticists.Key words: neurodegenerative disease, Nimann-Pick type C disease, convulsions, ataxia, vertical ophthalmoparesis, loss of acquired skills.Хотелось бы подчеркнуть, что НПС относится к той группе наследственных заболеваний, для которых разработаны специфические методы терапии, однако, эффективность лечения во многом зависит от сроков установления правильного диагноза и времени назначения патогенетической терапии.Историческая справкаВ 1961 г. впервые Crocker разделил болезнь Ниманна-Пика на 4 клинических фенотипа (типы А, В, С, D). До открытия молекулярно-генетического дефекта считалось, что все они обусловлены мутациями в гене сфин-гомиелиназы. В конце 1990-х годов были картированы гены NPC1 и NPC2, мутации, которые приводят к болезни Ниманна-Пика тип С (НПС) [5].Этиология и патогенезБолезнь Ниманна-Пика тип С — генетически гетерогенное аутосомно-рецессивное заболевание из группы лизосомных болезней накопления, обусловленное мутациями генов NPC1 и NPC2. Показано, что в 95% случаев болезнь НПС связана с мутациями гена NPC1 (локус 18q11-q12), около 4% случаев — с мутациями гена NPC2 (локус 14q24), в 1% - молекулярногенетический дефект идентифицировать не удается [5]. Ген NPC1 кодирует мембранный, стерол-чувствительный белок, содержащий 13 трансмембранных доменов. Этот белок локализован в эндосомах [6]. Про функции этого белка известно мало, но совершенно очевидно, что он играет важную роль в сортировке (распределении) холестерина и некоторых гликосфинголипидов внутри клетки [5, 7]. Для выполнения своих функций он тесно взаимодействует с NPC2 — небольшим белком, который имеет очень высокое сродство к холестерину [8]. Этот «тандем» белков, вероятнее всего, распределяет холестерин посредством челночного механизма. При мутациях в генах NPC1 и NPC2 происходит накопление неэстерифицированного холестерина, GM2 и GM3 ган-глиозидов, глюкозилцерамида и других гликосфинголипидов [9]. При этом холестерин накапливается в лизо-сомах в очень больших концентрациях, что, вероятно, приводит к нарушению его встраивания в мембраны клетки, следствием чего является нарушение их функции, что и запускает процессы апоптотической гибели клетки [10]. Кроме того, внутрилизосомное накопление холестерина ингибирует активность сфингомиелиназы (до 20% от нормы) и приводит к накоплению сфинго-миелина в клетках паренхиматозных органов (печени, селезенки, почках) и нервной системе. При микроскопическом исследовании во всех органах выявляют «пенистые» клетки — так называемые клетки Ниманна-Пика. При использовании специфических окрасок цитоплазма гистиоцитов приобретает цвет морской волны («sea-blue histiocytes») из-за отложения липопигмента или цероида. Однако, эти клетки не так типичны для болезни Ниманна-Пика тип С, как для типов, А и В [5].КлассификацияК настоящему моменту на основании молекулярногенетического дефекта выделяют два типа заболевания: болезнь Ниманна-Пика тип С 1-го типа и болезнь Ниманна-Пика тип С 2-го типа. Первоначально выделяли в отдельную форму болезнь Ниманна-Пика тип D — заболевание, выявляемое в изолятах Новой Шотландии, но в дальнейшем было показано, что причиной этой формы заболевания также являются мутации гена NPC1 [1, 11].ЭпидемиологияНПС относится к числу редких наследственных болезней обмена веществ. Заболевание распространено повсеместно. Частота заболевания 1: 120 000−1: 150 000 живых новорожденных. Высокая частота болезни НПС 1-го типа отмечена среди некоторых генетических изолятов: французской колонии Акадия (Новая Шотландия), групп бедуинов в Израиле, испанских поселений в Колорадо и Нью-Мексико (США), что связано с эффектом основателя [5].Клинические проявления болезни Ниманна-Пика тип СЗаболевание может проявиться в любом возрасте — от внутриутробного до шестого десятилетия жизни, с пиком манифестации в детстве. В зависимости от возраста дебюта НПС различают несколько форм болезни, различающихся по типу течения и продолжительности жизни пациента: неонатальная, младенческая, поздняя младенческая, юношеская и взрослая формы [5]. Неонатальная форма. В неонатальном периоде НПС нередко дебютирует внутриутробной водянкой плода. У большинства больных основными и ведущими симптомами являются мышечная гипотония и задержка психомоторного развития. В половине случаев у таких пациентов отмечается поражение печени с развитием внутрипеченочного холестаза и гепатоспленомега-лии. Редко заболевание имеет молниеносное течение с развитием тяжелой формы холестатической желтухи и неблагоприятным исходом на первом полугодии жизни от печеночной недостаточности. Выраженность клинической картины и отдельных симптомов меняется с возрастом. Так, у большинства пациентов желтуха и гепато-спленомегалия с возрастом исчезают почти полностью, но прогрессируют задержка психомоторного развития и интеллектуальные нарушения. Редко у таких пациентов развивается дыхательная недостаточность [2, 5]. Младенческая форма. Основные клинические симптомы НПС появляются на первом году жизни. В таких случаях обычно выявляют гепатоспленомегалию, задержку психомоторного развития, мышечную гипотонию. Большинство пациентов никогда не приобретает навыки самостоятельной ходьбы. Интеллектуальное развитие обычно не страдает. По мере прогрессирования заболевания происходит вовлечение в патологический процесс пирамидной системы и происходит постепенное снижение когнитивных функций [5].Поздняя младенческая форма. НПС в 60−70% случаев обычно манифестирует в позднем младенческом и юношеском возрасте. Первыми клиническими симптомами этой формы являются мозжечковые расстройства (шаткость при ходьбе, дизартрия, дисметрия), которые обычно проявляются в возрасте 3−5 лет. Практически у всех пациентов наблюдается гепатоспленомегалия различной степени выраженности, но в 10% случаев данный симптом может отсутствовать. Как при поздней младенческой, так и при юношеской формах заболевания, по мере развития болезни практически у всех пациентов развивается вертикальный супрануклеарный офтальмопарез [12]. На начальных этапах болезни происходит замедление движения глазных яблок по вертикали, постепенно прогрессирующее до полного ограничения вертикального, а иногда горизонтального взора. Нередко отмечается задержка речевого развития. По мере прогрессирования болезни происходит постепенная утрата ранее приобретенных двигательных навыков, становятся заметными интеллектуальные нарушения, появляются дисфагия и дизартрия. Иногда развивается демиелинизирущая периферическая полиневропатия [13]. НеблагоприятныйПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2010/ ТОМ 7/ № 5Редкие болезниисход при поздней младенческой форме обычно наступает в первую декаду жизни.Юношеская форма. При юношеской форме НПС начальные симптомы обычно появляются в возрасте от 6 до 15 лет. Первыми симптомами являются нарушения усвоения школьного материала, письма, снижение внимания, памяти, гиперактивное поведение, что приводит к установлению неправильного диагноза. В некоторых случаях заболевание манифестирует с психиатрических нарушений, таких как нарушение поведения, шизофре-ноподобный синдром, депрессия [11]. В 20% случаев наблюдается геластическая катаплексия, которая характеризуется кратковременной приступообразной утратой мышечного тонуса, приводящей к падению больного без потери сознания и нередко возникает на фоне сильных эмоциональных реакций (часто во время смеха) [14]. Со временем прогрессируют мозжечковые расстройства, появляется дисфагия, дизартрия и ухудшается интеллектуальное развитие. Частыми симптомами НПС являются экстрапирамидные расстройства в виде различных дисто-нических гиперкинезов. В половине случаев развиваются фокальные и/или генерализованные эпилептические приступы, трудно поддающиеся адекватной антиэпилепти-ческой терапии. На поздних стадиях НПС нарастают пирамидные нарушения в виде повышения мышечного тонуса, оживления сухожильных рефлексов, появления патологических рефлексов, бульбарно-псевдобульбарного синдрома, развиваются деменция, децеребрационная или декортикационная ригидность. Обычно гепатоспленоме-галия не наблюдается. Неблагоприятный исход обычно развивается в конце второго — на третьем десятилетии жизни, обычно от интеркуррентных инфекций [5]. Взрослая форма. Манифестные симптомы НПС появляются в возрасте старше 50 лет [5]. У таких пациентов отмечается медленно-прогрессирующее течение болезни. Постепенно развиваются мозжечковые расстройства (атаксия, дизартрия, дисметрия), мышечная дистония, различной степени выраженности интеллектуальные расстройства. Нередко у взрослых болезнь НПС манифестирует с развития биполярных расстройств [15]. При этой форме редко развиваются эпилептические приступы, обычно не наблюдаются увеличение селезенки и вертикальный надъядерный офтальмопарез.Дополнительные методы исследованияКак правило, при МРТ головного мозга на начальных стадиях патологического процесса патология не обнаруживается. По мере прогрессирования заболевания обычно наблюдают кортикальную и субкортикальную атрофию, атрофию мозжечка и перивентрикулярную лейкопатию [12, 16].При компьютерной электроэнцефалографии регистрируют диффузное замедление биоэлектрической активности, эпилептическую активность [2, 5].Лабораторная диагностикаЛабораторная диагностика НПС вызывает большие сложности. Специфичный гистохимический признак болезни Ниманна-Пика — накопление неэстерифицированного холестерина в лизосомах (нагрузочный тест с филипи-ном). При окрашивании культуры клеток филипином наблюдаются интенсивные флюоресцирующие области, сконцентрированные вокруг ядра клетки, которые соответствуют накоплению неэстерифицированного холестерина. Именно на его обнаружении в клетках крови плода, ворсинах хориона или амниотических клетках основана биохимическая диагностика заболевания.Дополнительными биохимическими маркерами могут быть: снижение активности сфингомиелиназы в лейкоцитах крови (20−30% от нормы), повышение активности маркерного фермента лизосом — хитотриозидазы в плазме крови. ДНК-диагностика является наиболее предпочтительным методом верификации диагноза. Описано несколько относительно распространенных мутаций в гене N901, которые локализованы в 20−22 экзонах гена N901, но в большинстве случаев требуется полное секвенирование генов N901 и N902 для выявления мутаций. Информативность такого тестирования составляет около 94% [2].Генно-фенотипические корреляцииВ гене N901 описано более 200 мутаций, при этом анализ генно-фенотипических корреляций затруднителен, поскольку подавляющее большинство больных являются компаунд-гетерозиготами, но у репрезентативных выборок пациентов некоторые закономерности выявить удалось. Например, показано, что при инфантильной форме заболевания характерны нонсенс-мутации (приводящие к появлению стоп-кодона), мутации в области стерол-чувствительного домена и замена р. А1а1054ТИг, а мутация р. Ие1061ТИг никогда не встречается у пациентов с этой формой болезни [17]. При молекулярно-генетическом тетстировании 40 пациентов испанского происхождения выявлено, что аллель р. Сув177Туг в гомозиготном состоянии приводит к поздней форме болезни с классическими неврологическими проявлениями. Для гена N902 провести такой анализ не представляется возможным, поскольку описаны единичные больные с мутациями в данном гене. Неонатальная и младенческая формы заболевания были описаны у пациентов, имеющих нонсенс-мутации р^!п45Х, р. Сув47Х в гомозиготном состоянии, взрослая форма болезни — при мутациях р^а!39Ме1 и р^ег67Рго в гомозиготном состоянии [18−20].Дифференциальная диагностикаВ связи с выраженным клиническим полиморфизмом и неспецифичностью ранних проявлений дифференциальную диагностику необходимо проводить с большим числом заболеваний как наследственной, так и ненаследственной природы. При манифестации болезни в раннем возрасте дифференциальный диагноз проводится с атре-зией желчевыводящих путей, внутриутробными инфекциями, наследственными болезнями обмена веществ (тирозинемией, недостаточностью альфа 1 антитрипсина, болезнью Гоше, болезнью Ниманна-Пика тип А/В, митохондриальными гепатопатиями), онкологическими заболеваниями (лимфомой, гистиоцитозом) [21]. При поздней манифестации НПС дифференциацию следует проводить с объемным образованием головного мозга, лизосомны-ми болезнями накопленият2 ганглиозидозом, болезнью Гоше), идиопатической формой торсионной дистонии, болезнью Вильсона-Коновалова, митохондриальными и психиатрическими заболеваниями.ЛечениеПри болезни НПС многочисленные попытки симптоматической медикаментозной и диетической коррекции липидного обмена, а также трансплантация гемопоэти-ческих стволовых клеток или печени не привели к значительному успеху. В последнее время появились данные о положительном эффекте субстрат-редуцирующей терапии препаратом миглустат (Завеска, Актелион, Швейцария). Данный препарат ингибирует гликозилце-рамидсинтазу — фермент, который катализирует первуюстадию синтеза гликосфинголипидов и тем самым может препятствовать их накоплению. Важным достоинством миглустата является способность проникать через гема-тоэнцефалический барьер. Препарат назначают перорально, и он разрешен к применению с 4-летнего возраста. Рекомендуемая доза для взрослых и детей старше 12 лет составляет 200 мг 3 раза в день. Детям в возрасте от 4 до 11 лет доза рассчитывается в соответствии с площадью поверхности тела [22−23].Всем пациентам показано проведение симптоматической терапии. При катаплексии назначают трициклические антидепрессанты, при дистонии — антихолинэргические препараты, при эпилептических приступах — антиэпилеп-тические средства.Результаты собственных наблюденийЗа период 2009—2010 гг. нами было обследовано 11 пациентов с подозрением на НПС в возрасте от 2 до 15 лет. Критериями включения в исследование были прогрессирующие неврологические нарушения в сочетании с поражением внутренних органов или без таковых, а также повышение активности маркерного фермента лизосом — хитотриозидазы в плазме крови. Всем пациентам, включенным в исследование, был проведен полный анализ гена NPC1 методом прямого секве-нирования. У двух пациентов были обнаружены мутации в гене NPC1, что позволило подтвердить предполагаемый диагноз.Один пациент находился на стационарном лечении и прошел тщательное клиническое и лабораторное обследование- второй больной обследовался амбулаторно, а представленные с места жительства выписки о развитии болезни были недостаточно информативны. В связи с редкой встречаемостью данной патологии, каждый случай этого заболевания важен для более полного представления о клиническом разнообразии этой наследственной патологии.Клинические примерыБольной Б., 9 лет, поступил в стационар с жалобами на шаткость походки, частые падения, прихрамывание при ходьбе («тянет левую ногу»), нарушение мелкой моторики, появление атетоидных гиперкинезов в конечностях, нарушение речи, снижение памяти и утомляемость. Из анамнеза известно, что ребенок от нормально протекавшей беременности, родов в срок путем кесарева сечения. Физическое развитие в раннем возрасте соответствовало средним значениям. Наследственность не отягощена. Профилактические прививки проводились по календарю. В возрасте 5 лет на фоне полного здоровья у мальчика появились жалобы на приступы головокружений. В 7 лет родители стали обращать внимание на присоединение неуверенной походки с тенденцией к пошатыванию и падению влево, общую вялость, нарастающее снижение памяти, заикание. Стали появляться трудности в учебе («плохие дни»). Обследовался по месту жительства. По данным МРТ головного мозга — диффузные субатрофические корко-подкорковые изменения вещества мозга. Желудочковая система умеренно вторично расширена, S = D. Ликвородинамика компенсирована. В перивентрикулярном белом веществе, преимущественно теменных регионов отмечаются зоны повышения МР сигнала на Т2 ВИ и режиме FLAIR, характерные для лейкопатии. При проведении МР венографии с внутривенным контрастным усилением синусы проходимы, однако можно отметить некоторое сужение просвета левого поперечного синуса. Данные компьютернойэлектроэнцефалографии (КЭЭГ) выраженных изменений не выявили. Курсами проводилась метаболическая, ноо-тропная терапия с некоторой положительной динамикой в виде улучшения координаторных функций, уменьшения вестибулярных нарушений. По окончании курса лечения родители отмечали быстрый регресс положительной динамики, нарастание координаторных и речевых нарушений, появление прихрамывания на левую ногу.При осмотре на момент поступления: гиперстеническое телосложение, повышенное питание. Кожные покровы бледные, видимые слизистые оболочки чистые. В легких везикулярное дыхание проводится во все отделы, хрипов нет. Тоны сердца ясные, ритм правильный. Живот мягкий, безболезненный. Печень, селезенка — не увеличены. Стул, диурез не нарушены.Неврологический статус: ребенок в сознании, ориентирован, несколько негативен к осмотру, плаксив, инструкции выполняет, правильно отвечает на вопросы. Общемозговых, менингеальных симптомов не выявляется. Обоняние сохранено, зрение не исследовано. Глазные щели асимметричны (справа шире), нарушения движения глазных яблок в виде ограничения по вертикали, проявляющиеся только при спонтанных движениях, а не при слежении за неврологическим молоточком, точки выхода тройничного нерва безболезненные. Лицо симметричное. Выявляется горизонтальный мелкоамплитудный нистагм в крайнем левом отведении. Небная занавеска подвижна. Мозжечковая дизартрия. Дисфонии, дисфагии — нет. Небный и глоточный рефлексы повышены. Повороты головы в полном объеме. Язык по средней линии.При исследовании рефлекторно-двигательной сферы отмечается изменение походки, элементы гемипареза. Мышечная дистония с 2-х сторон, сухожильные рефлексы высокие, без четкой разницы сторон. Сила мышц снижена до 4-х баллов. Положительный симптом Бабинского с двух сторон, больше слева.Координаторная сфера: в позе Ромберга пошатывается. Пальце-носовую, пальце-молоточковую пробы выполняет с интенцией, гиперметрией. Чувствительных нарушений не выявлено. Тазовых, вегетативных расстройств не отмечается.Высшие корковые функции: объем навыков, знаний представляется сниженным.Лабораторные исследованияВ общих анализах крови и мочи патология не выявлена. Биохимический анализ крови: АСТ-55 (норма10−42) Ед/л, Са (ионизированный) — 1,17 (норма 0,98−1,13) моль/л. В цереброспинальной жидкости: цитоз 2,7Х103, белок 0,3 (норма 0,08−0,42) г/л, глюкоза 2,86 (норма 3,33−4,44) ммоль/л, в цитопрепарате — 74 сохранные клетки: моноциты (23) + макрофаги (51). Иммунологлобулины крови в пределах возрастной нормы. Анализ крови на а-фетопротеин — 1,4 МЕ/мл (норма 0−9,5). Лактат сыворотки крови натощак и после нагрузки: 2,4 ммоль/л и 1,6 ммоль/л, соответственно. Анализ ликвора на лактат после нагрузки: 1,5 ммоль/л. Магнитно-резонансная томография (МРТ) головного мозга: на представленных МР изображениях в сравнении с ранее проведенным исследованием можно отметить некоторое повышение МР сигнала на Т2 ВИ и режиме FLAIR от перивентрикулярного белого вещества с утрированием ранее выявленных зон лейкопатии в теменных областях. Степень атрофических изменений и вентрикулярная геометрия остаются прежними.По данным КЭЭГ, в конвекситальных отделах полушарий регистрируются диффузные общемозговые измененияПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2010/ ТОМ 7/ № 5Редкие болезнибиоэлектрической активности, проявляющиеся в виде дизритмии и дезорганизации корковой ритмики, отсутствия регулярного основного а-ритма в задних отделах полушарий, доминировании медленных форм активности тета-диапазона по всем отделам конвекса, усиливающихся при выполнении HV пробы. РФС: фотопароксизмаль-ной реакции в коре больших полушарий не выявляется. Ультразвуковое исследование брюшной полости: печень не увеличена, контуры ровные, паренхима однородная, эхогенность обычная, подчеркнут сосудистый рисунок, хвостатая доля не изменена- поджелудочная железа умеренно увеличена в хвосте, 18x7x22 мм, контуры ровные, паренхима умеренно неоднородная, вирсунгов проток не расширен- желчный пузырь обычной формы, в просвете пристеночный осадок, стенки плотные, холедох не расширен- селезенка соответствует возрасту, структура зернистая- почки расположены обычно, контуры ровные, размеры соответствуют возрастной норме, паренхима — дифференцировка и васкуляризация сохранены, чашечно-лоханочная система не расширена, стенки уплотнены.Исследование зрительных вызванных потенциалов: на реверсивный паттерн регистрируются признаки дисфункции проведения возбуждения в центральных отделах зрительной афферентной системы с двух сторон, больше слева, проявляющиеся увеличением латентности основного компонента Р100 при стимуляции левого глаза до 115 мс, при стимуляции правого глаза — до 109 мс по сравнению с нормой.На рентгенограмме легких в прямой проекции легочные поля одинаковой прозрачности, легкие вздуты. Легочный рисунок не изменен, корни структурны, не расширены, не уплотнены, рисунок их не изменен. Тень средостения не расширена, расположена срединно. Тень сердца не изменена, не расширена. Костальная плевра не изменена. Плевральные синусы свободны. Диафрагма с четкими, ровными контурами, расположена обычно.Данный клинический случай НПС, безусловно, классический с дебютом в детском возрасте (поздняя младенческая форма). Учитывая возраст начала болезни (5 лет), прогредиентное течение, данные клинического осмотра: мозжечковый синдром, левосторонний гемипарез, полиневропатию- данные дополнительных исследований — МРТ головного мозга (корково-подкорковая субатрофия полушарий большого мозга, субатрофия мозжечка, негрубая лейкопатия) дифференциальный диагноз проводился с наследственными нейродегенеративными заболеваниями, такими как Gm2 ганглиозидоз, болезнь Фридрейха, атаксия-окуломоторная апраксия, синдромом Луи-Бар, а также с митохондриальными болезнями.Так же, как и в данном случае, при болезни Фридрейха и Gm2 ганглиозидозе первым симптомом болезни является расстройство походки — неустойчивость, неловкость при быстрой ходьбе и беге. Постепенно к нарушению ходьбы и неустойчивости в позе Ромберга присоединяется интенционный тремор, дискоординация в руках. Расстройства речи возникают рано и носят сложный мозжечково-дизартрический характер. При классической форме атаксии Фридрейха, в отличие от болезни НПС, часто развивается сухожильная арефлексия, которая является ранним и специфическим симптомом болезни- возникает нарушение суставно-мышечной и вибрационной чувствительности. Данных симптомов у пациента отмечено не было. Болезнь Фридрейха так же, как и НПС, относится к мультисистемной патологии, однако набор клинических проявлений при этих заболеваниях значительно отличается. Характерным для болезни Фридрейхаявляется вовлечение в патологический процесс костной системы с формированием так называемой «стопы Фридрейха" — нередко отмечаются кифосколиоз, кардио-миопатия и различные эндокринные нарушения. По данным литературы, при поздних формах 0т2 ганглиозидоза обычно развиваются различные типы эпилептических приступов (генерализованные тонико-клонические, мио-клонические), резистентные к антиэпилептической терапии, что не было зарегистрировано в нашем случае [2]. Неврологически неотличимыми от НПС заболеваниями являются атаксия-окуломоторная апраксия и синдром Луи-Бар. Также, как и НПС, атаксия-окуломоторная апраксия дебютирует в раннем детском возрасте. Начальными симптомами атаксии-окуломоторной апраксии являются мозжечковые расстройства, со временем присоединяется апраксия глазодвигательной мускулатуры, часто развивается полиневропатия. В отличие от НПС при синдроме Луи-Бар обнаруживают повышение уровня а-фетопротеина и изменения иммуноглобулинов основных классов [24].Дифференциальный диагноз проводился также с митохондриальной патологией, в частности с синдромом прогрессирующей наружной офтальмоплегии, при которой помимо появления глазодвигательных нарушений (как у нашего пациента) наблюдаются птоз, мышечная слабость в проксимальных отделах конечностей, повышение уровня лактата в крови и цереброспинальной жидкости. Одна из мутаций, выявленных у нашего пациента — замена цитозина на тимин в положении 2861 приводит к замене аминокислоты Ser954Leu и относится к числу мутаций, значительно нарушающих функции белка. Второй мутантный аллель — с. 3614с1еЮ является новой мутацией, но, можно предположить, что он также существенно влияет на функцию белка, поскольку приводит к сдвигу рамки считывания.Таким образом, в данном случае тщательный сбор анамнеза, выявление последовательности появления основных симптомов стали основными критериями, на основании которых появилась возможность предположить клинический диагноз.Больная Б., 5 лет. Родители обратились в поликлиническое отделение с жалобами на задержку психомоторного развития и увеличение размеров печени и селезенки.Из анамнеза известно, что ребенок от второй беременности, протекавшей без особенностей, вторых срочных самостоятельных родов. Наследственность не отягощена. Профилактические прививки проведены по календарю. На первом году жизни наблюдалась у ортопеда по поводу дисплазии тазобедренных суставов. Со слов родителей, к возрасту полутора лет стала заметна задержка психомоторного развития, при обследовании по месту жительства ребенку был установлен диагноз: детский церебральный паралич. Девочке проводилась реабилитационная терапия без явного положительного эффекта. В возрасте 3 лет при проведении ультразвукового исследования органов брюшной полости было обнаружено увеличение размеров печени и селезенки, в связи с чем ребенок проходил обследование и лечение в гематологическом отделении. С диагностической целью была проведена пункция костного мозга, в которой были выявлены клетки Гоше, что позволило заподозрить заболевание из группы лизосомных болезней накопления.При осмотре на момент поступления состояние очень тяжелое. Кожные покровы сухие, чистые. Сердечные тоны приглушены, отмечается систолический шум в V точ-ке. Аускультативно в легких дыхание жесткое, проводится во все отделы. Печень увеличена: + 3 см, +4 см, +4 см из-под края реберной дуги, край плотный, селезенка +6 см из-под края реберной дуги, край эластичный. Стул, диурез не нарушены.В неврологическом статусе: общемозговых и менинге-альных симптомов нет. Взор фиксирует и прослеживает, движения глазных яблок в полном объеме, лицо симметричное, глоточные и небные рефлексы снижены, дис-фагия и дисфония. Голову не держит, не сидит, не ходит. Мышечная гипотония. Контрактуры крупных суставов. В сознании, задержка психомоторного развития, не говорит, окружающим не интересуется.Лабораторные исследования: в общем анализе крови — гемоглобин 98 г/л, эритроциты 3,6×1012/л, цветовой показатель 0,81, тромбоциты 198×109/л, лейкоциты 5,0×109/л, палочкоядерные 1%, сегментоядерные 45%, эозинофилы 1%, лимфоциты 44%, моноциты 8%, СОЭ 12 мм/ч. В биохимическом анализе крови: АСТ — 55 (10−42) Ед/л, Са (ионизированный) — 1,17 (0,98−1,13) ммоль/л.Данный клинический случай иллюстрирует сложности дифференциальной диагностики НПС. Учитывая раннюю манифестацию болезни (на первом году жизни), прогрессирующее течение болезни, данные клинического осмотра (гепатолиенальный синдром, задержка психомоторного развития), дополнительных данных (наличие клеток Гоше в пунктате костного мозга), дифференциальныйдиагноз, в первую очередь, проводился с заболеваниями из группы лизосомных болезней накопления, протекающими с гепатоспленомегалией и неврологическими нарушениями (болезнью Гоше, болезнью Ниманна-Пика тип А/В, ганглиозидозами). При проведении исследований был выявлен высокий уровень хитотриозидазы (950 ммоль/мл в ч, при норме до 198 ммоль/мл в ч). Именно эта находка и послужила основанием для поиска причин болезни среди других, более редких форм лизо-сомных болезней накопления. Интересно, что у пациента Б., также была выявлена мутация Ser954Leu в гетерозиготном состоянии, второй мутации мы не обнаружили (вероятно, в связи с недостаточным количеством биологического материала пробанда.ЗаключениеКлиническая диагностика нейродегенеративных болезней представляет значительные трудности, связанные с чрезвычайной редкой встречаемостью отдельных форм, дебютом в любом возрасте, выраженным клиническим полиморфизмом, возможностью атипичного течения. Приоритетную роль в диагностике играют биохимические и молекулярно-генетические методы исследования. В настоящее время для данного заболевания разработано патогенетическое лечение и возможно проведение пренатальной диагностики. Своевременное выявление патологии играет ключевую роль в дальнейшем прогнозе болезни.СПИСОК ЛИТЕРАТУРЫ1. Carstea E. D., Morris J. A., Coleman K. G. et al. Niemann-Pick C1 disease gene: homology to mediators of cholesterol homeostasis // Science. — 1997- 277: 228−312. Краснопольская К. Д. Наследственные болезни обмена веществ. Справочное пособие для врачей. — М.: Москва,2005. — 364 с.: ил.3. Millard E. E., Gale S. E., Dudley N. et al. The sterol-sensing domain of the Niemann-Pick C1 (NPC1) protein regulates trafficking of low density lipoprotein cholesterol // J. Biol. Chem. — 2005- 280: 28 581−90.4. Zervas M., Somers K. L., Thrall M. A. et al. Critical role for glycosphingolipids in Niemann-Pick disease type C // Curr. Biol. — 2001- 11: 1283−7.5. Scriver C. R. et al. (eds). The Metabolic and Molecular Bases of Inherited Diseases (McGraw-Hill). — New York, 2005.6. Strauss J. F., Liu P., Christenson L.K. et al. Sterols andintracellular vesicular trafficking: lessons from the study of NPC1 // Steroids. — 2002- 67: 947−51.7. Greer W. L., Dobson M. J., Girouard G. S. et al. Mutations in NPC1 highlight a conserved NPC1-specific cysteine-rich domain // Am. J. Hum. Genet. — 1999- 65: 1252−60.8. Vanier M. T., Millat G. Structure and function of theNPC2 protein // Biochim. Biophys. Acta. — 2004- 1685: 14−21.9. Millat G., Marcais C., Rafi M. A. et al. Niemann-Pick C1disease: the I1061T substitution is a frequent mutant allelein patients of Western European descent and correlates with a classic juvenile phenotype // Am. J. Hum. Genet. — 1999- 65: 1321−9.10. Millat G., Marcais C., Tomasetto C. et al Lipid and cholesterol trafficking in NPC // Biochim. Biophys. Acta. — 2004- 1685: 28−37.11. Imrie J., Vijayaraghaven S., Whitehouse C. et al. Niemann-Pick disease type C in adults // J. Inherit. Metab. Dis. — 2002- 25: 491−500.12. Tedeschi G., Bonavita S., Barton N. W. et al. Proton magnetic resonance spectroscopic imaging in the clinical evaluation of patients with Niemann-Pick type C disease // J. Neurol. Neurosurg. Psychiatry. — 1998- 65: 72−9.13. Zafeiriou D. I., Triantafyllou P, Gombakis N. P et al. Niemann-Pick type C disease associated with peripheral neuropathy // Pediatr. Neurol. — 2003- 29: 242−4.14. Kanbayashi T., Abe M., Fujimoto S. et al. Hypocretin deficiency in niemann-pick type C with cataplexy // Neuropediatrics. — 2003- 34: 52−3.15. Sullivan D., Walterfang M., Velakoulis D. Bipolar disorder and Niemann-Pick disease type C // Am. J. Psychiatry. — 2005- 162: 1021−2.16. Grau A. J., Brandt T., Weisbrod M. et al. Adult Niemann-Pick disease type C mimicking features of multiple sclerosis // J. Neurol. Neurosurg. Psychiatry. — 1997- 63: 552.17. Millat G., Chikh K., Naureckiene S. et al. Niemann-Pick disease type C: spectrum of HE1 mutations and genotype/phenotype correlations in the NPC2 group // Am. J. Hum. Genet. — 2001- 69: 1013−21.18. Chikh K., Rodriguez C., Vey S. et al. Niemann-Pick type C disease: subcellular location and functional characterization of NPC2 proteins with naturally occurring missense mutations // Hum. Mutat. — 2005- 26: 20−8.19. Fernandez-Valero E. M., Ballart A., Iturriaga C. et al. Identification of 25 new mutations in 40 unrelated Spanish Niemann-Pick type C patients: genotype-phenotype correlations // Clin. Genet. — 2005- 68: 245−54.20. Park W. D., O'-Brien J. F., Lundquist P A. et al. Identification of 58 novel mutations in Niemann-Pick disease type C: correlation with biochemical phenotype and importance of PTC1-like domains in NPC1 // Hum Mutat. — 2003- 22: 313−25.21. Yerushalmi B., Sokol R. J., Narkewicz M. R. et al. Niemann-pick disease type C in neonatal cholestasis at a North American Center // J. Pediatr. Gastroenterol. Nutr. — 2002- 35: 44−50.22. Patterson M. C., Platt F. Therapy of Niemann-Pick disease, type C // Biochim. Biophys. Acta. — 2004- 1685: 77−82.23. Patterson M. C., Vecchio D., Prady H. et al. Miglustat for treatment of Niemann-Pick C disease: a randomised controlled study // Lancet Neurol. — 2007- 6: 765−72.24. Иллариошкин С. Н., Руденская Г. Е., Иванова-Смоленская И. А. Наследственные атаксии и параплегии. — М: МЕД пресс-информ,2006. — 416 с.ПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2010/ ТОМ 7/ № 5
Показать Свернутьr.bookap.info
"Болезнь Ниманна-Пика тип с глазами матери, медицинской сестры, врача"
Выдержка из работы
фОбучение обучающих — образовательные программы для родителейОт редакцииУважаемые коллеги! Мы продолжаем знакомить вас с редкими болезнями. Появляющиеся у ребенка симптомы, особенно в периоде новорожденности, нередко расцениваются его близкими как симптомы часто встречающихся болезней, свойственных его возрасту. И только профессионал (будь то квалифицированная медицинская сестра или педиатр) может заподозрить патологию и провести дополнительное обследование. Поэтому очень важно объяснить родителям, что необходимо обращаться к врачу за консультацией по поводу любого появившегося отклонения от обычного состояния ребенка. Представляем вам один из вариантов манифестации тяжелой наследственной патологии — болезни Ниманна-Пика тип С.Болезнь Ниманна-Пика тип С глазами матери, медицинской сестры, врачаВ последние годы все чаще диагностируются болезни, которые ранее считались крайне редкими и казуистическими. И дело не столько в том, что они стали встречаться чаще (хотя для некоторых болезней характерна такая тенденция), но и в появлении новых диагностических возможностей, достижениях генетической науки и, самое главное, — в повышении уровня знаний врачей-педиатров, которые первые видят те или иные отклонения в здоровье ребенка.К крайне редкой патологии относится болезнь Ниманна-Пика тип С (НП-С), ее распространенность составляет приблизительно 1: 150 000 новорожденных. Разнородность клинической симптоматики, сложность диагностики заставляют предположить, что реальное число детей с болезнью НП-С много больше, чем уже диагностировано. Поскольку прогноз болезни определяется временем появления неврологической симптоматики, крайне важно как можно раньше выявить болезнь и начать адекватную терапию.В связи с широкой гаммой жалоб, ребенок с болезнью НП-С может оказаться на приеме не только у педиатра, но и у гепатолога, гематолога, невролога или психиатра. Поэтому для успешной диагностики необходимо не только знание проявлений той или иной патологии, но и наличие настороженности у специалистов и чуткого отношения родителей к так называемым обычным, свойственным растущему организму, симптомам. Мама должна проконсультироваться с педиатром по поводу любого ненормального для здорового ребенка признака, будь то вздутие живота в периоде новорожденности, длительной желтухи новорожденных или изменение поведения в более старшем возрасте.Вот что вспоминает мама Калума, мальчика с болезнью НП-С, которому диагноз установили в периоде новорожденности наши британские коллеги: «Мы обратились в больницу, когда ему было три недели. У него был, по крайней мере, тогда мы это так называли, вздутый живот. Все говорили мне, что такое бывает у новорожденных. И я находила объяснение — думала, что живот вздут потому, что малыш только что поел, или что-то в этом роде. Тогда мне казалось, что все просто придираются к моему мальчику, понимаете? И, естественно, потом, после того, как прошло три недели, а живот так и оставался вздутым, я, наконец, отвезла его в больницу. На самом деле, мы отвезли его для того, чтобы проверить его тазобедренные суставы. Когда доктор их проверил, он сказал, что с бедрами все в порядке, но селезенка кажется увеличенной, и УЗИ подтвердило, что селезенка увеличена… Доктор провел все необходимые исследования, проверил печень и почки, так как он (Калум) долго болел желтухой, поэтому эти органы проверяли и перепроверяли. Кажется, ему также прове-ли исследование на наличие патологически измененных эритроцитов, потому что, как я понимаю, они могут приводить к увеличению селезенки, и, разумеется, у моего сына был не тот случай. А потом в феврале нам позвонили, мы поехали в госпиталь, и именно тогда нам впервые сказали об этом. И тогда я онемела с головы до ног. Ты просто немеешь и не можешь ни о чем думать. Я даже не помню, что происходило в течение той недели или двух недель, когда ребенку поставили этот диагноз, потому что я была в оцепенении, я находилась в другом мире.».Вот как описывает болезнь НП-С медицинская сестра специализированного центра по болезни Ниманна-Пика Жакли Имри, наблюдающая всех таких больных в Великобритании: «Обычно сначала дети чувствуют себя достаточно хорошо, потом они начинают постепенно утрачивать свои навыки, они не так хорошо поддаются обучению, как должны были бы. С течением времени они могут потерять способность глотать, принимать пищу. У них развиваются слабоумие, кратковременная потеря памяти, хотя обычно, на финальной стадии, как бы тяжело они не были больны, они все еще узнают членов своих семей. И хотя они не могут с ними говорить, видно, что они знают окружающих их людей, занимающих важное место в их жизни.Одним из типичных проявлений является затянувшаяся желтуха в периоде новорожденности. Все дети переносят желтуху в течение пары дней, но в случае НП-С она длится неделями, иногда месяцами. Обычно у новорожденного проверяют наличие инфекции или обычных заболеваний печени перед тем, как начать подозревать метаболическое нарушение, но в последние годы группа по болезням Ниманна-Пика обратила особое внимание на отделения заболеваний печени и попросила персонал этих отделений исследовать возможность наличия редких метаболических расстройств, если у них на лечении находятся дети с затянувшейся желтухой. Еще одной сложностью является то, что после того, как желтуха была вылечена, может пройти несколько лет до того, как начнут возникать другие симптомы, и они могут быть не слишком очевидными.Часто у таких детей отмечают труднообучаемость или дислексию, их винят в непослушании. Иногда мамам приходится годами настаивать, упрашивать окружающих: «Вы же должны понимать, что с моим ребенком что-то не так, это ненормально!», прежде чем будет поставлен верный диагноз.Дети школьного возраста с болезнью НП-С могут казаться вполне нормальными, а потом вдруг учителя начинают замечать, что они становятся все более неуклюжими, чем их ровесники. Они часто падают (признак атаксии), могут поначалу хорошо учиться в детском саду или школе, а потом начинают постепенно отставать от своих сверстников, и процесс обучения просто останавливается, а потом поворачиваетсяРР2_2010. МС 14922. 04. 2010 23: 36:05149¦¦¦ 1_СГИЛ1 чИ2 5у а1^ 050 и(r) -я1 5«гга& gt-1 о2 «о о ащ2X. вЩн(Паом(Паюовспять. Они могут нормально глотать пищу и пить, а потом вдруг начинают давиться едой или жидкостью.Эту болезнь сложно диагностировать, поэтому в случае таких пациентов, как Калум, приходится долго ждать результаты анализов. Обычно у неврологов или педиатров возникают первые подозрения из-за потери ребенком каких-либо навыков, но для постановки диагноза необходимо сделать биопсию кожи — это занимает около шести недель. Потом нужно, чтобы специальная лаборатория исследовала клетки кожи для постановки диагноза, и после этого мы обычно отправляем пробу во Францию для повторного анализа с тем, чтобы поставить окончательный диагноз. И затем, после проведения анализа, мы можем провести исследование ДНК и попробовать понять, что привело к появлению данного нарушения у конкретного ребенка. «Что же такое НП-С?НП-С — чрезвычайно редкое наследственное заболевание. Представляет собой сфингомиелиновый липидоз, который развивается в результате наследственной недостаточности сфингомиелиназы — фермента, гидролизующего сфингомиелин. Заболевание наследуется по аутосомно-рецессивному типу. Ген сфингомиелиназы локализуется на 11 хромосоме человека в позиции р15. 4-р15.1. Болезнь обусловлена мутацией гена NPC1 (90−95% случаев) или NPC2 (4% случаев).Первые симптомы обычно появляются у детей в возрасте 2−5 лет, но могут появиться и в более старшем возрасте — у подростков и даже у взрослых. Ребенок выглядит неуклюжим, часто падает — первые признаки атаксии и дистонии мышц конечностей. Далее развивается дизартрия, дисфагия, прогрессирующая умственная отсталость, генерализованная дистония, статическая и динамическая атаксия, интенционный тремор, иногда приступы акинезии, появляются судороги. Первые признаки деменции появляются в возрасте 6−8 лет. Кроме того, в этом возрасте появляется специфичный для НП-С признак — спонтанные вертикальные глазодвигательные нарушения. В пубертатном периоде могут развиться психозы. Взрослым пациентам ошибочно может быть поставлен диагноз деменция (слабоумие) или психические нарушения.Болезнь НП-С необратимо прогрессирует и большая часть пациентов умирает в течение 5−10 лет после постановки диагноза- в большинстве случаев пациенты не доживают до подросткового возраста.Диагностика НП-С трудна и длительна- средний возраст постановки диагноза НП-С 10 лет [1], что объясняется редкостью заболевания и, как следствие, отсутствием настороженности врачей, широким спектром клинических проявлений, отсутствием специфических симптомов и зачастую трудностью, либо невозможностью, проведения специфических анализов.В связи с тем, что появилась возможность эффективной субстрат-редуцирующей терапии, возрастает важность ранней диагностики больных и вопросы верификации диагноза в экспертных центрах по НП-С.Когда нужно заподозрить болезнь Ниманна-Пика тип С?Можно выделить ряд признаков, позволяющих предположить наличие у данного пациента болезни НП-С.Пациента рекомендуется направить в экспертный центр по болезни НП-С, если присутствует хотя бы один из следующих симптомов:• глазодвигательные нарушения по вертикали. Пациент старается компенсировать эти нарушения дви-жением головы (что поначалу может расцениваться как тики) —• геластическая катаплексия. У пациента отмечаются двигательные нарушения, обычно провоцируемые смехом — от легких «клевков» головой до атонических падений, осложняющихся травмами (без потери сознания).Наличие 2−6 из следующих симптомов также позволяют предположить НП-С:• атаксия. Проявляется в нарушении походки, пациенту трудно удерживать равновесие на одной ноге-• нарушение целенаправленных движений. Ребенок становится неуклюжим, чаще других детей падает и ударяется во время игры, испытывает сложности с подъемом по лестнице-• дизартрия. Речь становится замедленной, растянутой, «смазанной», со слабой артикуляцией-• деменция. Кратковременные провалы в памяти- у детей могут проявляться как поведенческие проблемы в школе-• дисфагия (расстройство глотания). Пациент может не осознавать, что у него есть нарушение глотания. Не диагностированная дисфагия может проявляться в периодическом расстройстве дыхания, истощении и дегидратации-• гепатоспленомегалия (у детей, чаще у новорожденных).Другие возможные симптомы, позволяющие предположить наличие НП-С У детей до 2 лет это могут быть:• фетальные отеки/асцит-• длительная неонатальная холестатическая желтуха-• задержка психомоторного развития-• мышечная гипотония-• судороги (генерализованные тонико-клонические, простые парциальные, миоклонические).У детей 2−10 лет это могут быть:• атаксия/дизартрия-• катаплексия-• судороги (генерализованные тонико-клонические, простые парциальные, миоклонические) —• задержка психомоторного развития-• нарушения слуха.Дополнительно у подростков и взрослых следует обращать внимание на:• психиатрические нарушения-• деменцию-• двигательные нарушения- атаксию/миоклонус/дисто-нию/тремор-• дизартрию/дисфагию.Если вы заподозрили у пациента болезнь Ниманна-Пика тип С, куда обращаться для уточнения диагноза?Москва, Научный центр здоровья детей РАМН, отделение восстановительного лечения для детей с болезнями нервной системы НИИ ПП и В Л Тел. +7 (499) 134-01-69• Мамедьяров Аяз Магерамович, заведующий отделением, к. м.н., amm@nczd. ru-• Мазурина Елена Михайловна, врач-невролог, к. м.н., ElenaMazurina@bk. ru-• Высоцкая Людмила Михайловна, врач-невролог, к. м.н., doc_vlm@bk. ru.150РР2_2010. 1пСС 15022. 04. 2010 23: 36:05
Показать Свернутьmgutunn.ru
"Болезнь Ниманна-Пика тип с — путь к эффективной терапии через своевременную диагностику"
Выдержка из работы
114Редкие болезниЛ.С. Намазова-Баранова1,2 3, Л.С. Высоцкая1, А.М. Мамедъяров1, Т.В. Маргиева1, 2,Н.Д. Вашакмадзе1, А.К. Геворкян1, 21 Научный центр здоровья детей РАМН, Москва2 Первый Московский государственный медицинский университет им. И.М. Сеченова3 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова, МоскваБолезнь Ниманна-Пика тип С — путь к эффективной терапии через своевременную диагностикуКонтактная информация:Мамедъяров Аяз Магерамович, доктор медицинских наук, заведующий отделением восстановительного лечения детей с болезнями нервной системы НИИ профилактической педиатрии и восстановительного лечения НЦЗД РАМН Адрес: 119 991, Москва, Ломоносовский проспект, д. 2/62, тел.: (499) 134−01−69 Статья поступила: 25. 08. 2011 г., принята к печати: 01. 11. 2011 г.В последние годы в условиях расширения диагностических возможностей и повышения уровня знаний все чаще выявляют болезни, которые ранее считались очень редкими. Наряду с достижениями фармакологической промышленности, своевременная диагностика и назначение адекватной терапии позволяют во многих случаях сохранить жизнь ребенку и замедлить прогрессирование болезни. Данная статья посвящена редкой, генетически обусловленной, патологии из группы лизосомных болезней, наследуемой аутосомно-рецессивно, — болезни Ниманна-Пика тип С. Подробно представлены варианты клинического течения и методы диагностики. Учитывая существующую в нашей стране гиподиагностику этой болезни, авторы предлагают внедрить в практику диагностический алгоритм «Индекс подозрения болезни НП-С» с целью улучшения выявляемости и своевременного начала патогенетической терапии. Ключевые слова: редкие болезни, болезни накопления, лизосомные болезни, болезнь Ниманна-Пика тип С, диагностика, клиническое течение, лечение, дети.Болезни накопления — группа редких генетически детерминированных болезней, обусловленных нарушением синтеза лизосомных ферментов, контролирующих внутриклеточное расщепление макромолекул (гликоза-миногликанов, гликолипидов, гликопротеинов) и внутри-лизосомным их накоплением, что приводит к прогрессирующему нарушению функции поврежденных органов. Наиболее часто в патологический процесс вовлекаютсяпечень, селезенка, центральная нервная система, костная система [1−4]. В результате мутации гена снижается активность того или иного фермента (до 10−20% нормы), что характерно для мукополисахаридозов и гликогено-зов. В редких случаях нарушается так называемая сортировка молекул внутри клеток. Последнее свойственно болезни Ниманна-Пика тип С (НП-С), которая представляет собой сфингомиелиновый липидоз, развивающий-L.S. Namazova-Baranova1, 2 3, L.S. Vysotskaya1, A.M. Mamedyarov1, T.V. Margieva1, 2, N.D. Vashakmadze1,A.K. Gevorkyan1, 21 Scientific Center for Children'-s Health, RAMS, Moscow2 I.M. Sechenov First Moscow State Medical University3 N.I. Pirogov Russian National Research Medical University, MoscowNPD type C — way to the effective therapy through timely diagnosisIn recent years in expanding diagnostic capabilities and improved knowledge level diseases that were previously considered rare become increasingly identified. Along with the achievements of the pharmaceutical industry, timely diagnosis and adequate therapy appointment can often save the life of the child and delay the progression of the disease. This article focuses on a rare, genetically determined, pathology of lysosomal diseases group, inherited autosomal recessively — NPD type C. Different versions of the clinical course and diagnostic methods are showed in details. Take account of the existing in our country hypo diagnostics of this disease, the authors propose to put into practice a diagnostic algorithm «index of suspicion of the disease NP-C» in order to improve detection and timely initiation of pathogenetic therapy.Key words: rare diseases, storage diseases, lysosomal diseases, Niemann-Pick disease type C, diagnostics, clinical course, treatment, children.ся в результате наследственной недостаточности белков, участвующих во внутриклеточном транспорте липидов, и вторичным снижением активности сфингомиелиназы (до 20% нормы). Заболевание наследуется по аутосомно-рецессивному типу. Гены ЫРС1 и NPC2 локализуются в локусах 18q11-q12 и 14q24.3. Болезнь обусловлена мутацией гена NPC1 (95%) или NPC2 (4%), в 1% случаев молекулярно-генетический дефект идентифицировать не удается [1−9].КлассификацияК настоящему моменту в зависимости от молекулярногенетического дефекта выделяют два типа заболевания: болезнь Ниманна-Пика тип С 1-го типа и болезнь Ниманна-Пика тип С 2-го типа. Первоначально выделяли в отдельную форму болезнь Ниманна-Пика тип D, выявляемую в изолятах Новой Шотландии, но в дальнейшем было показано, что причиной этой формы болезни также являются мутации гена NPC1 [2, 5, 10].ЭпидемиологияБолезнь НП-С относится к числу редких наследственных болезней обмена веществ. Заболевание распространено повсеместно. Частота заболевания — 1: 120 0001: 150 000 живых новорожденных. Высокая частота болезни НП-С 1-го типа отмечена среди некоторых генетических изолятов: французской колонии Акадия (Новая Шотландия), групп бедуинов в Израиле, испанских поселений в Колорадо и Нью-Мексико (США), что связано с эффектом основателя [11, 12].Клинические формы болезни Ниманна-Пика тип СБолезнь может манифестировать в любом периоде жизни — от внутриутробного до пожилого возраста, но чаще признаки болезни НП-С появляются в раннем детском возрасте и быстро прогрессируют, приводя к нарушению функций поврежденных органов. Течение болезни и продолжительность жизни пациента во многом зависят от возраста, в котором произошел дебют. Выделяют следующие формы болезни НП-С: неонатальную, младенческую, позднюю младенческую, юношескую и взрослую [2, 11−13]. Неонатальная форма (дебют до 3 мес) характеризуется развитием внутриутробной водянки плода. После рождения преобладают мышечная гипотония и задержка психомоторного развития, которые прогрессируют и приводят к нарушениям интеллекта. Приблизительно в половине случаев отмечаются внутрипеченочный холестаз, желтуха и гепатоспленомегалия, которые с возрастом могут полностью исчезнуть. Редко наблюдается молниеносное течение с развитием тяжелой формы холестатической желтухи и неблагоприятным исходом на первом полугодии жизни от печеночной недостаточности. В небольшом числе случаев развивается дыхательная недостаточность [9, 10, 13]. При младенческой форме (3 мес-2 года) основные клинические симптомы болезни НП-С (гепатоспленомегалия, задержка психомоторного развития, мышечная гипотония) появляются на первом году жизни. Большинство пациентов никогда не приобретает навыки самостоятельной ходьбы. Интеллектуальное развитие обычно не страдает. По мере прогрессирования болезни проис-ходит вовлечение в патологический процесс пирамидной системы, постепенно развивается снижение когнитивных функций [11].В 60−70% случаев болезнь НП-С обычно манифестирует в позднем младенческом и раннем детском возрасте (поздняя младенческая форма — 2−6 лет). Первыми клиническими симптомами этой формы являются мозжечковые расстройства (шаткость при ходьбе, дизартрия, дисметрия), которые обычно проявляются в возрасте 3−5 лет. В 90% случаев наблюдается гепатоспленомегалия различной степени выраженности. По мере прогрессирования болезни (в том числе при юношеской форме) практически у всех пациентов развивается вертикальный супрануклеарный офтальмопарез [14]. На начальных этапах происходит замедление движения глазных яблок по вертикали, постепенно прогрессирующее до полного ограничения вертикального, а иногда горизонтального, взора. Нередко отмечается задержка речевого развития. В дальнейшем постепенно утрачиваются ранее приобретенные двигательные навыки, проявляются интеллектуальные нарушения, развиваются дисфагия и дизартрия, реже демиелинизирующая периферическая полинейропатия [14, 15]. Неблагоприятный исход при поздней младенческой форме обычно наступает в первую декаду жизни [2, 13].При юношеской форме болезни НП-С первые симптомы обычно появляются в возрасте от 6 до 15 лет в виде нарушения усвоения школьного материала, письма, снижения внимания, памяти, гиперактивного поведения, что приводит к установлению неправильного диагноза. В некоторых случаях болезнь манифестирует с психиатрических нарушений, таких как нарушение поведения, шизофре-ноподобный синдром, депрессия [2, 11]. В 20% случаев наблюдается геластическая катаплексия: кратковременная приступообразная утрата мышечного тонуса, приводящая к падению больного без потери сознания, чаще возникающая на фоне сильных эмоциональных реакций (например, во время смеха) [16, 17]. Со временем прогрессируют мозжечковые расстройства, появляются дисфагия, дизартрия и ухудшается интеллектуальное развитие. Частыми симптомами НП-С являются экстрапира-мидные расстройства в виде различных дистонических гиперкинезов. В половине случаев развиваются фокальные и/или генерализованные эпилептические приступы, трудно поддающиеся адекватной антиэпилептической терапии. На поздних стадиях НП-С нарастают пирамидные нарушения в виде повышения мышечного тонуса, оживления сухожильных рефлексов, появления патологических рефлексов, бульбарно-псевдобульбарного синдрома- развиваются деменция, децеребрационная или декортикационная ригидность. Гепатоспленомегалия обычно не наблюдается. Неблагоприятный исход чаще развивается в конце второго — начале третьего десятилетия жизни, обычно от интеркуррентных инфекций [16−18].Взрослая форма. Симптомы болезни НП-С появляются на втором-третьем десятилетии жизни, но могут возникнуть и в возрасте старше 50 лет [18]. Характерно медленно прогрессирующее течение болезни. Постепенно развиваются мозжечковые расстройства (атаксия,115ПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2011/ ТОМ 8/ № 6Редкие болезни116дизартрия, дисметрия), мышечная дистония, различной степени выраженности интеллектуальные расстройства. Нередко у взрослых болезнь НП-С манифестирует с развития биполярных расстройств [16−18]. При этой форме эпилептические приступы развиваются редко- не характерны также увеличение селезенки и вертикальный надъядерный офтальмопарез.ДиагностикаВ настоящее время основными методами диагностики болезни НП-С считают биохимические тесты, позволяющие выявить нарушение внутриклеточного транспорта и гомеостаза холестерина. Наличие мутаций NPC1 или NPC2 генов в сочетании с характерными клиническими проявлениями подтверждают диагноз. Для изучения новых мутаций необходимы дополнительные исследования [1, 2, 5, 6, 9].Для диагностики болезни биохимическими методамитребуется наличие живых клеток (обычно культура фибро-бластов кожи).Самым чувствительным и специфичным методом считают тест с окрашиванием филипином. Фибробласты культивируют в среде с большим содержанием липопротеидов низкой плотности, после чего клетки фиксируют и окрашивают филипином. В 85% случаев («классический биохимический фенотип») при флюоресцентной микроскопии в исследуемых клетках обнаруживают многочисленные флюоресцирующие (заполненные холестерином) пери-нуклеарные пузырьки. Менее выраженное накопление холестерина отмечается в 15% случаев («вариантный биохимический фенотип»). Интерпретировать результаты микроскопии в таких случаях часто трудно, а результаты могут быть как ложноположительными, так и ложноотрицательными [19, 20].Второй по информативности тест — измерение скорости образования эфира холестерина, индуцированного липо-протеинами низкой плотности, в культуре фибробластов [19, 20]. В клеточных линиях пациентов с «классическим биохимическим фенотипом» скорость этерификации холестерина близка или равна нулю- при «вариантном биохимическом фенотипе» наблюдается легкое нарушение этерификации холестерина. Соответственно, результаты теста могут оказаться неоднозначными. В таких случаях для подтверждения диагноза необходим анализ генетических мутаций. Учитывая сложность, высокую стоимость и трудоемкость биохимического исследования, при положительной пробе с филипином часто сразу проводят анализ мутаций [19, 20].Биохимические тесты недостаточно информативны в случае гетерозиготных носителей болезни НП-С: результаты пробы с филипином при этом могут быть нормальными- наблюдаются легкие нарушения, сходные с таковыми в «вариантных» клеточных линиях [20, 21].Исследование мазков костного мозга, окрашенных филипином (а также по Гимзе), позволяет выявить пенистые клетки, заполненные холестерином, считается экспресс-методом скрининга НП-С, однако не дает возможности установить окончательный диагноз [20, 21].Для пренатальной диагностики болезни НП-С следует использовать молекулярно-генетический метод [5].Гистологические методы предполагают исследование биоптатов тканей с помощью световой и электронной микроскопии. Обнаруживают характерные (но неспецифические) пенистые клетки и/или голубые гистиоциты в костном мозге, селезенке, печени, легких и лимфатических узлах (при световой микроскопии), в некоторых случаях выявляя скрытое поражение кожи, скелетных мышц и глаз [16, 22, 23]. Отсутствие изменений при световой микроскопии не исключает диагноз болезни НП-С (например, проявляющейся холестатическим поражением печени у новорожденных).Патогномонично для пациентов с болезнью НП-С обнаружение полиморфных цитоплазматических включений при электронной микроскопии биоптатов печени или кожи, однако, их выявляют не всегда [5, 16, 22].Генетическое исследование является «золотым стандартом» для окончательной верификации диагноза, а также для пренатальной диагностики [5, 16]. Молекулярно-генетическое исследование генов NPC1 и NPC2 проводится в специализированных лабораториях. В некоторых случаях для выявления мутации NPC1 необходимо выполнить комбинированное исследование йДНК и сДНК [5, 6, 16, 23].Выявление носителей и пренатальный диагнозВ случае подтверждения диагноза болезни НП-С необходимо осуществить генетическое консультирование пациента: уточнить характер заболевания, тип наследования, дать рекомендации по планированию семьи (с проведением пренатальной диагностики). ДНК рекомендовано исследовать у обоих родителей.Пренатальный диагноз может быть установлен на основании исследования хорионических ворсинок на 10−12-й нед беременности. Предпочтительным считают молекулярно-генетический анализ, для которого (в отличие от биохимической пренатальной диагностики) не требуется культура клеток [5].Разнородность и вариабельность клинических проявлений болезни НП-С в зависимости от возраста манифестации обусловливают гиподиагностику болезни. Это очевидно на примере нашей страны: на начало 2010 г. в РФ было диагностировано всего 2 пациента с диагнозом «Болезнь Ниманна-Пика тип С» [24], но и в последующем, несмотря на многочисленные публикации по данной теме в медицинской периодической литературе, проведение научно-практических семинаров, зарегистрировано всего 7 случаев данной патологии [2, 10, 24, 25]. Учитывая распространенность болезни, очевидно, что пациентов с болезнью НП-С в стране должно быть больше. А это означает, что они, в отсутствие специфической терапии, подвергаются риску быстрого прогрессирования болезни, инвалидизации и, самое худшее, более раннему наступлению неблагоприятного исхода. В то время как раннее назначение специфической терапии позволяет замедлить дальнейшее развитие болезни. В настоящее время лучшую доказательную базу по эффективности и безопасности имеет лекарственный препарат миглу-стат (Завеска, Actelion Pharmaceuticals Ltd, Швейцария). Это единственный препарат, разрешенный для применения при болезни НП-С. Миглустат — небольшаямолекула (иминосахар), которая конкурентно ингибирует фермент глюкозилцерамид синтетазу, катализирующую первый этап синтеза гликосфинголипидов [26−28]. Тем самым он подавляет накопление нейротоксичных ганглиозидов GM2 и GM3, лактозилцерамида и глюко-зилцерамида. В странах Евросоюза (ЕС), США и некоторых других миглустат применяют для лечения больных с легкой или среднетяжелой формами болезни Гоше 1-го типа, которым не показана заместительная терапия ферментами [26−28]. Миглустат зарегистрирован для лечения болезни НП-С в 2006 г. в странах ЕС, в 2008 г. — в США. В январе 2009 г. Комиссия Е С расширила показания к применению миглустата: лечение прогрессирующих неврологических проявлений НП-С у взрослых и детей [2].Поскольку время начала специфической и адекватной симптоматической терапии имеет решающее значение для прогноза при болезни НП-С, важно как можно раньше выявить болезнь — установить диагноз. Данная проблема побудила группу исследователей во главе с проф. F. А. муЬи^ к созданию алгоритма диагностики болезни НП-С [29].Ученые поставили перед собой следующие цели:1) разработать прогностический инструмент «Индекс подозрения болезни НП-С» и валидировать специфичность и чувствительность показателей на основании анализа историй болезней пациентов-2) разработать балльную шкалу оценки симптомов и их комбинаций для оценки вероятности диагноза болезни НП-С-3) разработать простой инструмент, который мог бы позволить врачам различных специальностей, не знакомым с проблемой болезни НП-С:— понимать основные симптомы и проявления-— предположить у пациента болезнь НП-С как возможный диагноз.В рамках данного исследования все симптомы болезни НП-С были разделены на три основные категории: висцеральные, неврологические и психиатрические. Ретроспективный анализ данных 216 пациентов, направленных на обследование с подозрением на болезнь НП-С в 7 центров Европы и Австралии, позволил оценить диагностическую важность каждого отдельного симптома и их совокупности. По результатам статистического анализа, симптомы внутри каждой категории были разделены на 5 групп по степени вероятности болезни НП-С: от наиболее вероятных (40 баллов/пункт), таких как вертикальный супрануклеарный паралич взора и гела-стическая катаплексия, до маловероятных или дополнительных (1 балл/пункт), таких как гипотония, судороги и миоклонус. К примеру, атаксия встречается примерно у 80% пациентов с болезнью Ниманна-Пика тип С [1], как симптом в данном алгоритме оценена в 10 баллов (средний индекс вероятности). Подобный симптом может встречаться при многих других наследственных болезнях, то есть специфичность его невысока. В то же время необъяснимая изолированная спленомегалия, встречающаяся примерно в 50% случаев болезни НП-С [20], является высокоспецифичным симптомом этой патологии (20 баллов).В разделе «висцеральные симптомы» учитываются также данные анамнеза. Несмотря на возможность полного разрешения в течение первого года жизни затяжной желтухи, гепатоспленомегалии (в случае их наличия у пациентов в периоде новорожденности), эти симптомы являются важными для постановки диагноза.В ходе разработки диагностического алгоритма была проведена оценка взаимосвязи симптомов. Наличие у пациента одновременно симптомов из категорий «неврологические» и «висцеральные» повышает прогностический балл НП-С на 40, как и сочетание висцеральных и психиатрических симптомов. Сочетание неврологических и психиатрических симптомов оценено в 20 баллов. Дополнительно оценивается семейный риск: 40 баллов — при наличии родных братьев/сестер или родителей с болезнью Ниманна-Пика тип С, 20 баллов — двоюродных братьев/сестер с данной патологией. Суммарная оценка, или прогностический балл, позволяет врачу разработать тактику дальнейшего ведения пациента:• & lt-40 баллов — диагноз болезни НП-С маловероятен-• 40−69 баллов — необходимо дальнейшее наблюдение, консультация в специализированном Центре для проведения дифференциальной диагностики-• ^ 70 баллов — высокая вероятность болезни НП-С, необходимо срочно направить пациента в специализированный Центр для диагностики.Пример. Пациент Б., 8 летУ ребенка с 5-летнего возраста отмечаются жалобы на шаткость походки, нарушение координации. В 7 лет присоединились гиперкинезы рук и непроизвольные подергивания лицевой мускулатуры, затруднение речи, снижение когнитивных функций в виде трудностей при запоминании новой информации, выполнении заданий, утраты ранее приобретенных навыков. Ранний анамнез — без особенностей.При неврологическом обследовании у пациента выявлены атаксия, дизартрия, дистония, снижение когнитивных функций.Нейровизуализирующие обледования патологии не выявили.Для исключения системных проявлений пациенту проведено ультразвуковое исследование внутренних органов: выявлена изолированная спленомегалия (пальпаторного увеличения печени не отмечалось).Оценка пациента по шкале «Индекс вероятности НП-С». Висцеральные проявления: изолированная спленомега-лия (20 баллов).Неврологические проявления: атаксия (10 баллов), дизартрия (10), дистония (10).Психиатрические проявления: снижение когнитивных функций (20 баллов).Сочетание категорий «висцеральные» и «неврологические» проявления — 40 баллов.Сочетание категорий «висцеральные» и «психиатрические» проявления — 40 баллов.Сочетание категорий «психиатрические» и «неврологические» проявления — 20 баллов.Прогностический балл — 170.117ПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2011/ ТОМ 8/ № 6Редкие болезни118Данному пациенту требуется немедленное обследование на НП-С.Раннее направление пациента на обследование и постановка диагноза болезни НП-С способны помочь пациенту как можно раньше получить доступ к патогенетическому лечению и специализированной медицинской помощи. Детей с подозрением на болезнь Ниманна-Пика тип С мож-но направить на обследование для уточнения диагноза в Научный центр здоровья детей РАМН (Отделение восстановительного лечения детей с заболеваниями нервной системы НИИ профилактической педиатрии и восстановительного лечения НЦЗД РАМН- Адрес: Москва, Ломоносовский проспект, д. 2/62, тел.: +7 (499) 134-01-69), а также в Медико-генетический научный центр РАМН.СПИСОК ЛИТЕРАТУРЫ1. Vanier M. T., Millat G. Niemann-Pick disease type C // Clin. Genet. — 2003- 64: 269−281.2. Wraith J., BaumgartnerM., Bembi B. Рекомендации по диагностике и лечению болезни Ниманна-Пика типа С // Педиатрическая фармакология. — 2010- 7 (1): 16−24.3. URL: http: //www. esgld. org/(European Study Group onLysosomal Diseases — ESGLD).4. URL: http: //www. hgmd. cf. ac. uk HGMD (Human Gene Mutation Database, Cardiff).5. Vanier M. T. Prenatal diagnosis of Niemann-Pick diseases types A, B and C // Prenat. Diagn. — 2002- 22: 630−632.6. Millat G., Bailo N., Molinero S. et al. Niemann-Pick C disease: use of denaturing high performance liquid chromatography for the detection of NPC1 and NPC2 genetic variations and impact on management of patients and families // Mol. Genet. Metab. — 2005- 86: 220−232.7. Subramanian K., Balch W. E. NPC1/NPC2 function as a tag team duo to mobilize cholesterol // Proc. Natl. Acad. Sci. — 2008- 105: 15 223−15 224.8. Sleat D. E., Wiseman J. A., El-Banna M. et al. Genetic evidence for nonredundant functional cooperativity between NPC1 and NPC2 in lipid transport // Proc. Natl. Acad. Sci. — 2004- 101: 5886−5891.9. Fernandez-Valero E., Ballart A., Itturiaga C. et al. Identification of 25 new mutations in 40 unrelated Spanish Niemann-Pick type C patients: genotype-phenotype correlations // Clin. Genet. — 2005- 68: 245−254.10. Михайлова С. В., Захарова Е. Ю., Букина Т. М. и др. Болезнь Ниманна-Пика тип С: Клинические примеры // Педиатрическая фармакология. — 2010- 7 (5): 48−53.11. Scriver C. R. et al. The Metabolic and molecular bases of inherited diseases (McGraw-Hill). — New York, 2005.12. Imrie J., Dasgupta S., Besley G. T. et al. The natural history of Niemann-Pick disease type C in the UK // J. Inherit. Metab. Dis. — 2007- 30: 51−59.13. Kelly D. A., Portmann B., Mowat A. P. et al. Niemann-Pick disease type C: diagnosis and outcome in children, with particular reference to liver disease // J. Pediatr. -1993- 123: 242−247.14. Solomon D., Winkelman A. C., Zee D. S. et al. Niemann-Pick type C disease in two affected sisters: ocular motor recordings and brainstem neuropathology // Ann. N. Y. Acad. Sci. — 2005- 1039: 436−445.15. Zafeiriou D. I., Triantafyllou P, Gombakis N. P et al. Niemann-Pick type C disease associated with peripheral neuropathy // Pediatr. Neurol. — 2003- 29: 242−244.16. Patterson M. C., Vanier M. T., Suzuki K. et al. The Metabolic and molecular bases of inherited disease (McGraw-Hill). — New York, 2001. — P. 3611−3633.17. Sevin M., Lesca G., Baumann N. et al. The adult form of Niemann-Pick disease type C // Brain. — 2007- 130: 120−133.18. Bauer P., Boettcher T., Meyer W. P. et al. Niemann-Pick type C disease (NP-C) is a considerable diagnosis in juvenile and adult-onset psychiatric disorders. — Annual Meeting of theAmerican Society of Human Genetics (ASH-G), Philadelphia, USA, 2008.19. Argoff C. E., Comly M. E., Blanchette-Mackie J. et al. Type C Niemann-Pick disease: cellular uncoupling of cholesterol homeostasis is linked to the severity of disruption in the intracellular transport of exogenously derived cholesterol // Biochim. Biophys. Acta. — 1991- 1096: 319−327.20. Vanier M. T., Rodriguez-Lafrasse C., Rousson R. et al. Type C Niemann-Pick disease: spectrum of phenotypic variation in disruption of intracellular LDL-derived cholesterol processing // Biochim. Biophys. Acta. — 1991- 1096: 328−337.21. Strauss J. F., Liu P, Christenson L. K. et al. Sterols and intracellular vesicular trafficking: lessons from the study of NPC1 // Steroids. — 2002- 67: 947−951.22. Vanier M. T., Millat G. Structure and function of the NPC2 protein // Biochim. Biophys. Acta. — 2004- 1685: 14−21.23. Paciorkowski A. R., Westwell M., Ounpuu S. et al. Motion analysis of a child with Niemann-Pick disease type C treated with miglustat // Mov. Disord. — 2008- 23: 124−128.24. Руденская Г. Е., Захарова Е. Ю., Букина Т. М. и др. Болезнь Ниманна-Пика, тип С (ювенильный дистонический липидоз) // Журн. неврол. и психиатр. им. С. С. Корсакова. — 2008- 5: 76−79.25. Болезнь Ниманна-Пика тип С глазами матери, медицинской сестры, врача // Педиатрическая фармакология. — 2010- 7 (2): 149−150.26. Butters T. D., Dwek R. A., Platt F. M. Inhibition of glycosphingolipid biosynthesis: application to lysosomal storage disorders // Chem. Rev. — 2000- 100: 4683−4696.27. Wraith J. E., Vecchio D., Jacklin E. et al. Disease stability in patients with Niemann-Pick disease type C treated with miglustat, Lysosomal diseases network WORLD symposium 2009. — San Diego, California, USA, 2009.28. Wraith J. E., Pineda M., Sedel F. et al. Miglustat in patients with Niemann-Pick Type C disease (NP-C): a multicentre retrospective survey. — Annual Meeting of the American Society of Human Genetics, Philadelphia, USA, 2008.29. Wijburg F. A. et al. NP-C disease, an autosomal recessive neurovisceral cellular lipidosis, is characterized by the inappropriate movement and partitioning of LDL-derived cholesterol // Cell. Res. — 2005- 255: 56−66.
Показать Свернутьsinp.com.ua
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


