
 MgSO4 MgСО3 ¯ + Na2 SO4
MgSO4 MgСО3 ¯ + Na2 SO4В процессе промышленной водоподготовки применяют механические, физические, химические и физико-химические методы: осветление, умягчение, ионный обмен, обескремнивание и дегазацию. Питьевую воду, кроме того, дезинфицируют. В приведенной на рис. 1.1 схеме показаны основные методы промышленной водоподготовки. Осветление воды осуществляется в основном методами осаждения примесей, выделяющихся из воды в виде осадка. Эти методы называют также реагентными, так как для выделения примесей в воду вводят специальные реагенты. К процессам осаждения, применяемым для осветления воды в промышленной водоподготовке, относятся коагуляция, известкование и магнезиальное обескремнивание.
Рис. 1.1. Схема очистки воды
Под коагуляцией понимают физико-химический процесс слипания коллоидных частиц и образования грубодисперсной микрофазы (флокул) с последующим ее осаждением. В качестве реагентов для промышленной водоподготовки, обычно применяют сульфаты Al2(SO4)3 и FeSO4. Повышение эффекта коагуляции достигается при добавлении флокулянтов (полиакриламида, активной кремниевой кислоты и др.). При этом ускоряется образование хлопьев и улучшается их структура. Образовавшуюся хлопьевидную массу, состоящую в основном из гидроксидов Аl и Fe и примесей, выделяют из воды в отстойниках или специальных осветлителях (осадок в них поддерживается во взвешенном состоянии потоком поступающей снизу воды), напорных или открытых фильтрах и контактных осветлителях с загрузкой из зернистых материалов (кварцевый песок, дробленый антрацит, керамзит, шунгизит и др.), а также во флотаторах, гидроциклонах, намывных фильтрах. Для частичного удаления крупнодисперсных примесей и фитопланктона, образующегося при цветении водоемов, применяют сетчатые микрофильтры, плоские и барабанные сетки.
Известкование воды производится для снижения гидрокарбонатной щелочности воды. Одновременно с этим уменьшаются жесткость, солесодержание, концентрации грубодисперсных примесей, соединений железа и кремниевой кислоты. Реагентом для этого процесса является гашеная известь Са(ОН)2, которая подается в воду в виде суспензии (известкового молока). Для повышения эффективности удаления кремниевой кислоты при водоподготовке воду добавляют каустический магнезит (70…80 % MgO). Эти процессы, как правило, совмещаются и проводятся одновременно в одном аппарате – осветлителе. Окончательная очистка от осадка осуществляется с помощью фильтрования. В зависимости от соотношения размеров фильтруемых частиц и эффективного диаметра пор удержание частиц может происходить как в объеме фильтрующего слоя (адгезионное фильтрование), так и на его поверхности (пленочное фильтрование). В качестве фильтрующих материалов в основном используют кварцевый песок, дробленый антрацит, сульфоуголь, целлюлозу, перлит, вулканические шлаки, керамзит и др.
Умягчение воды в промышленной водоподготовке - очистка от соединений кальция и магния, обусловливающих жесткость воды. Одним из наиболее эффективных способов умягчения воды является известково-содовый в сочетании с фосфатным. Процесс умягчения основывается на следующих реакциях:
1. Обработка гашеной известью для устранения временной жесткости, удаления ионов железа и связывания СО2:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 ↓ + 2Н2О;
Mg(HCO3)2 + 2Ca(OH)2 → 2СаСО3 ↓ + Mg(OH)2 ↓ + 2h3O;
FeSO4 + Ca(OH)2 → Fe(OH)2 ↓ + CaSO4 ↓;
CO2 + Ca(OH)2 →CaCO3 ↓ + h3O;
2. Обработка кальцинированной содой для устранения постоянной жесткости:
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
MgCl2 + Na2CO3 → MgCO3 ↓ + 2NaCl
CaS04 + Na2CO3 → CaCO3 ↓ + Na2SO4
3. Обработка тринатрийфосфатом для более полного осаждения катионов Са2+ и Mg2+:
3Ca(HCO3)2 + 2Na3PO4 → Са3(РО4)2 ↓ + 6NaHCO3;
3MgCI2 + 2Na3PO4 → Mg3(PO4)2 ↓ + 6NaCl.
Растворимость фосфатов кальция и магния ничтожно мала, что обеспечивает высокую эффективность фосфатного метода.
Сегодня в промышленной водоподготовке для умягчения, обессоливания воды и удаления кремня специалисты РХТУ им. Д.И. Менделеева применяют мембранные технологии (нанофильтрации и низконапорный обратный осмос), а также технологии ионного обмена. Сущность метода ионного обмена в том, что твердое тело – ионит – поглощает из раствора электролита положительные или отрицательные ионы в обмен на эквивалентное количество других, одноименно заряжен- ных ионов. В соответствии со знаком заряда обменивающихся ионов различают катиониты и аниониты.
Катиониты – практически нерастворимые в воде вещества, представляющие собой соли или кислоты с анионом, обусловливающим нерастворимость в воде; катион же (натрий или водород) способен вступать в определенных условиях в обменную реакцию с катионами раствора, в котором находится катионит. Катиониты соответственно называются Na-катионитами и Н-катионитами.
Аниониты – основания или соли с твердым нерастворимым катионом. Аниониты содержат подвижную гидроксильную группу (ОН-аниониты).
В качестве Na-катионитов в промышленной водоподготовке применяют алюмосиликаты: глауконит, цеолит, пермутит и другие; в качестве Н-катионитов – сульфоуголь, синтетические смолы; к ОН-анионитам относятся искусственные смолы сложного состава, например карбамидные. Ионный обмен между раствором и ионитом имеет характер гетерогенной химической реакции. Следует отметить, что примеси, удаляемые из воды методом ионного обмена, не образуют осадка, и что такая обработка не требует непрерывного дозирования компонентов. Важной характеристикой ионитов является обменная емкость, показывающая способность ионита поглощать определенное количество ионов в данных условиях. Обменная емкость определяет продолжительность рабочего цикла ионитовых фильтров. При достижении заданного предела обменной емкости ионита проводят процесс его восстановления (ионный обмен, проводимый в обратном порядке). В основе катионного процесса умягчения лежат реакции обмена ионов натрия и водорода катионитов на ионы Са2+ и Mg2+. Обмен ионов натрия называется Na-катионированием, а ионов водорода – Н - катионированием:
2R/Na+ + Ca2+ R2/Ca2+ + 2Na+;
2R/Na+ + Mg2+ R2/Mg2+ + 2Na+,
где R – комплекс матрицы и функциональной группы, не участвующей в ионном обмене (его принято считать одновалентным). Обмен катионов при Н-катионировании протекает согласно реакциям:
2R/H+ + Ca2+ R2/Ca2+ + 2H+;
2R/H+ + Mg2+ R2/Mg2+ + 2H+;
R/H+ + Na+ R/Na+ + H+.
При достижении катионитами заданного предела обменной емкости их регенерируют промывкой раствором NaCl или серной кислоты h3SO4. Регенерация Н-катионного фильтра производится 1…1,5 %-ным раствором серной кислоты. Регенерация анионитовых фильтров производится обычно 4 %-ным раствором NaOH.
На рис. 1.2 представлена схема установки для водоподготовки с последовательным применением Н - катионирования и ОН-анионирования. При прохождении воды через катионит она освобождается от ионов кальция и магния в Н-катионитовом фильтре 1, а затем в анионитовом фильтре 2 из нее удаляются анионы. Далее вода проходит через дегазатор 3, где она освобождается от кислорода и диоксида углерода, и далее через сборник 4 к потребителю. Для регенерации в фильтр 1 подается раствор серной кислоты, в фильтр 2 – гидроксида натрия.
Рис. 1.2. Схема установки для умягчения воды: 1 – катионитовый фильтр; 2 – анионитовый фильтр; 3 – дегазатор; 4 – сборник воды.
Важная часть комплексного технологического процесса водоподготовки – удаление из воды растворенных газов. Наличие газов в воде объясняется как их сорбцией и протеканием химических реакций в процессе образования примесей в природной воде, так и появлением их в процессе различных стадий очистки. Эти газы можно разделить на химически невзаимодействующие (Н2, О2, СН4) и химически взаимодействующие с водой и ее примесями (Nh4, CO2, Сl2), а также на коррозионно-активные (О2, СО2, Nh4, Cl2, h3S) и инертные (N2, h3, СН4). Концентрация газов в воде зависит от многих факторов, основные из них – физическая природа газа, степень насыщения, давление в системе и температура воды.
Основной способ удаления из воды растворенных газов процессе водоподготовки – десорбция (термическая деаэрация). Принцип ее заключается в создании контакта воды с паром, в котором парциальное давление газа, удаляемого из воды, близко к нулю, что является необходимым условием процесса десорбции. Этот процесс осуществляется, в основном, в деаэраторах (вакуумных, атмосферных, постоянного давления), которые по способу распределения воды и пара разделяют на струйные, пленочные и барботажные. Интервал рабочего давления в вакуумных деаэраторах составляет 0,0075…0,05 МПа.
Промышленная водоподготовка в ряде случаев требует использования химических методов. Так, для удаления кислорода в воду добавляют сильные восстановители; для удаления h3S воду хлорируют.
Для получения дистиллята, необходимого для промышленного производства химически чистых реактивов, лекарственных препаратов, проведения различных анализов в лабораторной практике применяется термическое обессоливание воды для водоподготовки. Этот процесс осуществляется в испарителях кипящего типа. При этом дистиллят производят в основном из воды, предварительно умягченной на ионитовых фильтрах.
Наличие в воде болезнетворных микроорганизмов и вирусов делает ее не пригодной для хозяйственно-питьевых нужд, а присутствие в воде некоторых видов микроорганизмов (например, нитчатых, зооглейных, сульфатовосстанавливающих бактерий, железобактерий) вызывает биологическое обрастание, а иногда разрушение трубопроводов и оборудования для водоподготовки и водоснабжения. Обеззараживание воды осуществляют, в основном, путем хлорирования ее жидким или газообразным Сl2, гипохлоритами – NaClO, Ca(СlО)2, СlO2. Для обеззараживания воды применяют также озон и ультрафиолетовое облучение.
myunivercity.ru
Федеральное агентство по образованию
Тверской государственный технический университет
Кафедра общей химической технологии
Промышленная водоподготовка
Реферат по общей химической технологии
Тверь 2011
СОДЕРЖАНИЕ
Введение с.3
1 Водоподготовка с.9
1.1 Сорбция с.11
1.2 Экстракция с.12
1.3 Эвапорация с.15
1.4 Коагуляция с.16
1.5 Флотация с.18
1.6 Ионный обмен с.19
1.7 Кристаллизация с.24
1.8 Диализ с.27
Выводы с.30
Список используемых источников с.32
Введение
ВОДА (оксид водорода) НОН, мол. м. 18,016, простейшее устойчивое соединение водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Изотопный состав. Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (мол. %): - 99,13; - 0,2; -0,04; -0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных количествах (а именно:,,,,). Кроме стабильных изотопных разновидностей, в воде содержится небольшое кол-во радиоактивного (или ). Изотопный состав природной воды разного происхождения несколько варьирует. Особенно непостоянно отношение 1Н/2Н: в пресных водах - в среднем 6900, в морской воде -5500, во льдах - 5500-9000. По физ. свойствам заметно отличается от обычной воды. Вода, содержащая , по свойствам ближе к воде с .
Строение молекулы и физические свойства. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О—Н 0,0957 нм; валентный угол Н—О—Н 104,5°; дипольный момент 6,17*10-30 Кл*м; поляризуемость молекулы 1,45*10-3 нм3; средний квадрупольный момент — 1,87*10-41 Кл*м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимод. молекулы воды с др. атомами, молекулами и ионами, в т.ч. с другими молекулами воды в конденсир. фазах, эти параметры изменяются.
Объем потребляемой в мире воды достигает 4 трлн. м3 в год, а преобразованию со стороны человека подвергается практически вся гидросфера. Так при получении ядерной энергии в США вовлекается в использование почти половина всех водных ресурсов страны. Радиоактивное и тепловое загрязнение может поставить под угрозу их применение в хозяйственно-бытовых и промышленных целях.
Химическая и нефтехимическая отрасли промышленности способствуют проникновению в водную среду веществ, нормально отсутствующих в ней, или превышению естественного уровня их концентрации, ухудшающим качество среды.
За время существования человечества в природную среду было введено около миллиона новых веществ (всего известно свыше 6 млн. химических соединений). Ежегодно в мире синтезируется около 250 тысяч новых химических соединений, многие из которых получают широкое применение и могут поступать в окружающую среду. В практике используется 500 тысяч химических соединений, из них по оценке международных экологических организаций, около 40 тысяч обладают вредными для человека свойствами, а 12 тысяч являются токсичными.
Вредные химические элементы и вещества попадают в водоемы, ухудшая их санитарное состояние и вызывая необходимость специальной глубокой очистки воды перед использованием ее для хозяйственно-питьевых и некоторых промышленных целей
Различают природную, сточную и денатурированную воду. Природная вода - это вода, которая качественно и количественно формируется под влиянием естественных процессов при отсутствии антропогенного воздействия и качественные показатели которой находятся на естественном среднемноголетнем уровне. Сточная вода - это вода, бывшая в бытовом, производственном или сельскохозяйственном употреблении, а также прошедшая через какую-либо загрязненную территорию, в том числе населенного пункта. Природная вода, подвергаемая антропогенному загрязнению, например, путем смешения со сточной водой, называется денатурированной или природно-антропогенной.
Для очистки сточных вод используют очистные сооружения трех основных типов: локальные, общие и районные или городские.
Очистные сооружения локального типа предназначены для обезвреживания сточных вод непосредственно после технологических цехов, имеющих вредные химические вещества, например, после резервуарного парка технологических коммуникаций, насосных станций, хранящих и перекачивающих этилированные бензины. Применение таких установок дает возможность избежать необходимости пропускать сточные воды предприятия через установки для извлечения из воды определенных химических веществ.
Очистные сооружения общего типа предназначены для очистки всех нефтесодержащих вод нефтетранспортного предприятия. Обычно эти очистные сооружения включают механическую, физико-химическую и биологическую очистки. К сооружениям механической очистки относятся песколовки, нефтеловушки, отстойники, флотационные и фильтрационные установки и др. На этих сооружениях удаляют грубодисперсные примеси. К сооружениям физико-химической очистки относятся флотационные установки с применением химических реагентов, установки с применением коагулянтов для коллоидных примесей. К сооружениям биологической очистки относятся аэротенки, биофильтры, биологические пруды и др.
Очистные сооружения районного или городского типа предназначены в основном для механической, физико-химической и биологической очистки сточных вод. Если на эти очистные сооружения направляют производственные сточные воды, то в них не должно быть примесей, которые могут нарушить нормальный ритм работы канализации и очистных сооружений.
С точки зрения водоподготовки, наиболее общие и характерные признаки загрязняющих воду веществ - формы нахождения их в воде. Исходя из этого, академиком АН УССР профессором Леонидом Адольфовичем Кульским была предложена классификация примесей воды, основанная на их фазовом состоянии и дисперсности. Эта классификация имеет широкое практическое применение, т.к. дает приемлемое обоснование технологическим приемам водообработки и преследует цель упорядочить выбор оптимальных методов очистки и технологических схем.
Все примеси им были разделены на четыре группы.
Примеси первой группы - нерастворимые в воде суспензии и эмульсии (а также планктон и бактерии), кинетически неустойчивые и находящиеся во взвешенном состоянии благодаря гидродинамическому воздействию водного потока. В состоянии покоя эти взвешенные вещества выпадают в осадок.
Примеси второй группы - гидрофобные и гидрофильные органические и минеральные коллоидные частицы, а также нерастворимые и недиссоциированные формы гумусовых веществ, детергенты и вирусы, которые по своим размерам близки к коллоидным примесям.
Примеси третьей группы - молекулярно-растворимые вещества (органические соединения, растворимые газы и т.п.).
Примеси четвертой группы - вещества, диссоциированные на ионы.
Жесткостью называется свойство воды, обусловленное содержанием в ней ионов кальция Са2+и магния Mg2+. Жесткость определяют по специальной методике, описанной в ГОСТах на питьевую воду, единицы ее измерения — моль на кубический метр (моль/м3) или миллимоль на литр (ммоль/л).
Различаются несколько видов жесткости — общая, карбонатная, некарбонатная, устранимая и неустранимая; но чаще всего говорят об общей жесткости, связанной с суммой концентраций ионов кальция и магния.
Тяжёлая вода, как, известно кристаллизуется при более высокой температуре +3,8 0C, чем чистая.
Очистка сточных вод обычно включает три последовательных стадии, называемые первичной, вторичной и третичной обработкой. Приблизительно 10% сточных вод вообще не получают обработки, около 30% получают только первичную обработку и около 60% подвергаются еще вторичной обработке. Третичная обработка в настоящее время применяется редко, но, по-видимому, она станет более распространенной, когда для этого появятся материальные возможности, что позволит приблизить качество обработки к более высоким стандартам.
Первичная очистка по существу представляет собой отфильтровывание твердых примесей, песка и ила и хлорирование воды для обезвреживания находящихся в ней инфекционных бактерий.
Вторичная очистка включает медленную фильтрацию либо аэрацию. На стадии медленного фильтрования сточные воды просачиваются через слой гравия, в котором находятся бактерии, разлагающие 75% содержащихся в воде органических веществ. При аэробной биологической очистке сточные воды обезвреживают, пропуская их сквозь слой бактерий, окисляющих и минерализующих органические вещества, а затем обогащают воздухом и дают отстояться, чтобы удалить осаждающиеся примеси. Этот метод обладает 90%-ной эффективностью.
Третичная очистка воды связана с удалением из нее растворимых ионных веществ и остатков органических веществ, не извлеченных при вторичной очистке. Третичная очистка проводится не всегда одинаково, а зависит от конкретного характера сточных вод и самого метода очистки. В некоторых случаях для её проведения используются фильтры из активированного древесного угля, в других случаях для осаждения фосфат-иона PO проводится обработка воды гидроксидом кальция Са(ОН)2. Возможно также применение электродиализа, хотя этот метод сопряжен с большими расходами.
Мембранные методы очистки отличаются типами используемых мембран, движущими силами, поддерживающими процессы разделения, а также областями их применения.
Существуют мембранные методы шести типов:
микрофильтрация - процесс мембранного разделения коллоидных растворов и взвесей под действием давления;
ультрафильтрация - процесс мембранного разделения жидких смесей под действием давления, основанный на различии молекулярных масс или молекулярных размеров компонентов разделяемой смеси;
обратный осмос - процесс мембранного разделения жидких растворов путем проникновения через полупроницаемую мембрану растворителя под действием приложенного раствору давления, превышающего его осмотическое давление;
диализ - процесс мембранного разделения за счет различия скоростей диффузии веществ через мембрану, проходящий при наличии градиента концентрации;
электродиализ - процесс прохождения ионов растворенного вещества через мембрану под действием электрического поля в виде градиента электрического потенциала;
myunivercity.ru
Водоподготовка представляет собой комплекс мероприятий и технологических процессов получения воды требуемого качества. Процесс отстаивания позволяет удалить из воды грубодисперсные взвешенные примеси, оседающие на дно непрерывно действующих отстойных бетонированных резервуаров. Для достижения полного осветления и обесцвечивания воды or коллоидных примесей в отстойники вводят коагу-лянты — хлориды или сульфаты алюминия или железа. Коагулянты в воде гидролизуются с образованием аморфных осадков соответствующих гидроксидов, которые адсорбируют коллоидные примеси и увлекают их hi дно резервуара. Гидроксид алюминия образуется 1акже при взаимодействии сульфата алюминия с находящимися в воде бикарбонатами кальция и магния, тем самым снижая солесодержание в воде. Одновременно и кч процесс адсорбции на поверхности осадка органических красящих веществ, в результате чего вода обесцвечивается. Образующийся при коагуляции коллоидный окадок удаляется из воды отстаиванием и фильтрованием.
Фильтрование — важный метод очистки воды; для этого применяются песчаные фильтры с зернистым фильтрующим слоем.
Обеззараживание воды — обязательный процесс очистки воды, идущей для бытовых нужд. Уничтожение болезнетворных микробов и окисление органических примесей достигается хлорированием с помощью газообразного хлора, хлорной извести, гипохлорита кальция, а также озонированием и кипячением. Вода может быть обеззаражена также с помощью ультразвуковых волн и ультрафиолетового облучения. Большим преимуществом такого способа обеззараживания является то, что поражаются не только бактерии, но и растительные споры. Важным мероприятием водоподготовки для питьевых нужд следует считать устранение запахов воды.
Умягчение и обессоливание — основные процессы водоподготовки. Удаление из воды всех солей (всех катионов и анионов) называется обессоливанием, а солей кальция и магния — умягчением. Полное обессоливание для получения дистиллированной воды применяется сравнительно редко. Способы умягчения подразделяются на химические, физические и физико-химические. Сущность химических методов заключается в связывании ионов кальция и магния с помощью реагентов в нерастворимые и легко удаляемые соединения.
По применяемым реагентам различают химические способы: а) известковый (воздействие гашеной известью), б) содовый (кальцинированной содой), в) натронный (едким натром), г) фосфатный (тринатрийфосфатом). Наиболее экономично применение комбинированных методов, обеспечивающих устранение временной и постоянной жесткости, удаление СО2, ионов железа, коагулирование органических и других примесей. Таким методом является известково-содовый в сочетании с фосфатным или комбинированный химический метод умягчения с физико-химическим (например, ионообменным). Сущность ионообменного способа состоит в удалении из воды ионов кальция и магния с помощью ионитов (ионообменных смол), способных обменивать свои ионы на ионы, содержащиеся в воде.
К физическим способам умягчения воды относятся кипячение, дистилляция и вымораживание. Дистиллированную воду получают перегонкой на специальных дистилляционных установках. Дистиллированная вода широко применяется в производстве особо чистых реактивов и в лабораторной практике.
Современным методом физико-химического умягчения воды является электрохимический, основанный на использовании электродиализа и электроосмоса. Дегазация, т. е. удаление из воды растворенных газов, производится химическим и физическим способами. Нейтрализация применяется главным образом для оборотной воды, которая загрязняется кислотами или щелочами в производственных процессах. Для нейтрализации используют известь, соду и другие реагенты.
studfiles.net
Лекция:
Подготовка воды для производственных процессов. Изложение способов водоподготовки на предприятии.
Благодаря универсальным свойствам вода находит в народном хозяйстве разнообразное применение как сырье, в качестве химического реагента, как растворитель, тепло- и хладоноситель. Например, из воды получают водород различными способами, водяной пар в тепловой и атомной энергетике; вода служит реагентом в производстве минеральных кислот, щелочей и оснований, в производстве органических продуктов — спиртов, уксусного альдегида, фенола и других многочисленных реакциях гидратации и гидролиза. Воду широко применяют в промышленности как дешевый, доступный, неогнеопасный растворитель твердых, жидких и газообразных веществ (очистка газов, получение растворов и т.п.). Исключительно большую роль играет вода, в текстильном производстве: при получении различных волокон — натуральных,- искусственных и синтетических, в процессах отделки и крашения пряжи, суровых тканей и др.
Как теплоноситель вода используется в различных системах теплообмена — в экзотермических и эндотермических процессах. Теплота фазового перехода Ж — Г воды значительно выше, чем для других веществ, вследствие чего конденсирующийся водяной пар является самым распространенным теплоносителем. Водяной пар и горячая вода имеют значительные преимущества перед другими теплоносителями — высокую теплоемкость, простоту регулирования температуры в зависимости от давления, высокую термическую стойкость и пр., вследствие чего являются уникальными теплоносителями при высоких температурах. Воду используют также как хладагент для отвода теплоты в экзотермических реакциях, для охлаждения атомных реакторов. В целях экономии расхода воды применяют так называемую оборотную воду, т.е. использованную и возвращенную в производственный цикл.
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды — удаление из нее вредных примесей, находящихся в молекулярно-растворенном, коллоидном и взвешенном состоянии. Основные операции водоподготовки: очистка от взвешенных примесей отстаиванием и фильтрованием, умягчение, а в отдельных случаях — обессоливание, нейтрализация, дегазация и обеззараживание.
Отстаивание воды проводят в непрерывно действующих отстойных бетонированных резервуарах. Для достижения полного осветления и обесцвечивания декантируемую из отстойников воду подвергают коагуляции. Коагуляция — высокоэффективный процесс разделения гетерогенных систем, в частности выделения из воды коллоидно-дисперсных частиц глины, кварцевого песка, карбонатных и других пород, а также веществ органического происхождения, например белков. Суть процесса коагуляции сводится к введению в обрабатываемую воду коагулянтов, обычно различных электролитов. Ион-коагулянт, имеющий заряд, противоположный заряду коллоидной частицы, адсорбируется на поверхности. При этом нейтрализуется заряд частицы и сжимаются сольватные (гид-ратные) оболочки вокруг коллоидных частиц, которые могут объединяться друг с другом и седиментировать.
Часто, особенно когда в воде находятся не коллоидно-дисперсные вещества, а тонкодисперсные взвеси (т. е. более грубые по размерам частицы), которые, как правило, имеют очень слабый заряд, для водоподготовки используют процесс флокуляции. Вещества, вызывающие флокуляцию, называют флокулянтами. Флокулянты представляют собой растворимые в воде высокомолекулярные соединения (карбоксиметилцеллюлоза — КМЦ, полиакриламид — ПАА; полиоксиэтилен — ПОЭ; крахмал и др.). Ониобразуют мостиковые соединения между отдельными частицами дисперсной фазы, после чего эти тяжелые агрегаты седйментируют. Флокуляция происходит обычно очень быстро, а расход флокулянтов весьма незначительный; это делает рентабельным использование такого процесса, несмотря на достаточно высокую стоимость флокулянтов. Образующийся при коагуляции или флокуляции осадок удаляется из воды отстаиванием или фильтрованием.
Фильтрование — наиболее универсальный метод разделения неоднородных систем. В технике фильтрования наибольшее значение имеет развитая поверхность фильтрующего материала.
Умягчение и обессоливание водысостоит в удалении солей кальция, магния и других металлов. В промышленности применяют различные методы умягчения, сущность которых заключается в связывании ионов Са2+ и Mg2+ реагентами в нерастворимые и легко удаляемые соединения. По применяемым реагентам различают способы: известковый (гашеная известь), содовый (кальцинированная сода), натронный (гидроксид натрия) и фосфатный (тринатрийфосфат). Наиболее экономично применение комбинированного способа умягчения, обеспечивающего устранение временной и постоянной жесткости, а также связывание СО2, удаление ионов железа, коагулирование органических и других примесей. Одним из таких способов является известково-содовый в сочетании с фосфатным. Процесс умягчения основывается на следующих реакциях:
1. Обработка гашеной известью для устранения временной жесткости, удаления ионов железа и связывания СО2 :
Са(НСОз)2 + Са(ОН)2 = 2СаСО3 ¯ + 2Н2 О
Mg(НСО3 )2 + 2Са(ОН)2 = 2СаСО3 ¯ + Mg (ОН)2 ¯ + 2Н2 О
FeSO4 + Са (ОН)2 = Fe (OH)2 ¯ + CaSO4 ¯
4Fe (OH)2 + О2 + 2Н2 О = 4Fe (ОН)3 ¯
СО2 + Са (ОН)2 = СаСО3 ¯ + Н2 О
2. Обработка кальцинированной содой для устранения постоянной жесткости:

 MgSO4 MgСО3 ¯ + Na2 SO4
MgSO4 MgСО3 ¯ + Na2 SO4
MgCl2 + Na2 CO3 MgСО3 ¯ + NaCl
CaSO4 СаСО3 ¯ + Na2 SO4
3. Обработка тринатрийфосфатом для более полного осаждения катионов Са2+ и Mg2+:
ЗСа (НСО3 )2 + 2Na3 PO4 = Са3 (РО4 )2 ¯ + 6NaHCO3
3MgCl2 + 2Na3 PO4 = Mg3 (РО4 )¯ + 6NaCl
Растворимость фосфатов кальция и магния ничтожно мала; это обеспечивает высокую эффективность фосфатного метода.
Значительный экономический эффект дает сочетание химического метода умягчения с физико-химическим, т.е. ионообменным способом. Сущность ионообменного способа умягчения состоит в удалении из воды ионов кальция и магния при помощи, ионитов, способных обменивать свои ионы на ионы, содержащиеся в воде. Различают процессы катионного и анионного обмена; соответственно иониты называют катионитами и анионитами.
В основе катионного процесса умягчения лежит реакция обмена ионов натрия и водорода катионитов на ионы Са2+ и Mg2+. Обмен ионов натрия называется Na-катионированием, а ионов водорода— Н-катионированием:
Na2 [Кат] + Са (НСО3 )2 « Са [Кат] + 2NaHCO3
Na2 [Кат] + MgSO4 « Mg [Кат] + Na2 SO4
h3 [Кат] + MgCI2 «Mg [Кат] + 2HCI
Н [Кат] + NaCl«Na [Кат] + НС1
Приведенные реакции показывают, что ионообменный способ может обеспечить как умягчение воды, так и обессоливание, т. е. полное удаление солей из воды.
Реакции ионообмена обратимы, и для восстановления обменной способности ионитов проводят процесс регенерации. Регенерацию Na-катионитов осуществляют при помощи растворов поваренной соли, а Н-катионитов — введением растворов минеральных кислот. Уравнения регенерации катионитов:
Са [Кат] + 2NаС1 «Na2 [Кат] + СаС12
Na [Кат] + НС1 « Н [Кат] + NaCl
Примером анионного обмена может служить реакция обмена анионов ОН- по уравнению
[Ан] ОН + HCl« [Ан] Cl + Н2 О
Регенерацию анионита проводят при помощи растворов щелочей:
[ Ан] Cl + NaOH« [Ан] ОН + NaCl
Значительный экономический эффект дает современный способ обессоливания воды, в основе которого лежит последовательное проведение процессов Н-катионирования и ОН-анионирования. Образующиеся в результате этих процессов ионы Н+ и ОН- взаимодействуют друг с другом с образованием молекул воды.
Повышение технико-экономического эффекта водоподготовки связано с применением комбинирования нескольких технологических процессов, например коагуляции, умягчения и осветления с помощью современных методов ионного обмена, сорбции, электрокоагуляции и др.
Для современной промышленной водоподготовки значительный интерес представляет возможность применения электрохимических методов, в частности электрокоагуляции. Электрокоагуляция — способ очистки воды в электролизерах с растворимыми электродами — основана на электрохимическом получении гидроксида алюминия, обладающего высокой сорбционной способностью по отношению к вредным примесям. Перенос электричества при внесении электродов в воду и пропускании тока осуществляют в основном ионы, находящиеся в природной воде (Са2+, Mg2+, Na+, С1-, НСО3-, SO42- и др.).
На растворимом алюминиевом аноде происходят два процесса — анодное и химическое (не связанное с протеканием электрического тока) растворение алюминия с последующим образованием А1 (ОН) 3 :
Al — 3e ® Al3+
Аl3+ +ЗОН- ® А1(ОН)3
На катоде происходит выделение пузырьков газа — водорода(водородная поляризация), поднимающих частицы веществ на поверхность воды.
К достоинствам метода электрокоагуляции относятся: высокая сорбционная способность электрохимического А1(ОН)3, возможность механизации и автоматизации процесса, малые габариты очистных сооружений.
Для очистки главным образом кислых оборотных вод применяется нейтрализация — обработка воды оксидом или гидроксидом кальция.
Важной частью водоподготовки является удаление из воды растворенных агрессивных газов (СО2, О2 ) с целью уменьшения коррозии. Удаление газов осуществляют методом десорбции (термической деаэрации) путем нагревания паром. Термическую деаэрацию проводят в аппаратах, называемых деаэраторами (вакуумные, атмосферные, повышенного давления).
Воду, используемую для бытовых нужд, обязательно подвергают обеззараживанию — уничтожению болезнетворных бактерий и окислению органических примесей, в основном хлорированием при помощи газообразного хлора, а также хлорной извести и гипохлорита кальция.
2. Гомогенные некаталитические процессы, протекающие в жидкой и газовой фазах. Их закономерности и способы интенсификации
Гомогенными называют химические процессы, протекающие в однородной среде, т.е. в жидких или газообразных смесях, не имеющих поверхностей раздела, отделяющих части систем друг от друга. Гетерогенными называют химико-технологические процессы, в которых реагенты находятся в разных фазах. Поскольку чисто гомогенную среду, не содержащую примесей и включений другой фазы, получить трудно, то лишь условно относят к гомогенным те промышленные химические процессы, которые протекают в газовой или жидкой фазе. По размеру частиц, составляющих систему, границей между гомогенными и гетерогенными системами считают коллоиды и тонкие аэрозоли с величиной частиц более 0,1 мкм, называемые микрогетерогенными системами.
Большинство промышленных химико-технологических процессов относится к гетерогенным, но гетерогенные процессы часто включают в качестве одной из стадий гомогенный химический процесс в газовой или жидкой фазе. В гомогенных средах, особенно в жидкой фазе, химические реакции происходят быстрее, чем в гетерогенных, аппаратурное оформление гомогенных процессов проще и управление ими легче. Поэтому в промышленности широко используют прием гомогенизации системы для проведения химического процесса в однородной среде; чаще всего применяют поглощение газов жидкостью или конденсацию паров, растворение или плавление твердых веществ для получения жидкой реакционной среды.
Гомогенные процессы в газовой фазе особенно характерны для органической технологии и в ряде случаев реализуются испарением органических веществ с последующей обработкой паров газообразными реагентами — хлором, кислородом, диоксидом серы, оксидами азота; соответственно происходят химические реакции хлорирования, окисления, сульфирования, нитрования и т.д. Часто применяют парофазный пиролиз, т.е. нагревание паров органических веществ без доступа воздуха с целью получения новых продуктов; при пиролизе происходит расщепление сложных молекул с образованием свободных радикалов, предельных и непредельных углеводородов, которые вступают в реакции полимеризации, конденсации, изомеризации и др. Пиролиз жидких и газообразных веществ называется также крекингом. Примером промышленных газофазных процессов может служить термическое и фотохимическое хлорирование углеводородов для получения органических растворителей, ядохимикатов и других продуктов органического синтеза.
Парофазный пиролиз углеводородов — метана (природного газа), нефтепродуктов, каменноугольной смолы — происходит по радикально-цепному механизму. Сперва молекулы расщепляются, образуя свободные радикалы, которые затем продолжают цепь, заимствуя атомы водорода и образуя новые радикалы. Заданный состав продуктов реакции можно получить, изменяя температуру время пребывания продуктов расщепления в реакционной зоне.
В технологии неорганических веществ газофазные гомогенные процессы осуществляются, например, в производстве серной, азотной и соляной кислот. Так, в парах сжигают серу в печах камерного типа для получения диоксида серы; получают оксид азота из воздуха в условиях низкотемпературной плазмы (103 -105 К) по реакции:
N2 + O2 = 2NO, DН = -179,2 кДж
В низкотемпературной плазме осуществляется также электрокрекинг углеводородов, например метана с целью получения ацетилена, синтез озона из кислорода и др.
В производстве азотной кислоты в газовой фазе идет окисление оксида азота в диоксид по суммарному уравнению
2NO + O2 = 2NO2, DН= -119,3 кДж
В газовой фазе идет синтез хлороводорода из водорода и хлора в производстве соляной кислоты по экзотермической реакции:
Н2 + Cl2 = 2HCl
Гомогенные процессы в жидкой фазе применяют в промышленности чаще, чем газофазные. Скорость химических реакций в жидкой фазе, как правило, в тысячи раз выше, чем в газах (при той же температуре), но скорость диффузии в жидкостях значительно меньше, чем в газах, вследствие высокой вязкости жидкости. Коэффициент диффузии в газах составляет 0,1-1 см2 /с, а в жидкостях 10-4 — 10-5 см2 /с.
К гомогенным процессам в жидкой фазе относятся, например, реакции нейтрализации и обменного разложения в технологии минеральных солей. В жидкой фазе осуществляют ряд процессов в технологии органических веществ: получение простых и сложных эфиров, полимеризация в растворах и расплавах, щелочное плавление бензолсульфокислот в производстве фенола, отдельные стадии сернокислотной гидратации этилена в производстве этилового спирта и др.
В гомогенных средах — газовой и жидкой — многие процессы идут по цепному механизму: окисление, полимеризация и пиролиз углеводородов, галогенирование углеводородов, синтез хлороводорода из элементов и др.
На скорость гомогенных процессов в газовой и жидкой фазах влияют концентрации реагирующих компонентов, давление, температура и перемешивание.
Влияние концентрации реагирующих веществ. На скорость химических реакций в общем случае влияние концентрации описывается уравнением:
u = kDc,
причем u может быть выражено через изменение массы продукта D в единице реакционного объема концентрации с или степени превращения х во времени, т.е.

или 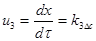 ,
,
где Dc определяется различно, в зависимости от порядка реакции и обратимости ее, а также от степени перемешивания.
Влияние давления. Повышение давления ускоряет газовые реакции аналогично повышению концентрации реагентов, так как с ростом давления увеличиваются концентрации компонентов. Следовательно, влияние давления увеличивается с возрастанием порядка реакции.
Всегда благоприятно применение давления для процессов, протекающих с уменьшением газового объема, так как, согласно принципу Ле Шателье, повышение давления вызывает увеличение выхода продукта.
Выход продукта газовой реакции синтеза увеличивается с повышением давления. Повышение давления уменьшает объем газовой смеси, в результате чего снижаются размеры аппаратов и сечения газопроводов.
Небольшое повышение давления мало влияет на скорость процессов в жидкой фазе, однако скорости многих реакций в жидкой среде сильно увеличиваются при весьма высоких давлениях. Так, при давлении в несколько сотен мегапаскалей скорость процессов полимеризации некоторых мономеров увеличивается в десятки раз. Установлено, что при нормальной температуре молекулы газов деформируются при давлениях выше 350-500 МПа, а молекулы органических жидкостей — выше 700 МПа. При давлениях, соответствующих деформации молекул, можно проводить такие синтезы, которые трудно или невозможно осуществить при обычных давлениях.
Влияние температуры. Повышение температуры вызывает ускорение гомогенных реакций в соответствии с уравнением Аррениуса.
При повышении температуры ускоряются и диффузионные процессы. Однако повышение температуры ограничивается условиями равновесия, возникновением побочных реакций и другими причинами. Для всех процессов стремятся установить наиболее рациональную температуру, при которой затраты на нагревание окупаются ускорением процессов.
Для обратимых реакций повышение температуры, увеличивая константу скорости химической реакции, одновременно влияет на равновесие. Выше указывалось, что для проведения обратимой экзотермической реакции (Р, Т) требуется определенная оптимальная температура, отвечающая максимальному выходу.
Влияние перемешивания. Перемешивание имеет наибольшее значение для жидкостных процессов, поскольку скорости диффузии в жидкостях в десятки и сотни тысяч раз меньше, чем в газах. Перемешивание растворов позволяет сильно увеличить общую скорость процесса за счет снятия диффузионных торможений. Перемешивание жидкости наиболее часто проводится в резервуарах с механическими или пневматическими мешалками.
Для газовых реакций перемешивание необходимо, во-первых, для начального смешения компонентов и, во-вторых, для выравнивания концентраций и температур в ходе процесса. Начальное смешение осуществляется при помощи разнообразных форсунок или сопл, через которые подводятся газы, с таким расчетом, чтобы оня смешались в общем турбулентном потоке.
3. Сравнение различных типов химических реакторов
Одним из факторов, используемых для сравнения и выбора реакторов, является влияние концентрации реагентов, точнее, движущей силы процесса на производительность реактора. При этом условно принимается постоянство других параметров технологического режима. Распределение концентрации реагентов в различных моделях реакторов приведено в таблице.
Реакторы идеального вытеснения и полного смешения. При прохождении реакционной смеси через реактор идеального вытеснения уменьшается концентрация исходных реагентов Са по высоте (длине) реактора и в соответствии с этим снижается движущая сила процесса, а при постоянстве других параметров — и скорость процесса.
Аналогичная картина наблюдается в реакторах периодического действия.
Сравнение различных типов химических реакторов

Сравнение реакторов только по скорости процесса недостаточно. Следует еще учитывать, что постоянство температуры и концентрации реагентов по всему объему реактора смешения облегчает управление процессом, автоматизацию работы реактора. Иногда представляется возможным получение продукта одинакового качества с большим выходом. Например, для проведения ряда процессов полимеризации предпочтителен реактор полного смешения вследствие выравнивания концентрации. Ряд каталитических синтезов проходит с достаточной селективностью лишь в узком интервале температур, легко достижимом в изотермических реакциях полного перемешивания. Характерными примерами таких процессов могут служить синтезы метанола и высших спиртов, в которых повышение температуры на 10—20°С от оптимальной вызывает побочные реакции.
В реакторах смешения, как правило, эффективнее, чем при режиме вытеснения, протекают реакции с высокими концентрациями реагентов и при больших тепловых эффектах реакции. Интенсивное перемешивание улучшает условия теплопередачи; уменьшаются теплообменные поверхности для отвода (или подвода) теплоты, от реагирующей системы.
С другой стороны, перемешивание может вызвать нежелательное истирание твердых реагентов, эрозию аппаратуры, усиление уноса из реактора измельченных твердых частиц или капель жидкости. Энергетические затраты в реакторах смешения могут быть в несколько раз выше, чем при режиме вытеснения.
Таким образом, для выбора модели реактора необходимо сопоставить все положительные и отрицательные стороны предполагаемых типов реакторов и остановиться на такой модели, которая обеспечит, в конечном счете наиболее экономическое осуществление процесса.
Единичный реактор и каскад реакторов полного смешения.Сравнение распределения концентраций в единичном реакторе полного смешения и в каскаде, состоящем из реакторов смешения одинакового объема, приведено в таблице.
Движущая сила процесса DС в каскаде будет больше, чем в единичном реакторе. Разница в DС будет тем большей, чем большее число реакторов в каскаде. При бесконечно большом числе реакторов в каскаде DС каскада приближается к DС реактора идеального вытеснения.
Реакторы периодического и непрерывного действия. Реакторы периодического действия работают при нестационарном технологическом режиме. При этом независимо от степени перемешивания реагирующих масс изменяются во времени не только концентрации реагентов, но и температура, давление, а соответственно и константа скорости процесса. Если периодический реактор работает в режиме полного смешения, то время, необходимое для достижения заданной степени превращения, рассчитывается по характеристическому уравнению (см. табл.), которое совпадает с характеристическим уравнением реактора идеального вытеснения (см. табл.). Следовательно, если были бы возможны одинаковые условия проведения процесса в реакторах периодического действия и идеального вытеснения, то их объемы были бы равны между собой. Однако, условия протекания процессов в промышленных проточных реакторах, как правило, лучше, чем в периодических.
Кроме того, производительность реактора периодического действия ниже, чем реактора идеального вытеснения, работающего непрерывно, потому что при использовании периодически действующего реактора затрачивается некоторое время на загрузку реагентов, после чего в нем происходит химическое превращение. По окончании реакции производят опорожнение реактора, на что также требуется определенное время. Следовательно, работа такого реактора складывается из чередующихся циклов: загрузка — химическое превращение — разгрузка. При этом полезным периодом работы реактора является стадия химических превращений.
Таким образом, использование периодически работающих реакторов целесообразно для малотоннажных производств, например реактивов, некоторых катализаторов, фармацевтических и лакокрасочных материалов.
4. Технологические связи между элементами ХТС
Химико-технологически есистемы представляют совокупность физико-химических процессов и средств для их проведения с целью получения продукта заданного качества и в требуемом количестве.
ХТС состоит из элементов, из отдельных частей, в которых протекают технологические операции, необходимые для достижения цели, поставленной перед ХТС.
Конкретные ХТС отличаются большой сложностью и разнообразием структур, практически все конкретные структуры могут быть при помощи декомпозиции и агрегации элементов (объединение нескольких элементов в так называемый суперэлемент) сведены к небольшому числу типовых структур с характерным соотношением направлений соединяющих их потоков.
Последовательная технологическая связь — это такая связь (рис.1, а), когда поток, выходящий из одного элемента, является входящим для следующего и все технологические потоки проходят через каждый элемент системы не более одного раза. Последовательное соединение элементов — основной прием в химической технологии, так как оно соответствует многошаговому принципу переработки сырья в качественно различных элементах.
Параллельная технологическая связь — это такая связь, когда выходящий из i-гo элемента ХТС поток разбивается на несколько параллельных подпотоков (рис. 1, б). Параллельная технологическая связь применяется для повышения мощности, надежности, гибкости ХТС, а также при параллельном получении на базе одного исходного вещества двух или нескольких продуктов.
Последовательно-обводная технологическая связь (байпас) — это такая технологическая связь, при реализации которой часть выходного потока из одного элемента минует некоторые элементы ХТС в последовательной цепи аппаратов, а затем снова объединяется с основным потоком. Примером такой связи является цепочка аппаратов: делитель потоков, теплообменник, смеситель потоков (рис. 1, 3) для регулирования температуры на выходе теплообменного узла. Кроме того, байпас широко применяется в системах переработки с последующим смешением, где для обеспечения заданного состава и качества продукта необходимо переработать не весь поток, а лишь часть его. Потоки смешиваются в таком соотношении, чтобы получился продукт заданного качества.
Обратная технологическая связь (рис. 1, г) характеризуется наличием рециркуляционного потока, связывающего выход последующего элемента ХТС с входом предыдущего.
Обратная технологическая связь предусматривает многократное возвращение потоков в один и тот же элемент системы. Типичными примерами ХТС с обратными связями являются ХТС синтеза метанола. аммиака и др.

а)



 Рис.1. Технологические связи
Рис.1. Технологические связиПо особенностям технологические структуры ХТС подразделяют на разомкнутые и замкнутые. В разомкнутых ХТС технологические потоки проходят через любой элемент системы только один раз. Замкнутыми называются ХТС, содержащие, по крайней мере, одну обратную технологическую связь.
Задача 5
Карбид кальция получают путем взаимодействия извести и кокса по реакции:
CaO + 3C ® CaC2 + CO
Определить расходные коэффициенты по коксу и извести в производстве технического карбида кальция, имеющего следующий состав: CaС2 – 7%, СаО – 15%, С – 3%, прочие примеси – 4%. Известь содержит 96% СаО, содержание углерода в коксе 89%. Расчет вести на 1 т технического карбида кальция.
Расчет извести: В 1 т продукта содержится 780 кг СаС2; на образование этого количества по стехеометрическому соотношению требуется: 
Кроме того в техническом продукте содержится непрореагировавшего СаО
1000·0,15 = 150 кг
Расход СаО:
682,5+150 = 832,5 кг
Расходный коэффициент технической извести:
Апр = 832,5/0,96 = 867,2 кг
Расход кокса: на образование СаС2 расходуется углерода:
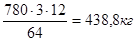
В готовом продукте непрореагировавшего углерода
1000·0,03 = 30 кг
Расход углерода 438,8 + 30 = 468,8 кг
Расходный коэффициент по коксу:
Апр = 468,8/0,89 = 526,7 кг
Список использованной литературы
1. Общая химическая технология / под ред. И.П.Мухленова. – М.: Высшая школа, 1991. – 463 с.
2. Общая химическая технология / под ред. А.Г.Амелина. – М.: Химия, 1977. – 269 с.
4. Кутепов А.М. Общая химическая технология / А.М. Кутепов, Т.И.Бондарева, М.Г.Беренгартен. – 2-е изд., перераб. и доп. – М.: Высшая школа, 1990. – 250 с.
www.ronl.ru
Водоподготовкой (водоочисткой) называется комплекс мер, направленных на повышение качества жидкости из природных источников путем ее освобождения от солей, примесей и биологических агентов.
Оптимальные технологические методики существенно различаются в каждом конкретном случае, однако, всех их можно отнести к той или иной стадии процесса подготовки воды.
Контроль над соответствием требованиям безопасности параметров подаваемой населению воды давно не является приоритетом для муниципальных служб. Проблему отчасти решает установка дополнительных систем очистки силами граждан. Наиболее доступное решение в этой сфере – бытовые фильтры для воды. Стоимость фильтрующего оборудования обычно невысока, а сложность их монтажа и регулярного обслуживания минимальна.При отсутствии централизованного водоснабжения возникает однозначная необходимость в более совершенных системах очистки. В загородном доме или на даче источником воды обычно служит закрытый колодец. Даже если качество жидкости устраивает владельцев большую часть года, при сезонных повышениях уровня грунтовых вод оно может резко ухудшаться.
Оптимальным вариантом в этом случае станет установка комплексной системы фильтров, обеспечивающей достаточный уровень очистки от механических загрязнений с последующим обеззараживанием.Особенно значимую роль играет водоподготовка для котельной частного дома или коттеджа. Возможности по очистке в этом случае ограничены соображениями безопасности: в частности, для умягчения воды и связывания солей жесткости не используются многие эффективные технологии из-за возможного пагубного влияния на здоровье людей. Стоит помнить, что установка любого дополнительного оборудования для бытового газового котла требует обязательного согласования проекта в соответствующих службах.
Основные требования к качеству воды.Установленные в нашей стране требования к физико-химическим параметрам технической и питьевой воды нельзя назвать слишком жесткими, однако для обеспечения нормальной работы оборудования и безопасности населения они вполне достаточны.
Отбор проб воды для анализа.Для проведения анализов используется свежая вода, забор которой осуществляется из скважины или колодца непосредственно перед процедурой. Допускается хранение в закрытой бутылке в течение 2-3 часов при температуре не выше 10С.
Пригодная для питья жидкость имеет мутность не выше 2.6 ЕМФ, жесткость - порядка 7мг-экв/л и слабо ощутимые привкус и запах. Коэффициент pH может изменяться в разных регионах, но должен оставаться в пределах 6-9 единиц. Содержание ионов металлов в такой воде не превышает 1мг/л, кроме кальция, магния, натрия и железа.
В миллилитре воды не должно содержаться болезнетворных микроорганизмов, а общее микробное число не может превышать 50 единиц на мл.
На сегодняшний день водоподготовка и водоочистка для нужд производства и коммунальных сетей является обязательной мерой, без которой работа системы водоснабжения попросту невозможна.
Наиболее важна обработка воды в энергетической промышленности, где жидкость выступает в роли теплоносителя. Если при простом перекачивании многие соли жесткости и другие примеси остаются в виде ионов, то нагревание и тем более испарение воды многократно повышает их активность и приводит к оседанию в виде накипи. Недостаточная очистка воды в теплоэнергетике становится причиной порчи дорогостоящего оборудования: котлов, трубопроводов, градирен.
Собственная станция очистки есть и на крупных предприятиях пищевой промышленности. Здесь требования к кондициям воды еще более жесткие, ведь она входит в состав продукции таких комбинатов.
В наименьшей степени водоподготовка значима при использовании жидкости в системах охлаждения и опрыскивания. Тем не менее, даже в этом случае необходимо проведение большинства процедур по ее очистке и обеззараживанию.
Следует учитывать тот факт, что промышленная водоподготовка включает не только методики, применяемые на производстве, но и всякую обработку жидкости с использованием оборудования соответствующего класса. К примеру, очистка воды в коммунальных сетях или хлорирование бассейнов также относятся к этой категории водоподготовки. Сюда же входит водоподготовка для коттеджа или частного дома, если они подключены к станции очистки воды дачного поселка или города.
В процессе промышленной водоподготовки применяют механические, физические, химические и физико-химические методы: осветление, умягчение, ионный обмен, обескремнивание и дегазацию. Питьевую воду, кроме того, дезинфицируют. В приведенной на рис. 1.1 схеме показаны основные методы промышленной водоподготовки. Осветление воды осуществляется в основном методами осаждения примесей, выделяющихся из воды в виде осадка. Эти методы называют также реагентными, так как для выделения примесей в воду вводят специальные реагенты. К процессам осаждения, применяемым для осветления воды в промышленной водоподготовке, относятся коагуляция, известкование и магнезиальное обескремнивание.
Рис. 1.1. Схема очистки воды
Под коагуляцией понимают физико-химический процесс слипания коллоидных частиц и образования грубодисперсной микрофазы (флокул) с последующим ее осаждением. В качестве реагентов для промышленной водоподготовки, обычно применяют сульфаты Al2(SO4)3 и FeSO4. Повышение эффекта коагуляции достигается при добавлении флокулянтов (полиакриламида, активной кремниевой кислоты и др.). При этом ускоряется образование хлопьев и улучшается их структура. Образовавшуюся хлопьевидную массу, состоящую в основном из гидроксидов Аl и Fe и примесей, выделяют из воды в отстойниках или специальных осветлителях (осадок в них поддерживается во взвешенном состоянии потоком поступающей снизу воды), напорных или открытых фильтрах и контактных осветлителях с загрузкой из зернистых материалов (кварцевый песок, дробленый антрацит, керамзит, шунгизит и др.), а также во флотаторах, гидроциклонах, намывных фильтрах. Для частичного удаления крупнодисперсных примесей и фитопланктона, образующегося при цветении водоемов, применяют сетчатые микрофильтры, плоские и барабанные сетки.
Известкование воды производится для снижения гидрокарбонатной щелочности воды. Одновременно с этим уменьшаются жесткость, солесодержание, концентрации грубодисперсных примесей, соединений железа и кремниевой кислоты. Реагентом для этого процесса является гашеная известь Са(ОН)2, которая подается в воду в виде суспензии (известкового молока). Для повышения эффективности удаления кремниевой кислоты при водоподготовке воду добавляют каустический магнезит (70…80 % MgO). Эти процессы, как правило, совмещаются и проводятся одновременно в одном аппарате – осветлителе. Окончательная очистка от осадка осуществляется с помощью фильтрования. В зависимости от соотношения размеров фильтруемых частиц и эффективного диаметра пор удержание частиц может происходить как в объеме фильтрующего слоя (адгезионное фильтрование), так и на его поверхности (пленочное фильтрование). В качестве фильтрующих материалов в основном используют кварцевый песок, дробленый антрацит, сульфоуголь, целлюлозу, перлит, вулканические шлаки, керамзит и др.
Умягчение воды в промышленной водоподготовке - очистка от соединений кальция и магния, обусловливающих жесткость воды. Одним из наиболее эффективных способов умягчения воды является известково-содовый в сочетании с фосфатным. Процесс умягчения основывается на следующих реакциях:
1. Обработка гашеной известью для устранения временной жесткости, удаления ионов железа и связывания СО2:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 ↓ + 2Н2О;
Mg(HCO3)2 + 2Ca(OH)2 → 2СаСО3 ↓ + Mg(OH)2 ↓ + 2h3O;
FeSO4 + Ca(OH)2 → Fe(OH)2 ↓ + CaSO4 ↓;
CO2 + Ca(OH)2 →CaCO3 ↓ + h3O;
2. Обработка кальцинированной содой для устранения постоянной жесткости:
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
MgCl2 + Na2CO3 → MgCO3 ↓ + 2NaCl
CaS04 + Na2CO3 → CaCO3 ↓ + Na2SO4
3. Обработка тринатрийфосфатом для более полного осаждения катионов Са2+ и Mg2+:
3Ca(HCO3)2 + 2Na3PO4 → Са3(РО4)2 ↓ + 6NaHCO3;
3MgCI2 + 2Na3PO4 → Mg3(PO4)2 ↓ + 6NaCl.
Растворимость фосфатов кальция и магния ничтожно мала, что обеспечивает высокую эффективность фосфатного метода.
Сегодня в промышленной водоподготовке для умягчения, обессоливания воды и удаления кремня специалисты РХТУ им. Д.И. Менделеева применяют мембранные технологии (нанофильтрации и низконапорный обратный осмос), а также технологии ионного обмена. Сущность метода ионного обмена в том, что твердое тело – ионит – поглощает из раствора электролита положительные или отрицательные ионы в обмен на эквивалентное количество других, одноименно заряжен- ных ионов. В соответствии со знаком заряда обменивающихся ионов различают катиониты и аниониты.
Катиониты – практически нерастворимые в воде вещества, представляющие собой соли или кислоты с анионом, обусловливающим нерастворимость в воде; катион же (натрий или водород) способен вступать в определенных условиях в обменную реакцию с катионами раствора, в котором находится катионит. Катиониты соответственно называются Na-катионитами и Н-катионитами.
Аниониты – основания или соли с твердым нерастворимым катионом. Аниониты содержат подвижную гидроксильную группу (ОН-аниониты).
В качестве Na-катионитов в промышленной водоподготовке применяют алюмосиликаты: глауконит, цеолит, пермутит и другие; в качестве Н-катионитов – сульфоуголь, синтетические смолы; к ОН-анионитам относятся искусственные смолы сложного состава, например карбамидные. Ионный обмен между раствором и ионитом имеет характер гетерогенной химической реакции. Следует отметить, что примеси, удаляемые из воды методом ионного обмена, не образуют осадка, и что такая обработка не требует непрерывного дозирования компонентов. Важной характеристикой ионитов является обменная емкость, показывающая способность ионита поглощать определенное количество ионов в данных условиях. Обменная емкость определяет продолжительность рабочего цикла ионитовых фильтров. При достижении заданного предела обменной емкости ионита проводят процесс его восстановления (ионный обмен, проводимый в обратном порядке). В основе катионного процесса умягчения лежат реакции обмена ионов натрия и водорода катионитов на ионы Са2+ и Mg2+. Обмен ионов натрия называется Na-катионированием, а ионов водорода – Н - катионированием:
2R/Na+ + Ca2+ R2/Ca2+ + 2Na+;
2R/Na+ + Mg2+ R2/Mg2+ + 2Na+,
где R – комплекс матрицы и функциональной группы, не участвующей в ионном обмене (его принято считать одновалентным). Обмен катионов при Н-катионировании протекает согласно реакциям:
2R/H+ + Ca2+ R2/Ca2+ + 2H+;
2R/H+ + Mg2+ R2/Mg2+ + 2H+;
R/H+ + Na+ R/Na+ + H+.
При достижении катионитами заданного предела обменной емкости их регенерируют промывкой раствором NaCl или серной кислоты h3SO4. Регенерация Н-катионного фильтра производится 1…1,5 %-ным раствором серной кислоты. Регенерация анионитовых фильтров производится обычно 4 %-ным раствором NaOH.
На рис. 1.2 представлена схема установки для водоподготовки с последовательным применением Н - катионирования и ОН-анионирования. При прохождении воды через катионит она освобождается от ионов кальция и магния в Н-катионитовом фильтре 1, а затем в анионитовом фильтре 2 из нее удаляются анионы. Далее вода проходит через дегазатор 3, где она освобождается от кислорода и диоксида углерода, и далее через сборник 4 к потребителю. Для регенерации в фильтр 1 подается раствор серной кислоты, в фильтр 2 – гидроксида натрия.
Рис. 1.2. Схема установки для умягчения воды: 1 – катионитовый фильтр; 2 – анионитовый фильтр; 3 – дегазатор; 4 – сборник воды.
Важная часть комплексного технологического процесса водоподготовки – удаление из воды растворенных газов. Наличие газов в воде объясняется как их сорбцией и протеканием химических реакций в процессе образования примесей в природной воде, так и появлением их в процессе различных стадий очистки. Эти газы можно разделить на химически невзаимодействующие (Н2, О2, СН4) и химически взаимодействующие с водой и ее примесями (Nh4, CO2, Сl2), а также на коррозионно-активные (О2, СО2, Nh4, Cl2, h3S) и инертные (N2, h3, СН4). Концентрация газов в воде зависит от многих факторов, основные из них – физическая природа газа, степень насыщения, давление в системе и температура воды.
Основной способ удаления из воды растворенных газов процессе водоподготовки – десорбция (термическая деаэрация). Принцип ее заключается в создании контакта воды с паром, в котором парциальное давление газа, удаляемого из воды, близко к нулю, что является необходимым условием процесса десорбции. Этот процесс осуществляется, в основном, в деаэраторах (вакуумных, атмосферных, постоянного давления), которые по способу распределения воды и пара разделяют на струйные, пленочные и барботажные. Интервал рабочего давления в вакуумных деаэраторах составляет 0,0075…0,05 МПа.
myunivercity.ru
1.4 Коагуляция
КОАГУЛЯЦИЯ (от лат. coagulatio- свертывание, сгущение), объединение частиц дисперсной фазы в агрегаты вследствие сцепления (адгезии) частиц при их соударениях. Соударения происходят в результате броуновского движения, а также седиментации, перемещения частиц в электрич. поле (электрокоагуляция), мех. воздействия на систему перемешивания... Наиболее часто в качестве коагулянта используют полигидраты солей алюминия и железа, например, полиалюмогидрохлорид или полиалюмогидросульфат, или полигидрат сульфата железа (II). Последний реагент применяется при совмещении процессов коагуляции и известкования.
Процесс осветления коагуляцией – сложное физико-химическое явление, успех которого зависит от массы параметров. Тем не менее, можно выделить четыре основных фактора, которые определяют скорость и качество протекания реакции.
1. Скорость потока. Поскольку глубина процесса детерминирована временем образования и укрупнения флокул, следует учитывать, что режим потока может существенно влиять на возникающие первичные рыхлые хлопья. В пределе, они могут даже разрушаться. Поэтому скорость потока воды в зоне реакции и отстаивания не должна превышать 1-1,5 мм/с.
2. рН среды. В связи с тем, что скорость и глубину гидролиза коагулянта определяет кислотность среды, она должна находиться в заданных для данного реагента параметрах. Например, для сульфата алюминия эмпирическое значение оптимального рН находится в пределах 5,5-7,5. В более кислой (рН≤ 4,5) среде гидролиз реагента не происходит, а в более щелочной (свыше 8) получившийся гидроксид алюминия, благодаря амфотерности металла, диссоциирует, как кислота, в результате чего эффективность процесса падает.
3. Температура. Подогрев (до 40єС) и перемешивание очищаемой воды увеличивает скорость процесса и повышает размер флокул.
4. Дозировка коагулянта. Оптимальная дозировка коагулянта определяется на основе анализа природной воды и может варьировать в достаточно широких пределах, в зависимости от времени года и пр.
Следует заметить, что последний фактор может иметь решающее значение в стоимости первичной обработки воды, поскольку реагенты для такой обработки достаточно дороги. Для снижения расходов оптимальным выходом становится внедрение автоматизированных систем первичной обработки. Они позволяют существенно сократить расход химикатов (за счет высокой точности подачи – до 1-1,5% по объему) и оптимизировать процессы первичной очистки. Такие системы сегодня нашли достаточно широкое применение в водозаборах. Например, на Западном водозаборе г. Москвы, откуда вода поступает, в том числе, и на ТЭЦ, вода из реки проходит обработку флокулянтами (полиалюмогидрохлорид) при помощи установок GRUNDFOS POLYDOS, при этом станция также самостоятельно поддерживает оптимальный рН. Система полностью автоматизирована и контролируется, через специальные шкафы управления, из центрального диспетчерского пункта.
1.5 Флотация
Флотация (франц. flottation, от flotter - плавать), процесс разделения мелких твёрдых частиц (главным образом минералов), основанный на различии их в смачиваемости водой.
Известно, что при флотации мелкие частицы уносятся мелкими газовыми пузырьками, крупные-крупными, а эффективность флотации зависит еще и от электрического заряда пузырька.
Флотация – способ промышленно очистки воды, основанный на удалении загрязнений с помощью пузырьков воздуха. Всплывая, они захватывают частицы примесей, в том числе масел и нефтепродуктов, и выносят их на поверхность воды, образуя там пленку или пенный слой, который затем снимается специальными пеносборными механизмами. Флотаторы предназначены для доочистки сточных вод от мелких частиц минерального происхождения и нерастворимых нефтепродуктов, которые присутствуют в воде в виде мелких капель.
Процесс образования комплекса пузырек-частица происходит в три стадии: сближение пузырька воздуха и частицы в жидкой фазе, контакт пузырька с частицей и прилипание пузырька к частице.
Прочность соединения пузырек-частица зависит от размеров пузырька и частицы, физико-химических свойств пузырька, частицы и жидкости, гидродинамических условий и других факторов.
Процесс очистки стоков при флотации заключается в следующем. Поток жидкости и поток воздуха (мелких пузырьков) в большинстве случаев движутся в одном направлении. Взвешенные частицы загрязнений находятся во всем объеме сточной воды и при совместном движении с пузырьками воздуха происходит агрегатирование частицы с воздухом. Если пузырьки воздуха значительных размеров, то скорости воздушного пузырька и загрязненной частицы различаются так сильно, что частицы не могут закрепиться на поверхности воздушного пузырька. Кроме того, большие воздушные пузырьки при быстром движении сильно перемешивают воду, вызывая разъединение уже соединенных воздушных пузырьков и загрязненных частиц. Поэтому для нормальной работы флотатора во флотационную камеру не допускаются пузырьки более определенного размера.
1.6 Ионный обмен
ИОННЫЙ ОБМЕН - это обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом (ионитом) и раствором электролита.
В водоподготовке ионный обмен применяют для умягчения, обессоливания воды, селективного удаления различных ионов и т.д.
ИОНИТЫ (ионообменники, ионообменные сорбенты), полимерные в-ва и материалы, содержащие ионогенные и (или) комплексообразующие группы, способные к обмену ионов при контакте с р-рами электролитов. Большинство ионитов - твердые нерастворимые полиэлектролиты аморфной или кристаллич. структуры. Ионогенные группы закреплены на мол. каркасе (матрице) и диссоциируют, давая полиионы (фиксир. ионы) и подвижные противоионы, компенсирующие заряды полиионов.
Принцип действия метода основан на возможности ионитов изменять состав обрабатываемой воды в необходимом направлении. Реакция происходит на поверхности ионита – полимера, в состав которого входят функциональные группы, способные поглощать из раствора ионы определенного заряда в обмен на эквивалентные количества других ионов того же заряда. При этом выбор типа смолы (анионит или катионит) напрямую зависит от состава и качества очищаемой воды.
В общих чертах, метод состоит в прокачивании воды через колонки с ионитом. При этом в формирующейся зоне фильтрации (фронт фильтрации) и происходит реакция ионообмена. Подлежащая очистке вода проходит через один или систему фильтров (колонки), заполненных ионитами, подбираемыми в зависимости от требуемой задачи. Иониты удаляют из воды соответствующие ионы и обмениваются с водой эквивалентными количествами других ионов, которые первоначально находились в ионите. Обменивающиеся ионы называются противоионами. После достижения предела емкости ионита (возникновения проскока поглощаемого иона) колонка требует регенерации.
Иониты состоят из неподвижного каркаса - матрицы и функциональных групп - фиксированных ионов, которые жестко прикреплены к матрице и взаимодействуют с противоионами.
В зависимости от знака заряда противоионов иониты делят на катиониты и аниониты. Если противоионы заряжены положительно, т.е. являются катионами (например, ионы водорода Н+ или ионы металлов), ионит называют катионитом. Если противоионы заряжены отрицательно, т.е. являются анионами (например, ион гидроксила ОН- или кислотные остатки), ионит называют анионитом.
Различают сильно- и слабокислотные катиониты (в Н+- или Na+ - форме) и сильно- и слабоосновные аниониты (в ОН- - или солевой форме), а также иониты смешанного действия.
Ионообменную очистку реализуют последовательным фильтрованием сточной воды через катиониты и аниониты. При контакте сточной воды с катионитом в водородной форме имеет место обмен катионов растворенных в воде солей на Н+ -ионы катионита в соответствии с уравнением реакции
n[К]Н + Меn+ [К]nМе + nН+ , (5)
где К — «скелет» (радикал) катионита; Me — извлекаемый из сточной воды катион металла; n — заряд катиона. При этом имеет место увеличение кислотности сточной воды.
При контакте сточной воды с анионитом в гидроксильной форм происходит обмен анионов кислот на ОН--ионы анионита в соответствии с уравнением реакции
m[Аn]ОН + Аm- [Аn]mА + mOН-, (6)
где Аn — «скелет» (радикал) анионита; А — извлекаемый из сточной воды анион; m —заряд аниона.
Основными характеристиками ионитов являются: селективность, рабочая обменная емкость и кинетика ионного обмена.
Селективность ионита показывает, насколько эффективно ионит способен удалять те или иные противоионы в присутствии других конкурирующих противоионов. Селективность ионитов определяется природой матрицы ионита, типом функциональных групп, концентрацией противоионов в растворе и т.д. Как правило, селективность ионитов возрастает с увеличением заряда противоиона, а среди ионов с одним и тем же зарядом - с увеличением атомного веса. Т.е., чем тяжелее противоион и чем выше его заряд, тем большую селективность проявляет к нему ионит. Типичный ряд селективности показан ниже:
Na+<K+<Mg2+<Ca2+<Fe 2+<Mn2+<Ba2+<Fe3+
Исключение составляют противоионы, которые образуют малодиссоциирующие соединения с фиксированными группами, например, слабоосновные иониты с анионами слабых кислот (карбонатами), или некоторые цеолиты с аммонием. Кроме того, возможны специфические взаимодействия, основанные на хелатном эффекте или на ситовом эффекте.
Обращение селективности наблюдается при увеличении концентрации раствора. Например, двухзарядные противоионы могут быть вытеснены из ионита однозарядными противоионами при контакте с раствором, содержащим однозарядные противоионы в высокой концентрации. Этим определяется важнейшее свойство ионитов - их способность к регенерации после насыщения ионами, удаляемыми из воды, путем промывки примерно 5-6%-ми растворами кислот (для катионитов) или щелочей (для анионитов) или 10-12%-ыми растворами солей. Именно это свойство позволяет многократно, в течение нескольких лет, использовать загрузку ионитов для очистки воды.
Величина рабочей обменной емкости определяет, как долго может работать ионит в данных условиях до первого проскока поглощаемого иона в фильтрат, а, следовательно, показывает ресурс работы ионита в процессе водоподготовки. Обычно обменную емкость принято выражать в эквивалентах на литр набухшего ионита.
Кинетика ионного обмена определяет скорость протекания ионообменной реакции и, следовательно, требуемую скорость фильтрования. На скорость ионного обмена влияют следующие факторы: доступность фиксированных ионов внутри каркаса ионита, размер гранул ионита, температура, концентрация раствора и т.д.
Общая скорость процесса ионного обмена может быть представлена как совокупность процессов, происходящих в растворе (диффузия противоионов к зерну и от зерна ионита) и в ионите (диффузия противоионов от поверхности к центру зерна ионита и в обратном направлении; обмен противоионов ионита на противоионы из раствора):
В условиях, приближенных к реальным условиям очистки воды, доминирующим фактором, определяющим скорость ионного обмена, является диффузия ионов внутри зерна ионита. Следовательно, скорость ионного обмена, прежде всего, зависит от размера зерна ионита и увеличивается с уменьшением размера зерна.
Следует отметить, что ионообмен, несмотря на эффективность, имеет ряд недостатков, которые снижают ценность технологии в глобальной перспективе.
Во-первых, велики затраты на регенерацию фильтров и досыпку ионитов. Во-вторых, низка экологичность метода из-за образования значительного количества солевых стоков опасной концентрации. Например, для умягчения при жесткости исходной воды 7 мгчэкв/л и расходе умягченной воды 1000 т/ч расход реагентов для регенерации фильтров (NaCl) достигает 30 т/сут. При этом сброс опасных засоленных стоков (в пересчете на твердые соли), который поступает в поверхностные водоемы, также соответствует этой цифре, следовательно, требуются меры по их обезвреживанию. В-третьих, велика вероятность «отравления» ионитов органическими соединениями, растворенными в воде, и, как следствие, снижения эффективности установки. Кроме того, неполярные органические соединения практически не задерживается на колоннах. В результате они попадает в котлы и трубопроводы, вызывая коррозию оборудования.
Преимущества ионного обмена. Основное преимущество умягчения воды с помощью ионного обмена - простота управления процессом. Обычные колебания жесткости сырьевой воды или скорости потока не влияют на эффективность умягчения. Кроме того, система обычно занимает меньшую площадь, чем система умягчения известью и кальцинированной содой, и в большинстве случаев дает более мягкую воду. Использование кислотных обменников обладает преимуществами, когда требуется мягкая вода с низкой щелочностью. Главное преимущество деминерализации при ионном обмене - ее способность производить воду лучшего качества по сравнению с той, которая может быть получена любым другим методом.
myunivercity.ru