
ТОП 10:
Реферат на тему:
Ге́нри Ка́вендиш (англ. Henry Cavendish; 10 октября 1731 — 24 февраля 1810) — британский физик и химик, член Лондонского королевского общества (с 1760 года).
Генри Кавендиш родился 10 октября 1731 в Ницце в семье лорда Чарльза Кавендиша, сына второго герцог Девоншира Вильяма Кавендиша, и леди Анны Грей, дочери первого герцога Кента Генри Грея. Младший брат Генри Фредерик получил серьезные повреждения мозга в результате случайного падения в возрасте двадцати одного года во время своего последнего года в Кембриджском университете. Данные свидетельствуют о том, что он пытался повторить знаменитый эксперимент Бенджамина Франклина о природе молнии во время приближающейся грозы, и упал из верхнего окна здания. Он нуждался в специальном уходе на протяжении всей своей жизни. Леди Анна умерла, предположительно от туберкулеза, вскоре после рождения Фредерика, так что ни один из мальчиков не знал мать. Семья Кавендишей была тесно связана с многими аристократическими семьями Великобритании, ее история насчитывает около восьми веков и восходит к эпохе Норманнов.
Генри вместе со своим братом Фредериком получил начальное образование дома. Первоначально планировалось продолжить обучение братьев в Итоне — классической английской школе, дававшей хорошую подготовку будущим государственным деятелям. Однако ни Генри, ни его брат, не проявляли склонности к юридической науке, поэтому отец решил отправить их в специализированное научное учреждение. Он остановился на академии Хакни, многие из преподавателей которой были тесно знакомы с передовыми умами современной науки. Генри и Фредерик были первыми членами семьи Кавендишей, окончившими академию Хакни, однако позднее эта школа стала очень популярной среди других аристократических английских семей.
В 1749 году в возрасте до восемнадцати лет Генри поступает в Кембриджский университет и, продолжая родовую традицию, становится двадцать первым членом семьи Кавендишей, поступившим в этот университет. Его брат Фердерик поступает в университет двумя годами позже. Обучение в университете, впитавшем в себя идеи Исаака Ньютона, сильно повлияло на мировоззрения братьев. Генри Кавендиш уходит из университета в 1753 году, не получая ученой степени, поскольку не видит необходимости в академической карьере. После ухода из университета он начинает вести собственные научные исследования в уединении своего жилища.
Опубликованные работы Кавендиша касаются в основном исследованиям газов и относятся к периоду 1766—1788 гг. Мы остановимся на основной работе ученого «Искусственный воздух». Эта работа представляет большой научный интерес, а также состава и свойств воды.
Пневматические исследования Кавендиша знаменательны количеством открытий, которые они предварили. Среди наиболее значимых из них первое полное изложение свойств водорода и углекислого газа; демонстрация постоянства состава атмосферного воздуха и его первый расчет его состава относительно высокой точности; записи известных экспериментов, которые привели к обнаружению нетривиальных свойств воды и к открытию состава азотной кислоты.
До плодотворных экспериментов Кавендиша пневматическая химия едва ли существовала. В работах немногих ученых по всему миру встречались упоминания об 'упругой жидкости', которая участвует в некоторых химических превращениях. Парацельс имел некоторое знакомство с водородом . Ван Гельмонт, который ввел понятие «газ», работал над выделением углекислого газа и некоторых горючих газообразных соединений углерода и серы, Бойль в своих экспериментах столкнулся с угольной кислотой и водородом.
Перечисленные ученые были наиболее близки к понимаю газов как индивидуальных веществ, но слишком мало знакомы с их различными свойствами, по которым эти газы можно отличить и распознать. Убежденность в том, что именно воздух, а не индивидуальные газы, выделяется в процессе реакции, была свойственна практически всем химикам второй половины восемнадцатого века. Развитие пневматической химии могло произойти только на основании наблюдения отличий между полученным в разных реакциях искусственным воздухом, но химики мало обращали внимания на эти различия, указывая лишь на сходство и отличия полученных газов от атмосферного воздуха.
Ярким примером служат знаменитые очерки Стивена Хейлза, в которых он пишет о реакциях, в которых выделяется «атмосферный воздух» или «упругие жидкости». Согласно современным представлениям, в ходе своего исследования в действительности он получал кислород, водород, азот, хлор, углекислый газ, сернистую кислоту и другие газы. Хейлз не сумел заметить различий в запахе, цвете, растворимости в воде, горючести полученных веществ. Он рассматривал их как идентичные атмосферному воздуху, потому что проявляли одинаковую эластичность и, как казалось ученому ввиду неточности оборудования, обладали одинаковыми весами. Их поразительные различия в реакционной способности он считал результатом случайного смешения «истинного воздуха» с инородными примесями, а не как существенные и отличительные свойства различных «упругих жидкостей» или газов.
Хакорт, исследуя эксперименты Бойля, отметил некоторые отличия полученных им «упругих жидкостей» от атмосферного воздуха. За неимением других доказательств, эта теория была отметена как ложная.
В 1754 году, однако, отмечается появление первой диссертации Блэка, в которой показано существование по крайней мере одной «упругой жидкости», которая обладает постоянным химическими свойствами, отличными от свойств атмосферного воздуха. Поскольку результаты его исследований шли в разрез со сложившимся мнением, он не осмеливается дать выделенному газу (водороду) название и ссылается на ошибку эксперимента, планируя в дальнейшем поставить его более точно.
Тем не менее, Блэк делает большой шаг вперед по сравнению со своими предшественниками. В более поздних работах он описывает свойства раствора угольной кислоты; двенадцатью годами позднее Кавендиш показывает, что она обладает точно такими же химическими свойствами и в свободном состоянии.
Его первое сообщение о газов под названием «Искусственный воздух» было опубликовано в 1766 году . Оно начинается с определения искусственного воздуха, как «любого вида воздуха, который содержится в других органах в „неупругом“ состоянии, и может быть получен оттуда». Далее следуют ссылки на работы Блэка, в которых он заявляет о своем намерении в последующем пользоваться термином «зафиксированный воздух» в отношении газа, содержащегося в карбонатах щелочных и щелочноземельных элементов. Кавендиш также называет этот газ «негорючим», противопоставляя его газу, который выделяется при гниении живых организмов и взаимодействии металлов с кислотами. Термины «горючий» и «негорючий» газ впоследствии находят широкое применение.
Свое сообщение Кавендиш делит на три части: первая относится к водороду, вторая — к углекислому газу, третья — к газам, выделяющимся во время брожения и гниения. К основным наблюдениям Кавенидша можно отнести следующие: цинк, железо и олово были единственными металлами, которые выделяли «горючий воздух» при взаимодействии с разбавленными растворами серной и соляной кислот. Цинк растворялся в обеих кислотах с большей скоростью, чем железо и олово, однако выделялось одинаковое количество газа вне зависимости от используемой кислоты. Железо давало одинаковое количество «горючего газа» в растворах серной кислоты разной силы. Олово растворялось лучше всего в теплой соляной кислоте. Унция цинка производила около 356, унция железа — 412 и унция олова — 202 унции «горючего газа».
Все эти металлы легко растворялись в закиси (азотной кислоте) и производили «негорючий воздух» (окислы азота), а также в горячем купоросном масле (концентрированной серной кислоте), также с образованием «негорючего воздуха» с сильным неприятным запахом.
Из этих наблюдений Кавендиш пришел к выводу, что, когда металлы растворяют в разбавленной серной или соляной кислоте, «их флогистон летит, не изменяя свою природу с изменением кислоты и формируя „горючий воздух“, но когда металлы взаимодействуют с концентрированной серной или с азотной кислотой, их флогистон теряет свою горючесть».
В своей работе Кавендиш указал на следующие свойства «горючего газа» (водорода): он не теряет свою эластичность, не проявляет заметного растворения в воде и взаимодействия с щелочами. Кавендиш также исследовал влияние состава смеси кислорода и водорода на взрывоопасность. Смесь из одной части «горючего воздуха» и девяти «обычного» горела исключительно в пределах рассматриваемого сосуда. Смесь из 8 частей «горючего воздуха» и 2 частей «ообычного» воспламенялись без взрыва. При увеличении количества водорода примерно в два раза, горение происходило со взрывом. Из этих экспериментов Кавендиш попытался установить пропорцию между водородом и атмосферным воздухом, необходимую для полного сгорания смеси, однако допустил ошибку, посчитав, что на два объема водорода необходимо 7 объемов воздуха, в то время как 5 объемов последнего было бы достаточно.
Кавендиш также пытался установить массу «горючего газа» водорода. Он пришел к выводу, что легковоспламеняющийся воздух выходит 8760 раз легче, чем вода, или в 11 раз легче, чем «обычный воздух». Водород, однако, в действительности в 14,4 раза легче воздуха.
Первую часть своей работы Кавендиш завершает исследованием взаимодействия меди с соляной кислотой и попытками получить «горючий газ» этим способом. Ученый приходит к выводу, что газ, выделяющийся в реакции (газообразная соляная кислота), не воспламеняется в смеси с атмосферным воздухом, а также теряет эластичность при взаимодействии с водой (в связи с растворением), а значит получить таким образом «горючий газ» не представляется возможным. Исследованиями газообразной соляной кислоты Кавендиш не занимался.
Вторая часть работы Кавендиша носит название «Эксперименты по связанному воздуху, или искусственный воздух, получаемый из щелочных веществ взаимодействием с кислотами или прокаливанием».
Описывая эту часть работы, Кавендиш опирается на полученные Блэком результаты касательно влиянии угольной кислоты на жесткость карбонатов. Кавендиш получил углекислый газ растворением мрамора в соляной кислоте. Он обнаружил, что выделяющийся газ обладает растворимостью в воде, быстро взаимодействует с щелочами, но может сохраняться до одного года под слоем ртути, не теряя эластичности и химических свойств. Для определения растворимости углекислого газа в воде Кавендиш использовал аппарат, открытие которого часто приписывают Пристли. В градуированный сосуд, наполненный ртутью, Кавендиш запускал известные объемы исследуемого газа и воды; таким образом он установил, что «при температуре 55° вода поглощает гораздо больше исследуемого газа, чем обычного воздуха». В ходе своих экспериментов он установил, однако, что вода не всегда поглощает один и тот же объем связанного в мраморе газа. Этот факт ученый объяснял тем, что данный газ содержит вещества, обладающие различной растворимостью в воде. Ученый также выяснил, что холодная вода растворяет гораздо больше такого газа, чем горячая; для объяснения этого факта он приводил в пример кипящую воду, которая не только не способна поглотить какой-либо газ, но и лишается того, что она уже поглотила.
Плотность угольной кислоты была определена так же, как и в случае водорода, она оказалась равной 1,57 плотности атмосферного воздуха. Это определение хорошо воспроизводит известное на данный момент значение 1,529. Неточность определения связано с наличием примеси газообразной соляной кислоты, а также с несовершенством оборудования. Была проведена серия опытов по влиянию углекислого газа на процесс горения, Кавендиш использовал простую установку, содержащую стеклянную банку и восковую свечу. При наличии в банке только атмосферного воздуха свеча горела в течение 80 секунд. При содержании в банке одной части «связанного воздуха» (углекислого газа) и 19 частей атмосферного воздуха свеча горела 51 секунду, при соотношении 1 к 9 — всего 11 секунд. Таким образом, добавление даже небольших количеств углекислого газа к атмосферному воздуху лишает последнего способности к поддержанию горения.
Далее следуют попытки определить количества «связанного воздуха» в карбонатах щелочных металлов. Для этого Кавендиш измерял потерю массы раствора при взаимодействии карбонатов с соляной кислотой. Он пришел к выводу, что карбонат аммония содержит гораздо больше связанного воздуха, чем мрамор, поскольку реакция с соляной кислотой протекает более бурно.
Третья часть работы Кавендиша посвящена «Воздуху, образующемуся в процессах брожения и гниения». Макбрайд, следуя предположению Блэка, показал, что в этих процессах выделяется исключительно углекислый газ. Кавендиш подтвердил этот результат опытами по брожению сладкого вина и яблочного сока. Действительно, газ, выделяющийся в этих процессах, полностью поглощался карбонатом калия, а также обладал такими же растворимостью в воде, действием на пламя и удельным весом, как и «воздух», выделяемый из мрамора.
Газы, выделяющиеся в процессе гниения Кавендиш получал, разлагая бульон при температуре, близкой к температуре кипения воды. Опыт проводил до тех пор, пока газ не переставал выделяться. Полученный газ пропускали через раствор карбоната калия, при этом углекислый газ поглощался и оставалась смесь «обычного воздуха» и некого «горючего воздуха» в пропорции 1 к 4,7. Далее Кавендиш определил удельный вес полученный смеси и сравнил с удельным весом 1 части атмосферного воздуха и 4,7 частями водорода; удельный вес последнего оказался меньше. Ученый сделал вывод о том, что новый полученный «горючий газ» обладает практически такой же природой, что и полученный взаимодействием металлов с кислотами.
Кавендиш смог точно определить состав атмосферы Земли. После тщательных измерений ученый пришел к выводу, что «обычный воздух состоит из одной части воздуха без флогистона (кислорода) и четырех частей воздуха с флогистоном (азота)».
В работе 1785 г описан эксперимент, в котором Кавендишу удалось удалить кислород и азот из образца атмосферного воздуха, но при этом оставалась определенная часть, которую ученый не мог удалить известными ему способами. Из этого эксперимента Кавендиш пришел к выводу, что не более 1 / 120 атмосферного воздуха состоит из газов, отличных от кислорода и азота. Несмотря на то, что аргон на тот момент был уже известен, понадобилось около ста лет, чтобы Рамзай и Релей показали, что именно этот газ составляет остаточную часть атмосферного воздуха.
Помимо своих достижений в области химии, Кавендиш также известен своими опытами, с помощью которых он сумел измерить гравитационную силу и определить точное значение плотности Земли. На основании его результатов, можно вычислить значение для G = 6,754×10−11 м²/кг² [1], что хорошо совпадает с известным всем значением 6,67428×10−11 м²/кг² [2]. Для своего эксперимента Кавендиш использовал оборудование, построенное и сконструированное геологом Джоном Митчеллом, который умер еще до начала эксперимента. Оборудование было направлено к Кавендишу, который завершил эксперимент в 1797 году и опубликовал результаты в 1798 г [3].
Экспериментальная установка состояла из крутильных весов для измерения гравитационного притяжения между двумя свинцовыми шарами массой 350-фунтов и парой 2-дюймовых шаров массой 1,61 фунтов. Используя это оборудование, Кавендиш установил, что средняя плотность Земли в 5,48 раза больше плотности воды. Джон Генри Пойнтинг позже отметил, что данные должны были привести к значению 5,448, и действительно именно это число является средним значением двадцати девяти экспериментов Кавендиша, описанных в его работе.
Кавендишу принадлежат несколько работ об изучении свойств электричества, написанных для Королевского общества, но большая часть его экспериментов была собрана и опубликована Джеймсом Максвеллом только век спустя в 1879 году, вскоре после того, как к тем же результатам пришли другие ученые. К открытиям Кавендиша принадлежат [4]:
Экспериментально установил (1771 г.) влияние среды на ёмкость конденсаторов и определил (1771) значение диэлектрических постоянных ряда веществ. В 1798 сконструировал крутильные весы и измерил с их помощью силу притяжения двух сфер, подтвердив закон всемирного тяготения; определил гравитационную постоянную, массу и среднюю плотность Земли. Занимался определениями теплоты фазовых переходов и удельной теплоёмкости различных веществ. Изобрёл эвдиометр — прибор для анализа газовых смесей, содержащих горючие вещества, ввёл в практику осушители. Предвосхитил многие изобретения XIX века в области электричества, но все его работы оставались достоянием семейного архива в Дервоншире, пока в 1879 Джеймс Максвелл не опубликовал его избранные труды. Именем Кавендиша названа организованная в 1871 г. физическая лаборатория в Кембриджском университете.
Многие источники ошибочно описывают работы Кавендиша как измерение гравитационной постоянной (G) или массы Земли, и эта ошибка уже отмечалась многими авторами [5][6], and this mistake has been pointed out by several authors.[7][8]. В действительности основная цель Кавендиша состояла в определении плотности Земли. Этот результат послужил основой для расчета константы G, которая впервые использована была в 1873 году, почти через 100 лет после опыта Кавендиша [9]. Результаты опыта Кавендиаш также могут быть использованы для вычисления массы Земли.
Кавендиш вел тихий и уединенный образ жизни. Со своими служанками он общался исключительно записками и не заводил личных отношений вне семьи. Согласно одному из источников, для того, чтобы попасть домой, Кавендиш часто пользовался черным ходом, чтобы избежать встреч со своей экономкой. Некоторые современные врачи (например, Оливер Сакс) предполагают, что Кавендиш страдал синдромом Аспергера, хотя он, возможно, просто был очень застенчивым. Круг его общения ограничивался лишь клубом Королевского общества, члены которого обедали вместе до еженедельных совещаний. Кавендиш редко пропускал эти встречи и был глубоко уважаем своими современниками.
Он также увлекался коллекционированием мебели тонкой работы, документально подтверждена покупка им «десяти стульев и дивана красного дерева с атласной обивкой».
Излюбленным способом тратить деньги была для Кавендиша благотворительная деятельность. Как-то раз, узнав, что студент, помогавший ему упорядочивать библиотеку, оказался в трудной финансовой ситуации, Кавендиш немедленно выписал ему чек на 10 тысяч фунтов — сумму по тем временам громаднейшую. Подобным образом он поступал всю жизнь — и, тем не менее, всегда располагал миллионами фунтов стерлингов, будто обладал сказочным «неразменным рублем».
Кавендиш был совершенно безразличен к окружающему его миру и никогда не интересовался происходящими в этом мире событиями — даже столь значительными, как Французская революция или наполеоновские войны, прокатившиеся по Европе.
Большинство научных работ Кавендиша не публиковалось вплоть до второй половины XIX века, когда Джеймс Максвелл занялся разбором архивов Кавендиша. И даже сейчас несколько ящиков, заполненных рукописями и приборами, назначение которых не поддается определению, остаются не разобранными. А то немногое, что известно, выглядит весьма необычно. Кавендиш проводил научные эксперименты, на целые столетия опережая своё время. Так, например, он рассчитал отклонения световых лучей, обусловленные массой Солнца, за 200 лет до Альберта Эйнштейна, и расчёты его почти совпадают с эйнштейновскими[источник не указан 31 день].
Одним из следствий его гравитационных измерений было довольно точное определение плотности. Однако, этот результат не был известен почти 100 лет, так как Кавендиш не заботился ни о публикации своих работ, ни о каком-либо признании учёным миром.
В 1775 г. он пригласил семерых выдающихся ученых, чтобы продемонстрировать сконструированного им искусственного электрического ската, и дал каждому ощутить электрический разряд, абсолютно идентичный тому, каким настоящий скат парализует свои жертвы. А по завершении показа он, опередивший своих современников Гальвани и Вольта, торжественно объявил приглашенным, что именно эта, продемонстрированная им новая сила когда-нибудь революционизирует весь мир.
Хотя распространено мнение, что всемирно известная Кавендишская лаборатория названа в честь Генри Кавендиша, это не соответствует действительности. Она названа в честь родственника Генри, Уильяма Кавендиша, 7-го герцога Девоншира. Он был канцлером Кембриджского университета и пожертвовал крупную сумму на открытие первой в мире учебно-научной лаборатории при университете. Примерно за 11 лет до Кулона закон взаимодействия зарядов был открыт Г. Кавендишем, однако результат не был опубликован и долгое время оставался неизвестным.
Он умер неженатым 24 февраля 1810 года, оставив состояние в 700 000 фунтов и еще 6000 годового дохода от имения. К сожалению, ни один фунт из этого богатства не был пожертвован на нужды науки. Завещание же ученого содержало категорическое требование, чтобы склеп с его гробом сразу после похорон был наглухо замурован, а снаружи не было никаких надписей, указывающих, кто в этом склепе похоронен. Так и было сделано. Кавендиша похоронили в соборе в Дерби. Ни осмотра тела, ни вскрытия трупа не производили. И ни одного достоверного портрета Кавендиша тоже не сохранилось.
wreferat.baza-referat.ru
ПНЕВМАТИЧЕСКАЯ ХИМИЯ
Одну из ярких страниц в развитии химии во второй половине XVIII в. представляет собой деятельность химиков-пневматиков, изучавших способы получения и свойства различных газов (от греческого — «дух», «дуновение», «дыхание», «воздух»). По существу эта область исследования представляла собой одно из направлений химико-аналитической и химико-технической деятельности химиков флогистического периода. К тому же химики-пневматики не только занимались исследованиями газов, но и работали в других важных областях химии того времени.
Однако специфический характер исследований химико-пневматиков и важное значение, которое приобрела их деятельность для дальнейшего развития химии, требуют особого рассмотрения истории открытий в области химии газов во второй половине XVIII столетия, а также анализа той борьбы мнений, которую вызвали новые открытия.
До середины XVII в., как уже говорилось, газы еще не различались и считались лишь разными видами воздуха. Ван-Гельмонт, по-видимому, первый показал, что помимо воздуха следует признать существование ряда различных воздухообразных тел, которые он называл газами, и, в частности, «лесного газа».
После Ван-Гельмонта изучением газов занимались отдельные исследователи, в частности Ж. Рей, Дж. Майов, Р. Бойль. В начале XVIII в. химики не проявляли особого интереса к изучению газов. Основной причиной этого было отсутствие в их распоряжении удобных методов получения, собирания и исследования свойств отдельных газов. Однако некоторые ученые все же пытались исследовать свойства известных в то время газов, применяя воздушный насос Бойля и примитивные приспособления для собирания выделяющихся в различных процессах газов. Так, Ломоносов, изучавший механизм растворения металлов в кислотах, получил при растворении меди в азотной кислоте окислы азота и описал некоторые свойства этого газа. Для собирания газа он пользовался бычьим пузырем, как, впрочем, и его современники и химики более позднего времени, например Пристлей.
В первой половине XVIII в. появилось описание так называемой пневматической ванны, предложенной Гейлсом, в которой приемник получаемого газа был отделен от генератора газа. Однако открытие Гейлса не сразу стало известно химикам, так как было опубликовано в книге, посвященной проблемам ботаники.
Стефен Гейлс (1667–1761) изучал в Кэмбридже теологию и стал священником. Свой досуг он посвящал изучению математики и естествознания, особенно биологии (физиологии растений). Гейлс экспериментально исследовал различные явления и процессы, связанные с ростом растений, а также и с их химическим составом. При этом он стремился пользоваться точными физическими методами исследования и объяснять явления жизни и роста растений с позиций физики и химии. Главным трудом Гейлса, посвященным физиологии растений, является книга «Статика растений» (1727 г.). В этом сочинении и описана «пневматическая ванна», которая служила Гейлсу для собирания газов, выделявшихся при сухой перегонке дерева. В дальнейшем «пневматическая ванна» приобрела большое значение в практике исследований газов как прибор для собирания газов над водой.
Первым видным представителем периода пневматической химии был английский ученый Джозеф Блэк (1728–1799). Он родился в Бордо (Франция) и в 12-летнем возрасте переехал в Англию для получения образования. Он учился в Бельфасте (Ирландия), а в 1746 г. поступил в университет в Глазго. Здесь он изучал медицину, но интересовался и естественными науками, особенно химией. В 1750 г. Блэк перешел в Эдинбургский университет, а в 1754 г. получил степень доктора медицины. Выполненное им в качестве докторской работы исследование (опубликовано в 1755 г.) было посвящено выяснению природы «едких» и «мягких» щелочей, а также свойствам «воздуха», выделяющегося при действии кислот на «мягкие» (т. е. углекислые) щелочи. Эта работа принесла Блэку известность и авторитет. В 1756 г. он был назначен профессором химии в Глазговском университете, а 10 лет спустя, в 1766 г., перешел на ту же должность в Эдинбургский университет.
Здесь он работал более 30 лет (до 1797 г.), привлекая своими замечательными лекциями много слушателей и учеников. В последние годы жизни Блэк был тяжело болен (80).
Хотя исследования Блэка немногочисленны, они приобрели важное значение в истории химии и оказались как бы вводными в исследования химиков-пневматиков. Тема первого его исследования, начатого в 1752 г., была поставлена им в связи с поисками эффективных лекарственных средств для растворения камней в мочевом пузыре. В то время для этого применялись едкие щелочи. Желая «смягчить» действие подобных средств, Блэк прежде всего занялся изучением природы едкости щелочей. Как и его современники, он полагал, что едкость щелочей связана с наличием в их составе элемента-огня. Так, считалось, что известняк при сильном прокаливании превращается в едкую известь вследствие присоединения «огненной материи». Но изучая переход от мягкой щелочи (известняка) к едкой (извести), Блэк убедился в ошибочности таких представлений. Он нашел, что при прокаливании известняка к нему не только не присоединяется какая-либо материя, а наоборот, прокаливание сопровождается выделением из известняка значительного количества «воздуха». После тщательного изучения свойств этого «воздуха» Блэк назвал его «фиксируемым воздухом», так как оказалось, что этот «воздух» легко поглощается — «фиксируется» (связывается) едкими щелочами, например раствором едкой извести.
Поставив подобные же опыты с жженой магнезией, Блэк получил новое подтверждение своим выводам. Он обнаружил далее, что «фиксируемый воздух», т. е. углекислый газ, выделяется из известняка (СаСO3) и белой магнезии (углекислого магния) при действии кислот, причем получаются соли. В своих исследованиях Блэк пользовался весами и точно определял потерю в весе «мягких» щелочей при их прокаливании. Так, он взял точно отвешенное количество белой магнезии и, прокалив ее, отметил потерю в весе. Затем он растворил полученную жженую магнезию в кислоте и осадил поташом из раствора белую магнезию. Отделив и высушив осадок, он получил точно такое же количество белой магнезии, которое было взято для опыта. На основании своих исследований Блэк пришел к заключению, что «мягкие щелочи» содержат «фиксируемый воздух», который играет роль кислоты в этих соединениях, представляющих собой, таким образом, соли.
Несмотря на ясность и доказательность выводов Блэка, в то время еще приверженца теории флогистона, его исследования многие ученые подвергли критике и даже нападкам. Против представлений Блэка о причине едкости щелочей выступил, в частности, немецкий химик И. Ф. Мейер, который, в противовес мнению Блэка, считал, что при прокаливании известняка и белой магнезии теряется не «фиксируемый воздух», а лишь вода и что переход от мягкой щелочи к едкой связан с поглощением из огня особой «жирной кислоты» (acidum pingue). Вслед за Мейером взгляды Блэка критиковали и другие химики, в частности французский химик Бомэ. Даже Лавуазье не хотел признавать справедливость выводов Блэка, склонялся к мнению его противников и лишь впоследствии изменил свои взгляды.
Нельзя не сказать и о другом важном исследовании Блэка, посвященном вопросу о скрытой, теплоте плавления и испарения. Блэк поставил следующий простой опыт: к определенному, взвешенному количеству льда, имеющего температуру 32° по Фаренгейту, он добавил равное количество воды с температурой 172° Ф. Казалось бы, при этом смесь должна была принять среднюю температуру 102 Ф. как это наблюдается при смешивании равных количеств воды с разными температурами. В действительности же Блэк обнаружил, что смесь сохранила температуру 32° Ф, но зато весь лед растаял. На основании ряда подобных опытов Блэк пришел к правильному выводу, что таяние льда связано с поглощением большого количества теплоты, которая берется из запасов тепла смеси. Эту теплоту Блэк назвал «скрытой теплотой» плавления.
Свои выводы о скрытой теплоте Блэк приложил и к другим явлениям, связанным с выделением и поглощением тепла, в частности к растворению солей, испарению жидкостей и т. д. Блэк объяснил с этой же точки зрения и действие охлаждающих смесей. Такие смеси, согласно Блэку, затрачивают особенно большое количество тепла на переход в жидкое состояние и берут это тепло из собственных запасов, вследствие чего сильно охлаждаются.
Исследования Блэка, таким образом, представляют собой выдающееся явление в истории науки и отражают его новаторский подход к решению важных научных вопросов, характерный для химии и физики конца XVIII в. Флогистик Блэк, после падения теории флогистона, примкнул к сторонникам учения Лавуазье.
Пневматические исследования Блэка продолжили и значительно расширили его современники — химики-пневматики, и особенно его соотечественники Кавендиш и Пристлей, а также швед Шееле.
Деятельность этих ученых, продолженная затем Лавуазье, теоретически обобщившего результаты всех их открытий в области пневматической химии, непосредственно привела к химической революции в конце XVIII в.
Видный английский химик и физик Генри Кавендиш (1731–1810) (81) родился в богатой аристократической семье. После нескольких лет обучения в школе он в 1749 г. поступил в Кэмбриджский университет, где изучал естественные науки.
Однако через четыре года он оставил университет, не получив никакой ученой степени. По-видимому, в 1753 г. он поселился в Лондоне в доме своего отца. О 10 годах его дальнейшей жизни не сохранилось никаких сведений. Вероятно, они были посвящены в значительной степени занятиям физикой и математикой. В это же время Кавендиш устроил в конюшне лабораторию и в течение всей дальнейшей жизни вел в ней исследования. В 1760 г. он был избран членом Лондонского Королевского общества.
Кавендиш был человеком особого склада, с большими странностями. Он был нелюдимым, мало говорил и смущался, когда к нему обращались незнакомые люди. Несмотря на то, что был весьма богат, он ходил в старомодной одежде и скромно питался. Г.Дэви писал о нем: «Голос его похож был на какой-то писк, обращение его было нервное. Он пугался чужих людей, и когда смущался, то ему трудно было говорить. Он одевался, как наши деды, был очень богат, но не пользовался своим богатством» (82).
В 1783 г. после смерти своего отца и тетки Кавендиш получил огромное наследство и, как выразился его биограф, физик Био в некрологе, «был самым богатым из ученых и, вероятно, самым ученым среди богачей» (83).
Всю свою жизнь Кавендиш посвятил научным занятиям и, особенно, экспериментальным исследованиям. Каждый день, включая и воскресенья, он проводил за работой. Только изредка он выезжал из Лондона в короткие путешествия, но не с целью отдохнуть, а для геологических обследований различных районов Англии и ознакомления с промышленными предприятиями. На лето Кавендиш переезжал в свою виллу, где также была устроена лаборатория и астрономическая обсерватория. Здесь он принимал иногда редких гостей.
Кавендиш как экспериментатор отличался высокой тщательностью работы. Он аккуратно заносил в лабораторный журнал-дневник свои наблюдения и результаты опытов, но публиковал свои работы неохотно. Лишь в 1766 г. он решил опубликовать некоторые свои исследования в журнале Королевского общества «Philosophical Transactions». Многие его статьи лежали в законченном виде более 10 лет, прежде чем он решал послать их в печать. Отдельные же его труды при его жизни так и не увидели света.
Как физик Кавендиш получил известность своими исследованиями по электрическому разряду, предпринятыми для выяснения причин «электрического удара» некоторых животных (электрический скат). Он изучал также явления, связанные с выделением и поглощением теплоты, и в частности скрытые теплоты плавления и испарения. Будучи сторонником молекулярно-кинетической теории теплоты (в отличие от Блэка — сторонника теории теплорода), он осуждал употреблявшееся Блэком выражение «выделение или поглощение скрытой теплоты», которое предполагает, что теплота представляет собой какое-то вещество, и сам употреблял вместо этого выражение «теплота возникает». Большое значение получили также определения Кавендишем постоянной земного тяготения при помощи крутильных весов.
Особенно важны исследования Кавендиша в области пневматической химии. Первая работа Кавендиша по химии, посвященная свойствам металлического мышьяка и его окислов, не была им опубликована и стала известна лишь после его смерти. Кавендиш — ревностный последователь теории флогистона (до конца своих дней), объяснял различие в свойствах окислов тем, что высший окисел — As2О5 — содержит меньше флогистона, чем As2О3, а последний содержит меньше флогистона по сравнению с металлическим мышьяком (корольком мышьяка).
Из других ранних исследований Кавендиша назовем работу, в которой он показал, что известь и магнезия хорошо растворяются в воде при насыщении последней углекислотой.
В 1788 г. Кавендиш выступил с интересной работой, которая особенно характеризует его роль в развитии методов количественного химического анализа. Эта работа посвящена определению крепости серной кислоты. Кавендиш так описывает свой метод: «Мой метод состоял в том, что я находил количество plumbum vitriolatum (сернокислого свинца), осажденное свинцовым сахаром, и отсюда вычислял крепость серной кислоты, исходя из предположения, что то количество серной кислоты, которое образует 100 частей сернокислого свинца, способно растворить 33 части мрамора; ибо я нашел опытным путем, что это количество серной кислоты насыщает столько же фиксируемой щелочи, сколько такое же количество азотной кислоты, которое растворяет 33 части мрамора» (84).
Здесь мы видим в зародыше учение об эквивалентности кислот, развитое позднее Рихтером, и намек на закон кратных отношений Дальтона.
Первая из работ, опубликованных Кавендишем, была посвящена пневматической химии. Она озаглавлена «Опыты с искусственным воздухом» (1766 г.). Исследование это, по-видимому, находится в связи с опубликованными Блэком в 1755 г. мемуарами «О белой магнезии, едкой извести и других щелочных веществах», где описывается «фиксируемый воздух». Кавендиш получил и исследовал различные виды «искусственного воздуха», представляющего, по его словам, «всякий род воздуха, который содержится в веществах в неупругом (связанном. — Н. Ф.) состоянии и может быть искусственно из них выделен» (85).
В качестве одного из видов «искусственного воздуха» Кавендиш исследовал прежде всего «горючий воздух», т. е. водород. Кавендиш не был первым, кто получил этот газ. Как мы видели, «горючий, или воспламеняемый, воздух» упоминается во многих химических сочинениях XVI–XVIII вв. задолго до Кавендиша, например у Лемери и Ломоносова. Однако именно Кавендишу принадлежит заслуга описания водорода как индивидуального вещества со своеобразными свойствами. Он получал водород действием разбавленных кислот — серной и соляной — на железо, цинк и олово и установил, что во всех случаях образуется один и тот же газ.
Будучи убежденным флогистиком, Кавендиш считал, что водород выделяется при действии кислоты на металлы не в результате разложения кислоты, а в результате «разложения» под действием кислоты металлов, считавшихся флогистиками сложными телами. Этой же точки зрения придерживался в середине XVIII в. и Ломоносов. По мнению Кавендиша, различные металлы содержат различные количества «воспламеняемого воздуха».
На основании этого Кавендиш решил, что «горючий воздух» и представляет собой тот самый флогистон, который улетучивается из металлов при их кальцинации. К тому же обнаруженная им необычайная легкость этого газа, казалось, блестяще подтверждала учение флогистиков об «отрицательном весе» флогистона.
Однако, исследуя свойства «горючего воздуха», Кавендиш убедился, что он имеет вес. Для определения его плотности Кавендиш взвешивал колбу с серной кислотой и цинком до реакции и затем после полного выделения водорода и отмечал убыль в весе за счет освободившегося водорода, объем которого он точно определял. Он получил для плотности водорода относительно воздуха значение, равное 0,09 (современное значение 0,0695).
Этот результат заставил Кавендиша отказаться от предположения, что «горючий воздух» представляет собой чистый флогистон. Однако он тут же принял, что водород — это соединение флогистона с водой, т. е. гидрат флогистона. Эта точка зрения также вполне соответствовала взглядам флогистиков, утверждавших, что свободный флогистон существовать не может и при выделении, например, из металлов в процессе их кальцинации он обязательно вступает в прочное соединение с воздухом или другими веществами.
Другим видом «искусственного воздуха», исследованного Кавендишем, был «фиксируемый воздух» Блэка. Кавендиш получал его, так же как и Блэк, действием кислот на известняк, белую магнезию, мрамор и т. п. Он нашел, что плотность фиксируемого воздуха» по отношению к обычному воздуху равна 1,57. Кавендиш исследовал также «искусственный воздух», образующийся в результате брожения, а также гниения органических веществ.
Спустя 17 лет после своего первого сообщения о различных видах «искусственного воздуха», Кавендиш в 1783 г. опубликовал мемуар под заглавием «Известие о новом эвдиометре». В этом исследовании описывается прибор для анализа воздуха[28], основанный на окислении окиси азота. За время между выходом первой и второй работ Кавендиша (с 1766 по 1783) в области пневматической химии были сделаны крупнейшие открытия. Сам Кавендиш получил в 1772 г. (согласно сообщению в одном из писем Пристлея) так называемый мефитический воздух, или, как его обычно называли флогистики, «флогистированный воздух», в дальнейшем названный «азотом». Способ получения «мефитического воздуха» состоял в том, что обычный воздух многократно пропускался над раскаленным углем и образующийся при этом углекислый газ (фиксируемый воздух) поглощался щелочью. Но Кавендиш не опубликовал своевременно результатов этого исследования, и поэтому честь открытия азота обычно приписывается Даниэлю Рутерфорду (1749–1819)[29], который в том же 1772 г. описал азот в своей диссертации «О так называемом фиксируемом и мефитическом воздухе», представленной для поручения ученой степени доктора медицины и выполненной под руководством Дж. Блэка.
Кавендишу, однако, принадлежит подробное количественное исследование свойств азота, а так же открытого в это же время Шееле и Пристлеем «огненного воздуха», т. е. кислорода. Для получения чистого азота Кавендшн также воспользовался свойствами «селитряного газа» (окиси азота), который, соединяясь с «дефлогистированной» частью воздуха (кислородом), образует красную двуокись азота, легко поглощаемую водой и растворами щелочей при встряхивании.
При помощи специально сконструированного эвдиометра Кавендиш провел большое число анализов воздуха. Он опроверг господствовавшее в то время представление, что «добротность» воздуха в различных местах различна. В течение 60 дней он брал пробы воздуха при разных условиях погоды и в различных местах и, проведя около 400 определений, установил, что состав воздуха всюду одинаков. Кавендиш нашел, что среднее содержание «дефлогистированного воздуха» в обычном воздухе составляет 20,84 % по объему.
В 1784–1785 гг. Кавендиш выполнил и опубликовал еще одно исследование под заглавием «Эксперименты с воздухом». Эта работа имела целью найти причину уменьшения объема воздуха при всякого рода его «флогистировании» и установить, что происходит с исчезающим при этом воздухом. После нескольких неудачных попыток решить этот вопрос Кавендиш, желая удалить из воздуха его «дефлогистированную часть» (кислород), смешал воздух с водородом и при помощи электрической искры взорвал смесь. К его удивлению, в результате взрыва получилась вода. Он повторил опыт в сосуде большего объема (8 фунтов длины и диаметром 3/4 дюйма) и получил в результате 8,7 г воды, «которая не имела ни вкуса, ни запаха и при испарении досуха не оставляла ни малейшего следа». При этом оказалось, что более 4/5 взятого воздуха оставались в трубке. В результате опытов Кавендиш пришел к выводу, что при «флогистировании» воздуха (т. е. при отнятии у него кислорода) из него выделяется влага.
В этом же сообщении Кавендиша описаны опыты взрыва смеси воздуха и водорода при недостаточном количестве водорода. Оказалось, что при этом отчасти образуются окислы азота, которые при растворении в воде дают азотную и азотистую кислоты. Кавендиш пытался установить источник появления кислоты, но безуспешно.
Используя простой прибор, Кавендиш исследовал действие электрического разряда на воздух. Изогнутая под острым углом стеклянная трубка, заполненная воздухом, была погружена концами в два сосуда с ртутью. Над ртутью в обоих коленах трубки было налито немного раствора едкого кали. Ртуть одного из сосудов соединялась при помощи проводника с кондуктором электростатической машины, ртуть второго сосуда — с землей. Для опытов бралась искусственная смесь из пяти частей «дефлогистированного воздуха» (кислорода) и трех частей обычного воздуха, через которую пропускались электрические искры. При этом объем воздуха в трубке постепенно уменьшался (в результате образования окиси, а затем двуокиси азота, растворявшейся в щелочи), пока не остался небольшой пузырек, не поддававшийся далее действию электрических разрядов. В щелочном растворе над ртутью Кавендиш обнаружил селитру. Таким образом, он впервые осуществил синтез азотной кислоты из воздуха.
В восьмидесятых годах Кавендиш, конечно, хорошо знал о новых представлениях, развитых Лавуазье, о роли кислорода в химических и жизненных процессах и даже иногда пытался с новых точек зрения толковать результаты своих пневматических опытов. Однако как убежденный флогистик в заключение своего мемуара «Опыты с воздухом» он писал: «Из сказанного как будто следует, что явления природы могут найти объяснение и без помощи флогистона; действительно, дело сводится к одному и тому же, говорят ли, что телу сообщается дефлогистированный воздух или что из него удаляется флогистон с заменой его водой. Так как нет, вероятно, вещества, совершенно свободного от воды, и так как я не знаю средства, как переносить флогистон с одного тела на другое, без того, чтобы оставалось сомнение, не была ли перенесена и вода, то чрезвычайно трудно при помощи опыта решить, какое из двух мнений самое истинное. Но так как общепринятый принцип флогистона так же хорошо объясняет явления, как и теория Лавуазье, то я придерживался первого» (86).
Кавендиш и в дальнейшем проводил опыты с воздухом, желая установить, весь ли азот, содержащийся в воздухе, может быть превращен в азотную кислоту. В результате этих опытов он пришел к выводу: «Если в нашей атмосфере содержится часть флогистированного воздуха, которая отличается от всего остального и не может быть превращена в азотную кислоту, то мы с уверенностью можем сказать, что она не больше 1/125 части его» (87).
Этот вывод оказался достаточно точным и спустя 100 лет был подтвержден при открытии аргона в воздухе. Таким образом, Кавендиш был выдающимся химиком-пневматиком, обогатившим химию и физику рядом крупнейших открытий (88).
Современником Кавендиша был другой выдающийся английский естествоиспытатель и философ — Джозеф Пристлей (1733–1804) (89). Он был сыном ткача, рано потерял мать и воспитывался у тетки. Еще в детстве обнаружились его выдающиеся способности, особенно к иностранным языкам. Религиозная склонность привела его в духовную академию в Девентри, где он, в течение 1752–1755 гг. изучал теологию. Впрочем, наряду с лекциями по теологии и философии, он с большим интересом слушал курсы по естественным наукам. Затем он увлекся филологией и изучил немецкий, французский, итальянский, латинский, греческий, арабский, сирийский, халдейский и древнееврейский языки.
По окончании академии в течение нескольких лет Пристлей был священником в диссидентских общинах и занимался преподаванием, в частности, иностранных языков. Будучи преподавателем в академии в Уоррингтоне (между Ливерпулем и Манчестером) и имея досуг, он начал заниматься научной работой. Он писал трактаты по теологии и философии и написал также популярную работу по истории электричества, за которую в 1766 г. был избран членом Королевского общества в Лондоне. В это же время он начал исследования в области пневматической химии.
В 1773 г. Пристлей был приглашен на должность литературного секретаря к богатому аристократу лорду Шельборну. В качестве секретаря Шельборна он совершил путешествие в Париж, где познакомился с Лавуазье и другими видными учеными Франции.
В этот период Пристлей интенсивно работал, выступая с философскими сочинениями (о материи и духе, о свободе воли и т. д.), высказывая материалистические идеи и в резкой форме выступая против догматов господствующей англиканской церкви. В связи с этим ему пришлось уйти от лорда Шельборна, так как его взгляды оказались несовместимыми со взглядами хозяина.
Переехав в Лондон, Пристлей возобновил свои занятия по пневматической химии. Он часто встречался с В. Франклином (1706–1790), который хорошо к нему относился и шутливо называл его за выступления против англиканской церкви «честным еретиком».
В 1780 г. Пристлей переселился в Бирмингам, был здесь священником в одной из общин и одновременно занимался научной работой. Он активно работал также в «Лунном обществе» любителей науки и продолжал свои химические исследования. Кроме того, он много писал на различные политические темы.
Пристлей с восторгом встретил французскую буржуазную революцию, страстно выступал в ее защиту и состоял даже членом общества «Друзей революции». В 1791 г. в июле, в годовщину падения Бастилии, когда Пристлей вместе с друзьями принял участие в праздновании этого события, толпа реакционеров, по наущению духовенства и местных властей, подвергла полному разгрому его дом, уничтожив лабораторию и библиотеку. Сам Пристлей едва спасся бегством в Лондон. Но и здесь он не мог чувствовать себя в безопасности и вскоре покинул Англию и переселился в Америку (в Нортумберлянд), где построил новую лабораторию и восстановил библиотеку. Последние годы жизни он продолжал усердно работать, в частности он опубликовал в 1800 г. книгу в защиту теории флогистона. Умер Пристлей в феврале 1804 г.
Научная деятельность Пристлея была исключительно напряженной и разносторонней. Не будем говорить о его философских, теологических и политических трудах (90). Отметим лишь, что в своих сочинениях он высказывал передовые и материалистические взгляды.
Пристлей не получил систематического естественнонаучного образования и работал в области пневматической химии и во многих разнообразных областях науки как любитель. Тем не менее Пристлей сделал ряд крупных открытий в области химии. Пристлей внес важное усовершенствование в аппаратуру для собирания газов. Он заменил в приемнике «пневматической ванны» Гейлса воду ртутью. Это дало возможность собирать и изучать те газы, которые ранее оказывались «неуловимыми», вследствие большой растворимости в воде (хлористый [водород, сернистый газ, аммиак). В 1767 г. Пристлей, так же как и Кавендиш, изучал действие электрических разрядов на различные газы, на обычный воздух, «фиксируемый воздух» и на только что открытый Кавендишем «горючий воздух» (водород). В этот же период Пристлей получил искусственную газированную воду, насыщенную углекислым газом. В 1772 г. он занялся исследованием «селитряного газа» (окиси азота), получаемого действием разбавленной азотной кислоты на железо. Так же как и Кавендиш, он изучал «добротность» воздуха, взятого из различных мест. Смешивая окись азота с определенными количествами обычного воздуха, Пристлей обнаружил, что объем взятого воздуха уменьшается на 1/6 часть, и оставшийся воздух оказывается неспособным поддерживать горение и непригоден для дыхания. Он пришел к выводу, что этот оставшийся воздух полностью насыщен флогистоном.
Продолжая опыты Гейлса и Майова, Пристлей также обнаружил уменьшение объема воздуха, если в нем сжигать горючие тела или прокаливать металлы и если образовавшийся при этом «фиксируемый воздух» удалять при помощи известковой воды. При этих опытах Пристлей сделал весьма крупное открытие. Он обнаружил, что «фиксируемый воздух» (углекислый газ) в присутствии зеленых растений вновь приобретает свойства обычного воздуха, т. е. становится пригодным для дыхания животных (1771 г.). Через некоторое время Пристлей, действуя «селитряным воздухом» на влажные железные опилки, получил «дефлогистированный селитряный газ» (закись азота), который поддерживал горение, но оказался непригодным для дыхания.
1 августа 1774 г. Пристлей сделал свое величайшее открытие. Нагревая красную окись ртути в замкнутом пространстве при помощи большой зажигательной линзы, он получил газ, который оказался не растворимым в воде и в котором свеча горела более ярко, чем в обычном воздухе, а тлеющая лучинка ярко вспыхивала. Этот же газ он получил из красного преципитата (окись ртути), полученного нагреванием азотнокислой ртути, а также из свинцового сурика. Смешивая новый газ с воздухом, Пристлей не обнаружил никакого окрашивания, как это наблюдалось при смешивании «селитряного газа» с воздухом. Однако если «селитряный воздух» смешивался с новым газом, то тотчас же происходило красно-бурое окрашивание, причем обнаруживалось более сильное уменьшение объема, по сравнению с уменьшением, происходившим при смешивании «селитряного газа» с обычным воздухом. Открытый новый вид воздуха (кислород) был назван Пристлеем «дефлогистированным воздухом».
Одновременно с Пристлеем кислород открыл и Шееле и назвал его «огненным воздухом», или «жизненным воздухом». В следующем, 1775 г. Лавуазье выступил в Парижской академии наук с докладом «О природе начала, который соединяется с металлами при их прокаливании и увеличивает их вес», в котором также описал открытый им кислород. Таким образом, открытие кислорода было сделано почти одновременно тремя исследователями в разных странах. Вот почему вопрос о приоритете открытия кислорода в течение более 150 лет очень живо обсуждался в историко-химической литературе.
В своем учебнике химии, вышедшем в свет в 1789 г., Лавуазье утверждал, что он открыл кислород «почти в то же самое время, как это сделали гг. Пристлей и Шееле» (91). Пристлей впервые познакомился с книгой Лавуазье (в английском издании) в Америке в 1800 г. и писал по поводу открытия кислорода: «Теперь, когда я работаю над темой о правах на открытия, я не хотел бы, как говорят испанцы, сохранять такого рода чернила в моей чернильнице, в надежде, что я в последний раз докучаю общественности. Г-н Лавуазье говорит («Элементы химии», английск. изд., стр. 36): «Этот вид воздуха («дефлогистрованного») был почти в одно и то же время открыт г. Пристлеем и г. Шееле и мной самим». В действительности же было следующее. Спустя короткое время после того, как я сделал открытие, я был в Париже в 1774 г. Я рассказал об этом открытии за обедом у г. Лавуазье, в присутствии большинства естествоиспытателей города. Я сказал, что это вид воздуха, в котором свеча горела лучше, чем в обычном воздухе, но что я еще не дал новому газу никакого названия. При этом все общество, а также г-н и г-жа Лавуазье выразили большое удивление. Я сказал им, что получил его (т. е. вид воздуха) из praecipitate per se и также из меннинга (red lead — красного свинца, т. е. сурика). Так как я недостаточно хорошо говорил по-французски и не особенно доверялся химическим выражениям, я сказал «plomb rouge» (красный свинец), что не было понято, пока г-н Макёр не сказал: «Я полагаю, из сурика» (Рb3O4). Открытие г-на Шееле было действительно сделано независимо от моего, но я полагаю, что оно было сделано не очень рано» (92).
Следует, однако, сказать, что представления Пристлея о кислороде в 1775 г. были весьма туманными. В то время как Лавуазье выступал с сообщением о кислороде в Парижской академии наук, Пристлей полагал, что для горения и дыхания лучше всего подходит естественный воздух и что наблюдавшееся им интенсивное горение свечи и лучинки во вновь открытом газе было лишь чисто случайным явлением. Только в дальнейшем он пришел к заключению, что кислород по отношению к горению и дыханию в 4 или 5 раз лучше обычного воздуха и потому назвал его «дефлогистированным воздухом». В то же время он исправил свою прежнюю ошибку, указав, что газ, ранее полученный им при прокаливании селитры, не представляет собой «дефлогистированного селитряного воздуха» (закись азота), а является просто «дефлогистированным воздухом» (кислородом).
Прочно стоя на платформе флогистической теории, Пристлей не смог понять подлинного значения своего открытия. Он развил весьма странные гипотезы, чтобы как-то оправдать флогистические представления, не способные объяснить новое открытие. Так, он считал, что обычный воздух состоит из селитряной (азотной) кислоты и земли и при этом содержит так много флогистона, что становится газообразным и упругим. Он полагал также, что чистый «дефлогистированный воздух» (кислород) переходит в «среднее» состояние обычного воздуха, если смешивается с «флогистированным воздухом» (азотом). Таким образом, по мнению Пристлея, кислород представляет собой смесь азотной кислоты, земли и флогистона. В такой смеси азотная кислота под действием земли утратила свою природу и лишилась своих кислых и едких свойств. Флогистики считали селитряную (азотную) кислоту соединением всеобщей (серной) кислоты с флогистоном (93).
Элементом же флогистики, естественно, считали и флогистон. Таким образом, Пристлей считал кислород сложным телом. Только значительно позднее, в 1786 г., он признал свой «дефлогистированный воздух» одним из газообразных элементов.
Однако, независимо от такого рода странных взглядов и объяснений, следует признать, что Пристлею принадлежат выдающиеся заслуги перед химией. Помимо открытия кислорода, он при помощи своей пневматической ртутной ванны получил в том же 1774 г. несколько других, до тех пор не известных газов. Действием купоросного масла на поваренную соль он получил «солянокислый воздух» (хлористый водород), а нагреванием нашатыря с известью — «щелочной» газ (аммиак). Он показал, что эти новые газообразные тела при смешивании с воздухом не испытывают никаких превращений. Пристлею удалось также собрать над ртутью фтористый кремний. Позднее он открыл сернистый газ (1775 г.), а будучи уже в Америке, окись углерода (1799 г.).
Пристлей до самой смерти оставался флогистиком-догматиком. Поэтому он не только не смог рационально объяснить, но даже и понять свои собственные открытия. В этом заключалась большая трагедия талантливого исследователя.
В годы, когда Кавендиш и Пристлей развили свои исследования в Англии, в Швеции с большим успехом работал химик-аналитик и химик-пневматик Карл Вильгельм Шееле (1742–1786) (94).
Шееле родился в семье торговца в г. Штральзунде, в то время находившемся под властью Швеции. По национальности Шееле был немцем. В шестилетнем возрасте он поступил в частную школу и учился в ней около девяти лет. В 1757 г. он покинул школу и родительский дом и в г. Гетеборге поступил учеником в аптеку М. А. Бауха, также выходца из Германии. Здесь под руководством Бауха он в течение восьми лет основательно изучил фармацию и химию, пользуясь не только библиотекой аптеки, но и практически работая в лаборатории.
В 1765 г., когда Баух продал свою аптеку, Шееле перешел в аптеку в Мальме, также в качестве аптекарского ученика. Однако в это время он превосходил своими знаниями химии и фармации даже опытных аптекарей. В Мальме Шееле познакомился с А. И. Ретциусом — видным шведским ученым того времени. Ретциус поощрял молодого Шееле в лабораторных занятиях и научил его вести лабораторный журнал. В Мальме Шееле открыл винную кислоту.
В апреле 1768 г. Шееле переехал в Стокгольм и здесь также работал в аптеке. Несмотря на менее благоприятные условия работы он продолжал свое самообразование и успел выполнить два химико-фармацевтических исследования. В 1770 г. он переехал в Упсалу — известный университетский город — и поступил в аптеку своего земляка X. Л. Локка. Локк предоставил Шееле полную свободу экспериментирования в лаборатории при аптеке и даже сам принял участие в опытах Шееле. В Упсале Шееле познакомился со знаменитым ботаником К. Линнеем и химиком Т. Бергманом. Знакомство с последним произошло при следующих обстоятельствах. Бергман приобрел в аптеке Локка селитру для своей лаборатории и забраковал ее на том основании, что после прокаливания она при действии уксусной кислоты выделяла бурые пары (95). Ни Локк, ни работавший в его аптеке студент И. Г. Ган, ставший впоследствии профессором Стокгольмского университета, не могли объяснить причин этого явления. Объяснил их лаборант аптеки Шееле, знавший, что при прокаливании селитра частично превращается в азотистокислую соль. Бергман захотел познакомиться с Шееле и посмотреть его лабораторию. В разговоре с Шееле он убедился, что имеет дело с хорошо образованным химиком. С тех пор они поддерживали тесное научное содружество. Шееле сообщал Бергману о своих новых исследованиях, Бергман же давал теоретические объяснения новым фактам, расширяя тем самым научный кругозор самоучки Шееле. Дружеская связь между обоими учеными продолжалась до смерти Бергмана (1784 г.) и оплодотворила научную деятельность обоих.
В 1775 г. Шееле в 32-летнем возрасте был избран членом Стокгольмской академии наук. Он получил в это время несколько предложений занять профессорские кафедры в Германии и других странах, но предпочел остаться в Швеции. В конце 1775 г. он сдал в печать свою книгу «Химический трактат о воздухе и огне» (96), в которой описывались его исследования в области пневматической химии с 1768 г. Однако по небрежности издателя книга вышла в свет только в августе 1777 г., когда уже были полностью опубликованы исследования Пристлея и Лавуазье о кислороде и его свойствах. Шееле естественно опасался, что описанные им в этой книге открытия могут быть расценены ученым миром как плагиат. К счастью этого не произошло, хотя приоритет обнародования ряда важных открытий и был потерян. Между тем, как было установлено на основании лабораторного журнала Шееле и его писем, он уже в 1772 г. получил «огненный воздух» различными путями. Ученый мир весьма доброжелательно встретил появление книги Шееле.
Осенью 1777 г. Шееле купил аптеку в Чёпинге и уже в полной независимости принялся за дальнейшие исследования, которые, как он выражался, «заставляли сердце смеяться». Но уже в конце того же года он заболел. Несмотря на болезнь Шееле продолжал напряженно работать до самой смерти (1786 г.). Умер он в возрасте всего лишь 44 лет.
Научные исследования Шееле охватывают многие области химии того времени. Здесь, мы, прежде всего, коснемся его открытий в области органической химии, основателем которой Шееле может считаться с полным правом.
Как уже говорилось, в 1769 г. Шееле открыл винную кислоту — одну из первых органических кислот [30]. Незадолго до Шееле Маргграф получил кальциевую соль винной кислоты из винного камня. Шееле разложил эту соль серной кислотой и выделил виннокаменную кислоту.
Далее, Шееле предположил, что многие растительные соки содержат различные кислоты в связанном состоянии. Обрабатывая эти соки известью и разлагая кальциевые соли органических кислот минеральными кислотами, он получил следующие кислоты: лимонную (1784 г.), яблочную (1785 г.), галловую (1786 г.). Действием азотной кислоты на сахар он еще в 1776 г. получил кислоту, которая была исследована Бергманом и названа им «сахарной» кислотой. Впоследствии (1784 г.) Шееле установил, что эта кислота и полученная И. Виглебом (1732–1800) из кислицы и щавеля «щавелевая кислота» — одно и то же вещество и что кислая калийная соль этой кислоты содержится во многих растениях.
Действуя на оливковое масло окисью свинца, Шееле получил (1783 г.) своеобразную вязкую жидкость сладкого вкуса. Эту жидкость он назвал «сладким маслом», а впоследствии она получила название «глицерин». Вначале Шееле думал, что глицерин можно превратить в сахар, но действием азотной кислоты на нее получил лишь щавелевую кислоту.
В 1782 г. Шееле опубликовал статью «Исследования и заметки об эфире». В ней описываются различные способы получения серного эфира и дается его определение: «Под эфиром в химии понимают очень летучее, проникающее, бесцветное с ароматическим запахом масло, не растворимое в воде».
Следует сказать, что еще в 1770 г. Шееле описал сложные азотнокислый и солянокислый этиловые эфиры, несколько позднее — уксусный и бензойный эфиры (1781–1782), а также и другие сложные эфиры. Выполняя все эти исследования, Шееле не чуждался и чисто практических вопросов. Так он указал на способ длительного хранения уксуса (1782 г.).
Одной из крупных работ Шееле было исследование об «окрашивающей материи берлинской лазури» (1782 г.). Еще раньше вместе с Ретциусом Шееле установил, что для образования берлинской лазури необходимо железо. Теперь он пришел к выводу, что окрашивающее вещество берлинской лазури состоит из некоторого рода кислоты и что это окрашивающее вещество дает с растительной щелочью (поташом) кристаллическую соль. В том же году Шееле, действуя на кровяную щелочь (желтую кровяную соль) серной кислотой, получил «летучую кислоту берлинской лазури», которую позднее кратко назвал «синильной кислотой». Из способа получения этой кислоты он пришел к заключению, что она составлена из летучей щелочной соли (аммиака), «воздушной кислоты» (углекислого газа) и флогистона (водорода).
Еще ранее Шееле объяснил природу «ледяного масла», или «философской соли» Василия Валентина. Это масло оказалось серным ангидридом. В 1777 г. Шееле получил и исследовал также сероводород и другие сернистые соединения.
Шееле первым указал, что железо, медь и ртуть могут быть окислены в различной степени. Он доказал также, что между молибденовым блеском и графитом, которые принимались за один и тот же минерал, имеется глубокое различие. Исследование Шееле, посвященное составу так называемого тунгстена (СаWO4), привело его к заключению, что это соединение извести с особой кислотой. В честь Шееле минерал тунгстен был назван «шеелитом». Из других многочисленных исследований Шееле укажем на его работу с флюоритом (фторид кальция), из которого действием серной кислоты он получил (1768 г.) газ, хорошо растворимый в воде. Исследуя полученный раствор (фтористого водорода), он обнаружил в нем кремневую кислоту. В дальнейшем он установил, что кремневая кислота попала в раствор из стекла реторты и, таким образом, чистый фтористый водород не содержит кремневой кислоты (1786 г.).
Замечательное исследование было выполнено Шееле с двуокисью марганца (черная магнезия). Действием соляной кислоты на это вещество Шееле получил желто-зеленый газ, который он определил как «дефлогистированную соляную кислоту». Позднее (1810 г.) этот газ, по предложению Дэви, стали называть хлором.
«Черная магнезия» была подвергнута Шееле специальному исследованию. В то время это вещество смешивали не только с магниевыми соединениями, но и с другими веществами, например магнитным железняком, и подозревали в нем присутствие железа. Шееле установил, что в «черной магнезии» содержится особое, неизвестное металлическое тело. Бергман предложил назвать это тело «магнезиум», как полученное из «черной магнезии». Впоследствии Дэви (1808 г.) предложил назвать этот металл «марганцем».
Упомянем также о работах Шееле по исследованию фосфора. Еще в 1768 г. он заинтересовался «фосфором Балдуина».
В дальнейшем, исследуя золу, полученную при сжигании оленьего рога (фармацевтический препарат того времени), Шееле установил, что в ней содержится обычная известковая земля и некоторая неизвестная субстанция. Эта «неизвестная субстанция» была изучена Шееле, совместно с И. Г. Ганом, причем было установлено, что это фосфорная кислота. В результате этого открытия в 1774 г. Шееле в сотрудничестве с Ганом и другими разработал способ получения фосфора из золы рога животных, а также из костей. Новый способ вытеснил старый способ получения фосфора из мочи. Не будем останавливаться на других многочисленных химических исследованиях Шееле и вернемся лишь к его книге «Химический трактат о воздухе и огне» (1777 г.), получившей особенно важное историко-химическое значение. Эта книга в значительной степени посвящена проблемам пневматической химии. В ней прежде всего описывается опыт, поставленный Шееле для решения вопроса о возможности «превращения воды в землю» при длительном кипячении. Как будет видно, тот же опыт поставил почти одновременно с Шееле и Лавуазье. Оба исследователя, независимо друг от друга, пришли к заключению, что осадок, получившийся в воде при длительном кипячении, образовался в результате разъедания водой стекла сосуда, в котором велся опыт. В отличие от Лавуазье, сделавшего этот вывод на основании взвешивания стеклянной колбы до и после опыта, а также взвешивания получившегося осадка, Шееле химически и очень тщательно исследовал осадок и нашел, что он состоит из кремневой земли с примесью небольшого количества извести.
Поделитесь на страничкеСледующая глава >
history.wikireading.ru

ТОП 10:
Пневматическая химия (пневматология) — название химии газов, применявшееся в конце XVIII — начале XIX вв. В настоящее время используется исключительно как исторический термин, характеризующий ранний период химического исследования газов.
После Ван-Гельмонта изучением газов занимались отдельные исследователи. Жан Рей (англ.)русск. ещё в 1630 году предположил участие воздуха при обжиге металлов. Роберт Бойль, основоположник экспериментального подхода к определению элементов сконструировал один из первых воздушных насосов и открыл с его помощью в 1660 году газовый закон, носящий теперь его имя. В 1665 году Роберт Гук в работе «Микрография» также предположил наличие в воздухе особого вещества, подобного веществу, содержащемуся в связанном состоянии в селитре. Дальнейшее развитие эти взгляды получили в книге «О селитре и воздушном спирте селитры», написанную в 1669 году английским химиком Джоном Мейоу (англ.)русск.. Мейоу, проведя знаменитые опытами с горящей свечой под колоколом, пытался доказать, что в воздухе содержится особый газ (spiritus nitroaëreus), поддерживающий горение и необходимый для дыхания.
Формирование во второй половине XVII века флогистонной теории — первой научной теории химии — послужило мощным стимулом развития количественных исследований, без которых было невозможно экспериментальное подтверждение гипотезы о химических элементах. Важным следствием появления флогистонной теории явилось активное изучение химиками газов вообще и газообразных продуктов горения в частности. Факт того, что воздух легко сжимается, стал несомненным доводом в пользу возрождения атомистических представлений и уже первые эксперименты с газообразными веществами привели к гипотезе о дискретном строении вещества.
2.Краткая история становления количественного химического анализа. _____________________________________________________________________________________________________________________________________________________-_
Билет № 21.
Открытие газов: CO2, h3, N2, O2.
Впервые азот изучен Даниэлем Резерфордом. После того как Д. Блек открыл реакцию взаимодействия углекислого газа с известковой водой, Резерфордом исследовал изменения состава воздуха, после того как в нём жило и погибало живое существо (в закрытом объёме). После того как углекислый газ поглощался щёлочью, оставшаяся часть газа не поддерживает горение, да и живые существа мгновенно погибали.
В примерно то же время азот был выделен из воздуха учеными-химиками Г. Кавендишем и К. Шееле, оба они в отличие от Д. Резерфорда поняли, что азот – это лишь составная часть воздухао составная часть.Кавендиш писал: «Я переводил обыкновенный воздух из одного сосуда через раскаленные угли в другой, потом через свежий горящий уголь – в следующий сосуд, поглощая каждый раз образующийся фиксируемый воздух (углекислый газ) кусковой известью. Удельный вес полученного газа оказался лишь незначительно разнящимся от удельного веса обыкновенного воздуха: из обоих газов азот несколько легче воздуха. Он гасит пламя и делает обыкновенный воздух неспособным возбуждать горение, так же как и фиксируемый воздух (CO2), но в меньшей степени"
Из за того, что в азоте погибали организмы, А. Лавуазье назвал его азотом. Согласно Лавуазье, «азот» означает «безжизненный», и слово это произведено от греческого «а» – отрицание и «зоэ» – жизнь. Такое название сохранилось в русском и французском языках, а в англосаксонских азот называют Nitrogen – «рождающий селитру», немцы же дали азоту название Stickstoff – «удушающая материя». С газами, которые горят, человек знаком был ещё с давних времён. К таким газам относился и водород. Его получали при взаимодействии металлов с кислотами (в настоящее время тривиальный способ получения кислот в лабораторных условиях). В XVI - XVIII вв. свойства водорода, его горение, наблюдали такие учёные как Парацельс, Бойль и другие учёные того времени. С распространением теории флогистона многие химики хотели получить водород в качестве свободного флогистона. Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч. - другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч. - третий. Официально считается[2][3], что кислород был открыт английским химиком Джозефом Пристли 1 августа1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы). Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химикаПьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
2.Краткая история становления инструментальных методов химического анализа. ________________________________________________________________________________________________________________________________________________________
Билет № 22.
Теория флогистона.
Флогисто́н (от греч. φλογιστός — горючий, воспламеняемый) — в истории химии — гипотетическая «сверхтонкая материя» — «огненная субстанция», якобы наполняющая все горючие вещества и высвобождающаяся из них при горении.
Термин введён в начале XVIII века Иоганном Бехером и Георгом Шталем в 1703 году для объяснения процессов горения. Флогистон представляли как невесомый флюид, улетучивавшийся из вещества при сжигании. В то время считалось, что металл — это соединение «земли» (оксидаметалла) с флогистоном, и при горении металл разлагается на «землю» и флогистон, который смешивается с воздухом и не может быть отделён от него. Открытое позже увеличение массы металла при прокаливании стали объяснять отрицательной массой флогистона. Способность выделять флогистон из воздуха приписывали растениям.
Химики XVI и XVII веков достаточно часто упоминали о выделении газа при воздействии кислот на металлы. Первым собрал и исследовал выделяющийся газ Генри Кавендиш только в 1766. Будучи сторонником теории флогистона, Кавендиш сперва полагал, что этот газ, по причине его горючести и легкости, и есть чистый флогистон, однако, вскоре отказался от этой идеи. Уже позже, в1783 году, Антуан Лавуазье, проведя исследование воды, доказал сложность её состава, а в 1787определил «горючий воздух» как новый химический элемент, который теперь известен какводород.
Поскольку вещество прекращает гореть, либо когда сгорит полностью, либо когда в объеме, где оно горит, закончится весь воздух, то воздух также был какое-то время частью теории. Таким образом считалось, что именно воздух поглощает флогистон, покидающий горящее тело. ПозжеДаниель Рутерфорд, ученик Джозефа Блэка, обнаружил азот в 1772 и использовал данную теорию, чтобы объяснить свой результат. Остаток воздуха, оставленного после горения, фактически являющийся смесью азота и углекислого газа, иногда упоминался как «phlogisticated air» (флогистированный воздух).
Наоборот же, когда был обнаружен кислород, его назвали «dephlogisticated air» (дефлогистированный воздух), как вещество, способное к объединению с большим количеством флогистона и таким образом поддерживающее горение дольше, чем обычный воздух.
Гипотеза флогистона была первой теорией в химии и позволила обобщить множество реакций. Это было заметным шагом на пути становления химии как науки. В 1770-х годах теория флогистона была опровергнута благодаря работам Антуана Лавуазье, после которых её сменила другая —кислородная теория горения.
2.Создание основ химической кинетики. ________________________________________________________________________________________________________________________________________________________
Билет № 23.
infopedia.su

 Воздушный насос Р. Бойля
Воздушный насос Р. Бойля Пневматическая химия (пневматология) (от греч. πνεῦμα — дыхание, дуновение, дух) — название химии газов, применявшееся в конце XVIII — начале XIX вв. В настоящее время используется исключительно как исторический термин, характеризующий ранний период химического исследования газов.
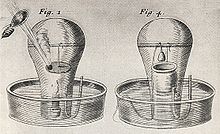
 Опыт Джона Мейоу по изучению горения
Опыт Джона Мейоу по изучению горения До середины XVII века газы еще не различались и считались лишь разными видами воздуха. Фламандский химик Ян Ван-Гельмонт, по-видимому, первый показал, что следует признать существование ряда различных воздухообразных тел, которые он назвал газами (франц. gaz, от греч. chaos - хаос). Он положил основание пневматической химии своими наблюдениями над образованием непохожего на воздух «лесного газа» (gas sylvestre) при действии кислот на известняк, при брожении молодого вина, при горении угля.
После Ван-Гельмонта изучением газов занимались отдельные исследователи. Жан Рей (англ.)русск. ещё в 1630 году предположил участие воздуха при обжиге металлов. Роберт Бойль, основоположник экспериментального подхода к определению элементов сконструировал один из первых воздушных насосов и открыл с его помощью в 1660 году газовый закон, носящий теперь его имя. В 1665 году Роберт Гук в работе «Микрография» также предположил наличие в воздухе особого вещества, подобного веществу, содержащемуся в связанном состоянии в селитре. Дальнейшее развитие эти взгляды получили в книге «О селитре и воздушном спирте селитры», написанную в 1669 году английским химиком Джоном Мейоу (англ.)русск.. Мейоу, проведя знаменитые опытами с горящей свечой под колоколом, пытался доказать, что в воздухе содержится особый газ (spiritus nitroaëreus), поддерживающий горение и необходимый для дыхания.
Формирование во второй половине XVII века флогистонной теории — первой научной теории химии — послужило мощным стимулом развития количественных исследований, без которых было невозможно экспериментальное подтверждение гипотезы о химических элементах. Важным следствием появления флогистонной теории явилось активное изучение химиками газов вообще и газообразных продуктов горения в частности. Факт того, что воздух легко сжимается, стал несомненным доводом в пользу возрождения атомистических представлений и уже первые эксперименты с газообразными веществами привели к гипотезе о дискретном (корпускулярном, от лат. corpuscula — частица) строении вещества.

 Приборы Стивена Хейлза для сбора воздуха и пневматическая ванна (1727)
Приборы Стивена Хейлза для сбора воздуха и пневматическая ванна (1727) В начале XVIII в. химики не проявляли особого интереса к изучению газов. Основной причиной этого было отсутствие в их распоряжении удобных методов получения, собирания и исследования свойств отдельных газов. Однако некоторые ученые все же пытались исследовать свойства известных в то время газов, применяя воздушный насос Бойля и примитивные приспособления для собирания выделяющихся в различных процессах газов. Так, Михаил Ломоносов, изучавший механизм растворения металлов в кислотах, получил при растворении меди в азотной кислоте оксиды азота и описал некоторые свойства этого газа. Для собирания газа он пользовался бычьим пузырем.
Важный шаг в начале XVIII век по преодолению экспериментальных затруднений был сделан английским химиком Стивеном Гейлсом, который изобрёл «пневматическую ванну» — прибор для улавливания газов, выделяющихся при разложении веществ, который представлял собой сосуд с водой, погруженный вверх дном в ванну с водой. Тем самым исследователи получили важнейший инструмент для выделения, идентификации и изучения различных летучих веществ.
Начало пневматической химии было положено работами английского ученого Джозефа Блэка. Блэк установил (1756), что при нагревании белой магнезии из неё выделяется газ и образуется с потерей массы жжёная магнезия. На основе этих опытов Блэк сделал вывод, что в состав мягких щелочей (углекислых солей) входит некий «связанный воздух», позже названный углекислым газом. Блэк открыл также реакцию поглощения углекислого газа «известковой водой». Отсюда возникло представление, что благодаря определенным воздействиям можно выделить отдельные газы из их смесей. Этот опыт явился важнейшей предпосылкой для возникновения газового анализа. Кроме того, Блэк обнаружил возможность определения массы газообразных веществ при рассмотрении их соединений, находящихся в твердом состоянии.

 Прибор Г. Кавендиша для получения и собирания водорода
Прибор Г. Кавендиша для получения и собирания водорода Открытие способов получения минеральных кислот (прежде всего, серной и соляной) в XVII веке положило начало наблюдениям за выделением некоего «воздуха» при действии кислот на железо и другие металлы. Исследователем впервые описавшем природу этого газа стал английский ученый Генри Кавендиш. В 1766 году Кавендиш опубликовал работу «Искусственный воздух», где сообщалось об открытии «горючего воздуха» (водорода), а также описывались методики собирания, очистки и изучения газов. Кавендишу удалось получить в чистом виде водород и углекислый газ, установить их относительную плотность и другие свойства.
В 1781 году Кавендиш определил состав воздуха, а в 1784 г., сжигая водород, установил качественный состав воды, опровергнув представления об её элементарности (неразложимости на более простые вещества). В своих исследованиях Кавендиш применил новый метод — действие электрического разряда на смеси газов в изолированных от воздуха стеклянных сосудах. Именно так Кавендиш впервые получил воду из смеси водорода и кислорода. В 1785 году Кавендиш обратил внимание на пузырьки «остаточного воздуха» (1/120 первоначального объема), который не изменялся под действием электричества (лишь в 1894 году лорд Рэлей установил, что «остаточный воздух» — это инертный газ аргон). Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лавуазье. Он же впервые получил его из воды и дал этому веществу название Hydrogenium (водород).

 Приборы Дж. Пристли для исследования газов
Приборы Дж. Пристли для исследования газов Больших успехов в выделении газов и изучении их свойств достиг протестантский священник Джозеф Пристли. Близ Лидса, где он служил, находился пивоваренный завод, откуда можно было получать в больших количествах «связанный воздух» для проведения опытов. Пристли обнаружил, что газы могут растворяться в воде, и предложил собирать их не над водой, а над ртутью. Так он сумел собрать и изучить «веселящий газ», аммиак, хлороводород, диоксид серы. В 1774 году Пристли сделал самое важное свое открытие — кислород: нагревая красный оксид ртути, он выделил газ, в котором вещества горели особенно ярко. Будучи сторонником теории флогистона, он назвал этот газ «дефлогистированным воздухом». Газ, открытый Пристли, казался антиподом химически инертного «флогистированного воздуха» (азота), выделенного в 1772 году английским химиком Даниэлем Резерфордом.
Из большей силы и яркости пламени свечи в этом чистом воздухе можно заключить, что он (полученный Пристли газ) может быть особенно полезен для лёгких в некоторых болезненных случаях. Я имел возможность испытать его эффект на себе, вдыхая значительное количество его через трубку. Это дало мне замечательное ощущение свободы и лёгкости в груди. Кто бы мог отрицать, что когда-нибудь этот чистый воздух станет модным средством для развлечений? До сих пор, однако, только две мыши и я сам имели привилегию дышать им.Я не могу не польстить сам себе, что, в своё время применение этих разнообразных видов газов станет широко использоваться в медицине
— Пер. по [1]
Следует отметить, что свойства газа, выделенного Пристли, еще в 1771 году описал шведский химик Карл Вильгельм Шееле, получивший его разложением селитры, но его сообщение по небрежности издателя появилось в печати лишь в 1777. Шееле назвал этот газ «огненным воздухом» и сообщил о своём опыте Лавуазье. Шееле использовал для улавливания газов дыхательные пузыри крупных рыб. Лишь необычайные способности Шееле как экспериментатора позволили ему с помощью этой примитивной техники совершить также такие выдающиеся открытия, как обнаружение хлора (1774) и сероводорода (1776).

 Эксперимент Лавуазье по выделению кислорода из воздуха
Эксперимент Лавуазье по выделению кислорода из воздуха Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида (1784).
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Прибегая в своих исследованиях постоянно к точному взвешиванию, Лавуазье показал, что при процессе горения вещество не выделяется из горящего тела, а присоединяется к нему. Установив свой новый взгляд на процессы горения и окисления (работы 1775-1789 гг.), Лавуазье вместе с тем правильно понял состав воздуха. Путём анализа и синтеза он показал, что воздух есть смесь двух газов: один из них — есть газ, преимущественно поддерживающий горение, «здоровый (salubre) воздух, чистый воздух, жизненный воздух, кислород», как последовательно называл его сам Лавуазье, другой газ — нездоровый воздух (moffette) или азот. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье также предположил (1778), что наличие в составе вещества кислорода обусловливает его кислотные свойства (именно эта гипотеза дала название кислороду как химическому элементу). Факт получения водорода (горючего воздуха) и кислорода (чрезвычайно чистого воздуха) из воды был установлен в 1783 году знаменитым изобретателем паровой машины Джеймсом Уаттом. В том же году Лавуазье проверил опыты Кавендиша и Пристли и уже вполне определенно заявил, что вода не есть элемент, но она может быть разложена и вновь соединена. Уатт узнал об этом объяснении Лавуазье и с чувством глубокой обиды написал одному из своих друзей:
Лавуазье знал о моей теории, но не упомянул ни в малейшей степени обо мне. Богатым людям дозволено совершать низкие дела.
— Цит. по [2]
За последнюю четверть века химия обогатилась открытием различных газообразных веществ, среди которых так и не было найдено вещества, идентичного флогистону. Таким образом, к концу XVIII века произошёл переворот в теоретических взглядах химиков, обычно называемый «химической революцией». Открытия газов и окислительная теория Лавуазье повлекли за собой рационализацию химии. С этого времени изучение газов стало происходить исключительно на основе методов взвешивания, измерения объёма и давления.

 Аппарат Дж. Уатта и Т. Беддо для ингаляций и кондиционирования воздуха (1795)
Аппарат Дж. Уатта и Т. Беддо для ингаляций и кондиционирования воздуха (1795) Исследования действия газов (в особенности кислорода) на живые организмы, начатые Пристли и Шееле, породило хотя и кратковременное, но весьма любопытное модное увлечение, получившее название «пневматическая медицина». Доктор Томас Беддо (англ.)русск. увлёкся перспективой применения газов для лечения заболеваний, в частности туберкулёза, с помощью ингаляции газов; его идеи встретили весьма горячий отклик и всяческую помощь в обществе[3]. В марте 1799 года по инициативе Беддо на средства меценатов под Бристолем создаётся «Пневматический институт (англ.)русск.» — научно-лечебное учреждение с лабораториями, больницей на 10 коек и поликлиническим отделением. В институте широко проводились испытания ингаляций кислорода, водорода, азота и некоторых недавно открытых углеводородов, создавались и испытывались первые ингаляторы, спирометры, баллоны для сжатых газов и т. д. Исследования Беддо и его коллег заложили основу современной респираторной терапии: впервые был применён с лечебной целью кислород; разработаны основы аэрозольной терапии; измерена общая ёмкость лёгких методом разведения водорода.

 «Новые открытия в пневматике». Карикатура Дж. Гиллрея (1802), изображающая лекцию о закиси азота в Королевском институте: за демонстрационным столом лектор (Томас Юнг или Томас Гарнетт), который проводит эксперимент над Джоном Гипписли (англ.)русск., директором Королевского института, ему ассистирует Гэмфри Дэви (с мехами), у дверей стоит граф Румфорд
«Новые открытия в пневматике». Карикатура Дж. Гиллрея (1802), изображающая лекцию о закиси азота в Королевском институте: за демонстрационным столом лектор (Томас Юнг или Томас Гарнетт), который проводит эксперимент над Джоном Гипписли (англ.)русск., директором Королевского института, ему ассистирует Гэмфри Дэви (с мехами), у дверей стоит граф Румфорд .
В том же году свои работы по изучению газов начал приглашенный в Пневматический институт молодой химик Гемфри Дэви. Особое внимание Дэви уделил закиси азота. Наркотические свойства этого газа позволили Дэви ранее назвать его «веселящим» (laughing gas). В 1800 году Дэви описывает обезболивающее действие ингаляции закиси азота:
При прорезывании одного злосчастного зуба, называемого dentes sapientiae, я испытывал острое воспаление десны, сопровождающееся большой болью, которая одинаково мешала как отдыху, так и сознательной работе. Однажды, когда воспаление было чрезвычайно чувствительно, я вдохнул три большие дозы закиси азота. Боль совершенно исчезла после первых четырёх или пяти вдохов и неприятные ощущения на несколько минут сменились чувством удовольствия. Когда прежнее состояние сознания возвратилось, вместе с ним вернулось и состояние в органе, и мне даже показалось, что боль была сильнее после опыта, чем раньше"
— Цит. по [4]

 «Жизнь становится легче». Граф Румфорд и Г. Дэви демонстрируют действие «веселящего газа» (карикатура нач. XIX в.)
«Жизнь становится легче». Граф Румфорд и Г. Дэви демонстрируют действие «веселящего газа» (карикатура нач. XIX в.) Большой заслугой Дэви за время работы в Пневматическом институте стала разработка методов очистки газов от ядовитых примесей. Дэви широко популяризировал свои открытия посредством публичных лекций в Королевском институте, созданного по инициативе Бенджамина Томпсона (графа Румфорда), Джозефа Банкса и Генри Кавендиша. По словам современника, «…люди первого ранга и таланта, из литературного общества и науки, практики и теоретики, „синие чулки“ и великосветские дамы, старые и молодые — все жадно наполняли аудиторию»[5].
Интерес публики к ингаляциям «веселящего газа» был столь высок, что даже нашёл отражение в многочисленных памфлетах и карикатурах.
Общественный интерес к «пневматической медицине» быстро угас. Причиной тому было отсутствие какой-либо научной основы эмпирического применения газов при различных болезнях. Через некоторое время «пневматическая медицина» была объявлена шарлатанством и запрещена, Пневматический институт был закрыт уже в 1802 году.
Значительный вклад в изучение газов в этот период внесли Жозеф Луи Гей-Люссак и Джон Дальтон, начавшие в 1802 году независимые исследования упругости газов в зависимости от температуры, а также процессов парообразования. Гей-Люссак получил весьма точное значение коэффициента теплового расширения газов и установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом (закон Гей-Люссака).

 «Поразительный эффект светильного газа» ((карикатура 1818 г.)
«Поразительный эффект светильного газа» ((карикатура 1818 г.) В 1808 году Гей-Люссак опубликовал небольшую заметку «О взаимном соединении газообразных веществ», содержащую результаты первых количественных исследований реакций между газами. Выводы, сделанные в этой статье оказались настолько важными, что впоследствии получили название закона объёмных отношений. Гей-Люссак установил, что «газы, действуя друг на друга, соединяются в простых отношениях, например 1 к 1, 1 к 2 или 2 к 3». В те годы атомистическая теория делала только первые шаги, поэтому выводы Гей-Люссака были настоящим прорывом в области исследования структуры вещества. Гей-Люссак выяснил также, что это соотношение не меняется с температурой, вопреки общепринятым тогда представлениям, что количество элементарных частиц, составляющих газ, изменяется с температурой, причём в разных пропорциях для различных газов.
Результаты исследований Гей-Люссака легли в основу одного из важных основных положений химии, сформулированных в 1811 году Амедео Авогадро: «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул».
Становление атомно-молекулярной теории положило конец периоду пневматической химии, ставшей частными разделами химии и физики.
Развитие пневматической химии и аналитических исследований во второй половине XVIII века оказало существенное влияние на представление химиков об элементах. Факт существования несколько видов воздуха свидетельствовали об укреплении представления о них как о химически индивидуальных веществах, в том числе формировалась гипотеза о существовании различных неразложимых на какие-либо компоненты и не трансмутируемых друг в друга элементов, сочетание которых образует химические соединения и обусловливает их свойства.
Расширение объектов химического исследования во второй половине XVIII в. привело к открытию настолько большого количества самых разнообразных экспериментальных фактов, что они уже не могли быть систематизированы в рамках теории флогистона. Ведущую роль здесь сыграли возникновение химии газов и постановка вопроса о весовых соотношениях. Теоретическое переосмысление химической информации рядом выдающихся исследователей привело к опровержению флогистики и созданию новой системы представлений о химических веществах и их превращениях. Вместе с крупными достижениями химического анализа это событие положило начало первой химической революции.
dic.academic.ru
Начинается развитие химии газов — пневматической химии, связанной в первую очередь с именем ирландского ученого Роберта Бойля (1627—1691). Однако главная роль Бойля в развитии химии определяется полным освобождением ее от алхимии (да и ятрохимии). Химики, — утверждал Бойль, — до сих пор руководствовались чересчур узкими принципами, не требовавшими особенно широкого умственного кругозора они усматривали свою задачу в приготовлении лекарств, в извлечении и превращении металлов. Я смотрю на химию с совершенно другой точки зрения я смотрю на нее не как врач, не как алхимик, а как должен смотреть на нее философ . Это Бойль отбросил частичку ал в самом термине, чтобы подчеркнуть отличие науки от алхимии. Он ввел первое научное определение химического элемента как составной части вещества, которую нельзя разложить на более простые части создал по-настоящему экспериментальный метод исследования положил начало химическому анализу, т. е. способствовал становлению химии как самостоятельной науки. Вот почему именно с Бойлем многие авторы связывают начало развития химической науки. [c.21]
И все же крупнейшим представителем пневматической химии следует считать Бойля и не только потому, что им был открыт закон, носящий его имя, но и потому, что он ввел первые аппараты для собирания воздуха и тем самым дал в руки химиков важнейшее средство для выделения и изучения других газов. [c.85]Важный шаг в этом направлении в начале ХУП1 в. сделал английский ботаник и химик Стивен Гейле (1677—1761). Он изобрел прибор для собирания газов над водой. Этот прибор известен ам под названием пневматической ванны . Пары, образующиеся я результате химической реакции, Гейле отводил через трубку в сосуд с водой, опущенный вверх дном в ванну с водой. Пузырьки газа поднимались в верхнюю часть сосуда и вытесняли оттуда воду. Таким образом Гейле собирал газ или газы, образующиеся в результате реакции. Сам Гейле не идентифицировал собранные газы и не изучал их свойств, однако сконструированный им прибор для собирания газов сыграл важную роль в развитии пневматической химии. [c.39]
Период объединения химии охватывает XVI, XVII и XVIII вв. и состоит из четырех подпериодов ятрохимии, пневматической химии (химии газов), теории флогистона и антифлогистической системы Лавуазье. [c.14]
Водород был открыт в 1766 г. английским химиком, который установил, что при взаимодействии металлов с разбавленными кислотами выделяется некий горючий воздух (в те времена все газы называли воздухом ). Наблюдая горение водорода на воздухе, химик установил, что в результате появляется вода. Это было в 1782 г. Английский естествоиспытатель, физик и химик, открывший водород, все научные исследования проводил в собственной лаборатории и много занимался пневматической химией — химией газов. На современников этот ученый производил очень странное впечатление голос его был похож на писк, а обращение с людьми — нервное. Он пугался незнакомых, от смущения терял дар речи... Имея изрядное состояние, своим богатством он почти не пользовался. Несмотря на все свои чудачества, этот человек вошел в историю химии как блестящий ученый-экспериментатор. Его именем названа знаменитая лаборатория в Кембриджском университете в Англии. Кто же этот химик [c.280]
IV. ПЕРИОД ОБЪЕДИНЕНИЯ. ПНЕВМАТИЧЕСКАЯ ХИМИЯ (ХИМИЯ ГАЗОВ) [c.86]
Во второй половине XVIII в. получила развитие пневматическая химия — исследование газов, выделяющихся при разложении различных веществ. Химики-пневматики были сторонниками теории флогистона, что мешало им правильно интерпретировать результаты своих опытов. Так, открытие кислорода по существу принадлежит Лавуазье (1775), а не Шееле и Пристли, которые так и не поняли, как указывал Энгельс, что именно они получили, так как ...оставались в плену флогистонных категорий, которые они иашли у своих предшественников . [c.15]
Представления о родстве процессов горения и кальцинации металлов, развитые Г. Шталем в 1690—1720 гг. и ставшие основанием теории флогистона, оказались простыми, ясными и доходчивыми в разъяснении вопросов о составных частях сложных тел, т, е, об элементном составе. Являясь результатом количественного химического анализа, они служили одновременно мощным стимулом развития последнего. И что особенно интересно тогда, когда фло-гистики были вынуждены приписать флогистону в высшей степени странное свойство отрицательного веса , количественные исследования элементного состава сложных тел, именно ввиду этой странности или загадочности отношений между весомой материей и невесомым (или даже отрицательно весомым) флюидом, стали более многочисленными. У флогистонной теории оказался, таким образом, мощный дополнительный стимул для развития количественного химического анализа. В поисках соответствия флогистонной теории со здравым смыслом, с традиционными представлениями о весомости материальных тел появились работы, направленные на сочетание объемных и гравиметрических методов количественного анализа. В русле теории флогистона появилась так называе-тя пневматическая химия, основоположники которой Дж. Блэк. [c.39]
Одновременно с Дж. Пристли в области пневматической химии работал К. Шееле. Он писал Исследования воздуха являются в настоящ(зе время важнейшим предметом химии. Этот упругий флюид обладает многими особыми свойствами, изучение которых способствует новым открытиям. Удивительный огонь, этот продукт химии, показывает нам, что без воздуха он не может производиться... В 1774 г., действуя иа черную магнезию (пиролюзит, МпОг) соляной кислотой при нагревании, К. Шееле получил деф-логистироваиную соляную кислоту (хлор), а в 1775 г. — мышьяковистый водород. [c.74]
В 1788 г. Г. Кавендиш опубликовал свою последнюю работу по пневматической химии, в которой рассматривал вопрос о составе флогистированной части воздуха (азот). [c.78]
Следовательно, как в XVII в., так и в первой половине XVIII в., когда количественный метод исследования еще только возникал, идея об участии воздуха в процессах горения и окисления не получила достаточно полного экспериментального подтверждения. Но к концу XVIII в. ситуация изменилась, что было связано главным образом с успехами пневматической химии. В 1774 г. А. Лавуазье выпустил в свет книгу Небольшие работы по физике и химии , содержащую, кроме обзора научных достижений в области химии газов, изложение новых представлений о процессе горения, обжигания и выводы о том, что увеличение массы олова и свинца происходит в результате присоединения части атмосферного воздуха (кислород был тогда еще неизвестен А. Лавуазье). Эту книгу он послал некоторым французским и зарубежным ученым, а также в иностранные академии наук, в том числе и в Петербургскую Академию наук. В сопроводительном письме [c.87]
Уже при самом общем знакомстве с этим процессом накопления химических знаний выявляются некоторые его характерные особенности. Прежде всего следует отметить, что основные направления развития химии заметно изменялись от эпохи к эпохе так, каждой из них были свойственны свои проблемы, выдвигавшиеся для разработки и решения. В истории химии известны периоды практической и ремесленной химии, алхимии, иатрохимии, теории флогистона, аналитической и пневматической химии, химической революции, формирования атомномолекулярного учения, зарождения и развития органической химии, физической химии и т. д. [c.5]
В рамках химико-аналитического периода, начиная с 60-х гг. XVIII в., химики заинтересовались изучением газов, выделяющихся при некоторых химических превращениях. С этого времени начался короткий, но исключительно важный в развитии химии этап развития пневматической химии . [c.43]
В области пневматической химии Дж. Пристлею принадлежит прежде всего усовершенствование пневматической ванны [c.54]
Весьма важными для дальнейшего развития химии оказались и исследования Ван-Гельмонта, посвященные газам. Эти исследования положили начало развитию химии газов, или, как она стала называться впоследствии, пневматической химии (стр. 292) (от греческого -v j[jwi — дух , газ ). Занимаясь как иатрохимик изучением и объяснением процессов, происходящих в животных организмах, в частности явлениями брожения, Ван-Гельмонт заинтересовался газообразными продуктами брожения. До него химики и врачи не имели никакого понятия о газах. Все газы, которые они, несомненно, получали случайно, они считали воздухом чистым или испорченным, не имеющим веса. Запахи же объясняли примесью к воздуху частиц тел с острыми углами. [c.154]
В 28-летнем возрасте К- Шееле познакомился с Т. Бергма ном, и между ними установились дружеские взаимоотношения В 1775 г. К. Шееле был избран членом Стокгольмской академи наук. С одинаковым успехом он работал как в области аналити ческой и фармацевтической, так и пневматической химии. Сво исследования он опубликовал лишь в 1777 г. в книге Химиче ский трактат о воздухе и огне , когда многие сделанные ил открытия были уже опубликованы другими. Однако приорите К. Шееле на эти открытия не подлежит сомнению. [c.56]
Исследования, относящиеся к химии, заложили основы науки о газах, или пневматической химии. Создал ряд приборов для изучения газов. Занимался изучением углекислого газа — воздуха, испорченного горением или дыханием и очищенного зелеными частями растений. Впервые получил солянокислый воздух — хлористый водород (1772), селитряный воздух — закись азота (1772), заметив, что он при соприкосновении с воздухом переходит в газ бурого цвета. Открыл (1772— 1774) щелочной воздух —аммиак. Открыл (1774) бесфлогнстонный воздух — кислород, получив его при нагревании оксида ртути. Изучил растворение углекислого газа и аммиака в воде. Получил продукт соединения серной и азотной кислот (названный позднее нитро-зилсерной кислотой) выделил (1775—1799) индивидуальные фтористый кремний, сернистый газ и окись углерода. Результаты своих химических исследований опубликовал в сочинении Опыты и наблюдения над различными видами воздуха (т. 1—3, 1774—1777). В теоретических воззрениях придерживался гипотезы флогистона. [c.409]
Подпериод пневматической химии характеризуется исследованием газов и открытием газообразных простых тел и соединений. Кроме Бойля, открывшего известный закон зависимости объема газа от давления, с пнев-матологией связаны имена Блэка, Кавендиша, Пристли, Фонтаны и др Все эти великие химики, за исключением Бойля, которого в известном отношении можно считать предвестником следующего периода, были приверженцами теории флогистона. [c.14]
Ван Гельмонт сохраняет в качестве первичных элементов (elementa primigenia) воду и воздух и в то же время не считает элементами землю и огонь по соображения, которые привели его к этому разграничению, находятся еще в орбите перипатетической школы. Согласно Ван Гельмонту, воздух и вода — элементы первичные, потому что они не могут превратиться один в другой напротив, чистая и простая земля (хотя и считавшаяся сначала элементом), по-видимому, происходит из воды, потому что при помощи некоторых средств может быть переведена в воду однако огонь — ни элемент, ни вещество. В главе XX Зари медицины Ван Гельмонт утверждает Теперь надо показать, что все тела (которые считались смешанными), какой бы природы они ни были, непрозрачные и проз рачные, твердые и жидкие, сходные и несходные (как камень, сера, металл, мед, воск, жир, охра, мозг, хрящи, дерево, кора, листья и т. д.), составлены фактически из простой воды и могут быть полностью переведены в безвкусную воду, причем не остается ни малейшей доли земляного мира . Подобные мысли не могли способствовать возникновению новых методов экспериментального исследования все же они означали конец переходного периода между перипатетической и бойлевской концепциями. Труды Ван Гельмонта, однако, в значительной степени способствовали признанию важности химических процессов в жизненных явлениях, а также положили начало пневматической химии, т. е. химии газов [c.67]
Основоположником пневматической химии был Ван Гельмонт, который не только ввел термин газ (gaz или gas), но и положил основание пневматической химии своими наблюдениями над образованием непохожего на воздух лесного газа (gas silvestre) при действии кислот на известняк, при брожении молодого вина и при приготовлении пива, а также при горении угля. Эти наблюдения, сделанные в первой половине XVII в., когда газы, выделявшиеся во время лабораторных работ, рассматривались как разновидность воздуха, имели большое значение. [c.85]
Открытие и изучение газов главным образом привело к падению теории флогистона и, следовательно, к созданию новой химии. Это является немалой заслугой, которая заставляет нас теперь оценивать весьма положительно пневматическую химйю, тем более что химики-пневматики в своих трудах частично примыкали к теории флогистона, господствовавшей в XVIII в., но одновременно закладывали экспериментальные основы главных химических процессов — от химического взаимодействия вообще до явлений горения в особенности. Период от Бойля до Лавуазье — это время расцвета экспериментальных исследований, которые не потеряли своего значения для новой химии весьма важной была и деятельность многочисленных других исследователей, приверягенцев теории флогистона. [c.86]
Генри Кавевдищ (1731—1810). Родился в Ницце, сын лорда Кавендиша, состоявшего в родстве с герцогом Девонширским и герцогом Кентским, умер в Лондоне. Хотя получил значительное наследство, но жил скромно был по природе больше женоненавистником, чем мизантропом. Он занимался исследованиями в области физики (удельный вес, удельная тепл> еикость), но также обогатил и химию сведениями фундаментального значения. Исследования газов, проведенные Кавендишем, дали основание считать его отцом пневматической химии он определил природу водорода как особого газа подтвердил, что атмосферный воздух есть смесь кислорода и азота, что вода [c.113]
Дж. Ф. Феличе Фонтана (1730—1805) был профессором рациональной философии в Пизе и директором Музея естественной истории во Флореннии Кроме его вклада в пневматическую химию, следует упомянуть об открытии им адсорбирующих свойств угля. Даже установив постоянство веса ври звмических реакпвях, он не смог ни вывести из этого факта принципа, имеющего фундаментальное значение для химии, ни освободиться от теории флогистона. [c.124]
Исследование химических превращений, сопровождавшихся выделением газов, приве.ло к возникновению специального интереса у химиков к этим веществам, в то время еще весьма мало изученным. В течение семидесятых и восьмидесятых годов XVIII в. были открыты многие новые газы как элементарной природы (кислород, водород, азот), так и сложного состава. Изучение свойств этих газов и их роли в химических и жизненных процессах привело к полному пересмотру взглядов на химическую сущность явлений горения и дыхания. Двадцатилетию период открытия и изучения газов во второй половине XVIII в. обычно называют периодом пневматической химии. [c.252]
chem21.info