|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Читать реферат по химии: "Оксиды. Кислоты. Основания. Амфотерность. Соли". Оксиды в природе реферат по химии
Реферат - Фрунзенского района Санкт-Петербурга реферат по химии «оксид алюминия»
Государственное общеобразовательное учреждение средняя общеобразовательная школа № 325
Фрунзенского района Санкт-Петербурга
РЕФЕРАТ ПО ХИМИИ
«ОКСИД АЛЮМИНИЯ»
Работу выполнила ученица 9 «А»
Ершова Мария
Научный руководитель:
Рогова Е. В.
Научный консультант:
Головко Н. В.
Санкт-Петербург
2011г.
Содержание
Введение……………………………………………………….3
Содержание в природе………………………………………..4
Драгоценные камни и их образование……………………….6
Корунд..………………………………………………….……..6
Сапфиры………………………………………………………..7
Рубины…………………………………………………….……8
Физические свойства……………………………………....…..9
Химические свойства ……………………..............................10
Применение…………………….. ………………………..…..12
Получение алюминия…………………………………….…..12
Использование физических свойств Al2O3………………......15
Заключение……………………………………………….…....17
Информационные источники…………………………..……..18
Введение
Драгоценности – это символ особого статуса, они украшают короны королей, как наглядное напоминание богатства и процветания того, кто их носит, а также и тех, кто это видит.
Знахари и целители приписывают некоторым драгоценным камням магическую силу. Легенды о знаменитых камнях, о счастье и бедах, которые они принесли своим владельцам, завораживают наше воображение.
^ Драгоценные камни – это именно сокровища. Их уникальные свойства ценились во все времена и по всему миру. Ценятся они, и по сей день. Возможно, внимание того, кто впервые поднял драгоценный камень, привлекла его яркая окраска или кристаллическая форма, а может быть, и цвет породы, в которую он был заключен.
Разнообразие цветов корунда зачаровывает и привлекает большинство людей, в особенности дам.
Чистый корунд бесцветен. Однако корунды используют не только, как драгоценность, есть еще множество применений этого минерала. А точнее то, из чего он состоит.
^ Цель работы: проанализировать свойства оксида алюминия и его применение в промышленности и в быту.
Задачи:
Проанализировать литературу по теме «Оксид алюминия»
Изучить исторический аспект явления вещества.
Изучить применение оксида алюминия.
Сделать выводы данной теме.
Содержание в природе
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых! Алюминий входит в огромное число минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Всего же известно более 250 минералов, в состав которых входит алюминий; большинство из них – алюмосиликаты, из которых и образована в основном земная кора.
Соединения алюминия были известны человеку с древних времён. Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO4)2. Они находили широкое применение. Использовались в качестве протравы и как средство, останавливающее кровь. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Известен интересный исторический факт. Архелай, полководец из Рима, во время войны с персами приказал намазать башни, которые служили в качестве оборонительных сооружений, квасцами. Персам так и не удалось сжечь их.
При выветривании алюмосиликатов образуется глина, основу которой составляет минерал каолинит Al2O3·2SiO2·2h3O. Химический состав глин колеблется в широких пределах, и входящие в состав глин оксиды по разному влияют на процесс получения конечные свойства керамики. Оксид алюминия (глинозем – А1203) при повышенном его количестве в глине приводит к увеличению температуры обжига и интервала спекания. А изделия с низким содержанием глинозема обладают невысокой прочностью. Примеси железа обычно окрашивают глину в бурый цвет, но встречаются и белая глина – каолин, которую применяют для изготовления фарфоровых и фаянсовых изделий.
Глинозём, Аl2Оз - белое кристаллическое веществово, нерастворимое в воде, tпл=2050оС. Встречается в природе в виде минералов - корунда (бесцветный), рубина (красный), сапфира (синий). О корунде мы будем говорить в следующей главе.
Важнейший минерал алюминия – боксит, Al2O3·xh3O. Крупнейшие месторождения боксита находятся в Австралии, Бразилии, Гвинее и на Ямайке; промышленная добыча ведется и в других странах. Боксит (фр. bauxite) (по названию местности Baux на юге Франции) — алюминиевая руда, сырьё для получения глинозёма и глинозёмосодержащих огнеупоров. Содержание глинозёма в промышленных бокситах колеблется от 40 % до 60 % и выше. Используется также в качестве флюса в чёрной металлургии.
Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.
(Алунит, квасцовый камень (фр. alunite — квасцы) — минерал состава K2SO4*Al2(SO4)3*4Al(OH)3 или KAl3(SO4)2(OH)6. Цвет белый, серый.
Нефелин (элеолит) — породообразующий минерал, алюмосиликат калия и натрия ортокремниевой кислоты (Na,K)AlSiO4.)
Образование драгоценных камней
Семейство корундов, к которому принадлежит рубин и сапфир, имеет очень простую химическую формулу - Al2O3: в молекуле корунда содержится два атома алюминия и три атома кислорода.
Чистый корунд - бесцветное вещество, но в природе редко образуются идеальные драгоценные камни, и обычно корунд бывает окрашен. Хром и ванадий – это те самые акцессорные элементы, которые придают рубину характерный для него красный цвет; синий сапфир обязан своим цветом железу и титану, а зеленый, желтый и розовый сапфиры – другим сочетаниям элементов-спутников.
Корунд
Название «корунд» происходит от древних названий этого минерала: от тамильского kurundam и kurund на хинди.
Древние греки добывали корунд на острове Наксос в Эгейском море, и в наше время Наксос остается основным поставщиком абразивного наждака, используемого в промышленности в виде порошка, в быту мы встречаемся с ним в виде пилок для ногтей.
Чистый корунд бесцветен, сегодня он используется, как декоративный камень, в производстве часов, и как абразивный материал.
Месторождение корунда есть во многих странах мира.
Сапфиры
В быту слово «сапфир» ассоциируется исключительно с синими камнями. Традиционные цвета сапфиров – от бледно-голубого до глубокого синего (индиго). Сапфиры других цветов обычно называют «фантазийными апфирами», и среди них встречаются черные, фиолетовые, зеленые, темно-серые, желтые, оранжевые и белые. Сапфиры, как драгоценные камни получили признание еще в VIII веке до н.э. Правители древней Персии полагали, что небо голубое потому, что в нем отражаются сапфиры. Разными оттенками сапфиры обязаны примесям железа и титана, причем встречаются полосатые и пятнистые камни. Включения, присутствующие в сапфирах отражают свет, в результате чего возникает эффект, получивший название «шелк». Самая прозрачная и бесцветная разновидность сапфира называется лейкосапфир.
Обычно сапфиры находят в виде кристаллов, имеющих таблитчатую пирамидальную или ромбоэдрическую форму, а также форму бочонка. Для сапфиров характерно повторяющееся двойникование. Всем сапфирам присущ плеохроизм: стоит камень повернуть, как его цвет меняется.
Звездчатыми называют такие камни, в которых несколько включений рутила, похожих на тонкие иглы, так отражают свет, что возникает мерцающая шестиконечная звезда. Этот эффект называется астеризмом.
Самые ценные сапфиры добываются в Кашмире. Эти сапфиры обладают богатым бархатным блеском.
С 1902 года стали выпускать синтетические сапфиры, полученные из расплава оксида алюминия с добавлением титана.
Сапфир-падпарадша
Падпарадша – чрезвычайно редкая разновидность сапфира нежного розовато-оранжевого цвета, что объясняется наличием небольших количеств хрома, железа и ванадия. Название происходит от сингальского padmaragaya, что значит «цвет лотоса».
Самый дорогой камень из всех сапфиров. Добывают его в Шри-Ланка.
Рубины
Рубины – чрезвычайно редкие драгоценные камни. Известны рубины разных оттенков красного цвета – от розоватого до коричневато-красного. Интенсивность красного цвета зависит от количества хрома, усиливающего цвет. Коричневатый оттенок рубина свидетельствует о присутствии в них железа. Название происходит от латинского слова ruber , что значит «красный».
Рубины упоминаются еще в Библии. В Шри-Ланке их добычей занимаются более двух с половиной тысяч лет, а в Бирме с VI века.
Рубины встречаются в кристаллической известняке вместе со слюдой графитом, пирротитом и т. д.
Рубин- твердый камень, но двойниковые кристаллы ломаются довольно легко .
В 1902 году французский химик Огюст Вернейль разработал способ получения синтетических рубинов из оксида алюминия и красящего вещества.
Физические свойства
O=Al-O-Al=O
Оксид алюминия Al2O3 – белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу. Известно несколько кристаллических форм оксида алюминия, до 2044°С стабильна кристаллическая модификация α-Al2O3 – корунд.
Его кристаллическая структура представляет собой двухслойную плотнейшую шаровую упаковку из ионов кислорода, в октаэдрических пустотах которой размещены ионы алюминия, решетка ромбоэдрическая.
Химические свойства Al2O3
На воздухе алюминий покрывается тончайшей, но очень плотной плёнкой оксида, предохраняющей металл от дальнейшего окисления. В связи с этим поверхность его обычно имеет не блестящий, а матовый вид.
Образующаяся на поверхности алюминия в атмосферных условиях плёнка оксида имеет обычно толщину менее 1 нм, но очень прочно связана с металлом. Искусственно получаемые действием окислителей плёнки значительно толще. Хорошая защитная плёнка может быть получена, например, погружением алюминия в раствор, содержащий 20 % Na2SO4 и 10 % HNO3. С помощью подобранных наполнителей таким плёнкам можно придавать различную окраску.
Напротив, после контакта алюминия с раствором HgCl2 плёнка эта становится столь рыхлой, что уже не защищает металл от дальнейшего окисления. В результате он быстро обрастает “бородой” из водного оксида (Al2O3·xh3O) и постепенно окисляется нацело. Получившийся водный оксид, и сам по себе и после обезвоживания нагреванием, обладает высокой сорбционной активностью.
При нагревании стойкость оксидной плёнки значительно снижается. Особо следует отметить возможность заметной растворимости алюминия при кипячении его с разбавленными растворами некоторых органических кислот.
Лёгкость растворения алюминия в сильных щелочах обусловлена снятием с него защитной оксидной плёнки по схеме:
Al2O3 + 2КOH- + 3 h3O = 2К[Al(OH)4].
Al2O3 + 2 OH- + 3 h3O = 2 Al(OH)4-
Так как в ряду напряжений Al стоит значительнее левее водорода, обнажение чистой поверхности металла тотчас сопровождается реакциями по схемам:
2Al + 6H+·(из воды) = 2Al+3 + 3h3 и 2Al+3 + 8 OH- = 2Al(OH)4-.
Равновесие первой из них всё время смещается вправо за счёт второй. Аналогично протекает растворение в щелочах и других активных металлов, гидроксиды которых амфотерны (Sn, Zn и т. п.).
Оксид алюминия представляет собой белую очень тугоплавкую и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также получаемый искусственно и затем сильно прокаленный, отличается большой твёрдостью и нерастворимостью в кислотах.
Оксид алюминия - амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1. Реагирует с кислотами и растворами щелочей:
а. Как основной оксид:
Al2O3 + 6HCl = 2AlCl3 + 3h3O
б. Как кислотный оксид:
Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al2O3 + Na2CO3 = 2NaAlO2 (алюминат натрия) + CO2
Al2O3 + 2NaOH = 2NaAlO2 + h3O
Al2O3+2KOH = 2KAlO2 (метаалюминат K) + h3O
Сплавляя Al2O3 со щелочами, получают высокомолекулярные метааоксоалюминаты.
В алюмосиликатах алюминий играет такую же роль, как кремний: оба эти элемента образуют смешанное соединение – алюминат-силикат.
Кристаллические модификации Al2O3 химически очень стойки, не взаимодействуют с водой и кислотами. В растворимое состояние оксид (сесквиоксид) алюминия можно перевести сплавлением со щелочами или K2S2O7 по реакциям:
Al2O3 + 2 NaOH = h3O + 2 NaAlO2
Al2O3 + 3 K2S2O7 = Al2(SO4)3 + 3 K2SO4.
Применение Al2O3
1. ^ Оксид алюминия - сырьё для получения алюминия; производится из алюминийсодержащих руд, преим. бокситов. Также алюминий получают из нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
Первые попытки получить алюминий были сделаны только в середине XIX века. Попытка, предпринятая, датским учёным Х.К.Эрстедом увенчалась успехом. Для получения он использовал амальгированный калий в качестве восстановителя алюминия из оксида. Но что за металл был получен тогда выяснить так и не удалось. Через некоторое время, алюминий был получен немецким ученым-химиком Велером, который получил алюминий, используя нагревание безводного хлорида алюминия с металлическим калием.
Многие годы труда немецкого ученого не прошли даром. За 20 лет он сумел приготовить гранулированный металл. Он оказался похожим на серебро, но был значительно легче его. Алюминий был очень дорогим металлом, и вплоть до начала XX века, его стоимость была выше стоимости золота. Поэтому многие-многие годы алюминий использовался как музейный экспонат.
Около 1807 г. Дэви попытался провести электролиз глинозема, получил металл, который был назван алюмиумом (Alumium) или алюминумом (Aluminum), что в переводе с латинского - квасцы.
Получение алюминия из глин интересовало не только ученых-химиков, но и промышленников. Алюминий очень тяжело было отделить от других веществ, это способствовало тому, что он был дороже золота. В 1886 году химиком Ч.М. Холлом был предложен способ, который позволил получать металл в больших количествах. Проводя исследования, он в расплаве криолита AlF3•nNaF растворил оксид алюминия. Полученную смесь поместил в гранитный сосуд и пропустил через расплав постоянный электрический ток. Он был очень удивлен, когда через некоторое время на дне сосуда он обнаружил бляшки чистого алюминия. Этот способ и в настоящее время является основным для производства алюминия в промышленных масштабах. Полученный металл всем был хорош, кроме прочности, которая была необходима для промышленности. И эта проблема была решена. Немецкий химик Альфред Вильм сплавил алюминий с другими металлами: медью, марганцем и магнием. Получился сплав, который был значительно прочнее алюминия. В промышленных масштабах такой сплав был получен в немецком местечке Дюрене. Это произошло в 1911 году. Этот сплав был назван дюралюминием, в честь городка.
В промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na3AlF6 . Процесс ведут при температурах около 1000 °С в специальных электрических печах. Электролиз Al2O3 можно представить следующей условной схемой. В растворе оксид диссоциирует на ионы
Al2O3 ↔Al3++AlO3-3
На катоде разряжаются ионы Al3+: Al3++3e-=Al0
На аноде происходит процесс: 4AlO3-3 – 12e-=2Al2O3+3O2
На аноде выделяется кислород, а на катоде — жидкий алюминий. Последний собирается на дне печи, откуда его периодически и выпускают. Катодом служит корпус элекролизера, на котором выделяется жидкий алюминий. На графитовом аноде выделяется кислород, который окисляет графит до оксидов углерода. По мере сгорания анода его наращивают. Поскольку жидкий алюминий имеет более высокую плотность, чем расплав, он собирается на дне элекролизера.
Очистка алюминия от примесей трудна, поэтому необходимо, чтобы чисты были сами исходные материалы для его получения. Криолит обычно готовят искусственно путём совместного растворения Al(OН)3 и соды в плавиковой кислоте по реакции:
3 Na2CO3 + 2 Al(OH)3 + 12 HF = 2 Na3AlF6 + 3 CO2 + 9 h3O.
Природные бокситы, в состав которых входит 50-60 % Al2O3и ряд примесей (SiO2, Fe2O3 и др), подвергаются предварительной химической переработке с целью выделения из них достаточно чистого сесквиоксида алюминия (содержащей не более 0,2 % SiO2 и 0,04 % Fe2O3). Методы такой переработки сильно зависит от состава исходного боксита и довольно сложны.
Печь для выплавки алюминия состоит из железного ящика, внутренние стенки и дно которого выложены теплоизолирующим слоем из огнеупорных материалов и поверх него — толстой угольной обкладкой, служащей при электролизе катодом. В качестве анода применяется массивный угольный электрод. Процесс ведут при температуре около 960 °С, напряжении около 5 В и силе тока около 140 тыс. А. Выделяющийся кислород образует с углём анода CO и CO2. Параллельно за счёт незначительного выделения фтора получаются небольшие количества CF4. Вследствие сгорания анода его приходится постепенно опускать вниз. Боковые стенки печи (и большая часть поверхности жидкости) покрыты твёрдой коркой электролита, препятствующий их разъединению выделяющимися у анода газами и предохраняющий расплав от охлаждения. Во время работы печи в неё периодически добавляется Al2O3 (и немного криолита), а расплавленный металл удаляется.
Выплавка алюминия весьма энергоемка: тонна металла требует затраты около 10 тыс. кВт·ч электроэнергии. Первичная его очистка осуществляется продувкой хлора. Продажный металл содержит обычно 99,7 % алюминия. Наряду с другими примесями (главным образом Si и Fe) в нём имеются и следы галия.
Постоянный и все возрастающий спрос на алюминий в 1980-е годы уже не мог удовлетворить запасы бокситов. По прогнозам ученых, к середине XXI столетия бокситовый источник начнет иссякать. Необходимо срочно найти другие виды сырья. Впервые в мировой практике, столкнувшийся с этой же проблемой, именно в СССР стали получать глинозем ( окись алюминия- Al2O3) из алунита – белых или серовато-желтых квасцов ( гидросульфатов калия и алюминия, содержащих до 37 % Al2O3).
2. Высокая прочность связи Al-O-Al и плотная кристаллическая структура предопределяют высокую температуру плавления (порядка 2050°С), твердость и огнеупорность оксида алюминия. Так, корунд по твердости уступает лишь алмазу и применяется в качестве абразивного материала в виде корундовых кругов и наждака. В качестве огнеупорного материала широко используется также искусственно, получаемый, из бокситов сильно прокаленный Al2O3 , называемый алундом. Благодаря высокой твердости, искусственно получаемые монокристаллы корунда (в частности рубины) используют как опорные камни в точных механизмах. Искусственные рубины используют в качестве квантовых генераторов (лазеры).
Обычно загрязнённый оксидом железа природный корунд вследствие своей чрезвычайной твёрдости применяется для изготовления шлифовальных кругов, брусков и т. п. В мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются оксидом алюминия, получаемым сплавлением боксита (техническое название — алунд).
Чистый оксид алюминия (т. пл. 2050, т. кип. 3500 °С) непосредственно используется в производстве зубных цементов. Так, порошок одного из видов высококачественного зубного цемента получается сплавлением при 700-800 °С и последующим измельчением тщательно приготовленной смеси следующего состава: 28,4 % Al2O3,20,9-SiO2, 19,7-Na2SiF6, 19,0-CaSiF6, 3,9-CaCO3, 4,1-h4PO4, 4,0-h4AsO4. Жидкость для замешивания такого цемента представляет собой крепкий раствор Al(h3PO4)3.
Изделия из оксида алюминия обладают очень высокой механической прочностью и сохраняют её до 1800 °С. Исключительно велика и их химическая стойкость. Вместе с тем они хорошо проводят тепло и переносят температурные колебания. Напылением расплавленного оксида алюминия может быть создано эффективное защитное покрытие на металлах.
Сплавление равных по массе количеств Al2O3 и SiO2 с последующим выдуванием их расплава было получено стекловолокно (“файберфракс”), характеризующееся высокой термической устойчивостью и большой устойчивостью к химическим воздействиям. Оно не изменяет свои свойства до 1250°С, плавится лишь выше 1600°С и особенно пригодно для изготовления теплоизоляционных материалов.
На основе корунда был сконструирован сверхпрочный искусственный камень — “микролит”. Он состоит из очень мелких (порядка микронов) зёрен корунда с небольшой добавкой связывающего стеклообразного материала. Микролитовые резцы сохраняют свою чрезвычайную твёрдость до 1200 °С и допускают поэтому очень большую скорость металлообработки.
На кристалле рубина была впервые (1960 г.) реализована идея оптического квантового генератора (“лазера”) — устройства, создающего направленный пучок монохроматического (т. е. имеющего одну определенную длину волны) излучения в видимой области спектра или вблизи неё. Действие лазера (как и родственного ему “мазера”, генерирующего аналогичный пучок коротких радиоволн) основано на выделение энергии за счёт одновременно происходящего определённого снижения энергетического уровня множества одинаковых частиц.
Заключение
Область применения оксида алюминия очень широка, увлекательная история его открытия начинается еще с древних времен. Еще в древнем Риме люди стремились узнать об этом веществе, узнавая все больше и больше о его свойствах. И уже сейчас существуют новые нано-технологии, в которых оксид алюминия играет главную роль. Возможно, в будущем с помощью этого вещества, будет разработана новая техника, появится еще один, а может и несколько видов драгоценных камней, полученных так же, как и ныне существующие, искусственным путем.
Информационные источники
1. Энциклопедия. Геология.М., «Аванта+»1995,с.304,306,357.
2. Ахметов Н.С. Общая и неорганическая химия.М., «Высшая школа»1998.с.430-432.
3. Олдершоу.К. Атлас драгоценных камней.
4. Комкова Е.Г. Группа химических астероидов.М., «Просвещение» 1984.с.404,405
5.Сайт: http://schoolchemistry.by.ru Оксид Алюминия.
6.Сайт: http://www.alhimikov.net Алюминий.
www.ronl.ru
Курсовая работа - Оксиды. Кислоты. Основания. Амфотерность. Соли
.
1. Оксиды
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, Fe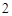 O
O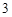
 — твердые вещества, немолекулярного строения.
— твердые вещества, немолекулярного строения.
Оксиды:
MgO – магния
NiO – никеля
SiO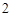 — кремния
— кремния
Fe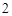 O
O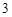
 — железа
— железа
ClO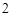 — хлора
— хлора
CO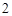 — углерода
— углерода
NO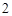 — азота
— азота
1.2. Вода
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4 градусов – 1 г/см в кубе.
градусов – 1 г/см в кубе.
При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2H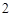 O = 2NaOH + H
O = 2NaOH + H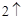
Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становится синей – это признак того, что в растворе есть щелочь.
2K + H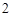 O = 2KOH + H
O = 2KOH + H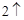
Ca + 2H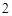 O = Ca(OH)
O = Ca(OH)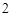 + H
+ H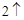
Б) с оксидами активных металлов, образуя растворимые основания – щелочи.
CaO + H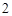 O = Ca(OH)
O = Ca(OH)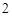
Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Б) еще примеры:
Na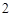 O + H
O + H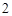 O = 2NaOH
O = 2NaOH
BaO + HO = Ba(OH)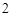
В) со многими оксидами неметаллов, образуя кислоты.
P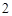 O
O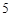 + H
+ H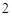 O = 2HPO
O = 2HPO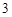
а с горячей водой:
P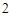 O
O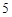 + 3H
+ 3H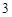 PO
PO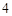 = 2H
= 2H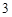 PO
PO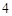
CO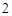 + H
+ H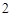 O = H
O = H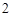 CO
CO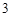
SO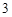 + H
+ H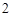 O = H
O = H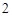 SO
SO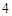
Г) вода разлагается под действие высокой температуры или электрического тока.
2H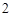 O = 2H
O = 2H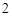
 + O
+ O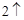
Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными.
2. Кислоты
В формулах кислот на первом месте всегда стоит водород, а дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO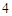 — кислотный остаток.
— кислотный остаток.
Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой:
SO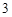 + H
+ H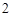 O = H
O = H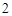 SO
SO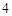
N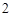 O
O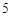 + H
+ H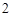 O = 2HNO
O = 2HNO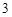
2.1. Химические свойства кислот
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl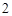 + H
+ H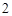

Zn + 2HCl = ZnCl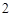 + H
+ H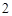

Cu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl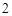 + H
+ H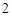 O — - — - Cu (II)
O — - — - Cu (II)
Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
2.2. Соляная кислота и хлороводород
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + H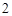 SO
SO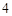 = NaHSO
= NaHSO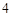 + HCl
+ HCl
2) сильное нагревание
2NaCl + H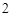 SO
SO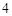 = Na
= Na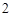 SO
SO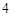 + 2HCl
+ 2HCl
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl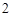 + H
+ H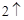
3е свойство: взаимодействует с основными оксиды:
Fe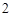 O
O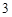 + 6HCl = 2FeCl
+ 6HCl = 2FeCl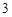 + 3H
+ 3H O
O
Примечание: HCl + AgNO = AgCl
= AgCl +HNO
+HNO
3. Основания
CaO + H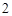 O = Ca(OH)
O = Ca(OH)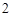
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция. Основания состоят из металла и одновалентных гидроксильных групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH)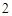 — гидроксид магния
— гидроксид магния
Ba(OH)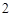 — гидроксид бария.
— гидроксид бария.
Fe(OH)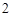 — гидроксид железа (II)
— гидроксид железа (II)
Fe(OH)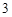 — гидроксид железа (III)
— гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)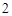 и т.п.
и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH)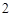 , гидроксид железа (III)
, гидроксид железа (III)
Fe(OH)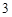 и т.п.
и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2H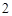 O = 2NaOH + H
O = 2NaOH + H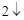
BaO + H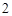 0 = Ba(OH)
0 = Ba(OH)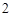
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO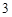 = NaNO
= NaNO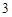 + H
+ H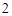 O
O
Cu(OH)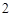 + 2HCl = CuCl
+ 2HCl = CuCl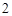 + 2H
+ 2H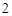 O
O
4. Амфотерные оксиды и гидроксиды
Основания реагируют с кислотами и наоборот. Всегда получается соль и вода.
Ca(OH)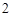 + 2HCl = CaCl
+ 2HCl = CaCl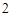 + 2H
+ 2H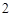 O
O
H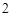 CO
CO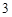 + 2NaOH = Na
+ 2NaOH = Na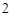 CO
CO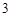 + 2H
+ 2H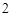 O
O
Есть такие хим. элементы, которые образуют оксиды и гидроксиды, обладающие двойственными свойствами – и основными и кислотными ( в зависимости от условий).
Это такие элементы как цинк, алюминий и др. Например:
Zn(OH)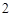 + 2HCl = ZnCl
+ 2HCl = ZnCl + 2H
+ 2H O
O
 сильная
сильная кислота
кислота
Zn(OH) + 2NaOH = Na
+ 2NaOH = Na ZnO
ZnO + 2H
+ 2H O
O
 сильное основание
сильное основание
Пример с оксидом цинка:
ZnO + 2HNO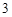 = Zn(NO
= Zn(NO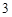 )
)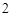 + H
+ H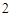 O
O
ZnO + 2KOH = K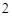 ZnO
ZnO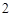 + H
+ H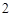 O (процесс сплавления)
O (процесс сплавления)
Способность химических соединений проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют, называется амфотерностью.
Zn(OH)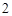 — амфотерный гидроксид
— амфотерный гидроксид
ZnO – амфотерный оксид
5. Соли
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей кислотного остатка.
Примеры солей:
NaCl — хлорид натрия
AgCl — серебра
K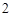 S — сульфид калия
S — сульфид калия
NaNo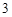 — нитрат натрия
— нитрат натрия
Mg(NO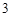 )
)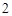 — магния
— магния
Na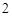 SiO
SiO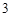 — силикат натрия
— силикат натрия
Al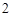 (SO
(SO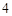 )
)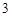 — сульфат алюминия
— сульфат алюминия
Na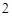 SO
SO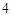 — натрия
— натрия
BaSO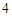 — бария
— бария
Na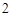 SO
SO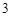 — сульфит натрия
— сульфит натрия
K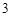 PO
PO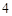 — фосфат калия
— фосфат калия
CaCO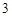 — карбонат кальция
— карбонат кальция
5.1. Химические свойства солей
Соли реагируют:
А) с металлами:
Cu + 2AgNO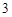 = Cu(NO
= Cu(NO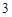 )
)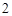 + 2Ag
+ 2Ag
Образуется новая соль и металл.
Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.
Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у.
Б) с растворимыми основаниями (щелочами):
AlCl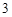 +3NaOH = Al(OH)
+3NaOH = Al(OH)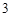
 + 3NaCl
+ 3NaCl
K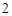 SO
SO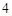 + Ba(OH)
+ Ba(OH)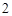 = 2KOH + BaSO
= 2KOH + BaSO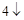
Образуется новая соль и новое основание.
Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок.
В) с кислотами:
CaCo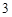 + 2HCl = CaCl
+ 2HCl = CaCl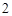 + H
+ H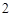 CO
CO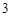
/ \
H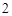 O CO
O CO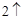
Образуется новая соль и новая кислота.
Поскольку H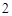 CO
CO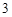 очень непрочная, она разлагается на воду и CO
очень непрочная, она разлагается на воду и CO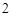 .
.
Примечание: реакция между солью и кислотой будет происходить при таких условиях:
а) когда образуется осадок, не растворимый в кислотах:
AgNO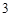 + HCl = AgCl
+ HCl = AgCl + HNO
+ HNO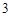
б) когда реагирующая кислота сильнее, чем та, которой образована соль:
Ca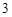 (PO
(PO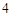 )
)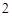 + 3H
+ 3H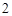 SO
SO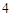 = 3CaSO
= 3CaSO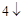 + 2H
+ 2H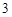 PO
PO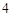
в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая:
2NaNO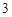 + H
+ H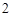 SO
SO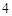 = Na
= Na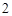 SO
SO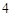 + 2HNO
+ 2HNO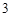
Г) с солями:
BaCl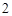 + Na
+ Na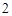 SO
SO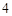 = BaSO
= BaSO + 2NaCl
+ 2NaCl
Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций:
Ответы на некоторые вопросы после параграфов:
Какие вещества называют оксидами?
Оксиды – это сложные вещества образованные двумя элементами одним из которых является кислород.
Какие вещества относятся к кислотам?
К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток.
Что называется реакцией соединения?
Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество.
Напишите уравнения химических реакций которые происходят при таких превращениях: C CO
CO
 H
H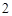 CO
CO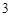
P  P
P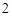 O
O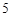
 HPO
HPO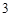
C + O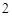 = CO
= CO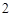
CO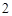 + H
+ H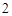 O = H
O = H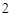 CO
CO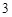
P + O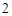 = P
= P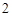 O
O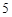
Как химическим путем отличить серебро от цинка?
Что такое хлороводород и как его получить?
Хлороводород – это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой.
Почему хлороводород на воздухе дымит?
Как доказать что выданный вам раствор кислота и это соляная кислота?
Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж – розовеет, фенолфталеин – бесцветный.
Какие вещества относятся к основаниям и как их классифицируют? Привести примеры.
К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые.
Все металлы не растворяются, а неметаллы наоборот.
Растворимые – NaOH, KOH, нерастворимые – Cu(OH)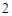 Fe(OH)
Fe(OH)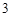 .
.
10) Что вам известно о гидроксиде натрия?
Гидроксид натрия NaOH – растворимый в воде…
11) Ca CaO
CaO Ca(OH)
Ca(OH)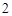
 Ca(NO
Ca(NO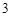 )
)
2Ca + O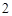 = 2CaO
= 2CaO
CaO + H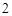 O = Ca(OH)
O = Ca(OH)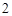
Ca(OH)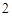 + 2HNO
+ 2HNO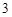 = Ca(NO
= Ca(NO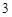 )
)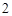 + 2H
+ 2H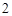 O
O
12) P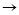 P
P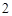 O
O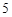
 H
H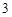 PO
PO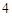
 Mg(PO
Mg(PO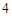 )
)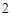
4P + 5O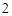 = 2P
= 2P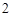 O
O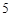

P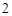 O
O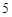 + 3H
+ 3H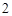 O = 2H
O = 2H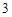 PO
PO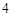
Что называется амфотерностью?
Амфотерность – это способность химических соединений
Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют.
Что такое соли?
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сформулируйте правило для составления формул солей.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка.
Ca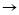 CaO
CaO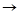 Ca(OH)
Ca(OH)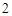
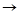 CaCl
CaCl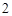
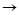 CaSO
CaSO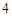
2Ca + O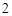 = 2CaO
= 2CaO
CaO + H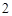 O = Ca(OH)
O = Ca(OH)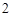
Ca(OH)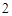 + 2HCl = CaCl
+ 2HCl = CaCl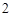 + 2H
+ 2H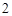 O
O
CaCl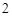 + H
+ H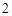 SO
SO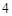 = CaSO
= CaSO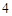 + 2HCl
+ 2HCl
Ba Ba(OH)
Ba(OH)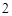
 Ba(NO
Ba(NO )
) 
 BaCO
BaCO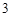
 BaCl
BaCl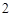
Ba + H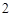 O = Ba(OH)
O = Ba(OH)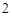
Ba(OH)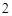 + 2HNO
+ 2HNO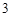 = Ba(NO
= Ba(NO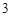 )
)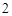 + 2H
+ 2H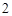 O
O
Ba(NO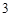 )
)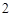 + H
+ H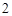 CO
CO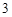 = BaCO
= BaCO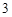 + 2HNO
+ 2HNO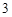
BaCO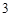 + 2HCl = BaCl
+ 2HCl = BaCl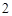 + H
+ H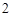 CO
CO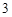
Обобщение знаний:
Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов.
Простые вещества – это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы – нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы – это растворимые в воде вещества, которые хрупкие и т.п.
Какие вещества называются сложными? На какие классы делятся неорганические вещества?
Сложные вещества – это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли.
По какому признаку оксиды делят на основные и кислотные?
Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными.
21) С чем могут взаимодействовать кислотные и основные оксиды? Что получается?
Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Короче, об этом дальше.
Что такое основания? Какие элементы их образуют?
Какие свойства для них характерны?
Основания – это сложные вещества, состоящие из металла и гидроксильных групп. Их можно получить при Взаимодействии активных металлов с водой и оксидов активных металлов с водой. Щелочи хорошо растворимы в воде.
Некоторые очень едкие. Они разъедают кожу, бумагу и другие материалы. Их называют едкими щелочами.
Какие вещества называют кислотами? Какие элементы их
Образуют? Какие свойства для них характерны?
Кислотами называют сложные вещества в состав которых входят водород и кислотный остаток. Получить кислородосодержащие кислоты можно взаимодействовать кислотных оксидов с водой. Для них характерны свойства: многие кислоты при н.у. – жидкости, но есть твердые кислоты.
Они хорошо растворяются в воде. Почти все кислоты бесцветны.
Какие вещества относятся к солям? С какими веществами могут реагировать соли?
К солям можно отнести сложные вещества, образованные атомами металлов и кислотными остатками.
Какие продукты образуются во время взаимодействия:
А) основания и кислоты
Образуются соль и вода: NaOH + HCl = NaCl + H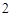 O
O
Б) основного и кислотного оксидов
Образуется тоже самое что и дано.
В) основного оксида и кислоты?
Образуется соль и вода
Na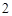 O + H
O + H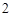 SO
SO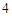 = NaSO
= NaSO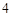 + H
+ H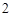 O
O
Написать уравнения реакций.
Написать уравнения реакций получения фосфата кальция четырьмя способами.
26) Написать уравнения реакций получения гидроксида калия тремя способами.
Как осуществить следующие превращения:
Натрий – Гидроксид натрия – Сульфат натрия – Хлорид натрия – Нитрат натрия
Na + H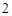 O = NaOH + H
O = NaOH + H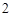
NaOH + H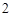 SO
SO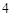 = NaSO
= NaSO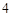 + H
+ H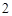 O
O
NaSO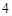 + HCl = HSO
+ HCl = HSO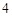
27) Что называется реакцией замещения и реакцией обмена?
Что с чем взаимодействует и что получается?
Основный оксид + кислота = соль + вода (обмен)
Оксид активных металлов + вода = щелочь (соединение)
Оксид неметаллов + вода = кислота (соединение)
Активные металлы + вода = гидроксид металлов (щелочь) + H
Кислоты + металлы = соль + H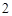
Соляная кислота + металл = соль + H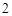
Соляная кислота + основный оксид = соль + вода (обмен)
Основания + кислота = соль + вода
Щелочи + оксид неметаллов = соль + вода
+ вода
Соль + металл (не все) = новая соль + новый металл (обмен)
Соль + щелочь = новая соль + новое основание (обмен)
Соль + кислота = новая соль + новая кислота (обмен)
Кислотные оксиды – это оксиды неметаллов – это щелочи.
www.ronl.ru
Реферат по химии «оксид алюминия»
Реферат по химии «оксид алюминия» - страница №1/1

Государственное общеобразовательное учреждение средняя общеобразовательная школа № 325
Фрунзенского района Санкт-Петербурга
РЕФЕРАТ ПО ХИМИИ
«ОКСИД АЛЮМИНИЯ»
Работу выполнила ученица 9 «А»
Ершова Мария
Научный руководитель:
Рогова Е. В.
Научный консультант:
Головко Н. В.
Санкт-Петербург
2011г.
Содержание
- Введение……………………………………………………….3
- Содержание в природе………………………………………..4
- Драгоценные камни и их образование……………………….6
- Корунд..………………………………………………….……..6
- Сапфиры………………………………………………………..7
- Рубины…………………………………………………….……8
- Физические свойства……………………………………....…..9
- Химические свойства ……………………..............................10
- Применение……………………..………………………..…..12
- Получение алюминия…………………………………….…..12
- Использование физических свойств Al2O3………………......15
- Заключение……………………………………………….…....17
- Информационные источники…………………………..……..18
Введение
Драгоценности – это символ особого статуса, они украшают короны королей, как наглядное напоминание богатства и процветания того, кто их носит, а также и тех, кто это видит.
Знахари и целители приписывают некоторым драгоценным камням магическую силу. Легенды о знаменитых камнях, о счастье и бедах, которые они принесли своим владельцам, завораживают наше воображение.
Драгоценные камни – это именно сокровища. Их уникальные свойства ценились во все времена и по всему миру. Ценятся они, и по сей день. Возможно, внимание того, кто впервые поднял драгоценный камень, привлекла его яркая окраска или кристаллическая форма, а может быть, и цвет породы, в которую он был заключен.
Разнообразие цветов корунда зачаровывает и привлекает большинство людей, в особенности дам.
Чистый корунд бесцветен. Однако корунды используют не только, как драгоценность, есть еще множество применений этого минерала. А точнее то, из чего он состоит.
Цель работы: проанализировать свойства оксида алюминия и его применение в промышленности и в быту.
Задачи:
- Проанализировать литературу по теме «Оксид алюминия»
- Изучить исторический аспект явления вещества.
- Изучить применение оксида алюминия.
- Сделать выводы данной теме.
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых! Алюминий входит в огромное число минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Всего же известно более 250 минералов, в состав которых входит алюминий; большинство из них – алюмосиликаты, из которых и образована в основном земная кора.
С оединения алюминия были известны человеку с древних времён. Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO4)2. Они находили широкое применение. Использовались в качестве протравы и как средство, останавливающее кровь. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Известен интересный исторический факт. Архелай, полководец из Рима, во время войны с персами приказал намазать башни, которые служили в качестве оборонительных сооружений, квасцами. Персам так и не удалось сжечь их.
оединения алюминия были известны человеку с древних времён. Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO4)2. Они находили широкое применение. Использовались в качестве протравы и как средство, останавливающее кровь. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Известен интересный исторический факт. Архелай, полководец из Рима, во время войны с персами приказал намазать башни, которые служили в качестве оборонительных сооружений, квасцами. Персам так и не удалось сжечь их.
При выветривании алюмосиликатов образуется глина, основу которой составляет минерал каолинит Al2O3·2SiO2·2h3O. Химический состав глин колеблется в широких пределах, и входящие в состав глин оксиды по разному влияют на процесс получения конечные свойства керамики. Оксид алюминия (глинозем – А1203) при повышенном его количестве в глине приводит к увеличению температуры обжига и интервала спекания. А изделия с низким содержанием глинозема обладают невысокой прочностью. Примеси железа обычно окрашивают глину в бурый цвет, но встречаются и белая глина – каолин, которую применяют для изготовления фарфоровых и фаянсовых изделий.
Глинозём, Аl2Оз - белое кристаллическое веществово, нерастворимое в воде, tпл =2050оС. Встречается в природе в виде минералов - корунда (бесцветный), рубина (красный), сапфира (синий). О корунде мы будем говорить в следующей главе.
Важнейший минерал алюминия – боксит, Al2O3·xh3O. Крупнейшие месторождения боксита находятся в Австралии, Бразилии, Гвинее и на Ямайке; промышленная добыча ведется и в других странах. Боксит (фр. bauxite) (по названию местности Baux на юге Франции) — алюминиевая руда, сырьё для получения глинозёма и глинозёмосодержащих огнеупоров. Содержание глинозёма в промышленных бокситах колеблется от 40 % до 60 % и выше. Используется также в качестве флюса в чёрной металлургии.
Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.
(Алунит, квасцовый камень (фр. alunite — квасцы) — минерал состава K2SO4*Al2(SO4)3*4Al(OH)3 или KAl3(SO4)2(OH)6. Цвет белый, серый.
Нефелин (элеолит) — породообразующий минерал, алюмосиликат калия и натрия ортокремниевой кислоты (Na,K)AlSiO4.)
Образование драгоценных камней
Семейство корундов, к которому принадлежит рубин и сапфир, имеет очень простую химическую формулу - Al2O3: в молекуле корунда содержится два атома алюминия и три атома кислорода.
Чистый корунд - бесцветное вещество, но в природе редко образуются идеальные драгоценные камни, и обычно корунд бывает окрашен. Хром и ванадий – это те самые акцессорные элементы, которые придают рубину характерный для него красный цвет; синий сапфир обязан своим цветом железу и титану, а зеленый, желтый и розовый сапфиры – другим сочетаниям элементов-спутников.
Корунд
Н азвание «корунд» происходит от древних названий этого минерала: от тамильского kurundam и kurund на хинди.
азвание «корунд» происходит от древних названий этого минерала: от тамильского kurundam и kurund на хинди.
Древние греки добывали корунд на острове Наксос в Эгейском море, и в наше время Наксос остается основным поставщиком абразивного наждака, используемого в промышленности в виде порошка, в быту мы встречаемся с ним в виде пилок для ногтей.
Чистый корунд бесцветен, сегодня он используется, как декоративный камень, в производстве часов, и как абразивный материал.
Месторождение корунда есть во многих странах мира.
Сапфиры
В быту слово «сапфир» ассоциируется исключительно с синими камнями. Традиционные цвета сапфиров – от бледно-голубого до глубокого синего (индиго). Сапфиры других цветов обычно называют «фантазийными апфирами», и среди них встречаются черные, фиолетовые, зеленые, темно-серые, желтые, оранжевые и белые. Сапфиры, как драгоценные камни получили признание еще в VIII веке до н.э. Правители древней Персии полагали, что небо голубое потому, что в нем отражаются сапфиры. Разными оттенками сапфиры обязаны примесям железа и титана, причем встречаются полосатые и пятнистые камни. Включения, присутствующие в сапфирах отражают свет, в результате чего возникает эффект, получивший название «шелк». Самая прозрачная и бесцветная разновидность сапфира называется лейкосапфир.
быту слово «сапфир» ассоциируется исключительно с синими камнями. Традиционные цвета сапфиров – от бледно-голубого до глубокого синего (индиго). Сапфиры других цветов обычно называют «фантазийными апфирами», и среди них встречаются черные, фиолетовые, зеленые, темно-серые, желтые, оранжевые и белые. Сапфиры, как драгоценные камни получили признание еще в VIII веке до н.э. Правители древней Персии полагали, что небо голубое потому, что в нем отражаются сапфиры. Разными оттенками сапфиры обязаны примесям железа и титана, причем встречаются полосатые и пятнистые камни. Включения, присутствующие в сапфирах отражают свет, в результате чего возникает эффект, получивший название «шелк». Самая прозрачная и бесцветная разновидность сапфира называется лейкосапфир.
 Обычно сапфиры находят в виде кристаллов, имеющих таблитчатую пирамидальную или ромбоэдрическую форму, а также форму бочонка. Для сапфиров характерно повторяющееся двойникование. Всем сапфирам присущ плеохроизм: стоит камень повернуть, как его цвет меняется.
Обычно сапфиры находят в виде кристаллов, имеющих таблитчатую пирамидальную или ромбоэдрическую форму, а также форму бочонка. Для сапфиров характерно повторяющееся двойникование. Всем сапфирам присущ плеохроизм: стоит камень повернуть, как его цвет меняется.
Звездчатыми называют такие камни, в которых несколько включений рутила, похожих на тонкие иглы, так отражают свет, что возникает мерцающая шестиконечная звезда. Этот эффект называется астеризмом.
Самые ценные сапфиры добываются в Кашмире. Эти сапфиры обладают богатым бархатным блеском.
С 1902 года стали выпускать синтетические сапфиры, полученные из расплава оксида алюминия с добавлением титана.
Сапфир-падпарадша
Падпарадша – чрезвычайно редкая разновидность сапфира нежного розовато-оранжевого цвета, что объясняется наличием небольших количеств хрома, железа и ванадия. Название происходит от сингальского padmaragaya, что значит «цвет лотоса».
Самый дорогой камень из всех сапфиров. Добывают его в Шри-Ланка.
Рубины
Р убины – чрезвычайно редкие драгоценные камни. Известны рубины разных оттенков красного цвета – от розоватого до коричневато-красного. Интенсивность красного цвета зависит от количества хрома, усиливающего цвет. Коричневатый оттенок рубина свидетельствует о присутствии в них железа. Название происходит от латинского слова ruber , что значит «красный».
убины – чрезвычайно редкие драгоценные камни. Известны рубины разных оттенков красного цвета – от розоватого до коричневато-красного. Интенсивность красного цвета зависит от количества хрома, усиливающего цвет. Коричневатый оттенок рубина свидетельствует о присутствии в них железа. Название происходит от латинского слова ruber , что значит «красный».
Рубины упоминаются еще в Библии. В Шри-Ланке их добычей занимаются более двух с половиной тысяч лет, а в Бирме с VI века.
Рубины встречаются в кристаллической известняке вместе со слюдой графитом, пирротитом и т. д.
Рубин- твердый камень, но двойниковые кристаллы ломаются довольно легко .
В 1902 году французский химик Огюст Вернейль разработал способ получения синтетических рубинов из оксида алюминия и красящего вещества.
Физические свойства
O=Al-O-Al=O
Оксид алюминия Al2O3 – белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу. Известно несколько кристаллических форм оксида алюминия, до 2044°С стабильна кристаллическая модификация α-Al2O3 – корунд.
Его кристаллическая структура представляет собой двухслойную плотнейшую шаровую упаковку из ионов кислорода, в октаэдрических пустотах которой размещены ионы алюминия, решетка ромбоэдрическая.
Химические свойства Al2O3
На воздухе алюминий покрывается тончайшей, но очень плотной плёнкой оксида, предохраняющей металл от дальнейшего окисления. В связи с этим поверхность его обычно имеет не блестящий, а матовый вид.
Образующаяся на поверхности алюминия в атмосферных условиях плёнка оксида имеет обычно толщину менее 1 нм, но очень прочно связана с металлом. Искусственно получаемые действием окислителей плёнки значительно толще. Хорошая защитная плёнка может быть получена, например, погружением алюминия в раствор, содержащий 20 % Na2SO4 и 10 % HNO3. С помощью подобранных наполнителей таким плёнкам можно придавать различную окраску.
Напротив, после контакта алюминия с раствором HgCl2 плёнка эта становится столь рыхлой, что уже не защищает металл от дальнейшего окисления. В результате он быстро обрастает “бородой” из водного оксида (Al2O3·xh3O) и постепенно окисляется нацело. Получившийся водный оксид, и сам по себе и после обезвоживания нагреванием, обладает высокой сорбционной активностью.
При нагревании стойкость оксидной плёнки значительно снижается. Особо следует отметить возможность заметной растворимости алюминия при кипячении его с разбавленными растворами некоторых органических кислот.
Лёгкость растворения алюминия в сильных щелочах обусловлена снятием с него защитной оксидной плёнки по схеме:
Al2O3 + 2КOH- + 3 h3O = 2К[Al(OH)4].
Al2O3 + 2 OH- + 3 h3O = 2 Al(OH)4-
Так как в ряду напряжений Al стоит значительнее левее водорода, обнажение чистой поверхности металла тотчас сопровождается реакциями по схемам:
2Al + 6H+·(из воды) = 2Al+3 + 3h3 и 2Al+3 + 8 OH- = 2Al(OH)4-.
Равновесие первой из них всё время смещается вправо за счёт второй. Аналогично протекает растворение в щелочах и других активных металлов, гидроксиды которых амфотерны (Sn, Zn и т. п.).
Оксид алюминия представляет собой белую очень тугоплавкую и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также получаемый искусственно и затем сильно прокаленный, отличается большой твёрдостью и нерастворимостью в кислотах.
Оксид алюминия - амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1. Реагирует с кислотами и растворами щелочей:
а. Как основной оксид:
Al2O3 + 6HCl = 2AlCl3 + 3h3O
б. Как кислотный оксид:
Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al2O3 + Na2CO3 = 2NaAlO2 (алюминат натрия) + CO2
Al2O3 + 2NaOH = 2NaAlO2 + h3O
Al2O3+2KOH = 2KAlO2 (метаалюминат K) + h3O
Сплавляя Al2O3 со щелочами, получают высокомолекулярные метааоксоалюминаты.
В алюмосиликатах алюминий играет такую же роль, как кремний: оба эти элемента образуют смешанное соединение – алюминат-силикат.
Кристаллические модификации Al2O3 химически очень стойки, не взаимодействуют с водой и кислотами. В растворимое состояние оксид (сесквиоксид) алюминия можно перевести сплавлением со щелочами или K2S2O7 по реакциям:
Al2O3 + 2 NaOH = h3O + 2 NaAlO2
Al2O3 + 3 K2S2O7 = Al2(SO4)3 + 3 K2SO4.
Применение Al2O3
1. Оксид алюминия - сырьё для получения алюминия; производится из алюминийсодержащих руд, преим. бокситов. Также алюминий получают из нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
Первые попытки получить алюминий были сделаны только в середине XIX века. Попытка, предпринятая, датским учёным Х.К.Эрстедом увенчалась успехом. Для получения он использовал амальгированный калий в качестве восстановителя алюминия из оксида. Но что за металл был получен тогда выяснить так и не удалось. Через некоторое время, алюминий был получен немецким ученым-химиком Велером, который получил алюминий, используя нагревание безводного хлорида алюминия с металлическим калием.
Многие годы труда немецкого ученого не прошли даром. За 20 лет он сумел приготовить гранулированный металл. Он оказался похожим на серебро, но был значительно легче его. Алюминий был очень дорогим металлом, и вплоть до начала XX века, его стоимость была выше стоимости золота. Поэтому многие-многие годы алюминий использовался как музейный экспонат.
Около 1807 г. Дэви попытался провести электролиз глинозема, получил металл, который был назван алюмиумом (Alumium) или алюминумом (Aluminum), что в переводе с латинского - квасцы.
Получение алюминия из глин интересовало не только ученых-химиков, но и промышленников. Алюминий очень тяжело было отделить от других веществ, это способствовало тому, что он был дороже золота. В 1886 году химиком Ч.М. Холлом был предложен способ, который позволил получать металл в больших количествах. Проводя исследования, он в расплаве криолита AlF3•nNaF растворил оксид алюминия. Полученную смесь поместил в гранитный сосуд и пропустил через расплав постоянный электрический ток. Он был очень удивлен, когда через некоторое время на дне сосуда он обнаружил бляшки чистого алюминия. Этот способ и в настоящее время является основным для производства алюминия в промышленных масштабах. Полученный металл всем был хорош, кроме прочности, которая была необходима для промышленности. И эта проблема была решена. Немецкий химик Альфред Вильм сплавил алюминий с другими металлами: медью, марганцем и магнием. Получился сплав, который был значительно прочнее алюминия. В промышленных масштабах такой сплав был получен в немецком местечке Дюрене. Это произошло в 1911 году. Этот сплав был назван дюралюминием, в честь городка.
В промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na3AlF6 . Процесс ведут при температурах около 1000 °С в специальных электрических печах. Электролиз Al2O3 можно представить следующей условной схемой. В растворе оксид диссоциирует на ионы
Al2O3 ↔Al3++AlO3-3
На катоде разряжаются ионы Al3+: Al3++3e-=Al0
На аноде происходит процесс: 4AlO3-3 – 12e-=2Al2O3+3O2
На аноде выделяется кислород, а на катоде — жидкий алюминий. Последний собирается на дне печи, откуда его периодически и выпускают. Катодом служит корпус элекролизера, на котором выделяется жидкий алюминий. На графитовом аноде выделяется кислород, который окисляет графит до оксидов углерода. По мере сгорания анода его наращивают. Поскольку жидкий алюминий имеет более высокую плотность, чем расплав, он собирается на дне элекролизера.
Очистка алюминия от примесей трудна, поэтому необходимо, чтобы чисты были сами исходные материалы для его получения. Криолит обычно готовят искусственно путём совместного растворения Al(OН)3 и соды в плавиковой кислоте по реакции:
3 Na2CO3 + 2 Al(OH)3 + 12 HF = 2 Na3AlF6 + 3 CO2 + 9 h3O.
Природные бокситы, в состав которых входит 50-60 % Al2O3 и ряд примесей (SiO2, Fe2O3 и др), подвергаются предварительной химической переработке с целью выделения из них достаточно чистого сесквиоксида алюминия (содержащей не более 0,2 % SiO2 и 0,04 % Fe2O3). Методы такой переработки сильно зависит от состава исходного боксита и довольно сложны.
Печь для выплавки алюминия состоит из железного ящика, внутренние стенки и дно которого выложены теплоизолирующим слоем из огнеупорных материалов и поверх него — толстой угольной обкладкой, служащей при электролизе катодом. В качестве анода применяется массивный угольный электрод. Процесс ведут при температуре около 960 °С, напряжении около 5 В и силе тока около 140 тыс. А. Выделяющийся кислород образует с углём анода CO и CO2. Параллельно за счёт незначительного выделения фтора получаются небольшие количества CF4. Вследствие сгорания анода его приходится постепенно опускать вниз. Боковые стенки печи (и большая часть поверхности жидкости) покрыты твёрдой коркой электролита, препятствующий их разъединению выделяющимися у анода газами и предохраняющий расплав от охлаждения. Во время работы печи в неё периодически добавляется Al2O3 (и немного криолита), а расплавленный металл удаляется.
Выплавка алюминия весьма энергоемка: тонна металла требует затраты около 10 тыс. кВт·ч электроэнергии. Первичная его очистка осуществляется продувкой хлора. Продажный металл содержит обычно 99,7 % алюминия. Наряду с другими примесями (главным образом Si и Fe) в нём имеются и следы галия. Постоянный и все возрастающий спрос на алюминий в 1980-е годы уже не мог удовлетворить запасы бокситов. По прогнозам ученых, к середине XXI столетия бокситовый источник начнет иссякать. Необходимо срочно найти другие виды сырья. Впервые в мировой практике, столкнувшийся с этой же проблемой, именно в СССР стали получать глинозем ( окись алюминия- Al2O3) из алунита – белых или серовато-желтых квасцов ( гидросульфатов калия и алюминия, содержащих до 37 % Al2O3).
2. Высокая прочность связи Al-O-Al и плотная кристаллическая структура предопределяют высокую температуру плавления (порядка 2050°С), твердость и огнеупорность оксида алюминия. Так, корунд по твердости уступает лишь алмазу и применяется в качестве абразивного материала в виде корундовых кругов и наждака. В качестве огнеупорного материала широко используется также искусственно, получаемый, из бокситов сильно прокаленный Al2O3 , называемый алундом. Благодаря высокой твердости, искусственно получаемые монокристаллы корунда (в частности рубины) используют как опорные камни в точных механизмах. Искусственные рубины используют в качестве квантовых генераторов (лазеры).
Обычно загрязнённый оксидом железа природный корунд вследствие своей чрезвычайной твёрдости применяется для изготовления шлифовальных кругов, брусков и т. п. В мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются оксидом алюминия, получаемым сплавлением боксита (техническое название — алунд).
Чистый оксид алюминия (т. пл. 2050, т. кип. 3500 °С) непосредственно используется в производстве зубных цементов. Так, порошок одного из видов высококачественного зубного цемента получается сплавлением при 700-800 °С и последующим измельчением тщательно приготовленной смеси следующего состава: 28,4 % Al2O3,20,9-SiO2, 19,7-Na2SiF6, 19,0-CaSiF6, 3,9-CaCO3, 4,1-h4PO4, 4,0-h4AsO4. Жидкость для замешивания такого цемента представляет собой крепкий раствор Al(h3PO4)3.
Изделия из оксида алюминия обладают очень высокой механической прочностью и сохраняют её до 1800 °С. Исключительно велика и их химическая стойкость. Вместе с тем они хорошо проводят тепло и переносят температурные колебания. Напылением расплавленного оксида алюминия может быть создано эффективное защитное покрытие на металлах.
Сплавление равных по массе количеств Al2O3 и SiO2 с последующим выдуванием их расплава было получено стекловолокно (“файберфракс”), характеризующееся высокой термической устойчивостью и большой устойчивостью к химическим воздействиям. Оно не изменяет свои свойства до 1250°С, плавится лишь выше 1600°С и особенно пригодно для изготовления теплоизоляционных материалов.
На основе корунда был сконструирован сверхпрочный искусственный камень — “микролит”. Он состоит из очень мелких (порядка микронов) зёрен корунда с небольшой добавкой связывающего стеклообразного материала. Микролитовые резцы сохраняют свою чрезвычайную твёрдость до 1200 °С и допускают поэтому очень большую скорость металлообработки.
На кристалле рубина была впервые (1960 г.) реализована идея оптического квантового генератора (“лазера”) — устройства, создающего направленный пучок монохроматического (т. е. имеющего одну определенную длину волны) излучения в видимой области спектра или вблизи неё. Действие лазера (как и родственного ему “мазера”, генерирующего аналогичный пучок коротких радиоволн) основано на выделение энергии за счёт одновременно происходящего определённого снижения энергетического уровня множества одинаковых частиц.
Заключение
Область применения оксида алюминия очень широка, увлекательная история его открытия начинается еще с древних времен. Еще в древнем Риме люди стремились узнать об этом веществе, узнавая все больше и больше о его свойствах. И уже сейчас существуют новые нано-технологии, в которых оксид алюминия играет главную роль. Возможно, в будущем с помощью этого вещества, будет разработана новая техника, появится еще один, а может и несколько видов драгоценных камней, полученных так же, как и ныне существующие, искусственным путем.
Информационные источники
1. Энциклопедия. Геология.М., «Аванта+»1995,с.304,306,357.
2. Ахметов Н.С. Общая и неорганическая химия.М., «Высшая школа»1998.с.430-432.
3. Олдершоу.К. Атлас драгоценных камней.
4. Комкова Е.Г. Группа химических астероидов.М., «Просвещение» 1984.с.404,405
5.Сайт: http://schoolchemistry.by.ru Оксид Алюминия.
6.Сайт: http://www.alhimikov.net Алюминий.
korshu.ru
Читать реферат по химии: "Оксиды. Кислоты. Основания. Амфотерность. Соли"
 (Назад)
(Назад) (Cкачать работу)
(Cкачать работу)
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Оксиды. Кислоты. Основания. Амфотерность. Соли.
1. Оксиды
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, FeO- твердые вещества, немолекулярного строения.
Оксиды:
MgO – магния
NiO – никеля
SiO - кремния
FeO- железа
ClO - хлора
CO - углерода
NO - азота
1.2. Вода
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4градусов – 1 г/см в кубе.
При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2HO = 2NaOH + H
Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становится синей – это признак того, что в растворе есть щелочь.
2K + HO = 2KOH + H
Ca + 2HO = Ca(OH) + H
Б) с оксидами активных металлов, образуя растворимые основания – щелочи.
CaO + HO = Ca(OH)
Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Б) еще примеры:
NaO + HO = 2NaOH
BaO + HO = Ba(OH)
В) со многими оксидами неметаллов, образуя кислоты.
PO + HO = 2HPO
а с горячей водой:
PO + 3HPO = 2HPO
CO + HO = HCO
SO + HO = HSO
Г) вода разлагается под действие высокой температуры или электрического тока.
2HO = 2H + O
Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными.
2. Кислоты
В формулах кислот на первом месте всегда стоит водород, а дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO - кислотный остаток.
Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой:
SO + HO = HSO
NO + HO = 2HNO
2.1. Химические свойства кислот
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl + H
Zn + 2HCl = ZnCl + H
Cu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl + HO - - - - Cu (II)
Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
2.2. Соляная кислота и хлороводород
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + HSO = NaHSO + HCl
2) сильное нагревание
2NaCl + HSO = NaSO + 2HCl
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl + H
3е свойство: взаимодействует с основными оксиды:
FeO + 6HCl = 2FeCl + 3HO
Примечание: HCl + AgNO = AgCl +HNO
3. Основания
CaO + HO = Ca(OH)
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция. Основания состоят из металла и одновалентных гидроксильных групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH) - гидроксид магния
Ba(OH) - гидроксид бария.
Fe(OH) - гидроксид железа (II)
Fe(OH) - гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH) и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH), гидроксид железа (III)
Fe(OH) и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2HO = 2NaOH + H
BaO + H0 = Ba(OH)
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO = NaNO + HO
Cu(OH) + 2HCl = CuCl + 2HO
4. Амфотерные оксиды и гидроксиды
Основания реагируют с кислотами и наоборот. Всегда получается соль и вода.
Ca(OH) + 2HCl = CaCl + 2HO
HCO + 2NaOH = NaCO + 2HO
Есть такие хим. элементы, которые образуют оксиды и гидроксиды, обладающие двойственными свойствами – и основными и кислотными ( в зависимости от условий).
Это такие элементы как цинк, алюминий и др. Например:
Zn(OH) + 2HCl = ZnCl + 2HO
сильнаякислота
Zn(OH) + 2NaOH = NaZnO + 2HO
сильное основание
Пример с оксидом цинка:
ZnO + 2HNO = Zn(NO) + HO
ZnO + 2KOH = KZnO + HO (процесс сплавления)
Способность химических соединений проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют, называется амфотерностью.
Zn(OH) - амфотерный гидроксид
ZnO – амфотерный оксид
5. Соли
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей кислотного остатка.
Примеры солей:
NaCl - хлорид натрия
AgCl - серебра
KS - сульфид калия
NaNo - нитрат натрия
Mg(NO) - магния
NaSiO - силикат натрия
Al(SO) - сульфат алюминия
NaSO - натрия
BaSO - бария
NaSO - сульфит натрия
KPO - фосфат калия
CaCO - карбонат кальция
5.1. Химические свойства солей
Соли реагируют:
А) с металлами:
Cu + 2AgNO = Cu(NO) + 2Ag
Образуется новая соль и металл.
Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.
Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у.
Б) с растворимыми основаниями (щелочами):
AlCl +3NaOH = Al(OH) + 3NaCl
KSO + Ba(OH) = 2KOH + BaSO
Образуется новая соль и новое основание.
Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок.
В) с кислотами:
CaCo + 2HCl = CaCl + HCO
/ \
HO CO
Образуется новая соль и новая кислота.
Поскольку HCO очень непрочная, она разлагается на воду и CO.
Примечание: реакция между солью и кислотой будет происходить при таких условиях:
а) когда образуется осадок, не растворимый в кислотах:
AgNO + HCl = AgCl + HNO
б) когда реагирующая кислота сильнее, чем та, которой образована соль:
Ca(PO) + 3HSO = 3CaSO + 2HPO
в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая:
2NaNO + HSO = NaSO + 2HNO
Г) с солями:
BaCl + NaSO = BaSO + 2NaCl
Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций:
Ответы на некоторые вопросы после параграфов:
Какие вещества называют оксидами?
Оксиды – это сложные вещества образованные двумя элементами одним из которых является кислород.
Какие вещества относятся к кислотам?
К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток.
Что называется реакцией соединения?
Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество.
Напишите уравнения химических реакций которые происходят при таких превращениях: C CO HCO
PPOHPO
C + O = CO
CO + HO = HCO
P + O = PO
Как химическим путем отличить серебро от
referat.co
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


