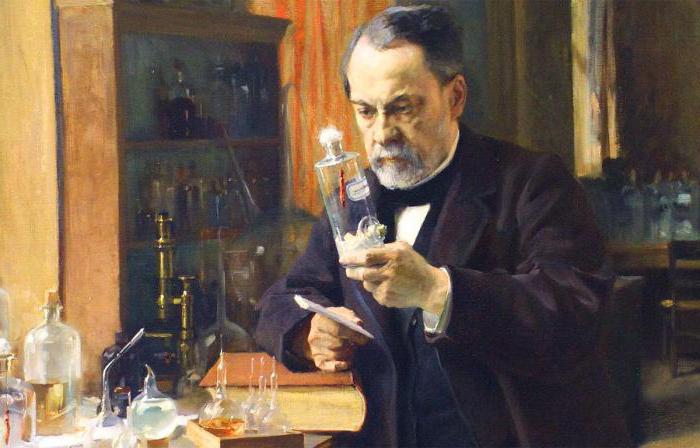Главная »
Реферат »
Лауреат нобелевской премии по биологии луи пастер реферат
Реферат по истории медицины. Врачилауреаты Нобелевской премии. Лауреат нобелевской премии по биологии луи пастер реферат
Реферат по истории медицины - Врачилауреаты Нобелевской премии
ПЕТРОЗАВОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Тема: « Врачи-лауреаты Нобелевской премии» Выполнила: студентка 3 курса медицинского факультета Гр. 302 Самадова Наталья Проверил: Глазков И.В. Петрозаводск 2012 Содержание 1. История – стр.3 2. Нобелевская премия по медицине и физиологии – стр.4 3. Статистика – стр. 4 4. Эмиль Адольф он Беринг – стр.4 5. Алексис Каррель- стр.5 6. Карл Ландштейнер – стр.6 7. Герти Тереза Кори – стр.7 8. Ральф Стайнман – стр.7 9. Последние Нобелевские лауреаты – стр.8 10. Русские врачи – лауреаты – стр. 8 Павлов И.П. – стр. 8 Мечников И.И. – стр. 10 11. Список литературы – стр.14 - История
Альфред Нобель родился в Стокгольме 21 октября 1833 года в семье Эммануила (Иммануэля) (1801—1872) и Андриетты Нобель. Он был третьим сыном, всего в семье было восемь детей, но выжили, помимо Альфреда, лишь Роберт, Людвиг и Эмиль.Ранней осенью 1842 года семья Нобеля переехала в Санкт-Петербург, где Эммануил начал работу по разработке торпед. В 1849 году, после семи лет пребывания семьи Нобелей в Петербурге, отец по рекомендации русского химика Николая Николаевича Зинина отправил сына на обучение в Европу и Америку. Весной следующего года шестнадцатилетний Альфред Нобель выехал из Петербурга. Он посетил Данию, Германию, Италию, Францию и затем Америку. Заграничная поездка заняла около двух лет. Вернувшись в Россию, Нобель занялся ведением дел семейных фабрик, исполнявших военные заказы для русской армии. Дальнейшему процветанию компании Нобеля способствовала начавшаяся в 1853 году Крымская война. В 1859 году этим стал заниматься второй сын Эммануила Нобеля — Людвиг Эммануэль Нобель (1831—1888). Альфред, вынужденный вернуться в Швецию с отцом после банкротства семейного дела, посвятил себя изучению взрывчатых веществ, особенно безопасному производству и использованию нитроглицерина, открытого в 1846 году Асканио Собреро. В 1868 году Нобель получил патент на динамит — смесь нитроглицерина со способными впитывать его веществами. Рекламируя своё открытие, он проводил публичные демонстрации нового взрывчатого вещества и читал лекции о том, как оно работает. В результате к изобретению Нобеля начали проявлять интерес всё больше и больше людей. На заводе, принадлежащем семье Нобеля, произошло несколько взрывов, в одном из которых в 1864 году погиб младший брат Нобеля Эмиль и ещё несколько рабочих. От производства динамита, других взрывчатых веществ и от разработок нефтяных полей Баку (Товарищество «Бранобель»), в которых он и его братья Людвиг и Роберт играли весомую роль, Альфред Нобель накопил значительное состояние. Деятельность Альфреда Нобеля в качестве драматурга — один из малоизвестных фактов его биографии. Его единственная пьеса, «Немезида», 4-актная трагедия в прозе о Беатрисе Ченчи, была написана, когда он был при смерти. Весь тираж, изданный в Париже в 1896 году, кроме трёх экземпляров, был уничтожен сразу после его смерти, так как пьеса была сочтена церковью скандальной и богохульной. Первое уцелевшее издание (двуязычное, на шведском и эсперанто) было опубликовано в Швеции в 2003, а в 2005 году в Стокгольме в день смерти учёного состоялась премьера спектакля. В 1888 году по ошибке репортёров в газете опубликовали сообщение о смерти Нобеля. Это оказало на Альфреда серьёзное влияние. Когда о нём стали писать «миллионер на крови», «торговец взрывчатой смертью», «динамитный король», он решил сделать так, чтобы не остаться в памяти человечества «злодеем мирового масштаба».В 1889 году он присутствовал на Всемирном конгрессе мира. 10 декабря 1896 года Альфред Нобель умер на своей вилле в Сан-Ремо, Италия, от кровоизлияния в мозг. Ему было 63 года. Похоронен на кладбище Норра бегравнингсплатсен в Стокгольме. - Нобелевская премия по медицине и физиологии
Нобелевская премия по физиологии или медицине - престижная награда за научные достижения в области физиологии и медицины, ежегодно вручаемая Нобелевским фондом в Стокгольме. Одна из пяти Нобелевских премий.Награждение: Лауреатов премии по физиологии или медицине обычно объявляют в начале октября. Церемония вручения премии проходит в Стокгольме 10 декабря, в день смерти Альфреда Нобеля. Как и лауреатам других Нобелевских премий, лауреатам премии по физиологии или медицине вручают диплом и медаль, а также денежное вознаграждение. Медаль для лауреатов в области физиологии или медицины отличается реверсом — на нём изображена женщина с раскрытой книгой на коленях, олицетворяющая гений медицины, которая собирает воду, льющуюся из камня, чтобы утолить жажду больной девочки, стоящей рядом с ней. Нобелевская премия по физиологии или медицине вручается ежегодно с 1901 года, кроме 1915, 1916, 1917, 1918, 1921, 1925, 1940, 1941 и 1942[3]. Первым лауреатом стал Эмиль Адольф фон Беринг. С тех пор 201 учёный получил премию. - Статистика
Первой женщиной-лауреатом премии стала Герти Кори в 1947 году; с тех пор Нобелевской премии по физиологии и медицине были удостоены ещё 9 женщин:Барбара Мак-Клинток, Рита Леви-Монтальчини, Гертруда Элайон, Кристиана Нюсляйн-Фольхард, Линда Бак, Франсуаза Барре-Синусси, Элизабет Блэкбёрн, Кэрол Грейдер, Самым молодым на момент вручения премии лауреатом стал Фредерик Бантинг, удостоенный её в 1923 году в возрасте 32 лет. Самым пожилым был лауреат 1966 года Фрэнсис Роус, которому на момент получения исполнилось 87 лет. - Эмиль Адольф фон Беринг:
За работу по сывороточной терапии, главным образом за её применение при лечении дифтерии, что открыло новые пути в медицинской науке и дало в руки врачей победоносное оружие против болезни и смерти.–1901г.Эмиль Беринг родился в Хансдорфе (ныне Польша) в многодетной семье прусского учителя Августа Георга Беринга. Отец Эмиля надеялся, что мальчик выберет одну из традиционных для семьи профессий — преподавание или теологию. Для того, чтобы получить среднее образование, Эмилю пришлось покинуть отчий дом в раннем детстве: уже в одиннадцать лет он стал гимназистом в Хохенштейне (Восточная Пруссия).У Беринга рано проявился интерес к медицине. Однако, понимая, что финансовое положение семьи не позволяет ему учиться в высшем медицинском учебном заведении, он по настоянию своего отца поступил в Кёнигсбергский университет на факультет теологии. Но вскоре счастливый случай вмешался в его жизнь и изменил все планы. Один из гимназических учителей Эмиля подсказал ему, что в Военно-медицинском институте в Берлине он был бы освобожден от платы за учёбу. Занятия будущих военных хирургов были бесплатными, но после окончания учёбы они обязаны были отслужить десять лет в прусской армии. Беринг согласился принять такие требования, и с 1874 года он стал кадетом этого института. Беринг получил диплом врача в 1880 году. В том же году он прошёл стажировку в берлинской больнице Шарите, а затем получил распределение в кавалерийский полк в Позене (ныне Познань, Польша.) Последующая декада жизни Беринга протекала в армии. До начала XX века дифтерия ежегодно уносила тысячи детских жизней, а медицина была бессильна облегчить их страдания и спасти от тяжелой агонии. В рождественскую ночь 1891 года умирающие от дифтерии берлинские дети получили первые уколы новой сыворотки Беринга. Многие из них были спасены, но все же успех был лишь частичным, и сыворотка Беринга не стала надежным средством, спасавшим всех детей. В 1894 году усовершенствованная сыворотка была успешно опробована на 220 больных детях. - Але́ксис Карре́ль (28 июня 1873, Сент-Фуа-ле-Лион — 5 ноября 1944, Париж) :
французский хирург, биолог, патофизиолог и евгенист, лауреат Нобелевской премии по физиологии и медицине в 1912 году.Окончил медицинский факультет Лионского университета, в 1900 году получил степень доктора медицины. С 1900 по 1902 год преподавал в университете анатомию. Будучи под впечатлением от смерти президента Франции Мари Франсуа Карно, который умер 24 июня 1894 года после нападения террориста от кровотечения при повреждении артерии, Каррель с 1902 года начал заниматься разработкой методов сшивания кровеносных сосудов. В 1904 году Каррель уехал в Канаду, затем в США, где стал ассистентом Физиологического института при Чикагском университете. В 1906 году по приглашению Симона Флекснера Каррель стал членом совета Рокфеллеровского института (впоследствии Рокфеллеровского университета). В 1938 году Каррель уволился из Рокфеллеровского института, получив звание заслуженного профессора. Вскоре после начала Второй мировой войны и оккупацией немцами части территории Франции вернулся в Париж и при поддержке правительства Виши основал «Институт по изучению проблем человека». Во время немецкой оккупации Франции Каррель активно сотрудничал с нацистами. В 1932 году Каррель опубликовал книгу «Человек — это неизвестное», в которой утверждал, что люди биологически неравны, постулировал умственную и физиологическую отсталость пролетариата и доказывал, что она передаётся по наследству. Каррель утверждал, что прогресс предупредительной медицины подавляет естественный отбор. Во время немецкой оккупации Франции Каррель активно сотрудничал с нацистами. - Карл Ла́ндштейнер (нем. Karl Landsteiner; 14 июня 1868, Вена — 26 июня 1943, Нью-Йорк)
австрийский врач, химик, иммунолог, инфекционист. Первый исследователь в области иммуногематологии и иммунохимии, автор трудов по молекулярной и клеточной физиологии реакции организма на размытые антигены и возникающие при этом специфические и неспецифические явления. Лауреат Нобелевской премии по физиологии и медицине (1930). Лауреат премии Альберта Ласкера в области клинических медицинских исследований (1946) — посмертно.Родился 14 июня 1868 года в Вене. Отец, Леопольд Ландштейнер, видный журналист, доктор права, издатель газеты, умер, когда мальчику было 6 лет. Карла воспитала мать, Фанни Хесс, к которой он был очень привязан. В молодости принял католичество. В 1891 году окончил медицинский факультет Венского университета. Затем работал в университете патологом. В 1891—1896 годах заинтересовался химией, которую изучал в течение 5 лет, практикуясь в Вюрцбурге, Мюнхене и Цюрихе. В 1896 году вернулся в Вену, устроился ассистентом в Венский институт гигиены. В этом же году он установил, что лабораторные культуры бактерий могут быть агглютинированы путем добавления иммунной сыворотки крови. С 1898 года работал на кафедре патологической анатомии Венского университета. Наставниками его были профессор А. Вейхсельбаум, установивший бактериальную природу менингита, и А. Френкель, открывший пневмококков (диплококк Френкеля). В это время он увлекся иммунологией. В 1900 году Ландштейнер, тогда ассистент Венского института патологии, взял кровь у себя и пяти своих сотрудников, отделил сыворотку от эритроцитов помощью центрифуги и смешал отдельные образцы эритроцитов с сывороткой крови разных лиц и с собственной. В совместной работе с Л. Янским по наличию или отсутствию агглютинации Ландштейнер разделил все образцы крови на три группы: А, В и 0. Два года спустя ученики Ландштейнера, А. Штурли и А. Декастелло, открыли четвертую группу крови — АВ. Обратив внимание на то, что собственная сыворотка крови не дает агглютинации со «своими» эритроцитами, ученый сделал вывод, известный сегодня как непреложное правило Ландштейнера: «В организме человека антиген группы крови (агглютиноген) и антитела к нему (агглютинины) никогда не сосуществуют». За свои открытия Ландштейнер получил в 1930 году Нобелевскую премию. В 1916 году женился на Хелен Власто. В 1917 году у них родился сын Эрнст. Во время первой мировой войны эмигрировал в Голландию. В 1922 году получил приглашение возглавить лабораторию в центре медицинских исследований Рокфеллеровского института (Нью-Йорк). 24 июня 1943 года у Ландштейнера в лаборатории за рабочим столом начался тяжелый приступ стенокардии. Его госпитализировали в клинику Рокфеллеровского института. Двумя днями позже (26 июня) он скончался. В мае 2005 года, в ходе 58-й сессии Всемирной ассамблеи здравоохранения, в Женеве было принято решение 14 июня (день рождения Карла Ландштейнера), ежегодно проводить Всемирный день донора крови (Резолюция WHA58.13) - Ге́рти Тере́за Ко́ри, урождённая Ра́дниц (Ге́рти Тере́за Ра́дниц-Ко́ри, 15 августа, 1896, Прага, Австро-Венгрия (ныне Чехия) — 26 октября, 1957)
американский биохимик, лауреат Нобелевской премии по физиологии и медицине в 1947 году (совместно с мужем Карлом Кори) «за открытие каталитического превращения гликогена».Они разделили премию поровну с аргентинским физиологом Бернардо Усаем, открывшим роли гормонов передней доли гипофиза в метаболизме глюкозы.- Ральф Стайнман
родился вторым из четверых детей в семье Ирвинга Стайнмана (ум. 1995) и Нетти Тейкефман (род. 1917) в Монреале. Его родители происходили из семей еврейских иммигрантов из Седы и Острополя. Вскоре семья перебралась в Шербрук (провинция Квебек), где его отец открыл галантерейный магазин «Mozart’s».[1][11] Учился в средней школе там же, в 1963 году окончил Университет Макгилла, а в 1968 году в Медицинскую школу Гарвардского университета (англ.)русск. получил степень доктора медицины. После прохождения интернатуры в Массачусетской больнице общего профиля . в 1970 году он устроился постдоком в лабораторию физиологии клетки и иммунологии Рокфеллеровского университета. В 1972 году Стейнман получил должность старшего преподавателя, в 1976 году — адъюнкт-профессора, а в 1988 году — профессора. В 1998 году Стейнман был назначен директором Центра по исследованию иммунологии и иммунопатологии имени Кристофера Брауна.В 1973 году, работая в лаборатории Занвила Кона, Ральф Стайнман впервые описал дендритные клетки и собственно ввёл в научный обиход сам этот термин. 30 сентября 2011 года за несколько часов до принятия нобелевским комитетом решения о присуждении премии. Ральф Стайнман скончался от рака поджелудочной железы в возрасте 68 лет. Несмотря на принцип прижизненного присуждения нобелевских премий, Ральфу Стайнману премия была присуждена посмертно «за открытие дендритных клеток и их роли в адаптивном иммунитете» - Последние Нобелевские лауреаты
Джон Гёрдон и Синъя Яманака - За работы в области биологии развития и получения индуцированных стволовых клеток. – 2012 г.- Русские врачи – лауреаты
Иван Петрович Павлов: За труды по физиологии пищеварения, расширившие и изменившие понимание жизненно важных аспектов этого вопроса. 1904 г.Иван Петрович родился 14 (26) сентября 1849 года в городе Рязани. Предки Павлова по отцовской и материнской линиям были служителями церкви. Отец Пётр Дмитриевич Павлов (1823—1899), мать — Варвара Ивановна (урождённая Успенская) (1826—1890). Окончив в 1864 году рязанское духовное училище, Павлов поступает в рязанскую духовную семинарию, о которой впоследствии вспоминал с большой теплотой. На последнем курсе семинарии он прочитал небольшую книгу «Рефлексы головного мозга» профессора И. М. Сеченова, которая перевернула всю его жизнь. В 1870 году поступил на юридический факультет (семинаристы были ограничены в выборе университетских специальностей), но через 17 дней после поступления перешёл на естественное отделение физико-математического факультета Петербургского университета (специализировался по физиологии животных у И. Ф. Циона и Ф. В. Овсянникова). Павлов, как последователь Сеченова, много занимался нервной регуляцией. Сеченову из-за интриг пришлось переехать из Петербурга в Одессу, где он некоторое время работал в университете. Его кафедру в Медико-хирургической академии занял Илья Фаддеевич Цион, и Павлов перенял у Циона виртуозную оперативную технику. Павлов более 10 лет посвятил тому, чтобы получить фистулу (отверстие) желудочно-кишечного тракта. Сделать такую операцию было чрезвычайно трудно, так как изливавшийся из кишечника сок переваривал кишечник и брюшную стенку. И. П. Павлов так сшивал кожу и слизистую, вставлял металлические трубки и закрывал их пробками, что никаких эрозий не было, и он мог получать чистый пищеварительный сок на протяжении всего желудочно-кишечного тракта — от слюнной железы до толстого кишечника, что и было сделано им на сотнях экспериментальных животных. Проводил опыты с мнимым кормлением (перерезание пищевода так, чтобы пища не попадала в желудок), таким образом сделав ряд открытий в области рефлексов выделения желудочного сока. За 10 лет Павлов, по существу, заново создал современную физиологию пищеварения. В 1903 году 54-летний Павлов сделал доклад на XIV Международном медицинском конгрессе в Мадриде. И в следующем, 1904 году, Нобелевская премия за исследование функций главных пищеварительных желез была вручена И. П. Павлову, — он стал первым российским Нобелевским лауреатом. В Мадридском докладе, сделанном на русском языке, И. П. Павлов впервые сформулировал принципы физиологии высшей нервной деятельности, которой он и посвятил последующие 35 лет своей жизни. Такие понятия как подкрепление (reinforcement), безусловный и условный рефлексы (не совсем удачно переведённые на английский язык как unconditioned and conditioned reflexes, вместо conditional) стали основными понятиями науки о поведении, см. также classical conditioning (англ.). Существует устойчивое мнение, что в период разрухи (1919—1920 годы), Павлов, терпя нищету, отсутствие финансирования научных исследований, отказался от приглашения Шведской Академии наук переехать в Швецию, где ему обещали создать самые благоприятные условия для жизни и научных исследований, причём в окрестностях Стокгольма планировалось построить по желанию Павлова такой институт, какой он захочет. Павлов ответил, что из России он никуда не уедет. Это опроверг историк В. Д. Есаков, который нашёл и обнародовал переписку Павлова с властями, где он описывает то, как он отчаянно борется за существование в голодном Петрограде 1920 года. Он крайне негативно оценивает развитие ситуации в новой России и просит отпустить его и его сотрудников за рубеж. В ответ советское правительство пытается предпринять меры, которые должны изменить ситуацию, но они не являются полностью успешными. Затем последовало соответствующее постановление Советского правительства, и Павлову построили великолепный институт в Колтушах, под Ленинградом, где он и проработал до 1936 года и воспитал целую плеяду выдающихся учёных: Б. П. Бабкин, А. И. Смирнов, В. Н. Болдырев, Л. А. Орбели, И. О. Нарбутович и др. Академик Павлов умер в 1936 году. В качестве причины смерти указывается пневмония или яд. Отпевание по православному обряду, согласно его завещанию, было совершено в церкви в Колтушах, после чего в Таврическом дворце состоялась церемония прощания. У гроба был установлен почётный караул из научных работников ВУЗов, ВТУЗов, научных институтов, членов пленума Академии и других. Сын И. П. Павлова по специальности был физиком, преподавал на физическом факультете Ленниградского государственного университета. Брат Павлова — Дмитрий Петрович Павлов преподавал в Новоалександрийском институте сельского хозяйства и лесоводства. Илья Ильич Мечников и Пауль Эрлих – « за труды по иммунитету» 1906 г Русский эмбриолог, бактериолог и иммунолог Илья Ильич Мечников родился в 1845 году в деревне Ивановке, расположенной на Украине, неподалеку от Харькова. Его отец Илья Иванович, офицер войск царской охраны в Санкт-Петербурге, до переезда в украинское поместье проиграл в карты большую часть приданого своей жены и имущества семьи. Мать Мечникова, в девичестве Эмилия Невахович, была дочерью Льва Неваховича, богатого еврейского писателя. Она всемерно способствовала тому, чтобы Илья - последний из пяти ее детей и четвертый по счету сын - выбрал карьеру ученого. Любознательный мальчик с ярко выраженным интересом к истории естествознания, Мечников блестяще учился в Харьковском лицее. Статья с критикой учебника по геологии, которую он написал в 16 лет, была опубликована в московском журнале. В 1862 году, окончив среднюю школу с золотой медалью, он решает изучать структуру клетки в Вюрцбургском университете. Поддавшись настроению, он отправляется в Германию, даже не узнав, что занятия начнутся лишь через 6 недель. Оказавшись один в чужом городе без знания немецкого языка, Мечников решает вернуться в Харьковский университет. С собой он привозит русский перевод книги Чарлза Дарвина "Происхождение видов путем естественного отбора" ("On the Origin of Species by Means of Natural Selection"), опубликованный тремя годами ранее. Прочитав книгу, Мечников стал убежденным сторонником дарвиновской теории эволюции. В Харькове Илья Мечников закончил университетский четырехгодичный курс естественного отделения физико-математического факультета за два года. Уже знакомый с особенностями строения представителей низших отрядов животного мира (червей, губок и других простых беспозвоночных), Мечников осознал, что в соответствии с теорией Дарвина у более высокоорганизованных животных должны обнаруживаться в строении черты сходства с низкоорганизованными, от которых они произошли. В то время эмбриология позвоночных была развита намного лучше, чем эмбриология беспозвоночных. В течение следующих трех лет Мечников занимался изучением эмбриологии беспозвоночных в различных частях Европы: вначале на острове Гельголанд в Северном море, затем в лаборатории Рудольфа Лейкарта в Гисене возле Франкфурта и, наконец, в Неаполе, где он сотрудничал с молодым русским зоологом Александром Ковалевским. Работа, в которой они показали, что зародышевые листки многоклеточных животных являются, по существу, гомологичными (демонстрирующими структурное соответствие), как и должно быть у форм, связанных общим происхождением, принесла им премию Карла Эрнста фон Баэра. Мечников к этому времени исполнилось всего 22 года. Тогда же из-за чрезмерного перенапряжения у него стали болеть глаза. Это недомогание беспокоило его в течение следующих 15 лет и препятствовало работе с микроскопом.В 1867 году, защитив диссертацию об эмбриональном развитии рыб и ракообразных, Мечников получил докторскую степень Санкт-Петербургского университета, где затем преподавал зоологию и сравнительную анатомию в течение последующих шести лет. В составе антропологической экспедиции он поехал к Каспийскому морю, в район проживания калмыков, для проведения антропометрических измерений, характеризующих калмыков как представителей монголоидной расы. По возвращении Мечников был избран доцентом Новороссийского университета в Одессе. Расположенная на берегу Черного моря, Одесса была идеальным местом для изучения морских животных. Мечников пользовался любовью студентов, однако растущие социальные и политические беспорядки в России угнетали его. Вслед за убийством царя Александра II в 1881 году реакционные действия правительства усилились, и Мечников, подав в отставку, переехал в Мессину (Италия). "В Мессине, - вспоминал он позднее, - совершился перелом в моей научной жизни. До того зоолог, я сразу сделался патологом". Открытие, круто изменившее ход его жизни, было связано с наблюдениями за личинками морской звезды. Наблюдая за этими прозрачными животными, Мечников заметил, как подвижные клетки окружают и поглощают чужеродные тела, подобно тому как это происходит при воспалительной реакции у людей. Если чужеродное тело было достаточно мало, блуждающие клетки, которые он назвал фагоцитами от греческого phagein ("есть"), могли полностью поглотить пришельца. Илья Мечников был не первым ученым, наблюдавшим, что лейкоциты у животных пожирают вторгшиеся организмы, включая бактерии. В то же время считалось, что процесс поглощения служит главным образом для распространения чужеродного вещества по всему телу через кровеносную систему. Мечников придерживался иного объяснения, т.к. смотрел на происходящее глазами эмбриолога. У личинок морских звезд подвижные фагоциты не только окружают и поглощают вторгшийся объект, но также резорбируют и уничтожают другие ткани, в которых организм более не нуждается. Лейкоциты человека и подвижные фагоциты морской звезды эмбриологически гомологичны, т.к. происходят из мезодермы. Отсюда Мечников сделал вывод, что лейкоциты, подобно фагоцитам, в действительности выполняют защитную или санитарную функцию. Далее он продемонстрировал деятельность фагоцитов у прозрачных водяных блох. "Согласно этой гипотезе, - писал впоследствии Мечников, - болезнь должна рассматриваться как борьба между патогенными агентами - поступившими извне микробами - и фагоцитами самого организма. Излечение будет означать победу фагоцитов, а воспалительная реакция будет признаком их действия, достаточного для предотвращения атаки микробов". Однако идеи Мечникова в течение ряда лет не воспринимались научной общественностью. В 1886 году Мечников вернулся в Одессу, чтобы возглавить вновь организованный Бактериологический институт, где он изучал действие фагоцитов собаки, кролика и обезьяны на микробы, вызывающие рожистое воспаление и возвратный тиф. Его сотрудники работали также над вакцинами против холеры кур и сибирской язвы овец. Преследуемый жаждущими сенсаций газетчиками и местными врачами, упрекавшими Мечникова в отсутствии у него медицинского образования, он вторично покидает Россию в 1887 году. Встреча с Луи Пастером в Париже привела к тому, что великий французский ученый предложил Мечникову заведовать новой лабораторией в Пастеровском институте. Мечников работал там в течение следующих 28 лет, продолжая исследования фагоцитов. Драматические картины сражений фагоцитов, которые рисовал Мечников в своих научных отчетах, были встречены в штыки приверженцами гуморальной теории иммунитета, считавшими, что центральную роль в уничтожении "пришельцев" играют определенные вещества крови, а не содержащиеся в крови лейкоциты. Мечников, признавая существование антител и антитоксинов, описанных Эмилем фон Берингом, энергично защищал свою фагоцитарную теорию. Вместе с коллегами он изучал также сифилис, холеру и другие инфекционные заболевания. Выполненные в Париже работы Мечникова внесли вклад во многие фундаментальные открытия, касающиеся природы иммунной реакции. Один из его учеников - Жюль Борде - показал, какую роль играет комплемент (вещество, найденное в нормальной сыворотке крови и активируемое комплексом антиген - антитело) в уничтожении микробов, делая их более подверженными действию фагоцитов. Наиболее важный вклад Мечникова в науку носил методологический характер: цель ученого состояла в том, чтобы изучать "иммунитет при инфекционных заболеваниях... с позиций клеточной физиологии". Когда представления о роли фагоцитоза и функции лейкоцитов получили более широкое распространение среди иммунологов, Мечников обратился к другим идеям, занявшись, в частности, проблемами старения и смерти. В 1903 году он опубликовал книгу, посвященную "ортобиозу" - или умению "жить правильно". - "Этюды о природе человека", в которой обсуждается значение пищи и обосновывается необходимость употребления больших количеств кисломолочных продуктов, или простокваши, заквашенной с помощью болгарской палочки. Имя Мечникова связано с популярным коммерческим способом изготовления кефира, однако ученый не получал за это никаких денег. Мечников совместно с Паулем Эрлихом был удостоен Нобелевской премии по физиологии и медицине 1908 года "за труды по иммунитету". Как отметил в приветственной речи К. Мернер из Каролинского института, "после открытий Эдварда Дженнера, Луи Пастера и Роберта Коха оставался невыясненным основной вопрос иммунологии: Каким образом организму удается победить болезнетворных микробов, которые, атаковав его, смогли закрепиться и начали развиваться? Пытаясь найти ответ на этот вопрос, - продолжал Мернер, - Мечников положил начало современным исследованиям по... иммунологии и оказал глубокое влияние на весь ход ее развития". В 1869 году Мечников женился на Людмиле Федорович, которая была больна туберкулезом; детей у них не было. Когда спустя четыре года жена умерла, Мечников предпринял неудачную попытку покончить жизнь самоубийством, выпив морфий. В 1875 году, будучи преподавателем Одесского университета, он встретил 15-летнюю студентку Ольгу Белокопытову и женился на ней. Когда Ольга заразилась брюшным тифом, Мечников снова попытался свести счеты с жизнью, на этот раз посредством инъекции возбудителей возвратного тифа. Тяжело переболев, он, однако, выздоровел: болезнь поубавила долю столь характерного для него пессимизма и вызвала улучшение зрения. Хотя и от второй жены у Мечникова не было детей, после смерти родителей Ольги, ушедших из жизни друг за другом в течение года, супруги стали опекунами двух ее братьев и трех сестер. Илья Ильич Мечников умер в Париже 15 июля 1916 года в возрасте 71 года после нескольких инфарктов миокарда. Среди многочисленных наград и знаков отличия Мечникова - медаль Копли Лондонского королевского общества, степень почетного доктора Кембриджского университета. Он - член Французской академии медицины и Шведского медицинского общества. Список литературы - Лауреаты Нобелевской премии: Энциклопедия - М.: Прогресс, 1992.
- Павлов И. П. Двадцатилетний опыт объективного изучения высшей деятельности (поведения) животных. — М.: Наука, 1973.
- Россия и мировой бизнес: дела и судьбы. Альфред Нобель, Адольф Ротштейн, Герман Спитцер, Рудольф Дизель / Ред. и предисл. В. И. Бовыкина. — М.: 1996.
- http://www.ras.ru/win/db/show_per.asp?P=.id-51632.ln-ru
- http://www.dinfor.ru/?p=istoriya21&news=1022
| newrefs.ru
Научные заслуги Луи Пастера
Скоро Новый год — очень удачное время, чтобы вспомнить о заслугах  великого французского химика и микробиолога Луи Пастера перед человечеством: во-первых, он родился 27 декабря, и в этом году мы отмечаем 193-ю годовщину с его рождения. Во-вторых, его вклад в развитие науки трудно переоценить, а рассказы о таких людях и их достижениях обычно вдохновляют и заряжают энтузиазмом. Согласитесь, в преддверии Нового года это весьма актуально.
великого французского химика и микробиолога Луи Пастера перед человечеством: во-первых, он родился 27 декабря, и в этом году мы отмечаем 193-ю годовщину с его рождения. Во-вторых, его вклад в развитие науки трудно переоценить, а рассказы о таких людях и их достижениях обычно вдохновляют и заряжают энтузиазмом. Согласитесь, в преддверии Нового года это весьма актуально.
Разоблачение теории самозарождения жизни
В 1862-м году Французская академия наук присудила Пастеру премию за окончательное разрешение вопроса о самозарождении жизни. Теория о зарождении живых существ из неживой материи считалась само собой разумеющейся со времен Древнего мира. В это верили в Древнем Египте, Вавилоне, Китае, Индии, Греции. Считалось, например, что черви рождаются от гнилого мяса, а лягушки и крокодилы — из речного ила.
Лишь в средние века некоторые ученые начали подвергать эту теорию сомнению, доказывая, что в прокипяченной и запаянной колбе с питательным раствором самозарождение не происходит. Однако на каждый аргумент ученых адепты теории находили контраргумент, придумывая то «животворную» силу, которая умирала при кипячении, то необходимость натурального непрогретого воздуха.
Луи Пастер провел остроумный эксперимент с питательной стерильной средой, которую он поместил в специально изготовленную для этого колбу с S-образным горлышком. Обычный воздух свободно поступал в колбу, но микроорганизмы оседали на стенках горлышка и не достигали питательной среды. Поэтому даже спустя несколько дней в лабораторной посуде не было найдено никаких живых микроорганизмов. То есть, несмотря на идеальные условия, самозарождения не произошло. Но стоило сполоснуть раствором стенки горлышка и в колбе начинали активно развиваться бактерии и споры.
Этот эксперимент Пастера опроверг царившее в медицинской науке мнение, что болезни зарождаются внутри организма самопроизвольно или происходят от «плохого» воздуха («миазмов»). Пастер заложил основы антисептики, доказав, что инфекционные болезни передаются методом заражения — в здоровый организм возбудители болезни должны проникнуть извне.
Пастеризация
Еще до того, как Пастер опроверг теорию самозарождения жизни, он исследовал процессы брожения. Он доказал, что это не химический процесс, как утверждал другой выдающийся химик, Либих, а биологический, то есть результат размножения определенных микроорганизмов. Параллельно ученый открыл существование анаэробных организмов, которым кислород или не нужен для существования, или он даже ядовит для них.
В 1864 году по просьбе французских производителей вина Пастер занялся исследованиями болезней вин. Он обнаружил, что они вызываются специфическими микроорганизмами, каждая болезнь — своими. Чтобы предотвратить порчу вина, он посоветовал нагревать его до температуры приблизительно 50-60 °С.  Этого достаточно, чтобы убить вредные бактерии, не повлияв на качества самого продукта.
Этого достаточно, чтобы убить вредные бактерии, не повлияв на качества самого продукта.
Теперь этот метод называют пастеризацией и широко применяют в лабораториях, на производстве пищи и некоторых непищевых продуктов. В настоящее время разработано несколько типов пастеризации:— длительная — 30-40 минут при t не более 65 °С;— короткая — ½-1 минуты при t 85-90 °С;— мгновенная — несколько секунд при t 98 °С;— ультрапастеризация — несколько секунд при t выше 100 °С.
Вакцинация и теория искусственного иммунитета
Начиная с 1876 года, Пастер сосредоточился на исследовании заразных заболеваний. Ему удалось выделить возбудителя сибирской язвы, холеры, родильной горячки, куриной холеры, краснухи свиней, бешенства и некоторых других инфекционных заболеваний. Для лечения он предложил использовать прививки ослабленными культурами микроорганизмов. Этот метод стал основой теории искусственного иммунитета и применяется до сих пор.
Особенно большую известность ученому принесла вакцина против бешенства. 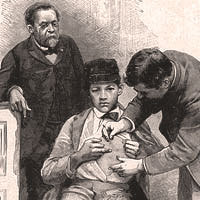 После первого же удачного опыта на человеке в июле 1885 года, в Париж стали приезжать люди со всей Европы, надеясь на исцеление от ранее смертельной болезни. Например, в группе из 19-и русских крестьян удалось вылечить 16, хотя с момента заражения прошло целых 12 дней. Илья Мечников, работавший с Пастером, назвал разработку вакцины от бешенства его «лебединой песней».
После первого же удачного опыта на человеке в июле 1885 года, в Париж стали приезжать люди со всей Европы, надеясь на исцеление от ранее смертельной болезни. Например, в группе из 19-и русских крестьян удалось вылечить 16, хотя с момента заражения прошло целых 12 дней. Илья Мечников, работавший с Пастером, назвал разработку вакцины от бешенства его «лебединой песней».
Во всем мире начали организовывать пастеровские станции, которые делали прививки от бешенства. В России первая такая станция заработала уже в 1886-м году.
Парижский институт Пастера
В 1889-м году Пастер возглавил организованный им частный институт в Париже, средства для которого собирались по подписке во всем мире. Ему удалось собрать в институте лучших биологов того времени и организовать научную школу микробиологии и иммунологии, из которой вышло много известнейших ученых, включая 8 Нобелевских лауреатов. Например, в Институте Пастера с самого начала и до своей смерти работал Лауреат Нобелевской премии 1908-го года Илья Мечников, которого Пастер лично пригласил возглавить одну из лабораторий.
pcgroup.ru
Первый «медицинский нобель»
Статья на конкурс «био/мол/текст»: Расскажем о научном пути Эмиля Адольфа фон Беринга, посвятившего жизнь борьбе со смертельными заболеваниями и ставшего первым лауреатом Нобелевской премии по физиологии и медицине. Формулировка Нобелевского комитета: «За работу по сывороточной терапии, главным образом за ее применение при лечении дифтерии, что открыло новые пути в медицинской науке и дало в руки врачей победоносное оружие против болезни и смерти». 
Главный спонсор конкурса — дальновидная компания Генотек.Конкурс поддержан ОАО «РВК».
Обратите внимание!
Эта работа представлена на конкурс научно-популярных статей «био/мол/текст»-2014 в номинации «Лучший обзор».
Спонсором номинации «Биоинформатика» является Институт биоинформатики. Спонсором приза зрительских симпатий выступила фирма Helicon. Свой приз также вручает Фонд поддержки передовых биотехнологий.

Поэт Витус Беринг.
Для среднестатистического россиянина фамилия Беринг вызывает, в первую очередь, образ мореплавателя Витуса Беринга и открытый им Берингов пролив (в скобках заметим, что известный еще с учебников хрестоматийный портрет путешественника — хотя и портрет Витуса Беринга, но не мореплавателя, а датского поэта и историка, дяди «нашего» Беринга).
А вот для историка науки, и, в особенности, медицины, Беринг — фигура знаковая, открывающая длинный список, на конец 2014 года насчитывающий 207 человек. Эмиль Адольф фон Беринг — первый в мире нобелевский лауреат в области физиологии или медицины. «Наш Беринг» — немец, уроженец нынешней Польши, старший из двенадцати детей скромного прусского учителя, ученик великого Коха, рассорившийся со своим учителем. И получил он премию за победу над очень опасным в те времена врагом — дифтерией. В XIX веке из ста заболевших дифтерией детей гарантированно умирало не менее пятидесяти. В Европе ежегодно умирали тысячи, и врачи ничем не могли облегчить агонию и страдания. До появления бактериальной теории возникновения болезней и плеяды блестящих бактериологов во главе с Луи Пастером и Робертом Кохом медицина была бессильна.

Луи Пастер.
Однако в 1870-х годах ситуация начала меняться. В 1876 году Кох публикует статью о возбудителе сибирской язвы, в 1881 году Пастер придумал предохранительную прививку от этого заболевания, в 1882 году случается триумф Коха — открыта бактерия туберкулеза (ссора Беринга с Кохом случилась именно на эту тему: Беринг, как позже выяснилось — справедливо, утверждал, что мясо больных туберкулезом животных опасно, бактерии одни и те же, а Кох не стерпел вторжения в область своего незыблемого авторитета).

Роберт Кох.
В 1885 году сделана первая прививка от бешенства. Настала очередь дифтерии. Однако первым в борьбу с этой болезнью вступил отнюдь не Беринг. Первый ход в партии против дифтерии сделал немецкий бактериолог Фридрих Лёффлер, первооткрыватель возбудителя сапа. В 1884 году он сумел открыть бактерии, вызывающие дифтерию — палочки Corynebacterium diphtheriae. Впрочем, дальше продвинуться он не смог, но в своих записях дал ключ к разгадке: «Эта бацилла всегда остается на месте в омертвелых тканях, заполняющих горло ребенка; она таится в одной какой-нибудь точке под кожей морской свинки, она никогда не размножается в организме мириадами, и в то же время она убивает. Как это может быть? Надо полагать, что она вырабатывает сильный яд — токсин, который, распространяясь по организму, проникает к важнейшим жизненным центрам. Несомненно, что этот токсин можно каким-то способом обнаружить в органах погибшего ребенка, в трупе морской свинки и в бульоне, где эта бацилла так хорошо размножается. Человек, которому посчастливится найти этот яд, сможет доказать то, что мне не удалось продемонстрировать».

Фридрих Лёффлер.
Следующий шаг в победе над дифтерией сделал другой Эмиль — ученик Пастера Эмиль Ру. Именно он сумел доказать, что, во-первых, действительно, дифтерийная палочка вызывает болезнь, и что все смертельные последствия дифтерии вызваны не самой бактерией, а вырабатываемым ею токсином. Во-вторых, Ру показал, что для того, чтобы выделить достаточное количество токсина, бактерии требуется время (именно поэтому все первые опыты в попытках выделить токсин из зараженных дифтерией морских свинок были неудачны). И именно Ру сумел выделить этот токсин, и впрыскиванием его морской свинке получить тот же эффект, что и от дифтерийной палочки. Статьи Contributions à l’etude de la diphtheria, опубликованные в 1888−1890 годах в журнале Annales de l’Institut Pasteur стали этапными в медицине.

Эмиль Ру.
Следующий (но не последний) шаг сделал именно Эмиль Беринг. Вместе с японским коллегой Сибабасуро Китасато (он не стал нобелевским лауреатом, но стал первооткрывателем возбудителя чумы), с которым он работал в Институте гигиены Роберта Коха, Беринг выяснил, что если сыворотку крови перенесших дифтерию и выздоровевших морских свинок ввести заболевшим животным, те выздоравливают. Значит, в крови переболевших появляется какой-то антитоксин, который нейтрализует токсин дифтеритной палочки.

Сибабасуро Китасато.
Рождественской ночью 1891 года первую сыворотку получили безнадежно больные дети. Многие были спасены, это был оглушительный успех. Но все же смертность снизилась всего в два раза. И тут Берингу помог еще один будущий нобелевский лауреат, коллега и друг — Пауль Эрлих. Будущий изобретатель «препарата 606» (сальварсана) и победитель сифилиса. А тогда он сумел наладить масштабное производство сыворотки, рассчитать правильные дозировки антитоксина и повысить эффективность вакцины. В 1908 году Эрлих разделил Нобелевскую премию с нашим соотечественником, Ильей Мечниковым.
А премия «за дифтерию» — и первая в истории Нобелевских премий — досталась Берингу. Если бы нобелевку за победу над дифтерией давали сейчас, то, вероятнее всего, премию дали бы всем троим — Ру, Берингу и Эрлиху. Устав премии это позволяет. Но впервые «разделение» Нобелевской премии по медицине случилось позже, в 1906 году. А при выборах первого в истории лауреата борьба была нешуточной.

Пауль Эрлих.
В базе данных номинаций на сайте нобелевского комитета можно посмотреть, что номинантов в 1901 году было аж 83. Cреди номинантов на первого медицинского «нобеля» можно встретить и учителя Беринга, Коха, ставшего лауреатом четырьмя годами позже, и Мечникова с Павловым (у последнего целых восемь номинаций). Беринг был номинирован шесть раз, Ру — один, Лёффлер — ни разу. Выбор Нобелевского комитета пал на Беринга.
Как говорилось в вердикте комитета, премия была присуждена «за работы по серотерапии, и, прежде всего, за ее использование в борьбе против дифтерии, которыми он открыл новое направление в области медицинских знаний и тем самым дал в руки врача победоносное оружие против болезни и смерти». Как видите, первые мотивировки комитета весьма цветасты, и ныне сохранились только в премии по литературе (я вообще считаю, что за сами мотивировки пора дать премию по литературе).
Впрочем, в своей нобелевской лекции фон Беринг отдал должное своим предшественникам. Во вступлении к ней он признал, что сывороточная терапия (серотерапия) была основана на теории, предложенной «Лёффлером в Германии и Ру во Франции, согласно которой бактерии Лёффлера не сами по себе вызывают дифтерию, а вырабатывают токсины, которые способствуют развитию болезни. [...] Без этой предварительной работы Лёффлера и Ру не было бы сывороточной терапии дифтерии». Интересно, что на нобелевском банкете краткая речь в честь Беринга профессора шведского Каролинского института Мёрнера и ответная речь Беринга звучали... на немецком. Да, тогда это был международный язык науки.
Мёрнер, чествуя Беринга, заявил, что благодаря Берингу (а также Пастеру и Коху) «орды бактерий» становятся все более «дисциплинированными толпами», а также выразил благодарность от имени тысяч спасенных пациентов. В ответном слове Беринг (а нужно помнить, что это была первая «нобелевская» речь на банкете в истории) сказал, что здесь Швеция, несмотря на свою небольшое население, вносит огромный вклад в ход человеческой истории. А также обещал, что потратит денежную премию на борьбу с туберкулезом. И пригласил шведских исследователей поработать в его лаборатории в Марбурге — «чтобы проконтролировать, как я буду выполнять свое обещание».
Во втором десятилетии XX века Эмиль Беринг сумел победить еще одну опаснейшую болезнь. В те годы не давали Нобелевских премий — шла Первая мировая война, — но разработанная Берингом противостолбнячная вакцина спасла множество жизней немецких солдат. И Беринг снова стал первым — будучи гражданским (хотя и военным врачом по образованию) и не участвуя в боевых действиях, он был награжден Железным крестом — наградой, вручаемой вне зависимости от звания или сословия, но только за боевые подвиги.
Впрочем, самого Беринга Первая мировая в итоге и убила, хотя умер он не от пули или бомбы. У ученого было очень мало близких друзей и учеников — и большинство их (например, Ру и Мечников) оказались в странах, с которыми воевала Германия. Это привело к депрессии и нежеланию бороться за свою жизнь. Истощенный организм не смог справиться с переломом бедра, Беринг быстро старел и 31 марта 1917 года скончался от воспаления легких.
Можно сказать, что Эмиль Адольф фон Беринг полностью соответствовал завещанию Нобеля: уж его-то работы действительно принесли огромную пользу человечеству. И громадные благородство и отвага в борьбе с болезнями обессмертили его имя, занеся Беринга в анналы истории человечества как первого лауреата Нобелевской премии по физиологии и медицине*.
Первоначально статья была опубликована в блоге на сайте Политехнического музея [5].
- Поль де Крюи. Охотники за микробами. М. 1957;
- Информация Нобелевского комитета о премии по физиологии и медицине за 1901 год;
- Нобелевская лекция Беринга;
- Речь Беринга на награждении Нобелевской премией;
- Паевский А. «Победитель дифтерии». Сайт Политехнического музея;
- Кузница нобелевских кадров.
biomolecula.ru
Читать реферат по биологии: "Луи Пастер и значение его трудов для человечества"
 (Назад)
(Назад) (Cкачать работу)
(Cкачать работу)
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Реферат
по биологии
на тему:
"Луи Пастер
и значение его трудов для человечества" ученика 8-Б класса
средней школы №14
Шпирны Артёма Одесса,2000 "Он освящает все, к чему прикасается..."
Био. 27 декабря 1822 года в городке Доле родился Луи Пастер, но все
свое сознательное детство он провел в Арбуа и считал этот город род-
ным. Его отец, бывший наполеоновский солдат Жан-Жозеф Пастер, по при-
меру своих крепостных предков стал кожевенником.
Пастер решил поступить в Нормальную школу, которая открывала до-
рогу к учительской и профессорской карьере. Готовясь к вступительным
экзаменам, Пастер слушал лекции в Сорбонне, Там он впервые присутство-
вал на лекциях знаменитого химика Жана-Батиста Дюма, крупного ученого
и блестящего лектора. С этих пор химия окончательно заняла первое мес-
то в его мыслях и сердце.
В конце 1843г. он блестяще окончил Нормальную школу, а затем до-
бился права работать простым препаратором в лаборатории великого Баля-
ра.
Свое первое открытие Пастер сделал в двадцать шесть лет, в то
время он уже закончил учебу и стал химиком. После долгой возни с кучей
крошечных кристаллов он открыл, что существует не два, а четыре вида
виннокаменной кислоты; что в природе существует масса странных комби-
наций, на вид совершенно одинаковых, но представляющих зеркальное от-
ражение одна другой.
Его открытие положило начало новой науке - стереохимии, химии в
пространстве, учению о группировке атомов в молекуле и о законах, уп-
равляющих этой группировкой.
Знаменитый французский физик Жан-Батист Био, признав открытие
Пастера, поверив в его силы, стал помогать ему в исследованиях, а по-
том взялся опубликовать доклад Пастера "Исследование о зависимости
между формой кристаллов, их химическим составом и направлением их вра-
щательной способности" в Академии наук.
С этих пор началась головокружительная карьера молодого химика.
Внимание научных кругов было привлечено к его работам.
Внезапно Пастера назначили профессором физики в Дижон, а потом
также неожиданно перевели в университет Страсбурга профессором химии.
Здесь он поселился в семье ректора профессора Огюста Лорана. Он подру-
жился с семьей профессора, здесь она заменяла ему родной дом, и, хотя
он писал домой , что не собирается жениться, все же это случилось. И
так же внезапно, как все, что случалось в жизни с Пастером. Он увлекся
с первого взгляда; со второго понял, что не увлечение, а любовь; через
три дня знал уже, что не может без нее жить. А через пятнадцать дней
после приезда в Страсбург сделал официальное предложение дочери Огюста
Лорана - Мари. И самое удивительное, что Луи Пастер и Мари Лоран про-
жили в браке сорок шесть лет и ни одно облачко не омрачило их супру-
жество.
Вскоре Пастер был назначен профессором и деканом научной части
Нормальной школы в Лилле, и здесь он впервые столкнулся с вопросом о
микробах. Однажды мосье Биго, богатый винокур, пришел к нему в лабораторию
в полном отчаянии.
- У меня большие неприятности с брожением, профессор,- удрученным
голосом сказал он. - Я ежедневно теряю тысячи франков. Не могли бы вы
заглянуть ко мне на завод и выручить меня? Сын Биго был студентом Нормальной школы, и поэтому Пастер поспе-
шил прийти к нему на помощь. Он пришел на завод и осмотрел больные ча-
ны, дававшие слишком мало алкоголя; он набрал в бутылки несколько об-
разцов серой вязкой свекольной массы, чтобы исследовать ее в своей ла-
боратории. При этом он не забыл захватить немного свекольной массы и
из здоровых чанов, дававших достаточное количество алкоголя. Пастер не
имел никакого понятия о том, как он сможет помочь Биго, ничего еще
точно не знал о процессах брожения, превращающих сахар в алкоголь, да,
пожалуй, и ни один химик на свете еще не знал об этом. Он вернулся в
лабораторию, почесал в затылке и решил сначала исследовать массу из
здоровых чанов. Он взял одну каплю из этой массы, положил ее под мик-
роскоп в смутной надежде найти в ней какие-нибудь кристаллы. Он увидел
в этой капле множество шариков, во много раз меньше самого мелкого
кристалла; эти шарики были желтоватого цвета и были наполнены внутри
странными мерцающими точками.
Пастер сразу догадался, что эти шарики и есть те самые дрожжи,
которые встречаются в каждой варке сахара, превращающегося путем бро-
жения в алкоголь.
Затем он взял бутылку с варкой из больного чана и положил одну
каплю из него под микроскоп - там совершенно не было дрожжей, а лишь
только сплошная серая однородная масса.
Он снова взял бутылку, уставился на нее долгим задумчивым взгля-
дом, пока до него не дошел несколько странный необычный вид сока, пла-
вающего поверх свекольной массы. Он выудил один из комочков, плавающих
в соке, растер его в капле чистой воды и положил под микроскоп.
Там не было дрожжевых шариков, зато там была огромная, беспоря-
дочно шевелящаяся масса крошечных палочкообразных существ одни из ко-
торых двигались одиночками, другие тянулись длинной лентой, и все они
очаровательно мерцали и вибрировали.
Ночью вместе с мадам Пастер он соорудил чудовищный аппарат, кото-
рый сделал его лабораторию похожей на кабинет алхимика. С помощью это-
го аппарата он обнаружил, что кишащий палочками сок из больных чанов
всегда содержит в себе молочную кислоту и не содержит алкоголя. В его
мозгу с быстротой молнии сложилась мысль:
"Эти маленькие палочки из больных чанов несомненно живые, и это
именно они производят молочную кислоту. Эти палочки ведут войну с
дрожжами и берут над ними верх".
Дальше он решил развести эти существа, но его опты постоянно за-
канчивались неудачей, пока он не придумал для них весьма странный
бульон. Он взял сухих дрожжей, прокипятил их в чистой воде и хорошень-
ко процедил ; затем он добавил туда небольшое количество сахара и нем-
ного углекислоты. Затем он посеял комочек из больного чана в этот но-
воизобретенный бульон и поставил его в термостат.
На следующий день, когда он взял каплю этого бульона и положил
под микроскоп, он увидел миллионы крошечных танцующих палочек. Прежде
всего он сообщил мосье Биго, что именно эти мелкие палочки портят ему
брожение.
История умалчивает о том, удалось ли мосье Биго изъять из своих
чанов эти палочки, но для Пастер это было уже на втором плане. Для не-
го важен был лишь один факт: существуют еле видимые живые существа,
которые являются истинной причиной брожения. И вдруг в один прекрасный день, когда они с женой уже хорошо уст-
роились в Лилле, он получил назначение на должность директора научного
кабинета в Нормальной школе в Париж.
По приезду в Париж Пастер сразу начал доказывать всем существова-
ние тех самых мелких существ, которые вызывают брожение. Но здесь он
не нашел поддержки, дело даже было не в самом наличии микроскопических
созданий; знаменитый немец Либих, король химиков утверждал, что дрожжи
не имеют ничего общего с брожением. Он настаивал на том, что процесс
превращения сахара в алкоголь начинает белок, а затем этот самый белок
увлекает за собой сахар.
Почти неприметно для себя он уже перешел с пути химика на путь
физиолога. По-настоящему он понял это, когда 30 января 1860г. Академия
наук присудила ему премию по экспериментальной физиологии. Премия была
присуждена за работы по брожению винной кислоты и ее изомеров, по
спиртовому и молочнокислому брожению.
В голове Пастера сразу созрел остроумный план, как разбить Либи-
ха. "Надо постараться вырастить дрожжи в бульоне, совершенно не содер-
жащем белка. Если в таком бульоне дрожжи будут расти и превращать са-
хар в алкоголь, то с Либихом и его теориями будет покончено".
Но у проклятых дрожжей были очень прихотливые вкусы, и только че-
рез несколько недель Пастеру случайно удалось обнаружить необходимую
среду. Он положил как-то
referat.co
Реферат - Нобелевские лауреаты в иммунологии
Министерство здравоохранения и социального развития РФ
Санкт-Петербургский государственный медицинский университет имени академика И.П.Павлова
кафедра философии и политологии
заведующий кафедрой профессор И.Б. Гардинар
РЕФЕРАТ
«Вклад нобелевских лауреатов в развитие иммунологии»
Аспирант: Мазинг А.В.
Специальность: Аллергология и иммунология (14.00.36)
Научный руководитель: д.м.н., проф. Тотолян А.А.
Санкт-Петербург
Оглавление
Введение
Глава 1. 1901 Эмиль Адольф Фон Беринг (1854-1917) 9
Глава 2. 1905 Роберт Кох (1843-1910)
Глава 3. 1908 Илья Ильич Мечников (1845-1916) и Пауль Эрлих (1854-1915)
Глава 4. 1913 Шарль Робер Рише (1850-1935)
Глава 5. 1919 Жюль Борде (1870-1961)
Глава 6. 1930 Карл Ландштейнер (1868-1943)
Глава 7. 1951 Макс Тэйлер (1899-1972)
Глава 8. 1957 Даниель Бове (1907)
Глава 9. 1960 Френк Макфалейн Бернет (1899-1985) и Питер Брайн Медавар (1915-1987)
Глава 10. 1972 Родни Р. Портер (1917-1985) и Джеральд М.Эдельман (1929)
Глава 11. 1977 Розалин Ялоу (1921)
Глава 12. 1980 Бару Бенацерраф (1920), Жан Доссе (1916) и Джорд Д. Снелл (1903)
Глава 13. 1984 Нильс К. Ерне (1911-1994), Георг Й. Келлер (1946-1995) и Сезар Мильштейн (1927-2002)
Глава 14. 1987 Сусуму Тонегава (1939)
Глава 15. 1996 Питер К. Догерти (1940) и Рольф М. Цинкернагель (1944)
Глава 16. 1997 Стенли Б. Прузинер (1942)
Заключение
Список литературы
Введение
О том, что человек не болеет некоторыми болезнями дважды, было известно с древних времен. Так, Фукидид, описывая чуму в Афинах, отметил, что те немногие, кто выжил, могли ухаживать за больными без риска повторного заражения. О том же сообщали сочинения арабского врача X века Разеса и «Канон врачебной науки», написанный Авиценной (Иби-Сина Абу Али 980-1037) в XI веке. В Средние века любой обладатель оспин без страха встречал очередную эпидемию этой смертельно опасной болезни, а все остальные заболевали почти поголовно («Любовь и оспа минуют лишь немногих»- поговорка тех лет). Механизмы такой индивидуальной невосприимчивости не были известны даже в общих чертах. Само слово иммунитет (лат. immunitas) употреблялось только в его юридическом значении «свобода от податей или судебной ответственности».
В 1798 году английский врач Эдуард Дженнер (1749-1823) прославился тем, что, заражая людей возбудителем легко переносимой коровьей оспы, избавлял их от риска заболеть смертельно опасной натуральной, то есть «человеческой», оспой. Таким образом, Дженнер первым (1798) показал возможность того, что позднее было названо созданием активного иммунитета. Сейчас мы знаем, что микроб, вводимый в организм человека, активирует его иммунную систему, и та вырабатывает защитные белки — антитела, связывающие микроорганизмы и способствующие их уничтожению. Разумеется, свое открытие Дженнер сделал на основании одной только наблюдательности: каких-либо данных или хотя бы догадок не только о механизмах иммунитета, но и о микроорганизмах как возбудителях заразных заболеваний тогда не существовало. Просто доярки часто болели коровьей оспой и практически никогда натуральной. Удача Дженнера состояла в том, что он нашел один из нечасто встречающихся случаев перекрестного иммунитета, когда одно заболевание вызывает невосприимчивость к другому. Именно поэтому открытие Дженнера не могло быть использовано для предупреждения многих других заразных болезней. Таким образом, Дженнер первым показал возможность того, что позднее было названо созданием активного иммунитета.
Следующий шаг к пониманию процессов иммунитета был сделан французом Луи Пастером, показавшим в 1880-е годы, что именно микроорганизмы являются причиной инфекционных заболеваний. Работая с возбудителем куриной холеры, он доказал принципиальную возможность создания активного искусственного иммунитета к возбудителям различных инфекционных заболеваний. Пастер заражал кур ослабленными микробами или микробами, взятыми из старых культур. Эти ослабленные патогенные микробы вызывали несмертельное заболевание, которое заканчивалось приобретением устойчивости к повторному заражению. Вскоре этот метод был применен для создания иммунитета и у человека. Правда, для объяснения феномена приобретенной невосприимчивости Пастер предложил наивную на сегодняшний взгляд теорию истощения: микроб, размножаясь в организме, полностью уничтожает запасы какого-либо вещества и в результате — погибает. Вскоре Теобальд Смит показал, что в качестве вакцины можно использовать убитые микроорганизмы.
Мечников и Эрлих разделили Нобелевскую премию 1908 года за открытие двух главных механизмов иммунитета: клеточного (фагоцитоз) и гуморального (антителообразование).
Благодаря работам Луи Пастера распространилось представление о микробах как возбудителях инфекционных болезней. Пастер создал первые методы экспериментального исследования иммунитета.
Мечников (Нобелевская премия 1908 года) предложил клеточную теорию иммунитета, основанную на представлении о фагоцитозе — способности некоторых белых клеток крови поглощать и переваривать бактерии и другие и чужеродные тела, проникшие в организм.
Фон Беринг (Нобелевская премия 1901 года) в 1890 году показал, что на введение некоторых токсинов (ядов) бактериального происхождения организм отвечает выработкой антитоксинов — специальных белковых молекул, способных связывать токсины. Эрлих (Нобелевская премия 1908 года) положил представление о защитных молекулах в основу своей гуморальной теории иммунитета. Сами защитные молекулы Эрлих называл амбоцепторами. Борде (Нобелевская премия 1919 года) именовал их сенситизаторами, но в конце концов утвердилось название «антитело». Было показано, что гуморальный иммунитет специфичен, то есть антитела, выработанные против возбудителя одной болезни, не защищают от возникновения другой.
В первоначальном виде гуморальная теория иммунитета, как ее сформулировал Эрлих, предполагала существование изначально заложенного в клетках механизма, готового синтезировать антитела к любому антигену, как только он проникнет в организм (селекционная интерпретация). В 1930 годы Ландштейнер (Нобелевская премия 1930 года) установил, что антитела могут образовываться и в ответ на введение искусственных антигенов, не существующих в природе. Это факт нанес сильный удар по теории селекционной интерпретации, и большинство исследователей, в том числе Полинг (Нобелевская премия по химии 1954 года), стали исповедовать инструктивную интерпретацию, согласно которой механизм ответа изначально не заложен, но формируется после попадания антигена в организм.
Борде (Нобелевская премия 1919 года) первым показал, что переливание животному крови животного другого биологического вида приводит к гемагглютинации — склеиванию эритроцитов, и объяснил это работой антител. В 1901-1902 годах году Ладштейнер (Нобелевская премия 1930 года) и его сотрудники предложили относить кровь каждого человека к одной из четырех групп: А, В, АВ или 0. Эта классификация основана на том, что на поверхности эритроцитов большинства людей содержатся антигены (участки белковых молекул, способные активировать чужую иммунную систему) А и/или В, а в плазме крови изначально присутствуют готовые антитела к таким антигенам. Если перелить человеку кровь иной группы, чем его собственная, возможна встреча антител с соответствующими им антигенами и как результат — гемагглютинация, закупорка капилляров и нарушение кровотока, иногда смертельное.
Туберкулез (лат. tuberculum — бугорок) был известен человечеству очень давно. Однако различные его формы считались отдельными заболеваниями. Наиболее известны были чахотка — туберкулез легких и обыкновенная волчанка (lupus vulgaris) — туберкулез кожи, особенно — кожи лица. Если поражались одновременно кожа и шейные лимфатические узлы, болезнь называли — золотухой. Чахотку считали следствием плохого питания, возникновение волчанки объясняли недостатком пребывания на солнце (и то и другое отчасти соответствует истине). Состоятельным чахоточным больным рекомендовали жить на горных швейцарских курортах с их свежим воздухом и жирным молоком альпийских коров. Тем, кто не мог себе этого позволить, советовали чаще дышать «густым воздухом хлева». Лечение золотухи было более экзотичным: в Средние века люди верили, что в роду французских королей передается по наследству мистический дар лечить эту болезнь возложением рук на голову страждущего.
Понадобилась проницательность французского врача Р. Лаэннека, изобретателя стетоскопа, чтобы увидеть в столь различных поражениях проявления единой болезни — туберкулеза. Мысль о том, что туберкулез является инфекционным заболеванием, высказывал еще итальянский врач и анатом Д.Б. Морганьи.
Фридрих Леффлер (1852-1915) и Эмиль Ру (1853-1933) предположили, что не сам микроб-возбудитель, а выделяемый им токсин (яд) поражает организм человека. В 1888 году Ру и Александр Йереен (1863-1943) выделили этот растворимый токсин из надосадочной жидкости культуры дифтерийной палочки, Беринг (Нобелевская премия 1901 года) и Сибасабуро Китасато (1852-1931) продвинулись дальше, показав в 1890 году, что введение этого токсина вызывает в организме образование антитоксина (противоядия). Они также показали, что если эти антитоксины выделить из крови и ввести заболевшему человеку, то можно спасти его от смерти. Механизм возникновения невосприимчивости известен не был.
В 1880 году Рише присутствовал на эксперименте Пастера и видел, как тот вводил цыплятам ослабленные микробы холеры. В связи с этим Рише заинтересовала идея о том, что инфекционные заболевания могут быть связаны с выработкой токсина. В 1881 году Рише предположил, что французских овец, подверженных сибирской язве, можно предохранять от этой болезни путем переливания им крови алжирских овец, устойчивых к сибирской язве. Эту идею Рише проверил в 1888 году — изучая кровь зараженных животных.
В 1894 году немецкий бактериолог Рихард Пфейффер и русский микробиолог Василий Исаевич Исаев (1854-1911) вводили холерные вибрионы животным, обладающим иммунитетом к холере, и обнаружили гибель бактерий. Явление получило название бактериолиз. Бактериолиз также происходил, если интактным (не обладающим иммунитетом к холере) животным вводили взвесь холерного вибриона вместе с сывороткой иммунных животных. Повторить пот эффект in vitro не удавалось. Мечников считал, что причину бактериолиза следует искать в деятельности фагоцитов (клеток-«пожирателей» микробов).
Первые, не очень надежные, сообщения о черной рвоте болезни, напоминавшей желтую лихорадку, относятся к XV веку. Первая документально зарегистрированная ее эпидемия имела место в 1648 году в Мексике, куда, как полагают, ее завезли из Западной Африки работорговцы.
В ХVII-Х1Х столетиях эта болезнь особенно свирепствовала в Карибском бассейне, откуда периодически распространялась по морским путям Атлантики и, в конечном счете, захватила большие территории в континентальной Южной Америке и в Африке. История желтой лихорадки изобилует драматическими событиями.
Природа желтой лихорадки и способ ее передачи долгое время оставались не известными. Однако в 1881 году гаванский врач Карлос Хуан Финлей-и-Баррес отметил изобилие москитов в местах распространения болезни и даже послал в Испанскую королевскую академию трактат, в котором утверждал, что болезнь передается комарами. Несмотря на то, что это сообщение в 1884 году появилось на страницах "Scientific American", оно не привлекло к себе должного внимания.
--PAGE_BREAK--Когда в 1898 году вспыхнула Испано-американская война, желтая лихорадка соде значительные трудности для армии США на Кубе. Из-за этого американские власти в 1900 году назначили Комиссию по изучению желтой лихорадки во главе с военным врачом Уолтером Ридом. В состав комиссии входили бактериолог Джеймс Кэррол и энтомолог Джесси У. Лейзер.
Комиссия обнаружила, что желтая лихорадка передается от человека к человеку через укусы комаров Aedes aegypti которые обитают вблизи человеческого жилья и размножаются в стоячей воде. Стало возможным бороться с лихорадкой, истребляя комаров и изолируя заболевших в местностях, где комаров не было. Аналогичные меры были предприняты на Юге США, в Мексике, зоне Панамского канала, Бразилии и других местах.
Комиссия Рида впервые показала, что причиной заболевания человека желтой лихорадкой может быть вирус. Там, где имеется достаточно большое количество людей, не обладающих иммунитетом к этой болезни и обитают комары Aedes aegypti, один-единственный инфицированный человек может стать причиной эпидемии.
Казалось, что комиссия Рида полностью решила проблему желтой лихорадки, но уже в1911 году группа южноамериканских врачей доказала, что заразиться этой болезнью можно не только возле человеческого жилья, но также и в девственных джунглях. Возникла догадка, что эта форма болезни, которая получила известность как лихорадка джунглей, существует среди диких обезьян и может быть передана от них человеку. Поскольку обезьяны и комары Aedes aegypti часто обитают на вершинах деревьев, их нельзя истребить, поэтому в джунглях желтая лихорадка до сих пор остается постоянной угрозой. Однако прошло много времени прежде, чем это удалось доказать, и шесть врачей-исследователей из экспедиции Фонда Рокфеллера заплатили за это своими жизнями.
К середине 1940-х годов было уже известно, что хромосомы состоят из дезоксирибонуклеиновой кислоты (ДНК) и белков. Освальд Теодор Эйвери и другие в 1944 году покачали, что наследственные признаки бактерий могут быть переданы от одной клетки к другой путем переноса ДНК. В 1952 году Хергаи (Нобелевская премия 1969 года) и Марта Чейс доказали, что генетическим материалом бактериофага является ДНК.
Основываясь на существовавших данных Э. Чаргаффа о соотошении различных азотистых оснований в молекуле ДНК и на результатах ее рентгеноструктурного анализа, выполненного Р. Франклин и Уилкинсом (Нобелевская премия 1962 года), Уотсон и Крик (Нобелевская премия 1962 года) в 1953 году открыли структуру молекулы ДНК и создали ее трехмерную модель — знаменитую двойную спираль. Очоа и Корнберг (Нобелевская премия 1959 года) синтезировали ДНК in vitro.
Количество вариантов антител, которые способен выработать человеческий организм, оценивалось числом не менее 10 млн. Согласно правилу Бидла-Тейтема (Нобелевская премия 1058 года) «один ген-один белок) для кодирования структуры 10 млн. молекул требуется 10 млн. генов. Это многократно превышает возможности ДНК. (По современной оценке, у человека примерно 30 тыс. генов.)
Структура антител оставалась неизвестной пока Тиселиус (Нобелевская премия по химии за 1948 год) и Э. А. Кэбет не показали, что антитела являются γ-глобулинами с огромной молекулярной массой, что и затрудняет их изучение. Чтобы облегчить задачу исследователей, требовалось найти способ расщепления больших молекул на точно определенные фрагменты, с которыми было бы легче работать.
Другая трудность заключалась в том, что работая с иммуноглобулинами исследователь вынужден иметь дело со смесью близких но структуре молекул. Выход подсказала работа Г. Кункеля, показавшего в 1950 году, что все клетки миеломы — злокачественной опухоли кроветворных органов происходят от одной-единственной клетки, и вырабатываемые ими иммуноглобулины — одинаковы (гомогенны).
На рубеже XIX и XX веков Каррель (Нобелевская премия 1912 года) добился выдающихся результатов в разработке техники сшивания сосудов и трансплантации, то есть пересадки, органов. После того, как большая часть чисто хирургических трудностей была разрешена, стало очевидным, что главная проблема заключается в другом: безупречно пересаженный орган сначала приживался, а через некоторое время — отторгался мощной реакцией иммунной системы. Причины отторжения были непонятны. Требовалось создать способы воздействия на иммунную систему, основанные на совершенно новых теоретических представлениях.
В 1927 году К. Бауэр обнаружил, что при пересадке кожного лоскута от одного монозиготного близнеца другому отторжения не происходит. Организм принимает трансплантат как собственную ткань. За этим последовало несколько успешных пересадок почек от близнеца близнецу. Так была доказана генетическая детерминированность реакции отторжения. В конце 1930-х годов в США было установлено, что процесс отторжения трансплантата управляется несколькими генами, но исследователи не сумели их идентифицировать. В 1937 году в Лондоне Питер Горер описал белок, участвующий в реакции отторжения.
В 1945 году Р.Д. Оуэн открыл явление химеризма, то есть возможность существования генетически неоднородных организмов: у телят-близнецов еще в утробе матери происходил обмен кровью, и чужие эритроциты потом длительно сохранялись в крови.
Берне и Медавар (Нобелевская премия 1960 года), экспериментируя с пересадками кожных лоскутов у телят и мелких лабораторных животных, установили, что способность организма отличать чужие антигены своих не является полностью наследуемой, и ее формирование иногда заканчивается уже после рождения. Таким образом, в течение внутриутробной жизни и иногда некоторое время после рождения индивид сохраняет способность принимать чужую ткань как свою -феномен иммунологической толерантности.
Бёрнет и Медавар (оба — Нобелевская премия 1960 года) установили, что в течение некоторого времени после рождения индивид сохраняет способность принимать чужую ткань как свою — феномен иммунологической толерантности. В конце 1950-х годов Бёрнет, Д. У. Толмэдж и Ледерберг (Нобелевская премия 1958 года), полностью отказавшись от инструктивной интерпретации, сформулировали клонально-селекционную теорию иммунитета, основу которой составляло представление об изначально существующих в организме клеточных клонах — группах клеток, способных продуцировать антитела на любой мыслимый антиген. Во время внутриутробного развития и в течение короткого времени после рождения клоны клеток, способные ответить на собственные антигены организма, элиминируются (подавляются), и таким образом, предупреждается разрушение иммунной системой тканей собственного организма. Оставшиеся клоны ожидают появления соответствующих «чужих» антигенов, и, когда это случается, активируются и синтезируют нужные антитела. В начале 1950-х годов Снелл (Нобелевская премия 1980 года) доказал существование у позвоночных главного комплекса гистосовместимости — системы генов, регулирующих ответ на пересадку чужеродной ткани. В 1954 году Доссе (Нобелевская премия 1980 года) обнаружил, что кровь пациентов, которым многократно производили переливание крови, содержит антитела против донорских лейкоцитов. Эти антитела агглютинировали (склеивали) лейкоциты большинства других людей, но не свои собственные. В конце 1950-х годов Доссе идентифицировал первый антиген гистосовместимости человека, а в 1965 году описал систему человеческих лейкоцитарных антигенов и соответствующие им HLA-гены. Вскоре было выявлено сходство систем МНС и HLA. Бенасерраф (Нобелевская премия 1980 года) показал, как эти гены регулируют не только ответ на пересадку чужеродной ткани, но и всю работу иммунной системы. Так, усилиями Снелла, Доссе и Бенасеррафа был раскрыт механизм, с помощью которого организм отличает свои здоровые клетки от чужих или своих, но переродившихся.
Существование носителей наследственности постулировал еще Мендель (18бб). В 1909 году датчанин Вильгельм Людвиг Иогансен назвал их генами, Морган (Нобелевская премия 1933 года) доказал, что гены упорядоченно расположены в хромах («как бусины на нитке»). Мак-Клинток (Нобелевская премия 1983 года) показала, что часть структурных элементов хромосомы способна перемешаться не только по самой хромосоме, но и к другой хромосоме. Роберте и Шара (Нобелевская премия 1993 года) установили, что ген может присутствовать в генетической материале в виде нескольких раздельных сегментов — экзонов.
То, что синтез белков управляется генами, предполагал еще в 1902 году А.Э. Гаррод. Билл и Тейтем (Нобелевская премия 3958 года) доказали, что структура каждого синтезируемого белка закодирована в одном из генов: «один ген один белок».
С конца 1960-х годов, когда большинство иммунологов отказалось от инструктивной интерпретации теории атитителообразования, вновь стало очевидным разительное несоответствие между числом необходимых вариантов антител и возможностями генетического аппарата хранить информацию об их структуре.
Антитела синтезируются В-лимфоцитами, которых у взрослого человека примерно 1012. Поскольку каждый В-лимфоцит может производить свой тип антител, число возможных вариантов антител в одном организме теоретически ограничено только этим числом — триллион. Число антигенов, с которыми может встретиться организм, оценивалось в сотни миллионов, и уникальная природа каждого требовала синтеза «собственного» антитела, а для этого, в соответствии с правилом Бидла-Тейтема нужны сотни миллионов генов. Весь же человеческий геном, как тогда считали, содержит 70 тыс. генов (сейчас известно, что 30 тыс.).
Кроме того, несмотря на общую победу селекционной интерпретации теории антителообразования, многим исследователям все же трудно было до конца примириться с мыслью о том, что иммунная система заранее создает антитела, способные опознать и обезвредить сотни миллионов веществ, при том, что с большей частью этих веществ организм в течение всей своей жизни так и не встретится. Структура антител оставалась неизвестной, пока Тиселиус (Нобелевская премия по химии за 1948 год) и Л. Кэбет не показали, что антитела являются γ-глобулинами, то есть белками с большой молекулярной массой. В 1962 году Эдельман и Портер (оба — Нобелевская премия 1972 года) установили, что молекула антитела состоит из четырех полипептидных цепей: двух длинных и двух коротких, все четыре вместе формируют Y-подобную симметричную молекулу. К. 1969 году сотрудники Одельмана полностью расшифровали первичную структуру молекулы иммуноглобулина (все 1300 аминокислотных остатков) и определили в ней домены, ответственные за различные функции антител.
В основании Y есть постоянная часть, последовательность аминокислот которой определяет принадлежность антитела к одному из следующих классов: M, D, G, A, или E. Соответственно были названы пять классов иммуноглобулинов: IgМ, IgD, IgG, IgA, и IgE. После связывания антитела с антигеном, например, вируса, молекула антитела меняется таким образом, что его постоянная часть (в стебле Y) начинает активизировать важные механизмы иммунной защиты. Среди них система комплемента, которая может непосредственно делать отверстия в бактериях и других микробах, а также притягивать лейкоциты — макробактериофаги и гранулоциты — к полю сражения.
Короткие цепи бывают двух типов: κ (каппа) и λ (ламбда). Каждая молекула антитела, независимо от класса, содержит или две κ- или две λ-цепи. Во внешних частях коротких цепей (в ветвях Y) существуют значительные различия в последовательности аминокислот. В этой переменной части имеются три области, где различия очень велики. Эти области представляют собою стенки «кармана», способного связывать чужеродное вещество (антиген). Они более или менее приспособлены к форме конкретного антигена. Чем лучше соответствие, тем крепче захват антигена.
Работами членов гак называемой «фаговой группы» в 1940-1950 годы в США Дельбрюка и Лурия (оба Нобелевская премия 1969 года), было показано, что вирус навязывает клетке свой вариант генетической информации, заставляя ее синтезировать новые вирусы.
В 1902 году Арчибальд Э. Гаррод предположил, что некоторые дефекты ферментной системы передаются от родителей к потомкам. Освальд Теодор Эйвери и другие доказали, что носителем наследственсти является не белок, как думали прежде, а ДНК. Бидл и Тейтем (оба Нобелевская премия 1958 года) постулировали четкую зависимость структуры белка от генетической информации («один ген один белок»). Затем (1953) было раскрыто строение молекулы ДНК «двойная спираль Уотсона и Крика (оба Нобелевская премия 1962 года). Жакоб и Моно (оба — Нобелевская премия 1965 года) описали механизм транскрипции передачи информации от ДНК к иРНК для последующей передачи ее рибосомам, синтезирущим белок. Расшифровка триплетного кода Ниренбергом и Корана (оба — Ноблевская премия 1968 года) стала завершающим звеном в формировании того что можно назвать «центральной догмой биологии XX века»: структура белка опредляется информацией, хранимой и переносимой нуклеиновыми кислотами.
продолжение --PAGE_BREAK--Заболевания животных, позднее отнесенные к классу прионных, известны более двух веков, аналогичные болезни человека с начала XX столетия. Так у людей был описана болезнь Крейцфельдта-Якоба (ВКЯ) — дегенеративное заболевание головного и спинного мозга, с поражением, в частности, мозжечка и базальных ядер, начинающееся обычно в старости и проявляющееся в нарастающей мышечной ригидности, нарушении речи и глотания, потере памяти, слабоумии и других психических расстройствах. В тканях мозга появлялись амилоидоподобные бляшки, содержащие палочкообразные белковые агрегаты. Было показано, что экстракт такого мозга содержит нечто, способное заразить человекообразных обезьян. В 1968 году инфекционный агент БКЯ был выделен у шимпанзе, позднее болезнь была привита кошке и хомяку. Временной интервал между заражением экспериментального животного и появлением симптомов обычно превышал один год.
Гайдузек (Нобелевская премия 1976 года) исследовал куру — описанную только в середине 1950-х годов загадочную болезнь, поражавшую исключительно аборигенов, живших в условиях неолита на плоскогорьях острова Новая Гвинея. При выполнении ритуала, сородичи съедали тело умершего. При этом чаще заболевали: женщины и дети: по-видимому, во время кулинарной обработки тела они имели доступ к наиболее питательной его части — головному мозгу. Через несколько месяцев кто-то из них начинал беспричинно смеяться… В 1959 году аборигенов убедили отказаться от этого обычая, и очаг куру исчез.
Была известна также сходная по проявлениям болезнь овец скрапи. Впервые ее наблюдали в Исландии в XVIII веке. Болезнь передавалась также экстрактами мозга животных.
Итак, инфекционный характер целого класса нейродегенеративных заболеваний животных и человека был доказан. Поскольку возбудитель не задерживался бактериальными фильтрами, естественно было отнести его к классу вирусов. Очень длительный латентный период и медленное развитие заболевания подсказали идею особых «медленных вирусов». Настоящие проблемы начались, когда выяснилось, что возбудителей не убивают ни формалин, ни ультрафиолетовое облучение. К факторам, вызывающим денатурацию и расщепление белков, эти агенты, наоборот, оказались чувствительны. Математик Дж.С. Гриффит предложил смелую гипотезу: агент вообще не содержит никакого генетического — материала, он лишь измененная форма клеточного белка. Воспроизведение его свойств происходит путем аутокатазиза. Именно эту гипотезу и подтвердило позднее открытие Прузинера.
Глава 1. 1901 Эмиль Адольф Фон Беринг (1854-1917)
Формулировка нобелевского комитета:
«за работы по серотерапии, и, прежде всего, за ее использование в борьбе против дифтерии, которыми он открыл новое направление в области медицинских знаний и тем самым дал в руки врача победоносное оружие против болезни и смерти».
В 1890 году Беринг и его ассистент японец Сибасабуро Китасато ослабляли культуру возбудителей дифтерии добавлением к ней небольших количеств трихлорида йода и вводили ее животным. Потом этим же животным вводили чуть более активную культуру и так далее, пока, наконец, не добивались невосприимчивости и к живым микробам.
Беринг сделал вывод о том, что «иммунитет вызывается метаболическими продуктами, выделяемыми дифтерийными бациллами в культуру». На то, что бацилла дифтерии не сама по себе поражает организм, а делает это, выделяя какие-то ядовитые вещества — токсины, указывали и результаты вскрытия трупов умерших от дифтерии. Болезнь поражала не только инфицированные ткани, но и всю сердечно-сосудистую систему.
Беринг указывал, что когда исследуешь трупы животных, умерших от дифтерии, находишь большое количество транссудата (то есть жидкости, выпота) в плевральной полости. Этот транссудат не содержит дифтерийных бацилл, но ядовит для морских свинок. Те немногие морские свинки, которые выжили после введения им 10-15 мл транссудата, переносили без вреда инъекции возбудителя, которые убивали здоровых животных за 3-4 дня.
Беринг занялся получением более концентрированных растворов дифтерийного токсина, совершенствовал методику выращивания культуры микробов и с помощью фильтрации получал все более сильнодействующие препараты: уже 1 мл жидкости хватало для того, чтобы вызвать у морских свинок заболевание, симптомы которого не исчезали и за 3-4 недели. Предварительно иммунизированные животные без видимого вреда переносили введение даже 3-5 мл жидкости.
Вначале Беринг сравнивал полученный им иммунитет с «привыканием», подобным тому, которое происходит у алкоголиков, морфинистов и людей, получающих препараты мышьяка. Однако такому объяснению противоречил факт видовой невосприимчивости мышей и крыс к возбудителю дифтерии. (Объяснить этот феномен удалось только в XX веке.) Пока же Беринг был поражен тем, что мыши без видимых последствий переносят дозы токсина, смертельные для более крупных морских свинок.
Беринг высказал идею, что в плазме крови крыс должно содержаться вещество, обезвреживающее токсин. Предполагалось, что такого вещества (антитоксина) нет в крови животных, чувствительных к дифтерии. Чтобы проверить это, Беринг ввел токсин крысам и через 3 ч их кровь инъецировал в брюшную полость морских свинок. Симптомов отравления не было. Беринг изменил схему опыта; теперь токсин вводился животным, чувствительным к дифтерии, и через 3 ч их кровь — морским свинкам. Наступало отравление, хотя несмертельное.
Уже в рождественскую ночь следующего 1891 года дифтерийный анатоксин был апробирован на человеке. Его применение позволило снизить смертность от дифтерии в среднем с 35 до 5 %, а при поражениях гортани — с 95 до 15 %. Спасение жизней тысяч детей принесло Берингу быструю славу. В том же 1890 году с помощью схожей методики была создана сыворотка против столбнячного токсина, и во время Первой мировой войны она стала спасением для многих раненых [1].
В 1893 году в США на основе работ Беринга были созданы методы диагностики для определения периода необходимой изоляции больных дифтерией. В 1913 году американский педиатр Бела Шик описал внутрикожное введение токсина — тест на индивидуальную невосприимчивость человека к дифтерии (реакция Шика). Тогда же Беринг предложил введение смеси токсина и антитоксина для выработки у детей активного иммунитета, и это оказалось наиболее действенным средством защиты (пассивный иммунитет, возникающий после введения одного только антитоксина, недолговечен). В 1924 году токсин-антитоксиновая смесь была заменена на токсин, обработанный формалином (его назвали анатоксином). Так Беринг создал новую отрасль медицины — серотерапию.
Глава 2. 1905 Роберт Кох (1843-1910)
Формулировка нобелевского комитета: «за его исследования и открытия в области туберкулеза».
В 1882 году Роберт Кох сообщил Берлинскому обществу врачей, что он открыл возбудитель туберкулеза, который он называл бациллой, его современники — палочкой Коха.
Перепробовав множество методик, Кох выбрал для выявления микобактерий в тканях окрашивание их метиленовым синим при температуре +40°С. После нескольких дополнительных манипуляций клетки микроорганизма приобретали коричневую окраску, а микобактерии — «прекрасно голубую». Более того, все исследованные Кохом возбудители других инфекционных заболеваний, кроме возбудителя проказы, тоже окрашивались в коричневый цвет. Кох показал наличие микобактерий в легких больного туберкулезом, в кишке, костях, почках, лимфатических узлах и коже.
Кох исследовал не только ткани больных туберкулезом людей, но и животных, спонтанно заразившихся и искусственно зараженных, и во всех случаях он обнаружил одного и того же возбудителя — микобактерию туберкулеза. Кох поставил перед собой задачу: выделить микобактерии из тканей, размножить их в культуре и, введя здоровому животному, вызвать у него типичную картину, туберкулеза. Кох разработал плотную питательную среду для культивирования микобактерии. Ее получали из сыворотки или цельной крови животных, подвергнутой термической обработке (+58°С в течение 1 ч на протяжении шести последовательных дней, затем +65°С в течение нескольких часов). Частицу пораженной туберкулезом ткани с помощью прокаленной на огне платиновой петли переносили на поверхность среды и помещали чашку со средой в термостат для выращивания при температуре 37-38°С. В результате из отдельных возбудителей возникали колонии, содержавшие только микобактерии туберкулеза (чистая культура). Частицы выращенной культуры вводили животным подкожно, внутривенно, внутрибрюшинно или в переднюю камеру глаза и в каждом случае получали типичную картину туберкулеза.
Доклад, сделанный Кохом на Берлинском физиологическом обществе 24 марта 1882 года, занимает лишь две печатных страницы и все же содержит доказательства открытия микобактерии туберкулеза и описание ее главных характеристик. В нем изложена методика окрашивания микобактерии в тканях и ее постоянное присутствие в туберкулезном процессе, упомянута методика создания чистых культур и дана информация о типичных и положительных результатах прививания микобактерии животным. Было также подчеркнуто, что возбудитель может передаваться с мокротой больного.
В 1890 году Кох объявил о выделении вещества, с помощью которого можно было контролировать рост микобактерии туберкулеза in vitro (в пробирке) и in vivo (в организме больного) [1]. Это был туберкулин — глицериновый экстракт чистой культуры микобактерии туберкулеза. Для лечения туберкулеза он оказался непригоден, зато был ценен, как диагностическое средство: его внутрикожное введение вызывало иммунную реакцию: в месте введения проявлялась воспалительная реакция, по величине которой можно было судить о наличии или отсутствии микобактерии в организме. Это позволило выявлять скрытые формы туберкулеза.
Кроме достижений в понимании природы туберкулеза, Кох еще и определил стратегию дальнейших исследований: бороться с заразными болезнями можно, только определив специфического возбудителя каждой из них.
Эрлих (Нобелевская премия 1908 года) и Ф. Циль усовершенствовали методики окраски тканей, что позволило ускорить диагностику туберкулеза. Прежние понятия «верхушечная пневмония» и «верхушечный катар» исчезли из медицинской литературы. Появилась возможность пробовать предлагаемые против туберкулеза лекарства сначала in vitro и только после этого in vivo. Работы Коха по туберкулину послужили отправной точкой для создания Берингом (Нобелевская премия 1901 года) антидифтерийной сыворотки.
Кох основал лабораторную бактериологию, создав методы выращивания чистых культур. Он сформулировал действующие до сих пор критерии для определения связи между конкретным микроорганизмом и инфекционной болезнью (постулаты Коха).
Глава 3. 1908 Илья Ильич Мечников (1845-1916) и Пауль Эрлих (1854-1915)
Формулировка нобелевского комитета: «в знак признания работ по иммунитету» И.И. Мечников.
В начале 1880-х годов Мечников в Мессине, Италия, отправив семью смотреть цирковое представление, спокойно рассматривал под микроскопом прозрачную личинку морской звезды. Он увидел, как подвижные клетки окружают инородную частицу, попавшую в тело личинки. Явление поглощения наблюдали и до Мечникова, но было принято считать, что это — просто подготовка к транспорту частиц кровью. Неожиданно у Мечникова возникло предположение: а что если это — механизм не транспорта, а защиты? Мечников тотчас же ввел в тело личинки кусочки шипов мандаринового дерева, которое он приготовил вместо новогодней елки для своих детей. Подвижные клетки вновь окружили чужеродные тела и поглотили их.
Если подвижные клетки личинки, думал он, защищают организм, они должны поглощать и бактерии. И это предположение подтвердилось. Мечников прежде не раз наблюдал, как белые клетки крови — лейкоциты, так же собираются вокруг проникшей в организм инородной частицы, формируя очаг воспаления. Кроме того, после многих лет работы в области сравнительной эмбриологии он знал, что эти подвижные клетки в теле личинки и лейкоциты человека происходят из одного зародышевого листка — мезодермы. Получалось, что у всех организмов обладающих кровью или ее предшественником — гемолимфой, есть единый механизм зашиты — поглощение инородных частиц клетками крови. Так был открыт фундаментальный механизм, с помощью которого организм защищает себя от проникновения в него чужеродных веществ и микробов. По предложению профессора Клауса из Вены, которому Мечников рассказал о своем открытии, клетки-защитники были названы фагоцитами (от греч. phagein — пожирать и kytos — клетка), а само явление — фагоцитозом. Механизм фагоцитоза был подтвержден в организме человека и высших животных. Лейкоциты человека окружают проникшие в организм микробы и, подобно амебам, образуют выпячивания, охватывают со всех сторон инородную частицу и переваривают ее.
продолжение --PAGE_BREAK--Пауль Эрлих
Начав с работы с дифтерийным токсином в Институте инфекционных болезней. Эрлих создал теорию гуморального иммунитета (по его терминологии — теорию боковых цепей). Согласно ей, микробы или токсины содержат в себе структурные единицы — антигены, которые вызывают в организме образование аптител — особых белков класса глобулинов. Антитела обладают стереоспецифичностью, то есть конформацией, позволяющей им связывать только те антигены, в ответ на проникновение которых они возникли. Так Эрлих подчинил взаимодействие аптиген-антитело законам стереохимии. Вначале антитела существуют в виде особых химических групп (боковых цепей) на поверхности клеток (фиксированные рецепторы), затем часть их отделяется от поверхности клетки и начинает циркулировать с кровью (свободно перерешающиеся рецепторы). Встречаясь с микробами или токсинами, антитела связываются с ними, обездвиживают их и предупреждают их действие на организм. Эрлих показал, что отравляющее действие токсина и его способность связываться с антитоксином — это разные функции и на них можно воздействовать раздельно. Повысить концентрацию антител можно было повторными введениями антигена — так Эрлих решил беспокоившую Беринга проблему получения высокоэффективных сывороток. Эрлих ввел различие между пассивным иммунитетом (введение готовых антител) и активным иммунитетом (введение антигенов для стимуляции собственного антителообразования). Исследуя растительный яд рицин, Эрлих показал, что антитела появляются не сразу после введения в кровь антигена. Он первым изучал передачу части иммунных свойств от матери к плоду через плаценту и к младенцу — с молоком.
Открытие Мечникова далеко не сразу получило признание ученого сообщества. Его поддерживали главным образом его же ученики и мало кто из посторонних. Намного большей популярностью пользовалась теория иммунитета, предложенная Эрлихом. Между Мечниковым и Эрлихом возникла долгая и упорная дискуссия в печати об «истинной теории иммунитета». Наиболее сильный удар по позициям Мечникова нанесла весть об открытии Берингом и Китасато в: 1890 году гуморальной (то есть обусловленной антителами) природы иммунитета к дифтерии. Борде (Нобелевская премия 1919 года), ученик Мечникова, невольно повредил учителю, описав лизис (разрушение и растворение) бактерий и эритроцитов антителами и неким термолабильным (нестойким к высоким температурам) фактором, содержащимся в крови. Эрлих и Моргенрот продолжили изучение этого фактора и назвали его комплементом (лат. complementum — дополнение, добавление). Фагоцитоз Мечникова здесь вроде бы был непричем. Казалось, идея «гуморализма» окончательно победила.
Мечников ответил простым опытом: возбудители сибирской язвы, помещенные в маленький бумажный мешочек, свободно пропускавший растворимые антитела и не пропускавший клетки-фагоциты, сохраняли свою вирулентность (способность вызывать заражение). Мечников изложил свои взгляды в вышедшей в 1901 году книге «Иммунитет к инфекционным болезням», но скептиков и она не убедила.
Долгая полемика между Мечниковым и Эрлихом не принесла победы ни одному из них. В начале XX века Альмрот Эдвард Райт (1861-1947) и С. Р. Дуглас в бактериологическом отделении лондонской больницы Св. Марии отрыли существование антител, облегчающих фагоцитоз, которым Райт — большой ценитель классической словесности — дал название опсонинов (греч. opsoniazo — снабжать пищей).
Накал страстей и интерес широкой публики к спору были так велики, что Бернард Шоу посвятил этой теме пьесу «Врач на распутье», где герои рассуждают о фагоцитах и опсонинах. Открытие Райта и Дугласа позволило, наконец, свести взгляды обеих школ в единую теорию иммунитета. Фагоцитоз получил название клеточного, а антителообразование — гуморального иммунитета. Мечников и Эрлих разделили в 1908 году Нобелевскую премию [2].
Признание научным сообществом теории фагоцитоза опосредованно привлекло внимание к той области науки, из которой эта теория вышла, — к эволюционной эмбриологии, одним из создателей которой по праву является Илья Ильич Мечников.
Глава 4. 1913 Шарль Робер Рише (1850-1935)
Формулировка нобелевского комитета:
«…за открытие того, что повторное введение в организм животного и человека чужеродных белков и некоторых других веществ приводит к повышению чувствительности к ним, и что при повторном контакте с тем же веществом может возникнуть анафилактический шок – тяжелая реакция всего организма, часто ведущая к смерти. Таким образом, было показано, что защитные иммунные механизмы могут вызывать болезнь».
Рише скромно утверждал, что его открытие было результатом не глубокого осмысления, но «простого наблюдения, почти случайного». «У меня нет другой заслуги, кроме той, что я не отказался увидеть факты, которые сами предстали передо мною совершенно очевидным образом, — говорил он в своей Нобелевской лекции. — В экваториальных морях можно встретить кишечнополостных животных, называемых Physalia, известных также как «португальский кораблик». Эти животные в принципе состоят из мешка, наполненного воздухом, что позволяет им плавать подобно кожаному меху. С этим мешком соединена полость, украшенная очень длинными филаментами, в воде висящими вниз. Эти филаменты, иногда в 2-3 м длиной, вооружены маленькими выростами, которые прилипают, как присоски, к встречаемым ими предметам. А во внутренней части этих бесчисленных присосок есть маленькое острое жало, которое вонзается в прикоснувшееся к ним чужеродное тело так, что контакт с филаментами физалии равноценен множественным инъекциям яда.»
Далее Рише рассказывал, как он, путешествуя по Средиземному морю на яхте Альбера, князя Монако, получил от него и двоих общих друзей Жоржа Ришара и Поля Портье совет: изучить яд физалии. Этот яд хорошо растворялся в глицерине и введение такого раствора вызывало симптомы отравления ядом физалии. Вернувшись в Париж, и не имея возможности работать с физалиями, Рише переключился на исследование актиний (Actiniae), которых было в избытке, так как они обитают в водах европейских побережий.
Экстракт щупалец актинии тоже оказался токсичным. Рише и Портье попытались определить токсическую дозу. Это было трудным делом, так как яд действовал медленно, и надо было ждать 3-4 дня, чтобы определить, была ли доза смертельной. Требовались 1 кг глицерина и 1 кг щупалец, чтобы получить (после фильтрования) жидкость, вызывающую смерть лабораторного животного в дозе 0,1 мл на 1 кг живого веса.
Что будет, если некто примет умеренную дозу яда и через несколько дней, восстановив свои силы полностью, вновь примет ту же дозу того же яда? — Такой вопрос задал себе Рише и предположил два возможных ответа. Первый и самый простой: ничто не изменится в организме и яд вызовет тот же эффект. Второй: произойдет некоторое привыкание, организм станет менее чувствительным или нечувствительным вовсе. Оба варианта развития событий были известны задолго до работ Рише. А потом случилось совершенно непредвиденное: у собаки, получившей ранее несмертельную инъекцию яда, после получения во второй раз чрезвычайно низкой дозы (5 мкл), немедленно проявились признаки острого отравления: рвота, кровавый понос, резкое нарушение сердечного ритма, потеря сознания, удушье и смерть. Так Рише впервые обнаружил существование третьего варианта развития событий — повышение чувствительности организма к яду. Для обозначения этого явления он в 1902 году предложил термин анафилаксия (от греч. ana — усиление действия и phylaxis — защита).
Повторяя в разных вариантах этот опыт, Рише и Портье выяснили три главных факта, касающихся анафилаксии: (1) животное, прежде получавшее яд, намного более чувствительно к нему при повторном введении, чем контрольное (интактное) животное; (2) повторная инъекция вызывает быстрое и полное угнетение нервной системы, симптомы которого совершенно отличны от имевших место после первого введения; (3) состояние анафилаксии вырабатывается за 3-4 недели (инкубационный период). Таким образом, то, что ранее считалось странным курьезом, Рише превратил в принцип общебиологического значения. Он также увидел, что анафилаксия не является простым усилением первоначальных симптомов, но имеет свои собственные признаки.
После того, как основные факты, касающиеся анафилаксии, были твердо установлены, другие ученые расширили поле исследований. В 1903 году французский физиолог Николя Морис Артюс в Лозанне показал, что если кролику вводить сыворотку крови, то первая инъекция является анафилактогенной, то есть через три недели кролик становится чрезвычайно чувствительным ко второй инъекции сыворотки. Он наблюдал в месте введения локальное воспаление, которое с тех пор называется реакцией Артюса. Так понимание анафилаксии было расширено от реакции на белок-токсин до всех белков, в том числе и тех, которые при первом введении токсичными не были.
В 1905 году американцы Розенау и Андерсон сообщили, что после того, как анафилаксия была выработана инъекциями молока, сыворотки крови, яичного белка или мясного экстракта, она при повторном введении проявлялась даже при столь малых дозах как 10 нл раствора. Они также установили специфичность этой реакции и показали, что из всех лабораторных животных наиболее чувствительна к анафилаксии морская свинка.
В 1907 году Рише провел эксперимент с целью выяснения патогенеза (механизма развития) анафилаксии: он ввел кровь животного, у которого уже была выработана анафилаксия, интактному животному и наблюдал развитие у него анафилаксии. Из этого следовало, что анафилактический токсин — вещество, содержащееся в крови [1].
Рише также разработал диагностические тесты для выявления повышенной чувствительности к различным веществам.
Значение открытия Рише для биологии и медицины огромно. Он первым показал, что защитные иммунные механизмы могут вызывать развитие болезни, притом смертельной. Например, анафилактический шок иногда возникал после введения противодифтерийной сыворотки, разработанной Берингом. Иногда причиной шока было введение лошадиной сыворотки для иммунизации против столбнячного токсина, и даже укусы пчел или инъекция пенициллина.
Ученик Мечникова Александр Михайлович Безредка (1870-1940) разработал метод десенситизации (лат. de — снижение и sensitivus — чувствительный) или десенсибилизации (лат. de и sensibitis — чувствительный) — профилактики анафилактического шока путем введения сверхмалых и постепенно повышающихся доз сыворотки.
Глава 5. 1919 Жюль Борде (1870-1961)
Формулировка нобелевского комитета: «за открытия, касающиеся иммунитета».
В 1895 году Борде сумел осуществить реакцию бактериолиза в пробирке. Сыворотка животных, перенесших холеру, вызывала бактериолиз холерного вибриона (возбудителя холеры). Из этого Борде сделал вывод, что иммунитет переболевших животных обусловлен присутствием в их крови двух веществ, из которых одно термостабильно (не теряет активности при нагревании), другое, наоборот, термолабильно (инактивируется нагреванием). Борде назвал первое «сенситизатором» (лат. sensitivus — чувствительный), второе «алексином» (от греч. alexo — защищать). Позднее по предложению Эрлиха сенситизатор называли «амбоцептором», сейчас его название – антитело. Алексин по предложению того же Эрлиха и Моргенрота превратился в комплемент (лат. соmрlеmеntum — дополнение), под этим названием он известен и сейчас. Нагреванием сывороток интактных и иммунизированных животных и введением их в различных сочетаниях другим животным, а также многочисленными опытами in vitro Борде установил, что комплемент содержится в сыворотке крови всех животных — иммунизированных и интактных, а антитела, наоборот, появляются только при иммунизации (через некоторое время после введения их в организм). Он также показал, что гемагглютинация и гемолиз (склеивание и разрушение эритроцитов при переливании крови) происходят по тому же механизму, что и бактериолиз [1].
Борде предложил метод определения антигенов. Суть его состоит в том, что введением известного антигена в кровь лабораторного животного вызывают образование в его организме антител. Затем сыворотку крови этого иммунизированного животного смешивают in vitro с кровью или другой исследуемой жидкостью тела, Если появляются характерные признаки реакции «антиген-антитело», например, преципитация (выпадение в осадок), делают вывод о присутствии в исследуемой жидкости данного антигена.
В 1900-е годы Борде разрабатывал и совершенствовал методы определения антигенов. Его многолетним помощником был муж сестры бактериолог Октав Жангу. В 1902 году Жангу продемонстрировал связывание комплемента с антителами, выработанными в ответ на инъекции молока.
Борде и Жангу разработали также непрямой тест гемагглютинации, в котором эритроциты используются в качество переносчиков чужеродного антигена, а затем агглютинируются соответствующими антителами и комплементом. Новые методы позволили Борде и Жангу идентифицировать палочку коклюша, которая в честь авторов получила название бактерии Борде — Жангу, или Bordetella pertussis. Продолжая исследования коклюша, Борде в 1910 году обнаружил антигенную вариабельность бактерий. Это явление имеет важное значение для медицины, так как некоторые патогенные микробы, меняя свою антигенную структуру, приобретают устойчивость к вакцинам.
продолжение --PAGE_BREAK--Борде впервые указал на роль ионов кальция и фермента тромбина в свертывании крови. По окончании Первой мировой войны Борде занялся проблемой взаимодействия между бактериями и поражающими их вирусами — бактериофагами. Он впервые показал наследование бактериальными клетками лизогении — способности вызывать разрушение клеток. Изучение бактериофагов и лизогении стало ключом к великим открытиям генетики в середине XX века.
Используя метод связывания комплемента, предложенный Борде в 1906 году немецкий иммунолог Август Вассерман и его коллеги сделали сразу несколько важных открытий. Во-первых, обнаружили антисифилитические антитела в крови обезьян, зараженных сифилисом. Во-вторых, нашли такие же антитела в цереброспинальной жидкости больных tabes dorsales (сухоткой спинного мозга) и тем самым доказали, что эта страшная болезнь является одной из форм сифилиса. В-третьих, продемонстрировали наличие этих антител в крови больных сифилисом. С тех пор реакция Вассермана остается одним из самых распространенных тестов в венерологии.
Реакция связывания комплемента была также применена для диагностики сапа.
Глава 6. 1930 Карл Ландштейнер (1868-1943)
Формулировка нобелевского комитета: «за открытие групп крови человека».
В 1900 году Ландштейнер и Самуэл Шатток, работая независимо, сообщили о несовместимости разных типов человеческой крови. Заслуга Ландштейнера состояла в том, что именно он понял, что агглютинация эритроцитов, происходящая при переливании крови, не патологическое, а нормальное явление [1]. Уже в следующем (1901) году он предложил относить кровь каждого человека к одной из трех групп: А, В или С. (Группа С позднее была переименована в «группу 0».) Различие между группами состояло в том, какие антигены (сложные белки, активирующие иммунную систему) имелись на поверхности эритроцитов данного человека. Эритроциты группы А несли антиген А, эритроциты группы В- антиген В, эритроциты группы 0 не содержали ни того, ни другого антигена. Не менее важным было то, что в крови большинства людей изначально содержатся готовые антитела к антигенам А и В чужих эритроцитов. Поэтому, если перелить человеку кровь иной группы, чем его собственная, возможна встреча антител с соответствующими им антигенами, реакция между ними и как результат — склеивание эритроцитов. Агглютинированные эритроциты закупоривают капилляры и тем самым нарушают кровоток в жизненно важных органах, прежде всего в почках, от чего человек может погибнуть.
В 1902 году сотрудник Ландштейнера А. Штурли вместе с А. фон Декастелло существенно уточнили схему, добавив к ней еще одну группу крови — АВ (эритроциты ее обладателей содержат оба антигена). То же сделал в 1907 году чех Ян Янский.
В течение нескольких лет было предложено два усовершенствования, которые сделали переливание крови практически выполнимым. Во-первых, был создан способ определения групп крови. Во-вторых, обнаружено, что цитрат натрия препятствует свертыванию крови, что позволило хранить донорскую кровь в течение хотя бы непродолжительного времени, а не переливать ее непосредственно от донора реципиенту. Первая мировая война показала, насколько своевременным было открытие Ландштейнера, хотя мощные службы переливания крови были созданы по всему миру позднее. Переливание крови сделало возможными операции на сердце, крупных сосудах, легких. Хирургия в целом смогла перейти к более продолжительным и сложным операциям. Периодическое переливание донорской крови — обязательный компонент лечения анемий, лейкемий и многих других болезней крови и иммунной системы.
Кровь рассматривают, как жидкую ткань. Переливание крови — строго говоря, первая успешная пересадка ткани от одного человека к другому. За ней последовали пересадки все более сложных и крупных органов вплоть до трансплантации сердца и даже комплекса «сердце-легкие».
Открытие Ландштейнера имело и другие, но началу неожиданные, последствия; для судебной медицины стало громадным подспорьем определение групповой принадлежности следов крови, находимых на месте преступления.
В 1910 году Эмиль фон Дунгерн высказал предположение о наследовании групп крови, в 1924-1925 годах математик Ф. Бернштейн проверил эту идею, и она утвердилась среди ученых. Теперь, сравнив группы крови ребенка и предполагаемого отца, можно было прийти к одному из двух заключений: «X может быть отцом У» или «Х не может быть отцом У». (Однако, утверждать«X, является отцом У» на основе сравнения групп крови нельзя. Это стало возможным лишь в последние десятилетия XX века в результате развития методов сравнения ДНК, пока еще сложных и очень дорогих.) Выяснилось, что АВО — не единственная система групп крови человека. Сам. Ландштейнер в 1927 году обнаружил антигены M и N, а в 1940-м он вместе с Александром Соломоном Винером и Ф. А. Т. Левином описал еще один белок эритроцитов, названный резус-фактором (Rh). Вскоре удалось объяснить многие случаи гемолитической желтухи новорожденных. Если кровь плода содержит резус-белок, а кровь матери — нет, то те небольшие количества белков крови плода, которые проникают сквозь плацентарный барьер в кровоток матери, оказываются достаточными для активации ее иммунной системы. Материнский организм вырабатывает средства защиты от чужеродного белка и они разрушают плод. Прежде такие дети почти всегда погибали, теперь их стали спасать с помощью полного (заместительного) переливай крови. Беременность «Rh-отрицательной» женщины от «Rh-положительного» мужчины стала предметом особой заботы врачей.
В 1937 году У. Бонд и Л. Дж. Бонд обнаружили антиген А и В в тканях мумий. Позднее такие методы были использованы для анализа миграции древних народов. Антропологи получили возможность, сравнивая распространенность различных групп крови среди населения разных стран, судить о перемещениях народов, происходивших в доисторические времена.
В 1950-1960-е годы количество антигенов, открытых в крови нарастало лавинообразно. Были описаны системы Кид, Даффи, Келл-Келдано, Льюис, Лютеран и многие другие. Однако все они, включая МN и Rh имели одно весьма существенное отличие от системы АВО только к антигенам А и В в крови здорового человека могли изначально присутствовать антитела. Поэтому переливание крови без учета групповой принадлежности в системе АВО часто приводило к тяжелым осложнениям фазу же, в момент трансфузии. Игнорирование всех прочих факторов при первом переливании никак не проявлялось, антитела к чужеродным белкам должны были накопиться в крови реципиента в течение нескольких месяцев. Только повторное переливание той же иногруппной крови могло закончиться трагически.
Возможность многократно производить массивные переливания крови во время хирургических операций позволила создать в 1960-е годы аппараты искусственного кровообращения, заменявшие на время операции сердце и легкие пациента. Стали проводить операции на «сухом» сердце.
Отрицательные последствия увлечения переливаниями крови появились позднее. Даже при постоянном и строгом контроле время от времени переливают кровь, зараженную вирусами гепатитов, СПИДа, реже — возбудителем сифилиса. Это послужило одной из причин разработки искусственных кровезамещающих жидкостей.
Глава 7. 1951 Макс Тэйлер (1899-1972)
Формулировка нобелевского комитета: «за открытия, касающиеся желтой лихорадки и способов борьбы с ней».
В 1930 году Тейлер сообщил, что желтую лихорадку можно привить и белым мышам, если вводить возбудителей непосредственно в мозг животных (введение в другие органы заболевания у мышей не вызывало) [1].
В следующем году Тейлер доказал, что мыши, которым привили желтую лихорадку введением сыворотки больных людей или обезьян, приобретают устойчивость к возбудителю. Тейлер также установил, что возбудитель, перевитый от одной мыши к другой, становится настолько ослабленным, что им уже можно прививать обезьян, делая их, таким образом, невосприимчивыми к болезни. Тейлер использовал для этого вирулентный (заразный) для макак-резусов штамм вируса, выделенный в Дакаре, Французская Западная Африка, Мати, Селляром и Легре. В результате прививки у мышей развивался энцефаломиелит (воспаление головного и спинного мозга). Селляр, Ллойд и Пенна показали, что этот вирус обладает выраженной нейротропностью, то есть поражает только нервную систему, но не затрагивает внутренние органы животного. Успешная проверка прививки па людях была произведена Селляром и Летре в 1932 году. Разработанная ими вакцина получила название французской.
Эта вакцина все еще считалась небезопасной для людей, что привело Тейлера и его сотрудников Ллойда, Смита и Риччи к попытке создать более безопасную вакцину. После 89-го пассажа вируса Asibi они получили мутантный штамм, названный штаммом 17D. Eго нейротропность была значительно ниже: при введении в мозг обезьян он вызывал менее тяжелые формы энцефалита, не приводящие, как правило, к смерти животных.
Тейлер также создал тест на наличие иммунитета к желтой лихорадке: сыворотку крови исследуемого человека вводили мышам, и после -этого их заражали вирусом. Отсутствие заражения свидетельствовало о наличии в крови человека антител к возбудителю.
Вакцину 17D в течение трех лет (1937-1940) испытывали в Бразилии. Рокфеллеровский институт разослал миллионы доз вакцины, которой было привито более 100 млн. человек.
Пельтье с сотрудниками в 1939 году разработали методику прививания желтой лихорадки путем скарификации (небольшого надреза) кожи, то есть так же, как это делали уже давно, прививая оспу. Это существенно упростило массовую вакцинацию, что позволило французам подвергнуть ей в своих африканских колониях 20 млн. человек без каких-либо серьезных осложнений.
Сойер, Китчен и Ллойд разработали методику иммунизации для всех, работающих с вирусом желтой лихорадки, после чего случаи заражения в лабораториях прекратились.
Желтая лихорадка из-за своей высокой контагиозности (заразности) и частоте смертельных исходов была отнесена (наравне с чумой и оспой) к числу особо опасных инфекций.
Всемирная организация здравоохранения разработала правила обязательной вакцинации пассажиров, путешествующих через страны, где распространена желтая лихорадка. Открытие Тейлора позволило ускорить освоение тропических территорий. Непривитые лица, побывавшие в районе эпидемии желтой лихорадки, подвергаются строгому карантину. Открытие Тейлера позволило держать под контролем распространение этой болезни, спасло жизнь и сохранило здоровье многим миллионам людей. Представляя лауреата, председатель Нобелевского комитета профессор X. Бергстра сказал, что хотя идея, положенная в основу работы Тейлера, известна чуть ли не со времен Дженнера, открытие Тейлера дает надежду на обуздание, других вирусных инфекций, и потому Тейлер оказал услугу человечеству, что сделал именно то, что Альфред Нобель определил в качестве критерия для награждения премией его имени.
Именем Тейлера назван эпидемический вирусный энцефаломиелит мышей, вспышка которого в лаборатории может полностью уничтожить всех лабораторных мышей — болеть Тейлера. Имя Тейлера сохранилось также в названии «вируса Тейлера, вызывающего эту болезнь.
Глава 8. 1957 Даниель Бове (1907)
Формулировка нобелевского комитета: «за открытия, касающиеся синтетических соединений, которые подавляют действия некоторых веществ организма и особенно их действие на сосудистую систему и скелетные мышцы».
Разработка фармакологических средств, действующих на передачу возбуждения в синапсах автономной (вегетативной) нервной системы, которая регулирует работу главным образом внутренних органов, была начата в парижской лаборатории учителя Бове химика Эрнеста Фурно. Именно на этом направлении Бове решил применить увлекшую его идею конкурентных отношений между физиологическими регуляторами и их аналогами — потенциальными лекарствами. Ему удалось синтезирован, вещества, структурно подобные важнейшим эндогенным регуляторам — нейротрансмиттерам ацетилхолину и норадреналину, гормону адреналину, а также к местному гормону серотонину. Новые вещества действовали как конкуренты или блокаторы эндогенных регуляторов. В этих работах, проводившихся в Высшем институте здоровья в Италии, участвовали, кроме самого Вове, химики Марини-Беттоло и Чиаварелли, также фармакологи Филомена Нитти, Лонго и Гварино. Они выявили некоторое структурное сходство между молекулами адреналина и некоторых вызывающих те же эфекты симпатомиметиков таких как амфетамин, с одной стороны и алкалоидами спорыньи, например, амидом лизергиновой кислоты, с другой. У некоторых производных алкалоидов спорыньи было обнаружено, наоборот, симпатолитическо, например, сосудорасширяющее действие. Это навело Бове и его коллег на мысль о возможности синтезирования ряда структурно родственных веществ, в которых симпатомиметические свойства постепенно снижались бы, а симпатолитические — также постепенно увеличивались, что и было сделано.
продолжение --PAGE_BREAK--Бове и его коллеги синтезировали более 400 курареподобных веществ и создали препарат галламин (коммерческое название — флакседил).
Поиски антагонистов еще одного местного гормона гистамина были начатые лаборатории Фурно в 1937 году. Первый активный препарат, антегран, был получен в 1939 году. Его антиаллергическое действие отвечало запросам медицины и сразу же сделало разработку данного направления в высшей степени перспективным.
Бове считал, что антигистаминные средства могут быть найдены среди веществ, сходных по структуре либо с симпатолитиками, либо с симпатолитиками и парасимпатолитиками одновременно, либо, наконец, с самим гистамином. Оправдались все три предположения [1].
Бове говорил, что примененный им подход дал фармакологам в руки нить Ариадны и избавил их «от блужданий в лабиринте физиологических эффектов и химических структур».
Бове инициировал создание антагонистов биогенных аминов, которые стали важнейшими средствами лечения гипертензии, нервных и психических расстройств а также множества других нарушений гуморальной и нервной регуляции. Например, холинолитики были применены для снятия колик (болезненных спазмов гладких мышц) внутренних органов, расширения зрачка для подробного исследования дефектов зрения и мн. др.
После первых успехов Бове и его коллег разработкой антигистаминных препаратов занялось сразу несколько исследовательских групп. Вскоре к ним присоединились еще 500 химиков, которые в совокупности менее чем за 10 лет синтезировали примерно 5000 антигистаминных препаратов.
Антигистаминные средства широко применяются для лечения аллергий, например, астмы и сенной лихорадки. Производные фенотиазина, первоначально синтезированные в качестве антигистаминных средств, позднее применялись при лечении болезни Паркинсона и шизофрении.
Глава 9. 1960 Френк Макфалейн Бернет (1899-1985) и Питер Брайн Медавар (1915-1987)
Формулировка нобелевского комитета: «за открытие приобретенной иммунологической толерантности».
Френк Макфалейн Бернет
Вклад Бёрнета был результатом, главным образом, его теоретических разработок. Он первым обратил внимание на то, что организм каждого позвоночного животного обладает способностью отличать собственные ткани от чужих и именно поэтому он не отвечает иммунной реакцией на антигены собственного тела. С точки зрения Бёрнета выработка искусственной иммунологической толерантности в опытах Оуэна являлась простым расширением «списка собственных антигенов организма» путем внесения в нее информации о чужих антигенах.
Белок или другая макромолекула несет антигенную информацию потому, что содержит в своем составе химические конфигурации (антигенные детерминанты), отличные от любых конфигураций в аналогичных молекулах другого организма. Были получены данные о том, что каждая антигенная детерминанта, подобно активному центру антитела, имеет маленькую площадь (примерно 1 — 2 нм²) и, чтобы быть активной, она должна быть частью соответствующей молекулы-носителя. На поверхности молекулы могло находиться несколько сотен паттернов, образованных узлами из 3-5 аминокислотных остатков, и каждый из них мог бы играть роль детерминанты. Большая часть потенциальных детерминант донора не отличается от таковых хозяина и потому — инертна.
Сенгер — (Нобелевская премия по химии за 1958 и 1980 годы) обнаружил, что молекулы инсулина у разных видов позвоночных различаются тремя аминокислотными остатками. Поскольку введение бычьего инсулина человеку вызывает у него иммунную реакцию. Бернет предположил, что антигенная информация должна быть сосредоточена в очень небольшой части молекулы.
Где же хранилась эта информация? Ерне (Нобелевская премия 1984 года) преполагал, что в глобулинах (белках плазмы крови). Вернет и Д. У. Толмэдж предпочитали видеть хранителей памяти в лимфоидных клетках (некоторых белых клетках крови и родственных им образованиях). Предполагалось также существование клеточных рецепторов, способных, подобно антителам, связываться с антигенной детерминантой и в результате активировать иммунную реакцию. Количество и доступность таких рецепторов определяли силу иммунной реакции.
Бёрнет создал методику выращивания вирусов in vitro на клетках куриных эмбрионов, которая была лучшей до тех пор, пока Эндерс (Нобелевская премия 1954 года) не предложил свою. Опыты Бёрнета с выращиванием вирусов в клетках куриных эмбрионов показали, что эти клетки не вырабатывают антител против вирусов, из чего он сделал вывод о том, что условием возникновения иммунологической толерантности является встреча иммунной системы с антигеном на ранней стадии развития организма [1].
Достижения Бёрнета окончательно опровергли инструктивную интерпретацию теории иммунитета и утвердили торжество селекционной интерпретации.
Питер Брайн Медавар
Вклад Медавара заключался в получении им ценнейших экспериментальных данных. Через несколько лет после Оуэна Медавар и Руперт Э. Биллинхем изучали телят — дизиготных близнецов, то есть близнецов, родившихся из двух оплодотворенных яйцеклеток и потому обладающих неодинаковыми наборами генетической информации. При этом они вовсе не стремились открыть один из основных законов иммунологии, а просто выполняли задание Г. П. Дональда — разработать методику, с помощью которой можно было бы надежно отличать дизиготных близнецов от монозиготных, (то есть родившим из одного оплодотворенного яйца). Медавар и Биллингэм пересаживали лоскуты кожи от одного теленка-близнеца другому и обнаружили, что у большей части близнецов трансплантаты (пересаживаемые ткани) прекрасно приживаются. Это происходило и у моно-, и у дизиготных пар, так что Медавар и Биллингэм задания не выполнили — теста не создали. Зато они заметили очевидную аналогию с феноменом Оуэна и сделали то, что отличает великое открытие от результатов рутинной исследовательской работы: они поняли, что открыли способ сделать так, чтобы взрослое животное (называемое хозяином) принимало без отторжения трансплантат от другого животного (донора), принадлежащего к тому же биологическому виду, Для этого сразу же после рождения хозяина надо пересадить ему небольшой фрагмент ткани донора, и в результате в течение всей своей жизни хозяин будет способен принимать от донора любые трансплантаты как свои собственные ткани, без реакции отторжения. Элемент везения здесь тоже присутствовал: химеризм чаще встречается у крупного рогатого скота, чем, например, у овец.
На основании результатов своих исследований на мышах Медавар сформулировал следующие выводы:
1. После пересадки адаптация происходит не в трансплантате, а в организме хозяина, так антигенные свойства трансплантата сохраняются. Клетки-потомки клеток трансплантата при введении их интактному взрослому животному вызывают иммунную реакцию.
2. Состояние иммунологической толерантности, то есть способности принимать; трансплантат без отторжения, специфично: хозяин, толерантный к трансплантатам от донора, по-прежнему отторгает трансплантаты от всех других доноров.
3. Толерантность неизбирательна: хозяин, принявший один трансплантат от донора, примет от него и все другие трансплантаты. Таким образом, разные ткани одного
организма не различаются антигенами, определяющими реакцию отторжения.
Однажды выработанную иммунологическую толерантность можно и ликвидировать. Для поддержания полной толерантности антигены трансплантата должны постоянно присутствовать в организме хозяина, хотя бы в крайне низких количествах.
Толерантность градуальна, то есть не подчиняется правилу «все или ничего». Можно получить любую степень от ослабленного иммунного ответа до полной толерантности.
Все указывало на то, что изменения, приводящие к толерантности, происходят не на периферическом уровне, но в центральном механизме иммунной защиты.
Медавар, Биллингзм и Лесли Брент опубликовали результаты своих экспериментов в 1953 году и, таким образом, подтвердили теоретические построения Бёрнета. Примерно в то же время дополнительное подтверждение было получено Н. Гашеком в Чехословакии, хотя он и исходил из неверных теоретических предпосылок. Бёрнет и Ф. И. Феннер включили феномен толерантности в новую теорию иммунологии.
Глава 10. 1972 Родни Р. Портер (1917-1985) и Джеральд М.Эдельман (1929)
Формулировка нобелевского комитета: «за открытия, касающиеся химической структуры антител».
Портер поставил себе задачу найти те части молекулы, которые ответственны за способность антитела специфически связываться именно с тем антигеном, против которого они выработаны. Он нашел, что это действительно могло быть сделано при помощи протеолитического (расщепляющего белки) фермента папаина. По некоторым причинам у него была уверенность, что антитело должно иметь два идентичных сайта связывания. Расщепив молекулу антитела, Портер получил два одинаковых малых Fab-фрагмента и один непарный большой Fc-фрагмент. Портер обнаружил, что Fab-фрагменты сохраняют способность связывания с антигеном, а Fc-фрагмент таким свойством не обладает. Поначалу Портер считал, что молекула антитела представляет собой линейную цепочку из примерно 1300 аминокислотных остатков.
Эдельман исходил из предположения, что если уж молекула инсулина, имеющая в своем составе только 51 аминокислотный остаток, состоит из двух цепей, то
антитело, молекулярная масса которого на десятки раз больше, должно состоять из нескольких полипептидных цепей, скрепленных скорее всего дисульфидными мостиками. Поскольку эти последние связи довольно слабы, Эдельман испробовал методы, способные их разорвать. В 1961 году Эдеяьман и М. Пулик сообщили, что им удалось разделить молекулу на отдельные полипептидные цепи: две «легкие» (L) и две (в два раза более длинные) «тяжелые» (H) цепи. Ни одна цепей не обладала специфической способностью связываться с антигеном.
Портер объединил эти данные с результатами собственных исследований и 1962 году объявил о создании модели молекулы антитела, которая с тех пор стала общепринятой. Согласно Портеру, молекула антитела (иммуноглобулина класса G) имеет вид буквы Y. Каждая из двух ветвей сформирована одной легкой цепью передней частью тяжелой цепи, а стебель образован задними частями тяже, цепей. Различные цепи залегают бок о бок, скрепляемые дисульфидными связями. Таким образом, способность к специфическому связыванию, свойственная кончикам ветвей, основана на взаимодействий между свободными концами легкой и тяжелой цепей, каждая из которых сама по себе неактивна.
Портер и Эдельман объединили усилия своих лабораторий, и периодически обсуждли полученные результаты на совместных рабочих совещаниях. Было установлено, что и в легких, и в тяжелых цепях есть вариабельные и константные области. Ценную информацию принесло сравнение структуры антител различной специфичности и антител, полученных от животных разных биологических видов.
Стало возможным определение аминокислотной последовательности в полипептидных цепях, из которых состоят молекулы антител. Проделав огромную работу, сотрудники Эдельмана к 1969 году полностью расшифровали первичную структуру молекулы иммуноглобулина (все 1300 аминокислотных остатков) и определили в ней домены, ответственные за различные функции антител [1].
Как известно, существует несколько главных классов антител с различными функциями и характеристиками. Легкие цепи во всех видах антител принципиально одни и те же (хотя и обладают разной электрофоретической подвижностью), а тяжелые цепи в каждом классе — свои. Задние части тяжелых цепей в стебле определяют способность антител активировать систему комплемента, который например, при контакте антитела с некоторыми клетками и микробами раствору и уничтожает их. В этой же части молекулы расположены химические группы, которых зависит способность антитела проникать сквозь некоторые мембраны, например, сквозь плаценту от матери в организм плода.
продолжение --PAGE_BREAK--Эдельман и Портер дали миру ясное изображение структуры и механизм действия антител — важнейших биологических веществ. Этим они заложили надежную основу для дальнейшего изучения иммунных процессов метода точных наук, то есть создали то, чего иммунологии так недоставало. Открытие тотчас же вызвало «взрыв» иммунологических исследований по всему миру.
В 1967 году Эдельман и Дж. Хелли предложили гипотезу, которая должна была указать решение парадокса, связанного с необходимостью генетической заданности 10 млн. возможных вариантой антител. Согласно гипотезе, каждая цепь (Н и L) в молекуле антитела определяется лишь одной парой генов. В ходе развития клеток, синтезирующих антитела, эти гены рекомбинируют, в результате чего и возникает такое обилие вариантов белка. Эта гипотеза получила признание только в конце 1970-х годов, когда была подтверждена методами генной инженерии.
Последовавшие вслед за признанием поиски быстро привели к результатам, ценным для клинической диагностики и терапии.
Глава 11. 1977 Розалин Ялоу (1921)
Формулировка нобелевского комитета:
«за открытие метода радиоиммунологического исследования пептидных гормонов ».
Ялоу и Соломон Берсон оказались способны устранить возникшее препятствие на пуги развития физиологии и сделали это наиболее неожиданный способом. К середине 1950-х годов они обнаружили, что в организме людей, которым для лечения диабета или шизофрении вводили инсулин, возникали антитела против; данного гормона. Этот вывод противоречил преобладавшей в то время концепция, согласно которой столь малый фрагмент белка (51 аминокислотный остаток) не может обладать антигенной активностью. Для принятия научным сообществом нового; взгляда потребовалось значительное время. Были получены и другие важные данные. Так, антитела образовывали растворимые комплексы с инсулином, к молекуле которого была присоединена радиоактивная метка (изотоп йода). Добавление в смесь немеченного (обычного) инсулина влияло на связывание меченного инсулина с антелами. Другими словами: процент меченого инсулина, связывающегося с антителами, является функцией общей концентрации инсулина в растворе. Этот факт стал отправной точкой для радиоиммунологического определения инсулина, а позднее всех прочих пептидных гормонов в крови и других жидкостях и тканях тела.
В серии блестящих, признанных теперь классическими, статей 1956-1960 годов Ялоу и Берсон подробно описали свой радиоиммунологический метод (англ. radioimmunolodical assay — RAI) определения пептидов [3]. Это было захватывающим воображение соединением иммунологии, изотопных методов, математики и физики. RAI настолько чувствителен, что позволяет определять инсулин в концентрации 10-20 пг/мл, а АКТГ — менее 1 пг/мл {одна триллионная доля грамма в одном миллилитре).
Глава 12. 1980 Бару Бенацерраф (1920), Жан Доссе (1916) и Джорд Д. Снелл (1903)
Формулировка нобелевского комитета: «за открытие метода радиоиммунологического исследования пептидных гормонов ».
Снелл изучал на мышах возможность пересева опухолей и установил, что переносимость опухолей детерминирована присутствием на поверхности клеток особых белково-углеводных комплексов, которые Снелл назвал антигенами тканевой совместимости, или Н-антигенами. Правила переносимости опухолей, которые вывел Снелл, оказались приложимы и к нормальной ткани, такой как кожа. При пересадках тканей клетки трансплантата, несущие на своей поверхности чужой для организма набор антигенов, входят в контакт с клетками иммунной системы организма-хозяина. Те вырабатывают защитную реакцию и отторгают чужую ткань.
В 1946 году Снелл обнаружил, что Н-антиген идентичен антигену, описанному Горером. Объединив свои усилия, Снелл и Горер начали серию исследований на мышах чистых линий. (Чистой линией, или просто линией, называется потомство, полученное в результате многократных близкородственных скрещиваний и ставшее генетически однородным, как монозиготные близнецы.)
После длительных экспериментов, результаты которых однажды были уничтожены пожаром в лаборатории, Снеллу удалось доказать, что формирование Н-антигенов детерминировано генами (Снелл назвал Н-генами), находящимися в пределах одной области в одной хромосоме. Эта область получила название гладкого комплекса гистосовместимости (англ. major histocompatibility complex — MHC), МНС был обнаружен у всех исследованных классов позвоночных — у рыб, рептилий, птиц и млекопитающих, В пределах МНС мыши было установлено существование приблизительно 80 различных генов. Участие МНС в регуляции важных иммунологических реакций позволило Снеллу назвать гены МНС «супергенами». Он усомнился в том, что истинное их назначение — сопротивляться пересадкам тканей, поскольку трансплантация — ситуация искусственная, в природе почти не встречающаяся. Возникал вопрос: зачем природа создала механизм защиты от пересадок?
Между 1930 и 1950 годами иммунологические закономерности трансплантаций устанавливались в опытах на мышах и ничего не было известно о соответствующей системе в организме человека. Экспериментальные пересадки тканей здесь невозможны. Выход нашел Доссе, обнаруживший громадное значение лейкоцитов (белых клеток крови) для реакции отторжения. Первоначально Доссе изучал аутоиммунные болезни, в том числе он исследовал пациентов, перенесших многократные переливания крови. В 1954 году Доссе обнаружил, что кровь таких пациентов содержит антитела против донорских лейкоцитов. Эти антитела агглютинировали (склеивали) лейкоциты большинства других людей, но не свои собственные. Подтверждение этому Доссе получил, исследуя антитела в крови женщин, родивших нескольких детей. В конце 1950-х годов он идентифицировал первый антиген (белок) гистосовместимости человека. Вскоре были описаны и другие подобные антигены. По месту своей локализации (на мембранах белых клеток крови) они были названы человеческими лейкоцитарными антигенами (англ. human leukocyte antigens — HLA). В 1965 году Доссе показал, что они детерминированы единой системой генов, локализованных на одной хромосоме [4]. Их назвали HLA-генами. Так Доссе открыл человеческий эквивалент МНС мышей. Вскоре было выявлено, что сходство систем МНС и HLA намного больше, чем первоначально предполагалось. Доссе показал, что в пределах HLA-системы человека, как и в МНС мышей, есть две доминирующих области. Была выдвинута гипотеза о существовании двух тесно сцепленных локусов (А и В). Позднее были открыты локусы С и D. Все они расположены в маленькой области хромосомы 6. Каждый из них может встречаться в нескольких альтернативных формах. Так, ген А встречается по крайней мере в 15 вариантах, В — в 29, С — в 9 и D — в 12-ти. Индивид может иметь два варианта каждого их этих генов — по одному в каждой хромосоме 6-й пары. Вероятность того, что два человека, не состоящие в кровном родстве друг с другом, получат одинаковый набор HLA-генов, мала, так как число возможных комбинаций превышает 100 млн. Монозиготные близнецы всегда имеют одинаковый набор HLA-генов.
Сподвижниками Доссе в это время были Ф. Киссмейер-Нильсен и многие др. Они, как до них это делали исследователи фагов, объединились в интернациональную труппу, члены которой в конце 1960-х — начале 1970-х годов регулярно обменивалась информацией, в том числе путем периодического проведения рабочих совещаний по гистосовместимости. Движущим фактором прогресса в этой области была вера членов группы в то, что результаты их труда позволят решить главную проблему, связанную с пересадками органов.
Работая с Эдельманом (Нобелевская премия 1972 года), Бенасерраф обнаружил, что одни морские свинки в ответ на введение простых антигенов (синтетических полипептидов) вырабатывали антитела, другие — нет. Бенасерраф понял, что способность реагировать таким образом детерминированна генетически. Он назвал эти факторы Ir-генами (англ, immune response — иммунный ответ). В 1965 году его коллеги описали подобные гены у мышей и выяснили, что они входят в МНС. В конце 1960-х годов Бенасерраф и его сотрудники в опытах на морских свинках чистых линий проверили эти данные.
В 1976 году другие авторы показали, что белки-продукты трансплантационных генов регулируют процесс, в ходе которого Т-лимфоциты отличают нормальные клетки своего организма от чужих (трансплантат) или переродившихся своих (опухоль) клеток. Иммунная система постоянно следит за тем, чтобы собственные клетки тела не изменяли своих уникальных поверхностных характеристик. Изменение этих характеристик может произойти при встрече с вирусом или когда нормальная клетка трансформируется в клетку опухоли. Именно в этих случаях способность отличать «свое» от «не-своего» становится очень важной; изменившиеся клетки должны быть обнаружены и уничтожены. Вскоре было выяснено, что Ir-гены, как и трансплантационные гены, входят в состав МНС. Продукты трансплантационных генов получили название молекул класса I. а продукты Ir-генов — молекул клаcca II.
Таким образом, главное назначение МНС — организация системы иммуннологического надзора, а отторжение трансплантатов лишь побочный результат деятельности МНС. В нормальном организме иммуннологический надзор сбалансирован так, чтобы организм внезапно не отреагировал против своих же собственных здоровых клеток. Если же такое случается, то возникают аутоиммунные заболевания, такие как, например, ревматоидный артрит.
Глава 13. 1984 Нильс К. Ерне (1911-1994), Георг Й. Келлер (1946-1995) и Сезар Мильштейн (1927-2002)
Формулировка нобелевского комитета: «за теории, касающиеся специфичности в развитии и регуляции иммунной системы и открытие принципа производства моноклональных антител».
Нильс К. Ерне
Иммунная система должна распознавать огромное количество чужеродных антигенов и специфически реагировать с каждым. Вопрос о причинах разнообразия в иммунной системе оставался долгое время открытым. Как лимфоциты развивают свои жизненно важные свойства и как они создают высокочувствительную систему распознавания антигенов? Все это озадачивало многие поколения исследователей.
В 1955 году Ерне предложил теорию естественного отбора в антителообразовании. Согласно этой теории каждый индивид имеет огромное количество естественных антител со специфичностями для всех антигенов, с которыми его организм может встретиться. Антитела развиваются уже во внутриутробной жизни, то есть в отсутствии каких-либо внешних антигенов. Когда появляется чужеродный антиген, он выбирает себе наиболее подходящую молекулу антитела. Реакция «антиген-антитело» стимулирует производство антител именно этой специфичности. Эта теория противоречила инструктивным теориям, которые преобладали в то время. Согласно этим теориям, антиген служит шаблоном для производства антител. В теории естественного отбора Ерне подразумевается, что возникновение огромного числа специфичностей антител происходит независимо от экзогенных антигенов. Эти представления и составляют основу современной иммунологии.
Если теория естественного отбора трактует вопросы созревания иммунной системы после того, как она приобрела способность реагировать с антигеном, то в теории соматического природы иммунного распознавания (1971) Ерне объяснил, как созревают лимфоциты, способные реагировать с антигеном. Он предположил, что каждый индивид обладает всеми генами, необходимыми для производства антител и антителоподобных молекул, которые могут связывать все сильные трансплантационные антигены. Ерне полагал, что лимфоциты созревают в тимусе и в других лимфоидных органах. Клетки, распознавшие антигены, активируются и начинают делиться. По мере того, как в быстро делящихся клетках накапливаются мутации, могут развиваться новые иммунологические специфичности. В то же самое время специфичности лимфоцитов к собственным трансплантационным антигенам ослабляются. Зрелые лимфоциты распознают чужеродный антиген. Теория объясняет, как иммунная система нормально созревает под влиянием собственных антигенов. Она также объясняет, как иммунологическая специфичность регулируется генами, принадлежащими к системе трансплантационных генов.
В теории сети Ерне (1974) объясняет, как регулируется специфический иммунный ответ. Основанием для теории стало наблюдение того, что антитела могут вызывать образование апти-антител, направленных против антиген-связывающих структур первого антитела. Кроме того, анти-антитела могут стимулировать производство следующею поколения антител — анти-анти-антител. По существу, этот каскад антител бесконечен, он последовательно добавляет иммунной системе всё новые специфические свойства. Различные поколения антител или стимулируют, или подавляют производство друг друга. В обычных условиях сеть сбалансирована. Однако когда появляется антиген, равновесие нарушается. Иммунная система пробует восстановить равновесие, что ведет к иммунному ответу на антиген. Теория мощно стимулировала исследования и привела к более глубокому проникновению в природу иммунной системы. Позднее она была приложена к диагностике и лечению болезней.
продолжение --PAGE_BREAK--Георг Й. Келлер и Сезар Мильштейн
Известно, что в организме есть клетки — лимфоциты, которые могут производить миллионы различных антител. Однако каждая отдельная клетка может производить антитела только с определенной специфичностью. Причина возникновения множества антител — не более, чем обилие лимфоцитов. Если организму представлен некий чужеродный антиген, может произойти активация лимфоцита, который случайно обладает способностью опознавать именно данный антиген. Этот лимфоцит начинает делиться и формирует клеточный клон, производящий идентичные моноклинальные антитела. В обычных условиях развитие клона находится под жестким контролем. Иногда же организм теряет контроль над антителопродуцируюшим клоном, что может привести к возникновению особого типа опухоли — миеломы. Клетки миеломы обычно сохраняют способность производить определенные антитела.
Антителопродуцирующие лейкоциты — это высокоспециализированные клетки. Поэтому они не могут долго жить в культуре клеток (вне организма). Клетки миеломы,
наоборот, иногда удается выращивать в питательной среде непрерывно. Долгое время биологи и медики лелеяли мечту получить клоны клеток, производящих антитела заданной специфичности. Эта мечта осуществилась, когда Кёлер и Мильштейн в 1975 году предложили гибридомную технологию производства моноклональных антител [5]. Принципиально способ получения гибридомы таков. Мышей иммунизируют избранным антигеном. Затем клетки их селезенки перемешивают с культурой миеломных клеток. Результат смешивания называется гибридомой. Как ни странно, гибрид двух типов клеток способен выживать и делиться. В этот гибрид клетки миеломы вносят способность к выживанию, в то время как клетки селезенки направляют синтез на производство антител с заданной специфичностью. Специальными мерами можно достичь размножения клеток гибридомы, а не только клеток миеломы. Полученную гибридную культуру разбавляют, чтобы выделить колонии, происходящие от единичных гибридных клеток. При помощи специального чувствительного метода определяют клоны, производящие специфичные антитела. Полученную гибридому можно использовать для безграничного производства высокоспецифичных антител.
Глава 14. 1987 Сусуму Тонегава (1939)
Формулировка нобелевского комитета: «за открытие генетического принципа происхождения разнообразия антител».
В 1976 году Тонегава сумел путем ряда изобретательных экспериментов показать, как части генома клетки (ДНК) перераспределяются в ходе дифференцировки от зародышевой клетки до В-лимфоцита, производящего антитела. К 1978 году Тонегава уже мог детально разъяснить, как те части генома, которые порождают, антитело, перемещаются так, чтобы позволить каждому В-лимфоциту производить; свои собственные уникальные антитела. Тонегава ответил на вопрос, как генетический материал В-клеток может создавать бесконечное число структур различных антител [6]. В 1976 году он убедительным и изящным способом смог показать как различные гены иммуноглобулина, которые были далеко друг от друга в зародышевой клетке, в В-лимфоците входят в более близкий контакт. В ходе развития от зародышевых клеток к антителобразующему В-лимфоциту гены, формирующие иммуноглобулины, перераспределяются. Различные части генома перемещаются, повторно объединяются и могут быть даже «потеряны», чтобы, наконец, создать ДНК, которую находят в зрелом В-лимфоците.
У человека гены для длинных цепей расположены в хромосоме 14, для κ- на хромосоме 2 и для λ-цепей — на хромосоме 22. Три группы генов участвуют» создании переменной части длинной цепи, которая вместе с неременной частью короткой цепи является специфичной для каждою антитела. Эти гены получили названия V, D и J. Короткая цепь детерминируется генами V и J. У человека число V-генов для длинных цепей примерно 200, и, кроме того, есть приблизительно 20 D генов и 4J-гена. Когда для синтеза антитела нужен функционирующий ген, по одному V-,D — и J-гену в случайном порядке берется от трех групп генов. Этот можно сравнить с лотереей, где число номеров равно 16000, то есть 200 х 20 х 4.
Случайный порядок сборки генов V, D и J еще более увеличивает обилие вари тов. И поскольку гены V и D часто неодинаковы (наследуются и от отца, и от матери), это уже означает уже возможность примерно 5 млн. различных вариантов переменной части длинной цепи. Последний вклад вносит легкая цель с ее 10 тыс. антов. Итоговая сумма составляет много миллиардов возможных форм антитела.
Человек хорошо подготовлен к встрече с любым возможным антигеном. Вероятно, только незначительная часть типов антител когда-либо используется. Иммунная система чрезвычайно экономична в использовании ДНК. В то же самое время производится большое количество лимфоцитов, и только некоторые из них будут когда-либо участвовать в иммунной защите организма. Экономия ДНК, таким образом, соседствует с очевидным расходованием клеток. Однако такой порядок позволяет сохранять состояние высокой готовности, которая требуется против возможных новых инфекционных болезней.
Глава 15. 1996 Питер К. Догерти (1940) и Рольф М. Цинкернагель (1944)
Формулировка нобелевского комитета:
«за открытия, касающиеся специфичности клеточно-опосредованной иммунной защиты».
Цинкернагель и Догерти в опытах на мышах изучали, как иммунная система и особенно Т-лимфоциты, защищают организм от проникших в него вирусов менингита. В организме инфицированных мышей развивались Т-лимфоциты-киллеры, которые in vitro могли убивать клетки,]инфицированные вирусом. Но было сделано и неожиданное открытие: Т-лимфоциты, полученные от мыши линии А, в пробирке успешно уничтожали пораженные вирусом клетки, полученные от мышей той же линии А, но оказывались неактивны против таких же пораженных вирусом менингита клеток, полученных от мышей В. Таким образом, для того, чтобы пораженная клетка была уничтожена лимфоцитами-килерами, она должна быть не только инфицирована вирусом, но и нести на своей поверхности то же вариант антигенов гистосовместимости, что и в организме, из которого были взяты лимфоциты-киллеры. Несколько упрощая, можно сказать что лимфоциты уничтожали пораженные клетки только в собственном организме, а в чужом теряли свою активность.
Результаты работы Цинкернагеля и Догерти, которые были опубликованы в Nature в 1974 году [7], убедительно продемонстрировали, что клеточная иммунная система должна одновременно распознавать и чужеродную молекулу, например, молекулу вируса, и молекулу МНС собственного организма. Стало очевидным, что антигены МНС играют важнейшую роль в нормальном иммунном ответе, а не только в отторжении трансплантатов.
Впоследствии Догерти и Цинкернагель предложили две модели. Одна описывает единичное распознавание измененных тканей собственного организма (когда антиген гистосовместимости изменен вирусом). Вторая модель объясняет двойное распознавание «чужого» и «своего». В течение нескольких лет было продемонстрировано, что только те Т-лимфоциты, которые оказываются способными распознавать трансплантационные антигены собственного организма, выживают и созревают, остальные — элиминируются (не получают развития и исчезают). Поэтому, принцип одновременного (двойного) распознавания важен для способности иммунной системы отличать «свое» от «не-своего». Дальнейшие молекулярные исследования подтвердили обе модели Цинкернагеля и Догерти, а также разъяснили структурную основу их открытия. Небольшая часть молекулы, например, пептид из состава вируса, непосредственно привязана к определенной переменной части антигенов гистосовместимости организма. И именно этот комплекс узнается специфичными молекулами распознавания Т-лимфоцитов (рецепторами Т-клеток).
Раскрыв механизмы, используемые иммунной системой, для того, чтобы отличать микробы от молекул собственного тела, открытие Догерти и Цинкернагеля существенно изменило представления о развитии и нормальном функционировании иммунной системы и обеспечило новые возможности для направленного влияния на иммунные реакции.
Глава 16. 1997 Стенли Б. Прузинер (1942)
Формулировка нобелевского комитета: «за его открытие прионов – новой биологической причины инфекций».
Вначале 1970-х годов в клинике Калифорнийского университета Прузинер наблюдал пациента, который медленно умирал от ВКЯ. При этом возбудителя столь грозного заболевания никак не удавалось выявить. Этот «медленный вирус», как его тогда называли, поразил воображение Прузинера, и он подумал, что определение молекулярной структуры этого неуловимого агента могло бы стать прекрасной темой для исследовательской работы.
Чем больше он читал о куру и скрапи, тем больше его интересовала эта проблема. Прузинер получил место ассистента и начал обустраивать лабораторию для изучения скрапи в 1974 году, хотя было довольно трудно получить финансирование по этой тематике. Пробы упорно выявляли только белок, но не нуклеиновые кислоты.
Прузинер решил точно идентифицировать болезнетворное начало. Этому препятствовала длительность инкубационного периода болезни. Всякий раз произведя заражение животных, Прузинер был вынужден использовать множество мышей в каждом эксперименте терпеливо ждать около 200 дней до появления симптомов заболевания. Усилия по очищению ускорились, когда было показано, что скрапи может быть привита хомякам, у которых инкубационный период заметно короче.
После десяти лет усилий Прузинер и его коллеги выделили инфекционный агент из мозга больных хомяков. Эксперименты упорно свидетельствовали, что он состоял из одиночного белка, который Прузинер назвал прионом (англ. prion от Proteinaceous Infectious particle белковая инфекционная частица).
В сотрудничестве с коллегами Прузинер выделил прион-белок PrP (англ. Prion protein), определил часть последовательности аминокислот. Далее получение антител к прион-белку сделало возможным определение его локализации в клеточной мембране.
Выводы, к которым пришел Прузинер в первой половине 1980-х годов, вызвал естественное недоверие вирусологов. Его взгляды явно противоречили традиции согласно которой структура белка определяется информацией, хранимой и переносимой нуклеиновыми кислотами. Большинство биологов и врачей не желали даже всерьез рассматривать идею о существовании прионов, поскольку абсолютно все открытые за почти полтора столетия инфекционные агенты (вирусы, бактерии, грибы, простейшие) обязательно содержали в себе генетический материал (ДНК или РНК). При разрушении нуклеиновых кислот болезнетворность агента исчезала. Прузинер проявил должное упорство, и к началу 1990-х годов доказательства существования прионов возобладали над всеобщим скептицизмом. Теория прионов была принята значительной частью научного сообщества.
Ген приона (Prnp) обнаружили в 1985 году у млекопитающих и птиц, а затем и у человека [8]. Оказалось, что нормальный прионовый белок — обычный компонент лейкоцитов, но особенно часто он встречается на поверхности нейронов мозга.
Обнаружение гена приона у всех исследованных (нормальных!) животных; заставило задуматься о том, как могут прионы быть причиной тяжелейших заболеваний мозга. Казалось очевидным, что Прузинер ошибся.
Пришлось ввести различие между двумя формами прион-белка. Нормальная форма РгР получила обозначение РгРС, а прионная — РгРSс (где Sс означает scrapie). В отличии от нормальной, прионная форма повышенно гидрофобии и склонна к образованию агрегатов, она также более устойчива к протеазам. РгРSс имеет конформацию с повышенным содержанием β-складчатой структуры, он чрезвычайно стабилен и резистентен к действию ферментов, органических растворите и высоким температурам (выше 100 °С).
Механизм инфицирования предполагается таким: РгРSс, связываясь с клеткой, способствует превращению РгРС в РгРSс. Иногда превращение РгРС в РгРSс происходит спонтанно — спорадическое возникновение прионного заболевания. Причина наследственных прионных болезней — измененный ген, кодирующий белок, который повышенно склонен к спонтанному превращению в РгРSс. Журналисты тотчас окрестили нормальный РгРС «доктором Джекилем», а патогенный РгРSс — «мистером Хайдом», подчеркнув тем самым, что одна и та же сущность может иметь два противоположных проявления. При смешивании in vitro РгРС с РгРSс нормальный белок превращается в прионный очень медленно: за несколько месяцев или лет РгРSс накапливается до уровня, приводящего к повреждению та мозга.
продолжение --PAGE_BREAK--Точный механизм прионного превращения еще не известен. Согласно гетеродимерной модели самого Прузинера, мономер РгР катализирует переход РгРС в РгРSc через образование комплекса РгРС/РгРSс. Полимеризационная модель рассматривает прион как упорядоченный полимер РгР, или одномерный кристалл. Его присутствие вызывает дальнейшую полимеризацию, подобно тому, как это происходит с истинными кристаллами. Различия, которые не только существуют между отдельными штаммами прионов, но и передаются от одного животного другому, лучше объясняются полимерной моделью (различная закладка РгР в фибриллы). Предполагается, что так же образуются и фибриллы амилоидообразующих белков. Возможно даже, что прионы — инфекционная разновидность амилоидных фибрилл.
Прузинер предположил, что наследственные формы прионных заболеваний зависели от мутаций в гене приона. Уверенность в том, что это, возможно, появилась после того, как мутантные гены были перенесены мышам. Эти трансгенные мыши заболели болезнью, сходной со скрапи. В 1992 году исследователи смогли уничтожить ген, кодирующий прионы у мышей, получив так называемых «мышей с выбитыми прионами». Было показано, что эти мыши полностью резистентны к заражению прионами. Более того, когда ген приона был повторно введен мышам, они снова стали восприимчивы к прионной инфекции. Пока непонятно, почему остаются здоровыми мыши prion knock-out. Выходит, что нормальный белок приона не является обязательным для жизни.
Заключение
Открытие двух фундаментальных механизмов иммунитета превратило иммунологию из собрания эмпирических правил в строгую научную дисциплину. Ее развитие в XX веке дало человечеству средства зашиты от десятков инфекций. Широкое распространение приобрела практика прививок, то есть создания искусственного активного иммунитета к возбудителям инфекционных болезней. Некоторые из этих болезней, в том числе одно из наиболее опасных, натуральная оспа, вообще исчезли. На основе теории антителообразования Ландштейнер создал учение о группах крови, применение которого спасло жизнь миллионам людей. Однако в период Второй мировой войны неудачные попытки лечения ожогов пересадкой донорской кожи привели к пониманию того, что иммунные реакции не ограничиваются сопротивлением микробам.
Получила развитие неинфекционная иммунология, обеспечившая относительный успех пересадок органов и тканей. Позднее стало понятно, что иммунная система также подавляет развитие раковых клеток, постоянно появляющихся в любом здоровом организме. Таким образом, иммунитет теперь рассматривается как всеобъемлющая система самозащиты организма от проникновения в него инородных частиц и от злокачественного перерождения собственных клеток (иммунный надзор за поддержанием генетической стабильности организма). В последние десятилетия XX века взаимодействие иммунологии и генетики позволило значительно углубить понимание механизмов иммунитета и их возможных нарушений и на этой основе многократно повысить эффективность защиты здоровья человека и полезных животных.
Стало возможным излечение больных от аллергий благодаря развитию аллергологии, отправной точкой создания которой стала работа Рише, — одной из важнейших отраслей современных медико-биологических наук. А также создание Даниелем Бове антигистаминных препаратов.
Открытие Догерти и Цинкернагеля обеспечило лучшую базу для конструирования новых вакцин: теперь можно точно определить, какие именно части микроба распознаются клеточной иммунной системой, и создавать вакцину именно к этим частям. Эти принципы были использованы при создании прививки против появления метастазов при некоторых формах рака. Удалось лучше понять связи между восприимчивостью к болезни и типом антигенов гистосовместимости данного индивида. Был достигнут также прогресс и в решении таких классических проблем — медицины как: (а) искусственное усиление иммунного ответа на вторжение микробов или на возникновение некоторых форм рака; и (б) подавление эффектов аутоиммунных реакций при воспалительных заболеваниях, ревматизме, рассеянном склерозе и диабете.
Открытие Тонегавы принесло ответ на одну из наиболее интригующих загадок иммуногенетики: оно показало, как ограниченное количество генов детерминирует синтез почти неограниченного количества вариантов антител. Кроме более глубокого понимания природы иммунной системы, эти открытия имеют значение в совершенствовании иммунологических методов профилактики и лечения (прививки, подавление реакций отторжения трансплантата, аутоиммунные заболевания и др.).
Такое стремительное развитие и становление иммунологии как науки с созданием профессиональных институтов, основанием специальных кафедр иммунологии в высших учебных заведениях для подготовки специалистов, организации научных обществ и международных союзов было бы невозможно без всех этих открытий авторы которых, по праву были удостоены Нобелевской премии.
Список литературы
Ноздрачев А.Д., Марьянович А.Т., Поляков Е.Л., Сибаров Д.А., Хавинсон В.Х. Нобелевские премии по физиологии и ли медицине за 100 лет. СПб.: Издательство«Гуманистика», 2002. 688 с.
Залкинд С.Я. Илья Ильич Мучников. Жизнь и творческий путь. М., 1957.
Meites J. The 1977 Nobel Prize for Physiology or Medicine. Science. 1977. V. 198. N.4317. P.594-594.
JL Marx 1980 Nobel Prize in Physiology or Medicine. Three immunologists win their research on the identification and action of histocompatibility antigens. Science 1980: V 210. N. 4470 P. 621-623.
Newmark P. Prizes (at last) for immunology Nature. 1984 Oct 18-24; 311 (5987):601.
Newmark P. Nobel prize for Japanese immunologist. Nature. 1987 Oct 15-21;329(6140):570.
Masood E, Weiss U. Nature. Nobel goes to T-cell pioneers whose work 'changed face of immunology'.1996 Oct 10;383(6600):465.
Coles H. Nobel panel rewards prion theory after years of heated debate.Nature. 1997 Oct 9;389(6651):529.
www.ronl.ru
Луи Пастер: краткая биография и фото
Знаменитые исследователи и ученые, первооткрыватели, которые навсегда вписали свои имена в летопись науки, нередко опережали свое время и потому остались непонятыми. Луи Пастер, краткая биография которого будет рассмотрена ниже, как раз и относится к числу подобных личностей. Он прожил непростую жизнь, был вынужден бороться за право заниматься наукой, но сумел одержать победу и подарить потомкам микробиологию, иммунологию и другие, не менее полезные, достижения. Познакомимся поближе с его жизненным путем.

Рождение и первые годы жизни
Даже краткая биография для детей Луи Пастера позволяет убедиться, что этот человек обладал незаурядными талантами и уникальным складом ума. На свет он появился в 1822 году, 27 декабря в небольшом французском городке Доле, в семье кожевенных дел мастера.

Годы обучения
Свое обучение будущий первооткрыватель микробиологии начал в колледже в Арбуа, где он являлся самым юным учащимся. Уже в своем первом учебном заведении Луи удалось добиться внушительных успехов, став помощником учителя. Тогда же он понял, что очень многое зависит от трудолюбия и упорства. Далее изучал науки в колледже в парижском лицее Сен-Луи и одновременно был посетителем лекций в Сорбонне. Блестяще окончив колледж, молодой Пастер продолжил образование в Высшей нормальной школе, где занимался постижением естественных наук. За один год ему удалось защитить сразу две докторские диссертации и получить звания профессора по физике и химии.
Первые шаги в работе
В краткой биографии Луи Пастера обязательно следует рассказать о его ранних трудах. Так, великий химик проработал в нескольких университетах в звании профессора, потом получил должность декана в своем же учебном заведении, Вышей нормальной школе. Исследователь оказывается очень строгим руководителем, существенно ужесточает правила приема в школу и требования к выпускнику, что сделало учебное заведение более солидным. Не достигший 40-летнего возраста Пастер уже был широко известен в научных кругах своими новаторскими работами:
- Труды по органической кристаллографии положили основу современной науке стереохимии.
- Ему удалось подробно исследовать процесс брожения и выявить его биологическую природу. Именно Луи Пастер установил, что за процесс превращения вина в уксус отвечают живые микроорганизмы, особые дрожжевые грибки.
В дальнейшем химик продолжил изучение пастеризации, предложив обрабатывать вино воздействием высоких температур для его сохранности.

Исследования
Следующий этап жизни Луи Пастера, краткая биография и фото которого представлены в данном материале, - работа в области медицины. Так, изучая причины гибели червей тутового шелкопряда, он научился под микроскопом отделять здоровых особи от больных. Это навело исследователя на мысль, что таким же образом можно воздействовать и на болезнетворные микроорганизмы в организме человека. Если ввести больному специальную сыворотку, то можно ослабить воздействие микроба и даже выработать у больного иммунитета к нему.
Пастер и его ученики ставили многочисленные опыты, позволяющие всестороннее изучить природу вакцин. Так, ему удалось найти лекарства от таких серьезных заболеваний, как сибирская язва, бешенство и краснуха свиней, куриная холера. В те времена эти вирусные инфекции уносили множество жизней. Первым успехом в деле вакцинации стала прививка 9-летнему мальчику, который был таким образом спасен от бешенства.

Обвинения
Как и всякого человека, опережающего свое время, гениального ученого обвинили в шарлатанстве. Его учение о вакцинации не пользовалось популярностью у исследователей, не желающих открыть свой разум новым веяниям. Поэтому в краткой биографии и открытиях Луи Пастера наступили тяжелые времена. Проводя вакцинации, ученый не смог помочь маленькой девочке, укушенной собакой и обратившейся спустя более 35 дней. Прививка оказалась бессильна, и ребенок скончался. Поэтому в адрес Пастера посыпались абсурдные обвинения в том, что ученый не несет людям благо, а занимается распространением бешенства. В некоторых городах, где были созданы станции для проведения вакцинаций, безумствовали толпы, грозящиеся уничтожить медицинские учреждения. Все это подорвало здоровье великого ученого.
На собственные средства Пастер основал Пастеровский институт в Париже, но работать там уже не мог.

Смерть
Луи Пастер покинул этот мир в 1895 году, 28 сентября в возрасте 72 лет. Причиной смерти исследователя называют целую серию инсультов, почти полностью разрушивших его организм.
До самой смерти он оставался верен своим идеям и стремился помогать людям. Похоронен Луи Пастер был в соборе Нотр-Дам в Париже, впоследствии прах его перезахоронили в склепе созданного им института.
Особенности преподавания младшим школьникам
Особый интерес представляет краткая биография Луи Пастера для 3 класса. Учителю выпадает сложная, но интересная задача не только рассказать об открытиях великого человека, но и отобразить ключевые черты его личности. Итак, что же следует прежде всего рассказать третьеклассникам?
- Родившись в простой рабочей семье, Луи Пастер не пошел по стопам своего отца – кожевника, выбрав для себя иной путь.
- Обязательно необходимо отметить, что этот человек всю жизнь учился и работал, не сдавался даже в моменты болезни и тогда, когда его работу откровенно не принимали, обвиняя исследователя в шарлатанстве.
- Его роль поистине велика в таких науках, как химия, физика, медицина и биология.
- Свои первые открытия гениальный исследователь сделал еще в студенчестве, опередив не только педагогов, но и свое время.
- Луи Пастеру довелось пережить и признание собственных заслуг, и несправедливые упреки, но ничто не могло сломить его тягу к знаниям и жажду открытий.
- Ученый был дружен со многими русскими исследователями, которые впоследствии продолжили его великое дело.
Также можно включить в процесс обучения подборку интересных фактов и перечислить сами открытия. Это поможет школьникам оценить вклад в науку этого гениального человека.
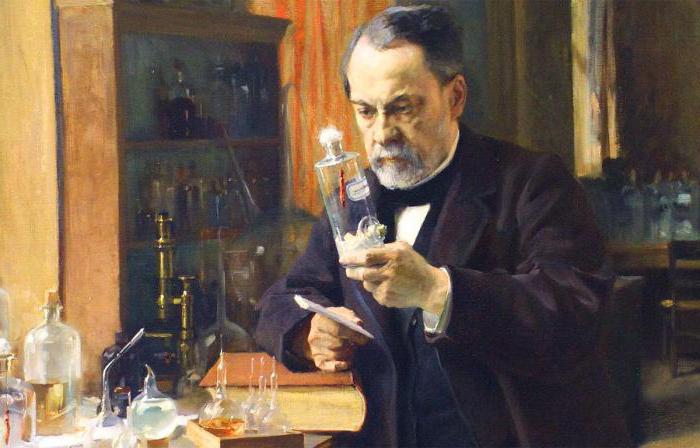
Интересные факты
Мы уже познакомились с краткой биографией Луи Пастера. Интересные факты представлены ниже:
- Он был не только выдающимся ученым, исследователем, но и одаренным художником, поэтому сумел увековечить на полотнах портреты матери и сестер.
- Супруга Пастера родила ему пятерых детей, но трое из них умерли в младенчестве от неизлечимого в те времена брюшного тифа. Это и стало одной из основных причин, побудивших Пастера заняться исследованием методик лечения опасных заболеваний.
- Был добросовестным католиком, полностью принимая на веру данное религиозное учение.
- Большую часть своей жизни Луи Пастер занимался лечением больных, не имея при этом медицинского образования.
- Свои самые значительные открытия совершил, будучи инвалидом: от кровоизлияния в мозг 45-летний Пастер остался почти полностью парализованным на левую половину, его рука и нога не двигались. Тем не менее ученый продолжил свою работу и сумел спасти множество жизней.
Жизнь этого незаурядного человека легкой не назовешь, отчего особенно поражают его настойчивость, трудолюбие и целеустремленность.

Открытия
Краткая биография Луи Пастера на английском или русском языке обязательно освещает открытия, сделанные этим великим человеком.
- Так, ему удалось доказать, что за брожение отвечают специфические микроорганизмы, это стало новым веянием в науке того времени. До Пастера было принято считать, что брожение представляет собой химический процесс.
- Именно этот талантливый микробиолог обнаружил существование микроорганизмов, которые способны жить без кислорода. Именно они и вызывают масляннокислое брожение, ведя к порче вина и пива. Поэтому, чтобы спасти напитки, Пастер предложил использовать кислород, губительный для таких организмов.
- Гениальный ученый сумел опровергнуть еще одну теорию из царивших в его время – о самозарождении бактерий. Так, исследователи 19-го века полагали, что организм может возникнуть из ничего, сам по себе. А Луи Пастер, краткая биография которого подходит к концу в нашем материале, провел интересный опыт, который доказал несостоятельность этой концепции. Он поместил питательный раствор в сосуд с изогнутым горлышком, жизнь там не появлялась, несмотря на все необходимые условия, поскольку споры бактерий оседали на изломах горлышка. А если при прочих равных условиях горлышко убирали, то вскоре в питательном растворе появлялись признаки живых существ. За это открытие Луи Пастер получил премию Французской Академии наук.
- Помог виноделам бороться с болезнями продукции, научив их нагревать вино при высоких температурах. Впоследствии метод получил название пастеризации, он и сейчас помогает продлить срок хранения многих пищевых продуктов, сохраняя их вкусовые качества и пищевую ценность. Но хранить пастеризованные вещества следует при пониженных температурах.
- Первый предложил профилактические прививки, которые делаются и по сей день.
Все это делает вклад ученого в развитие науки и медицины бесценным.

Мы рассмотрели краткую биографию Луи Пастера и его открытия и увидели, что это был не просто человек выдающегося ума, но и очень трудолюбивый исследователь, который пытался докопаться до истины, невзирая на господствующие в его годы нелепые теории, которые многими слепо принимались на веру. Сейчас многие учебные заведения носят имя великого микробиолога, как и один из кратеров Луны.
fb.ru
Пастер, Луи - Биологи

Луи Пасте р (правильно Пастёр, фр. Louis Pasteur; 27 декабря 1822, Доль, департамент Юра — 28 сентября 1895, Вильнёв-Л'Этан близ Парижа) — выдающийся французский микробиолог и химик, член Французской академии (1881). Пастер, показав микробиологическую сущность брожения и многих болезней человека, стал одним из основоположников микробиологии и иммунологии. Его работы в области строения кристаллов и явления поляризации легли в основу стереохимии. Также Пастер поставил точку в многовековом споре о самозарождении некоторых форм жизни в настоящее время, опытным путем доказав невозможность этого (см. Зарождение жизни на Земле). Его имя широко известно в ненаучных кругах благодаря созданной им и названной позже в его честь технологии пастеризации.
Ранние годы жизни
Луи Пастер родился во французской Юре в 1822 году. Его отец — Жан Пастер — был кожевником и ветераном Наполеоновских войн. Луи учился в коллеже Арбуа, затем Безансона. Там учителя посоветовали поступить в Высшую нормальную школу в Париже, что ему и удалось в 1843. Окончил её в 1847.
Пастер проявил себя талантливым художником, его имя значилось в справочниках портретистов XIX века.
Работы в области химии
Первую научную работу Пастер выполнил в 1848. Изучая физические свойства винной кислоты, он обнаружил, что кислота, полученная при брожении, обладает оптической активностью — способностью вращать плоскость поляризации света, в то время как химически синтезированная изомерная ей виноградная кислота этим свойством не обладает. Изучая кристаллы под микроскопом, он выделил два их типа, являющихся как бы зеркальным отражением друг друга. Образец, состоящий из кристаллов одного типа, поворачивал плоскость поляризации по часовой стрелке, а другого — против. Смесь двух типов 1, естественно, не обладала оптической активностью.
Пастер пришёл к заключению что кристаллы состоят из молекул различной структуры. Химические реакции создают оба их типа с одинаковой вероятностью, однако живые организмы используют лишь один из них. Таким образом впервые была показана хиральность молекул. Как было открыто позже, аминокислоты также хиральны, причем в составе живых организмов присутствуют лишь их L формы (за редким исключением). В чём-то Пастер предвосхитил и это открытие.
После данной работы Пастер был назначен адъюнкт-профессором физики в Дижонский лицей, но через три месяца уже в мае 1849 перешёл адъюнкт-профессором химии в университет Страсбурга.
Изучение брожения
Изучением брожения Пастер занялся с 1857 года. В то время господствовала теория что этот процесс имеет химическую природу (Ю. Либих), хотя уже публиковались работы о его биологическом характере (Ш. Каньяр де Латур, 1837), не имевшие признания. К 1861 Пастер показал, что образование спирта, глицерина и янтарной кислоты при брожении может происходить только в присутствии микроорганизмов, часто специфичных.
Луи Пастер доказал, что брожение есть процесс, тесно связанный с жизнедеятельностью дрожжевых грибков, которые питаются и размножаются за счет бродящей жидкости. При выяснении этого вопроса Пастеру предстояло опровергнуть господствовавший в то время взгляд Либиха на брожение, как на химический процесс. Особенно убедительны были опыты Пастера, произведенные с жидкостью, содержащей чистый сахар, различные минеральные соли, служившие пищей бродильному грибку, и аммиачную соль, доставлявшую грибку необходимый азот. Грибок развивался, увеличиваясь в весе; аммиачная соль тратилась. По теории Либиха, надо было ждать уменьшения в весе грибка и выделения аммиака, как продукта разрушения азотистого органического вещества, составляющего фермент. Вслед за тем Пастер показал, что и для молочного брожения также необходимо присутствие особого фермента, который размножается в бродящей жидкости, также увеличиваясь в весе, и при помощи которого можно вызывать ферментацию в новых порциях жидкости.
В это же время Луи Пастер сделал еще одно важное открытие. Он нашел, что существуют организмы, которые могут жить без кислорода. Для них кислород не только не нужен, но и вреден. Такие организмы называются анаэробными. Представители их — микробы, вызывающие маслянокислое брожение. Размножение таких микробов вызывает прогорклость вина и пива. Брожение, таким образом, оказалось анаэробным процессом, жизнью без дыхания, потому что на него отрицательно воздействовал кислород (эффект Пастера).
В то же время организмы, способные как к брожению, так и к дыханию, в присутствии кислорода росли активнее, но потребляли меньше органического вещества из среды. Так было показано, что анаэробная жизнь менее эффективна. Сейчас показано, что из одного количества органического субстрата аэробные организмы способны извлечь почти в 20 раз больше энергии, чем анаэробные.
В 1860—1862 Пастер изучал возможность самозарождения микроорганизмов. Он провёл элегантный опыт, взяв термически стерилизованную питательную среду и поместив её в открытый сосуд с загнутым вниз длинным горлышком. Сколько бы сосуд стоял на воздухе никаких признаков жизни в нём не наблюдалось, поскольку содержащиеся в воздухе бактерии оседали на изгибах горлышка. Но стоило отломить его, как вскоре на среде вырастали колонии микроорганизмов. В 1862 Парижская Академия присудила Пастеру премию за разрешение вопроса о самозарождении жизни.
Изучение инфекционных заболеваний
В 1864 году к Пастеру обращаются французские виноделы с просьбой помочь им в разработке средств и методов борьбы с болезнями вина. Результатом его исследований явилась монография, в которой Пастер показал, что болезни вина вызываются различными микроорганизмами, причем каждая болезнь имеет особого возбудителя. Для уничтожения вредных «организованных ферментов» он предложил прогревать вино при температуре 50—60 градусов. Этот метод, получивший название пастеризации, нашел широкое применение и в лабораториях, и в пищевой промышленности.
В 1865 Пастер был приглашен своим бывшим учителем на юг Франции чтобы найти причину болезни шелковичных червей. После публикации в 1876 работы Роберта Коха «Этиология сибирской язвы» Пастер полностью посвятил себя иммунологии, окончательно установив специфичность возбудителей сибирской язвы, родильной горячки, холеры, бешенства, куриной холеры и др. болезней, развил представления об искусственном иммунитете, предложил метод предохранительных прививок, в частности от сибирской язвы (1881), бешенства (совместно с Эмилем Ру 1885).
Первая прививка против бешенства была сделана 6 июля 1885 года 9-летнему Йозефу Майстеру по просьбе его матери. Лечение закончилось успешно, мальчик поправился.
Интересные факты
Пастер всю жизнь занимался биологией и лечил людей, не получив ни медицинского, ни биологического образования. Также Пастер в детстве занимался живописью. Когда Жаром увидел спустя годы его работы он сказал, как хорошо что Луи выбрал науку, так как он был бы нам большой конкурент.
В 1868 году (в возрасте 46 лет) у Пастера произошло кровоизлияние в мозг. Он остался инвалидом: левая рука бездействовала, левая нога волочилась по земле. Он едва не погиб, но в конце концов поправился. Более того, он совершил после этого самые великие открытия: создал вакцину против сибирской язвы и прививки против бешенства. Когда гениальный ученый умер, оказалось, что огромная часть мозга была у него разрушена .
Пастер был страстный патриот и ненавистник немцев. Когда ему приносили с почты немецкую книгу или брошюру, он брал ее двумя пальцами и отбрасывал с чувством великого отвращения. Позднее, в отместку его именем был назван род бактерий — пастерелла (Pasteurella), вызывающих септические заболевания, и к открытию которых он, по-видимому, не имел отношения.
faqo.ru
 великого французского химика и микробиолога Луи Пастера перед человечеством: во-первых, он родился 27 декабря, и в этом году мы отмечаем 193-ю годовщину с его рождения. Во-вторых, его вклад в развитие науки трудно переоценить, а рассказы о таких людях и их достижениях обычно вдохновляют и заряжают энтузиазмом. Согласитесь, в преддверии Нового года это весьма актуально.
великого французского химика и микробиолога Луи Пастера перед человечеством: во-первых, он родился 27 декабря, и в этом году мы отмечаем 193-ю годовщину с его рождения. Во-вторых, его вклад в развитие науки трудно переоценить, а рассказы о таких людях и их достижениях обычно вдохновляют и заряжают энтузиазмом. Согласитесь, в преддверии Нового года это весьма актуально.  Этого достаточно, чтобы убить вредные бактерии, не повлияв на качества самого продукта.
Этого достаточно, чтобы убить вредные бактерии, не повлияв на качества самого продукта. После первого же удачного опыта на человеке в июле 1885 года, в Париж стали приезжать люди со всей Европы, надеясь на исцеление от ранее смертельной болезни. Например, в группе из 19-и русских крестьян удалось вылечить 16, хотя с момента заражения прошло целых 12 дней. Илья Мечников, работавший с Пастером, назвал разработку вакцины от бешенства его «лебединой песней».
После первого же удачного опыта на человеке в июле 1885 года, в Париж стали приезжать люди со всей Европы, надеясь на исцеление от ранее смертельной болезни. Например, в группе из 19-и русских крестьян удалось вылечить 16, хотя с момента заражения прошло целых 12 дней. Илья Мечников, работавший с Пастером, назвал разработку вакцины от бешенства его «лебединой песней».







 (Назад)
(Назад) (Cкачать работу)
(Cкачать работу)