|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Болевые синдромы как междисциплинарная проблема. Боль и болевой синдром междисциплинарный подход к лечению боли реферат
Болевые синдромы как междисциплинарная проблема
Опубликовано в журнале: РМЖ »» БОЛЕВЫЕ СИНДРОМЫПрофессор В.В. Бадокин РМАПО
Основными клиническими проявлениями большинства воспалительных и дегенеративных заболеваний позвоночника и суставов являются боль, мышечный спазм, ригидность и ограничение подвижности. Все эти проявления находятся в тесной взаимосвязи и активно воздействуют друг на друга. В частности, на функциональную недостаточность опорно–двигательного аппарата (во всяком случае, в ранний период развития этих заболеваний) значительное воздействие оказывает выраженность не только боли, но также и утренней скованности. Боль и ригидность наиболее присущи ревматоидному артриту, анкилозирующему спондилиту (АС) и другим серонегативным спондилоартритам, включая псориатический и реактивный артриты, поражению суставов и позвоночника при воспалительных заболеваниях кишечника (неспецифическом язвенном колите и терминальном илеите), недифференцированном спондилоартрите. Эти же проявления присущи и многим другим заболеваниям, которые составляют содержание дорсопатий.
Боль и ригидность прежде всего имеют большое значение в полиморфной картине АС и других спондилоартропатий. Известно, что боль воспалительного типа в позвоночнике входит в диагностические критерии АС. Модифицированные критерии воспалительной боли в спине включают: утреннюю скованность более 30 мин., улучшение после выполнения физических упражнений, пробуждение во второй половине ночи из–за перемежающей боли в ягодицах [1]. Боль в спине считается воспалительной при наличии как минимум 2 из 4 перечисленных признаков, при этом чувствительность этих критериев составляет 70,3% и специфичность – 81,2%.
Динамика интенсивности боли является одним из показателей ответа на проводимую терапию и критерием ремиссии при этом заболевании (ASAS response criteria и ASAS remission criteria) [2]. Что касается ригидности или скованности, то этот симптом, также как и при ревматоидном артрите, адекватно отображает активность воспалительного процесса при анкилозирующем спондилоартрите (АС), причем в большей степени, чем такие лабораторные тесты, как СОЭ и уровень С–реактивного белка. Динамика выраженности и продолжительности утренней скованности также позволяет судить об эффективности проводимой терапии. Для анкилозирующего спондилоартрита и других спондилоартритов это тем более важно, что при этой группе заболеваний наблюдается диссонанс между клиническими и лабораторными показателями активности заболевания и нередко выраженный воспалительный процесс может протекать с нормальными или субнормальными лабораторными показателями в течение длительного периода, а подчас и всего заболевания.
В дебюте АС ригидность или скованность наблюдается преимущественно в поясничном отделе позвоночника и постепенно распространяется по всему осевому скелету. Она обычно более выражена в ранние утренние часы, но у некоторых больных с высокой активностью воспалительного процесса держится на протяжении всего дня. Интенсивность и длительность ригидности соответствует интенсивности болей в позвоночнике, подчеркивая их единый генез. Наличие воспалительного процесса в осевом скелете вызывает рефлекторное напряжение мышц спины, что, в свою очередь, приводит к изменению осанки и деформации позвоночника(нивелируется физиологический лордоз в поясничном отделе позвоночника, подчеркивается кифоз в грудном и развивается гиперлордоз в шейном отделе). В далеко зашедших случаях формируется характерная для больных АС поза «просителя» с положительным симптомом Форестье, высокими значениями теста Томайера и значительным нарушением функциональной способности позвоночника, причем ограничение подвижности и деформация позвоночника поддерживаются не только структурными изменениями в суставах и связках позвоночника, но и гипертонусом мышц.
Причинами болевого синдрома при АС являются воспалительные изменения в периферических, корневых и крестцово–подвздошных суставах, а также в позвоночнике. Как известно, все структуры позвоночного столба, за исключением костной ткани, содержат нервные окончания и могут быть причиной появления боли [3]. Свободные нервные окончания, выполняющие функцию болевых рецепторов, выявлены в капсулах межпозвонковых суставов, задней продольной и межостистой связках, периосте позвонков, стенках артериол и вен, сосудах паравертебральных мышц, наружной трети фиброзного кольца межпозвоночных дисков. Боли в позвоночнике при этом заболевании могут быть проявлением вертеброгенного корешкового синдрома (радикулопатии) или рефлекторных болевых синдромов.
При АС возможно формирование рефлекторных (мышечно–тонических) синдромов, которые обусловлены раздражением рецепторов в ответ на изменения в дисках, связках и суставах позвоночника. Импульсы от рецепторов достигают двигательных нейронов спинного мозга, что приводит к повышению тонуса соответствующих мышц. Спазмированные мышцы, в свою очередь, способствуют ограничению подвижности определенного сегмента позвоночника, а также становятся вторичным источником боли, который запускает порочный круг «боль – мышечный спазм – боль». Такие изменения сохраняются в течение длительного времени и способствуют формированию миофасциального синдрома [3]. Следует отметить, что в генезе развития контрактур и тугоподвижности позвоночника принимает участие гипертонус поперечно–полосатой мускулатуры. Одним из клинических проявлений такого гипертонуса является симптом «вожжей», который обусловлен заинтересованностью длинных мышц спины. Некоторые авторы рассматривают повышение мышечного тонуса как фактор риска неблагоприятного прогноза АС.
Среди отдельных болевых синдромов, которые встречаются в практике врача–ревматолога, болевой синдром в области позвоночника является наиболее распространенным вариантом, связанным с патологией опорно–двигательного аппарата. Известно, что боли в позвоночнике занимают 5 место среди всех причин обращений к врачу и 2 среди причин утраты трудоспособности. С ними связано примерно 25% от общих потерь рабочего времени. Важным обстоятельством является тот факт, что наибольшая распространенность болей в позвоночнике падает на молодой возраст (от 30 до 50 лет).
Боль и/или ригидность являются типичными симптомами не только воспалительных, но и дегенеративных заболеваний позвоночника. Большое значение придается боли, которая локализуется между 12–й парой ребер и ягодичной складкой. Она обозначается как поясничная боль или боль в нижней части спины (low back pain) [4]. Все заболевания, сопровождающиеся неспецифической болью в позвоночнике, в настоящее время объединены термином дорсопатии и включают в себя синдромы вертеброгенного и невертеброгенного генеза [5]. К заболеваниям вертеброгенного генеза относятся прежде всего дегенеративные заболевания позвоночника, а именно межпозвонковый остеохондроз и деформирующий спондилоартроз, а также нестабильность позвоночника с формированием спондилолистеза или грыжи диска, являющиеся, как правило, производными межпозвонкового остеохондроза. К этой группе относятся также спинальный стеноз, патологические переломы при остеопорозе, травматические повреждения позвоночника и наиболее частое поражение – мышечно–тонический синдром. Что же касается невертеброгенных причин, то они вызваны патологией мышц и связок спины, поражением внутренних органов, забрюшинного пространства, психическими расстройствами и т.д.
Мышечно–тонический (миофасциальный) синдром имеет четко очерченную клиническую картину. Он встречается у 30–85% больных со скелетно–мышечными болями. Основными причинами его развития являются аномалии развития костно–мышечного скелета, длительная иммобилизация мышцы и ее непосредственное сдавление, переохлаждение мышц, психические факторы и болезни внутренних органов и суставов. Этот симптомокомплекс характеризуется наличием триггерных точек, которые представляют собой ограниченные очаги локальной болезненности, расположенные в пучках напряженных мышечных волокон. Надавливание на такую точку обычно индуцирует не только локальную болезненность, но и боль в отдаленном участке. Активная триггерная точка является источником спонтанных болевых ощущений в покое и при движении, а также способствует нарушению функции мышцы и чаще локализуются в шее, плечевом и тазовом поясе, трапециевидной мышце, квадратной мышце поясницы. Диагностические критерии миофасциального синдрома включают спазмированную, болезненную мышцу, наличие болезненного мышечного уплотнения и активные триггерные точки.
Дорсопатия может быть связана с компрессией спинальных корешков и их ишемией (невропатическая или радикулярная боль). При компрессии корешков, которые обычно сопровождаются их отеком, наблюдается диссонанс между клинической картиной и выраженностью дегенеративных изменений, выявляемых рентгенографически. Сегментарная нестабильность позвоночника характерна для женщин среднего возраста с ожирением. Боль в спине при этом усиливается при нагрузке, ограничение подвижности позвоночника выражено незначительно, редко наблюдается и неврологическая симптоматика. Следует иметь в виду и наличие психогенной боли с локализацией в нижней части спины, которая возникает на фоне актуальной или хронической психотравмы. Для нее типичны тревожно–депрессивные расстройства, умеренно выраженный мышечно–тонический синдром, боль в пояснице при аксиальной нагрузке, несоответствие сенсорных расстройств зоне иннервации корешка.
При остеопорозе боль в позвоночнике является следствием имеющегося компрессионного перелома тел позвонков. Их диагностика ставится на основании снижения высоты тел позвонков или их клиновидной деформации. Для диагностики остеопороза важны также такие симптомы, как уменьшение роста, «круглая» спина, изменение осанки, эпизоды болей в спине, утомляемость и ноющие боли в спине после вынужденного пребывания в одном положении или длительной ходьбы, однако основное значение придается снижению минеральной плотности костной ткани. При остеопорозе выделяют 4 типа боли [6]:
1) Острая боль при свежем переломе позвонка, которая иррадиирует в грудную клетку, брюшную полость или бедро и резко ограничивает движения. Такая боль обычно резкая, усиливается при минимальных движениях, длится 1–2 нед. и затем постепенно стихает в течение 2–3 мес. 2) Боль, связанная со снижением высоты тел позвонков (вертебральный коллапс). Она является следствием увеличения поясничного лордоза, компенсирующего увеличение переднезадней кривизны в месте перелома. 3) Боль в спине, возникающая при множественных компрессионных переломах. Обычно она незначительно выражена и персистирует вследствие механического сдавления связок, мышц или мест их прикрепления. 4) Выраженный кифоз и снижение роста могут быть причиной боли от давления на ребра, на гребень подвздошных костей и межвертебральные суставные поверхности.
Для дегенеративных заболеваний позвоночника или его нестабильности, как и для остеопороза, типичны боли механического характера. Они характеризуются постепенным развитием, усилением в положении стоя, при физической нагрузке или к концу дня, минимальной утренней скованностью (<30 мин.), а также уменьшением объема движений. Выявление воспалительного или механического характера боли в позвоночнике имеет большое значение при проведении дифференциальной диагностики заболеваний осевого скелета.
Болевые синдромы в осевом скелете периодически возникают почти у всех людей в возрасте после 40 лет. У лиц моложе 45 лет боли в нижней части спины являются самой частой причиной временной потери трудоспособности. При дегенеративных заболеваниях позвоночника основными патогенетическими факторами развития таких синдромов являются компрессионные механизмы и рефлекторные влияния с присоединением воспалительных нарушений, микроциркуляторных расстройств и их сочетаниями. Особенностью болевых синдромов в поясничном отделе позвоночника является сочетание рефлекторных мышечно–тонических и миофасциальных синдромов с изменениями в эмоциально–личностной сфере. При диагностике дорсопатий следует обращать внимание на факторы провоцирующие боль, ее характер, иррадиацию и время ее появления, возможное нарушение функции тазовых органов, наличие общих симптомов (лихорадка, снижение массы тела). Тщательное обследование пациента требуется при наличии стойких болей в спине, их воспалительном ритме и их постепенном нарастании, онкологическом анамнезе, течении болезни на фоне лихорадки, симптомов поражения спинного мозга или лабораторных показателей воспалительной активности.
Наиболее часто в клинической практике встречаются рефлекторные болевые синдромы (около 85% больных с болями в спине) [3]. Они обусловлены раздражением как рецепторов фиброзного кольца, так и мышечно–суставных структур позвоночника и обычно не сопровождаются неврологическими нарушениями. В таких случаях рано развивается мышечный спазм, который поначалу носит характер защитного физиологического феномена, повышая болевой порог и ограничивая подвижность заинтересованного отдела позвоночника. Спазмированные мышцы являются вторичным источником боли, и они запускают порочный круг, что и способствует развитию миофасциального синдрома.
При многих ревматических заболеваниях формируется синдром спастичности, хотя и не в столь яркой форме, как это наблюдается в неврологической практике. Под спастичностью понимают двигательное расстройство, сопровождающееся повышением мышечного тонуса и обусловленное поражением кортикоспинального пути [7]. Синдром спастичности является проявлением заинтересованности верхних мотонейронов. К разнообразной симптоматике поражения этих мотонейронов, помимо ригидности мышц, относятся мышечная атрофия и развитие контрактур. Регуляция мышечного тонуса осуществляется под влиянием центральной и периферической импульсации α–мотонейронов спинного мозга. Эти мотонейроны, расположенные в передних рогах спинного мозга, осуществляют иннервацию мышечных волокон [7]. В основе возникновения спастичности лежит нарушение тормозящих влияний супраспинальных отделов на спинальные двигательные и вставочные нейроны. Эти нарушения на спинальном уровне приводят к дисбалансу процессов возбуждения и торможения. В происхождении спастичности принимает участие не только дисфункция центральной и периферической нервной системы. Не меньшее значение в этом процессе имеет органическое и функциональное состояние поперечно–полосатой мускулатуры.
Терапия болевых синдромов зависит от характера основного заболевания, этапности их развития и их интенсивности, наличии спастического компонента. Терапия вертеброгенной боли требует индивидуального и комплексного подхода с учетом фазы патологического процесса. Основные принципы лечения болей в позвоночнике является исключение неблагоприятных статико–динамических нагрузок, стимулирование активности мышц позвоночника, воздействие на вертебральные и экстравертебральные очаги поражения, назначение противовоспалительных препаратов, щадящий характер лечебных воздействий. Фармакотерапия направлена на купирование боли простыми или опиоидными аналгетиками, обезболивающими коктейлями или блокадами, а также назначение антиконвульсантов и антидепрессантов, проведение противовоспалительной терапии (НПВП, глюкокортикоиды), прием миорелаксантов, антихолинэстеразных средств. Важное значение имеет назначение препаратов, способных не только обезболить, но и разорвать порочный круг «боль – спазм – боль», который является одним из предикторов хронизации боли. К таким препаратам относится Катадолон.
Катадолон (флупиритина малеат) является ненаркотическим анальгетиком центрального действия нового класса веществ SNEPCO («Selective Neuronal Potassium Channel Opener» – «селективных активаторов калиевых нейрональных каналов»). Флупиртин является производным триаминопиридинов. Этот препарат обеспечивает несколько эффектов: обезболивание, нормализацию повышенного мышечного тонуса, нейропротекцию и прерывание хронизации боли (табл. 1).
Таблица 1. Механизмы реализации аналгетической активности Катадолона
| • Селективное открытие K+ каналов, что способствует стабилизации потенциала покоя нервной клетки (нейрон становится менее возбудимым) |
| • Блокада кальциевых каналов и снижение внутриклеточного тока ионов кальция (непрямой антагонист NMDA-рецепторов), (нейропротекция) |
| • Торможение возбуждения нейрона в ответ на ноцицептивные стимулы (анальгезия) |
| • Избирательное подавление боли на уровне чувствительных нейронов задних рогов спинного мозга |
| • Блокирование передачи возбуждения на мотонейроны и промежуточные нейроны приводит к снятию мышечного напряжения (миорелаксация). |
Фармакологическая активность Катадолона основана на непрямом антагонизме препарата по отношению к NMDA (N–метил–D–аспартат) – рецепторам, принимающих активное участие в нисходящих механизмах модуляции боли и ГАМК–ергических процессов [8]. Катадолон в терапевтических дозах открывает потенциал–независимые каналы ионов калия, что приводит к стабилизации мембранного потенциала нервной клетки и торможению возбуждения нейрона в ответ на ноцицептивные стимулы. В результате сдерживается формирование ноцицептивной сенситизации (болевой чувствительности) и феномена wind up («взвинчивания» – нарастания нейронального ответа на повторные болевые стимулы). Это ведет к предотвращению усиления боли и переходу ее в хроническую форму, а при уже имеющемся хроническом болевом синдроме – к снижению его интенсивности. Известно, что Катадолон воздействует на восприятие боли как на спинальном, так и супраспинальном (таламическом) уровне.
Миорелаксирующее действие Катадолона связано с блокированием передачи возбуждения на мотонейроны и промежуточные нейроны, что и приводит к снятию мышечного напряжения. Что же касается нейропротективных свойств этого препарата, обусловливающих защиту нервных структур от токсического действия высоких концентраций ионов внутриклеточного кальция, то оно связано с его способностью блокировать нейрональные ионные кальциевые каналы и снижать внутриклеточный ток ионов кальция. Миорелаксация, вызванная применением Катадолона, не приводит к генерализованной мышечной слабости, поскольку расслабляет спазмированные мышцы только в очаге боли.
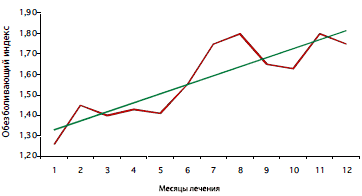
При длительном применении Катадолона (на протяжении ряда месяцев и даже лет) его обезболивающий эффект не только не уменьшается, но в ряде случаев становится более выраженным (рис. 1). Он способен вмешиваться в специфические механизмы хронической боли и прерывать ее за счет стабилизации мембранного потенциала, что позволяет «стереть» болевую память и снизить болевую чувствительность [9]. Кроме того, он сдерживает формирование болевой гиперчувствительности и феномена «взвинчивания», т.е. нарастания боли в ответ на повторные подпороговые неболевые стимулы. При комбинированном применении с НПВП Катадолон усиливает аналгетические свойства НПВП и позволяет снизить их суточную дозу. В то же время он лишен многих негативных особенностей НПВП, в частности не влияет на слизистую ЖКТ. Следует отметить, что при этом препарат не вызывает зависимости и привыкания.
Рис. 1. Возрастание аналгетического эффекта Катадолона в зависимости от длительности приема [9]
 |
Эффективность Катадолона продемонстрирована в многочисленных рандомизированных контролируемых исследованиях, в которых он сравнивался с другими аналгетиками или плацебо. Наибольшее количество таких исследований проведено при дегенеративных заболеваниях позвоночника и миофасциальном синдроме [10]. При этих заболеваниях Катадолон оказывает выраженный обезболивающий эффект, а также уменьшает исходно повышенный мышечный тонус, особенно у больных с мышечно–тоническими и миофасциальными синдромами [11]. Хорошие результаты были получены и при лечении большой когорты больных с остеопорозом, сопровождающимся болями в позвоночнике [12].
Катадолон выпускается в капсулах по 100 мг. Он назначается внутрь с небольшим количеством жидкости (100 мл). Суточная доза составляет 300–400 мг. Максимальная суточная доза составляет не более 600 мг. Дозу подбирают в зависимости от интенсивности боли и индивидуальной чувствительности больного к препарату. У больных с выраженными признаками почечной недостаточности или при гипоальбуминемии суточная доза не должна превышать 300 мг, как и у больных с нарушением функциональной активности печени. Длительность терапии зависит от динамики болевого синдрома и переносимости, однако следует отметить, что Катадолон необходимо принимать курсами, длительностью не менее 2–х недель.
Рис. 2. Переносимость Катадолона, по оценке врача и пациента [14]
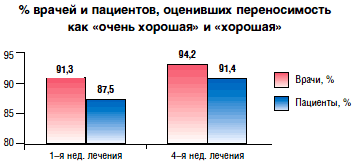 |
Рис. 3. Снижение частоты развития нежелательных явлений при длительном применении Катадолона [14]
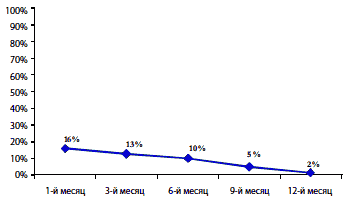 |
При применении Катадолона возможно развитие нежелательных реакций. Наиболее часто наблюдается общая слабость, которая обычно сопровождает начальный период лечения, реже – головокружение, головная боль, тошнота, рвота, изжога, нарушения стула, метеоризм, боль в животе, сухость во рту, потеря аппетита, нарушение сна, беспокойство, нервозность, тремор. Крайне редко наблюдаются спутанность сознания, нарушения зрения и аллергические реакции (повышенная температура тела, крапивница и зуд), а также повышение активности печеночных трансаминаз и синдром холестаза. Большинство из этих проявлений носят транзиторный характер и после отмены препарата или даже на фоне его приема полностью проходят без каких–либо дополнительных лечебных мероприятий. Катадолон усиливает действие алкоголя, седативных средств и миорелаксантов. При одновременном его назначении и производных кумарина рекомендуется регулярно контролировать протромбиновый индекс. Следует избегать комбинированного применения Катадолона и лекарственных средств, содержащих парацетамол. Однако переносимость препарата хорошая, и он высоко безопасен (рис. 2 и 3). В двойном слепом исследовании было показано, что нежелательные явления на фоне приема Катадолона встречаются в 3 раза реже по сравнению с трамадолом [13].
Согласно рекомендациям Немецкой ассоциации по изучению боли, Катадолон можно назначать на любом этапе развития болевого синдрома, а именно при острой, подострой и хронической боли [15]. Основным показанием для лечения этим препаратом являются боли в спине, ассоциированные с повышенным тонусом скелетной мускулатуры, что имеет место при многих воспалительных и дегенеративных заболеваниях позвоночника. Наиболее характерна такая ситуация для межпозвонкового остеохондроза, деформирующего спондилеза, артроза межпозвонковых (фасеточных) суставов, грыж межпозвонковых дисков, спондилолистеза, миофасциального синдрома, а также спондилоартритов/спондилоартропатий, включая анкилозирующий спондилит. Кроме того, этот препарат рекомендуется для лечения головной боли напряжения, онкологической боли, компрессионных переломов позвоночника, связанных с остеопорозом, послеоперационной и посттравматической боли, дисменорее. Катадолон является препаратом, который вбирает в себя фармакологическую активность как анальгетиков,так и миорелаксантов, при высоком профиле безопасности и его следует шире использовать в клинической практике врачами различных специальностей.
Литература
- Sieper J, Appel H, Braun J, Rudwaleit M: Critical appraisal of assessment of structural damage in ankylosing spondylitis: implications for treatment outcomes. Arthritis Rheum 2006; 54: 678–81.
- Dougados M., Dijrmans B., Khan M. et al. Сonventional treatments for ankylosing spondylitis. Ann Rheum Dis 2002; 61 (Suppl. III): 40–50.
- Алексеев В.В. Диагностика и лечение болей в спине. Соnsilium medicus 2002; 4 (2): 96–102.
- Насонова В.А. Боль в нижней части спины – большая медицинская и социальная проблема, методы лечения. Соnsilium medicus 2004; 6 (8): 536–41.
- Неспецифическая боль в нижней части поясницы / Клинические рекомендации. М., 2008.
- Рожинская Л.Я. Системный остеопороз / Практическое руководство для врачей. М., Издатель Мокеев, 2000 г.
- Дамулин И.В. Синдром спастичности и основные направления его лечения. Журнал неврологии и психиатрии 2003; 12: 4–9.
- Schuster D., Schwarz M., Block M. еt al. Flupirtine: a review of its neuroprotective and behavioral properties. CNS drugs, 1997; 12: 13–8.
- Herrmann WM et al. Long–Term Tolerability of Flupirtine. An Open, Multi–center Study of One Year Duration. Fortschr Med 1993; 111(15): 266–70.
- Mueller–Schwefe G. Flupertine in acute and chronic pain associated with мuscle tenseness. Results of a postmarketing surveillance study. Forschr Med 2003; 121: 3–10.
- Jurna I., Nickel B., Lobisch M. et al. Analgetisch und mioralaxierend: Flupirtine. Pharmazie 1992; 137 (35): 24–32.
- Ringe J., Miethe D., Pittrow D., Wegscheider K. Analgetic Effect of Flupirtine in Primary Care of Patients with Osteoporosis Related Pain. Fortschr. Med. 2003; 53 (7): 496–502.
- Luben V, Muller H., Lobisch M., Worz R. Treatment of cancer pain with fluprofene. Results of double–blind study versus tramadol. Forschr Med 1994; 112 (19): 282–6.
- Herrmann WM et al. Long–Term Tolerability of Flupirtine. An Open, Multi–center Study of One Year Duration. Fortschr Med 1993; 111 (15): 266–70.
- Worz R, Mueller–Schwefe G., Stroehmann I. et al. Back pain: Guidelines for drug therapy. Fortschr Med.2000; 142 (5): 27–33.
Комментарии (видны только специалистам, верифицированным редакцией МЕДИ РУ)
medi.ru
Боль – междисциплинарная проблема | Голубев В.Л.
Для цитирования: Голубев В.Л. Боль – междисциплинарная проблема // РМЖ. 2008. С. 3
Боль несомненно относится к самым частым жалобам, с которыми имеют дело врачи самых разных специальностей в своей повседневной практике. По данным ВОЗ, в развитых странах мира боль по масштабам своего распространения вполне сопоставима с пандемией.
Боль – субъективный феномен, плохо поддающийся какой–либо объективизации. В то же время она приносит человеку максимальные страдания. Совсем непросто дать боли исчерпывающее определение. Согласно наиболее распространенной сегодня научной дефиниции «боль – это неприятное ощущение и эмоциональное переживание, связанное с текущим или потенциальным тканевым повреждением или описываемое в терминах такого повреждения». Как это ни парадоксально на первый взгляд, боль рассматривается как важнейшее биологическое приобретение; она – не только проявление болезни, но и сигнал опасности. В этом ее огромное приспособительное значение. Сигнальное значение боли особенно характерно для острой боли. Хроническая боль – совсем другая категория. Она отличается от острой боли не столько своей длительностью, сколько своим патогенезом, клиническими проявлениями, а также лечением и прогнозом. Острая боль – это прежде всего сигнал какого–то повреждения ткани, в основе которого лежит местный патологический процесс, связанный, например, с травмой, воспалением, инфекцией и т.д. Острая боль уменьшается под влиянием анальгетиков. Хроническая боль продолжается более 3–6 месяцев, т.е. сверх обычного периода заживления тканей, она нередко носит более диффузный характер. Хроническая боль утрачивает свое полезное сигнальное значение; она как бы отрывается от конкретных местных патологических процессов, вызвавших острую боль, и начинает существовать уже по своим закономерностям. В генезе хронической боли, как было установлено в последние годы, среди прочих условий большую (но не исключительную) роль играет психический фактор. Если острая боль справедливо рассматривается как симптом, то хроническая боль может приобретать черты болезни («боль как болезнь» – Loeser J., 2006), которая проявляется не только болью, но и вегетативными, эмоциональными и другими психическими нарушениями, формированием неадаптивного болевого поведения. Помимо принципиального разделения боли на острую и хроническую, существует множество других классификаций боли. С общих клинических позиций выделяют местную, отраженную, иррадиирующую и генерализованную боль. Для невролога очень важна классификация, предусматривающая выделение ноцицептивной, нейропатической и психогенной боли. В неврологической практике чаще всего встречаются боли в спине и шее, головные боли. Помимо дорсалгий и цефалгий, достаточно распространены также абдоминалгии, торакалгии и кардиалгии, в том числе прозопалгии, несколько реже – боли другой локализации. Эта терминология отражает топографическую классификацию болевого синдрома. Последняя иногда дополняется другой классификацией, указывающей на источник боли. В частности, боли разной локализации могут иметь сосудистое, мышечно–скелетное, радикулопатическое, висцеральное или иное, в том числе психогенное, происхождение. Внутри отдельных топографически очерченных болевых синдромов разработаны еще более детализированные классификации, важные для практического использования. Предпринимаются попытки создать подробные классификации (например, боли в спине или в руке, боли в области шеи и руки или в области таза). В этих классификациях определено место для любого болевого синдрома, в том числе редкого (например, гломусной опухоли руки, шейно–язычного синдрома, вульводинии и т.д.). Неудивительно, что такие классификации выглядят иногда чрезвычайно объемными. Например, современная классификация головной боли, разработанная классификационным комитетом международного общества головной боли, насчитывает уже более 100 (!) форм. Таким образом складывается ситуация, при которой исследование боли превращается в глобальную и в высшей степени актуальную проблему, которая интенсивно изучается внутри отдельных медицинских специальностей. К последним относятся кардиология, гастроэнтерология, ревматология и другие терапевтические дисциплины, хирургия, онкология, анестезиология, неврология, нейрохирургия, паллиативная медицина, физиология и многие другие медицинские специальности. В США создано свыше 2000 клиник и центров по изучению и лечению боли. Получил распространение термин «медицина боли». В соответствии с этой тенденцией Конгресс США объявил 2001–2010 годы декадой контроля над болью и науки о боли. Более того, алгология, как наука о боли, признана в США самостоятельной медицинской специальностью и три американские ассоциации проводят сертификацию врачей по боли. Появились специальные журналы, целиком предназначенные для освещения проблемы боли. Такая тенденция в последние годы отчетливо просматривается и в России. Этот процесс повсеместной актуализации проблемы боли не является случайным и отражает назревшую необходимость интеграции отдельных дисциплин, изучающих различные аспекты боли, в рамках одного научного направления, получившего название алгологии. Среди многих дисциплин, имеющих отношение к изучению механизмов боли, центральное место, по–видимому, должна занять неврология. Совершенно очевидно, что неврология ближе других медицинских специальностей стоит к нейрофизиологии и нейрохимии, на достижениях которых зиждется все современное здание учения о боли. Однако неврология еще не взяла на себя в полной мере роль такой координирующей функции по отношению к исследованию проблемы боли. Это то, что еще предстоит сделать в ближайшем будущем. По данным Hansson P.T. (2006), из 7000 членов международной ассоциации по изучению боли (IASP) неврологи составляют менее 300 человек, что составляет примерно 4% от общего числа членов этой ассоциации. Но природа феномена боли такова, что настоятельно требует для своего изучения именно неврологической компетенции. Ведь боль является прежде всего феноменом соматосенсорной системы. Она может сопровождаться также разнообразными моторными, вегетативными, аффективными и другими проявлениями так называемого болевого поведения. Методы, используемые для изучения боли, относятся в основным к электрофизиологическим (вызванные потенциалы, в том числе тригеминальные; количественное сенсорное тестирование; ноцицептивный флексорный рефлекс и другие) и используются в основном в клинике нервных болезней. Методы лечения боли, в том числе с помощью инвазивных методик (стимуляция спинного мозга, глубокая стимуляция мозга и стимуляция моторной коры), также требуют неврологического подхода. Наконец, понимание интимных механизмов патогенеза боли (таких, например, как сенситизация ноцицепторов и центральная сенситизация, феномен «взвинчивания» («wind–up»), деафферентационная гиперчувствительность, воротный контроль боли и.т.д.) предполагает владение нейроанатомическими, нейрохимическими и нейрофизиологическими знаниями. Роль невролога еще более возрастает при изучении так называемой нейропатической и хронической боли. Если врачи общей практики чаще имеют дело с ноцицептивной болью, возникновение которой связано с активацией периферических болевых рецепторов (ноцицепторов), то невролог встречается, кроме того, со всеми вариантами нейропатической боли, возникающей при поражении соматосенсорной системы на любом ее уровне, начиная от периферического нерва и кончая корой головного мозга. Таким образом, нейропатическая боль может быть как периферической, так и центральной. Все виды нейропатической боли, независимо от причины ее вызвавшей, имеют некоторые общие особенности: персистирующий характер, неэффективность анальгетиков, многообразное сенсорное сопровождение (парестезии, невралгия, гиперестезия, гипералгезия, аллодиния), сочетание с вегетативными и моторными расстройствами. Хроническая боль, как уже говорилось выше, имеет существенные отличия в своих клинических проявлениях от острой боли и, что очень важно, в подавляющем большинстве случаев (более 80–90%) сопровождается эмоциональными и другими психическими нарушениями. Таким образом, боль имеет различные уровни своего выражения (рис. 1). Ощущение боли возникает прежде всего в результате активации ноцицепторов. Ноцицепция, тем самым, является первым уровнем или первым компонентом болевого восприятия. Само болевое ощущение обеспечивается функционированием всей ноцицептивной системы, которая, кроме ноцицепторов и сложной афферентации, имеет также спинальный и церебральный уровень своей организации. На активность ноцицептивной системы оказывает влияние антиноцицептивная система. Результатом их взаимоотношений и является субъективная интенсивность боли. Следующий более высокий уровень включает в себя аффективный компонент переживания боли. Он обеспечивается связями ноцицептивной и антиноцицептивной системы с другими областями мозга, такими как лимбическая система. Наконец, переживание боли определенным образом проявляется в поведении человека, которое имеет множество других более сложных детерминантов (наследственность, воспитание, «болевой опыт», образование, особенности личности и т.д.). Взаимодействие указанных уровней в конечном итоге и определяет конкретный уровень толерантности боли. Перцепция боли, ее осознание и субъективное переживание, как и ее отражение в поведении человека имеют в своей основе достаточно сложную мозговую организацию, которая испытывает также влияние других, в том числе половых, гендерных и социо–культуральных факторов. Таким образом, феномен боли может и должен стать предметом более широкого междисциплинарного исследования, в котором неврология по праву является связующим звеном, выполняющим важную интегрирующую функцию. Понятно, что дальнейшее развитие медицины боли имеет огромное практическое значение. Как показывают специальные исследования, недостаточная эффективность лечения многих болевых синдромов часто обусловлена недостаточным знакомством врачей с современными достижениями алгологии и, как следствие – неполным обследованием пациента, неправильной тактикой лечения или неполным объемом терапии, неадекватным выбором терапевтических методов и средств и т.п. С неврологической точки зрения лечение боли должно строиться с учетом общих представлений о патогенезе боли и клинико–физиологических особенностей отдельных болевых синдромов. Роль невролога становится очевидной еще и потому, что терапия отдельных болевых синдромов существенным образом зависит от того, как будет интерпретирован характер боли (ноциптивная, нейропатическая, психогенная и т.д.), что, несомненно, легче сделать неврологу, чем врачу какой–либо иной специальности. Известно, что основой симптоматического лечения острой боли является применение обезболивающих лекарственных средств. В настоящее время для фармакотерапии острых болевых синдромов разной природы используют ненаркотические и наркотические анальгетики, а также анестетики с разной выраженностью обезболивающего эффекта, сочетая их в случае необходимости с адъювантной терапией. Нейропатическая боль требует иных терапевтических подходов, в которых, помимо местных анестетиков, опиатов, комбинированных препаратов, более широко применяют антидепрессанты, антиконвульсанты, в том числе последнего поколения, блокаторы NMDA–рецепторов, а также нейростимуляционные и другие нелекарственные методы лечения. Большинство из указанных терапевтических средств требует предварительной консультации невролога. Существуют и другие достаточно распространенные варианты боли, например, такие как центральная боль, психогенная боль, фантомная боль, где главным образом невролог способен пролить свет на церебральные механизмы этих не совсем обычных болевых феноменов и попытаться оказать реальную помощь этим больным. Трудной для исследования и недостаточно разработанной остается концепция психогенной боли. В решении этого вопроса необходимы совместные усилия неврологов и психиатров. Таким образом, совершенно очевидно, что невролог становится одной из центральных фигур в междисциплинарном изучении боли. Именно благодаря неврологии представители разных специальностей, изучающие проблему боли, начинают говорить на общем и понятном друг другу языке. Не случайно в последние годы регулярно проводятся неврологические конференции разного масштаба, в том числе международные, посвященные медицине боли, которые собирают врачей разных специальностей. Такие творческие контакты и обмен опытом между специалистами разного профиля, безусловно способствуют более глубокому пониманию механизмов боли. Неврология, как центральная дисциплина в ряду многих других нейронаук, по праву должна занять лидирующие позиции в этом процессе познания боли, чтобы, в конечном итоге, научиться эффективно контролировать ее. Указанный выше круг вопросов, связанный с проблемами боли во врачебной практике, будет подробно обсуждаться на предстоящей междисциплинарной конференции («Вейновские чтения»), которая состоится в Москве 5–6 февраля 2008 года в Доме ученых РАН и о которой Русский медицинский журнал уже информировал читателя. Данная статья открывает цикл публикаций по вопросам, посвященным различным аспектам боли, которые будут более подробно обсуждаться на указанной конференции. Эти публикации призваны также служить приглашением заинтересованного читателя для участия в работе конференции.

Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
www.rmj.ru
Коррекция хронического болевого синдрома. Хроническая боль.
В практике врачей всех специальностей больные с хронической болью различной локализации встречаются часто. Высокая инвалидизация лиц трудоспособного возраста вследствие поражения опорно – двигательного аппарата возводят проблему лечения боли в ранг актуальной. В арсенале врачей разных специальностей (терапевтов, неврологов, ревматологов, травматологов) появился новый препарат ревмоксикам для терапии хронических болевых синдромов.
Боль, так же как голод и жажда, относятся к первичным феноменам жизни и является одной из самых полезных «изобретений» природы, поскольку именно она немедленно сигнализирует об опасности, грозящей организму со стороны повреждающего фактора и открывает путь к распознаванию и лечению многих заболеваний.
Боль для пациента–один из важнейших клинических признаков любого патологического процесса и одно из самых отрицательных проявлений болезни, принимая черты самостоятельного заболевания, она доставляет пациенту страдания, подтачивая его силы. Боль – наиболее частая причина обращения к врачу и она поражает наиболее трудоспособный возраст (от 30 до 50 лет).
Различают острую и хроническую боль. Острая боль непосредственно связана с повреждением поверхностных и глубоких тканей; длительность боли ограничивается временем восстановления поврежденных тканей, но требует курсового лечения. Через 6 месяцев острая боль приобретает хроническое течение. Хроническая боль – продолжается после завершения репарации ткани в «отрыве» от первоисточника болевой афферентации, требует постоянного купирования. Она сохраняется или появляется после заживления, не неся защитной функции, и напротив, становясь причиной страдания, связана с органическим поражением ПНС и ЦНС.
Различают хроническую боль воспалительного, механического, сосудистого, нейрогенного, ноцицептивного и психосоматического генеза. Хроническая боль может быть обусловлена различными патогенетическими механизмами. Она может быть следствием или симптомом многих заболеваний и развивается в тех случаях, когда происходит сенситизация последнего кортико – кортикального синаптического уровня афферентным сенсорным потоком.
Самые распространенные боли в суставах и перивентрикулярных тканях при остеоартрозе (ОА), боли в спине и в мышцах при синдроме фибромиалгии, при вертеброгенных заболеваниях. Хорошо известно развитие на фоне эндокринопатий, генетических дефектов или как исход воспалительных заболеваний суставов. У 40 % больных, страдающих боля в спине, она приобретает хронический характер.
Хроническая боль по природе является невропатической, но она может быть и ноцицептивной. В ряде случаев нейропатический болевой синдром возникает на фоне имеющейся ноцицептивной боли.
Понятие невропатической боли объединяет целую группу хронических болевых синдромов, которые ранее рассматривались самостоятельно. К этой группе относят болевой синдром при различных моно – и полинейропатиях (наиболее часто возникающих при диабетической и алкогольной полинейропатиях ), при органическом поражении или нарушении функции различных отделов нервной системы на любом уровне от периферических нервов до коры. Невропатическая боль обусловлена изменением состояния периферических и центральных отделов соматосенсорной системы: она плохо локализована, всегда сопровождается нарушением поверхностной чувствительности.
Считается, что ноцицептивная боль связана с воздействием на организм повреждающего фактора (воспаление, механическая травма, ожог) на периферические болевые рецепторы при интактности других отделов нервной системы, имеющего достаточную эффективность, чтобы вызвать генерацию потенциала действия в периферических болевых рецепторах. Ноцицепторы являются свободными нервными окончаниями, и реагирует лишь на патологические раздражители, т.е. возбуждаются во время работы мышц под влиянием алгических веществ в условиях ишемии, чтобы вызвать генерацию потенциала действия в периферических болевых рецепторах..
Отличительной чертой ноцицептивной боли, как особо тяжелого варианта хронической боли, являются постоянные интенсивные жгучие или простреливающие боль, которые продолжаются в течение трех – шести месяцев подряд. Она может исходить из поврежденного фиброзного кольца, мышц, суставов, связок и нервных корешков. Ноцицептивная боль – как сигнал болевого рецептора о нарушении целостности ткани и является транзиторной, острой, четко локализованной. К ней относятся мышечный спазм, артралгии, ожог и, боль, сопровождающую воспаление.
Группа смешанных болей включает люмбоишалгию, туннельные синдромы, онкологическую боль. Боль в спине имеет смешанное (и воспалительное, и миогенное) происхождение (включает ноцигенные и нейрогенные элементы, то есть многогранность клинических проявлений поясничной дорсоалгии у части пациентов обусловлена участием сразу нескольких механизмов формирования болевых ощущений. Хроническая боль, независимо от ее первоначальной причины, является следствие развертывания в периферической и центральной нервной системе в ответ на длительную болевую стимуляцию ряда последовательных изменений, постепенно приобретающих характер типичного патологического процесса.
Эти изменения сводятся в основном к следующему (Павленко С.С., 2003):
-
Усиление потока болевой импульсации с периферии вследствие повышенного высвобождения тканевых и плазменных алгенов (гистамин, серотонин простациклины, лейкотриены, цитокины, брадикинин) и развития периферической сенситизизации, проявляющейся первичной гиперальгезией и аллодинией;
-
Возникновение антидромной стимуляции и развития в месте поражения нейрогенного воспаления с высвобождением нейрогенных алгогенов и нейротрофических факторов (субстанция Р, кальцитонин – ген – связанный пептид), способствующих усилению периферической сенситизации и потока болевых импульсов в ЦНС;
-
Активация NMDA – рецепторов нейронов задних рогов спинного мозга, повышенное высвобождение в синапсах специфических нейромедиаторов и нейромодуляторов (глутамат, ионы кальция, окись азота, субстанция Р, нейрокинин -1), развитие центральной сенситизации с последующим истощением и гибелью нейронов, развитие зон вторичной гиперальгезии;
-
Ослабление и дезинтеграция естественной антиноцицептивной системы; развитие опиатной толератности.
- Образование в дорзальных рогах спинного мозга и других отделах центральной нервной системы агрегатов гиперативных нейронов с ослабленным тормозным контролем;
-
Формирование патологической алгической системы, включающей различные уровни ЦНС и определяющей течение и характер всех компонентов патологической боли: болевой перцепции, страдания и болевого поведения.
Исходя, из патогенеза хронической боли основными направлениями фармакотерапии хронических болевых синдромов должны быть следующие:
- – воздействие на периферическую ноцепцию с целью ликвидации или уменьшения периферической сенситизации;
- – воздействие на систему NMDA – рецепторов и синаптическую передачу болевых стимулов с целью снижения центральной сенситизации;
- - усиление влияния антиноцицептивной системы на передачу болевого сигнала;
- - воздействие на деятельность патологической алгической системы с целью ослабления ее влияния.
Ведущую роль в механизме формирования воспалительной боли (ноцицептивной и/ или невропатической) при повреждении тканей играет цикл арахидоновой кислоты и его конечные продукты распада – мощные медиаторы воспаления и боли: простагландины, простациклины и тромбоксан, брадикинин, субстанция Р.
При боли происходит выброс алгенных соединений в межклеточную жидкость, окружающую ноцицепторы, играющих ключевую роль в формировании боли, обусловленной повреждением, ишемией или воспалением. Они являются медиаторами воспаления и вызывают химическое раздражение болевых рецепторов.
Ключевую роль позицию в этом цикле занимает провоспалительный изофермент ЦОГ -2. Понимание, что ЦОГ играет огромную роль в индукции боли как в очаге воспаления, так и при ее передачи в спинной мозг, подавление воспалительной боли должно осуществляться с первую очередь нестероидных противоспалительных препаратов (НПВП). Они угнетают синтез провоспалительных медиаторов посредством блокады ЦОГ и способны прервать афферентную импульсацию из первоисточника боли – поврежденной соединительной ткани. Большинство НПВП не избирательно ингибируют ЦОГ.
К препаратам, селективно ингибирующем ЦОГ-2 относится ревмоксикам. Препарат принадлежит к классу оксикамов, является производным энолиевой кислоты. Это хондронейтральный препарат является избирательным ингигибитором ЦОГ-2.
Нами проведено исследование эффективности ревмоксикама у больных с хроническими болями различной локализации. Ревмоксикам назначался в дозе 7.5 мг (иногда в дозе 15 мг) в течение недели у 30 больных, страдающими болями различной локализации (5– боли суставов рук, 10–боли в области коленных суставов, 14– в области позвоночника, 1– мигренозные боли). У 25 больных боли уменьшились, у 4 – исчезли и только у 1 больной, в анамнезе которой был перелом ноги эффект не отмечался. Побочных эффектов у больных не наблюдалось.
Назначение ревмоксикама у больных болями в позвоночнике, в суставах рук и ног позволило быстро и эффективно купировать болевой синдром и снять ограничения двигательной активности, что позволяет снизить сроки реабилитации у больных с болевым синдромом при отсутствии выраженных побочных эффектов. Интенсивность болевых ощущений уменьшается уже в 1 –е сутки приема и эффект постепенно нарастал и достигал максимального уровня уже на 4-5 сутки. Препарат вызывал увеличение объема движений в суставах, уменьшение окружности пораженных суставов, преимущественно за счет ликвидации или уменьшения сопутствующего воспалительного процесса.
Таким образом Ревмоксикам является эффективным средством для снижения выраженности болевого синдрома при различной локализации болевых ощущений, в том числе при заболеваниях костно – мышечной системы (боль на уровне шейного и грудного отделов позвоночника, боль в нижней части спины, остеоартроз крупных суставов), наиболее он эффективен при остеоартрозе крупных суставов
Так как, хроническая боль требует подчас многолетней терапии для улучшения качества больного различными медикаментозными препаратами, то целесообразно использовать ревмоксикам (фирма «Фармак», Украина) при лечении боли различной локализации, учитывая, что препарат, воздействуя на патогенетические стороны боли, быстроту их купирования и отсутствия отрицательного воздействия на гастродуоденальную зону.
Литература:
- 1.П.Р. Камчатов. Современные подходы к ведению больных с болью в спине. CONSILIUMmedicum. Журнал доказательной медицины для практикующих врачей. Том 06/№6, 2004, -с. 1 -6.
- 2. Н.В. Чичасов, к.м.н. Е.В. Иголкина. Особенности лечения хронических болевых синдромов.
- 3. А.Н. Баринов, М.В. Новосадова. Периферические невропатии: практический подход к диагностике и лечению. Невр. Журн. 2002 №4, - с. 53 -61
- 4. В.В. Поворознюк. Боль в нижней части спины. Журнал для практических врачей, 2005, №115 -25
Фамилия автора: И.М. Кальменева
articlekz.com
Новые подходы в лечении пациентов с хронической болью | #04/09
Хроническая боль является чрезвычайно распространенным и недооцененным явлением. По данным широкомасштабного исследования Pain in Europe, в котором участвовало 46 000 человек из 16 стран, каждый пятый взрослый европеец страдает от хронической боли. В среднем продолжительность хронической боли составляет 7 лет. А каждый пятый больной испытывает хроническую боль в течение 20 лет и более [2]. По данным Российской ассоциации по изучению боли распространенность хронических болевых синдромов в России варьируется от 13,8% до 56,7%, составляя в среднем 34,3 случая на 100 человек. Более чем 40% людей, страдающих хронической болью, указывают на то, что боль серьезно снижает их качество жизни [1].
Лечение данной категории больных представляет собой большую трудность и требует особых подходов. В США, а в последнее время и в Европе получили распространение мультидисциплинарные специализированные центры для лечения пациентов, страдающих хронической болью. В основе лечебных программ, которые используются в этих центрах, лежит биопсихосоциокультурный подход.
Биопсихосоциокультурная модель боли
До недавнего времени была широко распространена биомедицинская модель, в соответствии с которой боль является результатом повреждения и выраженность боли коррелирует с выраженностью биологических изменений организма (т. е. чем значительнее повреждение, тем интенсивнее боль). Однако наш клинический опыт и данные многочисленных экспериментальных исследований указывают на то, что выявленная физическая патология не всегда коррелирует с интенсивностью боли или степенью нетрудоспособности. Стало очевидным, что хроническую боль невозможно объяснить с помощью биомедицинской модели. Исследования последних 30 лет продемонстрировали значимую роль психологических и социокультурных факторов в формировании и поддержании хронической боли. На основании полученных данных была предложена биопсихосоциокультурная модель боли. В соответствии с этой моделью боль представляет собой результат динамического взаимодействия биологических, психологических и социокультурных факторов [20]. Было показано, что в процессе хронизации боли на первый план выходят психологические и социальные факторы. В связи с этим для достижения успеха лечение должно быть направлено не только на физические аспекты, но и на когнитивные, эмоциональные и поведенческие факторы, связанные с хронической болью.
Биопсихосоциокультурный подход не заменяет традиционных методов лечения, но его можно использовать в виде дополнительного компонента при фармакологическом или хирургическом лечении хронической боли. Данный подход также лежит в основе специализированных мультидисциплинарных программ по лечению различных болевых синдромов.
Прежде чем перейти к конкретным подходам к лечению хронической боли, основанным на биопсихосоциальной модели, рассмотрим влияние психологических и социокультурных факторов на восприятие боли и развитие дезадаптации пациентов.
Психологические факторы и хроническая боль
Роль когнитивных факторов
Многочисленные исследования показывают, что ответ на лечение и исход заболевания во многом обусловлены когнитивными факторами: представлениями, установками и ожиданиями пациента.
Представления о боли
Клиницисты, работающие с пациентами с хронической болью, знают, что представления о боли у пациентов со схожей этиологий боли могут значительно отличаться. Некоторые представления приводят к неадекватной психофизиологической адаптации, обострению боли. Например, если боль интерпретируется как сигнал о постоянном повреждении ткани, а не как результат реальной проблемы, которую можно решить, это приводит к гораздо большим страданиям и нарушению поведения [18]. Если человек считает, что его боль непреодолима, он не прилагает усилий к адаптации, и ему не удается использовать когнитивные или поведенческие приемы, чтобы справляться с болью.
Боль способна изменить способ восприятия информации. Например, D. A. Williams и B. Thorn [23] обнаружили, что пациенты с хронической болью, которые считают свою боль «необъяснимой тайной», демонстрируют более высокий уровень психологического стресса и боли, а также более низкую приверженность лечению, чем те пациенты, которые считают, что понимают причины своей боли.
Представление о контроле над болью
Взаимосвязь между ощущением способности контролировать боль и самой болью была продемонстрирована при различных болевых синдромах. D. Mizener и соавт. [13] показали, что успешное лечение пациентов с мигренью сопровождалось повышением ощущения контроля над физиологической активностью и над своим здоровьем в целом, что в значительной мере коррелировало со снижением выраженности головной боли.
Хотя некоторые схемы лечения основаны на конкретном знании физиологии, способ действия не всегда связан с изменением физиологических процессов. R. A. Deyo и соавт. [9] исследовали пациентов со стойкой болью в области поясницы. Пациенты испытали значительное и статистически значимое улучшение физических функций и снижение интенсивности боли как после лечения с помощью чрескожной электронейростимуляции (ЧЭНС), так и после лечения с имитацией ЧЭНС. В исследовании E. Blanchard [4] было показано, что снижение частоты и интенсивности головной боли отмечалось не только у пациентов, прошедших курс биологической обратной связи (БОС), но также и у пациентов с имитацией БОС, т. е. с нефизиологической обратной связью. Эти примеры свидетельствуют о том, что эффект лечения может быть связан не с физиологическим механизмом, на котором основано это лечение, а скорее с ощущением контроля над болью.
Роль эмоциональных факторов
К настоящему времени накоплено большое количество данных, свидетельствующих о существенном влиянии эмоций на восприятие боли. Известно, что высокий уровень тревожности способствует повышению интенсивности боли.
Депрессия часто предшествует развитию хронической боли либо развивается в процессе хронизации боли и является важным фактором, способствующим снижению качества жизни. Однако депрессия развивается не у всех больных с хронической болью. A. Okifuji и соавт. [15] провели исследование для того, чтобы уточнить, какие факторы защищают пациентов от развития депрессии в процессе хронизации боли (Рис. 1).
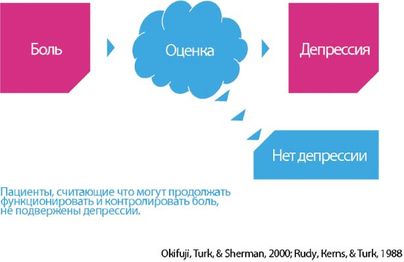
Они показали, что промежуточным звеном между болью и депрессией является оценка пациентами влияния боли на их жизнь, а также оценка собственной способности контролировать боль и свою жизнь. Те пациенты, которые считали, что могут продолжать функционировать и контролировать свою боль, не были подвержены депрессии, по данным проведенного исследования.
Очень часто у пациентов с хронической болью отмечается раздражительность. J. D. Summers и соавт. [19] обследовали пациентов с повреждениями спинного мозга и обнаружили, что раздражительностью и враждебностью объясняются 33% колебаний интенсивности боли. Фрустрация, связанная с наличием симптомов, ограниченная информация о причине боли и многочисленные неудачи при лечении наряду с раздражением по отношению к лечащим врачам, к системе оказания медицинской помощи, к членам семьи и к самим себе — все это приводит к дисфорическому настроению у пациентов. Точные механизмы усиления боли под влиянием раздражительности и фрустрации не известны. Одной из возможных причин влияния раздражительности на усиление боли является повышенная активация вегетативной нервной системы. Раздражительность также может блокировать мотивацию и положительное отношение к лечению.
Взаимосвязь эмоциональных и когнитивных факторов
Обычным явлением при хронической боли является страх. Связанный с болью страх и озабоченность тем, как избежать вредного воздействия, усугубляют симптомы заболевания [22]. Страх — это эмоциональное состояние, влияющее на оценочные процессы; здесь можно процитировать Гамлета: «Не существует ни «хорошего», ни «плохого», это размышления делают все таковым». Существует взаимосвязь между эмоциональным состоянием и когнитивно-интерпретационными процессами, в результате чего размышления влияют на настроение, настроение влияет на оценки и, в конечном итоге, на переживание боли (Рис. 2).
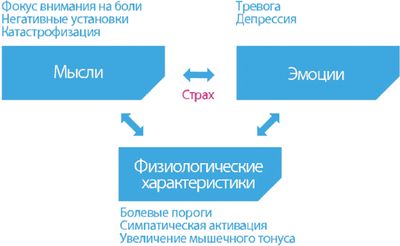
Исследования показали, что отсутствие двигательной активности из-за страха повторного повреждения имеет большую прогностическую значимость для предсказания функциональных ограничений, чем биомедицинские параметры (тяжесть заболевания, длительность заболевания, размер повреждения) [14]. Примерно две трети пациентов с неспецифической болью в области поясницы избегают работы, связанной с нагрузкой на спину, из-за страха повторной травматизации [6].
Роль социокультурных факторов
Возрастные, гендерные и этнические стереотипы во многом определяют представления о боли и реакцию на нее. Так, дети усваивают отношение к боли, к медицинской помощи, к восприятию и интерпретации симптомов, определенную реакцию на травму и болезнь от своих родителей на основании культурных стереотипов и социальной среды [2]. В исследовании [17] было показано, что дети, чьи родители страдают хронической болью, чаще демонстрируют болевое поведение (жалобы на боль, пропуск занятий и визиты к школьной медсестре), по сравнению с детьми, чьи родители страдают сахарным диабетом, и по сравнению с детьми здоровых родителей.
Болевое поведение может получить прямое положительное подкрепление, например, вниманием супруга или медицинского работника. Показано, что пациенты с заботливыми супругами сообщали о более выраженной боли в присутствии супругов, чем в присутствии более нейтрально настроенного медицинского работника [5]. В связи с этим при работе с пациентами, страдающими хронической болью, важно оценить влияние окружения на болевое поведение пациента. В некоторых случаях достаточно простого разъяснения пациенту о возможно негативном влиянии гиперопеки или других факторов со стороны социального окружения, в других случаях нельзя обойтись без помощи психотерапии.
Подходы к лечению в зависимости от стадии хронизации боли
Для оптимизации лечения пациентов, страдающих хронической болью, важно различать различные этапы перехода острой боли в хроническую. R. J. Gatchel [11] предложил концептуальную модель, которая предполагает три стадии перехода острой боли в хроническую. Стадия 1 связана с такими эмоциональными реакциями, как страх, тревога, беспокойство и др. Они являются результатом восприятия боли в процессе острой фазы. Поскольку боль или повреждение обычно ассоциируются с вредом, следовательно, это является естественной эмоциональной реакцией на потенциальную угрозу организму. Если боль продолжает сохраняться по истечении соответствующего периода времени (2–4 месяца), это ведет к переходу в cтадию 2. Стадия 2 связана с широким диапазоном поведенческих и психологических реакций: усвоенная беспомощность, депрессия, раздражительность и соматизация; все они обусловлены страданиями в результате уже имеющейся хронической боли.
Если «наслоение» поведенческих проблем продолжается, это приводит к переходу в cтадию 3, которую можно рассматривать как принятие «роли больного», когда пациенты освобождаются от своих обычных обязанностей и социальных обязательств. Это может стать мощным стимулом для того, чтобы не «выздоравливать». В этой фазе консолидируется физическая и психологическая «нетрудоспособность» и возникает «патологическое болевое поведение» [16].
Для повышения эффективности терапии болевых синдромов целесообразно разделить лечение на три этапа: первичное, вторичное и третичное лечение, поскольку подходы к лечению будут существенно отличаться на каждом из них.
Этап 1. Лечение острой боли
Задачей этого этапа является адекватное обезболивание для предотвращения развития хронизации боли. На этом этапе важна активная фармакотерапия, подбор оптимальных лекарственных препаратов для эффективного купирования боли. Недостаточно эффективное обезболивание может усилить тревожность пациента, привести к ощущению беспомощности, отсутствия контроля над болью, что может способствовать хронизации боли. Важно сформировать реальные ожидания по срокам выздоровления. При выявлении факторов риска развития хронической боли в лечение необходимо включить мероприятия для их нейтрализации. Особое внимание следует уделить просвещению больного, поскольку нередко первым толчком к хронизации является избыточный упор врачей на ограничение двигательной активности.
Этап 2. Вторичное лечение
Вторичное лечение — это восстановительное лечение, предназначенное для тех людей, которые не способны вернуться к работе, поскольку нормальный процесс выздоровления еще не завершен. Это лечение необходимо для профилактики стойкой утраты трудоспособности. Оно предназначено для предупреждения прогрессирования детренированности и развития психологических барьеров возвращения к работе. Для тех пациентов, у которых затягивается выздоровление, на этом этапе может потребоваться более активное психологическое вмешательство.
В плане первичной и вторичной медицинской помощи клиницист обязан учитывать многие психологические факторы, вносящие вклад в эпизод острой боли, которая затем становится подострой и хронической. Это и рассмотренные раннее психологические особенности, и функциональные, юридические, социальные и трудовые вопросы, которые могут серьезно влиять на полную реабилитацию пациента и его возврат к полноценной жизни. Медицинский персонал также должен учитывать вторичную выгоду от сохранения нетрудоспособности, которая может быть юридической, финансовой или семейной.
Важно, чтобы все, кто участвует в лечении этих пациентов, понимали их психологические проблемы. Это позволит персоналу не только лучше контактировать с пациентами и оказывать им помощь, но также и более эффективно решать проблемы, когда восстановление происходит не так быстро, как ожидалось. Иногда реальное стечение обстоятельств может использоваться пациентом в качестве «дымовой завесы», или оправдания недостаточной активности, или несоблюдения назначенного лечения. В самом деле, отсутствие прогресса в лечении является физическим выражением психологических барьеров для восстановления. Эти барьеры следует эффективно выявлять и обратить на них внимание всех членов команды (медицинского персонала и социального окружения пациента). Необходимо также выяснить причины плохого восстановления и не допустить, чтобы они помешали лечению.
Этап 3. Третичная медицинская помощь.
Третичная медицинская помощь — это лечение, предназначенное для пациентов, у которых уже есть некоторые изменения, характерные для стойкой нетрудоспособности. Эта категория пациентов отличается плохим ответом на лечение и требует высококвалифицированной, комплексной, индивидуализированной помощи.
Мультидисциплинарные программы
В последнее время в США и Европе получили распространение болевые центры, специализирующиеся на оказании помощи пациентам, страдающим от хронической боли. Разработаны специальные мультидисциплинарные программы продолжительностью от 4 до 8 недель, которые различаются в зависимости от разработавшего их центра или от болевого синдрома, но в основе всех этих программ лежат принципы, основанные на биопсихосоциокультурном подходе:
-
Отбор пациентов и индивидуальный подход к пациенту. Прежде чем включить пациента в программу, проводится тщательное клинико-психологическое исследование, включающие сбор подробной информации о социальном окружении пациента, его личностных особенностях, что позволяет определить степень готовности пациента к лечению, а также разработать индивидуальный план работы для каждого пациента.
-
Групповой формат занятий (8–15 человек). Оказалось, что наиболее эффективным для работы с хронической болью является не индивидуальный, а групповой формат занятий: пациенты учатся друг у друга и поддерживают друг друга.
-
Мультидисциплинарный командный стиль работы. В программах принимают участие невролог, психотерапевт, специалист по лечебной физкультуре и физиотерапии, специалист по профессиональной адаптации — трудотерапевт. К каждому пациенту прикреплен куратор, как правило, врач-невролог.
-
Интенсивность занятий (4–8 недель, 4–8 ч в день). Занятия проходят в интенсивном режиме, обычно 3–5 раз в неделю, по 4–6 часов в день и длятся 4–8 недель. Поочередно работают психологи, кинезиотерапевты. Пациенты приобретают навыки по управлению болью, учатся добиваться снижения частоты приема лекарств, повышения физической активности и др.
Можно выделить ряд факторов, которые влияют на успех лечения хронической боли. Все они в той или иной степени учитываются в мультидисциплинарных программах по лечению хронической боли.
Образование пациента. Очень важно формировать правильные представления о происхождении болезни, различных синдромов. Для этого проводится работа по объяснению пациентам причин болезни. Для этой цели широко используются школы для пациентов, выпускаются брошюры и создаются Интернет-сайты по отдельным проблемам (болевым синдромам) для пациентов.
Включение пациента в процесс лечения. Успех лечения невозможен без желания самого больного. При этом необходимо, чтобы пациент понимал, что ему надо делать и для чего ему надо что-то делать. Показано, что пациенты, которые сами активно включаются в процесс лечения, выздоравливают быстрее по сравнению с теми, которые предпочитают «полностью ввериться в руки врача» («пусть меня лечат»).
Сдвиг когнитивной парадигмы. Важно подчеркнуть, что пациент должен хотеть работать с лечащим врачом и другими членами команды реабилитации. Предлагаемые подходы к лечению заметно отличаются от того, что пациенты представляли себе в качестве подходящего лечения своего заболевания. Врач должен быть готов к обсуждению расхождений между представлением пациентов о своих проблемах, прошлым опытом лечения и предлагаемой программой лечения.
Для изменения дезадаптивных установок используются различные методики, начиная от убеждения в процессе беседы и заканчивая методиками, основанными на нейролингвистическом программировании и гипнозе. В мультидисциплинарных программах используется, главным образом, когнитивно-бихевиористская терапия.
В некоторых мультидисциплинарных программах акцент делается на том, что хроническую боль скорее всего нельзя будет излечить. Поэтому лучше всего было бы считать хроническую боль заболеванием такого же типа, как диабет или астма. При отсутствии радикального лечения пациенты с хронической болью должны научиться управлять своим состоянием.
Изменение восприятия боли и ее последствий. Саморегуляция боли и ее влияние зависят от того, как именно люди справляются с болью, адаптируются к боли и минимизируют стресс, обусловленный болью, — иными словами, от их стратегий психофизиологической адаптации. Психофизиологическая адаптация предполагает спонтанно предпринимаемые целенаправленные и преднамеренные действия; она оценивается в терминах внешнего и скрытого поведения. Внешние поведенческие стратегии адаптации включают отдых, использование техник релаксации или применение лекарственных препаратов. К скрытым стратегиям психофизиологической адаптации относятся различные способы самоотвлечения от боли: самовнушение, поиск информации и решение проблемы. Стратегии психофизиологической адаптации предназначены для воздействия на восприятие интенсивности боли и на способность справляться с болью или переносить боль, продолжая выполнять повседневные обязанности [8]. В исследованиях обнаружено, что стратегии активной психофизиологической адаптации (усилия для продолжения функционирования, несмотря на боль, или самоотвлечение от боли, например, погружение в работу или игнорирование боли) связаны с адаптивным функционированием, в то время как стратегиями пассивной психофизиологической адаптации (зависимость от других людей, которые помогают контролировать боль, и снижение собственной активности) приводят к усилению боли и к депрессии [12].
Такие методики, как релаксация, йога, метод ментального воображения, биологическая обратная связь, виртуальная реальность, основаны на психофизиологической адаптации и нашли применение в программах реабилитации пациентов с хронической болью.
Ощущение контроля над болью. Одним из ключевых факторов, ведущих к дезадаптации пациентов, является ощущение отсутствия контроля над болью. Это фрустрирует больного и, в конечном итоге, усугубляет страдание. Очень важной задачей врача является создание у пациента ощущения контроля над болью. Ощущение контроля над болью является конечной целью различных видов психотерапии и важным принципом стратегии повышения мотивации. Среди исследовавших данный феномен был известный американский ученый Jerome D. Frank из Института Джонса Хопкинса. Он утверждает, что чувство контроля, или господства (mastery), является одной из главнейших сил мотивации и укрепления духа и может оказывать огромное влияние на состояние пациента и течение болезни. Jerome D. Frank связывает чувство господства с «поднятием материального духа» индивидуума, порождающего позитивные чувства в противоположность негативным — отчаяния, оторванности, враждебности, неудачи, никчемности, бесполезности, беспомощности, бессилия [10]. «Все успешные виды терапевтического воздействия, — считает ученый, — явно или неявно изменяют образ пациента в его собственных глазах с личности, утонувшей в своих проблемах и симптомах, на личность, способную управлять ими».
Данный феномен в научной литературе обозначается как самоэффективность. Самоэффективность можно определить как веру человека в то, что он способен к определенному поведению [3]. Сюда относятся вера в свои способности и оптимизм в отношении успешности усилий, которые будут предприняты для изменения поведения.
Положительные эмоции. Безусловно, мощным фактором выздоровления являются положительные эмоции. Имеющиеся исследования показывают, что положительные эмоции через нейроимунные механизмы могут существенно улучшать клинико-биологические показатели. Но, как правило, у больных с хронической болью мало источников для «хороших новостей», т. к. болезнь обычно развивается на фоне различных «неприятностей» (финансовых трудностей, семейной неудовлетворенности и др.). Потеря силы и физической формы является ключевыми характеристиками многих болевых синдромов.
В связи с этим в лечебных мультидисциплинарных программах важная роль придается повышению физической активности, а также ряду мер, направленных на возвращение к профессиональной активности. В реабилитационных программах много внимания уделяют преодолению страха перед двигательной активностью, повышению физической силы и ловкости.
Физическая активность, помимо биологического эффекта (улучшение кровоснабжения тканей и др.), может стать источником приятных ощущений. Социальная активность позволяет отвлечься от болезни, возвращает веру в себя и также является причиной положительных эмоций.
Таким образом, лечение боли должно быть направлено не только на физические компоненты боли (устранение причины, блокада проводящих путей), но должно непременно учитывать психологические особенности больного, а также социокультурный контекст, в котором оказался пациент. Для достижения этой цели необходим многокомпонентный и индивидуализированный подход к лечению.
Литература
-
Яхно Н. Н., Кукушкин М. Л., Давидов М. Л., Данилов А. Б., Амелин А. В., Куликов С. М. Результаты Российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу // Боль. 2008. 3 (20).
-
Fricher J. Pain in Europe report. Pain in Europe journal//2006. painineurope.com.
-
Bandura A. Self-efficacy: The exercise of control. New York: Freeman, 1997.
-
Blanchard E. B. Long-term effects of behavioral treatment of chronic headache // Behavior Therapy. 1987. Vol. 18. P. 375–385.
-
Block A. R, Kremer E. E, Gaylor M. Behavioral treatment of chronic pain: Variables affecting treatment efficacy // Pain. 1980. Vol. 8. P. 367–375.
-
Crombez G., Vervaet L., Lysens R. et al. Avoidance and confrontation of painful, back straining movements in chronic back pain patients // Behavior Modification. 1998. Vol. 22. P. 62–77.
-
Crook J, Weir R., Tunks E. An epidemiologic follow-up survey of persistent pain sufferers in a group family practice and specialty pain clinic // Pain. 1989. Vol. 36. P. 49–61.
-
DeGood D. E, Tait R. С. Assessment of pain beliefs and pain coping / In D. С. Turk, R. Melzack (Eds.). Handbook of pain assessment. New York: Guilford Press, 2001.
-
Deyo R. A., Walsh N. E., Martin D. et al. A controlled trial of transcutaneous electrical nerve stimulation (TENS) and exercise for chronic low back pain // New England Journal of Medicine. 1990. Vol. 322. P. 1627–1634.
-
Frank J. Psychotherapy as Rhetoric: Some Implications // Clinical Psychology: Science and Practice. 2006. Vol. 2. P. 90–93.
-
Gatchel R. J. Psychological disorders and chronic pain: Cause-and effect relationships / In R. J. Gatchel, D. C. Turk (Eds.). Psychological approaches to pain management: A practitioner’s handbook. New York: Guilford Press, 1996.
-
Lawson K., Reesor K. A., Keefe E. J., Turner J. A. Dimensions of pain-related cognitive coping: Cross validation of the factor structure of the Coping Strategies Questionnaire // Pain. 1990. Vol. 43. P. 195–204.
-
Mizener D., Thoma, M., Billings R. Cognitive changes of migraineurs receiving biofeedback training // Headache. 1988. Vol. 28. P. 339–343.
-
McCracken L. M., Gross R. Т., Sorg P. J., Ed-mands T. A. Prediction of pain in patients with chronic low back pain: Effects of inaccurate prediction and pain-related anxiety // Behavior Research and Therapy. 1993. Vol. 31. P. 647–652.
-
Okifuji A., Turk D. C, Sherman J. J. Evaluation of the relationship between depression and fibromyalgia syndrome: Why aren’t all patients depressed? // Journal of Rheumatology. 2000. Vol. 27. P. 212–219.
-
Pilowsky I. A general classification of abnormal illness behavior // British Journal of Medical Psychiatry. 1978. Vol. 51. P. 131–137.
-
Richard K. The occurrence of maladaptive health-related behaviors and teacher-related conduct problems in children of chronic low back pain patients//Journal of Behavioral Medicine.1988.Vol.11.P.107–116
-
Spiegel D., Bloom J. R. Pain in metastatic breast cancer // Cancer. 1983. Vol. 52. P. 341–345.
-
Summers J. D., Rapoff M. A., Varghese G. et al. Psychological factors in chronic spinal cord injur pain // Pain. — 1992. — Vol. 47. — P. 183–189.
-
Turk D. С. Physiological and psychological bases of pain / In A. Baum, T. Revenson, J. Singer (Eds.). Handbook of health psychology. Hillsdale: Erlbaum, 2001.
-
Turk D. C, Okifuji A. Evaluating the role of physical, operant, cognitive, and affective factors in pain behavior in chronic pain patients // Behavior Modification. 1997. Vol. 21. P. 259–280.
-
Vlaeyen J. W., Kole-Snijders A. M., Boeren R. G., van Eek H. Fear of movement / (re)injury in chronic low back pain and its relation to behavioral performance // Pain. 1995. Vol. 62. P. 363–372.
-
Williams D. A., Thorn В. Е. An empirical assessment of pain beliefs // Pain. 1989. Vol. 36. P. 251–258.
Ал. Б. Данилов, доктор медицинских наук ММА им. И. М. Сеченова, Москва
www.lvrach.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


