check experiment
Русско-английский политехнический словарь. Академик.ру. 2011.
Контрольный абсорбер — 8.5 Контрольный абсорбер Ламповое стекло контрольного абсорбера (6.3) оставляют закрытым пробкой, пропускают поток диоксида углерода и кислорода через образцы до тех пор, пока все образцы, зажженные одновременно, не сгорят. Перекрывают подачу… … Словарь-справочник терминов нормативно-технической документации
Опыт реформирования государственной почты в разных странах — Несмотря на различия между подходами к реформе и реструктуризации государственной почты в разных странах, существуют общие правила, соблюдение которых определяет эффективность реструктуризации национального оператора и реформирования рынка услуг… … Энциклопедия ньюсмейкеров
ПРОВЕДЕНИЕ АНАЛИЗА — 5. ПРОВЕДЕНИЕ АНАЛИЗА Анализ проводят в ручном режиме работы прибора. 5.1. В память компьютера вводят результат контрольного опыта. 5.2. Взвешивают пробу на электронных весах, установленных на приборе. Нажатием клавиши «ENTER» на пульте… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Квантовая механика — волновая механика, теория устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов) а также связь величин, характеризующих частицы и системы, с… … Большая советская энциклопедия
Реактивы и растворы — 5.2 Реактивы и растворы Натрий углекислый по ГОСТ 83. Кремния двуокись по ГОСТ 9428. Кислота азотная по ГОСТ 4461, разбавленная 1:4. Аммоний углекислый по ГОСТ 3770. Метиловый оранжевый индикатор, водный раствор с массовой концентрацией 1 г/дм3.… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 12359-99: Стали углеродистые, легированные и высоколегированные. Методы определения азота — Терминология ГОСТ 12359 99: Стали углеродистые, легированные и высоколегированные. Методы определения азота оригинал документа: 4.2 Аппаратура, реактивы и растворы Установка для дистилляции аммиака с паром (рисунок 1) состоит из дистилляционной… … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 51859-2002: Нефтепродукты. Определение серы ламповым методом — Терминология ГОСТ Р 51859 2002: Нефтепродукты. Определение серы ламповым методом оригинал документа: 12.2 Воспроизводимость Расхождение между двумя отдельными и независимыми результатами испытаний, полученными разными лаборантами, работающими в… … Словарь-справочник терминов нормативно-технической документации
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
Противогнилостные средства — средства, препятствующие гнилостному разложению белковых веществ. Средства, задерживающие разложение безазотистых органических веществ, в отличие от П., называются противобродильными, так как разложение безазотистых органических веществ… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ШИФФА РЕАКТИВ — водный р р фуксинсернистой к ты (ф лы I или II). Служит для качественного обнаружения альдегидов. При взаимод. Ш. р. с альдегидом RCHO образуется пурпурно фиолетовый краситель (ф ла III). Р ция очень чувствительна (напр., можно определить 1 мкг… … Химическая энциклопедия
polytechnic_ru_en.enacademic.com
1) eng. Testversuch
2) chem. Leerversuch
3) psych. Gegenversuch, Kontrollversuch, Vergleichsversuch
Универсальный русско-немецкий словарь. Академик.ру. 2011.
Контрольный абсорбер — 8.5 Контрольный абсорбер Ламповое стекло контрольного абсорбера (6.3) оставляют закрытым пробкой, пропускают поток диоксида углерода и кислорода через образцы до тех пор, пока все образцы, зажженные одновременно, не сгорят. Перекрывают подачу… … Словарь-справочник терминов нормативно-технической документации
Опыт реформирования государственной почты в разных странах — Несмотря на различия между подходами к реформе и реструктуризации государственной почты в разных странах, существуют общие правила, соблюдение которых определяет эффективность реструктуризации национального оператора и реформирования рынка услуг… … Энциклопедия ньюсмейкеров
ПРОВЕДЕНИЕ АНАЛИЗА — 5. ПРОВЕДЕНИЕ АНАЛИЗА Анализ проводят в ручном режиме работы прибора. 5.1. В память компьютера вводят результат контрольного опыта. 5.2. Взвешивают пробу на электронных весах, установленных на приборе. Нажатием клавиши «ENTER» на пульте… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Квантовая механика — волновая механика, теория устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов) а также связь величин, характеризующих частицы и системы, с… … Большая советская энциклопедия
Реактивы и растворы — 5.2 Реактивы и растворы Натрий углекислый по ГОСТ 83. Кремния двуокись по ГОСТ 9428. Кислота азотная по ГОСТ 4461, разбавленная 1:4. Аммоний углекислый по ГОСТ 3770. Метиловый оранжевый индикатор, водный раствор с массовой концентрацией 1 г/дм3.… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 12359-99: Стали углеродистые, легированные и высоколегированные. Методы определения азота — Терминология ГОСТ 12359 99: Стали углеродистые, легированные и высоколегированные. Методы определения азота оригинал документа: 4.2 Аппаратура, реактивы и растворы Установка для дистилляции аммиака с паром (рисунок 1) состоит из дистилляционной… … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 51859-2002: Нефтепродукты. Определение серы ламповым методом — Терминология ГОСТ Р 51859 2002: Нефтепродукты. Определение серы ламповым методом оригинал документа: 12.2 Воспроизводимость Расхождение между двумя отдельными и независимыми результатами испытаний, полученными разными лаборантами, работающими в… … Словарь-справочник терминов нормативно-технической документации
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
Противогнилостные средства — средства, препятствующие гнилостному разложению белковых веществ. Средства, задерживающие разложение безазотистых органических веществ, в отличие от П., называются противобродильными, так как разложение безазотистых органических веществ… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ШИФФА РЕАКТИВ — водный р р фуксинсернистой к ты (ф лы I или II). Служит для качественного обнаружения альдегидов. При взаимод. Ш. р. с альдегидом RCHO образуется пурпурно фиолетовый краситель (ф ла III). Р ция очень чувствительна (напр., можно определить 1 мкг… … Химическая энциклопедия
universal_ru_de.academic.ru
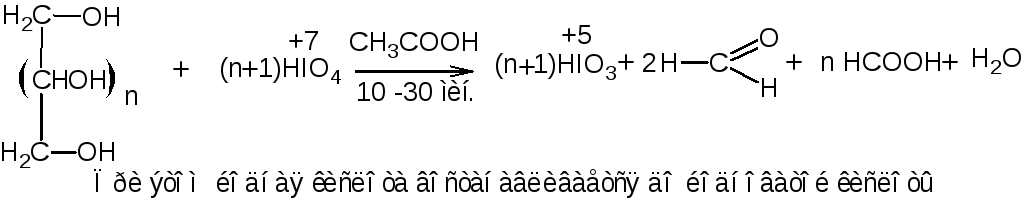
fэкв (вещества)=1/n, где n – количество спиртовых гидроксилов в молекуле вещества. fэкв (ментола)=1.
2. Перйодатный метод (для многоатомных спиртов). Основан на свойстве многоатомных спиртов окисляться йодной кислотой в кислой среде с образованием формальдегида и муравьиной кислоты по общей схеме:

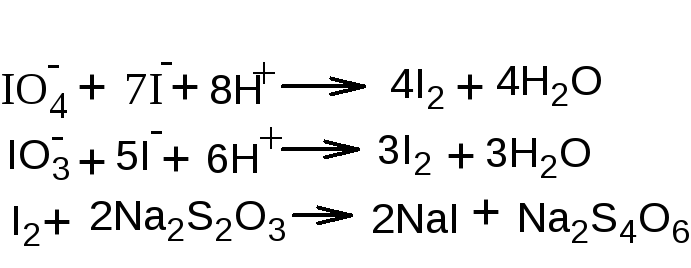 При окислении двух групп
При окислении двух групп 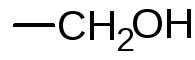 образуются две молекулы формальдегида, на что расходуется одна молекула йодной кислоты, а из группы
образуются две молекулы формальдегида, на что расходуется одна молекула йодной кислоты, а из группы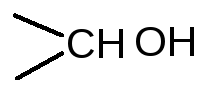 получается муравьиная кислота, для образования которой требуется также одна молекула йодной кислоты. Избыток йодной кислоты определяют йодометрическим методом: прибавляют раствор калия йодида и выделившийся йод титруют раствором натрия тиосульфата (индикатор крахмал). Параллельно проводят контрольный опыт. При титровании раствора после окисления, наряду с не вошедшим в реакцию перйодатом, определяется также образовавшийся йодат:
получается муравьиная кислота, для образования которой требуется также одна молекула йодной кислоты. Избыток йодной кислоты определяют йодометрическим методом: прибавляют раствор калия йодида и выделившийся йод титруют раствором натрия тиосульфата (индикатор крахмал). Параллельно проводят контрольный опыт. При титровании раствора после окисления, наряду с не вошедшим в реакцию перйодатом, определяется также образовавшийся йодат:
Реакция среды должна быть кислая, чтобы не окислился йодом выделившийся формальдегид. В расчётах учитывают количество раствора натрия тиосульфата, израсходованное на определение и контрольный опыт: Vнатр. тиосульфата(контр. опыт) - Vнатр. тиосульфата (на определение спирта).
Фактор эквивалентности зависит от числа гидроксильных групп в молекуле спирта. Расчёт проводится косвенным способом, по изменению степени окисления реагента. Каждая молекула реагента в ходе реакции принимает два электрона 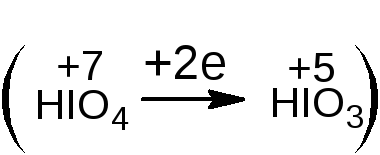 .
.
1 молекула спирта (n+1) молекул 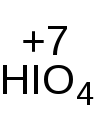 (n+1) молекул
(n+1) молекул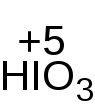
fэкв (спирта)=1/2(n+1), где n – число групп 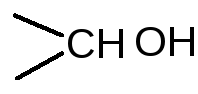 в молекуле спирта.
в молекуле спирта.
3. Куприметрический метод. Основан на свойстве спиртов образовывать с меди (II) сульфатом в щелочной среде устойчивые комплексные соединения (прямое титрование, индикатор – мурексид). Метод используется при внутриаптечном контроле препаратов хлорамфеникола (левомицетина).
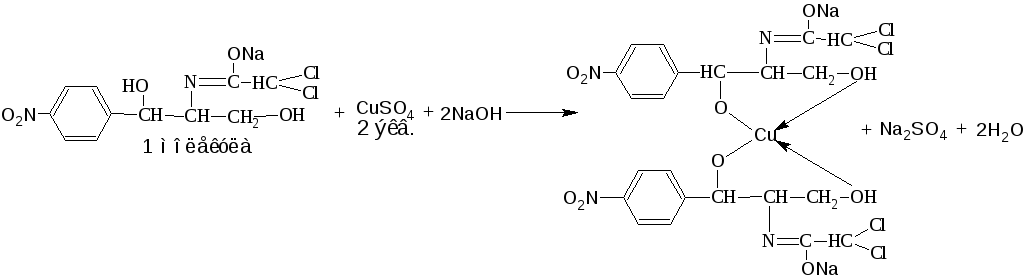
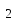
fэкв (хлорамфеникола)= 2
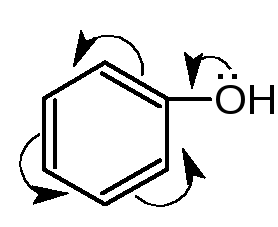 Гидроксил, связанный с ароматическим циклом.
Гидроксил, связанный с ароматическим циклом.
Химические свойства
1. Реакция этерификации (аналогично спиртовому гидроксилу).
2. Окислительно-восстановительные. Фенолы проявляют сильные восстановительные свойства, очень легко окисляется даже слабыми окислителями. Образуются окрашенные соединения хиноидной структуры.
3. Кислотно-основные. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов (рКа фенола 9,89). Образуют соли со щелочами (при рН ~ 12-13), комплексные соединения с железа (III) хлоридом (в нейтральных, слабощелочных, кислых растворах).
4. Реакции электрофильного замещения атома водорода в ароматическом кольце (бромирования, конденсации с альдегидами, сочетания с солями диазония, нитрования, нитрозирования, йодирования и др.) Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподелённой электронной пары атома кислорода с - электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и п- положениях по отношению к фенольному гидроксилу (ориентанту 1 рода).
Реакции подлинности
1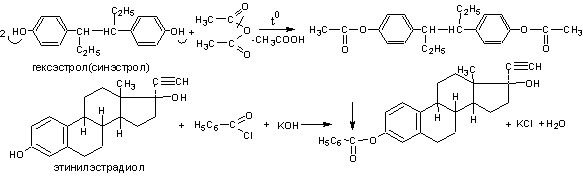 .Реакция этерификации (ацилирования). Реакция основана на свойстве фенолов образовывать сложные эфиры (ацильные производные) с ангидридами и галогенангидридами кислот, выпадающие в осадок и имеющие чёткую температуру плавления.
.Реакция этерификации (ацилирования). Реакция основана на свойстве фенолов образовывать сложные эфиры (ацильные производные) с ангидридами и галогенангидридами кислот, выпадающие в осадок и имеющие чёткую температуру плавления.
Методика. К 0,25 г гексэстрола (синэстрола) прибавляют 1 мл уксусного ангидрида и 2 мл безводного пиридина. Кипятят с обратным холодильником 15 минут, охлаждают, добавляют 50 мл воды и тщательно встряхивают. Осадок отфильтровывают, промывают водой, сушат при 100-105 и определяют температуру плавления. Температура плавления выделенного диацетата синэстрола 137-139С.
2. Реакции окисления. Примером реакции окисления является индофеноловая проба. Проба проводится в растворе аммиака при взаимодействии с такими окислителями, как хлорамин, хлорная известь, бромная вода.
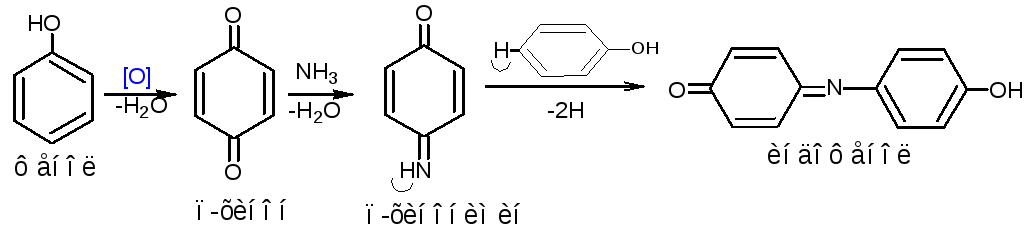
Методика. 0,05 лекарственного вещества (фенола, тимола, резорцина) растворяют в 0,5 мл раствора аммиака и добавляют 3-4 капли раствора хлорамина, нагревают смесь на кипящей водяной бане. Через несколько минут появляется окрашивание, изменяющееся при добавлении кислот. Фенол образует сине-зелёное окрашивание, переходящее при добавлении кислот в красное; тимол – слабо-розовое, переходящее в жёлтое; резорцин – буровато-желтое, переходящее в красное.
3. Реакция комплексообразования с ионами железа (III). В зависимости от количества фенольных гидроксилов, наличия в молекуле фенола других функциональных групп, их взаимного расположения, рН среды, температуры, образуются комплексные соединения различного состава и окраски (исключение составляет тимол). Фенол даёт синее окрашивание, резорцин - сине-фиолетовое, кислота салициловая - сине-фиолетовое или красно-фиолетовое, осалмид (оксафенамид) и натрия пара-аминосалицилат - красно-фиолетовое, хинозол - синевато-зелёное. Реакция является фармакопейной для большинства фенольных соединений.
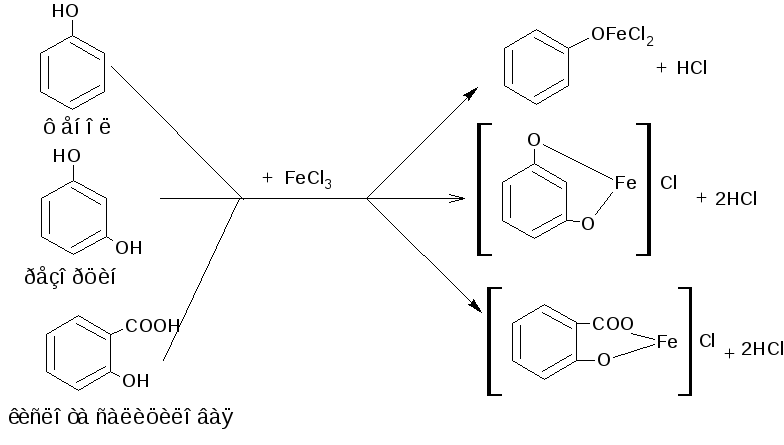
Методика. К 1 мл водного раствора (1:100) фенола, резорцина, хинозола, натрия пара-аминосалицилата, натрия салицилата, спиртового раствора парацетамола, осалмида (оксафенамида), кислоты салициловой прибавляют 2 капли раствора железа (III) хлорида; наблюдают эффект реакции.
4. Реакции электрофильного замещения.
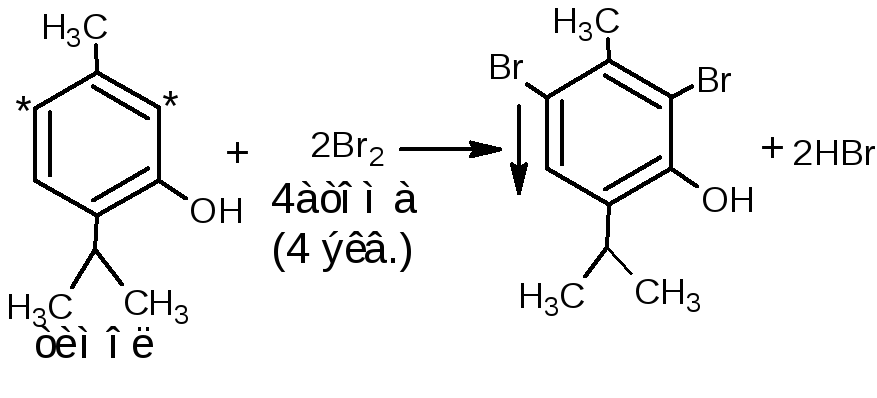
4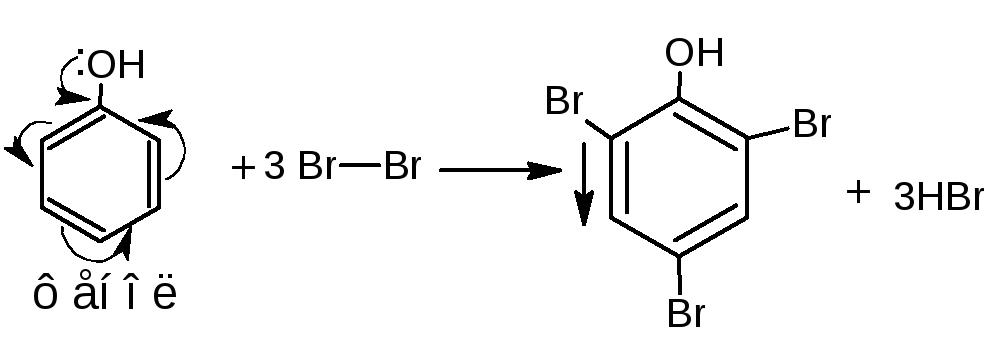 .1.Реакция бромирования. При бромировании бромной водой образуются белые или желтые осадки бромпроизводных.
.1.Реакция бромирования. При бромировании бромной водой образуются белые или желтые осадки бромпроизводных.
При наличии заместителей в о- и п-положениях ароматического кольца в реакцию вступают незамещённые атомы водорода ароматического кольца:
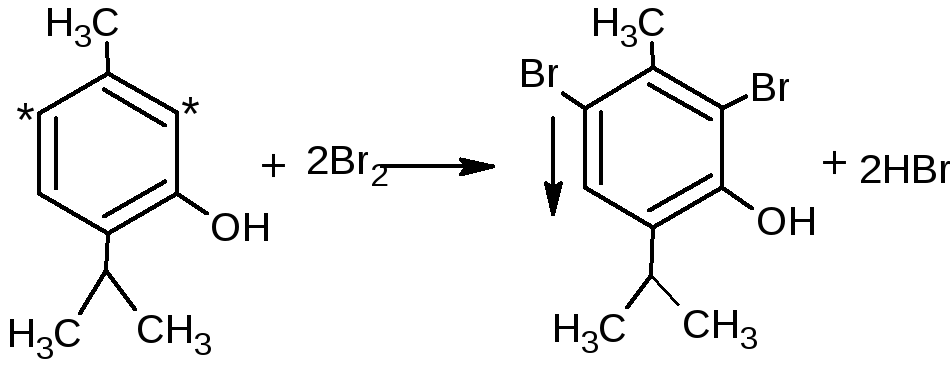
Если в о- и п-положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:
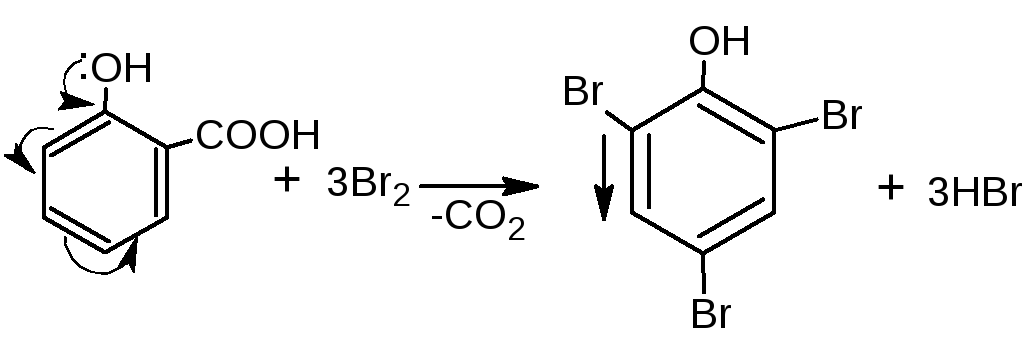
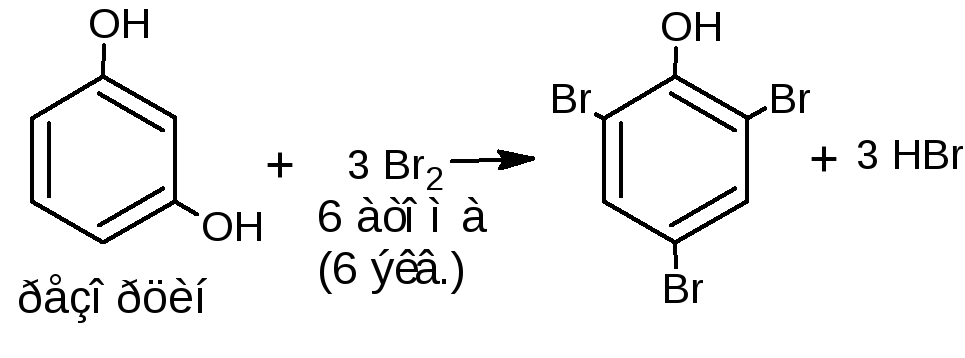
Е сли соединение содержит два фенольных гидроксила в м-положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):
сли соединение содержит два фенольных гидроксила в м-положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):
Если две гидроксильные группы расположены по отношению друг к другу в о- или п-положениях, то реакция бромирования не протекает (несогласованная ориентация):
Методика. К водному или спиртовому раствору (1:100-1:200) натрия салицилата, натрия пара-аминосалицилата, резорцина, тимола, хинозола прибавляют несколько капель бромной воды и разведённой серной кислоты; образуются осадки бромпроизводных.
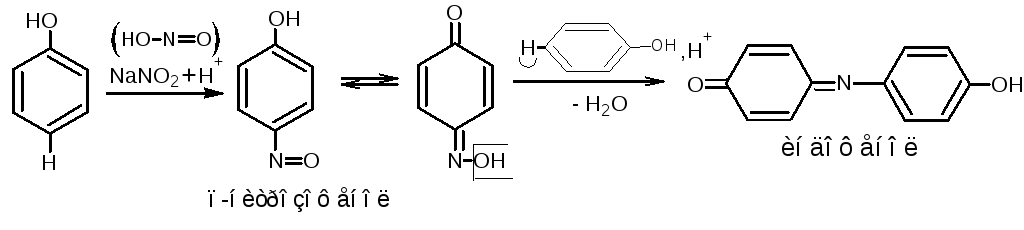 4.2.Реакция нитрозирования (нитрозореакция Либермана). Реакция характерна для фенолов, не имеющих заместителей в о- или п- положениях. При действии нитрита натрия в кислой среде образуется п-нитрозофенол, изомеризующийся в монооксим п- бензохинона, который, реагируя с избытком фенола в кислой среде, даёт индофенол. Реакцию нитрозирования можно рассматривать как разновидность индофеноловой реакции (см. «Фенолы», п.2).
4.2.Реакция нитрозирования (нитрозореакция Либермана). Реакция характерна для фенолов, не имеющих заместителей в о- или п- положениях. При действии нитрита натрия в кислой среде образуется п-нитрозофенол, изомеризующийся в монооксим п- бензохинона, который, реагируя с избытком фенола в кислой среде, даёт индофенол. Реакцию нитрозирования можно рассматривать как разновидность индофеноловой реакции (см. «Фенолы», п.2).
Методика. 0,01 г фенола, тимола, резорцина, гексэстрола (синэстрола) помещают на предметное стекло, смачивают 2-3 каплями 1% раствора натрия нитрита в концентрированной серной кислоте. Наблюдается окрашивание, изменяющееся при добавлении раствора щёлочи. Фенол образует тёмно-зелёное окрашивание, переходящее в вишнёво-красное; тимол - сине-зелёное, переходящее в фиолетовое; резорцин - фиолетово-чёрное, переходящее в фиолетовое; гексэстрол (синэстрол) - красно-фиолетовое, переходящее в вишнёвое.
4.3. Реакция нитрования. Фенолы вступают в реакцию с разведённой азотной кислотой при комнатной температуре с образованием о- и п- нитропроизводных. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциируемой соли:
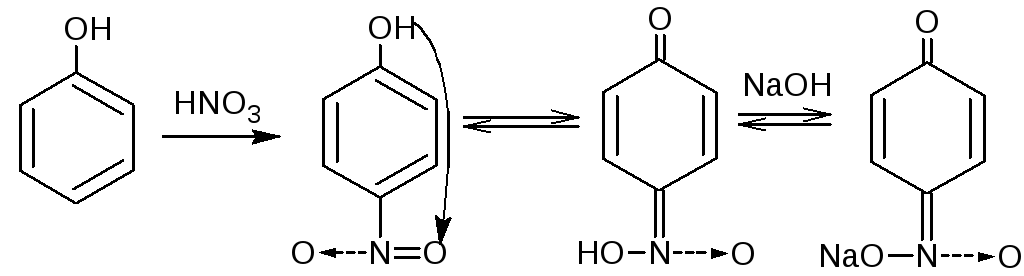
Методика. К 0,001 г лекарственного вещества (фенола, тимола, резорцина), растворённого в 2 мл воды или в 2 мл 95% спирта (синэстрол), добавляют 1-2 мл разведённой азотной кислоты и нагревают на водяной бане. Постепенно появляется жёлтое окрашивание.
4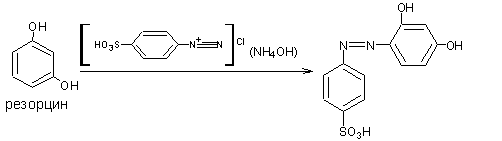 .4.Реакция азосочетания фенолов с солью диазония в щелочной среде. При взаимодействии фенолов с солью диазония при рН 9-10 образуются азокрасители, окрашенные в жёлто-оранжевый или красный цвет. Реакция азосочетания протекает в о- и п- положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.
.4.Реакция азосочетания фенолов с солью диазония в щелочной среде. При взаимодействии фенолов с солью диазония при рН 9-10 образуются азокрасители, окрашенные в жёлто-оранжевый или красный цвет. Реакция азосочетания протекает в о- и п- положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.
Методика. К 1мл водного раствора (1:100) натрия салицилата, хинозола, натрия пара-аминосалицилата, резорцина; спиртового раствора кислоты салициловой, гексэстрола (синэстрола) добавляют 0,5 мл раствора аммиака и 4 капли диазореактива - наблюдается красное или оранжево-красное окрашивание.
4.5. Реакции конденсации с альдегидами.
4.5.1. Реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной серной кислоты образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.
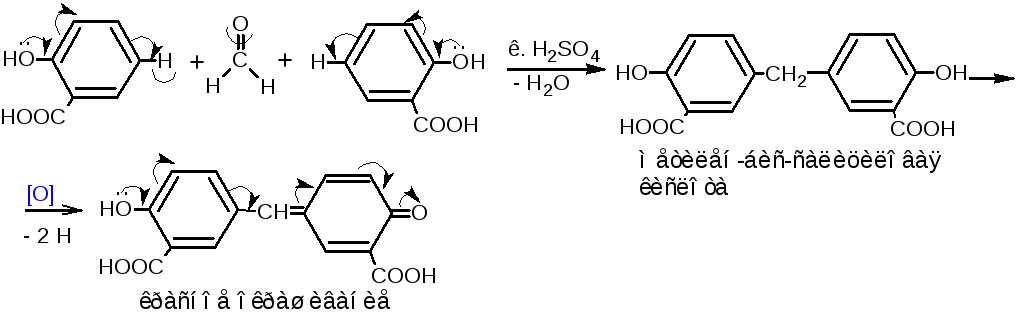
Методика. Около 0,02 г лекарственного вещества (резорцина, кислоты салициловой, кислоты ацетилсалициловой) помещают в фарфоровую чашку, прибавляют 1 каплю формалина и 2-3 капли концентрированной серной кислоты. При стоянии или после лёгкого нагревания образуется красное окрашивание.
4.5.2. Реакция с хлороформом в щелочной среде. При нагревании фенолов с хлороформом в щелочной среде образуются аурины – трифенилметановые красители. Реакция является фармакопейной на тимол.
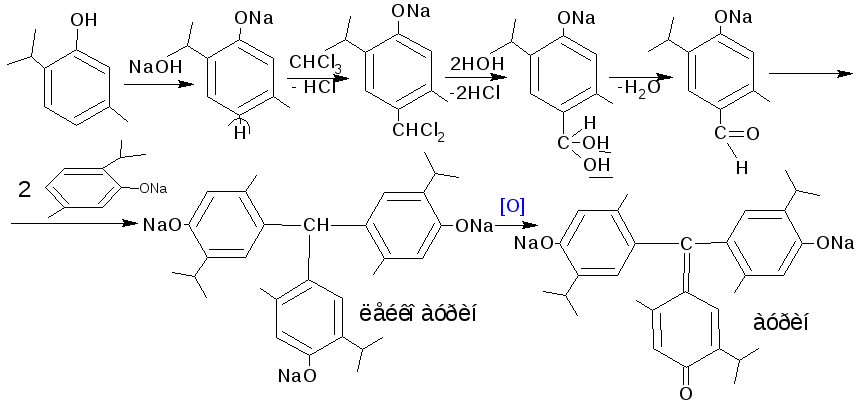
Методика. 0,2 г тимола или резорцина нагревают на водяной бане с 1 мл раствора натрия гидроксида. К подогретому раствору прибавляют 2-3 капли хлороформа и взбалтывают; появляется красно- фиолетовое окрашивание.
Количественное определение
1. Методы галогенирования. Основаны на реакции электрофильного замещения атомов водорода ароматического кольца на атомы галогена.
1.1.Броматометрический метод.
1.1.1. Прямое титрование раствором калия бромата в присутствии калия бромида (индикатор метиловый оранжевый или метиловый красный). В точке эквивалентности избыточная капля калия бромата образует бром, который необратимо окисляет индикатор и происходит обесцвечивание раствора. Метод является фармакопейным для тимола.

f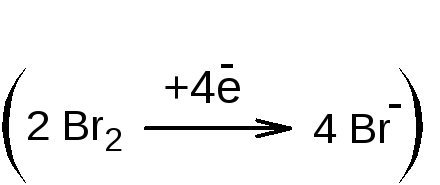 экв (тимола)=1/4, т.к. 1 молекула тимола взаимодействует с двумя молекулами брома, которые соответствуют 4 экв.
экв (тимола)=1/4, т.к. 1 молекула тимола взаимодействует с двумя молекулами брома, которые соответствуют 4 экв.
В общем виде: fэкв (вещества)=1/n, где n – число атомов галогена, реагирующих с одной молекулой вещества.
1.1.2. Обратное титрование. К лекарственному веществу добавляют избыток титрованного раствора калия бромата и калия бромид, раствор подкисляют серной или хлороводородной кислотой. Образующийся бром вступает в реакцию электрофильного замещения с фенолом. Через 10-15 минут избыток брома определяют йодометрическим методом: добавляют калия йодид
и выделившийся йод титруют раствором натрия тиосульфата (индикатор - крахмал). Иногда вместо крахмала применяют хлороформ – в этом случае титруют при сильном взбалтывании раствора до обесцвечивания хлороформного слоя. Обратное титрование используется, согласно ФС, для определения фенола, кислоты салициловой, раствора гексэстрола (синэстрола) в масле для инъекций.

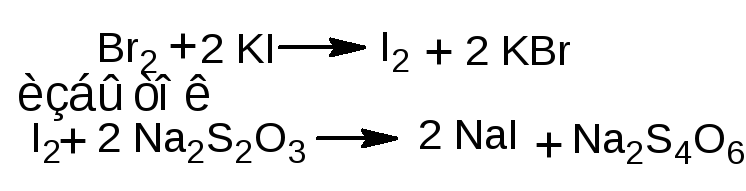
fэкв (резорцина, фенола, кислоты салициловой)=1/6; fэкв (гексэстрола)=1/8.
1.2. Йодометрический метод (прямое и обратное титрование). Т.к. реакция йодирования является обратимой, определение проводят в присутствии натрия гидрокарбоната или натрия ацетата для связывания выделяющегося йодоводорода.
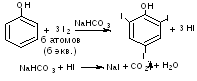
fэкв (фенола)=1/ 6
П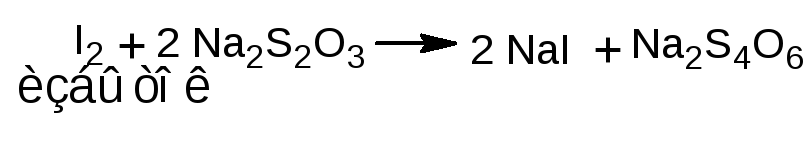 ри прямом титровании титруют до синего окрашивания, при обратном - избыток йода оттитровывают раствором натрия тиосульфата до обесцвечивания (индикатор - крахмал).
ри прямом титровании титруют до синего окрашивания, при обратном - избыток йода оттитровывают раствором натрия тиосульфата до обесцвечивания (индикатор - крахмал).
1.3. Йодхлорметрический метод (обратное титрование). При взаимодействии фенолов с йодмонохлоридом образуются йодпроизводные фенолов. Избыток йодмонохлорида определяют йодометрическим методом: прибавляют калия йодид и выделившийся йод титруют раствором натрия тиосульфата (индикатор крахмал). Йодмонохлорид, в отличие от брома, на вытесняет карбоксильную группу, находящуюся в о- и п- положениях по отношению к фенольному гидроксилу.
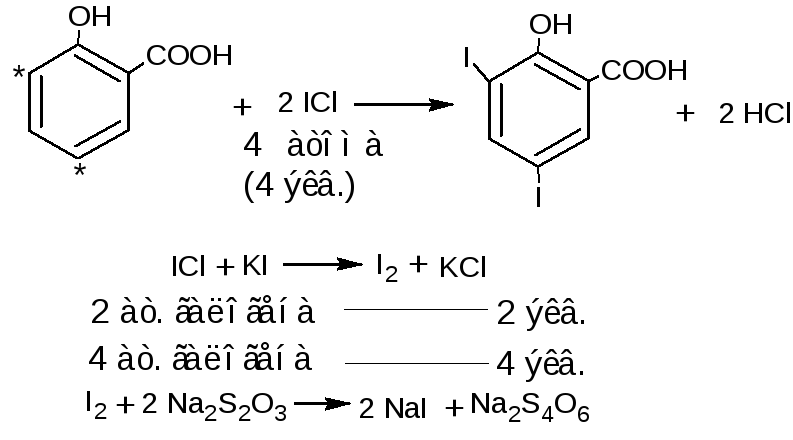
fэкв (кислоты салициловой)=1/4
2.Метод ацетилирования. Основан на свойстве фенолов образовывать при взаимодействии с уксусным ангидридом нерастворимые сложные эфиры.
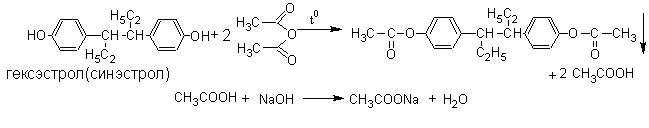
Метод является фармакопейным для гексэстрола (синэстрола). Условия определения и способы расчёта указаны в методах количественного определения спиртов (п.1).
3.Фотоколориметрический и спектрофотометрический методы с использованием цветных реакций (комплексообразования с железа (III) хлоридом, азосочетания с солями диазония и др.)
studfiles.net
control experiment (контрольный опыт)
check experiment (контрольный опыт)
Русско-английский синонимический словарь. 2014.
Контрольный абсорбер — 8.5 Контрольный абсорбер Ламповое стекло контрольного абсорбера (6.3) оставляют закрытым пробкой, пропускают поток диоксида углерода и кислорода через образцы до тех пор, пока все образцы, зажженные одновременно, не сгорят. Перекрывают подачу… … Словарь-справочник терминов нормативно-технической документации
Опыт реформирования государственной почты в разных странах — Несмотря на различия между подходами к реформе и реструктуризации государственной почты в разных странах, существуют общие правила, соблюдение которых определяет эффективность реструктуризации национального оператора и реформирования рынка услуг… … Энциклопедия ньюсмейкеров
ПРОВЕДЕНИЕ АНАЛИЗА — 5. ПРОВЕДЕНИЕ АНАЛИЗА Анализ проводят в ручном режиме работы прибора. 5.1. В память компьютера вводят результат контрольного опыта. 5.2. Взвешивают пробу на электронных весах, установленных на приборе. Нажатием клавиши «ENTER» на пульте… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Квантовая механика — волновая механика, теория устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов) а также связь величин, характеризующих частицы и системы, с… … Большая советская энциклопедия
Реактивы и растворы — 5.2 Реактивы и растворы Натрий углекислый по ГОСТ 83. Кремния двуокись по ГОСТ 9428. Кислота азотная по ГОСТ 4461, разбавленная 1:4. Аммоний углекислый по ГОСТ 3770. Метиловый оранжевый индикатор, водный раствор с массовой концентрацией 1 г/дм3.… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 12359-99: Стали углеродистые, легированные и высоколегированные. Методы определения азота — Терминология ГОСТ 12359 99: Стали углеродистые, легированные и высоколегированные. Методы определения азота оригинал документа: 4.2 Аппаратура, реактивы и растворы Установка для дистилляции аммиака с паром (рисунок 1) состоит из дистилляционной… … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 51859-2002: Нефтепродукты. Определение серы ламповым методом — Терминология ГОСТ Р 51859 2002: Нефтепродукты. Определение серы ламповым методом оригинал документа: 12.2 Воспроизводимость Расхождение между двумя отдельными и независимыми результатами испытаний, полученными разными лаборантами, работающими в… … Словарь-справочник терминов нормативно-технической документации
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
Противогнилостные средства — средства, препятствующие гнилостному разложению белковых веществ. Средства, задерживающие разложение безазотистых органических веществ, в отличие от П., называются противобродильными, так как разложение безазотистых органических веществ… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ШИФФА РЕАКТИВ — водный р р фуксинсернистой к ты (ф лы I или II). Служит для качественного обнаружения альдегидов. При взаимод. Ш. р. с альдегидом RCHO образуется пурпурно фиолетовый краситель (ф ла III). Р ция очень чувствительна (напр., можно определить 1 мкг… … Химическая энциклопедия
synonymum_ru_en.academic.ru
Testversuch
Русско-немецкий словарь по химии и химической технологии. 2013.
Контрольный абсорбер — 8.5 Контрольный абсорбер Ламповое стекло контрольного абсорбера (6.3) оставляют закрытым пробкой, пропускают поток диоксида углерода и кислорода через образцы до тех пор, пока все образцы, зажженные одновременно, не сгорят. Перекрывают подачу… … Словарь-справочник терминов нормативно-технической документации
Опыт реформирования государственной почты в разных странах — Несмотря на различия между подходами к реформе и реструктуризации государственной почты в разных странах, существуют общие правила, соблюдение которых определяет эффективность реструктуризации национального оператора и реформирования рынка услуг… … Энциклопедия ньюсмейкеров
ПРОВЕДЕНИЕ АНАЛИЗА — 5. ПРОВЕДЕНИЕ АНАЛИЗА Анализ проводят в ручном режиме работы прибора. 5.1. В память компьютера вводят результат контрольного опыта. 5.2. Взвешивают пробу на электронных весах, установленных на приборе. Нажатием клавиши «ENTER» на пульте… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Квантовая механика — волновая механика, теория устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов) а также связь величин, характеризующих частицы и системы, с… … Большая советская энциклопедия
Реактивы и растворы — 5.2 Реактивы и растворы Натрий углекислый по ГОСТ 83. Кремния двуокись по ГОСТ 9428. Кислота азотная по ГОСТ 4461, разбавленная 1:4. Аммоний углекислый по ГОСТ 3770. Метиловый оранжевый индикатор, водный раствор с массовой концентрацией 1 г/дм3.… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 12359-99: Стали углеродистые, легированные и высоколегированные. Методы определения азота — Терминология ГОСТ 12359 99: Стали углеродистые, легированные и высоколегированные. Методы определения азота оригинал документа: 4.2 Аппаратура, реактивы и растворы Установка для дистилляции аммиака с паром (рисунок 1) состоит из дистилляционной… … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 51859-2002: Нефтепродукты. Определение серы ламповым методом — Терминология ГОСТ Р 51859 2002: Нефтепродукты. Определение серы ламповым методом оригинал документа: 12.2 Воспроизводимость Расхождение между двумя отдельными и независимыми результатами испытаний, полученными разными лаборантами, работающими в… … Словарь-справочник терминов нормативно-технической документации
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
Противогнилостные средства — средства, препятствующие гнилостному разложению белковых веществ. Средства, задерживающие разложение безазотистых органических веществ, в отличие от П., называются противобродильными, так как разложение безазотистых органических веществ… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ШИФФА РЕАКТИВ — водный р р фуксинсернистой к ты (ф лы I или II). Служит для качественного обнаружения альдегидов. При взаимод. Ш. р. с альдегидом RCHO образуется пурпурно фиолетовый краситель (ф ла III). Р ция очень чувствительна (напр., можно определить 1 мкг… … Химическая энциклопедия
chemistry_ru_de.deacademic.com
Cтраница 1
Результаты контрольного опыта учитывают при расчете содержания серн в пробе. [1]
Результат контрольного опыта выражают в мл 0 02 н раствора азотнокислого серебра. [2]
Результаты контрольного опыта свидетельствовали о том, что не претерпевший перегруппировки продукт реакции - неофилбромид - устойчив в условиях проведения реакции. [3]
Результаты контрольных опытов, проведенных в тех же условиях, но без тока ( и с полиэтиленовой пленкой вместо кожи), обычно не отличались в пределах 0 1 мг А - от данных по титрованию аликвотных эталонных проб исходного раствора. [4]
Результаты контрольного опыта свидетельствовали о том, что не претерпевший перегруппировки продукт реакции - неофилбромид - устойчив в условиях проведения реакции. [5]
Результаты контрольных опытов после проведения опытов крекинга с фенолами показывают отсутствие сколько-нибудь заметных нежелательных изменений относительной активности катализатора. Регенерация катализатора во всех случаях также протекала совершенно нормально. [6]
Здесь же представлены результаты длительного контрольного опыта, подтверждающего правомерность использования ТВА при объемной ползучести. [7]
Отличие полученного результата от результата контрольного опыта, выражающееся в появлении окрашивания раствора в конической колбе от розового до оранжевого цвета, показывает на присутствие нитробензола в испытуемом масле. [8]
Отличие полученного результата от результата контрольного опыта, выражающееся в появлении окрашивания раствора в конической колбе от розового до оранжевого цвета, показывает на присутствие нитробензола в испытуемом масле. [9]
На рис. 4 - 6 приводятся некоторые результаты контрольных опытов и сравнение их с литературными данными. [10]
Массу сернокислого бария в граммах полученную в результате контрольного опыта ( среднее арифметическое двух параллельных определений), принимают за поправку на содержание серн в применявши: реактивах в внчнтают ее на массы сернокислого бария, полученной при анализе невытуемого материала. [11]
Однако работы по оценке нижней границы диапазона измерений на основании определения случайной изменчивости результатов контрольного опыта выявили многочисленные проблемы, возникающие вследствие трудоемкости, а главное, недостаточной надежности эксперимента. Кроме того, для многих аналитических методик не удается экспериментально изучить метрологические характеристики результатов контрольного опыта и установить таким образом нижнюю границу диапазона измерений. В этих условиях для методик, применяемых при аттестации государственных СО, в качестве нижней границы диапазона измерений принимают то минимальное содержание компонента, для которого экспериментально определены показатели точности, при условии соответствия полученных оценок установленным требованиям. [12]
Применение свежеприготовленного раствора Лейте дает правильные результаты, однако через 1 - 2 ч появляется осадок и снижается результат контрольного опыта, что приводит к ошибочным результатам. В работе [30] предложен раствор реагента, устойчивый в течение 5 - 6 суток. [13]
В результате анализа сульфита, выполненного очищенными реагентами, лучшие результаты получены при использовании парафуксина, что объясняется меньшим результатом контрольного опыта. Однако авторы работы [38] нашли, что очистку реагента методом хроматографии на бумаге трудно использовать в повседневной аналитической работе. Они установили, что основание парафуксина, которое образуется при обработке кислого раствора гидрохлорида парафуксина раствором гидроксида натрия, обладает преимуществами перед другими красителями триаминотрифенилметанового ряда. Это основание можно очистить перекристаллизацией из водного раствора метанола, при этом образуется чистый и стабильный реагент. [14]
Из всех изученных соединений, только для М - ацетил-1 3-оксазолидина наблюдается близость полученного значения mi / m с результатами контрольных опытов. [15]
Страницы: 1 2 3
www.ngpedia.ru
Vergleichsversuch
Русско-немецкий словарь по пиву. - М.: «РУССО». Е.С. Анюшкин . 2005.
Контрольный абсорбер — 8.5 Контрольный абсорбер Ламповое стекло контрольного абсорбера (6.3) оставляют закрытым пробкой, пропускают поток диоксида углерода и кислорода через образцы до тех пор, пока все образцы, зажженные одновременно, не сгорят. Перекрывают подачу… … Словарь-справочник терминов нормативно-технической документации
Опыт реформирования государственной почты в разных странах — Несмотря на различия между подходами к реформе и реструктуризации государственной почты в разных странах, существуют общие правила, соблюдение которых определяет эффективность реструктуризации национального оператора и реформирования рынка услуг… … Энциклопедия ньюсмейкеров
ПРОВЕДЕНИЕ АНАЛИЗА — 5. ПРОВЕДЕНИЕ АНАЛИЗА Анализ проводят в ручном режиме работы прибора. 5.1. В память компьютера вводят результат контрольного опыта. 5.2. Взвешивают пробу на электронных весах, установленных на приборе. Нажатием клавиши «ENTER» на пульте… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Квантовая механика — волновая механика, теория устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов) а также связь величин, характеризующих частицы и системы, с… … Большая советская энциклопедия
Реактивы и растворы — 5.2 Реактивы и растворы Натрий углекислый по ГОСТ 83. Кремния двуокись по ГОСТ 9428. Кислота азотная по ГОСТ 4461, разбавленная 1:4. Аммоний углекислый по ГОСТ 3770. Метиловый оранжевый индикатор, водный раствор с массовой концентрацией 1 г/дм3.… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 12359-99: Стали углеродистые, легированные и высоколегированные. Методы определения азота — Терминология ГОСТ 12359 99: Стали углеродистые, легированные и высоколегированные. Методы определения азота оригинал документа: 4.2 Аппаратура, реактивы и растворы Установка для дистилляции аммиака с паром (рисунок 1) состоит из дистилляционной… … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 51859-2002: Нефтепродукты. Определение серы ламповым методом — Терминология ГОСТ Р 51859 2002: Нефтепродукты. Определение серы ламповым методом оригинал документа: 12.2 Воспроизводимость Расхождение между двумя отдельными и независимыми результатами испытаний, полученными разными лаборантами, работающими в… … Словарь-справочник терминов нормативно-технической документации
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
Противогнилостные средства — средства, препятствующие гнилостному разложению белковых веществ. Средства, задерживающие разложение безазотистых органических веществ, в отличие от П., называются противобродильными, так как разложение безазотистых органических веществ… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ШИФФА РЕАКТИВ — водный р р фуксинсернистой к ты (ф лы I или II). Служит для качественного обнаружения альдегидов. При взаимод. Ш. р. с альдегидом RCHO образуется пурпурно фиолетовый краситель (ф ла III). Р ция очень чувствительна (напр., можно определить 1 мкг… … Химическая энциклопедия
beer_ru_de.deacademic.com