Углеводороды, 10 класс (профильный уровень)
Контрольная работа № 2 по теме: Углеводороды
10 класс (профиль)
Вариант 1
А1. Общая формула гомологического ряда аренов
1)СnH2n +2 2) CnH2n-2 3)CnHn 4) CnH2n-6
А2. Назовите вещество, формула которого:
CH3—CH—CH —CH2 —CH—CH3
│ │ │
CH3 CH3 CH3
1) 2,4,5 – триметилгексан 2) 2,3,5 – триметилгексан 3) 2,4 –диметилгептан 4) октан
А3. Какой из приведенных углеводородов относится к тому же гомологическому ряду, что и бутин-1:
1) бутан 2) бутин-2 3) пентин-1 4) бутадиен-1,3
А4. Вещества, имеющие формулы: СН3 — СН ═ СН — СН
СН3 — С ═ СН — СН3
│
СН3
1) являются гомологами 2)являются структурными изомерами 3)являются изомерами положения кратной связи 4) не являются ни гомологами, ни изомерами
А5. Какие реакции характерны для веществ, соответствующих общей формуле CnH2n-2
Какие реакции характерны для веществ, соответствующих общей формуле CnH2n-2
1) замещения 2) присоединения 3)дегидрирования 4) дегидратации
Приведите пример реакции данного типа
А6. В каком случае продуктом приведенных реакций является хлорбензол:
свет свет
1)С6Н6 + CI2 → 2)С6Н14 + 3CI2 → 3)С6Н6 + CI2 → 4)С6Н12 + CI2 →
Допишите уравнение реакции соответствующее условию задания
А7. К какому атому углерода присоединится бром в результате реакции:
1 2 3 4
СН2 ═ СН— СН2 — СН3 + НBr →
1)к первому 2)ко второму 3)к третьему 4) к четвертому
А8. Для алканов характерна изомерия:
геометрическая 3) углеродного скелета
положение функциональной группы 4) положение двойной связи
Приведите пример веществ изомеров согласно условию задания
А9. Характеристики: sp3-гибридизация; валентный угол 109,280; длина углерод – углеродной связи 0,154 нм соответствуют классу углеводородов с общей формулой:
Характеристики: sp3-гибридизация; валентный угол 109,280; длина углерод – углеродной связи 0,154 нм соответствуют классу углеводородов с общей формулой:
1)СnH2n +2 2) CnH2n-2 3)CnHn-6 4) CnH2
В1. Установите соответствие между типом химической реакции и уравнением реакции:
1) С2Н2
2) С2Н6 + CI2 → Б) замещения
3) С2Н4 +Br2 → В) разложения
4) СН2 ═ СН — СН3 + HF →
Запишите уравнения реакции для данного задания
В2. Установите соответствие между названием органического соединения и его структурной формулой: СН3 СН3
│
1) толуол А) СН3 — С— СН2 — СН3
│
2) пропин-2 СН3
3) 2,2 –диметилбутан Б) С6Н5СН3
4) пропен В) СН3 — С ≡ С—СН
5) пентин- 2 Г) СН2 ═ СН — СН3
6) бензол
В3. Метан образуется при:
Метан образуется при:
гидролизе карбида кальция 2) гидролизе карбида алюминия 3)гидрировании этилена 4)прокаливании ацетата натрия с гидроксидом натрия 5) разложении бензола 6) дегидратации этилового спирта
Напишите уравнения реакций данного задания
С1. Осуществить цепочку превращений:
t0 C 3C 2H2O C акт., t0 С2Н4 KMnO4, Н2SO4
CaCO3 CaO
Укажите типы реакций, дайте названия всем веществам
С2. При сжигании 10,5 г газообразного органического вещества выделилось 33 г углекислого газа и 13,5 г воды. Плотность вещества по аргону 1,05. В ходе исследования химических свойств этого вещества установлено, что при его взаимодействии с бензолом в присутствии хлорида алюминия образуется углеводород, который используется для получения фенола и ацетона.
На основании данных условия задания:
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок
связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с бензолом в при сутствии хлорида алюминия.
Контрольная работа №2 по теме: Углеводороды
Вариант 2
А1. Состав молекул углеводородов соответствует общей формуле CnH2n +2. К какому классу веществ могут относиться эти углеводороды:
1)алкены 2) алкины 3)алканы 4)арены
А2. Назовите вещество, формула которого:
СН3
\
CH—CH═ CH2
⁄
СН3
1) 2 – метилбутен-3 2) 1,1 – диметилпропен-2 3) 3,3 –диметилпропен-1 4) 3- метилбутен-1
А3. Вещества, имеющие формулы: СН3 — С ≡ С— СН2 — СН3 и НС≡ С — СН2 — СН2 — СН3
Вещества, имеющие формулы: СН3 — С ≡ С— СН2 — СН3 и НС≡ С — СН2 — СН2 — СН3
1) являются гомологами 2) являются структурными изомерами 3)являются изомерами положения кратной связи 4) не являются ни гомологами, ни изомерами
А4. Укажите ту пару веществ, которая включает названия гомологов 3- метилпентен-1:
1) 2- метилпентен-1; 4- метилпентен-1 2)2- метилбутен-1; 3- метилпентен-2
3) 3- метилгексен-1; 3- метилбутен-1 4)3- метилпропен-1; 2- метилпентен-2
А5. К какому атому углерода присоединится хлор в результате реакции:
1 2 3 4
НС ≡ С — СН2— СН3 + НCI →
1) к первому 2) ко второму 3)к третьему 4)к четвертому
А6. Какие реакции характерны для веществ, соответствующих общей формуле CnH2n+2
Приведите пример реакции данного типа
А7. В каком случае продуктом приведенных реакций является циклогексан
В каком случае продуктом приведенных реакций является циклогексан
катал. С актив. катал. катал.
1)С6Н6 + 3Н2 → 2) 3С2Н2 → 3) С7Н8 + 3Н2 4) С6Н12 + Н2 →
Допишите уравнение реакции соответствующее условию задания
А8. Для алкинов характерна изомерия
1) геометрическая 3) углеродного скелета
2) положение функциональной группы 4) положение двойной связи
Приведите пример веществ изомеров согласно условию задания
А9. Характеристики: sp2-гибридизация; валентный угол 1200; длина углерод – углеродной связи 0,134 нм соответствуют классу углеводородов с общей формулой:
1)СnH2n +2 2) CnH2n-2 3)CnHn-6 4) CnH2n
В1. Установите соответствие между названием органического соединения и его структурной формулой:
Установите соответствие между названием органического соединения и его структурной формулой:
1) пентадиен-1,3 А) СН2
2)2,3,4-триметилгексан Б) С6Н6
3) бензол В) СН3 — С ≡ С — СН3
4) бутин-2 Г) Н 3С —СН — СН— СН— СН2— СН3
│ │ │
5)пентен-1 СН3 СН3 СН3
6)3,4,5-триметилгексан
В2. Установите соответствие между типом химической реакции и уравнением реакции:
1) С3Н8 + CI2 → А) присоединения
2) С2Н6 → Б) замещения
3) С2Н2 +2Br2 → В) разложения
4) СН
Запишите уравнения реакции для данного задания
В3. Бутадиен -1,3 получают:
1) реакцией согласно правилу Зайцева 2) реакцией согласно правилу Марковникова 3) реакцией Лебедева 4) реакцией Кучерова 5) дегидрированием бутана 6)гидрированием одного моля бутина -1
Напишите уравнения реакций данного задания
С1. Осуществить цепочку превращений:
Осуществить цепочку превращений:
H2O 15000 C акт., t0 CH3Cl KMnO4, Н2SO4
Al4C3 Х1 Х2 Х3 Х4 Х5 → п-нитробензойная кислота
Укажите типы реакций, дайте названия всем веществам
С2. При сжигании 2,8 г газообразного органического вещества имеющего разветвлённую цепь углеродных атомов, выделилось 4,48 л (н. у.) углекислого газа и 3,6 г воды. Плотность вещества по воздуху 1,931. В ходе исследования химических свойств этого вещества установлено, что при его взаимодействии с бромоводородом образуется третичное моногалогенпроизводное.
На основании данных условия задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок
связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с бромоводородом.
Контрольная работа № 2 по теме: Углеводороды
Вариант 3
А1.Гомологическому ряду алкинов соответствует общая формула:
1)СnH2n +2 2)CnH2n-2 3)CnH2n 4)CnH2n-6
А2. Назовите вещество, формула которого:
CH3—C ≡ C —CH2
│
CH3
1) 1 – метилбутин-2 2) 4 – метилбутин-2 3) пентин-2 4) пентин-3
А3. Выберите среди предложенных формул гомолог пентадиена-1,3:
1)СН ≡ С — СН2—СН2 —СН2 —СН3
2)СН2 ═ СН — СН ═ СН2
3)СН2 ═ СН — СН2— СН ═ СН2
4)Гомолога нет
А4. Вещества, имеющие формулы: СН2 ═ СН —СН3 и СН3— С≡ СН
1) являются гомологами 2) являются структурным изомерами 3)не являются ни гомологами, ни изомерами
4) являются изомерами положения кратной связи
А5. Какие реакции характерны для веществ, соответствующих общей формуле CnH2n
Какие реакции характерны для веществ, соответствующих общей формуле CnH2n
1)замещения 2)присоединения 3)дегидратации 4) восстановления
А6. В каком случае продуктом приведенных реакций является бромбензол?
свет
1) С6Н6 + Br2 →
свет
2)С7Н8 + Br2 →
катал.
3)С6Н6 + Br2 →
4)С6Н12 + Br2 →
Напишите соответствующее уравнение реакции
А7. К какому атому углерода присоединится хлор в результате реакции:
1 2 3 4
СН3 — С ═ СН — СН3 + НCI →
│
СН3
1) к первому 2)ко второму 3) к третьему 4)к четвертому
А8. Для алкенов характерна изомерия
1) геометрическая 3) положение двух двойных связей
2) положение функциональной группы 4) положение тройной связи
Приведите примеры веществ изомеров согласно этого задания
А9. Характеристики: sp-гибридизация; валентный угол 1800; длина углерод – углеродной связи 0,120 нм соответствуют классу углеводородов с общей формулой:
Характеристики: sp-гибридизация; валентный угол 1800; длина углерод – углеродной связи 0,120 нм соответствуют классу углеводородов с общей формулой:
1)СnH2n +2 2) CnH2n-2 3)CnHn-6 4) CnH2n-6
В1. Установите соответствие между типом химической реакции и уравнением реакции:
1) С3Н6 + Н2О → А) присоединения
2) С2Н6 + Br2 → Б) замещения
t
3) СН4 → В) разложения
4) СН2 ═ С — СН═ СН2 + H2 →
│
СН3
Запишите уравнения реакций согласно задания
В2. Установите соответствие между названием органического соединения и его структурной формулой:
1) изобутан А) СН2 ═ СН — СН═ СН2
2) 3 –метилпентин-1 Б) СН3 — СН — СН3
│
3)гексен-3 СН3
4) бутадиен-1,3 В) СН ≡ С— СН—СН2 —СН3
│
5) 2- метилбутан СН3
6) гептен-3 Г) СН3—СН2—СН═ СН—СН2 — СН2— СН3
В3. Бензол образуется при:
Бензол образуется при:
пиролизе метана 2) термическом разложении полиэтилена 3) разложении гексана при нагревании с катализатором 4) восстановлении толуола 5) перегонки нефти 6) тримеризации ацетилена
Запишите все уравнения реакций
С1. Осуществить цепочку превращений:
NaOH, t0 Cl2, свет бензол Сl2, FeCl3 KMnO4, Н2SO4
CH3COONa Х1 Х2 Х3 Х4 Х5
Укажите типы реакций, дайте названия всем веществам
С2. При сжигании 21,0 г органического вещества выделилось 33,6 л (н.у.) углекислого газа и 27 г воды. Плотность вещества по аргону 1,05. В ходе исследования химических свойств этого вещества установлено, что при его взаимодействии с водным раствором перманганата калия образуется бурый осадок.
На основании данных условия задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок
связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с водным раствором перманганата калия.
Контрольная работа по химии «Углеводороды и их природные источники» (10 класс)
→→Контрольная работа №1 (10 класс)
Углеводороды и их природные источники
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа
1.(2 балла). Общая формула аренов:
А. CnH2n+2. Б. CnH2n. B. CnH2n-2. Г. CnH2n-6
2.(2 балла). Углеводород с формулой СН3—СН3 относится к классу:
А. Алканов. В. Алкинов.
Б. Алкенов. Г. Аренов.
3.(2 балла). Изомером вещества, формула которого СН2=СН—СН2—СН3, является:
А. 2-Метилбутен-2. В. Бутан.
Б. Бутен-2. Г. Бутин-1.
Бутен-2. Г. Бутин-1.
4.(2 балла). Предыдущим гомологом пентадиена-1,3 является:
А. Бутадиен-1,3. В. Пропадиен-1,2.
Б. Гексадиен-1,3. Г. Пентан.
5. (2 балла). Вещество, для которого характерна реакция замещения:
А. Бутан. В. Бутин.
Б. Бутен-1. Г. Бутадиен-1,3.
6.(2 балла). Вещество, для которого не характерна реакция гидрирования:
А. Пропен. Б. Пропан. В. Этин. Г. Этен.
7.(2 балла). Формула вещества X в цепочке превращений
СН4→Х → Н2 , Ni С2Н4:
А. СО2. Б. С2Н2 В. С3Н8. г. С2Н6.
8. (2 балла). Для получения углеводорода с более длинной углеродной цепью применяют реакцию:
А. Вюрца В. Кучерова.
Б. Зайцева Г. Марковникова.
9.(2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. C2H4 и СН4 В. С6Н6 и Н20.
C2H4 и СН4 В. С6Н6 и Н20.
Б.С3Н8 и Н2 Г. С2Н4 и Н2.
10 (2 балла). При полном сгорании 1 л газообразного углеводорода (н. у.) образовалось 2 л оксида углерода (IV). Углеводородом является:
А. Бутан. В. Пропан.
Б. Метан. Г. Этан.
ЧАСТЬ Б. Задания со свободным ответом
11. (9 баллов). Напишите уравнения химических реакций для следующих превращений:
СН4→ СН3С1→ С2Н6→C2H5N02.
Дайте названия продуктов реакций.
12. (6 баллов). Для З-метилбутина-1 запишите не менее трех формул изомеров. Дайте название каждого вещества, укажите виды изомерии.
13.(4 балла). Перечислите области применения алкенов.
14. (11 баллов). При сжигании 29 г углеводорода образовалось 88 г оксида углерода (IV) и 45 г воды. Выведите молекулярную формулу углеводорода.
Выведите молекулярную формулу углеводорода.
Контрольная работа №1 (10 класс)
Углеводороды и их природные источники
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Общая формула алканов:
А. CnH2n+2. Б. CnH2n. B. CnH2n-2. Г. CnH2n-6
2. (2 балла). Углеводород, формула которого
СН3—С(СН3 ) ===СН2,
относится к классу:
А. Алканов. В. Алкинов.
Б. Алкенов. Г. Аренов.
3 (2 балла). Изомером вещества, формула которого СН3—С=С—СН3, является:
A. Пентин-2. Б. Бутан. B. Бутен-2. Г. Бутин-1.
4 (2 балла). Последующим гомологом бутана является:
А. Гексан. Б. Пропан. В. Пропен. Г. Пентан.
Гексан. Б. Пропан. В. Пропен. Г. Пентан.
5 (2 балла). Вещество, для которого характерна реакция присоединения:
А. Гексан. Б. Пропан. В. Пропен. Г. Октан.
6 (2 балла). Вещество, для которого характерна реакция гидрирования:
А. Метан. Б. Пропан. В. Пропен. Г. Этан.
7 (2 балла). Вещество X в цепочке превращений
С3Н8 —> СН2=СН—СН3 ——> X:
А. 1,2-Дихлорпропан. В. 2-Хлорпропан.
Б. 2,2-Дихлорпропан. Г. 1-Хлорпропан.
8 (2 балла). Присоединение галогеноводородов к несимметричным алкенам осуществляется согласно правилу:
А. Вюрца. В. Кучерова.
Б. Зайцева. Г. Марковникова.
9 (2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. С3Н8 и О2. В. С4Н10 и НС1.
Б. С2Н4 и СН4. Г. С6Н6 и Н20.
10 (2 балла). При полном сгорании 3 л (н. у.) газообразного углеводорода образовалось 3 л (н. у.) оксида углерода (IV). Углеводородом является:
А. Бутан. Б. Метан. В. Пропан. Г. Этан.
ЧАСТЬ Б. Задания со свободным ответом
11. (9 баллов). Напишите уравнения химических реакций для следующих превращений:
СаС2→ С2Н2→ С6Н6→ C6H5N02.
Дайте названия продуктов реакций.
12. (6 баллов). Для бутадиена-1,3 запишите не менее трех формул изомеров. Дайте названия каждого вещества, укажите виды изомерии.
13. (4 балла). Перечислите области применения алканов.
14. (11 баллов). При полном сгорании 3г углеводорода получили 4,48 л (н.у.) углекислого газа и 5,4 г воды. Относительная плотность вещества по воздуху равна 1,03. Выведите молекулярную формулу углеводорода.
Контрольная работа 10 класс
Углеводороды
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором ответа
Тестовые задания с выбором ответа
(2 балла). Общая формула алкинов:
А. CnH2n+2. Б. CnH2n. B. CnH2n-2. Г. CnH2n-6
2. (2 балла). Углеводород с формулой С6Н5—СН3 относится к классу:
А. Алканов. В. Алкинов.
Б. Алкенов. Г. Аренов.
3 (2 балла). Изомером вещества, формула которого
СН3—СН(СН3)—СН2—СН3,
является:
А. Бутан. В. З-Метилпентан.
Б. 2-Метилпропан. Г. Пентан.
4. (2 балла). Предыдущим гомологом вещества бутин-1 является:
А. Бутин-2. В. Пентин-2.
Б. Пентин-1. Г. Пропин.
5 (2 балла). Вещество, для которого характерна реакция полимеризации:
А. Бутадиен-1,3. В. Бензол.
Б. Бутан. Г. Циклогексан.
6. (2 балла). Вещество, для которого характерна реакция гидратации:
А. Бутан. В. Циклопентан.
Бутан. В. Циклопентан.
Б. Полипропилен. Г. Этилен.
7. (2 балла). Формула вещества X в цепочке превращений
С2Н5ОН →X →СН3-СН2-С1:
А. С2Н2. Б. С2Н4. В. C2H6. Г. C3H6.
8. (2 балла). Присоединение воды к ацетилену называют реакцией:
А. Вюрца. В. Кучерова.
Б. Зайцева. Г. Марковникова.
9. (2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. С2Н6 и НС1. В. С6Н6 и Н20.
Б. С2Н4 и С12. Г. С2Н6 и Н20.
10 (2 балла). При полном сгорании 2 л (н. у.) газообразного углеводорода образовалось 8 л (н. у.) оксида углерода (IV). Углеводородом является:
А. Бутан. В. Пропан.
Б. Метан. Г. Этан.
ЧАСТЬ Б. Задания со свободным ответом
11 (9 баллов). Напишите уравнения химических реакций для следующих превращений:
сн4→с2н→с6н→c6h5ci.
Дайте названия продуктов реакций.
12 (6 баллов). Для З-метилпентена-1 запишите не менее трех формул изомеров. Дайте название каждого вещества, укажите виды изомерии.
13 (4 балла). Перечислите области применения алкинов.
14 (11 баллов). При сжигании 11,2 г органического вещества получено 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная молекулярная масса этого вещества равна 56. Выведите молекулярную формулу вещества.
Контрольная работа 10 класс
Углеводороды
Вариант 4
ЧАСТЬ А. Тестовые задания е выбором ответа
1. (2 балла). Общая формула алкенов:
А. CnH2n+2. Б. CnH2n. B. CnH2n-2. Г. CnH2n-6
2. (2 балла). Углеводород с формулой СН=С—СН3 относится к классу:
А. Алканов. В. Алкинов.
Б. Алкенов. Г. Аренов.
3. (2 балла). Изомером вещества, формула которого
СН2=СН—СН=СН2, является:
A. 2-Метилбутадиен-1,3. B. Бутен-1.
Б. Бутин-1. Г. Бутан.
4. (2 балла). Последующим гомологом вещества 2-метилпропан является:
А. 2-Метилбутан. В. Бутан.
Б. 2-Метилпентан. Г. Пентан.
5. (2 балла). Вещество, для которого характерна реакция гидратации:
А. Ацетилен. В. Полиэтилен.
Б. Бутан. Г. Циклобутан.
6. (2 балла). Вещество, для которого характерна реакция полимеризации:
А. Бензол. В. Пентадиен-1,3.
Б. Бутан. Г. Циклобутан.
7. (2 балла). Формула вещества X в цепочке превращений
СН4 —— С2Н2 —— X:
А. Бензол. В. Гексен.
Б. Гексан. Г. Циклогексан.
8. (2 балла). При составлении уравнения реакции отщепления галогеноводорода используют правило:
А. Вюрца. В. Кучерова.
Б. Зайцева. Г. Марковникова.
9. (2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. СН4 и Н2. В. С2Н2 и Н20.
Б. С6Н6 и Н20. Г. С2Н6 и Н20.
10.(2 балла). При полном сгорании 1 л (н. у.) газообразного углеводорода образовалось 3 л оксида углерода (IV). Углеводородом является:
А. Бутан. В. Пропан.
Б. Метан. Г. Этан.
ЧАСТЬ Б. Задания со свободным ответом
11.(9 баллов). Напишите уравнения химических реакций для следующих превращений:
С2Н5ОН→ С2Н4→ С2Н5С1→ С4Н10.
Дайте названия продуктов реакций.
12.(6 баллов). Для пентена запишите не менее трех формул изомеров. Дайте название каждого вещества, укажите виды изомерии.
13 (4 балла). Перечислите области применения аренов.
14 (11 баллов) При термическом разложении 5.6 л (н.у.) неизвестного алкана образовалось 6 г технического углерода и водород. Выведите формулу алкана.
Примерная шкала перевода в пятибалльную систему оценки
0-17 баллов – «2»
18-30 баллов – «3»
31 – 43 балла – «4»
44 – 50 баллов – «5»
Методическая разработка по химии (10 класс) по теме: Контрольная работа по теме «Углеводороды» 10 класс
Контрольная работа по теме «Углеводороды» (Проектирование теста учебных достижений в формате ЕГЭ)
составила: Шаншаева Сапижат Исаевна учитель химии МБОУ «СОШ № 2» г.Тарко-Сале. 2013г. |
Кодификатор элементов содержания проверочного контроля
по теме «Углеводороды».
Общие формулы классов углеводородов. Изомерия и гомология. Типы химических связей. Характерные химические свойства углеводородов. Способы получения углеводородов. Генетическая связь между классами углеводородов.
Дорогой десятитиклассник!
Внимательно прочитай инструкцию по выполнению контрольной работы.
На выполнение контрольной работы по химии отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий. Часть1 включает 7 заданий (А1-А7) базового уровня. Каждому заданию дается 4 варианта ответа, из которых только один правильный. За каждый верный ответ дается 1 балл. Внимательно прочитай каждое задание и проанализируй все варианты предложенных ответов.
Часть 2 — повышенного уровня, состоит из двух заданий (В1-В2), на которые надо дать краткий ответ в виде последовательности цифр. За каждый верный ответ задания, в части 2 дается 2 балла.
Часть 3 (С1) содержит одно задание высокого уровня. Это задача. Задание (С1) требует развернутого ответа. Полностью выполненное задание оценивается в 3 балла.
Постарайся выполнять задания в том порядке, в котором они даны. Для экономии времени пропускай задание, которое не удается выполнить сразу, и переходи к следующему. К пропущенному заданию ты сможешь вернуться после выполнения всей работы, если останется время.
При выполнении работы ты можешь пользоваться периодической системой химических элементов Д.И. Менделеева и непрограммируемым калькулятором.
Баллы, полученные тобой за выполненные задания, суммируются. Постарайся выполнить как можно больше заданий и набрать наибольшее количество баллов.
баллы | оценка |
0-6 баллов | 2 |
7-9 баллов | 3 |
10-12 баллов | 4 |
13-14 баллов | 5 |
План контрольной работы по теме:
«Углеводороды».
Цель: Контроль усвоения знаний учащихся по теме «Углеводороды».
Вид контроля: Тематический.
№ задания | Элемент содержания | Количество баллов |
А-1 | Общие формулы углеводородов. | 1 балл |
А-2 | Изомерия углеводородов. | 1 балл |
А-3 | Гомологи углеводородов. | 1 балл |
А-4 | Способы получения углеводородов. | 1 балл |
А-5 | Химические свойства углеводородов. | 1 балл |
А-6 | Качественные реакции на кратную связь. | 1 балл |
А-7 | Типы химических связей. | 1 балл |
В-1 | Умение определять по молекулярной формуле принадлежность классу углеводородов. | 2 балла |
В-2 | Генетическая связь классов углеводородов. | 2 балла |
С-1 | Решение расчетной задачи на нахождение формулы углеводорода по массе продуктов сгорания и его относительной плотности. | 4 балла |
Инструкция по выполнению работы.
На выполнение тематической контрольной работы по теме: «Углеводороды» отводится 40 минут. Работа состоит из трех частей и включает 10 заданий.
Часть 1 включает 7 заданий (А1-А7). К каждому заданию дается 4 варианта ответа, из которых только один правильный. Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
Часть 2 состоит из 2 заданий (В1-В2), на которые надо дать краткий ответ в виде последовательности цифр и составления химических реакций с указанием названия продуктов реакции.
Часть 3 содержит наиболее сложное задание (С1), которое требует полного (развернутого) ответа.
Постарайтесь выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы можете вернуться после выполнения всей работы, если останется время.
За выполнение различных по сложности заданий дается один или более баллов. Баллы, полученные вами за выполнение задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Система оценивания:
0-7 баллов «2»
8-10 баллов «3»
11-13 баллов «4»
14-15 баллов «5»
Желаю успеха!
Часть 1
Ghb При выпоПри
Общая формула алканов:
1) СпН2п 2) СпН2п-2 3) СпН2п-6 4) СпН2п+2
Изомером вещества, формула которого СН2 = СН – СН2 – СН3, является:
1) 2-Метилбутен-2 2) Бутан 3) Бутен-2 4) Бутин-1
Предыдущим гомологом пентадиена-1,3 является:
1) Пропадиен-1,2 2) Гексадиен-1,3 3) Бутадиен-1,3 4) Пентан
Присоединение воды к ацетилену называют реакцией:
1) Кучерова 2) Марковникова 3) Вюрца 4) Зайцева
Вещество, для которого характерна реакция замещения:
1) Бутин 2) Бутан 3) Бутен-1 4) Бутадиен-1,3
Выберите вещество, определяющее кратную связь в непредельных углеводородах:
1) HCI 2) CI2 3) h3O 4) Br2
Определите тип реакции не характерной для алканов:
1) присоединение 2) замещение 3) горение 4) разложение
Часть 2
Установите соответствие между формулой вещества и классом углеводородов,
к которому оно принадлежит.
ФОРМУЛА ВЕЩЕСТВА КЛАСС УГЛЕВОДОРОДОВ
А) С6Н14 1) арены
Б) С6Н12 2) алканы
В) С6Н6 3) алкины
Г) С6Н10 4) алкены
Напишите уравнения реакций, с помощью которых можно осуществить следующие
превращения:
Pt, t +HCI
С3Н8 → СН2 = СН – СН3 → Х
Часть 3
При полном сгорании углеводорода образовался оксид углерода (IV) массой 0,88г и вода массой 0,36г. Относительная плотность углеводорода по водороду равна 21. Найти молекулярную формулу углеводорода.
Инструкция по проверке и оценке учащихся по химии.
Часть 1.
Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует), задание считается невыполненным.
№ задания | Ответ |
А 1 | 4 |
А 2 | 3 |
А 3 | 3 |
А 4 | 1 |
А 5 | 2 |
А 6 | 4 |
А 7 | 1 |
Часть 2.
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ в заданиях В1-В2 ставиться 2 балла, допущена одна ошибка-1 балл, за неверный ответ или его отсутствие – 0 баллов.
№ задания | ответ |
В 1 | 2413 |
В 2 | 2-хлорпропан |
Часть 3.
Критерии проверки и оценки выполнения
Заданий с развернутым ответом.
За выполнение заданий ставится: С1 от 0 до 4 баллов.
При полном сгорании углеводорода образовался оксид углерода (IV) массой 0,88 г и вода массой 0,72 г. Относительная плотность углеводорода по водороду равна 21. Найдите молекулярную формулу углеводорода.
Ответ:
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа:
М (СхНу)= 21.2=42 г/моль.
n(C)= 0,88/44.1=0,02 моль n(Н)= 0,36/18.2=0,04 моль
С : Н=0,02: 0,04=1:2
С3Н6 | |
Ответ правильный и полный, включает все названные выше элементы | 4 |
В ответе допущена ошибка в одном из названных выше элементов | 3 |
В ответе допущена ошибка в двух названных выше элементов | 2 |
В ответе допущена ошибка в трех названных выше элементов | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 4 |
Итоговая контрольная работа по химии в 10 классе «Углеводороды»
Итоговая контрольная работа по химии в 10 классе
Тема «Углеводороды»
Пичугина Галина Михайловна — учитель химии ГБОУ лицей (экономический) с.Исаклы,
автор работы на Всероссийский конкурс для учителей химии «10 главных вопросов».
Тестовая работа соответствует учебно-методическому комплекту учебников
Г.Е. Рудзитиса,Ф.Г. Фельдмана, разработана для учащихся, изучающих химию на базовом уровне.
Цель работы: проверить уровень учебных достижений учащихся по теме «Углеводороды»: знание строения, номенклатуры и свойств углеводородов, умение выполнять задания в тестовой форме и решение задач по химическому уравнению и находение молекулярную формулу вещества по продуктам сгорания и известной относительной плотности одного газа по другому.
В заданиях 1-3 выберите по одному правильному ответу
1.Понятие «химическое строение» разработал и ввел в органическую химию:
1.А.Купер
2.Ф.Кекуле
3.А.Бутлеров
4.Д.Менделеев
2.Природа химической связи в органических веществах:
1.ионная
2.ковалентная
3.гетеролитическая
4.электронная
3.Бутан и циклобутан реагируют с:
1.водой
2.кислородом
3.водородом
4.хлороводородом
В задании 4 — 6 необходимо выбрать по три правильных ответа
4.Предельные (насыщенные) углеводороды имеют следующие особенности строения:
1.sp2 -гибридизация
2.длина связи C — C = 0,154 нм
3.одна двойная связь в молекуле
4.валентные углы атома углерода = 109град.28мин
5.sp — гибридизация
6.тетраэдрическая направленность гибридных облаков атомов углерода.
5.Укажите изомеры пентина — 1.
1.изопрен
2.пентен — 2
3.3-метилбутан
4.пентин -2
5.3-метилбутадиен-1,2
6.циклопентан
6.Гомологами являются:
1.пропан и циклопропан
2.этилен и этен
3.пропин и бутин
4.гексан и гептан
5.пентадиен-1,2 и дивинил
6.метан и метил
Задания 7-8 на соответствие
7.Установите соответствие между названием вещества и их признаками:
1.Ацетилен
2.Бензол
А.Общая формула СnН2n-2
Б.Ароматический углеводород
В.sp -гибридизация
Г.Форма молекулы линейная
Д.Молекуле этого вещества установлен памятник
Е.Молекула этого вещества устойчива к окислению.
8.Установите соответствие между названием вещества и его принадлежностью к определенному гомологическому ряду углеводородов:
1.циклобутен А.Арен
2.декан Б.Алкен
3.этен В.Циклоалкан
4.циклопропан Г.Алкин
5.бутин -2 Д.Алкан
6. толуол Е.Циклоалкен
В заданиях 9-10 необходимо провести соответствующие расчеты
9.Задача. Сколько литров воздуха потребуется для сжигания 200г бутана (н.у)?
10.Задача. При сжигании органического вещества массой 4,3 г получилось 13,2 граммов СО2 и 6,3 граммa Н2О. Относительная плотность этого вещества по водороду равна 43. Вывести молекулярную формулу органического вещества.
Ответы
1. 3
2.4
3.2
4.2,4,6
5.1,4,5
6.3,4,5
7. 1-АВГ 2-БДЕ
8. 1-Е 2-Д 3 -Б 4 — В 5-Г 6 — А
Решение задания №9
Алгорим решения:
1.Составить химическое уравнение
2.Записать данные условия задачи
3.Найти вспомогательные данные: молярную массу бутана и молярный объем газа при (н.у). Указать массовую долю кислорода в воздухе (21%)
4.Провести необходимые расчеты.
200г V-?
1) 2С4Н10 + 13O2———8CO2 + 10 h3O
116г 291,2л
М( С4Н10) = 58г/моль
Vm =22,4 л/моль
2) V (О2) = 200 х 291,2
116
V (О2) = 502л
3) V (воздуха) = 502 : 0,21 =2390,5л
Ответ: V (воздуха) =2390,5л
Решение задания №10
Алгорим решения:
1.Составить схему химической реакции.
2.Записать данные условия задачи.
3.Найти вспомогательные данные: молярную массу воды и молярный объем углекислого газа.
4.Провести необходимые расчеты.
4,3г 13,2г 6,3г
Х + O2———CO2 + h3O
М- ? 44г/моль 18г/моль
1.Определяем молярную массу неизвестного вещества М(Х)=М(Н2) х Dн2
М(Х) = 43 х 2 = 86г/моль
2.Определяем количество вещества CO2 и h3O по формуле n=m/M
n(CO2) =13,2/44 = 0,3 моль (6)
n(h3O) =6,3/18 = 0,35 моль (7)
n (Х) = 4,3/86 = 0,05 моль (1)
3.Привели к целым числам количество вещества, т.е. Определили
коэффициенты в схеме реакции.
4. Х + O2———6CO2 + 7 h3O
5. Проставив коэффициенты в правую часть уравнения находим число атомов
С и Н в неизвестном веществе: получаем С6Н14
6.Составим простейшую формулу и определим ее молярную массу
М(С6Н14) = 86г/моль
7. Простейшая формула является истинной формулой неизвестного вещества.
Ответ: С6Н14 — гексан
Тестовая контрольная работа по теме Предельные углеводороды для 10 класса по химии
Тест по теме «Предельные углеводороды». Часть А. тестовые задания с выбором одного правильного ответа и на соотношение. 1.(1 балл). Какое из следующих утверждений неверно? А. Любой предельный углеводород содержит первичный атом углерода; Б.Любой предельный углеводород содержит атом углерода в состоянии sp3 – гибридизации; В. Для алканов характерно большое число типов изомерии; Г. Молекулы алканов содержат только G связи. 2.(1 балл). Найдите верное утверждение: А. Два гомолога могут являться изомерами; Б. Два изомера могут являться гомологами; В. Два вещества, являются изомерами, могут относиться к различным гомологическим рядам; Г. Два вещества, состав которых отличается на одну или несколько групп – Ch3 -, являются гомологами. 3. (1 балл). Какой тип изомерии характерен для алканов? А. Изомерия углеводородного скелета; Б. Изомерия по положению двойной связи; В. Изомерия по положению тройной связи; 4. (1 балл). Метан в лаборатории получают: А. Пиролизом бутана; Б. Гидрогенизацией угля; В. Реакцией Вюрца; Г.
| № п/п | 1 вариант | 2 вариант | 3 вариант | 4 вариант |
| 1 | 4 | 2 | 3 | 1 |
| 2 | 1 | 2 | 4 | 3 |
| 3 | 2 | 4 | 4 | 2 |
| 4 | 2 | 3 | 3 | 1 |
| 5 | 1 | 1 | 1 | 1 |
| 6 | 1 | 3 | 1 | 3 |
| 7 | 2 | 3 | 2 | 1 |
| 8 | 1 | 4 | 2 | 3 |
| 9 | 4 | 1 | 2 | 3 |
| 10 | 2 | 4 | 2 | 4 |
| 11 | 3 | 1 | 2 | 3 |
| 12 | Производство полимеров, растворителей, уксусной кислоты, этанола, созревания плодов | Производство сажи, резины, типографской краски, органических соединений, фреонов, метанола, ацетилена | Производство растворителей, ацетона, уксусной кислоты, этанола, клея, резки и сварки металлов | Производство растворителей, анилина, фенола, пестицидов, лекарственных препаратов, феноформальдегидных смол |
| 13 | 1) CH4 + Cl2 → CH3Cl + HCl хлорметан р. замещения (галогенирование) 2)2 CH3Cl + 2Na → C2H6 + 2NaCl этан р. Вюрца 3) C2H6+HNO3 →C2H5NO2 +H2O нитроэтан р. замещения (нитрование) | 1) СаC2 + 2Н2О→ C2Н2 + Са(ОН)2 ацетилен р. получения ацетилена 2) 3C2Н2 → C6H6 бензол р. тримеризации 3) C6H6+HNO3 →C6H5NO2 +H2O нитробензол р. замещения (нитрование) | 1) 2CH4→ C2Н2 + 3H2 ацетилен р. разложения 2) 3C2Н2 → C6H6 бензол р. тримеризации 3) C6H6+ Cl2 →C6H5Cl +HCl хлорбензол р. замещения (галогенирование) | 1) C2H5ОН → C2H4 + H2О этилен р. разложения (дегидратация) 2) C2H4 + HCl → C2H5Cl хлорэтан р. присоединения (гидрогалогенирование) 3) 2C2H5Cl+2Nа →C4H10 +2NaCl р. Вюрца бутан |
| 14 | 1) М(СхНу)=29 ·2=58г/моль 2) υ(C)=(0,833·58)/12=4моль 3) υ(Н)= 0,167·58/1 = 8моль Ответ: С4Н8 | 1) М(СхНу)=2 · 2= 4г/моль 2) υ(C)=(0,8182· 4) /12 =2моль 3) υ(Н)=(0,1818 · 4)/1 =6моль Ответ: С2Н6 | 1) МСхНу)=13 · 2 =26г/моль 2) υ(C)=(0,9213 · 26) /12 =2моль 3) υ(Н)=(0,0769 · 26)/1 = 2моль Ответ: С2Н2 | 1) МСхНу)=28 · 2 =56г/моль 2) υ(C)=(0,857 · 56) /12 =4моль 3) υ(Н)=(0,143 · 56)/1 = 8моль Ответ: С4Н8 |
% PDF-1.5 % 2439 0 obj> endobj xref 2439 3230 0000000016 00000 н. 0000070647 00000 п. 0000070784 00000 п. 0000071039 00000 п. 0000066207 00000 п. 0000071084 00000 п. 0000071216 00000 п. 0000071495 00000 п. 0000071568 00000 п. 0000071720 00000 п. 0000071875 00000 п. 0000071996 00000 п. 0000072126 00000 п. 0000072331 00000 п. 0000072572 00000 п. 0000072834 00000 п. 0000083617 00000 п. 0000084434 00000 п. 0000084675 00000 п. 0000084941 00000 п. 0000085197 00000 п. 0000112008 00000 н. 0000112825 00000 н. 0000113188 00000 п. 0000113518 00000 н. 0000114006 00000 н. 0000126617 00000 н. 0000126842 00000 н. 0000127032 00000 н. 0000127487 00000 н. 0000130576 00000 н. 0000130927 00000 н. 0000131113 00000 н. 0000131598 00000 н. 0000135345 00000 п. 0000135673 00000 н. 0000135975 00000 н. 0000136483 00000 н. 0000140686 00000 н. 0000141155 00000 н. 0000141269 00000 н. 0000141381 00000 н. 0000141432 00000 н. 0000141489 00000 н. 0000142112 00000 н. 0000142863 00000 н. 0000143276 00000 н. 0000144263 00000 н. 0000151269 00000 н. 0000157898 00000 н. 0000164746 00000 н. 0000171393 00000 н. 0000178248 00000 н. 0000184907 00000 н. 0000185275 00000 п. 0000185330 00000 н. 0000185778 00000 н. 0000185970 00000 н. 0000186097 00000 н. 0000186594 00000 н. 0000192080 00000 н. 0000192575 00000 н. 0000192940 00000 н. 0000193117 00000 н. 0000193871 00000 н. 0000194042 00000 н. 0000194097 00000 н. 0000194154 00000 н. 0000194282 00000 н. 0000194452 00000 н. 0000201398 00000 н. 0000208262 00000 н. 0000330079 00000 п. 0000332191 00000 н. 0000335524 00000 н. 0000341868 00000 н. 0000393845 00000 н. 0000394100 00000 н. 0000394767 00000 н. 0000394922 00000 н. 0000395085 00000 н. 0000395135 00000 н. 0000395187 00000 н. 0000395238 00000 п. 0000395288 00000 н. 0000395329 00000 н. 0000395386 00000 п. 0000395448 00000 н. 0000395599 00000 н. 0000395709 00000 н. 0000395782 00000 н. 0000395844 00000 н. 0000395998 00000 н. 0000396113 00000 п. 0000396191 00000 н. 0000396266 00000 н. 0000396404 00000 н. 0000396480 00000 н. 0000396580 00000 н. 0000396617 00000 н. 0000396715 00000 н. 0000396765 00000 н. 0000396816 00000 н. 0000396919 00000 н. 0000396966 00000 н. 0000397068 00000 н. 0000397105 00000 н. 0000397203 00000 н. 0000397245 00000 н. 0000397334 00000 н. 0000397390 00000 н. 0000397521 00000 н. 0000397571 00000 н. 0000397620 00000 н. 0000397761 00000 н. 0000397887 00000 н. 0000397986 00000 п. 0000398135 00000 н. 0000398287 00000 н. 0000398337 00000 н. 0000398395 00000 н. 0000398522 00000 н. 0000398626 00000 н. 0000398769 00000 н. 0000398819 00000 н. 0000398873 00000 н. 0000398965 00000 н. 0000399100 00000 н. 0000399263 00000 н. 0000399313 00000 н. 0000399367 00000 н. 0000399512 00000 н. 0000399661 00000 н. 0000399806 00000 н. 0000399856 00000 н. 0000399912 00000 н. 0000400007 00000 п. 0000400109 00000 п. 0000400263 00000 п. 0000400313 00000 н. 0000400367 00000 н. 0000400447 00000 н. 0000400528 00000 н. 0000400673 00000 п. 0000400723 00000 п. 0000400779 00000 п. 0000400865 00000 н. 0000400996 00000 н. 0000401148 00000 н. 0000401198 00000 н. 0000401254 00000 н. 0000401339 00000 н. 0000401471 00000 н. 0000401623 00000 н. 0000401673 00000 н. 0000401729 00000 н. 0000401849 00000 н. 0000401998 00000 н. 0000402138 00000 п. 0000402188 00000 п. 0000402244 00000 н. 0000402348 00000 п. 0000402482 00000 н. 0000402532 00000 н. 0000402586 00000 н. 0000402731 00000 н. 0000402880 00000 н. 0000402979 00000 п. 0000403030 00000 н. 0000403084 00000 н. 0000403193 00000 н. 0000403244 00000 н. 0000403298 00000 н. 0000403404 00000 н. 0000403455 00000 н. 0000403509 00000 н. 0000403621 00000 н. 0000403671 00000 н. 0000403726 00000 н. 0000403776 00000 н. 0000403830 00000 н. 0000403936 00000 н. 0000404070 00000 н. 0000404225 00000 н. 0000404277 00000 н. 0000404332 00000 н. 0000404428 00000 н. 0000404522 00000 н. 0000404679 00000 н. 0000404731 00000 н. 0000404785 00000 н. 0000404874 00000 н. 0000404981 00000 н. 0000405161 00000 п. 0000405213 00000 н. 0000405268 00000 н. 0000405383 00000 п. 0000405485 00000 н. 0000405632 00000 н. 0000405684 00000 н. 0000405739 00000 н. 0000405825 00000 н. 0000405935 00000 н. 0000406087 00000 н. 0000406139 00000 н. 0000406194 00000 н. 0000406292 00000 н. 0000406383 00000 п. 0000406536 00000 н. 0000406588 00000 н. 0000406642 00000 н. 0000406756 00000 н. 0000406862 00000 н. 0000407012 00000 н. 0000407064 00000 н. 0000407118 00000 н. 0000407229 00000 н. 0000407357 00000 н. 0000407512 00000 н. 0000407564 00000 н. 0000407618 00000 н. 0000407715 00000 н. 0000407803 00000 н. 0000407952 00000 н. 0000408004 00000 н. 0000408058 00000 н. 0000408157 00000 н. 0000408264 00000 н. 0000408425 00000 н. 0000408477 00000 н. 0000408531 00000 н. 0000408639 00000 н. 0000408749 00000 н. 0000408893 00000 н. 0000408945 00000 н. 0000408999 00000 н. 0000409101 00000 п. 0000409203 00000 н. 0000409344 00000 п. 0000409396 00000 н. 0000409450 00000 н. 0000409540 00000 н. 0000409628 00000 н. 0000409779 00000 н. 0000409831 00000 н. 0000409885 00000 н. 0000409980 00000 н. 0000410071 00000 н. 0000410220 00000 н. 0000410272 00000 н. 0000410326 00000 н. 0000410433 00000 п. 0000410537 00000 п. 0000410682 00000 п. 0000410734 00000 п. 0000410788 00000 н. 0000410894 00000 п. 0000410983 00000 п. 0000411136 00000 н. 0000411187 00000 н. 0000411241 00000 н. 0000411347 00000 п. 0000411454 00000 п. 0000411604 00000 н. 0000411655 00000 н. 0000411709 00000 н. 0000411815 00000 н. 0000411910 00000 н. 0000412060 00000 н. 0000412111 00000 п. 0000412165 00000 н. 0000412272 00000 н. 0000412367 00000 н. 0000412514 00000 н. 0000412565 00000 н. 0000412619 00000 н. 0000412725 00000 н. 0000412820 00000 н. 0000412989 00000 н. 0000413040 00000 н. 0000413094 00000 н. 0000413203 00000 н. 0000413316 00000 н. 0000413468 00000 н. 0000413519 00000 п. 0000413574 00000 н. 0000413674 00000 н. 0000413779 00000 н. 0000413940 00000 н. 0000413991 00000 п. 0000414045 00000 н. 0000414169 00000 н. 0000414269 00000 н. 0000414432 00000 н. 0000414483 00000 н. 0000414537 00000 н. 0000414632 00000 н. 0000414728 00000 н. 0000414876 00000 н. 0000414927 00000 н. 0000414981 00000 п. 0000415064 00000 н. 0000415155 00000 н. 0000415206 00000 н. 0000415261 00000 н. 0000415312 00000 н. 0000415366 00000 н. 0000415417 00000 н. 0000415471 00000 н. 0000415522 00000 н. 0000415576 00000 н. 0000415627 00000 н. 0000415681 00000 н. 0000415732 00000 н. 0000415786 00000 н. 0000415837 00000 н. 0000415891 00000 н. 0000415942 00000 н. 0000415996 00000 н. 0000416047 00000 н. 0000416101 00000 п. 0000416152 00000 н. 0000416207 00000 н. 0000416258 00000 н. 0000416312 00000 н. 0000416363 00000 п. 0000416417 00000 н. 0000416468 00000 н. 0000416522 00000 н. 0000416573 00000 н. 0000416627 00000 н. 0000416678 00000 н. 0000416732 00000 н. 0000416783 00000 н. 0000416838 00000 н. 0000416889 00000 н. 0000416943 00000 н. 0000416994 00000 н. 0000417048 00000 н. 0000417099 00000 н. 0000417154 00000 н. 0000417205 00000 н. 0000417259 00000 н. 0000417310 00000 н. 0000417364 00000 н. 0000417416 00000 н. 0000417471 00000 п. 0000417523 00000 п. 0000417577 00000 н. 0000417629 00000 н. 0000417683 00000 н. 0000417735 00000 н. 0000417789 00000 н. 0000417841 00000 н. 0000417896 00000 н. 0000417948 00000 н. 0000418002 00000 н. 0000418054 00000 н. 0000418108 00000 п. 0000418160 00000 н. 0000418214 00000 н. 0000418266 00000 н. 0000418320 00000 н. 0000418372 00000 п. 0000418426 00000 п. 0000418478 00000 н. 0000418532 00000 н. 0000418584 00000 н. 0000418639 00000 п. 0000418691 00000 п. 0000418745 00000 н. 0000418797 00000 н. 0000418852 00000 н. 0000418904 00000 н. 0000418960 00000 н. 0000419012 00000 н. 0000419066 00000 н. 0000419118 00000 п. 0000419172 00000 н. 0000419224 00000 н. 0000419278 00000 н. 0000419330 00000 н. 0000419384 00000 п. 0000419436 00000 н. 0000419491 00000 п. 0000419543 00000 н. 0000419597 00000 п. 0000419649 00000 н. 0000419703 00000 п. 0000419755 00000 н. 0000419810 00000 п. 0000419862 00000 н. 0000419916 00000 н. 0000419968 00000 н. 0000420022 00000 н. 0000420074 00000 н. 0000420128 00000 н. 0000420180 00000 н. 0000420234 00000 н. 0000420286 00000 н. 0000420340 00000 н. 0000420392 00000 н. 0000420447 00000 н. 0000420499 00000 н. 0000420553 00000 н. 0000420666 00000 н. 0000420774 00000 н. 0000420825 00000 н. 0000420880 00000 н. 0000420931 00000 н. 0000420985 00000 н. 0000421036 00000 н. 0000421090 00000 н. 0000421140 00000 н. 0000421194 00000 н. 0000421297 00000 н. 0000421406 00000 п. 0000421569 00000 н. 0000421620 00000 н. 0000421675 00000 н. 0000421803 00000 н. 0000421931 00000 н. 0000422089 00000 н. 0000422140 00000 н. 0000422195 00000 н. 0000422295 00000 н. 0000422413 00000 н. 0000422513 00000 н. 0000422564 00000 н. 0000422622 00000 н. 0000422731 00000 н. 0000422782 00000 н. 0000422837 00000 п. 0000422937 00000 п. 0000422988 00000 н. 0000423043 00000 н. 0000423165 00000 п. 0000423216 00000 н. 0000423272 00000 н. 0000423387 00000 н. 0000423438 00000 п. 0000423493 00000 н. 0000423636 00000 н. 0000423686 00000 н. 0000423742 00000 п. 0000423792 00000 н. 0000423849 00000 н. 0000423966 00000 н. 0000424017 00000 н. 0000424072 00000 н. 0000424123 00000 п. 0000424178 00000 н. 0000424229 00000 н. 0000424284 00000 н. 0000424379 00000 н. 0000424430 00000 н. 0000424485 00000 н. 0000424593 00000 п. 0000424644 00000 н. 0000424700 00000 н. 0000424751 00000 н. 0000424806 00000 н. 0000424857 00000 н. 0000424912 00000 н. 0000425038 00000 н. 0000425089 00000 н. 0000425145 00000 н. 0000425196 00000 н. 0000425252 00000 н. 0000425303 00000 н. 0000425358 00000 н. 0000425408 00000 п. 0000425463 00000 н. 0000425574 00000 н. 0000425674 00000 н. 0000425773 00000 н. 0000425823 00000 п. 0000425880 00000 н. 0000425989 00000 н. 0000426039 00000 н. 0000426096 00000 н. 0000426214 00000 н. 0000426264 00000 н. 0000426321 00000 н. 0000426371 00000 н. 0000426427 00000 н. 0000426542 00000 н. 0000426593 00000 н. 0000426649 00000 н. 0000426773 00000 н. 0000426824 00000 н. 0000426880 00000 н. 0000427006 00000 н. 0000427057 00000 н. 0000427114 00000 н. 0000427237 00000 н. 0000427288 00000 н. 0000427344 00000 н. 0000427458 00000 н. 0000427509 00000 н. 0000427567 00000 н. 0000427687 00000 н. 0000427738 00000 н. 0000427794 00000 п. 0000427938 00000 н. 0000427989 00000 н. 0000428046 00000 н. 0000428163 00000 п. 0000428214 00000 н. 0000428272 00000 н. 0000428401 00000 п. 0000428452 00000 н. 0000428508 00000 н. 0000428638 00000 п. 0000428689 00000 н. 0000428746 00000 н. 0000428862 00000 н. 0000428913 00000 н. 0000428969 00000 н. 0000429090 00000 н. 0000429141 00000 п. 0000429197 00000 н. 0000429315 00000 н. 0000429366 00000 п. 0000429423 00000 н. 0000429541 00000 н. 0000429592 00000 н. 0000429648 00000 н. 0000429772 00000 н. 0000429823 00000 н. 0000429879 00000 н. 0000430013 00000 н. 0000430064 00000 н. 0000430121 00000 п. 0000430235 00000 п. 0000430286 00000 п. 0000430343 00000 п. 0000430466 00000 н. 0000430517 00000 н. 0000430573 00000 п. 0000430624 00000 н. 0000430683 00000 п. 0000430733 00000 н. 0000430789 00000 н. 0000430839 00000 п. 0000430895 00000 н. 0000431015 00000 н. 0000431123 00000 н. 0000431222 00000 н. 0000431272 00000 н. 0000431331 00000 н. 0000431440 00000 н. 0000431490 00000 н. 0000431546 00000 н. 0000431644 00000 н. 0000431694 00000 н. 0000431751 00000 н. 0000431871 00000 н. 0000431921 00000 н. 0000431977 00000 н. 0000432089 00000 н. 0000432139 00000 н. 0000432196 00000 н. 0000432246 00000 н. 0000432304 00000 н. 0000432439 00000 н. 0000432490 00000 н. 0000432546 00000 н. 0000432648 00000 н. 0000432699 00000 н. 0000432756 00000 н. 0000432860 00000 н. 0000432911 00000 н. 0000432967 00000 н. 0000433115 00000 п. 0000433166 00000 п. 0000433224 00000 н. 0000433333 00000 п. 0000433384 00000 п. 0000433440 00000 н. 0000433543 00000 н. 0000433594 00000 н. 0000433650 00000 н. 0000433770 00000 н. 0000433821 00000 н. 0000433878 00000 н. 0000433982 00000 п. 0000434033 00000 н. 0000434089 00000 н. 0000434140 00000 п. 0000434196 00000 п. 0000434246 00000 п. 0000434302 00000 п. 0000434352 00000 п. 0000434409 00000 п. 0000434504 00000 н. 0000434556 00000 п. 0000434612 00000 н. 0000434707 00000 п. 0000434759 00000 п. 0000434815 00000 н. 0000434911 00000 п. 0000434963 00000 н. 0000435019 00000 н. 0000435114 00000 п. 0000435165 00000 п. 0000435221 00000 н. 0000435316 00000 н. 0000435367 00000 н. 0000435423 00000 п. 0000435518 00000 н. 0000435569 00000 н. 0000435625 00000 н. 0000435720 00000 н. 0000435771 00000 п. 0000435827 00000 н. 0000435923 00000 п. 0000435974 00000 п. 0000436030 00000 н. 0000436126 00000 п. 0000436177 00000 н. 0000436233 00000 п. 0000436328 00000 н. 0000436379 00000 н. 0000436435 00000 н. 0000436530 00000 н. 0000436581 00000 н. 0000436637 00000 н. 0000436732 00000 н. 0000436783 00000 н. 0000436839 00000 н. 0000436934 00000 п. 0000436985 00000 п. 0000437041 00000 н. 0000437137 00000 п. 0000437188 00000 п. 0000437245 00000 н. 0000437340 00000 н. 0000437391 00000 п. 0000437447 00000 н. 0000437542 00000 н. 0000437593 00000 п. 0000437649 00000 н. 0000437744 00000 н. 0000437795 00000 н. 0000437851 00000 п. 0000437945 00000 н. 0000437996 00000 н. 0000438052 00000 н. 0000438147 00000 н. 0000438198 00000 п. 0000438254 00000 н. 0000438348 00000 п. 0000438399 00000 н. 0000438456 00000 п. 0000438550 00000 н. 0000438601 00000 п. 0000438657 00000 п. 0000438752 00000 п. 0000438803 00000 п. 0000438859 00000 п. 0000438953 00000 п. 0000439004 00000 н. 0000439060 00000 н. 0000439154 00000 п. 0000439205 00000 н. 0000439261 00000 п. 0000439312 00000 н. 0000439369 00000 н. 0000439420 00000 н. 0000439476 00000 н. 0000439595 00000 н. 0000439646 00000 н. 0000439700 00000 н. 0000439810 00000 н. 0000439861 00000 н. 0000439915 00000 н. 0000440028 00000 н. 0000440079 00000 н. 0000440133 00000 п. 0000440246 00000 н. 0000440297 00000 н. 0000440351 00000 п. 0000440466 00000 н. 0000440517 00000 н. 0000440571 00000 п. 0000440689 00000 н. 0000440740 00000 п. 0000440794 00000 п. 0000440905 00000 н. 0000440956 00000 н. 0000441010 00000 н. 0000441134 00000 н. 0000441185 00000 н. 0000441239 00000 н. 0000441345 00000 н. 0000441396 00000 н. 0000441450 00000 н. 0000441552 00000 н. 0000441603 00000 н. 0000441657 00000 н. 0000441770 00000 н. 0000441821 00000 н. 0000441875 00000 н. 0000441986 00000 н. 0000442037 00000 н. 0000442091 00000 н. 0000442196 00000 н. 0000442247 00000 н. 0000442301 00000 н. 0000442417 00000 н. 0000442468 00000 н. 0000442522 00000 н. 0000442653 00000 н. 0000442704 00000 н. 0000442758 00000 н. 0000442873 00000 н. 0000442924 00000 н. 0000442978 00000 н. 0000443100 00000 н. 0000443151 00000 п. 0000443205 00000 н. 0000443331 00000 н. 0000443381 00000 н. 0000443437 00000 н. 0000443487 00000 н. 0000443541 00000 н. 0000443591 00000 н. 0000443645 00000 н. 0000443740 00000 н. 0000443845 00000 н. 0000443997 00000 н. 0000444049 00000 н. 0000444105 00000 н. 0000444201 00000 н. 0000444325 00000 н. 0000444481 00000 н. 0000444533 00000 н. 0000444589 00000 н. 0000444674 00000 н. 0000444761 00000 н. 0000444941 00000 н. 0000444993 00000 н. 0000445049 00000 н. 0000445146 00000 п. 0000445231 00000 п. 0000445379 00000 н. 0000445431 00000 н. 0000445487 00000 н. 0000445572 00000 н. 0000445686 00000 п. 0000445838 00000 п. 0000445890 00000 н. 0000445947 00000 н. 0000446037 00000 н. 0000446126 00000 н. 0000446277 00000 н. 0000446329 00000 н. 0000446385 00000 н. 0000446485 00000 н. 0000446576 00000 н. 0000446728 00000 н. 0000446780 00000 н. 0000446837 00000 н. 0000446946 00000 н. 0000447038 00000 н. 0000447193 00000 н. 0000447245 00000 н. 0000447301 00000 н. 0000447417 00000 н. 0000447522 00000 н. 0000447672 00000 н. 0000447724 00000 н. 0000447781 00000 н. 0000447886 00000 н. 0000448016 00000 н. 0000448178 00000 н. 0000448230 00000 н. 0000448286 00000 н. 0000448369 00000 н. 0000448467 00000 н. 0000448613 00000 н. 0000448665 00000 н. 0000448721 00000 н. 0000448817 00000 н. 0000448916 00000 н. 0000449056 00000 н. 0000449108 00000 н. 0000449164 00000 н. 0000449253 00000 н. 0000449347 00000 н. 0000449498 00000 н. 0000449550 00000 н. 0000449606 00000 н. 0000449688 00000 н. 0000449779 00000 н. 0000449928 00000 н. 0000449980 00000 н. 0000450036 00000 н. 0000450137 00000 н. 0000450228 00000 п. 0000450371 00000 н. 0000450423 00000 п. 0000450480 00000 н. 0000450573 00000 н. 0000450676 00000 н. 0000450829 00000 н. 0000450881 00000 н. 0000450938 00000 п. 0000451038 00000 п. 0000451145 00000 н. 0000451295 00000 н. 0000451346 00000 н. 0000451403 00000 н. 0000451497 00000 н. 0000451604 00000 н. 0000451753 00000 н. 0000451804 00000 н. 0000451860 00000 н. 0000451958 00000 н. 0000452073 00000 н. 0000452219 00000 п. 0000452270 00000 н. 0000452326 00000 н. 0000452432 00000 н. 0000452554 00000 н. 0000452724 00000 н. 0000452775 00000 н. 0000452831 00000 н. 0000452947 00000 н. 0000453038 00000 н. 0000453190 00000 п. 0000453241 00000 н. 0000453297 00000 н. 0000453399 00000 н. 0000453498 00000 п. 0000453658 00000 н. 0000453709 00000 н. 0000453765 00000 н. 0000453865 00000 н. 0000453979 00000 п. 0000454142 00000 п. 0000454193 00000 п. 0000454249 00000 н. 0000454346 00000 п. 0000454445 00000 н. 0000454593 00000 п. 0000454644 00000 н. 0000454701 00000 н. 0000454799 00000 н. 0000454892 00000 н. 0000454943 00000 н. 0000454999 00000 н. 0000455119 00000 п. 0000455170 00000 н. 0000455226 00000 п. 0000455361 00000 п. 0000455412 00000 н. 0000455468 00000 н. 0000455519 00000 п. 0000455575 00000 п. 0000455626 00000 н. 0000455682 00000 н. 0000455790 00000 н. 0000455841 00000 н. 0000455898 00000 н. 0000456005 00000 н. 0000456056 00000 н. 0000456113 00000 п. 0000456164 00000 н. 0000456220 00000 н. 0000456271 00000 н. 0000456327 00000 н. 0000456434 00000 н. 0000456485 00000 н. 0000456541 00000 н. 0000456671 00000 н. 0000456722 00000 н. 0000456778 00000 н. 0000456829 00000 н. 0000456885 00000 н. 0000456936 00000 н. 0000456993 00000 н. 0000457110 00000 н. 0000457161 00000 п. 0000457217 00000 н. 0000457268 00000 н. 0000457324 00000 н. 0000457375 00000 п. 0000457433 00000 н. 0000457554 00000 н. 0000457605 00000 н. 0000457661 00000 н. 0000457712 00000 н. 0000457768 00000 н. 0000457819 00000 п. 0000457875 00000 п. 0000457995 00000 н. 0000458046 00000 н. 0000458102 00000 н. 0000458153 00000 п. 0000458209 00000 н. 0000458260 00000 н. 0000458318 00000 н. 0000458446 00000 н. 0000458497 00000 н. 0000458554 00000 н. 0000458684 00000 н. 0000458735 00000 н. 0000458792 00000 н. 0000458843 00000 н. 0000458900 00000 н. 0000458951 00000 п. 0000459008 00000 п. 0000459113 00000 п. 0000459164 00000 п. 0000459220 00000 н. 0000459331 00000 п. 0000459382 00000 п. 0000459438 00000 п. 0000459544 00000 н. 0000459595 00000 п. 0000459652 00000 п. 0000459703 00000 н. 0000459759 00000 н. 0000459810 00000 п. 0000459866 00000 н. 0000459989 00000 н. 0000460041 00000 н. 0000460097 00000 н. 0000460148 00000 п. 0000460205 00000 н. 0000460256 00000 н. 0000460312 00000 н. 0000460435 00000 п. 0000460487 00000 н. 0000460543 00000 н. 0000460652 00000 п. 0000460704 00000 н. 0000460761 00000 п. 0000460871 00000 п. 0000460923 00000 п. 0000460979 00000 н. 0000461031 00000 н. 0000461087 00000 н. 0000461139 00000 н. 0000461195 00000 н. 0000461304 00000 н. 0000461356 00000 н. 0000461412 00000 н. 0000461530 00000 н. 0000461582 00000 н. 0000461639 00000 н. 0000461691 00000 н. 0000461747 00000 н. 0000461799 00000 н. 0000461856 00000 н. 0000461965 00000 н. 0000462017 00000 н. 0000462073 00000 н. 0000462188 00000 п. 0000462240 00000 н. 0000462296 00000 н. 0000462348 00000 п. 0000462405 00000 н. 0000462457 00000 н. 0000462513 00000 н. 0000462621 00000 н. 0000462673 00000 п. 0000462729 00000 н. 0000462868 00000 н. 0000462920 00000 н. 0000462978 00000 н. 0000463030 00000 н. 0000463087 00000 н. 0000463139 00000 п. 0000463195 00000 п. 0000463322 00000 н. 0000463374 00000 н. 0000463430 00000 н. 0000463543 00000 н. 0000463595 00000 п. 0000463652 00000 п. 0000463704 00000 н. 0000463760 00000 н. 0000463812 00000 н. 0000463868 00000 н. 0000463988 00000 н. 0000464040 00000 н. 0000464096 00000 н. 0000464211 00000 н. 0000464263 00000 п. 0000464319 00000 п. 0000464451 00000 п. 0000464503 00000 н. 0000464559 00000 н. 0000464611 00000 н. 0000464667 00000 н. 0000464719 00000 н. 0000464775 00000 н. 0000464885 00000 н. 0000464937 00000 н. 0000464993 00000 п. 0000465118 00000 н. 0000465170 00000 н. 0000465227 00000 н. 0000465279 00000 н. 0000465335 00000 п. 0000465387 00000 н. 0000465443 00000 п. 0000465572 00000 н. 0000465624 00000 н. 0000465680 00000 н. 0000465732 00000 н. 0000465789 00000 н. 0000465841 00000 н. 0000465897 00000 н. 0000466000 00000 н. 0000466052 00000 н. 0000466108 00000 н. 0000466227 00000 н. 0000466279 00000 н. 0000466335 00000 п. 0000466387 00000 н. 0000466443 00000 н. 0000466495 00000 н. 0000466551 00000 н. 0000466669 00000 н. 0000466721 00000 н. 0000466777 00000 н. 0000466829 00000 н. 0000466885 00000 н. 0000466937 00000 н. 0000466993 00000 п. 0000467102 00000 п. 0000467154 00000 н. 0000467210 00000 н. 0000467262 00000 н. 0000467318 00000 н. 0000467370 00000 н. 0000467426 00000 н. 0000467524 00000 н. 0000467576 00000 н. 0000467633 00000 н. 0000467743 00000 н. 0000467795 00000 н. 0000467853 00000 п. 0000467980 00000 н. 0000468032 00000 н. 0000468088 00000 н. 0000468140 00000 н. 0000468196 00000 п. 0000468248 00000 н. 0000468304 00000 н. 0000468435 00000 п. 0000468487 00000 н. 0000468543 00000 н. 0000468654 00000 н. 0000468706 00000 п. 0000468762 00000 н. 0000468881 00000 н. 0000468933 00000 н. 0000468989 00000 н. 0000469041 00000 н. 0000469097 00000 н. 0000469149 00000 п. 0000469206 00000 н. 0000469310 00000 п. 0000469362 00000 п. 0000469418 00000 п. 0000469515 00000 н. 0000469567 00000 н. 0000469623 00000 н. 0000469727 00000 н. 0000469779 00000 п. 0000469835 00000 н. 0000469887 00000 н. 0000469943 00000 н. 0000469995 00000 н. 0000470052 00000 н. 0000470178 00000 п. 0000470230 00000 н. 0000470286 00000 п. 0000470390 00000 н. 0000470442 00000 п. 0000470498 00000 п. 0000470607 00000 н. 0000470659 00000 н. 0000470715 00000 н. 0000470767 00000 н. 0000470824 00000 н. 0000470876 00000 п. 0000470933 00000 п. 0000471037 00000 н. 0000471089 00000 н. 0000471147 00000 н. 0000471251 00000 н. 0000471303 00000 н. 0000471360 00000 н. 0000471412 00000 н. 0000471468 00000 н. 0000471520 00000 н. 0000471576 00000 н. 0000471680 00000 н. 0000471775 00000 н. 0000471825 00000 н. 0000471881 00000 н. 0000471989 00000 н. 0000472040 00000 н. 0000472096 00000 н. 0000472207 00000 н. 0000472257 00000 н. 0000472313 00000 н. 0000472363 00000 н. 0000472419 00000 н. 0000472469 00000 н. 0000472525 00000 н. 0000472633 00000 н. 0000472744 00000 н. 0000472794 00000 н. 0000472849 00000 н. 0000472963 00000 н. 0000473014 00000 н. 0000473068 00000 н. 0000473186 00000 п. 0000473237 00000 н. 0000473291 00000 н. 0000473433 00000 н. 0000473484 00000 н. 0000473538 00000 н. 0000473647 00000 н. 0000473698 00000 н. 0000473752 00000 н. 0000473865 00000 н. 0000473916 00000 н. 0000473971 00000 н. 0000474083 00000 н. 0000474134 00000 п. 0000474188 00000 н. 0000474302 00000 н. 0000474353 00000 п. 0000474407 00000 н. 0000474525 00000 н. 0000474576 00000 н. 0000474630 00000 н. 0000474742 00000 н. 0000474793 00000 н. 0000474848 00000 н. 0000474972 00000 н. 0000475023 00000 н. 0000475077 00000 н. 0000475184 00000 н. 0000475235 00000 н. 0000475289 00000 н. 0000475393 00000 п. 0000475444 00000 н. 0000475499 00000 н. 0000475613 00000 н. 0000475664 00000 н. 0000475718 00000 н. 0000475828 00000 н. 0000475879 00000 н. 0000475934 00000 п. 0000476039 00000 н. 0000476090 00000 н. 0000476145 00000 н. 0000476261 00000 н. 0000476312 00000 н. 0000476366 00000 н. 0000476481 00000 н. 0000476532 00000 н. 0000476586 00000 н. 0000476698 00000 н. 0000476749 00000 н. 0000476803 00000 н. 0000476912 00000 н. 0000476963 00000 н. 0000477017 00000 н. 0000477148 00000 п. 0000477199 00000 н. 0000477253 00000 н. 0000477368 00000 н. 0000477419 00000 п. 0000477473 00000 п. 0000477594 00000 н. 0000477645 00000 н. 0000477699 00000 н. 0000477824 00000 н. 0000477875 00000 н. 0000477929 00000 н. 0000478038 00000 н. 0000478088 00000 н. 0000478142 00000 н. 0000478192 00000 н. 0000478246 00000 н. 0000478296 00000 н. 0000478350 00000 н. 0000478400 00000 н. 0000478455 00000 н. 0000478585 00000 н. 0000478636 00000 н. 0000478690 00000 н. 0000478809 00000 н. 0000478860 00000 н. 0000478915 00000 н. 0000479047 00000 н. 0000479098 00000 н. 0000479152 00000 н. 0000479277 00000 н. 0000479328 00000 н. 0000479382 00000 н. 0000479521 00000 н. 0000479572 00000 н. 0000479626 00000 н. 0000479762 00000 н. 0000479813 00000 н. 0000479867 00000 н. 0000479988 00000 н. 0000480039 00000 н. 0000480093 00000 н. 0000480239 00000 п. 0000480290 00000 н. 0000480344 00000 п. 0000480467 00000 н. 0000480518 00000 н. 0000480572 00000 н. 0000480697 00000 н. 0000480748 00000 н. 0000480802 00000 н. 0000480922 00000 н. 0000480973 00000 п. 0000481027 00000 н. 0000481150 00000 н. 0000481201 00000 н. 0000481256 00000 н. 0000481394 00000 н. 0000481445 00000 н. 0000481499 00000 н. 0000481637 00000 н. 0000481688 00000 н. 0000481742 00000 н. 0000481867 00000 н. 0000481918 00000 н. 0000481972 00000 н. 0000482098 00000 н. 0000482149 00000 н. 0000482203 00000 н. 0000482327 00000 н. 0000482378 00000 н. 0000482432 00000 н. 0000482570 00000 н. 0000482621 00000 н. 0000482675 00000 н. 0000482796 00000 н. 0000482847 00000 н. 0000482901 00000 н. 0000483016 00000 н. 0000483066 00000 н. 0000483121 00000 н. 0000483232 00000 н. 0000483282 00000 н. 0000483336 00000 н. 0000483454 00000 н. 0000483504 00000 н. 0000483559 00000 н. 0000483685 00000 н. 0000483735 00000 н. 0000483789 00000 н. 0000483924 00000 н. 0000483974 00000 н. 0000484029 00000 н. 0000484079 00000 н. 0000484133 00000 п. 0000484183 00000 н. 0000484237 00000 н. 0000484324 00000 н. 0000484402 00000 н. 0000484554 00000 н. 0000484606 00000 н. 0000484663 00000 н. 0000484750 00000 н. 0000484828 00000 н. 0000484985 00000 н. 0000485037 00000 н. 0000485094 00000 н. 0000485180 00000 н. 0000485258 00000 н. 0000485439 00000 н. 0000485491 00000 н. 0000485548 00000 н. 0000485634 00000 н. 0000485712 00000 н. 0000485859 00000 н. 0000485911 00000 н. 0000485968 00000 н. 0000486054 00000 н. 0000486132 00000 н. 0000486285 00000 н. 0000486337 00000 н. 0000486395 00000 н. 0000486483 00000 н. 0000486561 00000 н. 0000486711 00000 н. 0000486763 00000 н. 0000486820 00000 н. 0000486906 00000 н. 0000486984 00000 н. 0000487134 00000 н. 0000487186 00000 н. 0000487244 00000 н. 0000487331 00000 н. 0000487409 00000 н. 0000487564 00000 н. 0000487616 00000 н. 0000487673 00000 н. 0000487759 00000 н. 0000487837 00000 н. 0000487986 00000 н. 0000488038 00000 н. 0000488095 00000 н. 0000488181 00000 н. 0000488259 00000 н. 0000488421 00000 н. 0000488473 00000 н. 0000488530 00000 н. 0000488616 00000 н. 0000488694 00000 н. 0000488838 00000 н. 0000488890 00000 н. 0000488948 00000 н. 0000489035 00000 н. 0000489113 00000 п. 0000489254 00000 н. 0000489306 00000 н. 0000489363 00000 н. 0000489449 00000 н. 0000489527 00000 н. 0000489679 00000 н. 0000489731 00000 н. 0000489788 00000 н. 0000489875 00000 н. 0000489953 00000 н. 00004 00000 п. 00004 00000 п. 00004
00000 п. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н. 00004 00000 н.
00004 00000 н.
00004 00000 н.
00004 00000 п.
00004 00000 н.
00004 00000 н.
00004 00000 н.
00004 00000 н.
00004
Что такое ресурс?
- основная статья
Ресурс относится к любой конкретной вещи, которая ценится людьми, потому что она способна удовлетворить определенную потребность или желание. [3] Однако энергетический сектор имеет дело с определенным типом, известным как природный ресурс. Природные ресурсы, такие как углеводороды, полезны, поскольку они могут использоваться в качестве топлива для обеспечения таких услуг, как отопление дома, электричество и транспорт. Происхождение используется для описания всех природных ресурсов, существующих на Земле — неоткрытых и открытых.
Типы углеводородных ресурсов
- см. Ископаемое топливо
Ресурсы ископаемого топлива — это просто углеводородные ресурсы, получившие другое название.Ископаемое топливо — это категория топлива, которое производится медленными геологическими процессами, воздействующими на мертвые организмы, которым сотни миллионов лет. Таким образом, ископаемое топливо не считается возобновляемым источником энергии из-за времени, необходимого для их образования. К наиболее распространенным видам углеводородных ресурсов относятся:
- Природный газ (на первом изображении ниже сжигаемый)
- Уголь (показан в виде брикетов на центральном изображении ниже)
- Нефть (с насосным домкратом, извлекающим масло, как показано на окончательном изображении ниже).
Обычное масло
- основная статья
Нефть добывается как сырая нефть и перегоняется с использованием фракционной перегонки для извлечения из нефти различных видов топлива. Сырая нефть — это основной жидкий компонент нефти, образующийся после нагревания и сжатия керогена в течение длительных периодов времени. Сама сырая нефть представляет собой сложную смесь углеводородов, поэтому точный состав нефти никогда не бывает одинаковым. Обычно сырая нефть на 85% состоит из углерода, а остальная часть состоит в основном из водорода.Однако также могут присутствовать значительные количества серы, кислорода и азота. [7]
Обычный природный газ
- основная статья
Природный газ — это бесцветный газ без запаха, который легко горит и является довольно широко используемым топливом во всем мире. В химическом отношении природный газ — это в основном метан — одна определенная молекула углеводорода. С годами природный газ приобрел популярность в качестве топлива, особенно в США, где большую часть используемого природного газа не нужно импортировать из других стран.Природный газ также может использоваться в качестве альтернативного топлива для транспортных средств, когда он сжимается в виде сжатого природного газа.
Уголь
- основная статья
Уголь — это горная порода, образовавшаяся в результате разложения растений. Он состоит в основном из углерода и многих других микроэлементов. Высокая удельная энергия угля делает его полезным в качестве топлива для выработки электроэнергии на угольных электростанциях, а в некоторых местах и для отопления. [8] Уголь может быть извлечен из различных «сортов». Истинный уголь самого низкого качества — это бурый уголь, затем полубитуминозный, битуминозный и, наконец, антрацитовый уголь высокого качества. Уголь образуется из торфа, который технически является ископаемым, однако широко не используется.
Нетрадиционные нефть и газ
- основная статья
Нетрадиционные ресурсы — это, как правило, ресурсы нефти или природного газа, которые не появляются в традиционных формациях и для получения которых необходимо использовать специальные методы добычи или добычи.Для нефти и газа обычные месторождения представляют собой пористые и проницаемые породы под землей, которые имеют крошечные связанные поровые пространства, содержащие нефть или природный газ. [9] Нетрадиционные ресурсы заблокированы в геологических структурах, добыча которых невозможна экономически или технологически без относительно недавних технологических достижений, которые могут превратить их в жизнеспособные запасы углеводородов. [7] Развитие технологий, включая гидравлический разрыв пласта, делает добычу этих ресурсов более рентабельной.
Примерами нетрадиционных месторождений являются сланцевая нефть, нефтеносные пески, сланцевый газ, плотный газ и метан угольных пластов.
Воздействие на окружающую среду
Когда углеводороды используются, они подвергаются процессу, известному как сжигание . Это означает, что углеводороды реагируют с кислородом в атмосфере с образованием диоксида углерода, водяного пара и тепла. Сжигание этих углеводородов оказывает серьезное воздействие на окружающую среду, поскольку при сжигании выделяется значительное количество парниковых газов.Помимо этих парниковых газов (которые являются основной причиной изменения климата), при сжигании нефти, угля и природного газа выделяются такие загрязнители, как NOx, SOx, твердые частицы, летучие органические соединения, окись углерода и ртуть. [7]
Добыча некоторых из этих ресурсов также может привести к изменениям окружающей среды. Добыча угля, особенно вскрышная добыча, может привести к уничтожению мест обитания диких животных и лесов, чтобы освободить место для мест добычи. Такое удаление фауны может привести к эрозии и загрязнению водных путей наносами. [10] Более того, гидравлический разрыв пласта, необходимый для получения некоторого количества нетрадиционного природного газа, вызывает сомнения из-за загрязнения в результате использования жидкости для гидроразрыва. [11]
Будущее углеводородных ресурсов
В настоящее время количество углеводородных ресурсов, существующих в земле, сокращается (особенно легкой нефти), но спрос на них растет. Это сбивает с толку, потому что запасы углеводородов увеличиваются из-за совершенствования технологий и более низкой цены, что позволяет нам достигать ранее «недостижимых» ресурсов (см. «Запасы против наличия»).Несмотря на увеличивающиеся запасы (и сокращение добычи), спрос и продолжающаяся добыча привели геофизика по имени Хабберт к предсказанию, что добыча нефти достигнет пика в 1970-х годах, а затем снизится. Этот прогноз относительно снижения добычи нефти известен как пик Хабберта. [8]
По мере увеличения потребления ресурсов изучаются альтернативные источники энергии для удовлетворения возникающих энергетических и экологических требований. [2] Некоторые из этих потенциальных альтернатив включают ядерную, солнечную, геотермальную и ветровую.
Для дальнейшего чтения
Ссылки
- ↑ R.D. Botts, D.M. Карсон и Д. Коглон. (3 июня 2015 г.). «Нефть в нашей жизни» в нашей нефтяной проблеме, 8-е изд. Калгари: Канадский центр развития энергетики, 2013 г., стр. 7-15.
- ↑ 2,0 2,1 Gordon Research Conferences. (3 июня 2015 г.). Углеводородные ресурсы [Онлайн]. Доступно: https://www.grc.org/programs.aspx?id=8188
- ↑ С. Мэйхью, Географический словарь.Оксфорд: Издательство Оксфордского университета, 2015.
- ↑ Тод Бейкер. (3 июня 2015 г.). Природный газ [Онлайн]. Доступно: https://www.flickr.com/photos/todbaker/92
- ↑ Pixabay. (3 июня 2015 г.). Уголь, брикеты [Онлайн]. Доступно: http://pixabay.com/en/coal-briquette-black-471903/
- ↑ Pixabay. (2 июня 2015 г.). Oil [Онлайн]. Доступно: http://pixabay.com/en/oil-monahans-texas-sunset-106913/
- ↑ 7,0 7.1 7,2 Ричард Вольфсон. (4 июня 2015 г.). Энергия, окружающая среда и климат , 2-е изд. Нью-Йорк, Нью-Йорк, США: 2012.
- ↑ 8,0 8,1 Дж. Бойл, Б. Эверетт, С. Пик, Дж. Рэмидж. (4 июня 2015 г.). Энергетические системы и устойчивость: сила для устойчивого будущего , 2-е изд. Оксфорд, Великобритания: Издательство Оксфордского университета, 2012 г.
- ↑ Регулятор энергетики Альберты. (3 июня 2015 г.). Что такое нетрадиционные нефть и газ? [Интернет]. Доступно: https: // www.aer.ca/about-aer/spotlight-on/unconventional-regulatory-framework/what-is-unconventional-oil-and-gas
- ↑ Агентство по охране окружающей среды США. (4 июня 2015 г.). Уголь [Онлайн]. Доступно: http://www.epa.gov/cleanenergy/energy-and-you/affect/coal.html
- ↑ Geology.com. (4 июня 2015 г.). Что такое сланцевый газ? [Интернет]. Доступно: http://geology.com/energy/shale-gas/
границ | Взаимодействие насыщенных и ненасыщенных углеводородов с углеродными наноструктурами
Введение
Углеродные наноматериалы, такие как графен и углеродные нанотрубки (УНТ), были признаны перспективными материалами для биомедицинских приложений благодаря своим уникальным физическим и химическим свойствам (Niyogi et al., 2002; Рао и др., 2009; Де Волдер и др., 2013). Они также рассматривались как потенциальные кандидаты при разработке современных функциональных материалов для датчиков, устройств накопления энергии, топливных элементов и электроники (Kumar et al., 2011). Благодаря своим исключительным свойствам и наноразмерным размерам, эти наноматериалы предоставляют прекрасные возможности для имитации отдельных ячеек с целью создания чипов, столь же эффективных, как и ячейки (Andersson and Van Den Berg, 2004). Высокая чувствительность углеродных наноструктур (УНС) к легированию и изменениям в химической среде делает их подходящими для сенсоров (Kong et al., 2000; Barone et al., 2005).
Нековалентные взаимодействия ЦНС получили широкое признание, поскольку они необходимы для понимания различных применений ЦНС в биологии и материаловедении (Chen et al., 2003; Zhao and Stoddart, 2009; Mahadevi and Sastry, 2013). Нековалентные взаимодействия ЦНС, таких как катион − π, π — π и CH ··· π, с различными ионами металлов, биомолекулами и небольшими молекулами были проанализированы в нескольких теоретических исследованиях (Umadevi and Sastry, 2011a, b, 2012 , 2013, 2014).Нековалентные взаимодействия являются повсеместными и центральными в нескольких областях, представляющих современный научный интерес. Влияние таких факторов, как размер, сольватация и кривизна систем на их нековалентные взаимодействия, широко изучалось (Priyakumar et al., 2004; Rao et al., 2008; Vijay and Sastry, 2008; Premkumar et al., 2012). . Недавние обзоры подчеркнули важность нековалентных взаимодействий в различных областях (Wheeler, 2012; Mahadevi and Sastry, 2013). Π — π-стэкинг-взаимодействия ЦНС с ароматическими молекулами являются центральными в объяснении биологического применения ЦНС.В дополнение к π — π-взаимодействиям, которые были широко изучены (Mahadevi et al., 2010; Chourasia et al., 2011), в последнее время интерес вызывают также XH ··· π-взаимодействия ЦНС. Kar et al. изучили величину и природу взаимодействий между УНТ и ароматическими системами (Kar et al., 2008). Шрайнер и его коллеги показали в своих исследованиях, что взаимодействия σ / σ и π / π одинаково важны, и, таким образом, настаивали на возможности существования многослойных графанов (Fokin et al., 2011). Важность нековалентных взаимодействий для понимания различных применений ЦНС подробно обсуждалась в недавних отчетах (Umadevi et al., 2014).
Физические и химические свойства ЦНС в решающей степени зависят от их размерности. Графен состоит из плоского расположения атомов углерода, упакованных в двумерную гексагональную решетку. Расширенная π-сетка в 2D-графене является основным строительным блоком для CNS различных размеров, например 3D-графита, который формируется из уложенных друг на друга слоев графена, 1D CNT, который в основном представляет собой свернутый лист графена, и формируется фуллерен 0D. обернув лист графена.Мы показали серией исследований, что планарный графен демонстрирует более сильное сродство связывания, чем изогнутые УНТ, к нековалентным взаимодействиям (Umadevi and Sastry, 2011b, 2013, 2014). Кроме того, сравнение и сопоставление аффинности связывания УНТ разной хиральности и кривизны представляет самостоятельный интерес. Субраманиан и его коллеги внесли плодотворный вклад в понимание влияния кривизны и хиральности ЦНС на связывание с различными биомолекулами (Balamurugan et al., 2011; Ravinder et al., 2012; Баламуруган, Субраманиан, 2013). Наша группа также показала, что зигзагообразные УНТ проявляют более сильную склонность к связыванию с различными ароматическими молекулами и биомолекулами, чем «кресельные» УНТ (Umadevi and Sastry, 2013).
Несмотря на то, что ЦНС продемонстрировали потенциал для широкого диапазона применений, их химическая инертность и нерастворимость являются основными ограничениями для их успешного применения. Ковалентная и нековалентная функционализация ЦНС служит полезным инструментом для преодоления этих ограничений и обеспечения гораздо более легкого манипулирования ЦНС.Ким и его сотрудники всесторонне рассмотрели ковалентную и нековалентную функционализацию графена в недавней литературе (Georgakilas et al., 2012). Нековалентная функционализация оказалась наиболее эффективным способом функционализации ЦНС без нарушения их сотовой углеродной сети. Ли и др. показали возможность использования нековалентной функционализации щелочных металлов для отделения полупроводниковых УНТ от металлических УНТ (Li et al., 2013). Недавнее исследование описывает силу и важность нековалентно функционализированного графена полимерными адсорбатами (Mann and Dichtel, 2013).Таким образом, нековалентное взаимодействие ЦНС является одной из очень активно исследуемых концепций в современной нанохимии, поскольку считается, что она открывает путь к различным инновационным приложениям.
Адсорбция и разделение различных газовых смесей играет важную роль в различных областях. CNS также использовались в адсорбции и разделении смесей олефин / парафин, что является одним из ключевых процессов в химической и нефтехимической промышленности (Cruz and Mota, 2009; Albesa et al., 2011). Jiang et al. изучили адсорбцию и разделение линейных и разветвленных алканов на пучках УНТ (Jiang et al., 2005). Очевидно, что необходимо лучше понимать разницу в прочности связывания этих насыщенных и ненасыщенных углеводородов (Premkumar et al., 2014). Кроме того, изучение взаимодействий алканов и алкенов с ЦНС было призвано пролить свет на π — π и CH ··· π взаимодействия, которые имеют фундаментальное значение в современной литературе по нанонауке. Настоящее исследование направлено на всесторонний и сравнительный анализ взаимодействия различных насыщенных и ненасыщенных углеводородов с ЦНС.Были рассмотрены различные возможные ориентации и их сила связывания. Мы также изучили влияние кривизны и хиральности углеродных материалов на прочность связи. По возможности сравнивались с экспериментальными данными. Природа линейных критических точек (LCP) между углеводородами и CNS в насыщенных и ненасыщенных углеводородах была охарактеризована с помощью теории атомов в молекулах Бадера (Bader, 1990; Cortés-Guzmán and Bader, 2005).
Вычислительные методы
Оптимизация геометрии всех рассмотренных структур модели была выполнена с использованием двухуровневого подхода ONIOM, реализованного в Gaussian 09 (Frisch et al., 2009). Рассматриваемые молекулы углеводородов и семикольцевый фрагмент в ЦНС, напоминающий коронен (24 атома), рассматривались как верхний слой, а остальная часть системы рассматривалась как нижний слой, как показано на рисунке 1. Оборванные связи в усеченные концы CNS были пассивированы атомами водорода для предотвращения ложных концевых эффектов.
Рис. 1. Атомы, показанные в шаровой модели, были учтены для верхнего слоя, а остальные атомы, показанные в модели трубки, были учтены для нижнего слоя в расчете ONIOM .
Полученные стационарные точки были охарактеризованы как минимумы путем проверки наличия всех реальных частот. Все оптимизации геометрии ОНИОМ были выполнены на уровне теории (M06–2X / 6–31G *: AM1). В то время как многие популярные функционалы теории функционала плотности (DFT) не подходят для моделирования нековалентных взаимодействий, параметризованные de novo функционалы M06-2X Чжао и Трулара оказались подходящими (Zhao and Truhlar, 2008).
Модели ONIOM (QM: QM) эффективно использовались для изучения различных нековалентных взаимодействий ЦНС в более ранних исследованиях (Umadevi and Sastry, 2011b, 2012, 2013, 2014). Однако, чтобы обеспечить надежность подхода ONIOM для точного описания энергий, была проведена полная оптимизация геометрии CNT (4,4) на уровне M06-2X / 6-31G *, и полученные результаты сравнивались с ONIOM. полученные результаты. Из таблицы 1 видно, что результаты, полученные в рамках подхода ONIOM, хорошо согласуются с результатами полной оптимизации.Энергия связи (BE) была рассчитана с помощью подхода супермолекул, где BE — это разница между суммой полных энергий исходной CNS (E CNS ) и углеводорода (E X ) и полной энергией комплекса (E CNS_X ), как показано в уравнении 1.
BE = (ECNS + EX) −ECNS_X (1)Таблица 1. БЭ (ккал / моль) углеводородов с УНТ (4,4), полученная с использованием подхода ONIOM и полной оптимизации .
Полученные таким образом значения энергии были точно настроены путем одноточечных вычислений на уровне M06-2X / 6-311G **.Электронная плотность на LCP во всех структурах была нанесена на карту с помощью программы AIM2000 (Biegler-König, 2000, 2001; Biegler-König and Schönbohm, 2002).
Модель системы, рассмотренная в исследовании
Мы приняли кластерные модели для расчетов из первых принципов, чтобы представить структуру ЦНС, таких как графен и УНТ, как показано на рисунке 2. Кресельные УНТ с различными диаметрами, такими как УНТ (4,4), УНТ (5,5), УНТ. Были рассмотрены (6,6), CNT (7,7) и зигзагообразные CNT, такие как CNT (8,0), CNT (10,0), CNT (12,0), CNT (14,0).Кроме того, были смоделированы графеновые наноленты (GNR), такие как GNR1, GNR2, GNR3 и GNR4. Таким образом, рассмотренные эклектические модельные системы помогут определить влияние хиральности и кривизны ЦНС на связывание с углеводородами. Модельные системы, используемые для представления углеводородов, приведены на рисунке 3. Набор ациклических углеводородов как в насыщенных, так и в ненасыщенных формах и набор циклических углеводородов как в насыщенных, так и в ненасыщенных формах были рассмотрены для изучения их взаимодействия с ЦНС.Номенклатура, используемая в этом обсуждении, следующая; ациклические предельные углеводороды (A n ), ациклические ненасыщенные углеводороды (E n ), циклические насыщенные углеводороды (CA n ) и циклические ненасыщенные углеводороды (CE n ), где n обозначает количество атомов углерода .
Рис. 2. Модельные системы, используемые для представления углеродных наноструктур .
Рис. 3. Ацильные и ацильные углеводороды, рассматриваемые в данном исследовании .
Результаты и обсуждение
Обсуждение сосредоточено на сравнении сродства связывания насыщенных и ненасыщенных углеводородов. Сродство связывания циклических углеводородов также сравнивали с соответствующими ациклическими углеводородами. Затем следует изображение эффекта хиральности и кривизны ЦНС в направлении связывания углеводородов. Мы также обсуждаем результаты анализа AIM, который обеспечивает дальнейшее понимание связывания насыщенных и ненасыщенных углеводородов.Было проведено качественное сравнение с нашими результатами и имеющимися экспериментальными результатами.
Насыщенные и ненасыщенные углеводороды
Был проведен систематический анализ для понимания взаимодействия углеводородов с центральной нервной системой. Прежде чем приступить к работе со всеми CNS, было проведено предварительное исследование, в котором были рассмотрены различные возможные ориентации всех углеводородов с CNT (4,4). Наиболее стабильные ориентации, наблюдаемые в ходе предварительного исследования, были рассмотрены для дальнейшего изучения во всех других ЦНС.Например, углеводороды E n и CE n ориентируются в стопке ( S ) или Т-образной ( T ) ориентации по отношению к CNS, что заставляет их взаимодействовать посредством CH ··· π или π — режим взаимодействия π соответственно (рисунок 4). Наши результаты показывают, что ориентации S более стабильны, чем ориентации T , в обоих случаях E n и CE n . Аналогичный анализ был проведен для всех других углеводородов с УНТ (4,4), и результаты приведены в дополнительном материале.Наилучшие возможные ориентации, полученные из приведенного выше анализа, были рассмотрены для дальнейшего изучения.
Рис. 4. Возможные ориентации (S и T) ненасыщенных углеводородов на ЦНС и их энергии связи (ккал / моль) .
Ациклические углеводороды — насыщенные по сравнению с ненасыщенными
BE ациклических углеводородов, таких как этан (A2), н-бутан (A4) и н-гексан (A6), были рассчитаны с использованием УНТ типа «кресло», УНТ зигзагообразной формы и ГНЛ, и значения приведены в таблице 2.Из таблицы видно, что с увеличением размера углеводорода BE также увеличивается. Увеличение энергии БЭ более заметно в случае графена, чем в случае УНТ. Чтобы сравнить их ненасыщенные аналоги, мы вычислили BE этилена (E2), 1,3-бутадиена (E4) и 1,3,5-гексатриена (E6) со всеми рассматриваемыми CNS. Как наблюдалось в случае A n , BE увеличивается по мере увеличения размера E n , и это увеличение более резкое в случае графена.Интересным наблюдением является то, что аффинность связывания A n оказалась выше, чем у соответствующего E n . Та же тенденция была отмечена как для CNT, так и для GNR; однако в случае графена разница в их БЭ намного меньше. В общем, молекулы алканов взаимодействуют с УНТ посредством взаимодействия CH ··· π, тогда как алкены взаимодействуют посредством взаимодействия π — π. Наши результаты показывают, что в случае ациклических углеводородов насыщенные молекулы A n связываются сильнее, чем ненасыщенные углеводороды E n .
Таблица 2. БЭ (ккал / моль) ЦНС с различными ациклическими насыщенными (A n ) и ненасыщенными (E n ) углеводородами при M06-2X / 6-311G ** // ONIOM (M06-2X / 6-31G *: AM1) уровень .
Кратчайшее расстояние между CNS и углеводородами (r), полученное при оптимизации геометрии комплексов CNS-A n и CNS-E n , указано в таблице S1 (дополнительный материал). В случае комплексов CNS-A n расстояние измеряется от ближайшего атома H комплекса A n до поверхности CNS.Для комплексов E n расстояние измеряется от ближайшего атома C E n до поверхности ЦНС. Из таблицы S1 видно, что углеводороды A n находятся на расстоянии около 2,5 Å от поверхности ЦНС. И E n ориентируются от поверхности ЦНС на расстоянии около 3,0 Å. Типичные оптимизированные структуры и геометрические параметры комплексов УНТ-углеводород представлены на рисунке 5, а остальные структуры — в дополнительном материале.
Рис. 5. Оптимизированная геометрия комплексов CNT (4,4) со всеми рассматриваемыми углеводородами . Ближайшее расстояние между мономерами указано в Å.
Циклические углеводороды — насыщенные по сравнению с ненасыщенными
Мы также сосредоточили свое внимание на БЭ циклических предельных углеводородов, таких как циклобутан (CA4), циклогексан (CA6) и декалин (CA10) с ЦНС. Полученные результаты сравнивали с результатами БЭ их ненасыщенных аналогов, таких как циклобутадиен (CE4), бензол (CE6) и нафталин (CE10).В таблице 3 приведены значения BE как насыщенных, так и ненасыщенных циклических углеводородов. Из таблицы очевидно, что BE увеличивается с увеличением размера углеводорода в большинстве комплексов, за исключением нескольких комплексов CNT, где BE CE4, как было обнаружено, больше, чем комплексы CE6. В отличие от наблюдений в ациклических углеводородах, сродство связывания ненасыщенного CE n больше, чем у его насыщенного аналога CA n .
Таблица 3.БЭ (ккал / моль) ЦНС с различными циклическими насыщенными (CA n ) и ненасыщенными (CE n ) углеводородами при M06-2X / 6-311G ** // ONIOM (M06-2X / 6-31G *: AM1) уровень .
Циклические и ациклические углеводороды
В этом разделе мы сравнили сродство связывания ациклических углеводородов с их циклическими аналогами по отношению к ЦНС. Например, мы рассмотрели углеводороды A4 и A6 в ациклическом наборе, который можно сравнить с таковым из циклических углеводородов CA4 и CA6.Точно так же в ненасыщенном наборе E4 и E6 могут иметь циклические аналоги как CE4 и CE6. Сравнение и сопоставление связывающего сродства этих углеводородов будет само по себе интересным. Фигуры 6, 7 иллюстрируют аффинность связывания циклических и ациклических углеводородов в их насыщенной и ненасыщенной формах соответственно. Проведено сравнение циклической и ациклической форм углеводородов с одинаковым числом атомов углерода. Из рисунков видно, что ациклические углеводороды демонстрируют более сильное сродство связывания с ЦНС, чем их циклические аналоги.Однако не наблюдается большой разницы между аффинностями связывания комплексов E4 и CE4.
Рис. 6. Энергия связи циклических предельных углеводородов по сравнению с ациклическими . (A) н-бутан в сравнении с циклобутаном и (B) н-гексан в сравнении с циклогексаном.
Рис. 7. Энергия связи циклических и ациклических ненасыщенных углеводородов . (A) 1,3-бутадиен против циклобутадиена и (B) 1,3,5-гексатриен противбензол.
Эффект хиральности и кривизны
Известно, чтоУНТ существуют с разной хиральностью, такие как кресельные УНТ и зигзагообразные УНТ. Поскольку УНТ считаются свернутой формой графенового листа в одном измерении, хиральность УНТ обеспечивается скручиванием графенового листа в различных ориентациях (Charlier, 2002). Основываясь на ориентации оси трубки относительно плоскости листа графена, структура УНТ может быть задана хиральными индексами (n, m).УНТ типа «кресло», которые проявляют металлическое поведение, представлены как УНТ (n, n), а зигзагообразные нанотрубки являются полупроводниками, которые определяются как УНТ (n, 0). Чтобы исследовать влияние хиральности УНТ на сродство связывания с различными углеводородами, мы рассмотрели модели «кресло» и «зигзаг» сопоставимых диаметров. Систематическое сравнение УНТ «кресло», зигзагообразных УНТ и ГНЛ приведено на рисунках 8, 9 для ациклических и циклических углеводородов соответственно. Из рисунков видно, что практически нет изменений в БЭ при изменении хиральности УНТ.
Рис. 8. Влияние кривизны и хиральности на сродство связывания ациклических углеводородов с CNS .
Рис. 9. Влияние кривизны и хиральности на аффинность связывания циклических углеводородов с CNS .
В то время как исследования взаимодействия плоских π-систем изучались в литературе, в последние годы постепенно стали проводиться несколько исследований изогнутых π-систем. Чтобы обсудить влияние кривизны на BE, были рассмотрены как изогнутые, так и плоские модельные системы, как показано на рисунке 2.Чтобы представить плоские π – системы, мы рассмотрели модельные системы GNR1, GNR2, GNR3 и GNR4. Модели, используемые для имитации кресельных УНТ, таких как CNT (4,4), (5,5), CNT (6,6) и CNT (7,7), представляют собой свернутую форму графеновых нанолент GNR1, GNR2, GNR3. , и GNR4 соответственно. Следовательно, влияние кривизны может быть изучено путем сравнения BE этих модельных систем. Обратимся к таблицам 2, 3, где даны БЭ всех углеводородных комплексов. Из таблицы видно, что УЭ планарных ГНЛ выше, чем у соответствующих искривленных π – систем i.е., УНТ. Также интересно отметить, что разница в BE плоской и криволинейной систем увеличивается с увеличением размера углеводорода. Рисунки 8, 9 также подтверждают тот факт, что плоский графен демонстрирует более сильное сродство к связыванию, чем изогнутые УНТ. Таким образом, предыдущий анализ по существу количественно оценивает влияние кривизны и хиральности π – π и CH ··· π взаимодействия углеводородов с CNS.
Сравнение с имеющимися экспериментальными результатами
В этом разделе мы сравнили имеющиеся экспериментальные наблюдения с результатами наших расчетов, и результат очень обнадеживает.Вышеупомянутое обсуждение БЭ молекул ЦНС-углеводородов ясно показало противоположную природу связывания ЦНС с ациклическими и циклическими углеводородами. В случае ациклических углеводородов сродство связывания A n оказалось выше, чем E n , в то время как для циклических углеводородов CE n имеет тенденцию связываться сильнее, чем соответствующий CAn. Во всех случаях BE увеличивается с увеличением размера углеводорода. Кроме того, ациклические углеводороды проявляют более сильное сродство связывания, чем циклические углеводороды, с ЦНС.
Интересно, что результаты, полученные в результате нашего вычислительного исследования, оказались в хорошем согласии с более ранними экспериментальными результатами на ЦНС. Díaz et al. изучили адсорбцию углеводородов с помощью обратной газовой хроматографии и сообщили, что энергия адсорбции увеличивается с увеличением размера углеводорода (Díaz et al., 2007). Несколько экспериментальных и вычислительных исследований показали, что УНТ предпочитают этан, чем этилен (Cruz, Müller, 2009; Albesa et al., 2011; Xingling et al., 2013). Sumanasekera et al. сообщили в своих экспериментальных исследованиях, что энергия адсорбции комплексов ОСНТ с бензолом составляет 9,42 кДж / моль, а циклогексана — 7,59 кДж / моль. Они систематически показали, что BE уменьшается при переходе от CE n к CA n (Sumanasekera et al., 2002). В экспериментальном исследовании было обнаружено, что свободная энергия адсорбции бензола на УНТ больше, чем свободная энергия адсорбции циклогексана (Díaz et al., 2007). В том же исследовании было также показано, что свободная энергия адсорбции ациклического углеводорода выше, чем у циклического аналога.Agnihotri et al. на основе экспериментального исследования образца ОСУНТ с электрической дугой показали, что энергия адсорбции гексана выше, чем у циклогексана (Agnihotri et al., 2005).
Анализ AIM
Мы использовали анализ AIM, чтобы понять нековалентное взаимодействие между углеводородами и CNS. Мы рассмотрели CNT (4,4), CNT (8,0) и GNR1 как репрезентативные случаи для изучения топологии электронной плотности комплексов кресельных CNT, зигзагообразных CNT и GNR соответственно.Знак лапласиана плотности, 2 ρ, является широко используемым инструментом для различения общих связей и связей замкнутой оболочки. Закрытая связь оболочки может быть либо нековалентным взаимодействием, либо полярно-ковалентной связью, подобной металлоорганическим связям (Cortés-Guzmán and Bader, 2005; Foroutan-Nejad et al., 2014). В общем, если знак лапласиана положительный, то они считаются связями с замкнутой оболочкой (Higashibayashi et al., 2013). Для комплексов CNS-углеводород было замечено, что значения лапласиана положительны, и это подтверждает существование замкнутых оболочечных связей и нековалентных взаимодействий в этом случае.Поскольку несколько LCP наблюдались между CNS и углеводородами, мы рассмотрели сумму значений электронной плотности на различных LCP в областях сгруппированных пакетов (Таблица 4). Из таблицы видно, что сумма электронных плотностей увеличивается с увеличением размеров систем. Кроме того, сумма электронных плотностей в комплексах предельных углеводородов в большинстве случаев оказывается выше, чем их ненасыщенные аналоги.
Таблица 4.Сумма электронных плотностей на LCP комплексов ЦНС-углеводород в а.е. получено с помощью анализа AIM .
Для дальнейшего понимания топология электронной плотности комплексов представлена на рисунке 10. Из рисунка видно, что между углеводородом и CNS находятся два разных LCP, такие как C ··· C и CH ··· C. Также интересно отметить, что в случае комплексов предельных углеводородов, таких как A n и CA n , LCP получают между H углеводорода и C CNS.Однако для ненасыщенных углеводородов, E n и CE n , LCP получают между C углеводорода и C CNS. Таким образом, контрастный характер LCP в комплексах насыщенных и ненасыщенных углеводородов по отношению к CNS четко выявлен с помощью анализа AIM.
Рис. 10. Атомные позиции и LCP комплексов УНТ с углеводородами, полученные на уровне M06-2X / 6-31G * .
Выводы
В этой работе было проведено систематическое исследование для понимания взаимодействия насыщенных и ненасыщенных углеводородов с ЦНС.Насыщенные молекулы показывают более сильное сродство связывания в ациклических углеводородах, тогда как ненасыщенные молекулы демонстрируют более сильное сродство связывания в циклических углеводородах. Было замечено, что BE комплексов CNS-углеводород увеличивается с увеличением размера углеводорода. Интересно отметить, что ациклические углеводороды демонстрируют более сильное сродство связывания, чем циклические углеводороды, по отношению к ЦНС. Наши результаты показывают, что плоский графен проявляет более сильное сродство к углеводородам по сравнению с изогнутыми УНТ.Результаты, полученные в результате нашего вычислительного исследования, оказались в хорошем согласии с более ранними экспериментальными результатами на CNS. Теория AIM дает рациональную основу для дифференциации комплексов предельных и непредельных углеводородов. Мы надеемся, что наши результаты будут очень полезны для понимания различных применений ЦНС.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Благодарим проект CSIR (INTELCOAT и MSM) за финансовую помощь в рамках 12-го пятилетнего плана. Деивасигамани Умадеви благодарит CSIR за стипендию для старшего исследователя.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: http://www.frontiersin.org/journal/10.3389/fchem.2014.00075/abstract
Оптимизированные структуры возможных ориентаций углеводородов на ЦНС; Оптимизированная геометрия рассматриваемых комплексов; Молекулярный график AIM зигзагообразных УНТ и ГНР.
Ссылки
Агнихотри, С., Руд, М. Дж., И Ростам-Абади, М. (2005). Адсорбционное равновесие органических паров на однослойных углеродных нанотрубках. Углерод 43, 2379–2388. DOI: 10.1016 / j.carbon.2005.04.020
CrossRef Полный текст
Албеса, А.Г., Рафти, М., Рават, Д.С., Висенте, Дж. Л., и Мигоне, А. Д. (2011). Адсорбция этана / этилена на углеродных нанотрубках: влияние температуры и размера на разделительную способность. Langmuir 28, 1824–1832.DOI: 10.1021 / la204314a
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бадер, Р. Ф. У. (1990). Квантовая теория молекулярной структуры и ее приложения. Chem. Ред. . 91, 893–928. DOI: 10.1021 / cr00005a013
CrossRef Полный текст
Баламуруган, К., Сингам, Э. Р. А., и Субраманян, В. (2011). Влияние кривизны на тенденцию к разрыву α-спирали углеродных наноматериалов. J. Phys. Chem. C 115, 8886–8892.DOI: 10.1021 / jp110898r
CrossRef Полный текст
Баламуруган, К., Субраманиан, В. (2013). Зависимая от длины стабильность α-спирального пептида при адсорбции на однослойной углеродной нанотрубке. Биополимеры 99, 357–369. DOI: 10.1002 / bip.22185
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Биглер-Кениг, Ф. (2000). Расчет данных атомарной интеграции. J. Comput. Chem . 21, 1040–1048. DOI: 10.1002 / 1096-987X (200009) 21:12 <1040 :: AID-JCC2> 3.0.CO; 2-8
CrossRef Полный текст
Чен, Р. Дж., Бангсарунтип, С., Дроувалакис, К. А., Вонг Ши Кам, Н., Шим, М., Ли, Ю. и др. (2003). Нековалентная функционализация углеродных нанотрубок для высокоспецифичных электронных биосенсоров. Proc. Natl. Акад. Sci. США . 100, 4984–4989. DOI: 10.1073 / pnas.0837064100
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Чурасия М., Састри Г. М. и Састри Г. Н. (2011). База данных ароматико-ароматических взаимодействий, A2ID: анализ ароматических π-сетей в белках. внутр. J. Biol. Макромол . 48, 540–552. DOI: 10.1016 / j.ijbiomac.2011.01.008
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кортес-Гусман, Ф., и Бадер, Р. Ф. У. (2005). Комплементарность теории QTAIM и МО в исследовании связывания в донорно-акцепторных комплексах. Coord. Chem. Ред. . 249, 633–662. DOI: 10.1016 / j.ccr.2004.08.022
CrossRef Полный текст
Круз, Ф. Дж. А. Л., и Мота, Дж. П. Б. (2009). Термодинамика адсорбции легких алканов и алкенов в пучках однослойных углеродных нанотрубок. Phys. Ред. B 79: 165426. DOI: 10.1103 / PhysRevB.79.165426
CrossRef Полный текст
Круз, Ф. Дж. А. Л., и Мюллер, Э. (2009). Поведение этилена и этана в однослойных углеродных нанотрубках. 1-Адсорбционные и равновесные свойства. Адсорбция 15, 1–12. DOI: 10.1007 / s10450-009-9154-0
CrossRef Полный текст
Де Волдер, М. Ф. Л., Тауфик, С. Х., Боуман, Р. Х., и Харт, А. Дж. (2013). Углеродные нанотрубки: настоящее и будущее коммерческое применение. Наука 339, 535–539. DOI: 10.1126 / science.1222453
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Диас, Э., Ордоньес, С., и Вега, А. (2007). Адсорбция летучих органических соединений на углеродные нанотрубки, углеродные нановолокна и графиты с большой площадью поверхности. J. Colloid Interface Sci . 305, 7–16. DOI: 10.1016 / j.jcis.2006.09.036
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Фокин А.А., Гербиг Д., и Шрайнер П. Р. (2011). Не менее важны σ / σ- и π / π-взаимодействия: многослойные графаны. J. Am. Chem. Soc . 133, 20036–20039. DOI: 10.1021 / ja206992j
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Фороутан-Нежад, К., Шахбазян, С., и Марек, Р. (2014). К последовательной интерпретации qtaim: извилистая связь между химическими связями, взаимодействиями и путями связи / линии. Химия 20, 10140–10152. DOI: 10.1002 / chem.201402177
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Фриш, М. Дж., Тракс, Г. У., Шлегель, Х. Б., Скузерия, Г. Э., Робб, М. А., Чизман, Дж. Р. и др. (2009). Gaussian 09, редакция C.01 . Уоллингфорд, Коннектикут: Gaussian, Inc.
Георгакилас В., Отепка М., Бурлинос А. Б., Чандра В., Ким Н., Кемп К. К. и др. (2012). Функционализация графена: ковалентный и нековалентный подходы, производные и приложения. Chem.Ред. . 112, 6156–6214. DOI: 10.1021 / cr3000412
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хигасибаяси, С., Оноги, С., Шривастава, Х. К., Састри, Г. Н., Ву, Ю. Т. и Сакураи, Х. (2013). Стереоэлектронный эффект искривленных ароматических структур: благоприятная неожиданная эндоконформация бензил-замещенного суманена. Angew. Chem. Int. Эд. Engl . 52, 7314–7316. DOI: 10.1002 / anie.201303134
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Цзян, Дж., Сандлер, С.И., Шенк, М., и Смит, Б. (2005). Адсорбция и разделение линейных и разветвленных алканов на пучках углеродных нанотрубок на основе моделирования Монте-Карло с конфигурационным смещением. Phys. Ред. B 72: 045447. DOI: 10.1103 / PhysRevB.72.045447
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кар Т., Беттингер Х. Ф., Шайнер С. и Рой А. К. (2008). Нековалентные π − π-стэкинг и CH-π-взаимодействия ароматических соединений на поверхности одностенных углеродных нанотрубок: исследование MP2. J. Phys. Chem. C 112, 20070–20075. DOI: 10.1021 / jp807809u
CrossRef Полный текст
Конг, Дж., Франклин, Н. Р., Чжоу, К., Чаплин, М. Г., Пэн, С., Чо, К. и др. (2000). Молекулярные нити нанотрубок как химические сенсоры. Наука 287, 622–625. DOI: 10.1126 / science.287.5453.622
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кумар А., Редди А. Л. М., Мукерджи А., Дубей М., Чжан Х., Сингх Н. и др. (2011).Прямой синтез интеркалированного литием графена для применения в электрохимическом накоплении энергии. ACS Nano 5, 4345–4349. DOI: 10.1021 / nn201527p
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ли, Н., Ли, Г., Янг, Дж. У., Ким, Х., Йом, М. С., Шайхер, Р. Х. и др. (2013). Нековалентная функционализация щелочным металлом для отделения полупроводников от металлических углеродных нанотрубок: теоретическое исследование. J. Phys. Chem. С 117, 4309–4313.DOI: 10.1021 / jp3123902
CrossRef Полный текст
Махадеви А. С., Рахалкар А. П., Гадре С. Р. и Састри Г. Н. (2010). Ab initio исследование бензольных кластеров: молекулярный подход. J. Chem. Phys . 133: 164308. DOI: 10.1063 / 1.3494536
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Манн, Дж. А., и Дихтель, В. Р. (2013). Нековалентная функционализация графена молекулярными и полимерными адсорбатами. Дж.Phys. Chem. Lett . 4, 2649–2657. DOI: 10.1021 / jz4010448
CrossRef Полный текст
Нийоги, С., Хамон, М. А., Ху, Х., Чжао, Б., Бхоумик, П., Сен, Р. и др. (2002). Химия однослойных углеродных нанотрубок. В соотв. Chem.Res . 35, 1105–1113. DOI: 10.1021 / ar010155r
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Премкумар, Дж. Р., Умадеви, Д., Састри, Г. Н. (2014). Количественная оценка дисперсионного взаимодействия: исследование алканов и димеров алкенов. Indian J. Chem. Sect A 53A, 985–991.
Премкумар, Дж. Р., Виджай, Д., и Састри, Г. Н. (2012). Значение размера алкена и природы иона металла в комплексах металл-алкен: теоретическое исследование. Дальтон Транс . 41, 4965–4975. DOI: 10.1039 / c2dt30119a
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Приякумар, У. Д., Пуннагаи, М., Мохан, Г. П. К., и Састри, Г. Н. (2004). Вычислительное исследование взаимодействия катион – π в полициклических системах: изучение зависимости от кривизны и электронных факторов. Тетраэдр 60, 3037–3043. DOI: 10.1016 / j.tet.2004.01.086
CrossRef Полный текст
Рао, К. Н. Р., Суд, А. К., Субрахманьям, К. С., и Говиндарадж, А. (2009). Графен: новый двумерный наноматериал. Angew. Chem. Int. Эд. Engl . 48, 7752–7777. DOI: 10.1002 / anie.2008
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Рао, Дж. С., Динадаялане, Т. К., Лещинский, Дж., И Састри, Г. Н. (2008). Комплексное исследование сольватации катионов одно- и двухвалентных металлов: Li + , Na + , K +, Be 2+ , Mg 2+ и Ca 2+ . J. Phys. Chem. А 112, 12944–12953. DOI: 10.1021 / jp8032325
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Равиндер, П., Кумар, Р. М., и Субраманиан, В. (2012). Исследования по инкапсулированию f– в однослойные нанотрубки различной хиральности с использованием расчетов теории функционала плотности и моделирования молекулярной динамики car – parrinello. J. Phys. Chem. А 116, 5519–5528. DOI: 10.1021 / jp210668b
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Суманасекера, Г.У., Прадхан, Б. К., Ромеро, Х. Э., Аду, К. В., и Эклунд, П. К. (2002). Гигантские эффекты термоЭДС от молекулярной физической сорбции на углеродных нанотрубках. Phys. Rev. Lett . 89: 166801. DOI: 10.1103 / PhysRevLett.89.166801
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Умадеви Д., Састри Г. Н. (2011a). Молекулярное и ионное взаимодействие с графеновыми нанофластями: вычислительное исследование взаимодействия CO2, h3O, Li, Mg, Li + и Mg2 + с полициклическими ароматическими углеводородами. J. Phys. Chem. С 115, 9656–9667. DOI: 10.1021 / jp201578p
CrossRef Полный текст
Умадеви Д., Састри Г. Н. (2011b). Квантово-механическое исследование физадсорбции азотистых оснований на углеродных материалах: графен против углеродных нанотрубок. J. Phys. Chem. Lett . 2, 1572–1576. DOI: 10.1021 / jz200705w
CrossRef Полный текст
Умадеви Д., Састри Г. Н. (2012). Связывание ионов металла с углеродными нанотрубками и графеном: эффект хиральности и кривизны. Chem. Phys. Lett . 549, 39–43. DOI: 10.1016 / j.cplett.2012.08.016
CrossRef Полный текст
Умадеви Д., Састри Г. Н. (2013). Влияние хиральности и кривизны углеродных наноструктур на их взаимодействие с ароматическими соединениями и аминокислотами. ChemPhysChem 14, 2570–2578. DOI: 10.1002 / cphc.201300089
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Умадеви Д., Састри Г. Н. (2014). Возможность использования углеродных наноматериалов в качестве газовых сенсоров: вычислительное исследование. Curr. Sci . 106: 1224.
Виджай Д. и Састри Г. Н. (2008). Изучение зависимости размера циклических и ациклических [малых пи] -систем от связывания катионов [малых пи]. Phys. Chem. Chem. Phys . 10, 582–590. DOI: 10.1039 / b713703f
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Xingling, T., Zhigang, W., Zaixing, Y., Peng, X., and Bo, Z. (2013). Адсорбционное разделение смесей этилен / этан с использованием углеродных нанотрубок: исследование молекулярной динамики. J. Phys. D Прил. Phys . 46: 395302. DOI: 10.1088 / 0022-3727 / 46/39/395302
CrossRef Полный текст
Чжао, Ю., и Трухлар, Д. (2008). Набор функционалов плотности M06 для термохимии основной группы, термохимической кинетики, нековалентных взаимодействий, возбужденных состояний и переходных элементов: два новых функционала и систематическое тестирование четырех функционалов класса M06 и 12 других функционалов. Теор. Chem. Acc . 120, 215–241. DOI: 10.1007 / s00214-007-0310-x
CrossRef Полный текст
алкенов | Химия, 11 класс, углеводороды
Ациклические ненасыщенные углеводороды, содержащие двойную связь углерод-углерод, называются алкенами .Их также называют олефинами , поскольку низшие представители этого класса образуют маслянистые продукты при реакции с галогенами, такими как хлор и бром.
Конструкции двойной связи
Двойная связь углерод-углерод в алкенах состоит из одной сильной σ-связи углерод-углерод с энергией диссоциации связи и слабой π-связи с энергией диссоциации связи 251 Дж · моль -1
σ-связь образована лобовым перекрытием sp 2 гибридизованных орбиталей, в то время как π-связь образуется за счет бокового или бокового перекрытия двух 2p-орбиталей двух атомов углерода.
Орбитальные диаграммы молекулы этена
Для эффективного перекрытия p-орбитали сдвигаются немного ближе, поэтому двойная связь укорачивается (134 пм), чем одинарная (154 пм). Кроме того, из-за плохого перекрытия между двумя p-орбиталями π-связь всегда слабее, чем a-связь.
Наличие π-связи заставляет алкены вести себя как источник слабо удерживаемых электронов. Следовательно, алкены легко атакуются реагентами или соединениями, которые ищут электроны.Такие реагенты называются электрофилами или электрофильными реагентами . Кроме того, наличие π-связи делает алкены менее стабильными и более реактивными, чем алканы, и, следовательно, легко превращаются в соединения, содержащие одинарные связи, путем добавления электрофильных реагентов.
Номенклатура алкенов
Изомерия алкенов
Алкены проявляют как структурную, так и стереоизомерию, т.е. геометрическую изомерию
Структурная изомерия
Этен и пропен могут иметь только структуру, но алкены, содержащие четыре или более атомов углерода, могут иметь изомерию как положения, так и цепи.
Геометрическая изомерия
Двойная связь состоит из σ-связи и π-связи. Π-связь образована боковым перекрытием негибридизованных p-орбиталей двух атомов углерода выше и ниже плоскости из
атомов углерода. Если теперь один из атомов углерода двойной связи повернуть относительно другого, p-орбитали больше не будут перекрываться и π-связь должна разорваться, но для разрыва π-связи требуется 251 кДж моль -1 энергии, которая не обеспечивается столкновениями молекул при комнатной температуре.Следовательно, вращение вокруг двойной связи углерод-углерод не является свободным, а сильно затруднено или ограничено.
π-связь препятствует свободному вращению атомов углерода двойной связи относительно друг друга. Из-за этого затрудненного вращения взаимное расположение атомов или групп, присоединенных к атомам углерода двойной связи, фиксируется.
Многие замещенные алкены могут существовать в виде двух различных изомеров, которые отличаются друг от друга только относительным положением атомов или групп в пространстве вокруг двойной связи.
Для Ex: but-2-ene
Оба эти изомера имеют одинаковые структурные формулы, но отличаются относительным расположением атомов водорода и метильных групп вокруг двойной связи.
Такие изомеры, которые имеют одинаковые структурные формулы, но отличаются относительным пространственным расположением
атомов или групп вокруг двойника, называются геометрическими изомерами, а
это явление называется геометрической изомерией . Таким образом, геометрическая изомерия — это пространство
или стереоизомерия.
Изомер, в котором аналогичные атомы или группы лежат на одной стороне двойной связи, называется цис-изомером , тогда как изомер, в котором аналогичные атомы или группы лежат на противоположных сторонах двойной связи, называется транс-изомером . -изомер . По этой причине геометрическую изомерию также называют цис-транс-изомерией .
Свойства геометрических изомеров
Точки плавления: Точка плавления транс-изомера выше, чем у соответствующего цис-изомера.
В транс-изомере два одинаковых атома или группы лежат на противоположных сторонах двойной связи. Следовательно, эти молекулы симметричны и, следовательно, хорошо упаковываются в кристаллической решетке. С другой стороны, в цис-изомере два одинаковых атома или группы лежат на одной стороне двойной связи. Следовательно, эти молекулы несимметричны и, следовательно, плохо упаковываются в кристаллической решетке.
Межмолекулярные силы притяжения, удерживающие молекулы транс-изомера в кристаллической решетке, намного сильнее, чем силы, удерживающие молекулы цис-изомера.Следовательно, м. транс-изомера намного выше, чем у соответствующего изомера цис- .
Например: м.п. цис-бут-2-ена ниже, чем транс-бут-2-ена.
Температура плавления цис-1,2-дихлорэтилена ниже, чем у транс-1,2-дихлорэтилена
(2) Растворимость: В целом растворимость цис-изомера выше, чем растворимость соответствующего транс-изомера. Это происходит по той причине, что молекулы цис-изомера, будучи менее симметричными, слабо удерживаются в кристаллической решетке, чем соответствующий более симметричный транс-изомер.В результате требуется меньшее количество энергии для разрушения кристаллической решетки цис-изомера и, следовательно, растворимость цис-изомера выше по сравнению с растворимостью транс-изомера в том же растворителе.
3) Дипольный момент: цис-изомер алкена оказался более полярным, чем транс-изомер.
Для Ex: Дипольный момент цис-бут-2-ена равен 0,33 D, тогда как момент транс-бут-2-ена равен нулю. Таким образом, транс-2-бутен можно сказать неполярным.
В цис-бут-2-ене дипольный момент двух связей C-CH 3 наклонен под углом 60 ° и, следовательно, имеет результирующую величину, равную 0,33 D. В случае транс-бут-2-ена две связи равные и противоположные дипольные моменты компенсируют друг друга, поэтому дипольный момент транс-бут-2-ена равен нулю.
Транс-пент-2-ен имеет конечный дипольный момент, хотя и намного меньше, чем у соответствующего цис-изомера. Дипольный момент связей C-CH 3 и C-CH 2 CH 3 не равны.Эти два диполя противостоят друг другу, они точно не компенсируют друг друга, и, следовательно, транспент-2-ен имеет небольшой, но конечный дипольный момент.
4) Точка кипения: Точка кипения цис-изомера выше, чем у транс-изомера. Температура кипения изомерных соединений зависит от диполь-дипольного взаимодействия. Так как цис-изомеры имеют более высокий дипольный момент, чем соответствующие транс-изомеры, поэтому температура кипения цис-изомеров выше, чем у их соответствующих транс-изомеров.
Способы получения алкенов
1) Путем частичного восстановления алкинов : Каталитическое гидрирование алкинов в алкены происходит быстрее, чем гидрирование алкенов в алканы. Поскольку алкины демонстрируют геометрическую изомерию, алкины могут быть восстановлены до цис- или транс-алкена в зависимости от природы используемого катализатора .
Для Ex: Каталитическое восстановление алкинов в присутствии палладия, нанесенного на CaCO 3 или BaSO 4 и частично отравленных добавлением PbCO 3 , S или хинолина (катализатор Линдлара ) дает цис-алкен.Если алкины восстанавливаются натрием в жидком аммиаке ( Восстановление по Березе ), транс-алкены являются основными продуктами.
2) Из алкилгалогенидов или галогеналканов : Алкилгалогениды при нагревании с сильным основанием, таким как этоксид натрия или концентрированный спиртовой раствор гидроксида калия, подвергаются дегидрогалогенированию с образованием алкенов.
Этот процесс удаления молекулы галогенида из галогеналкана с образованием алкена называется дегидрогалогенированием.
Дегидрогалогенирование является примером реакции элиминирования . В этой реакции водород удаляется из β-углерода и галоген из α-углерода, поэтому она называется реакцией β-элиминирования .
Правило Сацефа
В зависимости от структуры алкилгалогениды могут давать один или несколько изомерных алкенов.
Например: Дегидрогалогенирование 1-хлорбутана дает только один алкен, то есть бут-1-ен, поскольку только один тип β-водорода доступен в левой части молекулы.
CH 3 CH 2 CH 2 CH 2 Cl + KOH (алк.) ———> + KCl + H 2 O
Структура алкилгалогенида такова, что он имеет β-водород по обе стороны от атома углерода, несущего галоген, он может подвергаться элиминированию двумя разными способами с образованием двух алкенов. Относительное количество этих двух алкенов регулируется правилом Сайцефа.
Если во время реакции дегидрогалогенирования возможно наличие двух алкенов, всегда преобладает более сильно замещенный алкен (имеющий меньшее количество атомов в двойной связи).
3) Из вицинальных дигалогенидов или 1,2-дигалогеналканов : Дигалогеновые производные алканов, в которых два атома галогена присутствуют на соседних атомах углерода, называются вицинальными или 1,2-дигалогеналканами .
Алкены могут быть получены нагреванием подходящего вицинала или 1,2-дигалогеналканов с цинковой пылью в метаноле или этаноле.
Br-CH 2 -CH 2 -Br + Zn ——–> CH 2 = CH 2 + ZnBr 2
CH 3 -CHBr-CHBr-CH 3 + Zn ——> CH 3 CH = CHCH 3 + ZnBr 2
Дегалогенирование
Этот процесс удаления молекулы галогена (Cl 2 , Br 2 , I 2 ) из дигалогеналкана с образованием алкена называется дегалогенированием .
Даже 1,1-дигалогеналканы или гем-дигалогенид также подвергаются дегалогенированию при нагревании с цинковой пылью в метаноле.
CH 3 -CHBr 2 + Zn ——-> CH 2 = CH 2 + ZnBr 2
CH 3 CH 2 -CHBr 2 + Zn ——-> CH 2 = CH 2 + ZnBr 2
Если вместо цинка используется натрий и реакция проводится в эфире, образуется лишь небольшое количество пропена, главным продуктом которого является гекс-3-ен.
2 CH 3 CH 2 CHBr 2 +4 Na ——> CH 3 CH 2 CH = CHCH 2 CH 3 +4 NaBr
Этот метод бесполезен для получения алкенов, поскольку 1,2-дигалогеналканы сами получают из алкенов. Этот метод полезен для очистки алкенов или для защиты двойной связи. Для этого можно использовать NaI вместо цинковой пыли.
4) Из одноатомных спиртов или алканолов путем кислотной дегидратации : Одноатомные спирты или алканолы, содержащие β-водород, при нагревании с минеральной кислотой, такой как конц H 2 SO 4 или H 3 PO 4 или при прохождении их паров над нагретым оксидом алюминия при 623-633 K удаляет молекулу воды с образованием алкенов.Поскольку молекула воды удаляется из молекулы спирта в присутствии кислоты, эта реакция известна как кислотная дегидратация спиртов .
Примеры:
CH 3 CH 2 OH ——-> CH 2 = CH 2 + H 2 O в присутствии Al 2 O 3 при 623-633 K
CH 3 CH 2 OH ——-> CH 2 = CH 2 + H 2 O в присутствии 95% H 2 SO 4 при 433-443 K
CH 3 -CHOH-CH 3 ——–> CH 3 -CH = CH 2 + H 2 O в присутствии 60% H 2 SO 4 при 373 K
Порядок обезвоживания различных спиртов 3 °> 2 °> 1 °
Как и алкилгалогениды, дегидратация спиртов также следует правилу Сайцефа.
Механизм
H 2 SO 4 ——–> H + + HSO 4 ‾
Лабораторный способ приготовления Этен
Этен получают путем дегидратации этилового спирта с конц. H 2 SO 4 при 440 К. Смесь этанола и конц. H 2 SO 4 в соотношении 1: 2 по объему добавляют из капельной воронки в круглодонную колбу, содержащую безводный Al 2 (SO 4 ) 3 и песок, в котором Al 2 (SO 4 ) 3 катализирует реакцию, тогда как песок используется для предотвращения вспенивания во время процесса.
Реакционную смесь нагревают до 433-443 К и полученный таким образом этен собирают над водой. Этен, полученный указанным выше способом, содержит примеси SO 2 и CO 2 . Для удаления примесей нечистый этен пропускают через раствор едкого натра, который поглощает SO 2 и CO 2
2NaOH + CO 2 —–> Na 2 CO 3 + H 2 O
2NaOH + SO 2 —–> Na 2 CO 3 + H 2 O
5) Из калиевых солей насыщенной дикарбоновой кислоты (электролитическая реакция Кольбе)
Электролиз натриевых или калиевых солей насыщенной дикарбоновой кислоты дает алкены.
Физические свойства алкенов
1) Физическое состояние, цвет, запах : Первые три члена семейства, т.е. этен, пропен и бутен, представляют собой бесцветные газы, следующие 14 членов — жидкие, а более высокие — твердые. Этен имеет приятный запах, все остальные алкены — газы без цвета и запаха.
2) Растворимость: Они нерастворимы в воде, но довольно хорошо растворимы в неполярных растворителях, таких как бензол, петролейный эфир, эфир.
3) Точка кипения: Их точка кипения регулярно повышается с увеличением молекулярных масс. При добавлении каждой группы CH 2 к цепи температуры кипения обычно повышаются на 20-30 К. Алкены с прямой цепью имеют более высокую температуру кипения, чем изомерные алкены с разветвленной цепью.
Алкены вступают в реакцию электрофильного присоединения
Алкены характеризуются наличием двойной связи, которая состоит из сильной C-C, σ-связи и слабой π-связи C-C.
π-электроны образуют электронное облако, которое находится выше и ниже плоскости σ-связанных атомов углерода. Эти π-электроны более открыты и, следовательно, менее плотно удерживаются между двумя атомами углерода. Поскольку электроны являются отрицательно заряженными частицами, π-электрон притягивает электрофилов и отталкивает нуклеофилов.
Алкены подвергаются электрофильной реакции. Они бывают двух типов:
1) Дополнение
2) Замена
1) В реакции электрофильного замещения одна σ-связь C-H разрывается и образуется новая σ-связь между одним из двухсвязанных атомов углерода и электрофилом.Поскольку энергии связи разорванной связи σ C-H и образованной новой связи σ C-X не сильно различаются, следовательно, реакции электрофильного замещения не сопровождаются большими изменениями энергии.
2) В реакции электрофильного присоединения одна слабая π-связь разрывается и образуются две сильные связи. Реакции электрофильного присоединения энергетически более выгодны, чем реакция электрофильного замещения.
Механизм реакций электрофильного присоединения
Сама молекула брома неполярна, но когда она приближается к молекуле этена, π-электроны двойной связи начинают отталкивать электронную пару, удерживающую два атома брома вместе в молекуле брома.В результате молекула брома поляризуется. Положительный конец этого диполя брома ведет себя как электрофил и притягивается π-электронами молекулы этена с образованием π-комплекса, который впоследствии дает карбокатионы и бромид-ион. Этот этап является медленным и, следовательно, является этапом, определяющим скорость. реакции.
Образовавшийся карбокатион, являющийся реакционноспособным химическим веществом, немедленно подвергается нуклеофильной атаке со стороны бромид-иона, присутствующего в растворе, образующем продукт присоединения.Этот шаг выполняется быстро и, следовательно, не влияет на скорость реакции.
Химическая реакция алкенов
1) Реакции присоединения алкенов
1) Добавление дигидрогена: Добавление дигидрогена к ненасыщенным углеводородам в присутствии катализатора называется каталитическим гидрированием.
Алкены легко добавляют дигидроген в присутствии никеля Ренея, платины, палладия в качестве катализатора при комнатной температуре или обычного никеля при 523-573 К с образованием алканов.
Для Ex: CH 2 = CH 2 + H 2 ——–> CH 3 -CH 3 в присутствии никеля Ренея, Pt или Pd
CH 3 CH = CH 2 + H 2 ——> CH 3 CH 2 CH 2 в присутствии Ni при 523-573 k
2) Добавление галогенов: галогены, такие как хлор и бром, легко присоединяются к алкену с образованием 1,2-дигалогеналакнов.
CH 2 = CH 2 + Br 2 ——-> BrCH 2 -CH 2 Br
CH 3 CH = CH 2 + Br 2 ——-> CH 3 -CHBr-CH 2 Br
При добавлении брома к алкену выделяется оранжево-красный цвет брома, так как образовавшийся дибром бесцветен. Это тест на ненасыщенность в органических соединениях.
Порядок реакционной способности присоединения галогена к алкену:
F 2 > Cl 2 > Br 2 > I 2
3) Добавление галогенида: алкены реагируют с галогенидом галогена с образованием моногалогеналканов, называемых алкилгалогенидом.
CH 2 = CH 2 + HBr ——-> CH 3 -CH 2 Br
Порядок реакционной способности галогенида в данной реакции: HI> HBr> HCl.Этот порядок реакционной способности можно объяснить на основе энергий диссоциации связи галогенидов водорода; Чем ниже энергия диссоциации связи, тем активнее галогенид галогена.
Дополнение к симметричным алкенам
CH 2 = CH 2 + HBr ——-> CH 3 -CH 2 Br
CH 3 -CH = CH-CH 3 + HCl ——–> CH 3 -CHCl-CH 2 -CH 3
Механизм
H-Br ——–> H + + Br ¯
Дополнение к несимметричным алкенам
Если алкен несимметричен, возможны два продукта.
Например: добавление HBr к пропену в темноте и в отсутствие пероксидов может дать два продукта. Было обнаружено, что в этих условиях основным продуктом является 2-бромпропан, а второстепенным — 1-бромпропан.
CH 3 -CH = CH 2 + HBr ———–> CH 3 -CHBr- CH 3 (основной) + CH 3 CH 2 CH 2 Br (второстепенный)
Правило Марковникова
Добавление несимметричных реагентов, таких как HX, H 2 O, HOX, к несимметричным алкенам происходит таким образом, что отрицательная часть присоединяемой молекулы переходит к тому атому углерода двойной связи, который несет меньшее количество атомов водорода.
трет-бутилхлорид является основным продуктом.
Механизм
Добавление галогенида к алкену является реакцией электрофильного присоединения. Таким образом, во время добавления HBr к пропену первая стадия включает добавление протона. Это добавление может происходить двумя способами.
1) Если протон присоединяется к концевому атому углерода двойной связи, образуется 2-градусный карбокатион.
2) Если протон присоединяется к среднему атому углерода, образуется карбокатион 1 °.
Основной продукт
Незначительный продукт
Поскольку карбокатион 2 ° более стабилен, чем карбокатион 1 °, основным продуктом является 2-бромпропан.
Эффект перекиси
В присутствии пероксидов, таких как пероксид бензоила, добавление HBr к несимметричным алкенам происходит вопреки правилу Марковникова. Это известно как эффект пероксида или эффект Караша.
Пероксид бензоила: (C 6 H 5 COO) 2
CH 3 -CH = CH 2 + HBr ———–> CH 3 -CH 2 -CH 2 Br
Механизм
Добавление HBr к алкену в присутствии пероксида происходит по свободнорадикальному механизму .
4) Добавление элементов гипогалогеновой кислоты — Образование галогидрина
Хлор и бром в присутствии воды легко присоединяются к алкену из галогенгидринов.
X 2 + H 2 O ——> HOX + HX
CH 2 = CH 2 ———-> HO-CH 2 -CH 2 -Cl + HCl в присутствии Cl 2 / H 2 O или HOCl
Добавление элементов гипогалогеновой кислоты происходит по правилу Марковникова.
CH 3 -CH = CH 2 + HO-Br ——-> CH 3 -CHOH-CH 2 Br + HBr
Механизм
5) Добавление серной кислоты
Cold conc H 2 SO 4 присоединяется к алкенам с образованием алкилгидросульфатов. В случае несимметричных алкенов присоединение происходит по правилу Марковникова.
CH 2 = CH 2 + H + OSO 2 OH ——> CH 3 -CH 2 -OSO 2 OH
Алкилгидросульфаты при кипячении с водой подвергаются гидролизу с образованием спиртов.
CH 3 -CHOSO 3 H -CH 3 + H 2 O ——> CH 3 -CHOH -CH 3 + H 2 SO 4
CH 2 = CH 2 ———> CH 3 CH 2 OH в присутствии Conc H 2 SO 4 , H 2 O, тепло
Общее двухстадийное превращение алкена сначала в алкилгидросульфат с последующим гидролизом кипящей водой с образованием спиртов называется непрямой гидратацией спиртов.
6) Добавление воды
Некоторые реакционноспособные алкены добавляют воду в присутствии минеральных кислот с образованием спиртов. Добавление в соответствии с правилом Марковникова.
Реакции окисления алкенов
1) Полное окисление кислородом или воздухом
Алкены горят в кислороде или воздухе до CO 2 и H 2 О. Этот процесс называется горением. Все процессы горения являются сильно экзотермическими по своей природе.
CH 2 = CH 2 + 3 O 2 ——–> 2CO 2 + 2 H 2 O
2) Контролируемое окисление с помощью окислителей: Алкены реагируют с рядом окислителей с образованием различных продуктов.
1) Окисление кислородом: Алкены реагируют с O 2 в присутствии серебра в качестве катализатора с образованием эпоксиалканов или эпоксидов.
2) Окисление перманганатом калия
a) Холодным разбавленным нейтральным или щелочным KMnO 4 : Из-за наличия π-связей алкены легко окисляются холодным разбавленным нейтральным или щелочным раствором KMnO 4 с образованием вицинальных или 1,2-диолов или 1, 2-гликоли, в то время как KMnO 4 сам восстанавливается до MNO 2 .
Эта реакция называется гидроксилированием , так как во время этого процесса две гидроксильные группы добавляются через двойную связь.
2KMnO 4 + H 2 O ——> 2 KOH + 2 MnO 2 + 3 [O]
CH 2 = CH 2 + H 2 O + [O] ——-> CH 2 OH-CH 2 OH
3 CH 3 CH = CHCH 3 + 2KMnO 4 + 4H 2 O ——-> CH 3 -CHOH-CHOH-CH 3 + 2 MnO 2 + 2KOH
Во время этой реакции раствор KMnO 4 окрашивается в розовый цвет и образуется коричневый осадок диоксида марганца.Таким образом, эта реакция используется в качестве теста на ненасыщенность под названием тест Байера.
b) Окисление горячим раствором KMnO 4 : когда алкен нагревают горячим раствором KMnO 4 , происходит разрыв связи C = C, приводящий к образованию карбоновой кислоты, кетонов и диоксида углерода в зависимости от природы алкен.
В случае концевых алкенов одним из продуктов всегда является метановая кислота.
CH 2 = CH 2 + 4 [O] ——> 2HCOOH ——-> 2CO 2 +2 H 2 O
CH 3 CH = CH 2 + 4 [O] ——-> CH 3 COOH + [HCOOH] —–> CO 2 + H 2 O
С нетерминальными алкенами получают кетоны или карбоновую кислоту или оба этих продукта в зависимости от природы алкена.
CH 3 CH = CHCH 3 + 4 [O] ——> CH 3 COOH + HOOCCH 3 в присутствии KMnO 4 , KOH при 373-383 K
CH 3 CH 2 CH = CHCH 3 + 4 [O] ——> CH 3 CH 2 COOH + HOOCCH 3 в присутствии KMnO 4 , KOH при 373-383 К
(CH 3 ) 2 C = C (CH 3 ) 2 + 2 [O] ——-> 2 CH 3 COCH 3 в присутствии KMnO 4 , КОН при 373-383 К
c) Окисление озоном: когда озон пропускают через раствор алкена в инертном растворителе, таком как CH 2 Cl 2 , CHCl 3 , CCl 4 при низкой температуре, он окисляет алкен до озонидов. .
Озониды являются нестабильными и взрывоопасными соединениями, поэтому их обычно не выделяют, а восстанавливают на месте цинковой пылью и водой или H 2 / Pd с образованием альдегидов или кетонов или их смеси в зависимости от структуры алкен.
Если озониды разлагаются только водой, H 2 O 2 , образующийся в ходе реакции, окисляет первоначально образовавшиеся альдегиды до соответствующих кислот.
Озонолиз
Это двухстадийное превращение алкена в озонид с последующим его восстановительным расщеплением с образованием карбонильного соединения называется озонолизом.
CH 3 CH 2 CH = CH 2 ———> CH 3 CH 2 CHO + HCHO
CH 3 CH = CHCH 3 ————-> 2 CH 3 CHO
(CH 3 ) 2 C = C (CH 3 ) 2 ———-> 2 (CH 3 ) 2 CO
Реакции проходят в присутствии O 3 / CH 2 Cl 2 , 196-200 K и Zn / H 2 O
Реакция полимеризации
Полимеризация — это процесс, в котором большое количество простых молекул объединяется с образованием большой молекулы.Простые молекулы называются мономерами, а большие молекулы называются макромолекулами или полимером .
1) Полимеризация этена : Когда этен нагревается до 473 К под давлением 1500 атм и в присутствии небольшого количества кислорода, он подвергается полимеризации с образованием полиэтилена.
Он широко используется в качестве упаковочного материала и в качестве изоляции для электрических проводов и кабелей. Он также используется для изготовления бутылок, поддонов холодильника, труб, радио и Т.V. Шкафы.
2) Полимеризация пропена: Полипропен получают либо нагреванием проплиена в присутствии следов бензоилпероксида в качестве индикатора радикалов, либо полимеризацией Циглера-Натта.
Он тверже и прочнее полиэтилена и используется для изготовления ящиков для молока, пластиковых ведер, автомобильного литья, чехлов для сидений, ковровых волокон, веревок.
3) Полимеризация замещенных этенов: Ряд полимеров можно получить, используя замещенные этены в качестве мономеров.
Поливинилхлорид
Поливинилхлорид используется для изготовления пластиковых бутылок, шприцев, трубок, плащей, пластинок и т. Д.
Полиакрилнитрил используется для изготовления волокон орлона и акрилана, используемых для изготовления одежды, ковров и одеял.
Используется для упаковки, изготовления игрушек и товаров для дома.
Использование алкенов
1) Нижние члены семейства используются в качестве топлива и освещения.
2) Алкены и замещенные алкены при полимеризации образуют ряд полезных полимеров, таких как полиэтилен, ПВХ, тефлон, орлон и т. Д.
3) Этен используется для получения этилового спирта и этиленгликоля.
4) Этилен используется для искусственного созревания зеленых плодов.
5) Этилен также используется в кислородно-этиленовом пламени для резки и сварки металлов.
полициклических ароматических углеводородов (ПАУ) | Департамент здравоохранения штата Висконсин
ПАУ чрезвычайно распространены в окружающей среде.В частности, городская среда имеет множество источников ПАУ. Все мы ежедневно подвергаемся воздействию ПАУ в воздухе, которым мы дышим, и в еде, которую мы едим. Наш метаболизм адаптирован к таким частым воздействиям низкого уровня.
ПАУ, сокращенно от полициклических ароматических углеводородов, представляют собой группу химических веществ, состоящую из множества атомов углерода, соединенных вместе с образованием нескольких колец. Существует не менее 10 000 различных соединений ПАУ. Большинство из них образуется в результате неполного сгорания растительного или животного материала или углеродного топлива, такого как уголь или нефть.
ПАУ в окружающей среде будут знакомы большинству как сажистая часть дыма или золы. ПАУ могут быть результатом естественных (лесных пожаров) или антропогенных методов или промышленных процессов. Многие полезные продукты содержат ПАУ, такие как нафталиновые шарики, щебень и креозотовые консерванты для древесины. Они также содержатся в низких концентрациях в некоторых специальных кремах для кожи и шампунях против перхоти, которые содержат угольные смолы.
Выхлопные газы автомобилей, промышленные выбросы и дым от сжигания древесины, древесного угля и табака содержат высокие уровни ПАУ.Как правило, больше ПАУ образуется при горении органических материалов при низких температурах, например при дровах или сигаретах. Высокотемпературные печи производят меньше ПАУ. Дым от пожаров содержит мельчайшие частицы ПАУ и других химикатов. Они известны как твердые частицы или ТЧ. Когда ТЧ микроскопические по размеру, они остаются в воздухе и могут перемещаться на большие расстояния.
Большинство ПАУ не растворяются в воде, а связываются с отложениями. Когда отложения становятся взвешенными в воде, ПАУ могут переноситься вместе с осадком.ПАУ могут попадать в грунтовые воды из золы, смолы или креозота, которые неправильно выбрасываются на свалки.
Сигаретный дым содержит ПАУ и другие канцерогенные вещества. Воздействие ПАУ в результате курения или пассивного курения может повысить риск чрезмерного воздействия ПАУ и заболеваний, связанных с ПАУ.
Некоторые продукты содержат ПАУ. Сведение к минимуму потребления жареного на углях, жареного на углях и копченостей и рыбы может снизить воздействие ПАУ.
Вы можете уменьшить воздействие ПАУ, надев перчатки при работе с режущими маслами, промыв кожу сразу после контакта с продуктами или загрязненной почвой, содержащей ПАУ, и избегая дыма от костров.Продукты, выращенные на зараженной почве, перед употреблением необходимо мыть, а корнеплоды — мыть и очищать от кожуры.ПАУ знакомы большинству из нас как сажистые вещества в дыме. Большинство людей подвергаются воздействию ПАУ при вдыхании дыма, автомобильных выхлопов или промышленных выхлопных газов. Большинство выхлопных газов содержат много различных соединений ПАУ. Частое воздействие на протяжении многих лет может привести к проблемам со здоровьем, особенно с легкими и сердцем. Люди с самым высоким уровнем воздействия — это курильщики и люди, которые живут или работают с курильщиками, а также кровельщики, дорожные строители и люди, живущие вблизи крупных автомагистралей или промышленных источников.
Жареные, копченые и приготовленные на углях продукты, особенно мясо, являются источником некоторого воздействия ПАУ. ПАУ могут находиться в почве возле свалок, где захоронены строительные отходы или зола. Из-за метаболизма ПАУ позвоночными животными не происходит значительного накопления ПАУ в мясе рыбы. Однако употребление в пищу моллюсков, обитающих в загрязненной воде, может быть еще одним важным источником воздействия. Овощи не поглощают значительное количество ПАУ, содержащихся в почве. ПАУ могут находиться в грунтовых водах вблизи свалок, где захоронены строительные отходы или зола; люди могут подвергнуться воздействию при употреблении этой воды.
Концентрированные ПАУ могут поражать кожу, особенно при растворении в масляных растворителях с образованием смолы. Контакт с масляными или смолистыми материалами в сочетании с солнечным светом может вызвать покраснение или раздражение кожи. В загрязненных водных путях воздействие может происходить из-за контакта с маслянистым блеском в воде или контакта с маслом на рыбе или коряги. Большая часть воздействия происходит на руки, с меньшей вероятностью попадание брызг на конечности или лицо. Помимо воздействия, связанного с рыбной ловлей, существует вероятность контакта с кожей при переходе вброд.Кожу, контактирующую с ПАУ, следует немедленно промыть с мылом.
СодержаниеПАУ в воздухе косвенно регулируется Национальным стандартом качества атмосферного воздуха для PM2,5. ПАУ часто являются важным компонентом ТЧ. Когда PM в регионе штата превышает или, как ожидается, превысит воздушный стандарт, Департамент природных ресурсов Висконсина (DNR) может выпустить рекомендации по качеству воздуха или наблюдение за качеством воздуха. DNR регулирует количество нескольких ПАУ, которые могут выделяться промышленными предприятиями.
Висконсин установил стандарты питьевой воды для пяти наиболее изученных ПАУ:
- Антрацен — 3000 частей на миллиард (ppb)
- Бензо (а) пирен — 0,2 частей на миллиард
- Бензо (b) флуорантен — 0,2 частей на миллиард
- Флуорантен — 400 частей на миллиард
- Флуорен — 400 частей на миллиард
Мы рекомендуем вам прекратить пить воду, содержащую больше указанного количества. Если в вашей питьевой воде обнаружены другие ПАУ, обратитесь за советом в местное учреждение здравоохранения.
Многие индивидуальные ПАУ имеют значения фильтрации почвы, установленные Агентством по охране окружающей среды США или DNR. Информацию о конкретных уровнях остаточного загрязнения ПАУ можно получить на веб-сайте DNR.
Реакция человека на химические вещества зависит от нескольких факторов, включая индивидуальное здоровье, наследственность, предыдущее воздействие химических веществ, включая лекарства, и личные привычки, такие как курение или употребление алкоголя. Также важно учитывать продолжительность воздействия химического вещества, степень воздействия химического вещества, а также то, было ли это вещество вдыхано, затронуто или съедено.
Когда мы вдыхаем высокие концентрации ПАУ, это обычно в форме дыма. Вредность вдыхания дыма возникает из-за комбинированного действия многих химически активных веществ дыма. Мы также можем контактировать с кожей с высокими концентрациями ПАУ в виде смолы, например, с щебнем или кровельным материалом. Когда эти продукты попадают на кожу и подвергаются воздействию солнечных лучей, они могут вызвать покраснение, образование волдырей и шелушение.
Следующие последствия для здоровья могут возникнуть после нескольких лет воздействия ПАУ:
- Профессиональное и хроническое воздействие ПАУ может вызвать рак.Было показано, что несколько ПАУ вызывают рак легких и кожи у лабораторных животных. У людей, которые работали в отраслях, где они регулярно подвергались воздействию очень высоких уровней, развились дегтеобразные бородавки и рак кожи. Экстракты различных видов дыма, содержащие ПАУ, вызывали опухоли легких у лабораторных животных.
- Воздействие может повредить легкие, печень, кожу и почки человека
- Репродуктивные проблемы и проблемы в развитии нерожденных детей возникли у лабораторных животных, подвергшихся воздействию бенз (а) пирена.Другие ПАУ недостаточно изучены, чтобы определить, вызывают ли они репродуктивные проблемы.
Многие ПАУ могут быть обнаружены в крови или моче вскоре после контакта. Тесты на эти соединения не являются рутинными и могут выполняться только с использованием специального оборудования, которое обычно не встречается в кабинетах врачей. Людям, которые думают, что они могли подвергаться воздействию ПАУ в течение длительного времени, следует обратиться к своему врачу. Доступны анализы крови на функцию печени и почек. Люди, подвергающиеся воздействию ПАУ в воздухе, могут попросить своего врача рассмотреть возможность проведения функциональных тестов легких.
Обратитесь за медицинской помощью, если у вас есть симптомы, которые, по вашему мнению, могут быть связаны с воздействием химических веществ.
вакансий в сфере углеводородов (ноябрь 2020 г.) — Последние вакансии в сфере углеводородов
Инженерное дело — машиностроение / автомобилестроение / промышленность (2)
ЭТО (2)
Нефтяной газ (2)
Машиностроение — Химическая промышленность (1)
Инженерия — Окружающая среда / Здоровье / Безопасность

 замещения (нитрование)
замещения (нитрование) разложения (дегидратация)
разложения (дегидратация) Контрольная работа по химии 10 класс.
Контрольная работа по химии 10 класс. Укажите два вещества, которые будут взаимодействовать с этаном
Укажите два вещества, которые будут взаимодействовать с этаном В схеме превращений CaCY веществами
В схеме превращений CaCY веществами  Сумма коэффициентов в уравнении горения бензола. В ответе укажите число.
Сумма коэффициентов в уравнении горения бензола. В ответе укажите число.
 Укажите два вещества, которые не взаимодействуют с этиленом
Укажите два вещества, которые не взаимодействуют с этиленом
 В ответе представьте число.
В ответе представьте число.
 Укажите название вещества, для которого характерна реакция гидрирования
Укажите название вещества, для которого характерна реакция гидрирования Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этана
Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этана За задание 1 балл
За задание 1 балл Укажите формулу вещества X в цепочке превращений С2Н5ОН → X →
Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → Перечислите области применения алкинов (2 балла)
Перечислите области применения алкинов (2 балла) Тестовые задания с выбором ответа. За задание 1 балл
Тестовые задания с выбором ответа. За задание 1 балл Укажите формулу вещества X в цепочке превращений С2Н6 → СН2 = СН2 → X
Укажите формулу вещества X в цепочке превращений С2Н6 → СН2 = СН2 → X Задания со свободным ответом
Задания со свободным ответом Укажите к какому классу относится углеводород с формулой С6Н6
Укажите к какому классу относится углеводород с формулой С6Н6 Укажите название реакции присоединения к ацетилену воды
Укажите название реакции присоединения к ацетилену воды Задача
Задача Укажите название вещества, для которого не характерна реакция гидратации
Укажите название вещества, для которого не характерна реакция гидратации Сколько литров кислорода потребуется для сжигания 8,4 г гексена
Сколько литров кислорода потребуется для сжигания 8,4 г гексена Укажите формулу вещества X в цепочке превращений СН4 → X → С2Н6
Укажите формулу вещества X в цепочке превращений СН4 → X → С2Н6 При написании используйте только структурные формулы
При написании используйте только структурные формулы Изомерия и гомология. Типы химических связей. Характерные химические свойства углеводородов. Способы получения углеводородов. Генетическая связь между классами углеводородов.
Изомерия и гомология. Типы химических связей. Характерные химические свойства углеводородов. Способы получения углеводородов. Генетическая связь между классами углеводородов.


 К пропущенному заданию вы можете вернуться после выполнения всей работы, если останется время.
К пропущенному заданию вы можете вернуться после выполнения всей работы, если останется время.
 Относительная плотность углеводорода по водороду равна 21. Найти молекулярную формулу углеводорода.
Относительная плотность углеводорода по водороду равна 21. Найти молекулярную формулу углеводорода.
 2=42 г/моль.
2=42 г/моль.

 Задания со свободным ответом
Задания со свободным ответом Укажите название изомера для вещества, формула которого СН3 — С = С – СН3
Укажите название изомера для вещества, формула которого СН3 — С = С – СН3 Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
Сколько в граммах паров воды образуется при сжигании 5,8 г бутана Укажите к какому классу относится УВ с формулой С6Н5 – СН3
Укажите к какому классу относится УВ с формулой С6Н5 – СН3 Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → СН3 – СН2 Cl
Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → СН3 – СН2 Cl Задача
Задача Укажите название вещества, для которого характерна реакция гидратации
Укажите название вещества, для которого характерна реакция гидратации Сколько литров кислорода потребуется для сжигания 8,4 г гексена
Сколько литров кислорода потребуется для сжигания 8,4 г гексена замещения (галогенирование)
замещения (галогенирование) разложения (дегидратация)
разложения (дегидратация)
 7 Ссылки
7 Ссылки  Автор фото: Лэнс Капрал. Мэтью К. Хакер
Автор фото: Лэнс Капрал. Мэтью К. Хакер Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
 То, что он ожидал, описывается следующим уравнением.
То, что он ожидал, описывается следующим уравнением.
 ) Для дальнейшей иллюстрации типичных различий между органическими и неорганическими соединениями, таблица 7.1 также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворителя, который используется для экстракции соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице 7.1.
) Для дальнейшей иллюстрации типичных различий между органическими и неорганическими соединениями, таблица 7.1 также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворителя, который используется для экстракции соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице 7.1.
 2 Введение в алканы
2 Введение в алканы  Другими словами, он не содержит двойных или тройных связей, которые обладают высокой реакционной способностью в органической химии. Хотя они не полностью лишены реакционной способности, их отсутствие реакционной способности в большинстве лабораторных условий делает их относительно неинтересным, но очень важным компонентом органической химии. Как вы узнаете позже, энергия, заключенная в углерод-углеродной связи и углерод-водородной связи, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Другими словами, он не содержит двойных или тройных связей, которые обладают высокой реакционной способностью в органической химии. Хотя они не полностью лишены реакционной способности, их отсутствие реакционной способности в большинстве лабораторных условий делает их относительно неинтересным, но очень важным компонентом органической химии. Как вы узнаете позже, энергия, заключенная в углерод-углеродной связи и углерод-водородной связи, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня. 7.3)
7.3)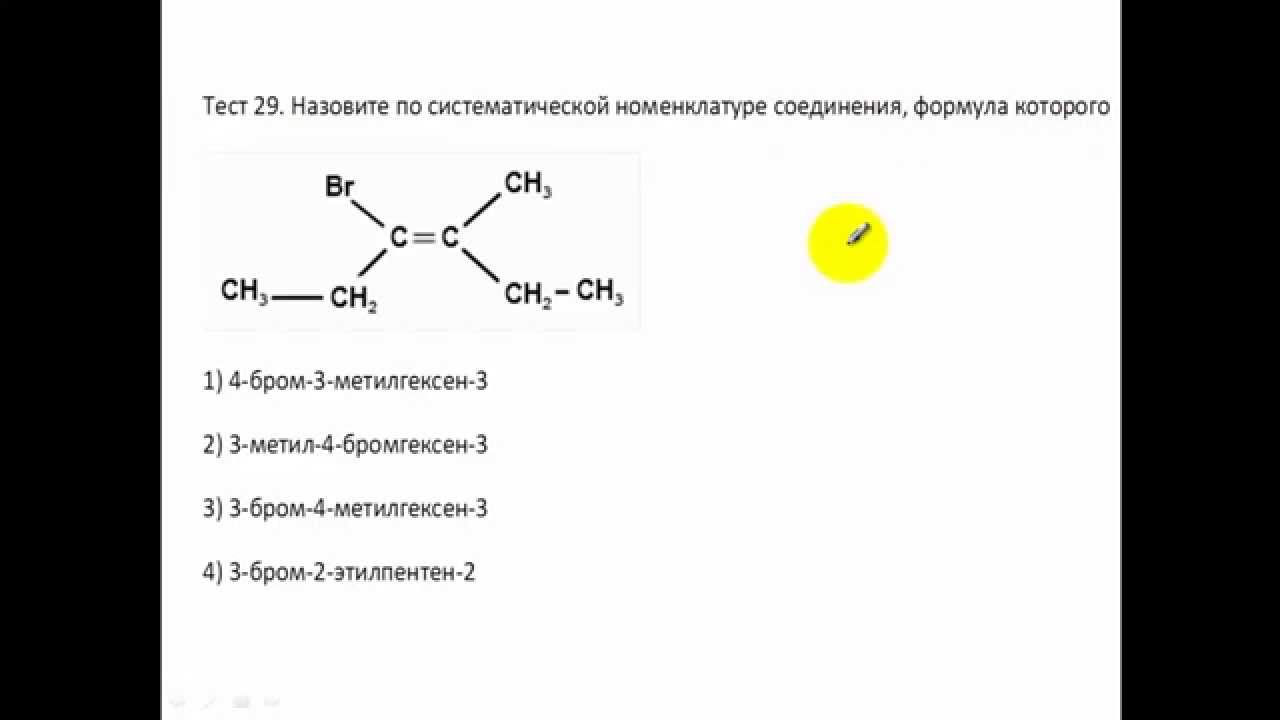 Таким образом, принцип гомологии придает организацию органической химии во многом так же, как периодическая таблица дает организацию неорганической химии.Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и на их основе вывести некоторые свойства других соединений в этом ряду.
Таким образом, принцип гомологии придает организацию органической химии во многом так же, как периодическая таблица дает организацию неорганической химии.Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и на их основе вывести некоторые свойства других соединений в этом ряду.
 Напомним, что соединения, имеющие ту же молекулярную формулу, но другое расположение в пространстве, называются структурными изомерами . Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Напомним, что соединения, имеющие ту же молекулярную формулу, но другое расположение в пространстве, называются структурными изомерами . Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
 Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линию, с группой CH 3 , идущей вниз от первого, присоединенной к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.
Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линию, с группой CH 3 , идущей вниз от первого, присоединенной к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.