
Алканы :
Алканы — это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула -
Физические свойства :
Химические свойства:
· Галогенирование
это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
Ch5 + 2O2 → CO2 + 2h3 O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
Сn Н2n +2 +(1,5n +0,5)O2 = n CO2 + (n +1)h3 O
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
Ch5 → C + 2h3(t > 1000 °C)
C2 H6 → 2C + 3h3
Алкены :
Алкены-это непредельные углеводороды, содержащие в молекуле, кроме одинарных связей, одну двойную углерод-углеродную связь.Формула- Cn h3n
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом –ен в его названии.
Физические свойства :
Химические свойства :
· Дегидратация -это процесс отщепления молекулы воды от молекулы органического соединения.
· Полимеризация -это химический процесс соединения множества исходных молекул низкомолекулярного вещества в крупные молекулы полимера.
Полимер -это высокомолекулярное соединение, молекулы которого состоят из множества одинаковых структурных звеньев.
Алкадиены :
Алкадиены -это непредельные углеводороды, содержащие в молекуле, кроме одинрных связей, дведвойные углерод-углеродные связи.Формула-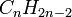 . Диены являются структурными изомерамиалкинов.
. Диены являются структурными изомерамиалкинов.
Физические свойства :
Бутадие́н — газ (tкип −4,5 °C), изопрен — жидкость, кипящая при 34 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ускорения вулканизации. Затем изделия нагревают — горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука. Вступают в реакции присоединения (гидрирование, галогенирование, гидрогалогенирование):
h3 C=CH-CH=Ch3 + h3 -> h4 C-CH=CH-Ch4
Алкины :
Алкины-этонепредельные углеводороды молекулы которых содержат, помимо одинарных связей, одну тройную углерод-глеродную связь.Формула-Cn h3n-2
Физические свойства :
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4 ) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше — в органических растворителях.
Химические свойства :
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
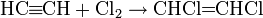
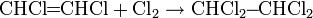
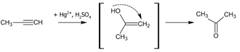
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов)
www.ronl.ru
КОНТРОЛЬНАЯ РАБОТА № 1 по теме: «АЛКАНЫ» (10 класс)
Вариант 1
ЧАСТЬ А
При выполнении заданий этой части для каждого задания (А1 – А10) запишите цифру, которая соответствует номеру выбранного вами ответа.
Задание A1
Общая формула циклоалканов
1) Сnh3n–6
2) Cnh3n–2
3) Cnh3n
4) Cnh3n+2
Задание A2
Название углеводорода, формула которого C5h22
1) этан
2) пентан
3) бутан
4) пропан
Задание A3
Изомером октана является:
1) 2,3-диметилгептан;
2) 2,3-диметилбутан;
3) 2,3-диметилпентан;
4) 2,3-диметилгексан.
Задание A4
Молекулярная формула бутана
1) Сh5
2) C3H6
3) C4h20
4) C4H8
Задание A5
Гомологом 2,4-диметилоктана является:
1) 2,5-диметилгептан;
2) 3,3-диметилбутан;
3) 2,3-диметилпентан;
4) 2,4-диметилгексан.
Задание A6
Процесс разложения углеводородов нефти на более летучие вещества называется
1) крекинг
2) дегидрирование
3) гидрирование
4) дегидратация
Задание A7
Пропан реагируют
1) с водой
2) с раствором KMnO4
3) с водородом
4) с хлором
Задание A8
Сумма коэффициентов в уравнении реакции полного сгорания этана равна
1) 10
2) 9
3) 19
4) 16
Задание A9
Известно термохимическое уравнение горения метана Ch5 + 2O2 → CO2 +2h3O + 896 кДж. Какое количество метана расходуется при выделении 89,6 кДж теплоты?
1) 0,1 моль
2) 0,2 моль
3) 0,25 моль
4) 0,5 моль
Задание A10
Реакция горения алкана
1) 2C3H6 + 9О2 6 CО2 +6 h3О
2) 2С2h3 +5О2 4CО2 + 2h3О
3) C3H8+ 5О2 3CО2 +4 h3О
4) С2h5 +3О2 2CО2 + 2h3О
ЧАСТЬ В
Ответом к заданиям этой части (В1 – В2) является набор чисел и букв, которые следует записать как соответствия, например: 1-А, 2-Д, 3-Г, 4-В.
Задание B1
Установите соответствие между формулой органического вещества и названием , принадлежащим ему.
ФОРМУЛА
1) СН3 - СН - СН2 - СН2 - СН3
|
СН3
2) СН3 - СН2 - СН2 - СН2 - Ch3 - Ch4
3) СН3 - СH - Ch4 - СН3
|
СН3
4) СН3 - СН - СН - СН2 - Ch3 - Ch4
| |
НАЗВАНИЕ ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА
А) 2 - метилбутан
Б) 2 - метилпентан
В) 2 - метил - 3 - этилгексан
Г) гексан
СН3 С2Н5
Задание B2
Установите соответствие между названием вещества и формулой его гомолога.
НАЗВАНИЕ ВЕЩЕСТВА ФОРМУЛА ГОМОЛОГА
1) циклопентан A) СН3
|
Н3С − С −СН2 − СН3
|
СН3
2) 2,4-диметилгептан Б) Ch4 – CH – Ch3 – CH – Ch4
||
Ch4Ch4
3) Изобутан (2-метилпропан) В) Ch3 – Ch3
||
Ch3 – Ch3
4) 2,2-диметилгексан Г) Ch4 – Ch3 – CH – Ch4
|
Ch4
ЧАСТЬ С
При ответе на задания этой части запишите полный ответ
Задание C1
Составьте структурную формулу органического вещества
2,2,4 – триметилгексана.
Задание C2
При полном сгорании циклического углеводорода образовался оксид углерода (IV) массой 3,52 г и вода массой 1,44 г. Относительная плотность этого углеводорода по воздуху равна 1,448. Найдите молекулярную формулу углеводорода.
Примерное распределение времени, отводимое на выполнение отдельных заданий составляет:
для каждого задания части 1–1-2 минуты;
для каждого задания части 2 – 5-7 минут;
для каждого задания части 3 – до 10-12 минут.
Оценки за тестовый вариант контрольной работы:
10 - 13 баллов – оценка «3».
14-17 баллов – оценка «4»
18-21 балл – оценка «5».
ОТВЕТЫ (Вариант 1):
№
Вариант ответа
Оценка
A1
3
1
A2
2
1
A3
4
1
A4
3
1
A5
4
1
A6
1
1
A7
4
1
A8
3
1
A9
1
1
A10
3
1
B1
БГАВ
2
B2
ВБГА
2
С1
СН3
|
Н3С − С −СН2 − СН−СН2 − СН3
| |
СН3 СН3
2
С2
1.Составим схему горения неизвестного углеводорода, представив его формулу в виде CxHy.
CxHy + O2 → CO2 + h3O
2. 44 г/моль CO2 содержит 12 г/моль C
3,52 г CO2 содержит y г C
m(C) = 0,96 г
3. 18 г/моль h3O содержит 2 г/моль H
1,44 г h3O содержит х г H
m(H) = 0,16 г
4. ν(C) = m(C)/M(C)
ν(C) = 0,96 г/12 г/моль
ν(C) = 0,08 моль
5. ν(H) = m(H)/M(H)
ν(H) = 0,16 г/1 г/моль
ν(H) = 0,16 моль
6. ν(C): ν(H) =0,08 моль : 0,16 моль (: 0,08 моль)
C: H=1:2
Ch3 –простейшая формула углеводорода
M(Ch3)= 12+2=14 г/моль
7. M(CxHy) = D(возд.) ×M(возд.)
M(CxHy) = 1,448 × 29 г/моль = 42 г/моль
8. . n= M(CxHy) / M(Ch3)= 42 г/моль: 14 г/моль=3
9. C3H6 формула циклического углеводорода- циклопропана.
Ответ: C3H6 - циклопропан.
5
infourok.ru
САНКТ-ПЕТЕРБУРГСКИЙ ФАРМАЦЕВТИЧЕСКИЙ ТЕХНИКУМ
ЦМК Фармацевтическая химия
Контрольная работа №1 по органической химии
ДЛЯ ФАРМАЦЕВТОВ,
Обучающихся по специальности 33.02.01. «Фармация», по сокращенной общеобразовательной программе с элементами дистанционных технологий
Тема «Углеводороды: алканы, алкены, алкины, арены»
Контрольная разработана:
Якубаускене И.В.
Шевкина А.А
Недобежкина Т.М.
Санкт-Петербург- 2016 г
Методические рекомендации к выполнению работы
Контрольная работа ставит своей целью выявить и обобщить знания студентов по теме «Углеводороды: алканы, алкены, алкины, арены»
При подготовки к контрольной студенты пользуются материалами установочных лекций, а также с методическими пособиями, предложенными фармацевтическим техникумом. Студенты могут использовать при подготовки и другие интернетресурсы.
Перед написанием контрольной работы студент должен ознакомится с методическими рекомендациями по написанию данной контрольной работы
Контрольная работа оформляется в соответствии с требованиями по написанию контрольных работ. (смотри общие документы). Выполнение контрольной работы по химии проводится в формате «рабочей тетради»
Сроки выполнения работы, ФИО, адрес преподавателя, проверяющего контрольную работу, указаны в рекомендациях требованиях по написанию контрольных работ, а также уточняются у лектора на установочных лекциях.
В работу включены следующие задания:
1. Какие соединения называются изомерами? Дайте определение. Приведите примеры структурных изомеров:
2. Какие частицы называются радикалами? Дайте определение. Напишите структурные формулы всех радикалов:
3. Напишите графические формулы следующих веществ:
4. Составьте уравнения реакций:
5. Напишите уравнения реакций, с помощью которых можно получить:
6. Составьте уравнения реакций, характеризующих химические свойства:
7. Напишите уравнения реакций, с помощью которых можно получить:
8. Составьте уравнения реакций.
9. Напишите уравнения реакций, с помощью которых можно получить:
10. Напишите уравнения реакций, характеризующих химические свойства:
10. Напишите уравнения реакций, характеризующих химические свойства:
11. Напишите уравнения реакций, с помощью которых можно получить:
12. Напишите уравнения реакций к следующим схемам:
Оформление титульного листа
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РФ
Государственное бюджетное образовательное учреждение высшего профессионального образования
САНКТ-ПЕТЕРБУРГСКАЯ ГОСУДАРСТВЕННАЯ ХИМИКО-ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ
ФАРМАЦЕВТИЧЕСКИЙ ТЕХНИКУМ
ЦМК фармацевтической химии
номер группы
Контрольная работа № по _____
______________
название дисциплины
Тема работы:
Вариант №______
Выполнил:______________________
(ФИО полностью)
______________________
Город
_____________________
Преподаватель:
Санкт-Петербург,
2016 г.
Контрольная работа № 1. Тема « Углеводороды: алканы, алкены, алкины, арены»
1. Какие соединения называются изомерами? Дайте определение. Приведите примеры изомеров:
Вариант № 1 – алканов на примере пентана;
Вариант № 2 – алкинов на примере гексина-2;
Вариант № 3 – алкенов на примере пентена-2;
Вариант № 4 – аренов на примере диэтилбензола;
Вариант № 5 – алканов на примере гексана;
Вариант № 6 – алкинов на примере гептина-3;
Вариант № 7 – алкенов на примере гексена-3
2. Какие частицы называются радикалами? Дайте определение. Напишите структурные формулы всех радикалов:
Вариант № 1 – бутана;
Вариант № 2 – пропана;
Вариант № 3 – изобутана;
Вариант № 4 –неопентана;
Вариант № 5 –пентана;
Вариант № 6 –изопентана;
Вариант № 7 –изобутана;
3. Напишите графические формулы следующих веществ:
Вариант № 1
а) 2,3-диметилпентан;
б) 3,5-диметил-4-этилгексен-2;
в) 2,5-диметил-5-этилгептин-3;
г) п-трет.бутилметилбензол;
Вариант № 2
а) 2,2-диметил-3-этилгептан;
б) 2,3-диметилбутен-2;
в) 4-трет.бутил-3-изопропилгептин-1;
г) о-метилизопропилбензол;
Вариант № 3
а) 5-изопропил-2,8-диметил-3-этилнонан;
б) 2,3,4-триметилпентен-1;
в) 2,2,5-триметилгексин-3;
г) 1-метил-3-изопропилбензол;
Вариант № 4
а) 2,2, 3 – триметилпентен – 3;
б) 2,4,5,5-тетраметил-3-этилоктан;
в) 1, 3 – диметилбензол;
г) 4-трет.бутил-3-изопропилгептин-1;
Вариант № 5
а) 2,3,4 – триметил – 4 – этилгептан;
б) 3,3 – дихлор – 4-изопропилоктен – 1;
в) 4-трет.бутил – 3 – этилнонин – 1;
г) толуол:
Вариант № 6
а) 2,2 – диметил – 3 – этилпентан;
б) 3- втор. бутил – 2 – метилгептен – 1;
в) 3,4,5,6 – тетрахлоргептин – 1;
г) 1-метил-3-изопропилбензол;
Вариант № 7
а) 4,4 – дибром - 2,3 – диэтилпентан
б) 3,5-диметил-4-этилгексен-2;
в) 2,5-диметил-5-этилгептин-3;
г) о-метилизопропилбензол;
4. Составьте уравнения реакций:
Вариант № 1 – нитрование пропана;
Вариант № 2 –изомеризация пентана;
Вариант № 3 – хлорирование изобутана;
Вариант №4 – дегидрирование гексана;
Вариант №5 – бромирование метана;
Вариант №6 – изомеризация гексана;
Вариант №7 – нитрование этана;
Укажите условия протекания реакций и названия продуктов.
5. Напишите уравнения реакций, с помощью которых можно получить:
Вариант № 1 – этан;
Вариант № 2 – пропан;
Вариант № 3 – бутан;
Вариант № 4 – изобутан;
Вариант №5 – пентан;
Вариант №6 – 2-метилбутан;
Вариант № 7 – изопентан;
Укажите условия протекания реакций и названия исходных веществ.
6. Составьте уравнения реакций :
Вариант № 1 – бромирование бутена-2;
Вариант № 2 –гидрогалогенирование пентена-1;
Вариант № 3 –окисление пропена водным раствором перманганата калия;
Вариант №4 –дегидрирование 2-метилбутена-1;
Вариант №5 – гидрогалогенирование пропена;
Вариант № 6 – хлорирование пентена-2;
Вариант №7– гидрирование пропена;
Укажите условия протекания реакций и названия продуктов.
7. Напишите уравнения реакций, с помощью которых можно получить:
Вариант № 1 – 2-метилбутен-2;
Вариант № 2 – бутен-1;
Вариант № 3 – пропен;
Вариант № 4 – бутен-2;
Вариант №5 – 3-метилпентен-2;
Вариант №6 – 3,3- диметилпентен-1;
Вариант № 7 – этен;
Укажите условия протекания реакций и названия исходных веществ.
8. Составьте уравнения реакций.
Вариант № 1 – гидрирование бутина-1;
Вариант № 2 – гидратация ацетилена;
Вариант № 3 – бромирование бутина-2;
Вариант № 4 – Тримеризация этина;
Вариант № 5 –гидрогалогенирование бутина-2
Вариант № 6– гидратация пропина;
Вариант №7– гидрирование пентина-1;
Укажите условия протекания реакций и названия продуктов.
9. Напишите уравнения реакций, с помощью которых можно получить:
Вариант № 1 – бутин-2;
Вариант № 2 – 3-метилпентин-1;
Вариант № 3 – пропин;
Вариант № 4 – бутин-1;
Вариант №5 – 4-метилпентин-2;
Вариант №6 – 3- метилбутин-1;
Вариант № 7 – этин;
Укажите условия протекания реакций и названия исходных веществ.
10. Напишите уравнения реакций:
Вариант № 1 – галогенирование этилбензола;
Вариант № 2 – галогенирование изопропилбензола;
Вариант № 3 – нитрование пропилбензола;
Вариант № 4 – сульфирование толуола;
Вариант №5 – окисление метилбензола;
Вариант №6 –гидрирование бензола;
Вариант № 7 – алкилирование бензола;
Укажите условия протекания реакций и названия продуктов.
11. Напишите уравнения реакций, с помощью которых можно получить:
Вариант № 1 – метилбензол;
Вариант № 2 – бензол;
Вариант № 3 – бензойную кислоту;
Вариант № 4 –толуол;
Вариант №5 – бромбензол;
Вариант №6 – нитробензол;
Вариант № 7 –тринитротолуол;
Укажите условия протекания реакций и названия исходных веществ.
12. Напишите уравнения реакций к следующим схемам:
Вариант № 1
а) метан → бутан → метилпропан;
б) бензол → толуол → 2,4,6-тринитротолуол;
Вариант № 2
а) метан → этан → бутан → изобутан;
б) ацетилен → этилен → этанол;
Вариант № 3
а) метан → этан → бромэтан → пропан;
б) карбид кальция → ацетилен → бензол → толуол;
Вариант № 4
а) Этан → хлорэтан → бутан → изобутан;
б) Гексан 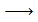 бензол
бензол  этилбензол;
этилбензол;
Вариант №5
а) бензол →  толуол →
толуол →  2,4,6-трибромтолуол;
2,4,6-трибромтолуол;
б) бутан 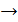 бутен-1
бутен-1 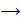 1,2 – дихлорбутан → бутин-1
1,2 – дихлорбутан → бутин-1
Вариант №6
а) ацетилен → бензол → толуол → бензойная кислота;
б) карбид кальция → этин → 1,1,2,2 тетрахлорэтан;
Вариант № 7
а) этан → бромэтан → этен → 1,2-дибромэтан;
б) ацетилен → бензол → нитробензол;
Укажите условия протекания реакций.
megalektsii.ru