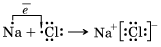 Ответ: ________________________________________.
Ответ: ________________________________________.Контрольная работа по теме «Химическая связь»
В а р и а н т 1
1. Тип химической связи в соединении Н2О:
а) ковалентная неполярная б) ионная в) ковалентная полярная
г) металлическая
2. Наиболее электроотрицательный химический элемент:
а) Br б) Cl в) I г) P
3. Заряд иона кальция:
а) 2+ б) 3+ в) 2- г) 3-
4. Завершенный внешний электронный слой имеет атом химического элемента:
а) Не б) Na в) S г) Н
5. Число общих электронных пар между атомами в молекуле О2 равно:
а) 1 б) 2 в) 3 г) 4
6. Ковалентная неполярная связь образуется между:
а) атомами одного неметалла б) атомами разных неметаллов
в) активными металлами и неметаллами г) между атомами металла
7. Сущность ионной связи состоит:
а) в электростатическом притяжении между разноименными зарядами
(ионами)
б) в образовании общих электронных пар
в) в электростатическом притяжении между положительными ионами и
электронами
г) в притяжении между молекулами
8. Электроотрицательность химических элементов в периодах с увеличением
порядкового номера элемента:
а) увеличивается б) уменьшается
в) сначала увеличивается, затем уменьшается г) не изменяется
9. К правильным утверждениям относятся:
а) соединяясь между собой, атомы стремятся к достижению устойчивого
состояния
б) причиной инертности гелия и неона является газообразное состояние
в) ковалентная связь возникает между атомами активных металлов и
неметаллов
г) между калием и хлором образуется ионная связь
10. В периоде слева направо радиус атома и металлические свойства
соответственно:
а) увеличивается и увеличиваются б) уменьшается и увеличиваются
в) увеличивается и уменьшаются г) уменьшается и уменьшаются
11. Внешний уровень считается завершенным (кроме водорода и гелия), если на
нем:
а) 2 электрона б) 1 электрон в) 7 электронов г) 8 электронов
12. Образование молекулы водорода из атомов, можно изобразить:
а) H + H → H • H б) H + • H → H •• H
в) H • + H → H • H г) H • + • H → H •• H
13. В какой молекуле тройная связь?
а) N2 б) Cl2 в) О2 г) Н2
14. Выберите элемент с переменной валентностью:
а) Cl б) K в) Al г) Na
15. При образовании ковалентной полярной связи электронная пара:
а) смещена влево б) смещена вправо
в) равноценна между всеми атомами
г) смещена к более электроотрицательному элементу
16. В каком соединении валентность железа равна III?
а) Fe3O4 б) FeO в) Fe2O3 г) FeO3
17. Ковалентная полярная связь образуется между:
а) между различными атомами металла
б) одинаковыми атомами неметаллов
в) различными атомами неметаллов
г) между атомами металла и неметалла
18. Напишите электронную и электронно-графическую формулы для атома Са.
Укажите валентность элемента.
19. Запишите электронные и графические схемы образования молекулы HCl.
20. В ряду элементов: Al Si P S:
а) увеличивается число электронных слоев в атомах;
б) усиливаются неметаллические свойства;
в) уменьшается число внешних электронов в атомах;
г) возрастают радиусы атомов.
Контрольная работа по теме «Химическая связь»
В а р и а н т 2
1. Тип химической связи в молекуле азота (N2):
а) ковалентная неполярная б) ионная
в) ковалентная полярная г) металлическая
2. Наиболее электроотрицательный химический элемент:
а) С б) P в) Н г) Cl
3. Заряд иона алюминия:
а) 2+ б) 3+ в) 2- г) 3-
4. Незавершенный внешний электронный слой имеет атом химического
элемента:
а) Не б) Na в) Ar г) Ca
5. Число электронов внешнего электронного слоя, принадлежащих только
одному атому кислорода в молекуле О2 равно:
а) 1 б) 2 в) 4 г) 6
6. Ионная связь образуется между:
а) атомами одного неметалла б) атомами разных неметаллов
в) активными металлами и неметаллами г) атомами одного металла
7. Сущность ковалентной полярной связи состоит:
а) в электростатическом притяжении между разноименными зарядами
(ионами)
б) в образовании общих электронных пар
в) в электростатическом притяжении между положительными ионами и
электронами
г) в притяжении между молекулами
8. В группе галогенов (VII A) электроотрицательность с увеличением
порядкового номера элементов:
а) увеличивается б) уменьшается
в) сначала увеличивается, затем уменьшается г) не изменяется
9. Нельзя отнести к правильным суждения:
а) завершенные электронные слои в атомах инертных газов
б) образование химической связи приводит к уменьшению потенциальной
энергии образования молекулы
в) ионная связь возникает между активными металлами и неметаллами
г) в периодах с увеличением порядкового номера электроотрицательность
падает
10. Атомы металлов, при образовании ионной связи:
а) отдают электроны б) принимают электроны
в) удваивают число электронов г) не меняются
11. В группах А сверху вниз заряд ядра и металлические свойства
соответственно:
а) увеличивается и увеличиваются б) уменьшается и уменьшаются
в) увеличивается и уменьшаются г) уменьшается и увеличиваются
12. В результате образования ковалентной связи объединяются:
а) спаренные электроны б) неспаренные электроны
в) ионы и неспаренные электроны г) различные ионы
13. Выберите молекулу с ковалентной неполярной связью:
а) P2O5 б) CO2 в) F2 г) CS2
14. Выберите пару, в которой первый элемент более электроотрицательный, чем второй:
а) С и Cl б) F и O в) P и O г) Si и S
15. Выберите элемент с постоянной валентностью:
а) C б) N в) Mg г) Fe
16. Выберите молекулу с ковалентной полярной связью:
а) N2 б) P4 в) h3 г) CO2
17. Укажите название химического элемента по электронной схеме атома:
2ē, 8ē, 5ē
18. Напишите электронную и электронно-графическую формулы для атома As.
Укажите валентность элемента.
19. Запишите электронные и графические схемы образования молекулы h3S.
20. В ряду химических элементов Na – Mg – Al:
а) уменьшается заряд ядер атомов;
б) увеличивается число электронов во внешнем энергетическом уровне;
в) уменьшается радиус атомов;
г) уменьшается электроотрицательность; усиливаются металлические
свойства
Контрольная работа по теме «Химическая связь»
В а р и а н т 3
1. Тип химической связи в соединении LiF:
а) ковалентная неполярная б) ионная
в) ковалентная полярная г) металлическая
2. Наиболее электроотрицательным является химический элемент:
а) Si б) B в) O г) S
3. Заряд иона серы в соединении с натрием равен:
а) 2+ б) 0 в) 2- г) 4-
4. Причина образования химической связи:
а) стремление приобрести устойчивую электронную структуру
б) стремление к уменьшению потенциальной энергии молекул
в) стремление к увеличению потенциальной энергии
г) притяжение между атомами
5. Число общих электронных пар между атомами азота в молекуле N2 равно:
а) 1 б) 2 в) 3 г) 4
6. Сущность ковалентной неполярной связи состоит:
а) в электростатическом притяжении между разноименными зарядами
б) в образовании общих электронных пар
в) в электростатическом притяжении между положительными ионами и
свободными электронами
г) в притяжении между молекулами
7. В ряду элементов P – S – N – F электроотрицательность изменяется
следующим образом:
а) увеличивается б) уменьшается
в) сначала увеличивается, затем уменьшается г) не изменяется
8. К правильным относятся утверждения:
а) причиной инертности гелия, неона, аргона является наличие завершенного
внешнего энергетического уровня
б) неполярная ковалентная связь образуется между атомами разных неметаллов
в) в периодах с увеличением порядкового номера элемента
электроотрицательность увеличивается
г) между натрием и хлором образуется металлическая химическая связь
9. Типичные металлы - это элементы:
а) I A группы б) VIII A группы в) II A группы г) I Б группы
10. У элементов с каким порядковыми номерами возможно образование ионной
связи?
а) 3 и 9 б) 5 и 17 в) 6 и 8 г) 1 и 8
11. Ион - это:
а) положительно заряженная частица б) отрицательно заряженная частица
в) положительно или отрицательно заряженная частица г) нейтральный атом
12. Ковалентная неполярная связь образуется между:
а) между атомами металла и неметалла б) различными атомами неметалла
в) между атомами различных неметаллов г) одинаковыми атомами неметалла
13. Если объединяются по два неспаренных электрона от каждого атома, то
образуется связь: а) ионная б) одинарная в) двойная г) тройная
14. Электротрицательность:
а) увеличивается по периоду слева направо
б) уменьшается по периоду слева направо
в) увеличивается в главных группах сверху вниз
г) уменьшается в группах снизу вверх
15. Чему равна валентность Р в соединении Р2O5?
а) V б) III в) VI г) II
16. Отметьте верные утверждения:
а) побочные группы образованы только металлами
б) номер группы показывает, как правило, число электронов на внешнем уровне
в) большими являются 3 - 7-й периоды
г) с увеличением атомного номера в периодах металлические свойства простых веществ уменьшаются, неметаллические - увеличиваются
17. Относительная молекулярная масса правильно указана в следующих случаях:
а) Mr(NO) = 30 б) Mr(Cl2) = 71 в) Mr(HCl) = 36,5 г) Mr(h3S) = 36
18. Напишите электронную и электронно-графическую формулы для атома Sr.
Укажите валентность элемента.
19. Запишите электронные и графические схемы образования молекулы Nh4.
20. Распределение электронов по электронным слоям: 2; 8; 8; 1 соответствует атому, расположенному
а) в 4 периоде, IVА группе б) в 3 периоде, IVА группе
в) в 4 периоде, IА группе г) в 3 периоде, IА группе
Контрольная работа по теме «Химическая связь»
В а р и а н т 4
1. Тип химической связи в соединении, имеющем формулу СН4:
а) ковалентная неполярная б) ионная
в) ковалентная полярная г) металлическая
2. Наиболее электроотрицательный химический элемент:
а) О б) S в) Se г) Te
3. Заряд иона кислорода равен:
а) 2- б) 2+ в) 0 г) 4+
4. Молекулы благородных газов одноатомны. Причина этого в следующем:
а) атомы газов отталкиваются друг от друга
б) их внешний электронный слой завершен
в) у их атомов незавершенный внешний электронный слой
г) их внешние электронные слои находятся близко к ядру
5. Ковалентная полярная связь образуется между:
а) атомами одного неметалла б) атомами разных неметаллов
в) активными металлами и неметаллами г) атомами металла
6. Число электронов внешнего слоя, принадлежащих только одному атому азота в
молекуле N2, равно:
а) 1 б) 2 в) 4 г) 6
7. В ряду элементов O – Cl – C – H электроотрицательность изменяется
следующим образом:
а) увеличивается б) уменьшается
в) сначала увеличивается, затем уменьшается г) не изменяется
8. Электроотрицательность химических элементов в группах сверху вниз:
а) увеличивается б) уменьшается
в) сначала увеличивается, затем уменьшается г) не изменяется
9. Нельзя отнести к правильным утверждения:
а) полярность химической связи объясняется различной
электроотрицательностью элементов, образующих ее
б) в периодах с увеличением порядкового номера элемента
электроотрицательность увеличивается
в) у атомов инертных газов внешний электронный слой завершен
г) все утверждения верны
10. У благородных газов:
а) внешний уровень завершен
б) не хватает 1-го электрона до завершения внешнего уровня
в) внешний уровень не завершен
г) не хватает 8-ми электронов до завершения внешнего уровня
11. При образовании ионной связи соединяются:
а) ионы Ме и ионы неМе б) атомы Ме и ионы неМе
в) ионы Ме и атомы неМе г) атомы Ме и атомы неМе
12. В какой молекуле двойная связь?:
а) Н2 б) Cl2 в) N2 г) О2
13. Какая связь самая прочная?
а) неполярная б) одинарная в) двойная г) тройная
14. При образовании ковалентной неполярной связи общая электронная пара:
а) смещена к более электроотрицательному атому б) смещена вправо
в) равноценна для двух атомов г) смещена влево
15. В каком соединении валентность Mn максимальна?
а) MnO б) Mn2O3 в) MnO2 г) Mn2O7
16. Отметьте правильные утверждения:
а) по периоду основные свойства ослабевают, а кислотные усиливаются
б) все элементы в периодической таблице расположены в соответствии с увеличением относительных атомных масс
в) каждый химический элемент имеет свой атомный номер, находится в определённом периоде и в определённой группе таблицы
г) атомы элементов одной группы имеют подобные свойства
17. Найдите соответствие:
а) Na 1) ковалентная полярная
б) NaCl 2) ковалентная неполярная
в) F2 3) ионная
г) h3O 4) металлическая
18. Напишите электронную и электронно-графическую формулы для атома Br. Укажите
валентность элемента.
19. Запишите электронные и графические схемы образования молекулы h3O.
20. Схема электронного строения соответствует веществу, формула которого
В
..
: А : В
..
В
а) Ch5 б) AlCl3 в) Nh4 г) SO3
infourok.ru
ГУО «Гимназия №2 г. Бреста»
Город Брест, Беларусь
Контрольная работа по теме «Химическая связь»
8 класс
Подготовила:
Учитель химии
Рудич Лариса Викторовна
Брест, 2010г
Текст заголовка
Рудич Лариса Викторовна,
учитель химии
2 категории
ГУО «Гимназия №2 г. Бреста»
Город Брест, Беларусь
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 1
Уровень
Задание
I
II
III
IV
V
Выпишите формулы веществ с ионной связью: NaCl, Cl2, Nh4, HCl, CaO, Ag, CO2, P4.
Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: HCl, Cl2.
Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель:
А) Ca+HCl→…+…;
Б) S+O2→…;
В) Mg(NO3)2→ MgO+NO2+O2.
Cоставьте уравнение горения железа в кислороде. Определите окислитель и восстановитель. Рассчитайте объём кислорода, который потребуется для сжигания 112г железных стружек.
По схеме реакции Cu+HNO3→Cu(NO3)2+NO+h3O рассчитайте массу окислителя, который потребуется для окисления восстановителя массой 768г.
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 2
Уровень
Задание
I
II
III
IV
V
Выпишите формулы веществ с ковалентной полярной связью: NaCl, Cl2, Nh4, HCl, CaO, Ag, CO2, P4.
Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: CaO, h3.
Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель:
А) I2+h3→…;
Б) Na+O2→…;
В) SO2+h3S→S+h3O.
Составьте уравнение взаимодействия магния с соляной кислотой. Определите окислитель и восстановитель. Рассчитайте массу соляной кислоты, которая потребуется для полного растворения 72г магния.
По схеме реакции HI+h3SO4→I2+S+h3O рассчитайте массу восстановителя, который потребуется для восстановления окислителя массой 784г.
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 3
Уровень
Задание
I
II
III
IV
V
Выпишите формулы веществ с ионной связью: NaBr, HCl, h3S, h3O, CaO, Ag, CaCl2, h3.
Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: HCl, N2.
Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель:
А) Al+O2→…;
Б) Mg+HCl→…+…;
В) h3S+FeCl3→FeCl2+S+HCl.
Cоставьте уравнение горения алюминия в кислороде. Определите окислитель и восстановитель. Рассчитайте объём кислорода, который потребуется для сжигания 189г алюминиевых стружек.
По схеме реакции Ag+HNO3→AgNO3+NO2+h3O рассчитайте массу окислителя, который необходим для полного окисления восстановителя массой 324г.
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 4
Уровень
Задание
I
II
III
IV
V
Выпишите формулы веществ с ковалентной полярной связью: NaI, Cl2, Nh4, HCl, h3S, Ag, CO, Ph4.
Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: NaCl, O2.
Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель:
А) Cl2+h3→…;
Б) Ca+O2→…;
В) Si+KOH+h3O→K2SiO3+h3↑.
Составьте уравнение взаимодействия магния с серной кислотой. Определите окислитель и восстановитель. Рассчитайте массу серной кислоты, которая потребуется для полного растворения 288г магния.
По схеме реакции S+h3SO4→SO2+h3O рассчитайте химическое количество восстановителя, который необходим для восстановления окислителя массой 686г.
doc4web.ru
Контрольная работа
Химическая связь
Вариант 1
Из приведенного перечня выберите химические формулы веществ с ионным типом связи: Ca, NaCl, P2O5, N2, Fe2O3
Определите степени окисления атомов каждого элемента в химических соединениях: N2, Sih5, BaSO4, MnO2, HCl, Li.
Укажите соединение с ковалентной неполярной связью.
В схеме химической реакции Fe + Cl2→FeCl3расставьте коэффициенты; укажите окислитель и восстановитель, составьте схемы процессов окисления и восстановления, схему перехода атомов.
Составьте формулы веществ из следующих ионов: Na+, Al3+, SO42-, NO3-. Дайте названия этим соединениям и укажите степени окисления всех атомов, входящих в их состав.
а) Составьте уравнение реакции взаимодействия кислорода с литием. Укажите окислитель и восстановитель. Составьте схемы процессов окисления и восстановления.
б) Вычислите объём кислорода, который необходим для взаимодействия с 3,5 г. металла, согласно составленной реакции.
Контрольная работа
Химическая связь
Вариант 2
Из приведенного перечня выберите химические формулы веществ с ионным типом связи: Cl2, K2O, CO2, Fe, CaI2.
Определите степени окисления атомов каждого элемента в химических соединениях: Nh4, O2, Ca(OH)2, Al2(SO4)3, Mg, CO2.
Укажите соединения с ковалентной неполярной связью.
В схеме химической реакции h3+ Br2→HBr расставьте коэффициенты; укажите окислитель и восстановитель, составьте схемы процессов окисления и восстановления, схему перехода атомов.
Составьте формулы веществ из следующих ионов: .K+, Fe3+, CO32-, Cl-Дайте названия этим соединениям и укажите степени окисления всех атомов, входящих в их состав.
а) Составьте уравнение реакции взаимодействия кислорода с натрием. Укажите окислитель и восстановитель. Составьте схемы процессов окисления и восстановления.
б) Вычислите объём кислорода, который необходим для взаимодействия с 2,3 г. металла, согласно составленной реакции.
Контрольная работа
Химическая связь
Вариант 3
Из приведенного перечня выберите химические формулы веществ с ионным типом связи: HBr, NaI, CaO, N2, Cu.
Определите степени окисления атомов каждого элемента в химических соединениях: h3SO3, Cl2O7, h3, Na, Cu(NO3)2, SiO2.
Укажите соединения с ковалентной неполярной связью.
В схеме химической реакции P + O2→P2O5расставьте коэффициенты; укажите окислитель и восстановитель, составьте схемы процессов окисления и восстановления, схему перехода атомов.
Составьте формулы веществ из следующих ионов: Li+, Ca2+, S2-, PO43-. Дайте названия этим соединениям и укажите степени окисления всех атомов, входящих в их состав.
а) Составьте уравнение реакции взаимодействия кислорода с серой. Укажите окислитель и восстановитель. Составьте схемы процессов окисления и восстановления.
б) Вычислите объём кислорода, который необходим для взаимодействия с 6,4 г. неметалла, согласно составленной реакции.
Контрольная работа
Химическая связь
Вариант 4
Из приведенного перечня выберите химические формулы веществ с ионным типом связи: h3O, KOH, I2, Ba, CaSO4.
Определите степени окисления атомов каждого элемента в химических соединениях: Fe(NO3)2, HBr, Al, F2, BaCl2, N2O5.
infourok.ru
К.р.№2 «Химическая связь. Строение вещества»
Вариант 1
1.Составьте образование ковалентной связи в молекуле Ph4
2.Составьте образование ионной связи в молекуле NaCl
3.Определить степень окисления элементов: NO2, NO, N2O, h4N
4.Составьте формулы следующих соединений: CaCl, PO, AlCl, NaO
5.Дайте определение термину ковалентная связь.
К.р.№2 «Химическая связь. Строение вещества»
Вариант 2
1.Составьте образование ковалентной связи в молекуле NCl3
2.Составьте образование ионной связи в молекуле CaCl2
3.Определить степень окисления элементов: MgO, CO2, Sih5, h4P
4.Составьте формулы следующих соединений: HO, HS, HCl, HP
5.Дайте определение термину электронная формула молекулы.
К.р.№2 «Химическая связь. Строение вещества»
Вариант 3
1.Составьте образование ковалентной связи в молекуле SO3
2.Составьте образование ионной связи в молекуле Al2S3
3.Определить степень окисления элементов: SO2, h3S, SO3, CS2
4.Составьте формулы следующих соединений: NaO, NO, CaO, CO
5.Дайте определение термину структурная формула молекулы
К.р.№2 «Химическая связь. Строение вещества»
Вариант 5
1.Составьте образование ковалентной связи в молекуле CS2
2.Составьте образование ионной связи в молекуле MgS
3.Определить степень окисления элементов: SO3, ZnO, CaO, Ag2O
4.Составьте формулы следующих соединений: MgO, NaS, AlBr, ZnO
5.Дайте определение термину электроотрицательность элемента
К.р.№2 «Химическая связь. Строение вещества»
Вариант 4
1.Составьте образование ковалентной связи в молекуле ClF3
2.Составьте образование ионной связи в молекуле Na2S
3.Определить степень окисления элементов: Cl2, HCl, BaCl2, AlCl3
4.Составьте формулы следующих соединений: HO, CuO, KO, AlO
5.Дайте определение термину одинарная связь
К.р.№2 «Химическая связь. Строение вещества»
Вариант 6
1.Составьте образование ковалентной связи в молекуле Ch5
2.Составьте образование ионной связи в молекуле Al2Cl3
3.Определить степень окисления элементов: P2O5, Ge2O3, SeO2, Cr2O3
4.Составьте формулы следующих соединений: HF, SO, NH, NO
5.Дайте определение термину ковалентная полярная связь
К.р.№2 «Химическая связь. Строение вещества»
Вариант 7
1.Составьте образование ковалентной связи в молекуле Br2
2.Составьте образование ионной связи в молекуле Li2O
3.Определить степень окисления элементов: SF6, As2O5, Alh4, CrO
4.Составьте формулы следующих соединений: HS, PO, PH, NaBr
5.Дайте определение термину ковалентная неполярная связь
К.р.№2 «Химическая связь. Строение вещества»
Вариант 8
1.Составьте образование ковалентной связи в молекуле h3S
2.Составьте образование ионной связи в молекуле MgCl2
3.Определить степень окисления элементов: TeO2, MgBr2, SnO2, Na2O
4.Составьте формулы следующих соединений: ZnCl, CO, NaJ, MoO
5.Дайте определение термину молекулярная кристаллическая решетка
К.р.№2 «Химическая связь. Строение вещества»
Вариант 9
1.Составьте образование ковалентной связи в молекуле N2
2.Составьте образование ионной связи в молекуле CaF2
3.Определить степень окисления элементов: h4N, HBr, Fe2O3, Ch5
4.Составьте формулы следующих соединений: LiO, CrO, VO, MgS
5.Дайте определение закону постоянства состава
К.р.№2 «Химическая связь. Строение вещества»
Вариант 10
1.Составьте образование ковалентной связи в молекуле CO2
2.Составьте образование ионной связи в молекуле CaCl2
3.Определить степень окисления элементов: V2O5, WO3, Co2O3, FeCl3
4.Составьте формулы следующих соединений: CO, CrCl, KBr, FeS
5.Дайте определение термину катион
К.р.№2 «Химическая связь. Строение вещества»
Вариант 11
1.Составьте образование ковалентной связи в молекуле h3O
2.Составьте образование ионной связи в молекуле BeO
3.Определить степень окисления элементов: ZnCl2, Sb2O3, ZnS, ZnO
4.Составьте формулы следующих соединений: NiO, PbO, SiH, AgCl
5.Дайте определение термину анион
К.р.№2 «Химическая связь. Строение вещества»
Вариант 12
1.Составьте образование ковалентной связи в молекуле Nh4
2.Составьте образование ионной связи в молекуле Na2O
3.Определить степень окисления элементов: Li2O, h3S, HgO, MgCl2
4.Составьте формулы следующих соединений: ZnBr, SiO, FeCl, HO
5.Дайте определение термину ионные соединения
К.р.№2 «Химическая связь. Строение вещества»
Вариант 13
1.Составьте образование ковалентной связи в молекуле h3
2.Составьте образование ионной связи в молекуле K2S
3.Определить степень окисления элементов: Br2O3, ZnO, CaO, Ag2O
4.Составьте формулы следующих соединений: CaCl, PO, AlCl, NaO
5.Дайте определение термину ионная связь
К.р.№2 «Химическая связь. Строение вещества»
Вариант 14
1.Составьте образование ковалентной связи в молекуле OF2
2.Составьте образование ионной связи в молекуле Al2O3
3.Определить степень окисления элементов: Ge2O3, SeO2, Cr2O3 , MgBr2
4.Составьте формулы следующих соединений: NaO, NO, CaO, CO
5.Дайте определение термину ионные кристаллические решетки
К.р.№2 «Химическая связь. Строение вещества»
Вариант 15
1.Составьте образование ковалентной связи в молекуле O2
2.Составьте образование ионной связи в молекуле Alh4
3.Определить степень окисления элементов: Sb2O5, CaCl2, ZnS, As2O5
4.Составьте формулы следующих соединений: HO, HS, HCl, HP
5.Дайте определение термину степень окисления
kopilkaurokov.ru
ГУО «Гимназия №2 г. Бреста»
Город Брест, Беларусь
Контрольная работа по теме «Химическая связь»
8 класс
Подготовила:
Учитель химии
Рудич Лариса Викторовна
Брест, 2010г
Текст заголовка
Рудич Лариса Викторовна,
учитель химии
2 категории
ГУО «Гимназия №2 г. Бреста»
Город Брест, Беларусь
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 1
| Задание | |
| I II III IV V | Выпишите формулы веществ с ионной связью: NaCl, Cl2, Nh4, HCl, CaO, Ag, CO2, P4. Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: HCl, Cl2. Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель: А) Ca+HCl→…+…; Б) S+O2→…; В) Mg(NO3)2→ MgO+NO2+O2. Cоставьте уравнение горения железа в кислороде. Определите окислитель и восстановитель. Рассчитайте объём кислорода, который потребуется для сжигания 112г железных стружек. По схеме реакции Cu+HNO3→Cu(NO3)2+NO+h3O рассчитайте массу окислителя, который потребуется для окисления восстановителя массой 768г. |
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 2
| Задание | |
| I II III IV V | Выпишите формулы веществ с ковалентной полярной связью: NaCl, Cl2, Nh4, HCl, CaO, Ag, CO2, P4. Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: CaO, h3. Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель: А) I2+h3→…; Б) Na+O2→…; В) SO2+h3S→S+h3O. Составьте уравнение взаимодействия магния с соляной кислотой. Определите окислитель и восстановитель. Рассчитайте массу соляной кислоты, которая потребуется для полного растворения 72г магния. По схеме реакции HI+h3SO4→I2+S+h3O рассчитайте массу восстановителя, который потребуется для восстановления окислителя массой 784г. |
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 3
| Задание | |
| I II III IV V | Выпишите формулы веществ с ионной связью: NaBr, HCl, h3S, h3O, CaO, Ag, CaCl2, h3. Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: HCl, N2. Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель: А) Al+O2→…; Б) Mg+HCl→…+…; В) h3S+FeCl3→FeCl2+S+HCl. Cоставьте уравнение горения алюминия в кислороде. Определите окислитель и восстановитель. Рассчитайте объём кислорода, который потребуется для сжигания 189г алюминиевых стружек. По схеме реакции Ag+HNO3→AgNO3+NO2+h3O рассчитайте массу окислителя, который необходим для полного окисления восстановителя массой 324г. |
Контрольная работа №2
«Химическая связь»
8 класс
Вариант 4
| Задание | |
| I II III IV V | Выпишите формулы веществ с ковалентной полярной связью: NaI, Cl2, Nh4, HCl, h3S, Ag, CO, Ph4. Запишите схемы образования молекул или формульных единиц с помощью электронных формул и определите тип химической связи: NaCl, O2. Составьте уравнения реакций, уравняйте методом электронного баланса, определите окислитель и восстановитель: А) Cl2+h3→…; Б) Ca+O2→…; В) Si+KOH+h3O→K2SiO3+h3↑. Составьте уравнение взаимодействия магния с серной кислотой. Определите окислитель и восстановитель. Рассчитайте массу серной кислоты, которая потребуется для полного растворения 288г магния. По схеме реакции S+h3SO4→SO2+h3O рассчитайте химическое количество восстановителя, который необходим для восстановления окислителя массой 686г. |
globuss24.ru
Контрольная работа «Химическая связь. Типы кристаллических решеток». 9 класс. 4 варианта.
Вариант 1.
1.Число валентных электронов в атоме серы равно 1)2 2)6 3)16 4)32
2. Металлические свойства слабее всего выражены у 1)Ca 2)Al 3)Li 4)K
3. C увеличением зарядов ядер металлические свойства элементов в подгруппе 1)увеличиваются 2)уменьшаются 3)меняются периодически 4)не изменяются
4. Последовательность элементов, в которой увеличивается радиус атома 1)O, C, F 2)C,O,F 3)C, F, O 4)F, O, C
5. Укажите пару веществ, образованных ковалентной связью 1)h3Se и CaCl2 2)Na2O и O3 3)N2 и HCl 4)NaCl и P2O3
6.Связь между барием и кислородом в оксиде бария 1) ковалентная полярная 2) ионная 3) ковалентная неполярная 4) металлическая
7.Электронная плотность связи смещена к атому углерода в соединении 1) CO 2) CO2 3) Ch5 4) CCl4
8. Кристаллическая решетка алмаза 1) атомная 2) ионная 3) металлическая 4) молекулярная
9.Частицы в узлах кристаллической решетки бромида калия 1) катионы металла 2) ионы 3) атомы 4) молекулы
10. Металлическая связь характерна для 1) Al2S3 2) h4As 3) B 4) Fe
В1. В соединении NaCrO2 степень окисления хрома 1) +1 2) +2 3) +3 4) +5
В2. Напишите название химической связи между элементами №3 и № 16 __________________ .
В3. Установите соответствие между типом кристаллической решетки и названием вещества
Тип решетки название вещества
Ионная А) сульфид калия
Атомная Б) цинк
Молекулярная В) оксид кремния (IV)
Металлическая Г) оксид углерода (IV)
C1. Для элемента №15 дать характеристику по таблице Менделеева, написать электронную формулу атома, формулу высшего оксида, определить его тип кристаллической решетки.
Контрольная работа «Химическая связь. Типы кристаллических решеток». 9 класс.
Вариант 2.
1.Число валентных электронов в атоме кремния равно 1)2 2)4 3)12 4)14
2. Металлические свойства сильнее всего выражены у 1)Ca 2)Sr 3)Ba 4)Mg
3. C увеличением зарядов ядер радиусы атомов элементов в периоде 1)увеличиваются 2)уменьшаются 3)меняются периодически 4)не изменяются
4. Последовательность элементов, в которой увеличивается неметаллические свойства атомов 1)O, C, F 2)C,O,F 3)C, F, O 4)F, O, C
5. Укажите пару веществ, образованных только ионной связью 1)K2Se и CaCl2 2)Na2O и Na 3)N2 и h3 4)NaCl и P2O3
6. Связь между водородом и фтором во фтороводороде 1) ковалентная полярная 2) ионная 3) ковалентная неполярная 4) металлическая
7.Электронная плотность связи не смещена к атому азота в соединении 1) NO 2) NBr3 3) Nh4 4) NCl3
8. Кристаллическая решетка бора 1) атомная 2) ионная 3) металлическая 4) молекулярная
9.Частицы в узлах кристаллической решетки калия 1) катионы металла 2) ионы 3) атомы 4) молекулы
10. Ковалентная неполярная связь характерна для 1) Al2S3 2) h4As 3) P 4) Cu
В1. В соединении Na2CrO4 степень окисления хрома 1) +7 2) +6 3) +5 4) +4
В2. Напишите название химической связи, образованной элементом №14 __________________ .
В3. Установите соответствие между типом кристаллической решетки и названием вещества
Тип решетки название вещества
Ионная А) бромид кальция
Атомная Б) водород
Молекулярная В) графит
Металлическая Г) серебро
C1. Для элемента №20 дать характеристику по таблице Менделеева, написать электронную формулу атома, формулу высшего оксида, определить его тип кристаллической решетки.
Контрольная работа «Химическая связь. Типы кристаллических решеток». 9 класс.
Вариант 3.
1.Число валентных электронов в атоме кальция равно 1)2 2)4 3)20 4)40
2. Металлические свойства сильнее всего выражены у 1)C 2)Sn 3)Pb 4)Ge
3. C увеличением зарядов ядер металлические свойства атомов элементов в подгруппе 1) увеличиваются 2) уменьшаются 3) меняются периодически 4) не изменяются
4. Последовательность элементов, в которой уменьшается радиус атома 1) Ga, As, Br 2) Br, Ga, As 3) As, Ga, Br 4) Br, As, Ga
5. Укажите пару веществ, образованных ковалентной полярной и неполярной связью 1) Н2S и BaCl2 2) Na2O и C 3) O2 и HCl 4) CsCl и N2O3
6. Связь между никелем и кислородом в оксиде никеля (III) 1) ковалентная полярная 2) ионная 3) ковалентная неполярная 4) металлическая
7.Электронная плотность связи смещена к атому серы в соединении 1) SCl6 2) SO2 3) S 4) CS2
8. Кристаллическая решетка магния 1) атомная 2) ионная 3) металлическая 4) молекулярная
9.Частицы в узлах кристаллической решетки льда 1) катионы металла 2) ионы 3) атомы 4) молекулы
10. Ионная связь характерна для 1) Al2S3 2) h4As 3) Si 4) Ca
В1. В соединении h4PO4 степень окисления фосфора 1) +5 2) +2 3) +3 4) +4
В2. Определите вид химической связи , образованной элементами №1 и №53 __________________ .
В3. Установите соответствие между типом кристаллической решетки и названием вещества
Тип решетки название вещества
Ионная А) сульфид кальция
Атомная Б) графит
Молекулярная В) алюминий
Металлическая Г) иод
C1. Для элемента №20 дать характеристику по таблице Менделеева, написать электронную формулу атома, формулу высшего оксида, определить его тип кристаллической решетки.
Контрольная работа «Химическая связь. Типы кристаллических решеток». 9 класс.
Вариант 4.
1.Число валентных электронов в атоме азота равно 1)3 2)5 3)7 4)14
2. Неметаллические свойства слабее всего выражены у 1)Sr 2)Sb 3)Rb 4)Te
3. C увеличением зарядов ядер неметаллические свойства атомов элементов в периоде 1) увеличиваются 2) уменьшаются 3) меняются периодически 4) не изменяются
4. Последовательность элементов, в которой увеличивается радиус атома 1) In, Sn, Te 2) Sn, Te, In 3) Te, Sn, In 4) In, Te, Sn
5. Укажите пару веществ, образованных ковалентной связью 1)SeO3 и Na 2)B2O3 и C 3)O2 и KNO3 4)Cs и N2O3
6. Связь между атомами хлора в простом веществе 1) ковалентная полярная 2) ионная 3) ковалентная неполярная 4) металлическая
7.Электронная плотность связи смещена к атому фосфора в соединении 1) PCl5 2) P2O3 3) P 4) Ph4
8. Кристаллическая решетка серы 1) атомная 2) ионная 3) металлическая 4) молекулярная
9.Частицы в узлах кристаллической решетки оксида кремния (IV) 1) катионы металла 2) ионы 3) атомы 4) молекулы
10. Ионная связь характерна для 1) Al2S3 2) h3S 3) Si 4) Cr
В1. В соединении Na2CO3 степень окисления углерода 1) +1 2) +2 3) +3 4) +4
В2. Определите вид химической связи, образованной элементом №30__________________ .
В3. Установите соответствие между типом кристаллической решетки и названием вещества
Тип решетки название вещества
Ионная А) золото
Атомная Б)оксид цинка
Молекулярная В) кислород
Металлическая Г) кремний
C1. Для элемента №37 дать характеристику по таблице Менделеева, написать электронную формулу атома, формулу высшего оксида, определить его тип кристаллической решетки.
infourok.ru
Северо-Казахстанская область
Тайыншинский район
КГУ «Леонидовская СШ»
Учитель Закревская Ирина Владимировна
Проверочная работа
Тема: Химическая связь. Кристаллические решётки.
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Задание 1. Ионная связь.
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам.
Выписать формулы химических соединений, молекулы которых образованы ионной связью.
NaCl, Br2, Ph4, Ag, HI, KI, N2, Mn, CO, K2S, P4, Zn, Cl2, FeCl3, SO3, Cr, назовите эти вещества.
_________________________________________________________________________
_________________________________________________________________________
_________________________________________________________________________
Задание 2. На схеме показан механизм образования ионной связи. Какое свойство химических элементов непосредственно оказывает влияние на образование химической связи?
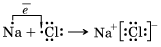 Ответ: ________________________________________.
Ответ: ________________________________________.
Задание 3. Ковалентная связь.
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Записать схему образования:
молекулы водорода_______________________________________________________, молекулы фтороводорода___________________________________________________, молекулы сероводорода____________________________________________________.
Ковалентная связь характерна для:
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной.
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Используя химические формулы следующих веществ NaCl, Br2, Ph4, Ag, HI, KI, N2, Mn, CO, K2S, P4, Zn, Cl2, FeCl3, SO3, Cr, заполнить таблицу.
Задание 4. Металлическая связь
Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называют металлической.
Схема образования металлической связи (М – металл):
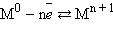
Выписать химические формулы веществ с металлической связью: NaCl, Br2, Ph4, Ag, HI, KI, N2, Mn, CO, K2S, P4, Zn, Cl2, FeCl3, SO3, Cr,
__________________________________________________________________________
Задание 5. Водородная связь.
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже Сl и S) другой молекулы (или ее части), называют водородной.
Водородная связь может быть межмолекулярной и внутримолекулярной.
А) 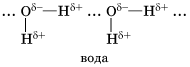 Б ) белок
Б ) белок 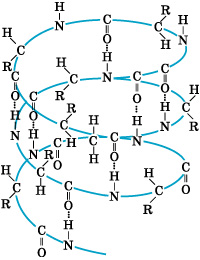
Межмолекулярная водородная связь обозначкена буквой _______, внутримолекулярная водородная связь обозначена буквой ______.
Задание 6. Типы кристаллических решёток.
infourok.ru