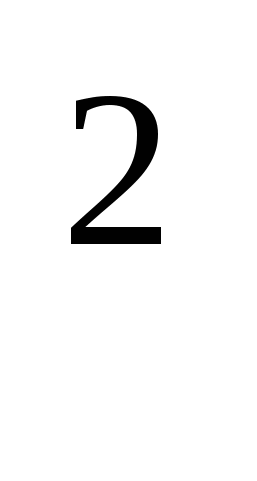 2s
2s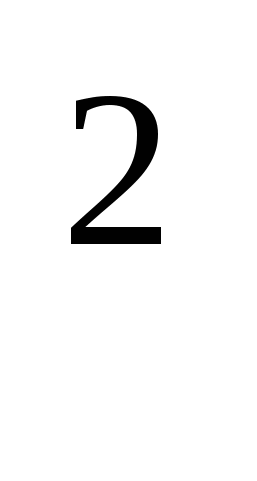 2p
2p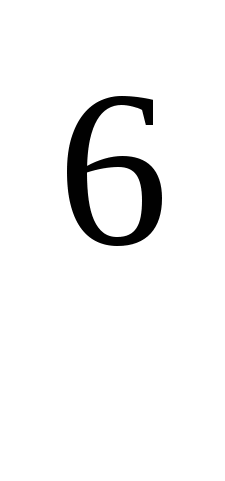 3s
3s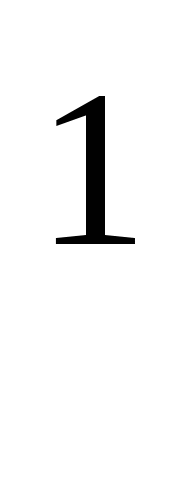
Рубаник Анна Иосифовна
учитель биологии и химии
МБОУ «СОШ№14»,г. Нижневартовск
Дифференцированный подход в обучении химии
Одной из перспективных и эффективных педагогических технологий обучения является дифференцированный подход обучения школьников, основанный на личностно-ориентированном характере образования. Цель дифференциации - обучение каждого на уровне его возможностей, способностей, адаптации обучения к особенностям различных групп учащихся.
Задания уровня «А» зафиксированы как базовый стандарт – минимальный, или репродуктивный. Здесь особенностью обучения является многократность повторения, умение выделять смысловые группы. Задание уровня «А» должен уметь выполнить каждый, прежде чем приступить к заданиям «В», «С». Уровень «В» – аналитико-синтетический уровень, руководствуется приемами умственной деятельности, которые необходимы для решения задач на применение. Здесь, кроме конкретных знаний вводятся дополнительные сведения, расширяющие материал уровня «А». Уровень «С» – творческий уровень, выводящий учащихся на уровень осознанного, творческого применения знаний, предусмотрены сведения, углубляющие материал, требующие логического обоснования. Этот уровень позволяет учащимся проявлять способность к дополнительной самостоятельной работе.
Опыт использования дифференциального подхода к контролю знаний учащихся покажу на примерах: разноуровневые контрольные работы по химии в 9 классе. Дифференцированные контрольные работы представлены в нескольких вариантах. Задания работы сгруппированы в три уровня: «А», «В», «С». В уровень «А» включены задания, проверяющие усвоение необходимого минимума конкретных знаний по химии. Выполнение ее требует от учащихся репродуктивной деятельности, оцениваю ее выполнение на «3». При выполнении уровня «В» учащиеся должны уметь раскрыть причинно-следственные связи, применять теоретические знания для объяснения конкретных явлений. Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5».
Источники материалов:
Царева Т.В., Реализация дифференцированного подхода в обучении химии как одно из направлений современных педагогических технологий. http://sarschool76.narod.ru/Tv_pab_ctv.pdf
Зуева М. В., Гара Н. Н. Контрольные и проверочные работы по химии. 8-9 кл.: методическое пособие. М.: Дрофа, 2002.
Иванова Р. Г. Вопросы, упражнения и задания по химии: пособие для учащихся 8-9 кл. М.: Просвещение, 2002.
Радецкий А. М. Проверочные работы по химии в 8-11 классах: пособие для учителя. М.: Просвещение, 2001.
Контрольная работа № 1
Электролитическая диссоциация
1 вариант
Уровень А
1.Какие из перечисленных веществ являются электролитами: сахар, h3, KCl, h4PO4, CuO, Ba(OH)2 , Fe(NO3)3, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
h3SO3 → BaCl2 →
NaOH → Fe2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются ионы железа Fe3+.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HCl + KOH →
Б)* MgCl2 + NaOH →
Уровень С
5.* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
K2CO3 + … → … + h3O + CO2
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
2H+ + SiO32- =h3SiO3
Контрольная работа № 1
Электролитическая диссоциация
2 вариант
Уровень А
1.Какие из перечисленных веществ являются неэлектролитами: сахар, h3, NaCl, h3SO4, MgO, KOH , Ba(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
HNO3 → ZnCl2 →
Ca(OH)2 → Na3PO4 →
3.Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Mg2+ + 2NO3- Б) ? ↔ 2К+ + SO42-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) KCl + AgNO3 →
Б)* Ba(NO3)2 + Na2SO4 →
Уровень С
5.* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
Cu(NO3)2 + … → Cu(OH)2 +
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Ca2+ + 2PO43- = Ca3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
3 вариант
Уровень А
1.Какие из перечисленных веществ являются неэлектролитами: сахар, O2, MgCl2, h3SO4, FeO, KOH , Zn(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
KNO3 → AlCl3 →
Ba(OH)2 → Na2SO4 →
3.Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Fe2+ + 2NO3 - Б) ? ↔ 3Na+ + PO43-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) NaBr + AgNO3 →
Б)* BaCl2 + CuSO4 →
Уровень С
5.* Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
CuCl2 + … → Cu(OH)2 + …
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Zn2+ + 2PO43- = Zn3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
4 вариант
Уровень А
1.Какие из перечисленных веществ являются электролитами: сахар, N2, BaCl2, HNO3, CO, Ca(OH)2 , FeSO4, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
Na2SO3 → MgCl2 →
KOH → Al2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются карбонат-ионы СО32-.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HNO3 + NaOH →
Б)* ZnCl2 + KOH →
Уровень С
5.* Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
FeCl3 + … → AgCl + …
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
Ba2+ + SiO32- =BaSiO3
Контрольная работа по теме “Неметаллы»
1 вариант
Уровень А
Выберите один правильный ответ.
Какой заряд ядра атома кремния:
+14
+28
+3
+4
Количество валентных электронов углерода:
2
4
6
12
Возможная валентность серы:
II
II, IV
II, IV, VI
II, IV, VI, VIII
Возможная валентность фосфора:
I
III
III, V
I, III, V, VII
Степень окисления углерода:
+2; -2
+4
-4
-4; +4; +2
Может быть красным или белым:
кислород
азот
сера
фосфор
Основной компонент воздуха:
кислород
азот
хлор
углекислый газ
Графит и алмаз состоят из:
фосфора
кремния
углерода
водорода
Формула оксида углерода (II):
CO
h3CO3
CO2
C2h3
Явление аллотропии не свойственно:
сере
азоту
фосфору
углероду
Формула летучего водородного соединения азота:
N2
Nh4
Nh5
NO
Формула сильного окислителя, который обугливает органические вещества:
h3SO4
h3S
h3SO3
SO3
Ядовитое вещество, светится в темноте, воспламеняется при 400 С:
Пластическая сера
Красный фосфор
Белый фосфор
Озон
Формула оксида кремния IV:
Si
SiO2
h3SiO3
SiO
Какой газ нельзя собрать в сосуд методом вытеснения воды:
водород
кислород
азот
аммиак
Формула соды:
CaCO3
Na2CO3
K2CO3
h3CO3
Уровень В
Допишите правильный ответ
Какое вещество используют в медицине, для приведения человека в чувства ______.
Для получения газированной воды используют _______ газ.
Это газообразное соединение углерода является сильным ядом ________.
Вещества, образующиеся при взаимодействии аммиака с кислотами называются _______.
Самый твердый природный минерал - ______.
Основные отрасли силикатной промышленности – это ________.
Уровень С
Допишите уравнения реакций
S + O2
h3S + Zn
h3SO4 + CuO
HNO3 + NaOH
HCl + K2CO3
h3SO4 + BaCl2
Nh4 + HСl
CO2 + CaO
Составьте уравнения реакций по схеме:
h3 → Nh4 → (Nh5)2SO4 → BaSO4
Запишите уравнение реакции по схеме в молекулярном и ионном виде:
Na2SiO3 → h3SiO3
Контрольная работа по теме “Неметаллы»
2 вариант
Уровень А
Выберите один правильный ответ.
1.Какой заряд ядра атома азота:
+14
+28
+7
+5
Количество валентных электронов серы:
6
4
2
12
Возможная валентность углерода:
II
II, IV
II, IV, VI
II, IV, VI, VIII
Возможная валентность азота:
I
III
III, V
I, II, III, IV, V
Степень окисления фосфора:
+3; +5; -3
+3; +7
-5; +5
+3; +5
Может быть кристаллической или пластической:
кислород
азот
сера
фосфор
Явление аллотропии свойственно:
водороду
азоту
хлору
фосфору
Очень твердый, прозрачный минерал:
алмаз
кремний
графит
фуллерит
Формула оксида углерода (IV):
CO
h3CO3
CO2
C2h3
Явление адсорбции свойственно:
сере
азоту
фосфору
углероду
Формула аммиака:
N2
Nh4
Nh5
NO
Формула сильного окислителя, который с белками образует вещества желтого цвета:
h3SO4
Nh4
HNO3
SO3
Ядовитое вещество с неприятным запахом тухлых яиц:
Пластическая сера
Сернистый газ
Белый фосфор
Сероводород
Формула кремниевой кислоты:
Si
SiO2
h3SiO3
SiO
Какой газ в промышленности получают из азота и водорода:
оксид азота (II)
угарный газ
фосфин
аммиак
Формула известняка, мела:
CaCO3
Na2CO3
K2CO3
h3CO3
Уровень В
Допишите правильный ответ
Какое вещество используют в производстве спичек, для вулканизации каучука ______.
«Сухой лед» - это твердый _______.
В быту нашатырным спиртом называют водный раствор ________.
Распознать кислород и оксид углерода (IV) можно с помощью _______.
Ядовитое, желтоватое вещество с чесночным запахом, светящееся в темноте - ______.
Основное сырье силикатной промышленности – это ________.
Уровень С
Допишите уравнения реакций
P + O2
h3SO4(разб) + Zn
HNO3 + CaO
HNO3 + Na2CO3
h3SO4 + Nh4
Na2SiO3 + HCl
Nh5Сl
SO3 + MgO
Составьте уравнения реакций по схеме:
CO2 → Na2CO3 → CO2 → CaCO3
Запишите уравнение реакции по схеме в молекулярном и ионном виде:
h3SO4 → BaSO4
Контрольная работа по теме «Металлы»
1 вариант
Уровень А. Выберите один правильный ответ.
1.Какой из металлов, электронные формулы которых записаны ниже, наиболее химически активен?
а) 1s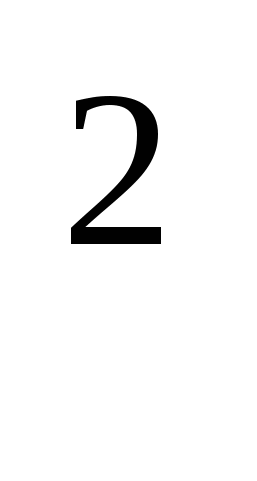 2s
2s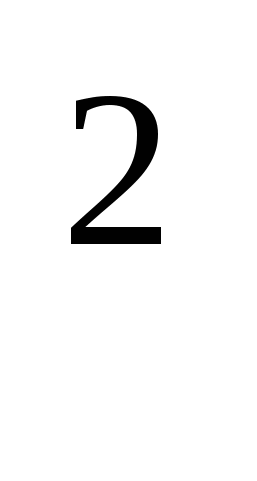 2p
2p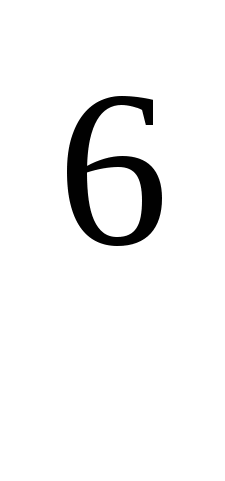 3s
3s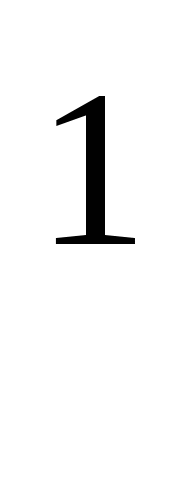
б) 1s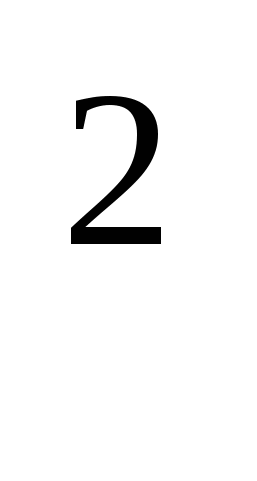 2s
2s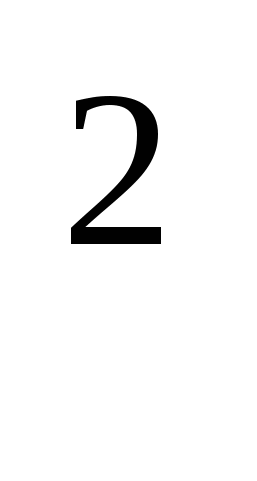 2p
2p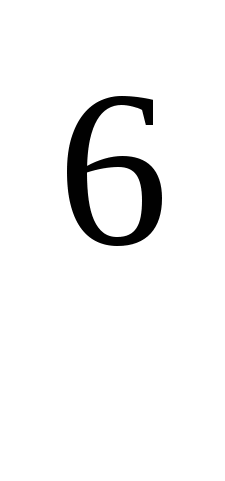 3s
3s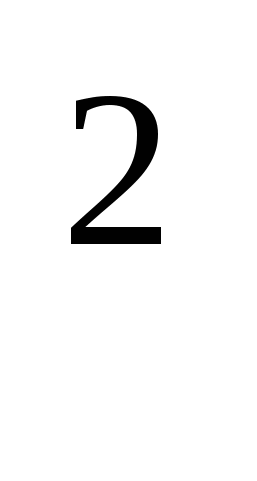 3p
3p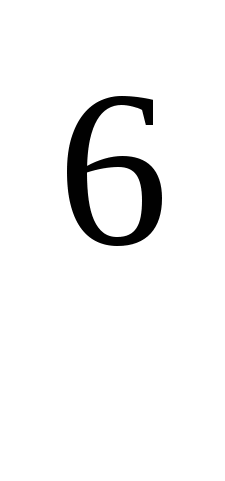 3d
3d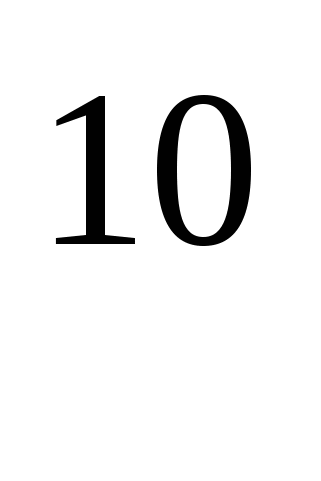 4s
4s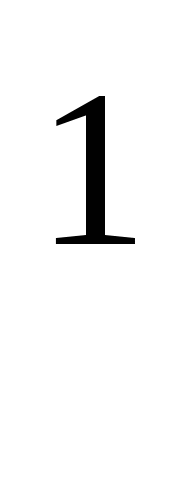
в) 1s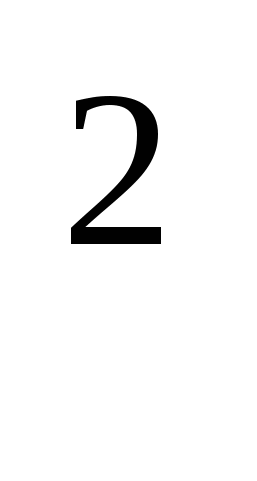 2s
2s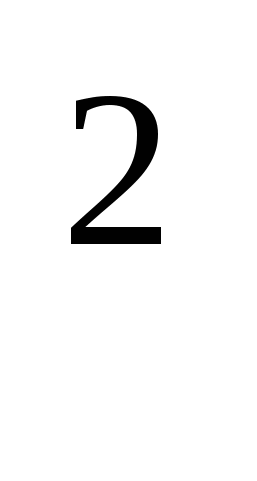 2p
2p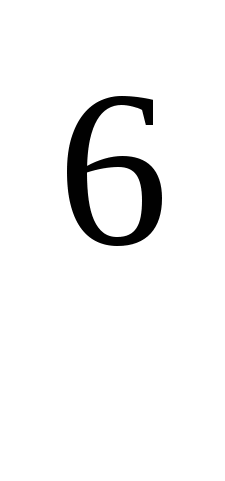 3s
3s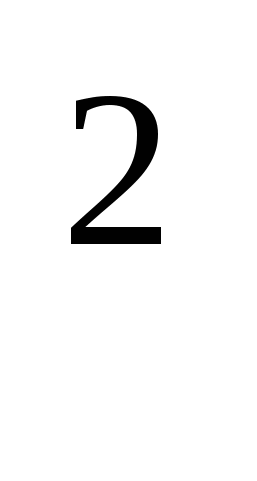 3p
3p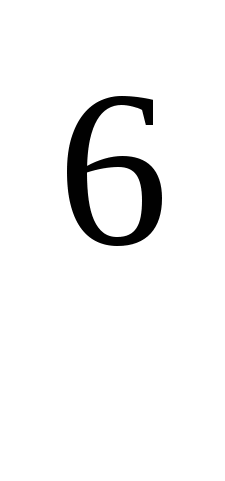 4s
4s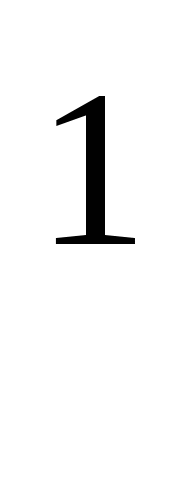
2.Восстановительные свойства в ряду элементов:Mg––Na––K––Rb а) усиливаются
б) ослабевают
в) изменяются периодически
3. Схема превращений Fe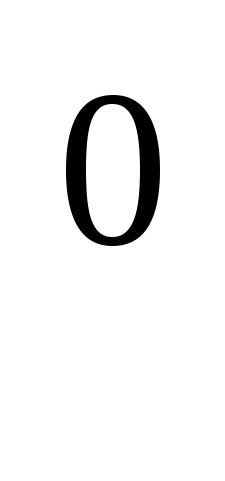 → Fe
→ Fe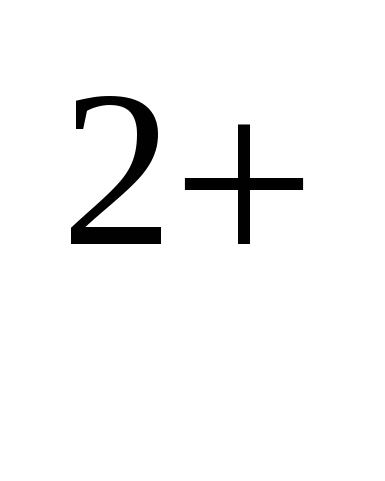 представляет собой процесс:
представляет собой процесс:
а) окисления
б) восстановления
в) не относится к окислительно-восстановительным процессам
4. Какой из гидроксидов проявляет амфотерные свойства?
а) Fe(OH)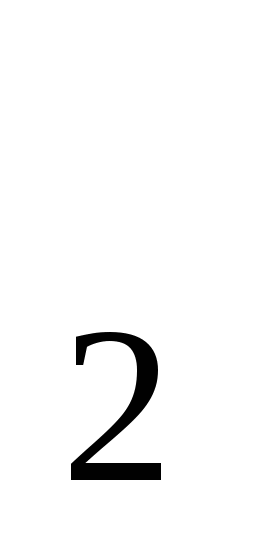
б) Ca(OH)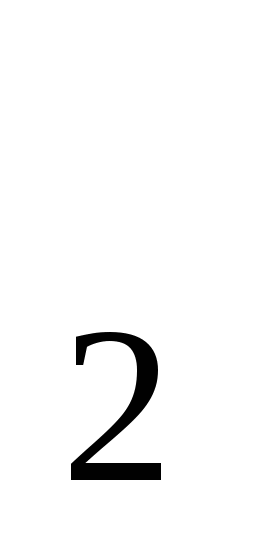
в) Al(OH)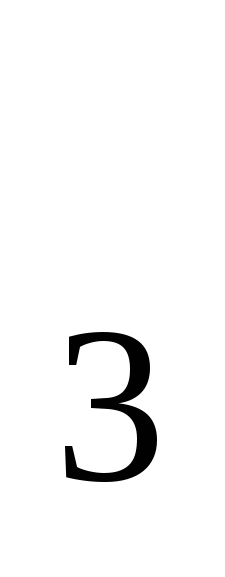
5.Соли какого металла окрашивают пламя
в желтый цвет:
а) Ca
б) Na
в) Ba
6. Какое из веществ можно использовать для устранения жесткости воды:
а) NaOH
б) CaCl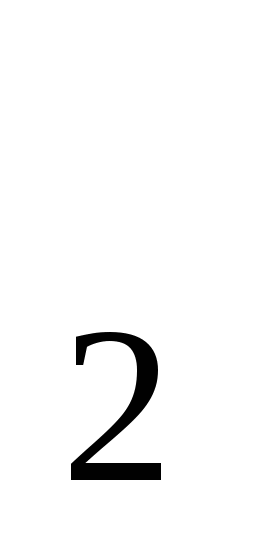
в) Na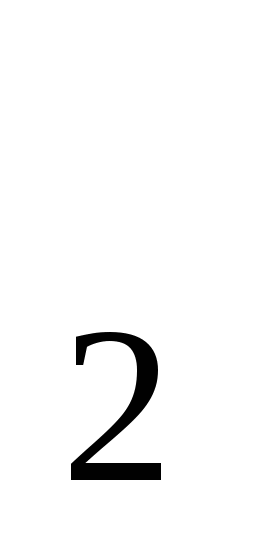 CO
CO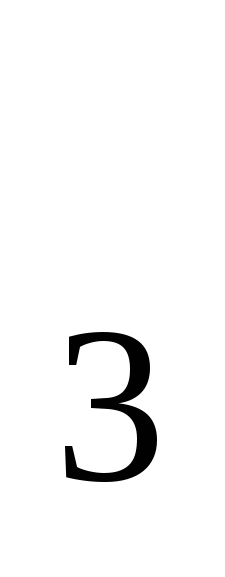
7. Степень окисления +2 проявляют металлы:
а) Mg, Ca, Ba
б) Li, Na, Ca
в) Al, Fe, Mg
8.Какой из металлов является самым легким?
a) натрий
б) литий
в) алюминий
9. Самый тугоплавкий металл:
а) железо
б) хром
в) вольфрам
10. Электропроводность и теплопроводность металлов объясняется особым строением кристаллической решетки:
а) наличием свободных электронов
б) наличием ионов металла в узлах решетки
в) наличием нейтральных атомов в узлах
11. Практически осуществима следующая реакция:
а) MgSO4 + Fe →
б) FeCl2 + Cu →
в) CuSO4 + Zn →
12. Формула гашеной извести:
а) Са(ОН)2
б) СаО
в)CaСО3
13. Какой металл называют «крылатым»?
а) железо
б) алюминий
в) кальций
14. При взаимодействии хлорида железа (II) с гидроксидом натрия наблюдается выпадение:
а) коричневого осадка
б) синего осадка
в) белого осадка (на воздухе зеленеет)
Уровень В. Допишите правильный ответ.
Наличие в природной воде солей кальция и магния обуславливает …… .
Связь, которую осуществляют свободные электроны между ионами металлов, называют ….
Самый распространенный металл в земной коре – это …..
Металлы, находящиеся в I группе главной подгруппе периодической системы называют …..
Сплав железа, содержащий 2-4% углерода, называется ….
Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
Реагирующие вещества
Продукты взаимодействия
А ) Са + h3SO4(разбавл.) ;
) Са + h3SO4(разбавл.) ;
Б ) Са + N2 ;
) Са + N2 ;
В ) Са(HCO3)2 ;
) Са(HCO3)2 ;
Г ) Са(OH)2 + h3SO4
) Са(OH)2 + h3SO4
1) СаO + CO2;
2) СаCO3 + CO2 + h3O;
3) Са3N2;
4) СаSO4 + h3S + h3O;
5) СаSO4 + h3;
6) СаSO4 + h3O.
Уровень С.
Восстановите левые части уравнений:
… + … = 2NaOH + h3
… + … = 2AlCl3 + 3h3
… + … = MgSO4 + 2h3O
… + … = Cu + ZnSO4
… + … = Ca(OH)2
… + … = Fe(OH)3 + 3KCl
Запишите уравнения реакций по схеме:
L i → Li2O → LiOH → Li2SO4
i → Li2O → LiOH → Li2SO4
LiOH
Контрольная работа по теме «Металлы»
2 вариант
Уровень А. Выберите один правильный ответ.
1. Степень окисления +1 проявляют металлы:
а) Mg, Ca, Na
б) Li, Na, Al
в) Li, Na, K
2. Какой из металлов имеет самую низкую температуру плавления? а) ртуть
б) литий
в) цезий
3. Самый твердый металл – это:
а) хром
б) осмий
в) марганец
4. В виде солей в природе встречаются металлы:
а) железо, медь, магний
б) натрий, калий, кальций
в) серебро, золото, платина
5. Практически осуществима следующая реакция:
а) CaCl2 + Fe
б) SnCl2 + Al
в) CuSO4 + Mg
6. При взаимодействии хлорида железа (III) с гидроксидом натрия наблюдается выпадение:
а) коричневого осадка
б) синего осадка
в) зеленого осадка
7. Какой металл в некоторых древних языках называли «небесным камнем»?
а) алюминий
б) магний
в) железо
8.Какой из металлов, электронные формулы которых записаны ниже, наиболее химически активен?
a) 1s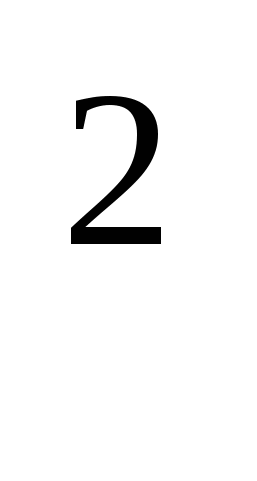 2s
2s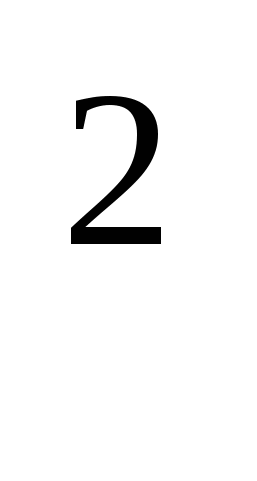 2p
2p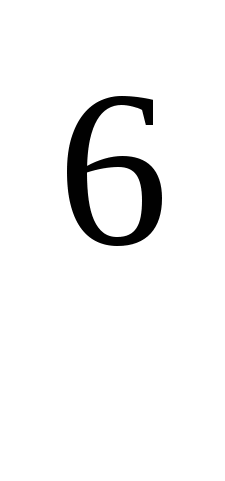 3s
3s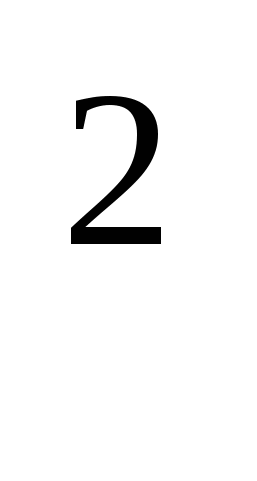 3p
3p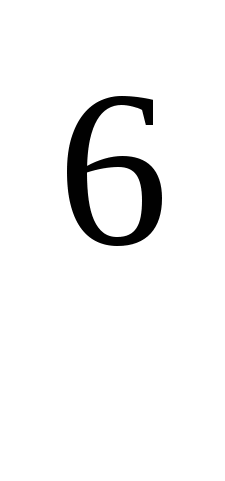 3d
3d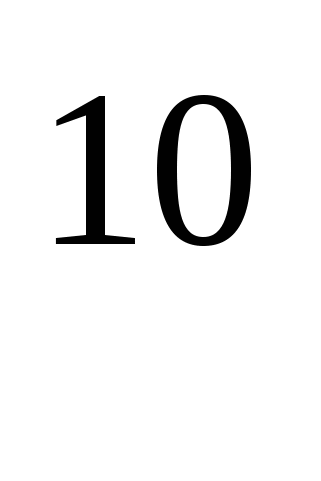 4s
4s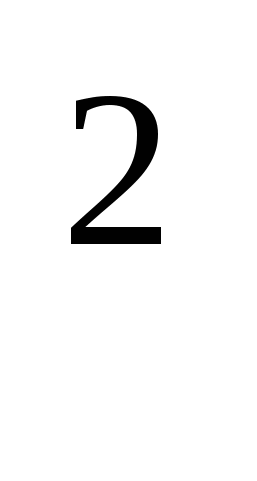
б) 1s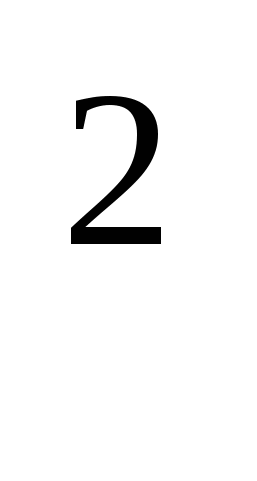 2s
2s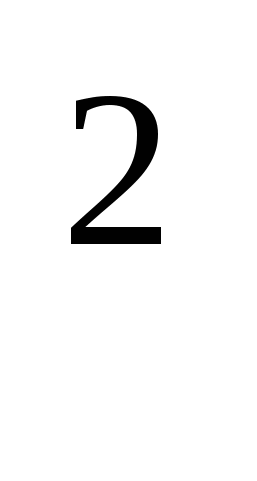
в) 1s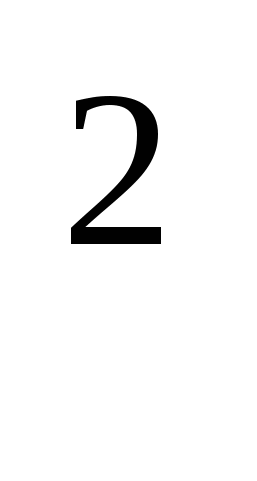 2s
2s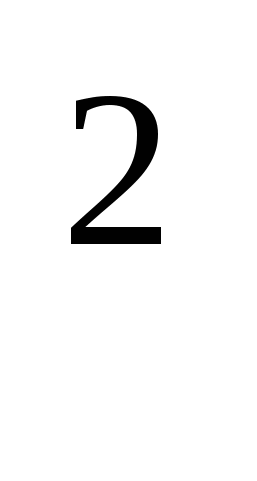 2p
2p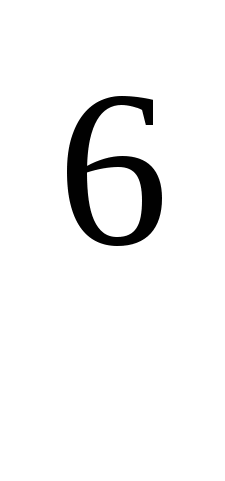 3s
3s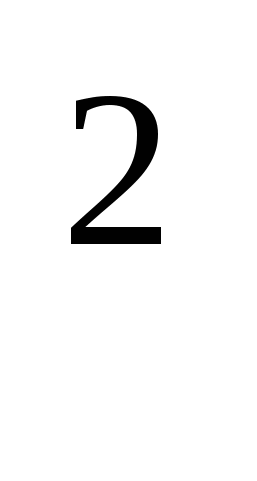
9.Восстановительные свойства в ряду элементов: Sr––Ca––Mg––Be
а) усиливаются
б) ослабевают
в) изменяются периодически
10. Схема превращений Fe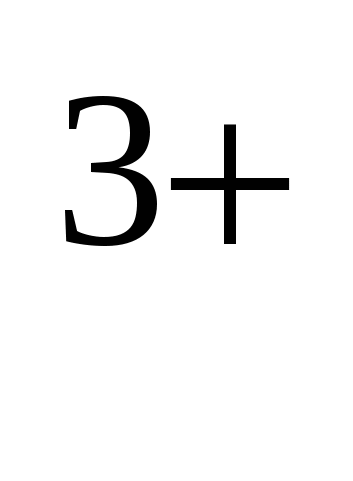 → Fe
→ Fe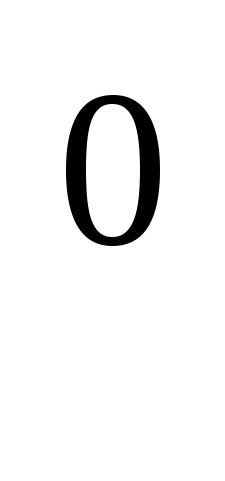
представляет собой процесс:
а) восстановления
б) окисления
в) не относится к окислительно-восстановительным процессам
11.Какой из гидроксидов проявляет амфотерные свойства?
а) Mg(OH)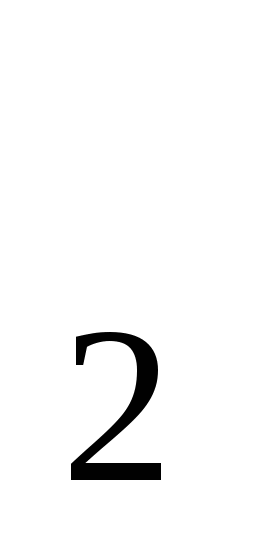
б) Fe(OH)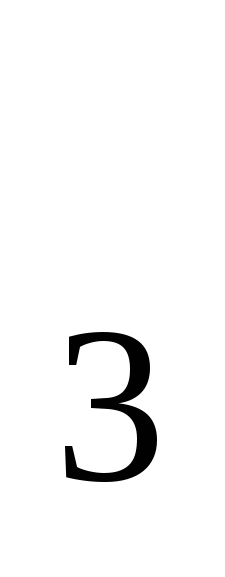
в) Ba(OH)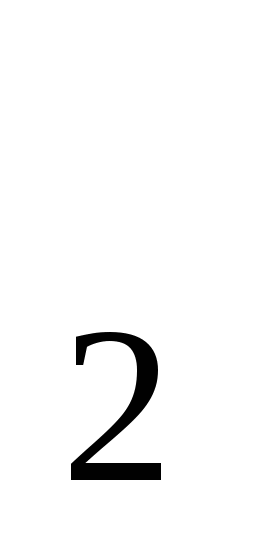
12.Соли какого металла окрашивают пламя
в кирпично-красный цвет:
а) Al
б) Mg
в) Ca
13. Какой ион обусловливает жесткость воды:
а) Ba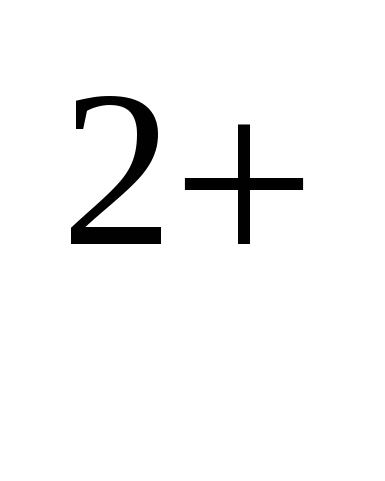
б) Mg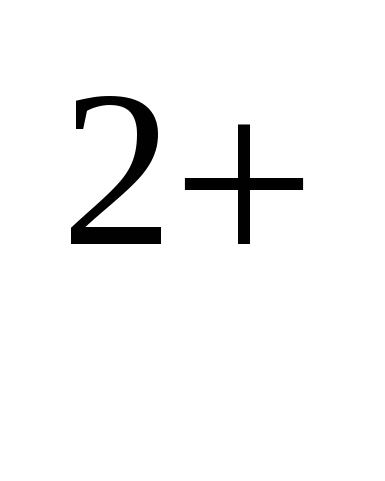
в) K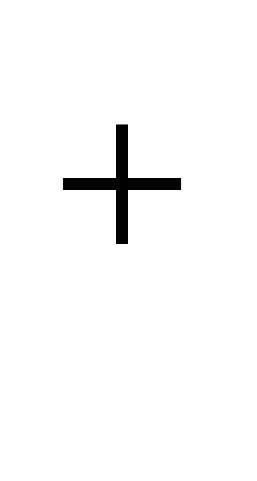
14. Формула негашеной извести:
а) СаО
б) Ca(ОН)2
в) СаCO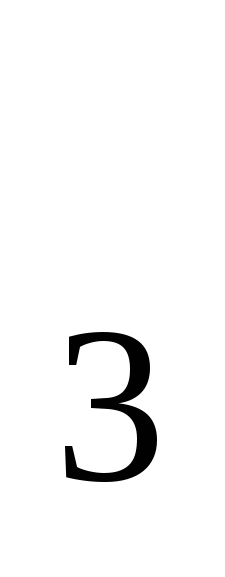
Уровень В. Допишите правильный ответ.
Способность металла изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку называется …… .
Металлы располагаются в основном в …. и ….. части периодической таблицы.
Второе место по распространенности среди металлов в земной коре занимает …..
Металлы в химических реакциях являются …..
Сплав железа, содержащий 0,3-2% углерода, называется ….
Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
Реагирующие вещества
Продукты взаимодействия
А ) Fe + Cl2 ;
) Fe + Cl2 ;
Б ) Fe + O2 ;
) Fe + O2 ;
В ) Fe + h3SO4(разб.) ;
) Fe + h3SO4(разб.) ;
Г ) Fe + HCl
) Fe + HCl
1) Fe2(SO4)3 + SO2 + h3O;
2) FeCl3;
3) FeCl2 + h3;
4) FeSO4 + h3;
5) Fe3O4;
6) Fe3O4 + h3.
Уровень С.
Восстановите левые части уравнений:
… + … = 2NaCl + h3
… + … = 2AlCl3
… + … = CaSO4 + h3O
… + … = Sn + MgSO4
… + … = AlCl3 + 3h3O
… + … = Fe(OH)2 + 2NaCl
Запишите уравнения реакций по схеме:
С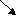 а → СаO → Са(OН)2 → СаСO3
а → СаO → Са(OН)2 → СаСO3
Са(OH)2
doc4web.ru
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
1 вариант.
Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) KOH + h3SO4 =
б) Na2CO3 + HNO3 =
в) CuCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) HCIO +Br2 + h3O = HBrO3 + HCI
б) PbO2 + Na3CrO3 + NaOH = Na2CrO4 + Na2PbO2 + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) FeCI3
б) Na2S
в) K2SO4
г) CuCO3
4) Дать расшифровку понятиям:
электролит
электролитическая диссоциация
гидролиз солей
окислительно-восстановительные реакции
основания
5) Решить задачу:
К 50г раствора, содержащего 10% хлорида железа (II), добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
вариант.
1) Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) KOH + h3SO4 =
б) Na2CO3 + HNO3 =
в) CuCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) HCIO +Br2 + h3O = HBrO3 + HCI
б) PbO2 + Na3CrO3 + NaOH = Na2CrO4 + Na2PbO2 + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) FeCI3
б) Na2S
в) K2SO4
г) CuCO3
4) Дать расшифровку понятиям:
электролит
электролитическая диссоциация
гидролиз солей
окислительно-восстановительные реакции
основания
5) Решить задачу:
К 50г раствора, содержащего 10% хлорида железа (II), добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
вариант.
1) Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) NaOH + h4PO4 =
б) K2CO3 + HCI =
в) FeCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) I2 + KOH = KIO3 + KI + h3O
б) CuCI + K2Cr2O7 + HCI = CuCI2 + CrCI3 + KCI + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) CuCI2
б) K3PO4
в) Li2SO4
г) CuS
4) Дать расшифровку понятиям:
5) Решить задачу:
К 100г раствора, содержащего 10% хлорида меди (II), добавили гидроксид калия. Вычислите массу образовавшегося осадка.
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
вариант.
1) Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) NaOH + h4PO4 =
б) K2CO3 + HCI =
в) FeCI2 + NaOH =
2) Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) I2 + KOH = KIO3 + KI + h3O
б) CuCI + K2Cr2O7 + HCI = CuCI2 + CrCI3 + KCI + h3O
3) Определить природу соли и указать, возможен ли гидролиз соли?
а) CuCI2
б) K3PO4
в) Li2SO4
г) CuS
4) Дать расшифровку понятиям:
5) Решить задачу:
К 100г раствора, содержащего 10% хлорида меди (II), добавили гидроксид калия. Вычислите массу образовавшегося осадка.
infourok.ru
Теория электролитической диссоциации.
Проверочная работа «Электролитическая диссоциация. Свойства электролитов».
Вариант 1.
Напишите уравнения электролитической диссоциации: а) нитрата никеля, б) серной кислоты, в) сульфата алюминия, г) гидроксида бария.
Запишите отдельно вещества электролиты и неэлектролиты: Cu(NO3)2, BaSO4, KMnO4, CaCO3, h4PO4, спирт.
Вариант 2.
Напишите уравнения электролитической диссоциации: а) гидроксида кальция, б) хлорида меди (II), в) ортофосфорной кислоты, г) нитрата бария.
Запишите отдельно вещества электролиты и неэлектролиты: SiO2, Ba(OH)2, HCl, сахар, CuO, CuSO4.
Вариант 3.
Напишите уравнения электролитической диссоциации: а) сульфита натрия, б) гидрокарбоната калия, в) сульфата железа (III), г) гидроксохлорида магния.
Какие из перечисленных веществ относятся к сильным электролитам, какие к слабым: нитрат калия, угольная кислота, сероводород, гидроксид натрия?
Вариант 4.
Напишите уравнения электролитической диссоциации: а) гидросульфита лития, б) карбоната натрия, в) гидроксохлорида бария, г) хлорной кислоты HClO4.
Какие из перечисленных веществ относятся к сильным электролитам, какие к слабым: серная кислота, гидроксид алюминия, кремниевая кислота, ортофосфат калия?
Проверочная работа «Свойства различных классов соединений в свете ТЭД».
Вариант 1.
Запишите молекулярные и ионные уравнения реакций, характеризующие химические свойства соляной кислоты.
Вариант 2.
Запишите молекулярные и ионные уравнения реакций, характеризующие химические свойства гидроксида калия.
Вариант 3.
С какими из перечисленных веществ будет реагировать раствор гидроксида бария: сульфат натрия, оксид железа (III), хлорид меди (II), азотная кислота, гидроксид калия, оксид углерода (IV)? Напишите молекулярные и ионные уравнения возможных реакций.
Вариант 4.
С какими из перечисленных веществ будет реагировать раствор хлорида меди (II): нитрат серебра, хлорид натрия, железо, ортофосфорная кислота, оксид цинка, гидроксид калия? Напишите молекулярные и ионные уравнения возможных реакций.
Проверочная работа « Реакции ионного обмена. Гидролиз солей».
Вариант 1.
Запишите уравнения возможных реакций в молекулярном и ионном виде между растворами: а) нитрата серебра и ортофосфата калия, б) карбоната калия и нитрата натрия, в) сульфата меди и гидроксида натрия.
Какие из перечисленных солей подвергаются гидролизу при растворении в воде: хлорид калия, нитрат меди (II), сульфит лития?
Вариант 2.
Запишите уравнения возможных реакций в молекулярном и ионном виде между растворами: а) гидроксида калия и соляной кислоты, б) хлорида бария и сульфата натрия, в) нитрата натрия и бромоводородной кислоты.
Какие из перечисленных солей подвергаются гидролизу при растворении в воде: нитрат бария, сульфид натрия, хлорид железа (III)?
Вариант 3.
Запишите уравнения возможных реакций в молекулярном и ионном виде между растворами: а) карбоната натрия и азотной кислоты, б) хлорида магния и нитрата серебра, в) нитрата бария и соляной кислоты.
Какие из перечисленных солей подвергаются гидролизу при растворении в воде: сульфат натрия, нитрат цинка, карбонат калия?
Вариант 4.
Запишите уравнения возможных реакций в молекулярном и ионном виде между растворами: а) гидроксида кальция и ортофосфорной кислоты, б) серной кислоты и хлорида натрия, в) карбоната натрия и нитрата свинца.
Какие из перечисленных солей подвергаются гидролизу при растворении в воде: хлорид алюминия, сульфид калия, хлорид натрия?
Контрольная работа по теме: « Теория электролитической диссоциации»
Вариант 1.
Вещества, которые при диссоциации образуют в качестве катионов ионы водорода и металла являются:
1) кислотами 2) средними солями 3) щелочами 4) кислыми солями
Лампочка прибора для испытания веществ на электропроводность загорится при погружении электродов в:
1) сахар (крист.) 2) сахар (водн. р-р)
3) хлорид натрия (крист.) 4) хлорид натрия (водн.р-р)
Определите, в каких случаях может осуществляться взаимодействие между растворами следующих веществ:
1) хлорид бария и серная кислота 2) гидроксид натрия и соляная кислота
3) хлорид калия и нитрат серебра 4) нитрат калия и хлорид натрия
Напишите молекулярные и ионные уравнения реакций.
Составьте молекулярное и полное ионное уравнение реакции, соответствующее данному сокращённому:
Ca2+ + CO32- → CaCO3 ↓
Какая из реакций является окислительно – восстановительной:
CaO + h3O → Ca(OH)2
2KI + Cl2 → 2KCl + I2
CuCl2 + 2KOH → Cu(OH)2 + 2KCl
Fe2O3 + 6HCl → 2FeCl3 + h3O
Разберите ОВР методом электронного баланса.
На оксид магния массой 4 г подействовали раствором, содержащим 15 г азотной кислоты. Вычислите массу полученной соли.
Соляная кислота не реагирует с:
1) гидроксидом кальция 2) магнием 3) оксидом серы (IV) 4) карбонатом калия
Вариант 2.
Вещества, которые при диссоциации образуют только катионы металла и гидроксид-анионы, являются:
1) кислотами 2) солями 3) щелочами 4) амфотерными гидроксидами
Лампочка прибора для испытания веществ на электропроводность загорится при погружении электродов в:
1) соляную кислоту 2) оксид железа (III)
3) хлорид кальция (крист.) 4) дистиллированную воду
Определите, в каких случаях может осуществляться взаимодействие между растворами следующих веществ:
1) хлорид кальция и карбонат натрия 2) серная кислота и гидроксид натрия
3) нитрат кальция и хлорид магния 4) соляная кислота и нитрат серебра
Напишите молекулярные и ионные уравнения реакций.
Составьте молекулярное и полное ионное уравнение реакции, соответствующее данному сокращённому:
Ba2+ + SO42- → BaSO4 ↓
Какая из реакций является окислительно-восстановительной:
HBr + KOH → KBr + h3O
2NaCl + Pb(NO3)2 → 2NaNO3 + PbCl2
CuSO4 + Fe → FeSO4 + Cu
CuO + 2HCl → CuCl2 + h3O
6,5 г цинка поместили в раствор, содержащий 20 г серной кислоты. рассчитайте массу выделившегося водорода.
Гидроксид натрия в водном растворе не реагирует с:
1) соляной кислотой 2) карбонатом кальция 3) сульфатом меди (II) 4) нитратом калия
Контрольная работа по теме: « Теория электролитической диссоциации»
Вариант 3.
Сумма коэффициентов перед всеми формулами электролитов в уравнении реакции
Al + HCl → AlCl3 + h3 равна:
1) 8 2) 6 3) 4 4) 2
Между какими из перечисленных веществ возможны химические реакции: серная кислота (р-р), медь, сульфат железа (II), гидроксид меди (II), сульфат калия, гидроксид натрия? Напишите молекулярные и ионные уравнения реакций.
Допишите сокращённое ионное уравнение реакции
2H+ + ? → СO2 + ?
и составьте соответствующее молекулярное уравнение.
Допишите схему и напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Оксид серы (VI) → ? → сульфат бария
Методом электронного баланса разберите ОВР:
MnO2 + HCl → MnCl2 + Cl2 + h3O
Укажите, какие из солей подвергаются гидролизу: хлорид калия, нитрат меди, карбонат натрия? Напишите уравнения реакций гидролиза по I ступени в молекулярной и ионной формах.
К 80 г 6,6 %-го раствора нитрата свинца прилили 60 г 5%-го раствора иодида натрия. Какова масса выпавшего осадка?
Вариант 4.
Сумма коэффициентов перед всеми формулами электролитов в уравнении реакции между магнием и соляной кислотой равна:
1) 2 2) 3 3) 4 4) 5
Между какими из перечисленных веществ возможны химические реакции: азотная кислота (р-р), оксид меди (II), гидроксид железа (II), хлорид меди (II), нитрат натрия, гидроксид кальция? Напишите молекулярные и ионные уравнения реакций.
Допишите сокращённое ионное уравнение реакции H+ + ? → Н2О и составьте соответствующее молекулярное уравнение.
Допишите схему и напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Оксид кальция → ? → карбонат кальция
Методом электронного баланса разберите ОВР:
Cu + h3SO4 → CuSO4 + SO2 + h3O
Укажите, какие из солей подвергаются гидролизу: хлорид цинка, нитрат натрия, сульфат калия? Напишите уравнения реакций гидролиза по I ступени в молекулярной и ионной формах.
Какой объём водорода (н.у.) можно получить при действии 228 мл 5%-го раствора серной кислоты (плотность 1,032 г/мл) на 9 г цинка
videouroki.net
 Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
 Вариант 5 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химическому элементу, в атоме которого распределение электронов по слоям 2е,
Вариант 5 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химическому элементу, в атоме которого распределение электронов по слоям 2е,
 Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
 ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
 2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
 Вариант 2 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
Вариант 2 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
 Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
 ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
 Вариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 1 2 3 4 изображен модель атома 1) кремния 2) серы 3)
Вариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 1 2 3 4 изображен модель атома 1) кремния 2) серы 3)
 1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: - химические уравнения; Вам необходимо
1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: - химические уравнения; Вам необходимо
 ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ «МИСиС»
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ «МИСиС»
 Проект Проект Государственная (итоговая) аттестация 2010 года (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные программы Демонстрационный вариант контрольных измерительных материалов
Проект Проект Государственная (итоговая) аттестация 2010 года (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные программы Демонстрационный вариант контрольных измерительных материалов
 Химия. 9 класс. I 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные
Химия. 9 класс. I 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные
 Химия. 9 класс. I Используется с бланками ответов - 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по
Химия. 9 класс. I Используется с бланками ответов - 2 Демонстрационный вариант 1 контрольных измерительных материалов для проведения в 2014 году государственной (итоговой) аттестации (в новой форме) по
 18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
 Экзаменационная работа для проведения государственной (итоговой) аттестации выпускников IX классов общеобразовательных учреждений 2008 года (в новой форме) по ХИМИИ Демонстрационный вариант 2008 года Район
Экзаменационная работа для проведения государственной (итоговой) аттестации выпускников IX классов общеобразовательных учреждений 2008 года (в новой форме) по ХИМИИ Демонстрационный вариант 2008 года Район
 Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
 УДК 373.167.1:54 12+ ББК 24я72 Я11 Авторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова Модульный курс «Я сдам ЕГЭ!» создан авторским коллективом
УДК 373.167.1:54 12+ ББК 24я72 Я11 Авторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова Модульный курс «Я сдам ЕГЭ!» создан авторским коллективом
 ХИМИЯ МЕТАЛЛОВ 1. Какая из электронных формул отражает строение атома натрия: 1. 1s 2 2s 2 2p 6 3s 1 ; 2. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ; 3. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ; 4. 1s 2 2s 1. 2. Какие
ХИМИЯ МЕТАЛЛОВ 1. Какая из электронных формул отражает строение атома натрия: 1. 1s 2 2s 2 2p 6 3s 1 ; 2. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ; 3. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ; 4. 1s 2 2s 1. 2. Какие
 Демонстрационный вариант контрольных измерительных материалов для проведения в 2011 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные
Демонстрационный вариант контрольных измерительных материалов для проведения в 2011 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные
 Химия. 9 класс 2 Демонстрационный вариант контрольных измерительных материалов для проведения в 2012 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные
Химия. 9 класс 2 Демонстрационный вариант контрольных измерительных материалов для проведения в 2012 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные
 Демонстрационный вариант контрольных измерительных материалов для проведения в 2011 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные
Демонстрационный вариант контрольных измерительных материалов для проведения в 2011 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные
 Химия. 9 класс Используется с бланками ответов - 2 Демонстрационный вариант контрольных измерительных материалов для проведения в 2013 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ
Химия. 9 класс Используется с бланками ответов - 2 Демонстрационный вариант контрольных измерительных материалов для проведения в 2013 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ
 Приложение к рабочей программе по химии для 8 класса Примерные оценочные и методические материалы для осуществления текущего контроля успеваемости и промежуточной аттестации учащихся 8 го класса по химии
Приложение к рабочей программе по химии для 8 класса Примерные оценочные и методические материалы для осуществления текущего контроля успеваемости и промежуточной аттестации учащихся 8 го класса по химии
docplayer.ru
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
1 вариант.
ЗАДАНИЯ по теме «ЭД», «РИО»
Дать определения следующим понятиям:
А) Электролитическая диссоциация – это процесс
Б) электролит – это
Примеры электролитов (2-3 вещества):
В) неэлектролит – это
Примеры неэлектролитов (2-3 вещества):
Г) РИО – это реакции
Д) условия протекания РИО до конца:
1)
2)
3)
Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения (на выбор 1 из трех предложенных):
а) KCl + AgNO3 =
б) Na2CO3 + h3SO4=
в) CuCl2 + NaOH =
ЗАДАНИЯ по теме «ОВР»
Дать определения следующим понятиям:
А) ОВР – это реакция
Б) окислитель – это
В) восстановитель – это
Г) процесс окисления – это
Д) процесс восстановления - это
Используя метод электронного баланса, составьте уравнение реакции

Определите окислитель и восстановитель.
Установите соответствие между схемой реакции и свойством элемента серы, которое она проявляет в этой реакции.
СХЕМА РЕАКЦИИ
СВОЙСТВО СЕРЫ
А) 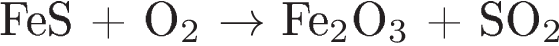
Б) 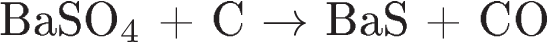
В) 
Г)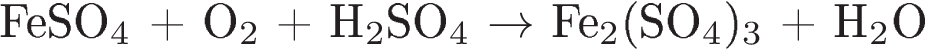
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств
Одинаковую степень окисления железо проявляет в соединениях:
1) 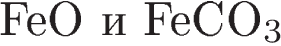 2)
2) 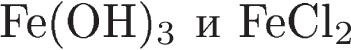 3)
3) 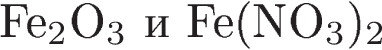 4)
4) 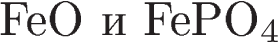
ЗАДАНИЯ по теме «ГИДРОЛИЗ солей»
Дать определения следующим понятиям:
А) гидролиз – это
Б) по какой части соли идет гидролиз -
В) катион – это
Г) анион – это
2. Установите соответствие между названием соли и её отношением к гидролизу.
НАЗВАНИЕ СОЛИПРИРОДА СОЛИ: каким основанием (слабым или сильным) и какой кислотой (слабой или сильной) она образована
ОТНОШЕНИЕ К ГИДРОЛИЗУ
A) фторид калия
Б) сульфид свинца (II)
B) фосфат натрия
Г) нитрит бария
1) гидролизуется по катиону
2) гидролизуется по аниону
3) не гидролизуется
4) гидролизуется по катиону и по аниону
3. Установите соответствие между формулой соли и средой её водного раствора.
ФОРМУЛА СОЛИПРИРОДА СОЛИ: каким основанием (слабым или сильным) и какой кислотой (слабой или сильной) она образована
СРЕДА РАСТВОРА
A) 
Б) 
B) 
Г) 
1) щелочная
2) нейтральная
3) кислая
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
2 вариант.
ЗАДАНИЯ по теме «ЭД», «РИО»
Дать определения следующим понятиям:
А) Электролитическая диссоциация – это процесс
Б) электролит – это
Примеры электролитов (2-3 вещества):
В) неэлектролит – это
Примеры неэлектролитов (2-3 вещества):
Г) РИО – это реакции
Д) условия протекания РИО до конца:
1)
2)
3)
Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения (на выбор 1 из трех предложенных) :
а) НCl + Na2SO3 =
б) Na2CO3 + Pb(NO3)2=
в) FeCl2 + KOH =
ЗАДАНИЯ по теме «ОВР»
Дать определения следующим понятиям:
А) ОВР – это реакция
Б) окислитель – это
В) восстановитель – это
Г) процесс окисления – это
Д) процесс восстановления - это
Используя метод электронного баланса, составьте уравнение реакции
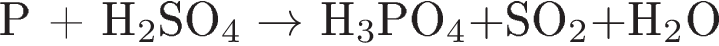
Определите окислитель и восстановитель.
Установите соответствие между схемой реакции и свойством элемента серы, которое она проявляет в этой реакции.
СВОЙСТВО ХЛОРА
A)
Б)
B)
Г)
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) ни окислитель, ни восстановитель
4. Степень окисления, равную −2, сера проявляет в каждом из двух соединений:
1)  и
и 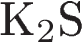 2)
2)  и
и  3)
3) 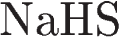 и
и 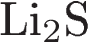 4)
4)  и
и 
ЗАДАНИЯ по теме «ГИДРОЛИЗ солей»
Дать определения следующим понятиям:
А) гидролиз – это
Б) по какой части соли идет гидролиз -
В) катион – это
Г) анион – это
2. Установите соответствие между названием соли и её отношением к гидролизу.
НАЗВАНИЕ СОЛИПРИРОДА СОЛИ: каким основанием (слабым или сильным) и какой кислотой (слабой или сильной) она образована
ОТНОШЕНИЕ К ГИДРОЛИЗУ
A) фосфат аммония
Б) нитрат цинка
B) карбонат калия
Г) сульфат натрия
1) гидролизуется по катиону
2) гидролизуется по аниону
3) не гидролизуется
4) гидролизуется по катионуи по аниону
3. Установите соответствие между формулой соли и средой её водного раствора.
ФОРМУЛА СОЛИПРИРОДА СОЛИ: каким основанием (слабым или сильным) и какой кислотой (слабой или сильной) она образована
СРЕДА РАСТВОРА
А) 
Б) 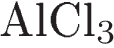
В) 
Г) 
1) щелочная
2) нейтральная
3) кислая
infourok.ru
 С этим файлом связано 41 файл(ов). Среди них: ПР №2_8_класс.ppt.ppt, Контрольная работа№ 2.doc для 9-х классов.doc, genialno.gif, 11кл_ХИМИЯ_КР №2.docx, Практическая работа № 3 Распознавание веществ.ppt.ppt, 8_klass_dlya_podgotovki_k_testu_po_teme_quot_Khimich_reaktsii_qu, Практическая работа №9 Знакомство с образцами хим средст санитар, Практическая работа №5_CO2.ppt.ppt, Zadachi_dlya_8_klassa.pdf и ещё 31 файл(а).
С этим файлом связано 41 файл(ов). Среди них: ПР №2_8_класс.ppt.ppt, Контрольная работа№ 2.doc для 9-х классов.doc, genialno.gif, 11кл_ХИМИЯ_КР №2.docx, Практическая работа № 3 Распознавание веществ.ppt.ppt, 8_klass_dlya_podgotovki_k_testu_po_teme_quot_Khimich_reaktsii_qu, Практическая работа №9 Знакомство с образцами хим средст санитар, Практическая работа №5_CO2.ppt.ppt, Zadachi_dlya_8_klassa.pdf и ещё 31 файл(а). Показать все связанные файлы 8 класс
Показать все связанные файлы 8 класс Контрольная работа по теме Электролитическая диссоциация
1. Наибольшее число ионов образуется в растворе при диссоциации 1 моль
1.сульфата цинка
2.хлорида магния
3.нитрата цинка
4.хлорида алюминия2. Наибольшее число ионов натрия образуется при диссоциации 1 моль
1.NaNO3
2.Na2SO4
3.Na3PO4
4.NaOh4. Катионы металла и гидроксид-ионы образуются при диссоциации
1.оснований
2.оксидов
3.кислот
4.средних солей4. Наибольшее количество анионов образуется при диссоциации 1 моль
1.хлорида бария
2.нитрата железа (III)
3.карбоната кальция
4.серной кислоты5. При полной диссоциации 2 моль хлорида железа (III) в растворе образуется
1.3 моль катионов железа и 6 моль хлорид-ионов
2.2 моль катионов железа и 6 моль хлорид-ионов
3.6 моль катионов железа и 2 моль хлорид-ионов
4.2 моль катионов железа и 3 моль хлорид-ионов6. Наименьшее число ионов образуется при диссоциации 0,5 моль
1.KNO2
2.K2S
3.CaCl2
4.Al(NO3)37. 4 моль ионов образуется при полной диссоциации 2 моль
1.K2SO4
2.Nh5Cl
3.CuCl2
4.Na3PO4
8. Какой из приведенных реакций не соответствует сокращенное ионное уравнение:
Ba2+ + SO42- = BaSO4?1) BaCl2 + h3SO4 = BaSO4 + 2HCl
2) Ba(OH)2 + h3SO4 = BaSO4 + 2h3O
3) 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3
4) Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO39. Какой из приведенных реакций соответствует сокращенное ионное уравнение
Ca2+ + CO32- = CaCO3?
1. CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2. Ca(OH)2 + CO2 + CaCO3 + h3O
3.Ca(HCO3)2 = CaCO3 + CO2 + h3O
4. CaO + CO2 = CaCO3
10. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1. Нитрат калия и хлорид кальция
2.карбонат бария и соляная кислота
3. гидроксид бария и соляная кислота
4. гидроксид бария и серная кислота
11. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1.сульфид натрия и соляная кислота
2. силикат натрия и соляная кислота
3. карбонат натрия и соляная кислота
4. хлорид натрия и серная кислота
12. Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl-
2) Cu2+ и S2-
3) Al3+ и SO42-
4) Zn2+ и NO3-
13. При сливании каких двух растворов в воде практически не остается ионов?
1. BaCl2 и Na2SO4
2. h3SO4 и Ba(OH)2
3. HNO3 и Ba(OH)2
4. HCl и Ba(OH)2
14. При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1. Nh5Cl
2. CuCl2
3. ZnSO4
4. h4PO415.Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции между гидроксидом железа (III) и соляной кислотой равны
1.14 и 8
2.18 и 8
3.18 и 6
4.14 и 616.Реакция ионного обмена идет до конца между веществами
1.сульфатом калия и соляной кислотой
2.гидроксидом натрия и нитратом магния
3.нитратом калия и карбонатом натрия
4.гидроксидом натрия и хлоридом калия17. Реакция ионного обмена идет до конца в результате выделения газа между веществами
1.углекислым газом и гидроксидом натрия
2.хлоридом бария и сульфатом магния
3.соляной кислотой и гидроксидом кальция
4.карбонатом калия и азотной кислотой18. Сокращенное ионное уравнение H+ + OH- = h3O соответствует взаимодействию
1.аммиака с водой
2.азотной кислоты и гидроксида натрия
3.аммиака с азотной кислотой
4.хлорида аммония с гидроксидом кальция19. Сокращенное ионное уравнение CO32- + 2H+ =CO2↑ + h3O соответствует взаимодействию
1.карбоната калия и серной кислоты
2.карбоната кальция и соляной кислоты
3.карбоната натрия и сероводородной кислоты
4.углекислого газа и воды20. Необратимо протекает реакция ионного обмена между
1.хлоридом натрия и гидроксидом калия
2.нитратом калия и сульфатом цинка
3.гидроксидом натрия и хлоридом алюминия
4.оксидом серы (VI) и соляной кислоты21. Сокращенное ионное уравнение реакции Mg2+ + 2OH- = Mg(OH)2↓соответствует взаимодействию
1.раствора соли магния со щелочью
2.нерастворимой соли магния со щелочью
3.раствора соли магния с нерастворимым основанием
4.магния со щелочью перейти в каталог файлов
перейти в каталог файлов
uhimik.ru
Контрольная работа по теме: « Растворы. Электролитическая диссоциация»
Вариант 1
В один сосуд вылили 200 г 5% -ного раствора некоторого вещества, 250 г 10% -ного раствора этого же вещества, затем добавили 80 г этого вещества и 120 г воды. Вычислите массовую долю данного вещества в образовавшемся растворе.
К 200 г 20% -ного раствора гидроксида натрия добавили азотную кислоту. Вычислите массу образовавшейся соли. Уравнение протекающей реакции:
NaOH + HNO3 = NaNO3 + h3O
Напишите уравнения диссоциации следующих веществ: BaCl2, Ca(OH)2, h3SO4, K3PO4, Na2S, NaOH, CuSO4, NaHCO3.
Контрольная работа по теме: « Растворы. Электролитическая диссоциация»
Вариант 1
В один сосуд вылили 200 г 5% -ного раствора некоторого вещества, 250 г 10% -ного раствора этого же вещества, затем добавили 80 г этого вещества и 120 г воды. Вычислите массовую долю данного вещества в образовавшемся растворе.
К 200 г 20% -ного раствора гидроксида натрия добавили азотную кислоту. Вычислите массу образовавшейся соли. Уравнение протекающей реакции:
NaOH + HNO3 = NaNO3 + h3O
Напишите уравнения диссоциации следующих веществ: BaCl2, Ca(OH)2, h3SO4, K3PO4, Na2S, NaOH, CuSO4, NaHCO3.
Контрольная работа по теме: « Растворы. Электролитическая диссоциация»
Вариант 1
В один сосуд вылили 200 г 5% -ного раствора некоторого вещества, 250 г 10% -ного раствора этого же вещества, затем добавили 80 г этого вещества и 120 г воды. Вычислите массовую долю данного вещества в образовавшемся растворе.
К 200 г 20% -ного раствора гидроксида натрия добавили азотную кислоту. Вычислите массу образовавшейся соли. Уравнение протекающей реакции:
NaOH + HNO3 = NaNO3 + h3O
Напишите уравнения диссоциации следующих веществ: BaCl2, Ca(OH)2, h3SO4, K3PO4, Na2S, NaOH, CuSO4, NaHCO3.
Контрольная работа по теме: « Растворы. Электролитическая диссоциация»
Вариант 2
В один сосуд вылили 50 г 2% -ного раствора соли, затем добавили 30 г 4% -ного раствора той же соли и 40 г ее 5% -ного раствора. Раствор нагрели, в результате чего испарилось 20 г воды. Вычислите массовую долю соли в полученном растворе.
К 126 г 25% -ного раствора азотной кислоты добавили гидроксид калия. Вычислите массу образовавшейся соли. Уравнение протекающей реакции:
HNO3 + KOH = KNO3 + h3O
Напишите уравнения диссоциации следующих веществ: Ba(OH)2, NaCl, Mg3(PO4)2, h3SO3, KHSO4, Nh5Cl, LiOH, Al2(SO4)3.
Контрольная работа по теме: « Растворы. Электролитическая диссоциация»
Вариант 2
В один сосуд вылили 50 г 2% -ного раствора соли, затем добавили 30 г 4% -ного раствора той же соли и 40 г ее 5% -ного раствора. Раствор нагрели, в результате чего испарилось 20 г воды. Вычислите массовую долю соли в полученном растворе.
К 126 г 25% -ного раствора азотной кислоты добавили гидроксид калия. Вычислите массу образовавшейся соли. Уравнение протекающей реакции:
HNO3 + KOH = KNO3 + h3O
Напишите уравнения диссоциации следующих веществ: Ba(OH)2, NaCl, Mg3(PO4)2, h3SO3, KHSO4, Nh5Cl, LiOH, Al2(SO4)3.
Контрольная работа по теме: « Растворы. Электролитическая диссоциация»
Вариант 2
В один сосуд вылили 50 г 2% -ного раствора соли, затем добавили 30 г 4% -ного раствора той же соли и 40 г ее 5% -ного раствора. Раствор нагрели, в результате чего испарилось 20 г воды. Вычислите массовую долю соли в полученном растворе.
К 126 г 25% -ного раствора азотной кислоты добавили гидроксид калия. Вычислите массу образовавшейся соли. Уравнение протекающей реакции:
HNO3 + KOH = KNO3 + h3O
Напишите уравнения диссоциации следующих веществ: Ba(OH)2, NaCl, Mg3(PO4)2, h3SO3, KHSO4, Nh5Cl, LiOH, Al2(SO4)3.
infourok.ru