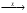 NaCl
NaCl 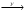 AgCl веществами «Х» и «У» являются соответственно:(1) NaOH и Ag (2) Na и Ag(3) Na2SO4 и AgNO3 (4) Na и AgNO3
AgCl веществами «Х» и «У» являются соответственно:(1) NaOH и Ag (2) Na и Ag(3) Na2SO4 и AgNO3 (4) Na и AgNO3ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ
СТРОЕНИЕ ВЕЩЕСТВАВАРИАНТ 1
Рассчитайте молекулярные массы веществ, а также массовую долю кислорода в каждом из веществ:
1) h4PO42) LiOH 3) Ca3(PO4)2
Установить формулу кристаллогидрата (вещества, содержащего воду), содержащего 8,11 % Al, 28,83 % O, 14,41 % S и 48,65 % h3O.
Определить количество вещества кислорода (O2) содержащегося в порции кислорода объемом 56 л.
Рассчитать относительную плотность азота по гелию.
Расставить коэффициенты в уравнениях следующих химических реакций:
1) Nh5NO3→ N2+ h3O 2) LiOH + h4PO4→ Li3PO4+ h3O
3) HgO → Hg + O24) Al + O2→ Al2O3
Горячий раствор KOH реагирует с хлором по схеме: KOH + Cl2 KCl + KClO3 + h3O. Сколько KOH потребуется для взаимодействия с 0,8 л хлора?
Кто является первооткрывателем скандия? Какова этимология его названия?
Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в основном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
1) бор 2) алюминий 3) ртуть
Составить электронные формулы ионов и графические схемы заполнения электронами валентных орбиталей.
1) Li+2) C2+3) S2-
Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления и определить элемент.
1) 2s22) 2s22p53) 3d54s2
Расположите следующие химические элементы по возрастанию
А) энергии ионизации их атомов;
Б) металлических свойств;
В) радиуса атома;
Г) электроотрицательности.
1) Mg 2) H 3) O 4) F 5) Sc
Дать характеристику элементу НАТРИЮ по его положению в периодической системе химических элементов Д.И. Менделеева по следующему плану:
Положение в периодической системе:
порядковый номер;
период;
группа;
подгруппа.
Строение атома:
число электронов, протонов и нейтронов в его атоме;
структура внешней электронной оболочки атома;
валентность в основном и возбужденном состояниях.
Тип элемента и его свойства:
s, p, d, f
металл, неметалл, переходный элемент
формула высшего оксида и водородного соединения
Определить тип и механизм образования химической связи (ионная, ковалентная: полярная, неполярная, обменный и донорно-акцепторный механизмы, металлическая, водородная) для веществ, а также тип кристаллической решетки для их твердого состояния (ионная, атомная, молекулярная, металлическая) и степень окисления каждого атома:
1) h32) LiOH 3) h4PO44) KClO4
Перечислите все известные аллотропные модификации углерода.
ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ
СТРОЕНИЕ ВЕЩЕСТВАВАРИАНТ 2
Рассчитайте молекулярные массы веществ, а также массовую долю кислорода в каждом из веществ:
1) HNO32) Fe(OH)33) Cl2O5
Установить формулу кислородного соединения азота, в котором массовая доля азота равна 30,4%, кислорода – 69,6%.
Определить количество вещества кислорода (O2) содержащегося в порции кислорода массой 56 г.
Рассчитать относительную плотность кислорода по водороду.
Расставить коэффициенты в уравнениях следующих химических реакций:
1) N2+ O2→ NO 2) NO + O2→ NO2
3) NO2+ O2+ h3O → HNO34) HNO3+ Ba(OH)2→ Ba(NO3)2+ h3O
infourok.ru
Контрольная работа № 2 по теме «Строение вещества»
Вариант 1
Между атомами элементов с порядковыми номерами 17 и 20 образуется химическая связь
ковалентная полярная
ковалентная неполярная
металлическая
ионная
Молекулярную кристаллическую решётку в твёрдом состоянии имеет каждое из двух веществ:
хлорид калия и нитрат натрия
хлорид аммония и аммиак
водород и кислород
уксусная кислота и ацетат калия
Изомером циклобутана является:
бутадиен-1,3
бутен-2
бутин-1
циклопентан
Молекулярное строение имеет 1) С12 2) СаО 3) ZnCl2 4) NaBr
Кристаллическая решетка хлорида кальция 1) металлическая 2) молекулярная 3) ионная 4) атомная
Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1) алмаза 2)поваренной соли 3)кремния 4)азота
Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическая 2) молекулярная 3) ионная 4) атомная
Вещество в молекуле которой нет π-связи
1) этилен 2) бензол 3) аммиак 4) азот
Атомную кристаллическую решетку имеет
1) сода 2) йод 3) алмаз 4) парафин
Выберите ряд, в котором элементы расположены в порядке возрастания электроотрицательности
1) Cl, Si, N, O 2) Si, P, N, F 3) F, Cl, O, Si 4) O, N, F, Cl
Между атомами есть ковалентная связь, образованная по донорно-акцепторному механизму в веществе, формула которого
1) Al(OH)3 2) [Ch4Nh4]Cl 3) C2H5OH 4) Ch4Nh3
Водородная связь образуется между молекулами
1) метана 2) диэтилового эфира 3) бутанола 4) ацетальдегида
Если интенсивно взболтать смесь растительного масла и воды, то получится
1) суспензия 2) эмульсия 3) пена 4) аэрозоль
Наиболее прочная связь в
1) C-Cl 2) C-F 3) C-Br 4) C-I
Число σ и π связей в молекуле пропина соответственно равно
1) 2 и 6 2) 5 и 1 3) 6 и 2 4) 5 и 2
Немолекулярное строение имеет 1) Н2О 2) I2 3) SiО2 4) СО2
Соотнесите тип связи и формулу вещества Тип Связи Формула вещества 1.Металлическая А.NaCl Б. O2 2.Ковалентная полярная В.HCl Г.SiO2 3.Ковалентная неполярная Д.Cu Е.CO2 4.Ионная Ж.O3
Соотнесите тип гибридизации и формулу вещества Тип гибридизации Формула вещества 1.sp2 А. этан2.sp Б. циклопентан 3.sp3 В. ацетиленГ. бензолД. этилен
Выпишите примеры коллоидных систем отвечающих схеме: Среда (жидкость ) – фаза (газ) 1)Туман 2) Зубная паста 3) Мыльная пена 4) Смесь в огнетушителе 5)Нефть
Установите соответствие между названием вещества и типом кристаллической решетки.
Название вещества: Тип кристаллической решетки:
оксид углерода (IV) А) металлическая;
алмаз Б) ионная;
натрий В) атомная;
фторид магния Г) молекулярная.
Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды.
Дисперсная система: Агрегатное состояние дисперсной фазы / дисперсионной среды:
минеральная вода А) газ / жидкость;
снежный наст Б) газ / твердое вещество;
нержавеющая сталь В) твердое вещество / твердое вещество.
Какую массу сульфата меди необходимо добавить к 100 г 10% раствора той же соли чтобы получить 20% раствор.
Магний массой 4, 8 г растворили в 200 мл 12% раствора серной кислоты плотностью 1, 05 г\мл. Вычислите массовую долю соли в растворе.
Контрольная работа № 2 по теме «Строение вещества»
Вариант 2
Только ковалентные связи присутствуют в каждом из двух соединений:
1) K2SO4 и Nh5Cl
2) Ash4 и KI
3) Mg(NO3)2 и KSCN
4) C6H5NO2 и SOCl2
Атомную кристаллическую решётку в твёрдом состоянии имеет каждое из двух веществ:
хлорид калия и нитрат натрия
йод и сера
алмаз и графит
уксусная кислота и ацетат калия
Для какого вещества характерна цис-транс-изомерия
1) циклогексан 2) пропин 3) гексен-2 4) бутен-1
Не молекулярное строение имеет 1) С12 2) СО 3) ZnCl2 4) НBr
Кристаллическая решетка хлороводорода 1) металлическая 2) молекулярная 3) ионная 4) атомная
Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1) графита 2)поваренной соли 3) кремния 4)озона
Вещества с низкой температурой плавления, летучие, неэлектропроводные, имеют, как правило, кристаллическую решётку:
1) молекулярную 2) металлическую 2) атомную 3)ионную
Вещество в молекуле которой нет π-связи
1) ацетилен 2) бензол 3) азот 4) хлор
Ионную кристаллическую решетку имеет
1) сода 2) йод 3) алмаз 4) парафин
Выберите ряд, в котором элементы расположены в порядке уменьшения электроотрицательности
1) Cl, Si, N, O 2) Si, P, N, F 3) F, Cl, O, Si 4) O, N, F, Cl
Между атомами есть ковалентная связь, образованная по донорно-акцепторному механизму в веществе, формула которого
1) Zn(OH)2 2) [C2H5Nh4]Cl 3) Nh4 4) Ch4Nh3
Водородная связь образуется между
1) молекулами аммиака 2) молекулами диэтилового эфира
3) молекулами водорода 4) молекулами ацетальдегида
Если интенсивно взболтать воду и песок, то получится
1) суспензия 2) эмульсия 3) пена 4) аэрозоль
Наименее прочная связь в
1) C-Cl 2) C-F 3) C-Br 4) C-I
Число σ и π связей в молекуле пропена соответственно равно
1) 2 и 7 2) 7 и 1 3) 6 и 2 4) 1 и 7
Молекулярное строение имеет 1) Н2О 2) С 3) SiО2 4) СaCl2
Соотнесите тип связи и формулу вещества
Тип Связи Формула вещества 1. ковалентная неполярная А) Аl;
2. ионная Б) РН3;
3. металлическая В) CaS
4. ковалентная полярная Г) S2.
Д) Nh5Cl
Соотнесите тип гибридизации и название класса Тип гибридизации Название класса 1. sp2 А. Алкены 2.sp Б. Алкины 3.sp3 В. Алкадиены Г.Алканы
Д.Арены
Выпишите примеры коллоидных систем отвечающих схеме: Среда(твердая )- фаза (жидкость) 1) Почва 2) Ил 3) Асфальт 4) Крем 5) Силикагель
Установите соответствие между названием вещества и типом кристаллической решетки.
Название вещества: Тип кристаллической решетки:
графит; А )молекулярная;
сульфат натрия; Б) металлическая
калий; В) атомная;
иод. Г) ионная.
Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды.
Дисперсная система: Агрегатное состояние дисперсной фазы / дисперсионной среды:
1. чугун а) твердое вещество / газ
2. смог б) твердое вещество / твердое вещество;
3. пористый шоколад в) газ / твердое вещество.
Какую массу сульфата натрия необходимо добавить к 150 г 15% раствора той же соли чтобы получить 25% раствор.
Цинк массой 5,6 г растворили в 150 мл 15% раствора серной кислоты плотностью 1, 05 г\мл. Вычислите массовую долю соли в растворе.
infourok.ru
Контрольная работа №1 по теме «Строение вещества» 10 кл.
I вариант.
Элементу, электронная формула которого 1s22s22p63s23p4,
соответствует водородное соединение:(1) HЭ (2) Эh4 (3) h3Э (4) Эh5.
Изобразите строение атома этого элемента и объясните его валентные возможности.
В каком ряду представлены только вещества с ковалентной неполярной связью:(1) HCl, O2, CO2 (2) N2, O3, h3(3) Cu, NaI, h3O (4) Ch5, Nh4, F2
Зарисуйте электронную и структурную формулу первого соединения в строке.
Ионную кристаллическую решетку имеет:(1) графит (2) бромоводород (3) железо (4) бромид аммония
Минимальную степень окисления сера проявляет в соединении:(1) K2SO4 (2) Na2SО3 (3) SO2 (4) CaS
К солям относится каждое из двух веществ:(1) КCl и NaHSO3 (2) h3SO3 и Cr(OH)3(3) Nh4 и MgBr2 (4) h3S и CaCO3
Могут взаимодействовать друг с другом:(1) Fe и Ca(OH)2 (2) Al и KNO3 3) Al и NaOH (4) Cu и HCl
Металлические свойства простых веществ в ряду
Na ->Mg-> Al->Ca->K:
а) возрастают;
б) уменьшаются;
в) вначале ослабевают, затем усиливаются;
г) вначале возрастают, затем уменьшаются.
8. Линейную форму имеет молекула:
а) Nh4; б)h3O; в)h3S; г) HCl
Составьте ее электронную формулу, укажите, в сторону атомов какого элемента смещается общая электронная пара, и изобразите схему перекрывания атомных орбиталей.
9. Из приведенных формул выпишите формулы веществ немолекулярного строения: CaO, HBr, CaCO3, h3CO3, Mg, Сl2O7, h3SO4, KNO3.
10.В схеме превращений Cl2 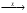 NaCl
NaCl 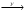 AgCl веществами «Х» и «У» являются соответственно:(1) NaOH и Ag (2) Na и Ag(3) Na2SO4 и AgNO3 (4) Na и AgNO3
AgCl веществами «Х» и «У» являются соответственно:(1) NaOH и Ag (2) Na и Ag(3) Na2SO4 и AgNO3 (4) Na и AgNO3
Составьте уравнения соответствующих реакций.
11. При взаимодействии цинка массой 13г. с избытком соляной кислоты образовался газ, объемом (н.у.)
А) 2,24л; б)4,48л.; в)1,12л.; г)3,36л.
Выбранный ответ подтвердите решением задачи.
Контрольная работа №1 по теме «Строение вещества» 10 кл.
II вариант.
Элементу, электронная формула которого 1s22s22p63s23p3, соответствует высший оксид(1) ЭО3 (2) Э2О5 (3) Э2О3 (4) ЭО2
Изобразите строение атома этого элемента и объясните его валентные возможности.
В ряду веществ водород, аммиак, хлорид кальция, азот, метан количество веществ с ковалентной неполярной связью равно:(1) одному (2) двум (3) трем (4) четырем
Зарисуйте электронную и структурную формулу одного из соединений.
Атомную кристаллическую решетку имеет:(1) кислород (2) графит(3) оксид углерода (IV) (4) хлороводород
Высшую степень окисления хлор проявляет в кислоте:(1) HCl (2) HClО (3) HClО4 (4) HClО3
Основным является каждый из двух оксидов:(1) Cs2O и CaO (2) SO3 и P2O5(3) ZnO и K2O (4) Al2O3 и BaO
Гидроксид бария не взаимодействует с:(1) HCl (2) CO2 (3) CaCl2 (4) h3SO4
Атомные радиусы химических элементов уменьшаются в ряду:
А)Zn,Cd,Ca,K; Б) I,Br,Se,As;
В )Ga, Ge, As ,Se Г) P,N,C,B.
Треугольную форму имеет молекула:
А)Nh4; Б)Seh3; В)BeCl2; Г)BCl3
Cоставьте ее электронную формулу, изобразите схему перекрывания атомных орбиталей и укажите, полярна или неполярна эта молекула.
Из приведенных формул выпишите формулы веществ молекулярного строения: CaO, HBr, CaCO3, h3CO3, Mg, Сl2O7, h3SO4, KNO3, Cl2.
В схеме превращений Na 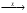 NaOH
NaOH 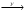 Na2CO3 веществами «Х» и «У» являются соответственно:(1) Н2О и СО2 (2) Na2O и CO2(3) h3O и CO (4) h3O и CaCO3
Na2CO3 веществами «Х» и «У» являются соответственно:(1) Н2О и СО2 (2) Na2O и CO2(3) h3O и CO (4) h3O и CaCO3
Составьте уравнения соответствующих реакций.
Количество вещества и объем кислорода, необходимого для получения 18г воды, составляют:
А) 0,5 моль и 22,4л;
Б) 1 моль и 11,2л;
В) 0,5 моль и 11,2л;
Г) 1 моль и 22,4л.
Выбранный ответ подтвердите решением задачи.
infourok.ru
Контрольная работа №1 «Строение Вещества»
---------------------------------------------------------------------------------------------------
Вариант 1.
Покажите образование связи в веществах MgF2, Br2, CF4. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Sih5. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H8. Укажите виды изомерии.
Сравните кислотные свойства сероводорода и хлороводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы индия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 2.
Покажите образование связи в веществах AlF3, CO2, F2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы SF4. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C3H6O2. Укажите виды изомерии.
Сравните кислотные свойства трихлоруксусной и уксусной кислот. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы лантана. К какому семейству относится этот элемент?
---------------------------------------------------------------------------------------------
Вариант 3.
Покажите образование связи в веществах NaBr, S2, SCl2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы NCl3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H6. Укажите виды изомерии.
Сравните основные свойства гидроксидов калия и магния. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы актиния. К какому семейству относится этот элемент?
Вариант 4.
Покажите образование связи в веществах CaCl2, F2, HCl. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы CO2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C2h5O2. Укажите виды изомерии.
Сравните окислительные свойства азотной и фосфорной кислот. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы европия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 5.
Покажите образование связи в веществах AlBr3, h3O, Br2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы C2h5. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h23N. Укажите виды изомерии.
Сравните восстановительные свойства сероводорода и фтороводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно–графическую формулы церия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
------------------------------------------------------------------------------------------------------------------------
Вариант 6.
Покажите образование связи в веществах K2O, HI, P2O5. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BeBr2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H6Cl2. Укажите виды изомерии.
Сравните основные свойства анилина и метиламина. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно–графическую формулы америция. К какому семейству относится этот элемент?
Вариант 7.
Покажите образование связи в веществах BaO, P2O3, h3. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BCl3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4h21N. Укажите виды изомерии.
Сравните кислотные свойства этанола и воды. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы вольфрама. К какому семейству относится этот элемент?
---------------------------------------------------------------------------------------------------
Вариант 8*.
Покажите образование связи в веществах MgCl2, SiO2, CO2 . Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы PCl5. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C3H7NO2. Укажите виды изомерии.
Докажите 1-2 примерами, что резкой границы между разными видами химической связи нет.
Постройте электронную и электронно-графическую формулы радия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 9.
Покажите образование связи в веществах LiI, SO3, N2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BeI2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h20. Укажите виды изомерии.
Сравните кислотные свойства этанола и фенола. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы свинца. К какому семейству относится этот элемент?
Вариант 10.
Покажите образование связи в веществах ZnO, HBr, SO2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BI3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H9Cl. Укажите виды изомерии.
Сравните основные свойства аммиака и фосфина. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы гафния. К какому семейству относится этот элемент?
-------------------------------------------------------------------------------------------------------------------------------
Вариант 11.
Покажите образование связи в веществах CaF2, O2, Ph4. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Ch5. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h21OH. Укажите виды изомерии.
Сравните основные свойства гидроксида натрия и алюминия. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы осмия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 12*.
Покажите образование связи в веществах O3, HNO3, Nh4. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы IF7. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H8ClOH. Укажите виды изомерии.
Покажите на 1-2 примерах взаимное влияние атомов в молекулах.
Постройте электронную и электронно-графическую формулы теллура. К какому семейству относится этот элемент?
Вариант 13.
Покажите образование связи в веществах MgO, NaH, Ph4. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы h3O. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h20. Укажите виды изомерии.
Сравните восстановительные свойства фтороводорода и йодоводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы полония. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 14.
Покажите образование связи в веществах Al2O3, Sih5, Cl2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Ph4. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h20. Укажите виды изомерии.
Сравните кислотные свойства этанола, воды, фенола. Объяснить причину увеличения кислотных свойств в этом ряду.
Постройте электронную и электронно-графическую формулы родия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 15.
Покажите образование связи в веществах AgF, HF, OF2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы h3S. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h23NO2. Укажите виды изомерии.
На примере полимеров докажите, что строение влияет на свойства веществ.
Постройте электронную и электронно-графическую формулы эрбия. К какому семейству относится этот элемент?
------------------------------------------------------------------------------------------------------------------
Вариант 16.
Покажите образование связи в веществах NaI, N2O3, F2 . Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы SO2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h20Br2. Укажите виды изомерии.
Докажите взаимное влияние атомов в молекуле конкретным примером.
Постройте электронную и электронно-графическую формулы золота. К какому семейству относится этот элемент?
-------------------------------------------------------------------------------------------------
Вариант 17.
Покажите образование связи в веществах FrH, Cl2O3, h3 . Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы CO2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h21Br. Укажите виды изомерии.
Сравните кислотные свойства этанола и воды. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы висмута. К какому семейству относится этот элемент?
-------------------------------------------------------------------------------------------------
Вариант 18.
Покажите образование связи в веществах Ch5, K2O, LiF . Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы SO3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h24. Укажите виды изомерии.
Сравните основные свойства анилина и метиламина. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы таллия. К какому семейству относится этот элемент?
Вариант 19.
Покажите образование связи в веществах CO2, Cah3, I2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BCl3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h22OH. Укажите виды изомерии.
Сравните восстановительные свойства сероводорода и фтороводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы тербия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 20.
Покажите образование связи в веществах Bah3, CO, Br2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы C2h3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5H8Br2. Укажите виды изомерии.
Сравните кислотные свойства этанола и фенола. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы урана. К какому семейству относится этот элемент?
--------------------------------------------------------------------------------------------------
-----------------------------------------------------------------------------------------------------------------------
Вариант 21.
Покажите образование связи в веществах CuO, SO3, HI. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BeBr2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C7h24. Укажите виды изомерии.
Сравните основные свойства аммиака и фосфина. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы плутония. К какому семейству относится этот элемент?
Вариант 22.
Покажите образование связи в веществах Ph4, O2, C2h3. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Nh4. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C7h22. Укажите виды изомерии.
Сравните основные свойства гидроксида натрия и алюминия. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы иода. К какому семейству относится этот элемент?
-------------------------------------------------------------------------------------------------
Вариант 23.
Покажите образование связи в веществах KH, MgF2, HI. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы CaF2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5H7Br. Укажите виды изомерии.
Сравните кислотные свойства хлорной и хлористой кислот. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы рения. К какому семейству относится этот элемент?
---------------------------------------------------------------------------------------------------
Вариант 24.
Покажите образование связи в веществах BeCl2, O2, MnO2 . Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы NF3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h22Br2. Укажите виды изомерии.
Сравните восстановительные свойства фтороводорода и йодоводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы астата. К какому семейству относится этот элемент?
Вариант 25*.
Покажите образование связи в веществах Na2SO4, K2O2, N2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Cl2O7. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h20FOH. Укажите виды изомерии.
Сравните кислотные свойства хлорноватой и хлорноватистой кислот. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы сурьмы. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------------------
Вариант 26.
Покажите образование связи в веществах CO, Al2O3, KOH. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы SO2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H8BrCl. Укажите виды изомерии.
Сравните основные свойства гидроксидов калия и магния. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы технеция. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 27.
Покажите образование связи в веществах NaBr, S2, SCl2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BaCl2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h21NO2. Укажите виды изомерии.
Сравните окислительные свойства азотной и фосфорной кислот. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы гольмия. К какому семейству относится этот элемент?
Вариант 28.
Покажите образование связи в веществах MgF2, Cl2, C2Cl4. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Beh3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5h21OH. Укажите виды изомерии.
Сравните кислотные свойства трихлоруксусной и уксусной кислот. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы фермия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 29.
Покажите образование связи в веществах Fe2O3, SO3, h3. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Bh4. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C7h22. Укажите виды изомерии.
Сравните восстановительные свойства фтороводорода и хлороводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы ксенона. К какому семейству относится этот элемент?
---------------------------------------------------------------------------------------------------
Вариант 30*.
Покажите образование связи в веществах Nh5Cl, CO, Ch5. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы SF6. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6H9O2Nh3. Укажите виды изомерии.
Докажите зависимость свойств вещества от строения на конкретном примере.
Постройте электронную и электронно-графическую формулы тория. К какому семейству относится этот элемент?
---------------------------------------------------------------------------------------------------
Вариант 31*.
Покажите образование связи в веществах KNO3, AlF3, C2h3. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Nh5+. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h20O2. Укажите виды изомерии.
Сравните способность вступать в реакции электрофильного замещения по бензольному кольцу с бромом у бензола и фенола. Объяснить причину отсутствия этих реакций у фенола.
Постройте электронную и электронно-графическую формулы менделевия. К какому семейству относится этот элемент?
--------------------------------------------------------------------------------------------------
Вариант 32*.
Покажите образование связи в веществах h3S2, HNO3, O3 . Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы h4O+. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C5H8O. Укажите виды изомерии.
Сравните способность вступать в реакции с галогенами и межмолекулярной дегидратации у этанола и фенола. Объяснить причину отсутствия этих реакций у фенола.
Постройте электронную и электронно-графическую формулы гадолиния. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------
Вариант 1.
Покажите образование связи в веществах MgF2, Br2, CF4. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы Sih5. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H8. Укажите виды изомерии.
Сравните кислотные свойства сероводорода и хлороводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы индия. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
Вариант 19.
Покажите образование связи в веществах CO2, Cah3, I2. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы BCl3. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C6h22OH. Укажите виды изомерии.
Сравните восстановительные свойства сероводорода и фтороводорода. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы тербия. К какому семейству относится этот элемент?
---------------------------------------------------------------------------------------------------
Вариант 26.
Покажите образование связи в веществах CO, Al2O3, KOH. Охарактеризуйте связь.
Определите тип гибридизации и форму молекулы SO2. Покажите образование молекулы с помощью облаков.
Постройте изомеры состава C4H8BrCl. Укажите виды изомерии.
Сравните основные свойства гидроксидов калия и магния. Объясните причину различия свойств. Какие положения теории строения органических веществ подтверждают этот пример.
Постройте электронную и электронно-графическую формулы технеция. К какому семейству относится этот элемент?
----------------------------------------------------------------------------------------------------
infourok.ru
Контрольная работа на тему
«Строение вещества»
1. В молекуле СО2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SiO2, CaO, Na 2SO4 ; б) HClO4, CO2 ,NaBr; в) MgO. NaI, Cs 2O ; г) H 2O, AlCl3, RbI.
3. Число σ-связей в молекуле этанола:
а) 6, б) 8, в) 7, г) 5.
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) Nh4, б) (Nh5)2S, в) CCl4, г) SiF4.
5.Наибольшую электроотрицательность имеет элемент:
а) азот, б) сера, в) бром, г) кислород.
6.Степень окисления -3 фосфор проявляет в соединении:
а) P2O3, б) P2O5, в) Ca3P2 г) Ca(h3PO4)2.
7.Валентность III характерна для:
а) Ca, б) P, в) O, г) Si.
8. Все элементы в ряду могут проявлять степени окисления -1 и +5:
а) Rb, Ca, Li, б) H, Si, F, в) Cl, I, Br, г) As, N,T e.
9. Молекулярную кристаллическую решётку имеет:
а) h3S, б) NaCl, в) SiO2, г) Cu.
10. Гомологом вещества, формула которого СН2=СН-СН3, является:
а) бутан, б) бутен-1, в) бутен-2, г) бутин-1.
11. Вещество, формула которого NaHS называют:
а) сульфид натрия, б) сульфат натрия, в) гидросульфид натрия, г) гидросульфат натрия.
Часть В: Задания со свободным ответом.
(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8. Назовите эти вещества.
( 5 балла)
Какой объём кислорода потребуется для полного сгорания 1 кг этилена (этена)?
( 7 баллов)
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57. Определите число связей и их тип в молекуле данного вещества.
Контрольная работа №2
«Строение вещества».
Вариант 2
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В молекуле азота N2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SO2, CaO, К 2SO4 ; б) H 2S, AlCl3 ,NaI; в) CO. C 2h3, Cs 2O ; г) CaO, BaI2, Li2O.
3. Число σ-связей в молекуле этина:
а) 5, б) 4, в) 3, г) 6.
4.Вещестао, между молекулами которого существует водородная связь:
а) этанол, б) метан, в) водород, г) бензол.
5.Наибольшая степень окисления серы в соединении:
а) KHSO3, б) Na2S, в) h3SO4, г) S8.
6.Среди элементов IVА группы наиболее электроотрицательным является:
а) Si, б) Ge, в) C г) Sn.
7.Валентность IV характерна для:
а) Ca, б) P, в) O, г) Si.
8. Все элементы в ряду могут проявлять степени окисления -3 и +5:
а) Ga , Al, Be, б) C, Se, F, в) S, In, Br, г) P, N, Sb.
9.Атомную кристаллическую решётку имеет каждое из двух веществ:
а) хлорид натрия и алмаз, б) оксид углерода и кремний, в) алмаз и графит, г) оксид кремния (IV) и красный фосфор.
10. Изомером вещества, формула которого СН 3 -СН=СН-СН3, является:
а) бутан, б) бутин-2, в) бутен-1, г) 2- метилпропан.
11. Вещество, формула которого СН3СООNa называют:
а) гидрокарбонат натрия, б) ацетат натрия, в) формиат натрия, г) карбонат натрия.
Часть В: Задания со свободным ответом.
(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н10 О. Назовите эти вещества.
( 5 балла)
Какая масса кислорода потребуется для полного сгорания 67,2 л (н.у.) фосфина (РН3), если в результате реакции образуется оксид фосфора (V) и вода?
( 7 баллов)
Найдите молекулярную формулу циклоалкана, если известно, что массовая доля углерода в нём составляет 85,71% .относительная плотность паров этого вещества по воздуху равна 1,931. Определите число связей и их тип в молекуле данного вещества.
Контрольная работа №2
«Строение вещества».
Вариант 3
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В хлориде натрия химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2 Соединениями с ковалентной неполярной и ионной связью являются соответственно:
а)P4 и N 2O ; б) P4 и SO3; в) P4 и LiCl; г)P4 и РН3.
3. Число π-связей в молекуле серной кислоты:
а) 4, б) 2, в) 8, г) 6.
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) Nh4, б) NaNO3, в) CO2, г) Sih5.
5.Наибольшую электроотрицательность имеет элемент:
а) натрий, б) литий, в) рубидий, г) калий.
6.Наибольшая степень окисления азота в соединении:
а) HNO3, б) Na 3N, в) N 2O г ) N2 h5.
7.Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б.Высшая валентность элемента определяется номером периода.
а) верно только Б, б) верно только А в) верны ода утверждения, г) оба утверждения неверны.
8. Все элементы в ряду могут проявлять степени окисления +7:
а) Sb, Al, Be, б) Te, Sn, F, в) Cl, I, Br, г) P, N,O.
9. Молекулярную кристаллическую решётку имеет:
а) хлорид калия, б) «сухой» лёд, в) сульфид натрия, г) чилийская селитра.
10. Изомером вещества, формула которого СН3 –СН2-СН2-ОН , является:
а) метилэтиловый эфир, б) бутанол-1, в) диметиловый эфир, г) бутанол-2.
11. Вещество, формула которого НСОН не называют:
а) формальдегид, б) метаналь , в) муравьиная кислота , г) муравьиный альдегид.
Часть В: Задания со свободным ответом.
(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8О2 . Назовите эти вещества.
( 5 балла)
Какая масса воды может быть получена при взаимодействии с кислородом 224л водорода (н.у.)?
( 7 баллов)
Найдите молекулярную формулу алкена, массовая доля углерода, в котором составляет 85,7%. Относительная плотность паров этого вещества по оксиду углерода (IV) равна 1,593. Определите число связей и их тип в молекуле данного вещества.
doc4web.ru
Контрольная работа по теме «Строение вещества»
Вариант 1
ЧАСТЬ А
А1. Ионная связь образуется:а) между двумя металлами б) между двумя неметаллами
в) между металлом и неметаллом г) между двумя молекулами
А2. Ковалентная неполярная связь наблюдается в следующем веществе:а) углекислый газ б) аммиак
в) алмаз г) хлороформ
А3.Орбитали s и р и р и р соответственно перекрываются в молекулах веществ:а) h3S и Cl2 б) HCl и HBr в) h3 и Br2 г) N2 и HI
А4. Вещество с металлической связью:а) оксид калия б) кремний в) медь г) гидроксид магния
А5. Прочность водородной связи зависит:а) от величины избыточного положительного заряда на атоме водорода
б) от электроотрицательности элемента, образующего связь с атомом водорода
в) от величины поляризации связи водород - гетероатом
г) все перечисленные ответы верны.
А6. Вещества твердые, прочные с высокими температурами плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку
а) металлическую б) молекулярную в) атомную г) ионную
А7. Только ковалентные связи имеет каждое из двух веществ:
| а) | C6H5Nh3 и P4 | б) | C3H8 и NaF | в) | KCl и Ch4Cl | г) | P2O5 и NaHSO3 |
А8.Формула соединения, в котором степень окисления серы максимальна, - это:
| а) | FeS2 | б) КHSO4 | в) SO2 | г) Вa(HSO3)2 |
A9.Атомную кристаллическую решетку имеет
| а) Свинец | б) Кремний | в) Белый фосфор | г) Сера ромбическая |
А10.Какие из перечисленных свойств характерны для веществ с молекулярной кристаллической решеткой?
| А) | низкая температура плавления | Б) высокая температура кипения | |
| В) | летучесть | Г) малая механическая твердость | |
| Д) | тугоплавкость | Е) электропроводность |
Укажите верный ответ.
| 1) | АБВ | 2) | АВГ | 3) | ВДГ | 4) | ВГЕ |
ЧАСТЬ В
В1. Установите соответствие между типом орбитали и механизмом образования ковалентной связи:
| ОРБИТАЛИ, УЧАСТВУЮЩИЕ В ОБРАЗОВАНИИ КОВАЛЕНТНОЙ СВЯЗИ | МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ | ||
| А) | орбитали с неспаренным электроном | 1) | обменный |
| Б) | орбитали с неподеленной электронной парой | 2) | донорно-акцепторный |
| В) | свободные (вакантные) орбитали |
В2. Установите соответствие между формулой вещества и степенью окисления азота в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | ||
| А) | NO2 | 1) | - 3 |
| Б) | (Ch4)2NH | 2) | -2 |
| В) | Nh5Br | 3) | + 2 |
| Г) | Nh4 | 4) | + 3 |
| 5) | + 4 | ||
| 6) | +5 |
ЧАСТЬ С
С 1. Из раствора массой 350 г с массовой долей соли 25 % выпариванием удалали 100 г воды. Массовая доля (в %) соли в полученном растворе равна …
С2. Дайте характеристику фторида азота (III) по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Контрольная работа по теме «Строение вещества»
Вариант 2
ЧАСТЬ А
А1. В результате разрыва ионной связи образуются:а) радикалы б) атомы металла и неметалла
в) катион и анион г) молекулы
А2. Только ковалентная связь наблюдается в соединении с формулой:а) Ba(OН)2 б) h3SO4
в) Nh5NO3 г) Li2CO3
А3.Линейное строение имеет молекула:
а) аммиака б) метанола
в) воды г) хлорида бериллия
А4. Найдите название вещества, имеющего металлический тип связи:а) мышьяк б) фосфор
в) галлий г) иод
А5. Укажите название вещества, молекулы которого способны к образованию водородных связей:а) водород б) гидрид натрия
в) муравьиная кислота г) метан
А6.В молекуле какого вещества длина связи между атомами углерода наибольшая
а) ацетилена б) этана в) этена г) бензола
А7.Какая из перечисленных химических связей самая длинная?
| а) H – F | б) H – Cl | в) H – Br | г) H – I |
А8.Наибольшее значение электроотрицательности имеет атом химического элемента:
А9.Формула соединения, в котором степень окисления серы минимальна, - это:
| а) К2S | б) SO3 | в) h3SO4 | г) Ca(HSO3)2 |
А10.Какие из перечисленных свойств характерны для веществ с металлической кристаллической решеткой?
| А) | хрупкость | Г) электропроводность |
| Б) | пластичность | Д) прозрачность |
| В) | теплопроводность | Е) летучесть |
Укажите верный ответ.
| 1) | АДЕ | 2) | БДГ | 3) | БВГ | 4) | ГДЕ |
ЧАСТЬ В
В1. Установите соответствие между разностью в электроотрицательности и типом химической связи:
| РАЗНОСТЬ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ | ТИП ХИМИЧЕСКОЙ СВЯЗИ | ||
| А) | 0,9 | 1) | ковалентая неполярная связь |
| Б) | 1,6 | 2) | ковалентая полярная связь |
| В) | 1,9 | 3) | ионная связь |
| Г) |
В2. Установите соответствие между формулой вещества и степенью окисления азота в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | ||
| А) | NaNO2 | 1) | +5 |
| Б) | Nh5NO3 | 2) | +3 |
| В) | Nh5NO2 | 3) | -3, +5 |
| Г) | HNO3 | 4) | 0, +2 |
| 5) | - 3, +3 | ||
| 6) | +4, +2 |
ЧАСТЬ С
С 1. К раствору массой 250 г, массовая доля соли в котором составляет 10 %, прилили воду объёмом 150 мл. Приняв плотность воды равной 1 г/мл, определите массовую долю соли в полученном растворе.
С2. Дайте характеристику хлорида магния по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Контрольная работа по теме «Строение вещества»
Вариант 3
ЧАСТЬ А
А1Пара элементов, между которыми образуется ионная химическая связь:а) углерод и сера в) калий и кислород
б) водород и азот г) кремний и водород
А2. Только ковалентная связь наблюдается в соединении с формулой:а) Ba(OН)2 в) h3SO4
б) Nh5NO3 г) Li2CO3
А3.В молекулах h3Te – h3Se – h3S длина связи:а) не изменяется в) уменьшается
б) увеличивается г) сначала уменьшается, затем растет
А4.Ковалентная связь отличается от ионной:а) большей длиной в) большей энергией
б) меньшей энергией г) насыщаемостью
А5. В молекуле какого соединения имеется ковалентная неполярная связь?а) CS2 в) COCl2
б) h3O2 г) Ch4OH
А6. Вещество с металлической связью:а) оксид калия в) кремний
б) медь г) гидроксид магния
А7. Наиболее прочные водородные связи образуются между атомом водорода и атомом:а) азота б) кислорода в) хлора г) серы
А8.Сколько и каких типов химических связей может образовывать атом азота?
| а) ни одной | б) 4 ковалентные связи | в)3 ковалентные связи | г) 2 ковалентные связи и 1 ионную |
A9.Наиболее полярна химическая связь в молекуле
| а) | Фосфина б) хлора в) сероводорода г) хлороводорода |
А10.Наименее электроотрицательный элемент
| а) | железо | б) | магний | в) | азот | г) | кальций |
ЧАСТЬ В
В1. Установите соответствие между формулой соединения и типом ковалентной связи:
| ФОРМУЛА СОЕДИНЕНИЯ | ТИП КОВАЛЕНТНОЙ СВЯЗИ ПО ЧИСЛУ ЭЛЕКТРОННЫХ ПАР | ||
| А) | O2 | 1) | одинарная |
| Б) | HCl | 2) | двойная |
| В) | N2 | 3) | тройная |
| Г) | Cl2 |
В2. Установите соответствие между формулой вещества и степенью окисления хрома в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА | ||
| А) | K2Cr2O7 | 1) | |
| Б) | CaCr2O7 | 2) | +2 |
| В) | CrO2F2 | 3) | + 3 |
| Г) | Ba3[Сr(OH)]2 | 4) | +4 |
| 5) | + 5 | ||
| 6) | +6 |
ЧАСТЬ С
С 1. В воде растворили гидроксид калия массой 11,2 г, объём раствора довели до 200 мл. Рассчитайте молярную концентрацию полученного раствора.
С2. Дайте характеристику хлора по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
Контрольная работа по теме «Строение вещества»
Вариант 4
ЧАСТЬ А
А 1. Вещество с ионной связью:
а) кислород в) фторид натрия
б) метан г) этаналь.
А 2. Ковалентная неполярная связь наблюдается в следующем веществе:а) углекислый газ в) аммиак
б) алмаз г) хлороформ
А 3.Кристаллическая решетка графита:
а) ионная в) атомная
б) молекулярная г) металлическая
А 4. Химическая связь наименее прочна в молекуле:а) бромоводорода в) хлороводорода
б) иодоводорода г) фтороводорода
А 5. Какая химическая связь образуется между атомами с порядковыми номерами 1 и 16?
а) ионная в) ковалентная полярная
б) ковалентная неполярная г) металлическая
А 6. Найдите название вещества, имеющего металлический тип связи:а) мышьяк в) фосфор
б) галлий г) иод
А 7. Укажите название вещества, молекулы которого способны к образованию водородных связей:а) метанол в) гидрид кальция
б) этан г)водород
А8.Только ковалентные связи имеет каждое из двух веществ:
| а) | C6H5Nh3 и P4 | б) | C3H8 и NaF | в) | KCl и Ch4Cl | г) | P2O5 и NaHSO3 |
А9.Наиболее прочная и короткая связь в молекуле:
| а) | аммиака б) воды в) сероводорода г) фтороводорода |
А10.Электроотрицательность элементов увеличивается в ряду:
1) C, Si, S ; 2) P, Cl, I; 3) Br, Cl, S; 4) Se, S, Cl.
ЧАСТЬ В
В1. Установите соответствие между типом орбитали и механизмом образования ковалентной связи:
| ОРБИТАЛИ, УЧАСТВУЮЩИЕ В ОБРАЗОВАНИИ КОВАЛЕНТНОЙ СВЯЗИ | МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ | ||
| А) | орбитали с неспаренным электроном | 1) | донорно-акцепторный |
| Б) | орбитали с неподеленной электронной парой | 2) | обменный |
| В) | свободные (вакантные) орбитали |
В2. Установите соответствие между формулой вещества и степенью окисления азота в нём
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | ||
| А) | NO2 | 1) | - 3 |
| Б) | (Ch4)2NH | 2) | -2 |
| В) | Nh5Br | 3) | + 2 |
| Г) | Nh4 | 4) | + 3 |
| 5) | + 4 | ||
| 6) | +5 |
ЧАСТЬ С
С 1. К раствору серной кислоты объёмом 400 мл, плотность которого равна 1,1 г/мл, а массовая доля кислоты 0,15, добавили воду массой 60 г. Определите массовую долю серной кислоты в полученном растворе.
С2. Дайте характеристику хлорида азота (III) по плану: вид связи, определение, схема образования связи, тип кристаллической решетки, физические свойства.
megaobuchalka.ru
Оборудование: Раздаточный материал- текст контрольной работы в двух вариантах. 1.Орг.момент 2.Выполнение работы Работа рассчитана на 40 минут Текст работы Строение вещества Вариант 1 Часть А 1. Молекулярное строение имеет 1) С12 2) СаО 3) ZnCl2 4) NaBr
2. Кристаллическая решетка хлорида кальция 1) металлическая 2) молекулярная 3) ионная 4) атомная
3. Кристаллическая решетка твердого оксида углерода (IV) 1) металлическая 2) молекулярная 3) ионная 4) атомная
4. Немолекулярное строение имеет 1) Н2О 2) h3SO4 3) SiО2 4) СО2
5. Ионное строение имеет 1) оксид бора 2) оксид углерода (IV) 3) оксид серы (VI) 4) оксид магния
6. Немолекулярное строение имеет каждое из двух веществ: 1) СО2иСl2 2) Fe и NaCl 3) СО и Mg 4) Na2CO3 и I2 (тв)
7. Металлическую кристаллическую решетку имеет 1) малахит 2) бронза 3) кремнезем 4) графит
8. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1)алмаза 2)поваренной соли 3)кремния 4)азота
9. Наименьшую температуру плавления имеет 1) алмаз 2) алюминий 3) кремний 4) оксид кремния (IV)
10. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическая 2) молекулярная 3) ионная 4) атомная Часть Б 1.Соотнесите тип связи и формулу вещества Тип Связи Формула вещества 1.Металлическая А.NaCl Б. O2 2.Ковалентная полярная В.HCl Г.SiO2 3.Ковалентная неполярная Д.Cu Е.CO2 4.Ионная Ж.O3
2.Соотнесите тип гибридизации и формулу вещества Тип. гибридизации Формула вещества 1.sp2 А. С2Н6 2.sp Б. С2Н4 3.sp3 В. С2Н2 4. нет гибризизации Г.Sih5 Д.Н2О
3. Выпишите только те вещества, в молекулах которых имеются пи-связи 1. СН4 2. С2Н4 3. Г.SiO2 4. Ph4 5. С6Н6 6. h3S
4.Выпишите примеры коллоидных систем отвечающих схеме: Среда(жидкость )- фаза (газ) 1.Туман 2.Зубная паста 3.Мыльная пена 4.Смесь в огнетушителе 5.Нефть
5Укажите изомеры
см.рисунок 1 Часть С 1. Какую массу 25% раствора сульфата меди необходимо добавить к 100 г 10%, чтобы получить 20% раствор. 2.Магний массой 4, 8 г растворили в 200 мл 12% раствора серной кислоты плотностью 1, 05 г\мл. Вычислите массовую долю соли в растворе.
Строение вещества Вариант 2 Часть А 1. Молекулярную кристаллическую решетку имеет 1) CaF2 2) СО2 3) SiO2 4) A1F3 2. Немолекулярное строение имеет 1) азот 2) графит 3) аммиак 4) кислород
3. Кристаллическая решетка брома 1) металлическая 2) молекулярная 3) ионная 4) атомная
4. Ионы являются структурной единицей для каждого из двух веществ: 1) СН4 и I2 2) SO, и Н2О 3) Сl2 и Nh4 4) LiF и KCl
5. Молекулярную кристаллическую решетку имеет 1) фторид кальция 2)бромид алюминия 3)сероводород 4)хлорид меди
6. Кристаллическая решетка оксида лития 1) металлическая 2) молекулярная 3) ионная 4) атомная
7. Металлическую кристаллическую решетку имеет 1) чугун 2) кремний 3) алмаз 4) бор
8. Утверждение о том, что структурной частицей данного вещества является атом, справедливо только для 1)алмаза 2)поваренной соли 3)воды 4)азота 9. Наибольшую температуру плавления имеет 1) водород 2) кислород 3) оксид углерода (IV) 4) оксид кремния (IV) 10. Вещества с металлической кристаллической решеткой 1) хрупкие, легкоплавкие 2) проводят электрический ток, пластичные 3) обладают низкой тепло- и электропроводностью 4) обладают хорошими оптическими свойствами Часть Б 1.Соотнесите тип связи и формулу вещества Тип Связи Формула вещества 1.Металлическая А.CuO Ж.Mg 2.Ковалентная полярная Б. h3 Е.LiF 3.Ковалентная неполярная В.h3S Д.Ph4 4.Ионная Г.SiO2 2.Соотнесите тип гибридизации и класс вещества Тип. гибридизации Класс вещества 1.sp2 А. Алкены 2.sp Б. Алкины 3.sp3 В. Алкадиены 4. нет гибризизации Г.Алканы Д.Арены 3. Выпишите только те вещества, в молекулах которых имеются пи-связи 1.СО. 2.О2 3. Г.Н2О 4. Ph4 5. N2 6. h3S
4.Выпишите примеры коллоидных систем отвечающих схеме: Среда(твердая )- фаза (жидкость) 1.Почва 2.Ил 3.Асфальт 4.Крем 5.Силикагель
5.Укажите гомологи см. рис 1
Часть С 1.Какую массу CuSO4*5h3O необходимо досыпать в 250 г 4% раствора. Чтобы получить 25% раствор. 2. К 142 г 10% раствора сульфата натрия добавили раствор, содержащий 31,2 г хлорида бария. Определите массовую долю хлорида натрия в растворе. 3.Смесь железа и цинка массой 18, 6 г сожгли в кислороде и получили 24, 2 г смеси оксидов. Найдите состав смеси
3. Критерии оценивания: Часть А 1 правильный ответ – 1 балл Часть А вариант 1 2 3 4 5 6 7 8 9 10 1 1 3 2 3 4 2 2 4 2 1 2 2 2 2 4 3 3 1 1 4 2
Часть Б
2 балла за правильный ответ, при наличие 1 ошибки – 1 балл 1 вариант 2 вариант Б1 А Б В Г Д Е Ж А Б В Г Д Е Ж 4 3 2 2 3 4 1 4 3 2 2 1 2 3
1 вариант 2 вариант
А Б В Г Ж А Б В Г Ж 1 2 2 3 1 3 1 2 3 4
1 вариант 2 вариант Б3 2 3 5 1 2 5 1 вариант 2 вариант Б4 3 4 1 3 5
1 вариант 2 вариант Б5 д е а б е ж и л в ж з и г ж
С 1 1 вариант 2 вариант
1 0,1* 100 + 0.25х = 0,2(100+х) 1 2 0.05х=10 1 3 Х=200 1 3 1 W(CuSO4)= 0,64 1 2 0,04*250+ 0.64х =( 250+х)0.25 1 3 Х=134, 6 1 3
С 2 1 Mg +h3SO4 =MgSO4+h3 1 2 m(к-ты) = 200*0.12* 1.05=25.2 1 3 n(к-ты)= 25,2\98 =0.257 моль 1 4 n (магния)= 4,8\24= 0.2 моль в нед 1+1 5 n (водорода) = 0.2 моль 1 6 m(водор)= 0.2*2= 0.4 г 1 7 m(р-ра) = 200*1.05+4.8- 0.4= 214.4 1 8 m(соли)= 0.2*120= 24 1 9 W(соли)= 24\214.4= 0.12 1 10 1 вариант 2 вариант 1 Na2SO4+BaCl2= BaSO4+2NaCl 1 2 m( Na2SO4) = 142*0.1= 14,2 1 3 n( Na2SO4)= 0/1 моль в нед 1+1 4 n ( BaCl2)= 31,2\208= 0.15 моль 1 5 n ( BaSO4) = 0.1 моль 1 6 m( BaSO4)= 0.1*233= 23,34 г 1 7 m(р-ра) = 142+100-23,34=218,66 1 8 m(соли)= 0.2*58,5= 11,7 1 9 W(соли)= 11,7\218,66=0,054 1 10
C3 1 вариант 2 вариант 1 Mg +2HCl =MgCl2+h3 1 2 2Al +6HCl =2AlCl3+3h3 1 3 Хмоль- Mg у моль- Al 1 4 24х+27у= 5,1 1 5 n (водорода)= 5,6л\22.4= 0.25 моль 1 6 Х+3у= 0.25 1 7 У=0.1 1 8 m( Al )= 0.1*27=2.7 1 9 W( Al )= 2.7\5.1= 0.53 1 W( Mg )= 0.47 1 10
1 4Fe+3O2=2 Fe2O3 1 2 2Zn+ O2 =2ZnO 1 3 Хмоль- Fe у моль- Zn 1 4 56х+65у= 18,6 1 5 0.5х*160+81у = 18.6 1+1 6 У=0.2 моль 1 7 m( Zn )=0.2865=13 1 8 W ( Zn )= 13/18.6=0.69 1 9 W( Fe )=0. 31 1
10
Итого: 43балла - 100% 29 баллов - 65% «3» 32балла – 75% «4» 37 баллов - 85% «5»
Итоги работы Д.з. Повт. типы химических реакций
Тема Контрольная работа №2 Тема: Строение вещества Вариант№
Бланк ответов
Часть А вариант 1 2 3 4 5 6 7 8 9 10 1 2
Часть Б Б1
А Б В Г Д Е Ж
Б2
А Б В Г Ж
Б3
Б4
Б5
Часть С
teacher-almaty.clan.su