
Работу выполнила:
Мещанова Кристина, ученица
МОУ «Ивановская СОШ»
7 года обучения.
Научный руководитель:
Сохорева Наталья Александровна
Ивановка, 2010 г.
Содержание.
Введение……………………………………………………………………………………………………………………………………………3
Кристаллы. Виды кристаллов………………………………………………………………………………………………………….4
Строение кристаллов…………………………………………………………………………………………………………………………7
Применение кристаллов на практике……………………………………………………………………………………………14
Выращивание кристаллов……………………………………………………………………………………………………………….16
Заключение………………………………………………………………………………………………………………………………………20
Введение.
Кто из нас не любовался формой и цветом драгоценных камней, идеальной и неповторимой формой снежинок? В чем причина этой красоты и удивительно точной формы?
Давно было замечено, что некоторые твердые тела встречаются в природе в виде кристаллов – тел, грани которых представляют собой правильные многоугольники. Однако мелкокристаллические вещества встречаются весьма часто. Так, например, почти все горные породы: гранит, песчаники известняк – кристалличны. В настоящее время изучением многообразия кристаллов занимаются следующие науки:
кристаллография - выявляет признаки единства в этом многообразии, исследует свойства и строение, как одиночных кристаллов, так и кристаллических агрегатов.
кристаллооптика изучает оптические свойства кристаллов.
кристаллохимия изучает закономерности образования кристаллов из различных веществ и в разных средах.
Кристаллография – наука не новая. У её истоков стоит М. В. Ломоносов. А вот выращивание искусственных кристаллов дело более позднее. Популярная книга Шубникова "Образование кристаллов" вышла в 1947 году. Эта научная практика выросла из минералогии, науки о кристаллах и аморфных телах. Выращивание кристаллов стало возможным благодаря изучению данных минералогии о кристаллообразовании в природных условиях. Изучая природу кристаллов, определяли состав, из которого они выросли и условия их роста. И теперь эти процессы имитируют, получая кристаллы с заданными свойствами. В деле получения кристаллов принимают участие химики и физики. Если первые разрабатывают технологию роста, то вторые определяют их свойства.
Благодаря кристаллографии известны многие способы искусственного выращивания кристаллов. Некоторые кристаллы даже можно вырастить в домашних условиях. Многие кристаллы являются продуктами жизнедеятельности организмов. Некоторые виды моллюсков обладают способностью наращивать на инородных телах, попавших в раковину, перламутр. За 5 — 10 лет образуется драгоценный камень жемчуг. В природе можно встретить такие кристаллы как горный хрусталь, флюорит, исландский шпат, каменная соль. К сожалению их нельзя вырастить без специальных приборов, но к счастью есть множество других красивых кристаллов, которые можно вырастить в домашних условиях или даже украсить ими дом.
Цель работы: изучить строения кристаллов, способы получения искусственных кристаллов, применение кристаллов на практике.
^ Кристаллы. Виды кристаллов.
Криста́ллы (от греч. κρύσταλλος, первоначально — лёд, в дальнейшем — горный хрусталь, кристалл) — твёрдые тела, в которых атомы расположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку.
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов).
Составляющие данное твёрдое вещество частицы образуют кристаллическую решётку. Если кристаллические решётки пространственно одинаковы или сходны (имеют одинаковую симметрию), то геометрическое различие между ними заключается, в частности, в разных расстояниях между частицами, занимающими узлы решётки. Сами расстояния между частицами называются параметрами решётки. Параметры решётки, а также углы геометрических многогранников определяются физическими методами структурного анализа. Часто твёрдые вещества образуют (в зависимости от условий) более чем одну форму кристаллической решётки; такие формы называются полиморфными модификациями.
Виды кристаллов
Следует разделить идеальный и реальный кристалл. Идеальный кристалл является, по сути, математическим объектом, имеющим полную, свойственную ему симметрию, идеализированно ровные гладкие грани ит.д. Реальный кристалл всегда содержит различные дефекты внутренней структуры решетки, искажения и неровности на гранях и имеет пониженную симметрию многогранника вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций. Реальный кристалл не обязательно обладает кристаллографическими гранями и правильной формой, но у него сохраняется главное свойство — закономерное положение атомов в кристаллической решётке.
Большой одиночный кристалл, имеющий более или менее правильную форму, называют монокристаллом. Характерной особенностью монокристалла является анизотропия, то есть зависимость его физических свойств от направления в кристалле. Анизотропия механических свойств монокристалла сказывается, прежде всего в том, что его прочность в разных направлениях различна. При определенный условиях из расплавов металлов можно получить монокристаллы. Если же просто охладить расплавленное железо, то полученное твердое тело анизотропией обладать не будет. Причину этого помогает понять изучение структуры металла, под микроскопом можно увидеть, что оно состоит из отдельных зерен микроскопических размеров. Каждое такое зерно – это кристалл, который принял неправильную форму потому, что его росту помешали соседние кристаллики. Возникшая зернистая структура называется поликристаллической (поли - много). Поскольку все эти зерна ориентированы беспорядочно, то их анизотропия проявиться не может. Вследствие этого поликристалл изотропен, т. е. его свойства в среднем по всем направлениям одинаковы.
^ Кристаллы в природе.
Кристаллы замершей воды, т.е. лед и снег, известны всем. Эти кристаллы почти полгода (а в полярных областях и круглый год) покрывают необозримые пространства Земли, лежат на вершинах гор и сползают с них ледниками, плавают айсбергами в океанах.
Ледяной покров реки, массив ледника или айсберга - это, конечно, не один большой кристалл. Плотная масса льда обычно поликристаллическая, т.е. состоит из множества отдельных кристаллов. Их не всегда различишь, потому что они мелки и все срослись вместе. Иногда эти кристаллы можно различить в тающем льду, например, в льдинках весеннего ледохода на реке. Тогда видно,
что лед состоит как бы из "карандашиков", сросшихся вместе, как в сложенной пачке карандашей: шестигранные столбики параллельны друг другу и стоят торчком к поверхности воды; эти "карандашики" и есть кристаллики льда.
Фотографии и рисунки снежинок можно найти во многих учебниках физики в главах, в которых рассказывают о симметрии. Но этим и ограничивался до недавнего времени интерес ученых к снежным кристаллам. Серьезное изучение зарождения, роста и структуры снежных кристаллов началось не так давно.Интерес к снежным кристаллам был связан в основном с изучением образования дождя и явлений, происходящих в облаках. Оказалось, что большая часть дождевых капель начинает свою жизнь как снежные кристаллы, тающие, прежде чем они упадут на землю. Однако только холодные, находящиеся на большой высоте перистые облака состоят из кристалликов льда. В основном же облака представляют собой скопление маленьких водяных капелек, удерживающихся в воздухе так же, как частички дыма. Долгие годы оставалось загадкой, как эти капельки вырастают до размеров, достаточных для того, чтобы они упали на землю. Осталось загадкой и то, что часто эти капельки «отказывались» замерзать, хотя температура облака была намного ниже нормальной температуры замерзания воды, то есть ниже 0?С.
Сейчас мы знаем, что переохлажденное облако остается стабильным до тех пор, пока в нем не появиться хотя бы небольшое количество маленьких кристалликов льда, зарождающихся на частичках земной пыли. Молекулы воды, попавшие на кристаллик льда, образуют с ним прочную связь, разорвать которую довольно трудно. Молекулы же воды, которые конденсируются на капле, оторвать сравнительно легко - теплота испарения меньше энергии, необходимой для отрыва молекулы воды от кристаллика льда. Поэтому если облако состоит из калек воды и кристалликов льда, то кристаллы льда растут гораздо быстрее, чем капли. Более того, благодаря росту кристалликов льда уменьшается влажность окружающего воздуха. Это приводит к тому, что водяные капли постепенно испаряются и исчезают. В то же время кристаллики льда вырастают до размеров, достаточных для их падения на землю. Падая, несколько кристалликов могут объединяться, образуя снежинку.
Хотя снежные кристаллы многообразны, их можно классифицировать по трем основным формам; шестиугольные призматические столбики, тонкие шестиугольные пластины и разветвлённые звёзды. Нетрудно объяснить шестигранную форму кристалликов и снежинок. Изучение кристаллов льда с помощью рентгеновских лучей показало, что молекулы воды в кристалле льда расположены так, что каждая из молекул окружена шестью соседями. Центры этих молекул образуют правильный шестиугольник. Что же касается причин различия форм кристаллов, то до недавнего времени ученые не могли прийти к единому мнению. По некоторым гипотезам форма кристалликов должна в основном определяться степенью пересыщения окружающего воздуха парами воды, а не температурой облака. Но исследования показали, что кристаллы различной формы вырастают при различных температурах.
Высокие перистые облака, температура которых ниже – 30?С, состоит в основном из снежных кристаллов в форме призматических столбиков длиной около половины миллиметра. Облака на средних высотах, температура которых изменяется от - 15? до - 30?С, состоят из кристаллов в форме призм и пластин. В низких облаках, температура которых колеблется от - 5?С до 0?С, можно встретить кристаллы в виде шестиугольных пластин, коротких призм и поражающих своей красотой звезд, имеющих диаметр порядка нескольких миллиметров. Эти звезды являются основой снежинок. При температуре в несколько градусов ниже нуля кристаллики слипаются, образуя снежинки.
Всё это говорит о том, что форма кристаллов определяется в основном температурой, при которой они вырастают. Это подтвердили и эксперименты по выращиванию кристаллов льда в лаборатории. Кристаллы льда выращивались в специальной камере, в которой строго контролировалась температура и количество водяных паров. В качестве затравки использовалась тонкая нить. Температура в камере в различных участках вдоль нити была разной.
Опыты показали, что именно температура определяет форму кристалла.Количество же водяных паров влияет на скорость роста. Однако до сих пор остается невыясненной точная природа роста снежных кристаллов.
Очень интересно изучение роста снежных кристаллов на земле. Часто зимой при резком потеплении ветки деревьев и стены домов покрываются инеем. Облака, в которых зарождаются снежинки, трудно доступны. Иней же легко доступен и за ним можно наблюдать во время его образования. Иней появляется обычно на предметах, имеющих большую теплоёмкость и малую теплопроводность.При резком потеплении температура этих предметов оказывается ниже температуры окружающего воздуха, и на них конденсируются водяные пары, находящиеся в воздухе. Если паров в воздухе мало, то получаются красивые пушистые хлопья. При большой влажности воздуха холодные предметы покрываются коркой льда. Вода просто конденсируется на холодных предметах и затем замерзает.
Особенно интересны узоры, которыми покрываются зимой окна квартир, автобусов и трамваев. При резком похолодании температура окон становится ниже температуры воздуха в помещении. На них и оседают молекулы пара, находящиеся во влажном воздухе в комнате, образуя красивые узоры. При этом тоже очень важно, чтобы воздух в комнате был не очень влажным. В противном случае пар сначала сконденсируется на стекле и затем замерзает, образуя слой льда. Узоры не появляются на окне, если открыта форточка. В этом случае температура воздуха в комнате у стекла понижается, став такой же, как и температура самого стекла. В ледяных узорах, можно увидеть большинство форм, которые могут принимать снежные кристаллы.
Известно, как опасны для растений весенние или осенние заморозки. Температура почвы и воздуха падает ниже нуля, подпочвенные воды и соки растений замерзают, образуя иголочки кристалликов льда. Эти острые иголки рвут нежные ткани растений, листья сморщиваются, чернеют, стебли и корни разрушаются. После морозных ночей по утрам в лесу и в поле часто можно наблюдать, как на земле вырастает "ледяная трава". Каждый стебелек такой травы - это прозрачный шестигранный кристаллик льда. Ледяные иголочки достигают длины в 1-2см, а иной раз доходят до 10-12см. Случается, что земля оказывается покрытой пластинками льда, стоящими торчком. Вырастая из земли, эти кристаллики льда поднимают на своих головках песок, гальку, камешки весом до 50-100г. Льдинки даже выталкивают из земли и уносят вверх маленькие растения. Иногда ледяная корка обволакивает растение, и корень просвечивает сквозь лед. Бывает и так, что щеточка ледяных иголок сообща поднимает тяжелый камень, сдвинуть который не под силу одному кристаллику. Искрится и горит радужным блеском хрустальная "ледяная трава", но лишь только пригреют лучи солнца, кристаллики изгибаются навстречу солнцу, падают и быстро тают.
В морозное весеннее или осеннее утро, когда солнце еще не успело уничтожить следы ночных заморозков, деревья и кусты покрыты инеем. На ветках повисли капли льда. Вглядитесь: внутри ледяных капель видны пучки тонких шестигранных иголочек - кристалликов льда. Покрытые инеем листья кажутся щетками: как щетинки стоят на них блестящие шестигранные столбики кристаллов льда. Сказочным богатством кристаллов, хрустальным нарядом украшен лес. Кристаллики льда, причудливыми узорами которых мы любуемся в снежинках, могут в несколько минут погубить самолет. Обледенение - страшный враг самолетов - тоже результат роста кристаллов.
^ Кристаллизация в пещерах.
Все природные воды - в океанах, морях, озерах, ручьях и подземных источниках - являются естественными растворами, все они растворяют встречающиеся им породы, и во всех этих растворах происходят сложные явления кристаллизации.
Особенно интересна кристаллизация подземных вод в пещерах. Капля за каплей просачиваются воды и падают со сводов пещеры вниз. Каждая капелька при этом частично испаряется и остается на потолке пещеры вещество, которое было в ней растворено. Так постепенно образуется на потолке пещеры маленький бугорок, вырастающий затем в сосульку. Эти сосульки сложены из кристалликов. Одна за другой капли мерно падают день за днем, год за годом, века за веками. Звук их падения глухо раздается под сводами. Сосульки все вытягиваются и вытягиваются, а навстречу им начинают расти вверх такие же длинные столбы сосулек со дна пещеры. Иногда сосульки, растущие сверху (сталактиты) и снизу (сталагмиты), встречаются, срастаются вместе и образуют колонны. Так возникают в подземных пещерах узорчатые, витые гирлянды, причудливые колоннады. Сказочно, необыкновенно красивы подземные чертоги, украшенные фантастическими нагромождениями сталактитов и сталагмитов, разделенные на арки решетками из сталактитов. В природе кристаллы неправильной формы встречаются несравненно чаще, чем правильные многогранники. В руслах рек из-за трения кристаллов о песок и камни углы кристаллов стираются, многогранные кристаллы превращаются в округлые камешки - гальку; от действия воды, ветра, морозов кристаллы растрескиваются, рассыпаются; в горных породах кристаллические зерна мешают, друг другу расти и приобретать неправильные формы.
Более 95% всех горных пород, из которых сложена земная кора, образовались непосредственно при кристаллизации природного расплава, т.е. магмы. Кристаллизация магмы - явление очень сложное. Магма представляет собой смесь многих веществ. У всех этих веществ разные температуры кристаллизации, к тому же температура кристаллизации каждого вещества меняется в зависимости от того, в каких условиях находится магма в данный момент, и от того, какие еще вещества присутствуют в ней. Поэтому при остывании и затвердевании магма разделяется на части: первыми в магме возникают и начинают расти кристаллы того вещества, у которого температура кристаллизации самая высокая. Обычно получается так, что это вещество еще не успеет выделиться полностью, а магма уже остыла до температуры кристаллизации второго минерала, и он тоже начинает выделяться в виде кристаллов. Влияя друг на друга, начинают кристаллизоваться и остальные вещества, между тем как ранее образовавшиеся кристаллы тоже продолжают расти. Так образуются горные породы.
^ Строение кристалла.
Правильная многогранная форма кристалла, прежде всего, бросается в глаза наблюдателю, и она, конечно же, не составляет главную особенность кристаллического тела, но всё-таки я предлагаю обратить внимание на это явление - идеальную форму кристалла.
Форму, которую принимает монокристалл тогда, когда при его росте устранены все случайные факторы, называют идеальной. Идеальная форма кристалла имеет вид многогранника. Такой кристалл ограничен плоскими гранями, прямыми рёбрами и обладает симметрией. Как и всякий многогранник, кристалл имеет некоторое число граней P, рёбер R, вершин E, причём эти числа связаны между собой соотношением P+E=R+2. например, у куба 6 граней, 8 вершин и 12 рёбер (6+8=12+2). Для октаэдра (рис.1), додекаэдра (рис.2) это соотношение также справедливо.
Куб, октаэдр, додекаэдр представляют собой простые правильные многогранники. В форме правильных многогранников кристаллизуется сравнительно небольшое число кристаллов. В форме куба кристаллизуется поваренная соль, сернистый цинк, в форме октаэдров - алмаз, в форме ромбического додекаэдра - гранат. Чаще всего вещества кристаллизуются в виде сложных многогранников, т.е. они бывают ограничены несколькими сортами равных между собой граней. Так, например, кристалл имеет обычно 6 восьмиугольных граней, 8 шестиугольных граней и 12 четырёхугольных граней.
Кристаллы одного и того же вещества могут иметь весьма разнообразную форму. Форма кристалла зависит от условий кристаллизации. Цвет также не является характерным признаком кристаллов данного вещества, так как он очень сильно зависит от примесей. Известно, например, что кристаллы плавикового шпата могут быть бесцветными, розовыми, чёрными, фиолетовыми, тёмно-вишнёвыми и золотистыми. Казалось бы, что установление принадлежности двух кристаллов (отличающихся друг от друга и формой и цветом) одному веществу нельзя произвести иначе, как определив их химический состав. Однако кристаллографы установили на первый взгляд в высшей степени поразительный факт: в кристаллах одного вещества углы между соответственными гранями всегда одинаковы (закон постоянства углов).
Что понимают под соответственными гранями? В геометрии грани (плоские многоугольники) считаются равными, если они при наложении совпадают всеми своими точками. В кристаллографии равенство граней означает совершенно иное. Грани могут отличаться между собой по форме и всё-таки считаться равными, если они обладают одинаковыми физическими и химическими свойствами. Установить равенство граней в кристаллографическом смысле удаётся иногда путём внешнего их осмотра.
На рисункеодинаковой штриховкой показаны одинаковые (равные) грани. В кристалле кварца можно установить три сорта граней (на рис.2 они отмечены буквами a,b и c). Хотя в разных кристаллах кварца грани a (b,c) имеют разный размер и форму, они считаются равными. Закон постоянства углов утверждает, что двугранный угол, образованный гранями a и b (рис.2) в различных кристаллах данного вещества, будет один и тот же. Соответственно во всех кристаллах данного вещества будут равны между собой и двугранные углы, образованные гранями a и c, b и c.
Итак, не форма кристаллов, не размер граней, а угол между ними является определенной величиной для каждого кристалла.
Рис. 3 Рис. 4
Для измерения углов между гранями применяют специальный прибор – гониометр. Прикладной гониометр (рис. 3) может быть применён для исследования крупных монокристаллов. Более точные измерения выполняют отражательным гониометром, схема которого дана на рисунке 4. Пучок света, идущий от источника А, попадает на грань кристалла и после отражения входит в зрительную трубку Т. При повороте кристалла на определённый угол пучок света вновь попадает в зрительную трубу. По шкале III гониометра отсчитывают угол между гранями. Измерив углы между гранями неизвестного кристалла, можно по специальному каталогу определить химический состав кристалла.
С явлением симметрии мы часто встречаемся в окружающей жизни. Симметрична бабочка (рис.1). Форма, рисунок и окраска левого крыла повторяет форму, рисунок и окраску правого.
Рис.1 Рис.2
Если тело можно мысленно пересечь плоскостью так, что каждой точке a тела с одной стороны плоскости будет соответствовать точка b , лежащая по другую сторону плоскости и при том так, что прямая ab, соединяющая эти две точки, перпендикулярна плоскости и делится этой плоскостью пополам, то это тело обладает зеркальной симметрией. Сама плоскость называется в этом случае плоскостью симметрии. Например, плоскость, проведённая через середину рёбер куба параллельно его двум граням, служит плоскостью симметрии куба (рис.2). Куб имеет девять плоскостей симметрии.
Кроме зеркальной симметрии, тела могут обладать еще поворотной симметрией. Тело обладает поворотной симметрией, если при повороте на соответствующий угол все части фигуры совмещаются друг с другом. Ось, вокруг которой происходит вращение тела, называют осью симметрии. Смотря по тому, сколько раз совместится фигура сама с собой при одном полном повороте вокруг оси, ось симметрии имеет различный порядок (первый, второй, третий и т. д.).
Цветок ириса, например, обладает осью симметрии третьего порядка (рис.3), снежинки – осью симметрии шестого порядка. В цветах очень часто наблюдается ось симметрии пятого порядка
Тела могут обладать ещё центром симметрии. Центр симметрии – точка в середине тела, относительно которой любая точка тела имеет другую соответствующую ей точку, лежащую на таком же расстоянии от центра в противоположном направлении. В телах может быть несколько плоскостей симметрии, несколько осей симметрии различного порядка, но не может быть больше одного центра симметрии.
Если в параллелограмме, отогнуть углы в противоположные стороны, то центр квадрата, получившегося в середине этой фигуры, будет центром симметрии, так как он делит пополам все прямые, попарно соединяющие одинаковые точки фигуры. Геометрический центр шара, куба, октаэдра является центром симметрии этих тел. Ось симметрии, плоскость симметрии и центр симметрии называют элементами симметрии.
Элементы симметрии обладают рядом свойств. Вот некоторые из них:
Пересечение двух плоскостей симметрии даёт ось симметрии.
Пересечение трёх взаимно перпендикулярных плоскостей симметрии даёт центр симметрии.
Идеальные формы кристаллов симметричны.
В кристаллах можно найти различные элементы симметрии: плоскость симметрии, ось симметрии, центр симметрии.
Рассмотрим симметрию некоторых простейших кристаллических форм. Кристаллы в форме куба (NaCl , KCl и др.) имеют девять плоскостей симметрии, три из которых проходят параллельно граням куба, а шесть – по диагоналям. Кроме того, куб имеет три оси симметрии 4-го порядка, четыре оси 3-го порядка и шесть осей 2-го порядка (рис.1), кроме того, он имеет центр симметрии. Всего в кубе 1+9+3+4+6=23 элемента симметрии.
Кристаллы алмаза, калиевых квасцов имеют форму октаэдров. Октаэдры обладают такими же элементами симметрии, что и кубы. показаны оси вращения октаэдра. У кристаллов медного купороса имеется лишь центр симметрии, других элементов симметрии у них нет.
Симметрия, закон постоянства углов и ряд других свойств! Как объяснить такую привередливость кристаллических форм?
Первой попыткой научного объяснения формы кристаллов считается произведение ^ Иоганна Кеплера " О шестиугольных снежинках" (1611г.). Кеплер высказал предположение, что форма снежинок (кристалликов льда) есть следствие особых расположений составляющих их частиц .
В 1783 году французский аббат Рене Жюст Гаюи, минералог по призванию, высказал предположение, что всякий кристалл составлен из параллельно расположенных равных частиц, смежных по целым граням. В 1824 году ученик великого Гаусса, профессор физики во Фрайбурге Л.А.Зеебер для объяснения расширения кристаллов при нагревании предложил заменить многогранники Гаюи их центрами тяжестей. Причём эти центры тяжести образуют правильную систему точек, которая впоследствии была названа пространственной решёткой, а сами точки – узлами пространственной решётки. Например, кристалл поваренной соли NaCl состоит из совокупности большого числа ионов Na+ и Cl-, определённым образом расположенных друг относительно друга. Если изобразить каждый из ионов точкой и соединить их между собой, то можно получить геометрический образ, рисующий внутреннюю структуру идеального кристалла поваренной соли, его пространственную решётку (рис.1).
Пространственные решётки различных кристаллов различны. На рисунке 2 показана пространственная решётка алмаза, а на рисунке 3 – графита.
Рис.1 Рис.2 Рис.3
В каждой пространственной решётке можно выделить некоторый повторяющийся элемент её структуры, или, иначе говоря, элементарную ячейку. Пространственные, т.е. объёмные, а не плоские элементарные ячейки – это "кирпичи", прикладыванием которых друг к другу в пространстве строится кристалл. Так, элементарной ячейкой пространственной решётки NaCl является куб (рис. 4а). Очень важно здесь отметить, что существует много способов построения пространственных решёток из элементарных ячеек. "А сколько же их существует?" - спросите вы. Эта сложная задача была решена Е.С.Фёдоровым. Он доказал, что должны существовать 230 способов построения кристалла.
К наиболее простым элементарным ячейкам относятся куб, объемно-центрированный куб, гранецентрированный куб, гексагональная призма (см. рис. 4,а,б,в,г).
Рис. 4
Догадка о пространственной решётке кристалла – свидетельство о возможности научного предвидения. Ведь в то время (во второй половине XIX в.) не только не существовало доказательства этой гипотезы, но и само существование молекул и атомов вещества многими ставилось под сомнение. Понятие о пространственной решётке кристалла оказалось очень плодотворным, оно позволило объяснить ряд свойств кристалла. Известно, например, что кристалл, имеющий идеальную форму, ограничен плоскими гранями и прямыми рёбрами. Этот факт можно объяснить тем, что плоскость и рёбра идеального кристалла всегда проходят через узлы пространственной решётки.
Становиться также понятным, почему кристаллы одного и того же вещества могут иметь разнообразную форму. Подобно тому, как из данной плоской сетки можно вырезать различные по форме плоскости фигуры, так и кристалл, имея определённую пространственную решётку, может иметь различную форму.
В зависимости от строения, кристаллы делятся на ионные, ковалентные, молекулярные и металлические. Ионные кристаллы построены из чередующихся катионов и анионов, которые удерживаются в определенном порядке силами электростатического притяжения и отталкивания.
Электростатические силы ненаправленные: каждый ион может удержать вокруг себя столько ионов противоположного знака, сколько помещается. Но при этом силы притяжения и отталкивания должны быть уравновешены и должна сохраняться общая электронейтральность кристалла. Все это с учетом размеров ионов приводит к различным кристаллическим структурам. Так, при взаимодействии ионов Na+ и Cl– возникает октаэдрическая координация: каждый ион удерживает около себя шесть ионов противоположного знака, расположенных по вершинам октаэдра.Ионные кристаллы образуют большинство солей неорганических и органических кислот, оксиды, гидроксиды, соли. В ионных кристаллах связи между ионами прочные, поэтому такие кристаллы имеют высокие температуры плавления (801° С для NaCl, 2627° С для СаО).
В ковалентных кристаллах (их еще называют атомными) в узлах кристаллической решетки находятся атомы, одинаковые или разные, которые связаны ковалентными связями
Эти связи прочные и направлены под определенными углами. Типичным примером является алмаз; в его кристалле каждый атом углерода связан с четырьмя другими атомами, находящимися в вершинах тетраэдра. Ковалентные кристаллы образуют бор, кремний, германий, мышьяк, ZnS, SiO2, ReO3, TiO2, CuNCS.
Молекулярные кристаллы построены из изолированных молекул, между которыми действуют сравнительно слабые силы притяжения. В результате такие кристаллы имеют намного меньшие температуры плавления и кипения, твердость их низка. Так, кристаллы благородных газов (они построены из изолированных атомов) плавятся уже при очень низких температурах. Из неорганических соединений молекулярные кристаллы образуют многие неметаллы (благородные газы, водород, азот, белый фосфор, кислород, сера, галогены), соединения, молекулы которых образованы только ковалентными связями (h3O, HCl, Nh4, CO2 и др.). Этот тип кристаллов характерен также почти для всех органических соединений. Прочность молекулярных кристаллов зависит от размеров и сложности молекул. Так, кристаллы гелия (радиус атома 0,12 нм) плавятся при –271,4°С (под давлением 30 атм), а ксенона (радиус 0,22 нм) – при –111,8° С; кристаллы фтора плавятся при –219,6° С, а иода – при +113,6° С; метана СН4 – при –182,5° С, а триаконтана С30Н62 – при +65,8° С.
Металлические кристаллы образуют чистые металлы и их сплавы. Такие кристаллы можно увидеть на изломе металлов, а также на поверхности оцинкованной жести. Кристаллическая решетка металлов образована катионами, которые связаны подвижными электронами («электронным газом»). Такое строение обусловливает электропроводность, ковкость, высокую отражательную способность (блеск) кристаллов. Структура металлических кристаллов образуется в результате разной упаковки атомов-шаров.
Применение кристаллов.
Применения кристаллов в науке и технике так многочисленны и разнообразны, что их трудно перечислить. Поэтому ограничимся несколькими примерами.
Самый твердый и самый редкий из природных минералов - алмаз. Сегодня алмаз в первую очередь камень-работник, а не камень-украшение. Благодаря своей исключительной твердости алмаз играет громадную роль в технике. Алмазными пилами распиливают камни. Алмазная пила - это большой (до 2-х метров в диаметре) вращающийся стальной диск, на краях которого сделаны надрезы или зарубки. Мелкий порошок алмаза, смешанный с каким-нибудь клейким веществом, втирают в эти надрезы. Такой диск, вращаясь с большой скоростью, быстро распиливает любой камень. Колоссальное значение имеет алмаз при бурении горных пород, в горных работах. В граверных инструментах, делительных машинах, аппаратах для испытания твердости, сверлах для камня и металла вставлены алмазные острия.
Алмазным порошком шлифуют и полируют твердые камни, закаленную сталь, твердые и сверхтвердые сплавы. Сам алмаз можно резать, шлифовать и гравировать тоже только алмазом. Наиболее ответственные детали двигателей в автомобильном и авиационном производстве обрабатывают алмазными резцами и сверлами.
Рубин и сапфир относятся к самым красивым и самым дорогим из драгоценных камней. У всех этих камней есть и другие качества, более скромные, но полезные. Кроваво-красный рубин и лазарево-синий сапфир - это родные братья, это вообще один и тот же минерал - корунд, окись алюминия А12О3. Разница в цвете возникла из-за очень малых примесей в окиси алюминия: ничтожная добавка хрома превращает бесцветный корунд в кроваво-красный рубин, окись титана - в сапфир. Есть корунды и других цветов. Есть у них ещё совсем скромный, невзрачный брат: бурый, непрозрачный, мелкий корунд - наждак, которым чистят металл, из которого делают наждачную шкурку. Корунд со всеми его разновидностями - это один из самых твердых камней на Земле, самый твердый после алмаза. Корундом можно сверлить, шлифовать, полировать, точить камень и металл. Из корунда и наждака делают точильные круги и бруски, шлифовальные порошки.
Вся часовая промышленность работает на искусственных рубинах. На полупроводниковых заводах тончайшие схемы рисуют рубиновыми иглами. В текстильной и химической промышленности рубиновые нитеводители вытягивают нити из искусственных волокон, из капрона, из нейлона. Новая жизнь рубина - это лазер или, как его называют в науке, оптический квантовый генератор (ОКГ), чудесный прибор наших дней. В 1960г. был создан первый лазер на рубине. Оказалось, что кристалл рубина усиливает свет. Лазер светит ярче тысячи солнц.
Мощный луч лазера громадный мощностью. Он легко прожигает листовой металл, сваривает металлические провода, прожигает металлические трубы, сверлит тончайшие отверстия в твердых сплавах, алмазе. Эти функции выполняет твердый лазер, где используется рубин, гранат с неодитом. В глазной хирургии применяется чаще всего неодиновые лазеры и лазеры на рубине. В наземных системах ближнего радиуса действия часто используются инжекционные лазеры на арсениде галлия.
Сапфир прозрачен, поэтому из него делают пластины для оптических приборов.
Основная масса кристаллов сапфира идет в полупроводниковую промышленность.
Кремень, аметист, яшма, опал, халцедон — все это разновидности кварца. Мелкие зернышки кварца образуют песок. А самая красивая, самая чудесная разновидность кварца - это и есть горный хрусталь, т.е. прозрачные кристаллы кварца. Поэтому из прозрачного кварца делают линзы, призмы и др. детали оптических приборов.
В технике также нашел своё применение поликристаллический материал поляроид. Поляроид - это тонкая прозрачная пленка, сплошь заполненная крохотными прозрачными игольчатыми кристалликами вещества, двупреломляющего и поляризующего свет. Все кристаллики расположены параллельно друг другу, поэтому все они одинаково поляризуют свет, проходящий через пленку. Поляроидные пленки применяются в поляроидных очках. Поляроиды гасят блики отраженного света, пропуская весь остальной свет. Они незаменимы для полярников, которым постоянно приходится смотреть на ослепительное отражение солнечных лучей от заледеневшего снежного поля. Поляроидные стекла помогут предотвратить столкновения встречных автомобилей, которые очень часто случаются из-за того, что огни встречной машины ослепляют шофера, и он не видит этой машины. Если же ветровые стекла автомобилей и стекла автомобильных фонарей сделать из поляроида, причем повернуть оба поляроида так, чтобы их оптические оси были смещены, то в
www.ronl.ru
МОУ «Шахунская гимназия имени А.С. Пушкина»
Исследовательская работа по физике
по теме « Удивительные кристаллы»
Выполнила ученица 8а класса
Астафьева Ангелина
Руководитель: учитель физики
Платова Татьяна Александровна
г. Шахунья
2011 год
Содержание
Введение……………………………………………………………………………..3
Глава 1.
Удивительные кристаллы…………………………………………………….5
Кристаллическая решетка…………………………………………………….8
Применение кристаллов……………………………………………………...12
Глава 2. Эксперимент
Заключение…………………………………………………………………………..16
Литература…………………………………………………………………………...17
Введение
В земле иногда находят камни такой формы, как будто их кто-то тщательно выпиливал, шлифовал, полировал. Это - многогранники с плоскими гранями, с прямыми ребрами. Вот эти-то камни с природной, то есть не сделанной руками человека, правильной, симметричной формы и называются кристаллами. Кристаллы, залегающие в земле, бесконечно разнообразны. Размеры природных многогранников достигают подчас человеческого роста и более. Встречаются кристаллы - лепестки, тоньше тетрадного листа бумаги и кристаллы - пласты в несколько метров толщиной. Бывают кристаллы маленькие, узкие и острые, как иголка, и бывают громадные, как колонны. В некоторых местностях Испании такие кристаллические колонны ставят как столбы для ворот. В музее Горного института в Санкт-Петербурге хранятся кристаллы горного хрусталя (кварца) высотой около метра и весом более тонны, который много лет служил тумбой ворот одного из домов Екатеринбурга. Многие кристаллы идеально чисты и прозрачны как вода. Недаром говорят: (прозрачный, как кристалл), (кристально чистый).
Все кристаллы, окружающие нас, не образовались когда-то раз и навсегда готовыми, а выросли постепенно. Кристаллы бывают не только природными, но так же и искусственные выращиваемые человеком. Зачем же создают еще и искусственные кристаллы, если и так почти все твёрдые тела вокруг нас имеют кристаллическое строение? При искусственном выращивании можно получить кристаллы крупнее и чище, чем в природе. Есть и такие кристаллы, которые в природе редки и ценятся дорого, а в технике очень нужны. Поэтому разработаны лабораторные и заводские методы выращивания кристаллов алмаза, кварца, сапфира и др. В лабораториях выращивают большие кристаллы, необходимые для техники и науки, драгоценные камни, кристаллические материалы для точных приборов, там создают и те кристаллы, которые изучают кристаллографы, физики, химики, металловеды, минералоги, открывая в них новые замечательные явления и свойства. В природе, в лаборатории, на заводе кристаллы растут из растворов, из расплавов, из паров, из твердых веществ. Поэтому представляется важным и интересным изучить процесс образования кристаллов, выяснить условия их образования, вырастить кристаллы без применения специальных приспособлений. Это и определило тему исследовательской работы.
Цель исследования – изучение влияния различных факторов и условий на процесс роста кристаллов из растворов и расплавов солей.
Для достижения поставленной цели необходимо решить следующие задачи:
1) изучить специальную литературу и ресурсы Internet, посвященные данной теме;
2) отобрать вещества, из которых возможно вырастить кристаллы;
3) проследить за ростом кристаллов с помощью микроскопа;
4) вырастить большие кристаллы медного купороса и поваренной соли способом испарения растворителя, способом постепенного снижения температуры растворов;
5) исследовать зависимость формы кристалла от условий кристаллизации.
Гипотеза:
Кристаллизация в природе – длительный процесс, чистые кристаллы, без включений – редкость; в лабораторных условиях можно вырастить кристаллы многих веществ за сравнительно короткое время.
Практическая значимость:
Результаты исследования могут быть использованы учителями для проведения уроков по теме «Кристаллы» и просто любознательными людьми для расширения кругозора.
Методы:
Химические опыты по выращиванию кристаллов в домашних условиях.
Фотографирование.
Изучение литературы.
ГЛАВА 1
Удивительные кристаллы
Большинство веществ в умеренном климате Земли находится в твердом состоянии. В отличие от жидкостей твердые тела сохраняют не только свой объем, но и форму, так как положение в пространстве частиц, составляющих тело, стабильно. Из-за значительных сил межмолекулярного взаимодействия частицы не могут удалиться друг от друга на значительное расстояние.
По характеру относительного расположения частиц твердые тела делят на три вида: кристаллические, аморфные и композиты. Принадлежность твердых тел к одному из трех видов определяется их химическим составом. Разная пространственная конфигурация отдельных молекул предопределяет различие пространственной структуры, возникающей при их объединении в твердое тело.
При наличии периодичности в расположении атомов (дальнего порядка) твердое тело является кристаллическим.
Слово «кристалл» происходит от греческого «крюсталлос», что означает лёд. В древности было подмечено сходство кристаллов льда и горного хрусталя: бесцветные прозрачные шестигранные «карандашики» с острыми пирамидками на концах. Полагали, что лёд, находясь длительное время в горах, на сильном морозе, окаменевает и теряет способность таять. Много ценных наблюдений над кристаллами было сделано древними фармацевтами в процессе приготовления лекарств. И это понятно, поскольку в таких случаях обычно прибегали к процедурам, которые мы теперь называем кристаллизацией. Кристаллы наделялись множеством таинственных свойств: исцелять от болезней, предохранять от яда, влиять на судьбу человека…
Кристаллы имеют правильную геометрическую форму, которая является результатом упорядоченного расположения частиц, составляющих кристалл.
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы.
Монокристаллы - это твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристалла обнаруживается по их внешней форме.
Поликристаллы агрегаты из большого числа маленьких кристаллов, ориентированных друг относительно друга хаотически. Большинство твердых технических материалов являются поликристаллическими.
Монокристалл Поликристалл
Блестящие и ровные грани кристаллов выглядят так, как будто над ними поработал искусный шлифовальщик (рис.1). Отдельные части кристалла повторяют друг друга, образуя красивую правильную форму (рис. 2).
Рис. 1 Рис. 2
Разнообразие кристаллов по форме очень велико. Кристаллы могут иметь от четырёх до нескольких сотен граней. Но при этом они обладают замечательным свойством, – какими бы небыли размеры, форма и число граней одного и того же кристалла, все плоские грани пересекаются друг с другом под определенными углами. Углы между соответственными гранями всегда одинаковы.
Посмотрим в лупу на сахарный песок: мы увидим, что это мелкие, но очень правильные кристаллы, блестящие, прозрачные, с плоскими сторонами – гранями (рис.3).

Рис.3
Приглядевшись, например, к выращенным кристаллам соли внимательно, мы видим, что они построены из «кирпичиков», плотно приложенных друг к другу. Разбив кристалл, мы можем наблюдать, что он разлетится на кусочки разной величины. Рассмотрев их внимательно, обнаружим, что эти кусочки имеют правильную форму, вполне подобную форме большого кристалла – их родителя. Для кристаллов поваренной соли типична форма кубиков (рис.4), для медного купороса – ромбов (рис.5), для йодида свинца – ровных шестиугольников (рис.6).
Рис.4 Рис.5 Рис.6
Существуют особые формы кристаллов: иглы, перья, ветки, цветы, деревца и т.п. Примерами таких причудливых кристаллов служат всем известные ледяные узоры на окнах и узоры из раствора хлорида аммония (рис.7). У каждого вещества есть своя характерная форма кристаллов, по которой его можно узнавать.
Рис.7
Кристаллическая решетка
Регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется пространственной (кристаллической) решеткой.

В кристаллическом твердом теле в отличие от жидкости и газа частицы располагаются упорядоченно, колеблясь вблизи узлов кристаллической решетки. Принцип построения кристаллической решетки можно представить следующим образом. Отдельные атомы группируются в идентичные элементарные блоки по принципу плотной упаковки. Получившиеся блоки объединяются, образуя общую геометрическую конструкцию – кристаллическую решетку.
Существует всего семь основных блоков, которыми можно заполнить трехмерное пространство (без пропусков) и из которых могут быть сконструированы все кристаллы (табл. 1).

Основные элементы (ячейки) кристаллических решеток решёток Брама
Кубическая
Тетрагональная
Гексагональная
Ромбоэдрическая
Ромбическая
Моноклинная
Триклинная
Таблица 1
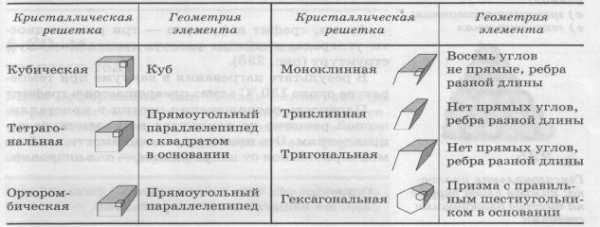
Типы кристаллических решеток
Простейший строительный блок (куб) допускает три способа размещения атомов: по углам (простая кубическая решетка), в центре куба {кубически центрированная решетка) и в центре граней {гранецентрированная решетка). Простая кубическая решетка характерна для соли NaCl (рис. 8, а). Электронные оболочки атомов, образующих такую решетку, касаются друг друга, заполняя лишь 52% пространства. Кубическая центрированная решетка, характерная для Fe и Na; заполняет 68% пространства (рис. 8, б).
Наиболее плотная упаковка (74% пространства) достигается при гранецентрированной решетке, которая характерна для Ag, Au, Ni, Си, Al, Sn (рис. 8, в). Такое же наиболее плотное заполнение пространства возможно при гексагональной решетке, характерной для Zn и инертных газов (рис. 8, г). В этой решетке нет ничего экзотического: именно так укладывают сливы, апельсины и пушечные ядра.
Рис. 8
Типы кристаллических решеток:
а) кубическая;
б) кубическая центрированная;
в) гранецентрированная;
г) гексагональная.
Некоторые вещества, имеющие одинаковый химический состав, отличаются по физическим свойствам из-за различия структуры их кристаллических решеток.
Полиморфизм — существование различных кристаллических структур у одного и того же вещества.
Алмаз, графит и фулерен — три разновидности углерода, имеющие разную кристаллическую структуру (рис. 9).
Рис.9
В результате нагревания в вакууме при температуре около 150 °С алмаз превращается в графит.
Плотность расположения частиц в кристаллической решетке не одинакова по различным направлениям. Это приводит к зависимости свойств монокристаллов от направления — анизотропии.
Анизотропия — зависимость физических свойств вещества от направления.
Физические свойства поликристаллов не зависят от направления; они изотропны.
Изотропия – независимость физических свойств вещества от направления.
Кристаллы могут иметь и разные размеры. Некоторые минералы образуют кристаллы, которые разглядеть можно только с помощью микроскопа. Другие же образуют кристаллы, вес которых составляет несколько сотен фунтов.
Изучение внешней формы кристаллов началось прежде изучения симметрии, однако только после вывода 32 видов симметрии появилась надежная основа для создания геометрического учения о внешней форме кристаллов. Основным его понятием является понятие простой формы (рис.10).
«Простой формой называется многогранник, который может быть получен из одной грани с помощью элементов симметрии (оси, плоскости и центра симметрии)».
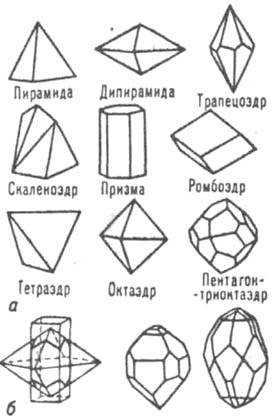 Рис. 10. Простые формы (а) кристаллов и некоторые их комбинации
Рис. 10. Простые формы (а) кристаллов и некоторые их комбинации
Простые формы могут быть общими и частными в зависимости от того, как расположена исходная грань по отношению к элементам симметрии. Если она расположена косо, то простая форма, полученная из нее, будет общей. Если же исходная форма расположена параллельно или перпендикулярно к элементам симметрии, то получается частная простая форма.
Простые формы так же могут быть закрытыми и открытыми.
Закрытая форма может одна образовать кристаллический многогранник, в то время как одна открытая простая форма замкнутого многогранника образовать не может.
Каждая грань кристалла представляет собой плоскость, на которой располагаются атомы. Когда кристалл растет, все грани передвигаются параллельно сами себе, так как на них откладываются все новые и новые слои атомов. По этой причине, параллельно каждой грани в структуре кристалла располагается огромное количество атомных плоскостей, которые когда-то в начальных стадиях роста тоже располагались на гранях кристалла, но в процессе роста оказались внутри него.
Ребра кристалла представляют собой прямые, на которых атомы располагаются в ряд. Таких рядов в кристалле тоже огромное количество и они располагаются параллельно действительным ребрам кристалла.
Кристаллы правильной геометрической формы встречаются в природе редко. Совместное действие таких неблагоприятных факторов, как колебания температуры, тесное окружение соседними твердыми телами, не позволяют растущему кристаллу приобрести характерную для него форму. Кроме того, значительная часть кристаллов, имевших в далеком прошлом совершенную огранку, успела утратить ее под действием воды, ветра, трения о другие твердые тела. Так, многие округлые прозрачные зерна, которые можно найти в прибрежном песке, являются кристаллами кварца, лишившимися граней в результате длительного трения друг о друга.
Природные кристаллы всегда возбуждали любопытство у людей. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и жилище. С давних пор с кристаллами были связаны суеверия; как амулеты, они должны были не только ограждать своих владельцев от злых духов, но и наделять их сверхъестественными способностями. Позднее, когда те же самые минералы стали разрезать и полировать, как драгоценные камни, многие суеверия сохранились в талисманах "на счастье" и "своих камнях", соответствующих месяцу рождения. Все природные драгоценные камни, кроме опала, являются кристаллическими, и многие из них, такие, как алмаз, рубин, сапфир и изумруд, попадаются в виде прекрасно ограненных кристаллов. Украшения из кристаллов сейчас столь же популярны, как и во время неолита. Опираясь на законы оптики, ученые искали прозрачный бесцветный и бездефектный минерал, из которого можно было бы шлифованием и полированием изготавливать линзы. Нужными оптическими и механическими свойствами обладают кристаллы неокрашенного кварца, и первые линзы, в том числе и для очков, изготавливались из них. Даже после появления искусственного оптического стекла потребность в кристаллах полностью не отпала; кристаллы кварца, кальцита и других прозрачных веществ, пропускающих ультрафиолетовое и инфракрасное излучение, до сих пор применяются для изготовления призм и линз оптических приборов.
Применения кристаллов в науке и технике так многочисленны и разнообразны, что их трудно перечислить. Поэтому ограничимся несколькими примерами.Самый твердый и самый редкий из природных минералов - алмаз. За всю историю человечества его добыто всего около 150 т, хотя в мировой алмазодобывающей промышленности сейчас работает почти миллион человек. Сегодня алмаз в первую очередь камень-работник, а не камень-украшение. Около 80% всех добываемых природных алмазов и все искусственные алмазы используются в промышленности. Примерно 80% применяемых в технике алмазов идет на заточку инструментов и резцов "сверхтвердых сплавов". Алмазы служат опорными камнями (подшипниками) в хронометрах высшего класса для морских судов и в других особо точных навигационных приборах. На алмазных подшипниках не обнаруживается никаких следов износа даже после 25 000 000 оборотов.
Несколько уступая алмазу по твердости, соревнуется с ним но разнообразию технических применении рубин - благородный корунд, окись алюминия Al2O3 с красящей примесью окиси хрома. Мировое производство искусственных рубинов превышает 100 г. в год. Из 1 кг синтетического рубина удается изготовить около 40 000 опорных камней для часов. Незаменимыми оказались рубиновые стержни на фабриках по изготовлению тканей из химического волокна. На изготовление 1 м ткани из искусственного волокна требуется израсходовать сотни тысяч метров волокна. Нитеводители из самого твердого стекла изнашиваются за несколько дней при протяжке через них искусственного волокна, агатовые способны работать до двух месяцев, рубиновые нитеводители оказываются практически вечными.
Новая область для широкого применения рубинов в научных исследованиях и в технике открылась с изобретением рубинового лазера - прибора, в котором рубиновый стержень служит мощным источником света, испускаемою в виде тонкого светового луча.Исключительная роль выпала на долю кристаллов в современной электронике. Большинство полупроводниковых электронных приборов изготовлено из кристаллов германия или кремния.
Почти любое вещество может при известных условиях дать кристаллы. Кристаллы образуются чаще всего из жидкой фазы - раствора или расплава; возможно получение кристаллов из газовой фазы или при фазовом превращении в твердой фазе. Кристаллы выращивают (синтезируют) в лабораториях и на заводах. Можно получать и кристаллы таких сложных природных веществ, как белки и даже вирусы.
Многим известно, что растворимость веществ зависит от температуры. Обычно с повышением температуры растворимость увеличивается, а с понижением – уменьшается. Мы знаем, что одни вещества растворяются хорошо, другие - плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы. Насыщенный раствор – это раствор, который содержит максимальное количество растворяемого вещества при данной температуре. Ненасыщенный раствор – это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре.
Я использовала самый простой способ выращивания кристаллов медного купороса и каменной соли из раствора. Сначала необходимо приготовить насыщенный раствор. Для этого в стакан наливают воду (горячую, но не кипящую) и в неё насыпают порциями вещество (порошок медного купороса или каменной соли) и размешивают стеклянной или деревянной палочкой до полного растворения. Как только вещество перестанет растворяться, это значит, что при данной температуре раствор насыщен. Потом он будет охлаждаться, когда вода станет постепенно испаряться из него, «лишнее» вещество выпадает в виде кристалликов. Сверху на стакан необходимо положить карандаш (палочку), вокруг которого обмотана нитка. К свободному концу нитки привешивается какой-нибудь груз, чтобы нитка распрямилась и висела в растворе вертикально, не доставая немного дна. Оставить стакан в покое на 2-3 дня. Спустя время можно обнаружить, что нитка обросла кристалликами. Результаты формирования кристаллов методом охлаждения представлены на фотографии.



Заключение
Изучив литературу, посвященную кристаллам, и проведя эксперимент по выращиванию кристаллов, мы пришли к следующим выводам:
кристаллы окружают нас повсюду, «почти весь мир кристалличен»;
кристаллы различных веществ отличаются друг от друга по всей форме;
кристаллы окружающие нас, не образовались когда-то раз и навсегда готовыми, а выросли постепенно: в природе, в лаборатории, на заводе. И мы убедились в этом, вырастив кристаллы, применяя раствор медного купороса, нитрата калия, хлорида кобальта, хлорида аммония и др.
процесс кристаллизации в растворах и расплавах веществ протекает сходным образом;
формы кристаллов зависят от условий кристаллизации – скорости охлаждения, чистоты препарата, формы и материала затравки;
вырастили кристаллы медного купороса и нитрата калия методом охлаждения, используя различные виды затравки.
Искусственные кристаллы очень нужны. Выращивая кристаллы в лабораториях, человек может узнать, как кристаллы рождаются и живут в природных условиях, изучить свойства кристаллов. Кроме того, процесс выращивания кристаллов очень красив и увлекателен.
ЛИТЕРАТУРА:
«Кристаллы. Их роль в природе и науке» Банн Ч. - М.: «Мир», 1977.
«Кристаллография» М.Л. Шаскольская М., «Высшая школа», 1976.
«Кристаллы» М.Л. Шаскольская М., «Наука», 1987.
«Большая энциклопедия Кирилла и Мефодия 2003» (электронная версия).
Журнал «Наука и жизнь», выпуск 2, 1987.
Кристаллы. Рост, структура, свойства. - М.: «Наука», 1993.
Современная кристаллография, т. 1-4, М., 1979-81
Интернет:
;
gigabaza.ru
Реферат на тему: Твердые кристаллы
Содержание
Введение
1. Монокристаллы и кристаллические агрегаты
2. Симметрия в кристаллах
3. Форма кристаллов
4. Атомная структура кристаллов
5. Свойства кристаллов
6. Как растут кристаллы
7. Прочность кристаллов
Заключение
Библиография
Введение
Кристаллы одни из самых красивых и загадочных творений природы. В настоящее время изучением многообразия кристаллов занимается наука кристаллография. Она выявляет признаки единства в этом многообразии, исследует свойства и строение как одиночных кристаллов, так и кристаллических агрегатов. Кристаллография является наукой, всесторонне изучающей кристаллическое вещество. Данная работа также посвящена кристаллам и их свойствам.
В давние времена считалось, что кристаллы представляют собой редкость. Действительно, нахождение в природе крупных однородных кристаллов — явление нечастое. Однако мелкокристаллические вещества встречаются весьма часто. Так, например, почти все горные породы: гранит, песчаники известняк — кристалличны. По мере совершенствования методов исследования кристалличными оказались вещества, до этого считавшиеся аморфными. Сейчас мы знаем, что даже некоторые части организма кристалличны, например, роговица глаза.
В настоящее время кристаллы имеют большое распространение в науке и техники, так как обладают особыми свойствами. Такие области использования кристаллов, как полупроводники, сверхпроводники, пьезо- и сегнетоэлектрики, квантовая электроника и многие другие требуют глубокого понимания зависимости физических свойств кристаллов от их химического состава и строения.
В настоящее время известны способы искусственного выращивания кристаллов. Кристалл можно вырастить в обыкновенном стакане, для этого требуется лишь определенный раствор и аккуратность с которой необходимо ухаживать за растущим кристаллом.
В школьных учебниках кристаллами обычно называют твердые тела, образующихся в природных или лабораторных условиях и имеющие вид многогранников, которые напоминают самые непогрешимо строгие геометрические построения. Поверхность таких фигур ограничена более или менее совершенными плоскостями — гранями, пересекающимися по прямым линиям — ребрам. Точки пересечения ребер образуют вершины. Сразу же следует оговорится, что приведенное выше определение требует существенных поправок. Вспомним, например, всем известную горную породу границ, состоящую из зерен полевого шпата, слюды и кварца. Все эти зерна являются кристаллами, однако, их извилистые зерна не сохранили прежней прямолинейности и плоскогранности, а следовательно не подходят к вышеуказанному описанию. Одновременный рост всех составляющих гранит кристаллов, мешавших друг другу развиваться, и привел к тому, что отдельные кристаллы не смогли получить свойственную им правильную многогранную форму. Итак, для образования правильно ограненных кристаллов необходимо, чтобы ничто не мешало им свободно развиваться, не теснило бы их и не препятствовало их росту.
Кристаллов в природе существует великое множество и так же много существует различных форм кристаллов. В реальности, практически невозможно привести определение, которое подходило бы ко всем кристаллам. Здесь на помощь можно привлечь результаты рентгеновского анализа кристаллов. Рентгеновские лучи дают возможность как бы нащупать атомы внутри кристаллического тела и определяет их пространственное расположение. В результате было установлено, что решительно все кристаллы построены из элементарных частиц, расположенных в строгом порядке внутри кристаллического тела. Упорядоченность расположения таких частиц и отличает кристаллическое состояние от некристаллического, где степень упорядоченности частиц ничтожна.
Во всех без исключения кристаллических постройках из атомов можно выделить множество одинаковых атомов, расположенных наподобие узлов пространственной решетки. Чтобы представить такую решетку, мысленно заполним пространство множеством равных параллелепипедов, параллельно ориентированных и соприкасающихся по целым граням. Простейший пример такой постройки представляет собой кладка из одинаковых кирпичиков. Если внутри кирпичиков выделить соответственные точки, например, их центры или вершины, то мы и получим модель пространственной решетки. Для всех без исключения кристаллических тел характерно решетчатое строение.
Итак, кристаллами называются «все твердые тела, в которых слагающие их частицы (атомы, ионы, молекулы) расположены строго закономерно наподобие узлов пространственных решеток».
1. Монокристаллы и кристаллические агрегаты
В отличие от других агрегатных состояний, кристаллическое состояние многообразно. Одни и те же по составу молекулы могут быть упакованы в кристаллах разными способами. От способа же упаковки зависят физические и химические свойства вещества. Таким образом одни и те же по химическому составу вещества на самом деле часто обладают различными физическим свойствами. Для жидкого состояния такое многообразие не характерно, а для газообразного — невозможно.
Если взять, например, обычную поваренную соль, то легко увидеть даже без микроскопа отдельные кристаллики. Каждый кристаллик есть вещество NaCl, но одновременно он имеет черты индивидуума. Он может быть большим или малым кубическим или прямоугольно-параллелепипедальным, по-разному ограненным и т.д.
В жидкости нельзя увидеть отдельные индивидуумы — капельки, в кристаллическом же веществе они видимы.
Если мы хотим подчеркнуть, что имеем дело с одиночным, отдельным кристаллом, то называем его монокристаллом, чтобы подчеркнуть что речь идет о скоплении многих кристаллов, используется термин кристаллический агрегат. Если в кристаллическом агрегате отдельные кристаллы почти не огранены, это может объяснятся тем, что кристаллизация началась одновременно во многих точках вещества и скорость ее была достаточно высока. Растущие кристаллы являются препятствием друг другу и мешают правильному огранению каждого из них.
2. Симметрия в кристаллах
Рассматривая различные кристаллы мы видим, что все они разные по форме, но любой из них представляет симметричное тело. И действительно симметричность это одно из основных свойств кристаллов. К понятию о симметрии мы привыкли с детства. Симметричными мы называем тела, которые состоят из равных одинаковых частей. Наиболее известными элементами симметрии для нас являются плоскость симметрии (зеркальное отображение), ось симметрии (поворот вокруг оси, перпендикулярной к плоскости). По углу поворота различают порядок оси симметрии, поворот на 180о – ось симметрии 2-ого порядка, 120о – 3-его порядка и так далее. Есть и еще один элемент симметрии — центр симметрии. Представьте себе зеркало, но не большое, а точечное: точку в которой все отображается как в зеркале. Вот эта точка и есть центр симметрии. При таком отображении отражение поворачивается не только справа налево, но и с лица на изнанку.
Все кристаллы симметричны. Это значит, что в каждом кристаллическом многограннике можно найти плоскости симметрии, оси симметрии, центры симметрии и другие элементы симметрии так, чтобы совместились друг с другом одинаковые части многогранника. Введем еще одно понятие относящиеся к симметрии полярность. Представим конус и цилиндр, у обоих объектов есть по одной оси симметрии бесконечного порядка, но они различаются полярностью, у конуса ось полярна (представим центральную ось в виде стрелочки, указывающей к вершине), а у цилиндра ось неполярна.
Поговорим о видах симметрии в кристалле. Прежде всего в кристаллах могут быть оси симметрии только 1, 2, 3, 4 и 6 порядков. Представим плоскость, которую надо полностью покрыть семи-, восьсми-, девятиугольниками и т.д., так чтобы между фигурами не оставалось пространства, это не получится, пятиугольниками покрыть плоскость так же нельзя. Очевидно, оси симметрии 5, 7-го и выше порядков не возможны, потому что при такой структуре атомные ряды и сетки не заполнят пространство непрерывно, возникнут пустоты, промежутки между положениями равновесия атомов. Атомы окажутся не в самых устойчивых положениях и кристаллическая структура разрушится.
В кристаллическом многограннике можно найти разные сочетания элементов симметрии – у одних мало, у других много. По симметрии, прежде всего по осям симметрии, кристаллы делятся на три категории.
К высшей категории относятся самые симметричные кристаллы, у них может быть несколько осей симметрии порядков 2,3 и 4, нет осей 6-го порядка, могут быть плоскости и центры симметрии. К таким формам относятся куб, октаэдр, тетраэдр и др. Им всем присуща общая черта: они примерно одинаковы во все стороны.
У кристаллов средней категории могут быть оси 3, 4 и 6 порядков, но только по одной. Осей 2 порядка может быть несколько, возможны плоскости симметрии и центры симметрии. Формы этих кристаллов: призмы, пирамиды и др. Общая черта: резкое различие вдоль и поперек главной оси симметрии.
У кристаллов низшей категории не может быть ни одной оси симметрии 3 4 и 6 порядков, могут быть только оси 2 порядка, плоскости или центр симметрии. Структура данных кристаллов самая сложная.
Из кристаллов к высшей категории относятся: алмаз, квасцы, гранаты германий, кремний, медь, алюминий, золото, серебро, серое олово вольфрам, железо; к средней категории – графит, рубин, кварц, цинк, магний, белое олово, турмалин, берилл; к низшей – гипс, слюда, медный купорос, сегнетовая соль и др. Конечно в этом списке не были перечислены все существующие кристаллы, а только наиболее известные из них. Категория, к которой принадлежит кристалл характеризует его физический свойства.
Категории в свою очередь разделяются на семь сингоний. В переводе с греческого «сингония» означает «сходноугольство». В сингонию объединяются кристаллы с одинаковыми осями симметрии, а значит, со сходными углами поворотов в структуре. Плоскости и центр симметрии могут быть в любой сингонии.
Каждый кристаллический многогранник обладает определенным набором элементов симметрии. Полный набор всех элементов симметрии, присущих данному кристаллу называется классом симметрии. Сколько же всего таких наборов? Их количество ограничено. Математическим путем было доказано, что в кристаллах существует 32 вида симметрии.
3. Форма кристаллов
Изучение внешней формы кристаллов началось прежде изучения симметрии, однако только после вывода 32 видов симметрии появилась надежная основа для создания геометрического учения о внешней форме кристаллов. Основным его понятием является понятие простой формы.
«Простой формой называется многогранник, который может быть получен из одной грани с помощью элементов симметрии (оси, плоскости и центра симметрии)».
Простые формы могут быть общими и частными в зависимости от того, как расположена исходная грань по отношению к элементам симметрии. Если она расположена косо, то простая форма полученная из нее будет общей. Если же исходная форма расположена параллельно или перпендикулярно к элементам симметрии, то получается частная простая форма. Простые формы так же могут быть закрытыми и открытыми. Закрытая форма может одна образовать кристаллический многогранник, в то время как одна открытая простая форма замкнутого многогранника образовать не может.
Каждая грань кристалла представляет собой плоскость, на которой располагаются атомы. Когда кристалл растет все грани передвигаются параллельно сами себе, так как на них откладываются все новые и новые слои атомов. По этой причине, параллельно каждой грани в структуре кристалла располагается огромное количество атомных плоскостей, которые когда-то в начальных стадиях роста тоже располагались на гранях кристалла, но в процессе роста оказались внутри него.
Ребра кристалла представляют собой прямые, на которых атомы располагаются в ряд. Таких рядов в кристалле тоже огромное количество и они располагаются параллельно действительным ребрам кристалла.
Кристаллический многогранник обычно представляет собой комбинацию нескольких простых форм, грани (или ребра) которых являются действительными гранями (ребрами). Грань, которой на данном кристалле нет, но которая может оказаться на других кристаллах того же вещества, называется возможной гранью. Возможной гранью может быть плоскость, проходящая через два действительных или возможных ребра кристалла. Точно так же, если возьмем две реальные грани, которые на данном кристаллическом многограннике не пересекаются, то линия, параллельная линии их пересечения, будет возможным ребром кристалла.
Совокупность граней, пересекающихся в параллельных ребрах, называется поясом или зоной. А параллельная этим ребрам линия называется осью зоны.
Необходимо упомянуть, что кристаллографами был создан строго математический вывод всех возможных на свете кристаллических форм, и теперь можно не только предположить, какова будет форма кристалла, а с большой уверенностью рассчитать будущую форму.
В течении долгих лет геометрия кристаллов казалась таинственной и неразрешимой загадкой. В 1619 великий немецкий математик и астроном Йоган Кеплер обратил внимание на шестерную симметрию снежинок. Он попытался объяснить ее тем, что кристаллы построены из мельчайших одинаковых шариков, теснейшим образом присоединенных друг к другу (вокруг центрального шарика можно в плотную разложить только шесть таких же шариков). По пути намеченному Кеплером пошли в последствии Роберт Гук и М. В. Ломоносов. Они так же считали, что элементарные частицы кристаллов можно уподобить плотно упакованным шарикам. В наше время принцип плотнейших шаровых упаковок лежит в основе структурной кристаллографии, только сплошные шаровые частицы старинных авторов заменены сейчас атомами и ионами.
Через 50 лет после Кеплера датский геолог, кристаллограф и анатом Николас Стенон впервые сформулировал основные понятия о формировании кристаллов: "Рост кристалла происходит не изнутри, как у растений, но путем наложения на внешние плоскости кристалламельчайших частиц, приносящихся извне некоторой жидкостью". Эта идея о росте кристаллов в результате отложения на гранях все новых и новых слоев вещества сохранила свое значение и до сих пор.
Очень часто кристаллы одного и того же вещества срастаются друг с другом закономерным образом, образуя так называемый двойник. При этом обычно возникают дополнительные элементы симметрии, называющиеся в данном случае двойниковые элементы симметрии. Если сросток состоит из многих кристаллов, закономерно чередующихся друг с другом, то он называется полисинтетическим двойником. Двойниковые кристаллы являются очень распространенным явлением в природе. Многие вещества, получаемые в лаборатории, также часто имеют двойники как простые, так и полисинтетические.
4. Атомная структура кристаллов
«Все найдено!»- воскликнул Рене Жюст Гаюи (1743-1822), заметив, что случайно выпавший из его рук большой кристалл кальцита раскололся на множество маленьких параллелепипедальных (ромбоэдрических) осколков (кальцит обладает хорошей спайностью — способностью раскалываться – по ромбаэдру). В этот именно момент в его уме зародилась новая теория строения кристаллов. В отличие от Кеплера, Гука и Ломоносова, Гаюи предположил, что кристаллы построены не из мельчайших шариков, а из молекул параллелепипедальной формы и что предельно малые спайные осколки и являются этими самими молекулами. Иными словами, кристаллы представляют собой своеобразные кладки из молекулярных «кирпичиков» Несмотря на всю свою наивность с современной точки зрения эта теория сыграла в свое время большую историческую роль, дав толчок к зарождению теории решетчатого строения кристаллов.
Во всем мире вы не найдете ни одного атома или иона, ни одной молекулы, которые покоились бы: все они движутся, но движения эти различны.
«Кристаллы построены правильно, строго закономерно. И в них тоже атомы, ионы и молекулы не находятся в покое, но частицы не сталкиваются друг с другом, потому что все они расположены правильным строем и каждая может только колеблется около определенного положения. Ряды частиц в пространстве, подобны трехмерным решеткам из атомов, которые образуют кристаллическую структуру».
Структура всех кристаллических веществ периодична и закономерна. Во всех кристаллах частицы выстраиваются симметричными правильными рядами, плоскими сетками, трехмерными решетками. В твердом кристаллическом веществе каждая частица движется «вольно», колеблется, но только у своего места в строю. Строй частиц в кристаллическом веществе похож на пчелиные соты или на строительные леса: влево и вправо, вперед и назад, вверх и вниз тянутся ровные, правильные, бесконечные ряды частиц. Однако отделиться, выйти из такой решетки частицы твердого тела не могут, только если, например, нагреть кристалл так, чтобы он начал плавится.
Порядок, закономерность, периодичность, симметрия расположения атомов — вот что характерно для кристаллов. Во всех кристаллах, во все твердых веществах частицы расположены правильным, четким строем, выстроены симметричным, правильным повторяющимся узором. Пока есть этот порядок существует твердое тело, кристалл. Нарушен порядок, рассыпался строй частиц — это значит, что кристалл расплавился, превратился в жидкость или испарился, перейдя в пар.
Одинаков ли порядок, строй атомов, в различных кристаллах? Конечно, нет. Природа бесконечно разнообразна и не любит повторений: строй атомов железа совсем не похож на постройку атомов кристалла льда. В каждом веществе есть именно свой характерный узор и порядок расположения атомов, и от того, каков этот порядок, зависят свойства вещества. Одни и те же атомы, частицы одного сорта, располагаясь по-разному, образуют вещества с совсем разными свойствами. Посмотрим например на атомы углерода: сажа или копоть — мягкий черный порошок; уголь — более твердый камень; графит — мягкий стерженек, оставляющий след на бумаге; алмаз- кристалл, твердостью которого восхищаются люди, крохотный кристаллик алмаза, вставленный в металлическую оправу, легко режет стекло. Все эти вещи состоят из атомов углерода, а разнообразие их свойств зависит от разнообразия кристаллической структуры.
К началу ХХ века об атомах знали совсем мало, и не было известно, что же именно группируется или правильно повторяется в пространстве, создавая геометрические формы и неизменные углы между гранями кристаллов, симметрию и анизотропию их свойств. И уж совсем ничего не было известно об атомном строении поликристаллических тел, у которых нет правильной внешней формы, — о технических металлах и их сплавах, о горных породах, о порошках.
В 1912 г. Физику Максу Лауэ и его ученикам Фридриху и Книппингу удалось доказать, что рентгеновские лучи претерпевают дифракцию на атомных решетках кристаллов. С тех пор отпала необходимость определять структуру кристалла по методу Федорова, основываясь на внешней форме. Английский ученый Виллиам Лоренс Брегг, изучая рентгеновсое облучение кристаллов сделал 2 интересных вывода: 1) различные атомные плоскости в кристаллах действуют как зеркала, отражая рентгеновские лучи; 2) способность атом рассеивать рентгеновские лучи зависит от его атомного номера. Эти два заключения сделали анализ кристаллов по результатам рентгеновского облучения еще более детальным.
Лишь через пару месяцев после открытия Лауэ был найден способ определения расстояния между атомами (d) по рентгенограммам. Пучок рентгеновских лучей с длинной волны λ, отражающихся от серии параллельных атомных плоскостей, отстоящих друг от друга на одинаковые расстояния d, будет усиливаться, если выполняется простое геометрическое соотношение, которое теперь носить названия формулы Вульфа — Брегга:
nλ=2dsinθ
Здесь n — целое число, а λ — угол между лучом и отражающей атомной плоскостью. Если знать длину волны рентгеновских лучей, а величины n и θ измерить на опыте, то по рентгенограмме можно определить расстояние между атомными плоскостями в кристалле. Это и удалось сделать Бреггу и он получил значение d=2.8*10-8 сантиметра.
Так родилась структурная (рентгеновская) кристаллография — определение структур кристаллов с помощью рентгеновских лучей.
Симметрия структуры кристалла отражается в его внешней форме, но и в отсутствии внешней характерной формы кристалл остается кристаллом, потому что сохраняется симметрия его структуры и его физические свойства.
Кристаллическое состояние является нормальным состоянием твердого вещества, аморфное — нарушенным, временным состоянием. Поэтому в кристаллическом состоянии вещество обнаруживает свои физические свойства в самом чистом виде и в самых богатых сочетаниях, а в аморфном же веществе свойств как бы затуманены.
Структура кристалла определяет его свойства и форму. Однако, кристаллическая структура обнаружена не только в природных многогранниках камней, в кристаллических горных породах и металлах, но и в очень многих других телах, о которых никому и в голову не приходило подумать, что они состоят из кристаллов. Вот, например, глина, она не похожа на кристалл, но и она состоит из мельчайших кристаллических частичек. Даже в таких вещах, как сажа, человеческие кости, волосы, волокна шерсти, шелк, целлюлоза и т. п., обнаружено кристаллическое состояние.
5. Свойства кристаллов
Физические свойства кристаллов чаще всего зависят от их структуры и химического строения.
Сначала стоит упомянуть два основных свойства кристаллов. Одним из них является анизотропия, о которой уже упоминалась выше. Под этим термином подразумевается изменение свойств в зависимости от направления. Так, например, если вырезать из кристалла поваренной соли в различных направлениях стержни в поперечным сечением 1мм2 и испытать их на разрыв, то окажется, что они имеют различную прочность.
Вместе с тем кристаллы являются телами однородными. Однородность кристаллического вещества состоит в том, что два его участка одинаковой формы и одинаковой ориентировки одинаковы по свойствам.
Поговорим сначала об электрических свойствах. В принципе электрические свойства кристаллов можно рассматривать на примере металлов, так как металлы, в одном из состояний, могут представлять собой кристаллические агрегаты. Электроны, свободно передвигаясь в металле, не могут выйти наружу, для этого нужно затратить энергию. Если при этом затрачивается лучистая энергия, то эффект отрыва электрона вызывает так называемый фотоэлектрический эффект. Аналогичный эффект наблюдается и в монокристаллах. Вырванный из молекулярной орбиты электрон, оставаясь внутри кристалла, обуславливает у последнего металлическую проводимость (внутренний фотоэлектрический эффект). В нормальных же условиях (без облучения) такие соединения не являются проводниками электрического тока.
6. Как растут кристаллы
Еще Стенон писал, что на наружные плоскости ранее ограненного кристалла осаждается новое вещество. Частицы (атомы, ионы, молекулы) из раствора, пара или расплава оседают на гранях кристаллического зародыша, продолжая его рост слой за слоем. Теоретически кристаллизация должна начинаться при перенасыщенности раствора на 30-50%. Эти цифры были рассчитаны учеными в двадцатые – тридцатые годы нашего столетия. Однако на практике кристалл может расти и при малой пересыщенности раствора. Еще одна несостыковка имеет место быть при сравнении теории с практикой. Долгое время ученые считали, что кристалл растет подобно кирпичной кладке: пока недостроен предыдущий ряд, новый не строится. Естественно атому легче осесть на плоскость «зацепившись» за находящийся рядом атом, но, когда ряд достроен и плоскость не нуждается в новых частицах, куда деваться «вновь прибывшему» атому? Считалось, что он отскакивает обратно в среду, из которой выпал. Тогда рост кристалла прекратился бы уже после построения первой грани. Как же происходит на самом деле?
В 1948 году английский кристаллограф Франк выдвинул остроумную догадку: Кристалл растет не параллельными слоями, не как кирпичная кладка, а подобно винтовой лестнице или спирали. Кристалл при росте как бы накручивается сам на себя, все время продвигая вперед одну и ту же ступень. На выходе этой ступеньки на грани кристалла как бы заготовлена уютная «посадочная площадка» для каждой вновь присоединяющейся частицы. И хитрость здесь в том, что частицы, оседая, присоединяются к ступеньке, а ступенька не зарастает, только число оборотов в винтовой лестнице увеличивается, и грань, продвигаясь вперед, непрерывно растет. Именно так, по представлению Франка, в некоторых местах в кристалле нарушено правильное чередование атомных слоев: атомные слои не параллельны друг другу, а закручены в единую винтовую лестницу. Схема такой атомной винтовой лестницы называется винтовая дислокация.
Однако, когда Франк рассказал о своей гипотезе на конференции по росту кристаллов в 1948 г., слушатели с недоверием отнеслись к его теории, ведь в таком случае на грани кристалла должен быть незарастающий выступ, меж тем спокон веков известно, что грани у кристаллов гладкие. И тем не менее Франк оказался прав: на гранях кристаллов действительно имеются спиральные выступы. Оказалось, что тремя годами ранее в 1945 г. в Москве Г. Г. Леммлейн обнаружил, что на зеркально-гладкой, ровной, плоской грани кристалла имеются спиральные ступеньки. Он обнаружил это при помощи росы нанесенной на грань кристалла. Росинки оседают и выделяют каждую неровность на поверхности, тогда в микроскоп ученый и разглядел эти выступы. Найденный им метод был назван «методом росы».
Сегодня уже нет сомнений в том, что именно так растут кристаллы из паров, расплавов и из слабо пересыщенных растворов: рост облегчается тем, что в кристалле есть винтовые дислокации и кристалл растет вдоль дислокации, образуя единую винтовую лестницу из атомных плоскостей.
7. Прочность кристаллов
Кристалл заполнен дефектами. Как же влияют дефекты на прочность кристаллов? Конечно же дефекты понижают прочность, в сотни, тысячи раз. Если к кристаллу приложить внешнюю силу, то атомная постройка начнет разрушаться именно в месте слабины, там, где есть дефект. Дефект — дислокация — начинает двигаться по кристаллу.
Но не так все просто, по мере того, как растет деформация кристалла, растет и число дефектов в нем. А так как дефекты взаимодействуют друг с другом, то, чем их больше, тем труднее им двигаться в кристалле. Получается парадокс: если есть дефект кристалл — кристалл деформируется и разрушается легче, чем если дефекта нет. А если дефектов слишком много, то кристалл опять становится прочным, и чем больше дефектов, тем он более упорядочивается. Значит, если мы научимся управлять числом и расположением дефектов, мы сможем управлять прочностью материалов.
Еще сильнее удалось бы изменить свойства кристаллов, если бы удалось вырастить кристалл совсем без дефектов. Как в стальном каркасе здания, если бы не было ни одной дефектной балки, прочность здания была бы расчетной. Без дефектов кристалл “не хочет” расти. И все же ученым удалось перехитрить природу. Научились выращивать кристаллы, в которых нет, совсем нет, дефектов, или есть один единственный дефект, очень удачно расположенный.
Такие идеальные кристаллы удивительно прочны. «Обычное техническое железо выдерживает, не разрушаясь, усилие в 20-30 кг/мм2, самая лучшая конструкционная сталь — 200-300 кг/мм2, а бездефектный кристаллик железа — 1400 кг/мм2. Иначе говоря, бездефектные кристаллы железа прочнее обычного в 40-50 раз».
Такие кристаллы научились растить, измерять их свойства и прочность, но эти кристаллы очень и очень малы. Это “нитевидные кристаллы”, или “усы” — волоски диаметром не более 1-2 микрон. Растить такой кристалл очень сложно, а вырастет он чуть потолще — в нем обязательно проявляются дефекты и прочность сразу снижается.
Такой усик выдерживает нагрузку значительно большую, чем обычная проволока. Он деформируется упруго, восстанавливает свою форму после деформации, не меняется при высоких температурах. Уже широко применяются нитевидные кристаллы для создания высокопрочных композитных материалов. Композит, или композитный материал — это сплошная основа, металл или полимер пронизанный нитевидными кристаллами.
Созданы кристаллизационные установки в которых вытягивают монокристаллические нити сапфира длинной до 30 метров. Кристалл получается такой упругий и гибкий, что его наматывают как нить на катушку. А затем этими гибкими нитями упрочняют основу. Из композитных материалов делают листы для обшивки самолетов и ракет. Человек научился получать материалы, гораздо прочнее природных.
Кристаллы из-за их прочности используют и в различных режущих аппаратах, так как кристалл один из самых прочных материалов на Земле.
Человек применяет кристаллы почти во всех областях материальной сферы их цена и значение чрезвычайно велики.
Заключение
Кристаллы неординарны и загадочны по своей сущности. В облаках, в глубинах Земли, на вершинах гор, в песчаных пустынях, в морях и океанах, в научных лабораториях, в клеточках растений, в живых и мертвых организмах – везде встретим мы кристаллы. Но может кристаллизация вещества совершается только на нашей планете? Нет, мы знаем теперь, что и на других планетах и далеких звездах все время непрерывно возникают, растут и разрушаются кристаллы. Метеориты, космические посланцы, тоже состоят из кристаллов, причем иногда в их состав входят кристаллические вещества, на Земле не встречающиеся. Кристаллы везде.
Люди привыкли использовать кристаллы, делать из них украшения, любоваться ими. Теперь, когда изучены методы искусственного выращивания кристаллов, область их применение расширилась, и, возможно, будущее новейших технологий принадлежит кристаллам и кристаллическим агрегатам.
Библиография
referati-besplatno.ru
Введение
Кристаллы — одно из самых красивых и загадочных творений природы. В настоящее время изучением многообразия кристаллов занимается наука кристаллография. Она выявляет признаки единства в этом многообразии, исследует свойства и строение как одиночных кристаллов, так и кристаллических агрегатов. Кристаллография является наукой, всесторонне изучающей кристаллическое вещество. Данная работа также посвящена кристаллам и их свойствам.
В давние времена считалось, что кристаллы представляют собой редкость. Действительно, нахождение в природе крупных однородных кристаллов — явление нечастое. Однако мелкокристаллические вещества встречаются весьма часто. Так, например, почти все горные породы: гранит, песчаники известняк — кристалличны. По мере совершенствования методов исследования кристалличными оказались вещества, до этого считавшиеся аморфными. Сейчас мы знаем, что даже некоторые части организма кристалличны, например, роговица глаза.
В настоящее время кристаллы имеют большое распространение в науке и технике, так как обладают особыми свойствами. Такие области использования кристаллов, как полупроводники, сверхпроводники, пьезо- и сегнетоэлектрики, квантовая электроника и многие другие, требуют глубокого понимания зависимости физических свойств кристаллов от их химического состава и строения.
В настоящее время известны способы искусственного выращивания кристаллов. Кристалл можно вырастить в обыкновенном стакане, для этого требуется лишь определенный раствор и аккуратность, с которой необходимо ухаживать за растущим кристаллом.
^ Что такое кристалл
В школьных учебниках кристаллами обычно называют твердые тела, образующихся в природных или лабораторных условиях и имеющие вид многогранников, которые напоминают самые непогрешимо строгие геометрические построения. Поверхность таких фигур ограничена более или менее совершенными плоскостями-гранями, пересекающимися по прямым линиям — ребрам. Точки пересечения ребер образуют вершины. Сразу же следует оговориться, что приведенное выше определение требует существенных поправок. Вспомним, например, всем известную горную породу границ, состоящую из зерен полевого шпата, слюды и кварца. Все эти зерна являются кристаллами, однако их извилистые зерна не сохранили прежней прямолинейности и плоскогранности, а, следовательно, не подходят к вышеуказанному описанию. Одновременный рост всех составляющих гранит кристаллов, мешавших друг другу развиваться, и привел к тому, что отдельные кристаллы не смогли получить свойственную им правильную многогранную форму. Итак, для образования правильно ограненных кристаллов необходимо, чтобы ничто не мешало им свободно развиваться, не теснило бы их и не препятствовало их росту.
Кристаллов в природе существует великое множество, и так же много существует различных форм кристаллов. В реальности практически невозможно привести определение, которое подходило бы ко всем кристаллам. Здесь на помощь можно привлечь результаты рентгеновского анализа кристаллов. Рентгеновские лучи дают возможность как бы нащупать атомы внутри кристаллического тела и определить их пространственное расположение. В результате было установлено, что решительно все кристаллы построены из элементарных частиц, расположенных в строгом порядке внутри кристаллического тела. Упорядоченность расположения таких частиц и отличает кристаллическое состояние от некристаллического, где степень упорядоченности частиц ничтожна.
Во всех без исключения кристаллических постройках из атомов можно выделить множество одинаковых атомов, расположенных наподобие узлов пространственной решетки. Чтобы представить такую решетку, мысленно заполним пространство множеством равных параллелепипедов, параллельно ориентированных и соприкасающихся по целым граням. Простейший пример такой постройки представляет собой кладка из одинаковых кирпичиков. Если внутри кирпичиков выделить соответственные точки, например, их центры или вершины, то мы и получим модель пространственной решетки. Для всех без исключения кристаллических тел характерно решетчатое строение.
Вот теперь мы подошли к возможности дать общее определение для кристаллов. Итак, кристаллами называются «все твердые тела, в которых слагающие их частицы (атомы, ионы, молекулы) расположены строго закономерно, наподобие узлов пространственных решеток» [4]. Это определения является максимально приближенным к истине, оно подходит к любым однородным кристаллическим телам: и булям (форма кристалла, у которого нет ни граней, ни ребер, ни выступающих вершин), и зернам, и плоскогранным фигурам).
^ Монокристаллы и кристаллические агрегаты
В отличие от других агрегатных состояний, кристаллическое состояние многообразно. Одни и те же по составу молекулы могут быть упакованы в кристаллах разными способами. От способа же упаковки зависят физические и химические свойства вещества. Таким образом, одни и те же по химическому составу вещества на самом деле часто обладают различными физическим свойствами. Для жидкого состояния такое многообразие не характерно, а для газообразного — невозможно.
Если взять, например, обычную поваренную соль, то легко увидеть даже без микроскопа отдельные кристаллики. Каждый кристаллик есть вещество NaCl, но одновременно он имеет черты индивидуума. Он может быть большим или малым, кубическим или прямоугольно-параллелепипедальным, по-разному ограненным и т. д.
В жидкости нельзя увидеть отдельные индивидуумы-капельки, в кристаллическом же веществе они видимы.
Если мы хотим подчеркнуть, что имеем дело с одиночным, отдельным кристаллом, то называем его монокристаллом, чтобы подчеркнуть, что речь идет о скоплении многих кристаллов, используется термин кристаллический агрегат. Если в кристаллическом агрегате отдельные кристаллы почти не огранены, это может объяснятся тем, что кристаллизация началась одновременно во многих точках вещества и скорость ее была достаточно высока. Растущие кристаллы являются препятствием друг другу и мешают правильному огранению каждого из них.
В данной работе речь пойдет, в основном, о монокристаллах, а так как они являются составными частями кристаллических агрегатов, то их свойства будут схожи со свойствами агрегатов.
^ Симметрия в кристаллах
Рассматривая различные кристаллы, мы видим ,что все они разные по форме, но любой из них представляет симметричное тело. И действительно, симметричность — это одно из основных свойств кристаллов. К понятию о симметрии мы привыкли с детства. Симметричными мы называем тела, которые состоят из равных одинаковых частей. Наиболее известными элементами симметрии для нас являются плоскость симметрии (зеркальное отображение), ось симметрии (поворот вокруг оси, перпендикулярной к плоскости). По углу поворота различают порядок оси симметрии, поворот на 180о — ось симметрии 2-ого порядка, 120о— 3-его порядка и так далее. Есть и еще один элемент симметрии — центр симметрии. Представьте себе зеркало, но не большое, а точечное: точку, в которой все отображается, как в зеркале. Вот эта точка и есть центр симметрии. При таком отображении отражение поворачивается не только справа налево, но и с лица наизнанку.
Все кристаллы симметричны. Это значит, что в каждом кристаллическом многограннике можно найти плоскости симметрии, оси симметрии, центры симметрии и другие элементы симметрии так, чтобы совместились друг с другом одинаковые части многогранника. Введем еще одно понятие, относящееся к симметрии, — полярность. Представим конус и цилиндр, у обоих объектов есть по одной оси симметрии бесконечного порядка, но они различаются полярностью, у конуса ось полярна (представим центральную ось в виде стрелочки, указывающей к вершине), а у цилиндра ось неполярна.
Поговорим о видах симметрии в кристалле. Прежде всего, в кристаллах могут быть оси симметрии только 1, 2, 3, 4 и 6 порядков. Представим плоскость, которую надо полностью покрыть семи-, восьсми-, девятиугольниками и т. д., так чтобы между фигурами не оставалось пространства, это не получится, пятиугольниками покрыть плоскость также нельзя. Очевидно, оси симметрии 5, 7-го и выше порядков невозможны, потому что при такой структуре атомные ряды и сетки не заполнят пространство непрерывно, возникнут пустоты, промежутки между положениями равновесия атомов. Атомы окажутся не в самых устойчивых положениях, и кристаллическая структура разрушится.
В кристаллическом многограннике можно найти разные сочетания элементов симметрии: у одних — мало, у других — много. По симметрии, прежде всего, по осям симметрии, кристаллы делятся на три категории.
К высшей категории относятся самые симметричные кристаллы, у них может быть несколько осей симметрии порядков 2,3 и 4, нет осей 6-го порядка, могут быть плоскости и центры симметрии. К таким формам относятся куб, октаэдр, тетраэдр и др. Им всем присуща общая черта: они примерно одинаковы во все стороны.
У кристаллов средней категории могут быть оси 3, 4 и 6 порядков, но только по одной. Осей 2 порядка может быть несколько, возможны плоскости симметрии и центры симметрии. Формы этих кристаллов — призмы, пирамиды и др. Общая черта: резкое различие вдоль и поперек главной оси симметрии.
У кристаллов низшей категории не может быть ни одной оси симметрии 3 4 и 6 порядков, могут быть только оси 2 порядка, плоскости или центр симметрии. Структура данных кристаллов самая сложная.
Из кристаллов к высшей категории относятся: алмаз, квасцы, гранаты, германий, кремний, медь, алюминий, золото, серебро, серое олово, вольфрам, железо; к средней категории: графит, рубин, кварц, цинк, магний, белое олово, турмалин, берилл; к низшей: гипс, слюда, медный купорос, сегнетовая соль и др. Конечно, в этом списке не были перечислены все существующие кристаллы, а только наиболее известные из них. Категория, к которой принадлежит кристалл характеризует его физический свойства.
Категории, в свою очередь, разделяются на семь сингоний. В переводе с греческого «сингония» означает «сходноугольство». В сингонию объединяются кристаллы с одинаковыми осями симметрии, а значит, со сходными углами поворотов в структуре. Классификация кристаллов по категориям и сингониям приведена в таблице 1.
Плоскости и центр симметрии могут быть в любой сингонии. Всего сингоний семь.
Каждый кристаллический многогранник обладает определенным набором элементов симметрии. Полный набор всех элементов симметрии, присущих данному кристаллу, называется классом симметрии. Сколько же всего таких наборов? Их количество ограничено. Математическим путем было доказано, что в кристаллах существует 32 вида симметрии.
Таб. 1
Категория
Сингония
Характерная симметрия кристаллов
Высшая
Кубическая
Несколько осей симметрии порядка выше, чем 2; обязательно четыре оси симметрии 3-ого порядка
Средняя
Тригональная
Тетрагональная
Гексагональная
Одна ось симметрии порядка выше, чем 2, а именно:
Одна ось 3-ого порядка
Одна ось 4-ого порядка
Одна ось 6-ого порядка
Низшая
Ромбическая
Моноклинная
Триклинная
Нет осей симметрии порядка выше, чем 2. (Эти сингонии различаются по углам между кристаллографическими осями координат)
^ Форма кристаллов
Изучение внешней формы кристаллов началось прежде изучения симметрии, однако только после вывода 32 видов симметрии появилась надежная основа для создания геометрического учения о внешней форме кристаллов. Основным его понятием является понятие простой формы.
«Простой формой называется многогранник, который может быть получен из одной грани с помощью элементов симметрии (оси, плоскости и центра симметрии)» [4].
Простые формы могут быть общими и частными в зависимости от того, как расположена исходная грань по отношению к элементам симметрии. Если она расположена косо, то простая форма, полученная из нее, будет общей. Если же исходная форма расположена параллельно или перпендикулярно к элементам симметрии, то получается частная простая форма. Простые формы также могут быть закрытыми и открытыми. Закрытая форма может одна образовать кристаллический многогранник, в то время как одна открытая простая форма замкнутого многогранника образовать не может.
Каждая грань кристалла представляет собой плоскость, на которой располагаются атомы. Когда кристалл растет, все грани передвигаются параллельно сами себе, так как на них откладываются все новые и новые слои атомов. По этой причине параллельно каждой грани в структуре кристалла располагается огромное количество атомных плоскостей, которые когда-то в начальных стадиях роста тоже располагались на гранях кристалла, но в процессе роста оказались внутри него.
Ребра кристалла представляют собой прямые, на которых атомы располагаются в ряд. Таких рядов в кристалле тоже огромное количество, и они располагаются параллельно действительным ребрам кристалла.
Кристаллический многогранник обычно представляет собой комбинацию нескольких простых форм, грани (или ребра) которых являются действительными гранями (ребрами). Грань, которой на данном кристалле нет но которая может оказаться на других кристаллах того же вещества, называется возможной гранью. Возможной гранью может быть плоскость, проходящая через два действительных или возможных ребра кристалла. Точно так же, если возьмем две реальные грани, которые на данном кристаллическом многограннике не пересекаются, то линия, параллельная линии их пересечения, будет возможным ребром кристалла.
Совокупность граней, пересекающихся в параллельных ребрах, называется поясом или зоной. А параллельная этим ребрам линия называется осью зоны.
Необходимо упомянуть, что кристаллографами был создан строго математический вывод всех возможных на свете кристаллических форм, и теперь можно не только предположить, какова будет форма кристалла, а с большой уверенностью рассчитать будущую форму.
В течение долгих лет геометрия кристаллов казалась таинственной и неразрешимой загадкой. В 1619 великий немецкий математик и астроном Йоган Кеплер обратил внимание на шестерную симметрию снежинок. Он попытался объяснить ее тем, что кристаллы построены из мельчайших одинаковых шариков, теснейшим образом присоединенных друг к другу (вокруг центрального шарика можно вплотную разложить только шесть таких же шариков). По пути, намеченному Кеплером, пошли впоследствии Роберт Гук и М. В. Ломоносов. Они также считали, что элементарные частицы кристаллов можно уподобить плотно упакованным шарикам. В наше время принцип плотнейших шаровых упаковок лежит в основе структурной кристаллографии, только сплошные шаровые частицы старинных авторов заменены сейчас атомами и ионами.
Через 50 лет после Кеплера датский геолог, кристаллограф и анатом Николас Стенон впервые сформулировал основные понятия о формировании кристаллов: «Рост кристалла происходит не изнутри, как у растений, но путем наложения на внешние плоскости кристалла мельчайших частиц, приносящихся извне некоторой жидкостью». Эта идея о росте кристаллов в результате отложения на гранях все новых и новых слоев вещества сохранила свое значение и до сих пор.
Очень часто кристаллы одного и того же вещества срастаются друг с другом закономерным образом, образуя так называемый двойник. При этом обычно возникают дополнительные элементы симметрии, называющиеся в данном случае двойниковыми элементами симметрии. Если сросток состоит из многих кристаллов, закономерно чередующихся друг с другом, то он называется полисинтетическим двойником. Двойниковые кристаллы являются очень распространенным явлением в природе. Многие вещества, получаемые в лаборатории, также часто имеют двойники как простые, так и полисинтетические.
^ Закон постоянства двухгранных углов. Отклонения от закона
Симметричность кристаллов всегда привлекала внимание ученых. Уже в 79 г. нашего летоисчисления Плиний Старший упоминает о плоскогранности и прямобедренности кристаллов. Этот вывод, может, и считается первым обобщением геометрической кристаллографии. С тех пор на протяжении многих столетий весьма медленно и постепенно накапливался материал, позволивший в конце XVIII в. открыть важнейший закон геометрической кристаллографии — закон постоянства двугранных углов. Этот закон связывается обычно с именем французского ученого Роме де Лиля, который в 1783г. опубликовал монографию, содержащую обильный материал по измерению углов природных кристаллов. Для каждого вещества (минерала), изученного им, оказалось справедливым положение, что углы между соответственными гранями во всех кристаллах одного и того же вещества являются постоянными.
Не следует думать, что до Роме де Лиля никто из ученых не занимался данной проблемой. История открытия закона постоянства углов прошла огромный, почти двухвековой путь, прежде чем этот закон был отчетливо сформулирован и обобщен для всех кристаллических веществ. Так, например, И. Кеплер уже в 1615г. указывал на сохранение углов в 60 омежду отдельными лучиками у снежинок. В 1669 г. Н. Стенон открыл закон постоянства углов в кристаллах кварца и гематита. Внимательно разглядывая реальные кристаллы кварца, Стенон также обратил внимание на их отклонение от идеальных геометрических многогранников с плоскими гранями и прямыми ребрами. В своем трактате он впервые ввел в науку реальный кристалл с его несовершенствами и отклонениями от идеализированных схем. Однако все эти отклонения не помешали ученому открыть на тех же кристаллах кварца основной закон геометрической кристаллографии. Однако написал он об этом очень кратко в пояснениях к рисункам, приложенным к его сочинению, поэтому честь называться автором закона досталась Лилю. Годом позже Стенона Э. Бартолин сделал тот же вывод применительно к кристаллам кальцита, а в 1695 г. Левенгук — к кристаллам гипса. Он показал, что и у микроскопически малых и у больших кристаллов гипса углы между соответственными гранями одинаковы. В России закон постоянства углов был отрыт М. В. Ломоносовым для кристаллов селитры (1749г.), пирита, алмаза и некоторых других минералов. Однако вернемся к определению, данному Лилем. В его версии закон постоянства углов звучит следующим образом: «Грани кристалла могут изменяться по своей форме и относительным размерам, но их взаимные наклоны постоянны и неизменны для каждого рода кристаллов».
Итак, все кристаллы обладают тем свойством, что углы между соответственными гранями постоянны. Грани у отдельных кристаллов могут быть развиты по-разному: грани, наблюдающиеся на одних экземплярах, могут отсутствовать на других, но если мы будем измерять углы между соответственными гранями, то значения этих углов будут оставаться постоянными независимо от формы кристалла.
Однако по мере совершенствования методики и повышения точности измерения кристаллов выяснилось, что закон постоянства углов оправдывается лишь приблизительно. В одном и том же кристалле углы между одинаковыми по типу гранями слегка отличаются друг от друга. У многих веществ отклонения двухгранных углов между соответственными гранями достигает 10 - 20', а в некоторых случаях и градуса.
Грани реального кристалла никогда не представляют собой идеальных плоских поверхностей. Нередко они бывают покрыты ямками или бугорками роста, в некоторых случаях грани представляют собой кривые поверхности, например, у кристаллов алмаза. Иногда замечаются на гранях плоские участки, положение которых слегка отклонено от плоскости самой грани, на которой они развиваются. Эти участки называются в кристаллографии вицинальными гранями, или просто вициналями. Вицинали могут занимать большую часть плоскости нормальной грани, а иногда даже полностью заменить последнюю. Иногда на гранях наблюдаются ступеньки, имеющие форму пандуса. Следовательно, можно говорить о скульптуре граней, являющейся причиной отклонения от равенства двугранных углов. Изучением различных наростов занимается раздел кристаллографии — морфология внешней формы кристаллов.
Наблюдаются, конечно, и более закономерные изменения двугранных углов, например, зависимость от температуры. В таблице 2 приведены значения углов между гранями кварца при разной температуре.
Таб. 2
T, oC
Угол
T, oC
Угол
-166
0
21
100
200
128 o 11’54’’
128 o 12’51”
128 o 13’12”
128 o 13’36”
128 o 14’54”
300
400
500
550
575
128 o 16’12”
128 o 17’54”
128 o 20’12”
128 o 22’00”
128 o 23’18”
В заключение раздела о главном геометрическом законе кристаллографии необходимо сказать и о случаях резкого изменения углов кристаллов, которое возникает при полиморфном превращении вещества (образование данным веществом разные по симметрии и форме кристаллы), явлении, открытом позже формулировки закона постоянства углов. Одно и то же вещество при полиморфном превращении скачком меняет свои свойства. Например, переход ромбической серы в моноклинную сопровождается увеличением удельного объема на 0.014 сантиметра на грамм и термическим эффектом в 3.12 калорий на грамм. Еще резче меняет свои свойства кристаллический углерод при переходе алмаза в графит. Плотность алмаза — 3.5, графита — 2.2; твердость алмаза — 10, графита — 1 и т.д.
При полиморфном превращении наряду со скачкообразным изменением физических свойств, скачком меняется и внешняя форма кристаллов, при этом совокупность двугранных углов одной модификации может совсем не соответствовать совокупность двугранных углов другой.
Учитывая все вышесказанное, можно так сформулировать закон постоянства углов: «Во всех кристаллах, принадлежащих к одной полиморфной модификации данного вещества, при одинаковых условиях углы между соответствующими гранями (и ребрами) постоянны».
Как определить вещество по форме его кристалла
К концу XIX – XX века в науке накопилось множество данных о внешней форме и углах кристаллов. Е. С. Федоров критически пересмотрел и суммировал весь фактический материал по измерениям кристаллов, накопленный к тому времени; произвел сам множество кристаллографических измерений; обработал эти измерения новым, созданным им оригинальным методом; сопоставил эти измерения с развитой им теорией строения кристаллов и, соединив воедино опыт и теорию, создал кристаллохимический анализ.
На основе кристаллохимического анализа можно было определять состав вещества, исходя из внешней формы его кристаллов. По внешней форме кристалла этот анализ позволял получить первые схематические представления о внутреннем строении кристалла.
Кроме углов между гранями, Федоров принял во внимание еще и то, как развиваются грани природных кристаллов. Формы одного и того же вещества могут быть весьма разнообразными. При идеальных условиях роста все грани кристалла развиваются свободно, но в реальных условиях они чаще всего развиваются неодинаково. Природные кристаллы одного и того же минерала из разных месторождений могут оказаться совсем различными, вовсе не похожими друг на друга. Тем не менее, как указал ученый, некоторые грани кристалла все же наиболее характерны для данного вещества, они встречаются на разных кристаллах чаще всего — почти всегда.
В кристаллохимическом анализе соединены представления о внешней форме и о внутреннем строении кристаллов. Гениально вычислив все законы симметрии структуры кристаллов задолго до того, как существование атомных решеток в кристаллах было доказано на опыте, Федоров считал несомненным, что внешние грани кристалла соответствуют его плоским сеткам, т. е. тем плоскостям кристаллических решеток, вдоль которых расположены частицы (атомы, ионы, молекулы), а наиболее развитые, чаще всего встречающиеся грани кристалла совпадают с теми плоскими сетками, на которых частицы расположены гуще всего.
Таким образом, по внешней форме кристалла можно судить о расположении частиц в его решетке. Расчетные методы Федорова и таблицы, составленные им и его учениками, позволяли по углам кристалла определить тип структуры вещества и его химический состав.
Кристаллохимический анализ Е.С. Федорова был значительно развит и предельно упрощен впоследствии его учеником, профессором А. К. Болдыревом. Было выпущено два тома таблиц, под названием «Определитель кристаллов», позволяющих определить химический состав вещества по углам между гранями кристаллов.
«В наши дни, однако, анализ кристаллов по их внешней форме в значительной мере вытеснен достижением ХХ века — рентгеноструктурным анализом. Этот метод, основывающийся на симметрии структуры кристаллов и на дифракции рентгеновских лучей в кристаллах, дает возможность определять кристаллическую структуру вещества независимо от того, какова его внешняя форма. Не нужно иметь многогранный кристалл, хватит и малой крупинки кристаллического вещества, чтобы с помощью рентгеноструктурного анализа полностью определить симметрию его структуры» [2].
^ Атомная структура кристаллов
Теперь пришло время углубится в рассмотрение атомной структуры кристаллов, о которой так часто упоминалось выше.
«Все найдено!» — воскликнул Рене Жюст Гаюи (1743 – 1822), заметив, что случайно выпавший из его рук большой кристалл кальцита раскололся на множество маленьких параллелепипедальных (ромбоэдрических) осколков (кальцит обладает хорошей спайностью — способностью раскалываться — по ромбаэдру). В этот именно момент в его уме зародилась новая теория строения кристаллов. В отличие от Кеплера, Гука и Ломоносовы, Гаюи предположил, что кристаллы построены не из мельчайших шариков, а из молекул параллелепипедальной формы, и что предельно малые спайные осколки и являются этими самими молекулами. Иными словами, кристаллы представляют собой своеобразные кладки из молекулярных «кирпичиков» Несмотря на всю свою наивность, с современной точки зрения, эта теория сыграла в свое время большую историческую роль, дав толчок к зарождению теории решетчатого строения кристаллов.
Во всем мире вы не найдете ни одного атома или иона, ни одной молекулы, которые покоились бы: все они движутся, но движения эти различны.
«Кристаллы построены правильно, строго закономерно. И в них тоже атомы, ионы и молекулы не находятся в покое, но частицы не сталкиваются друг с другом, потому что все они расположены правильным строем и каждая, может, только колеблется около определенного положения. Ряды частиц в пространстве подобны трехмерным решеткам из атомов, которые образуют кристаллическую структуру » [5].
Структура всех кристаллических веществ периодична и закономерна. Во всех кристаллах частицы выстраиваются симметричными правильными рядами, плоскими сетками, трехмерными решетками. В твердом кристаллическом веществе каждая частица движется «вольно», колеблется, но только у своего места в строю. Строй частиц в кристаллическом веществе похож на пчелиные соты или на строительные леса: влево и вправо, вперед и назад, вверх и вниз тянутся ровные, правильные, бесконечные ряды частиц. Однако отделиться, выйти из такой решетки частицы твердого тела не могут, только если, например, нагреть кристалл так, чтобы он начал плавиться.
Порядок, закономерность, периодичность, симметрия расположения атомов — вот что характерно для кристаллов. Во всех кристаллах, во все твердых веществах частицы расположены правильным, четким строем, выстроены симметричным, правильным повторяющимся узором. Пока есть этот порядок, существует твердое тело, кристалл. Нарушен порядок, рассыпался строй частиц, значит, кристалл расплавился, превратился в жидкость или испарился, перейдя в пар.
Одинаков ли порядок, строй атомов, в различных кристаллах? Конечно, нет. Природа бесконечно разнообразна и не любит повторений: строй атомов железа совсем не похож на постройку атомов кристалла льда. В каждом веществе есть именно свой характерный узор и порядок расположения атомов, и от того, каков этот порядок, зависят свойства вещества. Одни и те же атомы, частицы одного сорта, располагаясь по-разному, образуют вещества с совсем разными свойствами. Посмотрим, например, на атомы углерода: сажа или копоть — мягкий черный порошок; уголь — более твердый камень; графит — мягкий стерженек, оставляющий след на бумаге; алмаз — кристалл, твердостью которого восхищаются люди. Крохотный кристаллик алмаза, вставленный в металлическую оправу, легко режет стекло. Все эти вещи состоят из атомов углерода, а разнообразие их свойств зависит от разнообразия кристаллической структуры.
К началу ХХ века об атомах знали совсем мало, и не было известно, что же именно группируется или правильно повторяется в пространстве, создавая геометрические формы и неизменные углы между гранями кристаллов, симметрию и анизотропию их свойств. И уж совсем ничего не было известно об атомном строении поликристаллических тел, у которых нет правильной внешней формы: о технических металлах и их сплавах, о горных породах, о порошках.
В 1912 г. физику Максу Лауэ и его ученикам Фридриху и Книппингу удалось доказать, что рентгеновские лучи претерпевают дифракцию на атомных решетках кристаллов. С тех пор отпала необходимость определять структуру кристалла по методу Федорова, основываясь на внешней форме. Английский ученый Виллиам Лоренс Брегг, изучая рентгеновское облучение кристаллов, сделал 2 интересных вывода: 1)различные атомные плоскости в кристаллах действуют как зеркала, отражая рентгеновские лучи; 2) способность атома рассеивать рентгеновские лечи зависит от его атомного номера . Эти два заключения сделали анализ кристаллов по результатам рентгеновского облучения еще более детальным.
Лишь через пару месяцев после открытия Лауэ был найден способ определения расстояния между атомами (d) по рентгенограммам. Пучок рентгеновских лучей с длинной волны l, отражающихся от серии параллельных атомных плоскостей, отстоящих друг от друга на одинаковые расстояния d, будет усиливаться, если выполняется простое геометрическое соотношение, которое теперь носит названия формулы Вульфа - Брегга:
n l =2dsin q
Здесь n — целое число, а q — угол между лучом и отражающей атомной плоскостью. Если знать длину волны рентгеновских лучей, а величины n и q измерить на опыте, то по рентгенограмме можно определить расстояние между атомными плоскостями в кристалле. Это и удалось сделать Бреггу, и он получил значение d = 2.8*10 -8сантиметра.
Так родилась структурная (рентгеновская) кристаллография — определение структур кристаллов с помощью рентгеновских лучей.
Симметрия структуры кристалла отражается в его внешней форме. Но и в отсутствии внешней характерной формы кристалл остается кристаллом, потому что сохраняется симметрия его структуры и его физические свойства.
Кристаллическое состояние является нормальным состоянием твердого вещества, аморфное — нарушенным, временным состоянием. Поэтому в кристаллическом состоянии вещество обнаруживает свои физические свойства в самом чистом виде и в самых богатых сочетаниях, а в аморфном же веществе свойства как бы затуманены.
Структура кристалла определяет его свойства и форму. Однако кристаллическая структура обнаружена не только в природных многогранниках камней, в кристаллических горных породах и металлах, но и в очень многих других телах, о которых никому и в голову не приходило подумать, что они состоят из кристаллов. Вот, например, глина, не похожа на кристалл, но и она состоит из мельчайших кристаллических частичек. Даже в таких вещах, как сажа, человеческие кости, волосы, волокна шерсти, шелк, целлюлоза и т. п., обнаружено кристаллическое состояние.
^ Теория плотнейших шаровых упаковок
Рентгенограммы кристаллических веществ и их расшифровка на основе федоровских законов построения пространственной решетки позволяют судить о симметрии кристаллических структур. Но это только остов, скелет структуры кристалла. Каковы же свойства частиц, из которых сложены кристаллические решетки? Чем обусловлены геометрические структуры строения кристаллов? Какова природа сил, связывающих эти частица? На эти и многие другие вопросы отвечает кристаллохимия.
Неоценимым вкладом в развитие кристаллохимии являются работы академика Николая Васильевича Белова по обоснованию и углублению теории плотной упаковки частиц в кристаллах. Геометрическая задача о максимальном заполнении пространства шарами имеет множество решений, но только два из них имеют для кристаллографии наибольшее значение.
Хорошо известно, что плотность газов меняется очень сильно, в тысячи и более раз. Уплотнить жидкость уже значительно труднее: частицы расположены здесь гораздо плотнее, чем в газе. В твердых же телах частицы расположены наиболее плотно, максимально близко друг к другу.
Атомы и ионы каждого элемента характеризуются определенным размером — сферой действия, внутрь пределов которой не могут проникать другие частицы. Известно также, что размеры анионов (отрицательно заряженных ионов) значительно превышают размеры катионов (положительных ионов). Представим себе катионы и анионы в виде шаров соответствующих радиусов. Как можно уложить такие шары наиболее плотно?
Начнем с шаров одинакового радиуса. Ясно, что в одном слое можно наиболее плотно уложить равновеликие шары лишь одним способом: каждый шар окружен в слое шестью ближайшими соседями, между ним и его соседями имеются треугольные промежутки. Попробуем теперь закрыть этот плотно упакованный слой вторым слоем, тоже наиболее плотно упакованным. Очевидно, шары второго слоя должны попасть в углубления между шарами первого слоя. Это можно также сделать лишь одним способом: взять аналогичный первому слой и сдвинуть его так, чтобы «верхушки» шаров второго слоя попадали как раз в углубления между шарами первого слоя. У каждого верхнего шара будут три одинаковых соседа в нижнем слое, и наоборот, каждый нижний шар будет соприкасаться с тремя верхними. Третий, плотно упакованный слой можно уложить уже двумя способами: в варианте а каждый шар третьего слоя лежит на трех шарах второго слоя таким образом, что под шаром третьего слоя нет шара в первом слое. В варианте б каждый шар третьего слоя также лежит на трех шарах второго слоя, однако под каждым шаром третьего слоя оказывается шар в первом слое. Первый вариант называется кубической упаковкой, второй — гексагональной.
Между ними существует и еще одно различие, кроме метода упаковки. В гексагональной структуре имеется лишь одно направление, нормально (перпендикулярно) к которому расположены плотнейшие плоские слои, тогда как в кубической таких направлений 4, соответственно четырем объемным диагоналям куба. Это обстоятельство приводит к существенным физическим различиям. Плотность заполнения пространства шарами в обоих вариантах, конечно, одинакова, и соответственно число шаров одинаково на единицу пространства. Это обстоятельство приводит к существенным физическим различиям. Зная строение двух простейших упаковок шаров, легко понять, что число слоев в кристалле очень велико. На самом деле, в гексагональной упаковке третий слой повторяет первый, поэтому упаковка двухслойная. В кубической упаковке четвертый слой повторяет первый: упаковка трехслойная.
Представим теперь, что в плотной упаковке одинаковых шаров должны разместится шары меньшего размера. В металлах так размещаются кремний, углерод, кислород, водород, азот, образуя силициды, карбиды, оксиды, гидриды и нитриды.
В плотной упаковке равновекликих шаров-анионов меньшие шары-катионы размещаются в пустотах между анионами. В зависимости от разных типов пустот возникают различные типы взаимного расположения катионов и анионов, а значит, и раз
www.ronl.ru
Реферат
По курсу «Кристаллография и кристаллохимия»
«Кристаллогенезис – возникновение, рост и разрушение кристаллов»
Содержание
Введение
Образование кристаллов в природе
Причины и условия образования кристаллов
Механизмы роста кристаллов
Формы роста кристаллов
Дефекты кристаллов
История получения искусственных кристаллов
Список используемой литературы
Кристаллогенезис – возникновение, рост и разрушение кристаллов
Для понимания процессов, приводящих к зарождению и росту кристаллов, необходимы знания из области физики, химии, кристаллографии и других ветвей науки.
Однако подход к изучению кристаллов у разных специалистов разный: физиков кристаллы интересуют как материал, используемый в технике и обладающий интересными физическими свойствами; минерологи же на основе изучения тех или иных особенностей кристаллов пытаются выяснить историю их зарождения, роста и последующих превращений – определить температуру, давление и состав среды, в которой кристаллы зарождались и росли, т.е. определить последовательность тех физико-химических процессов, которые привели к образованию кристалла.
В природе кристаллы образуются при различных геологических процессах из растворов, расплавов, газовой или твердой фазы.
Значительная часть минеральных видов произошла путем кристаллизации из водных растворов. Примеры выпадения кристаллов из раствора – выпадение кристаллов солей в замкнутых водоемах; рост кристаллов на стенках трещин и полостей при гидротермальных процессах, на больших глубинах в условиях высоких давлений и температур; образование отдельных кристаллов вторичных минералов в зонах окисления рудных месторождений.
Образование кристаллов из расплавов. Если магматический очаг располагается на большой глубине и его остывание идет медленно, то магма успевает хорошо раскристаллизоваться и кристаллы вырастают достаточно крупными и хорошо ограненными. Если магма застывает внезапно, могут образоваться некристаллические минералы и горные породы. Внезапное застывание магмы происходит при извержении вулканов. Потоки застывшей лавы дает начало не кристаллическим, а стекловидным породам.
Образование кристаллов в результате конденсации газов или из паров. Кристаллизоваться могут не только водяные пары, но и пары других веществ. Пример- на фумаролах образуются кристаллы из газов.
Образование кристаллов при перекристаллизации твердых веществ. При переходе из твердого состояния в твердое выделяют 2 случая:
1. Кристаллическое вещество образуется из аморфного–например, с течением времени закристаллизовываются содержащие стекла кристаллические породы.
2. Перекристаллизация – это процесс, при котором структура одних веществ разрушается, и образуются новые кристаллы с другой структурой. Например, известняк под действием высоких температур и давления становится мрамором. Перекристаллизация связана с таким явлением как метосамотоз – преобразование горной породы или минерала в другую горную породу или минерал под воздействием привноса или выноса вещества.
Материальные частицы (атомы, молекулы, ионы), слагающие газообразные или жидкие (расплавленные) вещества, обладая высокой кинетической энергией, находятся в непрерывном движении. Время от времени они сталкиваются, образуя зародыши – микроскопические фрагменты будущей структуры. Чаще всего такие зародыши распадаются, что связано либо с собственными колебаниями, либо с бомбардировкой их свободными частицами. Однако для начала кристаллизации необходимо, чтобы зародыш достиг критической величины, т.е. содержал такое количество частиц, при котором присоединение следующей частицы сделало бы разрастание зародыша энергетически более выгодным, чем его распад. Такая возможность для большинства веществ проявляется либо с понижением температуры, в результате чего уменьшаются температурные колебания, либо с повышением концентрации вещества в растворе или газе, что приводит к увеличению вероятности встречи частиц друг с другом, то есть к возникновению зародышей.
Таким образом, рост кристаллов можно рассматривать как процесс, посредством которого мельчайшие кристаллические частицы – зародыши – достигают макроскопических размеров. Причем кристаллизация протекает не во всем объеме, а лишь там, где возникнут зародыши. Факторами, влияющими на появление зародышей, являются не только переохлаждение и повышение концентрации раствора или вязкости расплава, но и присутствие посторонних обломков кристаллов или пылинок, на поверхности которых собираются частицы, упрощая этим начало кристаллизации.
Процесс кристаллизации является энергетически выгодным. Растущий кристалл не принимает равновесную форму вследствие того, что на него влияют различные изменяющиеся условия кристаллизации: температура, давление, сила тяжести, химический состав и динамика среды и т.д.
Существенный вклад в решение вопросов о механизме роста кристаллов внесли разработанные теории роста идеальных кристаллов.
В конце XIX в. американским физиком Дж. Гиббсом (1839-1903), французским физиком П. Кюри и русским кристаллографом Г.В. Вульфом на термодинамической основе была разработана количественная теория зарождения и роста кристаллов. Несколько позже, в 20-х гг. XX в., немецким физиком М. Фольмером (1885-1965) была выдвинута теория самопроизвольного зарождения кристаллов и их роста.
Вслед за термодинамическим учением Гиббса в 1927 году наибольшее признание получили теоретические работы немецкого физико-химика В.Косселя (1888 – 1956) и болгарского физика И.Н. Странского (1897 — 1979), положившие начало молекулярно-кинетической теории роста кристаллов. Они рассмотрели рост идеального кристалла при незначительном перенасыщении без учета несовершенств реальных кристаллов и влияния среды кристаллизации. Эта теория объяснила явление послойного роста кристаллов с позиций атомно-молекулярного состояния поверхности растущего кристалла, опираясь на энергетическую выгодность присоединения отдельных частиц вещества в различные позиции на свободной от дефектов поверхности кристаллов.
В процессе роста возникают либо атомно-гладкие, либо атомно-шероховатые грани. Атомно-гладкие грани растут путем послойного отложения вещества, т.е. тангенциального перемещения ступеней, и остаются в процессе роста макроскопически плоскими. Такой рост называется тангенциальным или послойным. При этом скорость роста разных граней будет различна. В итоге кристаллы будут расти в идее многогранника.
Кристаллы с атомно-шероховатыми гранями могут присоединять частицы с макроскопической точки зрения практически в любой точке поверхности. Поэтому поверхность грани в процессе роста перемещается по нормали к самой себе в каждой своей точке. Такой рост называется нормальным. При этом скорости роста граней кристалла в разных направлениях будут примерно одинаковы и кристаллы приобретут округлые формы изотерм кристаллизации. Исследование морфологии кристаллов дает информацию об атомных процессах, происходящих на поверхности растущего кристалла.
Рост на атомно-шероховатых плоскостях и торцах ступеней требует лишь потенциальных барьеров для встраивания отдельных атомов или молекул. Рост же атомно-гладких поверхностей требует еще и образования ступеней, т.е. для роста каждого нового слоя необходимо появление на поверхности нового зародыша, а это не всегда возможно из-за недостатка пересыщения. В этом случае рост происходит лишь путем движения уже имеющихся ступеней. Таким образом, первый процесс с энергетической точки зрения оказывается более выгодным.
Кроме того, грани реальных кристаллов практически никогда не бывают идеальны. На их поверхности всегда имеются нарушения – дефекты, благодаря которым возникают винтовые и краевые дислокации. Нарастание граней происходит по спирали путем навивания одного слоя на другой. И такой рост может происходить при сколько угодно малых пересыщениях и даже из паров. Дислокации, следовательно, являются непрерывно действующим источником возникновения слоев и снимают необходимость появления на поверхности растущей грани двухмерных зародышей.
Однако такие представления оказались неприменимы для сильно пересыщенных растворов и расплавов. В условиях больших пересыщений возможны и другие механизмы роста. Исследования морфологии поверхностей роста дает возможность сделать важные выводы о механизмах кристаллизации. Существует много методов исследования поверхностей граней, главными из которых являются оптическая и электронная микроскопия; кроме того, структура и состав поверхности изучаются методами дифракции медленных электронов, масс-спектроскопии, ультрафиолетовой и рентгеновской спектроскопии и т.д.
При различных отклонениях от идеальных условий кристаллизации (например, в вязких, загрязненных или сильно пересыщенных средах) вырастают экзотические образования. Опыт показывает, что при малых пресыщениях и переохлаждениях на фронте роста возникают совершенные – гранные – формы кристаллов. С увеличением отклонения от равновесия кристаллы меняют свой облик, превращаясь в скелеты, дендриты (от греч. Дендрон – дерево), нитевидные образования или кристаллы сферической формы. Указанные формы различаются тем, что скелетные кристаллы – это монокристаллы, а дендриты – чаще всего поликристаллические агрегаты.
Нарушение правильности в расположении частиц, слагающие структуры реальных кристаллов, т.е. отклонения от их идеальной структуры, порождают дефекты. Для исследователя дефект – это источник информации о событиях, произошедших с кристаллом.
В реальных кристаллах всегда присутствуют структурные дефекты, которые оказывают существенное влияние на многие свойства твердых тел. К этим свойствам, именуемым структурно-чувствительными, относятся те, которые связаны с движением атомов или электронов. Это механические свойства (прочность и пластичность), ионная и полупроводниковая электропроводность, люминесценция, фотопроводимость, теплопроводность, скорость диффузии и фазовых превращений, и ряд других.
Дефекты — любые отклонения от периодической структуры кристалла — классифицируют по их размерам и протяженности областей решетки, на которое распространяется их действие. Выделяют следующие типы дефектов кристаллической решетки:
1) Точечные или нульмерные дефекты — нарушения в периодичности в изолированных друг от друга точках решетки; во всех трех измерениях они не превышают одного или нескольких междуатомных расстояний (параметров решетки). Точечные дефекты — это вакансии, междоузельные атомы, атомы примеси, внедренные или в позиции замещения.
2) Линейные дефекты — одномерные, т. е. протяженные в одном измерении: нарушения периодичности в одном измерении простираются на расстояния, сравнимые с размером кристалла, а в двух других не превышают нескольких параметров решетки. Специфические линейные дефекты — это дислокации. Неустойчивые линейные дефекты могут возникать из цепочек точечных дефектов.
3) Поверхностные или двумерные дефекты. Простираются в двух измерениях на расстояния, сравнимые с размером кристалла, а в третьем составляют несколько параметров решетки. Это плоскости двойникования у двойников, границы зерен и блоков, дефекты упаковки, стенки доменов, и сама поверхность кристалла.
4) Объемные или трехмерные. Это пустоты, поры, частицы другой фазы, включения.
Кроме перечисленных, можно выделить особую группу дефектов, характерную, в основном, для полупроводниковых кристаллов — микродефекты. Под микродефектами понимают любые дефекты структуры субмикронных размеров.
Первую попытку получения искусственных кристаллов можно отнести к Средневековью, к периоду расцвета алхимии. И хотя конечной целью опытов алхимиков было получение золота из простых веществ, можно предположить, что они пытались вырастить кристаллы драгоценных камней.
Целенаправленное создание искусственных кристаллов минералов связано с именем французского химика М. Годена, которому в 1837 г. удалось получить мельчайшие (в 1 карат – 0,2 г) кристаллы рубина. В дальнейшем предпринимались неоднократные попытки получения искусственных рубинов, и уже в конце XIX в. удалось синтезировать ряд соединений группы корунда. А в 1902 г. французский химик М.А. Вернейль начал поставлять на мировой рынок синтетические рубины, позже сапфиры и шпинели.
Несколько позже были синтезированы кристаллы многих драгоценных камней, нашедшие наряду с природными широкое применение не только в качестве ювелирного сырья, но и в промышленности, где понадобились уже монокристаллы достаточно крупных размеров.
В последние полвека в связи с бурным развитием техники и приборостроения с каждым годом возрастает потребность в кристаллах, обладающих специфическими свойствами, такими как пьезоэлектрические, полупроводниковые, люминесцентные, акустические, лазерные, оптические и т.д. Кроме того, для создания современных приборов требуются кристаллы с такими уникальными свойствами, которыми природные объекты не обладают. Все это способствует становлению промышленного выращивания искусственных кристаллов.
Работы по теории и практике выращивания кристаллов способствовали интенсивному развитию научных исследований в области процессов реального кристаллообразования, в частности в природных условиях.
Моделирование природных процессов кристаллообразования в лаборатории позволяет понять и объяснить ряд причин зарождения, роста и разрушения кристаллов в реальных условиях.
1. Булах А.Г. Минералогия с основами кристаллографии. М.: Альфа-М, 1989. – 156 с.
2. Егоров-Тисменко Ю.К. Кристаллография и кристаллохимия: учебник. – М.: КДУ, 2005. – 592 с.
3. Попов Г.М., Шафрановский И.И. Кристаллография. М.: ГОСГЕО — ЛТЕХИЗДАТ, 1955г. – 215с
www.ronl.ru
Реферат
По курсу «Кристаллография и кристаллохимия»
«Кристаллогенезис – возникновение, рост и разрушение кристаллов»
Содержание
Введение
Образование кристаллов в природе
Причины и условия образования кристаллов
Механизмы роста кристаллов
Формы роста кристаллов
Дефекты кристаллов
История получения искусственных кристаллов
Список используемой литературы
Кристаллогенезис – возникновение, рост и разрушение кристаллов
Для понимания процессов, приводящих к зарождению и росту кристаллов, необходимы знания из области физики, химии, кристаллографии и других ветвей науки.
Однако подход к изучению кристаллов у разных специалистов разный: физиков кристаллы интересуют как материал, используемый в технике и обладающий интересными физическими свойствами; минерологи же на основе изучения тех или иных особенностей кристаллов пытаются выяснить историю их зарождения, роста и последующих превращений – определить температуру, давление и состав среды, в которой кристаллы зарождались и росли, т.е. определить последовательность тех физико-химических процессов, которые привели к образованию кристалла.
В природе кристаллы образуются при различных геологических процессах из растворов, расплавов, газовой или твердой фазы.
Значительная часть минеральных видов произошла путем кристаллизации из водных растворов. Примеры выпадения кристаллов из раствора – выпадение кристаллов солей в замкнутых водоемах; рост кристаллов на стенках трещин и полостей при гидротермальных процессах, на больших глубинах в условиях высоких давлений и температур; образование отдельных кристаллов вторичных минералов в зонах окисления рудных месторождений.
Образование кристаллов из расплавов. Если магматический очаг располагается на большой глубине и его остывание идет медленно, то магма успевает хорошо раскристаллизоваться и кристаллы вырастают достаточно крупными и хорошо ограненными. Если магма застывает внезапно, могут образоваться некристаллические минералы и горные породы. Внезапное застывание магмы происходит при извержении вулканов. Потоки застывшей лавы дает начало не кристаллическим, а стекловидным породам.
Образование кристаллов в результате конденсации газов или из паров. Кристаллизоваться могут не только водяные пары, но и пары других веществ. Пример- на фумаролах образуются кристаллы из газов.
Образование кристаллов при перекристаллизации твердых веществ. При переходе из твердого состояния в твердое выделяют 2 случая:
1. Кристаллическое вещество образуется из аморфного–например, с течением времени закристаллизовываются содержащие стекла кристаллические породы.
2. Перекристаллизация – это процесс, при котором структура одних веществ разрушается, и образуются новые кристаллы с другой структурой. Например, известняк под действием высоких температур и давления становится мрамором. Перекристаллизация связана с таким явлением как метосамотоз – преобразование горной породы или минерала в другую горную породу или минерал под воздействием привноса или выноса вещества.
Материальные частицы (атомы, молекулы, ионы), слагающие газообразные или жидкие (расплавленные) вещества, обладая высокой кинетической энергией, находятся в непрерывном движении. Время от времени они сталкиваются, образуя зародыши – микроскопические фрагменты будущей структуры. Чаще всего такие зародыши распадаются, что связано либо с собственными колебаниями, либо с бомбардировкой их свободными частицами. Однако для начала кристаллизации необходимо, чтобы зародыш достиг критической величины, т.е. содержал такое количество частиц, при котором присоединение следующей частицы сделало бы разрастание зародыша энергетически более выгодным, чем его распад. Такая возможность для большинства веществ проявляется либо с понижением температуры, в результате чего уменьшаются температурные колебания, либо с повышением концентрации вещества в растворе или газе, что приводит к увеличению вероятности встречи частиц друг с другом, то есть к возникновению зародышей.
Таким образом, рост кристаллов можно рассматривать как процесс, посредством которого мельчайшие кристаллические частицы – зародыши – достигают макроскопических размеров. Причем кристаллизация протекает не во всем объеме, а лишь там, где возникнут зародыши. Факторами, влияющими на появление зародышей, являются не только переохлаждение и повышение концентрации раствора или вязкости расплава, но и присутствие посторонних обломков кристаллов или пылинок, на поверхности которых собираются частицы, упрощая этим начало кристаллизации.
Процесс кристаллизации является энергетически выгодным. Растущий кристалл не принимает равновесную форму вследствие того, что на него влияют различные изменяющиеся условия кристаллизации: температура, давление, сила тяжести, химический состав и динамика среды и т.д.
Существенный вклад в решение вопросов о механизме роста кристаллов внесли разработанные теории роста идеальных кристаллов.
В конце XIX в. американским физиком Дж. Гиббсом (1839-1903), французским физиком П. Кюри и русским кристаллографом Г.В. Вульфом на термодинамической основе была разработана количественная теория зарождения и роста кристаллов. Несколько позже, в 20-х гг. XX в., немецким физиком М. Фольмером (1885-1965) была выдвинута теория самопроизвольного зарождения кристаллов и их роста.
Вслед за термодинамическим учением Гиббса в 1927 году наибольшее признание получили теоретические работы немецкого физико-химика В.Косселя (1888 – 1956) и болгарского физика И.Н. Странского (1897 — 1979), положившие начало молекулярно-кинетической теории роста кристаллов. Они рассмотрели рост идеального кристалла при незначительном перенасыщении без учета несовершенств реальных кристаллов и влияния среды кристаллизации. Эта теория объяснила явление послойного роста кристаллов с позиций атомно-молекулярного состояния поверхности растущего кристалла, опираясь на энергетическую выгодность присоединения отдельных частиц вещества в различные позиции на свободной от дефектов поверхности кристаллов.
В процессе роста возникают либо атомно-гладкие, либо атомно-шероховатые грани. Атомно-гладкие грани растут путем послойного отложения вещества, т.е. тангенциального перемещения ступеней, и остаются в процессе роста макроскопически плоскими. Такой рост называется тангенциальным или послойным. При этом скорость роста разных граней будет различна. В итоге кристаллы будут расти в идее многогранника.
Кристаллы с атомно-шероховатыми гранями могут присоединять частицы с макроскопической точки зрения практически в любой точке поверхности. Поэтому поверхность грани в процессе роста перемещается по нормали к самой себе в каждой своей точке. Такой рост называется нормальным. При этом скорости роста граней кристалла в разных направлениях будут примерно одинаковы и кристаллы приобретут округлые формы изотерм кристаллизации. Исследование морфологии кристаллов дает информацию об атомных процессах, происходящих на поверхности растущего кристалла.
Рост на атомно-шероховатых плоскостях и торцах ступеней требует лишь потенциальных барьеров для встраивания отдельных атомов или молекул. Рост же атомно-гладких поверхностей требует еще и образования ступеней, т.е. для роста каждого нового слоя необходимо появление на поверхности нового зародыша, а это не всегда возможно из-за недостатка пересыщения. В этом случае рост происходит лишь путем движения уже имеющихся ступеней. Таким образом, первый процесс с энергетической точки зрения оказывается более выгодным.
Кроме того, грани реальных кристаллов практически никогда не бывают идеальны. На их поверхности всегда имеются нарушения – дефекты, благодаря которым возникают винтовые и краевые дислокации. Нарастание граней происходит по спирали путем навивания одного слоя на другой. И такой рост может происходить при сколько угодно малых пересыщениях и даже из паров. Дислокации, следовательно, являются непрерывно действующим источником возникновения слоев и снимают необходимость появления на поверхности растущей грани двухмерных зародышей.
Однако такие представления оказались неприменимы для сильно пересыщенных растворов и расплавов. В условиях больших пересыщений возможны и другие механизмы роста. Исследования морфологии поверхностей роста дает возможность сделать важные выводы о механизмах кристаллизации. Существует много методов исследования поверхностей граней, главными из которых являются оптическая и электронная микроскопия; кроме того, структура и состав поверхности изучаются методами дифракции медленных электронов, масс-спектроскопии, ультрафиолетовой и рентгеновской спектроскопии и т.д.
При различных отклонениях от идеальных условий кристаллизации (например, в вязких, загрязненных или сильно пересыщенных средах) вырастают экзотические образования. Опыт показывает, что при малых пресыщениях и переохлаждениях на фронте роста возникают совершенные – гранные – формы кристаллов. С увеличением отклонения от равновесия кристаллы меняют свой облик, превращаясь в скелеты, дендриты (от греч. Дендрон – дерево), нитевидные образования или кристаллы сферической формы. Указанные формы различаются тем, что скелетные кристаллы – это монокристаллы, а дендриты – чаще всего поликристаллические агрегаты.
Нарушение правильности в расположении частиц, слагающие структуры реальных кристаллов, т.е. отклонения от их идеальной структуры, порождают дефекты. Для исследователя дефект – это источник информации о событиях, произошедших с кристаллом.
В реальных кристаллах всегда присутствуют структурные дефекты, которые оказывают существенное влияние на многие свойства твердых тел. К этим свойствам, именуемым структурно-чувствительными, относятся те, которые связаны с движением атомов или электронов. Это механические свойства (прочность и пластичность), ионная и полупроводниковая электропроводность, люминесценция, фотопроводимость, теплопроводность, скорость диффузии и фазовых превращений, и ряд других.
Дефекты — любые отклонения от периодической структуры кристалла — классифицируют по их размерам и протяженности областей решетки, на которое распространяется их действие. Выделяют следующие типы дефектов кристаллической решетки:
1) Точечные или нульмерные дефекты — нарушения в периодичности в изолированных друг от друга точках решетки; во всех трех измерениях они не превышают одного или нескольких междуатомных расстояний (параметров решетки). Точечные дефекты — это вакансии, междоузельные атомы, атомы примеси, внедренные или в позиции замещения.
2) Линейные дефекты — одномерные, т. е. протяженные в одном измерении: нарушения периодичности в одном измерении простираются на расстояния, сравнимые с размером кристалла, а в двух других не превышают нескольких параметров решетки. Специфические линейные дефекты — это дислокации. Неустойчивые линейные дефекты могут возникать из цепочек точечных дефектов.
3) Поверхностные или двумерные дефекты. Простираются в двух измерениях на расстояния, сравнимые с размером кристалла, а в третьем составляют несколько параметров решетки. Это плоскости двойникования у двойников, границы зерен и блоков, дефекты упаковки, стенки доменов, и сама поверхность кристалла.
4) Объемные или трехмерные. Это пустоты, поры, частицы другой фазы, включения.
Кроме перечисленных, можно выделить особую группу дефектов, характерную, в основном, для полупроводниковых кристаллов — микродефекты. Под микродефектами понимают любые дефекты структуры субмикронных размеров.
Первую попытку получения искусственных кристаллов можно отнести к Средневековью, к периоду расцвета алхимии. И хотя конечной целью опытов алхимиков было получение золота из простых веществ, можно предположить, что они пытались вырастить кристаллы драгоценных камней.
Целенаправленное создание искусственных кристаллов минералов связано с именем французского химика М. Годена, которому в 1837 г. удалось получить мельчайшие (в 1 карат – 0,2 г) кристаллы рубина. В дальнейшем предпринимались неоднократные попытки получения искусственных рубинов, и уже в конце XIX в. удалось синтезировать ряд соединений группы корунда. А в 1902 г. французский химик М.А. Вернейль начал поставлять на мировой рынок синтетические рубины, позже сапфиры и шпинели.
Несколько позже были синтезированы кристаллы многих драгоценных камней, нашедшие наряду с природными широкое применение не только в качестве ювелирного сырья, но и в промышленности, где понадобились уже монокристаллы достаточно крупных размеров.
В последние полвека в связи с бурным развитием техники и приборостроения с каждым годом возрастает потребность в кристаллах, обладающих специфическими свойствами, такими как пьезоэлектрические, полупроводниковые, люминесцентные, акустические, лазерные, оптические и т.д. Кроме того, для создания современных приборов требуются кристаллы с такими уникальными свойствами, которыми природные объекты не обладают. Все это способствует становлению промышленного выращивания искусственных кристаллов.
Работы по теории и практике выращивания кристаллов способствовали интенсивному развитию научных исследований в области процессов реального кристаллообразования, в частности в природных условиях.
Моделирование природных процессов кристаллообразования в лаборатории позволяет понять и объяснить ряд причин зарождения, роста и разрушения кристаллов в реальных условиях.
1. Булах А.Г. Минералогия с основами кристаллографии. М.: Альфа-М, 1989. – 156 с.
2. Егоров-Тисменко Ю.К. Кристаллография и кристаллохимия: учебник. – М.: КДУ, 2005. – 592 с.
3. Попов Г.М., Шафрановский И.И. Кристаллография. М.: ГОСГЕО — ЛТЕХИЗДАТ, 1955г. – 215с
www.ronl.ru
Реферат на тему:
Кристалл кварца
Криста́ллы (от греч. κρύσταλλος, первоначально — лёд, в дальнейшем — горный хрусталь, кристалл) — твёрдые тела, в которых атомы расположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку.
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов).
Кристаллическая структура, будучи индивидуальной для каждого вещества, относится к основным физико-химическим свойствам.
Составляющие данное твёрдое вещество частицы образуют кристаллическую решётку. Если кристаллические решётки стереометрически (пространственно) одинаковы или сходны (имеют одинаковую симметрию), то геометрическое различие между ними заключается, в частности, в разных расстояниях между частицами, занимающими узлы решётки. Сами расстояния между частицами называются параметрами решётки. Параметры решётки, а также углы геометрических многогранников определяются физическими методами структурного анализа, например методами рентгеновского структурного анализа.
Часто твёрдые вещества образуют (в зависимости от условий) более чем одну форму кристаллической решётки; такие формы называются полиморфными модификациями. Например, среди простых веществ известны ромбическая и моноклинная сера, графит и алмаз, которые являются гексагональной и кубической модификациями углерода, среди сложных веществ — кварц, тридимит и кристобалит представляют собой различные модификации диоксида кремния.
Следует разделить идеальный и реальный кристалл.
Является, по сути, математическим объектом, имеющим полную, свойственную ему симметрию, идеализированно ровные гладкие грани.
Всегда содержит различные дефекты внутренней структуры решетки, искажения и неровности на гранях и имеет пониженную симметрию многогранника вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций. Реальный кристалл не обязательно обладает кристаллографическими гранями и правильной формой, но у него сохраняется главное свойство — закономерное положение атомов в кристаллической решётке.
Многим кристаллам присуще свойство анизотропии, то есть зависимость их свойств от направления, тогда как в изотропных веществах (большинстве газов, жидкостей, аморфных твёрдых телах) или псевдоизотропных (поликристаллы) телах свойства от направлений не зависят. В то же время существуют кристаллы, в которых анизотропия отсутствует.
Вообще свойства реальных кристаллов — огромная научная отрасль, достаточно сказать, что все полупроводниковые свойства некоторых кристаллов (на основе которых создаётся точная электроника и, в частности, компьютеры) возникают именно за счет дефектов.
wreferat.baza-referat.ru