|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Тромбоэмболия легочной артерии:. Тэла реферат
Реферат: Тромбоэмболия легочной артерии
Определение Тромбоэмболия легочной артерии (ТЭЛА)- эмболия ветвей или ствола легочной артерии тромботическими массами. До недавнего времени понятие ТЭЛА ассоциировалось с понятием "инфаркт легкого". Эта патология считалась относительно редкой, имеющей четко очерченную клиническую и рентгенологическую картину. В последние годы, с совершенствованием познаний клиники и методов диагностики заболеваний легких выясняется, что инфаркт легкого - это лишь малая, надводная часть массивного айсберга в современной патологии человека, каким является ТЭЛА. Это заболевание протекает под всевозможными клиническими масками. Чаще диагностируются: пневмония, хронический бронхит, бронхиальная астма, абсцесс легкого, инфаркт миокарда и др. По современным данным (Кеннет М. Мозер, США) ТЭЛА диагностируется, примерно, у 0,15 -0,20% населения, 10% из них ежегодно умирает от этого заболевания. При изучении данных аутопсий у умерших от различных причин легочные тромбоэмболы выявляются у 25-30%, однако прижизненная диагностика их составляет лишь 10-30% от числа посмертно обнаруживаемых. Автор отмечает, что эти данные не вполне отражают реальную распространенность ТЭЛА, поскольку значительная часть тромбоэмболов полностью лизируется у трупа и они не могут быть обнаружены при аутопсий. На материале вскрытии 1806 умерших в С-Петербурге за последние 45 лет (с 1945г.) выявлен рост частоты ТЭЛА, как причины смерти, более чем в 7,5 раз -с 1,4% до 11% (Клочков Н.Д, и соавт.). Трудности диагностики этого заболевания связаны с тем обстоятельством, что ТЭЛА более чем у 75% больных является спутницей многих тяжело протекающих заболеваний других систем, особенно сердечно-сосудистой, когда клинические признаки этого заболевания перекрыты симптомами фоновой патологии. ТЭЛА является нередким заболеванием среди пациентов с поражением легких в больнице общего профиля, она должна быть исключена у больных с пневмонией, плевритом, инфарктом миокарда. Больные с ТЭЛА чаще поступают к терапевту, большая часть их госпитализируется в терапевтические отделения (Подильчак М.Д. и соавт.). В определении ТЭЛА, как самостоятельной нозологической формы, имеется ряд специфических особенностей. Для возникновения этого заболевания необходимо наличие тромба в легочной артерии. Он может формироваться в бассейне легочной артерии автохтонно и служить в последующем эмболом этого сосуда, но в абсолютном большинстве случаев тромб заносится из венозной системы большого круга или из полостей сердца, т.е. формируясь в ином сосудистом бассейне. Система легочных артерий является своего рода тотальным фильтром крови в организме. Следствием эволюции формирования организма явилось то, что легочный ствол имеет наибольший диаметр по сравнению с другими сосудами, является самым широким кровеносным сосудом. Это обстоятельство исключает возможность несовместимого с жизнью тотального перекрытия его при заносе тромбов из других сосудов из-за меньшего диаметра их. Поэтому изначальная локализация тромба (эмбола) наблюдается, как правило, в разветвлениях или в основных ветвях легочной артерии. Разветвления легочных артерий имеют широкую сеть анастомозов (артерио-артериальных и артерио-венозных). Вследствие этого не каждый случай заноса тромба ведет к ишемии и реализуется в те или иные клинические проявления заболевания. Помимо того, в бассейне легочных сосудов функционирует мощная система расплавления (лизиса) тромбов, что ведет к такому положению, когда эпизод заноса тромба в разветвления легочной артерии не является обязательным фактором развития клиники тромбоэмболии. Для возникновения тромбоэмболии легочных артерий, помимо заноса тромба в них, необходим ряд специфических условий, составляющих особое содержание этиологии. Для клинических проявлений его необходим ряд специфических звеньев патогенеза. |
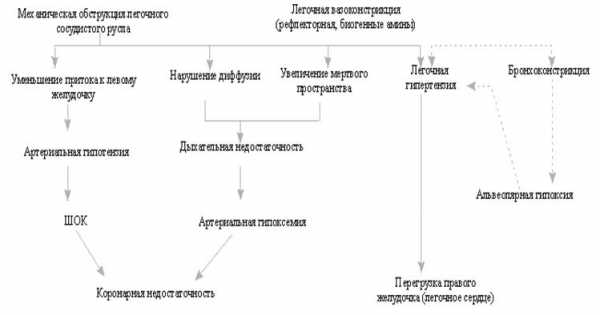
Патогенез При заносе тромба в легочную артерию с развитием эмболической обструкции сосуда в легких возникают респираторные и гемодинамические нарушения. Нарушение функции дыхания является следствием того, что появляется неперфузируемый, но вентилируемый участок легочной ткани. Поскольку этот участок исключен из газообмена легкие/кровь, его вентиляция становится "бесполезной". У части больных возможным последствием эмболической закупорки является спадение респираторных отделов легких, у части бронхоспазм в зоне поражения. Этот феноменпневмо- и бронхо-констрикции является своеобразным гомеостатическим (защитным) механизмом, препятствующим "бесполезной" вентиляции. В основе его лежит нарушение выработки альвеолярного сурфактанта. Выпадает поверхностно-активное действие последнего, наступает спадение альвеол. Отмечено, что уже через 2-3 часа после прекращения капиллярного кровотока начинается снижение секреции сурфактанта альвеолярным эпителием, достигающее наибольшей выраженности через 12-15 час после эмболизации артерии. Ателектаз легочной ткани из-за потери стабильности альвеол появляется к исходу 1-2 сут после прекращения капиллярного кровотока, что можно определить на рентгенограмме легких в виде дисковидной формы тени. У больных развивается артериальная гипоксемия. Причиной ее в основном являются вентиляционно - перфузионные несоответствия, а также возникающая сердечная недостаточность. Снижение содержания кислорода в оттекающей из малого круга крови является следствием того, что при повышении давления в легочной артерии из-за эмболической обструкции наступает перфузия гиповентилируемых и невентилируемых участков легкого, которые в норме не перфузируются вследствие физиологической вазоконстрикции их. Повышение давления в легочной артерии преодолевает эту, существующую в нормальных условиях вазоконстрикцию, "проталкивая" кровь через участки легкого находящиеся в состоянии физиологического ателектаза. Гемодинамические нарушения возникают вследствие того, что уменьшение емкости сосудистого русла малого круга из-за тромбоэмболии приводит к повышению сосудистого сопротивления, развитию легочной гипертензии и острого легочного сердца. Следствием развивающейся при этом острой правожелудочковой декомпенсации является уменьшение сердечного выброса левым желудочком, что ведет к резкому повышению общего периферического сосудистого сопротивления в большом круге и выраженной тахикардии. В патогенезе легочной гипертензии, помимо уменьшения объема сосудистого русла, имеют значение рефлекторные и гуморальные вазоконстрикторные механизмы. Известно, что повышение давления в легочной артерии вследствие анатомической редукции сосудистого русла происходит при выключении из активного кровотока более 50% суммарного его просвета. При ТЭЛА легочная гипертензия наступает и при существенно меньшем объеме выключенного сосудистого русла. Предполагается, что из тромбоцитов, покрывающих поверхность эмболов, высвобождаются гуморальные факторы, оказывающие выраженное вазо- и бронхоконстрикторное действие - серотонин и тромбоксан. Следовательно, тромбоэмболы в легочной артерии вызывают не только механическую закупорку сосудов, но и оказывают определенное фармакологическое действие с подключением механизмов повышения тонуса и спазма. При заносе в легочную артерию крупного эмбола с закупоркой одной из основных ветвей ее, или обеих сразу (тромб- "всадник" на бифуркации основного ствола) - массивной эмболии –возникают тяжелые гемодинамические нарушения вплоть до прекращения кровотока с летальным исходом. При этом вследствие остро развивающейся гипертонии малого круга у больных наступают выраженные изменения функции сердца с формированием подостро и остро текущего синдрома легочного сердца. У больных выявляется расширение правых отделов сердца с субэн-докардиальными кровоизлияниями, а у части с выпотом в полость перикарда. Таким образом, ТЭЛА является остро возникающим, быстроразвивающимся, у ряда больных длительно текущим с поэтапным формированием различных морфологических и функциональных поражений легких процессом. В патогенезе его можно выделить следующие звенья.1. Подавление выработки сурфактанта с локальными респираторными нарушениями в форме возникновения ателектаза или бронхоспазма с эмфиземой легкого.2. Несоответствие перфузионно-вентиляционных отношений в малом круге, возникновение перфузионного дефицита с гипоксемией.3. Гипертензия в системе легочной артерии на основе анатомической окклюзии сосуда, рефлекторных и гуморальных механизмов спазма артериол вследствие фармакологических воздействий биологически активных факторов из субстанции тромба с развитием синдрома острого и подострого легочного сердца.4. Уменьшение сердечного выброса с падением артериального давления в системе большого круга при повышении общего периферического сосудистого сопротивления.5. Развитие осложнений: инфаркта легкого, плеврита, пневмонии, недостаточности кровообращения и других.6. Формирование посттромбоэмболического пневмосклероза с синдромам хронического легочного сердца, дыхательной и сердечной недостаточностью. |
Схема 1. Патофизиология ТЭЛА
Исход, прогноз
Тромбоэмболия мелких ветвей легочной артерии без рецидивирования имеет, как правило, относительно благоприятной прогноз, с последствиями, зависящими от вида осложнения и исхода его. У части больных развивается очаговый пневмосклероз, локальный спаечный процесс в плевральной полости без прогрессирования. При рецидивирующем течении возможно многолетнее течение процесса с прогрессирующим поражением легких, развитием посттромбоэмболического пневмосклероза с нарастающей легочной гипертензией и развитием синдрома хронического легочного сердца.
При массивной и субмассивной ТЭЛА в случаях выживания после острых клинических проявлений по завершению реканализации пораженного сосуда отмечается у большинства прогрессирующая легочная гипертония с синдромом хронического легочного сердца, декомпенсация которого наступает в ближайшие 3-5 лет (Савельев B.C. и соавт).
Диагностика
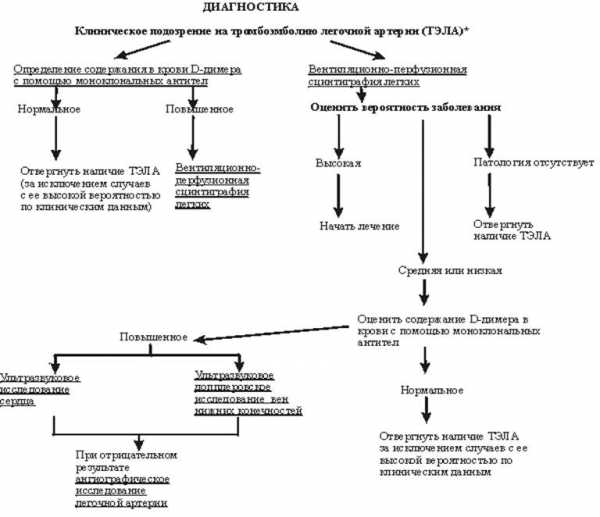 Схема 2.
Схема 2.
Диагностика ТЭЛА, как правило, затруднена. Диагностические ошибки являются скорее правилом нежели исключением. При расспросе больного настораживающим на диагноз ТЭЛА могут быть такие симптомы, как внезапно возникающая "необъяснимая" т.е. без видимой причины, одышка, боли в грудной клетке. В ряде случаев начало заболевания характеризуется пароксизмами сердцебиений, внезапно возникающими симптомами прогрессирующей сердечной слабости, признаками обострения хронического обструктивного бронхита. Важное значение для диагноза имеет изучение анамнеза с выявлением факторов риска ТЭЛА: наличие фоновых заболеваний сердечно-сосудистой системы с недостаточностью кровообращения; онкологических заболеваний; недавно перенесенных хирургических операций, особенно на органах брюшной полости и малого таза; вмешательств с катетеризацией подключичных вен; послеродовой период; наличие предшествовавшего периода гиподинамии из-за различных причин, особенно у пациентов в возрасте старше 40 лет; ожирение; прием эстрогенов; хроническая венозная недостаточность нижних конечностей. Физикальные данные при ТЭЛА скудные, малоинформативные, а если они и выявляются, то весьма "неспецифичны". Заслуживают внимание лишь два признака - тахикардия и учащение дыхания. Примерно у половины числа больных с ТЭЛА источник не представляется возможным выявитьВ специализированных хирургических отделениях для диагностики источника ТЭЛА проводятся исследования с помощью меченого фибриногена и ретроградной каваилеографии через правые полости сердца. Используется и транслюбальная каваилеография.
Важное диагностическое значение имеет рентгенологическое исследование.
Дифференциальный диагноз
Вследствие того, что малый круг кровообращения является своего рода тотальным фильтром на пути венозного кровотока, различные вещества, попадающие в венозную кровь, могут вызывать эмболизацию ветвей легочной артерии с клиническими проявлениями, сходными с таковыми при ТЭЛА. Однако эти патологические состояния не относятся к диагнозу ТЭЛА.
Таблица 1Критерии и шкала оценки для диагностики ТЭЛА
| Критерий | Баллы | Критерий | Баллы |
| I. Предрасполагающие факторы:злокачественные новообразованияфлебитзаболевания сердцаоперативное вмешательствоII. Симптомы:кашелькровохарканьеболь в грудной клеткеодышкаIII.Данные объективного исследования:снижение систолического АД менее 100 мм.рт.стхрипыповышение температуры более 370Сучащение пульса более 100 в 1 мин.увеличение размеров печениучащение дыхания более 16 в 1 мин.IV. Рентгенологическое исследование:высокое стояние купола диафрагмырасширение купола диафрагмысетчато-узловые затененияплевральные наслоенияинфильтрация | 1 111 1222 111 123 1 1222 | V.Изменения ЭКГ:блокада правой ножки пучка Гисаглубокие SI, QIIIотрицательные ТIIIвысокий, острый РIIотклонение электрической оси вправоVI.Лабораторные данныегематокрит более 35%ЛДГ более 450ГЩТ более 40ГПТ более 35билирубин более 1,2мочевина крови более 20число лейкоцитов более 8000число тромбоцитов менее 200000фибриноген менее 200фибриноген более 350плазминоген менее 10протромбиновое время более 13антитромбин III менее 25ПДФ более 10РН более 7,45Ра СО2 менее 40Ра О2 менее 85VII. Сканирование лёгкихсегментарные и долевые дефекты перфузиивентиляционно-перфузионные расстройстваVIII. Ангиопульмонография"обрыв" сосудовдефекты наполнения | 11222233122223124 |
Оценка и вероятность ТЭЛА:А: сумма менее 15 баллов - ТЭЛА маловероятна;Б: сумма более 20 баллов - вероятность ТЭЛА высока,ТЭЛА имеется наверняка при: А+УП+УШ Б+УП или УШ
.
Лечение При диагностировании ТЭЛА, равно как и при подозрении на ТЭЛА, до и в процессе обследования необходимо соблюдение строгого постельного режима. Это правило должно выполняться и при относительно удовлетворительном состоянии, при маловыраженной клинике, потому что всегда имеется угроза рецидива эмболии. Больной должен быть госпитализирован в отделение интенсивного наблюдения или в реанимационное, с возможностями эндоназального введения кислорода, непрямого массажа сердца, длительных внутривенных инфузий посредством катетеризации вен. При назначении медикаментозной терапии предусматривается решение следующих задач:
|
Литература 1. Баркаган З.С. Патология гемостаза // Руководство по гематологии. - М., 1985.-С. 160-349. 2. Вирганский А.О. Оценка функционального состояния сердечно-сосудистой системы // Массивная эмболия легочных артерий / Савельев B.C., Яблоков Е-Г., Кириенко А.И. - М., 1990. -С. 62-88. 3. Елагин О.С. Тромбоэмболия легочной артерии // Кардиология. -1995, N3.-С. 64-75. 4. Злочевский П.М. Тромбоэмболия легочной артерии. - М.: Медицина. - 1978.-С. 127. 5. Кеннет М. Мозер. Тромбоэмболия легочной артерии// Внутренние болезни. Перевод с англ. - М., 1995, кн.6, гл.211, - С. 132-145. 6. Клочков Н.Д., Тимофеев И.В., Коваленко В.И. Анализ исходов от тромбоэмболии легочных артерий // Вестник хирургии. -1994, N5-6.-С. 101-104. 7. Лепская Е.С. Клинико-рентгенологическая диагностика инфарктов легкого. - М., 1963. - С. 160. 8. Мазаев П.Н., Куницын Д.В. Клинико-рентгенологическая диагностика тромбоэмболии легочных артерий. - М., 1979. -С. 200. 9. Некласов Ю.Ф., Качан Л.В. Первичные методические рекомендации по лечению острой эмболии легочной артерии и ее профилактике. - Л., 1980. - С. 10. 10. Подильничак М.Д., Огоновский В.К. Некоторые аспекты прогнозирования, лечения и профилактики тромбоэмболии легочной артерии // Клиническая хирургия. - 1990, N1. -С. 23-25. 11. Рзаев Н.М. Эмболии и тромбозы легочной артерии. - Баку, 1970.-С.224. 12. Рябцев В.Г., Горцев П.С. Профилактика и диагностика послеоперационных тромбоэмболических осложнений. - М., 1987. -С. 144. 13. Савельев B.C., Яблоков Е.Г., Кириенко А.И. Тромбоэмболия легочных артерий. - М., 1979. - С. 264.. 14. Савельев B.C., Яблоков Е.Г., Кириенко А.И. Массивная эмболия легочных артерий. - М., 1990. - С. 336. 15. Трубников Г.В. Тромбоэмболия легочной артерии как следствие паранеопластического синдрома у больных лимфогранулематозом. // Актуальные вопр. онкологии: Сборник науч. трудов. - Барнаул, 1992. С. 264-267. 16. Fulkerson W.J., Coleman R.E., Ravin C.E., Paltzman H.A. Diagnosis of pulmonary embolism // Arch. Intern. Med. - 1986. -Vol. 146,N5-Р.961-967. |
superbotanik.net
Реферат на тему Тромбоэмболия легочной артерии
Министерство Здравоохранения Российской Федерации Иркутский Государстввенный Медицинский Университет Кафедра госпитальной хирургии Зав кафедрой: член-корр. РАМН академик Григорьев Е.Г. Преподаватель: Зеленин Н.Р. ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АТЕРИИ Выполнил: Зеленкова С.В. Группа: 510 леч. Дата: 20.12.01 Иркутск - 2001 ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ (ТЭЛА) Тромбоэмболия легочной артерии - одна из важнейших проблем клинической медицины. Уже более ста лет она привлекает внимание исследователей. Интерес к этой проблеме проявляют не только хирурги, но и специалисты других специальностей: терапевты, рентгенологи, патологоанатомы и др., т.к. ТЭЛА является одним из самых катастрофических осложнений, которое внезапно обрывает жизнь многих больных. Изучение тромбоэмболии легочной артерии началось в позапрошлом столетии. Известно, что первое описание геморрагического инфаркта легкого принадлежит французскому ученому Лаэнеку, который назвал его "легочной апоплексией". Первым, кто указал на наличие эмболии легочной артерии, был выдающийся немецкий патолог Вирхов. Он дал этому явлению название и экспериментально доказал, что тромбы в венах нижних конечностей служат источником эмболии. Первой русской фундаментальной работой, посвященной этой проблеме, была монография И.Ф.Клейна "О тромбозе, эмболии и ихорремии", опубликованная в 1863 году. Ежегодно в мире регистрируется около 600 000 случаев эмболии легочной артерии. Согласно патологоанатомическим отчетам, у 60% больных, умерших в больницах, обнаруживают признаки тромбоэмболических заболеваний. У каждых 5 их 1000 (0,5%), умерших после большой операции, причиной смерти послужила ТЭЛА. Существенное влияние на частоту обнаружения ТЭЛА оказывает контингент больных, находящихся в лечебном учреждении. Так, в терапевтических стационарах, где преобладают больные с сердечно-сосудистыми заболеваниями, ТЭЛА встречается в 15-30% случаев. Это осложнение очень часто встречается и у хирургических больных, больных травматологического профилях. Данные литературы о частоте ТЭЛА в основном базируются на патологоанатомических исследованиях. И по данным различных авторов составляет 10-12%. В хирургических стационарах частота ТЭЛА составляет 0,1-2,3%, причём в 40-50% приводит к летальному исходу. Летальность при массивной ТЭЛА может достигать 56%.Частота ТЭЛА в зимние месяцы выше, чем летом.По данным большинства авторв, за последние годы частота ТЭЛА увеличилась в 3 - 5 раз. Однако обычно анализируются смертельные исходы или случаи массивных эмболий легочной артерии, поэтому истинная частота тромбоэмболии легочной артерии занчительно выше.Чаще всего ТЭЛА возникает у больных пожилого и старческого возраста, а при патологии нижних конечностей и таза - нередко и у молодых. Следует различать первичный тромбоз и тромбоэмболию легочной артерии, хотя во многих случаях на основании патологоанатомических данных нельзя точно разгрничить эти два заболевания. Первичный тромбоз легочной артерии обчно развивается при застое в малом круге кровообращения, при тяжелых заболеваниях легких и сердца. До сих пор еще до конца не выяснены причины, способствующие мобилизиции венозных тромбов. Имеются основания полагать, что слабая связь тромботических масс со стенкой сосуджа приводит к их отрыву и миграции в легочную артерию. Так, легко понять, почему отрыву и миграции тромбов содействует различного рода физическое напряжение. Поэтому легочная эмболия возникает в момент, когда больной после продолжительного строгого постельного режима впервые садится, встает или начинает ходить. Нередко довольно трудно, а порой и невозможно выделить из многих причин главную. Наличие самой эмболии иногда служит единственным признаком того, что у больного имеется латентно протекающий эмбологенный тромбоз.Из заболеваний, которые предрасполагают к ТЭЛА, многие авторы на первое место ставят сердечно-сосудистую патологию (атеросклероз, ревмокардит, ревмопороки, септический эндокардит), так же можно выделить заболевания вен нижних конечностей, патология органов и сосудов малого таза. Послеоперационные ТЭЛА в особенности требуют пристального внимания. Это и понятно, т.к. мало кто из хирургов не испытывал чувства глубокого огорчения и досады, когда после удачной операции, казалось бы, с благоприятным исходом больной внезапно умирает от тромбоэмболии легочной артерию. Довольно трудно выделить какой-либо вид операции, который послужил причиной ТЭЛА. Однако, наиболее часто эмболия развивается при операциях на: сосудах нижних конечностей, мочевом пузыре, женских половых органах, предстательной железе, костях таза и тазобедренном суставе. Выяснить факторы, предрасполагающие к возникновению эмбологенных форм тромбоза, не прдставляется возможным даже на большом числе наблюдений, отсюда следует заключить, что склонность венозного тромба к эмболии определяется местными, чем общими причинами. Из причин общего порядка существенное значение имеют изменения в системе гемостаза, спонтанного фибринолиза, ретракции и организации венозных тромбов. При определении степени опасности венозного тромбоза как источника эмболии клиницисты до сих пор ориентируются на время на время проявления первых признаков заболевания - чем больше этот срок, тем меньше опасность эмболии. Конечно такая закономерность существует, и очевидно, что свежий тромб, имеющий небольшую протяженность и слабую фиксацию, значительно легче может стать эмболом, чем старый. Именно на этом и основан самый распространенный способ профилактики эмболии при остром венозном тромбозе - длительный постельный режим больного (3-4 недели). Таким образом, факторами риска возникновения ТЭЛА являются все состоянеия, предрасполвгающие к тромбозу вен: 1. Длительный постельный режим 2. Пеослеоперационный период 3. Сердечная недостаточность 4. Ожирение 5. Злокачественные опухоли 6. Прием эстрогенов 7. Беременность.Смертность от ТЭЛА во время родов составляет 1,5-2,7 на 100000. 8. Тромбоцитоз после спленэктомии 9. Преклонный возраст 10. Тромбоэмболические заболевания в анамнезе 11. Тромбофилии.Наиболее часто причиной венозного тромбоэмболизма (тромбоза глубоких вен нижних конечностей и ТЭЛА) является тромбофилия - врожденная предрасположенность к возникновению венозного тромбоэмболизма. Наиболее распространенные формы тромбофилии это: · Дефицит протеина С · Дефицит протеина S · Резистентность к активированному протеину С (мутация LIEDEN) · Дефицит антитромбина III · Дефект протромбина (G 20210 А) · Гипергомоцистеинемия (мутация гена метиленгидрофолатредуктазы и др.)Пока недостаточно изучен механизм, который приводит к патоморфологическим нарушениям и смерти при ТЭЛА. Надо полагать, что катастрофа возникает вследствие сочетания по крайней мере трех факторов: механического, нервного и гуморального. Рассмотрим механический фактор: Ументьшение площади поперечного сечения сосудов, отходящих от легочного ствола - основной механизм. В результате увеличиваектся сопротивление сосудов малого круга кровообращения, развиваются легочная гипертнезия, острая правожелудочковая недостаточность и тахикардия. Снижается сердечный выброс и артериальное давление. Наличие и вырадженость всех этих последствий зависят от размера тромьа и функциональных резервов сердца. В отсутствие сердечно - легочной патологии ументшение площади сечения легочных сосудов на 25% не влечет за собой особых последствий. Сердечный выброс не изменяется или увеличивается, пока площадь поперечного сечения составляет 50 % от нормы. Вентиляция неперфузируемых участков легких приводит к гипоксемии и нарушениям ритма сердца. При недостаточности коллатерального кровотока по бронхиальным артериям может возникнуть инфаркт легкого (осложняет около 10% ТЭЛА). Действие гуморпальных факторов: не зависит от размеров тромба, поэтому эмболия неболтшой ветви легочной артерии может привести к значительным нарушениям гемодинамики. Тромбоциты, оседающие на поверхности свежего тромба, высвобождабт серотонин, тромбоксан, гистамин и друие вещества, выхзывающие сужение легочных сосоудов и просвета бронхов. КЛАССИФИКАЦИЯ ТЭЛА I) по локализации: 1. Тромбоэмболия мелких ветвей легочной артерии, которая чаще бывает с двух сторон или справа и никогда не приводит к смерти. 2. Тромбоэболия долевых и сегментарных ветвей легочной артерии, которая заканчивается смертью около 6% случаев 3. Массивная тромбоэмболия легочной артерии, при которой эмбол чаще локализуется в обеих главных ветвях легочной артерии. При массивной тромбоэмболии молниенсная смерть наступает у 60 - 75 % больных. Однако у 35% больных массивной трьомбоэмболии предшествует микроэмболии ветвей легочной артерии. II) по объему поражения легочного русла: 1. Массивная - эмболия ствола и главных ветвей легочной артерии 2.Субмассивная - эмболия долевых ветвей легочной артерии с выключением более, чем 45% сосудистого русла легких. Эмболия ветвей легочной артерии, которая вызывает суммарное уменьшение перфузии в объеме меньше, чем одно легкое. III) по течению заболевания (Н.А. Рзаев - 1970) I форма - молниеносная, при которой смерть больного наступает внезапно в течение первых 10 минут от острой асфиксии или остановки сердца. II форма - острая, с внезапным началом в виде сильных болей за грудиной, затруднением дыхания (больные не могут глубоко вдохнуть) и коллапса. Обычно больные умирают в течение первых суток. III форма - подострая, развивается постепенно и проявляется в виде инфаркта легкого. Исход этой формы зависит от основной причины заболевания. IV форма - хроническая, не имеет внезапного начала и проявляется симптомами легочно - сердечной недостаточности. Причинами являются чаще тромбозы, чем тромбоэмболии. Клиническое проявление - инфаркты легкого. Исход определяется характером и тяжестью основного заболевания. Клиническая картина Клиническое течение ТЭЛА достаточно вариабельно. Наиболее частыми симптомами является внезапно появившаяся одышка, учащенное дыхание, бледность, чаще цианоз, набухание шейных вен, тахикардия, артериальная гипотензия. Могут быть загрудинные боли, кашель, кровохарканье. Каждый врач должен знать о трудностях диагностики ТЭЛА. Актуальность проблемы ТЭЛА обуславливается не только тяжестью заболевания и высокой летальностью, но и трудностями диагностики. Признаки ее неспецифичны и могут наблюдаться при многих заболеваниях. Из клинических признаков наиболее часто наблюдаются одышка (в 85% случаев), тахикардия (в 58% случаев). Болевой синдром встречается в нескольких вариантах: могут напоминать стенокардию, могут усиливаться при кашле и дыхании или локализоваться в правом подреберье. Одышка является одним из наиболее частыз и постоянных симптомов. Она может возникать в качестве компенсации уменьшения сердечного выброса и перфузии легких, но вместе с тем, может быть и рефлекторной. Одышка, как правило, появляется внезапной. С такой же частотой у больных возникают сильные боли или плеврального, или коронарного происхождения. Очень сильная коронарная боль может быть вызвана рефлекторным спазмом или перегрузкой и перерастяжением правого желудочка. Острые плевральные боли связаны с инфарктом легкого и усиливаются при кашле, глубоком вдохе, они обычно локализуются в задне - нижних отделах грудной клетки. Следующий симптом - внезапный цианоз - который бывает чаще на лице, верхней части туловища и конечностях. Кашель с выделением кровянистой мокроты наблюдается обычно позже, при развитии инфаркта легкого, и бывает лишь у 12 - 20 % больных. Некоторые авторы выделяют: 12. легочно - плевральный синдром ( одышка, плевральная боль, цианоз, кашель с кровянистой мокротой) 13. Кардиальный синдром (боль за грудиной или чувство дискомфорта, тахикардия и гипотония вплоть до коллапса) 14. Церебральный синдром (потеря сознания гемиплегия, судороги) 15. Почечный синдром (секреторная анурия) 16. Редко наблюдаемый абдоминальный синдром (боли в правом верхнем квадранте живота), который может быть следствием острого застоя в печени с растяжением глиссоновой капсулы или плевритом. При аускультации нередко определяется усиление II тона над легочной артерией. Косвенные признаки: а) биохимический анализ крови: увеличение ЛДГ и общего билирубина при нормальной активности АсАТ в сыворотке (в 12% случаев) б) газы артериальной крови: рО2 меньше 80 мм рт ст при нормальном или пониженном рСО2 ( в 909% случаях) На ЭКГ наиболее часто отмечаются признаки перегрузки правых отделов сердца. Рентгенологическая картина наиболее показательна при инфарктной пневмонии, но характерная картина наблюдается только в 37% случаев.Рентгенологические признаки, заключающиеся в увеличении размеров проксимальных отделов легочной артерии, обеднении периферического рисунка, а так же поднятии купола диафрагмы, являются достаточно патогномоничными, однако имеются не во всех случаях. В диагностике помогает вентяляционно-перофузионное радинуклеарное исследование. Диагностическая ценность этого исследования снижается при обтурации мелких ветвей. Золотым стандартом в диагностике ТЭЛА является легочная артериография. Однако приблизительно в 2% случаев при ТЭЛА мелких ветвей наблюдается нормальная ангиограмма. Диагноз ТЭЛА устанавливается на основе комплекса клинического, инструментального и лабораторного исследования. И тем не менее, в 65% случаев тромбоэмболия ветвей легочной артерии не диагностируется вообще, а при жизни диагноз был поставлен только у 34% пациентов. В тоже время, в 9% случаев имеет место ее ложноположительная диагностика. Профилактическое лечение ТЭЛА. Профилактика включает применение немедикаментозных мероприятий, такие как · ранняя активация больных в послеоперационный период при инфаркте миокарда, инсультах · бинтование эластическим бинтом голеней и бедер · перемежающая пневматическая компрессия манжетами, наложенными на голени. Медикаментозное: · антикоагулянтная терапия (гепарины, оральные антикоагулянты (ОАК)), · установка кава-фильтров.
Выбор метода профилактики и продолжительность антикоагулянтной терапии зависит от наличия факторов риска и врожденной предрасположенности. Проведение профилактики основывается на следующих положениях: · При бессимптомном носительстве пожизненная профилактика кумаринами может принести больше вреда, чем пользы · При наличии ситуаций, связанных с высоким риском, - показано курсовое применение антикоагулянтных препаратов · При повторном эпизоде ТЭЛА - необходимо пожизненное применение ОАК.
При возникновении ситуаций, связанных с высоким риском развития венозного тромбоэмболизма (см. факторы риска), профилактика начинается с применения гепарина. Нефракционированный гепарин вводится в дозе 5000 ЕД каждые 8-12 ч, низкомолекулярный гепарин -1 раз в сутки в дозе, определенной в зависимости от массы тела больного (Фраксипарин 0,3-0,6 МЕ/кг, Клексан 0,2-0,4 МЕ/кг, фрагмин 25000-5000 МЕ/кг). В случае хирургического вмешательства гепарины назначаются за два дня до операции, а при тяжелых травмах и иммобилизации - с момента поступления в стационар. Продолжительность гепаринотерапии составляет 7 - 10 дней.
Очевидно, что раздел немедикаментозной профилактики ТЭЛА необходимо, наряду с использованием бинтования эластичным бинтом, включить применение специальных чулок и колгот (причем оговорить сдавливающий потенциал - более 150 Den), что несомненно значительно удобнее для пациента. Применение тромболитиков в очень осторожном режиме достаточно понятно, однако зачастую времени для такой осторожности может нехватить. Вы же одним из показаний для применения тромболитиков указываете кардиогенный шок... коллега из Донецка справедливо напоминает о рефлекторном развитии спазма легочных и коронарных сосудов, следовательно нарушения сердечного ритма ( в том числе фатальные). Стоит рассмотреть ускоренные методики введения тромболитиков, которые завоевывают себе достойное место при тромболизисе у больных с острым инфарктом миокарда (болюсное введение стрептокиназы 750 тыс. Ед. за 10 минут или 1500 тыс. Ед. за 20 минут, капельное введение 100 мг ТАП за 30 минут ). За 2-3 дня до окончания гепаринотерапии назначают оральные антикоагулянты. Применение ранее общепринятых ударных доз ОАК не рекомендуется по причине реальной угрозы как тромбообразования (вследствие более быстрого снижения уровня протеина С в сравнении с фактором II), так и кровотечения (особенно в сочетании с гепарином). Поэтому терапию ОАК следует начинать с установленных поддерживающих доз: 2,5 -10 мг для варфарина, 0,75-6 мг для маркумара, 1-8 мг для Синкумара. Продолжительность терапии ОАК определяется наличием тромбофилии: · При непродолжительном первичном эпизоде венозного тромбоэмболизма при наличие явной причины (кроме врожденных тромбофилий) - 3 мес. · При первичном эпизоде венозного тромбоэмболизма при тромбофилии - 9 мес. · При повторном эпизоде венозного тромбоэмболизма и тромбофилии применение ОАК пожизненное Установку кава-фильтров следует проводить только при наличии противопоказаний к проведению терапии оральными антикоагулянтами у больных с проксимальными тромбозами глубоких вен и/или ТЭЛА. При тромбофилии в беременности в третьем триместре, а также в послеродовой период используется низкомолекулярный гепарин, а оральные антикоагулянты в течение 6 месяцев после родов. Всем больным, имеющим более двух факторов риска, рекомендуется ношение эластичных чулков.
ЛЕЧЕНИЕ Выбор метода лечения ТЭЛА крайне сложен. Многие считают, что при массивной эмболии может спасти больного только эмболоэктомия из легочной артерии, тогда как при эмболии мелких артерий достаточной эффективной бывает антикоагулянтная либо тромболитическая терапия. Основной целью лечебных мероприятий при ТЭЛА является нормализация перфузии легких и предотвращение развития тяжелой хронической постэмболической легочной гипертензии. Восстановление проходимости легочных артерий осуществляется консервативным и хирургическим путем. Консервативное лечение предусматривает лизис тромбоэмбола и профилактику нарастающего тромбоза и повторной тромбоэболизациии. Обязательным условием проведения тромболитической терапии является надежная верификация диагноза, возможность осуществления лабораторного контроля. Лечение стрептокиназой начинают с внутривенного ведения 250000 ЕД препарата за 30 мин, затем в течение 12-24 часов продолжается инфузионная терапия со скоростью 100 000 ЕД/ч. Урокиназа вводится первоначально в дозе 4400 ЕД/кг, затем по 4400 ЕД/кг/ч на протяжении 12 часов. Тканевой активатор плазминогена назначается в дозе 100 мг, который вводится в течение 2 часов. Эффективность тромболитической терапии оценивается по клиническим и ЭКГ- признакам, по данным повторных исследований перфузионной сцинтиграфии легких и результатам ангиографии. После окончания тромболитической терапии проводится гепаринотерапия. Первоначально вводят в/в струйно 5000-10000 ЕД нефракционированного гепарина. В дальнейшим переходят на непрерывное введение этого препарата в дозе 1300 ЕД/ч или подкожное введение по 5000 ЕД каждые 4ч. Суточная доза должна составлять 30000 ЕД. продолжительность гепаринотерапии составляет 7-10 дней, так как в эти сроки происходит лизис эмбола. Низкомолекулярный гепарин первоначально вводится в дозе 80 ЕД/кг, затем 18 ЕД/кг/ч. Адекватность гепаринотерапии осуществляется путем определения АЧТВ (см. лабораторный контроль). За 3-5 дней до предполагаемой отмены гепарина назначают антигоакулянты непрямого действия (дозы, продолжительность и см. профилактику).
Лабораторный контроль при проведении антикоагулянтной терапии Лабораторный контроль при проведении тромболизиса включает определение концентрации фибриногена, тромбинового времени. Лабораторный контроль гепаринотерапии осуществляется путем определения активированного частичного тромбопластинового времени (АЧТВ). Этот показатель должен увеличится в 1,5-2 раза от исходного. АЧТВ должно определяться через 4-6 ч после введения первоначальной дозы. Если АЧТВ увеличилось менее чем в 1,5 раза, то дополнительно внутривенно стройно вводят 2000-5000 ЕД гепарина и увеличивают скорость инфузии на 25%. Если АЧТВ увеличено более чем в 1,5-2 раза от исходного скорость инфузии снижают на 25%. Определение АЧТВ при изменения дозы проводится через 6-10 ч. после изменения до достижения необходимых значений. На протяжении всей гепаринотерапии уровень АЧТВ определяется ежедневно. Учитывая возможность развития гепарин индуцированной тромбоцитопении также необходимо подсчитывать количество тромбоцитов (до введения гепарина и на 5-7 день). При снижение количества тромбоцитов более чем на 50% от изначального значения, гепарин необходимо отменить. В случае использования низкомолекулярных гепаринов определение АЧТВ не требуется. Адекватная доза непрямых антикоагулянтов контролируется путем определения протромбинового времени и расчета международного нормализованного отношения (МНО). Это отношение протромбинового времени больного к протромбиновому времени донора, возведенное в степень международного индекса чувствительности того тромбопластина, который использовался при определении протромбинового времени. Данный показатель должен быть равен 2-3 единицам и поддерживаться на этом уровне в течение всей терапии непрямыми антикоагулянтами. В начале терапии определение МНО проводится 1 раз в 2 дня, далее 1 раз в неделю. Иногда у больных с острой эмболией легочной артерии бывает противопоказанной антикоагулянтная и тромболитическая терапия. Назначать антикоагулянты при наличии противопоказаний нельзя. К ним относится: 1. тяжелые повреждения головного мозга; 2. онкопатология с потенциальной возможностью развития кровотечения; 3. тромбоцитопения; 4. туберкулёз лёгких; 5. тяжёлые хронические заболевания паренхимы печени и почек с функциональной недостаточностью. У некоторых больных наблюдается рецидив заболевания, несмотря на адекватную консервативную терапию. В подобных случаях возникает вопрос о возможном оперативном вмешательстве, направленном на прерывание кровотока по руслу нижней полой вены. Многие хирурги предпочитают перевязку нижней полой вены ниже впадения почечных вен, в то же время другие используют различные методы пликации на этом уровне. Большой интерес проявляют к использованию зонтичных фильтров, вводимых в нижнюю полую вену с помощью специального проводника. Для правильной оценки эффективности подобных процедур необходимо накопление достаточного опыта. Острая эмболия легочной артерии может привести к тяжелому шоку и даже остановки сердца. В этих случаях для реанимации и стабилизации кровообращения можно использовать вспомогательное кровообращение с введением канюль в бедренную артерию и вену под местной анестезией. Эмболоэктомию производят под интубационным наркозом. Выполняют срединную стернотомию, неполное искусственное кровообращение переводят в полное путем дополнительного канюлирования верхней полой вены и окклюзией с помощью турникета нижней полой вены. В основном стволе легочной артерии делают продольный разрез и удаляют доступные тромботические массы. Затем вскрывают обе плевральные полости и производят массаж легких с тем, чтобы выдавить дистально расположенные тромботические массы в ствол легочной артерии, откуда их уже можно удалить с помощью отсоса. Отверстие легочной артерии ушивают непрерывным швом после предварительного удаления воздуха из правых отделов сердца и артерии. Прекращают искусственное кровообращение, как только сердце и легкие оказываются в состоянии поддерживать адекватное дыхание и кровообращение. Операцию заканчивают перевязкой либо пликцией нижней полой вены. Список литературы: 1. В.С. Савельев, Е.Г.Яблоков, А.И.Кириенко "Тромбоэмболия легочной артерии"- М., Медицина, 1975 2. А.В.Покровский " Клиническая ангиология" - М., Медицина, 1979. 3. В. С. Савельев, Е.Г. Яблоков "Массивеая эмболия легочных артерий" - М., Медицина, 1990 4. Р.Конден, Л.Найхус "Клиническая хирургия" - М., Практика, 1998. 5.Б.В.Петровский, А.А.Бунятян и др. "Экстренная хирургия сердца и сосудов - М., Медицина - 1980 6.http://www.hemostas.ru/wwwboard/messages/13.html - Ройтман Е.В.7.http://www.hemostas.ru/wwwboard/messages/14.html - Латышев П. 8. http://www.hemostas.ru/wwwboard/messages/15.html - Кузнецова И.В. 9.http://trauma.by.ru/o11.htm - Талако Т. Е.
bukvasha.ru
Реферат - Тромбоэмболия легочной артерии
Тромбоэмболией легочной артерии (ТЭЛА) называется закупорка артериального русла легкого тромбом, образованным в венозной системе, правом предсердии или в правом желудочке.
ТЭЛА по праву считается одним из тяжелейших и катастрофически протекающих острых сосудистых заболеваний, сопровождающихся высокой летальностью.
У подавляющего числа больных (более 90%) источником ТЭЛА является тромбоз в системе нижней полой вены. Чаще всего он локализуется в глубоких венах нижних конечностей и магистральных венах таза.
Наибольшая вероятность развития ТЭЛА наблюдается у тучных, рыхлых больных пожилого и старческого возраста после обширных хирургических вмешательств и длительной иммобилизации. Нередко в таких случаях ТЭЛА провоцируется физическим напряжением, натуживанием. К факторам риска развития ТЭЛА относятся также инфаркт миокарда, пороки сердца, сердечная недостаточность, мерцательная аритмия, злокачественные новообразования, обширные ожоги, полицитемия, сепсис, применение мочегонных средств.
Патофизиологические изменения при ТЭЛА определяются острой окклюзией легочно-артериального русла и легочно-артериальной гипертензией, что ведет к повышенной нагрузке на правый желудочек, а в ряде случаев к его острой недостаточности. Снижение легочного кровотока более, чем на 75% представляет собой критический уровень эмболической обструкции, поскольку приводит к депрессии сердечной деятельности, следствием чего являются падение сердечного выброса, системная гипотензия, шок и асистолия.
В зависимости от калибра эмболизированного сосуда выделяют три основных синдрома.
1. Тромбоэмболия крупных ветвей легочной артерии. Возможно развитие внезапной смерти или острого легочного сердца. Острое легочное сердце проявляется внезапной одышкой, цианозом, правожелудочковой недостаточностью, артериальной гипотензией.
2. Тромбоэмболия долевых и сегментарных артерий может привести к развитию инфаркта легкого, который проявляется одышкой, плевральными болями, иногда кровохарканьем.
3. Множественная тромбоэмболия мелких ветвей легочной артерии, чаще рецидивирующая, ведет к развитию хронической легочной гипертензии, морфологическим субстратом которой является тромботическая артериопатия мелких ветвей легочной артерии. Синдром хронической легочной гипертензии проявляется одышкой, набуханием шейных вен, гепатомегалией, асцитом, отеком ног.
Клиническая картина ТЭЛА варьирует в очень широких пределах, кроме того симптоматика, похожая на ТЭЛА, может объясняться наличием других заболеваний. Вот почему необходимо применение инструментальных методов исследования. Наиболее доступными из них являются электрокардиография и обзорная рентгенография грудной клетки.
Возникающее при ТЭЛА препятствие легочному кровотоку приводит к повышению работы правого желудочка и проявляется элетрокардиографическими признаками острого легочного сердца. Вместе с тем отсутствие ЭКГ-проявлений не исключает наличия ТЭЛА.
Обзорная рентгенография грудной клетки позволяет исключить другую, нежели эмболия, патологию легких, сходную с ней по симптоматике. Дилатация правых отделов сердца, высокое стояние диафрагмы на стороне окклюзии и обеднение легочного сосудистого рисунка указывают на массивную эмболию. К сожалению, почти у трети больных рентгенологические признаки вообще отсутствуют.
Более информативны ультразвуковые и радиоизотопные методы исследования.
Эхокардиография позволяет обнаружить возникновение острого легочного сердца, оценить выраженность гипертензии малого круга кровообращения, визуализировать тромбоэмболы в полостях сердца и в главных легочных артериях. Вместе с тем отрицательный результат не исключает диагноза легочной эмболии.
Перфузионное сканирование легких позволяет полностью исключить ТЭЛА при отсутствии нарушений легочного кровотока на сцинтиграммах, выполненных как минимум в 2-х проекциях.
Контрастная магнитно-резонансная томография позволяет выявить внезапный «обрыв» ветви легочной артерии и зону «обеднения» легочного кровотока, что является критерием достоверного диагноза.
Комплексное рентгеноконтрастное исследование, включающее зондирование правых отделов сердца и ангиопульмонографию является наиболее информативным методом верификации ТЭЛА и позволяет решить диагностические проблемы.
Целью лечения больного с ТЭЛА является предотвращение гибели пациента в острой стадии заболевания и развития хронического легочного сердца в отдаленном периоде. В задачи лечения входят: 1) восстановление проходимости легочных артерий, 2) нормализация гемодинамики и газообмена; 3) предотвращение рецидива заболевания.
Объем и содержание интенсивной терапии определяется состоянием больного, которое во многом зависит от степени поражения легочно-сосудистого русла и варианта течения заболевания.
При небольшом объеме васкулярной обструкции и незначительных клинических проявлениях достаточно адекватной антикоагулянтной терапии. Антикоагулянты предупреждают повторное тромбообразование и усиливают спонтанный фибринолиз. Целесообразно использовать низкомолекулярные гепарины, которые в отличии от нефракционированного гепарина легче дозируются, реже дают геморрагические осложнения, меньше влияют на функцию тромбоцитов. Они обладают более продолжительным действием и не требуют частого лабораторного контроля системы гомеостаза. Низкомолекулярные гепарины вводят 2 раза в сутки под кожу живота. Длительность гепаринотерапии 5-10 дней. Перед снижением дозы гепарина назначают непрямые антикоагулянты, которые, после подбора индивидуальной дозы, больной должен принимать не менее 6 месяцев для предотвращения рецидива флеботромбоза и ТЭЛА.
Использование тромболитической терапии при периферической локализации эмболической окклюзии в большинстве случаев не оправдано по соотношению риск/польза. Легочная гипертензия в данном случае не приближается к опасному уровню, и благоприятный исход не вызывает сомнений. В то же время велик риск геморрагических и аллергических осложнений, а стоимость тромболитических препаратов достаточно высока. Показания к тромболитической терапии следующие: шок, острая правожелудочковая недостаточность, выраженная легочная гипертензия и повторные эпизоды тромбоэмболии.
В клинической практике обычно используют препараты стрептокиназы, несмотря на частое возникновение аллергических реакций. Предварительно вводят 30 мг преднизолона, после чего инфузируют 250000 ЕД стрептокиназы в течение 30 мин. Далее препарат назначают в дозе 100.000 ЕД в 1 ч. Продолжительность лечебного тромболизиса составляет обычно 2-3 суток. Урокиназа лишена антигенных свойств, но применяется редко из-за высокой стоимости.
Использование тромболитиков высокоэффективно, но не безопасно, так как приводит к выраженной кровоточивости с возможными геморрагическими осложнениями. В связи с этим не следует проводить тромболизис в ближайшем послеоперационном, послеродовом или посттравматическом периодах (первые 10 суток). После завершения курса тромболитической терапии лечение антикоагулянтами проводят по обычной схеме.
При проведении лечения рассматриваемой категории больных помимо представленных специфических средств, естественно, необходим ряд других компонентов комплексной интенсивной терапии, направленных на нормализацию гемодинамики, газообмена и других важнейших функций.
Прогрессирующее ухудшение состояния больных с массивной ТЭЛА может потребовать экстренного вмешательства. К сожалению, подобная операция сопровождается очень высокой летальностью (до 90%). Оптимальным является выполнение эмболэктомии в условиях экстракорпорального кровообращения, хотя летальность после подобных операций составляет около 50%.
Всем больным, имеющим вероятность развития ТЭЛА, показана профилактическая терапия.
Из методов хирургической профилактики наибольшее распространение получило введение в просвет нижней полой вены специального фильтра. Показаниями для установки фильтра являются документированный тромбоз глубоких вен выше коленного сустава или ортопедические операции с высоким риском в сочетании с одним из перечисленных ниже факторов:
— наличие противопоказаний к антикоагулянтной профилактике и терапии;
— развитие ТЭЛА на фоне введения антикоагулянтов;
— тяжелые заболевания легких;
— легочная гипертензия.
Обычно используется фильтр Гринфилда. Конусообразный фильтр («зонтик») вводят чрезкожно через бедренную вену. Как только фильтр оказывается ниже места отхождения почечных вен, его распускают, и он прикрепляется к полой вене своеобразными крючками. Ось фильтра располагается по току крови, а «зонтик» способен задержать тромб.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|