Гибридизация атомных орбиталей. Sp гибридизация реферат
Концепция гибридизации — реферат
Гибридизация
Модель молекулы метана, образованной sp3-гибридными орбиталями.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации
Схема гибридизации атомных орбиталей атома углерода.
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л. Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л. Полинг не был удовлетворён введением σ,π – описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л. Полинг развил теорию изогнутой химической связи, учитывающую кулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи – Найхолма. Первое и наиболее важное правило, которое формулировалось следующим образом:
"Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т. е. электронные пары ведут себя так, как если бы они взаимно отталкивались».
Второе правило состоит в том, что "все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра".
Виды гибридизации
sp-гибридизация
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация
sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация
sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
Тип гибридизации | Число гибридных орбиталей | Геометрия | Структура | Примеры |
sp | 2 | Линейная | | BeF2, CO2, NO2+ |
| sp2 | 3 | Треугольная | | BF3, NO3-, CO32- |
| sp3 | 4 | Тетраэдрическая | | Ch5, ClO4-, SO42-, Nh5+ |
| dsp2 | 4 | Плоскоквадратная | | Ni(CO)4, XeF4 |
| sp3d | 5 | Гексаэдрическая | | PCl5, AsF5 |
| sp3d2 | 6 | Октаэдрическая | | SF6, Fe(CN)63-, CoF63- |
Литература:
- Паулинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М.: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — 278 с.
freepapers.ru
Реферат : Гибридизация орбиталей

Гибридизация орбиталей
3.3.1. Вращательные движения определяют важнейшие черты стационарных состояний электронных оболочек и ядер aтомов и молекул. Некоторые приемы теоретического анализа состояний атомно-молекулярных систем особенно наглядно можно исследовать на примере простейшей модели вращения – плоского ротатора. Мы уже рассмотрели замену комплексных орбиталей действительными волновыми функциями, допускающими наглядное графическое представление. Следующий прием построение гибридных орбиталей, каждая из которых уже не обладает центральной симметрией, а напротив, отличается ярко выраженной концентрацией в некотором выделенном направлении. Заглядывая вперед, отметим, что гибридные электронные орбитали атомов играют важнейшую роль в образовании химических связей.
Эффект гибридизации позволяет наглядно проиллюстрировать применение принципа суперпозиции состояний, чрезвычайно важного для химии и для всей квантовой механики.
3.3.2. Гибридизация – это смешение состояний с различными значениями момента импульса. Например, гибридные орбитали можно образовать из волновых функций σ- и π-типа, но из орбиталей только π-типа – нельзя.
Смешивая орбитали разных уровней, удается построить гибкие формы орбиталей, пригодные для описания каких-либо физических или химических явлений, рассмативая их как возмущение исходных состояний системы. С этой целью образуют линейные комбинации из волновых функций, принадлежащих различным уровням. Энергии гибридизующихся орбиталей различаются, но это отличие должно быть невелико.
3.3.3. На основе исходного набора волновых функций – тройки орбиталей ( ), принадлежащих двум низшим ypoвням плоского ротатора, возможны два предельных способа построения гибридов. В первом из них гибридизуются только σ- и лишь одна из двух π-орбиталей, тогда как вторая остается несмешанной. Например, образуем ниже гибрид из σ- πс, не затрагивая πs. Назовем этот тип смешения σπ-гибридизацией. Во втором случае смешиваются все три исходные орбитали, т.е. происходит σπ2-гибридизация. Число гибридных функций всегда равно числу исходных смешивающихся орбиталей.
), принадлежащих двум низшим ypoвням плоского ротатора, возможны два предельных способа построения гибридов. В первом из них гибридизуются только σ- и лишь одна из двух π-орбиталей, тогда как вторая остается несмешанной. Например, образуем ниже гибрид из σ- πс, не затрагивая πs. Назовем этот тип смешения σπ-гибридизацией. Во втором случае смешиваются все три исходные орбитали, т.е. происходит σπ2-гибридизация. Число гибридных функций всегда равно числу исходных смешивающихся орбиталей.
В обоих случаях исходные орбитали образуют ортонормированный базисный набор (2.4) или кратко базис, и в этом смысле совершенно подобны некоторым единичным векторам. Орбитали базисного набора удобно представить в упорядоченном виде вектора-столбца или вектора-строки, вводя при этом унифицированные обозначения
 ,
,
или равноценно
 , где
, где 
3.3.4. Образование гибридных орбиталей представляет собой смешение исходных базисных орбиталей, т.е. их линейную комбинацию. Численные коэффициенты при базисных функциях определяют их вклады в составе гибрида и, как правило, находятся из простых соображений.
Возможные варианты образования ортонормированных гибридных орбиталей представим схемой:
 (3.42)
(3.42)  (3.43)
(3.43)
В матричной форме эти выражения примут вид:

 (3.44)
(3.44)
Для каждой из гибридных i-орбиталей алгебраическая связь между коэффициентами при компонентах ортонормированного базиса (в нашем случае  ) идентична обычной связи между проекциями ортонормированных векторов:
) идентична обычной связи между проекциями ортонормированных векторов:
 для i=1, 2
для i=1, 2  i=1, 2, 3, j ≠ i
i=1, 2, 3, j ≠ i
Согласно постулату 4 (уравнение 2.29) квадраты коэффициентов наделены определенным смыслом. Каждый из них определяет вероятность “чистого” исходного состояния в составе смешанного.
3.3.5. Для простоты и определенности образуем такие гибриды, при смешении 2-х волновых функций (σ и πс), вес каждой из них в составе гибридных орбиталей одинаков, т.е. равен 1/2:
 .
.
Последнее соотношение приводит к выводу:
 (3.45)
(3.45)
откуда для разных значений i=1, 2 получаем равноценные возможности, т.е. два вектора

Следовательно, гибридные орбитали имеют вид:
 (3.46)
(3.46)
Подставив в (3.46) явные выражения базисных векторов (336) и (3.40), получим гибридные орбитали как функции полярного аргумента:
 (3.47)
(3.47)
На полярных графиках гибридных орбиталей (рис. 6) наглядно представлена их ориентированность. Основная часть каждой орбитали сконцентрирована в больших лепестках, противоположно направленных в разные стороны от полюса – центра вращения.
3.3.6. Рассмотрим теперь более сложный случай σπ2-гибридных орбиталей. Полагая  и выбирая для сi1 арифметическое значение корня, т.е.
и выбирая для сi1 арифметическое значение корня, т.е.  , мы неизбежно сохраняем свободу выбора значений сi2 и сi3, которая ограничена только условием
, мы неизбежно сохраняем свободу выбора значений сi2 и сi3, которая ограничена только условием
 . (3.48)
. (3.48)
Введем тригонометрическую постановку, удовлетворяющую условию (3.48):
 ,
,  . (3.49)
. (3.49)
Тогда общее выражение для гибридных орбиталей примет вид:
 (3.50)
(3.50)
Линейная комбинация орбиталей πс и πs в составе ξi представляет собой также πс-орбиталь, ось которой повернута под углом к исходному координат-ному лучу, так как:
 . (3.51)
. (3.51)
На этом основании из (3.50) получается общая формула для σπ2-гибридных волновых функций:
 ; i=1, 2, 3
; i=1, 2, 3
Один из трех углов αi можно выбрать произвольно, но остальные будут определяться из условия ортогональности гибридных орбиталей. Без потери общности положим α1=0 и получим
 , (3.53)
, (3.53)
 . (3.54)
. (3.54)
Найдем углы α2,3, используя ортогональность гибридных функций (1.14):

Откуда следует
 и с учетом ортонормированности базиса, т.е. ‹σ|σ›=1; ‹σ|πс›=0 (независимо от ориентации πс-функции) получаем уравнение:
и с учетом ортонормированности базиса, т.е. ‹σ|σ›=1; ‹σ|πс›=0 (независимо от ориентации πс-функции) получаем уравнение:

Совершим равносильные преобразования


В итоге получаем искомое тригонометрическое уравнение
 и (3.57)
и (3.57)
 . (3.58)
. (3.58)
Таким образом, все три гибридные орбитали ориентированны вдоль трех лучей, направленных под углом 1200 друг к другу.
3.3.7. Завершая расчеты волновых функций σπ- и σπ2-гибридов, изобразим полярные диаграммы гибридных орбиталей и уровни энергии.
3.3.8. Покажем, что энергия смешанного гибридного состояния отличается от энергий исходных чистых состояний и является их средневзвешенной величиной. Для расчета используем исходный гамильтониан плоского ротатора, для которого σ- π-орбитали являются собственными функциями.
Расчитывая уровни σπ- и σπ2-гибридов, мы имеем возможность продемонстрировать компактность и простоту математических выкладок, основанных на операторных уравнениях с использованием бра- и кет-символов скалярных произведений – интегралов.
Обратимся к 5-му постулату, на основании которого производится расчет средних значений динамических переменных. Энергия σπ-гибрида равна:



 . (3.59)
. (3.59)
Уровень σπ-гибрида оказался дважды вырожденным и лежащим точно посередине между исходными уровнями σ- и π-орбиталей. При выводе использованно свойство ортонормированности базиса: ‹σ|σ›=1; ‹σ|π› = ‹π|σ› = 0
3.3.9. Энергия σπ2-гибрида рассчитывается аналогично; для краткости записи введем обозначение  и получим:
и получим:



 (3.60)
(3.60)
Здесь гибридный уровень трижды вырожден и лежит ближе к π-уровню, котоpый представлен в формуле (3.60) со вдвое большим весом по сравнению с Еσ.
Информация, полученная нами в этом разделе, окажется очень полезной при качественном анализе химической. связи и теории валентности.
3.4. Совместные измерения динамических переменных. Коммутация операторов и соотношения неопределенностей Гейзенберга.
3.4.1. Вновь обратимся к анализу измерений. На основе результатов, полученных в разделах 2.2.3, 2.3.2 и 3.2.2, мы в состояниирешить очень важную проблему, связанную с совместными измерениями различных динамических переменных. Исследуем эту проблему на основе анализа операторных уравнений, имитирующих акты измерений. Последовательному измерению двух величин λ и μ соответствует произведение связанных с ними операторов  и
и  , т.е. их последовательное выполнение. Запись
, т.е. их последовательное выполнение. Запись  означает, что раньше измеряется величина μ, а затем λ. И, обратно, запись
означает, что раньше измеряется величина μ, а затем λ. И, обратно, запись  отвечает первичному измерению величины λ и затем – величины μ. Таким образом правило о последовательности выполнения операторов таково: произведение
отвечает первичному измерению величины λ и затем – величины μ. Таким образом правило о последовательности выполнения операторов таково: произведение  означает, что сначала на функцию действует оператор, стоящий непосредственно слева от функции, т.е.
означает, что сначала на функцию действует оператор, стоящий непосредственно слева от функции, т.е.  , в результате чего получается новая функция, над которой выполняется преобразование, диктуемое оператором
, в результате чего получается новая функция, над которой выполняется преобразование, диктуемое оператором  .
.
3.4.2. Вопрос о совместности измерений двух величин сводится к тому, можно ли без последствий изменять порядок измерений. Если результаты не зависят от последовательности измерений, то операторные схемы  и
и  должны быть эквивалентными, а их разность будет нулевой:
должны быть эквивалентными, а их разность будет нулевой:
 , (3.61)
, (3.61)
или, собирая влево от функции все операторы, получим:
 . (3.62)
. (3.62)
Формула (3.62) называется коммутационным (перестановочным) соотношением, а разность произведений операторов, записанных в разной последовательности, носит название коммутатора
 . (3.63)
. (3.63)
3.4.3. Коммутатор равен нулю для величин, которые могут наблюдаться одновременно. Коммутирующие операторы обладают одинаковыми наборами собственных функций. Если же коммутатор отличен от нуля, то совместное измерение величин не имеет смысла, т.е. такой прибор в принципе невозможно построить.
3.4.4. Рассмотрим одновременные измерения величин, у которых произведение их размерностей совпадает с размерностью константы Планка ([энергия]·[время]). Таковыми являются:
а) импульс и координата в одномерном поступательном движении;
б) проекция момента импульса на ось и точное положение, ротатора на орбите при плоском вращении, определяемом углом φ;
в) энергия и время у нестационарной системы.
Для этих трех случаев составим коммутаторы, пользуясь формулами (2.10), (3.24) и (2.19). На основании уравнения (2.19) оператор гамильтона  можно заменить оператором
можно заменить оператором  . Получаем:
. Получаем:
 , (3.64)
, (3.64)
 , (3.65)
, (3.65)
 (3.66)
(3.66)
В случае (3.66) волновая функция, на которую действует коммутатор, должна содержать временную часть.
Посмотрим, каков результат действий этих коммутаторов на волновую функцию на примере (3.64):

 .
.
Таким образом, исследуемый коммутатор  равен
равен
 . (3.67)
. (3.67)
Согласно равенству (3.67), во всех математических выражениях, где можно произвести группировку операторов  , приводящую к коммутатору, его можно заменить мнимым числом
, приводящую к коммутатору, его можно заменить мнимым числом  . Это же справедливо и для (3.65), и (3.66). Напомним, что операторы можно выносить только влево от функции и, производя преобразования, нельзя нарушать порядок сомножителей, но допустима группировка операторных слагаемых и сомножителей. Аналогично получаем:
. Это же справедливо и для (3.65), и (3.66). Напомним, что операторы можно выносить только влево от функции и, производя преобразования, нельзя нарушать порядок сомножителей, но допустима группировка операторных слагаемых и сомножителей. Аналогично получаем:
 , (3.68)
, (3.68)
 . (3.69)
. (3.69)
Формулы (3.67), (3.68) и (3.69) дают строгие операторные выражения принципа неопределенностей Гейзенберга, запрещающего одновременное точное измерение перечисленных пар переменных, и это принципиальное ограничение не связано с конструкцией прибора.
topref.ru
Гибридизация
Сопоставление электронных структур ряда элементов с их реально проявляемой валентностью порой приводит к противоречиям. Эти «противоречия» устраняются введением понятия о гибридных атомных орбиталях.
В частности, для углерода возможен переход одного 2s-электрона на 2р-уровень с последующей усреднением (перемешиванием) с 2р-орбиталями – с образованием гибридных орбиталей. Этот процесс и называется гибридизация.
переход гибридизация
C
 : 1s22s22p2 1s22s12p31s2(sp3)4
: 1s22s22p2 1s22s12p31s2(sp3)4
 1s22р1(sp2)3
1s22р1(sp2)3
 1s22р2(sp)2
1s22р2(sp)2
Процесс гибридизации характерен не только для атома углерода С, но и для других элементов. В частности для атома бора В:
переход гибридизация
В
 : 1s22s22p1 1s22s12p21s2(sp2)3
: 1s22s22p1 1s22s12p21s2(sp2)3
Гибридные орбитали естественно имеют иную форму по сравнению с «чистыми» орбиталями:

s-орбиталь p-орбиталь sp-орбиталь
S-орбитали обладают сферической симметрией, р-орбитали более вытянуты, их «центр тяжести» находится дальше от ядра. Чем больше доля s-орбиталей в гибриде, тем компактнее электронная плотность прилегает к ядру. И, наоборот, чем больше доля р-электронов, тем более вытянуто электронное облако, его «центр тяжести» находится от ядра дальше.
Это проявляется в различиях характеристик атомов углерода, находящихся в разных состояниях гибридизации (см. Табл. 3).
Таблица 3
Характеристики атома углерода в разных состояниях гибридизации
| | Состояние гибридизации |
| sp3 | sp2 | sp |
| Электроотрицательность, χ | 2.6 | 2.8 | 3.2 |
| Константа спин-спинового взаимодействия, J(13C-H), Гц | 125 | 159 | 249 |
Система сопряженных связей. Ароматичность
Чередование простой (ординарной) и двойной связей –С=С–С=С– образует систему сопряженных связей. Экспериментальными особенностями такой системы являются:
Пониженная, по сравнению с ожидаемой, теплота гидрирования. В частности, теплота гидрирования (Qгидр.) 1,4-пентадиена (несопряженная система) примерно в 2 раза больше теплоты гидрирования алкена (одна двойная связь):
алкен R–CH=Ch3 – Qгидр.= 126.6 кДж/моль,
1,4-пентадиен Н2С=СН–СН2–СН=СН2 – Qгидр.= 254.1 кДж/моль.
А вот у 1,3-бутадиена (сопряженная система) теплота гидрирования ниже
Н2С=СН–СН=СН2 – Qгидр.= 238.7 кДж/моль.
Реальные длины и порядки связей в 1,3-бутадиене отличаются от гипотетических:
Гипотетически
Порядок связи n: 2 1 2
Длина связи, ммк: 0.133 0.154 0.133
Н2С = СН – СН = СН2
Реально
Порядок связи, n : 1.894 1.447 1.894
Длина связи, ммк: 0.137 0.147 0.137
Из приведенных данных следует, кратные связи в бутадиене несколько ослаблены (n < 2), а ординарная связь более прочная (n > 1).
Сопряженные системы следует рассматривать не как комбинацию чередования двойных и ординарных связей, а как единое целое. Именно так 1,3-бутадиен реагирует с галогенами, присоединяя их в положения 1 и 4:
Н 2С=СН–СН=СН2 + Cl2 h3ClC–CH=CH–Ch3Cl
2С=СН–СН=СН2 + Cl2 h3ClC–CH=CH–Ch3Cl
1 2 3 4
Объяснение этих явлений сводится к тому, что в результате частичного перекрывания р-орбиталей атомов углерода С2 и С3 между ними возникает частичная двоесвязанность – порядок связи n > 1. В то же время вокруг каждого атома углерода не может быть свыше октета электронов. Следовательно, порядок связи между атомами углерода С1 и С2, С3 и С4 становится n < 2. Как уже было сказано, критерием порядка связи является длина связи (чем короче связь, тем она прочнее). В нашем примере, на сколько увеличиваются длины связей С1-С2 и С3-С4 (0.137 – 0.133 = 0.004 ммк), примерно на столько же уменьшается длина связи С2-С3 (0.154 – 0.147 = 0.007 ммк).
Условием проявления сопряжения является расположение углеродных атомов в одной плоскости (копланарность системы).
Существует так называемое кросс-сопряжение. Это явление наблюдается в соединениях, имеющих три группы двойных связей, две из которых не сопряжены друг с другом, но сопряжены с третьей группой. Примером соединения с кросс-сопряжением является 3-метилен-1,4-пентадиен:

Порядок связи С1-С2, С4-С5n = 1.930; С3-С6n = 1.859; С2-С3, С3-С4n = 1.363.
В бензоле отсутствует чередование ородинарной (0.154 ммк) и двойной (0.133 ммк), как предполагает классическая формула Кекуле4
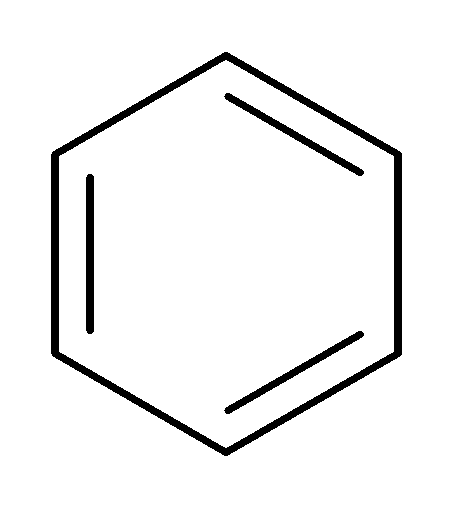
В молекуле бензола происходит полная делокализация π-электронов, приводящая к выравниванию длины всех шести С–С связей: длина связи - 0.139 ммк, порядок связи n = 1.667.
Хюккель5 сформулировал правило, согласно которому «плоские моноциклические сопряженные системы с числом π-электронов 4n + 2 будут ароматическими» Число n = 0, 1, 2, 3 и т.д.
Фрост6 предложил простой графический метод оценки устойчивости сопряженных циклических π-систем (см. Приложение).
Согласно этим правилам циклическое соединение с двумя π-электронами (n = 0) должно обладать ароматическими свойствами. Таким соединением является катион циклопропенилия, получающийся при взаимодействии хлористого циклопропена с пятихлористой сурьмой по схеме:



+
Образовавшийся катион модно представить в виде граничных структур:
+


В магнитном поле в ароматических соединениях возникает диамагнитный кольцевой ток. В результате протоны бензола, катиона циклопропенилия и «внешние» протоны других ароматических циклов менее экранированы – в спектрах протонного магнитного резонанса (ПМР) дают сигналы с большим химическим сдвигом (см.Табл.4).
Таблица 4
Сравнение величины химических сдвигов (δН) ароматических и неароматических соединений
| № | Соединение | δН, м.д. |
| 1 | Этилен | ~ 5.3 |
| 2 | Циклогексен | ~ 5.6 |
| 3 | Бензол | ~ 7.3 |
| 4 | Катион циклопропенилия | ~ 11.1 |
Таким образом, поскольку в бензоле и других ароматических соединениях как таковые двойные связи отсутствуют, эти соединения в большей степени склонны к реакциям замещения, чем к реакциям присоединения.





1Коссель Вальтер (1888 - 1956), немецкий физик
2Льюис Джильберт Ньютон (1875 - 1946), американский физико-химик
3Паули Вольфганг (1900 - 1958), швейцарский физик-теоретик, лауреат Нобелевской премии по физике 1945 г.
4 Кекуле Фридрих Август (1856 - 1896) – немецкий химик-органик
5 Хюккель Эрих Арманд Артур Йозеф (1896 - 1980) – немецкий физик и химик-теоретик
6 Фрост Андрей Владимирович (1906 - 1952) – советский физико-химик
12
studfiles.net
3. Типы гибридизации орбиталей атомов углерода (sp3-, sp2-, sp- гибритизация).
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р) с образованием новых атомных орбиталей, называемых гибридными орбиталями.
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон
Sp-гибридизация

Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Sp2-гибридизация

Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Sp2-гибридизация

Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
| Тип гибридизации | Число гибридных орбиталей | Геометрия | Структура | Примеры |
| sp | 2 | Линейная | 
| BeF2, CO2, NO2+ |
| sp2 | 3 | Треугольная | 
| BF3, NO3-, CO32- |
| sp3 | 4 | Тетраэдрическая | 
| Ch5, ClO4-, SO42-, Nh5+ |
| dsp2 | 4 | Плоскоквадратная | 
| Ni(CO)4, [PdCl4]2- |
| sp3d | 5 | Гексаэдрическая | 
| PCl5, AsF5 |
| sp3d2, d2sp3 | 6 | Октаэдрическая | 
| SF6, Fe(CN)63-, CoF63- |
4. Электровалентная, ковалентная, донорно-акцепторная, водородная связи. Электронное строение σ и π связи. Основные характеристики ковалентной связи: энергия связи, длина, валентный угол, полярность, поляризуемость.
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной.
Ковалентная связь-химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой.
Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов.
Водородная связь-это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами
σ связь-это первая и более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющий центры атомов.
σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи.
π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер
Электроны π и σ связи теряют свою принадлежность к определенному атому.
Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения.
Длина связи-это расстояние между центрами связанных атомов.
Валентный угол-это угол между двумя связями, имеющий общий атом.
Энергия связи-энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
5. Ионная связь (электровалентная)— очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Ковалентная связь – возникает за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону. Донорно акцепторная связь (координационная связь) химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).пример Nh5 Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную. При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т. е. при осевом перекрывании АО) . π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.  π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.  Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (h3, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии)*.
Однако до сих пор сохраняются и широко применяются (особенно в медицине) тривиальные (обыденные) и полутривиальные названия, использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях могут отражаться природные источники и способы получения, особо заметные свойства и области применения. Например, лактоза (молочный сахар) выделена из молока (от лат. lactum - молоко), пальмитиновая кислота - из пальмового масла, пировиноградная кислота получена при пиролизе виноградной кислоты, в названии глицерина отражен его сладкий вкус (от греч. glykys - сладкий).
Тривиальные названия особенно часто имеют природные соединения - аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных.
Рациональная номенклатура предельных углеводородов
В отличие от тривиальной названия основываются на строении молекул. Названия сложных структур состовляют из названия блоков те радикалов связанных с основным навиболее важным узлом молекулы по этой номенклатуре алканы рассматриваются как производные метана у которого атомы водорода замещены соответствующими радикалами. Выбор метанового углерода произвольный поэтому 1 соедин может иметь неск названий.по этой номенклатуре алкены рассматривают как производные этилена а алкины-ацетилена.
7. Гомология органических соединений или закон гомологов — состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только.
Изомеры- соединения имеющие одинаковый состав но разное строение и свойства.
8. Нуклеофильные и электрофильные реагенты. Участвующие в замещения реакциях реагенты подразделяются на нуклеофильные и электрофильные. Нуклеофильные реагенты, или нуклеофилы, предоставляют свою паруэлектронов на образование новой связи и вытесняют из молекулы RX уходящую группу (X) с парой электронов, образовывавшей старую связь, например:


(где R — органический радикал).
К нуклеофилам относятся отрицательно заряженные ионы (Hal-, ОН-, CN-, NO2-, OR-, RS-, Nh3-, RCOO- и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н2О, Nh4, R3N, R2S, R3P, ROH, RCOOH), и металлоорганич. соединения R — Me с достаточно поляризованной связью С — Me+, т. е. способные быть донорами карбанионов R-. Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН-, Н2О), алкоголиз (RO-, ROH), ацидолиз (RCOO-, RСООН), аминирование (NH-2, Nh4, RNh3 и др.), цианирование (CN-) и т. д.
Электрофильные реагенты, или электрофилы, при образовании новой связи служат акцепторами пары электронов и вытесняют уходящую группу в виде положительно заряженной частицы. К электрофилам относятся положительно заряженные ионы (например, Н+, NO2+), нейтральные молекулы с электронным дефицитом, например SO3, и сильно поляризованные молекулы (СН3СОО-Br+ и др.), причём поляризация особенно эффективно достигаетсякомплексообразованием с коэффициентами Льюиса (Hal+ — Hal- · А, R+ — Cl- · A, RCO+ — Cl- · А, где A= A1C13, SbCl5, BF3 и др.). К реакциям с участием электрофилов (электрофильное замещение) относятся важнейшие реакцииароматических углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя — Крафтса):

(E+ = Hal+, NO+2, RCO+, R+ и др.)
В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов — в алифатическом (чаще всего в ряду металлоорганических соединений).
53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика)
Реакции широко используются для получения спиртов.при присоединении к формальдегиду реактива гриньяра(R-MgX) образуется первичный спирт, другим альдегидом вторичные, а кетонам тритичные спирты
studfiles.net
Гибридизация атомных орбиталей — Мегаобучалка
Для объяснения фактов, когда атом образует большее число связей, чем число неспаренных электронов в его основном состоянии (например, атом углерода), используется постулат о гибридизации близких по энергии атомных орбиталей. Гибридизация АО происходит при образовании ковалентной связи, если при этом достигается более эффективное перекрывание орбиталей. Гибридизация атома углерода сопровождается его возбуждением и переносом электрона с 2s- на 2р-АО:

Основное и возбужденное состояния атома углерода.
Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.
Например, смешение 2s-АО с 2p-АО дает две гибридные 2sp-АО:

АО с большой разницей в энергии (например, 1s и 2р) в гибридизацию не вступают. В зависимости от числа участвующих в гибридизации p-АО возможны следующие виды гибридизации:
для атомов углерода и азота - sp3, sp2 и sp;
для атома кислорода - sp3, sp2;
для галогенов - sp3.
Гибридная АО асимметрична и сильно вытянута в одну сторону от ядра (форма неправильной восьмерки).

В отличие от негибридных s- или р-АО, она имеет одну большую долю, которая хорошо образует химическую связь, и малую долю, которую обычно даже не изображают. Гибридизованные АО при взаимодействии с орбиталями различных типов (s-, р- или гибридными АО) других атомов обычно дают s-МО, т.е. образуют s-связи. Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
3.3.1. sp3-Гибридизация (тетраэдрическая).
Одна s- и три р-орбитали смешиваются, и образуются четыре равноценные по форме и энергии sp3-гибридные орбитали.
Орбитальная модель атома в sp3-гибридизованном состоянии.

Для атома углерода и других элементов 2-го периода этот процесс происходит по схеме:
2s + 2px + 2py + 2pz = 4 (2sp3)

Схема sp3-гибридизации атомных орбиталей.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов.
Впервые идею о направленности единиц сродства (валентностей) атома углерода по углам тетраэдра независимо друг от друга выдвинули в 1874 г. Вант-Гофф и Ле Бель.
sp3-Орбитали могут образовывать четыре s-связи с другими атомами или заполняться неподеленными парами электронов.
А как наглядно изобразить пространственное строение атома в sp3-состоянии на рисунке?
В этом случае sp3-гибридные орбитали изображают не электронными облаками, а прямыми линиями или клиньями в зависимости от пространственной ориентации орбитали. Такое схематическое изображение используется при написании стереохимических (пространственных) формул молекул.

Переход от орбитальной модели (а) к пространственной формуле (б).
На примере молекулы метана показаны объемные модели и пространственная (стереохимическая) формула молекулы с sp3-углеродным атомом.
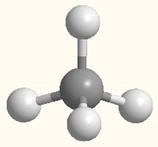


Модель молекулы метана
sp3-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 4.
Углерод в sp3-гибридном состоянии встречается в простом веществе - алмазе . Это состояние характерно для атомов С, N, O и др., соединенных с другими атомами одинарными связями (sp3-атомы выделены красным цветом):
Сh5, RCh4, Nh4, RNh3, h3O, ROH, R2O;
а также анионам типа:
R3C:-, RO-.
Следствием тетраэдрического строения sp3-атома является возможность существования двух оптических стереоизомеров у соединения, содержащего такой атом с четырьмя разными заместителями (Вант-Гофф, Ле Бель, 1874).
3.3.2. sp2-Гибридизация (плоскостно-тригональная).
Одна s- и две p-орбитали смешиваются, и образуются три равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° (выделены синим цветом). Они могут образовывать три s-связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р-АО участвует в образовании p-связи.

Для элементов 2-го периода процесс sp2-гибридизации происходит по схеме:
2s + 2px + 2py = 3 (2sp2) 2pz-АО в гибридизации не участвует.

Для изображения пространственного строения атомов в sp2-состоянии используются те же приемы, что и в случае sp3-атомов:

Переход от орбитальной модели атома в sp2-гибридизированном состоянии (а) к пространственной формуле (б). Строение молекул с sp2-атомами отражают их модели:


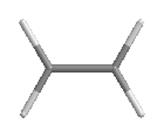
Модели молекулы этилена
sp2-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 3
Углерод в sp2-гибридном состоянии образует простое вещество графит. Это состояние характерно для атомов С, N, O и др. с двойной связью (sp2-атомы выделены красным цветом):
h3C=Ch3, h3C=CHR, R2C=NR, R-N=N-R, R2C=O, R-N=O,
а также для катионов типа
R3C+ и свободных радикалов R3C ·.
megaobuchalka.ru
Гибридизация (химия) - это... Что такое Гибридизация (химия)?

 Модель молекулы метана, образованной sp3-гибридными орбиталями
Модель молекулы метана, образованной sp3-гибридными орбиталями Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации

 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л.Полинг развил теорию изогнутой химической связи, учитывающую кулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
«Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2]. Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
Виды гибридизации
sp-гибридизация

 sp-гибридизация
sp-гибридизация Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация

 sp2-гибридизация
sp2-гибридизация Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация

 sp3-гибридизация
sp3-гибридизация Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
Тип гибридизации Числогибридных орбиталей Геометрия Структура Примеры
| sp | 2 | Линейная |  | BeF2, CO2, NO2+ |
| sp2 | 3 | Треугольная |  | BF3, NO3-, CO32- |
| sp3 | 4 | Тетраэдрическая |  | Ch5, ClO4-, SO42-, Nh5+ |
| dsp2 | 4 | Плоскоквадратная |  | Ni(CO)4, XeF4 |
| sp3d | 5 | Гексаэдрическая |  | PCl5, AsF5 |
| sp3d2 | 6 | Октаэдрическая |  | SF6, Fe(CN)63-, CoF63- |
Ссылки
Литература
- Паулинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М.: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — 278 с.
См. также
Примечания
- ↑ Под редакцией Р. Х. Фрейдлиной. Теоретическая органическая химия. — пер. с англ. канд. хим. наук Ю.Г.Бунделем. — М.: Издательство иностранной литературы, 1963. — Т. 1. — С. 11. — 365 с.
- ↑ 1 2 Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — С. 18-19. — 278 с.
- ↑ Здесь A — центральный атом, X — гибридные связывающие орбитали
dic.academic.ru
 ), принадлежащих двум низшим ypoвням плоского ротатора, возможны два предельных способа построения гибридов. В первом из них гибридизуются только σ- и лишь одна из двух π-орбиталей, тогда как вторая остается несмешанной. Например, образуем ниже гибрид из σ- πс, не затрагивая πs. Назовем этот тип смешения σπ-гибридизацией. Во втором случае смешиваются все три исходные орбитали, т.е. происходит σπ2-гибридизация. Число гибридных функций всегда равно числу исходных смешивающихся орбиталей.
), принадлежащих двум низшим ypoвням плоского ротатора, возможны два предельных способа построения гибридов. В первом из них гибридизуются только σ- и лишь одна из двух π-орбиталей, тогда как вторая остается несмешанной. Например, образуем ниже гибрид из σ- πс, не затрагивая πs. Назовем этот тип смешения σπ-гибридизацией. Во втором случае смешиваются все три исходные орбитали, т.е. происходит σπ2-гибридизация. Число гибридных функций всегда равно числу исходных смешивающихся орбиталей. ,
, , где
, где 
 (3.42)
(3.42)  (3.43)
(3.43)
 (3.44)
(3.44) для i=1, 2
для i=1, 2  i=1, 2, 3, j ≠ i
i=1, 2, 3, j ≠ i .
. (3.45)
(3.45) 
 (3.46)
(3.46) (3.47)
(3.47) и выбирая для сi1 арифметическое значение корня, т.е.
и выбирая для сi1 арифметическое значение корня, т.е.  , мы неизбежно сохраняем свободу выбора значений сi2 и сi3, которая ограничена только условием
, мы неизбежно сохраняем свободу выбора значений сi2 и сi3, которая ограничена только условием . (3.48)
. (3.48) ,
,  . (3.49)
. (3.49) (3.50)
(3.50) . (3.51)
. (3.51) ; i=1, 2, 3
; i=1, 2, 3 , (3.53)
, (3.53) . (3.54)
. (3.54)
 и с учетом ортонормированности базиса, т.е. ‹σ|σ›=1; ‹σ|πс›=0 (независимо от ориентации πс-функции) получаем уравнение:
и с учетом ортонормированности базиса, т.е. ‹σ|σ›=1; ‹σ|πс›=0 (независимо от ориентации πс-функции) получаем уравнение:


 и (3.57)
и (3.57) . (3.58)
. (3.58)


 . (3.59)
. (3.59) и получим:
и получим:


 (3.60)
(3.60) и
и  , т.е. их последовательное выполнение. Запись
, т.е. их последовательное выполнение. Запись  означает, что раньше измеряется величина μ, а затем λ. И, обратно, запись
означает, что раньше измеряется величина μ, а затем λ. И, обратно, запись  отвечает первичному измерению величины λ и затем – величины μ. Таким образом правило о последовательности выполнения операторов таково: произведение
отвечает первичному измерению величины λ и затем – величины μ. Таким образом правило о последовательности выполнения операторов таково: произведение  означает, что сначала на функцию действует оператор, стоящий непосредственно слева от функции, т.е.
означает, что сначала на функцию действует оператор, стоящий непосредственно слева от функции, т.е.  , в результате чего получается новая функция, над которой выполняется преобразование, диктуемое оператором
, в результате чего получается новая функция, над которой выполняется преобразование, диктуемое оператором  .
. и
и  должны быть эквивалентными, а их разность будет нулевой:
должны быть эквивалентными, а их разность будет нулевой: , (3.61)
, (3.61) . (3.62)
. (3.62) . (3.63)
. (3.63) можно заменить оператором
можно заменить оператором  . Получаем:
. Получаем: , (3.64)
, (3.64) , (3.65)
, (3.65) (3.66)
(3.66)
 .
. равен
равен . (3.67)
. (3.67) , приводящую к коммутатору, его можно заменить мнимым числом
, приводящую к коммутатору, его можно заменить мнимым числом  . Это же справедливо и для (3.65), и (3.66). Напомним, что операторы можно выносить только влево от функции и, производя преобразования, нельзя нарушать порядок сомножителей, но допустима группировка операторных слагаемых и сомножителей. Аналогично получаем:
. Это же справедливо и для (3.65), и (3.66). Напомним, что операторы можно выносить только влево от функции и, производя преобразования, нельзя нарушать порядок сомножителей, но допустима группировка операторных слагаемых и сомножителей. Аналогично получаем: , (3.68)
, (3.68) . (3.69)
. (3.69)
 : 1s22s22p2 1s22s12p31s2(sp3)4
: 1s22s22p2 1s22s12p31s2(sp3)4 1s22р1(sp2)3
1s22р1(sp2)3 1s22р2(sp)2
1s22р2(sp)2
 : 1s22s22p1 1s22s12p21s2(sp2)3
: 1s22s22p1 1s22s12p21s2(sp2)3
 2С=СН–СН=СН2 + Cl2 h3ClC–CH=CH–Ch3Cl
2С=СН–СН=СН2 + Cl2 h3ClC–CH=CH–Ch3Cl 




















 π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.  Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.


















 Модель молекулы метана, образованной sp3-гибридными орбиталями
Модель молекулы метана, образованной sp3-гибридными орбиталями 









