Количество просмотров публикации Протеазы (пептидгидролазы) - 503
Белок и пептиды расщепляют ферменты, объединяемые в подкласс пептидгидролаз (К.Ф.3.4.). Их называют также протеазами, протеолитическими ферментами.
Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и пептидов:
Расщепление пептидной связи в точках, удаленных от конца молекулы, катализируют эндопептидазы. Их делят на четыре группы: сериновые (К.Ф.3.4.21), тиоловые (К.Ф.3.4.22), карбоксильные (К.Ф.3.4.23) и металлосодержащие (К.Ф.3.4.24).
Отщепление концевых аминокислот и дипептидов, а также гидролиз дипептидов катализируют экзопептидазы, которые разделяют на пять групп. Аминопептидазы (К.Ф.3.4.11) катализируют отщепление единичных аминокислот от N-конца полипептидной цепи, карбоксипептидазы (К.Ф.3.4.16, 3.4.17) – от С-конца. Дипептидазы (К.Ф.3.4.13) гидролизуют дипептиды. Дипептидилпептидазы (К.Ф.3.4.14) и пептидилдипептидазы (К.Ф.3.4.15) катализируют отщепление дипептидов соответственно от N-конца и от С-конца полипептидной цепи. Схема классификации дана на рис 7.1
| |
Существующая классификация пептидгидролаз несовершенна, поскольку в ней используются в качестве разграничительных различные признаки: деление пептидаз на группы проведено по характеру действия на субстрат, а протеиназ – по структуре каталитического центра. Сегодня описано несколько сот пептидгидролаз различного происхождения. На основании этого обширного материала предлагаются новые варианты классификации, в частности, только по структуре каталитического центра.
Скорость ферментативного гидролиза белковых соединений определяется наличием в них пептидных связей, специфичных для действия фермента͵ а также пространственной структурой субстрата.
На доступность пептидных связей гидролизу влияют вторичная, третичная и четвертичная структура белков. Белки могут иметь один или два типа упорядоченных вторичных структур (α-спиральной и β-складчатой), представленных в различных сочетаниях и охватывающих более или менее значительную часть полипептидной цепи.
В упорядоченных структурах определенные участки полипептидной цепи экранированы и недоступны действию ферментов. Чем выше степень упорядоченности структуры, тем менее белок подвержен протеолизу.
Третичная структура белка, его геометрическая форма определяет соотношение экспонированной и экранированной частей молекулы (то есть доступной и недоступной протеолизу),
Наименее доступны протеолизу молекулы с наименьшей удельной поверхностью, то есть приближающиеся по форме к шару.
Четвертичную структуру имеют белковые молекулы, состоящие из субъединиц. Последние бывают ассоциированы за счёт ковалентных, ионных и водородных связей. Ассоциация субъединиц снижает относительную величину экспонированной части молекулы, увеличивает ее конформационную стабильность за счёт внутримолекулярных взаимодействий. Ассоциированные молекулы менее доступны действию ферментов, чем диссоциированные.
Денатурация белков сопровождается развертыванием полипептидной цепи, демаскированием прежде экранированных групп. Снимаются ограничения доступности субстрата͵ обусловленные вторичной, третичной четвертичной структурой. Денатурированные белки гидролизуются, целом быстрее и полнее нативных.
Сериновые протеиназы объединяют группу эндопептидаз, имеющих в каталитическом центре остаток серина. У большинства сериновых протеиназ в каталитическом центре находят аминокислотные остатки Асп 102, Гис 57 и Сер 195. Сериновыё протеазы ингибируют агентами, взаимодействующими с остатком серина, такими как диизопропилфторфосфат (DFP), фенилметилсульфонилфторид (PMSF), сульфогалогениды, а также природными протеолитическими ингибитора животного, растительного и микробного происхождения. Все сериновые протеиназы проявляют максимальную активность в нейтральной или щелочной среде. Молекулярная масса составляет от 12-15 кДа у ферментов с единственной полипептидной цепью, до 200-300 кДа – у ферментов с субъединичной структурой.
К группе сериновых протеиназ относятся ферменты животного, растительного и микробного происхождения, многие из которых хорошо изучены и выпускаются в виде промышленных препаратов.
В поджелудочной железе человека и млекопитающих животных синтезируются сериновыё протеиназы – трипсин (К.Ф.3.4.21.4), химотрипсины А и В (К.Ф.3.4.21.1), химотрипсин С (К.Ф.3.4.21.2). Эти ферменты образуются первоначально в виде предшественников (трипсиногена и химотрипсиногенов), которые превращаются в активные формы под действием трипсина. При протеолитическом процессинге трипсиногена от его молекулы отщепляется N-концевой гексапептид, реакция активируется кальцием.
Активная форма трипсина – однокомпонентный белок, состоящий из единственной полипептидной цепи. Фермент, выделенный из поджелудочной железы человека и различных млекопитающих, имеет молекулярную массу 22,9-25,5 кДа, оптимальный рН 7-8. Стабилен при рН не выше 6. В щелочной среде происходит самопереваривание. В организме трипсин стабилизируется с помощью ингибитора, с которым образует неактивный комплекс, устойчивый к протеолизу. Ингибитор синтезируется в поджелудочной железе. Трипсин гидролизует пептидные связи, образованные карбоксилами аргинина или лизина. Существенно наличие свободной аминогруппы диаминокислот по соседству с расщепляемой связью. Фермент гидролизует не только амидные, но также сложноэфирные связи. Он расщепляет различные животные и растительные белки, проявляет высокую активность в отношении белковых компонентов клеточных стенок микроорганизмов. Комплекс трипсина и литической мурамидазы – лизоцима, секретируемого слизистой кишечника, является важнейшим фактором регуляции состава микрофлоры пищеварительного тракта животных и человека.
Химотрипсины образуются из химотрипсиногенов после отщепления пептида, состоящего из 15 аминокислотных остатков. Молекулярная масса химотрипсинов составляет 24-25,8 кДа, оптимальный рН 7-9. Химотрипсины стабильны в кислой среде. Ферменты предпочтительно катализируют расщепление в белках пептидных связей, в образовании которых участвуют карбоксилы ароматических аминокислот. Гидролизуют также связи, образованные карбоксилами лейцина, метионина, триптофана. Химотрипсины, как и трипсин, расщепляют сложные эфиры. Разнообразие типов гидролизуемых связей определяет широкую специфичность действия химотрипсинов.
В группу сериновых входят многие внеклеточные и внутриклеточные протеиназы микроорганизмов. Классическими представителями секретируемых сериновых протеиназ бактерий являются субтилизины А, В и BPN' из культуры В. subtilis – белки молекулярной массы 26,3-27,5 кДа с оптимумом действия при рН 8-11. Многие бациллы продуцируют субтилизиноподобные сериновыё протеиназы.
Для внеклеточных сериновых протеиназ бактерий характерен оптимум действия в щелочной зоне (рН 8-12,5), при температуре 50-70° С. Ферменты стабильны в зоне рН от 6 до 13, при температуре не выше 50° С. В качестве стабилизатора могут использоваться соли кальция.
Сериновыё протеиназы входят в состав комплексных ферментных препаратов, выделяемых из грибов аспергиллов. У Asp. oryzae найдены разновидности сериновых протеиназ, которые при действии на казеин проявляют максимальную активность при рН 7-8,5 и 9-11,5.
Многие виды микроскопических грибов (p. p. Acremonium, Alternaria, Aspergillus, Cephalosporium, Fusarium, Penicillium, Trichoderma, Verticillium и др.) синтезируют внеклеточные сериновыё протеиназы. Большинство исследованных ферментов этой группы имеют молекулярную массу 18-35 кДа, оптимум действия – при рН от 5 до 12 и температуре 55-60° С. Многие сериновыё протеиназы грибов стабилизируются ионами кальция.
В соке растений присутствуют растворимые формы субтилизиноподобных сериновых протеиназ. Их выделили из плодов дыни, различных видов тыквы, из томатов, плодов маклюры (сем. тутовых), из листьев подсолнечника, корней одуванчика, клубеньков ольхи. Все исследованные растительные субтилизины – гликопротеины, фермент из маклюры содержит 25,6% углеводов. Οʜᴎ синтезируются в виде препроферментов, которые после протеолитического процессинга превращаются в активные формы. Молекулярная масса активных форм - 50-70 кДа, у подсолнечника – 25 кДа. Оптимальный рН действия – в интервале 7,3-11, при температуре 55-70° С. Стабильны при температуре не выше 50-60° С. Растительные субтилизины имеют широкую зону рН-стабильности: фермент из тыквы – 5-10, дыни – 4-12, подсолнечника – 4-10. Гидролизуют казеин, азоказеин, азоколлаген, гемоглобин и другие белки, преимущественно расщепляя связи, образованные гидрофобными аминокислотами (лейцином, фенилаланином, тирозином), с меньшей скоростью – образованные цистеином, дикарбоновыми аминокислотами и их амидами.
Растения синтезируют различные ингибиторы ферментов, среди которых наиболее широко представлены ингибиторы сериновых протеиназ, в частности, ингибиторы трипсина. Οʜᴎ найдены в семенах бобовых (сои, фасоли, гороха), злаков (пшеницы, ржи, кукурузы), гречихи, в клубнях картофеля, корнеплодах моркови, яблоках, листьях капусты и других источниках. Ингибиторы трипсина предотвращают инфицирование растений микроорганизмами и повреждение насекомыми, поскольку большая часть патогенных микроорганизмов и насекомых-вредителей синтезирует трипсиноподобные ферменты. В семенах гречихи найден медленно взаимодействующий и прочно связывающийся ингибитор трипсина, подавляющий прорастание спор и рост мицелия патогенного гриба Alternaria alternata. В клубнях картофеля присутствуют две разновидности ингибиторов сериновых протеиназ с молекулярной массой 21 и 22 кДа. Первый подавляет активность трипсина, химотрипсина и эластазы, второй – только двух первых ферментов. Среди ингибиторов химотрипсина, синтезирующихся в тканях картофеля, нашли высокоэффективный пептид массы всего 5 кДа. Расшифровка структуры низкомолекулярного ингибитора перспективна в целях создания синтетических аналогов для применения в качестве средств защиты растений и медицинских препаратов.
В семенах сои – две разновидности ингибиторов трипсина: ингибитор Кунитца и ингибитор Баумана-Бирк (ББИ). Второй способен одновременно и независимо связывать на одном центре – трипсин, а на другом – эластазу лейкоцитов человека и химотрипсиноподобные ферменты, за что получил название ʼʼдвухголовогоʼʼ. Показано, что ББИ обладает антиканцерогенным действием, препятствуя метастазированию и росту злокачественных опухолей, происходящему при участии лейкоцитарных ферментов химотрипсинового типа. Содержание ББИ в разных сортах сои составляет от 0,5 до 1,5 мг/г семян, в некоторых видах коммерческой соевой муки – до 1,9 мг/ᴦ. В семенах сои ББИ представлен несколькими изоформами, число которых, исходя из сорта сои, составляет от 2 до 7. Высокая биологическая активность ББИ побудила пересмотреть выводы об антипитательных свойствах соевых ингибиторов. Считают, что антипитательные свойства связаны с присутствием в сое большого количества таннинов – неспецифических ферментных ингибиторов широкого спектра, а также гемаглютининов.
Помимо ингибиторов собственно сериновых протеиназ, растения синтезируют бифункциональные ингибиторы, подавляющие активность α-амилазы и сериновых протеиназ. Такие ингибиторы характерны для семян злаков. В процессах гидролиза растительных белков крайне важно принимать во внимание присутствие ингибиторов в растительном сырье.
Сериновыё протеиназы животного и микробного происхождения прочно вошли в номенклатуру промышленных феррментных препаратов. Из животного сырья производят трипсин, химотрипсин и комплексный препарат панкреатин с активностью обоих этих ферментов. Из микробного сырья получают Проназу, Римопротелин, Протосубтилин щелочной, Амилопроторизин, Лизосубтилин и другие препараты.
Тиоловые (цистеиновые) протеиназы. В эту группу входят эндопептидазы, для проявления каталитической активности которых существенна сульфгидрильная группа цистеина. Тиоловые протеиназы ингибируются парахлормеркурибензоатом (PCMB), монойодуксусной кислотой (MIA) и другими окислителями, а также ионами тяжелых металлов. Активируются восстановителями (2-меркаптоэтанолом, дитиотреитолом, цистеином, бисульфитом натрия и пр.).
Большинство тиоловых протеиназ имеют рН-оптимум в слабокислой или нейтральной зоне. К тиоловым принадлежат широко применяемые в практике протеиназы растительного происхождения – папаин, химопапаины А и В, бромелаин, фицин.
Папаин (К.Ф.3.4.22.2) и химопапаины А и В (К.Ф.3.4.22.6) выделяют из млечного сока дынного дерева. Это ферменты молекулярной массы 23,4-28 кДа с оптимумом рН 6-7. Папаин стабилен в зоне рН 3-11. Наибольшая стабильность наблюдается при рН 5. В присутствии окислителей папаин быстро теряет активность, в связи с этим при работе с ним крайне важно следить за окислительным потенциалом среды.
Бромелаин (К.Ф.3.4.22.4) выделяют из сока зрелых стеблей ананаса, фермент имеет массу 35 кДа, оптимальный рН 5-6.
Фицин (К.Ф.3.4.22.3) получаемый из латекса тропического инжира, имеет молекулярную массу 23,8кДа и оптимальный рН 6,5-9,5.
Папаин, бромелаин, фицин - протеиназы широкой субстратной специфичности. Οʜᴎ гидролизуют в белках пептидные связи, образованные лейцином или глицином. Другие типы связей, в т.ч. характерные для специфичности пепсина, трипсина, химотрипсина, карбоксипептидазы, также могут расщепляться, хотя и с меньшей скоростью. Благодаря этому растительные тиоловые протеиназы более глубоко гидролизуют белки, чем сериновыё и карбоксильные протеиназы животного происхождения.
В растениях найдены ингибиторы цистеиновых протеиназ. Из клубней картофеля изолирован белок молекулярной массы 23 кДа, подавляющий активность папаина, бромелаина и фицина. В семенах тыквы – ингибитор молекулярной массы 7,5 кДа, эффективно подавляющий фицин и папаин, менее – химопапаин, на бромелаин не действует. В семенах сои содержатся две формы ингибитора цистеиновых протеиназ основная, с молекулярной массой 14 кДа, и минорная – 8,2 кДа. Основной компонент ингибирует папаин, бромелаин, фицин, химопапаин. В его молекуле три дисульфидных моста͵ разрыв которых под действием восстановителей (цистеина, цистамина) приводит к обратимой инактивации. Окислители реактивируют ингибитор.
Тиоловые протеиназы продуцируют эубактерии (клостридии, стрептококки, стафилококки) и архебактерии. У грибов их находят редко. Микробные тиоловые протеиназы наиболее активны при рН 7-8,8.
Карбоксильные протеиназы распространены у животных и эукариотических микроорганизмов. В каталитическом центре карбоксильных протеиназ – две карбоксильные группы. Активность подавляют эпоксисоединения, диазокетоны, природные ингибиторы типа пепстатина.
Карбоксильные, или кислые, протеиназы, за малыми исключениями, проявляют активность в кислой среде.
К числу кислых протеиназ относятся пепсины млекопитающих пепсин А (К.Ф.3.4.23.1), пепсин В (К.Ф.3.4.23.2) и пепсин С (К.Ф.3.4.23.3). Это белки молекулярной массы 31-40 кДа с оптимумом действия при рН2-4.
В слизистой желудка человека синтезируется предшественник пепсина – пепсиноген (42 кДа), который превращается в пепсин (34-35 кДа)| в присутствии кислоты или автокаталитически, в результате гидролиза активным пепсином.
Пепсин проявляет специфичность в отношении связей, образованных аминофуппами тирозина или фенилаланина. Наличие свободной аминофупиы вблизи пептидной связи препятствует гидролизу белка, а карбоксильной – увеличивает скорость гидролиза. Пепсин расщепляет различные животные и растительные белки, в т.ч. казеин, коллаген, глютин, эластин, кератин, гистон.
Способность синтезировать кислые протеиназы широко распространена у микроскопических грибов – аспергиллов, пенициллов, мукоров, Rhizopus, Trichoderma и др. Размещено на реф.рфВнеклеточные кислые протеиназы грибов – ферменты молекулярной массы от 30 до 100 кДа (чаще 32-39 кДа), с оптимумом действия при рН 2-4,6. Стабильны в кислой среде (рН 2,5-6), в нейтральной среде быстро и необратимо инактивируются. Оптимальная температура действия 55-75°С, большинство исследованных кислых протеиназ устойчивы при температуре до 55° С, некоторые при 60-65° С. По специфичности действия кислые протеиназы грибов сходны с пепсином.
Внеклеточные кислые протеиназы грибов, наряду с другими видами протеолитических ферментов, входят в состав комплексных ферментных препаратов, таких как Амилоризин, Амилопроторизин, Пектаваморин, Пектофоетидин, Целловиридин, Целлюлаза-100 и др. Размещено на реф.рфИз аспергиллов выделяют очищенные препараты кислойпротеиназы, предназначенные для пищевой промышленности и медицины.
Металлосодержащие протеиназы - ϶ᴛᴏ ферменты, в каталитический центр которых входит ион или ионы металлов, существенные для проявления каталитической активности. Такими металлами чаще всего являются цинк, кобальт или марганец. Некоторые металлопротеиназы содержат как единственный металл кальций или магний. Кальций может входить в молекулу фермента также как ион-стабилизатор. Размещено на реф.рфТак в металлопротеиназе В. subtilis цинк является каталитически активным металлом, а кальций – стабилизатором.
Металлы играют важную роль в каталитическом акте. С их помощью образуется тройной координационный комплекс: фермент-металл-субстрат. При этом стабилизируется высшее валентное состояние металла. Ионы металлов могут образовывать координационные связи с атомами азота͵ серы, кислорода, имеющими неподеленные пары электронов. Отток электронов от групп >С=0 и -NH- к иону металла облегчает разрыв пептидной связи.
Все металлопротеиназы ингибируются хелатными агентами (EDTA, EGTA, о-фенантролином и др.). Инактивация чаще всего носит обратимый характер.
Металлопротеиназы широко распространены у бактерий встречаются и у микроскопических грибов. Бактериальные металлопротеиназы – белки с молекулярной массой 28-48 кДа, проявляющие максимальную активность при рН 6,5-9 и температуре 50-75° С.
В. subtilis – продуцент протеолитического ферментного препарата Протосубтилина выделяет в среду две металлопротеиназы – А и Б, с молекулярной массой 44 и 40 кДа. Первая имеет оптимум при рН 7, вторая – при рН 7,5 и 11.
Микроскопические грибы синтезируют металлопротеиназы молекулярной массы 20–45 кДа. Среди них выделяют группу кислых ферментов, с оптимальным рН 5-6, и нейтральных, с оптимумом рН около 7 Температурный оптимум лежит обычно в пределах 45-55 С, у металлопротеиназы Asp. sojae – при 650С.
Среди металлопротеиназ аспергиллов и пенициллов находят цинксодержащие ферменты (1 ион цинка на молекулу).
Карбоксипептидазы широко представлены у животных, растений и микроорганизмов, они играют важную роль в белковом обмене. Среди карбоксипептидаз встречаются сериновыё и металлоферменты, редко – тиоловые.
В поджелудочной железе синтезируются карбоксипептидазы А и В. Предшественники этих ферментов активируются под действием трипсина. Карбоксипептидаза А – металлофермент, содержит один атом цинка на молекулу
Молекулярная масса фермента 34,3 кДа, оптимальный рН 7,5, зона стабильности – рН 6-10,2. Карбоксипептидаза В идентична по массе и содержанию цинка, стабильна при рН 7-9. Оба фермента имеют как пептидазную, так и эстеразную активность.
Карбоксипептидазы есть у многих покрытосеменных (томата͵ арбуза, фасоли, шпината и др.). В клетках растений присутствуют, как связанные, так и растворимые формы карбоксипептидаз. Максимальную активность находят во фракции митохондрий.
Все растительные карбоксипептидазы – кислые белки с изоэлектрической точкой при рН 4,3-5,4. Молекулярная масса 90-175 кДа. Оптимальный рН 5-5,6, стабильны в зоне рН 4-6. Оптимальная температура действия 40-50° С.
Большинство растительных карбоксипептидаз относится к сериновым ферментам. Из их числа – уникальная карбоксипептидаза фасоли, способная отщеплять с С-концов белков все аминокислоты, за исключением аспарагиновой. Предпочтительно наличие на С-конце аминокислоты с длинной алифатической цепью, а по соседству с ней – ароматаческой аминокислоты.
Карбоксипептидаза из кожуры апельсина является металлоферментом, содержащим 3,6 атома цинка на молекулу. Фермент отщепляет с С-конца белков ароматические, кислые аминокислоты и пролин. Приведенные примеры свидетельствуют о широкой субстратной специфичности растительных карбоксипептидаз.
Микробные карбоксипептидазы – белки молекулярной массы от 30 до 160 кДа. Оптимальный рН действия для грибных карбоксипептидаз – 3,0-6,8, для бактериальных - 8,0-9,8. Оптимальная температура действия карбоксипептидаз Asp. oryzae - 40-50° С.
Карбоксипептидазы микроорганизмов могут иметь различную структуру активного центра. У некоторых грибов и актиномицетов они являются металлоферментами, для проявления активности которых необходимы ионы цинка, марганца, магния, кальция.
Карбоксипептидазы микроскопических грибов характеризуются широкой субстратной специфичностью, что в значительной мере определяет способность грибных ферментных препаратов катализировать глубокое расщепление растительных и животных белков. Карбоксипептидазы пенициллов отщепляют от пептидов остатки пролина, лизина, аргинина, глицина, дикарбоновых аминокислот. Кислая карбоксипептидаза Asp. saitoi последовательно отщепляет все аминокислоты от нативного инсулина и некоторых других пептидов. Аналогичный фермент Asp. sojae глубоко расщепляет соевый белок.
Протеолитические ферменты семян растений. В семенах злаковых и бобовых культур содержится целый комплекс протеолитических ферментов, участвующих в расщеплении запасных белков до аминокислот в процессе прорастания семян.
Сегодня известно, что протеолиз белков в семенах растений осуществляется комплексом ферментов, различающихся по своим функциям, механизму действия и другим показателям. Некоторые из этих ферментов были выделены в виде высокоочищенных препаратов и подробно охарактеризованы. Так, к примеру, из семян пшеницы были выделены несколько типов протеолитических ферментов, различающихся по оптимуму рН: кислые протеиназы с оптимумом рН 3,7-4,0; нейтральные протеиназы с оптимумом рН 6,5-7,0; щелочные протеиназы с оптимумом рН > 8,0.
Из трех групп протеиназ наибольшего внимания технологов заслуживают нейтральные протеиназы. По активности они в несколько раз превосходят кислые и в условиях теста способны эффективно расщеплять белки клейковины. Одна из особенностей нейтральных протеиназ состоит в том, что они не растворяются в водных, солевых и буферных растворах. Οʜᴎ прочно связаны с белками клейковинного комплекса и извлекаются при частичном растворении клейковины в щелочном растворе. Максимальное извлечение нейтральных протеиназ происходит при обработке измельченного зерна, муки или лиофилизированной клейковины 0,35%-м раствором карбоната натрия созревших семян пшеницы нейтральные протеиназы и их белковые ингибиторы образуют единый неактивный комплекс, связанный с клейковиной. Соотношение активности протеиназ и их ингибиторов в созревшем зерне определяет стабильность белкового комплекса, его устойчивости в процессе тестирования.
Нейтральные протеиназы не активируются восстановленным глута-тионом или цистеином и в связи с этим не бывают отнесены к тиоловым ферментам, в отличие от кислых протеиназ. Нейтральные протеиназы ингибируются хлоридом натрия, фенольными соединениями, фенольными соединениями, ароматическими аминокислотами, продуктами сахаро-аминной реакции (меланоидинами).
Хлорид натрия является обязательным компонентов рецептуры и, внесенный в таком количестве, снижает активность нейтральных протеиназ и соответственно интенсивность автолиза на 60-70%.
При переработке слабой муки крайне важно как можно раньше вводить соль, тогда как для муки с чрезмерно крепкой клейковиной желательно активизировать протеолиз, и соль следует вносить на более поздних стадиях.
В связи с этим крайне важно еще раз подчеркнуть важность изучения собственных эндогенных ферментных систем биологического сырья, факторов, влияющих на их активность с точки зрения их огромной роли в процессах, происходящих при созревании, хранении и переработке пищевого сырья.
referatwork.ru
Области применения протеаз
Реферат выполнил: студент гр. 50-11 Кашапов Р.Р.
Казанский государственный технологический университет
Кафедра промышленной биотехнологии
Казань 2004
Введение.
Важнейшим свойством белков является их каталитическая активность. Вещества белковой природы, способные каталитически ускорять химические реакции, называют ферментами.
Роль ферментов в жизнедеятельности животных, растений и микроорганизмов колоссальна. Благодаря каталитической функции разнообразные ферменты обеспечивают быстрое протекание в организме или вне его огромного числа химических реакций. В настоящее время в биологических объектах обнаружено несколько тысяч индивидуальных ферментов, а несколько сотен из них выделено и изучено. Подсчитано, что одна живая клетка может содержать до тысячи различных ферментов, каждый из которых ускоряет ту или иную химическую реакцию.
Будучи выделены из организма, ферменты не утрачивают способность осуществлять каталитическую функцию. На этом основано их практическое применение в химической, пищевой, легкой и фармацевтической промышленности. Особое значение для химического производства имеет специфичность ферментов: ведь до 80% затрат в производстве многих химических веществ приходится на отделение примесей, возникших в результате побочных реакций. Кроме того, ферменты позволяют осуществлять ряд процессов, выполнение которых обычными методами органического синтеза остается пока нерешенной проблемой.
Протеазы относят к классу пептид-гидролаз – ферментов, ускоряющих реакции гидролиза белков, пептидов и других соединений, содержащих пептидные связи. Далее подробно рассматриваются основные области применения протеаз в различных областях промышленности.
1. Основные области применения протеаз
Пищевая промышленность
В сочетании с амилазой протеиназы, выделяемые из грибов, относящихся к роду Aspergillus, применяют в хлебопекарной промышленности. Будучи добавлены в количестве 20-50 г на 1 т муки, они улучшают качество и аромат хлеба, ускоряют созревание теста на 30%, сокращают расход сахара на производство высших сортов булочных изделий вдвое, увеличивают пористость мякиша и объем хлеба на 20%.
В кулинарии применение пептид-гидролаз (протелин и проназа) для обработки мяса перед его приготовлением резко улучшает качество мясных блюд.
В мясной промышленности протеолитические ферменты применяют для ускорения созревания мяса и повышения выхода мяса 1-го сорта с 15% до 40%.
В молочной промышленности использование протеаз ускоряет созревание сыров вдвое и снижает их себестоимость на 10%.
Легкая промышленность
В кожевенном и меховом производстве для ускорения снятия волоса со шкур и размягчения кожевенного сырья применяют препараты протеиназ (протелин и протофрадин), являющихся внеклеточными протеазами стрептомицетов. При этом время, необходимое на осуществление необходимых процессов сокращается в несколько раз, сортность и качество шерсти и кож повышается, а условия труда в этой отрасли производства резко улучшаются.
В текстильной промышленности процесс расшлихтовки тканей ферментными препаратами класса протеаз грибного происхождения ускоряется в 7-10 раз; эти же препараты служат для удаления серицина при размотке коконов тутового шелкопряда в производстве натурального шелка.
Применение в бытовой химии
Протеазы растительного происхождения, выдерживающие нагревание до 90С без заметной потери активности, являются компонентами стиральных порошков и моющих средств. Некоторые протеазы вместе с глюкозооксидазой и каталазой добавляют в зубную пасту – они обеспечивают их антимикробное действие и предохранение зубов от кариеса.
2. Применение протеаз в легкой промышленности.
В ферментативных процессах кожевенного и мехового производства чаще всего используются ферменты, относящиеся к классу протеаз. Наиболее широко применяются следующие ферменты.
Трипсин
Выделяется поджелудочной железой в виде трипсиногена, активируется автокаталитически при рН 7-9 или энтерокиназой, вырабатываемой слизистой оболочкой тонких кишок. Трипсин не является ферментом первичного действия, т.е. или совсем не расщепляет нативные белки, или действует на них слабо и медленно. Белки, денатурированные нагреванием, обработанные кислотами, солями, щелочами и пепсином, легко подвергаются действию трепсина.
Трипсин гидролизует связи (пептидные, амидные, сложноэфирные), в которых карбоксильная группа принадлежит основным аминокислотам лизину и аргинину.
Трипсин играет основную роль при мягчении голья панкреатином и его препаратами в кожевенном производстве.
Пепсин
Фермент желудочного сока, выделяемый клетками слизистой оболочки желудка в виде неактивного пепсиногена, активируется автокаталитически в присутствии соляной кислоты, превращаясь в пепсин. Пепсин является ферментом первичного воздействия, т.е. расщепляет почти все нативные белки, гидролизуя при продолжительном действии около 30% пептидных связей, однако, действует медленнее, чем другие протеиназы. Пепсин гидролизует связи аминокислот, содержащих ароматические кольца в боковой цепи и свободные карбоксильные группы.
Пепсин не действует на кератин, протамины и продукты гидролиза белков с низкой молекулярной массой. Растворы пепсина подвергаются медленному автолизу. В процессах кожевенного и мехового производства не используется, однако применяется для обработки коллагенсодержащих отходов с целью их дальнейшего растворения.
Катепсин
Фермент, находящийся в виде катепсиногена во всех животных тканях. В наибольших количествах содержится в печени, селезенке и почках. Вместе с ним присутствует естественный активатор зоокиназа, который можно отделить от катепсина. Катепсин действует на соединения, содержащие ароматическую аминокислоту, и расщепляет пептиды с N-конца пептидной связи. Обычно катепсин катализирует гидролиз белков при автолизе. В нейтральной среде он неактивен, оптимальный рН действия 4-5.
После смерти животного в тканях, в том числе в кожевенном и меховом сырье, накапливаются молочная и другие кислоты, т.е. образуется кислая среда. В результате этого катепсин приобретает способность каталитического действия на гидролиз тканевых белков. Это нужно учитывать при первичной обработке сырья, в частности нужно своевременно его консервировать.
Коллагеназа
Это специфический фермент, расщепляющий нативный коллаген на пептиды без образования аминокислот. Другие белки не расщепляет.
Коллагеназа действует на коллаген сильнее, чем на синтетические пептиды, построенные по типу коллагена. Выделяется из культур различных бактерий.
2.1 Применение протеиназ в кожевенном производстве
Отмотка кожевенного сырья
Для ускорения отмотки в производстве часто используют обострители – химические вещества, способствующие обводнению. Ускорить обводнение могут гидролитические ферменты6 протеазы,гликозидазы, липазы. Особенно эффективно действие ферментных препаратов при отмотке сырья, консервированного с применением сушки и содержащего большое количество жира.
Широкое применение в кожевенном производстве находят протеолитические ферменты: кислые, нейтральные и щелочные протеазы. В результате действия протеаз происходит частичное разделение структурных элементов дермы, что способствует улучшению обводнения и облегчает последующее обезволашивание шкур.
Обезволашивание
Обезволашивание является наиболее трудоемким подготовительным процессом кожевенного производства. Существующие неферментные методики обезволашивания не полностью удовлетворяют промышленность. Поэтому наиболее перспективно обезволашивание с помощью ферментов, поскольку при этом удается сохранить снимаемый волос, ускорить в 2-3 раза процесс и упростить очистку сточных вод, благодаря отсутствию в них серосодержащих веществ.
Обезволашивающего эффекта можно достигнуть, разрушая корень волоса путем разрыва дисульфидных связей, а также рахрушением веществ, выстилающих волосяную сумку, что способствует свободному выходу из нее волоса. Длительность процесса определяется скоростью проникания фермента к компонентам волосяной сумки – сложным белкам и белково-углеводистым комплексам. Поэтому ферментативному обезволашиванию, как правило, предшествует щелочная или ферментативная отмотка, способствующая повышению проницаемости дермы для больших молекул ферментов. Различные виды субстратов (белки, углеводы, жиры) вызывают необходимость использования композиций ферментных препаратов. Композиции могут содержать смеси ферментных препаратов, обладающих протеолитической, липолитической и гликозидазной активностью, а также различные специальные компоненты (ПАВ, антисептики, активаторы, регуляторы рН и т.д.).
Мягчение голья
Мягчение заключается в непродолжительной обработке голья ферментным препаратом в водной среде при 37-38С. в результате чего, голье приобретает мягкость пластичность, воздухопроницаемость; лицевой слой становится гладким и шелковистым.
В качестве мячителя на кожевенных заводах широко используется ферментативный препарат животного происхождения – технический панкреатин в виде порошка, получаемый из поджелудочной железы.
Панкреатин содержит ряд протеолитических ферментов – протеиназ и пептидаз, основным из которых является протеиназа – трипсин. Благодаря действию протеолитических ферментов при мягчении происходит удаление путем гидролитического расщепления продуктов частичного распада коллагена, кератина и межволоконных белков, оставшихся в голье после золения и обеззоливания.
Обработка дубленого кожевенного полуфабриката
Часто дубленый полуфабрикат требует переработки из-за различия в структуре топографических участков, физико-механических свойствах и окраске, а также из-за складок и заломов, образовавшихся при транспортировке и хранении. Для этого проводят ферментативную обработку дубленого полуфабриката с использованием кислых протеаз с оптимумом активности при рН 4,5-5. Перед ферментативной обработкой полуфабрикат промывают для удаления несвязанных соединений хрома, которые инактивируют применяемые ферменты. Кожи, подвергшиеся ферментативной обработке в кислой среде, имеют более мягкий гриф, нежную лицевую поверхность и интенсивную окраску.
2.2 Ферментативные процессы мехового производства
Отмотка мехового сырья
В последние годы предложено много методик отмотки меховых шкурок с помощью ферментных препаратов. Для более эффективного воздействия на межволоконные вещества кожевенной ткани меховых шкур целесообразно использовать ферментные препараты, имеющие несколько различных активностей. Требуемым комплексом ферментных свойств обладают препараты мальтавоморин П2х, Пп10х, Г10х. Так обработка шкурок кролика указанными препаратами позволяет не только сократить продолжительность цикла отмоточных процессов за счет более быстрого обводнения, но и значительно уменьшить количество порванных шкурок при последующем мездрении.
Обезжиривание мехового сырья
После отмотки на волосяном покрове меховых шкурок содержится значительное количество липидов, загрязнений белковой и углеводной природы. Ферментативный метод обезжиривания основан на гидролитическом расщеплении жира под действием липолитических ферментов. Ферментные препараты на их основе, как правило, содержат наряду с липазами ферменты другой активности, например протеазу и гликозидазу.
Разработаны методики обезжиривания с применением протеаз и ПАВ. Эффект обезжиривания в данном случае обусловлен тем, что протеазы способствуют расщеплению мембран жировых клеток, в результате чего натуральный жир под действием ПАВ эмульгирует. Так, в процессах мойки и обезжиривания овчин используются Ферментные препараты протеолитического действия – протосубтилин Г3х (щелочная протеаза)
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://www.monax.ru
topref.ru
Примером внеклеточных протеаз может служить система свертывания крови. Это совокупность более чем десяти разных белков. Многие из этих белков являются неактивными формами протеиназ (т.е. проферментами). Например, среди белков системы свертывания крови имеется фактор XII. Он вступает в контакт с чужеродной поверхностью (например, со стеклом при повреждении стенки сосуда) и при этом происходят конформационные изменения. На поверхность молекулы выступает ее активный центр, который был раньше спрятан. Этот белок уже становится активным и может разрушать одну пептидную связь в другом белке, который тоже в результате этого воздействия из профермента превращается в активный фермент.
Для этого активного фермента субстратом является следующий белок плазмы, который превращается под действием второго звена из профермента в активный фермент, пока процесс не дойдет до фибриногена. Очередной протеолитический фермент действует на фибриноген, превращая его в фибрин. Фибрин - не является ферментом, он плохо растворим в воде, образует нити, которые выпадают в осадок. В этом осадке запутываются форменные элементы крови. Так образуется кровяной сгусток.
Именно высокая субстратная специфичность позволяет протеиназам плазмы образовать в крови систему, звенья которой работают строго последовательно. Эта система - система свертывания крови работает по принципу каскадности. Происходит постепенное усиление первоначально слабого сигнала. Свертывание крови происходит постоянно, но оно уравновешивается процессом фибринолиза. Это обеспечивается наличием в плазме крови фермента плазмина, который образуется из плазминогена и не является звеном каскада свертывания. Плазмина, который содержится в крови, достаточно, чтобы обеспечить гидролиз фибрина внутри сосудов. При нарушениях фибринолиза наблюдается ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания).
К протеолитическим системам плазмы крови относятся также система комплемента и система регуляции сосудистого тонуса (с помощью вазоактивных пептидов).
Сериновые протеиназы
Сериновые протеиназы объединяют группу эндопептидаз, имеющих в каталитическом центре остаток серина. У большинства сериновых протеиназ в каталитическом центре находят аминокислотные остатки Асп 102, Гис 57 и Сер 195. Сериновыё протеазы ингибируют агентами, взаимодействующими с остатком серина, такими как диизопропилфторфосфат (DFP), фенилметилсульфонилфторид (PMSF), сульфогалогениды, а также природными протеолитическими ингибитора животного, растительного и микробного происхождения. Все сериновые протеиназы проявляют максимальную активность в нейтральной или щелочной среде. Молекулярная масса составляет от 12-15 кДа у ферментов с единственной полипептидной цепью, до 200-300 кДа – у ферментов с субъединичной структурой.
К группе сериновых протеиназ относятся ферменты животного, растительного и микробного происхождения, многие из которых хорошо изучены и выпускаются в виде промышленных препаратов.
В поджелудочной железе человека и млекопитающих животных синтезируются сериновыё протеиназы – трипсин (К.Ф.3.4.21.4), химотрипсины А и В (К.Ф.3.4.21.1), химотрипсин С (К.Ф.3.4.21.2). Эти ферменты образуются первоначально в виде предшественников (трипсиногена и химотрипсиногенов), которые превращаются в активные формы под действием трипсина. При протеолитическом процессинге трипсиногена от его молекулы отщепляется N-концевой гексапептид, реакция активируется кальцием.
Активная форма трипсина – однокомпонентный белок, состоящий из единственной полипептидной цепи. Фермент, выделенный из поджелудочной железы человека и различных млекопитающих, имеет молекулярную массу 22,9-25,5 кДа, оптимальный рН 7-8. Стабилен при рН не выше 6. В щелочной среде происходит самопереваривание. В организме трипсин стабилизируется с помощью ингибитора, с которым образует неактивный комплекс, устойчивый к протеолизу. Ингибитор синтезируется в поджелудочной железе. Трипсин гидролизует пептидные связи, образованные карбоксилами аргинина или лизина. Существенно наличие свободной аминогруппы диаминокислот по соседству с расщепляемой связью. Фермент гидролизует не только амидные, но также сложноэфирные связи. Он расщепляет различные животные и растительные белки, проявляет высокую активность в отношении белковых компонентов клеточных стенок микроорганизмов. Комплекс трипсина и литической мурамидазы – лизоцима, секретируемого слизистой кишечника, является важнейшим фактором регуляции состава микрофлоры пищеварительного тракта животных и человека.
Химотрипсины образуются из химотрипсиногенов после отщепления пептида, состоящего из 15 аминокислотных остатков. Молекулярная масса химотрипсинов составляет 24-25,8 кДа, оптимальный рН 7-9. Химотрипсины стабильны в кислой среде. Ферменты предпочтительно катализируют расщепление в белках пептидных связей, в образовании которых участвуют карбоксилы ароматических аминокислот. Гидролизуют также связи, образованные карбоксилами лейцина, метионина, триптофана. Химотрипсины, как и трипсин, расщепляют сложные эфиры. Разнообразие типов гидролизуемых связей определяет широкую специфичность действия химотрипсинов.
В группу сериновых входят многие внеклеточные и внутриклеточные протеиназы микроорганизмов. Классическими представителями секретируемых сериновых протеиназ бактерий являются субтилизины А, В и BPN' из культуры В. subtilis – белки молекулярной массы 26,3-27,5 кДа с оптимумом действия при рН 8-11. Многие бациллы продуцируют субтилизиноподобные сериновыё протеиназы.
Для внеклеточных сериновых протеиназ бактерий характерен оптимум действия в щелочной зоне (рН 8-12,5), при температуре 50-70° С. Ферменты стабильны в зоне рН от 6 до 13, при температуре не выше 50° С. В качестве стабилизатора могут использоваться соли кальция.
Сериновыё протеиназы входят в состав комплексных ферментных препаратов, выделяемых из грибов аспергиллов. У Asp. oryzae найдены разновидности сериновых протеиназ, которые при действии на казеин проявляют максимальную активность при рН 7-8,5 и 9-11,5.
Многие виды микроскопических грибов (p. p. Acremonium, Alternaria, Aspergillus, Cephalosporium, Fusarium, Penicillium, Trichoderma, Verticillium и др.) синтезируют внеклеточные сериновыё протеиназы. Большинство исследованных ферментов этой группы имеют молекулярную массу 18-35 кДа, оптимум действия – при рН от 5 до 12 и температуре 55-60° С. Многие сериновыё протеиназы грибов стабилизируются ионами кальция.
В соке растений присутствуют растворимые формы субтилизиноподобных сериновых протеиназ. Их выделили из плодов дыни, различных видов тыквы, из томатов, плодов маклюры (сем. тутовых), из листьев подсолнечника, корней одуванчика, клубеньков ольхи. Все исследованные растительные субтилизины – гликопротеины, фермент из маклюры содержит 25,6% углеводов. Они синтезируются в виде препроферментов, которые после протеолитического процессинга превращаются в активные формы. Молекулярная масса активных форм - 50-70 кДа, у подсолнечника – 25 кДа. Оптимальный рН действия – в интервале 7,3-11, при температуре 55-70° С. Стабильны при температуре не выше 50-60° С. Растительные субтилизины имеют широкую зону рН-стабильности: фермент из тыквы – 5-10, дыни – 4-12, подсолнечника – 4-10. Гидролизуют казеин, азоказеин, азоколлаген, гемоглобин и другие белки, преимущественно расщепляя связи, образованные гидрофобными аминокислотами (лейцином, фенилаланином, тирозином), с меньшей скоростью – образованные цистеином, дикарбоновыми аминокислотами и их амидами.
Растения синтезируют различные ингибиторы ферментов, среди которых наиболее широко представлены ингибиторы сериновых протеиназ, в частности, ингибиторы трипсина. Они найдены в семенах бобовых (сои, фасоли, гороха), злаков (пшеницы, ржи, кукурузы), гречихи, в клубнях картофеля, корнеплодах моркови, яблоках, листьях капусты и других источниках. Ингибиторы трипсина предотвращают инфицирование растений микроорганизмами и повреждение насекомыми, поскольку большая часть патогенных микроорганизмов и насекомых-вредителей синтезирует трипсиноподобные ферменты. В семенах гречихи найден медленно взаимодействующий и прочно связывающийся ингибитор трипсина, подавляющий прорастание спор и рост мицелия патогенного гриба Alternaria alternata. В клубнях картофеля присутствуют две разновидности ингибиторов сериновых протеиназ с молекулярной массой 21 и 22 кДа. Первый подавляет активность трипсина, химотрипсина и эластазы, второй – только двух первых ферментов. Среди ингибиторов химотрипсина, синтезирующихся в тканях картофеля, нашли высокоэффективный пептид массы всего 5 кДа. Расшифровка структуры низкомолекулярного ингибитора перспективна в целях создания синтетических аналогов для применения в качестве средств защиты растений и медицинских препаратов.
В семенах сои – две разновидности ингибиторов трипсина: ингибитор Кунитца и ингибитор Баумана-Бирк (ББИ). Второй способен одновременно и независимо связывать на одном центре – трипсин, а на другом – эластазу лейкоцитов человека и химотрипсиноподобные ферменты, за что получил название «двухголового». Показано, что ББИ обладает антиканцерогенным действием, препятствуя метастазированию и росту злокачественных опухолей, происходящему при участии лейкоцитарных ферментов химотрипсинового типа. Содержание ББИ в разных сортах сои составляет от 0,5 до 1,5 мг/г семян, в некоторых видах коммерческой соевой муки – до 1,9 мг/г. В семенах сои ББИ представлен несколькими изоформами, число которых, в зависимости от сорта сои, составляет от 2 до 7. Высокая биологическая активность ББИ побудила пересмотреть выводы об антипитательных свойствах соевых ингибиторов. Считают, что антипитательные свойства связаны с присутствием в сое большого количества таннинов – неспецифических ферментных ингибиторов широкого спектра, а также гемаглютининов.
Помимо ингибиторов собственно сериновых протеиназ, растения синтезируют бифункциональные ингибиторы, подавляющие активность α-амилазы и сериновых протеиназ. Такие ингибиторы характерны для семян злаков. В процессах гидролиза растительных белков необходимо принимать во внимание присутствие ингибиторов в растительном сырье.
Сериновыё протеиназы животного и микробного происхождения прочно вошли в номенклатуру промышленных феррментных препаратов. Из животного сырья производят трипсин, химотрипсин и комплексный препарат панкреатин с активностью обоих этих ферме
biofile.ru
КЛАССИФИКАЦИЯ БЕЛКОВ ПО ФОРМЕ МОЛЕКУЛ
Это одна из самых старых классификаций, которая делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков - рассмотренные выше миоглобин и гемоглобины.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией.
КЛАССИФИКАЦИЯ БЕЛКОВ ПО ХИМИЧЕСКОМУ СТРОЕНИЮ
Простые белки
Некоторые белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют «простые белки». Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд . Рассмотренный выше белок межклеточного матрикса эластин также относят к простым белкам.
Сложные белки
Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют «сложные белки». Прочно связанная с белком небелковая часть носит название про-стетической группы.
Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины. В состав гемопротеинов, кроме уже рассмотренных выше белков гемоглобинов и миоглобина, входят ферменты - цитохромы, каталаза и пероксидаза. Гем, присоединённый к разным белковым структурам, выполняет в них характерные для каждого из белков функции (например, в составе гемоглобина переносит О2, а в составе цитохромов - электроны).
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами.
КЛАССИФИКАЦИЯ БЕЛКОВ
ПО ФУНКЦИЯМ

Семейство сериновых протеаз
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах).
Для всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз).
Семейство иммуноглобулинов
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов.
Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ. light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидны-ми связями. Поэтому молекулу IgG относят к мономерам.
Классы иммуноглобулинов. Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ε, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A, D, E, G и M. Особенности строения тяжёлых цепей придают их «шарнирным участкам» и С-концевым областям характерную для каждого класса кон-формацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками).
Иммуноглобулины, особенности строения, избирательность
Читайте также:
lektsia.com
Активный центр РНКазы А и структура фермент-субстратного комплекса. В рибонуклеазе имеется четко выраженная расщелина для связывания субстрата, в ней располагаются Lys7, Gln11, His12, Lys41, Thr45, Lys66, His119, Phe120, Ser123 (P0, R1, B1, P1, R2, B2, P2, B3 - места связывания соответственно 5’-фосфатной группы, рибозы, урацила, фосфатной группы, рибозы, аденина, фосфатной группы, аденина тринуклеотида - pUpApA).

Схема механизма действия РНКазы А
Пиримидиновое основание (на схемах Ura) образует три водородные связи с Ser123 (ОН-гр.) и Thr45 (ОН- и NH-гр.) и находится в стэкинге с ароматическим кольцом Phe120. His119 и Gln11 образуют водородные (Н–Н) связи с кислородами гидролизуемой фосфодиэфирной связи, а His12 с 2’–ОН-группой рибозы пиримидина. Кислороды фосфатных групп Р0, Р1 и Р2, образуют электростатические взаимодействия с Lys66, Lys41 и Lys7, соответственно.
На стадии циклизации His12 выступает в роли общего основного катализатора, а His119 ¾ в роли общей кислоты. Заряженный имидазольный остаток His119 подает протон, необходимый для образования 5'-гидроксигруппы аденозина, а непротонированный His12 отнимает протон от 2'-гидроксигруппы, атакуемой атомом Р (первая реакция схемы).
На стадии гидролиза His12 и His119 меняются ролями; His119 активирует атаку воды по механизму общего основного катализа, а His12 является кислотным катализатором, протонирующим уходящую группу (нижняя реакция схемы).
Сериновые протеазы (ЕС 3.4.21.) являются ферментами, гидролизующими пептидные связи в белках.
Активный центр сериновых протеаз и структура фермент-субстратного комплекса. В протеазах есть «карман», связывающий боковую цепь С-концевой расщепляемой аминокислоты.
Каталитический центр протеаз представлен сериновой триадой – серином, гистидином и аспартатом. В случае химотрипсина - это Ser-195, His-57 и Asp-102.
Химический механизм действия сериновых протеаз как пример нуклеофильного катализа. Механизм действия сериновых протеаз хорошо исследован на примере трипсина, химотрипсина и эластазы, отличающихся лишь специфичностью по отношению к природе карбонильного компонента расщепляемой пептидной связи.
На первой стадии гидролиза пептидов химотрипсином (ЕС 3.4.21.1.) - ацилирования, в результате атаки субстрата гидроксилом Ser195 образуется невалентно связанное промежуточное соединение, превращающееся в тетраэдрическое промежуточное соединение (см. схему ниже). Затем оно распадается с образованием ацилфермента - промежуточного продукта катализа, при этом расщепляется пептидная связь.
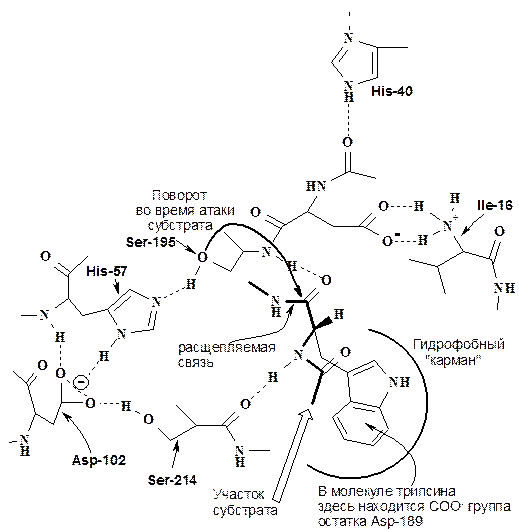
Схема фермент-субстратного комплекса (химотрипсин)
На второй стадии гидролиза пептида - деацилирования, ацилфермент гидролизуется с отщеплением N-концевой части полипептида и одновременной регенерацией в активном центре триады аминокислот.
Каталитическая активность химотрипсина определяется необычайно высокой реакционноспособностью Ser-195. Находящиеся рядом карбоксилат-анион аспартата и имидазольная группа гистидина формируют систему переноса заряда. Эта система играет ключевую роль в катализе, благодаря способности связывать протон и обеспечивает с одной стороны челночную передачу протона, а с другой – повышает нуклеофильный характер остатка серина в активном центре.
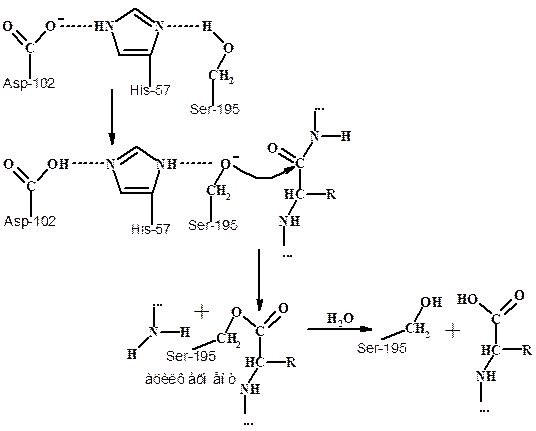
Схема механизма действия сериновых протеаз (химотрипсина)
Для осуществления электрофильного или окислительно-восстановительного катализа белковые молекулы фермента сами по себе неактивны и требуют присутствия кофакторов - ионов металлов или сложных органических молекул (простетических групп), белковая часть фермента без кофактора называется апоферментом.
Карбоксипептидаза А (ЕС 3.4.17.1.)– пример фермента, кофактором которого является ион цинка, осуществляющего благодаря последнему электрофильный катализ.
Панкреатическая карбоксипептидаза А – экзопептидаза, гидролизующая С-концевую пептидную связь в полипептидах; она специфична к объемным остаткам гидрофобных аминокислот, содержащим ароматическую или большую алифатическую боковую цепь.
vunivere.ru