|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Жесткость воды и ее устранение. Реферат устранение жесткости воды на промышленных предприятиях
Устранение жёсткости воды
Содержание
1.Введение. 3
2. Определение жесткости воды. 4
3. Устранение жёсткости воды на промышленных предприятиях. 5
3.2 Магнитная обработка воды 14
3.3 Электромагнитное воздействие с переменной частотой 15
4.Заключение 16
5. Список литературы 17
1.Введение
В пещерах спелеологи встречаются с красивейшими известковыми образованьями – свешивающимися со сводов сталактитами и растущими вверх сталагмитами. С точки зрения химии, возникновение этих удивительных творений природы – это жесткость подземных вод. Понятие жесткости воды мы встречаем не только в спелеологии и в геологии, а, вообще, повсеместно – в химии, техники и производстве. И поэтому это понятие очень важно для определения качества воды.
2.Определение жесткости воды
Жёсткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде.
Жесткость - это особые свойства воды, во многом определяющие её потребительские качества и потому имеющие важное хозяйственное значение. Жесткая вода образует накипь на стенках нагревательных котлов, батареях и пр., чем существенно ухудшает их теплотехнические характеристики. Такой тонкий слой на греющей поверхности вовсе не безобиден, так как продолжительность нагревания через слой накипи, обладающей малой теплопроводностью, постепенно возрастает, дно прогорает все быстрее и быстрее – ведь металл охлаждается с каждым разом все медленнее и медленнее, долго находится в прогретом состоянии. В конце концов, может случиться так, что дно сосуда не выдержит и даст течь. Этот факт очень опасен в промышленности, где существуют паровые котлы
Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает еще и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки и повышая расход моющего средства, т.е. жесткая вода плохо мылится
Существует два типа жесткости: временная и постоянная. Обусловлено это различие типом анионов, которые присутствуют в растворе в качестве противовеса кальцию и магнию.
Временная жесткость связана с присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
Постоянная жесткость (или некарбонатная) возникает, если в растворе присутствуют сульфатные, хлоридные, нитратные и другие анионы, соли кальция и магния которых хорошо растворимы и так просто не удаляются. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом:
3.Устранение жёсткости воды на промышленных предприятиях.
Самый простой способ борьбы с карбонатной жесткостью - прокипятить воду. При этом гидрокарбонат кальция распадается с выделением углекислого газа и выпадением в осадок карбоната кальция. Этот процесс мы можем наблюдать при кипячении воды в чайнике. В промышленности термический способ применяют при наличии дарового тепла. Реагентные методы наиболее распространены на станциях муниципальной водоподготовки и сводятся к переводу солей кальция в нерастворимые соединения, выпадающие в осадок. В зависимости от состава воды прибавляют соду, гашеную известь или и то, и другое. Вода умягчается и попутно освобождается от мутных взвесей. Неудобства и недостатки способа следующие: большой объем твердых отходов, необходимость точной дозации химикатов и специально оборудованные склады для их хранения. Полное представление о содово-известковом способе можно получить, умягчая воду для стирки "бабушкиным" способом с помощью кальцинированной соды (карбонат натрия). Обычно достаточно одной-двух чайных ложек без верха на ведро воды. Растворите соду в небольшом количестве воды, затем размешайте и дождитесь выпадения осадка карбоната кальция. Так умягчали воду еще в Древней Греции, добавляя в нее печную золу. Обратный осмос и электродиализ применяются при одновременном обессоливании воды, в том числе и для питьевых целей. Поэтому наибольшее распространение получил способ умягчения на синтетических ионнообменных смолах. Во время работы ионы жесткости, имеющиеся в исходной воде, заменяются на ионы натрия смолы, отсюда и название способа. Во время регенерации ионообменной смолы раствором поваренной соли осуществляется обратный процесс: ионы натрия из поваренной соли заменяются на ионы солей жесткости, задержанные смолой. Технически это воплощается в современных импортных умягчителях, представляющих собой высокопрочный напорный бак (по виду напоминающий газовый баллон), заполненный ионообменной смолой. Бак сконструирован из пищевого полиэтилена и армирован снаружи стекловолокном. Это позволяет ему работать под давлением до 8,8 атмосфер и выдерживать гидравлический удар до 53 атмосфер. Выпускаются баки самых различных размеров, что позволяет в зависимости от анализа исходной воды и необходимой производительности подобрать фильтр на основе типового оборудования. В этом Вам с удовольствием помогут представители фирм, занимающихся очисткой воды. Программируемый автоматический клапан, управляющий работой умягчителя (регенерирующий ионообменную смолу в нужной последовательности с необходимой частотой без вмешательства людей), настраивается таким образом, что включает фильтр на регенерацию или по расходу воды, или по времени. Частота регенераций рассчитывается в зависимости от жесткости исходной воды и емкости умягчителя по солям жесткости. Изменение направления потоков воды во время регенерации достигается, в зависимости от фирмы-производителя автоматических клапанов, либо системой рабочих клапанов (как в музыкальной шкатулке), либо передвижениями поршня с проточками, либо вращением программного диска с отверстиями (как в керамическом кране). Реже используются системы, работающие с применением гидравлических, пневматических и соленоидных клапанов. Из реагентного бака во время регенерации поступает раствор поваренной соли для восстановления рабочих свойств ионообменной смолы. В настоящее время номенклатура умягчителей настолько велика, что позволяет повсеместно применять их как для бытовых, так и для промышленных целей. Очень часто промышленные умягчители отличаются от бытовых только размером баллонов и объемом смолы, хотя и не всегда. Любому умягчителю - и бытовому, и промышленному - необходимо время на проведение регенерации. Если потребность в умягченной воде небольшая и производство не является непрерывным, то с задачей может справиться и бытовая модель умягчителя. Для непрерывного производства используют так называемые TWIN-системы, или дуплексные умягчители. Выглядят они следующим образом: два баллона управляются одним общим клапаном. Баллоны со смолой работают попеременно: через один проходит умягчаемая вода, ионообменная смола другого в это время регенерируется. Как правило, умягчители непрерывного действия используются для водоподготовки в небольших котельных. (подробнее см. Оборудование) Главное отличие между бытовыми умягчителями и пищевым производством с одной стороны, и непищевым производством с другой стороны состоит в том, что в первом случае необходимо использовать ионообменную смолу только пищевого класса. Так как ионообменная смола является продуктом полимеризации, то существует вероятность вымывания молекул исходных продуктов-мономеров в первые дни эксплуатации. При производстве пищевой формы смолы осуществляется дополнительный медицинский контроль готовой продукции. Соль для регенерации бытовых умягчителей тоже должна отвечать пищевым стандартам. К тому же высокая степень очистки соли от ионов кальция и магния обеспечивает смоле более высокую удельную обменную емкость во время регенерации. Итак, с мягкой водой и способами ее получения разобрались. Вернемся к вопросу пользы жесткой воды для питья. Действительно, недостаток кальция в организме чреват заболеваниями опорно-двигательной системы, а недостаток магния провоцирует инфаркт. Это неоспоримая медицинская статистика. Однако та же самая медицинская статистика приводит данные о заболевании населения мочекаменной болезнью, артритом и склерозом (отложения солей кальция в суставных сумках и сосудах головного мозга соответственно). И увеличение заболеваемости странным образом совпадает с увеличением жесткости потребляемой питьевой воды (см. статью Здоровье и вода.). Однако, в районах с малой жесткостью потребляемой воды почему-то не наблюдается увеличения количества больных остеопорозом, рахитом и сердечно-сосудистыми заболеваниями. То есть жесткость потребляемой воды - ионы кальция и магния - никоим образом не связана с заболеваниями, которыми нас так пугают. Почему? Потому что недостаток кальция в организме лучше восполнять с молоком и молочными продуктами, от жесткой воды можно получить только камни в почках и суставах и толстый слой накипи в чайнике. Кальция в 100 граммах молока "ПАРМАЛАТ" содержится 120 мг. То есть жесткость молока составляет 60 мг-экв/л. Стакан молока заменит 3-4 литра выпитой московской воды. То же самое относится к железу: людям, страдающим малокровием, лучше есть виноград, яблоки, гранаты, пить соки - от железистой воды печень страдает больше, чем от неумеренного пьянства. Кстати, о соке. Внимательно прочитаем его состав на этикетке. Например, томатный сок "WIMM-BILL-DANN" Лианозовского завода: Калий - 155 мг/100 г продукта, то есть 1 550 мг/л. Магний - 7 мг/100 г, или 70 мг/л, или 5,75 мг-экв/л. Кальций - 90 мг/л, или 4,5 мг-экв/л. То есть жесткость сока - 5,75 + 4,5 = 10,25 мг-экв/л. Жесткость усвояемая, полезная для здоровья. Почему питьевая вода, расфасованная в пластиковые бутылки, жесткая, если и для приготовления пищи предпочтительна мягкая вода с малым солесодержанием? Ответ гораздо прозаичнее, чем может показаться. С заботой о здоровье это если и связано, то далеко не в первую очередь и не так, как нас уверяют в рекламе. Вода без солей лучше для приготовления кофе и чая, но она безвкусная и утоляет жажду плохо. Утолить жажду в жаркий день можно только компенсировав уходящие из организма с потом соли. Но обычная поваренная соль придает воде солоновато-горький привкус, а гидрокарбонат кальция - приятный сладковатый.
Железо в воде и методы его устранения
Лет двадцать назад никто особо и не задумывался над качеством воды (не считая специалистов Водоканала, занятых этим по долгу службы). Знали, что у нас в стране - самая лучшая в мире вода. В городе - "хорошая, только жесткая, а хлоркой почти не пахнет, разве что только по весне". В деревне - "хорошая, колодезная, самая что ни на есть природная". На даче - "хорошая, только на колонку ходить далеко. А что железа много - зато в Железноводск ездить не надо, курорт прямо под боком". Из диалога героев фильма "Мимино" зрителям запомнилось, что "самая вкусная вода - в Сан-Франциско", на втором месте - вода из солнечного Дилижана, хотя жителями других городов и весей эти утверждения оспаривались, подобно семи греческим городам, борющихся за право называться родиной Гомера. С началом гласности, появлением "желтых" газет и "жареных" репортажей ситуация изменилась на прямо противоположную. Свою воду ругали с тем же воодушевлением, с каким раньше хвалили. Сейчас страсти немного улеглись и к вопросу качества воды относятся более прагматично. Если качество воды не устраивает, ее очищают в домашних условиях. С жесткостью научились бороться раньше всего - кипячением. Для устранения запаха сегодня уже не требуется воду отстаивать или кипятить. Фильтры на основе активированного угля в форме насадок на кран, кувшинчиков и картриджей рекламируются на каждом третьем трамвае. В магазинах на полках изобилие очищенной бутылированной воды. Но... все это касается только воды для питья. А начинаешь наполнять ванну - течет железистая жидкость желто-зеленого цвета, отбивающая желание в ней купаться. Откуда появляется железо в воде и как его оттуда удалить? Дождь - природный конденсат - поглощает углекислый газ из атмосферы, поэтому имеет слабокислую реакцию. Если вода проходит через известняки, то, растворяя их, становиться жесткой. При прохождении через железистые руды растворяет железо, через марганцевые - марганец... Из школьного курса химии и из личного опыта известно, что железо в природе встречается двухвалентное - растворенное и трехвалентное - обычно в виде знакомой ржавчины. Также существуют органические соединения железа и так называемые железобактерии. Примером наличия железоорганики можно считать высокоцветные воды северных рек. В природных условиях эти соединения достаточно стойкие, кислородом воздуха практически не окисляются. Для очистки такой воды от железа используют специальные методы - озонирование, коагуляция, флокуляция. Железобактерии встречаются практически везде. Их "визитной карточкой" можно считать ржавую слизь, покрывающую трубы водопровода. Железобактерии питаются растворенным в воде железом, а когда отмирают, откладываются в виде вышеупомянутой слизи. Кстати, согласно одной из гипотез, крупные месторождения железных руд являются доисторическими кладбищами железобактерий, сконцентрировавших железо на малом пространстве. В крупных городах забор воды идет в основном из поверхностных источников - рек, озер, водохранилищ. Такая вода практически не содержит растворенного железа - оно окисляется на воздухе и выпадает в осадок в виде гидроокиси. К тому же вода, как правило, проходит очистку на муниципальных станциях водоподготовки, где ее фильтруют и обеззараживают. Поэтому железо может появиться в такой воде только из-за коррозии стальных труб водопровода, которая происходит в присутствии воздуха. Обычно это бывает после перебоев с водой или ремонта трубопроводов - сначала вода идет из "чихающего" крана ржавая, затем становится прозрачной. Немного особняком стоит Санкт-Петербург и другие города с очень мягкой водой. Такая вода не дает известковых отложений на бойлерах и накипи в чайниках, но обладает повышенной коррозионной агрессивностью (опять углекислота!). Поэтому вода может идти постоянно желтоватого цвета, особенно если трубопровод насчитывает не один десяток лет. В обоих случаях железа в воде мало, и все оно находится в нерастворимой окисленной форме, поэтому предпочтение следует отдать патронным фильтрам со сменными механическими картриджами сплошностью фильтрации 20 - 30 микрон. Это защитит кафель, фаянс и стиральную машину. Поселковый водопровод в отличие от городского качает воду из артезианской скважины, в которой, как правило, есть растворенное железо. Когда для водоснабжения используется водонапорная башня, то растворенное железо при контакте с кислородом воздуха начинает окисляться уже в ней и частично выпадает в виде осадка в башне и трубопроводах. Если водоразбор осуществляется быстрее, чем железо успевает окислиться, а хлопья осадка - сформироваться, то к потребителю вода приходит прозрачная или слегка желтоватая. Содержание железа в такой воде на порядок выше, чем в городской, и присутствует постоянно. Обычные механические картриджи задерживают только выпавшее железо, пропуская растворенное, и хватает их ненадолго. Итак, для того чтобы перевести железо в нерастворимую форму, его надо сначала окислить. А затем отфильтровать осадок на зернистой загрузке, которая обладает большей грязеемкостью по сравнению с картриджем. Способов окисления железа множество. Это и уже упомянутый просто контакт воды с воздухом, осуществляемый в водонапорной башне, и свободный излив с высоты, и душирование, и фонтанирование (так называемые брызгальные установки), и барботаж - продувание воздухом, и эжекция через сопла Вентури, и подача воздуха в линию компрессором. У всех приведенных выше способов окисление происходит кислородом воздуха, бесплатным природным окислителем. Он обладает только одним недостатком - для окисления железа требуется длительное время, как правило, 15-30 минут. То есть требуется контактная емкость, а иногда и повысительный насос. Сократить время окисления железа помогают катализаторы. При нанесении на зернистые среды получается фильтрующая засыпка для удаления железа, но подробнее об этом см. в "Обезжелезивание"). При контакте с жидким окислителем или с зернистой загрузкой, обладающей окисляющей способностью, время сокращается на 3-4 порядка, то есть в тысячу раз. Когда вода подается напрямую из скважины и нет контакта с воздухом, растворенное железо окисляется непосредственно у потребителя - в ванной, в бассейне, в сливном бачке. Ввиду этих особенностей в области коттеджных систем водоподготовки широкое распространение получили уже упомянутые зернистые среды, обладающие окислительной способностью. Интересна история их создания: первоначально в качестве фильтрующей среды для осадочных фильтров применяли дробленый кварц (кварцевый песок), дешевый инертный материал. Стали применять его и для фильтрации выпавшего осадка гидроокиси железа. Со временем было замечено, что порыжевший, покрывшийся пленкой гидроокиси железа в процессе работы песок удаляет растворенное железо быстрее и качественнее, чем исходный, чистый. Предположив, что это связано с каталитическими свойствами пленки гидроокиси железа, начали производство фильтрующих сред специально для обезжелезивания и поиск новых катализаторов. Скорость катализа у оксида марганца оказалась выше, он обладает не только каталитическими, но и окислительными свойствами, но дробленый природный минерал - пиролюзит - оказался еще тяжелее кварцевого песка, то есть требовал еще больше воды для промывки. Стали покрывать пленкой оксида марганца более легкие материалы - сульфоугли, полимерную загрузку и т. д. В конце концов остановили свой выбор на алюмосиликатах, природных и искусственных цеолитах. В зависимости от содержания оксида марганца меняется плотность фильтрующей среды, скорость катализа, емкость засыпки по железу и так называемая буферная емкость - то количество железа, которое катализатор среды может окислить сам, без помощи растворенного в воде кислорода. Преимущественно это импортные материалы, имеющие, как правило, фирменное название: Birm, МТМ, Pyrolox, Manganese Greensand. Два последних названия - один и тот же материал, покрытый оксидом марганца глауконит. Благодаря относительно высокому содержанию оксида марганца, каталитическое окисление железа кислородом воздуха на нем происходит быстрее по сравнению с другими фильтрующими средами, и он обладает уже упомянутыми окислительными свойствами: растворенное в воде железо окисляется с двухвалентного до трехвалентного состояния, а марганец фильтрующей среды при этом восстанавливается с четырехвалентного до трехвалентного состояния. По окончании фильтрации засыпка регенерируется раствором перманганата калия, трехвалентный оксид марганца вновь окисляется до четырехвалентного. Коттеджный автоматический обезжелезиватель с окислительной фильтрующей средой устроен следующим образом: баллон, являющийся корпусом фильтра, заполнен фильтрующей средой. В верхней части баллона закреплен автомат, меняющий направление потоков воды во время фильтрации и циклов регенерации и соблюдающий оптимальную продолжительность каждого цикла. Автомат управляется таймером или расходомером. От автомата внутри баллона через всю фильтрующую среду проходит так называемая водоподъемная труба. Фильтр соединен с реагентным баком гибкой трубкой. Во время фильтрации вода проходит через фильтрующую среду сверху вниз, поднимается по водоподъемной трубке и выходит из фильтра-обезжелезивателя. Далее следует цикл обратной промывки: вода из входного штуцера направляется в водоподъемную трубку, взрыхляет марганцевый цеолит, вынося загрязнения в канализацию. Затем идет реагентная обработка раствором марганцовки, восстанавливающая химическую активность фильтрующей среды. После этого следует цикл промывки марганцевого цеолита от остатков марганцовки. И, наконец, цикл пополнения реагентного бака водой, который обычно совмещен с циклом прямой промывки, во время которого фильтрующая среда "уминается" потоком воды. После окончания регенерации фильтр снова готов к работе. Обезжелезиватели с реагентной промывкой требуют периодического пополнения реагентного бака марганцовкой и регулярной прочистки эжектора реагентной линии - места выпадения окисляющегося марганцовкой растворенного железа. Конструкция обезжелезивателя с каталитической фильтрующей средой отличается отсутствием реагентного бака и соответствующих циклов регенерации. Загрязнения удаляются при обратной промывке, затем сразу следует цикл прямой промывки. К плюсам подобного оборудования следует отнести безреагентную работу. Минусы - фильтрующая среда работает в более жестких условиях. Так как скорость работы каталитической среды меньше, ее требуется в два раза больше для достижения той же производительности. При поступлении воды непосредственно из скважины требуется оборудование для ее аэрации, контактная емкость при наличии сероводорода или содержании железа выше определенного уровня и система автоматики для управления аэрирующим оборудованием. Опасность завоздушивания баллона при работе в напорной линии и как следствие - вероятность гидравлических ударов. Фильтры-обезжелезиватели вне зависимости от наполнителя достаточно неприхотливы в работе и требуют только еженедельной промывки во избежание слеживания фильтрующей среды, проходящей в автоматическом режиме.
3.2 Магнитная обработка воды в промышленности
В последние десятилетия, как в России, так и за рубежом для борьбы с образованием накипи и инкрустаций применяют магнитную обработку воды. Ее широко используют в конденсаторах паровых турбин, в парогенераторах низкого давления и малой производительности, в тепловых сетях и системах горячего водоснабжения, в различных теплообменных аппаратах. В сравнении с распространенными методами умягчения воды магнитную обработку отличают простота, дешевизна, безопасность, экологичность, низкие эксплутационные расходы.
Первый патент на аппарат магнитной обработки воды был выдан бельгийскому инженеру Т. Вермейрену в 1946 г. Еще в 1936 г. он обнаружил, что при нагреве воды, пересекшей силовые линии магнитного поля, на поверхности теплообмена накипь не образуется [4].
Механизм воздействия магнитного поля на воду и содержащиеся в ней примеси окончательно не выяснен, но имеется ряд гипотез. Специалистами МЭИ и МГСУ выполнен большой объем работ по изучению влияния магнитного поля на процессы образования накипи, разработаны аппараты для магнитной обработки воды, сформулированы технические требования и условия их использования для практических целей.
Современные воззрения объясняют механизм воздействия магнитного поля на воду и ее примеси поляризационными явлениями и деформацией ионов солей. Гидратация ионов при обработке уменьшается, ионы сближаются и образуют кристаллическую форму соли. В основу одной из теорий положено влияние магнитного поля на коллоидные примеси воды, по другой - изменяется структура воды. При наложении магнитного поля в массе воды формируются центры кристаллизации, вследствие чего выделение нерастворимых солей жесткости происходит не на теплопередающей поверхности (нагрева или охлаждения), а в объеме воды. Таким образом, вместо твердой накипи в воде появляется мигрирующий тонкодисперсный шлам, который легко удаляется с поверхности теплообменников и трубопроводов. В аппаратах магнитной обработки вода должна двигаться перпендикулярно магнитным силовым линиям.
Очень интересное объяснение механизма магнитной обработки воды предлагает В.А. Присяжнюк в своей работе [4]. Известно, что карбонат кальция может кристаллизоваться в двух модификациях (кальцит или арагонит), при этом основной солью, осаждающейся на теплообменном оборудовании, является карбонат в форме кальцита. Магнитная обработка «заставляет» карбонат кальция кристаллизоваться в виде арагонита, у которого ниже адгезия (прилипание) к материалу теплообменной поверхности, а также ниже силы когезии (слипания) кристаллов между собой. Для объяснения данного явления автор [4] использует теорию магнито-гидродинамического (МГД) резонанса. При пересечении жидкостью магнитных силовых линий создается сила Лоренца, которая и вызывает структурную перестройку карбоната (изменение энтропии вещества) при ее попадании в резонанс с собственными колебаниями частиц вещества (молекулами, ионами, радикалами).
В настоящее время в России выпускают два типа аппаратов для магнитной обработки воды - с постоянными магнитами и электромагнитами. Время пребывания воды в аппарате определяется ее скоростью в пределах 1-3 м/с.
Условия использования аппаратов для магнитной обработки воды приведены в справочнике [2]:
- подогрев воды должен осуществляться до температуры не выше 95 °С;
- карбонатная жесткость должна быть не выше 9 мг-экв/л;
- содержание растворенного кислорода должно быть не более 3 мг/л, а сумма хлоридов и сульфатов - не более 50 мг/л;
- содержание двухвалентного железа в артезианской воде допускается не больше 0,3 мг/л.
Для определения противонакипного эффекта Э, % используется следующее выражение:
Э = (mн - mм) * 100/ mн, (1)
где - mн и mм - масса накипи, образовавшейся на поверхности нагрева при кипячении в одинаковых условиях одного и того же количества воды с одинаковым исходным химическим составом, соответственно необработанной и обработанной магнитным полем, г.
Несмотря на все достоинства аппаратов для магнитной обработки воды, на практике эффект обработки зачастую проявлялся только в первый период эксплуатации, затем результат пропадал. Появился даже термин - эффект «привыкания» воды. Свои свойства омагниченная вода сохраняет меньше суток. Это явление потери магнитных свойств называется релаксацией. Поэтому в тепловых сетях кроме омагничивания подпиточной воды необходимо обрабатывать воду, циркулирующую в системе путем создания так называемого антирелаксационного контура, при помощи которого обрабатывается вся вода, циркулирующая в системе
3.3 Электромагнитное воздействие с переменной частотой
В конце прошлого тысячелетия появились зарубежные и отечественные аппараты для обработки воды электромагнитными волнами в диапазоне звуковых частот, которые имеют существенные преимущества перед аппаратами для магнитной обработки воды. Их отличает небольшие габариты, простота монтажа и обслуживания, экологическая безопасность, низкие эксплутационные расходы. Значительно расширен диапазон условий их применения, в первую очередь для воды с высокой жесткостью, отсутствуют высокие требования по общему содержанию солей, устранен эффект «привыкания» воды. Кроме того, обработанная питьевая вода сохраняет кальций и магний, которые необходимы нашему организму для опорно-двигательной, сердечно-сосудистой и нервной систем. Т.е. устройства данного типа можно использовать не только для защиты теплообменного оборудования, систем горячего водоснабжения и пр., но и для систем водоочистки и коммуникаций питьевой воды. Еще одно преимущество этих аппаратов - разрушение сформировавшихся ранее отложений солей жесткости в течение 1-3 месяцев.
stud24.ru
Жесткость воды и ее устранение - Реферат
Реферат по химии
Тема: “Жесткость воды”
Исполнитель работы: Грабин Павел .
План
1. Введение 3
2. Определение жесткости воды. 3
3. Методы устранения жесткости 4
4. Список литературы 6
Введение
В пещерах спелеологи встречаются с красивейшими известковыми образованьями – свешивающимися со сводов сталактитами и растущими вверх сталагмитами. С точки зрения химии, возникновение этих удивительных творений природы – это жесткость подземных вод. Понятие жесткости воды мы встречаем не только в спелеологии и в геологии, а, вообще, повсеместно – в химии, техники и даже в быту. И поэтому это понятие очень важно для определения качества воды.
Определение жесткости воды
Жёсткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде.
Жесткость - это особые свойства воды, во многом определяющие её потребительские качества и потому имеющие важное хозяйственное значение. Жесткая вода образует накипь на стенках нагревательных котлов, батареях и пр., чем существенно ухудшает их теплотехнические характеристики. Такой тонкий слой на греющей поверхности вовсе не безобиден, так как продолжительность нагревания через слой накипи, обладающей малой теплопроводностью, постепенно возрастает, дно прогорает все быстрее и быстрее – ведь металл охлаждается с каждым разом все медленнее и медленнее, долго находится в прогретом состоянии. В конце концов, может случиться так, что дно сосуда не выдержит и даст течь. Этот факт очень опасен в промышленности, где существуют паровые котлы
Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает еще и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки и повышая расход моющего средства, т.е. жесткая вода плохо мылится
Существует два типа жесткости: временная и постоянная. Обусловлено это различие типом анионов, которые присутствуют в растворе в качестве противовеса кальцию и магнию.
Временная жесткость связана с присутствием в воде наряду с катионами Ca2+ , Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3 - ).
Постоянная жесткость (или некарбонатная) возникает, если в растворе присутствуют сульфатные, хлоридные, нитратные и другие анионы, соли кальция и магния которых хорошо растворимы и так просто не удаляются. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В
разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом:- Мягкая вода с жесткостью менее 3,0 мг-экв/л,
- Средней жесткости – 3,0-6,0 мг-экв/л
- Жесткая – более 6,0 мг-экв/мл.
Методы устранения жесткости.
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок.
Ca2 + 2HCO3 - = CaCO3 ↓ + h3 O + CO2 ↑
С ионами железа реакция протекает сложнее из-за того, что FeCO3 неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH)3 , представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении.
С постоянной жесткостью бороться труднее. Один из вариантов: вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лед превратить обратно в воду. Все соли, которые образую жесткость, остаются в не замершей воде.
Еде один способ – перегонка, то есть, испарение воды с последующие ее конденсацией. Так как соли относятся к нелетучим соединениям, они остаются, а вода испаряется.
Но такие методы, как замораживание и перегонка пригодны только для смягчения небольшого количества воды. Промышленность же имеет дело с тоннами. Поэтому используют другие методы. Наиболее широко используется катионообменный способ, основанный на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия.
С последствием жесткости воды - накипью, с точки зрения химии можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной. Последняя и занимает место угольной, которая, будучи неустойчивой, разлагается на воду и углекислый газ. В состав накипи могут входить и силикаты, и сульфаты, и фосфаты. Но если разрушить карбонатный “скелет”, то и эти соединения не удержатся на поверхности.
В качестве средства для удаления накипи применяются также адипиновая кислота и малеиновый ангидрид, которые добавляются в воду. Эти вещества слабее сульфаминовой кислоты, поэтому для снятия накипи необходимо так же кипячение.
Список литературы :
1. Шпаусус З. Путешествие в мир химии – М.: Просвещение, 1967. – 431с.
2. Харлампович Г.Д. и др. Многоликая химия. – М.: Просвещение, 1992.-159 с.
3. Хомченко Г.П. Учебник химии –М.: Новая волна, 1996. – 304с.
www.litsoch.ru
Жесткость воды и ее устранение
Реферат по химии
Тема: “Жесткость воды”
Исполнитель работы: Грабин Павел .
План
1. Введение 3
2. Определение жесткости воды. 3
3. Методы устранения жесткости 4
4. Список литературы 6
Введение
В пещерах спелеологи встречаются с красивейшими известковыми образованьями – свешивающимися со сводов сталактитами и растущими вверх сталагмитами. С точки зрения химии, возникновение этих удивительных творений природы – это жесткость подземных вод. Понятие жесткости воды мы встречаем не только в спелеологии и в геологии, а, вообще, повсеместно – в химии, техники и даже в быту. И поэтому это понятие очень важно для определения качества воды.
Определение жесткости воды
Жёсткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде.
Жесткость - это особые свойства воды, во многом определяющие её потребительские качества и потому имеющие важное хозяйственное значение. Жесткая вода образует накипь на стенках нагревательных котлов, батареях и пр., чем существенно ухудшает их теплотехнические характеристики. Такой тонкий слой на греющей поверхности вовсе не безобиден, так как продолжительность нагревания через слой накипи, обладающей малой теплопроводностью, постепенно возрастает, дно прогорает все быстрее и быстрее – ведь металл охлаждается с каждым разом все медленнее и медленнее, долго находится в прогретом состоянии. В конце концов, может случиться так, что дно сосуда не выдержит и даст течь. Этот факт очень опасен в промышленности, где существуют паровые котлы
Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает еще и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки и повышая расход моющего средства, т.е. жесткая вода плохо мылится
Существует два типа жесткости: временная и постоянная. Обусловлено это различие типом анионов, которые присутствуют в растворе в качестве противовеса кальцию и магнию.
Временная жесткость связана с присутствием в воде наряду с катионами Ca2+ , Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3- ).
Постоянная жесткость (или некарбонатная) возникает, если в растворе присутствуют сульфатные, хлоридные, нитратные и другие анионы, соли кальция и магния которых хорошо растворимы и так просто не удаляются. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом:
- Мягкая вода с жесткостью менее 3,0 мг-экв/л,
- Средней жесткости – 3,0-6,0 мг-экв/л
- Жесткая – более 6,0 мг-экв/мл.
Методы устранения жесткости.
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок.
Ca2 + 2HCO3- = CaCO3 ↓ + h3 O + CO2 ↑
С ионами железа реакция протекает сложнее из-за того, что FeCO3 неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH)3 , представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении.
С постоянной жесткостью бороться труднее. Один из вариантов: вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лед превратить обратно в воду. Все соли, которые образую жесткость, остаются в не замершей воде.
Еде один способ – перегонка, то есть, испарение воды с последующие ее конденсацией. Так как соли относятся к нелетучим соединениям, они остаются, а вода испаряется.
Но такие методы, как замораживание и перегонка пригодны только для смягчения небольшого количества воды. Промышленность же имеет дело с тоннами. Поэтому используют другие методы. Наиболее широко используется катионообменный способ, основанный на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия.
С последствием жесткости воды - накипью, с точки зрения химии можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной. Последняя и занимает место угольной, которая, будучи неустойчивой, разлагается на воду и углекислый газ. В состав накипи могут входить и силикаты, и сульфаты, и фосфаты. Но если разрушить карбонатный “скелет”, то и эти соединения не удержатся на поверхности.
В качестве средства для удаления накипи применяются также адипиновая кислота и малеиновый ангидрид, которые добавляются в воду. Эти вещества слабее сульфаминовой кислоты, поэтому для снятия накипи необходимо так же кипячение.
Список литературы :
1. Шпаусус З. Путешествие в мир химии – М.: Просвещение, 1967. – 431с.
2. Харлампович Г.Д. и др. Многоликая химия. – М.: Просвещение, 1992.-159 с.
3. Хомченко Г.П. Учебник химии –М.: Новая волна, 1996. – 304с.
www.yurii.ru
Жесткость воды и ее устранение
Введение
В пещерах спелеологи встречаются с красивейшими известковыми образованьями – свешивающимися со сводов сталактитами и растущими вверх сталагмитами. С точки зрения химии, возникновение этих удивительных творений природы – это жесткость подземных вод. Понятие жесткости воды мы встречаем не только в спелеологии и в геологии, а, вообще, повсеместно – в химии, техники и даже в быту. И поэтому это понятие очень важно для определения качества воды.
Определение жесткости воды
Жёсткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде.
Жесткость - это особые свойства воды, во многом определяющие её потребительские качества и потому имеющие важное хозяйственное значение. Жесткая вода образует накипь на стенках нагревательных котлов, батареях и пр., чем существенно ухудшает их теплотехнические характеристики. Такой тонкий слой на греющей поверхности вовсе не безобиден, так как продолжительность нагревания через слой накипи, обладающей малой теплопроводностью, постепенно возрастает, дно прогорает все быстрее и быстрее – ведь металл охлаждается с каждым разом все медленнее и медленнее, долго находится в прогретом состоянии. В конце концов, может случиться так, что дно сосуда не выдержит и даст течь. Этот факт очень опасен в промышленности, где существуют паровые котлы
Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает еще и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки и повышая расход моющего средства, т.е. жесткая вода плохо мылится
Существует два типа жесткости: временная и постоянная. Обусловлено это различие типом анионов, которые присутствуют в растворе в качестве противовеса кальцию и магнию.
Временная жесткость связана с присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
Постоянная жесткость (или некарбонатная) возникает, если в растворе присутствуют сульфатные, хлоридные, нитратные и другие анионы, соли кальция и магния которых хорошо растворимы и так просто не удаляются. Общая жесткость определяется как суммарное содержание всех солей кальция и магния в растворе.
В разных странах существуют свои нормы жесткости для воды. У нас в стране вода классифицируется по жесткости таким образом:
§ Мягкая вода с жесткостью менее 3,0 мг-экв/л,
§ Средней жесткости – 3,0-6,0 мг-экв/л
§ Жесткая – более 6,0 мг-экв/мл.
Методы устранения жесткости.
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок.
Ca2 + 2HCO3- = CaCO3↓ + h3O + CO2↑
С ионами железа реакция протекает сложнее из-за того, что FeCO3 неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH)3, представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении.
С постоянной жесткостью бороться труднее. Один из вариантов: вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лед превратить обратно в воду. Все соли, которые образую жесткость, остаются в не замершей воде.
Еде один способ – перегонка, то есть, испарение воды с последующие ее конденсацией. Так как соли относятся к нелетучим соединениям, они остаются, а вода испаряется.
Но такие методы, как замораживание и перегонка пригодны только для смягчения небольшого количества воды. Промышленность же имеет дело с тоннами. Поэтому используют другие методы. Наиболее широко используется катионообменный способ, основанный на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия.
С последствием жесткости воды - накипью, с точки зрения химии можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной. Последняя и занимает место угольной, которая, будучи неустойчивой, разлагается на воду и углекислый газ. В состав накипи могут входить и силикаты, и сульфаты, и фосфаты. Но если разрушить карбонатный “скелет”, то и эти соединения не удержатся на поверхности.
В качестве средства для удаления накипи применяются также адипиновая кислота и малеиновый ангидрид, которые добавляются в воду. Эти вещества слабее сульфаминовой кислоты, поэтому для снятия накипи необходимо так же кипячение.
www.referatmix.ru
2. Жесткость воды и способы ее устранения.
Жесткость воды отражает содержание в ней ионов кальция и магния.
Жесткость, обусловленная наличием в воде гидрокарбонатов кальция и магния, называется временной, или карбонатной (Жвр). Жесткость, обусловленная хлоридами и сульфатами этих металлов,называется постоянной (Жп). Суммарная жесткость воды носитназвание общей жесткости. Жесткость воды (степень жесткости принято выражать в миллимолях ионов Са2+или Mg2+(или обоих ионов) в 1 дм3или 1 кг воды – ммоль/дм3или ммоль/кг. В технической литературе встречается единица измерения степени жесткости воды – мг экв/дм3или мг-экв/кг. Зная, что молярные массы эквивалентов ионов Са2+и Mg2+соответственно равны 20,04 и 12,16 мг/дм3, можно рассчитать обжую жесткость воды (в ммоль/дм3):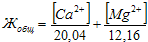 . Часто в расчетах жесткости используют формулу:
. Часто в расчетах жесткости используют формулу: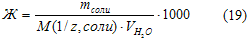
Содержание в питьевой воде большого количества растворимых солей магния и кальция не только ухудшает ее вкус, но и обуславливает жесткость воды. Жесткая вода неприменима в ряде отраслей промышленности, теплотехники и неблагоприятна при бытовом использовании. В ней труднее развиваются многие продукты, их питательная ценность уменьшается. Резко ухудшается моющая способность и возрастает расход мыла. Способствует развитию ряда заболеваний. Питьевая вода – жесткость не должна быть выше 7 ммоль/л.
Один из методов устранения жесткости воды – введение соды (Na2CO3).
3. Виды сточных вод. Классификация производственных сточных вод. Сточные вод машиностроительных предприятий. Общая характеристика методов очистки сточных вод.
Виды сточных вод. Сточные воды, отводимые с территории промышленных предприятий, по своему составу могут быть разделены на 3 вида:
производственные – использованные в технологическом процессе производства или получающиеся при добычи полезных ископаемых.
бытовые – от санитарных узлов производственных и не производственных корпусов и зданий, а также от душевых установок, имеющихся на территории, промышленных предприятий.
атмосферные – дождевые и оттаивание снега.
Производственные сточные воды делятся на 2 две основные категории:
Загрязненные производственные сточные воды содержат различные примеси и подразделяются на 3 группы:
загрязнённые преимущественно минеральными примесями (предприятия металлургической, машиностроительной, угледобывающей промышленности)
загрязнённые преимущественно органическими примесями (предприятия рыбной, мясной, молочной, пищевой, целлюлозно-бумажной промышленности)
загрязнённые минеральными неорганическими примесями (предприятия нефтедобывающей, нефтеперерабатывающей, текстильной, лёгкой промышленности)
Машиностроительные заводы характеризуются наличием ряда водоёмких производственных процессов, а следовательно, и образованием значительного количества, производственных сточных вод, которые в основном загрязняются отходами травильных и гальванических цехов и нефтепродуктами.
В гальванических цехах детали из металлов и сплавов подвергаются различным видам химической или электрохимической обработки. В начале поверхность изделий подвергается предварительной обработки: обезжириванию и травлению с применением различных растворов кислот, щелочей, солей металлов. Отработанные растворы травильных ванн образуют кислые и щелочные сточные воды. В каждом травильном отделение существует 2 вида сточных вод: концентрированные и разбавленные. Разбавленные являются промывными водами.
Методы очистки сточных вод.
Механические методы применяются как первая стадия в общей схеме очистки сточных вод. Выбор механического метода очистки осуществляется с учётом размера взвешенных частиц. Механическая очистка состоит из:
процеживания через решётки
пескоулавливания
отстаивание
фильтрование
центрифугирование
Химические методы обработки сточных вод основаны на применение химических реакций. В результате которых загрязнения превращаются в соединения безопаснее для потребителя или легко выделяются в виде осадков. В особую группу химических методов следует выделить хлорирование и озонирование сточных вод, содержащих органические примеси, а также цианиды и другие пахнущие не органические вещества. Хлорирование и озонирование наиболее часто применяют для доочистки и обезвреживания питьевой воды на городских водопроводных станция.
осаждение
окисление-востановление
Физико-химические методы. В большинстве случаев использование физико-химических методов выделения загрязняющих веществ из сточных вод позволяет в дальнейшем рекуперацию.
флотация
коагуляция
ионный обмен
сорбция
электрохимические методы
магнитная обработка
экстракция
Биологическая очистка. Биологическое окисление осуществляется сообществом микроорганизмов, включающим множество различных бактерий, простейших и ряд более высокоорганизованных организмов, связанных между собой единый комплекс сложными взаимоотношениями. Главенствующая роль в том сообществе принадлежит бактериям.
1. аэробный
2. анаэробный
При термической очистке сжигают жидки отходы нефтепродуктов и других горючих веществ в печах и горелках.
1. огневое концентрирование
2. огневое обезвреживание
studfiles.net
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


