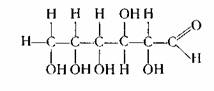
Курсовая работа
по химии
на тему:
«Углеводы»
Введение
По химической классификации, все углеводы являются полигидроксикарбонильными соединениями. Номенклатура их, как и в большинстве случаев природной химии, носит тривиальный характер, систематический подход разработан и им удобно пользоваться при названии производных углеводов и обозначении характерных структурных элементов. Общее окончание для всех углеводов, исключая полимерные системы — оза.
Здесь следует отметить, что обычно углеводы подразделяют в первую очередь на моносахариды, олигосахариды и полисахариды. Но так как моносахара являются фундаментальными углеводными единицами, а олигосахара и полисахара — это не что иное, как их производные, то мы и будем придерживаться этой схемы: не выделять олигосахара в отдельный класс, рассматривая их как соответствующие производные моносахаров.
1. Классификация
Классификация углеводов ступенчатая. В первую очередь, отмечается количество атомов углерода углеводородной части молекулы — тетрозы, пентозы, гексозы, гептозы и т.д. Наиболее распространенными являются пентозы и гексозы. В зависимости от числа атомов углерода в моносахаридной цепочке, их подразделяют на низшие, обычные и высшие моносахара с количеством углеродных атомов от 7 до 10. Нормальные углеводы структурно расходуют один углеродный атом на карбонильную группу, при всех остальных углеродных атомах находится по одной гидроксильной группе. Вторая ступень классификации связана с расположением карбонильной группы в углеводородной цепи — либо это альдегидная группа, либо кетонная — ив соответствии с этим, мы имеем либо альдозы, либо кетозы. С учетом первой ступени классификации, мы можем теперь различать альдопентозы, альдокетозы, альдогексозы, кетогексозы и т.д.
Следующий этап подразделения углеводов определяется пространственным структурным фактором, а именно, наличием асимметрических центров. Как видно на схеме 1, молекула альдозы содержит асимметрических центра, молекула кетозы — таких центра: это значит, что альдогексозы могут существовать в виде 24 конфигурационных изомеров, кетогексозы — в виде 23 конфигурационных изомеров. Учитывая структурное соотношение между диастереомерными и энантио-мерными формами, в простейшем варианте рассмотренное нами на примере винных кислот, можно уточнить: альдогектозы будут представлены 8 диастереомерами, каждый из которых может существовать в виде пары оптических антиподов.
/>
Диастереомеры различаются между собой различным взаимным расположением гидроксильных групп в пространстве, в результате чего они будут существенно различаться физическими и, в некоторой степени, химическими свойствами. В связи с этим, а также с учетом важности этих индивидуальных соединений в природной химии, каждому из диастереомеров присвоено свое собственное тривиальное название. Оптические же антиподы обозначают индексами D— и L— в зависимости от конфигурации последнего, по нумерации углеводородной цепи, асимметрического центра Так как при переходе от углеводной молекулы с п-асимметрическими центрами к молекуле с центрами количество конфигурационных изомеров удваивается, то, приняв за минимальную альдозу глицериновый альдегид и минимальную кетозу — эритрулозу, мы можем построить иерархическую схему стереохимического родства природных углеводов с учетом того факта, что, в основном, они относятся к D-ряду в проекциях Фишера.
/>
Доказательство строения и стереохимического родства восьми D— гексоз и четырех D-пентоз было основано на блестящих работах Эмиля Фишера, за которые он получил Нобелевскую премию по химии в 1901 году.
Относительно особенностей конфигураций D— и L-рядов моносахаров следует отметить два факта:
1. Обозначение D— и L— не находятся во взаимосвязи со знаком их оптического вращения.
2. Живые организмы «не узнают» и «не умеют» усваивать углеводы L-ряда, тогда как синтезировать они их могут. Свойство инертности ферментов к L— сахарам природа часто использует для построения сложных устойчивых молекулярных систем.
2. Свойства и структура моносахаридов
Специфика химических свойств углеводов заключается уже в том, что не имеет смысла рассматривать отдельно реакции, обусловленные только спиртовыми функциями или только карбонильными. Прежде всего, мы познакомимся с теми их свойствами, которые обусловлены взаимным влиянием этих функций, поскольку результатом их взаимного влияния являются существенные структурные изменения и появление новых химических свойств молекул моносахаридов.
Поскольку карбонильные группы обладают ярко выраженной способностью к присоединению нуклеофильных реагентов, а в молекулах Сахаров присутствуют эти нуклеофильные группы в количестве, более чем достаточном, то естественно ожидать от них осуществления этой реакции внутримолекулярным вариантом. И она осуществляется. Остается только выяснить, какой именно гидроксил осуществляет этот процесс и каков результат этого процесса.
/>
Согласно пространственному строению моносахаридной молекулы, наиболее благоприятны для нуклеофильной атаки гидроксильные группы при углеродах С4, Csи С6, если мы за основу возьмем альдогексозу; С4и Cs— если за основу возьмем альдопентозу. Второй фактор, влияющий на выбор гидроксильной группы для этой реакции — это устойчивость образующегося циклического полуацеталя: образование малых циклов энергетически невыгодно из-за байеров-ского напряжения; образование больших циклов невыгодно по причине торсионных дестабилизирующих взаимодействий.
Из классической органической химии известно, что пяти — и шестичленные циклы, как карбоциклические, так и гетероциклические, термодинамически наиболее предпочтительны.
Следствием этих основных факторов является преимущественное образование шестичленного циклического полуацеталя в случае глюкозы, пятичленного циклического полуацеталя в случае рибозы, пятичленного циклического полуацеталя в случае фруктозы. В номенклатуре соединений это отражают введением названия соответствующего кислородного гетероцикла в качестве корневого слова — пираноза и фураноза. Но надо еще раз подчеркнуть, что такое формирование циклических форм является преимущественным: образование фураноз в случае альдогексоз и пираноз в случае альдопентоз также не исключено.
/>
Согласно предложению Хеуорса, формулы всех циклов представляют схематически плоскими, что удобно для представления взаимного расположения гидроксильных групп, а для пятичленных циклов это близко к истине
При анализе циклических структур моносахаридов первое, что мы можем отметить — это исчезновение карбонильной функции и появление новой гидроксильной функции при С1и, соответственно, нового асимметрического центра при этом же углеродном атоме Так вот, в силу планарности карбонильной группы, присоединение реагента к ней возможно с обеих сторон плоскости, результатом чего является пара циклических изомеров, называемых а — ив-формами А во-вторых, возникает вопрос, что же является истиной для моносахаридов в структурном плане9Многочисленными пионерскими работами в начале двадцатого столетия, основанными на виртуозных химических превращениях, а также современными исследованиями, в большей степени использующими физические методы показано, что в растворах существует динамическое равновесие между всеми тремя формами, а в кристалле — только циклические формы в зависимости от природы углевода и условий кристаллизации Динамическое равновесное состояние моносахаридов называют кольчато-цепной таутомерией. Соотношение между различными формами таутомерной смеси в растворе весьма трудно определяемо, так как оно в существенной степени зависит от природы моносахарида и от среды.
Глюкоза, конечно же, изучена лучше всех по всем аспектам. Так, для нее было установлено, что при кристаллизации из воды или из спирта образуются кристаллы чистой a-D-глюкопиранозы, а при кристаллизации из пиридина — тольков-0-РєК) К0РЗс3З033. В водном растворе D-глюкоза существует в виде смеси а — ив-форм в соотношении 36'64, т.е. все-таки предпочтительнее являетсяв-структура глюкозы.
/>
Ациклическая форма глюкозы в растворе присутствует в столь незначительных количествах, что не регистрируется физическими методами, но она безусловно есть, ибо не был бы возможен таутомерный переход между а — ив-формами. Указанное выше равновесие устанавливается при растворении чистой a-D-глюкозы в воде через 24 часа. Кроме того, только она — ациклическая форма глюкозы — дает четкие реакции альдегидной группы. В столь же незначительных концентрациях в растворе присутствуют и фуранозные формы глюкозы.
К настоящему моменту установлено, что преобладающей формой и для альдогексоз, и для альдопентоз, является наиболее термодинамически выгодная пиранозная. Только в нескольких случаях в растворах моносахаридов фуранозная форма зафиксирована в значительных количествах: для рибозы, альтрозы, иодозы и талозы. Кроме того, следует отметить, что иногда альдогексоза может образовать и семичленный цикл взаимодействием гидроксила при С6с альдегидной функцией. Такую форму, называемую септаноза, образует тетраметил глюкоза.
/>
Несколько иначе обстоит дело с таким типичным моносахаридом кетозной структуры, как фруктоза. Из двух возможностей образования циклической формы, она реализует обе. В водном растворе фруктоза существует в виде смеси таутомеров, в которой содержится до 15%в-фуранозной формы, значительные количества ациклических форм, но в основном, пиранозитный таутомер. В кристаллическом состоянии известна только р-0-фруктопираноза. Следует отметить, забегая несколько вперед, что ее природные производные по полуацетальному гидроксилу всегда имеют фуранозную структуру.
Из альдопентоз следует выделить рибозу, как наиболее распространенный моносахарид с пятью атомами углерода В водном растворе она представляет собой смесь всех четырех циклических таутомеров, из которых предпочтительными являются пиранозные формы, но фуранозные формы также значительны Нормальная кристаллическая форма рибозы — р-й-рибопираноза, а для производных характернав-0-рибофуранозная структура.
Вернемся к глюкозе, отвлекшись от проекционных формул Фишера и Хеуорса, и проанализируем ее пространственную структуру, так сказать, в окончательном варианте. Поскольку все шестичленные циклы, включая гетероатомные, предпочтительно существуют в форме кресла, так же изобразим и глюкозу. В таком случае,в-глюкопираноза окажется термодинамически предпочтительной и по стереохимическому расположению всех заместителей цикла — они расположены экваториально. В связи с этим, становится понятным предпочтение, отданное Природой в-форме глюкозы при построении различных биологических структур, которые, в первую очередь, требуют стабильности.
--PAGE_BREAK--/>
/>
б-Форма глюкопиранозы отличается аксиальным положением гликозидного гидроксила. Факторов, определяющих относительную стабильность б-изомера, несколько, но основным, очевидно, является стабилизирующее взаимодействие неподеленной электронной пары эндоциклического кислорода и свободной орбитали связи С'-ОН, котороемаксимально именно в этой конфигурации молекулы. Аномерный эффект, обнаруженный и изученный на молекуле глюкозы, оказался довольно общим явлением не только в химии углеводов, но и в химии циклических полуацеталей вообще, однако свое начало он берет из природной химии — из химии углеводов.
Таким образом, используя кресловидное изображение молекул альдопи-раноз, мы увидим, чтс пои переходе от глюкопиранозы ко всему остальному ряду альдогексоз, гидроксильные функции периодически меняют свое положение с экваториального на аксиальное, за исключением группировки — СН2ОН — она всегда экваториальна.
/>
/>
/>
Только D-иодоза имеет аксиальное положение — СН2ОН группы в термодинамически наиболее стабильной конформации, так как остальные ее — ОН функции при этом расположены экваториально.
Так как фруктоза также имеет склонность к образованию пиранозной формы, то полезно рассмотреть и ее пространственную структуру. Установлено, что из двух кресловидных конформеров реализуется тот, в котором наиболее тяжелая группа занимает экваториальное положение при равном соотношении экваториальных и аксиальных гидроксифункций.
3. Химические свойства моносахаридов
Химические свойства моносахаридов, как и других бифункциональных соединений, могут быть разделены на три группы: это свойства спиртов, карбонильных соединений, и специфические реакции, обязанные взаимному влиянию и взаимному участию спиртовых и карбонильных функций.
Из типичных спиртовых свойств моносахаридов следует отметить, в первую очередь, реакции этерификации различного типа, ведущие к образованию сложных эфиров карбоновых кислот, сложных эфиров минеральных кислот, простых алкиловых эфиров. Так как в молекуле любого моносахарида содержится несколько спиртовых групп, то очевидно, что в любом случае эти реакции могут иметь различную степень кратности, т.е. могут быть получены, в зависимости от активности реагента, моноэфиры, дизфиры, триэфиры и т.д. При этом не полностью этерифицированные моносахара будут представлены еще и набором региоизомеров. Таким образом, в одной только реакции ожидаемое многообразие получаемых эфиров более чем достаточно.
Реакции карбонильных групп моносахаридов всегда могут проявиться, так как в растворе моносахарида всегда имеется ациклический таутомер, всегда имеется хоть в каких-то количествах и тогда, независимо от количества этой формы, процесс таутомерии обеспечивает полное прохождение реакции по карбонильной группе, т.е. так, как будто все вещество в растворе имело нециклическую структуру. В первую очередь, здесь следует отметить различные реакции нуклеофильного присоединения, окислительно-восстановительные реакции, реакции азометиновой конденсации.
Реакции окисления наиболее любопытны тем, что могут быть реализованы потрем направлениям!
/>
/>
/>
Наиболее мягкое окисление по альдегидной группе приводит к гликоновым кислотам, окисление немного более энергичное — переводит спиртовую группу в карбоксильную. Концевая спиртовая группа может быть окислена до карбоксильной при условии защиты последней, т.е. в условиях жесткой стабилизации циклической формы молекулы. При действии некоторых окислителей, циклическая форма альдогексоз окисляется непосредственно по полуацетальному гидроксилу с образованиемд-лактонов, которые обычно перегруппировываются в более стабильныег-лактоны.
Специфические свойства моносахаридов. Наличие в молекуле углеводов спиртовых гидроксилов открывает возможность одновременного участия в реакции нескольких из них. Типичная реакция моносахаридов с карбонильными реагентами приводит к образованию циклических ацеталей, структура которых определяется взаимным пространственным расположением гидроксильных групп: обычно в таких реакциях участвует пара цис расположенных гидроксифункций.
/>
Так как моносахара в растворе обычно представлены смесью нескольких таутомеров, то при взаимодействии их с карбонильным соединением возможно образование циклических производных нетипичных форм, присутствующих в незначительных количествах, но, по ряду факторов, благоприятных для реакций такого типа.
Сближение в пространстве двух гидроксильных групп моносахаридов может, в условиях, соответствующих образованию простых эфиров, реализоваться в такой реакции внутримолекулярно. Продукты реакций имеют бициклическую структуру и называются ангидросахарами. Подобная реакция эффективно проходит в молекуле йодозы, так как в ее пиранозной форме один из информационных переходов сближает гидроксилы при С и С6, тогда как все остальные приобретают энергетически выгодное экваториальное положение.
/>
Ангидросахара, полученные взаимодействием реакционных центров при С1 и С4, имеют структуру, в которой зафиксирована форма лодки шестичленного цикла пиранозы.
/>
Специфической реакцией моносахаридов можно считать и окисление их реагентами, действующими на пару вицинальных гидроксильных групп, предпочтительно имеющих цис-конфигурацию. Окисление выполняется йодной кислотой или тетраацетатом свинца и протекает через промежуточный циклический диэфир с последующим расщеплением углерод-углеродной связи циклического фрагмента. В свое время, реакция сыграла решающее значение при исследовании строения моносахаров.
/>
Но так как обычно углеводная молекула имеет более, чем два гидроксила, то вариантов деструктивного гликольного окисления несколько, и процесс протекает часто постадийно и достаточно глубоко: например, так, как эрjимеет место в случае D-глюкозы.
/>
Под действием оснований и кислот моносахара претерпевают изомеризацию и деградацию в зависимости от условий.
В мягких щелочных условиях обычно имеет место эпимеризация, т.е. изменение конфигурации углеродного атома в 2-положении к карбонильной группе, а также изомеризация типа альдоза р. кетоза. Так, при выдерживании D-глюкозы в течении нескольких дней в 0,01Мрастворе гидроокиси натрия образуется смесь, содержащая 28% D-фруктозы, 3% D-маннозы и исходную D-глюкозу. Оба изомеризационных процесса протекают через общий интермедиат, являющийся енольной формой D-глюкозы, т.е. указанная смесь веществ является следствием кетоенольной таутомерии, катализируемой основанием. Заметим, что реакция идет из ациклической формы, являющейся также компонентой таутомерного процесса.
/>
/>
В более жестких щелочных условиях проходят более глубокие перегруппировки до сахариновых кислот. Та же самая D-глюкоза при обработке 0,15М раствором гидроокиси кальция превращается в смесь нескольких гидрокси-кислот. Эти реакции многоступенчатые и, как правило, малой степени стерео-специфичности.
В кислой среде моносахара обычно более стабильны, но при нагревании в растворах минеральных кислот протекают процессы дегидратации, результатом которых являются производные фурана. Так, альдопентозы, отщепляя три молекулы воды, образуют фурфурол, а альдогексозы — 5-гидроксиме-тилфурфурол.
/>
Характерным свойством моносахаров, обязанным совместному присутствию карбонильной и гидроксильной функций, является реакция образования озазонов, образующихся при взаимодействии как альдоз, так и кетоз с фенилгидразином. Обычная азометиновая конденсация по карбонильной группе моносахарида с одной молекулой фенилгидразина приводит к соответствующему фенилгидразону, но характерно то, что процесс на этом не заканчивается, а наблюдается последующая реакция окисления соседней гидроксильной группы до карбонильной, на что расходуется еще одна молекула фенилгидразина, далее новая карбонильная группа конденсируется с третьей молекулой фенилгидразина.
/>
Образующиеся в результате бисфенилгидразоны хорошо кристаллизуются и потому часто используются для идентификации моносахаридов. На заре углеводной химии эта реакция использовалась для установления строения отдельных моносахаридов и их взаимосвязи. К примеру,
D-глюкоза и D-манноза образуют один и тот же озазон.
Рассматривая химические свойства углеводов, невозможно обойти их реакции брожения; фактически являясь биохимическими реакциями, они широко используются в химической технологии и в лабораторной практике. Большинство углеводов под действием ферментов, внутриклеточно, образуют пировиноградную кислоту и АТР.
/>
Далее, в зависимости от природы микроорганизма, поставляющего определенный набор ферментов, пировиноградная кислота превращается в тот конечный продукт, который соответствует каталитическим возможностям данного комплекта энзимов. По продуктам брожения различают следующие его основные виды: спиртовое, молочнокислое, пропионовокислое, маслянокислое. Иногда основной процесс брожения может осложняться некоторыми параллельными или последовательными реакциями, обусловленными вариациями условий среды или ферментного набора: так, при маслянокислом брожении может реализоваться так называемое ацетон-бутиловое брожение; спиртовое брожение сопровождается уксуснокислым, виннокислым и глицериновым брожениями; при некоторых видах брожения в значительных количествах могут накапливаться лимонная, фумаровая и янтарная кислоты.
4. Биосинтетические реакции углеводов
Одно из важных свойств моносахаров — это способность к енолизации, обеспечивающая как процессы взаимопревращения моносахаров, так и различные реакции биосинтеза.
В ряду последних, в первую очередь, следует отметить реакцию фиксации диоксида углерода дифосфатом рибулозы как один из этапов цикла Кальвина.1,5-дифосфат D-рибулозы в присутствии оснований становится С-нуклеофилом, который легко присоединяет электрофильный диоксид углерода. Образующийся промежуточный разветвленный С6-сахарид гидролитически расщепляется на два фрагмента глицериновой кислоты — таким образом, молекула углекислоты может считаться «усвоенной».
продолжение --PAGE_BREAK--/>
/>
На следующем этапе 3-фосфат глицериновой кислоты восстанавливается реагентом invivoдо фосфата глицеринового альдегида; последний изомеризуется до соответствующего кетона — фосфата дигидроксиацетона. Показано, что из фосфатов глицеринового альдегида и дигидроксиацетона реакцией конденсации образуется молекула дифосфата фруктозы: при этом дигидроксиацетоновая компонента выступает в качестве нуклеофила в форме енолят-аниона.
Очень похожими реакциями получаются другие моносахара, а также регенерируется рибулоза, необходимая для первичного захвата диоксида углерода. Кроме этого пути фотосинтетической фиксации диоксида углерода существуют и некоторые другие: например, образование щавелевоуксусной кислоты присоединением фосфата енол-пировиноградной кислоты, имеющего нуклеофильный центр, по атому углерода углекислоты, об электрофильном характере которого уже говорилось выше. В свою очередь, щавелевоуксусная кислота легко восстанавливается до яблочной кислоты, а последняя служит источником и пировиноградной кислоты, и фосфата ее енольной формы.
К этой схеме следует заметить, что высвобождающийся в ходе каталитического разложения диоксид углерода не выделяется «наружу», а тут же используется для последующих фотосинтетических превращений, например, для образования фруктозы, а пируваты снова возвращаются на начальную стадию биосинтеза.
Одним из интереснейших и важнейших химических преобразований альдогексоз является реакция образования аскорбиновой кислоты. Процесс реализуется invivoиз D-глюкозы и D-галактозы, а в промышленности ее получают из D-глюкозы. Важно отметить, что природная аскорбиновая кислота имеет L-конфигурацию.
/>
/>
Установлено, что процесс ее образования имеет обязательные стадии: окисление при С1, С2или С3, эпимеризация или родственный процесс при С5, лактонизация между С и С4. В каком порядке эти реакции осуществляются, не всегда можно сказать однозначно, хотя бы потому, что эти процессы несколько различаются у животных и у растений. Наиболее доказана к настоящему времени следующая.
5. Производные моносахаров
К производным моносахаридов относятся соединения, имеющие моносахаридную основу, но содержащие вместо одной или нескольких гидрокси-функций какие-либо другие функциональные группы. Ввиду большого их разнообразия и широкого распространения в природе, имеет смысл разделить производные моносахаров на две подгруппы: производные по всем спиртовым группам и производные по полуацетальному гидроксилу. Последние в силу своей специфичности называют гликозидами и выделяют в особую группу, которую мы проанализируем позже.
Все производные моносахаридов, в которых спиртовая группа замещена на любую другую, получают приставку дезокси-, далее называют замещающую функцию.
Итак, дезоксисахара — это моносахариды, в которых одна или более спиртовых функций восстановлены до углеводородной. В природе широко распространена 2-дезоксирибоза в виде производных. В растениях часто встречаются моно-сахара с терминальной дезокси-группой: например, L-рамноза, L-фукоза, D-дигитоксоза. Многие моно — и ди-дезоксисахара входят в состав антибиотиков.
Аминосахара редко встречаются в свободном виде, обычно они входят как мономерные звенья в цепочки различных полисахаридов. Но так как в связанном виде они распространены широко и, можно сказать, фундаментально, мы эти звенья как бы в изолированном виде и рассмотрим. Важнейшими из них являются 2-аминопроизводные глюкозы и галактозы, аминогруппа которых может быть свободной или модифицированной ацильной или сульфогруппами.
/>
/>
Особенно богатым источником различных аминосахаров являются плесневые грибы семейства Streptomyces, продуцирующие разнообразные аминосахаридные антибиотики. В качестве типичного примера таких антибиотиков можно назвать канамицин В, в молекулу которого входят такие аминосахара как 2,6-диамино-2,6-дидезокcи-D-глюкоза и 3-амино-3-дезокси-D-глюкоза.
/>
Важное место среди аминопроизводных моносахаров занимает нейраминовая кислота и ее производные — сиаповые кислоты Моносахаридной основой нейраминовой кислоты является кетононоза. Сиаловые кислоты — это ее ацилированные по азоту и кислороду производные, содержащиеся в свободном состоянии в спинномозговой жидкости.
Несмотря на большую углеродную цепочку ациклической формы нейраминовой кислоты, ее циклический таутомер, как и в случае гексоз, имеет размер пиранозы.
Отметим также аминопроизводное D-глюкозы, этерифицированной по третьему гидроксилу молочной кислотой — мурамовую кислоту, которая в виде Н-ацетильного производного входит в состав полисахаридов клеточной стенки бактерий. Наличие в ее молекуле аминной и карбоксильной функций позволяет мурамовой кислоте образовывать цвиттер-ионную форму.
/>
Через свою карбоксильную функцию мурамовая кислота обычно осуществляет химическую связь с аминокислотами и пептидами, образуя класс пептидогликанов.
Разветвленные моносахара сравнительно немногочисленны, но их структуры уникальны: они являются компонентами некоторых антибиотиков, встречаются в растениях в связанном виде. Отметим стрептозу, которая входит в состав антибиотика стрептомицина; апиозу, обнаруженную в виде гликозида в петрушке; гамамелозу, которая в виде диэфира с галловой кислотой найдена в коре лещины виргинской.
/>
/>
Молекула апиозы интересна в структурном плане: имея только один асимметрический центр в цепной форме, она приобретает два новых асимметрических центра при переходе в циклическую форму, следовательно, D-апиоза может образовывать четыре циклических стереоизомера.
6. Гликозиды
Среди всех производных моносахаров, безусловно, на первое место следует поставить гликозиды. Гликозиды представляют собой моносахариды, в молекулах которых полуацетальный гидроксил замещен на какую-либо другую функциональную группу.
Из схемы 6.1 очевидно, что два атома кислорода при одном углероде как пиранозной, так и фуранозной форм моносахарида — это уже достаточное основание для создания существенного положительного заряда на этом атоме. Вследствие этого, для молекулы открываются две возможности реагирования: во-первых, облегчается диссоциация по связи С-ОН с образованием соответствующего карбкатиона, катионный центр которого стабилизирован взаимодействием с п-уровнем эндоциклического атома кислорода; во-вторых, достаточно большой положительный заряд на углероде создает благоприятную предпосылку для непосредственной атаки его нуклеофильным реагентом. Другими словами, ожидается, что полуацетальный гидроксил пираноз и фураноз будет легко замещаться нуклеофильно как по механизму SN1; так и по механизму SN2.
/>
/>
В соответствии с общими закономерностями реакций нуклеофильного замещения, в случае реализации мономолекулярного механизма ожидается образование продукта реакции в виде смеси диастереомеров, так как карбкатионный фрагмент переходного состояния молекулы плоский; если же процесс пойдет по синхронному бимолекулярному пути — пространственная структура продукта будет зависеть от конфигурации исходного моносахарида: из б-формы образуетсяв-гликозид, из в-формы — б-гликозид, так как атака нуклеофила осуществляется в тыл связи С-0 и завершается обращением конфигурации реакционного центра. Поскольку моносахарид всегда будет существовать в растворе в виде таутомерной смеси а — ив-форм, то независимо от механизма реакции мы, как правило, получим гликозид в виде изомерной смеси. Только лишь их соотношение будет варьироваться в зависимости от условий реакций и природы реагента. Но это все верно тогда, когда реакция проводится в колбе, т.е. invitro.
Внутри живой клетки такой процесс катализируется ферментами, которые, как правило, работают стереоспецифично: это значит, что они будут избирательно вовлекать в реакцию какой-либо один из диастереомеров, а также осуществлять реакцию по какому-либо одному механизму, что в итоге приведет к продукту одной изомерной формы. Схематично такую реакцию можно представить, моделируя реагент и фермент в виде единой молекулы, на одном конце которой находится остаток фосфорной кислоты, катализирующий отщепление гидроксильной группы, на другом конце — нуклеофильный остаток, атакующий электрофильный атом углерода. Синхронное воздействие каталитического и нуклеофильного фрагментов на электрофильный центр а-глюкопиранозы приводит к соответствующему в-гликозиду.
Вполне возможно, чтоб-изомер большинства моносахаров более реакционно способен хотя бы по причине стерической доступности его реакционного центра. Тогда следует ожидать, что большинство природных гликозидов будут относится к рядув-изомеров, так как их образование ферментативно катализируемо. Трудно проанализировать
все природные гликозиды на предмет принадлежности их к а — илив-ряду в виду их многочисленности. Но все-таки создается впечатление, чтов-диастереомеры все же более многочисленны. Так какб-изомерные формы часто также образуются исключительно стереоспецифично, следует предположить, что комплексирование каталитического сайта фермента и молекулы моносахарида чувствительно к исходной пространственной форме пиранозы или фуранозы. Это возможно только при условии, что образование одних и тех же гликозидов различной конфигурации должно катализироваться различными ферментативными системами.
Для всех гликозидов характерно отсутствие таутомерных превращений в растворе, т.е. переход их в ациклическую форму невозможен, так как для этого процесса требуется подвижный атом водорода полуацетального гидроксила для преобразования последней в карбонильную группу. Второе общее свойство гликозидов — это достаточно легкая способность их к гидролизу в кислой среде, фактически являющемуся процессом, обратным реакции их образования.
Классификация гликозидов. Классифицируются гликозиды достаточно однозначно — согласно типу нуклеофила, заместившего полуацетальный гидроксил. Такой нуклеофил также называют агликоном. Если агликонами являются спирты или фенолы, то образующиеся гликозиды называют 0-гликозидами; серусодержащие нуклеофилы ведут к образованию S-гликозидов; если нуклеофилом являлось соединение, генерирующее в ходе реакции карбанион, то полученный гликозид имеет структуру С-гликозида; и наконец, очень распространены в природе различные варианты образованияН-гликозидов в ходе замещения полуацетального гидроксила моносахаров азотистыми основаниями разного типа.
продолжение --PAGE_BREAK--/>
О-гликозиды в природных источниках представлены как довольно простыми молекулами по структуре агликона, так и очень большими и разнообразными по строению и биологическим функциям соединениями, включая целые биополимерные системы.
Т. к. О-гликозиды образуются при взаимодействии спиртов любой природы с циклической формой моносахарида, а последний сам по себе содержит вполне достаточное количество различных по состоянию гидроксильных функций, то вполне естественно, что Природа использовала возможность образования новых структур, новых связей и новых возможностей путем взаимодействий молекул моносахаридов между собой по схеме О-гликозидирования, без привлечения других соединений. Такой путь всегда энергетически и материально наиболее экономичен.
/>
Результатом этих реакций являются дисахариды, олигосахариды и полисахариды, которые могут быть построены как из одинаковых моносахаридных звеньев, так и из различных моносахаридных звеньев.
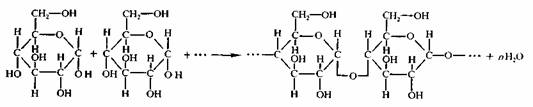
Дисахариды. Самый важный момент, который следует определить в структуре дисахарида после того как установлена природа его моносахаридных звеньев — это характер гликозидной связи: какая гидроксильная группа участвует со стороны моносахарида — агликона и какова конфигурация гликозидной связи. Чаще всего реализуется связь 1-4', реже встречается гликозидная связь 1-6', еще реже — связь 1-3'.
Образованные таким способом дисахариды называются восстанавливающими, так как фрагмент моносахарида — агликона содержит полуацетальный гидроксил свободным, что оставляет за ним способность к таутомерному превращению в ациклическую форму, которая и вступит в окислительно-восстановительную реакцию своей альдегидной группой.
В том случае, если дисахарид образован связью 1-1', т.е. моносахарид — агликон предоставляет для формирования гликозидной связи свой полуацетальный гидроксил — его относят к группе невосстанавливающих, так как таутомерного превращения, ведущего к ациклическому фрагменту с альдегидной группой, молекула не претерпевает и, следовательно, легких окислительно-восстановительных реакций от нее ожидать не приходится.
Типичными представителями гетеродетных дисахаридов являются лактоза и сахароза. Само название этих дисахаридов говорит о степени важности их для живых организмов и степени распространенности в живой системе. Лактоза представляет собой дисахарид, образованный из галактозы и глюкозы-агликона со связьюв-1-4", тогда как сахароза образована из глюкозы и фруктозы со связью1б-1'в, т.е. из этих данных следует, что лактоза является восстанавливающим дисахаридом, а сахароза – не восстанавливающим.
/>
Полисахариды также должны быть классифицированы как О-гликозиды, поскольку образуются точно по той же схеме и имеют ту же природу связывания моносахаридных звеньев между собой Само собой разумеется, что от О-гликозидов дисахаридного типа они отличаются количеством этих звеньев — многие природные полисахариды имеют весьма высокую степень полимерности. Поскольку полисахариды, как и все биополимеры — это все-таки больше объекты биохимии и химии высокомолекулярных соединений, мы приведем здесь лишь краткое описание основных типов макромолекул этого класса веществ.
Полисахариды в силу того, что они являются О-гликозидами, легко подвергаются кислотному гидролизу до моносахаридов Полисахариды, построенные из остатков одного моносахарида, называются гомополисахаридами, а если они составлены из остатков различных моносахаридов — гетерополисахаридами, т. е так же, как и в случае дисахаридов. Так же, как и в дисахаридах, связь между моносахаридными фрагментами может осуществляться по типу 1-4', 1-6', 1-3', 1-2' при а — ив — конфигурациях гликозидного центра Последнее и понятно, так как такая конденсация двух молекул моносахаридов не оставляет свободного полуацетального гидроксила, способного взаимодействовать с третьей молекулой моносахарида и т.д., т.е. не оставляет возможности для реализации полимерного процесса.
/>
/>
/>
О-гликозиды разные, т.к. О-гликозиды образуются взаимодействием спирта с циклическим изомером моносахарида, то очень часто природные соединения со спиртовой группы существуют в растениях именно в такой связанной форме в виде гликозидов. Они могут быть извлечены из сырья в мягких условиях без изменения, а если в процессе обработки сырья используется кислая среда и нагревание, то естественно, что моносахариды и агликоны будут найдены в индивидуальном состоянии и о природе гликозида можно будет только рассуждать. Известны 0-гликозиды стероидов: приблизительно у 11 семейств растений обнаружены такие производные, называемые сердечными гликозидами. Сердечные гликозиды образованы из моносахаридов или олигосахаридов различной природы, связанныхв-гликозидной связью растительных стероидов через их спиртовую группу. В малых дозах они возбуждают деятельность сердечной мышцы, в больших дозах это сердечные яды.
/>
Примером таких гликозидов может служить ланатозид А, найденный в одном из видов наперстянки.
Другая интересная группа растительных О-гликозидов — это цианогенные гликозиды, агликоновый компонент которых образован из а-циангидринов. Их особенностью является способность выделять синильную кислоту при ферментативном гидролизе, которому они подвергаются чрезвычайно легко: появление запаха «горького миндаля» при использовании семян некоторых растений указывает на присутствие в них таких гликозидов и на начало реакции их распада.
/>
Циангидрины цианогенных гликозидов образуются из соответствующих аминокислот; в качестве сахарного остатка почти всегда фигурирует D-глюкоза, гликозидная связь которой имеетв-конфигурацию.
S-гликозиды. S-гликозиды весьма немногочисленны, наиболее хорошо изучена группа глюкозинолетов. Эти лечебные соединения легко расщепляются при действии ферментов, выделяя соответствующие изотиоцианаты и тиоцианаты, являющиеся причиной отравления при использовании растений, содержащих эти гликозиды.
/>
/>
Они содержатся во многих видах крестоцветных, максимум накопления тиогликозидов у большинства из них — в недозрелых семенах.
Н-гликозиды. О степени важности для живых системН-гликозидов говорить не приходится. Нуклеиновые кислоты, многие коферменты, макроэрги — вот те классы природных веществ, в основе которых лежитН-гликозидный фрагмент, играя при этом далеко не второстепенную роль. Можно утверждать, что нет живой клеткибезН-гликозидов. Но при всем при этом, в структурном плане они представляют собой довольно локальный класс природных соединений, так как он ограничен сравнительно небольшим набором азотистых агликонов, а еще в большей степени — набором моносахаров, участвующих в их формировании. Поскольку основная массаН-гликозидов представлена фрагментами, составляющими базис нуклеиновых кислот, и именно эти гликозиды выделены на первичных этапах исследования состава и строения ДНК и РНК, то из них и образовали отдельную группу под названием нуклеозиды.
/>
Нуклеозиды образованы всего двумя моносахаридами — D-рибозой и D-2-дезокси-рибозой в своих фуранозных формах и небольшой серией азотистых гетероциклов св-конфигурацией гликозидного фрагмента.
/>
Азотистые агликоны нуклеозидов представлены двумя группами гетероциклов: производными пиримидина и производными пурина. Пиримидин и пурин функционализированы— НЗ2и ОН-группами, но последний функционал претерпевает таутомерное превращение из гидроксиформы в соответствующую карбонильную функцию — это равновесие в нейтральной среде сдвинуто в сторону пиридоновых форм, тогда как соли имеют гидроксипиридиновую структуру.
Аминопиридиновый фрагмент этих нуклеиновых оснований также способен к таутомерному превращению, равновесие обычно сдвинуто в сторону аминной формы.
Таким образом, нуклеозиды можно разделить на «нормальные» — те, которые содержат в гетероцикле карбонильные и аминные функции, и на «редкие» — те, которые содержат в гетероцикле гидроксильные и иминные функции.
/>
Механизм образованияН-гликозидов этого ряда может быть объяснен, основываясь на следующих предпосылках: как правило, моносахара в водных растворах предпочтительно существуют вб-форме; во-вторых, все нуклеозиды при этом имеютв-конфигурацию; и, наконец, поскольку образование Н-гликозида — это процесс нуклеофильного замещения, из двух таутомерных форм всех нуклеиновых оснований нуклеофильными свойствами обладают их лактимные формы. Учитывая все это, можно предположить, что реакция идет по механизму SN2, при котором электрофильный центр С атакуется атомом азота в пиридиновом валентном состоянии. А если учесть еще и то, что процесс должен реализоваться в очень мягких условиях живой клетки, можно предположить двойной катализ этой реакции — кислотный по полуацетальному гидроксилу и основной по фенольному гидроксилу. В принципе, он может быть реализован одной молекулой фермента, имеющей и кислотную, и основную функциональную группу.
Аналогичным образом могут быть образованыН-гликозиды — с участием аминокислот и других биогенных аминов. Так как аминокислоты в нейтральных условиях существуют преимущественно в цвиттер-ионной форме, то катализатор-фермент двойственной природы, связывая кислотную функцию, активирует тем самым нуклеофильный реагент — а его кислотная функция будет синхронно активировать электрофильный центр.
/>
Н-гликозиды, указанные на схеме 6.13 и называемые нуклеозидами, являются фрагментами, или, можно сказать, мономерными звеньями нуклеиновых кислот, которыесвязаны между собой фосфатными группами. Дезоксирибонуклеиновые и рибонуклеиновые кислоты, а также белки и полисахариды относятся к группе биополимеров, которые в настоящем издании мы рассматриваем очень кратко по причине вышеуказанной — это объекты физико-химии, химии ВМС и смежных областей биологии.
ДНК и РНК построены практически по одной схеме: полимерная цепочка представляет собой полиэфир фосфорной кислоты и моносахарида с боковыми ответвлениями в видеН-гликозидных фрагментов.
/>
Различаются они между собой природой моносахарида и набором оснований, образующихН-гликозидный фрагмент: в ДНК это тимин, цитозин, аденин, гуанин, в РНК — урацил, цитозин, аденин, гуанин.
Эти небольшие казалось бы различия в структуре ДНК и РНК, в основном, сводятся к тому, что молекулы
ДНК являются более гидрофобными, а это, в свою очередь, приводит к тому, что в водной среде они проявляют тенденцию к агрегации, которая реализуется в виде двойной спирали. Двойная спираль ДНК построена на базе водородных связей между нуклеиновыми основаниями двух полимерных цепочек по схеме: тимин… аденин, цитозин… гуанин. Эти пары оснований представляют собой как бы «ступеньки веревочной лестницы», скрученной в виде спирали — это своего рода «винтовая лестница».
продолжение --PAGE_BREAK--/>
/>
Водородные связи, образующие ступеньки этой «винтовой лестницы», уникальны по своей структуре — они являются кратными. Это двойная водородная связь в паре аденин-тимин и тройная связь в паре цитозин-гуанин. Бесспорно, такие мостики прочнее ординарных водородных связей, но они по-прежнему слабее любых ковалентных связей.
РазличныеН-гликозиды. РазличныеН-гликозиды, близкие по структуре к вышеописанным нуклеозидам, выполняющие функции, отличные от функций ДНК и РНК, широко распространены в живом мире — одинаково и в растительном, и в животном. Прежде всего, укажем на аденозин-трифосфат — основной макроэрг живой клетки, или другими словами — молекула, выполняющая роль аккумулятора энергии invivo. Это лабильное соединение имеет одну важную особенность: первичная спиртовая группа рибозы фосфорилирована трижды и содержит вследствие этого трифосфорную группу, атомы фосфора которой имеют высокую степень электрофильности. Фосфорилированная часть молекулы АТР по своей структуре и свойствам похожа на фосфорный ангидрид — Р25, основной особенностью которого является высокоэкзотермичная реакция гидролиза. Взаимодействие АТР с нуклеофильными реагентами протекает легко и с выделением энергии, которая была затрачена на его синтез — т.е. энергия уже была как бы запасена в этой молекуле.
/>
/>
Аденозинтрифосфат участвует в большинстве метаболических реакций и является ключевым интермедиатом реакций invivo, протекающих с переносом энергии запасенной им ранее. При гидролизе АТР на первом этапе отщепляется концевая фосфатная группа и выделяется около 30 кДж/моль энергии.
/>
/>
Образовавшийся аденозиндифосфат может гидролизоваться до аденозинмонофосфата с выделением еще некоторого количества энергии. Кроме того, фосфатные группы могут замещаться другими нуклеофилами — например, аминокислотами с образованием ацилфосфатов, которые являются ангидридами по своей химической природе и могут, в свою очередь, легко вступать в другие биохимические реакции также с выделением энергии. Широко распространен в живых системах циклический изомер AMP, выполняющий функцию посредника в работе ряда гормонов и нервных медиаторов.
СредиН-гликозидов следует также особо отметить кофермент гликозидной структуры — НАД+, являющийся наиболее распространенным окислительно-восстановительным коферментом: он участвует в реакциях спиртокарбонильные превращения и др. Этот кофермент по химической структуре является дигликозидом.
Другой интересный коферментН-гликозидной структуры — кофермент А, который участвует в биохимических реакциях переноса ацильного фрагмента invivoи образует при биосинтезе большинства классов природных соединений интермедиат Co-S-CO-Ch4. Н-гликозидом является и кофермент S-аденозилметионин, осуществляющий перенос метиленой группы в биосинтетических реакциях.
Из всего вышесказанного о различныхН-гликозидах ясно, что все они построены с участием аденина — поэтому часто их выделяют в отдельную группу.
www.ronl.ru
Федеральное агентство по образованию
Контрольная работа
по дисциплине «Физиологические и санитарно-гигиенические основы питания»
тема: «Биологическая роль углеводов»
Содержание
Введение
1. Углеводы и их значение в питании
2. Виды углеводов
Заключение
Список используемой литературы
Гигиена питания — наука о закономерностях и принципах организации рационального (оптимального) питания здорового и больного человека. В ее рамках разрабатывают научные основы и практические мероприятия по оптимизации питания различных групп населения и санитарной охране пищевых ресурсов, сырья и продуктов на всех этапах их производства и оборота.
Фундаментальные аспекты гигиены питания связаны с изучением физиологических процессов, биохимических механизмов переваривания, усвоения пищи и клеточной метаболизации нутриентов и других компонентов пищевых продуктов, а также нутриогеномики, т.е. основ алиментарной регуляции экспрессии генов.
Гигиена питания, с одной стороны, определяет нормы физиологических потребностей в пищевых веществах и энергии, разрабатывает требования к качеству пищевой продукции и рекомендации по употреблению различных групп пищевых продуктов в зависимости от возрастных, социальных, географических и экологических факторов, режиму и условиям питания, а с другой стороны, регламентирует мероприятия по санитарно-эпидемиологической (гигиенической) экспертизе качества и безопасности пищевых продуктов и контактирующих с ними материалов и по контролю соответствия пищевых объектов на этапе их строительства и во время эксплуатации.
Гигиена питания как наука развивается с использованием общей методологии научных исследований в области физиологии, биохимии, токсикологии, микробиологии, эпидемиологии, внутренних болезней, а также собственных уникальных подходов и методик, включающих в себя оценку состояния питания, параметров пищевого статуса и алиментарной адаптации, показателей пищевой и биологической ценности продуктов.
Современный период развития гигиены питания связан с реализацией следующих научно-практических направлений:
разработка основ государственной политики в области здорового питания населения России;
фундаментальные исследования физиолого-биохимических основ питания;
постоянный мониторинг состояния питания населения России;
организация профилактики алиментарно-зависимых заболеваний;
исследования по проблеме безопасности пищевых продуктов;
разработка научно-методических подходов к оценке нетрадиционных и новых пищевых источников;
разработка и совершенствование научных основ и практики детского, диетического и профилактического питания;
научное обоснование и практическое осуществление системы алиментарной адаптации в современных экологических условиях;
широкое внедрение образовательных и просветительских программ и проектов как в системе профессионального образования и обучения, так и в обществе в целом.
В настоящее время гигиена питания в третий раз за последние 100 лет приобретает мощный общественный характер, обеспечивая выработку государственных подходов в области питания населения.
Питание является одним из важнейших факторов, определяющих здоровье населения. Правильное питание обеспечивает нормальный рост и развитие детей, способствует профилактике заболеваний, продлению жизни людей, повышению работоспособности и создает условия для адекватной адаптации их к окружающей среде.
Вместе с тем в последнее десятилетие состояние здоровья населения характеризуется негативными тенденциями. Продолжительность жизни населения в России значительно меньше, чем в большинстве развитых стран. Увеличение частоты сердечно-сосудистых, онкологических и других хронических неинфекционных заболеваний в определенной степени связано с питанием. У большинства населения России выявлены нарушения полноценного питания, обусловленные как недостаточным потреблением пищевых веществ, в первую очередь витаминов, макро — и микроэлементов (кальция, йода, железа, фтора, цинка и др.), полноценных белков, так и их нерациональным соотношением.
Одним из важных элементов являются углеводы. Они служат основным источником энергии. Свыше 56% энергии организм получает за счет углеводов, остальную часть — за счет белков и жиров.
Мир углеводов представляется нам очень неоднозначным. Иногда углеводы обвиняют в том, что именно они являются причиной лишнего веса. А иногда, наоборот, говорят, что углеводы — это идеальный источник энергии для организма.
Впервые термин «углеводы» был предложен профессором Дерптского (ныне Тартуского) университета К.Г. Шмидтом в 1844 г. В то время предполагали, что все углеводы имеют общую формулу Cm (h3O) n, т.е. углевод + вода. Отсюда название «углеводы». В дальнейшем оказалось, что ряд соединений, по своим свойствам относящихся к классу углеводов, содержат водород и кислород в несколько иной пропорции, чем указано в общей формуле.
В 1927 г. Международная комиссия по реформе химической номенклатуры предложила термин «углеводы» заменить термином «глициды», однако старое название «углеводы» укоренилось и является общепризнанным.
Углеводы образуются в растениях при фотосинтезе и поступают в организм главным образом с растительными продуктами. Однако все большее значение в питании приобретают добавленные углеводы, которые чаще всего представлены сахарозой (или смесями других сахаров), получаемой промышленным способом и вводимой затем в пищевые рецептуры.
Величина потребности в углеводах для человека определяется их ведущей ролью в обеспечении организма энергией и нежелательностью синтеза глюкозы из жиров (а тем более из белков) и находится в прямой зависимости от энергозатрат. Средняя потребность в углеводах для тех, кто не занят тяжелым физическим трудом, 400 — 500 г. в сутки.
Способность углеводов быть высокоэффективным источником энергии лежит в основе их сберегающего белок действия. При поступлении с пищей достаточного количества углеводов аминокислоты лишь в незначительной степени используются в организме как энергетический материал. Хотя углеводы не принадлежат к числу незаменимых факторов питания и могут образовываться в организме из аминокислот и глицерина, минимальное количество углеводов суточного рациона не должно быть ниже 50 — 60 г.
Дальнейшее снижение количества углеводов ведет к резким нарушениям метаболических процессов. Избыточное потребление углеводов ведет к ожирению. При поступлении с пищей значительных количеств сахаров они не могут полностью откладываться в виде гликогена, и их избыток превращается в триглицериды, способствуя усиленному развитию жировой ткани. Повышенное содержание в крови инсулина способствует ускорению этого процесса, поскольку инсулин оказывает мощное стимулирующее действие на жироотложение.
При построении пищевых рационов чрезвычайно важно не только удовлетворить потребности человека в необходимом количестве углеводов, но и подобрать оптимальные соотношения качественно различных типов углеводов. Наиболее важно учитывать соотношение в рационе легкоусвояемых углеводов (сахаров) и медленно всасывающихся (крахмал, гликоген).
В отличие от сахаров крахмал и гликоген медленно расщепляются в кишечнике. Содержание сахара в крови при этом нарастает постепенно. В связи с этим целесообразно удовлетворять потребности в углеводах в основном за счет медленно всасывающихся углеводов. На их долю должно приходиться 80 — 90% от общего количества потребляемых углеводов. Ограничение легкоусвояемых углеводов приобретает особое значение для тех, кто страдает атеросклерозом, сердечно-сосудистыми заболеваниями, сахарным диабетом, ожирением.
Углеводы являются основными энергонесущими элементами в питании человека, обеспечивая 50-70% общей энергетической ценности рациона.
Наряду с основной энергетической функцией углеводы участвуют в пластическом обмене. Углеводы оказывают антикетогенное действие, стимулируя окисление ацетилкоэнзима А, образующегося при окислении жирных кислот. Основным источником углеводов в питании человека является растительная пища, и только лактоза и гликоген содержатся в продуктах животного происхождения.
Основная функция углеводов — обеспечение энергией всех процессов в организме. Клетки способны получать из углеводов энергию, как при их окислении, т.е. «сгорании», так и в анаэробных условиях (без доступа кислорода). В результате метаболизации 1 г углеводов организм получает энергию, эквивалентную 4 ккал. Обмен углеводов тесно связан с обменом жиров и белков, что обеспечивает их взаимные превращения. При умеренном недостатке углеводов в питании депонированные жиры, а при глубоком дефиците (менее 50 г/сут) и аминокислоты (как свободные, так и из состава мышечных белков) вовлекаются в процесс глюконеогенеза, приводящий к получению необходимой организму энергии. Боль в мышцах после тяжелой работы — результат действия на клетки молочной кислоты, которая образуется при анаэробном распаде углеводов, когда для обеспечения работы мышечных клеток не хватает кислорода, поступающего с кровью.
Часто резкое ограничение углеводов в диете ведет к значительным нарушениям обмена веществ. Особенно страдает при этом белковый обмен. Белки при дефиците углеводов используются не по назначению: они становятся источником энергии и участниками некоторых важных химических реакций. Это приводит к повышенному образованию азотистых веществ и, как следствие, к повышенной нагрузке на почки, нарушениям солевого обмена и другим, вредным для здоровья, последствиям.
При дефиците углеводов в пище организм использует для синтеза энергии не только белки, но и жиры. При усиленном распаде жиров могут возникнуть нарушения обменных процессов, связанные с ускоренным образованием кетонов (к этому классу веществ относится известный всем ацетон) и накоплением их в организме. Избыточное образование кетонов при усиленном окислении жиров и частично белков может привести к «закислению» внутренней среды организма и отравлению тканей мозга вплоть до развития ацидотической комы с потерей сознания. При достаточном поступлении углеводов с пищей белки используются, главным образом, для пластического обмена, а не для производства энергии. Таким образом, углеводы необходимы для рационального использования белков. Они также способны стимулировать окисление промежуточных продуктов обмена жирных кислот.
Этим, однако, не исчерпывается роль углеводов. Они являются составной частью молекул некоторых аминокислот, участвуют в построении ферментов, образовании нуклеиновых кислот, являются предшественниками образования жиров, иммуноглобулинов, играющих важную роль в системе иммунитета, и гликопротеидов — комплексов углеводов и белков, которые являются важнейшими компонентами клеточных оболочек. Гиалуроновые кислоты и другие мукополисахариды образуют защитную прослойку между всеми клетками, из которых состоит организм.
Интерес к углеводам сдерживался чрезвычайной сложностью их структуры. В отличие от мономеров нуклеиновых кислот (нуклеотидов) и белков (аминокислот), которые способны связываться между собой только одним определенным путем, моносахаридные единицы в олигосахаридах и полисахаридах могут соединяться между собой несколькими путями по множеству разных положений.
Со второй половины XX в. происходит стремительное развитие химии и биохимии углеводов, обусловленное их важным биологическим значением.
Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящими в состав живых организмов. У человека и животных углеводы выполняют важные функции: энергетическую (главный вид клеточного топлива), структурную (обязательный компонент большинства внутриклеточных структур) и защитную (участие углеводных компонентов иммуноглобулинов в поддержании иммунитета).
Углеводы (рибоза, дезоксирибоза) используются для синтеза нуклеиновых кислот, они являются составными компонентами нуклеотидных ко-ферментов, играющих исключительно важную роль в метаболизме живых существ. В последнее время все большее внимание к себе привлекают смешанные биополимеры, содержащие углеводы: гликопептиды и глико-протеины, гликолипиды и липополисахариды, гликолипопротеины и т.д. Эти вещества выполняют в организме сложные и важные функции.
Итак, выделюб иологическое значение углеводов:
· Углеводы выполняют пластическую функцию, то есть участвуют в построении костей, клеток, ферментов. Они составляют 2-3 % от веса.
· Углеводы являются основным энергетическим материалом. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
· В крови содержится 100-110 мг глюкозы. От концентрации глюкозы зависит осмотическое давление крови.
· Пентозы (рибоза и дезоксирибоза) участвуют в построении АТФ.
· Углеводы выполняют защитную роль в растениях.
Различают две основные группы углеводов: простые и сложные. К простым углеводам относятся глюкоза, фруктоза, галактоза, сахароза, лактоза и мальтоза. К сложным — крахмал, гликоген, клетчатка и пектиновые вещества.
Углеводы подразделяются на моносахариды (простые), олигосахариды и полисахариды (сложные).
1. Моносахариды
· глюкоза
· фруктоза
· галактоза
· манноза
2. Олигосахариды
· Дисахариды
· сахароза (обычный сахар, тростниковый или свекловичный)
· мальтоза
· изомальтоза
· лактоза
· лактулоза
3.Полисахариды
· декстран
· гликоген
· крахмал
· целлюлоза
· галактоманнаны
Моносахариды (простые углеводы) являются наиболее простыми представителями углеводов и при гидролизе не расщепляются до более простых соединений. Простые углеводы легко растворяются в воде и быстро усваиваются. Они обладают выраженным сладким вкусом и относятся к сахарам.
В зависимости от числа углеродных атомов в молекулах моносахариды делятся на триозы, тетрозы, пентозы и гексозы. Для человека наиболее важны гексозы (глюкоза, фруктоза, галактоза и др.) и пентозы (рибоза, дезоксирибоза и др.).
При соединении двух молекул моносахаридов образуются дисахариды.
Наиболее важной из всех моносахаридов является глюкоза, так как она является структурной единицей (кирпичиком) для построения большинства пищевых ди — и полисахаридов. Транспорт глюкозы в клетки регулируется во многих тканях гормоном поджелудочной железы — инсулином.
У человека излишки глюкозы в первую очередь превращаются именно в гликоген — единственный резервный углевод животных тканей. В организме человека общее содержание гликогена составляет около 500 г — это суточный запас углеводов, используемый при их глубоком дефиците в питании. Длительный дефицит гликогена в печени ведет к дисфункции гепатоцитов и ее жировой инфильтрации.
Олигосахариды — более сложные соединения, построенные из нескольких (от 2 до 10) остатков моносахаридов. Они делятся на дисахариды, трисахариды и т.д. Наиболее важны для человека дисахариды — сахароза, мальтоза и лактоза. Олигосахариды, к которым относятся рафиноза, стахиоза, вербаскоза, в основном содержатся в бобовых и продуктах их технологической переработки, например в соевой муке, а также в незначительных количествах во многих овощах. Фрукто-олигосахариды встречаются в зерновых (пшенице, ржи), овощах (луке, чесноке, артишоках, спарже, ревене, цикории), а также в бананах и меде.
К группе олигосахаридов также относятся мальто-декстрины, являющиеся основными компонентами промышленно производимых из полисахаридного сырья сиропов, паток. Одним из представителей олигосахаридов является лактулоза, образующаяся из лактозы в процессе тепловой обработки молока, например при выработке топленого и стерилизованного молока.
Олигосахариды практически не расщепляются в тонком кишечнике человека из-за отсутствия соответствующих ферментов. По этой причине они обладают свойствами пищевых волокон. Некоторые олигосахариды играют существенную роль в жизнедеятельности нормальной микрофлоры толстого кишечника, что позволяет отнести их к пребиотикам — веществам, частично ферментирующимся некоторыми кишечными микроорганизмами и обеспечивающим поддержание нормального микробиоценоза кишечника.
Полисахариды — высокомолекулярные соединения-полимеры, образованные из большого числа мономеров, в качестве которых выступают остатки моносахаридов. Полисахариды делятся на перевариваемые и неперевариваемые в желудочно-кишечном тракте человека. В первую подгруппу входят крахмал и гликоген, во вторую — разнообразные соединения, из которых наиболее важны для человека целлюлоза (клетчатка), гемицсллюлоза и пектиновые вещества.
Олиго — и полисахариды объединяют термином «сложные углеводы». Моно — и дисахариды обладают сладким вкусом, в связи с чем их называют также «сахарами». Полисахариды сладким вкусом не обладают. Сладость сахароз различна. Если сладость раствора сахарозы принять за 100 %, то сладость эквимолярных растворов других Сахаров составит: фруктозы — 173 %, глюкозы — 81 %, мальтозы и галактозы — 32 % и лактозы — 16 %.
Основным усваиваемым полисахаридом является крахмал — пищевая основа зерновых, бобовых и картофеля. На его долю приходится до 80% потребляемых с пищей углеводов. Он представляет из себя сложный полимер, состоящий из двух фракций: амилозы — линейного полимера и амило-пектина — разветвленного полимера. Именно соотношение этих двух фракций в различных сырьевых источниках крахмала и определяет его различные физико-химические и технологические характеристики, в частности растворимость в воде при разной температуре. Источником крахмала служат растительные продукты, в основном злаковые: крупы, мука, хлеб, а также картофель.
Для облегчения усвоения крахмала организмом продукт, содержащий его, должен быть подвергнут тепловой обработке. При этом образуется крахмальный клейстер в явной форме, например кисель, или скрытом виде в составе пищевой композиции: каше, хлебе, макаронах, блюд из бобовых. Крахмальные полисахариды, поступившие с пищей в организм, подвергаются последовательной, начиная с ротовой полости, ферментации до мальтодекстринов, мальтозы и глюкозы с последующим практически полным усвоением.
Вторым перевариваемым полисахаридом является гликоген. Его пищевое значение невелико — с рационом поступает не более 10-15 г гликогена в составе печени, мяса и рыбы. При созревании мяса гликоген превращается в молочную кислоту.
Некоторые сложные углеводы (клетчатка, целлюлоза и др.) в организме человека не перевариваются вовсе. Тем не менее, это необходимый компонент питания: они стимулируют перистальтику кишечника, формируют каловые массы, способствуя тем самым выведению шлаков и очистке организма. Кроме того, клетчатка хоть и не переваривается человеком, но служит источником питания для полезной кишечной микрофлоры.
Значение углеводов в питании человека весьма велико. Они служат важнейшим источником энергии, обеспечивая до 50-70 % общей калорийности рациона.
Способность углеводов быть высокоэффективным источником энергии лежит в основе их «сберегающего белок» действия. Хотя углеводы не принадлежат к числу незаменимых факторов питания и могут образовываться в организме из аминокислот и глицерина, минимальное количество углеводов суточного рациона не должно быть ниже 50-60 г.
С нарушением обмена углеводов тесно связан ряд заболеваний: сахарный диабет, галактоземия, нарушение в системе депо гликогена, нетолерантность к молоку и т.д. Следует отметить, что в организме человека и животного углеводы присутствуют в меньшем количестве (не более 2% от сухой массы тела), чем белки и липиды; в растительных организмах за счет целлюлозы на долю углеводов приходится до 80% от сухой массы, поэтому в целом в биосфере углеводов больше, чем всех других органических соединений вместе взятых.
1. Справочник по диетологии/под ред. А.А. Покровского, М.А. Самсонова. — М.: Медицина, 1981
2. Популярно о питании. Под ред. А.И. Столмаковой, И.О. Мартынюка, Киев, «Здоровье», 1990
3. Королев А.А. Гигиена питания — 2-е изд. Перераб. и доп. — М.: «Академия», 2007
4. Ауреден Л. Как стать красивой. — М.: Топикал, 1995
5. hudeemtut.ru
6. Ленинджер А. Основы биохимии // М.: Мир, 1985.
www.ronl.ru
Углеводы
Творческая работа по химии.
Выполнила: учащаяся группы ОТ-07-2
Семенищева Полина
Департамент образования г. Астана. Политехнический колледж
Астана 2008
Введение.
Ежедневно сталкиваясь с множеством бытовых предметов, продуктов питания, природных объектов, продуктов промышленного производства, мы не задумываемся о том, что все вокруг есть и индивидуальные химические вещества или совокупность этих веществ. Любое вещество обладает собственной структурой и свойствами. Человек с момента своего появления на Земле употреблял растительную пищу, содержащую крахмал, фрукты и овощи, содержащие глюкозу, сахарозу и другие углеводы, использовал для своих нужд древесину и другие растительные объекты, состоящие главным образом из другого природного полисахарида — целлюлозы. И только в начале XIX в. стало возможным изучение химического состава природных высокомолекулярных веществ, строения их молекул. В этой области были сделаны важнейшие открытия.
В бескрайнем мире органических веществ есть соединения, о которых можно сказать, что они состоят из углерода и воды. Они так и называются – углеводы. Впервые термин “углеводы” предложил русский химик из Дерпта (ныне Тарту) К. Шмидт в 1844 году. В 1811 году русский химик Константин Готлиб Сигизмунд (1764-1833) впервые получил глюкозу гидролизом крахмала. Углеводы широко распространены в природе и играют большую роль в биологических процессах живых организмов и человека.
Углеводы в зависимости от строения можно подразделить на моносахариды, дисахариды и полисахариды: ( см. приложение 1)
1. Моносахариды:
- глюкоза С6Н12О6
- фруктоза С6Н12О6
- рибоза С5Н10О5
Из шестиуглеродных моносахаридов – гексоз – наиболее важное значение имеют глюкоза, фруктоза и галактоза.
Если в одной молекуле объединяются два моносахарида, такое соединение называется дисахаридом.
2. Дисахариды:
- сахароза С12Н22О11
Сложные углеводы, образованные многими моносахаридами, называются полисахаридами.
3. Полисахариды:
- крахмал (С6Н10О5)n
- целлюлоза (С6Н10О5)n
В молекулах моносахоридов может содержаться от 4-х до 10-ти атомов углерода. Названия всех групп моносахаридов, а также названия отдельных представителей оканчиваются на –оза. Поэтому в зависимости о числа атомов углерода в молекуле моносахариды подразделяют на тетрозы, пентозы, гексозы и т.д. наибольшее значение имеют гексозы и пентозы.
Классификация углеводов.
| Пентозы | Гексозы | Дисахариды | Полисахариды |
| Глюкоза Рибоза Дезоксирибоза Арабиноза Ксилоза Ликсоза Рибулоза Ксилулоза | Глюкоза Галактоза Манноза Гулоза Идоза Талоза Аллоза Альтроза Фруктоза Сорбоза Такатоза Псикоза Фукоза Рамноза | Сахароза Лактоза Трегалоза Мальтоза Целлобиоза Аллолактоза Гентиобиоза Ксилобиоза Мелибиоза | Гликоген Крахмал Целлюлоза Хитин Амилоза Амилопектин Стахилоза Инулин Декстрин Пектины |
Животные и человек не способны синтезировать сахара и получают их с различными пищевыми продуктами растительного происхождения.
В растениях углеводы образуются из двуокиси углерода и воды в процессе сложной реакции фотосинтеза, осуществляемой за счет солнечной энергии с участием зелёного пигмента растений - хлорофилла.
I.Моносахариды.
Из шестиуглеродных моносахаридов – гексоз – важное значение имеют глюкоза, фруктоза и галактоза.
Глюкоза.
Основные понятия. Строение молекулы.
Для установления структурной формулы молекулы глюкозы необходимо знать её химические свойства. Экспериментально доказали, что один моль глюкозы реагирует с пятью молями уксусной кислоты с образованием сложного эфира. Это означает, что в молекуле глюкозы имеется пять гидроксильных групп. Так как глюкоза в аммиачном растворе оксида серебра (II) дает реакцию «серебрянного зеркала», то в её молекуле должна быть альдегидная группа.
Опытным путем так же одказали, что глюкоза имеет неразветвленную углеродную цепь. На основании этих данных строение молекулы глюкозы можно выразить следующей формулой:
Как видно из формулы, глюкоза является одновременно многоатомным спиртом а альдегидом, т.е альдегидоспиртом.
Дальнейшие исследование показали, что кроме молекул с открытой цепью, для глюкозы характерны молекулы циклического строения. Это объясняется тем, что молекулы глюкозы, вследствие вращения атомов углерода вокруг связей могут принимать изогнутую форму и гидроксильная группа 5 углерода может приблизиться к гидроксильной группе. В последней под действием гидроксильной группы разрывается π-связь. К свободной связи присоединяется атом водорода, и образуется шестичленное кольцо, в котором альдегидная группа отсутствует. Доказано, что в водном растворе существуют обе формы молекул глюкозы – альдегидная и циклическая, между которыми устанавливается химическое равновесие:
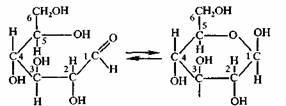
В молекулах глюкозы с открытой цепью альдегидная группа может свободно вращаться вокруг σ-связи, которая находится между первым и вторым атомами углерода. В молекулах циклической формы такое вращение не возможно. По этой причине циклическая форма молекулы может иметь различное пространственное строение:
α-форма глюкозы - гидроксильные группы (-ОН) при первом и втором атомах углерода расположены по одну сторону кольца.
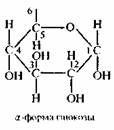
б - форма глюкозы - гидроксильные группы находятся по разные стороны кольца молекулы.

Физические свойства.
Глюкоза - бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора кристаллизуется. По сравнению со свекловичным сахаром менее сладкая.
Химические свойства.
Глюкоза обладает химическими свойствами, характерными для спиртов (гидроксильная (-ОН) группа) и альдегидов ( группа альдегида (-СНО). Кроме того, она обладает и некоторыми специфическими свойствами.
1. Свойства, характерные для спиртов:
а) взаимодействие с оксидом меди (II):
C6h22O6 + Cu(OH)2 → C6h20O6Cu + h3O
алкоголят меди (II)
б) взаимодействие с карбоновыми кислотами с образованием сложных эфиров (реакция этерификации).
C6h22O6+5Ch4COOH→C6H7O6(Ch4CO)5
2. Свойства, характерные для альдегидов
а) взаимодействие с оксидом серебра ( I ) в аммиачном растворе (реакция "серебряного зеркала"):
C6h22O6 + Аg2O → C6h22O7 +2Ag↓
глюкоза глюконовая кислота
б)восстановление (гидрирование) - до шестиатомного спирта (сорбита):
C6h22O6 + h3 → C6h24O6
глюкоза сорбит
3. Специфические реакции - брожение:
а) спиртовое брожение (под действием дрожжей):
С6Н12О6 → 2С2Н5ОН + 2СО2
глюкоза этиловый спирт
б) молочнокислые брожение (под действие молочнокислых бактерий):
С6Н12О6 → С3Н6О3
глюкоза молочная кислота
в) маслянокислое брожение:
С6Н12О6 → С3Н7СООН +2Н2 +2СО2
глюкоза масляная кислота
Получение глюкозы.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А.М.Бутлеровым в 1861 году:
са(он)2
6НСОН → С6Н12О6
формальдегид люкоза
На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
Н2SО4
(С6Н10О5)n + nН2О → nC6h22O6
крахмал глюкоза
Применение глюкозы.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям, в результате которых освобождается энергия, которая накопилась в процессе фотосинтеза. Упрощено процесс окисления глюкозы в организме можно выразить следующим уравнением:
С6Н12О6 + 6О2→6СО2+6h3O+Q
Так как глюкоза легко усваивается организмом, ее используют в медицине в качестве укрепляющего лечебного средства. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников).
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же, как при силосований кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Нахождение в природе и организме человека.
В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках. Много глюкозы находится во фруктах, ягодах, нектаре цветов, особенно много в винограде.
В природе глюкоза образуется в растениях в результате фотосинтеза в присутствии зелёного вещества - хлорофилла, содержащего атом магния. В свободном виде глюкоза содержится почти во всех органах зеленых растений. Особенно ее много в соке винограда, поэтому глюкозу иногда называют виноградным сахаром. Мед в основном состоит из смеси глюкозы с фруктозой.
II Дисахариды.
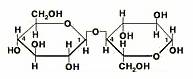
Дисахариды - кристаллические углеводы, молекулы которых построены из соединённых между собой остатков двух молекул моносахаридов.
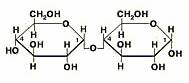
Простейшими представителями дисахаридов являются обычный свекловичный или тростниковый сахар - сахароза, солодовый сахар - мальтоза, молочный сахар - лактоза и целлобиоза. Все эти дисахариды имеют одну и туже формулу С12Н22О11.
Сахароза.
Основные понятия. Строение молекулы
Опытным путем доказано, что молекулярная формула сахарозы C12h32O11. При исследовании химических свойств сахарозы можно убедиться, что для нее характерна реакция многоатомных спиртов: при взаимодействии с гидроксидом меди (II) образуется ярко-синий раствор. Реакцию «серебряного зеркала» с сахарозой осуществить не удается. Следовательно, в ее молекуле имеются гидроксильные группы, но нет альдегидной.
Но если раствор сахарозы нагреть в присутствии соляной или серной кислоты, то образуются два вещества, одно из которых, подобно альдегидам, реагирует как с аммиачным раствором оксида серебра (I), так и с гидроксидом меди (II). Эта реакция доказывает, что в присутствии минеральных кислот сахароза подвергается гидролизу и в результате образуются глюкоза и фруктоза. Так подтверждается, что молекулы сахарозы состоят из взаимно связанных остатков молекул глюкозы и фруктозы.
Физические свойства.
Чистая сахароза — бесцветное кристаллическое вещество сладкого вкуса, хорошо растворимое в воде.
Химические свойства.
Главным свойством дисахаридов, отличающим их от моносахаридов, является способность к гидролизу в кислой среде (или под действием ферментов в организме):
С12Н22О11+Н2О→ С6Н12О6+ С6Н12О6
сахароза глюкоза фруктоза
Образовавшуюся в процессе гидролиза глюкозу можно обнаружить реакцией «серебряного зеркала» или при взаимодействии ее с гидроксидом меди (II).
Получение сахарозы.
Сахарозу C12h32O11 (сахар) получают в основном из сахарной свеклы и сахарного тростника. При производстве сахарозы не происходят химические превращения, ибо она уже имеется в природных продуктах. Ее лишь выделяют из этих продуктов по возможности в более чистом виде.
Процесс выделения сахарозы из сахарной свеклы:
Очищенную сахарную свеклу в механических свеклорезках превращают в тонкую стружку и помещают ее вспециальные сосуды — диффузоры, через которые пропускают горячую воду. В результате из свеклы вымывается почти вся сахароза, но вместе с ней в раствор переходят различные кислоты, белки и красящие вещества, которые требуется отделить от сахарозы.
Образовавшийся в диффузорах раствор обрабатывают известковым молоком.
С12Н22О11+Ca(OH)2→ С12Н22О11∙2CaO∙h3O
Гидроксид кальция реагирует с содержащимися в растворе кислотами. Так как кальциевые соли большинства органических кислот малорастворимы, то они выпадают в осадок. Сахароза же с гидроксидом кальция образует растворимый сахарат типа алкоголятов - С12Н22О11∙2CaO∙h3O
3. Чтобы разложить образовавшийся сахарат кальция и нейтрализовать избыток гидроксида кальция, через их раствор пропускают оксид углерода (IV). В результате кальций осаждается в виде карбоната:
С12Н22О11∙2CaO∙h3O + 2СО2 → С12Н22О11 + 2CaСO3↓ 2Н2О
4. Полученный после осаждения карбоната кальция раствор фильтруют, затем упаривают в вакуумных аппаратах и кристаллики сахара отделяют центрифугированием.
Однако выделить весь сахар из раствора не удается. Остается бурый раствор (меласса), который содержит еще до 50% сахарозы. Мелассу используют для получения лимонной кислоты и некоторых других продуктов.
5. Выделенный сахарный песок обычно имеет желтоватый цвет, так как содержит красящие вещества. Чтобы их отделить, сахарозу вновь растворяют в воде и полученный раствор пропускают через активированный уголь. Затем раствор снова упаривают и подвергают кристаллизации. ( см. приложение 2)
Применение сахарозы.
Сахароза в основном используется в качестве продукта питания и в кондитерской промышленности. Путем гидролиза из нее получают искусственный мед.
Нахождение в природе и организме человека.
Сахароза входит в состав сока сахарной свеклы (16 — 20%) и сахарного тростника (14 — 26%). В небольших количествах она содержится вместе с глюкозой в плодах и листьях многих зеленых растений.
III Полисахариды.
Некоторые углеводы представляют собой природные полимеры, состоящие из многих сотен и даже тысяч моносахаридных звеньев, входящих в состав одной макромолекулы. Поэтому такие вещества получили название полисахариды. Наиболее важными среди полисахаридов являются крахмал и целлюлоза. Оба они образуются в растительных клетках из глюкозы, основного продукта процесса фотосинтеза.
Крахмал
Основные понятия. Строение молекулы.
Экспериментально доказано, что химическая формула крахмала (C6h20O5)n, где п достигает нескольких тысяч. Крахмал является природным полимером, молекулы которого состоят из отдельных звеньев C6h20O5. Так как при гидролизе крахмала образуется только глюкоза, то можно сделать вывод, что эти звенья являются остатками молекул α-глюкозы.
Ученым удалось доказать, что макромолекулы крахмала состоят из остатков молекул циклической глюкозы. Процесс образования крахмала можно представить так:
Кроме того, установлено, что крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
Физические свойства.
Крахмал — белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер. В отличие от моно- и олигосахаридов полисахариды не обладают сладким вкусом.
Химические свойства.
Качественная реакция на крахмал.
Характерной реакцией крахмала является его взаимодействие с йодом. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь. Этим свойством пользуются при определении крахмала в пищевых продуктах. Так, например, если каплю йода поместить на срез картофеля или ломтик белого хлеба, то появляется синее окрашивание.
Реакция гидролиза:
(С6Н6О5)n + nh3O → nC6h22O6
Получение крахмала.
В промышленности крахмал получают в основном из картофеля, риса или кукурузы.
Применение крахмала.
Крахмал является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают действию высокой температуры, т. е. картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и образуются декстрины, растворимые в воде. Декстрины в пищеварительном тракте подвергаются дальнейшему гидролизу до глюкозы, которая усваивается организмом. Избыток глюкозы превращается в гликоген (животный крахмал). Состав гликогена такой же, как у крахмала, но его молекулы более разветвленные. Особенно много гликогена содержится в печени (до 10%). В организме гликоген является резервным веществом, которое превращается в глюкозу по мере ее расходования в клетках.
В промышленности крахмал путем гидролиза превращают в патоку и глюкозу. Для этого его нагревают с разбавленной серной кислотой, избыток которой затем нейтрализуют мелом. Образовавшийся осадок сульфата кальция отфильтровывают, раствор упаривают и выделяют глюкозу. Если гидролиз крахмала не доводить до конца, то образуется смесь декстринов с глюкозой — патока, которую применяют в кондитерской промышленности. Получаемые из крахмала декстрины используются в качестве клея, для загустения красок при нанесении рисунков на ткань.
Крахмал применяется для накрахмаливания белья. Под горячим утюгом происходит частичный гидролиз крахмала и превращение его в декстрины. Последние образуют на ткани плотную пленку, которая придает блеск ткани и предохраняет ее от загрязнения.
Нахождение в природе и организме человека.
Крахмал, являясь одним из продуктов фотосинтеза, широко распространен в природе. Для различных растений он является запасным питательным материалом и содержится главным образом в плодах, семенах и клубнях. Наиболее богато крахмалом зерно злаковых растений: риса (до 86%), пшеницы (до 75%), кукурузы (до 72%), а также клубни картофеля (до 24%). В клубнях крахмальные зерна плавают в клеточном соке, поэтому картофель является основным сырьем для получения крахмала. В злаках частицы крахмала плотно склеены белковым веществом клейковиной.
Для организма человека крахмал наряду с сахарозой служит основным поставщиком углеводов — одного из важнейших компонентов пищи. Под действием ферментов крахмал гидролизуется до глюкозы, которая окисляется в клетках до углекислого газа и воды с выделением энергии, необходимой для функционирования живого организма. Из продуктов питания наибольшее количество крахмала содержится в хлебе, макаронных и других мучных изделиях, крупах, картофеле.
Целлюлоза.
Вторым наиболее распространенным в природе полисахаридом является целлюлоза или клетчатка (см. приложение 4).
Основные понятия. Строение молекулы.

.Формула целлюлозы, как и крахмала - (С6Н10О5)n, элементарным звеном этого природного полимера также служат остатки глюкозы. Степень полимеризации у целлюлозы намного больше, чем у крахмала.
Макромолекулы целлюлозы, в отличие от крахмала, состоят из остатков молекул б-глюкозы и имеют только линейное строение. Макромолекулы целлюлозы располагаются в одном направлении и образуют волокна (лен, хлопок, конопля).
Физические свойства.
Чистая целлюлоза — твердое белое вещество, имеющее волокнистую структуру. Она нерастворима в воде и органических растворителях, но хорошо растворяется в аммиачном растворе гидроксида меди (II). Как известно, сладкого вкуса целлюлоза не имеет.
Химические свойства.
Горение. Целлюлоза легко горит с образованием углекислого газа и воды.
(С6Н10О5)n + 6nО2 → nСО2 + nН2О + Q
Гидролиз. В отличие от крахмала клетчатка гидролизуется с трудом. Только очень длительное кипячение в водных растворах сильных кислот приводит к заметному расщеплению макромолекулы до глюкозы:
(С6Н10О5)n + nh3O → nC6h22O6
Образования сложных эфиров. Каждое элементарное звено молекулы целлюлозы имеет три гидроксильные группы, которые могут участвовать в образовании сложных эфиров как с органическими, и с неорганическими кислотами.
Нитраты целлюлозы. При обработке целлюлозы смесью концентрированных азотной и серной кислот (нитрующая смесь) образуются нитраты целлюлозы. В зависимости от условий проведении реакции и соотношения реагирующих веществ можно получить продукт по двум (динитрат) или трем (тринитрат) гидроксильным группам
Получение целлюлозы.
Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитным. По этому методу, измельченную древесину в присутствии раствора гидросульфита кальция или гидросульфита натрия нагревают в автоклавах при давлении 0,5-0,6 МПа и температуре 150 °С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Применение целлюлозы.
Целлюлоза используется человеком с очень древних времен. Ее применение весьма разнообразно. Из целлюлозы изготавливают многочисленные искусственные волокна, полимерные пленки, пластмассы, бездымный порох, лаки. Большое количество целлюлозы идет на производство бумаги. Большое значение имеют продукты этерификации целлюлозы. Так, например, из ацетилцеллюлозы получают ацетатный шелк. Для этого триацетилцеллюлозу растворяют в смеси дихлорметана и этанола. Образовавшийся вязкий раствор продавливают через фильеры — металлические колпачки с многочисленными отверстиями. Тонкие струи раствора опускаются в шахту, через которую противотоком проходит нагретый воздух. В результате растворитель испаряется и триацетилцеллюлоза выделяется в виде длинных нитей, из которых прядением изготовляют ацетатный шелк .Ацетилцеллюлоза идет также на производство негорючей пленки и органического стекла, пропускающего ультрафиолетовые лучи.
Тринитроцеллюлоза (пироксилин) используется как взрывчатое вещество и для производства бездымного пороха. Для этого тринитроцеллюлозу растворяют в этил-ацетате или в ацетоне. После испарения растворителей компактную массу размельчают и получают бездымный порох. Исторически это был первый полимер, из которого была изготовлена промышленная пластмасса — целлулоид. Ранее пироксилин использовался для изготовления кино- и фотопленки и лаков. Его главный недостаток — легкая горючесть с образованием токсичных оксидов азота.
Динитроцеллюлоза (коллоксилин) применяется также для получения коллодия. В этих целях ее растворяют в смеси спирта и эфира. После испарения растворителей образуется плотная пленка — коллодий, применяемый в медицине. Динитроцеллюлоза идет также на производство пластмассы целлулоида. Его получают путем сплавления ди-нитроцеллюлозы с камфорой.
Нахождение в природе и организме человека.
Целлюлоза является основной частью стенок растений. Относительно чистой целлюлозой являются волокна хлопчатника, джута и конопли. Древесина содержит от 40 до 50% целлюлозы, солома — 30%. Целлюлоза растений служит питательным веществом для травоядных животных, в организме которых имеются расщепляющие клетчатку ферменты. Целлюлоза, так же как и крахмал, образуется в растениях при реакции фотосинтеза. Она является основной составной частью оболочки растительных клеток; отсюда происходит ее название —- целлюлоза («целлула» — клетка). Волокна хлопка — это почти чистая целлюлоза (до 98%). Волокна льна и конопли тоже состоят главным образом из целлюлозы. В древесине ее содержится примерно 50%.
Заключение:
Биологическое значение углеводов очень велико:
Углеводы выполняют пластическую функцию, то есть участвуют в построении костей, клеток, ферментов. Они составляют 2-3 % от веса.
Углеводы выполняют две основные функции: строительную и энергетическую. Целлюлоза образует стенки растительных клеток. Сложный полисахарид хитин служит главным структурным компонентом наружного скелета членистоногих. Строительную функцию хитин выполняет и у грибов.
Углеводы являются основным энергетическим материалом (см. ). При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 воды. Крахмал у растений и гликоген у животных откладываются в клетках и служат энергетическим резервом.
В крови содержится (0,1-0,12%) глюкозы. От концентрации глюкозы зависит осмотическое давление крови.
Пентоза (рибоза и дезоксирибоза) участвуют в постоении АТФ.
В суточном рационе человека и животных преобладают углеводы. Животные получают крахмал, клетчатку, сахарозу. Хищники получают гликоген с мясом.
Ежедневная потребность человека в сахарах составляет около 500 граммов, но она пополняется в основном за счет крахмала, содержащегося в хлебе, картофеле, макаронных изделиях. При рациональном питании суточная доза сахарозы не должна превышать 75 граммов (12 – 14 стандартных кусочков сахара, включая тот, что расходуется на приготовление пищи).
Кроме того, углеводы играют значительную роль в современной промышленности – технологии и продукты, в которых используются углеводы, не загрязняют окружающей среды, не приносят ей ущерба.
Приложения.
Приложение 1:
 Приложение 2:
Приложение 2:
История открытия и производства сахара из свёклы.
Родиной сахарного тростника считается Индия (слово «сахар» тоже «родом» из Индии: «сакхара» на языке одного из древних народов полуострова означало сначала просто «песок», а затем – «сахарный песок»). Из Индии это растение было вывезено в Египет и Персию; оттуда через Венецию сахар поступал в европейские страны. Долгое время он стоил очень дорого и считался роскошью.
Культивировалась свекла с давних времен. В древних Ассирии и Вавилоне свекла выращивалась уже за 1,5 тыс. лет до н.э. Окультуренные формы свеклы известны на Ближнем Востоке с VIII-VI вв. до н.э. А в Египте свекла служила главной пищей рабов. Так, из диких форм свеклы, благодаря соответствующей селекции, постепенно были созданы сорта кормовой, столовой и белой свеклы. Из белых сортов столовой свеклы были выведены первые сорта сахарной свеклы.
Появление нового альтернативного тростнику, сахароноса историки науки связывают с эпохальным открытием немецкого ученого-химика, члена Прусской академии наук А. С. Маргграфа (1705-1782). В докладе на заседании Берлинской академии наук в 1747 г. он изложил результаты опытов по получению кристаллического сахара из свеклы.
Полученный сахар, как утверждал Маргграф, по своим вкусовым качествам не уступал тростниковому. Однако Маргграф не видел широких перспектив практического применения своего открытия.
Дальше в исследовании и изучении данного открытия пошел ученик Маргграфа - Ф. К. Ахард (1753-1821). Он с 1784 года активно взялся за усовершенствование, дальнейшую разработку и внедрение в практику открытия своего учителя.
Ахард прекрасно понимал, что одним из важнейших условий успеха нового, весьма перспективного дела, является улучшение сырья-свеклы, т.е. повышение ее сахаристости. Уже в 1799 году труды Ахарда увенчались успехом. Появилась новая ветвь культурной свеклы – сахарная. В 1801 году в своем имении в Кюцерне (Силезия) Ахард построил один из первых сахарных заводов в Европе, на котором освоил получение сахара из свеклы.
Комиссия, направленная Парижской академией наук, провела обследование ахардовского завода и пришла к выводу, что выработка сахара из свеклы нерентабельна.
Лишь единственные на то время английские промышленники, которые являлись монополистами по производству и продаже тростникового сахара, усмотрели в сахарной свекле серьезного конкурента и несколько раз предлагали Ахарду крупные суммы при условии, что он откажется от проведения своих работ и публично заявит бесперспективности производства сахара из свеклы.
Но Ахард, свято веривший в перспективность нового сахароноса, на компромисс не шел.С 1806 года Франция отказывается от производства сахара из тростника и переходит на свеклосахарное, которое со временем получало все большее распространение. Наполеон оказывал большую поддержку тем, кто проявлял желание выращивать свеклу и производить из нее сахар, т.к. увидел в развитии новой отрасли возможность одновременного развития сельского хозяйства и промышленности
Старинный русский способ получения сахара из растений, содержащих сахарозу.
Этот простой метод получения сахара, рассчитан специально для домашних условий. Способ содержит элементы старинных русских рецептов получения сахара, в том числе использованы методики, предложенные еще в 1850-1854 г. инженером Толпыгиным. Сырьем для получения сахара служат растения - сахароносы, содержащие сахарозу. Для получения сахара следует использовать ягоды, фрукты, овощи с наибольшим содержанием сахара, т.е. наиболее сладкие.
Последовательность получения сахара следующая:
Измельчение продукта;
Получение сока;
Отделение от примесей;
Сгущение сока до сиропа;
Извлечение кристаллического сахара.
Первый этап: Итак, превращение сахаросодержащего продукта в сахар основано на добывании сока из него.
Если вы используете нежные плоды (земляника, клубника и др. ягоды), то достаточно их размять. Если это, например, абрикосы, персики, то их следует разломить, вынуть косточки. Если применяется арбуз или дыня, то содержимое плода извлекается из оболочки и освобождается от семечек. Также рекомендуется свежесорванные ягоды, плоды выдержать предварительно 2-3 часа для повышения выхода сока. Если это сахарная свекла, яблоки или морковь и др., продукт измельчается в стружку. Чем тоньше и длиннее стружка, тем больше факторов, благоприятствующих ее обессахариванию. Хорошая стружка рекомендуется с шириной полоски 2-3 мм, а толщина 1-1,5 мм.
Второй этап: Измельченный продукт заливается водой до полного его покрытия и проваривается при температуре 70-72 °С. Если температура будет ниже 70°С, то не убиваются возможные микробы, если выше 72°С, то начинается размягчение стружки.
Время варки 45-60 минут при помешивании деревянной лопаткой. Сахар из стружки переходит в воду, которая становится соком. Стружка после извлечения из нее сахара называется жом. Из жома отжимается сок и жом убирается.
Третий этап: Полученный сок имеет темный цвет и высокое содержание примесей. Темная окраска, если от нее не избавиться, передается потом кристаллам сахара. Если на этой стадии выпарить из сока воду, вы получите сахар, но он будет иметь привкус исходного продукта, его цвет и запах. Сок имеет кислую реакцию, поэтому необходима его нейтрализация. Если этого не сделать, сок будет сильно пениться при выпаривании и тем затруднять этот процесс. Наиболее дешевый способ счистки сока - его обработки обожженой гашенной известью СА (ОН)2. В сок, подогретый до 80-90 °С, добавляем известь (в крайнем случае можно использовать строительную известку). На 10 л сока требуется примерно 0,5 кг извести. Известь следует добавлять постепенно, постоянно помешивая сок. Дать раствору выдержку 10 минут. Затем для того, чтобы осадить известь нужно пропустить через сок углекислый газ СО2. Можно использовать углекислый газ из баллончиков к бытовым сифонам (для получения газированной воды), промышленные баллоны с газом для сатураторов или из огнетушителей серии ОУ и ОВП. Газ из баллончика по трубке подается в нижнюю часть сосуда с горячим соком. На конце трубки следует установить распылитель (рассеиватель) с множеством мелких отверстий для более эффективного использования газа. Еще лучшего результата можно добиться одновременно помешивая раствор. Хорошее распыление газа гарантирует высокий коэффициент его использования и сокращает время процесса (около 10 минут). Раствору надо отстояться, затем профильтровать. Более эффективными являются фильтры с использованием активизированного древесного или костяного угля. Но в крайнем случае можно использовать тканевый фильтр.
Для окончательного осветления сока и удаления запаха сырья предлагаю русский проверенный способ. Через сок следует пропустить сернистый газ SO2. Обработку сернистым газом важно провести именно перед выпариванием, т. к. действие газа сказывается и при выпарке, что способствует меньшему потемнению сиропа. Необходимо иметь серу. Сера при нагревании плавится и в смеси с воздухом образуется сернистый газ. Старыми мастерами применялись два герметичных сосуда, соединенных между собой трубкой. В одном - вода, в другой закладывалась сера. Из сосуда с серой выходила 2-я трубка к рассеивателю на дно емкости с соком. При нагревании обоих сосудов водяной пар, проходя по трубке, вытеснял сернистый газ из 2-го сосуда и поступал к рассеивателю. Рассеиватель можно взять тот же.
Эту схему можно несколько упростить: взять только один сосуд с серой, к входной трубке его подсоединить компрессор для аквариума или другой насос и продувать воздухом газ, скапливающийся в сосуде с серой. Продувку газом надо проводить до полного осветления сока. Для ускорения процесса лучше одновременно подмешивать сок. Сернистый газ бесследно улетучивается из раствора в открытом сосуде, но работать следует в хорошо проветриваемом помещении.
Сернистый газ SO2 является лучшим антисептиком. Он сильно коррозирует металлическую посуду, поэтому следует использовать эмалированную. Очень большим достоинством этого газа, в значительной мере перекрывающим его недостатки, является возможность полостью удалить его из продукта. При нагревании продукта, обработанного сернистым газом, последний улетучивается, не оставляя ни запаха, ни привкуса. Газ широко используется на консервных заводах для консервирования различных продуктов.
Серу можно купить в хозяйственном магазине или в магазине для садоводов, она там продается как "Сера садовая" - содержит 99,9 % серы. Если найти серу Вам не удалось, не расстраивайтесь. Ваш сахар будет не такой белый, сохранит оттенок исходного продукта, но по вкусовым качествам будет не хуже белого.
Четвертый этап: Следующий этап - сгущение очищенного и обесцвеченного сока в сироп. Необходимо удалить из сока большое количество воды. Лучше всего это сделать выпариванием сока на русской печи, на малом огне плиты, ни в коем случае не доводя сироп до кипения (во избежание его потемнения).
В процессе выпаривания сироп все более сгущается. Если в пересыщенный раствор, не имеющий кристаллов сахара, ввести затравку в виде нескольких граммов сахарной пудры, то она вызовет образование новых кристаллов. Определение момента заводки в раствор пудры является очень ответственным и заключается с следующем простейшем способе: капля сиропа, зажатая между пальцами, при их раздвигании образует тонкую нить (волос), тогда наступает момент затравки. На 10 литров сиропа количество затравки составит половину чайной ложки пудры. Если завести мало пудры, то кристаллы образующегося сахара будут крупными, если много - мелкими. Достаточное количество кристаллов образуется примерно через 10-15 минут после внесения затравки. Дальнейшую кристаллизацию следует проводить при непрерывном охлаждении и перемешивании продукта,
Полученный продукт называется «утфель», в нем содержится до 7-10% воды и 50-60% выкристаллизовавшегося сахара и межкристаллическая жидкость (патока).
Пятый этап: Следующая операция отделение кристаллов от патоки. После окончания кристаллизации всю массу нужно выгрузить в ткань с ячейкой 0,3 мм, подвесить ее за углы в один узел над емкостью для слива патоки. При этом постараться отжать массу. Для увеличения процента выхода сахара патоку лучше использовать повторно в качестве добавки к сиропу.
Сахар после слива патоки получается желтоватого цвета. Далее можно использовать метод пробелки, отлично зарекомендовавший себя в 1854 г. и предложенный инженером Толпыгиным. Этот метод, внедренный в России, быстро распространился в мировой сахарной промышленности и именовался «русским». Сейчас метод незаслуженно забыт. Он заключается в пробелке утфеля паром и позволяет получить белый сахар высокого качества. Ткань с сахаром надо плотно подвязать на таз с малым количеством кипящей воды. Пар, поднимаясь, будет проходить через сахар, очищая его от белой патоки. Полученный белый сахар даже на ощупь влажный при хранении будет комковаться и превратится в сплошную глыбу. Поэтому пред долговременным хранением сахар следует высушить.
Особенности производства сахара.
Сахарное производство относится к непрерывно-поточному механизированному производству с высоким уровнем автоматизации основных процессов.
Особенностью территориального размещения сахарных заводов является их жёсткая привязка к посевным площадям сахарной свеклы, поскольку перевозка свеклы на значительные расстояния экономически неэффективна. В ряде случаев, сахарные заводы имеют собственные посевные площади, расположенные непосредственно вблизи предприятия. Отходы сахарной промышленности (жом, барда, дефекационная грязь) могут быть использованы как удобрения, в некоторых случаях — и как корм для скота.
Приложение 3:
Углеводы – важнейший источник энергии в организме.
Из всех потребляемых человеком пищевых веществ углеводы, несомненно, являются главным источником энергии. В среднем на их долю приходится от 50 до 70% калорийности дневных рационов. Несмотря на то, что человек потребляет значительно больше углеводов, чем жиров и белков, их резервы в организме невелики. Это означает, что снабжение ими организма должно быть регулярным.
Основными углеводами пищи являются сложные сахара, так называемые полисахариды: крахмал и гликоген, построенные из большого числа остатков глюкозы. Сама глюкоза содержится в больших количествах в винограде и сладких фруктах. В меде и фруктах, помимо глюкозы, содержатся значительные количества фруктозы. Обычный сахар, который мы покупаем в магазинах, относится к дисахаридам, так как его молекула построена из остатков глюкозы и фруктозы. В молоке и молочных продуктах содержатся большие количества менее сладкого, молочного сахара – лактозы, в состав которого наряду с глюкозой входит и моносахарид галактоза.
Потребности в углеводах в очень большой степени зависят от энергетических трат организма. В среднем у взрослого мужчины, занятого преимущественно умственным или легким физическим трудом, суточная потребность в углеводах колеблется от 300 до 500 г. У работников физического труда и спортсменов она значительно выше. В отличие от белков и в известной степени жиров, количество углеводов в рационах питания без вреда для здоровья может быть существенно снижено. Тем, кто хочет похудеть, стоит обратить на это внимание: углеводы имеют главным образом энергетическую ценность. При окислении 1 г углеводов в организме освобождается 4,0 – 4,2 ккал. Поэтому за их счет легче всего регулировать калорийность питания.
Какие же продукты следует считать главными источниками углеводов? Наиболее богаты углеводами многие растительные продукты: хлеб, крупы, макароны, картофель. Чистым углеводом является сахар. Мед, в зависимости от происхождения, содержит 70-80% моно- и дисахаридов. Его высокая сладость объясняется значительным содержанием фруктозы, сладкие свойства которой примерно в 2,5 раза выше глюкозы и в 1,5 выше сахарозы. Конфеты, пирожные, торты, варенье, мороженое и другие сладости являются наиболее привлекательными источниками углеводов и представляют несомненную опасность для полнеющих людей. Отличительной особенностью этих продуктов является высокая калорийность и низкое содержание незаменимых факторов питания.
К группе углеводов тесно примыкают встречающиеся в большинстве растительных продуктов, плохо усвояемые организмом человека вещества – клетчатка и пектины.
Важнейшие источники углеводов:
| Продукты | Содержание углеводов, г в 100 г продукта |
| Хлеб ржаной | 42-45 |
| Хлеб пшеничный | 43-50 |
| Крупа гречневая | 64 |
| Крупа манная | 70 |
| Рис | 72 |
| Сахар | 95-99 |
| Картофель | 20 |
| Капуста белокочанная | 5 |
| Арбуз | 9 |
| Морковь | 7-8 |
| Свекла | 10 |
| Виноград | 17 |
| Яблоки | 11 |
Приложение 4:
Клетчатка – это полисахарид, входящий в состав массивных оболочек растительных клеток. Большие ее количества обнаружены во многих овощах, фруктах, листьях и стеблях растений. Только незначительная часть клетчатки может подвергнуться пищеварению в организме человека под влиянием находящихся в кишечнике микроорганизмов. Поэтому клетчатка и пектины большей частью проходят желудочно-кишечный тракт без изменений. Но они играют важную роль –пищевые массы быстрее продвигаются вдоль кишечника. Из-за этого тем, кто хочет похудеть, советуют есть много овощей и фруктов. Большие количества балластных веществ содержатся в хлебе из муки грубого помола, как уже сказано, в различных овощах, фруктах, особенно в свекле, моркови и черносливе.
Список литературы
Органическая химия: Учебное издание для 10 кл. сред. шк. - Москва, Просвещение, 1993 г.
Электронная энциклопедия Кирилла и Мефодия, 2004г.
Справочник школьника, II том, Амфора, 2002 г.
Интернет сайты: поисковые системы www.nigma.ru, www.rambler.ru.
Биология. Введение в общую биологию и экологию. 9 класс. (2003г.). "Дрофа" А.А.
Для подготовки данной работы были использованы материалы с сайта http://referat.ru/
Дата добавления: 21.01.2009
www.km.ru