|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Разработка урока по теме: "Метан, его строение и валентные состояния атома углерода". Реферат строение атома углерода
строение, особенности и свойства :: SYL.ru
В этой статье мы рассмотрим элемент, входящий в состав периодической таблицы Д.И. Менделеева, а именно углерод. В современной номенклатуре он обозначается символом С, входит в четырнадцатую группу и является «участником» второго периода, имеет шестой порядковый номер, а его а.е.м. = 12.0107.
Атомные орбитали и их гибридизация

Начнем рассмотрение углерода с его орбиталей и их гибридизации - его главных особенностей, благодаря которым он и по сей день заставляет удивляться ученых всего мира. Каково же их строение?
Гибридизации атома углерода устроена таким образом, что валентные электроны занимают позиции на трех орбиталях, а именно: один находится на орбитали 2s, а два - на 2p-орбиталях. Последние две из трех орбиталей образуют угол, равный 90 градусам по отношению друг к другу, а 2s-орбиталь обладает сферической симметрией. Однако данная форма устройства рассматриваемых орбиталей не позволяет нам понять, почему же углерод, входя в органические соединения, образует углы в 120, 180 и 109.5 градусов. Формула электронного строения атома углерода выражает себя в следующем виде: (He) 2s22p2.
Разрешение возникшего противоречия было сделано при помощи введения в оборот понятия гибридизации атомных орбиталей. Чтобы понять трехгранную, вариантную природу С, потребовалось создать три формы представления о его гибридизации. Главный вклад в появление и развитие данной концепции был сделан Лайнусом Полингом.
Свойства физического характера
Строение атома углерода обуславливает наличие ряда некоторых особенностей физического характера. Атомы этого элемента образуют простое вещество – углерод, который имеет модификации. Вариации изменений его строения могут придавать образовавшемуся веществу различные качественные характеристики. Причина наличия большого количества модификаций углерода заключается в его способности устанавливать и образовывать разнотипные связи химической природы.
Строение атома углерода может варьироваться, что позволяет ему иметь определенное количество изотопных форм. Углерод, находимый в природе, образуется при помощи двух изотопов в стабильном состоянии – 12C и 13C - и изотопа с радиоактивными свойствами – 14С. Последний изотоп сосредотачивается в верхних слоях коры Земли и в атмосфере. Вследствие влияния космического излучения, а именно его нейтронов, на ядро атомов азота, образуется радиоактивный изотоп 14С. После середины пятидесятых годов двадцатого века он стал попадать в окружающую среду в качестве техногенного продукта, образованного при работе АЭС, и вследствие использования водородной бомбы. Именно на процессе распада 14С основывается методика радиоуглеродного датирования, нашедшая свое широкое применение в археологии и геологии.
Модификация углерода в аллотропной форме
В природе существует множество веществ, в состав которых входит углерод. Человек использует строение атома углерода в собственных целях при создании различных веществ, среди которых:
- Кристаллические углероды (алмазы, углеродные нанотрубки, волокна и проволоки, фуллерены и т.д.).
- Аморфные углероды (активированный и древесный уголь, различные виды кокса, техуглерод, сажа, нанопена и антрацит).
- Кластерные формы углерода (диуглероды, наноконусы и астраленовые соединения).
Структурные особенности атомного строения
Электронное строение атома углерода может обладать различной геометрией, которая зависит от уровня гибридизации орбиталей, которыми он обладает. Существует 3 главных вида геометрии:
- Тетраэдрическая – создается вследствие смещения четырех электронов, один из которых s-, а три принадлежат к p-электронам. Атом С занимается центральное положение в тетраэдре, связывается четырьмя равносильным сигма-связями с другими атомами, занимающими вершину данного тетраэдра. При таком геометрическом расположении углерода могут образоваться его аллотропные формы, например алмаз и лонсдейлит.
- Тригональная – обязана своим появлением смещению трех орбиталей, из которых одна s- и две p-. Здесь имеются три сигма-связи, которые находятся между собой в равносильной положении; они залегают в общей плоскости и придерживаются угла в 120 градусов по отношению друг к другу. Свободная р-орбиталь располагается перпендикулярно по отношению к плоскости сигма-связей. Подобной геометрией строения обладает графит.
- Диагональная – появляется благодаря смешиванию s- и p-электронов (гибридизация sp). Электронные облака вытягиваются вдоль общего направления и принимают форму несимметричной гантели. Свободные электроны создают π-связи. Данное строение геометрии в углероде дает начало появлению карбина, особой формы модификации.
Атомы углерода в природе
Строение и свойства атома углерода издавна рассматриваются человеком и используются с целью получения большого количества разнообразных веществ. Атомы этого элемента, благодаря своей уникальной способности образовывать разные химические связи и наличию гибридизации орбиталей, создают множество различных аллотропных модификаций при участии всего лишь одного элемента, из атомов одного типа, – углерода.

В природе углерод содержится в земной коре; принимает формы алмазов, графитов, различных горючих природных богатств, например, нефти, антрацита, бурого угля, сланцев, торфа и т.д. Входит в состав газов, используемых человеком в энергетической промышленности. Углерод в составе его диоксида заполняет гидросферу и атмосферу Земли, причем в воздухе доходит до 0.046%, а в воде - до шестидесяти раз больше.
В организме человека С содержится в количестве, приблизительно равном 21%, а выводиться преимущественно с мочой и выдыхаемым воздухом. Этот же элемент участвует в биологическом цикле, он поглощается растениями и расходуется в ходе процессов фотосинтеза.
Атомы углерода благодаря своей способности устанавливать разнообразные ковалентные связи и строить из них цепи, и даже циклы, могут создавать огромнейшее количество веществ органической природы. Помимо этого, данный элемент входит в состав солнечной атмосферы, пребывая в соединениях с водородом и азотом.
Свойства химической природы

Теперь рассмотрим строение и свойства атома углерода с химической точки зрения.
Важно знать, что углерод проявляет инертные свойства в условиях обычной температуры, но может показывать нам свойства восстановительного характера под влиянием высоких температур. Основные степени окисления: + - 4, иногда +2, а также +3.
Участвует в реакции с большим количеством элементов. Может вступать в реакции с водой, водородом, галогенами, щелочными металлами, кислотами, фтором, серой и т.д.
Строение атома углерода порождает невероятно огромное количество веществ, отделенных в отдельный класс. Такие соединения называются органическими и основываются на С. Это является возможным благодаря свойству атомов данного элемента образовывать полимерные цепи. Среди самых известных и обширных групп находятся протеины (белки), жиры, углеводы и углеводородные соединения.
Способы эксплуатации
Благодаря уникальному строения атома углерода и сопутствующим этому свойствам, элемент широко применяется человеком, например, при создании карандашей, выплавке металлических тиглей - здесь используют графит. Алмазы используются в качестве абразивных материалов, украшений, насадок для бормашин и т.д.
Фармакология и медицина также занимаются использованием углерода в разнообразных соединениях. Этот элемент входит в состав стали, служит основой для каждого органического вещества, участвует в процессе фотосинтеза и т.д.
Токсичность элемента

Строение атома элемента углерода заключает в себе наличие опасного воздействия на живую материю. Углерод попадает в мир вокруг нас в результате угольного сгорания на ТЭС, входит в состав газов, вырабатываемых автомобилями, в случае получения угольного концентрата и т.д.
Высок процент содержания углерода в аэрозолях, что влечет за собой увеличение процента заболеваемости людей. Чаще всего страдают верхние дыхательные пути и легкие. Некоторые заболевания можно относить к профессиональным, например, пылевой бронхит и болезни группы пневмокониоза.
14С – токсичен, а силу его влияния определяет радиационное взаимодействие с β-частицами. Этот атом входит в составы биологических молекул, в том числе содержится в дезокси- и рибонуклеиновых кислотах. Допустимым количеством 14С в воздухе рабочей зоны считается отметка в 1.3Бк/л. Максимальное количество поступающего в организм углерода во время дыхания равно соответствует 3.2*108 Бк/год.
www.syl.ru
Строение атома углерода — реферат
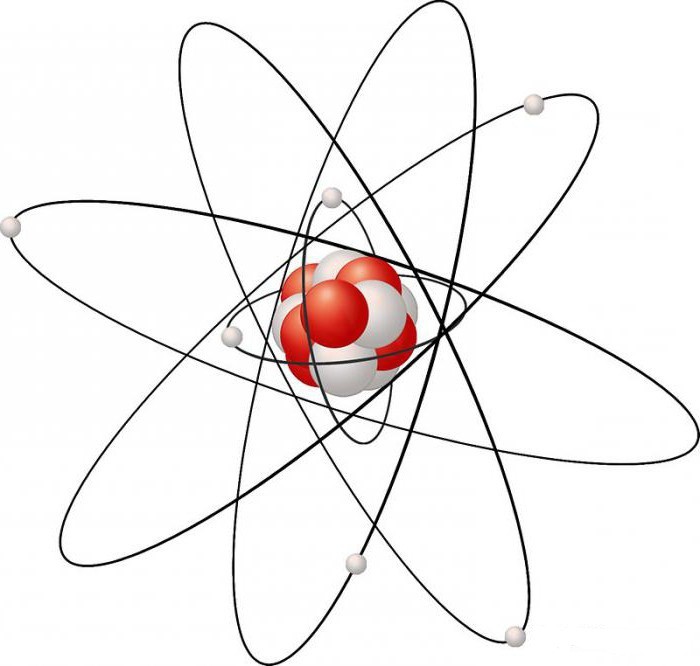
Строение атома углерода. Ядро наиболее стабильного изотопа углерода массой 12 (распространенность 98,9%) имеет 6 протонов и 6 нейтронов (12 нуклонов), расположенных тремя квартетами, каждый содержит 2 протона и два нейтрона аналогично ядру гелия. Другой стабильный изотоп углерода - 13C (ок. 1,1%), а в следовых количествах существует в природе нестабильный изотоп 14C с периодом полураспада 5730 лет, обладающий b-излучением. В нормальном углеродном цикле живой материи участвуют все три изотопа в виде СO2. После смерти живого организма расход углерода прекращается и можно датировать С-содержащие объекты, измеряя уровень радиоактивности 14С. Снижение b-излучения 14CO2 пропорционально времени, прошедшему с момента смерти. В 1960 У.Либби за исследования с радиоактивным углеродом был удостоен Нобелевской премии. В основном состоянии 6 электронов углерода образуют электронную конфигурацию 1s22s22px12py12pz0. Четыре электрона второго уровня являются валентными, что соответствует положению углерода в IVA группе периодической системы Поскольку для отрыва электрона от атома в газовой фазе требуется большая энергия (ок. 1070 кДж/моль), углерод не образует ионные связи с другими элементами, так как для этого необходим был бы отрыв электрона с образованием положительного иона. Имея электроотрицательность, равную 2,5, углерод не проявляет и сильного сродства к электрону, соответственно не являясь активным акцептором электронов. Поэтому он не склонен к образованию частицы с отрицательным зарядом. Но с частично ионным характером связи некоторые соединения углерода существуют, например, карбиды. В соединениях углерод проявляет степень окисления 4. Чтобы четыре электрона смогли участвовать в образовании связей, необходимо распаривание 2s-электронов и перескок одного из этих электронов на 2pz-орбиталь; при этом образуются 4 тетраэдрические связи с углом между ними 109°. В соединениях валентные электроны углерода лишь частично оттянуты от него, поэтому углерод образует прочные ковалентные связи между соседними атомами типа С-С с помощью общей электронной пары. Энергия разрыва такой связи равна 335 кДж/моль, тогда как для связи Si-Si она составляет всего 210 кДж/моль, поэтому длинные цепочки -Si-Si- неустойчивы. Ковалентный характер связи сохраняется даже в соединениях высокореакционноспособных галогенов с углеродом, CF4 и CCl4. Углеродные атомы способны предоставлять на образование связи более одного электрона от каждого атома углерода; так образуются двойная С=С и тройная СєС связи. Другие элементы также образуют связи между своими атомами, но только углерод способен образовывать длинные цепи. Поэтому для углерода известны тысячи соединений, называемых углеводородами, в которых углерод связан с водородом и другими углеродными атомами, образуя длинные цепи или кольцевые структуры.. большого атома урана.
При низких температурах все формы углерода достаточно инертны, но при нагревании окисляются кислородом воздуха, образуя оксиды:
Мелкодисперсный углерод в избытке кислорода способен взрываться при нагревании или от искры. Кроме прямого окисления существуют более современные методы получения оксидов. Субоксид углерода C3O2 образуется при дегидратации малоновой кислоты над P4O10:
C3O2 имеет неприятный запах, легко гидролизуется, вновь образуя малоновую кислоту. Монооксид углерода(II) СО образуется при окислении любой модификации углерода в условиях недостатка кислорода. Реакция экзотермична, выделяется 111,6 кДж/моль. Кокс при температуре белого каления реагирует с водой: C + h3O = CO + h3; образующаяся газовая смесь называется "водяной газ" и является газообразным топливом. СO образуется также при неполном сгорании нефтепродуктов, в заметных количествах содержится в автомобильных выхлопах, получается при термической диссоциации муравьиной кислоты:
Степень окисления углерода в СО равна +2, а поскольку углерод более устойчив в степени окисления +4, то СО легко окисляется кислородом до CO2: CO + O2 (r) CO2, эта реакция сильно экзотермична (283 кДж/моль). СО применяют в промышленности в смеси с h3 и другими горючими газами в качестве топлива или газообразного восстановителя. При нагревании до 500° C CO в заметной степени образует С и CO2, но при 1000° C равновесие устанавливается при малых концентрациях СO2. CO реагирует с хлором, образуя фосген - COCl2, аналогично протекают реакции с другими галогенами, в реакции с серой получается сульфид карбонила COS, с металлами (M) СO образует карбонилы различного состава M(CO)x, являющиеся комплексными соединениями. Карбонил железа образуется при взаимодействии гемоглобина крови с CO, препятствуя реакции гемоглобина с кислородом, так как карбонил железа - более прочное соединение. В результате блокируется функция гемоглобина как переносчика кислорода к клеткам, которые при этом погибают (и в первую очередь поражаются клетки мозга). (Отсюда еще одно название СО - "угарный газ"). Уже 1% (об.) СO в воздухе опасен для человека, если он находится в такой атмосфере более 10 мин. Некоторые физические свойства СО приведены в таблице. Диоксид углерода, или оксид углерода(IV) CO2 образуется при сгорании элементного углерода в избытке кислорода c выделением тепла (395 кДж/моль). CO2 (тривиальное название - "углекислый газ") образуется также при полном окислении СО, нефтепродуктов, бензина, масел и др. органических соединений. При растворении карбонатов в воде в результате гидролиза также выделяется СО2:
Такой реакцией часто пользуются в лабораторной практике для получения CO2. Этот газ можно получить и при прокаливании бикарбонатов металлов:
при газофазном взаимодействии перегретого пара с СО:
при сжигании углеводородов и их кислородпроизводных, например:
Аналогично окисляются пищевые продукты в живом организме с выделением тепловой и других видов энергии. При этом окисление протекает в мягких условиях через промежуточные стадии, но конечные продукты те же - СO2 и h3O, как, например, при разложении сахаров под действием ферментов, в частности при ферментации глюкозы:
Многотоннажное производство углекислого газа и оксидов металлов осуществляется в промышленности термическим разложением карбонатов:
referat911.ru
Реферат - Разработка урока по теме: Метан, его строение и валентные состояния атома углерода
Разработка урока по теме: «Метан, его строение и валентные состояния атома углерода».
( урок для учащихся 11 классов по органической химии, изучаемый в разделе « Предельные углеводороды на который отводится 6 уроков).
Цели урока: сформировать представление о составе и строении метана, его нахождении в природе и физических свойствах; изучить валентные состояния атома углерода.
Задачи урока: 1) изучить строение метана (молекулярная, электронная и структурная формулы), физические свойства, нахождение в природе, тип химической связи в молекуле, пространственное строение молекулы; строение атома углерода в трёх валентных состояниях, понятие гибридизации; 2) развить и обобщить знания о химической связи в органических соединениях; 3) продолжить формирование диалектико-материалистического мировоззрения на примере молекулы метана, этилена, ацетилена.
Оборудование: Периодическая таблица Д. И. Менделеева, масштабная модель и шаростержневая модель метана, таблица « Электронное и пространственное строение молекулы метана», фрагмент фильма о строении органических соединений, компьютер, мультимедиа проектор, интерактивная доска, на столах учащихся набор для создания шаростержневых молекул.
Тип урока: комбинированный.
Методы: словесный (лекция), наглядный, проблемное изложение, работа с книгой.
Ход урока
I. 1. Организационный момент.
2. Фронтальная проверка знаний по теме « Строение атома углерода» 1) Записать электронную формулу атома углерода в основном и возбуждённом состояния 2) Что называют химической связью? 3) Какая связь называется σ- связью? 4) Какая связь называется π – связью? 5) Выполнить у доски письменно вопрос № 11, 16 стр.20. ( Учащиеся проверяют в тетрадях домашнее задание, два ученика работают у доски).
II . Изучение нового материала
1. Работа с книгой. (Учащиеся находят ответы на вопросы и на задания).
1) Где в природе встречается метан и какими физическими свойствами обладает?
2) Запишите молекулярную, электронную и структурную формулы в тетрадь. Какую валентность проявляет углерод в органических соединениях?
Ребята на последний вопрос отвечают логично: атомы углерода в органических соединениях всегда четырёхвалентны. Для этого при образовании химических связей атом должен перейти в возбуждённое состояние, при котором один из 2s-электронов перемещается на 2р- орбиталь.
Теперь рассмотрим молекулу метана. Учащиеся отвечают на вопросы:
1. Сколько химических связей в молекуле метана?
2. Каков тип химической связи С-Н?
3. К какому типу относятся эти связи ( к σ- или π- типу)?
4. За счёт перекрывания орбиталей какого типа происходит образование связей углерод- водород?
На последний вопрос ребята ответили правильно: три связи образованы за счёт перекрывания р-орбиталей атома углерода и s-орбитали атомов водорода, четвёртая связь – результат перекрывания двух s-орбиталей. Учителем создаётся проблемная ситуация. Очевидно, что в таком случае одна из связей С-Н будет отличаться от трёх остальных: по энергии, длине, направленности. Однако с помощью современных методов исследования доказано, что все связи в метане абсолютно равноценны! Почему? Учащиеся выражают сомнения в возможности образования молекулы, мотивируя тем, что разные электроны, видимо, не образуют одинаковые химические связи. Выдвинуть предположения учащиеся затрудняются. Для объяснения этого факта выдвинута гипотеза, называемая теорией гибридизации. Учитель объясняет гибридизацию электронных облаков, выравнивая их по форме и энергии, говорит об образовании устойчивой молекулы метана. Происходит выравнивание электронных облаков ( s и 3р) и образуется 4 облака одинаковой формы, т.е. гибридных ( на интерактивной доске нарисованы электронные облака) Образование новых орбиталей симметрично расположенных и с одинаковой энергией, получило название гибридизации. Учащиеся записывают в тетради определение гибридизации: « Гибридизацией орбиталей называют процесс выравнивания их по форме и энергии».
При «смешении» 2s – орбитали и 2р- орбиталей образуются четыре одинаковые sр3 – гибридные орбитали. Каждая из них имеет грушевидную форму, сильно вытянутую в одну сторону от ядра. Такая форма очень выгодна: она способствует более полному перекрыванию с орбиталями других атомов при образовании химических связей. Чем полнее такое перекрывание, тем прочнее химическая связь.
Состояние углеродного атома с sр3 — гибридными орбиталями характерно для соединений с одинарной связью: метана и подобных ему углеводородов. Как известно, четыре одинаковые σ связи составляют между собой угол 109028/. Поэтому молекула в пространстве имеет форму тетраэдра. Демонстрирую шаростержневую модель молекулы метана. Ставлю перед учащимися два вопроса: 1) почему именно под углом 109029/ образуется химическая связь в молекуле? 2) почему при образовании связей облака электронов утрачивают форму симметричных восьмёрок, оказываются вытянутыми в одном направлении? ( Демонстрация видеофрагмента).
Только при угле 1090 28/ заряжённые электронные облака могут находиться на максимальном удалении друг от друга, и это способствует большей устойчивости системы. Вытянутая форма облаков атома углерода обеспечивает наибольшее перекрывание их с электронными облаками атома водорода, что способствует образованию более прочных связей. Между водородными атомами в этом случае будут действовать меньшие силы отталкивания, что также приводит к большей устойчивости. Это первое валентное состояние атома углерода. Учащиеся заполняют таблицу в тетрадях:
Валентное состояние атома углерода | Формула вещества | Тип гибридизации | Длина связи | Угол связи |
Второе валентное состояние атома углерода. Существуют органические вещества, в которых атом углерода связан не с четырьма, а с тремя соседними атомами, оставаясь при этом четырёхвалентным. Как такое может быть? Только в том случае, если с одним из соседей углерод связан двойной связью. Валентное состояние атомов углерода в этилене уже другое. Гибридизации подвергаются не четыре, а только три орбитали атома углерода: s и 2р – орбитали. Это sр2 — гибридизация. Четвёртое гантелеобразное р- облако остаётся негибридизованным. ( Демонстрация видеофрагмента). Учащиеся записывают в таблицу данные о длине связи ( 0,134 нм), угле связи (120о ), пространственной формы молекулы этилена. Учитель объясняет, механизм образования σ- и π- связей в этилене, обращает внимание на различия в природе связей между атомами углерода ( боковое перекрывание, прочность, доступность для реагентов), проводит сравнение с одинарной С-С связью в этане ( длина связи 0,154 нм).
Третье валентное состояние атома углерода.
Учитель, говорит, что существуют органические вещества, в которых атом углерода связан только с двумя соседними атомами. Это ацетилен. В этом соединении атомы углерода прибывают в третьем валентном состоянии sр- гибридизации.
Совместно учащиеся отвечают на вопросы:
1.Сколько орбиталей подвержены гибридизации в третьем валентном состоянии?
2.Как расположены в пространстве оси sр-гибридных орбиталей, исходя из принципа их взаимного отталкивания?
3. Сколько и каких орбиталей остаётся негибридными?
4. Как расположены в пространстве оси двух негибридизованных р- орбиталей по отношению друг к другу и осям sр-орбиталей. Анализ рисунка 20. стр. 69. ( Демонстрация видеофрагмента). Учащиеся заполняют таблицу для третьего валентного состояния атома углерода: длина связи 0, 120 нм, угол связи – 1800.
III . Закрепление материала
1. а) Собрать шаростержневые молекулы метана, этилена, ацетилена.
б) Показать валентные углы.
в) Показать направление ковалентных связей.
2. Какой тип гибридизации не существует и почему: sр3, sp2, sp4, sp?
3. Определите тип гибридизации каждого атома углерода в молекулах веществ, структурные формулы, которых записаны ниже.
1) СН3 — СН2 – СН3; 2) СН2 = СН – СН2 – СН3; 3) СН С – СН2 – СН3 ;
С – СН2 – СН3 ;
IV . Задание на дом:
§5, № 1, и № 3 стр. 25.
www.ronl.ru
Сочинение - Разработка урока по теме: Метан, его строение и валентные состояния атома углерода
Разработка урока по теме: «Метан, его строение и валентные состояния атома углерода».
( урок для учащихся 11 классов по органической химии, изучаемый в разделе « Предельные углеводороды на который отводится 6 уроков).
Цели урока: сформировать представление о составе и строении метана, его нахождении в природе и физических свойствах; изучить валентные состояния атома углерода.
Задачи урока: 1) изучить строение метана (молекулярная, электронная и структурная формулы), физические свойства, нахождение в природе, тип химической связи в молекуле, пространственное строение молекулы; строение атома углерода в трёх валентных состояниях, понятие гибридизации; 2) развить и обобщить знания о химической связи в органических соединениях; 3) продолжить формирование диалектико-материалистического мировоззрения на примере молекулы метана, этилена, ацетилена.
Оборудование: Периодическая таблица Д. И. Менделеева, масштабная модель и шаростержневая модель метана, таблица « Электронное и пространственное строение молекулы метана», фрагмент фильма о строении органических соединений, компьютер, мультимедиа проектор, интерактивная доска, на столах учащихся набор для создания шаростержневых молекул.
Тип урока: комбинированный.
Методы: словесный (лекция), наглядный, проблемное изложение, работа с книгой.
Ход урока
I. 1. Организационный момент.
2. Фронтальная проверка знаний по теме « Строение атома углерода» 1) Записать электронную формулу атома углерода в основном и возбуждённом состояния 2) Что называют химической связью? 3) Какая связь называется σ- связью? 4) Какая связь называется π – связью? 5) Выполнить у доски письменно вопрос № 11, 16 стр.20. ( Учащиеся проверяют в тетрадях домашнее задание, два ученика работают у доски).
II . Изучение нового материала
1. Работа с книгой. (Учащиеся находят ответы на вопросы и на задания).
1) Где в природе встречается метан и какими физическими свойствами обладает?
2) Запишите молекулярную, электронную и структурную формулы в тетрадь. Какую валентность проявляет углерод в органических соединениях?
Ребята на последний вопрос отвечают логично: атомы углерода в органических соединениях всегда четырёхвалентны. Для этого при образовании химических связей атом должен перейти в возбуждённое состояние, при котором один из 2s-электронов перемещается на 2р- орбиталь.
Теперь рассмотрим молекулу метана. Учащиеся отвечают на вопросы:
1. Сколько химических связей в молекуле метана?
2. Каков тип химической связи С-Н?
3. К какому типу относятся эти связи ( к σ- или π- типу)?
4. За счёт перекрывания орбиталей какого типа происходит образование связей углерод- водород?
На последний вопрос ребята ответили правильно: три связи образованы за счёт перекрывания р-орбиталей атома углерода и s-орбитали атомов водорода, четвёртая связь – результат перекрывания двух s-орбиталей. Учителем создаётся проблемная ситуация. Очевидно, что в таком случае одна из связей С-Н будет отличаться от трёх остальных: по энергии, длине, направленности. Однако с помощью современных методов исследования доказано, что все связи в метане абсолютно равноценны! Почему? Учащиеся выражают сомнения в возможности образования молекулы, мотивируя тем, что разные электроны, видимо, не образуют одинаковые химические связи. Выдвинуть предположения учащиеся затрудняются. Для объяснения этого факта выдвинута гипотеза, называемая теорией гибридизации. Учитель объясняет гибридизацию электронных облаков, выравнивая их по форме и энергии, говорит об образовании устойчивой молекулы метана. Происходит выравнивание электронных облаков ( s и 3р) и образуется 4 облака одинаковой формы, т.е. гибридных ( на интерактивной доске нарисованы электронные облака) Образование новых орбиталей симметрично расположенных и с одинаковой энергией, получило название гибридизации. Учащиеся записывают в тетради определение гибридизации: « Гибридизацией орбиталей называют процесс выравнивания их по форме и энергии».
При «смешении» 2s – орбитали и 2р- орбиталей образуются четыре одинаковые sр3 – гибридные орбитали. Каждая из них имеет грушевидную форму, сильно вытянутую в одну сторону от ядра. Такая форма очень выгодна: она способствует более полному перекрыванию с орбиталями других атомов при образовании химических связей. Чем полнее такое перекрывание, тем прочнее химическая связь.
Состояние углеродного атома с sр3 — гибридными орбиталями характерно для соединений с одинарной связью: метана и подобных ему углеводородов. Как известно, четыре одинаковые σ связи составляют между собой угол 109028/. Поэтому молекула в пространстве имеет форму тетраэдра. Демонстрирую шаростержневую модель молекулы метана. Ставлю перед учащимися два вопроса: 1) почему именно под углом 109029/ образуется химическая связь в молекуле? 2) почему при образовании связей облака электронов утрачивают форму симметричных восьмёрок, оказываются вытянутыми в одном направлении? ( Демонстрация видеофрагмента).
Только при угле 1090 28/ заряжённые электронные облака могут находиться на максимальном удалении друг от друга, и это способствует большей устойчивости системы. Вытянутая форма облаков атома углерода обеспечивает наибольшее перекрывание их с электронными облаками атома водорода, что способствует образованию более прочных связей. Между водородными атомами в этом случае будут действовать меньшие силы отталкивания, что также приводит к большей устойчивости. Это первое валентное состояние атома углерода. Учащиеся заполняют таблицу в тетрадях:
Валентное состояние атома углерода | Формула вещества | Тип гибридизации | Длина связи | Угол связи |
Второе валентное состояние атома углерода. Существуют органические вещества, в которых атом углерода связан не с четырьма, а с тремя соседними атомами, оставаясь при этом четырёхвалентным. Как такое может быть? Только в том случае, если с одним из соседей углерод связан двойной связью. Валентное состояние атомов углерода в этилене уже другое. Гибридизации подвергаются не четыре, а только три орбитали атома углерода: s и 2р – орбитали. Это sр2 — гибридизация. Четвёртое гантелеобразное р- облако остаётся негибридизованным. ( Демонстрация видеофрагмента). Учащиеся записывают в таблицу данные о длине связи ( 0,134 нм), угле связи (120о ), пространственной формы молекулы этилена. Учитель объясняет, механизм образования σ- и π- связей в этилене, обращает внимание на различия в природе связей между атомами углерода ( боковое перекрывание, прочность, доступность для реагентов), проводит сравнение с одинарной С-С связью в этане ( длина связи 0,154 нм).
Третье валентное состояние атома углерода.
Учитель, говорит, что существуют органические вещества, в которых атом углерода связан только с двумя соседними атомами. Это ацетилен. В этом соединении атомы углерода прибывают в третьем валентном состоянии sр- гибридизации.
Совместно учащиеся отвечают на вопросы:
1.Сколько орбиталей подвержены гибридизации в третьем валентном состоянии?
2.Как расположены в пространстве оси sр-гибридных орбиталей, исходя из принципа их взаимного отталкивания?
3. Сколько и каких орбиталей остаётся негибридными?
4. Как расположены в пространстве оси двух негибридизованных р- орбиталей по отношению друг к другу и осям sр-орбиталей. Анализ рисунка 20. стр. 69. ( Демонстрация видеофрагмента). Учащиеся заполняют таблицу для третьего валентного состояния атома углерода: длина связи 0, 120 нм, угол связи – 1800.
III . Закрепление материала
1. а) Собрать шаростержневые молекулы метана, этилена, ацетилена.
б) Показать валентные углы.
в) Показать направление ковалентных связей.
2. Какой тип гибридизации не существует и почему: sр3, sp2, sp4, sp?
3. Определите тип гибридизации каждого атома углерода в молекулах веществ, структурные формулы, которых записаны ниже.
1) СН3 — СН2 – СН3; 2) СН2 = СН – СН2 – СН3; 3) СН С – СН2 – СН3 ;
С – СН2 – СН3 ;
IV . Задание на дом:
§5, № 1, и № 3 стр. 25.
www.ronl.ru
Разработка урока по теме: "Метан, его строение и валентные состояния атома углерода"
Разработка урока по теме: «Метан, его строение и валентные состояния атома углерода».
( урок для учащихся 11 классов по органической химии, изучаемый в разделе « Предельные углеводороды на который отводится 6 уроков).
Цели урока: сформировать представление о составе и строении метана, его нахождении в природе и физических свойствах; изучить валентные состояния атома углерода.
Задачи урока: 1) изучить строение метана (молекулярная, электронная и структурная формулы), физические свойства, нахождение в природе, тип химической связи в молекуле, пространственное строение молекулы; строение атома углерода в трёх валентных состояниях, понятие гибридизации; 2) развить и обобщить знания о химической связи в органических соединениях; 3) продолжить формирование диалектико-материалистического мировоззрения на примере молекулы метана, этилена, ацетилена.
Оборудование: Периодическая таблица Д. И. Менделеева, масштабная модель и шаростержневая модель метана, таблица « Электронное и пространственное строение молекулы метана», фрагмент фильма о строении органических соединений, компьютер, мультимедиа проектор, интерактивная доска, на столах учащихся набор для создания шаростержневых молекул.
Тип урока: комбинированный.
Методы: словесный (лекция), наглядный, проблемное изложение, работа с книгой.
Ход урока
I. 1. Организационный момент.
2. Фронтальная проверка знаний по теме « Строение атома углерода» 1) Записать электронную формулу атома углерода в основном и возбуждённом состояния 2) Что называют химической связью? 3) Какая связь называется у- связью? 4) Какая связь называется р - связью? 5) Выполнить у доски письменно вопрос № 11, 16 стр.20. ( Учащиеся проверяют в тетрадях домашнее задание, два ученика работают у доски).
II. Изучение нового материала
1. Работа с книгой. (Учащиеся находят ответы на вопросы и на задания).
1) Где в природе встречается метан и какими физическими свойствами обладает?
2) Запишите молекулярную, электронную и структурную формулы в тетрадь. Какую валентность проявляет углерод в органических соединениях?
Ребята на последний вопрос отвечают логично: атомы углерода в органических соединениях всегда четырёхвалентны. Для этого при образовании химических связей атом должен перейти в возбуждённое состояние, при котором один из 2s-электронов перемещается на 2р- орбиталь.
Теперь рассмотрим молекулу метана. Учащиеся отвечают на вопросы:
1. Сколько химических связей в молекуле метана?
2. Каков тип химической связи С-Н?
3. К какому типу относятся эти связи ( к у- или р- типу)?
4. За счёт перекрывания орбиталей какого типа происходит образование связей углерод- водород?
На последний вопрос ребята ответили правильно: три связи образованы за счёт перекрывания р-орбиталей атома углерода и s-орбитали атомов водорода, четвёртая связь - результат перекрывания двух s-орбиталей. Учителем создаётся проблемная ситуация. Очевидно, что в таком случае одна из связей С-Н будет отличаться от трёх остальных: по энергии, длине, направленности. При этом с помощью современных методов исследования доказано, что все связи в метане абсолютно равноценны! Почему? Учащиеся выражают сомнения в возможности образования молекулы, мотивируя тем, что разные электроны, видимо, не образуют одинаковые химические связи. Выдвинуть предположения учащиеся затрудняются. Для объяснения этого факта выдвинута гипотеза, называемая теорией гибридизации. Учитель объясняет гибридизацию электронных облаков, выравнивая их по форме и энергии, говорит об образовании устойчивой молекулы метана. Происходит выравнивание электронных облаков ( s и 3р) и образуется 4 облака одинаковой формы, т.е. гибридных ( на интерактивной доске нарисованы электронные облака) Образование новых орбиталей симметрично расположенных и с одинаковой энергией, получило название гибридизации. Учащиеся записывают в тетради определение гибридизации: « Гибридизацией орбиталей называют процесс выравнивания их по форме и энергии».
При «смешении» 2s - орбитали и 2р- орбиталей образуются четыре одинаковые sр3 - гибридные орбитали. Каждая из них имеет грушевидную форму, сильно вытянутую в одну сторону от ядра. Такая форма очень выгодна: она способствует более полному перекрыванию с орбиталями других атомов при образовании химических связей. Чем полнее такое перекрывание, тем прочнее химическая связь.
Состояние углеродного атома с sр3- гибридными орбиталями характерно для соединений с одинарной связью: метана и подобных ему углеводородов. Как известно, четыре одинаковые у связи составляют между собой угол 1090 28/. Поэтому молекула в пространстве имеет форму тетраэдра. Демонстрирую шаростержневую модель молекулы метана. Ставлю перед учащимися два вопроса: 1) почему именно под углом 1090 29/ образуется химическая связь в молекуле? 2) почему при образовании связей облака электронов утрачивают форму симметричных восьмёрок, оказываются вытянутыми в одном направлении? ( Демонстрация видеофрагмента).
Только при угле 1090 28/ заряжённые электронные облака могут находиться на максимальном удалении друг от друга, и это способствует большей устойчивости системы. Вытянутая форма облаков атома углерода обеспечивает наибольшее перекрывание их с электронными облаками атома водорода, что способствует образованию более прочных связей. Между водородными атомами в этом случае будут действовать меньшие силы отталкивания, что также приводит к большей устойчивости. Это первое валентное состояние атома углерода. Учащиеся заполняют таблицу в тетрадях:
Валентное состояние атома углерода | Формула вещества | Тип гибридизации | Длина связи | Угол связи | |
Второе валентное состояние атома углерода. Существуют органические вещества, в которых атом углерода связан не с четырьма, а с тремя соседними атомами, оставаясь при всём этом четырёхвалентным. Как такое может быть? Только в том случае, если с одним из соседей углерод связан двойной связью. Валентное состояние атомов углерода в этилене уже другое. Гибридизации подвергаются не четыре, а только три орбитали атома углерода: s и 2р - орбитали. Это sр2- гибридизация. Четвёртое гантелеобразное р- облако остаётся негибридизованным. ( Демонстрация видеофрагмента). Учащиеся записывают в таблицу данные о длине связи ( 0,134 нм), угле связи (120о), пространственной формы молекулы этилена. Учитель объясняет, механизм образования у- и р- связей в этилене, обращает внимание на различия в природе связей между атомами углерода ( боковое перекрывание, прочность, доступность для реагентов), проводит сравнение с одинарной С-С связью в этане ( длина связи 0,154 нм).
Третье валентное состояние атома углерода.
Учитель, говорит, что существуют органические вещества, в которых атом углерода связан только с двумя соседними атомами. Это ацетилен. В этом соединении атомы углерода прибывают в третьем валентном состоянии sр- гибридизации.
Совместно учащиеся отвечают на вопросы:
1.Сколько орбиталей подвержены гибридизации в третьем валентном состоянии?
2.Как расположены в пространстве оси sр-гибридных орбиталей, исходя из принципа их взаимного отталкивания?
3. Сколько и каких орбиталей остаётся негибридными?
4. Как расположены в пространстве оси двух негибридизованных р- орбиталей по отношению друг к другу и осям sр-орбиталей. Анализ рисунка 20. стр. 69. ( Демонстрация видеофрагмента). Учащиеся заполняют таблицу для третьего валентного состояния атома углерода: длина связи 0, 120 нм, угол связи - 1800.
III. Закрепление материала
1. а) Собрать шаростержневые молекулы метана, этилена, ацетилена.
б) Показать валентные углы.
в) Показать направление ковалентных связей.
2. Какой тип гибридизации не существует и почему: sр3 , sp2 , sp4 , sp ?
3. Определите тип гибридизации каждого атома углерода в молекулах веществ, структурные формулы, которых записаны ниже.
1) СН3 - СН2 - СН3; 2) СН2 = СН - СН2 - СН3; 3) СНС - СН2 - СН3;
IV. Задание на дом:
§5, № 1, и № 3 стр. 25.
referatwork.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


