 Современная химия представляет собой разветвлённую область знаний:
Современная химия представляет собой разветвлённую область знаний: Основные положения и законы химии.
Вводная часть.
Наука «химия» и наука общая химия.
Основные понятия и законы химии.
Во-первых, человек сам представляет собой систему, в которой происходят различные химические превращения.
Во-вторых, человек использует эти процессы с древнейших времён. Первой такой химической реакцией, которую люди использовали ещё в каменном веке, была экзотермическая реакция окисления органических веществ при высокой температуре (горение дров). Затем на заре цивилизации – в Древнем Египте, Китае, использовали химические реакции для получения красок, металлов и т.д.
Сейчас невозможно представить себе нашу жизнь без химических процессов, будь то получение лекарств, продуктов и многое другое.
Окружающий нас мир (мы полагаем) – природа – различные формы движущейся материи. Материя может существовать в виде элементарных частиц, имеющих массу покоя и полей, лишённых массы покоя.
Взаимодействуя друг с другом, элементарные частицы образуют более сложные системы – различные атомы. Наконец, атомы, взаимодействуя друг с другом, образуют различные вещества. Каждое вещество обладает некоторым набором характерных признаков – свойствами: плотностью, электропроводностью, окраской, запахом, твёрдостью и т.д., то, что отличает одно вещество от другого.
В определённой совокупности вещества образуют материалы – бумагу, лекарство, стекло, сталь.
При изменении условий – нагревании, освещении, ударе – могут происходить превращения одних веществ в другие – самопроизвольные или в результате взаимодействия нескольких веществ.
II. Химия – это область естествознания, наука о веществах и их превращениях.
 Современная химия представляет собой разветвлённую область знаний:
Современная химия представляет собой разветвлённую область знаний:
геометрическое строение кристаллов (кристаллохимия)
электронное строение (квантовая химия)
в живых организмах (биохимия)
зависимость свойств веществ от их состава и строения
(физическая химия)
о превращениях в космосе (космохимия)
На базе современных химических знаний создаются новые технологии, позволяющие получать из природного сырья принципиально новые вещества и материалы: различные сплавы, сверхпроводящие материалы, полимеры, красители.
Каждый из вас использует химические реакции в своей жизни – печёт ли блины, запускает ли двигатель автомобиля, использует ли минеральные удобрения.
Достижения химии огромны, но есть и другая сторона медали.
Новые вещества не всегда безобидны для природы (инсектициды, ядохимикаты, дым из труб электростанций загрязняют почву, атмосферу). Полимеры медленно разлагаются в природных условиях. Увеличение  в атмосфере ведёт к нарушению круговорота
в атмосфере ведёт к нарушению круговорота  и вызывает изменение климата на планете.
и вызывает изменение климата на планете.
Таким образом, неграмотное использование химических достижений ведёт к возникновению экологических.
Поэтому каждому образованному специалисту (инженеру) необходим достаточный минимум химических знаний.
Наука беспредельна, всегда есть вопросы, не имеющие ответов, новые факты, что раньше было неизвестно, сейчас констатируется как известный факт. Возникают новые проблемы, умирают старые гипотезы и возникают новые.
Общая химия знакомит читателя с современным ядром – фундаментом химической науки, так как любой раздел общей химии – это предельно сжатое, сделанное в общих чертах целого направления в химии.
Атомно-молекулярное учение.
Начало этому учению положили взгляды древнегреческих философов, которые пытались представить мир, построенный из основных «начал»: элементов воды, воздуха, огня, земли.
С другой стороны возникает понятие «атом» (неделимый) – неделимая частица.
Представления об «элементах» из которых можно получать любые вещества развивались алхимиками. Они собрали огромный фактический материал (получили множество новых соединений, разработали основные методы синтеза и анализа веществ).
Далее химики занимались изготовлением лекарств, красок.
Следующий этап в развитии химии связан с именами Ломоносова и Лавуазье, которые независимо друг от друга открыли законы сохранения.
В 1748 г. Ломоносов обосновал законы сохранения материи и энергии. Лавуазье сформулировал закон сохранения материи на 50 лет позже.
В XIX в. открыты 3 важных закона:
закон постоянства состава (Пруст, 1799 г)
закон простых кратных отношений (Дальтон, 1804 г)
закон простых объёмных отношений для реагирующих газов (Гей-Люссак, 1805 г)
В химию введены понятия атома как носителя свойств химического элемента и молекулы – сложной частицы, состоящей из нескольких атомов и являющейся наименьшей частицей вещества, обладающей его химическими свойствами.
В 1811 г. Авогадро объяснил закон простых объёмных отношений, поняв, что простые газообразные вещества состоят не из атомов, а из молекул. Закон Авогадро был последним «кирпичиком» в создании атомно-молекулярного учения до конца XIXв. Опираясь на него, Д.И. Менделеев открыл в 1869 г. периодический закон – один из основных законов природы.
Открытие в конце XIX в. электрона, радиоактивности, сложного строения атома и целого мира элементарных частиц привело к тому, что многие положения атомно-молекулярного учения пришлось пересмотреть. Стало ясно, что атом неделим только химически. И всё же это вошло в основу современного атомно-молекулярного учения.
Современное представление.
Все вещества состоят из атомов. Атомы представляют собой мельчайшие частицы вещества, которые химическим путём невозможно разделить на составные части, превратить друг в друга или уничтожить. Атомы различных элементов различаются по массе. Совокупность одинаковых атомов образует простое вещество, соответствующее определённому химическому элементу.
Атомы различных элементов взаимодействуют друг с другом в целочисленных отношениях. В результате получаются сложные образования, в частности молекулы.
Молекула – наименьшая частица вещества, обладающая всеми его химическими свойствами. Одно из наиболее важных свойств молекулы – масса.
Как же определить массу этих мельчайших частиц – атомов и молекул?
Уже во времена Ломоносова и Лавуазье химики определили, что, например, в соединении  с
с  –
–  94,2%
94,2%  , а в соединении с
, а в соединении с  – только 13,8%. Отсюда можно сделать вывод, что атомы
– только 13,8%. Отсюда можно сделать вывод, что атомы  тяжелее, чем атомы
тяжелее, чем атомы  , но легче чем атомы
, но легче чем атомы  . На основании этого можно сказать какие атомы легче, какие тяжелее и далее расположить их в порядке возрастания масс. При этом выяснили, что самый лёгкий –
. На основании этого можно сказать какие атомы легче, какие тяжелее и далее расположить их в порядке возрастания масс. При этом выяснили, что самый лёгкий –  .
.
Атом 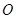 оказался в 16 раз тяжелее атома
оказался в 16 раз тяжелее атома  , атом
, атом  – в 2 раза тяжелее атома
– в 2 раза тяжелее атома  . На основании эти данных Дальтон предложил шкалу относительных атомных масс. Атом каждого элемента характеризовался безразмерным числом, показывающим во сколько раз данный атом тяжелее самого лёгкого (т.е. за единицу приняли
. На основании эти данных Дальтон предложил шкалу относительных атомных масс. Атом каждого элемента характеризовался безразмерным числом, показывающим во сколько раз данный атом тяжелее самого лёгкого (т.е. за единицу приняли  ).
).
Существовала и кислородная шкала.
В 1961 г. была принята углеродная шкала, в которой за единицу приняли 1/12 массы атома изотопа углерода  .
.
III. Относительной атомной массой называется безразмерное число, показывающее во сколько раз масса данного атома больше чем 1/12 атома изотопа углерода  .
.
Совершенно аналогично определяется и относительная масса молекул.
Основные законы.
Закон постоянства состава: Состав чистого вещества не зависит от способа получения этого вещества.
Т. е. для одной и той же молекулы, например  соотношение
соотношение  и
и 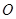 всегда постоянно.
всегда постоянно.
Сейчас мы знаем, что большинство твёрдых веществ состоят не из молекул, а из атомов или ионов и в этом случае возможны изменения состава в зависимости от условий его получения.
Закон кратных отношений: Если 2 элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа.
Например,  с
с  образуют 2 соединения – твёрдое белое вещество и бесцветную тяжёлую жидкость. Оба различаются по своему составу: 1-ое содержит 37,2%
образуют 2 соединения – твёрдое белое вещество и бесцветную тяжёлую жидкость. Оба различаются по своему составу: 1-ое содержит 37,2%  , а 2-ое 54%
, а 2-ое 54%  .
.
Например, какая масса  присоединится на единицу массы
присоединится на единицу массы  .
.


закон утверждает, что  – отношение целых чисел
– отношение целых чисел 
Для нас очевидно, что в состав молекулы  входят 2 атома
входят 2 атома  и 1 атом
и 1 атом  . Раньше этого не знали, считая, что 11,1%
. Раньше этого не знали, считая, что 11,1% 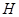 и 88,9%
и 88,9%  .
.
Закон простых объёмных отношений: Объёмы реагирующих газов относятся друг к другу и к объёмам газообразных продуктов как небольшие целые числа.
Например, один объём  реагирует с двумя объёмами
реагирует с двумя объёмами  и при этом получается точно 2 объёма водяного пара:
и при этом получается точно 2 объёма водяного пара:  .
.
Подобные наблюдения позволили предположить, что в одинаковых объёмах газов содержится одинаковое число атомов, но не объясняли соотношение объёмов продуктов реакции.
Выход нашёл Авогадро в 1811 г., предположив, что газообразные вещества состоят из молекул, а не из атомов.
В настоящее время число Авогадро принято равным  .
.
Количество частиц, равное числу Авогадро, получило название «моль».
Моль – количество вещества, содержащего столько же частиц (молекул, атомов, ионов, электронов, фотонов) сколько содержится атомов в 12 г изотопа  .
.
Масса 1-го моль называется молярной массой и выражается в [г/моль].
Из этого следует:
молекулярная масса, выраженная в г, равна относительной молекулярной массе в углеродной шкале;
при одинаковых условиях 1 моль любого газа занимает один и тот же объём, равный 22,4 л.
Вопросы для самоконтроля
Закон постоянства состава.
Закон сохранения массы.
Закон простых кратных отношений.
Относительная молекулярная и атомные массы.
Моль. Молярная масса.
www.ronl.ru
Основные положения и законы химии.
Вводная часть.
Наука «химия» и наука общая химия.
Основные понятия и законы химии.
Во-первых, человек сам представляет собой систему, в которой происходят различные химические превращения.
Во-вторых, человек использует эти процессы с древнейших времён. Первой такой химической реакцией, которую люди использовали ещё в каменном веке, была экзотермическая реакция окисления органических веществ при высокой температуре (горение дров). Затем на заре цивилизации – в Древнем Египте, Китае, использовали химические реакции для получения красок, металлов и т.д.
Сейчас невозможно представить себе нашу жизнь без химических процессов, будь то получение лекарств, продуктов и многое другое.
Окружающий нас мир (мы полагаем) – природа – различные формы движущейся материи. Материя может существовать в виде элементарных частиц, имеющих массу покоя и полей, лишённых массы покоя.
Взаимодействуя друг с другом, элементарные частицы образуют более сложные системы – различные атомы. Наконец, атомы, взаимодействуя друг с другом, образуют различные вещества. Каждое вещество обладает некоторым набором характерных признаков – свойствами: плотностью, электропроводностью, окраской, запахом, твёрдостью и т.д., то, что отличает одно вещество от другого.
В определённой совокупности вещества образуют материалы – бумагу, лекарство, стекло, сталь.
При изменении условий – нагревании, освещении, ударе – могут происходить превращения одних веществ в другие – самопроизвольные или в результате взаимодействия нескольких веществ.
II. Химия – это область естествознания, наука о веществах и их превращениях.
 Современная химия представляет собой разветвлённую область знаний:
Современная химия представляет собой разветвлённую область знаний:
геометрическое строение кристаллов (кристаллохимия)
электронное строение (квантовая химия)
в живых организмах (биохимия)
зависимость свойств веществ от их состава и строения
(физическая химия)
о превращениях в космосе (космохимия)
На базе современных химических знаний создаются новые технологии, позволяющие получать из природного сырья принципиально новые вещества и материалы: различные сплавы, сверхпроводящие материалы, полимеры, красители.
Каждый из вас использует химические реакции в своей жизни – печёт ли блины, запускает ли двигатель автомобиля, использует ли минеральные удобрения.
Достижения химии огромны, но есть и другая сторона медали.
Новые вещества не всегда безобидны для природы (инсектициды, ядохимикаты, дым из труб электростанций загрязняют почву, атмосферу). Полимеры медленно разлагаются в природных условиях. Увеличение  в атмосфере ведёт к нарушению круговорота
в атмосфере ведёт к нарушению круговорота  и вызывает изменение климата на планете.
и вызывает изменение климата на планете.
Таким образом, неграмотное использование химических достижений ведёт к возникновению экологических.
Поэтому каждому образованному специалисту (инженеру) необходим достаточный минимум химических знаний.
Наука беспредельна, всегда есть вопросы, не имеющие ответов, новые факты, что раньше было неизвестно, сейчас констатируется как известный факт. Возникают новые проблемы, умирают старые гипотезы и возникают новые.
Общая химия знакомит читателя с современным ядром – фундаментом химической науки, так как любой раздел общей химии – это предельно сжатое, сделанное в общих чертах целого направления в химии.
Атомно-молекулярное учение.
Начало этому учению положили взгляды древнегреческих философов, которые пытались представить мир, построенный из основных «начал»: элементов воды, воздуха, огня, земли.
С другой стороны возникает понятие «атом» (неделимый) – неделимая частица.
Представления об «элементах» из которых можно получать любые вещества развивались алхимиками. Они собрали огромный фактический материал (получили множество новых соединений, разработали основные методы синтеза и анализа веществ).
Далее химики занимались изготовлением лекарств, красок.
Следующий этап в развитии химии связан с именами Ломоносова и Лавуазье, которые независимо друг от друга открыли законы сохранения.
В 1748 г. Ломоносов обосновал законы сохранения материи и энергии. Лавуазье сформулировал закон сохранения материи на 50 лет позже.
В XIX в. открыты 3 важных закона:
закон постоянства состава (Пруст, 1799 г)
закон простых кратных отношений (Дальтон, 1804 г)
закон простых объёмных отношений для реагирующих газов (Гей-Люссак, 1805 г)
В химию введены понятия атома как носителя свойств химического элемента и молекулы – сложной частицы, состоящей из нескольких атомов и являющейся наименьшей частицей вещества, обладающей его химическими свойствами.
В 1811 г. Авогадро объяснил закон простых объёмных отношений, поняв, что простые газообразные вещества состоят не из атомов, а из молекул. Закон Авогадро был последним «кирпичиком» в создании атомно-молекулярного учения до конца XIXв. Опираясь на него, Д.И. Менделеев открыл в 1869 г. периодический закон – один из основных законов природы.
Открытие в конце XIX в. электрона, радиоактивности, сложного строения атома и целого мира элементарных частиц привело к тому, что многие положения атомно-молекулярного учения пришлось пересмотреть. Стало ясно, что атом неделим только химически. И всё же это вошло в основу современного атомно-молекулярного учения.
Современное представление.
Все вещества состоят из атомов. Атомы представляют собой мельчайшие частицы вещества, которые химическим путём невозможно разделить на составные части, превратить друг в друга или уничтожить. Атомы различных элементов различаются по массе. Совокупность одинаковых атомов образует простое вещество, соответствующее определённому химическому элементу.
Атомы различных элементов взаимодействуют друг с другом в целочисленных отношениях. В результате получаются сложные образования, в частности молекулы.
Молекула – наименьшая частица вещества, обладающая всеми его химическими свойствами. Одно из наиболее важных свойств молекулы – масса.
Как же определить массу этих мельчайших частиц – атомов и молекул?
Уже во времена Ломоносова и Лавуазье химики определили, что, например, в соединении  с
с  –
–  94,2%
94,2%  , а в соединении с
, а в соединении с  – только 13,8%. Отсюда можно сделать вывод, что атомы
– только 13,8%. Отсюда можно сделать вывод, что атомы  тяжелее, чем атомы
тяжелее, чем атомы  , но легче чем атомы
, но легче чем атомы  . На основании этого можно сказать какие атомы легче, какие тяжелее и далее расположить их в порядке возрастания масс. При этом выяснили, что самый лёгкий –
. На основании этого можно сказать какие атомы легче, какие тяжелее и далее расположить их в порядке возрастания масс. При этом выяснили, что самый лёгкий –  .
.
Атом 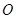 оказался в 16 раз тяжелее атома
оказался в 16 раз тяжелее атома  , атом
, атом  – в 2 раза тяжелее атома
– в 2 раза тяжелее атома  . На основании эти данных Дальтон предложил шкалу относительных атомных масс. Атом каждого элемента характеризовался безразмерным числом, показывающим во сколько раз данный атом тяжелее самого лёгкого (т.е. за единицу приняли
. На основании эти данных Дальтон предложил шкалу относительных атомных масс. Атом каждого элемента характеризовался безразмерным числом, показывающим во сколько раз данный атом тяжелее самого лёгкого (т.е. за единицу приняли  ).
).
Существовала и кислородная шкала.
В 1961 г. была принята углеродная шкала, в которой за единицу приняли 1/12 массы атома изотопа углерода  .
.
III. Относительной атомной массой называется безразмерное число, показывающее во сколько раз масса данного атома больше чем 1/12 атома изотопа углерода  .
.
Совершенно аналогично определяется и относительная масса молекул.
Основные законы.
Закон постоянства состава: Состав чистого вещества не зависит от способа получения этого вещества.
Т. е. для одной и той же молекулы, например  соотношение
соотношение  и
и 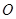 всегда постоянно.
всегда постоянно.
Сейчас мы знаем, что большинство твёрдых веществ состоят не из молекул, а из атомов или ионов и в этом случае возможны изменения состава в зависимости от условий его получения.
Закон кратных отношений: Если 2 элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа.
Например,  с
с  образуют 2 соединения – твёрдое белое вещество и бесцветную тяжёлую жидкость. Оба различаются по своему составу: 1-ое содержит 37,2%
образуют 2 соединения – твёрдое белое вещество и бесцветную тяжёлую жидкость. Оба различаются по своему составу: 1-ое содержит 37,2%  , а 2-ое 54%
, а 2-ое 54%  .
.
Например, какая масса  присоединится на единицу массы
присоединится на единицу массы  .
.


закон утверждает, что  – отношение целых чисел
– отношение целых чисел 
Для нас очевидно, что в состав молекулы  входят 2 атома
входят 2 атома  и 1 атом
и 1 атом  . Раньше этого не знали, считая, что 11,1%
. Раньше этого не знали, считая, что 11,1% 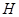 и 88,9%
и 88,9%  .
.
Закон простых объёмных отношений: Объёмы реагирующих газов относятся друг к другу и к объёмам газообразных продуктов как небольшие целые числа.
Например, один объём  реагирует с двумя объёмами
реагирует с двумя объёмами  и при этом получается точно 2 объёма водяного пара:
и при этом получается точно 2 объёма водяного пара:  .
.
Подобные наблюдения позволили предположить, что в одинаковых объёмах газов содержится одинаковое число атомов, но не объясняли соотношение объёмов продуктов реакции.
Выход нашёл Авогадро в 1811 г., предположив, что газообразные вещества состоят из молекул, а не из атомов.
В настоящее время число Авогадро принято равным  .
.
Количество частиц, равное числу Авогадро, получило название «моль».
Моль – количество вещества, содержащего столько же частиц (молекул, атомов, ионов, электронов, фотонов) сколько содержится атомов в 12 г изотопа  .
.
Масса 1-го моль называется молярной массой и выражается в [г/моль].
Из этого следует:
молекулярная масса, выраженная в г, равна относительной молекулярной массе в углеродной шкале;
при одинаковых условиях 1 моль любого газа занимает один и тот же объём, равный 22,4 л.
Вопросы для самоконтроля
Закон постоянства состава.
Закон сохранения массы.
Закон простых кратных отношений.
Относительная молекулярная и атомные массы.
Моль. Молярная масса.
www.ronl.ru
Занятие №1. Основные химические понятия и законы. Расчёты по химическим формулам и уравнениям.
Теоретическая часть
1. Место и значение химии в системе наук.
Современная химия представляет собой систему научных дисциплин: общей,
неорганической, аналитической, органической физической, коллоидной химии,…Основой химической науки являются атомно-молекулярное учение, закон сохранения материи, периодический закон, теория химической связи и учение о химическом процессе.
Как всякая наука, химия изучает некоторую часть явлений окружающего мира. Химия играет значительную роль в научно-техническом прогрессе. Нет ни одной отрасли не связанной в той или иной мере с применением химии.
2. Основные понятия и законы химии
Химия – наука о свойствах вещества и его превращениях, она включает в себя законы и принципы, описывающие эти превращения, а так же представления и теории, позволяющие дать им объяснение.
Атомно-молекулярное учение заключается в следующем:
1. Все вещества состоят из молекул.
2. Молекулы состоят из атомов.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Рассмотрим следующие определения:
Вещество – вид материи, которая обладает массой покоя.
Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Такие вещества принято подразделять на простые и сложные (хим. соединения). Простые вещества образованы
атомами одного хим. элемента и потому являются формой его существования в свободном состоянии, напр. Сера, железо, озон, алмаз. Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды).
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства.
Различным элементам соответствуют различные атомы, обозначаемые символом данного элемента (Ag, Fe, Mg).
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
В настоящее время известно 118 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов
вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая
подчиняется законам, характерным для микросистем.
Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд.
Положительные ионы называют катионами (от греч. kation, буквально – идущий вниз), отрицательные – анионами (от греч. anion, буквально идущий вверх). В свободном состоянии существуют в газовой фазе (в плазме).
Валентность (от лат. valentia – сила), способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Реакции химические (от лат. re- – приставка, означающая обратное действие, и actio –действие), превращения одних веществ (исходных соединений) в другие (продукты реакции) при неизменяемости ядер атомов.
Исходные вещества иногда называют реагентами, однако чаще (особенно в органической химии) термин "реагент" используют по отношению к одному, наиболее активному исходному соединению, определяющему направление химической реакции.
Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле).
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества- молекулы, состоят из атомов одного и того же элемента.
Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода.
1 а.е.м = 1/12 • m (12C) = 1,66057 • 10-27 кг
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м. Ar(Mg) = 24,312
m(Mg) = 24,312 • 1,66057 • 10-24 = 4,037 • 10-23 г
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = mг / (1/12 mа(12C))
mr - масса молекулы данного вещества;
mа(12C) - масса атома углерода 12C.
Mг = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных
атомных масс всех элементов с учетом индексов.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов).
Обозначается n, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность - моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m / υ
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества и численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая - безразмерная.
M = NA • m(1 молекула) = NA • Mг • 1 а.е.м. = (NA • 1 а.е.м.) • Mг = Mг
Это означает, что если масса некоторой молекулы равна, например, 80 а.е.м. (SO3), то масса одного моля молекул равна 80 г. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Все утверждения относительно молекул остаются справедливыми для молей (при замене, в случае необходимости, а.е.м. на г)
Например, уравнение реакции: 2Na + Cl2 ® 2NaCl, означает, что два атома натрия реагируют с одной молекулой хлора или, что одно и то же, два моль натрия реагируют с одним молем хлора.
3. Основные законы
Закон сохранения массы веществ (М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов
реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и
по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава впервые сформулировал Ж.Пруст (1808 г)
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Пример.
CuS - сульфид меди. m(Cu) : m(S) = Ar(Cu) : Ar(S) = 64 : 32 = 2 : 1
Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в массовых
отношениях 2 : 1.
Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке.
Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию. Вещества немолекулярного строения не обладают строго постоянным составом.
Их состав зависит от условий получения.
Закон Авогадро ди Кваренья (1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразных веществ.)
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Практическая часть
Проверьте себя, я задам эти вопросы устно (ответы в скобках – выучить!) Каждый правильный ответ оценивается в 1 балл.
1. Что такое атом?
(Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства)
2. Что такое молекула?
( Молекула - наименьшая частица вещества, обладающая его химическими свойствам).
3. Что такое атомная масса?
(Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C)
4. Что такое относительная молекулярная масса? Как ее найти?
( Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Чтобы ее посчитать, необходимо сложить атомные массы с учетом их стехиометрических коэффициентов)
5. Что такое молярная масса вещества? В каких единицах она выражается? (Молярная масса показывает массу одного моля вещества. Выражается в граммах на моль – г/моль.
6. Как вычислить количество вещества, зная массу, объём или число структурных единиц?
( n=m/M n=N/NА n=V/Vm)
Как формулируется закон Авогадро?
7. (В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул)
8. Что называется относительной плотностью одного газа по другому? (Отношение масс двух газов, занимающих равные объёмы при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D
D=M1/М2).
9. Сформулируйте закон постоянства состава.
(Состав соединений молекулярной структуры является постоянным независимо от способа получения. Состав соединений с немолекулярной структурой (атомной, ионной и металлической кристаллической решеткой) не является постоянным и зависит от способа получения).
10. Сформулируйте закон сохранения массы веществ.
(Масса веществ, вступивших в реакцию, равна массе образующихся продуктов)
lidijavk.ucoz.ru
Главная » Рефераты » Текст работы «Основные положения и законы химии - Химия»
2
Лекция № 1. Основные положения и законы химии. Вводная часть. Наука «химия» и наука общая химия. Основные понятия и законы химии. Во-ᴨȇрвых, человек сам представляет собой систему, в которой происходят различные химические превращения. Во-вторых, человек использует эти процессы с древнейших времён. Первой такой химической реакцией, которую люди использовали ещё в каменном веке, была экзотермическая реакция окисления органических веществ при высокой темᴨȇратуре (горение дров). Затем на заре цивилизации - в Древнем Египте, Китае, использовали химические реакции для получения красок, металлов и т.д. Сейчас невозможно представить себе нашу жизнь без химических процессов, будь то получение лекарств, продуктов и многое другое. Окружающий нас мир (мы полагаем) - природа - различные формы движущейся материи. Материя может существовать в виде элементарных частиц, имеющих массу покоя и полей, лишённых массы покоя. Взаимодействуя друг с другом, элементарные частицы образуют более сложные системы - различные атомы. Наконец, атомы, взаимодействуя друг с другом, образуют различные вещества. Каждое вещество обладает некоторым набором характерных признаков - свойствами: плотностью, электропроводностью, окраской, запахом, твёрдостью и т.д., то, что отличает одно вещество от другого. В определённой совокупности вещества образуют материалы - бумагу, лекарство, стекло, сталь. При изменении условий - нагревании, освещении, ударе - могут происходить превращения одних веществ в другие - самопроизвольные или в результате взаимодействия нескольких веществ. II. Химия - это область естествознания, наука о веществах и их превращениях. Современная химия представляет собой разветвлённую область знаний: геометрическое строение кристаллов (кристаллохимия) электронное строение (квантовая химия) в живых организмах (биохимия) зависимость свойств веществ от их состава и строения(физическая химия) о превращениях в космосе (космохимия) На базе современных химических знаний создаются новые технологии, позволяющие получать из природного сырья принципиально новые вещества и материалы: различные сплавы, сверхпроводящие материалы, полимеры, красители. Каждый из вас использует химические реакции в своей жизни - ᴨȇчёт ли блины, запускает ли двигатель автомобиля, использует ли минеральные удобрения. Достижения химии огромны, но есть и другая сторона медали. Новые вещества не всегда безобидны для природы (инсектициды, ядохимикаты, дым из труб электростанций загрязняют почву, атмосферу). Полимеры медленно разлагаются в природных условиях. Увеличение в атмосфере ведёт к нарушению круговорота и вызывает изменение климата на планете. Итак, неграмотное использование химических достижений ведёт к возникновению экологических. В связи с этим каждому образованному сᴨȇциалисту (инженеру) необходим достаточный минимум химических знаний. Наука беспредельна, всегда есть вопросы, не имеющие ответов, новые факты, что раньше было неизвестно, сейчас констатируется как известный факт. Возникают новые проблемы, умирают старые гипотезы и возникают новые. Общая химия знакомит читателя с современным ядром - фундаментом химической науки, так как любой раздел общей химии - это предельно сжатое, сделанное в общих чертах целого направления в химии. Атомно-молекулярное учение. Начало этому учению положили взгляды древнегреческих философов, которые пытались представить мир, построенный из основных «начал»: элементов воды, воздуха, огня, земли. С другой стороны возникает понятие «атом» (неделимый) - неделимая частица. Представления об «элементах» из котоҏыҳ можно получать любые вещества развивались алхимиками. Они собрали огромный фактический материал (получили множество новых соединений, разработали основные методы синтеза и анализа веществ). Далее химики занимались изготовлением лекарств, красок. Следующий этап в развитии химии связан с именами Ломоносова и Лавуазье, которые независимо друг от друга открыли законы сохранения. В 1748 г. Ломоносов обосновал законы сохранения материи и энергии. Лавуазье сформулировал закон сохранения материи на 50 лет позже. В XIX в. открыты 3 важных закона: закон постоянства состава (Пруст, 1799 г) закон простых кратных отношений (Дальтон, 1804 г) закон простых объёмных отношений для реаᴦᴎҏующих газов (Гей-Люссак, 1805 г) В химию введены понятия атома как носителя свойств химического элемента и молекулы - сложной частицы, состоящей из нескольких атомов и являющейся наименьшей частицей вещества, обладающей его химическими свойствами. В 1811 г. Авогадро объяснил закон простых объёмных отношений, поняв, что простые газообразные вещества состоят не из атомов, а из молекул. Закон Авогадро был последним «кирпичиком» в создании атомно-молекулярного учения до конца XIX в. Опираясь на него, Д.И. Менделеев открыл в 1869 г. ᴨȇриодический закон - один из основных законов природы. Открытие в конце XIX в. электрона, радиоактивности, сложного строения атома и целого мира элементарных частиц привело к тому, что многие положения атомно-молекулярного учения пришлось ᴨȇресмотреть. Стало ясно, что атом неделим только химически. Перед Вами учебный материал, опубликованный на сайте реф.рфИ всё же это вошло в основу современного атомно-молекулярного учения. Современное представление. Все вещества состоят из атомов. Атомы представляют собой мельчайшие частицы вещества, которые химическим путём невозможно разделить на составные части, превратить друг в друга или уничтожить. Атомы различных элементов различаются по массе. Совокупность одинаковых атомов образует простое вещество, соответствующее определённому химическому элементу. Атомы различных элементов взаимодействуют друг с другом в целочисленных отношениях. В результате получаются сложные образования, в частности молекулы. Молекула - наименьшая частица вещества, обладающая всеми его химическими свойствами. Одно из наиболее важных свойств молекулы - масса. Как же определить массу этих мельчайших частиц - атомов и молекул? Уже во времена Ломоносова и Лавуазье химики определили, что, например, в соединении с - 94,2% , а в соединении с - только 13,8%. Отсюда можно сделать вывод, что атомы тяжелее, чем атомы , но легче чем атомы . На основании этого можно сказать какие атомы легче, какие тяжелее и далее расположить их в порядке возрастания масс. При этом выяснили, что самый лёгкий - . Атом оказался в 16 раз тяжелее атома , атом - в 2 раза тяжелее атома . На основании эти данных Дальтон предложил шкалу относительных атомных масс. Атом каждого элемента характеризовался безразмерным числом, показывающим во сколько раз данный атом тяжелее самого лёгкого (т.е. за единицу приняли ). Существовала и кислородная шкала. В 1961 г. была принята углеродная шкала, в которой за единицу приняли 1/12 массы атома изотопа углерода . III. Относительной атомной массой называется безразмерное число, показывающее во сколько раз масса данного атома больше чем 1/12 атома изотопа углерода . Совершенно аналогично определяется и относительная масса молекул. Основные законы. Закон постоянства состава: Состав чистого вещества не зависит от способа получения этого вещества. Т. е. для одной и той же молекулы, например соотношение и всегда постоянно. Сейчас мы знаем, что большинство твёрдых веществ состоят не из молекул, а из атомов или ионов и в этом случае возможны изменения состава в зависимости от условий его получения. Закон кратных отношений: Если 2 элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа. Например, с образуют 2 соединения - твёрдое белое вещество и бесцветную тяжёлую жидкость. Оба различаются по своему составу: 1-ое содержит 37,2% , а 2-ое 54% . Например, какая масса присоединится на единицу массы . закон утверждает, что - отношение целых чисел Для нас вполне понятно, что в состав молекулы входят 2 атома и 1 атом . Раньше этого не знали, считая, что 11,1% и 88,9% . Закон простых объёмных отношений: Объёмы реаᴦᴎҏующих газов относятся друг к другу и к объёмам газообразных продуктов как небольшие целые числа. Например, один объём реаᴦᴎҏует с двумя объёмами и при этом получается точно 2 объёма водяного пара: . Подобные наблюдения позволили предположить, что в одинаковых объёмах газов содержится одинаковое число атомов, но не объясняли соотношение объёмов продуктов реакции. Выход нашёл Авогадро в 1811 г., предположив, что газообразные вещества состоят из молекул, а не из атомов. В настоящее время число Авогадро принято равным . Количество частиц, равное числу Авогадро, получило название «моль». Моль - количество вещества, содержащего столько же частиц (молекул, атомов, ионов, электронов, фотонов) сколько содержится атомов в 12 г изотопа . Масса 1-го моль называется молярной массой и выражается в [г/моль]. Из этого следует: молекулярная масса, выраженная в г, равна относительной молекулярной массе в углеродной шкале; при одинаковых условиях 1 моль любого газа занимает один и тот же объём, равный 22,4 л. Вопросы для самоконтроляЗакон постоянства состава. Закон сохранения массы. Закон простых кратных отношений. Относительная молекулярная и атомные массы. Моль. Молярная масса.  Перейти в список рефератов, курсовых, контрольных и дипломов по дисциплине Химия
Перейти в список рефератов, курсовых, контрольных и дипломов по дисциплине Химия
referatwork.ru