
Во всех органических соединениях С проявляет валентность, равную 4. Это связано со строением атома углерода. 6С 1s2 2s2 2p2 В нормальном состоянии
| 2 | ↑↓ | ↑ | ↓ |
| 1 | ↑↓ | p | |
| s |
А в возбужденном
| 2 | ↑ | ↓ | ↑ | ↓ |
| 1 | ↑↓ | p | ||
| s |
Четыре валентные электрона и определяют такую валентность
Изомеризация – химические реакции, в результате которых происходит изменение взаимного расположения атомов в молекуле, места кратных связей и их кратности; могут осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.

Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия.

Исходное вещество и продукт реакции изомеризации имеют одинаковые молекулярные формулы и являются структурными изомерами (изомерия углеродного скелета).
Полимеризация – процесс получения высокомолекулярных соединений, при котором молекула полимера (макромолекула) образуется путем последовательно присоединения молекул низкомолекулярного вещества (мономера) к активному центру, находящемуся на конце растущей цепи.
муравьиный кислота изомеризация крахмал целлюлоза


Дано
m(Ch4 CHO) = 132
Решение


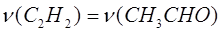



Ответ
V(C2 h3 ) = 67,2 л
Найти
V(C2 h3 )-?
46
Дано
m(C6 H5 NO2 ) = 226 г
Решение



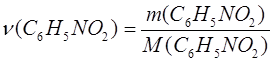

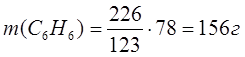
Ответ
m(C6 H6 ) = 156 г
Найти
m(C6 H6 )-?
Дано
m(C6 H5 OH)=188г
Решение






Ответ
m(C6 h3 OHBr3 ) = 662 г
Найти
m(C6 h3 OHBr3 )-?
Муравьиная кислота проявляет свойства альдегида и кислоты, т.к. содержит как карбоксильную группу (обведена синим цветом), так и альдегидную (обведена красным)

Муравьиная кислота — хороший восстановитель
HCOOH + [Ag(Nh4 )2 ]OH → Ag + CO2 + h3 O — реакция серебряного зеркала
HCOOH + HgCl2 → Hg + CO2 + 2HCl
При нагревании с концентрированной серной кислотой муравьиная кислота дегидратируется с образованием СО

Муравьиная кислота образует ортоэфиры — сложные эфиры нестабильной ортоформы кислоты

Этиловый эфир ортрумуравьиной кислоты называется ортомуравьиный эфир

Получают ортомуравьиный эфир кипячением этилата натрия с хлороформом по реакции:

Крахмал и целлюлоза – полимеры, мономером которых является глюкоза. Целлюлоза – полисахарид, которому отвечает брутто-формула (C6 h20 O5 )n. Молекулы целлюлозы отличаются от крахмала, имеющего такую же брутто-формулу, более высокой степенью полимеризации. Последняя у целлюлозы составляет 2500-3000 и иногда доходит даже до 4000, тогда как у крахмала она находится в пределах 600-900.
Кроме того, целлюлоза построена из звеньев β-глюкозы, а крахмал – из α-глюкозы.
Правда, различие в свойствах целлюлозы и крахмала вызвано не только различием в строении звеньев, из которых они состоят. Молекулы целлюлозы, в отличие от крахмала, не имеют разветвлений, то есть они построены более упорядочение. Обычно цепи молекул целлюлозы располагаются параллельно друг другу и образуют между собой связи за счет так называемых водородных мостиков.
Гидролиз крахмала

86 а) 
б) 

1. 
2. 
3. 
4. 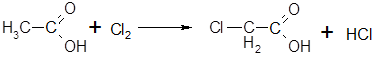
5. 
www.ronl.ru
 Опубликовать
ОпубликоватьРеферат на тему:
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация – электронная изомеризация – диссоциация, в котором активными частицами являются радикалы,ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Существует большое количество признаков, по которым можно классифицировать химические реакции.
NaOH(р.) + HCl(р.) → NaCl(р.) + h3O
CaCO3(т.) + 2HCl(р.) → CaCl2(р.) + CO2(г.) + h3O(ж.)
Nh4(г.) + HCl(г.) → Nh5Cl(т.)
N2(г.) + 3h3(г.) → 2Nh4(г.) (кат. Pt)
В данном случае различают
2h3 + O2 = 2h3O
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:Nh5NO3 = N2O + 2h3O (до 250 °C)
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение.
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Категории: Основные положения и определения в химии, Химические реакции.
Текст доступен по лицензии Creative Commons Attribution-ShareAlike.wreferat.baza-referat.ru
1. Химические реакции.
2. Окислительно-восстановительные реакции.
3. Реакции в растворах электролитов.
4. Представление о кислотах и основаниях.
5. Гидролиз солей.
Возможно вы искали - Реферат: Химия платины и ее соединений
Список литературы.
2
3
4
5
7
9
1. Химические реакции
Химические свойства веществ выявляются в химических реакциях . Химическая реакция заключается в разрыве одних и образовании других связей. Химическая реакция изображается в общем виде уравнением
aA + bB = cC + dD,
где вещества A и B, вступившие в реакцию, называют реагентами (или исходными веществами ), а новые вещества C и D, образующиеся в результате протекания реакции, - продуктами (или конечными веществами ). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами.
Химические реакции классифицируются различными способами:
1) По типу взаимодействия:
Похожий материал - Реферат: Сурьма
реакции разложения 2HgO = 2Hg + O2
реакции соединения 2Na + Cl2 = 2NaCl
реакции замещения CuO + h3 = h3 O + Cu
реакции двойного обмена CaO + 2HCl = CaCl2 + h3 O
Указанные типы нередко совмещаются в более сложных реакциях. Например:
Na2 CO3 + 2HCl = 2NaCl + CO2 + h3 O.
Очень интересно - Реферат: Тепловой эффект химической реакции и его практическое применение.
Эта реакция – одновременно и реакция двойного обмена, и реакция разложения, так как промежуточно образующаяся угольная кислота h3 CO3 неустойчива и разлагается на CO2 и h3 O.
2) По тепловому эффекту:
экзотермические реакции, протекающие с экзо -эффектом – выделением энергии в форме теплоты (+Q):
C + O2 = CO2 + Q,
эндотермические реакции, протекающие с эндо -эффектом – поглощением энергии в форме теплоты (-Q):
N2 + O2 = 2NO – Q.
3) По направлению протекания процесса реакции подразделяются на необратимые , которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl¯ + NaNO3 ,
Вам будет интересно - Реферат: Задачи по химии
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т.е. реакции не идут до конца слева направо):
2SO2 + O2 « 2SO3 .
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками («).
4) По изменению степеней окисления реакции подразделяются на:
протекающие без изменения степеней окисления всех элементов, входящих в исходные вещества, например
NaOH + HCl = NaCl + h3 O,
и окислительно-восстановительные реакции, протекающие с изменением степеней окисления всех или некоторых (или даже хотя бы одного!) элементов, например:
2Cu0 + O0 = 2Cu2+ O2- ,
Cu2+ O2- + H0 = Cu0 + h2+ O2- ,
Cl0 + 2Na1+ O2- h2+ = Na1+ Cl1- + Na1+ Cl1+ O2- + h2+ O2- .
2. Окислительно-восстановительные реакции
Похожий материал - Реферат: Технико-экономические расчеты к проекту отделения переработки КХК коллективного химического конц
Окислительно-восстановительные реакции – это химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдаёт свои электроны, то он приобретает положительный заряд, например:
Zn0 – 2e = Zn2+ .
Если отрицательно заряженный ион (заряд –1), например Cl- , отдаёт 1 электрон, то он становится нейтральным атомом:
Cl- - 1e = Cl0 .
Если положительно заряженный ион или атом отдаёт электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ - 1e = Fe3+ .
К-во Просмотров: 336
Бесплатно скачать Реферат: Химические реакции
cwetochki.ru