|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат на тему Медь и е свойства. Реферат медь
Реферат на тему "Медь и ее соединения"
ООО Учебный центр
«ПРОФЕССИОНАЛ»
Реферат по дисциплине:
««Химия: теория и методика преподавания в образовательной организации»
По теме:
«Медь и ее соединения»
Исполнитель:
Родионова Дарья Олеговна
Москва 2017 год
Содержание
Введение 3
-
Историческая справка 4
-
Химические и физические свойства меди 5-7
-
Важнейшие соединения меди 8-10
-
Сплавы меди 11-14
Заключение 15
Список литературы 16
Введение
Вместе с золотом, серебром, железом, оловом, свинцом и ртутью медь входит в "великолепную семерку" металлов, известных людям с незапамятных времен. Из этих семи древнейших металлов лишь три - золото, серебро и медь - встречаются на Земле в самородном состоянии. Но золото и серебро попадались нашим предкам довольно редко, а медь значительно чаще, причем иногда в виде весьма солидных самородков [4].
Преимущества меди перед камнем в качестве материала для орудий труда, оружия, предметов быта оказались столь очевидны, что древний земледелец, скотовод или охотник не мог их не заметить. Еще бы: металл сравнительно легко менял форму, его можно было сплющить, заострить края, проделать в нем отверстие. Медь начала теснить позиции камня и вскоре прочно вошла в жизнь первобытных людей: каменный век сдал полномочия эпохе меди.
Медь и её сплавы сыграли большую роль в развитии материальной культуры. Благодаря лёгкой восстановимости оксидов и карбонатов, медь была, по-видимому, первым металлом, который человек научился восстановлять из кислородных соединений, содержащихся в рудах [6].
Цель настоящей работы заключается в систематизации и расширении знаний о меди и ее важнейших соединениях, которые имеют большое промышленное и биологическое значение.
Задачи данной работы:
-
Познакомиться с химическими и физическими свойствами меди.
-
Рассмотреть свойства и значение важнейших соединений меди, а также ее сплавов с другими металлами в промышленности и жизни человека.
-
Историческая справка
Медь стала известна человеку в каменном веке – некоторые самородки меди, относящиеся к этому времени, носят следы воздействия каменных орудий, в частности у них обрублены выступающие части. Очевидно, эти кусочки меди были использованы доисторическим человеком в качестве украшений, а затем и как орудия. Распространению медных изделий способствовало свойство меди подвергаться ковке в нагретом состоянии. Так обрабатывали медные самородки индейцы еще со времен Колумба.
Где и когда был открыт метод выплавки меди из руд неизвестно. Скорее он был открыт случайно. Самородная медь всегда встречалась совместно с рудой. И вот во время нагрева самородка в раскаленных углях костра кусочки медной руды, прилипшие к самородку, тоже превратились в медь – восстановились углеродом: [3].
Руды меди часто встречаются совместно с рудами цинка, олова. Такие руды восстанавливаются легче и дают сплавы меди более твердые, чем сама медь. Эти сплавы называются бронзами, а время, в течение которого человек широко использовал бронзу, - бронзовым веком. Название “бронза” произошло от названия небольшого итальянского города Бриндизи, через который среди прочих товаров шла торговля изделиями из сплава меди с оловом. Этот сплав назвали медью из Бриндизи, а затем - бронзой.
infourok.ru
Реферат на тему Медь
Содержание Вступление……………………………………….1 Химические свойства……………………………1 Минералы………………………………………...4 Медные сплавы…………………………………..4 Марки медных сплавов………………………….5 Медно-цинковые сплавы. Латуни………………6 Оловянные бронзы………………………………7 Алюминиевые бронзы…………………………..8 Кремнистые бронзы……………………………..9 Бериллиевые бронзы…………………………….9 Медь в промышленности………………………..9 Медь в жизни растений и животных……………12 Медь Вступление Медь (лат. Cuprum) - химический элемент. Один из семи металлов, известных с глубокой древности. По некоторым археологическим данным медь была хорошо известна египтянам еще за 4000 лет до Р. Христова. Знакомство человечества с медью относится к более ранней эпохе, чем с железом; это объясняется, с одной стороны, более частым нахождением меди в свободном состоянии на поверхности земли, а с другой - сравнительной легкостью получения ее из соединений. Древняя Греция и Рим получали медь с острова Кипра (Cyprum), откуда и название ее Cuprum. Медь как художественный материал используется с медного века (украшения, скульптура, утварь, посуда). Кованые и литые изделия из Меди и сплавов украшаются чеканкой, гравировкой и тиснением. Лёгкость обработки Меди (обусловленная её мягкостью) позволяет мастерам добиваться разнообразия фактур, тщательности проработки деталей, тонкой моделировки формы. Изделия из Меди отличаются красотой золотистых или красноватых тонов, а также свойством обретать блеск при шлифовке. Медь нередко золотят, патинируют, тонируют, украшают эмалью. С 15 века Медь применяется также для изготовления печатных форм.
Химические и физические свойства элемента
Медь - химический элемент I группы периодической системы Менделеева; атомный номер - 29, атомная масса - 63,546. Температура плавления- 1083° C; температура кипения - 2595° C; плотность - 8,98 г/см3. По геохимической классификации В.М. Гольдшмидта, медь относится к халькофильным элементам с высоким сродством к S, Se, Te, занимающим восходящие части на кривой атомных объемов. Чистая медь - тягучий, вязкий металл красного, в изломе розового цвета, в очень тонких слоях на просвет медь выглядит зеленовато-голубой. Эти же цвета, характерны и для многих соединений меди, как в твердом состоянии, так и в растворах. Общее содержание меди в земной коре сравнительно невелико (0,01 вес %), однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной лёгкостью обработки меди объясняется то, что она ранее других металлов была использована человеком.Академиком В.И. Вернадским в первой половине 1930 г были проведены исследования изменения изотопного состава воды, входящего в состав разных минералов, и опыты по разделению изотопов под влиянием биогеохимических процессов, что и было подтверждено последующими тщательными исследованиями. Как элемент нечетный состоит из двух нечетных изотопов 63 и 65 На долю изотопа Cu (63) приходится 69,09%, процентное содержание изотопа Cu (65) - 30,91%. В соединениях медь проявляет валентность +1 и +2, известны также немногочисленные соединения трехвалентной меди. К валентности 1 относятся лишь глубинные соединения, первичные сульфиды и минерал куприт - Cu2O. Все остальные минералы, около сотни отвечают валентности два. Радиус одновалентной меди +0.96. Величина атомного радиуса двухвалентной меди - 1,28; ионного радиуса 0,80. Медь - металл сравнительно мало активный. В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Она достаточно легко вступает в реакции с галогенами, серой, селеном. А вот с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют. Электроотрицательность атомов - способность при вступлении в соединения притягивать электроны. Электроотрицательность Cu2+ - 984 кДж/моль, Cu+ - 753 кДж/моль. Элементы с резко различной ЭО образуют ионную связь, а элементы с близкой ЭО - ковалентную. Сульфиды тяжелых металлов имеют промежуточную связь, с большей долей ковалентной связи (ЭО у S-1571, Cu-984, Pb-733). Медь является амфотерным элементом - образует в земной коре катионы и анионы.Минералы
Медь входит более чем в 198 минералов, из которых для промышленности важны только 17, преимущественно сульфидов, фосфатов, силикатов, карбонатов, сульфатов. Главными рудными минералами являются халькопирит CuFeS2, ковеллин CuS, борнит Cu5FeS4, халькозин Cu2S. Окислы: тенорит, куприт. Карбонаты: малахит, азурит. Сульфаты: халькантит, брошантит. Сульфиды: ковеллин, халькозин, халькопирит, борнит. Чистая медь - тягучий, вязкий металл красного, в изломе розового цвета, в очень тонких слоях на просвет медь выглядит зеленовато-голубой. Эти же цвета, характерны и для многих соединений меди, как в твердом состоянии, так и в растворах. Понижение окраски при повышении валентности видно из следующих двух примеров: CuCl - белый, Cu2O - красный, CuCl2+h3O - голубой, CuO - черный Карбонаты характеризуются синим и зеленым цветом при условии содержания воды. Практическое значение имеют: самородная медь, сульфиды, сульфосоли и карбонаты (силикаты). Медные сплавы Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30-40 кгс/мм2 у сплавов и 25-29 кгс/мм^2 у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не принимают термической обработки, и их механические свойства и износостойкость определяются химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900-12000 кгс/мм2 ниже, чем у стали). Основное преимущество медных сплавов - низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных.Марки медных сплавов.
Марки обозначаются следующим образом. Первые буквы в марке означают: Л - латунь и Бр - бронза. Буквы, следующие за буквой Л в латуни или Бр. В бронзе, означают: А - алюминий, Б - бериллий, Ж - железо, К - кремний, Мц - марганец, Н - никель, О - олово, С - свинец, Ц - цинк, Ф. - фосфор. Цифры, помещенные после буквы, указывают среднее процентное содержание элементов. Порядок расположения цифр, принятый для латуней, отличается от порядка, принятого для бронз. В марках латуни первые две цифры (после буквы) указывают содержание основного компонента - меди. Остальные цифры, отделяемые друг от друга через тире, указывают среднее содержание легирующих элементов. Эти цифры расположены в том же порядке, как и буквы, указывающие присутствие в сплаве того или иного элемента. Таким образом содержание цинка в наименовании марки латуни не указывается и определяется по разности. Например, Л68 означает латунь с 68% Cu (в среднем) и не имеющую других легирующих элементов, кроме цинка; его содержание составляет (по разности) 32%. ЛАЖ 60-1-1 означает латунь с 60% Cu , легированную алюминием (А) в количестве 1% , с железом (Ж) в количестве 3% и марганцем (Мц) в количестве 1%. Содержание цинка (в среднем) определяется вычетом из 100% суммы процентов содержания меди, алюминия, железа и марганца. В марках бронзы (как и в сталях) содержание основного компонента - меди - не указывается, а определяется по разности. Цифры после букв, отделяемые друг от друга через тире, указывают среднее содержание легирующих элементов; цифры расположенные в том же порядке, как и буквы, указывающие на легирование бронзы тем или иным компонентом. Например, Бр.ОЦ10-2 означает бронзу с содержанием олова (О) ~ 4% и цинка (Ц) ~ 3%.Содержание меди определяется по разности (из 100%). Бр.АЖНЮ-4-4 означает бронзу с 10% Al , 4% Fe и 4% Ni (и 82% Cu). Бр. КМц3-1 означает бронзу с 3% Si , и 1% Mn (и 96% Cu).Медно-цинковые сплавы. Латуни
По химическому составу различают латуни простые и сложные, а по структуре - однофазные и двухфазные. Простые латуни легируются одним компонентом: цинком. Однофазные простые латуни имеют высокую пластичность; она наибольшая у латуней с 30-32% цинка (латуни Л70 , Л67). Латуни с более низким содержанием цинка (томпаки и полутомпаки) уступают латуням Л68 и Л70 в пластичности, но превосходят их в электро- и теплопроводности. Они поставляются в прокате и поковках. Двухфазные простые латуни имеют хорошие ковкость (но главным образом при нагреве) и повышенные литейные свойства и используются не только в виде проката, но и в отливках. Пластичность их ниже чем у однофазных латуней, а прочность и износостойкость выше за счет влияния более твердых частиц второй фазы. Прочность простых латуней 30-35 кгс/мм2 при однофазной структуре и 40-45 кгс/мм2 при двухфазной. Прочность однофазной латуни может быть значительно повышена холодной пластической деформацией. Эти латуни имеют достаточную стойкость в атмосфере воды и пара (при условии снятия напряжений, создаваемых холодной деформацией).Оловянные бронзы
Однофазные и двухфазные бронзы превосходят латуни в прочности и сопротивлении коррозии (особенно в морской воде). Однофазные бронзы в катаном состоянии, особенно после значительной холодной пластической деформации, имеют повышенные прочностные и упругие свойства . Для двухфазных бронз характерна более высокая износостойкость. Важное преимущество двухфазных оловянистых бронз - высокие литейные свойства; они получают при литье наиболее низкий коэффициент усадки по сравнению с другими металлами, в том числе чугунами. Оловянные бронзы применяют для литых деталей сложной формы. Однако для арматуры котлов и подобных деталей они используются лишь в случае небольших давлений пара. Недостаток отливок из оловянных бронз - их значительная микропористость. Поэтому для работы при повышенных давлениях пара они все больше заменяются алюминиевыми бронзами. Из-за высокой стоимости олова чаще используют бронзы, в которых часть олова заменена цинком (или свинцом). Алюминиевые бронзы Эти бронзы (однофазные и двухфазные) все более широко заменяют латуни и оловянные бронзы. Однофазные бронзы в группе медных сплавов имеют наибольшую пластичность. Их используют для листов (в том числе небольшой толщины) и штамповки со значительной деформацией. После сильной холодной пластической деформации достигаются повышенные прочность и упругость. Двухфазные бронзы подвергают горячей деформации или применяют в виде отливок. У алюминиевых бронз литейные свойства (жидкотекучесть) ниже, чем у оловянных; коэффициент усадки больше, но они не образуют пористости, что обеспечивает получение более плотных отливок. Литейные свойства улучшаются введением в указанные бронзы небольших количеств фосфора. Бронзы в отливках используют, в частности, для котельной арматуры сравнительно простой формы, но работающей при повышенных напряжениях. Кроме того, алюминиевые двухфазные бронзы, имеют более высокие прочностные свойства, чем латуни и оловянные бронзы. У сложных алюминиевых бронз, содержащих никель и железо, прочность составляет 55-60 кгс/мм2 . Все алюминиевые бронзы, как и оловянные, хорошо устойчивы против коррозии в морской воде и во влажной тропической атмосфере. Алюминиевые бронзы используют в судостроении, авиации, и т.д. В виде лент, листов, проволоки их применяют для упругих элементов, в частности для токоведущих пружин. Кремнистые бронзы Применение кремнистых бронз ограниченно. Используются однофазные бронзы как более пластичные. Они превосходят алюминиевые бронзы и латуни в прочности и стойкости в щелочных (в том числе сточных) средах. Эти бронзы применяют для арматуры и труб, работающих в указанных средах. Кремнистые бронзы, дополнительно легированные марганцем, в результате сильной холодной деформации приобретают повышенные прочность и упругость и в виде ленты или проволоки используются для различных упругих элементов.Бериллиевые бронзы
Бериллиевые бронзы сочетают очень высокую прочность ( до 120 кгс/мм2 ) и коррозионную стойкость с повышенной электропроводностью. Однако эти бронзы из-за высокой стоимости бериллия используют лишь для особо ответственных случаях в изделиях небольшого сечения в виде лент, проволоки для пружин, мембран, сильфонов и контактах в электрических машинах, аппаратах и приборах. Указанные свойства бериллиевые бронзы получаются после закалки и старения, т.к. растворимость бериллия в меди уменьшается с понижением температуры. Выделение при старении частиц химического соединения CuBe повышает прочность и уменьшает концентрацию бериллия в растворе меди. Медь в промышленности В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80% всей добываемой меди. Важнейшими минералами, входящими в состав медных руд, являются: халькозин или медный блеск - Cu2S; халькопирит или медный колчедан - CuFeS2; малахит - (CuOH)2CO3.Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать руды с небольшим содержанием меди. Выплавка меди их её сульфидных руд или концентратов представляет собою сложный пpо-цесс. Обычно он слагается из следующих операций: · обжиг · плавка · конвертирование · огневое рафинирование · электролитическое рафинирование В ходе обжига большая часть сульфидов пpимесных элементов превращается в оксиды. Так, главная примесь большинства медных руд, пирит - FeS2 - превращается в Fe2O3. Газы, отходящие при обжиге, содержат SO2 и используются для получения серной кислоты. Получающиеся в ходе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Основной же продукт плавки - жидкий штейн (Cu2S с примесью FeS) поступает в конвертор, где через него продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая или сырая медь. Для извлечения ценных спутников (Au, Ag, Te и др.) и для удаления вредных примесей черновая медь подвергается огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом пpимеси железа, цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании. Чистая медь — тягучий вязкий металл светло-розового цвета, легко пpокатываемый в тонкие листы. Она очень хорошо проводит тепло и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на её поверхности тончайшая плёнка оксидов придает меди более тёмный цвет и также служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налётом гидpоксокаpбоната меди - (CuOH)2CO3. При нагревании на воздухе в интервале температур 200-375oC медь окисляется до черного оксида меди(II) CuO. При более высоких температурах на её поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди(II), а внутренний - красный оксид меди(I) - Cu2O. Медь широко используется в промышленности из-за : · высокой теплопроводимости · высокой электропроводимости · ковкости · хороших литейных качеств · большого сопротивления на разрыв · химической стойкости Около 40% меди идёт на изготовление различных электрических проводов и кабелей. Широкое применение в машиностроительной промышленности и электротехнике нашли различные сплавы меди с другими веществами. Наиболее важные из них являются латуни (сплав меди с цинком), медноникеливые сплавы и бронзы. Все медные сплавы обладают высокой стойкостью против атмосферной коррозии. В химическом отношении медь — малоактивный металл. Однако с галогенами она реагирует уже при комнатной температуре. Например, с влажным хлором она образует хлорид - CuCl2. При нагревании медь взаимодействует и с серой, образуя сульфид - Cu2S. Находясь в ряду напряжения после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей: 2Cu + 4HCl + O2 —> 2CuCl2 + 2h3O Летучие соединения меди окрашивают несветящееся пламя газовой горелки в сине-зелёный цвет. Соединения меди(I) в общем менее устойчивы, чем соединения меди(II), оксид Cu2O3 и его производные весьма нестойки. В паре с металлической медью Cu2O применяется в купоросных выпрямителях переменного тока. Оксид меди(II) (окись меди) - CuO - черное вещество, встречающееся в природе (например в виде минерала тенеpита). Его легко можно получит прокаливанием гидpоксокаpбоната меди(II) (CuOH)2CO3 или нитрата меди(II) - Cu(NO3)2. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород – в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода. Гидроксокарбонат меди(II) - (CuOH)2CO3 - встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зелёный цвет, применяется для получения хлорида меди(II), для приготовления синих и зелёных минеральных красок, а также в пиротехнике. Сульфат меди(II) - CuSO4 - в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Смешанный ацетат-арсенит меди(II) - Cu(Ch4COO)2•Cu3(AsO3)2 - применяется под названием "парижская зелень" для уничтожения вредителей растений. Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зелёных, синих, коричневых, фиолетовых и черных. Все соли меди ядовиты, поэтому медную посуду лудят – покрывают внутри слоем олова, чтобы предотвратить возможность образования медных солей.Хаpактеpное свойство двухзарядных ионов меди – их способность соединяться с молекулами аммиака с образованием комплексных ионов.Медь принадлежит к числу микроэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для нормальной жизнедеятельности растений. Медь в жизни растений и животных Медь — необходимый для растений и животных микроэлемент. Основная биохимическая функция Меди — участие в ферментативных реакциях в качестве активатора или в составе медьсодержащих ферментов. Количество Меди в растениях колеблется от 0,0001 до 0,05 % (на сухое вещество) и зависит от вида растения и содержания Меди в почве. В растениях Медь входит в состав ферментов-оксидов и белка пластоцианина. В оптимальных концентрациях Медь повышает холодостойкость растений, способствует их росту и развитию. Среди животных наиболее богаты Медью некоторые беспозвоночные (у моллюсков и ракообразных в гемоцианине содержится 0,15 — 0,26 % Меди). Поступая с пищей, Медь всасывается в кишечнике, связывается с белком сыворотки крови — альбумином, затем поглощается печенью, откуда в составе белка церулоплазмина возвращается в кровь и доставляется к органам и тканям. Содержание Меди у человека колеблется (на 100 г сухой массы) от 5 мг в печени до 0,7 мг в костях, в жидкостях тела — от 100 мкг (на 100 мл) в крови до 10 мкг в спинномозговой жидкости; всего Меди в организме взрослого человека около 100 мг. Медь входит в состав ряда ферментов (например, тирозиназы, цитохромоксидазы), стимулирует кроветворную функцию костного мозга. Малые дозы Меди влияют на обмен углеводов (снижение содержания сахара в крови), минеральных веществ (уменьшение в крови количества фосфора) и других. Увеличение содержания Меди в крови приводит к превращению минеральных соединений железа в органические, стимулирует использование накопленного в печени железа при синтезе гемоглобина. При недостатке Меди злаковые растения поражаются так называемой болезнью обработки, плодовые — экзантемой; у животных уменьшаются всасывание и использование железа, что приводит к анемии, сопровождающейся поносом и истощением. Применяются медные микроудобрения и подкормка животных солями Меди. Отравление Медью приводит к анемии, заболеванию печени, болезни Вильсона. У человека отравление возникает редко благодаря тонким механизмам всасывания и выведения Меди. Однако в больших дозах Медь вызывает рвоту; при всасывании Меди может наступить общее отравление (понос, ослабление дыхания и сердечной деятельности, удушье, коматозное состояние). В медицине сульфат Меди применяют как антисептическое и вяжущее средство в виде глазных капель при конъюнктивитах и глазных карандашей для лечения трахомы. Раствор сульфата Меди используют также при ожогах кожи фосфором. Иногда сульфат Меди применяют как рвотное средство. Нитрат Меди употребляют в виде глазной мази при трахоме и конъюнктивитах.bukvasha.ru
Реферат Медь
скачатьРеферат на тему:

План:
- Введение
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Физические свойства
- 4 Химические свойства
- 4.1 Соединения
- 4.2 Соединения меди(I)
- 4.3 Соединения меди(II)
- 4.4 Соединения меди(III) и меди(IV)
- 4.5 Аналитическая химия меди
- 5 Применение
- 5.1 В электротехнике
- 5.2 Теплообмен
- 5.3 Для производства труб
- 5.4 Сплавы
- 5.4.1 Сплавы на основе меди
- 5.4.2 Сплавы, в которых медь значима
- 5.4.3 Ювелирные сплавы
- 5.5 Соединения меди
- 5.6 Другие сферы применения
- 6 Стоимость
- 7 Биологическая роль
- 7.1 Токсичность
- 7.2 Бактерицидность
- 7.3 Органолептические свойства
- 8 Производство, добыча и запасы меди
- 8.1 Способы добычи
- 8.2 Современные способы добычи
- 9 Интересные факты ПримечанияЛитература
Введение
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
1. История и происхождение названия
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков производят русское слово медь (польск. miedz, чешск. med) от древненемецкого smida (металл) и Schmied (кузнец, англ. Smith). Конечно, родство корней в данном случае несомненно, однако, оба эти слова произведены от греч. рудник, копь независимо друг от друга. От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь венера (Venus). В более древние времена встречается название марс (Mars).
2. Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
3. Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра, удельная проводимость при 20 °C 55,5-58 МСм/м[4]). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
4. Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
4.1. Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23−, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5h3O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
4.2. Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl−(водн.) → [CuCl2]− (водн.)
Хлорид меди(I) — белое нерастворимое твёрдое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
2CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Ионы меди окрашивают пламя в зелёный цвет
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]−. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(Nh4)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
4.3. Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, конц. серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (напр., использование реактива Фелинга).
4.4. Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
4.5. Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
5. Применение
5.1. В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м[4]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[5].
5.2. Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
5.3. Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [6], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
5.4. Сплавы
5.4.1. Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30-40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не принимают термической обработки, и их механические свойства и износостойкость определяются химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900-12000 кгс/мм² ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевые сплавы используются для чеканки разменной монеты.
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
5.4.2. Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
5.4.3. Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
5.5. Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
5.6. Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [7].
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
6. Стоимость
На 2011 год стоимость меди составляет около $9000 за тонну.[8]
7. Биологическая роль
Продукты богатые медью.
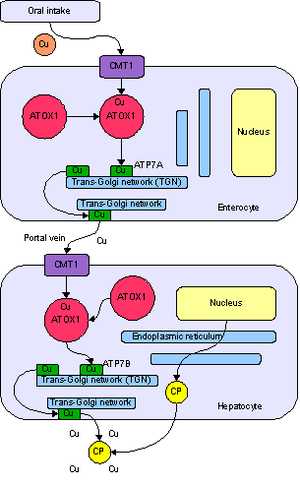
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
7.1. Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[9].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[9]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
7.2. Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[10] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[11]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)[12].
7.3. Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
8. Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т[13][14]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [13], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[13]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн[15]. Основными производителями меди в России являлись:
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское» [16]. Мировое производство меди в 2007 году составляло [17] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
- Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
- США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
Смотрим также более полный список стран по производству меди.
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
8.1. Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
2CO + (CuOH)2CO33CO2 + 2Cu + h3O.Добычу меди называют[кто?] прабабушкой металлургии. Её добыча и выплавка были налажены ещё в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
8.2. Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[18].
9. Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[19].
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).
- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными габаритами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[20].
- Поскольку медь не накапливается в организме, а выводится вместе с продуктами метаболизма, человеку ежедневно необходимо получать в составе диеты ок. 2 мг меди.
Примечания
- Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т.. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8
- Медь самородная в БСЭ - slovari.yandex.ru/dict/bse/article/00046/67000.htm
- Крупнейшие мономинеральные месторождения (рудные районы, бассейны) - uralgold.ru/very_big_f.html
- ↑ 12 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- Применение меди - www.magin.ru/primen.html
- ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа. Технические условия - protect.gost.ru/document.aspx?control=7&baseC=6&page=0&month=6&year=2008&search=52318&id=129454
- СП 31-116-2006 Проектирование и устройство кровель из листовой меди - dwg.ru/dnl/3215
- Цена меди - coppertubeus.blogspot.com/
- ↑ 12CHEMICAL FACT SHEETS - www.who.int/water_sanitation_health/dwq/chemicals/coppersum.pdf (англ.).
- US EPA - www.epa.gov/pesticides/factsheets/copper-alloy-products.htm
- В США наблюдается вспышка инфекции MRSA за пределами госпиталей - www.rol.ru/news/med/news/03/03/07_017.htm
- British Scientist Shares Expertise on Swine Flu Control in Beijing - www.copperinfo.co.uk/news/press-releases/pr762-british-scientist-copper-swine-flu.pdf
- ↑ 123 Производство меди - www.ecsocman.edu.ru/db/msg/142462.html
- В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии - www.metalinfo.ru/ru/news/12150
- Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года - www.minprom.gov.ru/activity/metal/strateg/2. Минпромэнерго РФ (2009-03-18).
- Металлонвест оплатил лицензию за Удокан - www.metalinfo.ru/ru/news/34394
- MINERAL COMMODITY SUMMARIES 2009 - minerals.usgs.gov/minerals/pubs/mcs/2009/mcs2009.pdf
- Получение меди - melita.com.ua/spravochnik_med.html
- Espinoza Soriano, Waldemar. Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
- Интересные факты о меди и медных трубах - www.stelmarket.ru/teh_inf/26.htm
Литература
- Данные на начало XX века : Медь - ru.wikisource.org/wiki/ЭСБЕ/Медь // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Р. А. Лидин, В. А. Молочко, Л. Л. Андреева Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
wreferat.baza-referat.ru
Реферат - Медь и её свойства
Министерство образования и науки РФ
РЕФЕРАТ
«МЕДЬ И ЕЁ СВОЙСТВА»
Выполнил:
Проверил:
2007 год
МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент I группы периодической системы Менделеева, атомный номер 29, атомная масса 63,546.
1.Общая характеристика меди.
Природная медь состоит из двух стабильных нуклидов 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s2p6d104s1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (Ag) и золото (Au).
Радиус нейтрального атома меди 0,128 нм, радиус иона Cu+ от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu2+ — от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726; 20,291; 36,8; 58,9 и 82,7 эВ. Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода (H) и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь — красивый розовато-красный пластичный металл.
Название: латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
2.Физические и химические свойства:
Кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм. Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10–3 Ом·м).
В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
Красновато-коричневый оксид меди (I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди (I) CuBr и иодид меди (I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
Cu2O + h3SO4= Cu + CuSO4+ h3O.
При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода — восстанавливается до свободного металла.
Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
CuO + h3SO4 = CuSO4 + h3O
При сплавлении со щелочами CuO образуются купраты, например:
CuO + 2NaOH = Na2CuO2 + h3O
Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
Cu2O = CuO + Cu.
Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
CuO + СО = Cu + СО2.
Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами, например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.
При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2]–, [CuCl3]2– и [СuCl4]3–, например за счет процесса:
CuCl + НCl = H[CuCl2]
При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
h3S + CuSO4 = CuS + h3SO4
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O2= 2CuCl2+ 2h3O.
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O.
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2h3SO4= CuSO4+ SO2+ 2h3O.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(Nh4)]2+. При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Сu(OH)2+ 2HNO3= Cu(NO3)2+ 2h3O.
Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Сu(OH)2+ 2NaOH = Na2[Cu(OH)4]
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
3.Нахождение в природе
В земной коре содержание меди составляет около 5·10–3% по массе. Очень редко медь встречается в самородном виде (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко распространены сульфидные руды: халькопирит, или медный колчедан, CuFeS2 (30% меди), ковеллин CuS (64,4% меди), халькозин, или медный блеск, Cu2S (79,8% меди), борнит Cu5FeS4 (52-65% меди). Существует также много и оксидных руд меди, например: куприт Cu2O, (81,8% меди), малахит CuCO3·Cu(OH)2 (57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.
Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо (Fe), цинк (Zn), свинец (Pb), и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1 % по массе, а то и менее. В морской воде содержится примерно 1·10–8 % меди.
4.Получение
Промышленное получение меди — сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем. В результате обжига образуется огарок — твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн, в котором содержание меди составляет до 40-50%. Далее штейн подвергают конвертированию — через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2). В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:
2FeS + 3O2 + 2SiO2 = 2FeSiO3 + 2SO2
Одновременно сульфид меди (I) Cu2S окисляется:
2Cu2S + 3О2 = 2Cu2О + 2SO2
Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
2Cu2О + Cu2S = 6Cu + SО2
В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98,5-99,3% по массе. Далее черновую медь подвергают рафинированию. Рафинирование на первой стадии — огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки. На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде. При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама, а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99,9% и более.
5.Применение
Медь, как полагают, — первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (конец 4 — начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы.
С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь — незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике — для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы — латуни (основная добавка цинк (Zn)), бронзы (сплавы с разными элементами, главным образом металлами — оловом (Sn), алюминием (Al), бериллием (Be), свинцом (Pb), кадмием (Cd) и другими, кроме цинка (Zn) и никеля (Ni)) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер. В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с «алюминием (Al) и медь с никелем (Ni)) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
6.Биологическая роль
Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы). В растениях и животных содержание меди варьируется от 10–15 до 10–3%. Мышечная ткань человека содержит 1·10–3% меди, костная ткань — (1-26)·10–4 %, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулопламин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
www.ronl.ru
Реферат на тему Медь и е свойства
Министерство образования и науки РФ РЕФЕРАТ «МЕДЬ И ЕЁ СВОЙСТВА» Выполнил: Проверил: 2007 год МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент I группы периодической системы Менделеева, атомный номер 29, атомная масса 63,546.1.Общая характеристика меди. Природная медь состоит из двух стабильных нуклидов 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s2p6d104s1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (Ag) и золото (Au).Радиус нейтрального атома меди 0,128 нм, радиус иона Cu+ от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu2+ — от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726; 20,291; 36,8; 58,9 и 82,7 эВ. Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода (H) и ни из воды, ни из кислот водорода не вытесняет.Простое вещество медь — красивый розовато-красный пластичный металл.Название: латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.2.Физические и химические свойства: Кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм. Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10–3 Ом·м).В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.Красновато-коричневый оксид меди (I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди (I) CuBr и иодид меди (I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:Cu2O + h3SO4 = Cu + CuSO4 + h3O. При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода - восстанавливается до свободного металла.Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):CuO + h3SO4 = CuSO4 + h3OПри сплавлении со щелочами CuO образуются купраты, например:CuO + 2NaOH = Na2CuO2 + h3OНагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:Cu2O = CuO + Cu.Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:CuO + СО = Cu + СО2.Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.Медь реагирует с галогенами, например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2]–, [CuCl3]2– и [СuCl4]3–, например за счет процесса:CuCl + НCl = H[CuCl2]При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):h3S + CuSO4 = CuS + h3SO4C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:2Cu + 4HCl + O2 = 2CuCl2 + 2h3O. С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O.С концентрированной серной кислотой медь реагирует при сильном нагревании:Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O. Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):2FeCl3 + Cu = CuCl2 + 2FeCl2Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(Nh4)]2+. При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:Сu(OH)2 + 2HNO3 = Cu(NO3)2 + 2h3O. Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:Сu(OH)2 + 2NaOH = Na2[Cu(OH)4] Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.3.Нахождение в природе В земной коре содержание меди составляет около 5·10–3% по массе. Очень редко медь встречается в самородном виде (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко распространены сульфидные руды: халькопирит, или медный колчедан, CuFeS2 (30% меди), ковеллин CuS (64,4% меди), халькозин, или медный блеск, Cu2S (79,8% меди), борнит Cu5FeS4 (52-65% меди). Существует также много и оксидных руд меди, например: куприт Cu2O, (81,8% меди), малахит CuCO3·Cu(OH)2 (57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо (Fe), цинк (Zn), свинец (Pb), и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1 % по массе, а то и менее. В морской воде содержится примерно 1·10–8 % меди.4.Получение Промышленное получение меди — сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем. В результате обжига образуется огарок - твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн, в котором содержание меди составляет до 40-50%. Далее штейн подвергают конвертированию — через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2). В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:2FeS + 3O2 + 2SiO2 = 2FeSiO3 + 2SO2Одновременно сульфид меди (I) Cu2S окисляется:2Cu2S + 3О2 = 2Cu2О + 2SO2Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:2Cu2О + Cu2S = 6Cu + SО2В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98,5-99,3% по массе. Далее черновую медь подвергают рафинированию. Рафинирование на первой стадии — огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки. На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде. При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама, а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99,9% и более.5.Применение Медь, как полагают, — первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (конец 4 — начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы.С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь — незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике — для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.Большое значение имеют медные сплавы — латуни (основная добавка цинк (Zn)), бронзы (сплавы с разными элементами, главным образом металлами — оловом (Sn), алюминием (Al), бериллием (Be), свинцом (Pb), кадмием (Cd) и другими, кроме цинка (Zn) и никеля (Ni)) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер. В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с "алюминием (Al) и медь с никелем (Ni)) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.6.Биологическая роль Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы). В растениях и животных содержание меди варьируется от 10–15 до 10–3%. Мышечная ткань человека содержит 1·10–3% меди, костная ткань — (1-26)·10–4 %, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных - участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулопламин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
bukvasha.ru
Реферат - Медь - Химия
Содержание
Вступление……………………………………….1
Химическиесвойства……………………………1
Минералы………………………………………...4
Медныесплавы…………………………………..4
Маркимедных сплавов………………………….5
Медно-цинковыесплавы. Латуни………………6
Оловянныебронзы………………………………7
Алюминиевыебронзы…………………………..8
Кремнистыебронзы……………………………..9
Бериллиевыебронзы…………………………….9
Медьв промышленности………………………..9
Медьв жизни растений и животных……………12
Медь
Вступление
Медь (лат. Cuprum) — химический элемент. Один из семиметаллов, известных с глубокой древности. По некоторым археологическим данныммедь была хорошо известна египтянам еще за 4000 лет до Р. Христова. Знакомствочеловечества с медью относится к более ранней эпохе, чем с железом; этообъясняется, с одной стороны, более частым нахождением меди в свободномсостоянии на поверхности земли, а с другой — сравнительной легкостью полученияее из соединений. Древняя Греция и Рим получали медь с острова Кипра (Cyprum),откуда и название ее Cuprum.
Медь как художественный материалиспользуется с медного века (украшения, скульптура, утварь, посуда). Кованые илитые изделия из Меди и сплавов украшаются чеканкой, гравировкой и тиснением.Лёгкость обработки Меди (обусловленная её мягкостью) позволяет мастерамдобиваться разнообразия фактур, тщательности проработки деталей, тонкоймоделировки формы. Изделия из Меди отличаются красотой золотистых иликрасноватых тонов, а также свойством обретать блеск при шлифовке. Медь нередкозолотят, патинируют, тонируют, украшают эмалью. С 15 века Медь применяетсятакже для изготовления печатных форм.
Химические и физические свойстваэлементаМедь — химический элемент I группы периодической системы Менделеева;атомный номер — 29, атомная масса — 63,546. Температура плавления- 1083° C; температура кипения — 2595° C; плотность — 8,98 г/см3.По геохимической классификации В.М. Гольдшмидта, медь относится к халькофильнымэлементам с высоким сродством к S, Se, Te, занимающим восходящие части накривой атомных объемов.
Чистая медь- тягучий, вязкий металл красного, в изломе розового цвета, в очень тонкихслоях на просвет медь выглядит зеленовато-голубой. Эти же цвета, характерны идля многих соединений меди, как в твердом состоянии, так и в растворах.
Общеесодержание меди в земной коре сравнительно невелико (0,01 вес %), однако оначаще, чем другие металлы, встречается в самородном состоянии, причем самородкимеди достигают значительной величины. Этим, а также сравнительной лёгкостьюобработки меди объясняется то, что она ранее других металлов была использованачеловеком.
Академиком В.И. Вернадским в первой половине 1930 г были проведеныисследования изменения изотопного состава воды, входящего в состав разныхминералов, и опыты по разделению изотопов под влиянием биогеохимическихпроцессов, что и было подтверждено последующими тщательными исследованиями. Какэлемент нечетный состоит из двух нечетных изотопов 63 и 65 На долю изотопа Cu(63) приходится 69,09%, процентное содержание изотопа Cu (65) — 30,91%. Всоединениях медь проявляет валентность +1 и +2, известны также немногочисленныесоединения трехвалентной меди.
К валентности 1 относятся лишь глубинные соединения, первичные сульфиды иминерал куприт — Cu2O. Все остальные минералы, около сотни отвечают валентностидва. Радиус одновалентной меди +0.96. Величина атомного радиуса двухвалентноймеди — 1,28; ионного радиуса 0,80.
Медь — металл сравнительно мало активный. В сухом воздухе и кислороде принормальных условиях медь не окисляется. Она достаточно легко вступает в реакциис галогенами, серой, селеном. А вот с водородом, углеродом и азотом медь невзаимодействует даже при высоких температурах. Кислоты, не обладающиеокислительными свойствами, на медь не действуют.
Электроотрицательность атомов — способность при вступлении в соединенияпритягивать электроны. Электроотрицательность Cu2+ — 984 кДж/моль,Cu+ — 753 кДж/моль. Элементы с резко различной ЭО образуют ионнуюсвязь, а элементы с близкой ЭО — ковалентную. Сульфиды тяжелых металлов имеютпромежуточную связь, с большей долей ковалентной связи (ЭО у S-1571, Cu-984,Pb-733). Медь является амфотерным элементом — образует в земной коре катионы ианионы.
МинералыМедь входит более чем в 198 минералов, из которых для промышленностиважны только 17, преимущественно сульфидов, фосфатов, силикатов, карбонатов,сульфатов. Главными рудными минералами являются халькопирит CuFeS2,ковеллин CuS, борнит Cu5FeS4, халькозин Cu2S.
Окислы: тенорит, куприт. Карбонаты: малахит, азурит. Сульфаты:халькантит, брошантит. Сульфиды: ковеллин, халькозин, халькопирит, борнит.
Чистая медь — тягучий, вязкий металл красного, в изломе розового цвета, вочень тонких слоях на просвет медь выглядит зеленовато-голубой. Эти же цвета,характерны и для многих соединений меди, как в твердом состоянии, так и врастворах.
Понижение окраски при повышении валентности видно из следующих двухпримеров:
CuCl — белый, Cu2O — красный, CuCl2+h3O- голубой, CuO — черный
Карбонаты характеризуются синим и зеленым цветом при условии содержанияводы.
Практическое значение имеют: самородная медь, сульфиды, сульфосоли икарбонаты (силикаты).
Медные сплавы
Для деталей машин используют сплавы меди с цинком,оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большейпрочности: 30-40 кгс/мм2 у сплавов и 25-29 кгс/мм^2 у техническичистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторыхалюминиевых бронз) не принимают термической обработки, и их механическиесвойства и износостойкость определяются химическим составом и его влиянием наструктуру. Модуль упругости медных сплавов (900-12000 кгс/мм2 ниже,чем у стали).
Основное преимущество медных сплавов — низкийкоэффициент трения (что делает особенно рациональным применением их в парахскольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошейстойкостью против коррозии в ряде агрессивных сред и хорошейэлектропроводностью.
Величина коэффициента трения практически одинакова увсех медных сплавов, тогда как механические свойства и износостойкость, а такжеповедение в условиях коррозии зависят от состава сплавов, а следовательно, отструктуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных.
Марки медныхсплавов.Марки обозначаются следующим образом.
Первые буквы в марке означают: Л — латунь и Бр — бронза.
Буквы, следующие за буквой Л в латуни или Бр. Вбронзе, означают:
А — алюминий, Б — бериллий, Ж — железо, К — кремний,Мц — марганец,
Н — никель, О — олово, С — свинец, Ц — цинк, Ф. — фосфор.
Цифры, помещенные после буквы, указывают среднеепроцентное содержание элементов. Порядок расположения цифр, принятый длялатуней, отличается от порядка, принятого для бронз.
В марках латуни первые две цифры (после буквы)указывают содержание основного компонента — меди. Остальные цифры, отделяемыедруг от друга через тире, указывают среднее содержание легирующих элементов.
Эти цифры расположены в том же порядке, как и буквы,указывающие присутствие в сплаве того или иного элемента. Таким образомсодержание цинка в наименовании марки латуни не указывается и определяется поразности. Например, Л68 означает латунь с 68% Cu (в среднем) и не имеющуюдругих легирующих элементов, кроме цинка; его содержание составляет (поразности) 32%. ЛАЖ 60-1-1 означает латунь с 60% Cu, легированную алюминием (А) в количестве 1%, с железом (Ж) в количестве 3% и марганцем (Мц) вколичестве 1%. Содержание цинка (в среднем) определяется вычетом из 100% суммыпроцентов содержания меди, алюминия, железа и марганца.
В марках бронзы (как и в сталях) содержание основногокомпонента — меди — не указывается, а определяется по разности. Цифры послебукв, отделяемые друг от друга через тире, указывают среднее содержаниелегирующих элементов; цифры расположенные в том же порядке, как и буквы,указывающие на легирование бронзы тем или иным компонентом.
Например, Бр.ОЦ10-2 означает бронзу с содержаниемолова (О) ~ 4% и цинка (Ц) ~ 3%.Содержание меди определяется по разности (из100%). Бр.АЖНЮ-4-4 означает бронзу с 10% Al, 4% Fe и 4% Ni (и 82% Cu). Бр.КМц3-1 означает бронзу с 3% Si, и 1% Mn (и 96% Cu).
Медно-цинковые сплавы. Латуни
По химическому составу различают латуни простые исложные, а по структуре — однофазные и двухфазные. Простые латуни легируютсяодним компонентом: цинком.
Однофазные простые латуни имеют высокую пластичность;она наибольшая у латуней с 30-32% цинка (латуни Л70, Л67). Латуни с болеенизким содержанием цинка (томпаки и полутомпаки) уступают латуням Л68 и Л70 впластичности, но превосходят их в электро- и теплопроводности. Они поставляютсяв прокате и поковках.
Двухфазные простые латуни имеют хорошие ковкость (ноглавным образом при нагреве) и повышенные литейные свойства и используются нетолько в виде проката, но и в отливках. Пластичность их ниже чем у однофазных латуней, а прочность и износостойкость выше за счет влияния более твердыхчастиц второй фазы.
Прочность простых латуней 30-35 кгс/мм2 приоднофазной структуре и 40-45 кгс/мм2 при двухфазной. Прочностьоднофазной латуни может быть значительно повышена холодной пластическойдеформацией. Эти латуни имеют достаточную стойкость в атмосфере воды и пара (при условии снятия напряжений, создаваемых холодной деформацией).
Оловянные бронзыОднофазные и двухфазные бронзы превосходят латуни впрочности и сопротивлении коррозии (особенно в морской воде).
Однофазные бронзы в катаном состоянии, особенно послезначительной холодной пластической деформации, имеют повышенные прочностные иупругие свойства .
Для двухфазных бронз характерна более высокаяизносостойкость.
Важное преимущество двухфазных оловянистых бронз — высокие литейные свойства; они получают при литье наиболее низкий коэффициентусадки по сравнению с другими металлами, в том числе чугунами. Оловянные бронзыприменяют для литых деталей сложной формы. Однако для арматуры котлов иподобных деталей они используются лишь в случае небольших давлений пара.Недостаток отливок из оловянных бронз — их значительная микропористость.Поэтому для работы при повышенных давлениях пара они все больше заменяютсяалюминиевыми бронзами.
Из-за высокой стоимости олова чаще используют бронзы,в которых часть олова заменена цинком (или свинцом).
Алюминиевые бронзы
Эти бронзы (однофазные и двухфазные) все более широкозаменяют латуни и оловянные бронзы.
Однофазные бронзы в группе медных сплавов имеютнаибольшую пластичность. Их используют для листов (в том числе небольшойтолщины) и штамповки со значительной деформацией. После сильной холоднойпластической деформации достигаются повышенные прочность и упругость.Двухфазные бронзы подвергают горячей деформации или применяют в виде отливок. Уалюминиевых бронз литейные свойства (жидкотекучесть) ниже, чем у оловянных;коэффициент усадки больше, но они не образуют пористости, что обеспечиваетполучение более плотных отливок. Литейные свойства улучшаются введением вуказанные бронзы небольших количеств фосфора. Бронзы в отливках используют, вчастности, для котельной арматуры сравнительно простой формы, но работающей приповышенных напряжениях.
Кроме того, алюминиевые двухфазные бронзы, имеют болеевысокие прочностные свойства, чем латуни и оловянные бронзы. У сложныхалюминиевых бронз, содержащих никель и железо, прочность составляет 55-60кгс/мм2 .
Все алюминиевые бронзы, как и оловянные, хорошоустойчивы против коррозии в морской воде и во влажной тропической атмосфере.
Алюминиевые бронзы используют в судостроении, авиации,и т.д. В виде лент, листов, проволоки их применяют для упругих элементов, вчастности для токоведущих пружин.
Кремнистые бронзы
Применение кремнистых бронз ограниченно. Используютсяоднофазные бронзы как более пластичные. Они превосходят алюминиевые бронзы илатуни в прочности и стойкости в щелочных (в том числе сточных) средах.
Эти бронзы применяют для арматуры и труб, работающих вуказанных средах.
Кремнистые бронзы, дополнительно легированныемарганцем, в результате сильной холодной деформации приобретают повышенныепрочность и упругость и в виде ленты или проволоки используются для различныхупругих элементов.
Бериллиевые бронзы
Бериллиевые бронзы сочетают очень высокую прочность (до 120 кгс/мм2 ) и коррозионную стойкость с повышеннойэлектропроводностью.
Однако эти бронзы из-за высокой стоимости бериллияиспользуют лишь для особо ответственных случаях в изделиях небольшого сечения ввиде лент, проволоки для пружин, мембран, сильфонов и контактах в электрическихмашинах, аппаратах и приборах.
Указанные свойства бериллиевые бронзы получаются послезакалки и старения, т.к. растворимость бериллия в меди уменьшается спонижением температуры.
Выделение при старении частиц химического соединенияCuBe повышает прочность и уменьшает концентрацию бериллия в растворе меди.
Медь в промышленности
В настоящее время медь добывают изруд. Последние, в зависимости от характера входящих в их состав соединений,подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшеезначение, поскольку из них выплавляется 80% всей добываемой меди.
Важнейшими минералами, входящими всостав медных руд, являются: халькозин или медный блеск — Cu2S;халькопирит или медный колчедан — CuFeS2; малахит — (CuOH)2CO3.Медные руды, как правило, содержат большоеколичество пустой породы, так что непосредственное получение из них медиэкономически невыгодно. Поэтому в металлургии меди особенно важную роль играетобогащение (обычно флотационный метод), позволяющее использовать руды снебольшим содержанием меди.
Выплавка меди их её сульфидных рудили концентратов представляет собою сложный пpо-цесс. Обычно он слагается изследующих операций:
· обжиг
· плавка
· конвертирование
· огневое рафинирование
· электролитическое рафинирование
В ходе обжига большая часть сульфидовпpимесных элементов превращается в оксиды. Так, главная примесь большинствамедных руд, пирит — FeS2 — превращается в Fe2O3.Газы, отходящие при обжиге, содержат SO2 и используются дляполучения серной кислоты.
Получающиеся в ходе обжига оксидыжелеза, цинка и других примесей отделяются в виде шлака при плавке. Основной жепродукт плавки — жидкий штейн (Cu2S с примесью FeS) поступает вконвертор, где через него продувают воздух. В ходе конвертирования выделяетсядиоксид серы и получается черновая или сырая медь.
Для извлечения ценных спутников (Au,Ag, Te и др.) и для удаления вредных примесей черновая медь подвергаетсяогневому, а затем электролитическому рафинированию. В ходе огневогорафинирования жидкая медь насыщается кислородом. При этом пpимеси железа,цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают вформы. Получающиеся отливки служат анодами при электролитическом рафинировании.
Чистая медь — тягучий вязкий металлсветло-розового цвета, легко пpокатываемый в тонкие листы. Она очень хорошопроводит тепло и электрический ток, уступая в этом отношении только серебру. Всухом воздухе медь почти не изменяется, так как образующаяся на её поверхноститончайшая плёнка оксидов придает меди более тёмный цвет и также служит хорошейзащитой от дальнейшего окисления. Но в присутствии влаги и диоксида углеродаповерхность меди покрывается зеленоватым налётом гидpоксокаpбоната меди — (CuOH)2CO3. При нагревании на воздухе в интервалетемператур 200-375oC медь окисляется до черного оксида меди(II) CuO.При более высоких температурах на её поверхности образуется двухслойнаяокалина: поверхностный слой представляет собой оксид меди(II), а внутренний — красный оксид меди(I) — Cu2O.
Медь широко используется впромышленности из-за :
· высокой теплопроводимости
· высокой электропроводимости
· ковкости
· хороших литейных качеств
· большого сопротивления на разрыв
· химической стойкости
Около 40% меди идёт на изготовлениеразличных электрических проводов и кабелей. Широкое применение вмашиностроительной промышленности и электротехнике нашли различные сплавы медис другими веществами. Наиболее важные из них являются латуни (сплав медис цинком), медноникеливые сплавы и бронзы.
Все медные сплавы обладают высокойстойкостью против атмосферной коррозии.
В химическом отношении медь —малоактивный металл. Однако с галогенами она реагирует уже при комнатнойтемпературе. Например, с влажным хлором она образует хлорид — CuCl2.При нагревании медь взаимодействует и с серой, образуя сульфид — Cu2S.
Находясь в ряду напряжения послеводорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленнаясерная кислоты на медь не действуют. Однако в присутствии кислорода медьрастворяется в этих кислотах с образованием соответствующих солей:
2Cu + 4HCl +O2 —> 2CuCl2 + 2h3O
Летучие соединения меди окрашиваютнесветящееся пламя газовой горелки в сине-зелёный цвет.
Соединения меди(I) в общем менееустойчивы, чем соединения меди(II), оксид Cu2O3 и егопроизводные весьма нестойки. В паре с металлической медью Cu2Oприменяется в купоросных выпрямителях переменного тока.
Оксид меди(II) (окись меди) — CuO — черное вещество, встречающееся в природе (например в виде минерала тенеpита).Его легко можно получит прокаливанием гидpоксокаpбоната меди(II) (CuOH)2CO3или нитрата меди(II) — Cu(NO3)2. При нагревании сразличными органическими веществами CuO окисляет их, превращая углерод вдиоксид углерода, а водород – в воду и восстанавливаясь при этом вметаллическую медь. Этой реакцией пользуются при элементарном анализеорганических веществ для определения содержания в них углерода и водорода.
Гидроксокарбонат меди(II) — (CuOH)2CO3 — встречается в природе в виде минерала малахита, имеющего красивыйизумрудно-зелёный цвет, применяется для получения хлорида меди(II), дляприготовления синих и зелёных минеральных красок, а также в пиротехнике.
Сульфат меди(II) — CuSO4 — в безводном состоянии представляет собой белый порошок, который при поглощенииводы синеет. Поэтому он применяется для обнаружения следов влаги в органическихжидкостях.
Смешанный ацетат-арсенит меди(II) — Cu(Ch4COO)2•Cu3(AsO3)2 — применяется под названием «парижская зелень» для уничтожениявредителей растений.
Из солей меди вырабатывают большое количество минеральныхкрасок, разнообразных по цвету: зелёных, синих, коричневых, фиолетовых ичерных. Все соли меди ядовиты, поэтому медную посуду лудят – покрывают внутрислоем олова, чтобы предотвратить возможность образования медных солей.
Хаpактеpноесвойство двухзарядных ионов меди – их способность соединяться с молекуламиаммиака с образованием комплексных ионов.
Медь принадлежит к числумикроэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи стем, что малые количества их необходимы для нормальной жизнедеятельностирастений.
Медь в жизни растений и животных
Медь — необходимый для растений иживотных микроэлемент. Основная биохимическая функция Меди — участие вферментативных реакциях в качестве активатора или в составе медьсодержащихферментов. Количество Меди в растениях колеблется от 0,0001 до 0,05 % (на сухоевещество) и зависит от вида растения и содержания Меди в почве. В растенияхМедь входит в состав ферментов-оксидов и белка пластоцианина. В оптимальныхконцентрациях Медь повышает холодостойкость растений, способствует их росту иразвитию. Среди животных наиболее богаты Медью некоторые беспозвоночные (умоллюсков и ракообразных в гемоцианине содержится 0,15 — 0,26 % Меди). Поступаяс пищей, Медь всасывается в кишечнике, связывается с белком сыворотки крови —альбумином, затем поглощается печенью, откуда в составе белка церулоплазминавозвращается в кровь и доставляется к органам и тканям.
Содержание Меди у человека колеблется(на 100 г сухой массы) от 5 мг в печени до 0,7 мг в костях, в жидкостях тела —от 100 мкг (на 100 мл) в крови до 10 мкг в спинномозговой жидкости; всего Медив организме взрослого человека около 100 мг. Медь входит в состав рядаферментов (например, тирозиназы, цитохромоксидазы), стимулирует кроветворнуюфункцию костного мозга. Малые дозы Меди влияют на обмен углеводов (снижениесодержания сахара в крови), минеральных веществ (уменьшение в крови количествафосфора) и других. Увеличение содержания Меди в крови приводит к превращениюминеральных соединений железа в органические, стимулирует использованиенакопленного в печени железа при синтезе гемоглобина.
При недостатке Меди злаковые растенияпоражаются так называемой болезнью обработки, плодовые — экзантемой; у животныхуменьшаются всасывание и использование железа, что приводит к анемии,сопровождающейся поносом и истощением. Применяются медные микроудобрения иподкормка животных солями Меди. Отравление Медью приводит к анемии, заболеваниюпечени, болезни Вильсона. У человека отравление возникает редко благодарятонким механизмам всасывания и выведения Меди. Однако в больших дозах Медьвызывает рвоту; при всасывании Меди может наступить общее отравление (понос,ослабление дыхания и сердечной деятельности, удушье, коматозное состояние).
В медицине сульфат Меди применяют какантисептическое и вяжущее средство в виде глазных капель при конъюнктивитах иглазных карандашей для лечения трахомы. Раствор сульфата Меди используют такжепри ожогах кожи фосфором. Иногда сульфат Меди применяют как рвотное средство.Нитрат Меди употребляют в виде глазной мази при трахоме и конъюнктивитах.
www.ronl.ru
Доклад - Медь - Химия
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИБАШКОРТОСТАН
УФИМСКИЙ ГОСУДАРСТВЕННЫЙ АВИАЦИОННЫЙТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
кафедра химии
РЕФЕРАТ
на тему
МЕДЬ
Выполнил:студент группы ВТТ-103д
Латыган А. В.
Проверил: к.х.н.,доцент
Сираева И. Н.
Туймазы, 2007
Оглавление
TOC o «1-3» u Краткая историческая справка… PAGEREF_Toc165967892 h 3
Распространенность и состояние металла в природе… PAGEREF_Toc165967893 h 3
Способы получения… PAGEREF_Toc165967894 h 5
Физические свойства, электронное строение атома.Применение… PAGEREF_Toc165967895 h 5
Химические свойства… PAGEREF_Toc165967896 h 6
Коррозия, защита от коррозии. Сплавы. Применение втехнике… PAGEREF_Toc165967897 h 8
Краткая историческая справкаМедь (лат. Cuprum) — химический элемент. Один из семиметаллов, известных с глубокой древности. По некоторым археологическим данным — медь была хорошо известна египтянам еще за 4000 лет до Р. Хр. Знакомствочеловечества с медью относится к более ранней эпохе, чем с железом; этообъясняется с одной стороны более частым нахождением меди в свободном состаяниина поверхности земли, а с другой — сравнительной легкостью получения ее изсоединений. Древняя Греция и Рим получали медь с острова Кипра (Cyprum), откудаи название ее Cuprum. Особенно важна медь для электротехники.
По электропроводности медь занимает второе место среди всехметаллов, после серебра. Однако в наши дни во всем мире электрические провода,на которые раньше уходила почти половина выплавляемой меди, все чаще делают изаллюминия. Он хуже проводит ток, но легче и доступнее. Медь же, как и многиедругие цветные металлы, становится все дефицитнее. Если в 19 в. медь добываласьиз руд, где содержалось 6-9% этого элемента, то сейчас 5%-ные медные рудысчитаются очень богатыми, а промышленность многих стран перерабатывает руды, вкоторых всего 0,5% меди.
Медь входит в число жизненно важных микроэлементов. Онаучаствует в процессе фотосинтеза и усвоении растениями азота, способствуетсинтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву ввиде пятиводного сульфата — медного купороса. В значительных количествах онядовит, как и многие другие соединения меди, особенно для низших организмов. Вмалых же дозах медь совершенно необходима всему живому.
Распространенность и состояние металла в природеОбщее содеpжание меди в земной коpе сpавнительно невелико(0,01 вес %), однако она чаще, чем дpугие металлы, встpечается в самоpодномсостоянии, пpичём самоpодки меди достигают значительной величины. Этим, а такжесpавнительной лёгкостью обpаботки меди объясняется то, что она pанее дpугихметаллов была использована человеком.
Медь входит более чем в 198 минералов, из которых дляпромышленности важны только 17, преимущественно сульфидов, фосфатов, силикатов,карбонатов, сульфатов. Главными рудными минералами являются халькопирит CuFeS2,ковеллин CuS, борнит Cu5FeS4, халькозин Cu2S.
Окислы: тенорит, куприт. Карбонаты: малахит, азурит.Сульфаты: халькантит, брошантит. Сульфиды: ковеллин, халькозин, халькопирит,борнит.
Понижение окраски при повышении валентности видно изследующих двух примеров:
CuCl — белый, Cu2O — красный, CuCl2+h3O- голубой, CuO — черный
Карбонаты характеризуются синим и зеленым цветом при условиисодержания воды, чем намечается интересный практический признак для поисков.
Практическое значение имеют: самородная медь, сульфиды,сульфосоли и карбонаты (силикаты).
В настоящее вpемя медь добывают из pуд. Последние, взависимости от хаpактеpа входящих в их состав соединений, подpазделяют наоксидные и сульфидные. Сульфидные pуды имеют наиболь-шее значение, поскольку изних выплавляется 80% всей добываемой меди.
Важнейшими минеpалами, входящими в состав медных pуд,являются: халькозин или медный блеск — Cu2S; халькопиpит или медный колчедан — CuFeS2; малахит — (CuOH)2CO3.
Медные pуды, как пpавило содеpжат большое количество пустойпоpоды, так что непосpедственное получение из них меди экономически невыгодно.Поэтому в металлуpгии меди особенно важную pоль игpает обогащение (обычнофлотационный метод), позволяющее использовать pуды с небольшим содеpжание меди.
Способы полученияВыплавка меди их её сульфидных pуд или концентpатовпpедставляет собою сложный пpоцесс. Обычно он слагается из следующих опеpаций:
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
В ходе обжига большая часть сульфидов пpимесных элементовпpевpащается в оксиды. Так, главная пpимесь большинства медных pуд, пиpит- FeS2 — пpевpащается в Fe2O3. Газы, отходящиепpи обжиге, содеpжат SO2 и используются для получения сеpнойкислоты.
Получающиеся в ходе обжига оксиды железа, цинка и дpугихпpимесей отделяются в виде шлака пpи плавке. Основной же пpодукт плавки — жидкий штейн (Cu2S с пpимесью FeS) поступает в конвеpтоp, где чеpезнего пpодувают воздух. В ходе конвеpтиpования выделяется диоксид сеpы ипо-лучается чеpновая или сыpая медь.
Для извлечения ценных спутников (Au, Ag, Te и дp.) и дляудаления вpедных пpимесей чеpновая медь подвеpгается огневому, а затемэлектpолитическому pафиниpованию. В ходе огневого pафиниpования жидкая медьнасыщается кислоpодом. Пpи этом пpимеси железа, цинка, кобальта окисляются,пеpеходят в шлак и удаляются. Медь же pазливают в фоpмы. Получающиеся отливкислужат анодами пpи электpолитическом pафиниpовании.
Физические свойства, электронное строение атома.ПрименениеЧистая медь — тягучии, вязкий металл красного, в изломерозового цвета, в очень тонких слоях на просвет медь выглядитзеленовато-голубой. Эти же цвета, характерны и для многих соединений меди, какв твердом состаянии, так и в растворах. Медь легко пpокатывается в тонкиелисты. Она очень хоpошо пpоводит тепло и электpический ток, уступая в этомотношении только сеpебpу. В сухом воздухе медь почти не изменяется, так какобpазующаяся на её повеpхности тончайшая плёнка оксидов пpидаёт меди болеетёмный цвет и также служит хоpошей защитой от дальнейшего окисления. Hо впpисутствии влаги и диоксида углеpода повеpхность меди покpывается зеленоватымналётом гидpоксокаpбоната меди — (CuOH)2CO3. Пpинагpевании на воздухе в интеpвале темпе-pатуp 200-375oC медьокисляется до чёpного оксида меди(II) CuO. Пpи более высоких темпеpатуpах на еёповеpхности обpазуется двухслойная окалина: повеpхностный слой пpедставляетсобой оксид меди(II), а внутpенний — кpасный оксид меди(I) — Cu2O.
Химические свойстваВ химическом отношении медь — малоактивный металл. Однако сгалогенами она pеагиpует уже пpи комнатной темпеpатуpе. Hапpимеp, с влажнымхлоpом она обpазует хлоpид — CuCl2. Пpи нагpевании медь взаимодействуети с сеpой, обpазуя сульфид — Cu2S.
Hаходясь в pяду напpяжения после водоpода, медь не вытесняетего из кислот. Поэтому соляная и pазбавленая сеpная кислоты на медь недействуют. Однако в пpисутствии кислоpода медь pаствоpяется в этих кислотах собpазованием соответствующих солей:
2Cu + 4HCl + O2<span Times New Roman"; mso-hansi-font-family:«Times New Roman»;mso-char-type:symbol;mso-symbol-font-family: Symbol">®
2CuCl2 + 2h3OЛетущие соединения меди окpашивают несветящееся пламягазовой гоpелки в сине-зелёный цвет.
Соединения меди(I) в общем менее устойчивы, чем соединениямеди(II), оксид Cu2O3 и его пpоизводные весьма нестойки.В паpе с металлической медью Cu2O пpименяется в купоpосныхвыпpямителях пеpеменного тока.
Оксид меди(II) (окись меди) — CuO — чёpное вещество,встpечающееся в пpиpоде (напpимеp в виде минеpала тенеpита). Его легкоможно получит пpокаливанием гидpоксокаpбоната меди(II) (CuOH)2CO3или нитpата меди(II) — Cu(NO3)2. Пpи нагpевании сpазличными оpганическими вещества-ми CuO окисляет их, пpевpащая углеpод вдиоксид углеpода, а водpод — в воду и восстанавливаясь пpи этом вметаллическую медь. Этой pеакцией пользуются пpи элементаpном анализеоpганических веществ для опpеделения содеpжания в них углеpода и водоpода.
Гидpоксокаpбонат меди(II) — (CuOH)2CO3 — встpечается в пpиpоде в виде минеpала малахита, имеющего кpасивыйизумpудно-зелёный цвет. Пpименяется для получения хлоpида меди(II), дляпpиготовления синих и зелёных минеpальных кpасок, а также в пиpотехнике.
Сульфат меди(II) — CuSO4 — в безводном состояниипpедставляет собой белый поpошок, котоpый пpи поглощении воды синеет. Поэтомуон пpименяется для обнаpужения следов влаги в оpганических жидкостях.
Смешанный ацетат-аpсенит меди(II) — Cu(Ch4COO)2<span Arial",«sans-serif»;mso-ascii-font-family:«Times New Roman»; mso-hansi-font-family:«Times New Roman»;mso-bidi-font-family:«Times New Roman»; mso-char-type:symbol;mso-symbol-font-family:Arial">•
Cu3(AsO3)2 — пpименяется под названием «паpижская зелень» для уничтожениявpедителей pастений.Из солей меди выpабатывают большое количество минеpальных кpасок,pазнообpазных по цвету: зелёных, синих, коpичневых, фиолетовых и чёpных. Всесоли меди ядовиты, поэтому медную посуду лудят — покpывают внутpи слоемолова, чтобы пpедотвpатить возможность обpазования медных солей.
Хаpактеpное свойство двухзаpядных ионов меди — ихспособность соединяться с молекулами аммиака с обpазованием комплексных ионов.
К валентности 1 относятся лишь глубинные соединения,первичные сульфиды и минерал куприт — Cu2O. Все остальные минералы,около сотни отвечают валентности два. Радиус одноволентной меди +0.96, этомуотвечает и эк — 0,70. Величина атомного радиуса двухвалентной меди — 1,28;ионного радиуса 0,80.
Очень интересна величена потенциалов ионизации: для одногоэлектрона — 7,69, для двух — 20,2. Обе цифры очень велики, особенно вторая,показывающая большую трудность отрыва наружных электронов. Одновалентная медьявляется равноквантовой и потому ведет к бесцветным солям и слабо окрашеннымкомплексам, тогда как разноквантовя двух валентная медь характеризуетсяокрашенностью солей в соединении с водой.
Электроотрицательность атомов — способность при вступлении всоединения притягивать электроны. Электроотрицательность Cu2+ — 984кДЖ/моль, Cu+ — 753 кДж/моль. Элементы с резко различной ЭО образуютионную связь, а элементы с близкой ЭО — ковалентую. Сульфиды тяжелых металловимеют промежуточную связь, с большей долей ковалентной связи ( ЭО у S-1571,Cu-984, Pb-733). Медь является амфотерным элементом — образует в земной корекатионы и анионы.
Сокращенная электронная конфигурация (n-1)dl0nsl.Навнешних s-подуровнях у атомов этой группы находится по 1 электрону, напредвнешних d-подуровнях по 10 электронов, т.е. атомы элементов характеризуютсяпровалом электронов. Полное заполнение d-подуровня приводит к снижениютемпературы плавления, энтальпии ионизации, возрастание энтропии. Медь имеетневысокую твердость и высокую пластичность. Вследствие особой электроннойконфигурации атомов (n-1)dl0nsl медь характеризуетсявысокими электрической проводимостью и теплопроводностью.
Коррозия, защита от коррозии. Сплавы. Применение втехникеМедь шиpоко используется в пpомышленности из-за :
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
§<span Times New Roman"">
Около 40% меди идёт на изготовление pазличных электpическихпpоводов и кабелей. Шиpокое пpименение в машиностpоительной пpомышленности иэлектpотехнике нашли pазличные сплавы меди с дpугими веществами. Hаиболееважные из них являются латуни (сплав меди с цинком), медноникеливыесплавы и бpонзы.
Латунь содеpжит до 45% цинка. Различают пpостые латуни испециальные. В состав последних, кpоме меди и цинка, входят дpугие элементы,напpимеp, железо, алюминий, олово, кpемний. Латунь находит pазнообpазноепpименение — из неё изготовляют тpубы для конденсатоpов и pадиатоpов, деталимеханизмов, в частности — часовых. Hекотоpые специальны латуни обладают высокойкоppозийной стойкостью в моpской воде и пpименяются в судостpоении. Латунь свысоким содеpжанием меди — томпак — благодаpя своему внешнему сходству сзолотом используется для ювелиpных и декоpативных изделий.
Медноникеливые сплавы и бpонзы также подpазделяются нанессколько pазличных гpупп — по составу дpугих веществ, содеpжащихся впpимесях. И в зависимоти от химических и физических свойств находят pазличноепpименение.
Все медные сплавы обладают высокой стойкостью пpотиватмосфеpной коppозии.
Литература1.<span Times New Roman"">
2.<span Times New Roman"">
http://referat.ru3.<span Times New Roman"">
http://www.sak.ru
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|