|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Клонирование животных. Реферат клонирование
Реферат - Клонирование - Биология
Министерство общего и профессионального образования Свердловскойобласти
МОУ СОШ №24 Кировского района
<img src="/cache/referats/27246/image001.gif" v:shapes="_x0000_i1025">
<img src="/cache/referats/27246/image002.gif" v:shapes="_x0000_i1026">
<img src="/cache/referats/27246/image003.gif" v:shapes="_x0000_i1027">
Исполнитель:
ученица11класса
ШириноваА.
Руководитель:
Порубенко Н.В
Екатеринбург
2007
Содержание
I. Введение …………………………………...…………………..……2
II. Основная часть ……………………..…………………………….3
1.Теорияклонирования ………………………………………………………….4
2. Видыклонирования ……...………………………………………………...….6
3.Клонированиерастений………………...………………………………………9 4.Клонирование животных……………………………………………………...10
5.Тканевое клонирование ……………………………………………………...28 6.Задачи,стоящие перед клонированием ……………………………………...30
III. Заключение………………………………………………………33
IV. Список литературы...…………………...……………………...37
V. Приложение……………………………………………………….38
1.Хронологияклонирования………………………………………………...….38
2.Определения…………………………………………………………………...41
3.Схемы клонирования…………………………………………………………42
Введение
В последние десятилетияпрошлого века происходило бурное развитие одной из интереснейших ветвейбиологической науки — молекулярной генетики. Уже в начале 1970-х годов возниклоновое направление генетики — генная инженерия. На основе ее методологии началиразрабатываться различного рода биотехнологии, создаваться генетическиизмененные организмы. Появилась возможность генной терапии некоторыхзаболеваний человека. К настоящему времени учеными сделано множество открытий вобласти клонировании животных из соматических клеток, которые успешноприменяются на практике.
Идея клонирования Homo sapiens ставит перед человечествомтакие проблемы, с какими оно прежде не сталкивалось. Так развивается наука, чтокаждый ее новый шаг несет с собой не только новые, неведомые ранее возможности,но и новые опасности.
Клонирование человека сейчас уже оченьблизко к реальности благодаря историческому научному прорыву д-ра Яна Вильмутаи его коллег из Великобритании. Эта возможность потенциально дает всем намневероятные преимущества. К сожалению, на обсуждение этой темы с самого началаоказывали влияние сенсационные, но вводящие в заблуждение сообщения СМИ, иобщая негативная эмоциональная реакция, порожденная ошибочной научнойфантастикой. Отрицательное отношение к клонированию людей — больше следствиезахватывающей дух новизны идеи, чем каких-либо реальных нежелательныхпоследствий. При разумном регулировании преимущества клонирования людейсущественно перевесили бы недостатки. Если введенная в заблуждениеобщественность наложит полный запрет на клонирование человека, это оказалось быпечальным эпизодом в человеческой истории.
1.Теория клонирования
Термин клон происходит от греческого слова «klon», что означает веточка, побег, отпрыск. Клонированию можно давать много определений, вот некоторые самые распространенные из них, клонирование– популяция клеток или организмов произошедших от общего предка путём бесполого размножения, причём потомок при этом генетически идентичен своему предку. Клонирование– образование идентичных потомков (клонов) путём бесполого размножения.Результатом клонирования является популяция клеток или организмов с одинаковымнабором генов (генотип).
Воспроизводство организмов полностью повторяющих особь, возможно только в том случае, если генетическая информация матери будет без каких-либо изменений передана дочерям. Но при естественном половом размножении этому препятствует мейоз. В ходе этого незрелая яйцеклетка, имеющая двойной,или диплоидный набор хромосом – носителей наследственной информации –делиться дважды и в результате образуются четыре гаплоидных, с одинарным набором хромосом, клетки.Три из них дегенерируют, а четвёртая с большим запасом питательных веществ,становится яйцеклеткой. У многих животных она в силу гаплоидности не может развиваться в новый организм. Для этого необходимо оплодотворение.Организм, развившийся из оплодотворенной яйцеклетки, приобретает признаки, которые определяются взаимодействием материнской и отцовской наследственности.Следовательно, при половом размножении мать не может быть повторена в потомстве.
Как же вопреки этой строгой закономерности заставить клетку развиваться только с материнским диплоидным набором хромосом? Теоретически решение этой трудной биологической проблемы найдено.
Для процедуры клонирования (иликопирования) используется молекула ДНК того живого существа, котороепредполагается копировать. Молекула ДНК заимствуется из одного живого организмаи вживляется внутрь яйцеклетки другого живого существа того же вида. Тотчас жепосле этого процесса вживленияприменяется электрический шок, которыевызывает начало стремительного процесса деления яйцеклетки. Таким образом,внутри яйцеклетки формируется эмбрион, зародыш. Эмбрион, продолжающий делиться,помещают в матку любого животного того же вида и ждут, пока созревающее внутриживого существа животное не родится на свет.
Клонирование происходит в три основных этапа:
1. Из яйцеклетки самкиполностью удаляется ДНК. Таким образом, клетка становится пустой оболочкой,которая не имеет генетической информации.
2. В эту пустую оболочкувводится предварительно реактивированная зрелая клетка (клетка-донор).
3. Оплодотвореннаяяйцеклетка пересаживается в матку самки (суррогатной матери). Плод, которого донори клон генетически идентичны, как и однояйцовые близнецы. Близнецы тождественныгенетически, однако, подрастая, часто оказываются совершенно разнымиличностями. Это отличие вызвано:
Донор и клон генетическиидентичны, как и однояйцовые близнецы. Близнецы тождественны генетически,однако, подрастая, часто оказываются совершенно разными личностями. Это отличиевызвано:
а)уникальностью души, как следствие, характеров; б) различием жизненного опыта.
Единственнаяразница между близнецом и клоном заключается в том, что близнецы — ровесники, аклон отделен от матрицы поколением или, если быть более точным, возрастомдонорской клетки.
2.Виды клонирования
На сегодняшний день известно несколько видовклонирования, среди которых наиболее близким к естественному размножениюявляется эмбриональное клонирование. Входе этого процесса создается дубликат плода, который сформирован в маткематери естественным путем. Ученые научились делить зиготу на ранней стадии ееразвития на две и более частей. В результате такого разделения появляется клонпервоначальной зиготы, и обе зиготы впоследствии вырастают в близнецов,рожденных путем эмбрионального клонирования. В природе сходные процессы нередкопроисходят и без участия человека, когда появляются на свет однояйцовыеблизнецы. Таким образом, путем эмбрионального клонирования можно получить клонребенка еще на эмбриональном этапе его развития. Однако в настоящее время основное внимание исследователейсосредоточено на клонировании путемпересадки ядер. Между учеными существуют большие разногласия по поводутого, являются ли полученные таким способом особи клоном в полном смысле этогослова. Дело в том, что эукариотическая клетка, обладающая оформленным клеточнымядром, содержит два различных генома. Геномом называется совокупность генов,содержащихся в одинарном наборе хромосом данного организма. Один из нихнаходится в ядре (яДНК) и наследуется в соответствии с законами Менделя. Другойрасполагается в митохондриях (мДНК) и передается через цитоплазму яйцеклетки.Этот процесс называется цитоплазматической наследственностью. При клонировании млекопитающих путемпересадки ядер донорская соматическая клетка под воздействием электрическоготока целиком сливается с цитоплазмой безъядерной яйцеклетки. В результатетакого слияния в яйцеклетку переносится как яДНК, так и мДНК донорской клетки. Таким образом, гибридная клетка содержит мДНК как из донорской, так и из реципиентнойцитоплазмы.
До недавнего времени для подтвержденияпересадки ядер и происхождения полученных особей изучалась только их яДНК. Лишьнедавно ученые начали детально изучать геном митохондрий и влияние цитоплазматическойнаследственности. Взависимости от целей, поставленных перед исследователями, клонирование путемпересадки ядер бывает репродуктивным и терапевтическим. Репродуктивное клонирование – это искусственное воспроизведение влабораторных условиях генетически точной копии любого живого существа. Цельюрепродуктивного клонирования является создание клона – генетической копииживущего или даже давно умершего существа. Овечка Долли стала первым примеромподобного клонирования крупного животного. Весь этот процесс состоит изнескольких стадий. Сначала у женской особи берется яйцеклетка, из котороймикроскопической пипеткой вытягивается ядро. Затем в безъядерную яйцеклеткувводится любая клетка, содержащая ДНК клонируемого организма. Фактически, онаимитирует роль сперматозоида при оплодотворении яйцеклетки. С момента слиянияклетки с яйцеклеткой начинается процесс размножения клеток и рост эмбриона. Репродуктивное клонирование имеет огромное научное и прикладное значение дляживотноводства, но если речь идет о клонировании человека, то оно единодушноосуждается общественностью и подавляющим большинством ученых.
Во многих странах, включая Россию,репродуктивное клонирование человека с целью получения детей-клонов запрещенозаконом. В Великобритании подобное клонирование человека карается тюремнымзаключением сроком до 10 лет. Терапевтическое клонирование отличается отрепродуктивного клонирования тем, что по прошествии двух недель роста эмбрионапроцесс размножения клеток искусственно прерывается.
Помнению большинства ученых, после 14-дневного срока в эмбриональных клеткахначинает развиваться центральная нервная система и конгломерат клеток (эмбрион,бластоцист) уже следует считать живым существом. Ещеодно отличие терапевтическогоклонирования от репродуктивного заключается в изначальной цели этогопроцесса. Целью терапевтического клонирования является получение не клоновживых существ, а так называемых эмбриональных стволовых клеток (ЭСК). В ходеисследований было установлено, что образующиеся в течение первых 14 дней ЭСКспособны в дальнейшем превращаться в специфические тканевые клетки отдельныхорганов (сердца, почек, печени, поджелудочной железы и т.д.) и использоваться вмедицине для терапии многих заболеваний. Законодательство Великобританииразрешает проводить терапевтическое клонирование и исследовать возможностидальнейшего применения стволовых клеток в медицинских целях. В России многиеученые, например, академик РАМН Н.П.Бочков, профессор Института молекулярнойгенетики В.З.Тарантул, предпочитают не употреблять термин «терапевтическоеклонирование» и называют этот процесс «клеточным размножением». Каковыже перспективы терапевтического клонирования?
Помнению исследователей, получение в большом количестве ЭСК даст возможностьмедикам лечить диабет, болезнь Паркинсона, болезнь Альцгеймера, инфарктмиокарда, болезни почек, печени, заболевания костей, крови и многие другиеболезни.
3.Клонирование растений
Клонирование, прежде всего, изначально относится к вегетативному размножению. Клонирование растений черенками, почками или клубнями известно уже более 4 тысяч лет. Начиная с 70-х гг. нашего столетия для клонирования растений стали широко использовать небольшие группы и даже соматические (неполовые) клетки.
Дело в том, что у растений в отличие от животных по мере их роста, в ходе клеточной специализации – дифференцировки – клетки не теряют так называемые тотипотентные свойства, то есть, не теряют своей способности реализовывать всю генетическую информацию, заложенную в ядре. Поэтому практически любая растительная клетка,сохранившее в процессе дифференцировки своё ядро, может дать начало новому оргазму. Эта особенность растительных клеток лежит в основе многих методов генетики и селекции.
При вегетативном размножении и при клонировании гены не распределяются по потокам, как в случае полового размножения, а сохраняются в полном составе в течение многих поколений. Все организмы, входящие в состав определённого клона имеют одинаковый набор генов и фенотипически не различаются между собой.
Клетки животных, дифференцируясь, лишаются тотипотенстности, и в этом, одно из существенных отличий от клеток растений. Как будет показано ниже именно здесь главное препятствие для клонирования взрослых позвоночных животных.
4.Клонирование животных
Клонирование шелкопряда
В изобретение клонирования животных, несомненно, надо отдать должное русским учёным. Сто лет тому назад русский зоолог московского университета А.А.Тихомиров впервые открыл, что яички тутового шелкопряда в результате различных химических и физических воздействий начинают развиваться без оплодотворения.
Однако это развитие,названное партеногенезом, рано останавливалось: партеногенетические эмбрионы погибли ещё до вылупления личинок из яиц. Но это уже была прелюдия к клонированию животных.
Л.Л. Астауров в 30-е гг. в результате длительных исследований,получивших мировую известность, подобрал термическое воздействие, которое одновременно активизировало неоплодотворённое яйцо к развитию и блокировало стадию мейоза, то есть превращение диплоидного ядра яйцеклетки в гаплоидное. Развитие с ядром, оставшимся диплоидным, заканчивалось вылуплением личинок, точно повторяющих генотип матери, включая и пол. Так, в результате амейотического партеногенеза были получены первые генетические копии, идентичные матери.
Количество вылупившихся партеногенетических гусениц находилось в зависимости от жизнеспособности матери.
Поэтому у «чистых» пород вылупление гусениц не превышало 1%, в то время как у значительно более жизнеспособных межрасовых гибридов оно достигло 40-50%. Несмотря на огромный успех, автор этого метода пережил горькоеразочарование: партеногенетическое потомство характеризовалосьпониженной жизнеспособностью на эмбриональных и постэмбриональных стадияхразвития (гусеницы, куколки, бабочки). Гусеницы развивались неравномерно, срединих было много уродливых, а завитые ими коконы различались по массе.
Позже Астауров улучшил метод, применив гибридизацию между селекционными линиями.
Так он смог повысить жизнеспособность у новых клонов до нормы, но довести до этого уровня другие количественные признаки ему не удалось: например масса партеногенетических коконов не превышала 82% от массы нормальных коконов такого же генотипа.
Позднее установили причины партеногенетической депрессии и сложными методами, которые позволили накапливать «гены партеногенеза», вывели новые высоко жизнестойкие клоны самок, а позднее и партеногенетических самцов. Скрещивая таких самцов со своими «матерями» или склонными к партеногенезу самками других клонов, получили потомство с ещё большей склонностью к партеногенезу. От лучших в этом отношении самок закладывали новые клоны.
В результате многолетнего отбора удалось накопить в генотипе селекционируемых клоновневиданно большое число генов, обуславливающих высокую склонность к партеногенезу. Вылупление гусениц достигло 90%, а их жизнеспособность повысилась до 95-100%, опередив в этом отношении обычные породы и гибриды. В дальнейшем «скрестили» с помощью партеногенетических самцов два генетически резко отличающихся клона разных рас и от лучших гибридных самок вывели сверхжизнеспособные клоны.
Наконец, научились клонировать самцов тутового шелкопряда. Это стало возможным после того, как удалось получить самцов, у которых все парные гены были идентичными, или гомозиготными. Вначале таких самцов клонировали особым мужским партеногенезом (андрогенезом).Для этого воздействием гамма-лучей и высокой температуры лишали ядро яйца способности к оплодотворению. Ядро проникшего втакое яйцо сперматозоида, не встретив дееспособного женского ядра, само,удваиваясь, приступало к развитию мужского зародыша, который естественно повторял генотип отца. Таким способом ведутся мужские клоны в десятках поколениях.
Позже один из таких клонов был преобразован в обо половую линию, также состоящих из генетически идентичных (за исключением половых хромосом) теперь уже самок и самцов. Поскольку положивший начало этой линии полностью гомозиготный отец возник в результате размножения, приравненного к самооплодотворению, то сам он и линия двойников обоего пола имеют пониженную жизнеспособность.Скрещивая между собой две такие линии, стали без труда получать гибридных и высоко жизнеспособных двойников в неограниченном количестве.
Итоги клонирования шелкопряда:полученные клоны самок и самцов тутового шелкопряда для практического шелководства непригодны, но это не крах всех надежд. Целесообразно использовать клоны не для непосредственного применения в шелководческой практике, а на племя для выдающегося по продуктивности потомства. Примерная схема использования клонов в промышленном производстве выглядит следующим образом. Из большого количества коконов выбирают те, из которых развиваются выдающиеся по продуктивности самки, и от каждой получают партеногенетическое потомство,для дальнейшей работы используют партеногенетических клоны, которые повторяют высокую продуктивность матери и проявляют высокую склонность к партеногенезу.
За этим следует скрещивание сопределёнными клонированными самцами, и из полученного гибридногопоколения выбирают два производства,только те клоны, которые дали прекрасное во всех отношениях потомство. Его высокие качества обусловлены не только предшествующей селекцией, а ещё и тем, что в процессе отбора особей на высокую склонность кпартеногенезу в их генотипе образуется комплекс генов жизнеспособности, компенсирующейвредное влияние искусственного размножения. При переводе клонов на половое размножение этот комплекс, оказавшись несбалансированным, сильно повышает гетерозис.
Первые опыты на амфибияхВозможность клонирования эмбрионов позвоночных впервые была показана в конце 40-х начале 50-х гг. в опытах на амфибиях, когда российский эмбриолог Георгий Викторович Лобашов разработал метод пересадки (трансплантации) ядер в яйцеклетку лягушки. В июне 1948 года он отправил в «Журнал общей биологии» статью, написанную по материалам собственных экспериментов.Однако на беду Лобашова в августе 1948 года состоялась печально известная сессия ВАСХНИЛ, утвердившая по воле коммунистических вождей беспредельное господство в биологии малограмотного агронома Т.Д. Лысенко, и набор статьи Лобашова, принятой к печати, был рассыпан, потому что она доказывала ведущую роль ядра и содержащихся в нём хромосом в индивидуальном развитии организмов. Работу Лобашова забыли, а в
50-х гг. американские эмбриологи Бригс и Кинг выполнили сходные опыты, и приоритет достался им, как это часто случалось в истории российской науки.
Бригс и Кинг разработали микрохирургический метод пересадки ядер эмбриональных клеток с помощью тонкой стеклянной пипетки в лишённые ядра клетки (энуклеированные клетки).
Они установили, что если брать ядра из клеток зародыша на ранней стадии его развития – бластуле (бластула – стадия в развитии зародыша, представляющая собой полный шар из одного слоя клеток), то примерно в 80% случаях зародыши благополучно развиваются дальше и превращаются в нормального головастика. Если же развитие зародышей продвинулось на следующую стадию – гаструлу,то лишь менее чем в 20% случаев оперированные клеткиразвивались нормально. Эти результаты позже были подтверждены в других работах.
Большой вклад в эту область внёс английский биолог Гордон. Он первый в опытах с южноафриканской жабой Xenopus laevis в качестве донора ядер использовалне зародышевые клетки, а уже вполне специализировавшиеся клетки эпителия кишечника плавающего головастика. Ядра яйцеклеток-реципиентов он не удалял хирургическим путём, а разрушал ультрафиолетовыми лучами. В большинстве случаев реконструированные яйцеклетки не развивались, но примерно десятая часть из них образовывала эмбрионы, 5% из этих эмбрионов достигали стадии бластулы, 2,5% стадии головастика и только 1% развивалось в половозрелые особи (схема) однако появление нескольких взрослых особей в таких условиях могло быть связано с тем, что среди клеток эпителия кишечника развивающегося головастика довольно длительно присутствуют первичные половые клетки, ядра, которых могли быть использованы для пересадки. В последующих работах, как самого автора, так и других исследователей не смогли подтвердить данные этих первых опытов.
Позже Гордон модифицировал эксперимент. Поскольку большинство реконструированных яйцеклеток с ядром клетки кишечного эпителия погибают до завершения стадии гаструлы, он попробовал извлечь из них ядра на стадии бластулы и снова пересадить их в новые энуклеированные яйцеклетки, такая процедура называется «серийной пересадкой». Число зародышей с нормальным развитием после этого увеличилось, и они развивались до более поздних стадий по сравнению с зародышами, полученными в результате первичной пересадки ядер.
Затем Гордон вместе с Ласки (1970 год) стали культивировать (вне организма в питательной среде) клетки почки, лёгкого и кожи взрослых животных и использовать уже эти клетки в качестве доноров </sp
www.ronl.ru
Доклад - Клонирование - Биология
Термин «клон» происходит от греческого слова«klon», что означает — веточка, побег, черенок, и имеет отношение,прежде всего к вегетативному размножению. Клонирование растений черенками,почками или клубнями в сельском хозяйстве, в частности в садоводстве, известноуже более 4-х тыс. лет. При вегетативном размножении и при клонировании гены нераспределяются по потомкам, как в случае полового размножения, а сохраняются вполном составе в течение многих поколений.
Однако у животных есть препятствие. По мере роста ихклеток, они в ходе клеточной специализации – дифференцировки – теряют способность реализовывать всю генетическую информацию, заложенную в ядре
Впрочем, оказывается, есть ящерицы-прыгуны, которые испоконвеков размножаются именно клонированием, так как у них в роду есть толькосамки.
Хотя это не совсем клонирование, это называетсяпартогенез. Эта встречающаяся в природе (прежде всего у беспозвоночных) формаоднополого размножения предполагает развитие яйцеклеток без оплодотворения.Эксперименты по искусственному провоцированию партеногенеза начались еще вконце XIX века (работы русского зоолога Тихомирова). В дальнейшем ученые,применяя различные физико-химические раздражители, такие как растворы сильныхкислот, трение, нагрев, сумели получить партеногенез у многих животных, в томчисле млекопитающих
Возможность клонирования эмбрионов позвоночных впервыебыла показана в начале 50-х годов в опытах на амфибиях. Опыты с ними показали,что серийные пересадки ядер и культивирование клеток in vitro в какой-тостепени увеличивает эту способность.
Уже в начале 90-х была решена и проблема клонирования эмбриональных клеток млекопитающих. Реконструированные яйцеклеткикрупных домашних животных, коров или овец сначала культивируют не in vitro, a invivo — в перевязанном яйцеводе овцы — промежуточного (первого) реципиента.Затем их оттуда вымывают и трансплантируют в матку окончательного (второго)реципиента — коровы или овцы соответственно, где их развитие происходит дорождения детеныша.
Статья Уилмута с соавторами, появившаяся в начале 1997года, стала сенсационной именно потому, что впервые клональное животное (овцапо кличке Долли) появилось в результате использования донорского ядраклетки молочной железы взрослой овцы. У этого первого успешного экспериментаесть существенный недостаток — очень низкий коэффициент выхода живых особей(0,36%). Однако он доказывает возможность полноценного клонирования, (илиполучения копии взрослого человека). Остаётся лишь разрешить технические иэтические вопросы.
Самое интересное, что методология клонирования,использованная Уилмутом, была подготовлена в СССР ещё в 1987-ом году, но вАкадемии наук на это прореагировали вяло — не до того, видимо…
Первые опыты на амфибиях
Возможностьклонирования эмбрионов позвоночных впервые была показана в начале 50-х годов вопытах на амфибиях. Американские исследователи Бриггс и Кинг разработалимикрохирургический метод пересадки ядер эмбриональных клеток с помощью тонкойстеклянной пипетки в лишенные ядра (энуклеированные) яйцеклетки. Ониустановили, что если брать ядра из клеток зародыша на ранней стадии егоразвития — бластуле, то примерно в 80% случаев зародыш благополучно развиваетсядальше и превращается в нормального головастика. Если же развитие зародыша,донора ядра, продвинулось на следующую стадию — гаструлу, то лишь менее чем в20% случаев оперированные яйцеклетки развивались нормально. Эти результатыпозже были подтверждены и в других работах.
Большойвклад в эту область внес английский биолог Гердон. Он первым в опытах сюжноафриканскими жабами Xenopus laevis (1962) в качестве донора ядериспользовал не зародышевые клетки, а уже вполне специализировавшиеся клеткиэпителия кишечника плавающего головастика. Ядра яйцеклеток реципиентов он неудалял хирургическим путем, а разрушал ультрафиолетовыми лучами. В большинствеслучаев реконструированные яйцеклетки не развивались, но примерно десятая частьих них образовывала эмбрионы. 6,5% из этих эмбрионов достигали стадии бластулы,2,5% — стадии головастика и только 1% развился в половозрелых особей (рис. 1).Однако появление нескольких взрослых особей в таких условиях могло быть связанос тем, что среди клеток эпителия кишечника развивающегося головастика довольнодлительное время присутствуют первичные половые клетки, ядра которых могли бытьиспользованы для пересадки. В последующих работах как сам автор, так и многиедругие исследователи не смогли подтвердить данные этих первых опытов.
ПозжеГердон модифицировал эксперимент. Поскольку большинство реконструированныхяйцеклеток (с ядром клетки кишечного эпителия) погибают до завершения стадиигаструлы, он попробовал извлечь из них ядра на стадии бластулы и сновапересадить их в новые энуклеированные яйцеклетки (такая процедура называется«серийной пересадкой», в отличие от «первичной пересадки»).Число зародышей с нормальным развитием после этого увеличивалось, и ониразвивались до более поздних стадий по сравнению с зародышами, полученными врезультате первичной пересадки ядер.
ЗатемГердон вместе с Ласки (1970) стали культивировать in vitro (вне организма впитательной среде) клетки почки, легкого и кожи взрослых животных ииспользовать уже эти клетки в качестве доноров ядер. Примерно 25% первичнореконструированных яйцеклеток развивались до стадии бластулы. При серийныхпересадках они развивались до стадии плавающего головастика. Таким образом,было показано, что клетки трех разных тканей взрослого позвоночного (X.laevis) содержат ядра, которые могут обеспечить развитие, по крайней мере,до стадии головастика.
Всвою очередь ДиБерардино и Хофнер использовали для трансплантации ядра неделящихсяи полностью дифференцированных клеток крови — эритроцитов лягушки Ranapipiens. После серийной пересадки таких ядер 10% реконструированных яйцеклетокдостигали стадии плавающего головастика. Однако даже с помощью многократныхсерийных пересадок (более 100 клеточных циклов) реконструированные яйцеклеткидальше стадии головастика не развивались.
Такимобразом, во многих работах показано, что в случае амфибий донорами ядер могутбыть лишь зародыши на ранних стадиях развития. Некоторые авторы называютподобные эксперименты клонированием амфибий, хотя правильнее называть ихклонированием эмбрионов амфибий, так как в этом случае мы размножаем бесполым путемне взрослых животных, а зародышей.
Дифференцировкаклеток в ходе развития позвоночных сопровождается инактивацией неработающихгенов. Поэтому клетки теряют тотипотентность, дифференцировка становитсянеобратимой. В конце концов у одних клеток происходит полное репрессированиегенома, у других — в той или иной степени деградирует ДНК, а в некоторыхслучаях разрушается даже ядро. Однако наряду с дифференцированными кочеткамикультивируемыеin vitro клеточные популяции содержатмалодифференцированные стволовые клетки, которые и могут быть использованы какдоноры ядер для клонирования млекопитающих.
Опытыс амфибиями показали, что ядра различных типов клеток одного и того жеорганизма генетически идентичны и в процессе клеточной дифференцировкипостепенно теряют способность обеспечивать развитие реконструированныхяйцеклеток, однако серийные пересадки ядер и культивирование клеток in vitroв какой-то степени увеличивает эту способность.
Неудачи экспериментов смышами
Успешныеопыты с амфибиями заставили ученых задуматься о клонировании эмбрионовмлекопитающих, в частности мышей. МакКиннел в одной из своих работ отмечал, чтовсе необходимые для этого методы уже существуют, и непонятно, почему мышь досих пор не клонирована. По его мнению, первыми объектами должны были статьименно мелкие животные, такие как мышь или кролик. Однако предсказание
МакКиннеллане сбылось, хотя в конце 70-х годов опыты на мышах действительно начались ипротекали весьма драматично. К тому времени, замечу, весьма основательно былиизучены биология и генетика ранних этапов развития млекопитающих, и, вчастности, мыши как модельного объекта.
Работаметодически оказалась довольно трудной, прежде всего потому, что объемяйцеклетки у млекопитающих примерно в тысячу раз меньше, чем у амфибий. Однакоэти трудности были успешно преодолены. Экспериментаторы научилисьмикрохирургически удалять пронуклеусы из зигот (оплодотворенных яйцеклеток)мыши и пересаживать в них клеточные ядра ранних эмбрионов. Однако всеполученные разными способами зародыши мышей развивались лишь до стадиибластоцисты.
/>В 1977 году появилось сенсационное сообщение Хоппе и Илменси о том,что они получили семь взрослых самок мышей, пять из которых имели только материнский,а две — отцовский геном. Это, якобы, зависело от того, какой пронуклеус былоставлен в яйце — женский или мужской, он и определял развитие особи по типугиногенеза или андрогенеза. Их успех был связан, но описанию авторов, с тем,что, удаляя один пронуклеус, они удваивали число хромосом другого, обрабатываяяйца специальным веществом, затем выращивали полученные диплоидные гомозиготные(с двумя одинаковыми наборами генов) зародыши in vitro до стадиибластоцисты и пересаживали в матку самки-реципиента для дальнейшего развития.
Казалось,теперь можно будет быстро получать млекопитающих со 100%-ной гомозиготностью повсем генам. Это особенно важно в селекции, так как для получениясельскохозяйственных животных, в частности, крупного рогатого скота, сзакрепленными особо ценными качествами обычными приемами требуются десятки летработы.
Однако,к сожалению, данные Хоппе и Илменси подтвердить не удалось, хотя многиепытались это сделать. Оказалось, что полученные любым способом диплоидныеандрогенетические и гиногенетические зародыши мышей погибают на тех же стадиях,что и диплоидные партеногенетические (развивающиеся из неоплодотвореннойяйцеклетки) эмбрионы.
Значительноусовершенствовав методы извлечения ядер и введения их в клетку, МакГрат иСолтер провели свою серию экспериментов и сообщили, что высокий выход живыхмышей они получили, когда в качестве доноров ядер использовали зиготы, но еслидонорами были ранние эмбрионы, то реконструированные яйцеклетки, как и прежде,развивались только до стадии бластоцисты.
МетодМакГрата и Солтера стал широко использоваться разными экспериментаторами. Так,Манн и Ловел-Бадж выделяли пронуклеусы из яиц, активированных к партеногенезу,и пересаживали их энуклеированные зиготы мышей. В этих случаях эмбрионыпогибали на ранних стадиях. Если же наоборот, пронуклеусы получали изоплодотворенных яиц и пересаживали в партеногенетически активированные илишенные ядра яйца, то такие зародыши развивались нормально до рождения. Суранис соавторами установили, что если добавить женский пронуклеус из зиготы мыши кгаплоидному набору хромосом яйцеклетки, то нормального развития не происходит,добавление же мужского ядра приводит к нормальному развитию. С другой стороны,рекомбинации мужского и женского пронуклеусов из разных оплодотворенныхяйцеклеток мышей обеспечивает нормальное развитие, а комбинация двух мужскихили двух женских пронуклеусов останавливает развитие эмбриона.
Этиопыты показали, что для нормального развития млекопитающих требуются два наборахромосом — отцовский и материнский. Поэтому ни у одного из известных видовмлекопитающих не описан партеногенез. Поэтому работы Хоппе и Илменси не удалосьповторить.
Однакоэти исследователи еще дважды будоражили научное сообщество. В 1982 году онипересадили ядра клеток партеногенетических бластоцист мышей в энуклеированные зиготы.Некоторые из этих реконструированных яйцеклеток нормально развивались, и якобыбыли получены четыре взрослых самки. В свете вышесказанного эти результатывесьма маловероятны.
Гибельпартеногенетических (гиногенетических) и андрогенетических зародышей умлекопитающих связана с различной активностью в онтогенезе материнского иотцовского геномов. Механизм, регулирующий эти функциональные различия, былназван геномным импринтингом и изучался в ряде работ, где было показано, чтодля нормального развития млекопитающих требуется наличие мужского генома.Другая статья Илменси и Хоппе имела еще больший резонанс.
Авторысообщили о пересадке ядер клеток внутренней клеточной массы бластоцисты вэнуклеированные зиготы мышей и получении трех взрослых мышей (двух самок исамца), генетически идентичных донорской линии мышей. Введение ядер-доноров иудаление пронуклеусов из зиготы проводили за один прием, затемреконструированные яйцеклетки культивировали in vitro до стадиибластоцисты и пересаживали в матку самок. Из 16-ти пересаженных бластоцист триразвились во взрослых животных. В следующей работе (1982) эти же авторыиспользовали в качестве доноров ядер клетки эмбрионов еще более поздних стадий(7 суток) и будто бы получили трех половозрелых мышей. Однако никто изработающих в том же направлении не смог добиться подобных результатов, идостоверность данных Илменси и Хоппе была вновь поставлена под сомнение.
МакГрати Солтер показали, что ядра 8-клеточных зародышей и клеток внутренней клеточноймассы бластоцисты не обеспечивают развитие in vitro реконструированныхяйцеклеток даже до стадии морулы, которая предшествует стадии бластоцисты.Небольшая часть (5%) ядер 4-клеточных зародышей дает возможность развиватьсятолько до стадии морулы. В то же время 19% реконструированных яйцеклеток,содержащих ядра 2-клеточных зародышей, смогли достичь стадии морулы илибластоцисты.
Этии многие другие данные показывают, что в эмбриогенезе у мышей клеточные ядрарано теряют тотипотентность, что связано, очевидно, с очень ранней активациейгенома зародыша — уже на стадии 2-х клеток. У других млекопитающих, вчастности, у кроликов, овец и крупного рогатого скота, активация первой группыгенов в эмбриогенезе происходит позднее, на 8-16-клеточной стадии. Возможнопоэтому первые значительные успехи в клонировании эмбрионов были достигнуты надругих видах млекопитающих, а не на мышах. Тем не менее, работы с мышами,несмотря на их непростую судьбу, значительно расширили наши представления ометодологии клонирования млекопитающих.
Кролики, коровы и свиньи
Американскиеисследователи Стик и Робл, используя методику МакГрата и Солтера, получили 6живых кроликов, пересадив ядра 8клеточных эмбрионов одной породы в лишенныеядра яйцеклетки кроликов другой породы. Фенотип родившихся полностью соответствовалфенотипу донора.
Однакотолько 6 из 164 реконструированных яйцеклеток (3,7%) развились в нормальныхживотных. Это, конечно, очень низкий выход, практически не позволяющийрассчитывать на получение таким методом клона генетически идентичных животных.Ценность этой работы, тем не менее, в том, что она показала возможностьклонирования эмбрионов кроликов.
Работас реконструированными яйцеклетками крупных домашних животных, коров или овец,идет несколько по-другому. Их сначала культивируют не in vitro, a invivo — в перевязанном яйцеводе овцы — промежуточного (первого) реципиента.Затем их оттуда вымывают и трансплантируют в матку окончательного (второго)реципиента — коровы или овцы соответственно, где их развитие происходит дорождения детеныша. Уиладсин предложил заключать реконструированные яйцеклетки вагаровый цилиндр, который он затем трансплантировал в перевязанный яйцеводовцы. По данным одних авторов реконструированные зародыши лучше развиваются вяйцеклетке, чем в культуральной среде, хотя некоторые исследователи получилинеплохие результаты и при культивировании.
АмериканцыРобл и его сотрудники, используя щадящий метод извлечения ядра без прокалываниямембраны яйцеклетки, предложенный МакГратом и Солтером, пересаживали в зиготытак называемые кариопласты — мужской и женский пронуклеусы вместе с окружающейих цитоплазмой, а также ядра 2-, 4- или 8-клеточных эмбрионов коровы. Сначалазиготы центрифугировали, чтобы освободить пронуклеусы от окружающих их гранулжелтка, после чего ядра были хорошо видны под микроскопом, что значительнооблегчало их удаление. При помощи манипулятора и заостренной стеклянноймикропипетки извлекали один из бластомеров вместе с ядром из ранних зародышей ипереносили его в энуклеированную зиготу.
Реконструированныезародыши были заключены в агаровый цилиндр и пересажены в перевязанный яйцеводовцы. Через пять дней культивирования их вымывали, освобождали от агара иисследовали. Реконструктурированные зародыши в этой работе развивались только втех случаях, когда в зиготы пересаживали пронуклеусы: 17% таких зародышейдостигли стадии морулы или бластоцисты. Два зародыша были пересажены второмуреципиенту — в матку коровы, и развитие их завершилось рождением живых телят.Если в качестве доноров использовали ядра 2-, 4- или 8-клеточных зародышей, тореконструированные яйцеклетки не развивались даже до стадии морулы.
Позжебыли и более успешные работы. Уиладсин, в частности, сообщил, что ему удалосьполучить четырех генетически идентичных бычков холстейнской породы в результатепересадки в реципиентные яйцеклетки ядер бластомеров одного 32-клеточногозародыша (рис. 3). Автор утверждал, что большинство ядер сохраняеттотипотентность на 32-клеточной стадии, а значительная их часть даже на64-клеточной стадии, обеспечивая нормальное развитие реконструированныхяйцеклеток до стадии ранней бластоцисты в яйцеводе овцы. После пересадки вматку коров — окончательных реципиентов, как полагает автор, они могут и дальшенормально развиваться.
Бондиолии соавторы, используя в качестве доноров ядер 16-64-клеточные зародыши коров,трансплантировали 463 реконструированных зародыша в матку синхронизированныхреципиентов, и было получено 92 живых теленка. Семь из них были генетическиидентичны, представляя собой клон, полученный в результате пересадки ядерклеток одного донорского эмбриона.
Такимобразом, клеточные ядра зародышей крупного рогатого скота достаточно долгосохраняют тотипотентность и могут обеспечить полное развитие реконструированныхяйцеклеток. Иначе говоря, методические трудности клонирования зародышейкрупного рогатого скота практически решены. Но остается основная задача — найтидонорские ядра, обладающие тотипотентностью, для клонирования взрослыхживотных.
Клонированиюэмбрионов свиней посвящена только одна небольшая работа. Скудность данных,видимо, и связана с определенными трудностями работы с этим объектом.
Клонирование овец
Уиладсинеще в 1986 году показал, что и у эмбрионов овец на 16-клеточной стадии развитияядра сохраняют тотипотентность. Реконструированные яйцеклетки, содержащие ядрабластомеров 16-клеточных зародышей, развивались нормально до стадии бластоцистыв перевязанном яйцеводе овцы (в агаровом цилиндре), а после освобождения отагара и пересадки в матку овцы — второго реципиента — еще 60 дней. В другомслучае донорами служили ядра 8-клеточных зародышей и были получены 3 живыхягненка, фенотип которых соответствовал породе овец — доноров.
В1989 году Смит и Уилмут трансплантировали ядра клеток 16-клеточного эмбриона иранней бластоцисты в лишенные ядра неоплодотворенные яйцеклетки овец. В первомслучае было получено два живых ягненка, фенотип которых соответствовал породеовец — доноров ядер. Во втором случае один полностью сформировавшийся ягненокпогиб во время родов. Его фенотип также соответствовал породе — донору. Авторысчитали, что в ходе дифференцировки эмбриональных клеток происходит инактивациянекоторых важных для развития генов, в результате которой ядра бластоцисты ужене могут репрограммироваться в цитоплазме яйцеклетки и обеспечить нормальноеразвитие реконструированного зародыша. Поэтому, по мнению авторов, в качестведоноров ядер лучше использовать 16-клеточные эмбрионы или культивируемые invitro линии эмбриональных клеток, ядра которых обладают тотипотентностью.
Позднее,в 1993-1995 годах, группа исследователей под руководством Уилмута получила клоновец — 5 идентичных животных, донорами ядер которых была культура эмбриональныхклеток. Клеточную культуру получали следующим образом: выделялимикрохирургически эмбриональный диск из 9-дневного овечьего эмбриона(бластоцисты) и культивировали клетки in vitro в течение многих пассажей(по крайней мере до 25). Сначала клеточная культура напоминала культурустволовых недифференцированных эмбриональных клеток, но вскоре, после 2-3-хпассажей, клетки становились уплотненными и морфологически сходными сэпителиальными. Эта линия клеток из 9-дневного зародыша овцы была обозначенакак TNT4.
Чтобыдонорское ядро и реципиентная цитоплазма находились на сходных стадияхклеточного цикла, останавливали деление культивируемых клеток TNT4 наопределенной стадии (GO) и ядра этих клеток пересаживали в энуклеированныеяйцеклетки (соответственно на стадии метафазы II). Реконструированные эмбрионызаключали в агар и трансплантировали в перевязанные яйцеводы овец. Через 6 днейэмбрионы вымывали из яйцевода первого реципиента и исследовали под микроскопом.Отбирали те, которые достигли стадии морулы или бластоцисты и пересаживали их вматку овцы — окончательного реципиента, где развитие продолжалось до рождения.Родилось 5 ягнят (самок) из них 2 погибли вскоре после рождения, 3-й в возрасте10 дней, а 2 оставшихся нормально развивались и достигли 8-9-месячноговозраста. Фенотипически все ягнята были сходны с породой овец, от которойполучали исходную линию клеток TNT4. Это подтвердил и генетический анализ.
Этаработа, особенно в части культуры эмбриональных клеток, — значительноедостижение в клонировании млекопитающих, хотя она и не вызвала столь шумногоинтереса, как статья того же Уилмута с соавторами, опубликованная в начале 1997года, где сообщалось, что в результате использования донорского ядра клеткимолочной железы овцы было получено клональное животное — овца по кличке Долли.Последняя работа методически во многом повторяет предыдущее исследование 1996года, но в ней ученые использовали не только эмбриональные, но еще ифибробластоподобные клетки (фибробласты — клетки соединительной ткани) плода иклетки молочной железы взрослой овцы. Клетки молочной железы получали отшестилетней овцы породы финн дорcет, находящейся на последнем триместребеременности. Все три типа клеточных культур имели одинаковое число хромосом — 54, как обычно у овец. Эмбриональные клетки использовали в качестве доноровядер на 7-9-м пассажах культивирования, фибробластоподобные клетки плода — на4-6-м пассажах и клетки молочной железы — на 3-6-м пассажах. Деление клетоквсех трех типов останавливали на стадии GO и ядра клеток пересаживали вэнуклеированные ооциты (яйцеклетки) на стадии метафазы II. Большинствореконструированных эмбрионов сначала культивировали в перевязанном яйцеводеовцы, но некоторые и in vitroв химически определенной среде.Коэффициент выхода морул или бластоцист при культивировании in vitro водной серии опытов был даже вдвое выше, чем при культивировании в яйцеводе.(Поэтому, видимо, нет строки необходимости в промежуточном реципиенте и можнообойтись культивированием in vitro. Однако для полной уверенности в этомнужны дополнительные данные.)
Выходморул или бластоцист в серии опытов с культурой клеток молочной железы былпримерно втрое меньше, чем в двух других сериях, когда в качестве доноров ядериспользовали культуру фибробластов плода или эмбриональных клеток. Число живыхягнят в сравнении с числом пересаженных в матку окончательного реципиента морулили бластоцист было также в два раза ниже. В серии опытов с клетками молочнойжелезы из 277 реконструированных яйцеклеток был получен только один живойягненок, что говорит об очень низкой результативности такого рода экспериментов(0,36%). Анализ генетических маркеров всех семи родившихся в трех серияхэкспериментов живых детенышей показал, что клетки молочной железы были донорамиядер для одного, фибробласты плода — для двух и эмбриональные клетки — четырехягнят. Овца по кличке Долли развилась из реконструированной яйцеклетки, доноромядра которой была культивируемая клетка молочной железы овцы породы финн дорсети фенотипически не отличается от овец этой породы, но сильно отличается от овцы-реципиента(рис. 4). Анализ генетических маркеров подтвердил этот результат.
Успехавторов этой работы, прежде всего, связан с использованием длительных клеточныхкультур, так как после многих пассажей в культуре клеток могли быть отобранымалодифференцированные стволовые клетки, которые, вероятно, и были использованыкак доноры ядер. Большое значение также имел тот факт, что авторы, учитываярезультаты своих предыдущих работ, синхронизировали стадии клеточного циклаяйцеклеток реципиентов и клеток доноров.
Новернёмся к клонированию человека. Существует несколько способов обойтиэтические проблемы – выращивать отдельные органы из клеток реципиента илииспользовать животных. Но это только «косметический»метод. Реальный шаг к бессмертию — искусственное изменение ДНК. В июне2000 года и случилось то, чего так долго ждали и чего некоторые такбоялись. Появилось сообщение, что ученым из уже знаменитой своей овцой Доллишотландской фирмы PPL Therapeutics (коммерческого отделенияРозлин Института в Эдинбурге) удалось получить успешные клоны овечек сизмененной ДНК. Шотландские ученые смогли осуществить клонирование, прикотором генетический материал клона был «подправлен» с лучшуюсторону. Однако именно этого, генетического вмешательства и боятся многие противникиклонирования.
Хотясуществует и уже узаконенный путь обхода запрета наклонирование человека, который называется «терапевтическое»клонирование человеческих существ. Речь идет о создании ранних эмбрионов — своего рода банка донорских тканей для конкретных индивидуумов. Именноиспользуя его, американская компания Advanced Cell Technology Inc. (ACT, городВустер, штат Массачусетс) объявила в ноябре 2001 года об успешном клонированиичеловеческого эмбриона.
Интересноотметить, что эта компания в октябре получила правительственный грант 1.8млн. $ на проведение исследований в области биотехнологии. Порадовала и реакция конкурентов: «Я очень рада, что мы не одиноки. Мы получаемэмбрионы каждый день», — заявила директор Clonaid Бриджит Боселье (BrigitteBoisselier).
Дляэксперимента учёные использовали в общей сложности 17 женских яйцеклеток:удалив из них ядра, они внедрили на их место ядра, позаимствованные из клетоккожи взрослого человека. В трёх яйцеклетках начался нормальный процесс роста иделения. Когда эмбрионы состояли из 6-ти клеток каждый, учёные прервали ихдальнейшее развитие с тем, чтобы использовать полученные клетки для дальнейшихисследований.
Следуетотметить, что стволовые клетки, которые, собственно, и являются предметоминтереса ученых, занимающихся исследованиями в области терапевтическогоклонирования, можно выделить только из эмбриона, в своем развитии достигшегостадии бластоцисты (около сотни клеток). Однако специалисты ACT заявляют, чтосозданные ими, в другом эксперименте, обезьяньи зародыши развились достадии бластоцисты. Из эмбрионов были выделены стволовые клетки, которые в ходеих специализации удалось превратить в нейроны. Сообщается, что эти нейроныоказались в состоянии вырабатывать допамин и серотонин — два важнейших гормона,которые вырабатываются мозгом.
В интервью CNNпрезидент компании ACT доктор Майкл Вест сказал, что его компания незаинтересована в клонировании людей, и что она не создавала эмбрион человекадля репродуктивных целей «Мы только хотим помочь больным людям,нуждающимся в помощи, и в этом состоит работа всего нашего центра».
Определениелечебного клонирования человека
Одобрениеи разрешение терапевтического клонирования человека основывалось наморально-этическом различии между «репродуктивным» и «терапевтическим»клонированием. Репродуктивное клонирование — это воспроизведение всегочеловеческого организма целиком. Лечебное же (медицинское, терапевтическое)клонирование по определению прекращает копирование человеческих клонов наэмбриональной стадии и не допускает имплантации и нормальной беременности. Притерапевтическом клонировании эмбрион разрушают на ранней стадии развития — настадии бластоцита, и получают из него культуру стволовых клеток. Для полученияэтой клеточной массы, которая при нормальной беременности дает начало плоду,эмбрион неизбежно следует разрушить. Стволовые клетки человеческого эмбрионаназывают плюрипотентными стволовыми клетками (ПСК), поскольку они могут даватьначало разнообразным типам клеток. В ноябре 1998 года доктор Томсон (Thomson) вВисконсинском университете получил культуру стволовых клеток человеческогоэмбриона из зародышей, предоставленных клиниками по искусственномуоплодотворению в пробирке — in vitro. Эти клетки были плюрипотентны, то естьобладали большими возможностями, и неограниченно делились в лабораторныхусловиях. При имплантации под кожу мыши они давали начало клеткам выстилкикишечника, хряща, кости, мышц и эпителия нервной системы.
Открытиеспособности стволовых клеток эмбриона давать начало другим типам клетокпородило веру в их целебные свойства, с помощью которых можно победить едва лине любую болезнь и избежать старения. Было высказано мнение, что наивысшийтерапевтический потенциал эмбриональных стволовых клеток в обновлении тканейможет быть реализован при их выделении из собственных клеток пациента. Чтобыполучить «по заказу» такие индивидуально специфичные ПСК, требуетсяприменить метод переноса ядра соматической клетки (ПЯСК) — этот же метод былиспользован при клонировании овцы Долли для создания эмбриона, идеальноподходящего пациенту. Цель эмбрионального, или терапевтического, клонированиясостоит в получении стволовых клеток человеческого эмбриона, идентичныхсобственным клеткам пациента, что со временем можно будет использовать для леченияболезней. Пока же о стволовых клетках эмбриона известно лишь то, что из нихможно получать клетки разных типов, которые способны длительное времясуществовать в лабораторной культуре. Способности же управлять дифференцировкойи пролиферацией пока остаются на уровне гипотез. Эмбрион– нечто большее, чем человеческая ткань? Двекрайние точки зрения на ограниченное клонирование отражают двеморально-этические позиции по отношению к эмбриону человека. Эмбриолог Уинстон(Winston) утверждает: «Никто не собирается, да и не может клонироватьчеловеческие эмбрионы… Всё, что нам нужно, — получить ткань эмбриональногопроисхождения и выделить из нее участки клеток, с помощью которых можно будетлечить больных людей». Однако профессор Скэрисбрик (Jack Scarisbrick) говоритиное: «Это — клонирование. Вы создаете точную копию человека. И от этогонового человека отрываете кусок, а потом убиваете его». Почему двоевысокообразованных ученых высказывают прямо противоположные мнения об одной итой же методике? Первое мнение отражает биологический подход. Согласно ему,эмбрион, который не прошел имплантацию и внутриутробное развитие, не имеетникаких интересов, которые общество должно защищать. Такой эмбрион — не болеечем скопище клеток, управляемых не мозгом, а генетическим кодом.Противоположный подход рассматривает эмбрион как живого человека, которогоследует воспринимать как полноценную личность с первого мгновения егосуществования. «Вопрос не в том, похож ли развивающийся человеческийзародыш на взрослого человека, а в том, соответствует ли его развитиечеловеческой природе на данной конкретной стадии» (5). Общество обязанозащищать человеческий эмбрион в силу его генетической уникальности испособности вырасти в личность. Вот почему эксперименты над эмбрионами — ничемне оправданное убийство.
В 1994 годуНациональный институт здоровья США учредил комиссию по вопросу о человеческомэмбрионе с целью примирения этих двух противоположных точек зрения. Былразработан компромиссный подход, согласно которому эмбрион — не личность, но,будучи формой человеческой жизни, обладает моральной ценностью. Критерий этогопромежуточного статуса — определение человеческой жизни и личности черезобладание тремя обусловленными деятельностью мозга способностями: сознанием,способностью мыслить и способностью ощущать. Был сделан вывод, что человеческаяличность проявляется только на 14-й день развития. В основу этого вывода леглитри биологических факта. Во-первых, первичная полоска — предшественникцентральной нервной системы развивается на 14-й день (6). Во-вторых, на раннихстадиях развития эмбриона его индивидуальность размыта. До седьмого-десятогодня развития возможны два явления: формирование близнецов и мозаицизм.Формирование близнецов — способность эмбриона разделяться и образовыватьнесколько генетически идентичных особей. В случае мозаицизма два разныхзародыша сливаются воедино, образуя один организм с двумя различными геномами.И, наконец, приблизительно на 14-й день (иногда раньше, на 7-й -10-й день)происходит имплантация в стенку матки; до 60% эмбрионов при естественномоплодотворении не имплантируются в теле матери. Вывод: если в природебольшинство зародышей в возрасте менее 14 дней погибают естественным путём, тоэксперименты над эмбрионами допустимы до достижения 14 дней без имплантации.
Устойчивость компромиссной точкизрения.
Многихубеждает утверждение, что жизнь человека обретает уникальную, только ейприсущую ценность лишь тогда, когда человек становится личностью. Есть ещё однасходная точка зрения, рассматривающая человеческий эмбрион с позиций роста иразвития: моральная ценность внутриутробной жизни возрастает с течениембеременности, и на поздних её стадиях (или к моменту рождения) достигаетобщечеловеческого уровня. Однако принципиально важно рассмотреть предпосылки,на которых основаны «моральная граница» 14-го дня беременности изапрет на имплантацию эмбриона. Первая предпосылка: личностность должнаопределяться нашим восприятием человека как такового. Вторая предпосылка:составляющие личности — сознание, способность мыслить и способность ощущать.Третья предпосылка: первичная полоска есть точная мера сознания, способностимыслить и способности ощущать.
Очевидно,что, в соответствии с биологическими данными, сознание, способность мыслить испособность ощущать развиваются на более поздних стадиях. В недавней статье в«Журнале Американской медицинской ассоциации» (JAMA) Ланца (Lanza) идр. доказывают, что это — чёткая и реальная граница, поскольку как толькоформируется первичная ось тела, обретает конкретность «индивидуальность»,являющаяся ключевым понятием для определения личности. Другие же учёныепризнают, что граница 14-го дня выбрана произвольно, поскольку«биологически» ясно, что раньше этого времени жизнь существовать неможет. Специалист по этике из Принстонского университета Питер Сингер (PeterSinger) предполагает, что «новорожденный ребёнок не способен ни ксамосознанию, ни к осознанию собственного существования во времени — онприобретает эти качества много позже. Это — не личность. Его жизнь заслуживает защитыне более, чем жизнь плода». «В нашей книге „Должен ли ребенокжить?“ моя коллега Хельга Кузе (Helga Kuhse) и я высказываемпредположение: только в возрасте 28 дней о новорожденном можно сказать, что онимеет такое же право на жизнь, как любой человек. И, конечно же, лишь намногопозже ребенок приобретает чувство собственного существования во времени…».Если довести ход мысли сторонников «личностного подхода» дологического завершения, выходит, что инвалиды, умственно отсталые люди,маленькие дети и старики — неполноценные члены общества.
«Имплантационныйподход», на первый взгляд, кажется обоснованным. В определенных ситуацияхпрерывание беременности — в интересах общества; ведь страшно подумать, чтоможно дать жизнь эмбрионам, возникшим в ходе экспериментов, мутантным иклонированным. Нельзя допустить, чтобы такие дети появлялись на свет. Вообще,клонирование человека недопустимо, потому что оно нарушает принцип уникальностикаждой человеческой личности. Клонирование обесценивает уникальность личности — весьма вероятно, что клонированный человек будет считаться неполноправным поотношению к человеку, появившемуся на свет обычным образом. В отношенииисследований плодов в матке уже разработаны этические нормы, допускающиевмешательство в тех случаях, когда ожидаемая польза перевешивает риск жизниличности плода. Следовательно, согласно этому подходу, эксперименты надэмбрионами или клонирование допустимо производить только в лабораторныхусловиях, и результатом этих операций может быть лишь производство клеточноймассы, а не тканей и органов.
Но чемотличаются эмбрион в утробе и эмбрион в чашке Петри? Есть мнение, что«разница между эмбрионом в утробе и гаметами в чашке Петри состоит в том,что эмбриону для развития достаточно „естественного“ существования…Лабораторный же эксперимент требует активного, направленного и»искусственного" (в виде механического переноса в матку)вмешательства третьей стороны, без которого беременность невозможна".Иначе говоря, перенесение эмбрионов, зачатых или клонированных в чашке Петри, вутробу — искусственный процесс. Это — любопытное замечание, учитывая, чтогаметы требуют такого же «активного, направленного и»искусственного" (в виде механического переноса) вмешательства"в первую очередь для того, чтобы попасть в чашку Петри. Если мы противискусственного переноса гамет из чашки Петри, то почему мы должны радоваться ихискусственному переносу в чашку Петри? На это отвечают: «Чтобы бесплодныепары могли иметь детей».
Создание эмбрионов для научныхисследований
Создание эмбрионов было позволенодля размножения рода человеческого. Но совсем другое дело — создаватьэмбрионов, чтобы ставить на них эксперименты. Во-первых, разрешение на созданиеэкспериментальных эмбрионов поднимает проблему инструментализации — созданиячеловеческой жизни исключительно в утилитарных целях. Во-вторых, клонированныеэмбрионы или полученные из них стволовые клетки имеют большую коммерческуюценность, а значит, встает проблема коммодификации людей — возможности торговличеловеческой жизнью. Создание эмбрионов в целях эксперимента подрывает принципсамостоятельной ценности человеческой жизни. Жизнь ценна сама по себе, а непотому, что из нее можно извлечь пользу при лечении болезни. США выступилипротив создания эмбрионов в научных целях, но предложили разрешить производствостволовых клеток из эмбрионов, не усыновленных после искусственногооплодотворения, поскольку «лишние» эмбрионы и выброшенные плодыобречены на неминуемую гибель, и мы не должны отказываться от их использованиядля пополнения медико-биологического знания и возможности оказать медицинскуюпомощь больным. Но разве эмбрион, произведенный путем клонирования, имеетменьшую ценность, чем эмбрион, порожденный слиянием яйцеклетки и сперматозоида?
Цель оправдывает средства?
Дляоправдания терапевтического клонирования привлекаются богословские иутилитарные аргументы. Высказывается мысль, что общество должно бытьзастраховано от наиболее очевидной опасности: от имплантации клонированногоэмбриона и, следовательно, появления детей-клонов. Однако следует разрешитьприменение методов, способствующих излечению диабета, болезни Паркинсона,болезни Альцгеймера, рака, сердечных заболеваний, артрита, ожогов и болезнейспинного мозга. Этика же не может оправдать терапевтическое клонированиечеловека. Во-первых, нельзя создавать эмбриона просто для того, чтобы другиелюди его использовали. Более того, если такие эксперименты окажутся успешными,то спрос на эмбрионы для удовлетворения человеческих нужд будет расти. К томуже, необходимо будет создавать экспериментальные эмбрионы, чтобы определить,будет ли от них медицинская польза.
Обратимся кпринципам исследований человека, на концепцию этики исследований человеческогоорганизма оказали влияние три плодотворных документа, касающихся этическихнорм. Это Нюрнбергский кодекс (1946-49 гг.), Бельмонтский доклад (1979 г.) иХельсинкская декларация (1964 г., поправки внесены в 2000 г.). Хотя каждый изэтих документов посвящён отдельным вопросам, из всех них вытекают общиеруководящие принципы. Научные эксперименты, равно как и исследования, должныбыть высочайшего качества. Предварительные эксперименты над животными должныдавать плодотворные и многообещающие результаты. Если для достижения целиприменим метод, не требующий экспериментов над людьми, то такие экспериментыпроводиться не должны.
Пока что все клонированные животные или рождаются сгенетическими аномалиями, или оказывают не в состоянии произвести на светздоровое потомство.
Специалисты-биологи спорят о возможных причинах этого настраницах журнала Science.
Сотрудники двух известных американских научных центровиспользовали мышей для того, чтобы понять, что же именно нарушается в работеорганизма при клонировании. Выяснилось, что у клонированных мышей ДНК измененаи не вполне соответствует нормальной. Некоторые из генов, как говорят ученые,«не включаются».
«Стало быть, можно предположить: даже клоны, которыекажутся здоровыми, рождаются с нарушениями генетического кода», — говоритодин из авторов исследования, профессор Рудольф Йенич.
«Экспериментировать на людях пока рано», — считает он.
Создатель Долли согласен
Такой же точки зрения придерживается и британский ученый ЯнВилмут — один из создателей известной во всем мире овечки Долли. В интервьюБи-би-си он заявил: «Клонирование людей приведет к тому, что младенцыбудут рождаться с серьезными отклонениями от нормы».
Очередным доказательством справедливости собственных словпрофессор Вилмут и считает результаты работ американских ученых.
«Пока что результаты клонирования мы можем предсказыватьтолько приблизительно, — говорит профессор Вилмут. — И неважно, идет ли речь омышах, овцах, коровах или, если уж на то пошло, о людях».
Кстати, в 2002 году у знаменитой Долли было отмеченоразвитие артрита, который, как предполагается, мог стать результатом генныхмутаций, инициированных процессом клонирования. Помимо артрита у животногонаблюдался целый ряд отклонений от нормального развития, и в феврале учёныеусыпили овечку из-за рака лёгких. Но опухоль могла быть и не вызвана процессомклонирования, за два года до кончины Долли умерла от той же болезни её соседкапо камере.
«Мы понимали, что животное вопасности, — говорит создатель Долли Йен Уилмут из Института Рослин вЭдинбурге. — Тем более что инфекции гораздо быстрее распространяются, когда овецсодержат в закрытых помещениях». Но спасать ценного клона почему-то не стали — в карантин не отправили.
Но возможно ли клонирование человека?
Учёныеиз США считают, что клонирование человека может оказаться неосуществимым побиологическим причинам. Они заявляют, что сотни попыток создать клонобезьяны провалились. По их словам, устройство яйцеклеток приматов, в том числеи человека, делает их клонирование практически невозможным. «Такимобразом, подтверждается тот факт, что шарлатаны, сообщавшие о клонированиичеловека, никогда не понимали клеточной биологии настолько хорошо, чтобыдобиться успеха», — заявил руководитель группы доктор Джеральд Шаттен.
Клонированию успешно подвергаютсянекоторые животные, в том числе мыши, овцы и другой скот, однако в последнеевремя появляются все более явные признаки того, что не все виды можновоспроизвести искусственным путем. Исследование, результаты которого былиопубликованы в журнале Science, усиливает сомнения в том, что заявлениякомпании Clonaid о создании первых человеческих клонов являются правдой. Этакомпания, созданная последователями уфологического культа раэлитов, сообщила орождении уже нескольких детей-клонов, однако до сих пор не предоставилаубедительных доказательств
Большинство ученых сходятся натом, что попытки создать клон человека опасны и сомнительны с моральной точкизрения. Многие клоны животных появлялись на свет с теми или иными отклонениями.Здоровыми они рождались редко, сообщает BBC.
Исследователи университетаПиттсбургской школы медицины попытались клонировать макаку-резус с помощьютехнологии, использовавшейся при создании клона знаменитой овцы Долли. Послесотен попыток им так ни разу не удалось добиться беременности у носителя клона.Другим группам ученым также не удалось клонировать обезьян. Судя по всему, уприматов при делении клонированных клеток ДНК не передается новым клеткамдолжным образом. Некоторые клетки в итоге получают либо слишком много, либослишком мало ДНК, и оказываются нежизнеспособными. Ученые полагают, что попыткиклонировать других приматов, в том числе и человека, скорее всего, обречены напровал.
Тем временем японские ученые утверждают, что нашлиальтернативу технике клонирования при выращивании отдельных органов.Исследователи из Института репродукции человека при Киотском университетеобъявили, что им впервые в мире удалось вернуть обычные клетки крови к томусостоянию, когда из них можно получить абсолютно любой трансплантант.
В ходе опытову лабораторных мышей изъяли лимфоциты и при помощи электрошока объединили их сзародышевыми стволовыми клетками — предшественницами всех взрослых тканей,составляющими «тело» эмбриона. Полученный гибрид пересадили впитательную среду и по прошествии короткого времени лимфоциты превратились вклубок клеток самой разной «ориентации». В нем были намешаныначальные формы костной, мышечной, нервной и прочих тканей. Оставалось тольковычленить необходимую клетку и создать условия для ее дальнейшего перерастанияв отдельный орган.
Как говорятученые, новая техника репродукции обещает прорыв в трансплантологии — донором вданном случае выступает сам же реципиент. Это также, по их мнению, позволяетобойти этические проблемы, которые возникают при клонировании, когда роль«фабрики запчастей для тела» играют зародыши-клоны.
Заключение
Итак,работы по клонированию позвоночных были начаты на амфибиях в начале 50-хгодов и интенсивно продолжаются вот уже более четырех десятилетий. Что касаетсяамфибий, то, как было сказано в соответствующем разделе, несмотря назначительные достижения, проблема клонирования взрослых особей остается до сихпор не решенной. Установлено, что в ходе клеточной дифференцировки упозвоночных происходит или потеря определенных генных локусов или ихнеобратимая инактивация. Судя по всему, утрачивается та часть генома, котораяконтролирует не ранние, а более поздние этапы онтогенеза. Механизм этогоявления пока не поддается научному объяснению. Но очевидно, что дляклонирования взрослых позвоночных необходимо использовать малодифференцированныеделящиеся клетки.
Что касается этической стороны дела, то заповеди, которымичеловечество пользуется века, к сожалению, не предусматривают новыхзакономерностей и возможностей, какие вносит в нашу жизнь наука. Поэтому людями необходимо обсуждать и принимать новые законы общежития, учитывающие новыереальности.
www.ronl.ru
Реферат: Клонирование
Клонирование
Термин "клон" происходит от греческого слова "klon", что означает - веточка, побег, черенок, и имеет отношение, прежде всего к вегетативному размножению. Клонирование растений черенками, почками или клубнями в сельском хозяйстве, в частности в садоводстве, известно уже более 4-х тыс. лет. При вегетативном размножении и при клонировании гены не распределяются по потомкам, как в случае полового размножения, а сохраняются в полном составе в течение многих поколений.
Однако у животных есть препятствие. По мере роста их клеток, они в ходе клеточной специализации – дифференцировки – теряют способность реализовывать всю генетическую информацию, заложенную в ядре
Впрочем, оказывается, есть ящерицы-прыгуны, которые испокон веков размножаются именно клонированием, так как у них в роду есть только самки.
Хотя это не совсем клонирование, это называется партогенез. Эта встречающаяся в природе (прежде всего у беспозвоночных) форма однополого размножения предполагает развитие яйцеклеток без оплодотворения. Эксперименты по искусственному провоцированию партеногенеза начались еще в конце XIX века (работы русского зоолога Тихомирова). В дальнейшем ученые, применяя различные физико-химические раздражители, такие как растворы сильных кислот, трение, нагрев, сумели получить партеногенез у многих животных, в том числе млекопитающих
Возможность клонирования эмбрионов позвоночных впервые была показана в начале 50-х годов в опытах на амфибиях. Опыты с ними показали, что серийные пересадки ядер и культивирование клеток in vitro в какой-то степени увеличивает эту способность.
Уже в начале 90-х была решена и проблема клонирования эмбриональных клеток млекопитающих. Реконструированные яйцеклетки крупных домашних животных, коров или овец сначала культивируют не in vitro, a in vivo - в перевязанном яйцеводе овцы - промежуточного (первого) реципиента. Затем их оттуда вымывают и трансплантируют в матку окончательного (второго) реципиента - коровы или овцы соответственно, где их развитие происходит до рождения детеныша.
Статья Уилмута с соавторами, появившаяся в начале 1997 года, стала сенсационной именно потому, что впервые клональное животное (овца по кличке Долли) появилось в результате использования донорского ядра клетки молочной железы взрослой овцы. У этого первого успешного эксперимента есть существенный недостаток - очень низкий коэффициент выхода живых особей (0,36%). Однако он доказывает возможность полноценного клонирования, (или получения копии взрослого человека). Остаётся лишь разрешить технические и этические вопросы.
Самое интересное, что методология клонирования, использованная Уилмутом, была подготовлена в СССР ещё в 1987-ом году, но в Академии наук на это прореагировали вяло - не до того, видимо…
Первые опыты на амфибиях
Возможность клонирования эмбрионов позвоночных впервые была показана в начале 50-х годов в опытах на амфибиях. Американские исследователи Бриггс и Кинг разработали микрохирургический метод пересадки ядер эмбриональных клеток с помощью тонкой стеклянной пипетки в лишенные ядра (энуклеированные) яйцеклетки. Они установили, что если брать ядра из клеток зародыша на ранней стадии его развития - бластуле, то примерно в 80% случаев зародыш благополучно развивается дальше и превращается в нормального головастика. Если же развитие зародыша, донора ядра, продвинулось на следующую стадию - гаструлу, то лишь менее чем в 20% случаев оперированные яйцеклетки развивались нормально. Эти результаты позже были подтверждены и в других работах.
Большой вклад в эту область внес английский биолог Гердон. Он первым в опытах с южноафриканскими жабамиXenopus laevis(1962) в качестве донора ядер использовал не зародышевые клетки, а уже вполне специализировавшиеся клетки эпителия кишечника плавающего головастика. Ядра яйцеклеток реципиентов он не удалял хирургическим путем, а разрушал ультрафиолетовыми лучами. В большинстве случаев реконструированные яйцеклетки не развивались, но примерно десятая часть их них образовывала эмбрионы. 6,5% из этих эмбрионов достигали стадии бластулы, 2,5% - стадии головастика и только 1% развился в половозрелых особей (рис. 1). Однако появление нескольких взрослых особей в таких условиях могло быть связано с тем, что среди клеток эпителия кишечника развивающегося головастика довольно длительное время присутствуют первичные половые клетки, ядра которых могли быть использованы для пересадки. В последующих работах как сам автор, так и многие другие исследователи не смогли подтвердить данные этих первых опытов.
Позже Гердон модифицировал эксперимент. Поскольку большинство реконструированных яйцеклеток (с ядром клетки кишечного эпителия) погибают до завершения стадии гаструлы, он попробовал извлечь из них ядра на стадии бластулы и снова пересадить их в новые энуклеированные яйцеклетки (такая процедура называется "серийной пересадкой", в отличие от "первичной пересадки"). Число зародышей с нормальным развитием после этого увеличивалось, и они развивались до более поздних стадий по сравнению с зародышами, полученными в результате первичной пересадки ядер.
Затем Гердон вместе с Ласки (1970) стали культивировать in vitro (вне организма в питательной среде) клетки почки, легкого и кожи взрослых животных и использовать уже эти клетки в качестве доноров ядер. Примерно 25% первично реконструированных яйцеклеток развивались до стадии бластулы. При серийных пересадках они развивались до стадии плавающего головастика. Таким образом, было показано, что клетки трех разных тканей взрослого позвоночного (X. laevis) содержат ядра, которые могут обеспечить развитие, по крайней мере, до стадии головастика.
В свою очередь ДиБерардино и Хофнер использовали для трансплантации ядра неделящихся и полностью дифференцированных клеток крови - эритроцитов лягушкиRana pipiens. После серийной пересадки таких ядер 10% реконструированных яйцеклеток достигали стадии плавающего головастика. Однако даже с помощью многократных серийных пересадок (более 100 клеточных циклов) реконструированные яйцеклетки дальше стадии головастика не развивались.
Таким образом, во многих работах показано, что в случае амфибий донорами ядер могут быть лишь зародыши на ранних стадиях развития. Некоторые авторы называют подобные эксперименты клонированием амфибий, хотя правильнее называть их клонированием эмбрионов амфибий, так как в этом случае мы размножаем бесполым путем не взрослых животных, а зародышей.
Дифференцировка клеток в ходе развития позвоночных сопровождается инактивацией неработающих генов. Поэтому клетки теряют тотипотентность, дифференцировка становится необратимой. В конце концов у одних клеток происходит полное репрессирование генома, у других - в той или иной степени деградирует ДНК, а в некоторых случаях разрушается даже ядро. Однако наряду с дифференцированными кочетками культивируемыеin vitroклеточные популяции содержат малодифференцированные стволовые клетки, которые и могут быть использованы как доноры ядер для клонирования млекопитающих.
Опыты с амфибиями показали, что ядра различных типов клеток одного и того же организма генетически идентичны и в процессе клеточной дифференцировки постепенно теряют способность обеспечивать развитие реконструированных яйцеклеток, однако серийные пересадки ядер и культивирование клетокin vitroв какой-то степени увеличивает эту способность.
Неудачи экспериментов с мышами
Успешные опыты с амфибиями заставили ученых задуматься о клонировании эмбрионов млекопитающих, в частности мышей. МакКиннел в одной из своих работ отмечал, что все необходимые для этого методы уже существуют, и непонятно, почему мышь до сих пор не клонирована. По его мнению, первыми объектами должны были стать именно мелкие животные, такие как мышь или кролик. Однако предсказание
МакКиннелла не сбылось, хотя в конце 70-х годов опыты на мышах действительно начались и протекали весьма драматично. К тому времени, замечу, весьма основательно были изучены биология и генетика ранних этапов развития млекопитающих, и, в частности, мыши как модельного объекта.
Работа методически оказалась довольно трудной, прежде всего потому, что объем яйцеклетки у млекопитающих примерно в тысячу раз меньше, чем у амфибий. Однако эти трудности были успешно преодолены. Экспериментаторы научились микрохирургически удалять пронуклеусы из зигот (оплодотворенных яйцеклеток) мыши и пересаживать в них клеточные ядра ранних эмбрионов. Однако все полученные разными способами зародыши мышей развивались лишь до стадии бластоцисты.
В 1977 году появилось сенсационное сообщение Хоппе и Илменси о том, что они получили семь взрослых самок мышей, пять из которых имели только материнский, а две - отцовский геном. Это, якобы, зависело от того, какой пронуклеус был оставлен в яйце - женский или мужской, он и определял развитие особи по типу гиногенеза или андрогенеза. Их успех был связан, но описанию авторов, с тем, что, удаляя один пронуклеус, они удваивали число хромосом другого, обрабатывая яйца специальным веществом, затем выращивали полученные диплоидные гомозиготные (с двумя одинаковыми наборами генов) зародышиin vitroдо стадии бластоцисты и пересаживали в матку самки-реципиента для дальнейшего развития.
Казалось, теперь можно будет быстро получать млекопитающих со 100%-ной гомозиготностью по всем генам. Это особенно важно в селекции, так как для получения сельскохозяйственных животных, в частности, крупного рогатого скота, с закрепленными особо ценными качествами обычными приемами требуются десятки лет работы.
Однако, к сожалению, данные Хоппе и Илменси подтвердить не удалось, хотя многие пытались это сделать. Оказалось, что полученные любым способом диплоидные андрогенетические и гиногенетические зародыши мышей погибают на тех же стадиях, что и диплоидные партеногенетические (развивающиеся из неоплодотворенной яйцеклетки) эмбрионы.
Значительно усовершенствовав методы извлечения ядер и введения их в клетку, МакГрат и Солтер провели свою серию экспериментов и сообщили, что высокий выход живых мышей они получили, когда в качестве доноров ядер использовали зиготы, но если донорами были ранние эмбрионы, то реконструированные яйцеклетки, как и прежде, развивались только до стадии бластоцисты.
Метод МакГрата и Солтера стал широко использоваться разными экспериментаторами. Так, Манн и Ловел-Бадж выделяли пронуклеусы из яиц, активированных к партеногенезу, и пересаживали их энуклеированные зиготы мышей. В этих случаях эмбрионы погибали на ранних стадиях. Если же наоборот, пронуклеусы получали из оплодотворенных яиц и пересаживали в партеногенетически активированные и лишенные ядра яйца, то такие зародыши развивались нормально до рождения. Сурани с соавторами установили, что если добавить женский пронуклеус из зиготы мыши к гаплоидному набору хромосом яйцеклетки, то нормального развития не происходит, добавление же мужского ядра приводит к нормальному развитию. С другой стороны, рекомбинации мужского и женского пронуклеусов из разных оплодотворенных яйцеклеток мышей обеспечивает нормальное развитие, а комбинация двух мужских или двух женских пронуклеусов останавливает развитие эмбриона.
Эти опыты показали, что для нормального развития млекопитающих требуются два набора хромосом - отцовский и материнский. Поэтому ни у одного из известных видов млекопитающих не описан партеногенез. Поэтому работы Хоппе и Илменси не удалось повторить.
Однако эти исследователи еще дважды будоражили научное сообщество. В 1982 году они пересадили ядра клеток партеногенетических бластоцист мышей в энуклеированные зиготы. Некоторые из этих реконструированных яйцеклеток нормально развивались, и якобы были получены четыре взрослых самки. В свете вышесказанного эти результаты весьма маловероятны.
Гибель партеногенетических (гиногенетических) и андрогенетических зародышей у млекопитающих связана с различной активностью в онтогенезе материнского и отцовского геномов. Механизм, регулирующий эти функциональные различия, был назван геномным импринтингом и изучался в ряде работ, где было показано, что для нормального развития млекопитающих требуется наличие мужского генома. Другая статья Илменси и Хоппе имела еще больший резонанс.
Авторы сообщили о пересадке ядер клеток внутренней клеточной массы бластоцисты в энуклеированные зиготы мышей и получении трех взрослых мышей (двух самок и самца), генетически идентичных донорской линии мышей. Введение ядер-доноров и удаление пронуклеусов из зиготы проводили за один прием, затем реконструированные яйцеклетки культивировалиin vitroдо стадии бластоцисты и пересаживали в матку самок. Из 16-ти пересаженных бластоцист три развились во взрослых животных. В следующей работе (1982) эти же авторы использовали в качестве доноров ядер клетки эмбрионов еще более поздних стадий (7 суток) и будто бы получили трех половозрелых мышей. Однако никто из работающих в том же направлении не смог добиться подобных результатов, и достоверность данных Илменси и Хоппе была вновь поставлена под сомнение.
МакГрат и Солтер показали, что ядра 8-клеточных зародышей и клеток внутренней клеточной массы бластоцисты не обеспечивают развитиеin vitroреконструированных яйцеклеток даже до стадии морулы, которая предшествует стадии бластоцисты. Небольшая часть (5%) ядер 4-клеточных зародышей дает возможность развиваться только до стадии морулы. В то же время 19% реконструированных яйцеклеток, содержащих ядра 2-клеточных зародышей, смогли достичь стадии морулы или бластоцисты.
Эти и многие другие данные показывают, что в эмбриогенезе у мышей клеточные ядра рано теряют тотипотентность, что связано, очевидно, с очень ранней активацией генома зародыша - уже на стадии 2-х клеток. У других млекопитающих, в частности, у кроликов, овец и крупного рогатого скота, активация первой группы генов в эмбриогенезе происходит позднее, на 8-16-клеточной стадии. Возможно поэтому первые значительные успехи в клонировании эмбрионов были достигнуты на других видах млекопитающих, а не на мышах. Тем не менее, работы с мышами, несмотря на их непростую судьбу, значительно расширили наши представления о методологии клонирования млекопитающих.
Кролики, коровы и свиньи
Американские исследователи Стик и Робл, используя методику МакГрата и Солтера, получили 6 живых кроликов, пересадив ядра 8клеточных эмбрионов одной породы в лишенные ядра яйцеклетки кроликов другой породы. Фенотип родившихся полностью соответствовал фенотипу донора.
Однако только 6 из 164 реконструированных яйцеклеток (3,7%) развились в нормальных животных. Это, конечно, очень низкий выход, практически не позволяющий рассчитывать на получение таким методом клона генетически идентичных животных. Ценность этой работы, тем не менее, в том, что она показала возможность клонирования эмбрионов кроликов.
Работа с реконструированными яйцеклетками крупных домашних животных, коров или овец, идет несколько по-другому. Их сначала культивируют неin vitro, ain vivo- в перевязанном яйцеводе овцы - промежуточного (первого) реципиента. Затем их оттуда вымывают и трансплантируют в матку окончательного (второго) реципиента - коровы или овцы соответственно, где их развитие происходит до рождения детеныша. Уиладсин предложил заключать реконструированные яйцеклетки в агаровый цилиндр, который он затем трансплантировал в перевязанный яйцевод овцы. По данным одних авторов реконструированные зародыши лучше развиваются в яйцеклетке, чем в культуральной среде, хотя некоторые исследователи получили неплохие результаты и при культивировании.
Американцы Робл и его сотрудники, используя щадящий метод извлечения ядра без прокалывания мембраны яйцеклетки, предложенный МакГратом и Солтером, пересаживали в зиготы так называемые кариопласты - мужской и женский пронуклеусы вместе с окружающей их цитоплазмой, а также ядра 2-, 4- или 8-клеточных эмбрионов коровы. Сначала зиготы центрифугировали, чтобы освободить пронуклеусы от окружающих их гранул желтка, после чего ядра были хорошо видны под микроскопом, что значительно облегчало их удаление. При помощи манипулятора и заостренной стеклянной микропипетки извлекали один из бластомеров вместе с ядром из ранних зародышей и переносили его в энуклеированную зиготу.
Реконструированные зародыши были заключены в агаровый цилиндр и пересажены в перевязанный яйцевод овцы. Через пять дней культивирования их вымывали, освобождали от агара и исследовали. Реконструктурированные зародыши в этой работе развивались только в тех случаях, когда в зиготы пересаживали пронуклеусы: 17% таких зародышей достигли стадии морулы или бластоцисты. Два зародыша были пересажены второму реципиенту - в матку коровы, и развитие их завершилось рождением живых телят. Если в качестве доноров использовали ядра 2-, 4- или 8-клеточных зародышей, то реконструированные яйцеклетки не развивались даже до стадии морулы.
Позже были и более успешные работы. Уиладсин, в частности, сообщил, что ему удалось получить четырех генетически идентичных бычков холстейнской породы в результате пересадки в реципиентные яйцеклетки ядер бластомеров одного 32-клеточного зародыша (рис. 3). Автор утверждал, что большинство ядер сохраняет тотипотентность на 32-клеточной стадии, а значительная их часть даже на 64-клеточной стадии, обеспечивая нормальное развитие реконструированных яйцеклеток до стадии ранней бластоцисты в яйцеводе овцы. После пересадки в матку коров - окончательных реципиентов, как полагает автор, они могут и дальше нормально развиваться.
Бондиоли и соавторы, используя в качестве доноров ядер 16-64-клеточные зародыши коров, трансплантировали 463 реконструированных зародыша в матку синхронизированных реципиентов, и было получено 92 живых теленка. Семь из них были генетически идентичны, представляя собой клон, полученный в результате пересадки ядер клеток одного донорского эмбриона.
Таким образом, клеточные ядра зародышей крупного рогатого скота достаточно долго сохраняют тотипотентность и могут обеспечить полное развитие реконструированных яйцеклеток. Иначе говоря, методические трудности клонирования зародышей крупного рогатого скота практически решены. Но остается основная задача - найти донорские ядра, обладающие тотипотентностью, для клонирования взрослых животных.
Клонированию эмбрионов свиней посвящена только одна небольшая работа. Скудность данных, видимо, и связана с определенными трудностями работы с этим объектом.
Клонирование овец
Уиладсин еще в 1986 году показал, что и у эмбрионов овец на 16-клеточной стадии развития ядра сохраняют тотипотентность. Реконструированные яйцеклетки, содержащие ядра бластомеров 16-клеточных зародышей, развивались нормально до стадии бластоцисты в перевязанном яйцеводе овцы (в агаровом цилиндре), а после освобождения от агара и пересадки в матку овцы - второго реципиента - еще 60 дней. В другом случае донорами служили ядра 8-клеточных зародышей и были получены 3 живых ягненка, фенотип которых соответствовал породе овец - доноров.
В 1989 году Смит и Уилмут трансплантировали ядра клеток 16-клеточного эмбриона и ранней бластоцисты в лишенные ядра неоплодотворенные яйцеклетки овец. В первом случае было получено два живых ягненка, фенотип которых соответствовал породе овец - доноров ядер. Во втором случае один полностью сформировавшийся ягненок погиб во время родов. Его фенотип также соответствовал породе - донору. Авторы считали, что в ходе дифференцировки эмбриональных клеток происходит инактивация некоторых важных для развития генов, в результате которой ядра бластоцисты уже не могут репрограммироваться в цитоплазме яйцеклетки и обеспечить нормальное развитие реконструированного зародыша. Поэтому, по мнению авторов, в качестве доноров ядер лучше использовать 16-клеточные эмбрионы или культивируемыеin vitroлинии эмбриональных клеток, ядра которых обладают тотипотентностью.
Позднее, в 1993-1995 годах, группа исследователей под руководством Уилмута получила клон овец - 5 идентичных животных, донорами ядер которых была культура эмбриональных клеток. Клеточную культуру получали следующим образом: выделяли микрохирургически эмбриональный диск из 9-дневного овечьего эмбриона (бластоцисты) и культивировали клеткиin vitroв течение многих пассажей (по крайней мере до 25). Сначала клеточная культура напоминала культуру стволовых недифференцированных эмбриональных клеток, но вскоре, после 2-3-х пассажей, клетки становились уплотненными и морфологически сходными с эпителиальными. Эта линия клеток из 9-дневного зародыша овцы была обозначена как TNT4.
Чтобы донорское ядро и реципиентная цитоплазма находились на сходных стадиях клеточного цикла, останавливали деление культивируемых клеток TNT4 на определенной стадии (GO) и ядра этих клеток пересаживали в энуклеированные яйцеклетки (соответственно на стадии метафазы II). Реконструированные эмбрионы заключали в агар и трансплантировали в перевязанные яйцеводы овец. Через 6 дней эмбрионы вымывали из яйцевода первого реципиента и исследовали под микроскопом. Отбирали те, которые достигли стадии морулы или бластоцисты и пересаживали их в матку овцы - окончательного реципиента, где развитие продолжалось до рождения. Родилось 5 ягнят (самок) из них 2 погибли вскоре после рождения, 3-й в возрасте 10 дней, а 2 оставшихся нормально развивались и достигли 8-9-месячного возраста. Фенотипически все ягнята были сходны с породой овец, от которой получали исходную линию клеток TNT4. Это подтвердил и генетический анализ.
Эта работа, особенно в части культуры эмбриональных клеток, - значительное достижение в клонировании млекопитающих, хотя она и не вызвала столь шумного интереса, как статья того же Уилмута с соавторами, опубликованная в начале 1997 года, где сообщалось, что в результате использования донорского ядра клетки молочной железы овцы было получено клональное животное - овца по кличке Долли. Последняя работа методически во многом повторяет предыдущее исследование 1996 года, но в ней ученые использовали не только эмбриональные, но еще и фибробластоподобные клетки (фибробласты - клетки соединительной ткани) плода и клетки молочной железы взрослой овцы. Клетки молочной железы получали от шестилетней овцы породы финн дорcет, находящейся на последнем триместре беременности. Все три типа клеточных культур имели одинаковое число хромосом - 54, как обычно у овец. Эмбриональные клетки использовали в качестве доноров ядер на 7-9-м пассажах культивирования, фибробластоподобные клетки плода - на 4-6-м пассажах и клетки молочной железы - на 3-6-м пассажах. Деление клеток всех трех типов останавливали на стадии GO и ядра клеток пересаживали в энуклеированные ооциты (яйцеклетки) на стадии метафазы II. Большинство реконструированных эмбрионов сначала культивировали в перевязанном яйцеводе овцы, но некоторые иin vitroв химически определенной среде. Коэффициент выхода морул или бластоцист при культивированииin vitroв одной серии опытов был даже вдвое выше, чем при культивировании в яйцеводе. (Поэтому, видимо, нет строки необходимости в промежуточном реципиенте и можно обойтись культивированиемin vitro. Однако для полной уверенности в этом нужны дополнительные данные.)
Выход морул или бластоцист в серии опытов с культурой клеток молочной железы был примерно втрое меньше, чем в двух других сериях, когда в качестве доноров ядер использовали культуру фибробластов плода или эмбриональных клеток. Число живых ягнят в сравнении с числом пересаженных в матку окончательного реципиента морул или бластоцист было также в два раза ниже. В серии опытов с клетками молочной железы из 277 реконструированных яйцеклеток был получен только один живой ягненок, что говорит об очень низкой результативности такого рода экспериментов (0,36%). Анализ генетических маркеров всех семи родившихся в трех сериях экспериментов живых детенышей показал, что клетки молочной железы были донорами ядер для одного, фибробласты плода - для двух и эмбриональные клетки - четырех ягнят. Овца по кличке Долли развилась из реконструированной яйцеклетки, донором ядра которой была культивируемая клетка молочной железы овцы породы финн дорсет и фенотипически не отличается от овец этой породы, но сильно отличается от овцы-реципиента (рис. 4). Анализ генетических маркеров подтвердил этот результат.
Успех авторов этой работы, прежде всего, связан с использованием длительных клеточных культур, так как после многих пассажей в культуре клеток могли быть отобраны малодифференцированные стволовые клетки, которые, вероятно, и были использованы как доноры ядер. Большое значение также имел тот факт, что авторы, учитывая результаты своих предыдущих работ, синхронизировали стадии клеточного цикла яйцеклеток реципиентов и клеток доноров.
Но вернёмся к клонированию человека. Существует несколько способов обойти этические проблемы – выращивать отдельные органы из клеток реципиента или использовать животных. Но это только "косметический" метод. Реальный шаг к бессмертию - искусственное изменение ДНК. В июне 2000 года и случилось то, чего так долго ждали и чего некоторые так боялись. Появилось сообщение, что ученым из уже знаменитой своей овцой Долли шотландской фирмы PPL Therapeutics (коммерческого отделения Розлин Института в Эдинбурге) удалось получить успешные клоны овечек с измененной ДНК. Шотландские ученые смогли осуществить клонирование, при котором генетический материал клона был "подправлен" с лучшую сторону. Однако именно этого, генетического вмешательства и боятся многие противники клонирования.
Хотясуществуети уже узаконенный путь обхода запрета на клонирование человека, который называется "терапевтическое" клонирование человеческих существ. Речь идет о создании ранних эмбрионов - своего рода банка донорских тканей для конкретных индивидуумов. Именно используя его, американская компания Advanced Cell Technology Inc. (ACT, город Вустер, штат Массачусетс) объявила в ноябре 2001 года об успешном клонировании человеческого эмбриона.
Интересно отметить, что эта компания в октябре получила правительственный грант 1.8 млн. $ на проведение исследований в области биотехнологии. Порадовала и реакция конкурентов: "Я очень рада, что мы не одиноки. Мы получаем эмбрионы каждый день", - заявила директор Clonaid Бриджит Боселье (Brigitte Boisselier).
Для эксперимента учёные использовали в общей сложности 17 женских яйцеклеток: удалив из них ядра, они внедрили на их место ядра, позаимствованные из клеток кожи взрослого человека. В трёх яйцеклетках начался нормальный процесс роста и деления. Когда эмбрионы состояли из 6-ти клеток каждый, учёные прервали их дальнейшее развитие с тем, чтобы использовать полученные клетки для дальнейших исследований.
Следует отметить, что стволовые клетки, которые, собственно, и являются предметом интереса ученых, занимающихся исследованиями в области терапевтического клонирования, можно выделить только из эмбриона, в своем развитии достигшего стадии бластоцисты (около сотни клеток). Однако специалисты ACT заявляют, что созданные ими, в другом эксперименте, обезьяньи зародыши развились до стадии бластоцисты. Из эмбрионов были выделены стволовые клетки, которые в ходе их специализации удалось превратить в нейроны. Сообщается, что эти нейроны оказались в состоянии вырабатывать допамин и серотонин - два важнейших гормона, которые вырабатываются мозгом.
В интервью CNN президент компании ACT доктор Майкл Вест сказал, что его компания не заинтересована в клонировании людей, и что она не создавала эмбрион человека для репродуктивных целей "Мы только хотим помочь больным людям, нуждающимся в помощи, и в этом состоит работа всего нашего центра".
Определение лечебного клонирования человека
Одобрение и разрешение терапевтического клонирования человека основывалось на морально-этическом различии между "репродуктивным" и "терапевтическим" клонированием. Репродуктивное клонирование - это воспроизведение всего человеческого организма целиком. Лечебное же (медицинское, терапевтическое) клонирование по определению прекращает копирование человеческих клонов на эмбриональной стадии и не допускает имплантации и нормальной беременности. При терапевтическом клонировании эмбрион разрушают на ранней стадии развития - на стадии бластоцита, и получают из него культуру стволовых клеток. Для получения этой клеточной массы, которая при нормальной беременности дает начало плоду, эмбрион неизбежно следует разрушить. Стволовые клетки человеческого эмбриона называют плюрипотентными стволовыми клетками (ПСК), поскольку они могут давать начало разнообразным типам клеток. В ноябре 1998 года доктор Томсон (Thomson) в Висконсинском университете получил культуру стволовых клеток человеческого эмбриона из зародышей, предоставленных клиниками по искусственному оплодотворению в пробирке - in vitro. Эти клетки были плюрипотентны, то есть обладали большими возможностями, и неограниченно делились в лабораторных условиях. При имплантации под кожу мыши они давали начало клеткам выстилки кишечника, хряща, кости, мышц и эпителия нервной системы.
Открытие способности стволовых клеток эмбриона давать начало другим типам клеток породило веру в их целебные свойства, с помощью которых можно победить едва ли не любую болезнь и избежать старения. Было высказано мнение, что наивысший терапевтический потенциал эмбриональных стволовых клеток в обновлении тканей может быть реализован при их выделении из собственных клеток пациента. Чтобы получить "по заказу" такие индивидуально специфичные ПСК, требуется применить метод переноса ядра соматической клетки (ПЯСК) - этот же метод был использован при клонировании овцы Долли для создания эмбриона, идеально подходящего пациенту. Цель эмбрионального, или терапевтического, клонирования состоит в получении стволовых клеток человеческого эмбриона, идентичных собственным клеткам пациента, что со временем можно будет использовать для лечения болезней. Пока же о стволовых клетках эмбриона известно лишь то, что из них можно получать клетки разных типов, которые способны длительное время существовать в лабораторной культуре. Способности же управлять дифференцировкой и пролиферацией пока остаются на уровне гипотез.Эмбрион – нечто большее, чем человеческая ткань?Две крайние точки зрения на ограниченное клонирование отражают две морально-этические позиции по отношению к эмбриону человека. Эмбриолог Уинстон (Winston) утверждает: "Никто не собирается, да и не может клонировать человеческие эмбрионы... Всё, что нам нужно, - получить ткань эмбрионального происхождения и выделить из нее участки клеток, с помощью которых можно будет лечить больных людей". Однако профессор Скэрисбрик (Jack Scarisbrick) говорит иное: "Это - клонирование. Вы создаете точную копию человека. И от этого нового человека отрываете кусок, а потом убиваете его". Почему двое высокообразованных ученых высказывают прямо противоположные мнения об одной и той же методике? Первое мнение отражает биологический подход. Согласно ему, эмбрион, который не прошел имплантацию и внутриутробное развитие, не имеет никаких интересов, которые общество должно защищать. Такой эмбрион - не более чем скопище клеток, управляемых не мозгом, а генетическим кодом. Противоположный подход рассматривает эмбрион как живого человека, которого следует воспринимать как полноценную личность с первого мгновения его существования. "Вопрос не в том, похож ли развивающийся человеческий зародыш на взрослого человека, а в том, соответствует ли его развитие человеческой природе на данной конкретной стадии" (5). Общество обязано защищать человеческий эмбрион в силу его генетической уникальности и способности вырасти в личность. Вот почему эксперименты над эмбрионами - ничем не оправданное убийство.
В 1994 году Национальный институт здоровья США учредил комиссию по вопросу о человеческом эмбрионе с целью примирения этих двух противоположных точек зрения. Был разработан компромиссный подход, согласно которому эмбрион - не личность, но, будучи формой человеческой жизни, обладает моральной ценностью. Критерий этого промежуточного статуса - определение человеческой жизни и личности через обладание тремя обусловленными деятельностью мозга способностями: сознанием, способностью мыслить и способностью ощущать. Был сделан вывод, что человеческая личность проявляется только на 14-й день развития. В основу этого вывода легли три биологических факта. Во-первых, первичная полоска - предшественник центральной нервной системы развивается на 14-й день (6). Во-вторых, на ранних стадиях развития эмбриона его индивидуальность размыта. До седьмого-десятого дня развития возможны два явления: формирование близнецов и мозаицизм. Формирование близнецов - способность эмбриона разделяться и образовывать несколько генетически идентичных особей. В случае мозаицизма два разных зародыша сливаются воедино, образуя один организм с двумя различными геномами. И, наконец, приблизительно на 14-й день (иногда раньше, на 7-й -10-й день) происходит имплантация в стенку матки; до 60% эмбрионов при естественном оплодотворении не имплантируются в теле матери. Вывод: если в природе большинство зародышей в возрасте менее 14 дней погибают естественным путём, то эксперименты над эмбрионами допустимы до достижения 14 дней без имплантации.
Устойчивость компромиссной точки зрения.
Многих убеждает утверждение, что жизнь человека обретает уникальную, только ей присущую ценность лишь тогда, когда человек становится личностью. Есть ещё одна сходная точка зрения, рассматривающая человеческий эмбрион с позиций роста и развития: моральная ценность внутриутробной жизни возрастает с течением беременности, и на поздних её стадиях (или к моменту рождения) достигает общечеловеческого уровня. Однако принципиально важно рассмотреть предпосылки, на которых основаны "моральная граница" 14-го дня беременности и запрет на имплантацию эмбриона. Первая предпосылка: личностность должна определяться нашим восприятием человека как такового. Вторая предпосылка: составляющие личности - сознание, способность мыслить и способность ощущать. Третья предпосылка: первичная полоска есть точная мера сознания, способности мыслить и способности ощущать.
Очевидно, что, в соответствии с биологическими данными, сознание, способность мыслить и способность ощущать развиваются на более поздних стадиях. В недавней статье в "Журнале Американской медицинской ассоциации" (JAMA) Ланца (Lanza) и др. доказывают, что это - чёткая и реальная граница, поскольку как только формируется первичная ось тела, обретает конкретность "индивидуальность", являющаяся ключевым понятием для определения личности. Другие же учёные признают, что граница 14-го дня выбрана произвольно, поскольку "биологически" ясно, что раньше этого времени жизнь существовать не может. Специалист по этике из Принстонского университета Питер Сингер (Peter Singer) предполагает, что "новорожденный ребёнок не способен ни к самосознанию, ни к осознанию собственного существования во времени - он приобретает эти качества много позже. Это - не личность. Его жизнь заслуживает защиты не более, чем жизнь плода". "В нашей книге "Должен ли ребенок жить?" моя коллега Хельга Кузе (Helga Kuhse) и я высказываем предположение: только в возрасте 28 дней о новорожденном можно сказать, что он имеет такое же право на жизнь, как любой человек. И, конечно же, лишь намного позже ребенок приобретает чувство собственного существования во времени…". Если довести ход мысли сторонников "личностного подхода" до логического завершения, выходит, что инвалиды, умственно отсталые люди, маленькие дети и старики - неполноценные члены общества.
"Имплантационный подход", на первый взгляд, кажется обоснованным. В определенных ситуациях прерывание беременности - в интересах общества; ведь страшно подумать, что можно дать жизнь эмбрионам, возникшим в ходе экспериментов, мутантным и клонированным. Нельзя допустить, чтобы такие дети появлялись на свет. Вообще, клонирование человека недопустимо, потому что оно нарушает принцип уникальности каждой человеческой личности. Клонирование обесценивает уникальность личности - весьма вероятно, что клонированный человек будет считаться неполноправным по отношению к человеку, появившемуся на свет обычным образом. В отношении исследований плодов в матке уже разработаны этические нормы, допускающие вмешательство в тех случаях, когда ожидаемая польза перевешивает риск жизни личности плода. Следовательно, согласно этому подходу, эксперименты над эмбрионами или клонирование допустимо производить только в лабораторных условиях, и результатом этих операций может быть лишь производство клеточной массы, а не тканей и органов.
Но чем отличаются эмбрион в утробе и эмбрион в чашке Петри? Есть мнение, что "разница между эмбрионом в утробе и гаметами в чашке Петри состоит в том, что эмбриону для развития достаточно "естественного" существования… Лабораторный же эксперимент требует активного, направленного и "искусственного" (в виде механического переноса в матку) вмешательства третьей стороны, без которого беременность невозможна". Иначе говоря, перенесение эмбрионов, зачатых или клонированных в чашке Петри, в утробу - искусственный процесс. Это - любопытное замечание, учитывая, что гаметы требуют такого же "активного, направленного и "искусственного" (в виде механического переноса) вмешательства" в первую очередь для того, чтобы попасть в чашку Петри. Если мы против искусственного переноса гамет из чашки Петри, то почему мы должны радоваться их искусственному переносу в чашку Петри? На это отвечают: "Чтобы бесплодные пары могли иметь детей".
Создание эмбрионов для научных исследований
Создание эмбрионов было позволено для размножения рода человеческого. Но совсем другое дело - создавать эмбрионов, чтобы ставить на них эксперименты. Во-первых, разрешение на создание экспериментальных эмбрионов поднимает проблему инструментализации - создания человеческой жизни исключительно в утилитарных целях. Во-вторых, клонированные эмбрионы или полученные из них стволовые клетки имеют большую коммерческую ценность, а значит, встает проблема коммодификации людей - возможности торговли человеческой жизнью. Создание эмбрионов в целях эксперимента подрывает принцип самостоятельной ценности человеческой жизни. Жизнь ценна сама по себе, а не потому, что из нее можно извлечь пользу при лечении болезни. США выступили против создания эмбрионов в научных целях, но предложили разрешить производство стволовых клеток из эмбрионов, не усыновленных после искусственного оплодотворения, поскольку "лишние" эмбрионы и выброшенные плоды обречены на неминуемую гибель, и мы не должны отказываться от их использования для пополнения медико-биологического знания и возможности оказать медицинскую помощь больным. Но разве эмбрион, произведенный путем клонирования, имеет меньшую ценность, чем эмбрион, порожденный слиянием яйцеклетки и сперматозоида?
Цель оправдывает средства?
Для оправдания терапевтического клонирования привлекаются богословские и утилитарные аргументы. Высказывается мысль, что общество должно быть застраховано от наиболее очевидной опасности: от имплантации клонированного эмбриона и, следовательно, появления детей-клонов. Однако следует разрешить применение методов, способствующих излечению диабета, болезни Паркинсона, болезни Альцгеймера, рака, сердечных заболеваний, артрита, ожогов и болезней спинного мозга. Этика же не может оправдать терапевтическое клонирование человека. Во-первых, нельзя создавать эмбриона просто для того, чтобы другие люди его использовали. Более того, если такие эксперименты окажутся успешными, то спрос на эмбрионы для удовлетворения человеческих нужд будет расти. К тому же, необходимо будет создавать экспериментальные эмбрионы, чтобы определить, будет ли от них медицинская польза.
Обратимся к принципам исследований человека, на концепцию этики исследований человеческого организма оказали влияние три плодотворных документа, касающихся этических норм. Это Нюрнбергский кодекс (1946-49 гг.), Бельмонтский доклад (1979 г.) и Хельсинкская декларация (1964 г., поправки внесены в 2000 г.). Хотя каждый из этих документов посвящён отдельным вопросам, из всех них вытекают общие руководящие принципы. Научные эксперименты, равно как и исследования, должны быть высочайшего качества. Предварительные эксперименты над животными должны давать плодотворные и многообещающие результаты. Если для достижения цели применим метод, не требующий экспериментов над людьми, то такие эксперименты проводиться не должны.
Пока что все клонированные животные или рождаются с генетическими аномалиями, или оказывают не в состоянии произвести на свет здоровое потомство.
Специалисты-биологи спорят о возможных причинах этого на страницах журнала Science.
Сотрудники двух известных американских научных центров использовали мышей для того, чтобы понять, что же именно нарушается в работе организма при клонировании. Выяснилось, что у клонированных мышей ДНК изменена и не вполне соответствует нормальной. Некоторые из генов, как говорят ученые, "не включаются".
"Стало быть, можно предположить: даже клоны, которые кажутся здоровыми, рождаются с нарушениями генетического кода", - говорит один из авторов исследования, профессор Рудольф Йенич.
"Экспериментировать на людях пока рано", - считает он.
Создатель Долли согласен
Такой же точки зрения придерживается и британский ученый Ян Вилмут - один из создателей известной во всем мире овечки Долли. В интервью Би-би-си он заявил: "Клонирование людей приведет к тому, что младенцы будут рождаться с серьезными отклонениями от нормы".
Очередным доказательством справедливости собственных слов профессор Вилмут и считает результаты работ американских ученых.
"Пока что результаты клонирования мы можем предсказывать только приблизительно, - говорит профессор Вилмут. - И неважно, идет ли речь о мышах, овцах, коровах или, если уж на то пошло, о людях".
Кстати, в 2002 году у знаменитой Долли было отмечено развитие артрита, который, как предполагается, мог стать результатом генных мутаций, инициированных процессом клонирования. Помимо артрита у животного наблюдался целый ряд отклонений от нормального развития, и в феврале учёные усыпили овечку из-за рака лёгких. Но опухоль могла быть и не вызвана процессом клонирования, за два года до кончины Долли умерла от той же болезни её соседка по камере.
«Мы понимали, что животное в опасности, - говорит создатель Долли Йен Уилмут из Института Рослин в Эдинбурге. - Тем более что инфекции гораздо быстрее распространяются, когда овец содержат в закрытых помещениях». Но спасать ценного клона почему-то не стали - в карантин не отправили.
Но возможно ли клонирование человека?
Учёные из США считают, что клонирование человека может оказаться неосуществимым по биологическим причинам. Они заявляют, что сотни попыток создать клон обезьяны провалились. По их словам, устройство яйцеклеток приматов, в том числе и человека, делает их клонирование практически невозможным. "Таким образом, подтверждается тот факт, что шарлатаны, сообщавшие о клонировании человека, никогда не понимали клеточной биологии настолько хорошо, чтобы добиться успеха", - заявил руководитель группы доктор Джеральд Шаттен.
Клонированию успешно подвергаются некоторые животные, в том числе мыши, овцы и другой скот, однако в последнее время появляются все более явные признаки того, что не все виды можно воспроизвести искусственным путем. Исследование, результаты которого были опубликованы в журнале Science, усиливает сомнения в том, что заявления компании Clonaid о создании первых человеческих клонов являются правдой. Эта компания, созданная последователями уфологического культа раэлитов, сообщила о рождении уже нескольких детей-клонов, однако до сих пор не предоставила убедительных доказательств
Большинство ученых сходятся на том, что попытки создать клон человека опасны и сомнительны с моральной точки зрения. Многие клоны животных появлялись на свет с теми или иными отклонениями. Здоровыми они рождались редко, сообщает BBC.
Исследователи университета Питтсбургской школы медицины попытались клонировать макаку-резус с помощью технологии, использовавшейся при создании клона знаменитой овцы Долли. После сотен попыток им так ни разу не удалось добиться беременности у носителя клона. Другим группам ученым также не удалось клонировать обезьян. Судя по всему, у приматов при делении клонированных клеток ДНК не передается новым клеткам должным образом. Некоторые клетки в итоге получают либо слишком много, либо слишком мало ДНК, и оказываются нежизнеспособными. Ученые полагают, что попытки клонировать других приматов, в том числе и человека, скорее всего, обречены на провал.
Тем временем японские ученые утверждают, что нашли альтернативу технике клонирования при выращивании отдельных органов. Исследователи из Института репродукции человека при Киотском университете объявили, что им впервые в мире удалось вернуть обычные клетки крови к тому состоянию, когда из них можно получить абсолютно любой трансплантант.
В ходе опытов у лабораторных мышей изъяли лимфоциты и при помощи электрошока объединили их с зародышевыми стволовыми клетками - предшественницами всех взрослых тканей, составляющими "тело" эмбриона. Полученный гибрид пересадили в питательную среду и по прошествии короткого времени лимфоциты превратились в клубок клеток самой разной "ориентации". В нем были намешаны начальные формы костной, мышечной, нервной и прочих тканей. Оставалось только вычленить необходимую клетку и создать условия для ее дальнейшего перерастания в отдельный орган.
Как говорят ученые, новая техника репродукции обещает прорыв в трансплантологии - донором в данном случае выступает сам же реципиент. Это также, по их мнению, позволяет обойти этические проблемы, которые возникают при клонировании, когда роль "фабрики запчастей для тела" играют зародыши-клоны.
Заключение
Итак, работы по клонированию позвоночных были начаты на амфибиях в начале 50-х годов и интенсивно продолжаются вот уже более четырех десятилетий. Что касается амфибий, то, как было сказано в соответствующем разделе, несмотря на значительные достижения, проблема клонирования взрослых особей остается до сих пор не решенной. Установлено, что в ходе клеточной дифференцировки у позвоночных происходит или потеря определенных генных локусов или их необратимая инактивация. Судя по всему, утрачивается та часть генома, которая контролирует не ранние, а более поздние этапы онтогенеза. Механизм этого явления пока не поддается научному объяснению. Но очевидно, что для клонирования взрослых позвоночных необходимо использовать малодифференцированные делящиеся клетки.
Что касается этической стороны дела, то заповеди, которыми человечество пользуется века, к сожалению, не предусматривают новых закономерностей и возможностей, какие вносит в нашу жизнь наука. Поэтому людям и необходимо обсуждать и принимать новые законы общежития, учитывающие новые реальности.
superbotanik.net
Реферат - Клонирование животных - Биология
Содержание
Тезисы
Вступление
1. Из истории исследований по клонированию животных
2. Клонирование животных
3. Методы клонирования животных
3.1. Методы трансплантации ядер
3.2. SLIC (sequence and ligation-independent cloning) методклонирования
3.3. Метод генетического перепрограммирования клеток кожи
4. Этические проблемы клонирования животных
5. Применения клонов животных
6. Эффективность клонирования животных
Выводы
Список использованной литературы
Тезисы
Клонирование, в биологии – это метод получения нескольких идентичных организмов путем бесполого (в том числе вегетативного) размножения.
Термин «клонирование» пришёл в русский язык из английского. Лишь немного изменив своё звучание и написание, он является аналогом английского clone, cloning. В самом же английском языке это слово стало употребляться (как биологический термин) менее 100 лет назад. Однако за этот небольшой для жизни слова срок оно уже успело несколько раз поменять своё значение.
Создавать животных и растения с заданными качествами всегда было чем-то чрезвычайно заманчивым так как это означало создать организмы уникальнейшие и нужнейшие, устойчивые к болезням, климатическим условиям, дающие достаточный приплод, необходимое количество мяса, молока, плодов, овощей и прочих продуктов. Использование таких технологий клонирования предполагает уникальную возможность получать фенотипически и генетически идентичные организмы, которые могут быть использованы для решения различных теоретических и прикладных задач, стоящих перед биомедициной и сельским хозяйством. В частности, использование клонирования могло бы способствовать изучению проблемы тотипотентности дифференциированных клеток, развития и старения организмов, злокачественного перерождения клеток. Благодаря технологиям клонирования предполагается появление ускоренной генетической селекции и тиражирования животных с исключительными производственными показателями. В сочетании с трансгенозом клонирование животных открывает дополнительные возможности для производства ценных биологически активных белков для лечения различных заболеваний животных и человека. Клонирование животных возможно позволит проводить испытания медицинских препаратов на идентичных организмах.
Все клетки организма животных несут одинаковую генетическую информацию. Однако в процессе морфогенеза соматические клетки дифференцируются, в результате чего часть генома репрессируется. Чем выше уровень специализации клеток, тем меньше их тотипотентность. Эта закономерность была установлена в экспериментах по пересадке ядер.
Вступление
«Клонирование» — получение потомков, являющихся точной генетической копией организма. Совокупность таких потомков-копий, происходящих от одного организма, называют клоном. Организмы в пределах каждого клона характеризуются одинаковой фенотипической однородностью и идентичным генотипом.
Термин «клон» был впервые использован в 1903 году Веббером (Webber, Германия) применительно к растениям, размножаемым вегетативно, и означал, что дочерние растения клона генетически идентичны материнскому. В настоящее время разработки в области генной инженерии позволяют клонировать не только микроорганизмы и растения, но и животных. Впервые трансплантацию ядер соматических клеток зародышей в энуклеированные клетки лягушки осуществили американские исследователи Р. Бриггс и Т. Кинг в 1952 году. Ученые, пользуясь микропипеткой, удаляли ядра из яйцеклеток шпорцевой лягушки, а вместо них пересаживали ядра клеток эмбрионов, находящихся на разных стадиях развития. Проведенные исследования показали, что ядра ранних эмбрионов в стадии поздней бластулы и даже ранней гаструлы обладают тотипотентностью и обеспечивают нормальное развитие эмбрионов. Если брать ядра из клеток зародыша на ранней стадии его развития — бластуле, то примерно в 80% случаев зародыш благополучно развивается дальше и превращается в нормального головастика. Если же развитие зародыша, донора ядра, продвинулось на следующую стадию — гаструлу, то лишь менее чем в 20% случаев оперированные яйцеклетки развивались нормально. При пересадке ядер из более дифференцированных клеток (мезодермы и средней кишки) поздней гаструлы у эмбрионов наблюдалось недоразвитие и даже отсутствие нервной системы. После пересадки ядра из клеток более позднего развития яйцеклетки вообще не развивались.
1. Из истории исследований по клонированию животных
Возможность клонирования животных доказал Дж. Гердон, английский биолог, который первым сумел получить клонированные эмбрионы шпорцевых лягушек. Он выжигал ультрафиолетом ядра икринок и затем подсаживал в них ядра, выделенные из клеток эпителия головастиков этого вида. Большая часть полученных таким образом икринок погибала, и лишь совсем маленькая их доля (2,5%) развивалась в головастиков. Взрослых лягушек получить таким образом не удавалось. Тем не менее это был успех, и результаты опытов Гердона попали во многие учебники и руководства по биологии. В 1976 г. Гердон и его соавтор Р. Ласки публикуют работу, в которой описывают опыты с ядрами, выделенными из клеток почек, кожи и легкого уже взрослых шпорцевых лягушек. Исследователи сначала подращивают эти клетки вне организма (in vitro), а затем вводят их ядра в безъядерные икринки. Четверть таких икринок начинает делиться, но вскоре замирает на одой из стадий развития. Тогда ученые выделяют ядра полученных эмбрионов и снова подсаживают их в лишенные собственных ядер икринки… В результате целой серии подобных пересадок на свет наконец-то появляется несколько головастиков. Хотя эксперименты Гердона и его последователей показали принципиальную возможность получения серийных клонов амфибий, появляющиеся на свет головастики упорно не желали превращаться во взрослых лягушек. Вопрос, таким образом, по-прежнему заключался в том, можно ли вырастить из одной специализированной клетки его тела взрослое позвоночное животное. Опыты на амфибиях давали отрицательный результат, но ученые не прекращали исследований в этой области.
Более широкие исследования, охватывающие не только амфибий, но и рыб, а также дрозофил, в 1962 г. были начаты английским биологом Дж. Гордоном. Он первым в опытах с южноафриканскими жабами Xenopus laevis) в качестве донора ядер использовал не зародышевые клетки, а уже вполне специализировавшиеся клетки эпителия кишечника плавающего головастика.
Затем Гердон вместе с Ласки (1970) стали культивировать in vitro (вне организма в питательной среде) клетки почки, легкого и кожи взрослых животных и использовать уже эти клетки в качестве доноров ядер. Примерно 25% первично реконструированных яйцеклеток развивались до стадии бластулы. При серийных пересадках они развивались до стадии плавающего головастика. Таким образом было показано, что клетки трех разных тканей взрослого позвоночного (X. laevis) содержат ядра, которые могут обеспечить развитие по крайней мере до стадии головастика.
В свою очередь Ди Берардино и Хофнер (1983) использовали для трансплантации ядра неделящихся и полностью дифференцированных клеток крови — эритроцитов лягушки Rana pipiens. После серийной пересадки таких ядер 10% реконструированных яйцеклеток достигали стадии плавающего головастика. Эти эксперименты показали, что некоторые ядра соматических клеток способны сохранять тотипотентность.
Причины, по которым ядра клеток взрослых животных и даже поздних эмбрионов остаются тотипотентными, пока точно не установлены. Решающую роль играет взаимодействие ядра и цитоплазмы. Содержащиеся в цитоплазме животных вещества принимают участие в регулировании экспрессии клеточного генов ядра[5].
Работы М. ди Бернардино и Н. Хоффера показали, что цитоплазма ооцитов амфибий содержит факторы, восстанавливающие тотипотентность ядер дифференцированных соматических клеток. Эти факторы реактивируют репрессированные участки генома.
В 1985 г. была описана технология клонирования костных рыб, разработанная советскими учеными Л.А. Слепцовой, Н.В. Дабагян и К.Г.Газарян. Зародыши на стадии бластулы отделяли от желтка. Ядра клеток зародышей впрыскивали в цитоплазму неоплодотворенных икринок, которые начинали дробиться и развивались в личинки. Эти эксперименты показали, что потеря ядром тотипотентности в процессе онтогенеза связана не с утерей генов, а их репрессией. При культивировании соматических клеток in vitro частота тотипотентности ядер увеличивается. Генетический механизм стабильной репрессии генома дифференцированных клеток не выяснен, способы восстановления тотипотентности не разработаны, поэтому в основном ведется клонирование путем трансплантации ядер эмбриональных клеток.
Пересадки ядер у млекопитающих начались позднее, в 80-х годах. Это было связано с техническими трудностями, так как зигота млекопитающих имеет небольшие размеры. Например, диаметр зиготы мыши приблизительно 60 мкм, а диаметр оплодотворенной яйцеклетки лягушки около 1200 мкм, т.е. в 20 раз больше[26].
Несмотря на перечисленные трудности, первые сообщения о получении клонов мышей, идентичных донору, появились уже в 1981 году. В качестве донора были использованы эмбриональные клетки одной из линий мышей, взятые на стадии бластоцисты. Достоверность полученных данных вначале была поставлены под сомнение, так как воспроизвести результаты проведенных экспериментов в других лабораториях не удавалось, однако пару лет спустя Дж. Мак Грат и Д. Солтер также достигли успеха. В этих экспериментах клоны мышей удавалось получить лишь в том случае, если трансплантировали ядра эмбрионов на стадии не позднее 2 бластомеров. Было показано, что ядра 8-клеточных зародышей и клеток внутренней клеточной массы бластоцисты не обеспечивают развитие in vitro реконструированных яйцеклеток даже до стадии морулы, которая предшествует стадии бластоцисты. Небольшая часть (5%) ядер 4-клеточных зародышей дает возможность развиваться только до стадии морулы. Эти и многие другие данные показывают, что в эмбриогенезе у мышей клеточные ядра рано теряют тотипотентность, что связано очевидно, с очень ранней активацией генома зародыша — уже на стадии 2-х клеток. У других млекопитающих, в частности, у кроликов, овец и крупного рогатого скота, активация первой группы генов в эмбриогенезе происходит позднее, на 8-16-клеточной стадии. Возможно поэтому первые значительные успехи в клонировании эмбрионов были достигнуты на других видах млекопитающих, а не на мышах. Тем не менее, работы с мышами, несмотря на их непростую судьбу, значительно расширили наши представления о методологии клонирования млекопитающих.
В начале пути
1883 — Открытие яйцеклетки немецким цитологом Оскаром Гертвигом.
1943 — Журнал Science сообщил об успешном оплодотворении яйцеклетки «в пробирке».
1977 — Профессор зоологии Оксфордского университета Дж. Гордон клонирует более полусотни лягушек.
1978 — Рождение в Англии Луизы Браун, первого ребёнка «из пробирки».
1985 — 4 января в одной из клиник северного Лондона родилась девочка у миссис Коттон — первой в мире суррогатной матери (зачата не из яйцеклетки миссис Коттон).
1987 — Специалисты Университета имени Дж. Вашингтона, использовавшие специальный фермент, сумели разделить клетки человеческого зародыша и клонировать их до стадии тридцати двух клеток (бластов, бластомеров).
Дж. Гордон
Первые успешные опыты по клонированию животных были проведены в середине 1970-х годов английским эмбриологом Дж. Гордоном (J. Gordon) в экспериментах на амфибиях, когда замена ядра яйцеклетки на ядро из соматической клетки взрослой лягушки привела к появлению головастика. Это показало, что техника трансплантации ядер из соматических клеток взрослых организмов в энуклеированные ооциты позволяет получать генетические копии организма, послужившего донором ядер дифференциированных клеток. Результат эксперимента стал основанием для вывода об обратимости эмбриональной дифференцировки генома по крайней мере у земноводных[18].
2. Клонирование животных
В своем эксперименте Кэмпбелл и его коллеги извлекли из эмбриона овцы на ранней стадии развития (на стадии эмбрионального диска) клетку и вырастили культуру клеток, то есть добились того, что клетка размножилась в искусственной питательной среде. Полученные генетически идентичные клетки (клеточная линия) сохранили тотипонентность. Затем ученые взяли яйцеклетку овцы-реципиента, тщательно удалили из нее весь хромосомный материал и добились ее слияния с тотипотентной клеткой из культуры. Полученные синтетические эмбрионы выращивали до стадии морулы-бластулы, а затем имплантировали в матку овцы. В результате удалось вырастить нескольких нормальных ягнят, которые были генетически идентичны.
Рис. 1. Методика, с помощью которой Кэмпбелл и его коллеги клонировали овец. Из клеток эмбрионального диска получили устойчивые культуры клеток. Из ооцитов-реципиентов удаляли часть цитоплазмы вместе с метафазной пластинкой и индуцировали слияние таких безъядерных | |
| ооцитов с клеткой из тотипотентной клеточной линии. Полученные таким образом эмбрионы временно помещались в овцу-реципиента. через неделю проверяли уровень их развития. Наконец, морулы и бластоцисты имплантировались другим овцам, где и проходил весь онтогенез. |
В принципе, после того, как получена устойчивая линия тотипонентных клеток, ничто не мешает вносить в них генетические изменения. Например, перестраивая или удаляя отдельные гены, можно создавать трансгенные линии овец и других сельскохозяйственных животных. Однако прежде чем эта технология найдет практическое применение, предстоит решить еще множество проблем.
Пока число клонированных животных очень мало по сравнению с числом исходных эмбрионов, из клеток которых удавалось получить культуру. Многие клетки погибали, не успев достичь стадии бластоцисты. Не ясно, вызван ли высокий процент неудач разнообразными вредными факторами, воздействующими на клетку при манипуляциях с нею, или гетерогенностью самой клеточной линии. Последнее менее вероятно, поскольку процент успешных случаев не меняется при пересевах культуры. Для прояснения этого вопроса необходимо исследовать другие тотипотентные клеточные линии.
Результативность пересадки ядра в яйцеклетку и ее последующее благополучное развитие зависит от адекватного перепрограммирования ядра донора. Макромолекулы (белки и транспортная РНК) ооцита отвечают за его развитие только в течение сравнительно короткого времени (между двумя клеточными делениями), и чем этот период короче, тем меньше остается времени для перепрограммирования. Клетки более зрелых эмбрионов требуют большего времени для перепрограммирования, поэтому вероятность успеха при их использовании снижается. Определенную роль играет также совместимость ядра донора и цитоплазмы реципиента, все еще слабо изученная.
Успех пересадки клеточных ядер связан по крайней мере с двумя факторами. Во-первых, овулировавшие ооциты являются лучшими реципиентами, чем зиготы, либо потому, что у неоплодотворенных яйцеклеток остается больше времени для перепрограммирования, либо потому, что их цитоплазма является более подходящей. Возможно, в цитоплазме ооцита есть элементы, необходимые для перестройки хромосом и активации генома и исчезающие после оплодотворения либо потому, что они каким-то образом связаны с реплицирующейся ДНК, либо в результате запрограммированного распада. Во-вторых, клетки с ядрами донора, взятыми на стадиях G1 или G0клеточного цикла, развиваются гораздо лучше, чем клетки с ядрами со стадий S или G2. Интуитивно это кажется понятным, ведь перепрограммировать открытый реплицирующийся геном проще.
Клонирование животных возможно с помощью экспериментальных манипуляций с яйцеклетками (ооцитами) и ядрами соматических клеток животных in vitro и in vivo подобно тому, как в природе появляются однояйцевые близнецы. Клонирование животных достигается в результате переноса ядра из дифференцированной клетки в неоплодотворённую яйцеклетку, у которой удалено собственное ядро (энуклеированная яйцеклетка) с последующей пересадкой реконструированной яйцеклетки в яйцевод приёмной матери. Однако долгое время все попытки применить описанный выше метод для клонирования млекопитающих были безуспешными. Значительный вклад в решение этой проблемы был сделан шотландской группой исследователей из Рослинского института и компании «PPL Therapeuticus» (Шотландия) под руководством Яна Вильмута (Wilmut). В 1996 году появились их публикации по успешному рождению ягнят в результате трансплантации ядер, полученных из фибробластов плода овцы, в энуклеированные ооциты. [2] В окончательном виде проблема клонирования животных была решена группой Вильмута в 1997, когда родилась овца по кличке Долли — первое млекопитающее, полученное из ядра взрослой соматической клетки: собственное ядро ооцита было заменено на ядро клетки из культуры эпителиальных клеток молочной железы взрослой лактирующей овцы. [3] В дальнейшем были проведены успешные эксперименты по клонированию различных млекопитающих с использованием ядер, взятых из взрослых соматических клеток животных (мышь, коза, свинья, корова), а также взятых у мёртвых, замороженных[4] на несколько лет, животных. Появление технологии клонирования животных вызвало не только большой научный интерес, но и привлекло внимание крупного бизнеса во многих странах. Подобные работы ведутся и в России, но целенаправленной программы исследований не существует. В целом технология клонирования животных ещё находится в стадия развития. У большого числа полученных таким образом организмов наблюдаются различные патологии, приводящие к внутриутробной гибели или гибели сразу после рождения.
В апреле 2008 года Южнокорейские таможенники приступили к дрессировке семи щенков, клонированных из соматических клеткок лучшего корейского розыскного пса породы канадский лабрадор-ретривер. По мнению южнокорейских ученых, 90 % клонированных щенков будут удовлетворять требованиям для работы на таможне, тогда как лишь менее 30 % обычных щенков проходят тесты на профпригодность.
Клонирование с целью воссоздания вымерших видов
Клонирование может быть использовано для воссоздания естественых популяций животных, вымерших по вине человека. Несмотря на наличие определённых проблем и трудностей, первые результаты в данном направлении уже имеются.
Клонирование бантенгов
В 2004 году на свет появилась пара бантенгов (диких быков, обитавших в Юго-Восточной Азии), клонированных из клеток животных, умерших более 20 лет назад. Два бантенга были клонированы из уникального «замороженного зоопарка» Сан-Диего, созданного еще до того, как люди поняли, что клонирование вообще возможно. Произведшая клонирование американская компания Advanced Cell Technology сообщила, что в нем использовались клетки животных, которые умерли в 1980 году, не оставив потомства.
Бантенгов клонировали, перенеся их генетический материал в пустые яйцеклетки обычных домашних коров; из 16 зародышей до рождения дожили только два. [7] [8]
Императорский дятел
В последний раз императорского дятла видели в Мексике в 1958 году. С тех пор орнитологи пытаются найти следы этой популяции, но безуспешно. Около десяти лет назад появились даже слухи, что птица еще живет на планете, но и они не подтвердились.
Зато в музеях остались чучела птицы. Научный сотрудник Дарвиновского музея Игорь Фадеев считает, что если операцию по выделению ДНК провести со всеми чучелами, которые находятся в разных странах мира, то дятла можно будет воскресить. В разных музеях мира на сегодняшний день осталось лишь десять чучел императорского дятла.
Если проект увенчается успехом, то в недалеком будущем на нашей планете, возможно, вновь появится императорский дятел. В Государственном Дарвиновском музее уверены, что последние методы молекулярной биологии позволяют выделить и воспроизвести ДНК этих птиц. [9]
Дронт
В июне 2006 года голландские учёные обнаружили на острове Маврикий хорошо сохранившиеся останки дронта — вымершей исторически недавно (в XVII веке) нелетающей птицы. Ранее наука не располагала останками птицы, в исчезновении которой, как всегда, виноват человек. Но теперь появилась определенная надежда на «воскресение» удивительного представителя пернатых. [10]
Клонирование гигантских птиц
Планы по клонированию исчезнувших гигантских птиц были поставлены под сомнение в результате исследований учёных Оксфордского университета. Выделив участки ДНК из останков вымерших птиц, ученые обнаружили, что их генетический материал настолько разрушен, что современная технология не позволяет провести полноценное клонирование. Цель научных работ состояла в возрождении вымерших несколько веков назад новозеландского страуса Моа, а также Мадагаскарского эпиорниса (птицы-слона).
Образцы ДНК были взяты из фрагментов тканей, сохранившихся в музеях. Однако ученые не смогли получить достаточную по своей длине цепочку ДНК, чтобы провести клонирование. Тем не менее, некоторые ученые считают, что в ближайшие годы будет разработана технология восстановления утраченных частей ДНК, путем вшивания туда «заплат» из ДНК близкородственных видов.
1970 — успешное клонирование лягушки[12]
1985 — клонирование костных рыб[13]
1996 — овечка Долли.
1997 — первая мышь.[14].
1998 — первая корова[15].
1999 — первый козёл[16].
2001 — первая кошка[17].
2002 — первый кролик[18].
2003 — первые бык[19], мул[20], олень[21].
2004 — первый опыт клонирования с коммерческими целями (кошки).[22]
2005 — первая собака (афганская борзая по кличке Снуппи).[23]
2006 — первый хорёк
2007 — вторая собака [24]
2008 — третья собака (лабрадор по кличке Чейс). Клонирована по государственному заказу[25]. Начало коммерческого клонирования собак[26]
3. Методы клонированияживотных
Последние десятилетия XX века ознаменовались бурным развитием одной из главных ветвей биологической науки — молекулярной генетики. Уже в начале 70-х годов ученые в лабораторных условиях начали получать и клонировать рекомбинантные молекулы ДНК, культивировать в пробирках клетки и ткани растений и животных. Возникло новое направление генетики генетическая инженерия. На основе ее методологии начали разрабатываться различного рода биотехнологии, создаваться генетически измененные организмы (ГМО). Появилась возможность генной терапии некоторых заболеваний человека, а последнее десятилетие XX века ознаменовалось еще одним важным событием — достигнут огромный прогресс в клонировании животных из соматических клеток.
Особенно большой резонанс у мировой общественности получили исследования шотландских ученых из Рослинского Университета, которым удалось из клетки молочной железы беременной овцы получить генетически точную ее копию. Клонированная овца по кличке Долли нормально развивалась и произвела на свет сначала одного, а затем еще трех нормальных ягнят. Вслед за этим появился ряд новых сообщений о воспроизведении генетических близнецов коров, мышей, коз, свиней из соматических клеток этих животных. У приматов, в частности, у обезьян пока не удалось получить клоны с использованием клеток взрослого организма, плода или даже эмбриональных стволовых клеток.
Тем не менее работы в этом направлении активно ведутся. В прошлом году появилось сообщение о клональном размножении потомства приматов путем деления зародыша. Американским исследователям удалось получить генетически идентичные эмбрионы обезьяны резус путем разделения бластомеров зародыша на стадии деления. Из эмбриона родилась вполне нормальная обезьянка Тетра.
Такой тип клонирования обеспечивает генетически идентичное потомство, и в результате можно получить двойню, тройню и более генетических близнецов. Это позволяет проводить теоретические исследования по эффективности новых методов терапии тех или иных заболеваний, появляется возможность повторять научные эксперименты на абсолютно генетически идентичном материале. Имплантируя зародыши последовательно одной и той же суррогатной самке, можно исследовать влияние ее организма на развитие плода [31].
Разработанные методы клонирования животных пока еще далеко не совершенны. В процессе экспериментов наблюдается высокая смертность плодов и новорожденных. Еще не ясны многие теоретические вопросы клонирования животных из отдельной соматической клетки.
Тем не менее успех, достигнутый в клонировании овцы и обезьян, показал теоретическую возможность создания генетических копий также человека из отдельной клетки, взятой из какого-либо его органа. Многие ученые с энтузиазмом восприняли идею клонирования человека.
3.1 Методы трансплантации ядер
В нашей стране Б.В. Конюховым и Е.С. Платоновым в 1985 г. был разработан метод менее травматического переноса ядер методом микроманипуляции. Он протекает в два этапа: сначала тонкой микропипеткой прокалывают зоны пеллюцида и плазматической мембраны и извлекают пронуклеусы, а затем другой пипеткой, большего диаметра (12 мкм) в то же отверстие вводят диплоидное ядро донора. В этом случае меньше травмируется цитоплазма зиготы и транспортируемое ядро донора.
Трансплантация ядер может осуществляться и другим способом, с использованием цитохалазинов (веществ, синтезируемых грибами).
Цитохалазин В разрушает структуру микрофиламентов и способствует уникальному расположению ядра. Ядро остается соединенным с клеткой тоненьким стебельком цитоплазмы. При центрифугировании этот мостик разрывается, образуются безъядерные клетки (цитопласты) и кариопласты, представляющие собой ядра, окруженные тонким слоем цитоплазмы и цитоплазматической мембраной. Цитопласты отделяют от интактных клеток в градиенте плотности. Они сохраняют способность прикрепляться к поверхности культурального сосуда и могут быть использованы для слияния с кариопластами других клеток с целью получения жизнеспособной клетки [14][12].
Методы выделения кариопластов несколько сложнее и включают в себя ряд операции по центрифугированию, разделению в градиенте плотности и т.д. В некоторых случаях к смеси клеток и кариопластов добавляют частицы тантала диаметром 1 – 3 мкм. Они проникают в клетки и никогда в кариопласт, поэтому более тяжелые клетки осаждаются быстрее кариопластов.
Цитопласты содержат все виды органелл, присущие нормальной клетке, сохраняют способность прикрепляться к субстрату, образовывать складчатую мембрану, передвигаться, осуществлять пиноцитоз.
Кариопласты окружены тонким слоем цитоплазмы (около 10% от всей клеточной цитоплазмы), содержат компактный эндоплазматический ретикулум, несколько митохондрий и рибосом. У некоторых клеточных линий 1/10 кариопластов способна восстановить весь утраченный объем цитоплазмы и восстановиться в жизнеспособные клетки.
Для реконструкции клеток суспензию кариопластов в солевом буфере добавляют к монослою культуры цитопластов из пропорции 100 кариопластов на 1 цитопласт. Цитопласты должны быть уже покрыты инактивированными вирусными частицами. Инкубируют при температуре 4оС 45 минут, а затем еще 45 минут при температуре 37оС. Отмывают раствором Эрла для удаления не слившихся кариопластов [8].
3.2 SLIC (sequenceandligation-independentcloning) метод клонирования
Стив Элледж и неутомимая Мами Ли в очередной раз порадовали научное сообщество оригинальным методом клонирования. Новыйметодполучилназвание SLIC (sequence and ligation-independent cloning). Новинка является модификацией известного метода LIC (ligation-independent cloning) — клонирования без использования лигазы. Для того чтобы вставить фрагмент ДНК в вектор при помощи классического метода LIC, достаточно смешать вектор и вставку, на концах которых расположены протяженные одноцепочечные участки, комплементарные друг другу. При этом вставка «прилипает» к вектору, образуя рекомбинантную плазмиду с никами в обеих цепях. Полученной плазмидой трансформируют Е.coli, система репарации которой восстанавливает нормальную структуру плазмиды.
Метод SLIC — это то же самое, что и LIC с единственной разницей: «слипание» вектора и вставки проводят в присутствии белка RecA. Эта незначительная модификация метода позволяет добиться достаточно высокого выхода (1 нг. вектора способен дать 3900 трансформантов) а также упростить саму процедуру клонирования. Так если для классического метода LIC необходимо точно подогнать размер одноцепочечных участков у вектора и вставки (чтобы в итоге на стыке вектора и вставки получились ники), то метод SLIC допускает наличие протяженных гэпов [19].
Фактор RecA- один из ключевых факторов репарации и рекомбинации E.coli. Связываясь с одноцепочечным участком ДНК, RecA стимулирует процесс «strand exchange» (в ходе этого процесса одноцепочечный участок одной молекулы ДНК встраивается в гомологичный двухчепоченый участок другой молекулы ДНК, образуя D-петлю). Очевидно, добавление RecA in vitro на шаге клонирования позволяет E.coli эффективнее репарировать плазмиду in vivo.
Для успешного клонирования необходимо наличие 30-ти нуклеотидных участков гомологии по краям вектора и вставки. Получать одноцепочечные участки предлагается с помощью T4 ДНК-полимеразы без добавления нуклеотидов. При помощи SLIC в один вектор можно запихнуть сразу 5 вставок в одну стадию без снижения выхода. Наконец, высокий выход позволяет использовать метод SLIC при клонировании библиотек [7].
3.3 Метод генетического перепрограмирования клеток кожи
Разработан новый метод клонирования – менее трудоемкий, чем способ, благодаря которому была создана овечка Долли. В связи с этим возникли опасения, что однажды он будет использован для обработки эмбрионов человека, дабы формировать детей «по заказу».
Ученые, благодаря этому методу получившие мышат из клеток кожи взрослых особей, обнаружили: такая технология намного более эффективна, чем способ создания Долли, а побочных эффектов у нее меньше – следовательно, она лучше подходит для использования применительно к человеку.
Для клонирования мышей ученые вводили клетки кожи, взятые у взрослой особи, в ткани эмбриона на ранней стадии развития, полученного путем экстракорпорального оплодотворения (ЭКО). Некоторые из детенышей оказались частичными клонами особей-доноров, а некоторые, как и Долли, стопроцентными.
Однако, в отличие от «метода имени Долли», этот способ настолько прост и эффективен, что возникли опасения: в клиниках, где практикуется ЭКО человека, им могут воспользоваться для помощи бесплодным супружеским парам, которые мечтают о полностью «своем» в биологическом отношении ребенке[11].
Метод предполагает генетическое перепрограммирование клеток кожи, в результате которого они возвращаются в квазиэмбриональное состояние. В прошлом году, когда эта революционная методика впервые была применена к клеткам кожи человека, Католическая церковь и президент Джордж Буш высоко оценили ее как нравственно-приемлемый способ получения эмбриональных стволовых клеток, не сопряженный с необходимостью создавать или уничтожать человеческие эмбрионы [13].
Однако тот же метод уже используется в иных целях – для воспроизводства потомства лабораторных мышей, которое является либо стопроцентными клонами, либо генетическими «химерами» взрослых мышей, клетки кожи которых подверглись перепрограммированию.
Эксперименты на мышах показали, что в принципе теперь возможно взять клетку кожи человека, перепрограммировать ее для возврата в эмбриональное состояние, а затем ввести ее в эмбрион человека на ранней стадии. В результате получится ребенок, обладающий некоторыми общими генами не только с родителями эмбриона, но и с человеком, у которого были взяты клетки кожи.
Такой ребенок является химерой – генетической «помесью» двух или большего числа особей – так как некоторые из его клеток происходят от эмбриона, а другие – от клетки кожи. Фактически у такого ребенка будет три биологических родителя. Известны химеры человека, возникающие в естественных условиях – когда в матке соединяются два эмбриона. Часто подобные люди являются совершенно нормальными и здоровыми. По словам доктора Ланцы, нет причин предполагать, что люди-химеры, созданные при помощи нового метода, будут нездоровы.
Более того, эксперименты на мышах показали, что возможно создавать полные клоны – детенышей, которые на 100% идентичны взрослой особи в генетическом плане. Этого удалось достигнуть, используя разновидность дефективных эмбрионов мышей с четырьмя наборами хромосом вместо нормального числа – двух.
Этот «тетраплоидный» эмбрион, развиваясь, превращался исключительно в плаценту плода; когда же в него ввели перепрограммированную клетку кожи, остальная часть плода развилась из этой единственной клетки и сделалась стопроцентным клоном взрослой особи, кожа которой использовалась [15].
Никто из ученых, разрабатывающих методы перепрограммирования клеток для производства индуцированных плюрипотентных стволовых клеток (induced pluripotent stem, сокращенно iPS) – так называют эмбриональные клетки – не планирует применять их в репродуктивной медицине человека. Главная цель ученых – наладить производство стволовых клеток для терапевтического лечения таких заболеваний, как болезнь Паркинсона, болезнь Альцгеймера и инсульт [3].
4. Этические проблемы клонирования животних
Члены Европарламента на пленарном заседании ассамблеи в Страсбурге проголосовали «широким большинством голосов» против клонирования животных в продовольственных целях, сообщил РИА Новости представитель пресс-службы Европарламента.
На сегодняшний день нигде в мире продукты из мяса животных-клонов не продаются, однако, по мнению экспертов, они могут появиться на продовольственных рынках к 2010 году, в частности, в США. В марте комитет по безопасности продуктов питания при правительстве Японии сделал заключение о том, что мясо клонированных коров и свиней безопасно.
Европейское агентство по продовольственной безопасности (EFSA) в январе прошлого года обнародовало предварительное заключение, согласно которому, мясо и молоко клонированных животных пригодно в пищу. Эксперты EFSA, проводившие исследование по поручению Еврокомиссии, считают «очень маловероятным, что существует какое-либо отличие в плане продовольственной безопасности» между мясом и молоком животных-клонов и их сородичей, выращенных традиционным путем.
Независимая Европейская экспертная группа по этике в области науки и новых технологий (EGE), со своей стороны, высказала сомнения в оправданности возможности потребления человеком мяса и молока животных-клонов. Эксперты EGE исходят из того, что подсадка эмбрионов клонов самкам домашних животных является болезненным процессом и зачастую чревата их гибелью, а сами клонированные животные преждевременно стареют и очень уязвимы в плане здоровья.
Решение о разрешении к продаже мяса и молока животных-клонов надлежит принимать Еврокомиссии совместно со странами-членами ЕС [24].
5. Применения клонов животных
Клоны не всегда выглядят одинаково. Хотя у клонов один и тот же генетический материал, окружающая среда так же играет огромную роль в том, как приспособится к ней организм клонированного существа. К примеру, первая кошка, которая была клонирована, ее звали Сиси, была каленкорской породы и была совсем не похожа на свою мать (донора) [21].
Репродуктивное клонирование может позволять исследователям клонировать животных с потенциальной выгодой для областей медицины и сельского хозяйства. Например, те же самые Шотландские исследователи, которые клонировали Долли, клонировали другую овцу, которая была генетически модифицирована, чтобы давать молоко, которое содержит человеческую основу белка для крови. Мы надеемся, что в дальнейшем этот белок может отбираться из молока и подаваться человеку в чистом виде, это очень поможет людям, у которых низкая свертываемость крови. Так же можно использовать животных для того чтобы тестировать на них новые виды лекарств и обычную продукцию, предназначенную для человека. Большое преимущество использования клонированных животных для проверки на таблетки состоит в том, что все они являются генетически идентичными, что означает, что их реакция на таблетки должна быть боле менее сходной, чем у животных с различным генетическим набором.
Другой причиной для клонирования может служить то, что существуют популяции животных, которые стоят на грани вымирания. В 2001 году именно по этой причине ученые произвели первого клона, подвергнутого опасности вымирания — азиатского вола.
Детеныш, который развивался в матке у своей мамы-заместителя погиб всего лишь через три дня после своего рождения. Этот опыт был перенят и уже через два года, в 2003 году, ученые создают клон особи вола, так же стоящего на грани исчезновения. Вскоре 3 африканских диких кошки были клонированы из замороженных эмбрионов, которые были использованы в качестве ДНК. Несмотря на то, что некоторые эксперты считают, что клонирование спасает особи, стоящие на гране вымирания; некоторые ученые считают, что клонирование несет негативный характер, так как все особи имею генетически идентичный набор хромосом, что в целом играет отрицательную роль, так как для выживания разновидности необходимы разные варианты ДНК.
Некоторые люди так же проявили интерес в том, чтобы их умерших домашних любимцев клонировали, надеясь, что эти клоны будут абсолютно такими же как и их умерший донор. Но как показало клонирование Кошки Сиси, клон не всегда выглядит так же, как и его «оригинал», у которого было взято ДНК [4].
Репродуктивное клонирование — очень неэффективная техника и большинство клонированных животных эмбрионов, не могут развиваться в здоровых особях. Например, Долли была единственным клоном, который был рожден живым из общего количества 277 клонированных эмбрионов. Эта очень низкая эффективность, объединенная беспокойствами по поводу безопасности, представляет серьезное препятствие для применения репродуктивного клонирования. Исследователи выявили некоторые проблемы со здоровьем у овцы и других млекопитающих, которые были клонированы. Это увеличение размера плода при рождение и разнообразные дефекты в жизненных органах, типа печени, мозга и сердца. Другими последствиями являются преждевременное старение и проблемы с иммунной системой.
Другая потенциальная проблема заключается в возрасте хромосомы клонируемой клетки. Все клетки проходят их нормальные стадии деления. Кончик хромосомы, который называется теломером с каждым делением укорачивается. Через какое-то время теломер становится настолько маленьким, что клетка не может больше делится, и в конечном итоге погибает. Это обычный процесс старения, который присущ всем типам клеток. Следовательно, клоны, созданные от клетки, принятой от взрослой особи, могут иметь хромосомы, которые уже короче, чем нормальная, и это может повлиять на быстрое старение клонированной особи. И действительно, Долли, которая была клонирована от клетки шестилетней овцы, имела хромосомы, теломеры которого были короче, чем у овец ее возраста. Долли умерла в возрасте 6 лет, приблизительно половина продолжительности жизни овцы, которая составляет 12 лет [27].
6. Эффективность клонирования животных
Клонирование млекопитающих методом переноса ядер сопровождается патологией в эмбриональный, плодный и неонатальный периоды развития клонов. Возможными причинами аномалий у клонированных животных могут быть ошибки репрограммирования генома, повреждение наследственного материала при культивировании эмбрионов in vitro и сама процедура переноса ядер [9].
Значительная часть выживших клонов обладает рядом нарушений, возникающих из-за несоответствующего эпигенетического репрограммирования генома. Суть проблемы заключается в том, что развитие клонированного животного происходит за счет реализации генетической информации, заключенной в хромосомах донорского ядра из дифференцированной соматической клетки, при этом состояние активности разных генов в соматических и эмбриональных клетках значительно отличается. В соматических клетках в активном состоянии находятся гены, характерные для дифференцированной ткани и ответственные за синтез специфических белков. В то же время для развития эмбриона на ранних стадиях требуется, чтобы синтезировались совершенно другие белки, информация о которых закодирована в генах раннего развития.
В процессе естественного полового размножения зигота образуется в результате слияния мужской и женской половых клеток. В процессе гаметогенеза в половых клетках происходит ремоделирование наследственного материала, т.е. его подготовка к дальнейшим процессам оплодотворения и раннего развития. В момент оплодотворения их гены «молчат», с них не происходит считывания информации. Ядро соматической клетки при его переносе в энуклеированный ооцит не «молчит», в нем активно происходят процессы транскрипции (считывания) [21].
Первые успешные опыты по клонированию доказали, что соматическое ядро в цитоплазме ооцита подвергается репрограммированию — процессу переориентирования донорского генома на синтез белков, соответствующих раннему зародышу. Становятся активными те участки хромосом, которые усиленно работают у раннего зародыша. Во многих случаях процесс репрограммирования генома ядерного трансплантата является неполным, что и приводит к ранней остановке развития эмбрионов.
Существует и другая проблема, связанная с так называемым геномным импринтингом. Явление геномного импринтинга состоит в том, что для нормального развития организма необходимы гены как отцовского, так и материнского происхождения. Известно, что определенные гены так импринтированы в процессе гаметогенеза, что после процесса оплодотворения экспрессируется только отцовский или только материнский аллель. При переносе соматического ядра в энуклеированный ооцит этот механизм может нарушаться, поскольку после их слияния происходит сложная функциональная перестройка всего клеточного генома, в течение которой велика вероятность ошибок.
В данных работах приводится информация о различиях в организации материнского и отцовского хроматина, подчеркивается роль метилирования в подавлении активности генов. Высказывается предположение, что причиной низкой выживаемости животных, полученных в результате переноса ядер, являются генетические нарушения (мутации), аккумулирующиеся в процессе старения клеток организма-донора ядер или во время их культивирования в условиях in vitro.
Высокая частота возникновения аномалий и их межвидовое сходство, а также получение здорового потомства от животных-клонов говорит в пользу эпигенетической природы возникновения таких нарушений, то есть наиболее достоверным объяснением пороков развития является неспособность реконструированных эмбрионов соответствующим образом репрограммировать статус ядра соматической клетки[22].
В работах R. Jaenisсh обсуждается проблема укорачивания концевых участков хромосом (теломер) в клетках клонированных животных. С началом дифференцировки в большинстве клеток происходит необратимое укорачивание концевых участков хромосом, что ставит вопрос о том, наследуют ли клонированные животные укороченные теломеры их генетических родителей и подвержены ли они вследствие этого преждевременному старению. Укорачивание теломер зарегистрировано у первой клонированной овцы Долли, но не отмечено у клонированных в 2000 г. телят. Было установлено, что активность фермента теломеразы, удлиняющего концевые участки хромосом, в ядерных трансплантатах находится на уровне, сходном с контролем. Теломераза полностью восстанавливает длину теломер донорского генома на стадии раннего эмбриона, и, как считает автор статьи, этот фактор не может влиять на выживаемость клонов.
Клонирование методом переноса ядер неодинаково эффективно при использовании в качестве доноров дифференцированных соматических и тотипотентных эмбриональных стволовых клеток. Реконструированные эмбрионы с геномом эмбриональной стволовой клетки, достигшие стадии бластоцисты, развиваются до рождения в 10-20 раз чаще, чем эмбрионы, полученные после переноса ядер соматических клеток. Эти наблюдения дают основания предполагать, что ядру недифференцированной эмбриональной клетки в отличие от дифференцированной требуется лишь незначительное репрограммирование. Это объясняется сходством эпигенетического статуса геномов эмбриональных стволовых клеток и клеток раннего эмбриона. Под эпигенетическим статусом в генетике развития понимается сумма всех взаимодействий генов со средой их функционирования.
Ранее было показано, что родившиеся животные-клоны часто проявляют признаки нарушения дыхания и кровообращения, при рождении имеют повышенный вес тела и плаценты, вследствие чего этой патологии был присвоен термин «синдрома крупного молодняка». Авторами данных статей, однако, не было установлено какой-либо взаимосвязи между изменением активности ряда импринтированных генов у клонов и повышенным весом; аномалии в экспрессии генов носили случайный характер.
Полученные результаты свидетельствовали о значительных вариациях в активности и уровне метилирования импринтированных генов в плацентах и тканях мышат, полученных в результате трансплантации ядер из эмбриональных стволовых клеток. Чтобы выяснить, являются ли эти нарушения результатом изменения импринтинга в донорской популяции ЭС клеток или следствием неправильного репрограммирования донорского генома после пересадки ядер, у нескольких линий ЭС клеток вызывалась направленная дифференцировка добавлением ретиноевой кислоты. В результате выяснилось, что имеются значительные вариации в уровне экспрессии импринтированных генов не только между разными линиями ЭС клеток, но и между различными субклонами одной линии ЭС клеток (т.е. между ЭС клетками, берущими начало от одной-единственной родительской клетки). Эти аномалии возникают в процессе культивирования ЭС клеток в условиях in vitro[27].
Независимо от типа клеток, используемых в качестве доноров ядер, только небольшой процент реконструированных эмбрионов (1-3%) развиваются до рождения, из них менее половины достигают стадии половозрелости. Это поднимает вопрос о том, имеет ли вообще место нормальная регуляция взаимодействия генов у клонированных животных. Рождение здоровых клонов может объясняться толерантностью развития млекопитающих к большей части эпигенетических нарушений, а летальный эффект вызывается кумулятивным действием потерь нормальной регуляции генов во многих локусах.
В заключение авторами статей делается вывод, что, по всей вероятности, клоны всех видов млекопитающих, включая людей, будут обладать эпигенетическими аномалиями и связанным с ними фенотипом. Поскольку эмбриональные стволовые клетки являются потенциальным источником многих типов клеток для использования в целях трансплантационной терапии, очень важно установить, характерно ли состояние эпигенетической нестабильности для ЭС клеток человека, и оценить значение этого явления на перспективы применения ЭС клеток в медицине[13][24].
Выводы
Клонирование – процесс создания генетически сходного организма несексуальным (неполовым) путем. Клонирование использовали много лет для выращивания растений. Животное клонирование было предметом изучения для ученых многие годы, но получало мало внимания до 1997, пока не было клонировано первое млекопитающее — овечка Долли. Ученный Долли и несколько других ученых клонировали различных животных, включая коров и мышей. Недавний успех клонирования привел к жестким дебатам среди ученых, политиков и широкой публики об использование и этике клонирования животных и возможно человека.
За последние 50 лет, ученые провели эксперименты по клонированию в обширном круге животных, использовав много различных методов. В 1979, исследователи произвели первых генетически идентичных мышей, расколов эмбрион мыши в экспериментальной трубе, а затем внедрив получившийся эмбрион в матку взрослой самки мыши. Вскоре после того, как исследователи произвело первых генетически идентичных коров, овцу и цыплят, перемещая ядро клетки, взятой у раннего эмбриона в яйцо, у которого было освобождено ядро.
Главная причина клонирования животных в том, чтобы произвести организмы с определенными качествами, которые необходимы человеку, например овца была выведена чтобы предоставить человеческий инсулин. Если бы ученые полагались только на половое (сексуальное) размножение чтобы вывести этих животных, они бы рисковали тем, что необходимые им качества исчезли, так как половое размножение (сексуальное) переставляет генетический код в блоках. Другими причинами для клонирования могут быть потерянные или умершие домашние животные или животные, которые находятся на грани вымирания. Какими бы не были причины, новые технологии клонирования разожгли много этических спорах среди ученых. Некоторые государства рассмотрели или предписали законодательство, чтобы замедлить, ограничить или запретить эксперименты клонирования. Ясно, что клонирование будет частью нашей жизни в будущем, но будущее этой технологии должно всё же быть определено.
Список использованной литературы
1. С.И.Заир – Бек, И.В.Муштавинский, Развитие критического мышления на уроке, — М.; Просвещение,2004.
2. Газета «Биология» Издательского дома «Первое сентября», № 12/2003.(Л.В. ЯКОВЕНКО Медицина и клонирование)
3. Газета «Биология» Издательского дома «Первое сентября», № 30/2003.(Голем третьего тысячелетия. Религиозные и исторические последствия клонирования)
4.Газета «Первое сентября» Издательского дома «Первое сентября», № 12/2003 ( Василий ЧЕШИРСКИЙ.Самая тонкая цепочка. Что такое клонирование с биологической точки зрения?)
5.Газета «Первое сентября» Издательского дома «Первое сентября», № 15/2003. (А.ВОЛКОВ. Клонирование: мертвый сезон)
6. Газета «Первое сентября» Издательского дома «Первое сентября», № 15/2003.(А.ГРУДИНКИН, Рождены по ошибке. Клонированные организмы чаще всего нежизнеспособны. Почему?) 7. Афонькин С. Ю. Долли бросает вызов, или размышления о клонировании людей. Биология. N 6, 1999.
8. Бутенко Р. Г. Биология клетки и биотехнология. Наука и человечество, 1987.
9. Дейвор Сольтер. Разведение овец путем пересадки клеточных ядер. Биология. N 38, 1997.
10. Кот М. М. Селекция животных. Перспективы развития. Биология в школе. N 2, 1991.
11. Преждевременное старение Долли (обзор журнала «Nature»). Знание-сила. N 9-10, с. 10, 1999.
12. Рувинова Э. И. Еще раз о клонировании. Биология. N7, 1998.
13. Чижиков Максим. Клонирование, сэр! Комсомольская правда. 5 апреля 2000.
14. Чикин Максим. Овечка Долли стареет не по дням, а по часам! Комсомольская правда. 1999.
15. Чойрыш А. И. Правовые и этические проблемы клонирования человека. Государство и право. N 11, 1998, с. 87-93.
16. В.А.Струнников «Клонирование животных: теория и практика», «Природа», №7, 1998 г.
17. Е.В.Мохов. «В ЧЕМ СЕКРЕТЫ ДОЛГОЛЕТИЯ. ПОЧЕМУ МЫ ЖИВЕМ ТАК МАЛО?..»
18. Соровский образовательный журнал, 1999 №4, клонирование животных, Л.И.Корочкин.
19. Журнал «Человек», 1998 №3, Долли – случайность или закономерность? Конюхов Б.В.
20. Журнал «Свет: природа и человек», 1999 №1.
21. Журнал «Студенческий меридиан», 2001 январь.
22. Журнал «Природа», 1998 №7, клонирование животных: теория и практика Струнников В.А.
23. Афонькин С. Ягнята Франкенштейна //Химия и жизнь. — 1999. — № 3.
24. Краснопольская И. Медицина, которой мы не знали // Российская газета. — 2002. — №40 (2908).
25. Кирпанев В.П. Этика клонирования: жизнь или смерть? — Ставрополь, 2004.
26. Дягтерев Н.Д. Клонирование: Правда и вымысел — 128 с. Наука и жизнь: За гранью очевидного
27. Корочкин Л.И. Клонирование Наука сегодня
28. Н. Грин, У. Стаут, Д. Тейлор, Биология, Москва, «Мир», 1993 г.
29. Ф. Киберштерн, Гены и генетика, Москва, «Параграф», 1995 г.
30. Стивен Вир «Клонирование человека аргументы в защиту» //Русская газета
31.Кузина С., Черкасов И: «Клонирование человека: Происки дьявола или победа науки» // Комсомольская правда, 2007 г.
32. Кутковец Т.И., Юдин Б.Г. Уроки незаконченной дискуссии // Человек. 1998
33. Баев А.А. «Геном человека»: некоторые этико-правовые проблемы настоящего и будущего//Человек, 1995, №2
34. Дубинин Н.П. Генетика вчера, сегодня, завтра. М., «Советская Россия», 1981
www.ronl.ru
Реферат на тему Клонирование
ПЛАН Введение 1. История клонирования 2. За и против клонирования Заключение Список литературыВведение Последние десятилетия XX века ознаменовались бурным развитием одной из главных ветвей биологической науки - молекулярной генетики. Уже в начале 70-х годов ученые в лабораторных условиях начали получать и клонировать рекомбинантные молекулы ДНК, культивировать в пробирках клетки и ткани растений и животных. Возникло новое направление генетики - генетическая инженерия. На основе ее методологии начали разрабатываться различного рода биотехнологии, создаваться генетически измененные организмы (ГМО). Появилась возможность генной терапии некоторых заболеваний человека, а последнее десятилетие XX века ознаменовалось еще одним важным событием - достигнут огромный прогресс в клонировании животных из соматических клеток. Разработанные методы клонирования животных пока еще далеко не совершенны. В процессе экспериментов наблюдается высокая смертность плодов и новорожденных. Еще не ясны многие теоретические вопросы клонирования животных из отдельной соматической клетки. Тем не менее, многие ученые с энтузиазмом восприняли идею клонирования человека. Опрос общественного мнения в США показал, что 7% американцев готовы подвергнуться клонированию. Вместе с тем, большинство ученых и многие политики высказываются против создания клонов человека. И их возражения и опасения вполне оправданы. Цель данного реферата – определить положительные и отрицательные стороны клонирования.
1. История клонирования Клон – (от греч. сlon – отпрыск, ветвь) это группа клеток или организмов, происшедших от общего предка путём бесполого размножения и являющихся генетически идентичными. Примером клона можно назвать группу бактериальных клеток, образовавшихся в результате деления исходной клетки, потомков морской звезды, регенерировавших из частей разделённого материнского организма, клоном также являются все кусты или деревья, полученные путём вегетативного размножения. Однако вот млекопитающим способность размножаться путём клонирования природа не "предусмотрела". Высокий уровень дифференциации клеток как бы "обратной стороной медали" обозначает утрату ними способности давать начало новому организму. Однако, как показала практика, ядро даже дифференцированной клетки сохраняет все потенции, необходимые для того, чтобы дать начало новому организму. Суть клонирования проста: требуется две клетки – одна, которая будет донором ядра и хозяин которой клонируется, и яйцеклетка, развитием которой и будет управлять подсаживаемое ядро. Собственное ядро яйцеклетки должно быть уничтожено (клетка энуклеирована). Опыт также показывает, что для клонирования лучше, если яйцеклетка не оплодотворена. Клетку-донор тем или иным способом заставляют перейти в так называемую G0-фазу или стадию покоя. После этого её ядро либо путём пересадки, либо слиянием клеток доставляется в яйцеклетку. Последняя стимулируется к делению и приступает к формированию эмбриона. Последний подсаживается в матку так называемой суррогатной матери, где в случае удачного развития формирует новый организм, являющийся генетически идентичным тому, который был донором ядра. Сейчас наиболее известны два варианта данной методики – так называемая Рослинская и Гонолульская технологии. Первая была использована при клонировании овцы Долли Яном Вильмутом и Китом Кембеллом из Рослинского института в 1996, а вторая – группой учёных из Университета Гавайи в 1998, в результате чего было получено полсотни клонов мыши. История клонирования весьма насыщена и динамична. Первые опыты, связанные с клонированием, по крупному счёту, начали проводить лишь около сотни лет назад. Вот вкратце весь список основных открытий, в результате которых "копирование" живых организмов стало возможным. 1902 – Ганс Шпеманн проделывает опыт по разделению раннего эмбриона саламандры. Обе части зародыша развиваются в нормальных животных. Опыт доказывает, что даже отдельные клетки содержат информацию, достаточную для формирования целого нового организма. 1928 – тот же Шпеманн производит первую пересадку клеточного ядра, тем самым закладывая основы метода, который будет ключевым в будущих экспериментах по клонированию. 1952 – учёные Бриггс и Кинг путём клонирования получают поколение головастиков. 1958 – Ф. Стьюард выращивает целое растение моркови из единственной клетки. 1962 – Дж. Гердон получает клон лягушки, выращенный из дифференцированных клеток взрослого животного. 1963 – Дж.Б.С. Холдейн вводит термин "клон". 1981 – Карл Иллменси и Питер Хоппе объявляют, что им удалось клонировать мышь путём пересадки ядра из клетки эмбриона в яйцеклетку. Однако их результаты не удаётся подтвердить другим специалистам. Позже выясняется, что результаты опыта были сфальсифицированы. 1984 – датский учёный Стин Вилладсен сообщает, что ему удалось клонировать овцу из клеток недельного эмбриона путём так называемого "сдваивания" ("twinning"). 1986 – Фёрст, Пратер и Айстоун клонируют корову из эмбриональных клеток. 1990 – начало проекта "Геном человека". 1994 – Нил Фёрст получает генетические копии телят из эмбриональных клеток. Зародыши достигают по крайней мере 120-клеточной стадии. 1996, июль – рождение овцы Долли, первого крупного животного, клонированного с использованием ДНК взрослого животного (клеток молочной железы). Опыт удался с 276 попытки. Официально это событие было освещено лишь в 23 февраля 1997. После Долли учёные шотландского Института Рослин (Roslin Institute) клонировали ещё 7 ягнят трёх различных пород. 1997, 4 марта – в ответ на бурную реакцию общественности, вызванную дискуссиями относительно возможности клонирования человека, президент США Билл Клинтон подписывает 5-летний меморандум, запрещающий использование государственных средств на опыты по клонированию человека на территории страны. 1997, июль – команда учёных, клонировавших Долли, представляет Поли – клонированную овцу, содержащую человеческие гены. Развитие темы относительно получения необходимых человеку белков от клонированных животных в промышленном масштабе. 1997, декабрь – клонирование Долли признано журналом Science научным достижением года. 1997 – Ричард Сид объявляет о планах заняться клонированием человека. 1998, июль – группа учёных из Гавайского института объявляет, что с октября 1997 клонировала 50 мышей из дифференцированных клеток, при этом используя новую методику, которая обещает быть более эффективной, нежели использованная при клонировании Долли. 1998, декабрь – японские учёные сообщают, что получили 8 клонов из клеток взрослой коровы – третьего клонированного млекопитающего. 1999, май – Институт Рослин покупается биотехнологической компанией Geron. Вскоре Япония, Индия и большинство европейских стран принимают законопроекты, запрещающие клонирование, либо регулирующие исследования в данном направлении. (Однако уже достаточно скоро законодательное давление начинает слабеть). 2000, март – группа, клонировавшая Долли, клонирует свинью. Учёные выражают надежды на использование генетически модифицированных свиней в качестве доноров органов для трансплантации. 2002, февраль – японские учёные сообщают, что клонированные ними мыши гибнут в раннем возрасте, а также подвержены ожирению. Они выражают сомнение относительно безопасности клонирования. 2002, февраль – американские специалисты представляют 2-месячного клонированного котёнка, названного СС (от "carbon copy"). 2002, май – американский специалист по репродуктивной медицине Панайотис Завос (Panayiotis Zavos) из Лексингтона, Кентукки обещает приступить к клонированию человека позже в этом же году. 2002, ноябрь – итальянский учёный Северино Антинори сообщает, что одна из пациенток, участвующих в его проекте, должна родить клонированного ребёнка (мальчика) в январе 2003. По его словам, клоны вынашивают ещё по крайней мере две женщины. 2002, декабрь – представители компании Clonaid обещают представить миру первого клонированного ребёнка ещё до конца 2002 года. 2002, 27 декабря – Clonaid сообщает о рождении первого клонированного ребёнка (девочки Евы). По их словам, ребёнок, появившийся на свет путём кесарева сечения 26 декабря, при рождении имел вес около 3,1 кг и чувствует себя вполне нормально. В ближайшие недели компания ожидает рождения ещё нескольких детей. Итак, по утверждению Бриджит Буаселье (Brigitte Boisselier), руководителя компании Clonaid, 26 декабря посредством Кесарева сечения на свет появилась девочка, названная Евой, которая является первым человеческим клоном. На следующий день Буаселье выступила на пресс-конференции в Голливуде, Флорида, где заявила, что ребёнок "чувствует себя очень хорошо". Вес новорожденной составляет около 3,1 кг, и девочка является клоном женщины 31 лет, муж которой бесплоден. Место рождения ребёнка, а также местонахождение и личность его родителей неизвестны. Глава Clonaid уверенно заявила, что общественность в праве считать её и представляемую ней компанию мошенниками, однако уже через неделю ("8-9 дней") будут получены результаты лабораторных тестов, которые должны подтвердить генетическую идентичность новорожденной и её 31-летней "матери-донора". Генетические тесты должен был проводить журналист издательства ABC News Майкл Джиллен, некогда математик Гарвардского университета. Реакция специалистов на выступление госпожи Буаселье была довольно скептической. Так, в частности, С. Антинори выразил своё сомнение в достаточности квалификации членов Clonaid для осуществления удачного клонирования и добавил, что заявления такого рода вряд ли имеют научную основу и чреваты лишь замешательством в широких кругах общественности. Многие специалисты высказывали опасения относительно высокого процента патологий у клонированных детей, если таковые всё-таки родятся, ссылаясь на опыт клонирования предыдущих семи видов млекопитающих. Сообщение о появлении на свет человеческого клона повлекло очередную волну негодования противников клонирования и дебаты относительно запрета каких-либо форм клонирования. Однако перед тем как продолжить рассказ о дальнейшем ходе событий, нельзя не упомянуть более подробно о Clonaid, небольшой компании, находящейся на Багамских островах, название которой так внезапно попало на первые страницы газет всей планеты. Clonaid - компания, которая была основана в феврале 1997 года Раэлем, главой движения раэлитов и группой инвесторов на Багамских островах. Предназначением компании было объявлено клонирование человека, и, что любопытно, ещё в 2000, согласно данным на сайте компании, в списках желающих было более 250 богатеньких граждан, готовых выложить 200 000 долларов за услуги клонирования. В 2000 главой компании была назначена уже известная нам Бриджит Буаселье, епископ секты раэлитов. Госпожа Буаселье является доктором физики и биомолекулярной химии и до этого, как сообщается, возглавляла крупную фармацевтическую компанию во Франции. Как далее сообщается в истории компании, в 2000 году Буаселье имела контакт с некой бездетной американской парой, первым крупным инвестором Clonaid, которая, вероятно, и является родителями недавно рожденной Евы. Первые работы по клонированию были начаты в начале 2001. Позже в этом же году компания, чтобы избежать излишнего интереса со стороны американского правительства, перебазировала свои лаборатории на территорию "другой страны, где клонирование является легальным". Специалисты компании работают над созданием следующего поколения клонов, среди которых будут также дети больных СПИДом, для которых клонирование открывает способ рождения незараженных потомков. Существуют и более "смелые" прогнозы самого Раэля, главы секты, в частности, относительно того, что вскоре станет возможным перенос памяти и сознания из одного тела в другое, клонированное, что позволит жить вечно, а также насчёт "вечной жизни в компьютере", нанотехнологий, которые сделают ненужными сельское хозяйство и тяжелую промышленность, и других не менее смелых достижениях, которые ожидают человечество уже в ближайшие 20 лет. Кстати, более подробно обо всём этом можно прочитать в книге Раэля ""Да" человеческому клонированию". Раэль - духовный наставник раэлитов, а в прошлом Клод Ворилон (Claude Vorilhon), французский журналист, которого 13 декабря 1973 года якобы посетили пришельцы и обратились с просьбой организовать на Земле "посольство инопланетян", дабы те могли вернуться сюда. Оказывается, жизнь на нашей планете является никаким не результатом биологической эволюции, а есть продукт целенаправленного клонирования, осуществленного инопланетянами 25 тысяч лет назад. Они клонировали человека по своему образу и подобию (кстати, согласно описанию, пришельцы были где-то 1,2 метра, имели длинные темные волосы, миндалевидные глаза, кожу цвета оливок и "источали юмор и гармонию"). Также они поведали Раэлю, что всё это время следили за нами, время от времени посылая специально обученных пророков – Будду, Моисея, Иисуса, Мухаммеда и т.д., которые обучали людей и должны были способствовать тому, чтобы люди не утеряли возможность потом узнать своих создателей (между прочим, раэлиты утверждают, что воскрешение Христа – также результат клонирования). И вот теперь они, то есть пришельцы, считают, что мы достаточно развиты, дабы встретиться непосредственно со своими создателями. Но они очень уважают нашу свободу и право выбора и предоставляют право самостоятельно решить вопрос относительно встречи и подготовиться. Сейчас, по утверждению раэлитов, их ряды насчитывают около 55 тысяч членов в 84 странах мира. Согласно описанию, секта является добровольным бесприбыльным обществом, которое преследует преимущественно просветительские цели и стремится подготовить человечество к большим изменениям, грядущим в ближайшие годы. Но все же, что касается клонирования. Обещанная Буаселье неделя прошла, однако официального подтверждения того, что родившийся ребёнок является клоном, так и не последовало. Тем не менее, 3 января появилось сообщение относительно того, что Clonaid ожидают рождения второго ребёнка, которое должно произойти в Европе и ещё до воскресенья (5 января). Тестирование первого ребёнка-клона и его матери, начало которого назначалось на 31 декабря, было отложено в связи с тем, что родители не определились, хотят ли они называть себя или нет. Суд штата Флорида постановил передать ребёнка под опеку государства, мотивируя это тем, что, скорее всего, новорожденный может иметь врожденные патологии и государство чувствует ответственность за его здоровье. По словам Буаселье, родителям давалось 48 часов на то, чтобы решить, раскрывать ли общественности секрет своей персоны или нет. В последнем случае генетические тесты будут проведены на втором ребёнке, который, возможно, будет более доступен, поскольку родится в Европе и стране с более подходящими для этого условиями. Далее события развертывались следующим образом. 5 января, в воскресенье, Буаселье объявляет о рождении второго клонированного ребёнка – девочки, клона датской лесбийской пары. По словам Бриджит, роды имели место в пятницу, и вес девочки составляет 2,7 кг. О том, в какой стране появился на свет ребёнок, глава Clonaid умалчивает. Она также добавила, что компания ожидает рождения ещё троих клонированных младенцев. Научное сообщество продолжает придерживаться скептической точки зрения. Довольно многие полагают, что выступления Буаселье и заявления относительно получения компанией человеческих клонов не имеют научной подоплеки и рассчитаны лишь на публику. Пятое января, однако официального подтверждения генетической идентичности первого ребёнка и его матери до сих пор нет. 7 января. Clonaid заявляет, что родители ребёнка отказываются разрешить ДНК-тесты, мотивируя это опасениями потерять ребёнка. В заголовках статей о Clonaid всё чаще появляются слова "фальсификация", "тщательно продуманный обман" и тому подобное. 20 января. Clonaid заявляет о том, что со дня на день ожидается рождение ещё одного клона. В этот раз клон – мальчик, который якобы является генетической копией двухлетнего ребёнка, погибшего 18 месяцев назад - должен появится на свет в японской семье где-то на территории Японии. Экспертиза ранее рожденных клонированных детей так и не проведена.
2. За и против клонирования Уже известно, что, по крайней мере, 8 исследовательских групп по всему миру работают над клонированием человека. На протяжении 2002 всё больше и больше стран "дают законодательское добро" на клонирование, в основном в терапевтических целях, несмотря на активный протест Ватикана и международные акты, запрещающие клонирование человека. В этом направлении двигаются Германия, Франция, Австралия и другие аналогично настроенные державы. В США первым штатом, регламентировавшим терапевтическое клонирование, стала Калифорния. Использование эмбрионов для исследования потенциала стволовых клеток, по свидетельству специалистов, может совершить в медицине революцию, предложив возможности для такой трансплантации тканей, которая предотвратит или излечит множество самых серьезных человеческих недугов. Эмбрион представляет собой шарообразное скопление клеток, которые развиваются в утробный плод, когда стволовые клетки примерно через 14 дней начинают дифференцироваться для формирования нервной системы, позвоночника и прочих элементов организма. Ученые полагают, что выделяя стволовые клетки из эмбриона, когда срок его жизни составляет от 3 до 4 дней, их рост в лабораторных условиях можно будет направить в любом направлении. Таким образом, появится возможность для выращивания нужных клеток или типов тканей для трансплантантов. И однажды станет возможно выращивать нейроны для замены нервных клеток в мозге, погибающем от болезни Паркинсона, выращивать кожу для лечения ожогов или панкреатические клетки для выработки инсулина диабетикам. Теоретически, стволовые клетки способны вырасти в заменитель для практически любой части человеческого тела. Если же они получены на основе клеток, взятых у того же самого человека, которому выращивают трансплантант, то не будет никаких проблем с отторжением тканей. Стволовые клетки клетки делят на три основных типа. Первый тип, "тотипотентные" стволовые клетки образуются при первых делениях оплодотворенной яйцеклетки. Они могут превращаться в любой тип ткани и формируют весь организм в целом. Примерно через пять дней после оплодотворения формируется бластоциста - полый пузырек, который образуют около 100 клеток. Те клетки, что находятся снаружи, развиваются в плаценту, а те, что внутри, превращаются собственно в эмбрион. Эти 50 или около того клеток являются "плюрипотентными", они могут превратиться почти во все виды ткани, но не в целый организм. По мере того как эмбрион развивается дальше, стволовые клетки становятся "мультипотентными". Теперь они могут порождать лишь специфические типы клеток. Тотипотентные и плюрипотентные клетки именуют также зародышевыми стволовыми клетками, а мультипотентные часто называют взрослыми стволовыми клетками. Какие клетки интересуют медицину в аспекте клонирования? Наибольший интерес для медиков представляют плюрипотентные стволовые клетки, потому что они способны предоставить все необходимые виды тканей человеческого тела, однако их нельзя превратить в целое человеческое существо. Самая большая проблема (морально-этического, прежде всего) характера состоит в том, что в настоящее время единственным источником плюрипотентных клеток являются человеческие эмбрионы. И именно поэтому анти-абортные группы столь яростно выступают также и против исследований стволовых клеток. Что же касается технической стороны, то сейчас в мире известны три исследовательские группы, которые в ходе экспериментов над животными разработали способы для выращивания в лабораторных условиях потенциально неограниченных количеств мультипотентных клеток. Но все эти методы в первую очередь ориентированы на эмбрионы. В общем случае при пересадке пациенту органа, выращенного из чьих-то чужих клеток, всегда остается проблема отторжения тканей, так что человеку в течение всей остальной жизни может понадобиться принимать лекарства-иммунодепрессанты. Однако технология клонирования дает иной путь. Подобно тому методу, которым была выращена знаменитая клонированная овца Долли, можно получить и собственные плюрипотентные стволовые клетки для каждого человека. Для этого изымается какая-нибудь клетка ткани и ядро ее помещается в донорскую яйцеклетку с удаленным собственным генетическим материалом. А затем яйцеклетке дают вырасти в бластоцисту, из которой извлекают зародышевые стволовые клетки. Отсюда, собственно, и идет название "терапевтическое клонирование". Группа генов, без которой нормальное развитие эмбрионов практически невозможно, в процессе клонирования остается незадействованной. Именно эти гены, возможно, таят в себе ключ к совершенствованию процедуры создания генетических копий и лечению рака. В процессе клонирования (из взрослых клеток) есть несколько ключевых моментов. Большинство неудач становятся очевидны через несколько дней, когда бластоциста имплантируется в матку. В эксперименте, в результате которого на свет появилась овечка Долли, только 29 из 277 клонированных яйцеклеток успешно пересекли этот барьер. Рудольф Яниш из Whitehead Institute обнаружил, что 70-80 генов, которые обычно активизируются в развивающихся мышиных эмбрионах, у клонов оказываются либо неактивны, либо демонстрируют пониженную активность. Хотя непонятно, что же делают эти гены, однозначно установлено, что они включаются одновременно с еще одним геном, Oct4. Этот ген, в свою очередь, дает эмбрионам возможность создавать плюрипотентные клетки – то есть клетки, которые могут превратиться в любую ткань. Возможно, что часть активизирующихся одновременно с этим генов также задействуется в этом процессе. Теперь ученым предстоит выяснить, что заставляет эти гены молчать. Проблема эта представляется фундаментальной – ведь если эти гены не будут выключены в клетках во взрослом состоянии, это может привести к раку. Не случайно, часть генов, выявленных Янишем, в опухолевых клетках оказывается активна. Не исключено, что клон, полученные из взрослых клеток, подавляют то, что для взрослых клеток является опасными генами. Даже если загадка молчащих генов будет разгадана, клонирование целого животного тем не менее останется проблемой, поскольку клонированному эмбриону потребуется преодолеть еще много проблем на более поздних стадиях развития. Не случайно, из 29 имплантированных эмбрионов овечкой Долли стал только один.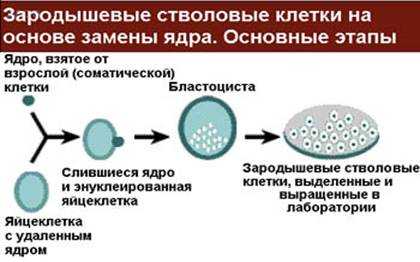 С этической точки зрения, противники гентических экспериментов на человеческих клетках убеждены, что это аморально, убивать в бластоцисте потенциал для развития жизни. Кроме того, многих беспокоит, что вместе с оттачиванием всей этой методики у людей появится искушение к собственному клонированию. Но есть ли иной способ? Многие исследователи полагают, что в принципе еще имеется возможность научиться обращать вспять эволюцию взрослых стволовых клеток, чтобы получать мультипотентные клетки без необходимости создания жизнеспособного эмбриона. Но именно нынешний подъем планки для санкционированных исследований, сконцентрированных на человеческих клетках и эмбрионах, способен ускорить прогресс в этой области. Группа ученых из Rockefeller University и University of Hawaii (New York) во главе с Терухико Вакайама (Teruhiko Wakayama) столкнулась с проблемой клонирования мышей в шестом поколении. Результаты их последних экспериментов (Nature (vol 407, p 318)) говорят о том, что у зверюшек возникает некий скрытый дефект, явно приобретенный в процессе клонирования. Мышки выглядят вполне здоровыми, но с каждым поколением они все труднее и труднее поддаются клонированию. Несмотря на отчаянные усилия ученых, лишь одна мышка родилась на свет путем клонирования в шестом поколении, после чего была тут же съедена своей мамой... Клонирование основано на технике пересадки ядер клеток. Ядро донорской клетки вживляется в яйцеклетку, состоящую из того же генетического материала. В результате на свет рождается животное, генетически идентичное животному-донору ядра клетки. Группа Вакайамы была первой, кто произвела клонирование от взрослого животного со времени знаменитой овечки Доли. Это произошло два года назад, и мышку звали Кумулина (Cumulina). После чего, последовало несколько публикаций, говорящих о том, что ученые успешно клонируют зверюшек уже на протяжении третьего и четвертого поколения. Ученые пытаются понять причину неожиданного торможения клонирования. На обсуждение выдвигались две версии. Первая заключалась в том, что окончание хромосомы, так называемый "telomere", с каждым поколением должно было бы "стачиваться", становясь короче, что могло привезти к вырождению, т.е. к невозможности дальнейшего произведения потомства, так и к преждевременному старению клонов. Эта версия основывалась на предыдущих результатах исследования овечки Доли. Но группа Вакайамы обнаружила, что теломер у некоторых мышей был на много длиннее, чем они ожидали. Вторая версия - ухудшение общего состояния здоровья мышек-клонов с каждым новым клонированием. Но и эта версия не нашла пока подтверждения. Мышки чувствуют себя прекрасно, выдерживают все тесты по прохождению лабиринтов и всевозможные "познавательные" тесты на цвета, запахи и так далее. Мышки также явно не предрасположены к ранней гибели: одна из мышек пятого поколения клонов находиться в полном здравии до сих пор в возрасте 18 месяцев, что составляет средний срок жизни для грызунов. "Наше предположение состоит в том, что мыши-клоны несут в себе какую-то приобретенную аномалию", говорит Вакайама. Этот дефект пока скрыт от глаз ученых, но явно был узнаваем мышами, раз последний клон был съеден собственной мамой... Данное открытие исключительно важно для развития клонирования. Дело в том, что это может оказаться сильным аргументом в спорах при выработке законодательства по клонированию. Среди вопросов, которые возникают: есть ли гарантии, что при клонировании человеческих органов не выявятся подобные или более серьезные "дефекты", могущие привести к различным раковым или геронтологическим заболеваниям. Вспомним клонированного котенка СС. Результат эксперимента по клонированию кошки озадачил ученых Техасского университета. После того, как клонированная кошка Сиси успешно родилась и выжила, эксперимент можно было бы объявить абсолютно удавшимся. Сиси сегодня 2 года. Однако по прошествии этого времени оказалось, что она совершенно не похожа на оригинал - кошку по кличке Радуга. Начать следует с того, что окрас Сиси отличается от окраса Радуги. У Радуги окрас "коленкор": пятна коричневого, желтоватого и золотистого цвета на белом. А у Сиси - серые полоски разных оттенков на белом фоне. Психика у кошек также значительно отличается. Радуга сдержанная и замкнутая, а Сиси - любопытная и игривая. Можно было бы усомниться в том, что Сиси вообще является клоном, но результаты исследования ДНК, подтвердившие факт успешного клонирования, были опубликованы в авторитетном журнале Nature. Так что люди, надеявшиеся, что клонирование поможет им воскресить любимых животных, будут разочарованы. Еще более результаты эксперимента должны разочаровать компанию Genetic Savings & Clone, которая финансировала исследование и планировала хорошо заработать на воскрешении домашних любимцев. Впрочем, пока ученые не обобщают результаты и говорят, что та же ДНК не гарантирует того же окраса "коленкор". Представители же общества защиты животных, выступавшие против клонирования, говорят, что их прогнозы подтвердились: клонирование не означает дублирования ни на физическом уровне, ни, тем более, на уровне психики. Genetic Savings & Clone перед рождением Сиси развернули масштабную компанию среди владельцев домашних животных, которым за $895 предлагали сохранить образцы клеток живых животных, а за $1.395 тыс. - для умерших или тяжело больных. Тем не менее, руководство компании не отказалось от идеи промышленного клонирования. Правда, как признает пресс-секретарь компании Бен Карлсон, необходимы дополнительные исследования, чтобы стабильно производить здоровых клонов. Сколько лет займут эти исследования Карлсон не берется даже предположить. Королевское общество - британская академия наук - призвало правительство начать кампанию за полный запрет на исследования в области репродуктивного клонирования человека во всем мире. В противном случае, утверждают британские ученые, уже через несколько лет на свет могут появиться клонированные дети. Как показывают эксперименты над животными, при имплантации в матку клонированных человеческих эмбрионов весьма велик риск появления индивидов с серьезнейшими физическими или умственными дефектами. Только настаивая на всемирном моратории на репродуктивное клонирование можно снизить вероятность проведения подобных экспериментов в других странах. При нынешнем уровне развития науки - запрет будет оправдан. Кроме того, идею запрета поддерживает общественное мнение, и игнорировать этот факт было бы аморально. Королевское общество, однако, проводит различие между репродуктивным и терапевтическим клонированием. Последнее, по мнению британской академии, необходимо всячески развивать. Задача терапевтического клонирования - создавать "запасные" ткани и органы, которые можно использовать для пересадки и лечения самых разных болезней. В теории - если исследования в этой области пойдут успешно - возможно создание практически неисчерпаемого запаса нейронов, костной ткани, сердечных мышц и любых других человеческих органов и тканей. Для "выращивания" этих тканей и органов можно будет использовать стволовые клетки не из взрослых организмов - здесь неизбежна постоянная нехватка, так как клетки необходимо извлекать из органов практически сразу после смерти "донора" - а из клонированных человеческих эмбрионов. Здесь, правда, возникает другая опасность. Теоретически ученые должны позаботиться о том, чтобы клонированные эмбрионы, используемые в целях терапевтического клонирования, не развились до стадии зародыша. Но кто может поручиться за то, что получится на практике? Не исключено, что соблазн экспериментирования окажется слишком велик - и грань между терапевтическим и репродуктивным клонированием будет размыта. Среди ученых и медиков единства в вопросе о клонировании нет. У приматов, в частности, у обезьян пока не удалось получить клоны с использованием клеток взрослого организма, плода или даже эмбриональных стволовых клеток. Тем не менее, работы в этом направлении активно ведутся. В прошлом году появилось сообщение о клональном размножении потомства приматов путем деления зародыша. Американским исследователям удалось получить генетически идентичные эмбрионы обезьяны резус путем разделения бластомеров зародыша на стадии деления. Из эмбриона родилась вполне нормальная обезьянка Тетра. Такой тип клонирования обеспечивает генетически идентичное потомство, и в результате можно получить двойню, тройню и более генетических близнецов. Это позволяет проводить теоретические исследования по эффективности новых методов терапии тех или иных заболеваний, появляется возможность повторять научные эксперименты на абсолютно генетически идентичном материале. Имплантируя зародыши последовательно одной и той же суррогатной самке, можно исследовать влияние ее организма на развитие плода. Разработанные методы клонирования животных пока еще далеко не совершенны. В процессе экспериментов наблюдается высокая смертность плодов и новорожденных. Еще не ясны многие теоретические вопросы клонирования животных из отдельной соматической клетки. Тем не менее успех, достигнутый в клонировании овцы и обезьян, показал теоретическую возможность создания генетических копий также человека из отдельной клетки, взятой из какого-либо его органа. Многие ученые с энтузиазмом восприняли идею клонирования человека. Например "отец" первого ребенка из пробирки Эдвардс заявил, что этот метод можно будет применять для получения запасных органов, которые можно будет использовать для лечения больных. Известный эволюционист профессор Оксфордского Университета Р. Даукинс пишет, что он сам хотел бы клонироваться. "Я считаю, - пишет он, - что это было бы прекрасным стимулом наблюдать за копией самого себя, только на 50 лет моложе". Многие другие ученые, в том числе лауреаты Нобелевских премий, также поддерживают идею создания генетических копий человека. Опрос общественного мнения в США показал, что 7% американцев готовы подвергнуться клонированию. Вместе с тем, большинство ученых и многие политики высказываются против создания клонов человека. И их возражения и опасения вполне оправданы. Европейская Комиссия выступила с призывом к глобальному запрещению клонирования человека. Позиция исполнительного органа Европейского Союза заключается в том, необходимость принятия такой меры обусловлена «очевидными этическими соображениями». Кроме того, практика клонирования является безответственной с точки зрения науки. По словам члена Европейского Комисии Филиппа Бюскена, отвечающего в ЕС за политику в области научных исследований, «опыты на животных показывают, что все еще остается немало неточных результатов и рисков, связанных с клонированием». Страны Залива согласовывают своё законодательство по вопросам клонирования в различных областях. Решение об этом было принято на форуме министров здравоохранения тех стран, которые входят в Совет сотрудничества арабских государств Персидского залива. Конференция завершилась 8 января в Абу-Даби (ОАЭ). Министры Саудовской Аравии, ОАЭ, Омана, Кувейта, Катара и Бахрейна также решили создать объединённую комиссию по биологической этике, которая будет изучать проблемы, связанные с генной инженерией и исследованиями в этой сфере. Этические и моральные аспекты проблемы клонирования человека не могут оставить равнодушным ни одного человека. Растет число стран, запрещающих проведение подобных экспериментов на своей территории. Несмотря на это, почти в каждой стране появились компании и фирмы, готовые за весьма крупную сумму обеспечить своим клиентам “генетическое бессмертие”. Не осталась в стороне и Россия. В России, как и во многих других странах мира, введен мораторий на клонирование человека, поэтому любая подобная деятельность является противозаконной. Первые комментарии российских и зарубежных учёных по поводу родившегося клона - весьма пессимистичны и недоверчивы. Так, сомнение в том, что компании Clonaid удался эксперимент по клонированию человека высказали директор Института молекулярной биологии РАН Евгений Свердлов и профессор того же института Александр Зеленин. Им вторит известный французский генетик Аксель Кан. Учёный Евгений Свердлов отметил, что "в 99 процентов случаев существует риск рождения урода". Так, знаменитая овца Долли была трёхсотым по счёту клоном, 299 предыдущих либо погибали, либо рождались уродами. Директор Института молекулярной генетики "не исключает возможности фальсификации" со стороны секты раэлианцев. "Когда речь идет о незаконной и бесконтрольной акции, можно ожидать всякого", - сказал он. "Возможно, имело место деление эмбриона на фрагменты, а не перенос ядра из донора в яйцеклетку, как в случае с Долли,- предположил Евгений Свердлов, - что увеличивает вероятность успеха". Мысль о ненужности и недопустимости технологии клонирования высказал профессор Института молекулярной биологии РАН Александр Зеленин. "В среднем из ста манипуляций над животными только один случай заканчивается появлением на свет нормального клонированного организма ", - напомнил он. Столь низкий процент объясняется неполным сохранением генома взрослой клетки, которую используют для пересадки. "Если это действительно так, тогда это накладывает на опыты над человеком теоретический, принципиальный запрет", - подчеркнул профессор. Ещё более категоричен был известный французский генетик Аксель Кан, назвавший известие о появлении клона "чистой пропагандой". "Весьма сомнительно, - сказал француз, - что опыты по генной инженерии, которые в применении к обезьяне и человеку не давали положительных результатов, на сей раз увенчались успехом". К тому же для чистоты эксперимента необходимо сравнить генетические карты клонированного ребенка и человека, от которого произошел клон. Не осталась в стороне и русская православная церковь. Русская православная церковь считает клонирование опасным экспериментом. Очень тревожным фактом для христиан назвал клонирование заместитель главы Отдела внешних связей Русской православной церкви отец Всеволод Чаплин. Священнослужитель также добавил, что такую точку зрения разделяют практически все христианские церкви мира, а в законодательстве цивилизованных стран клонирование человека запрещено. По мнению представителя РПЦ, «все дело в том, что за этими опытами стоит стремление богатых, ни во что не верящих гордецов жить на Земле вечно». Не случайно секта раэлитов, которая спонсировала эксперимент по клонированию, заявила, что ее конечная цель - это постоянная пересадка мозга из одного клонированного тела в другое, то есть, как пояснил священник, фактически, выращивание «тела на замену». Русская православная церковь не осуждает клонирование отдельных органов, сказал отец Всеволод, но «если люди-клоны будут выращиваться для эгоистического стремления другой личности дать себе вторую, третью, сотую и так далее жизнь, то возникнет глубокий нравственный кризис». Одна из крупнейших юридических организаций США - Американская ассоциация юристов (American Bar Association - АВА), насчитывающая более 400 тыс. членов, намерена устроить масштабное выступление в защиту клонирования. По мнению представителей этой почтенной организации, клонирование является ни чем иным, как прогрессом в медицине. В то же время, АВА осуждает правительство за вероломное вмешательство в ход прогресса, которое делает учёных преступниками. Само собой, речь идёт о так называемом терапевтическом клонировании - получении стволовых клеток посредством выращивания человеческих эмбрионов. Таким образом, Американская ассоциация юристов вступает в открытую конфронтацию с администрацией президента Буша, который, как известно, требует повсеместного запрещения всех видов клонирования. Законопроекты о запрете в настоящее время "зависли" в Сенате США, где двое сенаторов потребовали для учёных, которые решатся нарушить запрет, уголовного наказания, например, крупных штрафов. Однако голосов не хватило, поэтому был предложен другой более мягкий вариант - двухлетний мораторий на исследования в области клонирования. Позиция АВА - не допустить принятия ни одного из этих проектов в качестве закона. Аналитики полагают, что такая мощная ассоциация как АВА, способна существенно повлиять на позицию сенаторов. Если в Сенате всё пройдёт успешно, юристы смогут лоббировать свой вариант в Конгрессе.
С этической точки зрения, противники гентических экспериментов на человеческих клетках убеждены, что это аморально, убивать в бластоцисте потенциал для развития жизни. Кроме того, многих беспокоит, что вместе с оттачиванием всей этой методики у людей появится искушение к собственному клонированию. Но есть ли иной способ? Многие исследователи полагают, что в принципе еще имеется возможность научиться обращать вспять эволюцию взрослых стволовых клеток, чтобы получать мультипотентные клетки без необходимости создания жизнеспособного эмбриона. Но именно нынешний подъем планки для санкционированных исследований, сконцентрированных на человеческих клетках и эмбрионах, способен ускорить прогресс в этой области. Группа ученых из Rockefeller University и University of Hawaii (New York) во главе с Терухико Вакайама (Teruhiko Wakayama) столкнулась с проблемой клонирования мышей в шестом поколении. Результаты их последних экспериментов (Nature (vol 407, p 318)) говорят о том, что у зверюшек возникает некий скрытый дефект, явно приобретенный в процессе клонирования. Мышки выглядят вполне здоровыми, но с каждым поколением они все труднее и труднее поддаются клонированию. Несмотря на отчаянные усилия ученых, лишь одна мышка родилась на свет путем клонирования в шестом поколении, после чего была тут же съедена своей мамой... Клонирование основано на технике пересадки ядер клеток. Ядро донорской клетки вживляется в яйцеклетку, состоящую из того же генетического материала. В результате на свет рождается животное, генетически идентичное животному-донору ядра клетки. Группа Вакайамы была первой, кто произвела клонирование от взрослого животного со времени знаменитой овечки Доли. Это произошло два года назад, и мышку звали Кумулина (Cumulina). После чего, последовало несколько публикаций, говорящих о том, что ученые успешно клонируют зверюшек уже на протяжении третьего и четвертого поколения. Ученые пытаются понять причину неожиданного торможения клонирования. На обсуждение выдвигались две версии. Первая заключалась в том, что окончание хромосомы, так называемый "telomere", с каждым поколением должно было бы "стачиваться", становясь короче, что могло привезти к вырождению, т.е. к невозможности дальнейшего произведения потомства, так и к преждевременному старению клонов. Эта версия основывалась на предыдущих результатах исследования овечки Доли. Но группа Вакайамы обнаружила, что теломер у некоторых мышей был на много длиннее, чем они ожидали. Вторая версия - ухудшение общего состояния здоровья мышек-клонов с каждым новым клонированием. Но и эта версия не нашла пока подтверждения. Мышки чувствуют себя прекрасно, выдерживают все тесты по прохождению лабиринтов и всевозможные "познавательные" тесты на цвета, запахи и так далее. Мышки также явно не предрасположены к ранней гибели: одна из мышек пятого поколения клонов находиться в полном здравии до сих пор в возрасте 18 месяцев, что составляет средний срок жизни для грызунов. "Наше предположение состоит в том, что мыши-клоны несут в себе какую-то приобретенную аномалию", говорит Вакайама. Этот дефект пока скрыт от глаз ученых, но явно был узнаваем мышами, раз последний клон был съеден собственной мамой... Данное открытие исключительно важно для развития клонирования. Дело в том, что это может оказаться сильным аргументом в спорах при выработке законодательства по клонированию. Среди вопросов, которые возникают: есть ли гарантии, что при клонировании человеческих органов не выявятся подобные или более серьезные "дефекты", могущие привести к различным раковым или геронтологическим заболеваниям. Вспомним клонированного котенка СС. Результат эксперимента по клонированию кошки озадачил ученых Техасского университета. После того, как клонированная кошка Сиси успешно родилась и выжила, эксперимент можно было бы объявить абсолютно удавшимся. Сиси сегодня 2 года. Однако по прошествии этого времени оказалось, что она совершенно не похожа на оригинал - кошку по кличке Радуга. Начать следует с того, что окрас Сиси отличается от окраса Радуги. У Радуги окрас "коленкор": пятна коричневого, желтоватого и золотистого цвета на белом. А у Сиси - серые полоски разных оттенков на белом фоне. Психика у кошек также значительно отличается. Радуга сдержанная и замкнутая, а Сиси - любопытная и игривая. Можно было бы усомниться в том, что Сиси вообще является клоном, но результаты исследования ДНК, подтвердившие факт успешного клонирования, были опубликованы в авторитетном журнале Nature. Так что люди, надеявшиеся, что клонирование поможет им воскресить любимых животных, будут разочарованы. Еще более результаты эксперимента должны разочаровать компанию Genetic Savings & Clone, которая финансировала исследование и планировала хорошо заработать на воскрешении домашних любимцев. Впрочем, пока ученые не обобщают результаты и говорят, что та же ДНК не гарантирует того же окраса "коленкор". Представители же общества защиты животных, выступавшие против клонирования, говорят, что их прогнозы подтвердились: клонирование не означает дублирования ни на физическом уровне, ни, тем более, на уровне психики. Genetic Savings & Clone перед рождением Сиси развернули масштабную компанию среди владельцев домашних животных, которым за $895 предлагали сохранить образцы клеток живых животных, а за $1.395 тыс. - для умерших или тяжело больных. Тем не менее, руководство компании не отказалось от идеи промышленного клонирования. Правда, как признает пресс-секретарь компании Бен Карлсон, необходимы дополнительные исследования, чтобы стабильно производить здоровых клонов. Сколько лет займут эти исследования Карлсон не берется даже предположить. Королевское общество - британская академия наук - призвало правительство начать кампанию за полный запрет на исследования в области репродуктивного клонирования человека во всем мире. В противном случае, утверждают британские ученые, уже через несколько лет на свет могут появиться клонированные дети. Как показывают эксперименты над животными, при имплантации в матку клонированных человеческих эмбрионов весьма велик риск появления индивидов с серьезнейшими физическими или умственными дефектами. Только настаивая на всемирном моратории на репродуктивное клонирование можно снизить вероятность проведения подобных экспериментов в других странах. При нынешнем уровне развития науки - запрет будет оправдан. Кроме того, идею запрета поддерживает общественное мнение, и игнорировать этот факт было бы аморально. Королевское общество, однако, проводит различие между репродуктивным и терапевтическим клонированием. Последнее, по мнению британской академии, необходимо всячески развивать. Задача терапевтического клонирования - создавать "запасные" ткани и органы, которые можно использовать для пересадки и лечения самых разных болезней. В теории - если исследования в этой области пойдут успешно - возможно создание практически неисчерпаемого запаса нейронов, костной ткани, сердечных мышц и любых других человеческих органов и тканей. Для "выращивания" этих тканей и органов можно будет использовать стволовые клетки не из взрослых организмов - здесь неизбежна постоянная нехватка, так как клетки необходимо извлекать из органов практически сразу после смерти "донора" - а из клонированных человеческих эмбрионов. Здесь, правда, возникает другая опасность. Теоретически ученые должны позаботиться о том, чтобы клонированные эмбрионы, используемые в целях терапевтического клонирования, не развились до стадии зародыша. Но кто может поручиться за то, что получится на практике? Не исключено, что соблазн экспериментирования окажется слишком велик - и грань между терапевтическим и репродуктивным клонированием будет размыта. Среди ученых и медиков единства в вопросе о клонировании нет. У приматов, в частности, у обезьян пока не удалось получить клоны с использованием клеток взрослого организма, плода или даже эмбриональных стволовых клеток. Тем не менее, работы в этом направлении активно ведутся. В прошлом году появилось сообщение о клональном размножении потомства приматов путем деления зародыша. Американским исследователям удалось получить генетически идентичные эмбрионы обезьяны резус путем разделения бластомеров зародыша на стадии деления. Из эмбриона родилась вполне нормальная обезьянка Тетра. Такой тип клонирования обеспечивает генетически идентичное потомство, и в результате можно получить двойню, тройню и более генетических близнецов. Это позволяет проводить теоретические исследования по эффективности новых методов терапии тех или иных заболеваний, появляется возможность повторять научные эксперименты на абсолютно генетически идентичном материале. Имплантируя зародыши последовательно одной и той же суррогатной самке, можно исследовать влияние ее организма на развитие плода. Разработанные методы клонирования животных пока еще далеко не совершенны. В процессе экспериментов наблюдается высокая смертность плодов и новорожденных. Еще не ясны многие теоретические вопросы клонирования животных из отдельной соматической клетки. Тем не менее успех, достигнутый в клонировании овцы и обезьян, показал теоретическую возможность создания генетических копий также человека из отдельной клетки, взятой из какого-либо его органа. Многие ученые с энтузиазмом восприняли идею клонирования человека. Например "отец" первого ребенка из пробирки Эдвардс заявил, что этот метод можно будет применять для получения запасных органов, которые можно будет использовать для лечения больных. Известный эволюционист профессор Оксфордского Университета Р. Даукинс пишет, что он сам хотел бы клонироваться. "Я считаю, - пишет он, - что это было бы прекрасным стимулом наблюдать за копией самого себя, только на 50 лет моложе". Многие другие ученые, в том числе лауреаты Нобелевских премий, также поддерживают идею создания генетических копий человека. Опрос общественного мнения в США показал, что 7% американцев готовы подвергнуться клонированию. Вместе с тем, большинство ученых и многие политики высказываются против создания клонов человека. И их возражения и опасения вполне оправданы. Европейская Комиссия выступила с призывом к глобальному запрещению клонирования человека. Позиция исполнительного органа Европейского Союза заключается в том, необходимость принятия такой меры обусловлена «очевидными этическими соображениями». Кроме того, практика клонирования является безответственной с точки зрения науки. По словам члена Европейского Комисии Филиппа Бюскена, отвечающего в ЕС за политику в области научных исследований, «опыты на животных показывают, что все еще остается немало неточных результатов и рисков, связанных с клонированием». Страны Залива согласовывают своё законодательство по вопросам клонирования в различных областях. Решение об этом было принято на форуме министров здравоохранения тех стран, которые входят в Совет сотрудничества арабских государств Персидского залива. Конференция завершилась 8 января в Абу-Даби (ОАЭ). Министры Саудовской Аравии, ОАЭ, Омана, Кувейта, Катара и Бахрейна также решили создать объединённую комиссию по биологической этике, которая будет изучать проблемы, связанные с генной инженерией и исследованиями в этой сфере. Этические и моральные аспекты проблемы клонирования человека не могут оставить равнодушным ни одного человека. Растет число стран, запрещающих проведение подобных экспериментов на своей территории. Несмотря на это, почти в каждой стране появились компании и фирмы, готовые за весьма крупную сумму обеспечить своим клиентам “генетическое бессмертие”. Не осталась в стороне и Россия. В России, как и во многих других странах мира, введен мораторий на клонирование человека, поэтому любая подобная деятельность является противозаконной. Первые комментарии российских и зарубежных учёных по поводу родившегося клона - весьма пессимистичны и недоверчивы. Так, сомнение в том, что компании Clonaid удался эксперимент по клонированию человека высказали директор Института молекулярной биологии РАН Евгений Свердлов и профессор того же института Александр Зеленин. Им вторит известный французский генетик Аксель Кан. Учёный Евгений Свердлов отметил, что "в 99 процентов случаев существует риск рождения урода". Так, знаменитая овца Долли была трёхсотым по счёту клоном, 299 предыдущих либо погибали, либо рождались уродами. Директор Института молекулярной генетики "не исключает возможности фальсификации" со стороны секты раэлианцев. "Когда речь идет о незаконной и бесконтрольной акции, можно ожидать всякого", - сказал он. "Возможно, имело место деление эмбриона на фрагменты, а не перенос ядра из донора в яйцеклетку, как в случае с Долли,- предположил Евгений Свердлов, - что увеличивает вероятность успеха". Мысль о ненужности и недопустимости технологии клонирования высказал профессор Института молекулярной биологии РАН Александр Зеленин. "В среднем из ста манипуляций над животными только один случай заканчивается появлением на свет нормального клонированного организма ", - напомнил он. Столь низкий процент объясняется неполным сохранением генома взрослой клетки, которую используют для пересадки. "Если это действительно так, тогда это накладывает на опыты над человеком теоретический, принципиальный запрет", - подчеркнул профессор. Ещё более категоричен был известный французский генетик Аксель Кан, назвавший известие о появлении клона "чистой пропагандой". "Весьма сомнительно, - сказал француз, - что опыты по генной инженерии, которые в применении к обезьяне и человеку не давали положительных результатов, на сей раз увенчались успехом". К тому же для чистоты эксперимента необходимо сравнить генетические карты клонированного ребенка и человека, от которого произошел клон. Не осталась в стороне и русская православная церковь. Русская православная церковь считает клонирование опасным экспериментом. Очень тревожным фактом для христиан назвал клонирование заместитель главы Отдела внешних связей Русской православной церкви отец Всеволод Чаплин. Священнослужитель также добавил, что такую точку зрения разделяют практически все христианские церкви мира, а в законодательстве цивилизованных стран клонирование человека запрещено. По мнению представителя РПЦ, «все дело в том, что за этими опытами стоит стремление богатых, ни во что не верящих гордецов жить на Земле вечно». Не случайно секта раэлитов, которая спонсировала эксперимент по клонированию, заявила, что ее конечная цель - это постоянная пересадка мозга из одного клонированного тела в другое, то есть, как пояснил священник, фактически, выращивание «тела на замену». Русская православная церковь не осуждает клонирование отдельных органов, сказал отец Всеволод, но «если люди-клоны будут выращиваться для эгоистического стремления другой личности дать себе вторую, третью, сотую и так далее жизнь, то возникнет глубокий нравственный кризис». Одна из крупнейших юридических организаций США - Американская ассоциация юристов (American Bar Association - АВА), насчитывающая более 400 тыс. членов, намерена устроить масштабное выступление в защиту клонирования. По мнению представителей этой почтенной организации, клонирование является ни чем иным, как прогрессом в медицине. В то же время, АВА осуждает правительство за вероломное вмешательство в ход прогресса, которое делает учёных преступниками. Само собой, речь идёт о так называемом терапевтическом клонировании - получении стволовых клеток посредством выращивания человеческих эмбрионов. Таким образом, Американская ассоциация юристов вступает в открытую конфронтацию с администрацией президента Буша, который, как известно, требует повсеместного запрещения всех видов клонирования. Законопроекты о запрете в настоящее время "зависли" в Сенате США, где двое сенаторов потребовали для учёных, которые решатся нарушить запрет, уголовного наказания, например, крупных штрафов. Однако голосов не хватило, поэтому был предложен другой более мягкий вариант - двухлетний мораторий на исследования в области клонирования. Позиция АВА - не допустить принятия ни одного из этих проектов в качестве закона. Аналитики полагают, что такая мощная ассоциация как АВА, способна существенно повлиять на позицию сенаторов. Если в Сенате всё пройдёт успешно, юристы смогут лоббировать свой вариант в Конгрессе. Заключение Итак, клонирование – это хорошо или плохо? Завершая работу над рефератом невозможно прийти к одному выводу. У каждого человека свое мнение на этот счет. Но все же я постараюсь обобщить итоги. Ученым необходимо, чтобы наука развивалась дальше. Они будут ставить свои опыты даже несмотря на запреты. Медики выступают за терапевтическое клонирование – ведь это поможет оказать реальную помощь человеку и спасти ему жизнь. Представители почти всех конфессий против клонирования вообще, т.к. они утверждают, что человек не может творить подобно Богу. Общественное мнение направлено в основном тоже против бездумного клонирования всего и вся. Политики многих стран издали моратории и законопроекты, запрещающие деятельность по клонированию, по крайней мере, в отношении человека. Я считаю, что наука, конечно, должна развиваться, но биоэтические принципы должны быть обязательно соблюдены. Все достижения науки должны быть использованы во благо человека.
Список литературы 1. Берд К. Начало эпохи клонирования. // КОМПЬЮТЕРРА, 28.01.2001. 2. Вир С. Клонирование человека: Аргументы в защиту. – М.: Медицина, 2002. 3. Висенс А. Природа сама решила поставить запрет на клонировании. // Nature, vol 407, p 318. 4. Дзюбан Ю. Сделайте копию! // КОМПЬЮТЕРРА, 01.02.2003. 5. Смирнов Ю. Дорога к бессмертию. – Ярославль: Наука, 2001.
bukvasha.ru
Реферат - Особенности клонирования - Биология
РЕФЕРАТ
по курсу Естествознание
по теме: Особенности клонирования
Содержание
Введение
1.Понятие и история клонирования
1.1Биологическая сущность клонирования
1.2Исторический очерк
2.Клонирование человека
Заключение
Список литературы
Введение
Пожалуй, ни одно из достижений науки не вызвало в минувшем веке столь бурных дебатов, как клонирование. Благодаря историческому научному прорыву д-ра Яна Вильмута и его коллег из Великобритании клонирование человека сейчас уже очень близко к реальности. Эта возможность потенциально дает всему человечеству невероятные возможности. Вот только какие? Споры в научном мире между сторонниками и противниками клонирования становятся всё более жаркими с каждым годом. К сожалению, на обсуждение этой темы с самого начала оказывали влияние сенсационные, но вводящие в заблуждение сообщения СМИ, и общая негативная эмоциональная реакция, порожденная ошибочной научной фантастикой. Отрицательное отношение к клонированию, в первую очередь людей – больше следствие захватывающей дух новизны идеи, чем каких-либо реальных нежелательных последствий. Вполне возможно, что при разумном регулировании преимущества клонирования людей существенно перевесили бы недостатки. Если общественность наложит полный запрет на клонирование человека, это может оказаться печальным эпизодом в человеческой истории.
В работе мы попытаемся разобраться как с преимуществами, так и с предполагаемыми отрицательными последствиями клонирования животных и человека.
1. Понятие и история клонирования
1.1 Биологическая сущность клонирования
Термин «клон» происходит от греческого слова «klon», что означает – веточка, побег, черенок, и имеет отношение, прежде всего к вегетативному размножению. Клонирование растений черенками, почками или клубнями в сельском хозяйстве, в частности в садоводстве, известно уже более 4-х тыс. лет. Начиная с 70-х годов нашего столетия для клонирования растений стали широко использовать небольшие группы и даже отдельные соматические (неполовые) клетки. Дело в том, что у растений (в отличие от животных) по мере их роста в ходе клеточной специализации – дифференцировки – клетки не теряют так называемых тотипотентных свойств, т.е. не теряют своей способности реализовывать всю генетическую информацию, заложенную в ядре. Поэтому практически любая растительная клетка, сохранившая в процессе дифференцировки свое ядро, может дать начало новому организму. Эта особенность растительных клеток лежит в основе многих методов генетики и селекции. При вегетативном размножении и при клонировании гены не распределяются по потомкам, как в случае полового размножения, а сохраняются в полном составе в течение многих поколений. Все организмы, входящие в состав определенного клона, имеют одинаковый набор генов и фенотипически не различаются между собой. Клетки животных, дифференцируясь, лишаются тотипотентности, и в этом – одно из существенных их отличий от клеток растений. Это – главное препятствие при клонирования взрослых позвоночных животных. Дифференцировка клеток в ходе развития позвоночных сопровождается инактивацией неработающих генов. Поэтому клетки теряют тотипотентность, дифференцировка становится необратимой. В конце концов, у одних клеток происходит полное репрессирование генома, у других – в той или иной степени деградирует ДНК, а в некоторых случаях разрушается даже ядро. Однако наряду с дифференцированными клетками культивируемые in vitro (в пробирке) клеточные популяции содержат малодифференцированные стволовые клетки, которые и могут быть использованы как доноры ядер для клонирования млекопитающих.
1.2 Исторический очерк
Начало истории уместно датировать 1839 годом, когда Теодор Шванн доказал свою клеточную теорию, закрепленную в учебниках биологии следующим лозунгом: клетка происходит от клетки. Клеточная теория таила в себе два противоречащих начала: наследственность и дифференциацию. Образуются ли в результате клеточного деления две идентичных дочерних клетки, или производные разные? Когда через некоторое время носителем наследственности определили несущее хромосомы ядро, внимание ученых переключилось с клеточного на ядерный потенциал. Одним из видных учёных, занимавшийся проблемой был Ганс Спиман. Его исследования были прерваны войной. После Второй мировой войны, советский эмбриолог Георгий Викторович Лопашов разработал метод пересадки (трансплантации) ядер в яйцеклетку лягушки. Однако ученому не повезло. В августе 1948 года состоялась печально известная сессия ВАСХНИЛ, где окончательно утвердилось непререкаемое лидерство в биологии известного борца с генетикой Т.Д. Лысенко. Как это часто случалось в истории российской науки, приоритет достался американским эмбриологам Роберту Бригсу и Томасу Кингу, когда в 1952 году они потрясли ученый мир сообщением об удачной пересадке ядра лягушки Rana pipiens. Но к 1960 году Бригс и Кинг пришли к неутешительному выводу, что дифференциация сопровождается прогрессирующим сужением возможности ядер стимулировать нормальное развитие организма. В то же самое время в Англии шведский эмбриолог Майкл Фишберг совместно с коллегами Томасом Элсдейлом и Джоном Гердоном работал над видом лягушки Xenopus laevis, более перспективным для исследований, чем Rana, поскольку там легче решались вопросы трансплантации. На примере Xenopus удалось вырастить головастиков из ядер половозрелых особей. Это был настоящий прорыв. На примере Xenopus Гердон с коллегами в конце концов научились создавать плодовитых взрослых лягушек, используя ядра отдельных эпителиальных клеток пищеварительного тракта головастиков. Это означало, что используемый для пересадки генетический материал все еще содержал необходимую информацию для всего организма. Вокруг исследований Гердона поднялся большой шум. Тогда впервые заговорили и о клонировании человека. Наряду с амфибиями проводились и опыты на млекопитающих. Еще в 1942 году были получены живые особи крыс из изолированных на этапе двухклеточного деления бластомеров, а в 1968 году – кролики из бластомеров поделившихся на 8 клеток. Успешные опыты с амфибиями заставили ученых задуматься о клонировании эмбрионов млекопитающих, в частности мышей. Первое клонирование мыши и клонирование первого млекопитающего было осуществлено в СССР в 1987 г. в лаборатории Чайлахяна Л.М, Вепренцева Б.Н., Свиридовой Т.А., Никитина В.А. Авторы послали свою статью – в журнал «Nature», но работа не была опубликована. Ответом на посланную статью было абсолютное молчание редакции журнала. Первенство в клонировании первого млекопитающего за советскими учеными не признано до сих пор. В 1979 году Стин Вилландсен вырастил отдельные взрослые клетки из восьмиклеточных эмбрионов овцы и крупного рогатого скота. Эксперименты по пересадке ядер для крупного рогатого скота оказались более эффективными, нежели для мышей. В 1991 году Вилландсен сообщил об эксперименте по переносу 100 ядер телят, источником которых была морула. Результатом следующих экспериментов явились клоны восьми телят, полученных из эмбриона одного донора. К сожалению, все телята развивались с отклонениями и имели явные признаки патологии. В феврале 1997 года появилось сообщение о том, что в лаборатории Яна Вильмута в шотландском городе Эдинбурге в Рослинском институте сумели клонировать овцу. Как стало известно позднее, только один опыт из 236 стал удачным. Ян Вилмут из шотландского института Рослина в 1997 году объявил о клонировании первого млекопитающего из ядра соматической клетки. В результате таких манипуляций из 244 образцов 34 развились до стадии, когда их можно было имплантировать в матку суррогатной матери. Летом 1995 года родились 5 ягнят, из которых двое – Меган и Мораг, первые клонированные млекопитающие – дожили до половозрелого возраста, но вскоре погибли. Так стали появляться на свет клонированные овцы. Долли оказалась единственной выжившей из 277. В 2002 году у Долли было отмечено развитие артрита, который как предполагается, мог стать результатом генных мутаций, инициированных процессом клонирования. Помимо артрита у животного наблюдался целый ряд отклонений от нормального развития и в феврале ученые усыпили знаменитую овечку из-за прогрессирующей болезни легких. Долли умерла в возрасте 6 лет. Ныне уже получены клоны таких млекопитающих как овца, мышь, крыса, кошка, корова, коза, свинья, лошадь, мул, кролик и собака.
Технология клонирования не является совершенной. Многие клоны умирают после имплантации в матку, другие – вследствие аномалий развития. Причина – неполное перепрограммирование генетического материала.
В 2006 г. исполнилось 10 лет с момента научно-подтвержденного клонирования животного. Отметим основные вехи после этого события.
· 1997 г. Американский врач Ричард Сид объявил о строительстве собственной клиники по клонированию человека;
· 2001 г. Итальянский доктор Северино Антинори объявил о планах создания клонированных детей для бесплотных пар;
· 2001 г. Декан медицинского факультета Университета Питтсбурга Джеральд Шаттен провел 724 неудачные попытки клонирования обезьяны;
· 2002 г. Генетик Ирина Полежаева впервые в мире клонировала котенка, а в 2006 г. — лошадь;
· 2002 г. Президент компании Clonaid Брижит Буаселье объявила о рождении первого клонированного ребенка, не представив никаких научных доказательств;
· 2004 г. Корейский биолог Хван У Сок разработал новую технологию клонирования человека, которая впоследствии оказалась фальшивкой;
· 2006 г. Американский медик Панайотис Зевос впервые опубликовал технологию клонирования человека.
Итак работы по клонированию позвоночных были начаты на амфибиях в начале 50-х годов и интенсивно продолжаются вот уже пять десятилетий. Что касается амфибий, то проблема клонирования взрослых особей остается до сих пор не решенной. Установлено, что в ходе клеточной дифференцировки у позвоночных происходит или потеря определенных генных локусов или их необратимая инактивация. Судя по всему, утрачивается та часть генома, которая контролирует не ранние, а более поздние этапы онтогенеза, в частности, метаморфоз амфибий. Механизм этого явления пока не поддается научному объяснению. Но очевидно, что для клонирования взрослых позвоночных необходимо использовать малодифференцированные делящиеся клетки. Это методически важное положение было учтено в более поздних работах.
Клонирование животных может оказаться особенно важно в селекции, так как для получения сельскохозяйственных животных, в частности, крупного рогатого скота, с закрепленными особо ценными качествами обычными приемами требуются десятки лет работы.
2. Клонирование человека
Клон – это идентичный близнец другого человека, отсроченный во времени. В сущности, речь идет даже не о клонировании, а о получении копии отдельного индивида, поскольку термин «клонирование» предполагает получение некоего множества особей. Но слово уже прижилось, поэтому используется по-прежнему. Научно-фантастические романы и кинофильмы создали у людей впечатление, будто человеческие клоны окажутся бездумными зомби, монстрами вроде Франкенштейна или двойниками.
На самом же деле существует мнение, что клоны человека будут обычными человеческими существами. Их будет вынашивать обычная женщина в течение 9 месяцев, они родятся и будут воспитываться в семье, как и любой другой ребенок. Им потребуется 18 лет, чтобы достичь совершеннолетия, как и всем остальным людям. Следовательно, клон-близнец будет на несколько десятилетий младше своего оригинала, поэтому нет опасности, что люди будут путать клона-близнеца с оригиналом. Так же как и идентичные близнецы, клон и донор ДНК будут иметь различные отпечатки пальцев. Клон не унаследует ничего из воспоминаний оригинального индивида. Благодаря всем этим различиям, клон – это не ксерокопия или двойник человека, а просто младший идентичный близнец. Человеческие клоны будут иметь те же самые юридические права и обязанности, как и любой другой человек. Клоны будут человеческими существами в самом полном смысле. Основные моменты, из-за которых клонирование человека вызывает множество возражений, следующие:
· становление человека как личности, базируется не только на биологической наследственности, оно определяется также семейной, социальной и культурной средой. При клонировании индивида невозможно воссоздать все те условия воспитания и обучения, которые сформировали личность его прототипа (донора ядра).
· при бесполом размножении изначально жесткая запрограммированность генотипа предопределяет меньшее разнообразие взаимодействий развивающегося организма с изменяющимися условиями среды (по сравнению с половым размножением, когда в формировании индивида участвуют два генома, сложным и непредсказуемым образом взаимодействующие между собой и с окружающей средой).Это возражение базируется на т.н. экстремальной экстраполяции. На планете существует более 5 млрд. людей. Очевидно, на первых порах клонирование человека будет производиться очень в скромных масштабах из-за предполагаемой стоимости процедуры. Кроме того, большинство женщин все же не захотят быть матерями клонов-близнецов. Пройдет много десятилетий прежде, чем общее количество клонов людей достигнет хотя бы 1 млн. человек во всем мире. По процентному соотношению, это составило бы микроскопическую часть от общего населения и не оказало бы никакого воздействия на генетическое разнообразие людей. Но в дальнейшем ограничения станут необходимыми. Но где провести черту? Этот вопрос может оказаться неразрешимым.
· практически все религиозные учения настаивают, что появление человека на свет – в «руках» высших сил, что зачатие и рождение должно происходить только естественным путем.
· считается, что клонирование человека может привести к созданию уродов и монстров. Клонирование человека часто сопоставляется с генной инженерией человека. При клонировании ДНК копируется, в результате чего появляется еще один человек, точный близнец существующего индивида и следовательно – не монстр или урод. Генная же инженерия подразумевает модификацию человеческой ДНК, в результате чего может появиться человек, непохожий ни на одного другого, ранее существовавшего. Это предположительно могло бы привести к созданию очень необычных людей, даже монстров. Генная инженерия человека, имея большой позитивный потенциал, действительно очень рискованное предприятие, и должна была бы проводиться только с величайшей осторожностью и под надзором. Клонирование же безопасно и банально по сравнению с генной инженерией. Это часто выступает доводом в защиту клонирования: «Если вы опасаетесь клонирования человека, то генная инженерия человека вас должна просто ужасать».
· технология не совершенна, она может привести к смерти плода. Ни одна сфера человеческой деятельности не свободна от случайной смерти. Клонирование человека – не исключение. Некоторые из клонированных в Раслине овечек были мертворожденные. В настоящий момент технология клонирования млекопитающих находится в экспериментальной стадии и процент успешных исходов пока что низкий. Судя по дополнительным экспериментам на высших млекопитающих, можно предвидеть, что процедура клонирования будет усовершенствованна вплоть до такого качества, когда риск выкидыша или смерти ребенка будет такой же, что и для остальных рождений
В то же время существует как минимум две веские причины в защиту клонирования:
· предоставить возможность семьям зачать детей-близнецов выдающихся личностей;
· позволить бездетным парам иметь детей.
Клонирование выдающихся людей явление весьма неоднозначное. В настоящее время невозможно с уверенностью сказать, какой процент близнецов выдающихся людей будет делать равные по значимости вклады в науку, и будет ли давать вообще. В то же время это может сократить вливание посторонних талантов в научную сферу. Однако если запретить клонирование, этого мы никогда и не узнаем. Решительность и энергичность – несомненно, важные характеристики многих выдающихся людей. Есть предположения, что на них сильно влияет генетика. Если же обнаружится, что клоны выдающихся людей не оправдывают репутацию своих предшественников, то стимул для клонирования людей ослабнет. Тогда мы увидим, что люди, будучи информированными, захотят производить клонирование менее часто.
Кроме всего прочего, клонирование человека – это новое и неисследованное правовое поле, которое определенно потребует некоторого законодательного регулирования для предотвращения злоупотреблений.
Интересный, но малоизвестный факт процедуры клонирования, что она производится с замороженными, а не свежими клетками. Это означает, что нет необходимости, чтобы донор ДНК, будь то животное или человек, были живы, когда производится клонирование. Если образец ткани человека заморожен должным образом, человека можно было бы клонировать через длительное время после его смерти. В случае людей, которые уже умерли, и чья ткань не была заморожена, клонирование становится более сложным, и сегодняшняя технология это делать не позволяет. Однако для любого биолога было бы очень смелым заявить, что это невозможно. Если наука сможет разработать метод для получения клона из ДНК уже умершего существа перед ней откроются новые возможности.
Все ткани человека содержат ДНК и могут потенциально быть источником для клонирования. Перечень тканей включает человеческие волосы, кости и зубы. Однако, ДНК начинает медленно разлагаться через несколько недель после смерти, разрушая сегменты генетического кода. Например, по прошествии 60 миллионов лет, сохранились только короткие фрагменты ДНК динозавров, поэтому шансы воспроизведения парка Юрского периода невелики. Однако существуют хорошие шансы восстановления последовательности ДНК из образцов человеческой ткани, т. к. времени прошло существенно меньше. Представьте себе генетический код как книгу, из которой с течением времени случайным образом удаляются абзацы или страницы. Если у нас есть только одна копия книги, полный текст не может быть восстановлен. К счастью, у нас есть больше, чем одна копия. В кости или образце ткани могут быть многие тысячи клеток, каждая со своей копией кода ДНК. Это подобно обладанию тысячами копий той же самой книги. Если какая-либо страница удалена из одной книги, эта страница может оказаться целой невредимой в другой, поэтому, комбинируя информацию из многих клеток, можно в точности восстановить исходный генетический код. Еще один обнадеживающий фактор – что только небольшой процент из трех миллиардов символов генетического кода человека отвечает за индивидуальные различия. Например, генетические коды шимпанзе и людей на самом деле на 99% совпадают. Это означает, что восстанавливать придется менее 1% кода, т.е. только ту часть, которая определяет индивидуальные различия между людьми. Все это за пределами сегодняшней технологии, но принципиально осуществимо.
Очевидно, что клонирование человека имеет громадные потенциальные преимущества и несколько возможных отрицательных последствий. Как и со многими научными достижениями прошлого, такими как самолеты и компьютеры, единственная угроза – это угроза нашей собственной узкой умственной самоудовлетворенности. Клоны человека могут сделать большой вклад в области научного прогресса и культурного развития. В определенных случаях, где предвидятся возможные злоупотребления, их можно предотвратить с помощью узконаправленного специализированного законодательства. С каплей здравого смысла и разумным регулированием, клонирование человека – не есть нечто, чего нужно бояться. Нам следует ожидать его с волнительным нетерпением и поддерживать научные исследования, которые ускорят осуществление клонирования. Исключительные люди находятся среди величайших сокровищ мира. Клонирование человека позволит нам сохранить, а со временем даже восстановить эти сокровища.
Заключение
Клонирование очень важное явление в биологии и науке в целом. Исследования, положившие начало современным достижениям в области клонирования, начали проводиться ещё в XIX в. Немалая роль в исследованиях принадлежит российским и советским учёным. Клонирование растений – явление очень древнее, стало неотъемлемой частью жизнедеятельности людей, в отличие от клонирования животных и человека, где сделаны только первые шаги. Клонирование ценных трансгенных животных может быстро и экономично обеспечить человечество новыми лекарственными препаратами, содержащимися в молоке, специально полученных для этого генно-инженерными методами овец, коз или коров. Клонирование высокопродуктивных домашних животных, в частности, молочных коров, может произвести буквально революцию в сельском хозяйстве, так как только этим методом можно создать не отдельные экземпляры, а целые стада элитных коров. Это же относится к размножению выдающихся спортивных лошадей, ценных пушных зверей, сохранению редких и исчезающих животных в природных популяциях и т.д. Работы с домашними животными очень важны с практической точки зрения, это вызвало подъем среди любителей домашних животных, которые получили возможность получать копии своих любимцев. Новые технологии, без сомнения, приносят пользу человечеству, и их необходимо всячески поощрять. Запреты нужны в тех крайних случаях, когда явно просматривается вред или ущерб для здоровья и благополучия людей. Пока клонирование человека можно отнести к этому разряду. Возможность создавать человеческие копии фактически разделила мир на две части: тех, кто за и тех, кто против. Причем, против оказалось не только большинство религиозных деятелей, но и часть научного сообщества. Противники клонирования утверждают: создание людей с идентичным генетическим кодом противоестественно и аморально. На это сторонники идеи отвечают, что сегодня в мире живет 150 миллионов людей, чей генетический код не уникален. Речь идет о близнецах, у которых гораздо больше общего, чем у клона и его донора. Следующее возражение: клонирование уменьшает генетическое разнообразие и делает человечество более уязвимым в случае эпидемий. Однако сторонники идеи считают, что общее количество клонов будет очень незначительным из-за высокой стоимости процедуры клонирования и нежелания большинства женщин вынашивать клонов. Клонирование может привести к созданию людей-монстров, говорят противники. Сторонники утверждают, что в этом смысле гораздо опаснее генная инженерия, поскольку в этом случае ДНК не копируется, а модифицируется. Клонирование равнозначно принятию на себя роли Бога, полагают представители религиозной оппозиции. Приверженцы идеи отвечают, что священные тексты не содержат явного запрета на клонирование и напоминают, что любое открытие в области медицины в первое время вызывало аналогичные возражения со стороны религиозных деятелей. Сторонники клонирования утверждают, что преимущества, которые дает человечеству это достижение науки, при разумном регулировании значительно перевесит нежелательные последствия. Они полагают, что клонирование даст возможность бездетным парам иметь детей, а обществу – воспроизводить выдающихся личностей: актеров, ученых, спортсменов. Результатом многочисленных дискуссий стало законодательное запрещение экспериментов с эмбриональными клетками в одних странах, в других они, напротив, привели к тому, что эксперименты по клонированию человека, пусть с некоторыми ограничениями, но получили официальное благословение властей. Конец же спору о плюсах и минусах клонирования, видимо, будет положен лишь с появлением первой человеческой копии. Именно тогда появится реальная возможность узнать, что же такое на самом деле этот двойник.
Список литературы
1. Вир С. Клонирование человека // «NewsWeek», 2007 №12.
2. Данилова В.С., Кожевников Н.Н. Основные концепции современного естествознания. – М.: «Аспект Пресс», 2001.
3. Жигалов Ю.И. Концепции современного естествознания.- М.: «Гелиос АРВ», 2002.
4. Концепции современного естествознания // Под ред. С.И.Самыгина. – Ростов-на-Дону, 2003.
5. Конюхов Б.В. Этическая сторона клонирования. // «Наука и жизнь», 2006. №5.
6. Корочкин Л.И. Генетическая теория отбора, подбора и методов разведения животных. – Новосибирск: Наука, 1976.
7. Лось В.А. Основы современного естествознания. – М.: «ИНФРА-М», 2003.
8. Основы естественно-научных знаний для юристов // Под ред. Е.Р Россинской., – М.: НОРМА-ИНФРА.М, 2000.
9. Рузавин Г.И. Концепции современного естествознания. – М.: «Культура и спорт», 1997.
10. Сингер М., Берг П. Гены и геномы: в 2 т. – М.: Мир, 1998.
11. Хорошавина С.Г. Концепции современного естествознания. – Ростов-на-Дону: Феникс, 2005.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|



