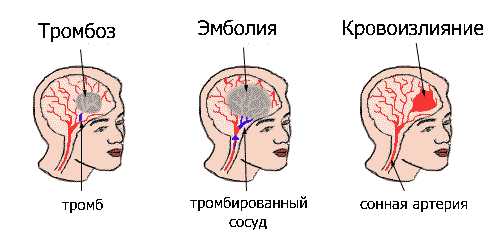
|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Что такое иммунитет и как его повысить? Реферат иммунитет
Реферат на тему: «Иммунитет. иммунная система организма»
Введение.
1.Иммунитет.
2.Антигены.
3.Органы иммунной системы.
4.Клеточные и гуморальные показатели иммунитета.
5.Иммунный ответ.
6.Регуляция иммунитета.
7.Функциональная система поддержания постоянства клеток организма.
Введение.
Внешние и внутренние факторы меняют клеточные циклы здорового человека. В результате образуются аномальные (чужеродные, или синтезированные не так, как свои собственные) молекулы и клетки. Специальные клетки крови и других тканей продуцируют и поддерживают достаточную концентрацию фиксированных на клетках и свободных молекул, которые распознают, связывают (преобразуют) и выводят из организма аномальные молекулы и клетки.
Перераспределение частиц и клеток, «иммунного надзора» во все ткани организма происходит через крово- и лимфоток, а также транспорт через гистогематические барьеры.
Иммунитет (от лат. immunis) дословно означает свободный от чего- либо. Организм здорового человека непрерывно освобождается от веществ и структур, в том числе болезнетворных, как попадающих в него извне, так и образующихся внутри организма.
Источниками внешних (экзогенных) веществ и структур являются компоненты пищи, химические примеси воздуха и капельки жидкости, микроорганизмы, попадающие на кожу, в легкие, желудочно-кишечный тракт. Эндогенными (возникающими в самом организме) веществами, нарушающими постоянство внутренней среды и выводимыми с помощью иммунных механизмов, являются аномальные (мутантные) клетки и их компоненты, появившиеся при делении клеток, внутриклеточном синтезе веществ, метаболиты (шлаки) и др.
Тело человека состоит примерно из 1012-1013генотипически похожих клеток. Если принять, что при делении клеток каждая миллионная клетка подвергается мутации, то в любой момент в организме человека есть примерно 10 млн. аномальных клеток, которые могут стать источником смертельных опухолей.
Различают специфическую защиту, или иммунитет, и неспецифическую резистентность организма. Последняя в отличие от иммунитета направлена на уничтожение любого чужеродного агента. К неспецифической резистентности относятся фагоцитоз и пиноцитоз, система комплемента, естественная цитотоксичность, действие интерферонов, лизоцима, -лизинов и других гуморальных факторов защиты.
1.Иммунитет.
Благодаря иммунитету организм опознает, связывает, разрушает и выводит вещества и структуры. Вещества, отличающиеся по происхождению от собственных структур, называют чужеродными.
Иммунитет — способность специальных клеток жидкостей организма опознавать, связывать и удалять (выводить) вещества и структуры, происходящие из клеток других организмов или потерявших сходство с клетками собственного тела.
Иммунитет поддерживает жизнедеятельность организма путем выведения изношенных клеток, белков (гемоглобин, др.), шлаков, возобновления специфических для организма белков, клеток, в том числе клеток крови определенной группы, сохранения чужеродного плода во время беременности, и др. Поэтому понятие иммунитет шире способности защищаться от инфекции. Хотя значение инфекции очевидно: около 50% здоровых людей является носителями болезнетворных микроорганизмов (Лебедев К.К., др., 1989).
Таким образом, иммунитет поддерживает определенные (молекулярные) показатели гомеостаза и, значит, здоровья человека: динамическое равновесие количества удаляемых и восстанавливаемых клеток, тканей и жидкостей тела.
Одним из механизмов гомеостаза является поддержание иммунитета — определенного уровня активности клеток (лимфоцитов, лейкоцитов, эпителиоцитов, др.), синтезирующих и выделяющих естественные антитела (глобулины и др.) в кровь и другие жидкости тела. Сохранение постоянства клеток и их производных есть результат деятельности иммунной системы.
Воздействие формирует систему ответа на него. Непрерывность антигенных воздействий на организм поддерживает иммунитет здорового человека. Помещенный в стерильные условия (стерильная пища, вода, окружающая среда) организм (гнотобионт, греч. gnotos- известный, biontos — живой организм) теряет иммунитет.
Раздражителями для органов иммунной системы являются антигены — сложные химические вещества, микроорганизмы, появляющиеся в результате деления аномальные клетки или их компоненты.
Эти антигенные воздействия вызывают ответы «органов» иммунной системы — костного мозга, тимуса, селезенки, пейеровых бляшек стенки кишечника, лимфоузлов, лимфатических сосудов и др. Степень активности органов иммунной системы, вызванная воздействием внутренних и внешних антигенов, описывается как состояние — иммунный статус человека, или иммунитет.
Человек остается здоровым до тех пор, пока не нарушается динамическое равновесие между антигенным воздействием и активностью иммунной системы. Поэтому иммунная система — понятие не столько морфологическое, сколько функциональное..
2. Антигены — это макромолекулярные соединения с жесткой структурой, вызывающие иммунный ответ организма
Макромолекулы, отличающиеся по происхождению и строению от основной массы меток организма и вызывающие иммунный ответ, называют антигенами (АГ). АГ поступают извне (пищевые, микробные, бытовые) или образуются внутри (эндогенные) организма. Антигенность вещества относительна: она зависит от способности клеток и находящихся в жидкостях тела веществ распознавать АГ..
Иммунная система реагирует на химические вещества различно: легче связывает такие, к которым имеет специальные молекулы- рецепторы. Такие вещества называют антигенами. Другие вещества реагируют с иммунными соединениями и могут разрушать их.
Значит, антигены (греч, ага -против, gennao- создавать) — это воспринимаемые иммунной системой химические раздражители (адекватные), вызывающие иммунные реакции.
По химическому строению антигены разнообразны. Большинство из них представляет собой макромолекулярные (масса молекулы 10 тыс. и более) соединения достаточной жесткости. Антигенами могут быть белки, пептиды, полисахариды, нуклеиновые кислоты, комплексные соединения и др.
Антигенность, т.е. способность вызывать иммунный ответ, приобретается в ходе внутриутробного или внеутробного развития, имеет свойство иммунной избирательности. Фиксированный на плазматической мембране клеток набор антигенов образует главный комплекс гистосовместимости (ГКО).
Аномальные клетки имеют на своих мембранах образованные с участием вируса антигены Т (англ.tumor — опухоль). Узнавание Т- антигенов таких клеток рецепторами (антителами) цитотоксических Т-лимфоцитов (Тц- тимус-зависимые цитотоксические лимфоциты) и связывание тех и других клеток приводит к разрушению и выведению из организма аномальных клеток.
3.Органы иммунной системы — анатомические образования, участвующие в формировании иммунной готовности организма нейтрализовать чужеродные структуры и вещества.
Костный мозг, тимус, селезенка, лимфоузлы, пейеровы бляшки кишечника, миндалины и червеобразный отросток являются образованиями, в которых непрерывно образуются и созревают клетки, способные осуществлять «иммунный надзор» в человеческом теле. Эти иммунные органы и ткани непрерывно обмениваются между собой метками и молекулами, создавая достаточный уровень антител в каждой ткани. Активность органов иммунной системы регулируется автономной нервной системой и гуморальными веществами.
Постоянное воздействие антигенов поддерживает активность органов иммунной системы — костного мозга, тимуса, пейеровых бляшек кишечника, миндалин, селезенки, лимфоузлов. . Клетки этих органов синтезируют антитела к соответствующим антигенам и населяют ими жидкости тела — кровь, слизь, пот, секреты.
Костный мозг — центральный (первичный) орган кроветворной ткани, называемой миелоидной (греч. mielos — мозг, оidеоs — похожий).
Подобно другим клеткам организма, клетки крови — эритроциты, лейкоциты и тромбоциты — становятся зрелыми после приобретения иммунологических рецепторовмбранах, характеризующих сходство (происхождение) клетки с другими аналогичными клетками. Иммунологическую компетентность клетки крови приобретают либо в костном мозге (эритроциты), либо в других иммунных органах (в лимфатической ткани миндалин глотки и пейеровых бляшек кишечника «созревают» В-лимфоциты с большим, в 100-200 раз превосходящим таковое у Т -лимфоцитов, количеством микроворсин на поверхности, в тимусе — Т-лимфоциты).
Кровоток в костном мозге уменьшается почти в 2 раза при стрессе и возрастает до 8-ми кратных объемов при успокоении.
Вилочковая железа (thymus, зобная железа) — центральный орган другой разновидности кроветворной ткани — лимфоидной. Железа располагается за грудиной в верхнем средостении и покрыта соединительнотканной капсулой.
После наступления половой зрелости соответствует периодам активного участия тимуса в формировании иммунитета.
Лимфоидная ткань тимуса представлена эпителиальными, фиксированными на мембранах кровеносных соcудов, контактирующими между собой клетками и большим количеством лимфоцитов различной формы.
Тимус выполняет роль эндокринной железы (его эпителиальные клетки выделяют в кровь тимозин) и иммунопродуцирующего органа, осуществляющего образование Т-лимфоцитов (тимус-зависимых).
Созревание Т-лимфоцитов в тимусе осуществляется за счет деления лимфоцитов, имеющих рецепторы к тем чужеродным антигенам с которыми организм встречался в детстве. Образование Т-лимфоцитов происходит независимо от содержания антигенов и количества Т- лимфоцитов в крови (вследствие непроницаемости гистогематического барьера тимуса) и определяется генетическими механизмами и возрастом.
Стрессорные воздействия (психоэмоциональное напряжение, тепло, холод, голодание, кровопотеря, сильная физическая нагрузка) подавляют образование Т-лимфоцитов. .
Селезенка (lien) — паренхиматозный вторичный лимфоидный орган массой 140-200 г, расположенный в левом подреберье и покрытый соединительнотканной оболочкой и брюшиной. Иннервируется селезенка блуждающим и чревным (смешанным симпатическим) нервами. Вторичным лимфоидным органом селезенка названа потому, что основная часть делящихся в ее строме клеток поступает из костного мозга.
Лимфоузлы (nodi lymphatici) — мелкие (диаметром 0,5-1 см), сильно меняющиеся по величине периферические органы иммунной системы. У взрослого человека имеется около 460 лимфоузлов, общая масса которых составляет примерно 1% веса тела. Лимфоузлы важнейших областей тела имеют иннервацию.
Лимфоузел построен так, чтобы создать большую поверхность обмена лимфы и протекающей через капилляры лимфоузла крови. Лимфоузел является местом иммунизации лимфоцитов и образования антител, фильтром мелких частиц и чужеродных клеток.
Лимфоузлы каждой области человеческого тела имеют собственный набор антител, поскольку поступающие с лимфой антитела каждой области специфичны.
Пейеровы бляшки — лимфоидная ткань стенки тонкого кишечника, где образуются В- лимфоциты.
Миндалины (tonsilae) скопления лимфоидной ткани в слизистой оболочке рта, носа и глотки. Миндалины построены так, что их складчатая поверхность слизистого эпителия задерживает попадающие в начальные отделы дыхательных и пищеварительных путей мелкие частицы и микроорганизмы, связывает их и лизирует с помощью внутриклеточных ферментов. Лимфоидная ткань миндалин аналогична таковой лимфоузла. Лимфатических сосудов в миндалинах нет.
Червеобразный отросток (арреndiх) также относят к периферическим иммунным органам («кишечная миндалина»). Объем лимфоидной ткани отростка сильно меняется под влиянием изменений деятельности начального отдела толстого кишечника (образование твердого кала, изменение перистальтики, др.). Изменения лимфоидной ткани червеобразного отростка чаще наблюдаются у лиц мужского пола.
4.Клеточные и гуморальные показатели
Клеточными компонентами иммунитета являются прежде всего лимфоциты, циркулирующие с током крови по всем органам и выполняющие главную роль «иммунного надзора» (патрулирования).
Лимфоциты, т.е. такие лейкоциты, у которых в цитоплазме нет гранул пероксидаз (ферментов, катализирующих окислительно- восстановительные реакции с участием перекисей), обладают способностью отличать в организме «чужие», т.е. необычного происхождения, крупные молекулы благодаря имеющимся на их мембранах рецепторам-антителам. Лимфоциты синтезируют антитела, лизируют чужеродные клетки, в том числе обеспечивают отторжение трансплантанта, иммунную память (способность отвечать усиленной реакцией на повторную встречу с антигеном) и др.
По месту созревания, составу органелл, размерам, рецепторам и функциям различают 3 основные группы лимфоцитов: 0-, В- и Т- лимфоциты.
0-лимфоциты — это некоммитированные клетки, образовавшиеся в костном мозге из стволовых клеток. Попадающие с током крови в тимус предшественники лимфоцитов за счет изменения антигенных свойств мембран становятся линейно-ограниченнными, т.е. способными при делении образовывать только Т-лимфоциты. Вероятно, что В-лимфоциты приобретают иные свойства в том числе антигенные при попадании в пейеровы бляшки кишечника.
Т- лимфоциты выполняют разные функции. Образуют плазматические клетки, блокируют чрезмерные реакции, поддерживая постоянство разных форм лейкоцитов, выделяя лимфокины, активируя лизосомальные ферменты и ферменты макрофагов, разрушают антигены.
В-лимфоциты обеспечивают гуморальный иммунитет путем выработки антител. При встрече с антигеном они мигрируют в костный мозг, селезенку, лимфатические узлы, где делятся и трансформируются в плазматические клетки. Последние и являются продуцентами антител — иммуноглобулинов.
Другой группой лимфоидных клеток иммунной системы являются макрофаги. Они различны по строению, находятся в жидкостях и тканях, фагоцитируют антитела, активируют лимфоциты и участвуют в образовании антител.
5.Иммунный ответ — последовательно развертывающаяся многоуровневая реакция антител и иммунных органов на антиген, сопровождающаяся гемодинамическими сдвигами.
Опознание и связывание чужеродных молекул и клеток происходит при контакте их с другой группой молекул. Это взаимодействие в отличие от химической реакции называют иммунным ответом.
Удаление или переход в неактивное состояние иммунокомпетентных клеток (Т-, В-лимфоцитов, макрофагов, плазматических клеток) является сигналом стимуляции центральных органов иммунитета — костного мозга и тимуса.
В целом иммунный ответ — это поэтапная каскадная реакция готовых АТ и последующее вовлечение периферических и центральных иммунных органов в активность. Иммунный ответ включает также гемодинамические изменения кровотока в области попадания «чужих» АГ. В упрощенном виде иммунный ответ можно представить в виде определенной последовательности развертывающихся процессов.
Узнавание антигена антителом происходит при контакте рецепторов двух структур. Если АГ и АТ совместимы, то они объединяются. Контакт АГ с АТ чаще происходит в жидкостях, поскольку при этом те и другие молекулы получают более высокую вероятность встречи.. Основным условием узнавания является сходство (совместимость) рецепторных поверхностей АГ и АТ.
Для узнавания («обшаривания» окружающего пространства вместо «оглядывания») нужно много времени и большое количество молекул АТ и АГ. Кроме того, есть возможность группового узнавания и изменения узнавания под влиянием различных веществ. Поэтому скорее всего в естественных условиях существуют и другие механизмы этих процессов. Узнавание инородных частиц фагоцитом облегчается в присутствии компонентов сыворотки крови (опсонины, альбумины, С-реактивный белок).
Первым этапом иммунного ответа является реакция связывания АГ антителом. Организм имеет готовый набор сформированных в предшествующих поколениях нормальных антител — естественный гуморальный иммунитет. «Привычные » АГ, попадая в те или иные жидкости организма, непрерывно связываются естественными АТ.
Связывание осуществляется за счет гидрофобного соединения активных центров АТ и АГ, соответствующих друг другу: специфичность АГ-АТ реакции).
Эти процессы осуществляются с затратой энергии, метаболизм макрофага резко повышается (наблюдается «метаболический или дыхательный взрыв»). Основным источником энергии служит АТФ.
Фагоцитоз приводит к усилению и видоизменению иммуного ответа. Выделение фагоцитирующими клетками различных веществ, осуществляющих передачу иммунологической сигнализации (медиаторов иммунного ответа).
Иммунологическая память выражается в конечном итоге в увеличении содержания Т- и В-лимфоцитов, несущих рецепторы к АГ и переходящих в покоящееся состояние после 2-3 делений, вызванных АГ.
Первичный иммунный ответ — наработка АТ и последующее связывание АГ с АТ- как реакция на первую встречу с новым АГ. Во внеутробной жизни человека непрерывно происходят реакции готовых антител с АГ — вторичный иммунный ответ.
ЗАКЛЮЧЕНИЕ
Мы рассмотрели сложную и индивидуально целесообразно устроенную систему защитных реакций организма. Одной из важнейших проблем современной биологии является вопрос о том, как и из чего она могла возникнуть в процессе эволюции. Подходы к этой проблеме лишь только намечаются.
Ясно, что защиту организма от внешней и внутренней биологической агрессии иммунная система обеспечивает путем двух основных механизмов — распознавания и разрушения чужеродных молекул и клеток. Это достигается благодаря слаженной работе иммуноцитов различного функционального предназначения. Основным молекулярным инструментом для реализации иммунного ответа служат антитела и поверхностные рецепторы. Причем те и другие могут выполнять как функцию распознавания, так и функцию разрушения чужеродных тел. Межклеточная связь между иммуноцитами выполняют интерлейкины, интерфероны и другие медиаторы. Нарушение этих механизмов приводит к различным формам иммунопатологии, опасной для здоровья и жизни
Список литературы
Ю.В. Урываев. Физиологические основы гомеостаза. Москва, 1995.
Г.В. Гущин, Е.Э. Яковлева. Нейрогуморальная регуляция иммунного гомеостаза. Ленинград: Наука, 1986.
Е.А. Зотиков. Антигенная система человека и гомеостаз. Москва: Медицина, 1982.
medicalru.ru
Реферат - Иммунитет - 1.doc
Реферат - Иммунитет (141 kb.)Доступные файлы (1):| 1.doc | 141kb. | 19.11.2011 22:26 |
1.doc
Оглавление:Введение........................................................................................................................................21.Иммунитет..................................................................................................................................22.Антигены.....................................................................................................................................33.Органы иммунной системы.......................................................................................................54.Клеточные и гуморальные показатели иммунитета................................................................85.Иммунный ответ.........................................................................................................................96.Регуляция иммунитета.............................................................................................................117.Функциональная система поддержания постоянства клеток организма............................13Заключение...................................................................................................................................15Введение.Внешние и внутренние факторы меняют клеточные циклы здорового человека. В результате образуются аномальные (чужеродные, или синтезированные не так, как свои собственные) молекулы и клетки. Специальные клетки крови и других тканей продуцируют и поддерживают достаточную концентрацию фиксированных на клетках и свободных молекул, которые распознают, связывают (преобразуют) и выводят из организма аномальные молекулы и клетки.
Перераспределение частиц и клеток, "иммунного надзора" во все ткани организма происходит через крово- и лимфоток, а также транспорт через гистогематические барьеры.
Иммунитет (от лат. immunis) дословно означает свободный от чего- либо. Организм здорового человека непрерывно освобождается от веществ и структур, в том числе болезнетворных, как попадающих в него извне, так и образующихся внутри организма.
Источниками внешних (экзогенных) веществ и структур являются компоненты пищи, химические примеси воздуха и капельки жидкости, микроорганизмы, попадающие на кожу, в легкие, желудочно-кишечный тракт. Эндогенными (возникающими в самом организме) веществами, нарушающими постоянство внутренней среды и выводимыми с помощью иммунных механизмов, являются аномальные (мутантные) клетки и их компоненты, появившиеся при делении клеток, внутриклеточном синтезе веществ, метаболиты (шлаки) и др.
Тело человека состоит примерно из 1012-1013генотипически похожих клеток. Если принять, что при делении клеток каждая миллионная клетка подвергается мутации, то в любой момент в организме человека есть примерно 10 млн. аномальных клеток, которые могут стать источником смертельных опухолей.
Различают специфическую защиту, или иммунитет, и неспецифическую резистентность организма. Последняя в отличие от иммунитета направлена на уничтожение любого чужеродного агента. К неспецифической резистентности относятся фагоцитоз и пиноцитоз, система комплемента, естественная цитотоксичность, действие интерферонов, лизоцима, -лизинов и других гуморальных факторов защиты.1.Иммунитет.
Благодаря иммунитету организм опознает, связывает, разрушает и выводит вещества и структуры. Вещества, отличающиеся по происхождению от собственных структур, называют чужеродными.
Иммунитет - способность специальных клеток жидкостей организма опознавать, связывать и удалять (выводить) вещества и структуры, происходящие из клеток других организмов или потерявших сходство с клетками собственного тела.
Иммунитет поддерживает жизнедеятельность организма путем выведения изношенных клеток, белков (гемоглобин, др.), шлаков, возобновления специфических для организма белков, клеток, в том числе клеток крови определенной группы, сохранения чужеродного плода во время беременности, и др. Поэтому понятие иммунитет шире способности защищаться от инфекции. Хотя значение инфекции очевидно: около 50% здоровых людей является носителями болезнетворных микроорганизмов (Лебедев К.К., др., 1989).
Таким образом, иммунитет поддерживает определенные (молекулярные) показатели гомеостаза и, значит, здоровья человека: динамическое равновесие количества удаляемых и восстанавливаемых клеток, тканей и жидкостей тела.
Эти показатели гомеостаза включают не только постоянство жидких сред организма, но и нормальную жизнедеятельность клеток- интенсивность митоза и мейоза, дифференцировку клеток, скорость образования клеточных клонов, продолжительность жизни клеток и др. Показатели гомеостаза, в том числе количество клеток каждого типа, как и размеры органов зависят от характера жизнедеятельности.
Восстановление и умножение структур невозможны без участия иммунных механизмов, создающих "нормальный", идентичный собственному, клеточный состав увеличенной мышцы или другой структуры.
Одним из механизмов гомеостаза является поддержание иммунитета - определенного уровня активности клеток (лимфоцитов, лейкоцитов, эпителиоцитов, др.), синтезирующих и выделяющих естественные антитела (глобулины и др.) в кровь и другие жидкости тела. Сохранение постоянства клеток и их производных есть результат деятельности иммунной системы.
Воздействие формирует систему ответа на него. Непрерывность антигенных воздействий на организм поддерживает иммунитет здорового человека. Помещенный в стерильные условия (стерильная пища, вода, окружающая среда) организм (гнотобионт, греч. gnotos- известный, biontos - живой организм) теряет иммунитет.
Раздражителями для органов иммунной системы являются антигены - сложные химические вещества, микроорганизмы, появляющиеся в результате деления аномальные клетки или их компоненты.
Эти антигенные воздействия вызывают ответы "органов" иммунной системы - костного мозга, тимуса, селезенки, пейеровых бляшек стенки кишечника, лимфоузлов, лимфатических сосудов и др. Степень активности органов иммунной системы, вызванная воздействием внутренних и внешних антигенов, описывается как состояние - иммунный статус человека, или иммунитет. Условно выделяют клеточные и гуморальные показатели степени активности иммунных органов.
Человек остается здоровым до тех пор, пока не нарушается динамическое равновесие между антигенным воздействием и активностью иммунной системы. Поэтому иммунная система - понятие не столько морфологическое, сколько функциональное.. 2. Антигены - это макромолекулярные соединения с жесткой структурой, вызывающие иммунный ответ организма
Макромолекулы, отличающиеся по происхождению и строению от основной массы меток организма и вызывающие иммунный ответ, называют антигенами (АГ). АГ поступают извне (пищевые, микробные, бытовые) или образуются внутри (эндогенные) организма. Антигенность вещества относительна: она зависит от способности клеток и находящихся в жидкостях тела веществ распознавать АГ. Антигенность молекул может усиливаться или ослабевать в случае соединения их с другими. Антигенны клетки мода по отношению к матери, сперма относительно слизистой влагалища, кровь одного человека относительно другого.
Иммунная система реагирует на химические вещества различно: легче связывает такие, к которым имеет специальные молекулы- рецепторы. Такие вещества называют антигенами. Другие вещества реагируют с иммунными соединениями и могут разрушать их.
Значит, антигены (греч, ага -против, gennao- создавать) - это воспринимаемые иммунной системой химические раздражители (адекватные), вызывающие иммунные реакции.
По химическому строению антигены разнообразны. Большинство из них представляет собой макромолекулярные (масса молекулы 10 тыс. и более) соединения достаточной жесткости. Антигенами могут быть белки, пептиды, полисахариды, нуклеиновые кислоты, комплексные соединения и др.
Обычно увеличение молекулярного веса антигена сопровождается повышением его иммунореактивности. Однако белки одинаковой молекулярной массы (гемоглобин и альбумин) могут иметь разную иммунореактивность. Агрегированные антигены (объединенные с другими на поверхности клеток крови, бактерий, др.) более иммунореактивны, чем отдельные антигены.
Антигенность, т.е. способность вызывать иммунный ответ, приобретается в ходе внутриутробного или внеутробного развития человека.
Главным свойством антигена является его чужеродность, т.е. особенности молекулы, образованные иным, непохожим на собственный, набором синтезирующих ферментов. Антигенная чужеродность проявляется в перестройке внутриклеточного синтеза. Для предотвращения этого антиген разрушается с помощью иммунной системы.
"Происхождение" антигена определяет расположение радикалов в его молекуле. Наиболее важная часть расположения радикалов молекулы антигена, которая характеризует его происхождение, называется детерминантой (эпитопом) антигена.
В отличие от химической реакции, взаимодействие антигена с антителом происходит не со всеми однотипными молекулами, а только с той их частью, которая имеет соответствующие детерминанте активные центры - антидетерминанты антитела. Поэтому Антигенность имеет свойство иммунной избирательности. Фиксированный на плазматической мембране клеток набор антигенов образует главный комплекс гистосовместимости (ГКО). Поскольку ГКС человека обнаружен на лейкоцитах, они были названы НLА(human leukocyte antigen). Структура антигенов ГКС похожа на молекулу иммуноглобулина G. Антигены ГКС человека представлены гликопротеидами 5 классов (групп): НLА-А, НLА-В, НLА-С, НLА- 0, НLА-ОК.. Каждый класс антигенов ГКС состоит из десятков разных антигенов. Специфичность ГКС определяется наличием соответствующих антигенов.
^ имеют на своих мембранах образованные с участием вируса антигены Т (англ.tumor - опухоль). Узнавание Т- антигенов таких клеток рецепторами (антителами) цитотоксических Т-лимфоцитов (Тц- тимус-зависимые цитотоксические лимфоциты) и связывание тех и других клеток приводит к разрушению и выведению из организма аномальных клеток.
Антигенность одних тканей организма относительно других неодинакова Метаболиты крови и некоторых жидкостей внутренней среды человека (индивидуальноспецифические антигены) не антигенны для других тканей того же организма. Достаточно крупные метаболиты органов и тканей, отделенные от внутренней среды гистогематическими барьерами - гематоэнцефалическим, гематоофтальмическим, гематотестикулярным, др.- являются антигенами для других тканей организма (органо - или гистоспецифические антигены). В случае повышения проницаемости гистогематического барьера, например при стрессе, усиленной физической нагрузке и др., в кровь поступают гистоспецифические антигены мозга, семенников, хрусталика, желез внутренней секреции, вызывая иммунный ответ.
^ представляют собой олигосахариды, связанные с белками поверхности мембран клеток крови. В настоящее время известно более 160 различных антигенов, образующих свыше 20 групп крови. Наиболее распространена АВНО (О) система групповой принадлежности крови. Антигены данной системы объединены в 3 вида: 1) гликофосфолипиды и гликопротеины. на поверхности эритроцитов и других клеток, 2) олигосахариды молока и мочи и 3) олигосахариды, связанные с муцинами, секретируемыми желудочно-кишечным, мочевыделительным и дыхательным трактами.
Антигенными свойствами обладают клетки и жидкости плода по отношению к матери. Иммунный ответ здоровой беременной женщины не развивается вследствие специфического его подавления (развития иммунологической толерантности).
Антигенность - чрезвычайно относительный признак: специфическая иммунологическая реакция на антиген определяется не столько свойствами антигена, сколько наличием антител к нему. Антигенность изменяется под влиянием химических веществ. Так, адъювантами (лат .adjuvare - помогать) названы вещества, усиливающие иммуногенность различных антигенов (неспецифический эффект). Депонируя антигены, адъюванты усиливают взаимодействие антигенов с антителами.
Адъювантами являются минеральные масла, гидроокиси и фосфаты аллюминия, Д-воска и др. В присутствии адъювантов антигенные свойства приобретают низкомолекулярные соединения. Например, глюкагон - полипептид с ММ 3.500 - в присутствии адъюванта становится антигеном. Кроме того, антигенность химических соединений зависит от чувствительности (реактивности) иммунной системы.
Резкое повышение чувствительности иммунной системы проявляется, в частности, в виде аллергической реакции. Антигены, чувствительность к которым значительно усилена и которые вызывают аллергическую реакцию, названы аллергенами (греч. allos - иной. ergen - действие).
Пищевые аллергены вызывают усиленный иммунный ответ не столько благодаря своей природе (наиболее часто аллергическую реакцию вызывают лактоглобулин коровьего молока, казеин, овальбумин яиц, белки крабов, раков и др.), сколько снижением иммунных свойств кишечной стенки, в частности способности секретировать IgА, недостаток которых способствует ускоренному всасыванию нерасщепленных белков и пептидов.
По источнику антигены делят на эндогенные и экзогенные. Эндогенными антигенами являются аномальные клетки и их компоненты, а также эмбрион для матери. Экзогенными антигенами являются попадающие на поверхность и слизистые оболочки, а также в желудочно-кишечный тракт белковые и полисахаридные вещества пищи, пыли, жидкости, воздуха, а также микроорганизмов.
Стафиллококки, грибки, микобактерии обнаруживаются в глубоких слоях кожи, протоках сальных и потовых желез здорового человека. Носовые ходы и носоглотка задерживают в 1 час до 14.000 микроорганизмов (стафиллококки, стрептококки, дифтерийные палочки, микобактерии и др.). Борту, кишечнике, особенно в толстом присутствует разнообразная микрофлора.
Пищевые и другие экзогенные антигены изменяют иммунный статус человека. Так, круглые черви - аскариды, трихинеллы, др., попадающие в пищеварительный канал, подавляют иммунитет. Амебы, токсоплазма, giardia, др., попадая в пищеварительный канал, могут как подавлять, так и усиливать иммунный ответ.
Имеют свою флору и наружные половые органы. Несовместимость антигенных свойств, обусловленных различием микрофлоры половых органов супругов, может быть причиной бесплодного брака (10-25% бесплодия). Сперма, содержащая антигены, агглютинирует в результате встречи с антителами слизи влагалища. Повторные половые сношения приводят либо к усилению, либо к снижению образования антиспермальных антител. Снижение антиспермальных антител выявлено у женщин при пользовании презервативами.
Бытовые аллергены входят в состав пыли (нитраты, смолы, лаки, биологические частицы, др.), косметических средств, покрытий мебели, стен, красок для одежды, обуви и т.д. Мужской Н-У-антиген клеточной поверхности обеспечивает дифференцировку первичной гонады в семенник.
^ - анатомические образования, участвующие в формировании иммунной готовности организма нейтрализовать чужеродные структуры и вещества.
Костный мозг, тимус, селезенка, лимфоузлы, пейеровы бляшки кишечника, миндалины и червеобразный отросток являются образованиями, в которых непрерывно образуются и созревают клетки, способные осуществлять "иммунный надзор" в человеческом теле. Эти иммунные органы и ткани непрерывно обмениваются между собой метками и молекулами, создавая достаточный уровень антител в каждой ткани. Активность органов иммунной системы регулируется автономной нервной системой и гуморальными веществами.
Постоянное воздействие антигенов поддерживает активность органов иммунной системы - костного мозга, тимуса, пейеровых бляшек кишечника, миндалин, селезенки, лимфоузлов. Эти анатомические образования условно делятся на центральные (первичные) и иммунной системы, из которых клетки крови расселяются в остальные ее органы. Эти клетки синтезируют антитела к соответствующим антигенам и населяют ими жидкости тела - кровь, слизь, пот, секреты.
^ - центральный (первичный) орган кроветворной ткани, называемой миелоидной (греч. mielos - мозг, оidеоs - похожий). Это сеть контактирующих между собой (с помощью десмосом) ретикулярных клеток и волокон (стремы) вокруг артериол, синусоидов (тонкостенных капилляров большого диаметра, лат. sinus -полый, оidеоs - подобный) и венул, пространства которой заполнены предшественниками клеток крови, макрофагами и жировыми клетками, не связанными между собой контактами.
Отсутствие контактов между основной массой клеток - предшественниц форменных элементов крови обеспечивает относительную самостоятельность их функционирования, подвижность и сменяемость всей ткани. Миелоидная ткань располагается внутри жесткого костного каркаса.
Костный мозг - производное клеток крови. У эмбриона человека колониеобразующие единицы (КОЕ) появляются в печени. Это мелкие, подвижные, самообновляющиеся благодаря митозу клетки, группирующиеся в колонии (скопления). При делении КОЕ образуются клетки-предшественники эритроцитов, а также лейкоцитов и тромбоцитов. Как только у плода развивается костная ткань, в ее полости попадают КОЕ и начинается образование клеток крови. После рождения в костной ткани накапливаются соли кальция, они уплотняются. Давление крови выталкивает через синусоиды в костные полости мелкие КОЕ, а затем и более крупные клетки крови. Увеличение количества костей сопровождается расселением КОЕ в них.
Миелоидная ткань костей черепа, грудины, позвоночника, ребер, конечностей приобретает способность к кроветворению по мере уплотнения и развития в ней кровеносных сосудов. У пожилых и старых людей происходят обратные процессы.
Подобно другим клеткам организма, клетки крови - эритроциты, лейкоциты и тромбоциты - становятся зрелыми после приобретения иммунологической компетентности, т.е. рецепторов на своих мембранах, характеризующих сходство (происхождение) клетки с другими аналогичными клетками. Иммунологическую компетентность клетки крови приобретают либо в костном мозге (эритроциты), либо в других иммунных органах (в лимфатической ткани миндалин глотки и пейеровых бляшек кишечника "созревают" В-лимфоциты с большим, в 100-200 раз превосходящим таковое у Т -лимфоцитов, количеством микроворсин на поверхности, в тимусе - Т-лимфоциты).
Кровоток в костном мозге составляет 15-20 мл/мин./100 г ткани. Он осуществляется по кровеносным сосудам, включающие синусоиды, через которые в костный мозг попадают не только белки, гормоны и др. вещества, но и клетки крови (микроциркуляция в костном мозге). Кровоток в костном мозге уменьшается почти в 2 раза при стрессе и возрастает до 8-ми кратных объемов при успокоении.
^ (thymus, зобная железа) - центральный орган другой разновидности кроветворной ткани - лимфоидной. Железа располагается за грудиной в верхнем средостении и покрыта соединительнотканной капсулой.
Масса вилочковой железы у взрослого человека 7-32 г. Большая абсолютная ( 10-15 г) и относительная (1/ЗОО часть массы тела) величина тимуса у детей и ее инволюция (лат. involutio - загибание, обратное развитие) после наступления половой зрелости соответствует периодам активного участия тимуса в формировании иммунитета.
Лимфоидная ткань тимуса представлена эпителиальными, фиксированными на мембранах кровеносных соcудов, контактирующими между собой клетками и большим количеством лимфоцитов различной формы. Последние очень подвижны: около 15% лимфоцитов ежесуточно выходит в селезенку и лимфоузлы.
Тимус выполняет роль эндокринной железы (его эпителиальные клетки выделяют в кровь тимозин) и иммунопродуцирующего органа, осуществляющего образование Т-лимфоцитов (тимус-зависимых).
Созревание Т-лимфоцитов в тимусе осуществляется за счет деления лимфоцитов, имеющих рецепторы к тем чужеродным антигенам с которыми организм встречался в детстве. Образование Т-лимфоцитов происходит независимо от содержания антигенов и количества Т- лимфоцитов в крови (вследствие непроницаемости гистогематического барьера тимуса) и определяется генетическими механизмами и возрастом.
Стрессорные воздействия (психоэмоциональное напряжение, тепло, холод, голодание, кровопотеря, сильная физическая нагрузка) подавляют образование Т-лимфоцитов. Возможными путями реализации стрессорных воздействий на тимус могут быть сосудистый (уменьшение кровотока в железе) и гуморальный (подавляющее митоз клеток влияние кортикоидов и др.).При длительном стрессе иммунитет снижается. Селезенка (lien) - паренхиматозный вторичный лимфоидный орган массой 140-200 г, расположенный в левом подреберье и покрытый соединительнотканной оболочкой и брюшиной. Иннервируется селезенка блуждающим и чревным (смешанным симпатическим) нервами. Вторичным лимфоидным органом селезенка названа потому, что основная часть делящихся в ее строме клеток поступает из костного мозга. Лимфоидная ткань селезенки представляет собой образованную ретикулярными клетками сеть вокруг кровеносных капилляров (синусоидов). Основной объем органа в ячейках сети заполнен форменными элементами крови - эритроцитами (красная пульпа, от лат. рu1ра - мякоть) или лейкоцитами (белая пульпа). Эта масса не контактирующих между собой контактов клеток изменяется по количеству и составу, т. е. обменивается, сравнительно быстро.
Микроциркуляция в селезенке осуществляется через синусоиды, пропускающие как компоненты плазмы крови, так и форменные элементы.
Уменьшение объема селезенки (на 20-40 мл) вследствие выталкивания части подвижных клеток крови в кровяное русло происходит за счет сокращения гладкомышечных тяжей капсулы органа и пучков гладкомышечных клеток, проникающих вглубь органа. Это возникает под влиянием адреналина и норадреналина, выделяемых симпатическими постганглионарными волокнами (до 90% таких волокон входит в состав блуждающего нерва) или мозговой частью надпочечников.
Регуляция тонуса артериол и венул селезенки обеспечивает изменение состава клеток крови в органе.
Лимфоузлы (nodi lymphatici) - мелкие (диаметром 0,5-1 см), сильно меняющиеся по величине периферические органы иммунной системы. У взрослого человека имеется около 460 лимфоузлов, общая масса которых составляет примерно 1% веса тела. Лимфоузлы важнейших областей тела имеют иннервацию.
Лимфоузел построен так, чтобы создать большую поверхность обмена лимфы и протекающей через капилляры лимфоузла крови. Лимфоидная ткань лимфоузла покрыта соединительнотканной оболочкой. Под оболочку лимфоузла из нескольких лимфатических сосудов притекает лимфа, просачивающаяся через щели лимфоидной ткани лимфоузла и вытекающая из одного лимфососуда. Кровь поступает в лимфоузел через артериолу и выходит через венулу. Из крови в лимфоузел заселяются КОЕ. Лимфоузел является местом иммунизации лимфоцитов и образования антител, фильтром мелких частиц и чужеродных клеток.
Физиологическая активность лимфоузла - лимфе- и кроваток, пополнение Т- и В-лимфоцитов, интенсивность деления клеток, образование антител (до 75% всех иммуноглобулинов) на мембранах плазматических (ретикулярных) клеток лимфоузла, проницаемость мембран и обмен между лимфой и кровью, связывание мелких частиц лимфы и т.д. - зависят от активности АНС, гормонов в крови и иммунномедиаторов .
Лимфоузлы каждой области человеческого тела имеют собственный набор антител, поскольку поступающие с лимфой антитела каждой области специфичны.
^ - лимфоидная ткань стенки тонкого кишечника, где образуются В- лимфоциты.
Миндалины (tonsilae) скопления лимфоидной ткани в слизистой оболочке рта, носа и глотки. Миндалины построены так, что их складчатая поверхность слизистого эпителия задерживает попадающие в начальные отделы дыхательных и пищеварительных путей мелкие частицы и микроорганизмы, связывает их и лизирует с помощью внутриклеточных ферментов. Лимфоидная ткань миндалин аналогична таковой лимфоузла. Лимфатических сосудов в миндалинах нет.
^ (арреndiх) также относят к периферическим иммунным органам ("кишечная миндалина"). Объем лимфоидной ткани отростка сильно меняется под влиянием изменений деятельности начального отдела толстого кишечника (образование твердого кала, изменение перистальтики, др.). Изменения лимфоидной ткани червеобразного отростка чаще наблюдаются у лиц мужского пола.
Кроме центральных и периферических иммунных органов, существуют забарьерные (ЦНС, семенники, глаза, паренхима тимуса и при беременности – плод) и внутрибарьерные (кожа). ^ - характеристики клеток и веществ внутренней среды, отражающие иммунную активность.
Показателями готовности клеток, и тканей организма обнаруживать и связывать чужеродные молекулы являются количество антител и других молекул, участвующих в иммунных реакциях, а также степень активности меток тканей и жидкостей организма.
Иммунитет оценивается по иммунологической активности клеток различных тканей и органов, а также концентрации нефиксированных антител и способности их участвовать в иммунных реакциях, находящихся в жидкостях тела - крови, лимфе и межклеточной жидкости.
Клеточными компонентами иммунитета являются прежде всего лимфоциты, циркулирующие с током крови по всем органам и выполняющие главную роль "иммунного надзора" (патрулирования).
Лимфоциты, т.е. такие лейкоциты, у которых в цитоплазме нет гранул пероксидаз (ферментов, катализирующих окислительно- восстановительные реакции с участием перекисей), обладают способностью отличать в организме "чужие", т.е. необычного происхождения, крупные молекулы благодаря имеющимся на их мембранах рецепторам-антителам. Лимфоциты синтезируют антитела, лизируют чужеродные клетки, в том числе обеспечивают отторжение трансплантанта, иммунную память (способность отвечать усиленной реакцией на повторную встречу с антигеном) и др.
По месту созревания, составу органелл, размерам, рецепторам и функциям различают 3 основные группы лимфоцитов: 0-, В- и Т- лимфоциты.
0-лимфоциты - это некоммитированные клетки, образовавшиеся в костном мозге из стволовых клеток. Попадающие с током крови в тимус предшественники лимфоцитов за счет изменения антигенных свойств мембран становятся линейно-ограниченнными, т.е. способными при делении образовывать только Т-лимфоциты. Вероятно, что В-лимфоциты приобретают иные свойства в том числе антигенные при попадании в пейеровы бляшки кишечника.
^ выполняют разные функции. Образуют плазматические клетки, блокируют чрезмерные реакции, поддерживая постоянство разных форм лейкоцитов, выделяя лимфокины, активируя лизосомальные ферменты и ферменты макрофагов, разрушают антигены.
В-лимфоциты обеспечивают гуморальный иммунитет путем выработки антител. При встрече с антигеном они мигрируют в костный мозг, селезенку, лимфатические узлы, где делятся и трансформируются в плазматические клетки. Последние и являются продуцентами антител - иммуноглобулинов.
Другой группой лимфоидных клеток иммунной системы являются макрофаги. Они различны по строению, находятся в жидкостях и тканях, фагоцитируют антитела, активируют лимфоциты и участвуют в образовании антител.
Гуморальные компоненты иммунной системы - глобулины плазмы и других жидкостей тела, синтезированные макрофагами лимфоузлов, селезенки, печени, костного мозга и др., дезактивирующие чужеродные антигены. Они содержатся в крови, в меньшем количестве - в органах и тканях, отделенных от крови гистогематическими барьерами - коже, слизистых оболочках, мозге, почках, легких, др. Иммуноглобулины осуществляют местные реакции и являются первым эшелоном защиты организма от антигенов. Специфичность иммунных реакций человека сформировалась в предшествующих поколениях благодаря встречам с определенными антигенами.
Электрофоретически выделенные гамма - глобулины сыворотки крови делят на несколько видов При иммунизации первоначально возрастает содержание Ig, затем IgG, а потом и др. Нормальные, или естественные, антитела человека - это антитела жидкостей и тканей здорового человека .^ - последовательно развертывающаяся многоуровневая реакция антител и иммунных органов на антиген, сопровождающаяся гемодинамическими сдвигами.
Опознание и связывание чужеродных молекул и клеток происходит при контакте их с другой группой молекул. Это взаимодействие в отличие от химической реакции называют иммунным ответом. Иммунная реакция развертывается как микропроцесс образование комплекса молекул (в простейшем случае АГ-АТ), изменение свойств клеточных мембран, приближение особых клеток (макро-и микрофагов)к зоне взаимодействия и т.д. После взаимодействия АГ и АТ может быть 2 варианта: прекращение иммунного ответа в случае полного связывания АГ или усиление ответа в случае сохранения АГ. В последнем варианте усиление иммунной реакции выражается в увеличении кровотока и лимфотока в месте нахождения АГ, усилении продукции АТ и т.д. Это происходит за счет появления химических веществ, опосредующих это усиление иммунной реакции (медиаторов) - факторов хемотаксиса, фагоцитоза, антителогенеза и др. При попадании АГ в жидкости тела в иммунный ответ быстро вовлекаются гуморальные и нервные аппараты регуляции.
Связывание и удаление АГ постоянно восполняется продукцией новых копий АТ взамен выведенных, доставкой их в зоны активности, перераспределением между тканями и органами и т.д. Периферические органы иммунной системы - селезенка и лимфоузлы - являются источниками некоторого количества готовых АТ, а также местами перераспределения АТ вследствие изменения кровотока и лимфотока в отдельных тканях данного региона.
Удаление или переход в неактивное состояние иммунокомпетентных клеток (Т-, В-лимфоцитов, макрофагов, плазматических клеток) является сигналом стимуляции центральных органов иммунитета - костного мозга и тимуса. Эти постоянно протекающие ответы иммунной системы на "привычные" АГ или их количество составляют иммунный фон активности, колеблющийся в зависимости от состояния и биоритмов человека. Встреча с "новым" АГ, поступление повышенного количества "привычных" АГ, изменение состояния организма, в частности, ослабление при утомлении, стрессе, гиповитаминозе, т.д., изменяет иммунный ответ. Иммунный ответ осуществляется по статистическим закономерностям, требует для реализации АГ-АТ реакции определенного соотношения концентраций АГ и АТ (Г.И.Марчук).
В целом иммунный ответ - это поэтапная каскадная реакция готовых АТ и последующее вовлечение периферических и центральных иммунных органов в активность. Иммунный ответ включает также гемодинамические изменения кровотока в области попадания "чужих" АГ. В упрощенном виде иммунный ответ можно представить в виде определенной последовательности развертывающихся процессов.
^ антителом происходит при контакте рецепторов двух структур. Если АГ и АТ совместимы, то они объединяются. Контакт АГ с АТ чаще происходит в жидкостях, поскольку при этом те и другие молекулы получают более высокую вероятность встречи. В особенности в жидкостях перемещающихся ("патрулирование" лейкоцитов, лимфоцитов, макрофагов крови, лимфы). Основным условием узнавания является сходство (совместимость) рецепторных поверхностей АГ и АТ. На поверхности АТ имеется от двух (IgО, IgА, IgЕ) до десяти (Igм) активных центров узнавания АГ. Узнавание возможно как при совпадении одной рецепторной поверхности АТ (одиночное узнавание), так и совпадении двух поверхностей (двойное узнавание).
Для узнавания ("обшаривания" окружающего пространства вместо "оглядывания") нужно много времени и большое количество молекул АТ и АГ. Кроме того, есть возможность группового узнавания и изменения узнавания под влиянием различных веществ. Поэтому скорее всего в естественных условиях существуют и другие механизмы этих процессов. Узнавание инородных частиц фагоцитом облегчается в присутствии компонентов сыворотки крови (опсонины, альбумины, С-реактивный белок).
Первым этапом иммунного ответа является реакция связывания АГ антителом. Организм имеет готовый набор (до 10000 антител у эмбриона по Ф .Барнету) сформированных в предшествующих поколениях нормальных антител - естественный гуморальный иммунитет. "Привычные " АГ, попадая в те или иные жидкости организма, непрерывно связываются естественными АТ.
Связывание осуществляется за счет гидрофобного соединения активных центров АТ и АГ, соответствующих друг другу: специфичность АГ-АТ реакции). После этого структура комплекса АГ-АТ изменяется (конформируется, от лат. соnformis - подобный). Комплекс приобретает способность связывать другие белки, например, комплемент. Поскольку АГ и АТ часто фиксированы на мембранах клеток (микробных, тканевых), то образовавшийся АГ-АТ комплекс "утяжеляет" клетки, меняет их свойства. В результате клетки склеиваются (агглютинируют, от лат. agglutiare - приклеивать), оседают (седиментируют, отлат. sedimentare - оседать, преципитируют, от лат. ргесipitare -сбрасывать). Если же комплекс АГ-АТ образуется из свободных, не фиксированных на мембранах белков, то формируются хлопья (происходит флокулляция, от лат. floculli - клочки, хлопья).
Итак, в результате связывания АГ антителом комплекс АГ-АТ теряет подвижность и либо лишается активности (цитотоксический эффект), либо растворяется (лизируется, от лат. lisis - растворение) с участием других белков.
"Привычные" (для них есть нормальные АТ), а также "новые" АГ подвергаются фагоцитозу (греч. phagos - пожирающий) макрофагами. Первоначально макрофаги образуют псевдоподию - выпячивание протоплазмы в направлении АГ- за счет, активации Са-зависимого фермента гельсолина, подавляющего образование геля из сократительных белков (актин, миозин) цитоплазмы. При сокращении цитоплазматических белков макрофаг постепенно приближается и контактирует с АГ. Имеющиеся на поверхности макрофага специфические (для "привычных" ) и неспецифические (гликопротеидные, полисахароидные для "новых" АГ) рецепторы соединяются с активными центрами АГ, который постепенно погружается в цитоплазму макрофага.
Эти процессы осуществляются с затратой энергии, метаболизм макрофага резко повышается (наблюдается "метаболический или дыхательный взрыв"). Основным источником энергии служит АТФ.
Фагоцитоз приводит к усилению и видоизменению иммуного ответа. Выделение фагоцитирующими клетками различных веществ, осуществляющих передачу иммунологической сигнализации (медиаторов иммунного ответа).
С помощью медиаторов клеточного иммунитета местная реакция генерализуется. За счет хемоатрактантов (лат. attractare - притягивать) к месту попадания АГ начинают приближаться другие макрофаги, в том числе естественные клетки-киллеры аномальных клеток. Усиление кровотока в месте попадания АГ, происходящее а счет выделения гистамина и др. сосудорасширяющих веществ, ведет к поступлению дополнительных количеств АТ и макрофагов. Другие факторы (антителогенеза, стимуляции роста колоний, интерлейкин-3, др.) увеличивают синтез клеток-продуцентов антител.
Особую роль выполняют медиаторы иммунного ответа, стимулирующие образование АТ к "непривычным" АГ. В этом случае иммунный ответ обеспечивает синтез таких АТ, которые соответствуют АГ, а также запоминают иммунный сигнал, поддерживая в течение некоторого времени установившийся тип синтеза АТ.
^ выражается в конечном итоге в увеличении содержания Т- и В-лимфоцитов, несущих рецепторы к АГ и переходящих в покоящееся состояние после 2-3 делений, вызванных АГ.
^ - наработка АТ и последующее связывание АГ с АТ- как реакция на первую встречу с новым АГ. Во внеутробной жизни человека непрерывно происходят реакции готовых антител с АГ - вторичный иммунный ответ.
Характер иммунного ответа зависит от многих факторов: исходной активности иммунной системы, вида АГ, способа поступления в организм, количества и динамики поступления и т.д., состояния организма (возраста, образа жизни, питания, т.д.) и др.
Лучше изучены иммунные ответы на моделях, где контролируются условия введения АГ, его характеристики и т.д., а также состояние объекта воздействия. Так, установлен ряд закономерностей динамики накопления антител после первого и второго введния АГ. Первый пик концентрации АТ появляется через несколько дней (латентный период иммунного ответа) и обусловлен усиленным синтезом главным образом IgМ, После второго введения того же АГ амплитуда ответа больше, он продолжается дольше и обусловлен возрастанием преимущественно синтеза IgG. Для понимания природы происходящей при иммунном ответе динамики АТ следует учитывать различие продолжительности существования их в плазме крови .
Повторные введения АГ помогли установить явленне сенсибилизации (повышения чувствительности к данному АГ, лат.sensibilis-чувствительный) иммунной системы. Сенсибилизация сопровождается активацией образования специфических АТ, которые разносятся с током крови во все ткани и фиксируются на клетках. Поэтому повторное введение данного АГ вызывает усиленную АГ-АТ реакцию, в результате которой высвобождается много биологически активных веществ, (гистамин, серотонин, кинины,т.д.), вызывающих быстрые и сильнее изменения физиологических функций - анафилактический шок.
Найдены способы понижения усиленной чувствительности иммунной системы (десенсибилизация по А.М.Безредка, др.). Многократные воздействия АГ могут извращать иммунный ответ (аллергии, др.). Эти и подобные им "необычные" иммунные ответы относят к патологическим и не рассматриваются здесь, хотя граница между нормой и патологией в большинстве случаев неопределенна. ^ - воздействия на активность иммунных органов, изменяющие иммунные ответы
Изменение иммунных ответов под влиянием психо-эмоционального состояние, питания, степени физической активности, биологических ритмов, привычек, климата и т.д. называют регуляцией иммунитета. Исполнительными механизмами регуляции иммунитета у человека являются автономная нервная система и эндокринные органы. Выявлен относительный антагонизм влияний симпатической и парасимпатической нервной систем, а также катехоламиновых и инсулиноподобных гормонов на иммунитет.
Способность организма сохранять постоянство клеток и тканей меняется в зависимости от психического, эмоционального, биологического состояния, возраста, наследственности, биологических ритмов, питания, климата, поведения. Иначе говоря, иммунитет регулируется в соответствии с индивидуальными особенностями человека.
Общие положения регуляции функций, такие как ведущая роль психики, высшей нервной деятельности, нервных регуляций (нервизм) по отношению к другим (субординационные отношения), общих по сравнению с локальными и др., полностью приложимы к регуляции иммунитета.
У здорового человека активность иммунной системы изменяется так, чтобы обеспечить выживание. Такие изменения иммунитета опосредуются ЦНС, АНС, гуморальными и гормональными влияниями. Факторы, подтверждающие роль психики и ВНД, реализующиеся через активность ЦНС, АНС и периферических нервов, в регуляции состояния иммунитета человека широко известны. Так, установлена связь между типом ВНД человека и особенностями иммунного ответа, а также обратные зависимости - изменения условнорефлекторной деятельности вследствие иммунизации (в особенности при первичном ответе, Д.Ф.Плецитый, др.). В последнее время выявлена возможность образования условнорефлекторных сдвигов показателей иммунитета у человека после сочетания условного сигнала с подкреплением (введение адреналина).
Эмоциональный стресс сопровождается повышением пролиферации естественных клеток-киллеров (ЕКК), повышением активности тимус- зависимых лимфоцитов-хелперов, а невроз-снижением активности этой группы лимфоцитов.
Депрессия сопровождается общим снижением лейкоцитов, Т- хелперов и Т-супрессоров, а также ЕКК. В гипоталамусе выявлены волокна, содержащие интерлейкин -1-1b, опосредующий реакцию структуры мозга на неблагоприятные воздействия (охлаждение, перегревание, перенапряжение и т.д.).
Установлено, что у левшей чаще встречаются аллергические и аутоиммунные заболевания (вследствие наследственных или приобретенных свойств?).
Медиаторами иммунного ответа являются гормоны (глюкокортикоиды, нейропептиды, др.), а также полипептиды клеток иммунной системы. В частности, иммунные реакции модулируются АКТГ, бета- эндорфином, метэнкефалином и др. фрагментами проопиомеланокортина, синтезируемого клетками аденогипофиза). Эти гормоны воздействуют на рецепторы клеток иммунной системы. Например, метэнкефалин стимулирует формирование антителопродуцирующих клеток, рост клеточных колоний в тимусе и селезенке. Однако концентрация бета- эндорфинов в плазме является решающим фактором в появлении конечного эффекта: низкие концентрации ( 1/10.-14 моль) стимулируют, а более высокие подавляют продукцию специфических антигерпетических систем.
Важным фактором регуляции иммунитета является характер и тип питательных веществ. Полиненасыщенные жирные кислоты пищи подавляют активность ЕКК, усиливают синтез простагландина ИГЕ. Наоборот, арахидоновая кислота пищи, подавляя синтез ПГЕ, стимулирует иммунитет. Ограничение белковой пищи вызывает снижение активности Т-хелперов, миграцию макрофагов и их способность образовывать антитела. Состав флоры кишечника в значительной степени определяет состояние иммунитета человека. Например, коринебактерии JК прямой кишки выявляются у людей с выраженным иммунодефицитом (лейкоз, СПИД, др.). Иммунорегуляция липопротеидами низкой плотности, появляющимися в плазме крови после приема пищи, опосредуется через рецепторы иммунокомпетентных клеток.
В значительной степени регуляция иммунитета определяется содержанием серотонина в клетках кишечника (до 90% от общего количества).
Описаны биоритмологические и возрастные изменения иммунитета здорового человека. Так, в утренние часы наблюдается максимум Т- лимфоцитов и минимум В-лимфоцитов (противофазно содержанию 11-оксикортикостеровдов), а фагоцитоз и уровень пропердина наиболее высоки и в дневное и вечернее время, снижаясь ночью и утром. Иммунореактивность имеет сезонные колебания - снижается весной и осенью. С возрастом нарастает число аномальных клеток. Например, спонтанные перестройки хромосом в клетках крови составляют почти 3% у лиц старшей возрастной группы (50-80 лет). С другой стороны, в этом возрасте наблюдается снижение иммунных реакций на инородные клетки-мутанты. Причиной этого является ухудшение иммунного опознания собственных АГ вследствие дефектов клеточных рецепторов, активности макрофагов, т.д. Кроме того, в указанном возрасте отмечается снижение содержания лимфоцитов (1.5.109/л в 50 лет сравнительно с 2.0.109/лв20лет). Наконец, у лиц старшей возрастной группы усиливается аутоиммунные. реакции вследствие накопления тканевых комплексов АГ-АТ(например,к гемоглобулину), нарушения соотношения иммуноглобулинов (преобладание продукции IgМ и снижение продукции IgО и IgА), др.
Беременность сопровождается повышением содержания комплемента Сз, особенно в 1ом и Зм триместрах, усилением фагоцитарной и бактерицидной активности лейкоцитов. На ранних сроках беременности иммунитет специфически подавляется, что предотвращает отторжение зародышевых клеток, несущих признаки чужеродности.
Таким образом, активность иммунных органов, связанных со всеми системами организма -кровообращением, кровью, дыханием, метаболизмом, т.д. - меняется не только под влиянием факторов, исходящих из иммунных органов, но и многих других. Последние могут нетолько способствовать, но и препятствовать осуществлению нормальных саморегуляторных влияний иммунной системы, как стабилизировать, так и ухудшать иммунные ответы.
^ - динамическое взаимодействие органов, тканей и неклеточных структур, поддерживающее постоянство клеток организма благодаря саморегуляции .
Возможным механизмом поддержания иммунологической "чистоты" индивидуальной внутренней среды человека является иерархически построенная особая функциональная система. Предположительными уровнями ее функционирования являются местный, органный(региональный) и уровень всего организма.
Описанные в предыдущем параграфе частные проявления влияний различных факторов на иммунные органы и их производные-антитела - можно представить в общем виде как функциональную систему, компоненты которой взаимодействуют так, что сохраняется определенное количество каждого вида клеток и их признаки (отсутствие аномальных клеток).
Это осуществляется за счет саморегуляции: увеличение числа тех или иных клеток вызывает возрастание специфических цитотоксических подавляющих влияний, и наоборот, снижение количества определенных клеток вызывает усиление цитогенетических. влияний.
Саморегуляция клеточного состава тела инерционна. Это обусловлено тем, что жизненный цикл большинства эукариотов тела человека длится десятки часов и суток. Переход из одного состояния иммунной активности в другую завершается благодаря гуморальным влияниям - столь же медленным и инерционным. Также медленно происходит приобретение иммунной компетенции клетками, перераспределение их между иммунными и остальными органами, выход клеток и компонентов плазмы в ткань через гистогематические барьеры и т.д. Можно предполагать, что в естественных условиях периоды колебаний тех или иных клеточных популяций происходят в течение часов и суток. В этих условиях важное регуляторное значение приобретает кумулятивный эффект (накопление воздействий) регуляции.
Полезным приспособительным результатом, или системообразующим фактором данной функциональной системы является поддержание характерного для конкретной окружающей среды, определенного возраста, пола, сезона и вида деятельности (поведения, питания и образа жизни) уровня активности клеточных клонов (греч.klonos-движение, т.е. образовавшихся из одной клетки группы клеток). Это означает сохранение состояния неустойчивого равновесия: должную степень активности АТ клеток, тканей и жидкостей организма, препятствующей с одной стороны образованию достаточного для развития опухолей количества аномальных клеток, а с другой - развитию микробной флоры.
Таким образом, полезный приспособительный результат функциональной системы поддержания постоянства клеточного состава тканей и жидкостей организма состоит из антисептических и антионкотических компонентов.
Афферентная часть функциональной системы, воспринимающая отклонения клеточного состава той или иной ткани от "нормального" состояния и передающая сигналы другим клеткам и органам, представлена в основном гуморальными сигналами. Это преимущественно специальные, не полностью до настоящего времени идентифицированные компоненты внутренней среды .
В большинстве случаев избирательность влияния этих гуморальных сигнализаций зависит от наличия специальных рецепторов клеточных мембран, с которыми связываются переносимые жидкостью-кровью, лимфой, межклеточной, спинномозговой, внутрисуставной, плевральной и др. жидкостями - вещества. Хотя установлены влияния медиаторов клеточного иммунитета и на ЦНС, однако нервная система играет роль аппарата регуляции более высокого порядка сравнительного с гуморальным периферическим. Поэтому афферентная сигнализация в ЦНС имеет качественно иной характер: вероятно эта импульсация сигнализирует о состоянии исполнительных органов- желез внутренней секреции и функционировании жизненно важных тканей.
Эффекторными (исполнительными) аппаратами функциональной системы поддержания постоянства клеток организма являются как специфические структуры и вещества - АТ, фиксированные на мембранах клеток и свободные, а также лимфоциты, макрофаги, специфические факторы активации связывания АГ и др., так и неспецифические - расширение капилляров, увеличение проницаемости их .стенок и т.д. под влиянием биологически активных веществ, поступающих из разрушенных клеток (базофилов, эозинофилов, др.). В конечном счете эффекторные аппараты иммунитета осуществляют постепенно развертывающуюся защитную иммунную реакцию. Она зависит от соотношения свойств и количества АГ с одной стороны и исходного состояния иммунитета с другой.
Основные принципы работы эффекторных аппаратов сводятся .к следующему:
1.Образование и поступление АТ в определенную область тела пропорционально количеству и виду АГ.
2.. Характер и тип иммунного ответа (локальный, региональный, генерализованный, быстрый, медленный) зависят от способа и темпа поступления АГ, его вида, а также состояния иммунной системы.
Аппаратами интеграции афферентных нейрогуморальных и эффекторных влияний являются морфологические структуры, в которых происходит объединение, взаимодействие большого числа факторов. Наиболее возможными аппаратами интеграции могут быть либо мозговые структуры с их громадным числом (1014) взаимодействующих элементов, либо образования с обильным кровотоком, позволяющим всем компонентам крови легко контактировать с их стенками или их содержимым.
Аппаратами интеграции иммунной системы являются главным образом центральные и периферические органы иммунной системы. Циркулирующие вместе с жидкостями иммуноактивные агенты воздействуют на органы иммунной системы, обеспечивая усиление синтеза АТ, активацию деления клеток, миграцию их из центральных иммунных органов в периферические или в определенные области организма и др. ЗАКЛЮЧЕНИЕ
Мы рассмотрели сложную и индивидуально целесообразно устроенную систему защитных реакций организма. Одной из важнейших проблем современной биологии является вопрос о том, как и из чего она могла возникнуть в процессе эволюции. Подходы к этой проблеме лишь только намечаются.
Ясно, что защиту организма от внешней и внутренней биологической агрессии иммунная система обеспечивает путем двух основных механизмов - распознавания и разрушения чужеродных молекул и клеток. Это достигается благодаря слаженной работе иммуноцитов различного функционального предназначения. Основным молекулярным инструментом для реализации иммунного ответа служат антитела и поверхностные рецепторы. Причем те и другие могут выполнять как функцию распознавания, так и функцию разрушения чужеродных тел. Межклеточная связь между иммуноцитами выполняют интерлейкины, интерфероны и другие медиаторы. Нарушение этих механизмов приводит к различным формам иммунопатологии, опасной для здоровья и жизниСписок литературы1.Ю.В. Урываев. Физиологические основы гомеостаза.
Москва, 1995.
- Г.В. Гущин, Е.Э. Яковлева. Нейрогуморальная регуляция иммунного гомеостаза. Ленинград: Наука, 1986.
- Е.А. Зотиков. Антигенная система человека и гомеостаз
www.students.ru
www.studmed.ru
Реферат - Иммунная система человека
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
“СЫКТЫВКАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ”
Финансово-экономический факультетКафедра философии и культурологи
Контрольная работа
(реферат)
по Концепции современного естествознания
Иммунная система человека
Научный руководитель
доцент кафедры, кандидат
философских наук И.В. Федорович
Исполнитель,
студентка 4130 гр. А.Н. Селиванова
Сыктывкар 2009
Содержание:
1. Введение
2. Неспецифический (врожденный) иммунитет
3. Специфический (приобретенный) иммунитет
4. Иммунный ответ
5. Заключение
Список литературы
Приложение
Введение
В медицинскую практику термин иммунитет вошел во второй половине 19 века – начальный период активной разработки способов вакцинации для защиты людей от инфекционных заболеваний.
В настоящее время понятно, что иммунные механизмы защиты срабатывают всегда, когда конкретный организм сталкивается с тем или иным чужеродным материалом – будь то бактерии, вирусы, мутационно измененные собственные клетки тела, тканевые или органные трансплантанты или просто химические соединения, которым приданы иммуногенные свойства. Иначе, иммунитет есть способ защиты организма от всех антигенно чужеродных веществ, как экзогенной так и эндогенной природы. Биологический смысл подобной защиты- обеспечение биологической целостности организма в течение жизни.
Источниками внешних (экзогенных) веществ и структур являются компоненты пищи, химические примеси воздуха и капельки жидкости, микроорганизмы, попадающие на кожу, в легкие, желудочно-кишечный тракт. Эндогенными (возникающими в самом организме) веществами, нарушающими постоянство внутренней среды и выводимыми с помощью иммунных механизмов, являются аномальные (мутантные) клетки и их компоненты, появившиеся при делении клеток, внутриклеточном синтезе веществ, метаболиты (шлаки) и др.
Тело человека состоит примерно из 1012 -1013 генотипически похожих клеток. Если принять, что при делении клеток каждая миллионная клетка подвергается мутации, то в любой момент в организме человека есть примерно 10 млн. аномальных клеток.
Благодаря иммунитету организм опознает, связывает, разрушает и выводит вещества и структуры.
Наиболее характерными признаками иммунной системы, отличающим её от других систем организма, являются следующие:
1. способность дифференцировать все «свое» от всего «чужого»
2. создание памяти от первичного контакта с чужеродным антигенным материалом
И.И. Мечников открыл первую клетку иммунной системы, которую назвал фагоцит или макрофаг. Фагоцитоз был известен ученым с 1862 года по работам Э. Геккеля, но только Мечников первый связал фагоцитоз с защитной функцией иммунной системы. В 1892 г. Мечников выпускает свою ставшую знаменитой книгу «Лекции по патологии воспаления», где он впервые употребил слово «иммунитет» для обозначения системы защиты организма от внешнего инфекционного агента, которая делает его свободным от болезней.
Неспецифический (врожденный) иммунитет
Под неспецифическим иммунитетом подразумевают систему защитных факторов организма, присущих данному виду, как наследственно обусловленное свойство. Иммунитет, создаваемый анатомическими, физиологическими, клеточными и молекулярными факторами, которые являются естественными составляющими элементами организма, иначе называют конституционным.
Условно факторы неспецифической защиты можно разбить на 4 типа:
· физические (анатомические)
· физиологические
· клеточные. Осуществляющие эндоцитоз
· факторы воспаления
Физические барьеры
Одним из существенных препятствий на пути проникновения возбудителя во внутреннюю среду организма являются внешние покровы. В этом смысле кожа человека выполняет в первую очередь механическую и барьерную функции. Кроме того кожа подавляет колонизацию и размножение бактерий. Поскольку характеризуется сниженным рН за счет присутствия в потовых выделениях молочной и жирных кислот. Другим физическим препятствием являются слизистые покровы дыхательных путей и желудочно-кишечного тракта. Мерцательный эпителий этих образований удаляет проникшие бактерии. Механическим препятствием к колонизации являются так же секреты слизи, слезных и слюнных желез.
Физиологические барьеры
Этот тип защиты включает температуру тела, рН. Кислотность желудка – ещё одни барьер на пути проникновения патогенов в организм. Лишь очень немногие микроорганизмы способны преодолеть низкое значение РН желудочного сока. Бактерицидное действие отделяемого слизистых оболочек связано так же с наличием в этом отделяемом особого вещества – лизоцима. Лизоцим содержится в слезах, мокроте, слюне, плазме, сыворотке крови, лейкоцитах. Лизоцим растворяет не только живых, но и мертвых бактерий.
Так же к физиологическим барьерам относят интерфероны — группа белков, продуцируемых вирусоинфецированными клетками. Среди прочих функций интерфероны способны прямо подавлять размножение вирусов.
Эндоцитоз
Эндоцитоз — это реакция клеток, направленная на поглощение и переваривание растворимых макромолекулярных соединений, а также чужеродных или структурно- измененных собственных клеток. Это обобщающий термин для двух близких, но тем не менее самостоятельных процессов — пиноцитоза и фагоцитоза.
Пиноцитоз характеризуется поглощением и внутриклеточным разрушением макромолекулярных соединений, таких как белки, нуклеиновые кислоты, полисахариды, липопротеины.
Фагоцитоз – явление поглощение и переваривание клеткой корпускулярного материала – бактерий, крупных вирусов, отмирающих собственных клеток организма и чужеродных клеток. Случайный контакт фагоцита с микробной клеткой приводит к тому, что фагоцит поглощает микробную клетку и за счет гидролитических ферментов происходит полное или частичное разрушение патогенна (см. приложение)
Воспаление
Воспаление является основным механизмом работы иммунной системы. Поврежденные кожные покровы являются наиболее доступными воротами для инфекции. Проникшие патогенны вызывают комплексную реакцию воспаления, которая направлена на локализацию и уничтожение микроорганизмов в месте внедрения. Разнообразие протекания воспалительного процесса не позволяет дать точное количественно-временное описание фаз этого процесса. Поэтому, можно говорить лишь о последовательности включения тех или иных иммунных механизмов.
При внедрении в организм чужеродных клеток или их антигенных продуктов, часть из них немедленно связывается с «нормальными антителами». Этот процесс сопровождается выбросом биологически активных веществ (в первую очередь гистамина). Эти вещества вызывают многократное усиление кровотока в данном регионе из-за расширения регионарных сосудов всех типов и включения в работу резервных сосудов. Другие биологически активные вещества, например серотонин, воздействуют на нервные окончания и это клинически проявляется как боль. Постепенно сосуды в очаге воспаления расширяются ещё сильнее и скорость тока крови резко замедляется практически до полного стаза. Это приводит к так называемому «краевому стоянию лейкоцитов»- приклеиванию их к сосудистой стенке. Вместе с развивающейся в это же время повышенной проницаемостью сосудистой стенки это ускоряет миграцию лейкоцитов из русла. Возникает очаг воспаления. В очаг воспаления мигрируют фагоцитирующие клетки, которые начинают процесс фагоцитоза. Нередко, когда патогенность и число внедрившихся чужеродных клеток невелико, а количество специфических лимфоцитов и антител в очаге достаточно, на этом этапе происходит полное уничтожение чужеродного и реакция заканчивается.
Вторая фаза воспалительной реакции развивается на фоне продолжающихся реакций первой фазы. Начинается она с поступления в очаг воспаления специфических Т-лимфоцитов. В это же время в очаг воспаления начинают приходить макрофаги. Активированные макрофаги начинают захватывать и уничтожать чужеродные клетки. Это процесс препятствует расширению области воспаления. Наконец, этот продуктивный этап воспаления переходит в заключительную фазу, основой которой является регенерация поврежденной ткани. Эта фаза включает окончательное освобождение от поврежденных элементов, регенерацию ткани и завершается исчезновением из очага воспаления всех лейкоцитарных элементов.
Специфический (приобретенный) иммунитет
Она основана на специфических функциях лимфоцитов, клеток крови, распознающих чужеродные макромолекулы и реагирующих на них либо непосредственно, либо выработкой защитных белковых молекул- антител.
Существенный признак иммунной системы связан со способностью сохранять память о первой встрече с антигеном. Именно это свойство специфического иммунитета лежит в основе вакцинации.
Главенствующую роль в приобретенном иммунитете играют органы иммунной системы. Центральные органы иммунной системы — костный мозг и тимус. Периферические органы — селезенка, лимфатические узлы, пейровы бляшки кишечника, миндалины. Кроме того значительная часть макрофагов и лимфоцитов находиться в циркулирующей крови и лимфе.
Основной функцией красного костного мозга является продукция клеток крови. В красном костном мозгу образуются стволовые клетки, которые дают начало всем формам кровяных и лимфоидных клеток. Стволовые клетки, дифференцирующиеся по лимфоидному типу, мигрируют в тимус. В тимусе под действием гормонов тимозина, тимостимулина, тимопоэтинов происходит дифференциация стволовых клеток в Т-лимфоциты. Тимус состоит из 2-3 долек, каждая долька имеет корковый и мозговой слой. В корковом веществе происходит дифференциация родоначальной кроветворной костномозговой клетки в Т-лимфоциты. Т-лимфоциты мигрируют в мозговой слой, а оттуда с кровью и лимфой мигрируют в периферические лимфоидные органы — лимфоузлы, селезёнку и пейеровы бляшки.
В эмбриогенезе тимус формируется раньше других лимфоидных образований (на 5 неделе беременности) и к рождению является самым большим лимфоидным органом. У человека вес вилочковой железы увеличивается до начала полового созревания (до 30г, в среднем), а затем снижается (в среднем, до 20г). Из тимуса в кровь поступают пептидные гормоны тимозины и тимопоэтины. Они стимулируют дифференцировку и пролиферацию Т- и В-лимфоцитов.
Согласно новейшим данным иммунологов, при формировании иммунной системы важную роль играет аппендикс. Аппендикс нам необходим в младенчестве и первые годы жизни. Наибольшего развития он достигает вскоре после рождения, а затем, выполнив свою функцию в строительстве иммунной системы, орган начинает регрессировать.
Скопления лимфоидной ткани находят и в других местах желудочно-кишечного тракта. Эти образования отвечают за распознание чужеродных антигенов в пище.
Лимфоузлы служат механическими барьерами для микробов. В них происходит и рекогносцировка антигенов (чужеродных белков) и их элиминация.
Лимфатическая система также играет значительную роль в детоксикации организма и удалении избыточной жидкости. Каждая клетка окружена лимфой, её в нашем теле в 4 раза больше, чем крови. Кровь с кислородом и питательными веществами из капилляров просачивается в лимфу, окружающую клетки. Клетки забирают кислород и питательные вещества и выделяют взамен токсины, часть которых вновь попадает в капилляры. Мёртвые клетки, протеины крови и другой токсичный мусор удаляется через лимфатическую систему. Лимфа проходит через лимфатические узлы, в которых мертвые клетки и яды нейтрализуются и разрушаются. Если лимфатическую систему перекрыть на 24 часа, то организм неминуемо умрёт в результате накопления протеинов крови и излишней жидкости вокруг клеток.
В селезёнке паренхима содержит красную и белую пульпу. В красной пульпе преобладают эритроциты, а в белой лимфоциты и макрофаги.
Диффузно рассеянная лимфоидная ткань слизистых оболочек кишечника, дыхательных путей и мочеполового тракта состоит из скоплений лимфоцитов и макрофагов. При антигенном стимуле в ней активируются Т- и В-лимфоциты, а также макрофагальная реакция, продуцируются секреторные иммуноглобулины. Они обеспечивают местный иммунитет.
Различают 3 типа Т-лимфоцитов:
Т-киллеры разрушают инфицированные и злокачественные клетки. Клетки-мишени поражаются при прямом контакте под действием лимфотоксина без участия антител и комплемента.
Т-хелперы – посредники. Они через контакт с тимусзависимым антигеном индуцируют превращение В-лимфоцитов в плазмоциты. Индуцируют образование Т-киллеров.
Т-супрессоры — регуляторы антителообразования, участвуют в формировании иммунологической толерантности. Активированные Т-супрессоры подавляют активность Т-хелперов.
Основными клеточными элементами приобретённого иммунитета являются В-лимфоциты, Т-лимфоциты и макрофаги. Эта система функционирует как единое целое при гуморальном иммунном ответе в селезёнке и лимфоузлах. В-лимфоциты являются предшественниками плазмоцитов. В-лимфоциты генетически запрограммированы на синтез поверхностного рецептора, специфичного к одному определенному антигену. Встретив и распознав этот антиген В-лимфоциты размножаются и деферинцируются в плазмоциты, которые образуют и выделяют большое количестиво антител.
Патогенный микроб попадает в лимфоузел, где подвергается фагоцитозу. В сыворотке новорождённых находят генетически запрограммированные нормальные антитела к различным видам микроорганизмов. Нормальные антитела экспрессируются на поверхностных мембранах незрелых В-лимфоцитов. Уровень свободно плавающих нормальных антител в крови возрастает, когда повышается их воспроизводство В-лимфоцитами. Последнее происходит под воздействием микроорганизмов, служащим пусковым сигналом.
Вскоре после рождения организм ребёнка заселяется микрофлорой. Кроме прямого антагонистического действия на патогенные микроорганизмы, нормальная микрофлора является, по-видимому, фактором стимуляции иммунной системы. Маленькие дети особенно восприимчивы к вирусам до тех пор, пока не приобретут иммунитет к наиболее распространенным из них. Малыши простужаются в среднем 6-10 раз в год, так как их иммунная система недостаточно развита. К 8-летнему возрасту уровень антител в организме ребёнка достигает взрослой концентрации. В дальнейшем они болеют ОРВИ реже. Ребёнок к подростковому возрасту набирает банк данных — формирует библиотеку антител. Этот механизм хорошо работает в условиях жизни при большой скученности населения (в городе).
Иммунный ответ
Иммунный ответ представляет собой реакцию организма на внедрение в него микробов или различных ядов. В целом, любое вещество, чья структура отличается от структуры тканей человека способно вызвать иммунный ответ. Исходя из механизмов, задействованных в его реализации, иммунный ответ может быть различным. Можно выделить две основные фазы иммунного ответа:
1. распознавание антигена
2. реакция, направленная на его устранение
В результате, различаем специфический и неспецифический иммунный ответ.
Неспецифический иммунный ответ — это первый этап борьбы с инфекцией он запускается сразу же после попадания микроба в наш организм. В его реализации задействованы система комплимента, лизоцим, тканевые макрофаги. Неспецифический иммунный ответ практически одинаков для всех типов микробов и подразумевает первичное разрушение микроба и формирование очага воспаления. Воспалительная реакция это универсальный защитный процесс, который направлен на предотвращение распространения микроба. Неспецифический иммунитет определяет общую сопротивляемость организма. Так, например, люди с ослабленным иммунитетом чаще болеют различными заболеваниями.
Специфический иммунитет это вторая фаза защитной реакции организма. Основной характеристикой специфического иммунного ответа является распознавание микроба и выработка факторов защиты направленных специально против него. Процессы неспецифического и специфического иммунного ответа пересекаются и во многом дополняют друг друга. Во время неспецифического иммунного ответа часть микробов разрушается, а их части выставляются на поверхности клеток (например, макрофагов). Во второй фазе иммунного ответа клетки иммунной системы (лимфоциты) распознают части микробов, выставленные на мембране других клеток, и запускают специфический иммунный ответ как таковой. Специфический иммунный ответ может быть двух типов: клеточный и гуморальный.
Клеточный иммунный ответ подразумевает формирование клона лимфоцитов (К-лимфоциты, цитотоксические лимфоциты), способных разрушать клетки мишени, мембраны которых содержат чужеродные материалы (например, вирусные белки).
Клеточный иммунитет задействован в ликвидации вирусной инфекции, а также таких типов бактериальных инфекций как туберкулез, проказа, риносклерома. Раковые клетки тоже разрушаются активированными лимфоцитами.
Гуморальный иммунный ответ опосредован В-лимфоцитами, которые после распознания микроба начинают активно синтезировать антитела по принципу один тип антигена – один тип антитела. На поверхности одного микроба может быть множество различных антигенов, поэтому обычно вырабатывается целая серия антител, каждое из которых при этом направлено на определенный антиген.
Антитела (иммуноглобулины, Ig) – это молекулы белков, способные прилипать к определенной структуре микроорганизма, вызывая его разрушение или скорейшее выведение из организма.
Существует несколько типов иммуноглобулинов, каждый из которых выполняет специфическую функцию.
· Иммуноглобулины типа А (IgA) синтезируются клетками иммунной системы и выводятся на поверхность кожи и слизистых оболочек. В больших количествах IgA содержатся во всех физиологических жидкостях (слюна, молоко, моча). Иммуноглобулины типа А обеспечивают местный иммунитет, препятствуя проникновению микробов через покровы тела и слизистые оболочки.
· Иммуноглобулины типа M (IgM) выделяются в первое время после контакта с инфекцией. Эти антитела представляют собой большие комплексы способные связывать сразу несколько микробов одновременно. Определение IgM в крови является признаком развития в организме острого инфекционного процесса.
· Антитела типа G (IgG) составляют 75% всех иммуноглобулинов сыворотки крови и являются наиболее долгоживущими. Они появляются вслед за IgM и представляют собой основной фактор гуморального иммунитета. Этот тип антител защищает организм на протяжении длительного времени от различных микроорганизмов.
· Иммуноглобулины типа Е (IgE) накапливаются в тканях слизистых и кожных оболочек. Участвуют в развитии аллергических реакций немедленного типа, тем самым защищая организм от проникновения микробов и ядов через кожу.
Антитела вырабатываются во время всех инфекционных болезней. Период развития гуморального иммунного ответа составляет примерно 2 недели. За это время в организме вырабатывается достаточное количество антител для нейтрализации инфекции.
Клоны цитотоксических лимфоцитов и В-лимфоцитов сохраняются в организме длительное время и при новом контакте с микроорганизмом запускают мощный иммунный ответ. Присутствие в организме активированных иммунных клеток и антител против определенных типов антигенов носит название сенсибилизация. Сенсибилизированный организм способен быстро ограничивать распространение инфекции, предупреждая развитие болезни.
Сила иммунного ответа зависит от реактивности организма, то есть от его способности реагировать на внедрение инфекции или ядов. Различаем несколько типов иммунного ответа в зависимости от его силы: нормоэргический, гипоэргический и гиперэргический (от греч. ergos – сила).
Нормоэргический ответ – соответствует силе агрессии со стороны микроорганизмов и приводит к их полному устранению. При нормоэргическом иммунном ответе повреждение тканей в ходе воспалительной реакции умеренно и не вызывает серьезных последствий для организма. Нормоэргический иммунный ответ характерен для людей с нормальной функцией иммунной системы.
Гипоэргический ответ – слабее агрессии со стороны микроорганизмов. Поэтому при таком типе ответа распространение инфекции ограничивается не полностью, а само инфекционное заболевание переходит в хроническую форму. Гипоэргический иммунный ответ характерен для детей и пожилых людей (у этой категории людей иммунная система работает недостаточно в силу возрастных особенностей), а также у лиц с первичными и вторичными иммунодефицитами.
Гиперэргический иммунный ответ развивается на фоне сенсибилизации организма по отношению к какому-либо антигену. Сила гиперэргического иммунного ответа во многом превышает силу агрессии микробов. В ходе гиперэргического иммунного ответа воспалительная реакция достигает значительных значений, что приводит к повреждению здоровых тканей организма. Возникновение гиперэргического иммунного ответа определяется особенностями микроорганизмов и конституциональными характеристиками самой иммунной системы организма. Гиперэргические иммунные реакции лежат в основе формирования аллергии.
Заключение
Иммунная система – это большая биологическая система, имеющая сложную иерархическую структуру организации. Иммунная система обладает всеми характеристиками больших систем. Она многокомпонентна: в её состав входят клетки и молекулы, обладающие разными свойствами, функциями и специфичностью. Все компоненты иммунной системы работают во взаимосвязи, как единое целое, а сама система обладает целостностью и сложностью поведения. Иммунная система — открытая система. Она тесно связана с другими системами организма — гуморальной, нервной, эндокринной и др., которые не только определяют условия её существования, но и участвуют в регуляции её функционирования.
Нормальным состоянием иммунной системы является состояние постоянной её работы с разной степенью активности. Ясно, что полностью спокойного, «нерабочего» состояния иммунной системы быть не может, поскольку в организме все время появляются дефектные и отмирающие собственные клетки. Покровы организма постоянно контактируют с нормальной микрофлорой, часть которой проникает внутрь из-за дефектов кожи и слизистых оболочек.
Список используемой литературы:
1. Галактионов В.Г. «Иммунология»: Учебник. -М.; Изд-во МГУ, 1998, 488с.
2. Игнатов П.Е. «Иммунитет и инфекция»- М.: Время, 2002, 352с
3. «Иммунология в клинической практике» под ред. Профессора К.А. Лебедева, 1 том, 1996, 387с.
4. Ройт А., Бростофф Дж., Мейл Д., «Иммунология», пер с англ.- М.: Мир, 2000, 592с.
Приложение
Фагоцитоз
www.ronl.ru
Реферат - Что такое иммунитет и как его повысить?
Городской конкурс реферативных работ
«Ступень к исследованию»
Тема: Иммунитет
Автор:
Болотникова О.В.
г. Зеленогорск
Гимназия №164 8Б класс
научный руководитель
Миколайко В.К.
Учитель гимназии №164
Зеленогорск
2007г.
Оглавление
Глава 1. Введение
Глава 2. Основная часть
2.1 Что такое иммунитет
2.2 Виды иммунитета
2.3 Механизм действий
2.4 Факторы, наносящие вред иммунной системе
2.5 Признаки ослабления иммунитета
Глава 3. Вывод
Глава 4. Список литературы
Глава 1. Введение
В народе говорят:
здоровье, как погода,
пока хорошее – не замечаешь.
Зачем людям – не медикам, нужно знать об иммунитете? Анализ состояния здоровья населения во всем мире показал, что медицине не удается сделать здоровыми без вооружения человека знаниями о его собственной природе, о причинах возникновения болезней о путях восстановления и поддержания нормальной деятельности всех органов и систем организма.
В этой связи осведомленность людей – не медиков, в вопросах сохранения нормального функционирования иммунной системы организма неоценимо важна. В современном мире у человека могут формироваться различные иммунные нарушения, в результате чего человек становится, по сути, заложником иммунодефицита на всю жизнь, который и определяет его «здоровье».
Исследования последних лет показали, что основной причиной многих и многих заболеваний являются нарушения иммунитета. Чем бы и как бы человек не лечился, болезнь возвращается вновь и вновь до тех пор, пока не будет восстановлена его иммунная система, пока организм не сможет излечивать себя сам.
Цель: выяснить, что такое иммунитет и как его повысить.
Задачи:
· изучить и проанализировать материал по теме;
· рассмотреть механизм действия иммунитета;
· выяснить причины ослабления иммунитета;
· найти пути повышения иммунитета;
· проанализировать и систематизировать полученные сведения.
Глава 2. Основная часть
2.1. Что такое иммунитет?
Когда мы обращаемся к врачам? Ответ прост: когда мы заболеваем. Почему мы болеем? На этот более сложный вопрос огромное число медицинских справочников, учебников, монографий и научных публикаций отвечает по-разному. Указывают на различные причины (этиология) и механизмы развития (патогенез) многочисленных заболеваний. Понятно, что однозначно ответить очень трудно. Но может нужно поставить вопрос по-другому: почему одни люди болеют, а другие – здоровы? У организма человека много врагов – внешних и внутренних.
Ежедневно, ежеминутно в любом организме на страже человека стоит целая армия клеток и механизмов, которая способна отразить любую инфекционную агрессию. Есть и милиция, готовая в случае необходимости подавить внутреннюю агрессию. И все это делает иммунная система. Для того чтобы обеспечить внутреннюю безопасность, специальные клетки «курсируют» по организму, и проверяют у каждого «молекулярный паспорт». Потому что, к нам в организм ежеминутно с пищей и воздухом, через микротрещины на коже проникают разнообразные микроорганизмы. Но наша иммунная система стоит стражей и ей быстро удается их узнать, локализовать и уничтожить инфекционного агента, причем в большинстве случаев мы этого даже не замечаем. Но когда атака извне случается слишком массированной, а враг оказался очень сильным, объявляется всеобщая мобилизация, и тогда в очаг воспаления несутся несметные полчища клеток-воинов, что б защитить ту среду, которая их взрастила, наш общий организм. Иногда в нашем организме вместо внешних врагов появляются внутренние «смутьяны». Потому как все организмы и ткани все время обновляются, происходят различные изменения в составе тканей и органов. Для этого клеткам, составляющим специальный клеточный «резерв», приходится постоянно делиться. Именно в процессе таких делений в их генетическом аппарате делящихся клеток происходит перестройка структуры клетки, что и улавливают клетки — полицейские. Они как бы не узнают своих же. И вот при выполнении таких делений возможны сбои. На 10 000 делений может приходиться один сбой. Неблагоприятные условия окружающей среды могут повышать частоту ошибок. Из-за этих ошибок клетка могут погибать, или перерождаться в клетку злокачественную, что может послужить причиной рака. И вот тут-то иммунитет нормального человека при очередной «проверке документов» отреагирует, и раковая клетка будет уничтожена. Однако, если у клеток – полицейских" нарушены функции защиты, то вероятность развития злокачественного опухоли очень велика. Случается и так, что «клетки полиции» не могут различить кто прав, а кто не прав и тогда репрессиям подвергаются все нормальные клетки. Этот процесс называется – «аутоиммунная патология». К этим аутоиммунным болезням относятся такие заболевания как ревматоидный артрит — заболевания суставов, системную красную волчанку — тоже ревматологическое заболевания поражающее кожу, почки, суставы, сердце, а также некоторые нервные и гематологические заболевания. Иногда, сражаясь с несколькими видами инфекции или с одной в разных местах, наша иммунная система не успевает своевременно произвести «демобилизацию». Тогда очаг воспаления не рассасывается, и в нем продолжают накапливаться «солдаты» и «вооружение». Незначительная «провокация»— и оружие начинает стрелять. Так, в частности, развиваются приступы бронхиальной астмы.
2.2. Виды иммунитета
Существуют механизмы неимунной естественной неспецифической резистентности организма. К ним относят защиту организма от внешних повреждений наружными покровами (кожа, слизистые оболочки), приспособительными реакциями в виде слущивания эпителия, движение ресничек и секретов, чихания, кашля, лихорадки; химическими веществами (бактерицидное действие соляной кислоты желудочного сока, молочной, жирных кислот, ряда ферментов). От неспецифической резистентности следует отличать неспецифические факторы иммунитета. Они включают клеточные и гуморальные (жидкостные) факторы. Клеточные – это фагоциты. Гуморальные факторы неспецифического иммунитета разнообразны: система комплемента, неспецифические глобулины, С- реактивный белок, интерфероны, цитокины и др. Специфическими факторами иммунитета являются антитела и Т- лимфоциты.
По механизму развития различают следующие виды иммунитета:
Видовой иммунитет, генетический обусловленный особенностями обмена веществ данного вида. Он, в основном, связан с отсутствием необходимых условий для размножения возбудителя.
Например, собаки не болеют некоторыми болезнями человека (сифилис, гонорея, дизентерия), и, наоборот, люди не восприимчивы к возбудителю чумы собак. Строго говоря, данный вариант резистентности не является истинным иммунитетом, так как он не осуществляется системой иммунитета. Однако есть варианты видового иммунитета, обусловленные естественными предсуществующими антителами. Такие антитела исходно имеются в необходимом количестве против многих бактерий и вирусов.
Приобретенный иммунитет возникает в течение жизни. Он бывает естественным и искусственным, каждый из которых может быть активным и пассивным.
Естественный пассивный иммунитет возникает в результате передачи от матери к плоду через плаценту (трансплацентарный) или с молоком готовых защитных факторов.
Естественный активный иммунитет появляется в результате контакта с возбудителем после перенесенного заболевания.
Искусственный пассивный иммунитет создается после введения в организм готовых антител с сыворотками крови иммунизированных доноров.
Искусственный активный иммунитет создается после введения в организм вакцин, содержащих микроорганизмы или их части
2.3. Механизм действия иммунитета
Когда в организм человека вторгается инфекция, в дело вступают защитные системы организма. Нормальная, здоровая реакция иммунной системы – попытаться дать отпор «чужаку».
Когда микроб попадает в организм, первыми на его пути встречаются фаги (или фагоциты), постоянно курсирующие по кровеносным и лимфатическим сосудам. Фагоциты не относятся непосредственно к системе иммунитета. В отличие от собственно иммунных клеток они не разбираются, что за пришелец встретился им на дороге – важная персона или мелочь. Они знают только одно: свой или чужой. Их задача – поглотить как можно больше микробов. Если врагов слишком много, объявляется мобилизация резервов – количество фагоцитов крови быстро возрастает. Поэтому при встрече с инфекцией первое самое быстрое изменение в анализах крови – рост числа лейкоцитов (фагоцитов). Это происходит в первую же неделю после начала заболевания.
Далее микробы встречаются уже с самой иммунной системой. Клетки этой системы отличаются тем, что они умеют распознать врагов по типам и вырабатывать наиболее эффективные методы защиты против каждого.
Первыми из иммунных клеток с микробом встречаются макрофаги – «большие пожиратели». Эти клетки действительно больше по размеру, чем просто фаги. Прежде чем уничтожить микроба, они проводят расследование, расщепляя бактерию.
Затем макрофаги докладывают о появлении в организме неприятеля Т-лимфоцитам-хэлперам. Буква «Т» в названии этих клеток – от слова «тимус». Так по-латыни именуется вилочковая железа. Этот важный иммунный орган находится в грудной клетке. Итак, расщепление микроба в макрофаге – это анализ неприятеля. Получив необходимые данные, макрофаг движется с докладом к Т-хэлперу. Между этими клетками образуется протоплазматический мостик – он хорошо виден под микроскопом. По нему расщепленный материал убитого микроба поступает в Т-хэлпер.
Т-хэлпер – клетка более высокого интеллекта. Она способна не только различать отдельных микробов, но и определять, встречался ли с ними организм раньше.
В результате анализа ситуации Т-хэлпер отдает приказание подчиненным — В-лимфоцитам — готовить средства защиты против конкретного микроба, исходя из его привычек и слабых мест. Именно В-лимфоциты готовят оружие для атаки на врага — вырабатывают особые белки, иммуноглобулины.
Весь процесс, приводящий к иммунному ответу организма на вторжение врага, происходит в среднем за 10-14 дней. Через этот срок В-лимфоциты начинают выделять иммуноглобулины, которые попадают в кровь. Эти иммуноглобулины иначе называются антителами.
Антитела вырабатываются именно против того микроба, который попал в организм. Они по-разному воздействуют на врага и в зависимости от этого носят разные названия. Одни из них микробов склеивают (агглютинины), другие — осаждают (преципитины), третьи — растворяют (лизины). А такие антитела, как опсонины, играют роль приправы — они подсоединяются к микробу и делают его более съедобным для фагов, повышают их аппетит. В любом случае микробы погибают.
Между тем борьба с инфекцией продолжается, и вот враг уже отступает и человек выздоравливает.
Организм не может тратить силы зря. Иммунную реакцию надо приостановить. Это делают клетки Т-супрессоры (супрессия — подавление). Если бы Т-супрессоров не было, иммунная реакция нарастала бы как цепная реакция, она стала бы неуправляемой. Поэтому очень важно вовремя ее остановить. Таким образом, за пуск иммунной реакции отвечает. Т – хэлперы, а за остановку – Т – супрессоры.
Кроме двух видов лимфоцитов есть еще и клетки-киллеры, или NK (убийцы). Это специалисты очень высокой квалификации. Цель клетки-киллера — распознать предателей, переметнувшихся на сторону врага, в любом месте и уничтожить. Дело в том, что не все микробы можно уничтожить описанными выше способами — съесть или обстрелять антителами. Такие способы годятся для борьбы с бактериями, а с вирусами это не проходит. Вирус ведет себя хитрее — он прячется. Внедряется в клетку и заставляет эту клетку работать на себя. Пораженная клетка начинает штамповать новые вирусы. Клетка-убийца такие клетки распознает и уничтожает.
2.4. Факторы, наносящие вред иммунной системе
· Нездоровый образ жизни
· Загрязнение окружающей среды
· Появление новых вирусных бактерий
· Частые бактериальные и вирусные инфекции
· Неправильное питание
· Длительное лечение антибиотиками и др. препаратами
· Тяжелые физические и умственные нагрузки, стресс
2.5. Признаки ослабления иммунитета
· Частые простудные заболевания (более 4-6 раз в год)
· Частые рецидивы хронических заболеваний
· Герпес, папилломатоз и подобные заболевания
· Повышенная утомляемость
· Аллергические заболевания
2.6. Как повысить иммунитет
Вашему организму необходим активный поток витаминов и минералов. Для иммунной системы наиболее важны: минералы — селен, цинк, кальций, железо, йод, марганец; витамины — А, В5, С, D, F, PP. Также необходима отчистка организма от шлаков, ядов и токсинов и нормализация кишечной микрофлоры, которая участвует в усвоении жизненно важных веществ и синтезирует ряд витаминов. Микрофлору надо восстанавливать, так как ее количество снижается с возрастом и нарушается при отрицательном влиянии внешней среды, после лечения антибиотиками, отравлений, инфекций. Нельзя также забывать о здоровом образе жизни, сюда относится закаливание и правильное питание.
Глава 3. Вывод
В ходе работы мы достигли поставленной цели, выполнив соответствующие задачи:
· изучили и проанализировали материал по теме;
· рассмотрели механизм действия иммунитета;
· выяснили причины ослабления иммунитета;
· нашли пути повышения иммунитета;
· проанализировали и систематизировали полученные сведения.
Глава 4. Список литературы
1. www.urocus.ru
2. www. leg .ru
3. Володин В.А. Энциклопедия для детей. Человек. – М., 2001
www.ronl.ru
Реферат - Иммунитет - Заболевания
Внешние и внутренние факторы меняют клеточные циклы здорового человека. В результате образуются аномальные (чужеродные, или синтезированные не так, как свои собственные) молекулы и клетки. Специальные клетки крови и других тканей продуцируют и поддерживают достаточную концентрацию фиксированных на клетках и свободных молекул, которые распознают, связывают (преобразуют) и выводят из организма аномальные молекулы и клетки. Перераспределение частиц и клеток, "иммунного надзора" во все ткани организма происходит через крово- и лимфоток, а также транспорт через гистогематические барьеры. Иммунитет (от лат. immunis) дословно означает свободный от чего- либо. Организм здорового человека непрерывно освобождается от веществ и структур, в том числе болезнетворных, как попадающих в него извне, так и образующихся внутри организма. Источниками внешних (экзогенных) веществ и структур являются компоненты пищи, химические примеси воздуха и капельки жидкости, микроорганизмы, попадающие на кожу, в легкие, желудочно-кишечный тракт. Эндогенными (возникающими в самом организме) веществами, нарушающими постоянство внутренней среды и выводимыми с помощью иммунных механизмов, являются аномальные (мутантные) клетки и их компоненты, появившиеся при делении клеток, внутриклеточном синтезе веществ, метаболиты (шлаки) и др. Тело человека состоит примерно из 1012-1013генотипически похожих клеток. Если принять, что при делении клеток каждая миллионная клетка подвергается мутации, то в любой момент в организме человека есть примерно 10 млн. аномальных клеток. Благодаря иммунитету организм опознает, связывает, разрушает и выводит вещества и структуры. Вещества, отличающиеся по происхождению от собственных структур, называют чужеродными. Иммунитет - способность специальных клеток жидкостей организма опознавать, связывать и удалять (выводить) вещества и структуры, происходящие из клеток других организмов или потерявших сходство с клетками собственного тела. Иммунитет поддерживает жизнедеятельность организма путем выведения изношенных клеток, белков (гемоглобин, др.), шлаков, возобновления специфических для организма белков, клеток, в том числе клеток крови определенной группы, сохранения чужеродного плода во время беременности, и др. Поэтому понятие иммунитет шире способности защищаться от инфекции. Хотя значение инфекции очевидно: около 50% здоровых людей является носителями болезнетворных микроорганизмов (Лебедев К.К., др., 1989). Таким образом, иммунитет поддерживает определенные (молекулярные) показатели гомеостаза и, значит, здоровья человека: динамическое равновесие количества удаляемых и восстанавливаемых клеток, тканей и жидкостей тела. Эти показатели гомеостаза включают не только постоянство жидких сред организма, но и нормальную жизнедеятельность клеток- интенсивность митоза и мейоза, дифференцировку клеток, скорость образования клеточных клонов, продолжительность жизни клеток и др. Показатели гомеостаза, в том числе количество клеток каждого типа, как и размеры органов зависят от характера жизнедеятельности. Так, при тренировке возрастает не только мышечная масса, обмен структур костей, связок, сухожилий, нейронных, синаптических, глиальных и др. структур мозга, кровоток активных органов и тканей, но и размеры кишечника, пищеварительных желез и др. Восстановление и умножение структур невозможны без участия иммунных механизмов, создающих "нормальный", идентичный собственному, клеточный состав увеличенной мышцы или другой структуры. Здоровье означает поддержание как психического, так и телесного- не только жидкостного, но и структурного - гомеостаза. Одним из механизмов гомеостаза является поддержание иммунитета - определенного уровня активности клеток (лимфоцитов, лейкоцитов, эпителиоцитов, др.), синтезирующих и выделяющих естественные антитела (глобулины и др.) в кровь и другие жидкости тела. Сохранение постоянства клеток и их производных есть результат деятельности иммунной системы. Воздействие формирует систему ответа на него. Непрерывность антигенных воздействий на организм поддерживает иммунитет здорового человека. Помещенный в стерильные условия (стерильная пища, вода, окружающая среда) организм (гнотобионт, греч. gnotos- известный, biontos - живой организм) теряет иммунитет. Раздражителями для органов иммунной системы являются антигены - сложные химические вещества, микроорганизмы, появляющиеся в результате деления аномальные клетки или их компоненты. Эти антигенные воздействия вызывают ответы "органов" иммунной системы - костного мозга, тимуса, селезенки, пейеровых бляшек стенки кишечника, лимфоузлов, лимфатических сосудов и др. Степень активности органов иммунной системы, вызванная воздействием внутренних и внешних антигенов, описывается как состояние - иммунный статус человека, или иммунитет. Условно выделяют клеточные и гуморальные показатели степени активности иммунных органов. Человек остается здоровым до тех пор, пока не нарушается динамическое равновесие между антигенным воздействием и активностью иммунной системы. Поэтому иммунная система - понятие не столько морфологическое, сколько функциональное.. Врожденный иммунитет - образованная во внутриутробной жизни способность клеток синтезировать мембранные рецепторы к антигенам других организмов, других тканей и некоторым микроорганизмам, а также синтезировать соответствующие антитела и выводить их в жидкости тела. Вовремя внутриутробного онтогенеза происходит коммитирование всех клеток, в том числе клеток крови, к антигенам другого организма ч к антигенам других тканей. Поэтому главной частью врожденного иммунитета является приобретение мембранами клеток молекул-рецепторов, способных связываться с определенными молекулами, фиксированными или продуцируемыми клетками других организмов (материнского), а также собственными клетками других органов и тканей. Эту часть врожденного иммунитета (иммунного статуса) называют главным комплексом гисто- совместимости. В течение антенатального онтогенеза формируется также иммунитет к некоторым микроорганизмам. Приобретенный иммунитет - образованная во внеутробной жизни способность клеток синтезировать мембранные рецепторы к экзогенным антигенам. В общем приобретенный иммунитет менее устойчив, чем врожденный. Антигены - это макромолекулярные соединения с жесткой структурой, вызывающие иммунный ответ организма Макромолекулы, отличающиеся по происхождению и строению от основной массы меток организма и вызывающие иммунный ответ, называют антигенами (АГ). АГ поступают извне (пищевые, микробные, бытовые) или образуются внутри (эндогенные) организма. Антигенность вещества относительна: она зависит от способности клеток и находящихся в жидкостях тела веществ распознавать АГ. Антигенность молекул может усиливаться или ослабевать в случае соединения их с другими. Антигенны клетки мода по отношению к матери, сперма относительно слизистой влагалища, кровь одного человека относительно другого. Иммунная система реагирует на химические вещества различно: легче связывает такие, к которым имеет специальные молекулы- рецепторы. Такие вещества называют антигенами. Другие вещества реагируют с иммунными соединениями и могут разрушать их. Значит, антигены (греч, ага -против, gennao- создавать) - это воспринимаемые иммунной системой химические раздражители (адекватные), вызывающие иммунные реакции. По химическому строению антигены разнообразны. Большинство из них представляет собой макромолекулярные (масса молекулы 10 тыс. и более) соединения достаточной жесткости. Антигенами могут бить белки, пептиды, полисахариды, нуклеиновые кислоты, комплексные соединения и др. Обычно увеличение молекулярного веса антигена сопровождается повышением его иммунореактивности. Однако белки одинаковой молекулярной массы (гемоглобин и альбумин) могут иметь разную иммунореактивность. Агрегированные антигены (объединенные с другими на поверхности клеток.крови, бактерий, др.) более иммунореактивны, чем отдельные антигены.Антигенность, т.е. способность вызывать иммунный ответ, приобретается в ходе внутриутробного или внеутробного развития человека. Главным свойством антигена является его чужеродность, т.е. особенности молекулы, образованные иным, непохожим на собственный, набором синтезирующих ферментов. Антигенная чужеродность проявляется в перестройке внутриклеточного синтеза. Для предотвращения этого антиген разрушается с помощью иммунной системы. "Происхождение" антигена определяет расположение радикалов в его молекуле. Наиболее важная часть расположения радикалов молекулы антигена, которая характеризует его происхождение, называется детерминантой (эпитопом) антигена. В отличие от химической реакции, взаимодействие антигена с антителом происходит не со всеми однотипными молекулами, а только с той их частью, которая имеет соответствующие детерминанте активные центры - антидетерминанты антитела. Поэтому Антигенность имеет свойство иммунной избирательности. Фиксированный на плазматической мембране клеток набор антигенов образует главный комплекс гистосовместимости (ГКО). Поскольку ГКС человека обнаружен на лейкоцитах, они были названы НLА(human leukocyte antigen). Структура антигенов ГКС похожа на молекулу иммуноглобулина G. Антигены ГКС человека представлены гликопротеидами 5 классов (групп): НLА-А, НLА-В, НLА-С, НLА- 0, НLА-ОК.. Каждый класс антигенов ГКС состоит из десятков разных антигенов. Специфичность ГКС определяется наличием соответствующих антигенов. Аномальные клетки имеют на своих мембранах образованные с участием вируса антигены Т (англ.tumor - опухоль). Узнавание Т- антигенов таких клеток рецепторами (антителами) цитотоксических Т-лимфоцитов (Тц- тимус-зависимые цитотоксические лимфоциты) и связывание тех и других клеток приводит к разрушению и выведению из организма аномальных клеток. Антигенность одних тканей организма относительно других неодинакова Метаболиты крови и некоторых жидкостей внутренней среды человека (индивидуальноспецифические антигены) не антигенны для других тканей того же организма. Достаточно крупные метаболиты органов и тканей, отделенные от внутренней среды гистогематическими барьерами - гематоэнцефалическим, гематоофтальмическим, гематотестикулярным, др.- являются антигенами для других тканей организма (органо - или гистоспецифические антигены). В случае повышения проницаемости гистогематического барьера, например при стрессе, усиленной физической нагрузке и др., в кровь поступают гистоспецифические антигены мозга, семенников, хрусталика, желез внутренней секреции, вызывая иммунный ответ.
Антигены групп крови представляют собой олигосахариды, связанные с белками поверхности мембран клеток крови. В настоящее время известно более 160 различных антигенов, образующих свыше 20 групп крови. Наиболее распространена АВНО (О) система групповой принадлежности крови. Антигены данной системы объединены в 3 вида: 1) гликофосфолипиды и гликопротеины. на поверхности эритроцитов и других клеток, 2) олигосахариды молока и мочи и 3) олигосахариды, связанные с муцинами, секретируемыми желудочно-кишечным, мочевыделительным и дыхательным трактами. Антигенными свойствами обладают клетки и жидкости плода по отношению к матери. Иммунный ответ здоровой беременной женщины не развивается вследствие специфического его подавления (развития иммунологической толерантности). Антигенность - чрезвычайно относительный признак: специфическая иммунологическая реакция на антиген определяется не столько свойствами антигена, сколько наличием антител к нему. Антигенность изменяется под влиянием химических веществ. Так, адъювантами (лат.adjuvare - помогать) названы вещества, усиливающие иммуногенность различных антигенов (неспецифический эффект). Депонируя антигены, адъюванты усиливают взаимодействие антигенов с антителами. Адъювантами являются минеральные масла, гидроокиси и фосфаты аллюминия, Д-воска и др. В присутствии адъювантов антигенные свойства приобретают низкомолекулярные соединения. Например, глюкагон - полипептид с ММ 3.500 - в присутствии адъюванта становится антигеном. Пиранозные и фукозные кольца, увеличивая жесткость синтетических полипептидов и полисахаридов, придают им свойства антигенности. Кроме того, антигенность химических соединений зависит от чувствительности (реактивности) иммунной системы. Резкое повышение чувствительности иммунной системы проявляется, в частности, в виде аллергической реакции. Антигены, чувствительность к которым значительно усилена и которые вызывают аллергическую реакцию, названы аллергенами (греч. allos - иной. ergen - действие). Пищевые аллергены вызывают усиленный иммунный ответ не столько благодаря своей природе (наиболее часто аллергическую реакцию вызывают лактоглобулин коровьего молока, казеин, овальбумин яиц, белки крабов, раков и др.), сколько снижением иммунных свойств кишечной стенки, в частности способности секретировать IgА, недостаток которых способствует ускоренному всасыванию нерасщепленных белков и пептидов. По источнику антигены делят на эндогенные и экзогенные. Эндогенными антигенами являются аномальные клетки и их компоненты, а также эмбрион для матери. Экзогенными антигенами 161 являются попадающие на поверхность и слизистые оболочки, а также в желудочно-кишечный тракт белковые и полисахаридные вещества пищи, пыли, жидкости, воздуха, а также микроорганизмов. Стафиллококки, грибки, микобактерии обнаруживаются в глубоких слоях кожи, протоках сальных и потовых желез здорового человека. Носовые ходы и носоглотка задерживают в 1 час до 14.000 микроорганизмов (стафиллококки, стрептококки, дифтерийные палочки, микобактерии и др.). Борту, кишечнике, особенно в толстом присутствует разнообразная микрофлора. Пищевые и другие экзогенные антигены изменяют иммунный статус человека. Так, круглые черви - аскариды, трихинеллы, др., попадающие в пищеварительный канал, подавляют иммунитет. Амебы, токсоплазма, giardia, др., попадая в пищеварительный канал, могут как подавлять, так и усиливать иммунный ответ. Имеют свою флору и наружные половые органы. Несовместимость антигенных свойств, обусловленных различием микрофлоры половых органов супругов, может быть причиной бесплодного брака (10-25% бесплодия). Сперма, содержащая антигены, агглютинирует в результате встречи с антителами слизи влагалища. Повторные половые сношения приводят либо к усилению, либо к снижению образования антиспермальных антител. Снижение антиспермальных антител выявлено у женщин при пользовании презервативами. Бытовые аллергены входят в состав пыли (нитраты, смолы, лаки, биологические частицы, др.), косметических средств, покрытий мебели, стен, красок для одежды, обуви и т.д. Мужской Н-У-антиген клеточной поверхности обеспечивает дифференцировку первичной гонады в семенник. Органы иммунной системы - анатомические образования, участвующие в формировании иммунной готовности организма нейтрализовать чужеродные структуры и вещества. Костный мозг, тимус, селезенка, лимфоузлы, пейеровы бляшки кишечника, миндалины и червеобразный отросток являются образованиями, в которых непрерывно образуются и созревают клетки, способные осуществлять "иммунный надзор" в человеческом теле. Эти иммунные органы и ткани непрерывно обмениваются между собой метками и молекулами, создавая достаточный уровень антител в каждой ткани. Активность органов иммунной системы регулируется автономной нервной системой и гуморальными веществами. Постоянное воздействие антигенов поддерживает активность органов иммунной системы - костного мозга, тимуса, пейеровых бляшек кишечника, миндалин, селезенки, лимфоузлов. Эти анатомические образования условно делятся на центральные (первичные) и иммунной системы, из которых клетки крови расселяются в остальные ее органы. Эти клетки синтезируют антитела к соответствующим антигенам и населяют ими жидкости тела - кровь, слизь, пот, секреты. Костный мозг - центральный (первичный) орган кроветворной ткани, называемой миелоидной (греч. mielos - мозг, оidеоs - похожий). Это сеть контактирующих между собой (с помощью десмосом) ретикулярных клеток и волокон (стремы) вокруг артериол, синусоидов (тонкостенных капилляров большого диаметра, лат. sinus -полый, оidеоs - подобный) и венул, пространства которой заполнены предшественниками клеток крови, макрофагами и жировыми клетками, не связанными между собой контактами. Отсутствие контактов между основной массой клеток - предшественниц форменных элементов крови обеспечивает относительную самостоятельность их функционирования, подвижность и сменяемость всей ткани. Миелоидная ткань располагается внутри жесткого костного каркаса. Костный мозг - производное клеток крови. У эмбриона человека колониеобразующие единицы (КОЕ) появляются в печени. Это мелкие, подвижные, самообновляющиеся благодаря митозу клетки, группирующиеся в колонии (скопления). При делении КОЕ образуются клетки-предшественники эритроцитов, а также лейкоцитов и тромбоцитов. Как только у плода развивается костная ткань, в ее полости попадают КОЕ и начинается образование клеток крови. После рождения в костной ткани накапливаются соли кальция, они уплотняются. Давление крови выталкивает через синусоиды в костные полости мелкие КОЕ, а затем и более крупные клетки крови. Увеличение количества костей сопровождается расселением КОЕ в них. Миелоидная ткань костей черепа, грудины, позвоночника, ребер, конечностей приобретает способность к кроветворению по мере уплотнения и развития в ней кровеносных сосудов. У пожилых и старых людей происходят обратные процессы. Подобно другим клеткам организма, клетки крови - эритроциты, лейкоциты и тромбоциты - становятся зрелыми после приобретения иммунологической компетентности, т.е. рецепторов на своих мембранах, характеризующих сходство (происхождение) клетки с другими аналогичными клетками. Иммунологическую компетентность клетки крови приобретают либо в костном мозге (эритроциты), либо в других иммунных органах (в лимфатической ткани миндалин глотки и пейеровых бляшек кишечника "созревают" В-лимфоциты с большим, в 100-200 раз превосходящим таковое у Т -лимфоцитов, количеством микроворсин на поверхности, в тимусе - Т-лимфоциты). Кровоток в костном мозге составляет 15-20 мл/мин./100 г ткани. Он осуществляется по кровеносным сосудам, включающие синусоиды, через которые в костный мозг попадают не только белки, гормоны и др. вещества, но и клетки крови (микроциркуляция в костном мозге).
Кровоток в костном мозге уменьшается почти в 2 раза при стрессе и возрастает до 8-ми кратных объемов при успокоении. Вилочковая железа (thymus, зобная железа) - центральный орган другой разновидности кроветворной ткани - лимфоидной. Железа располагается за грудиной в верхнем средостении и покрыта соединительнотканной капсулой. Иннервируется блуждающими и симпатическими нервами. Эфферентные окончания нервных волокон располагаются вокруг кровеносных сосудов, афферентные окончания- в паренхиме железы. Масса вилочковой железы у взрослого человека 7-32 г. Большая абсолютная ( 10-15 г) и относительная (1/ЗОО часть массы тела) величина тимуса у детей и ее инволюция (лат. involutio - загибание, обратное развитие) после наступления половой зрелости соответствует периодам активного участия тимуса в формировании иммунитета. Лимфоидная ткань тимуса представлена эпителиальными, фиксированными на мембранах кровеносных соcудов, контактирующими между собой клетками и большим количеством лимфоцитов различной формы. Последние очень подвижны: около 15% лимфоцитов ежесуточно выходит в селезенку и лимфоузлы. Тимус выполняет роль эндокринной железы (его эпителиальные клетки выделяют в кровь тимозин) и иммунопродуцирующего органа, осуществляющего образование Т-лимфоцитов (тимус-зависимых). Созревание Т-лимфоцитов в тимусе осуществляется за счет деления лимфоцитов, имеющих рецепторы к тем чужеродным антигенам с которыми организм встречался в детстве. Образование Т-лимфоцитов происходит независимо от содержания антигенов и количества Т- лимфоцитов в крови (вследствие непроницаемости гистогематического барьера тимуса) и определяется генетическими механизмами и возрастом. Стрессорные воздействия (психоэмоциональное напряжение, тепло, холод, голодание, кровопотеря, сильная физическая нагрузка) подавляют образование Т-лимфоцитов. Возможными путями реализации стрессорных воздействий на тимус могут быть сосудистый (уменьшение кровотока в железе) и гуморальный (подавляющее митоз клеток влияние кортикоидов и др.). Длительный стресс сопровождается развитием симптомов, сходных с синдромом истощения (wasting - синдром, от англ. waste - расходовать, тратить) в виде нарушений деятельности кишечника, увеличением ломкости ногтей, усилением выпадения волос, нарушением тургора и влажности кожи, снижением иммунитета и др. Селезенка (lien) - паренхиматозный вторичный лимфоидный орган массой 140-200 г, расположенный в левом подреберье и покрытый соединительнотканной оболочкой и брюшиной. Иннервируется селезенка блуждающим и чревным (смешанным симпатическим) нервами. Вторичным лимфоидным органом селезенка названа потому, что основная часть делящихся в ее строме клеток поступает из костного мозга. Лимфоидная ткань селезенки представляет собой образованную ретикулярными клетками сеть вокруг кровеносных капилляров (синусоидов). Основной объем органа в ячейках сети заполнен форменными элементами крови - эритроцитами (красная пульпа, от лат. рu1ра - мякоть) или лейкоцитами (белая пульпа). Эта масса не контактирующих между собой контактов клеток изменяется по количеству и составу, т. е. обменивается, сравнительно быстро. Микроциркуляция в селезенке осуществляется через синусоиды, пропускающие как компоненты плазмы крови, так и форменные элементы. Уменьшение объема селезенки (на 20-40 мл) вследствие выталкивания части подвижных клеток крови в кровяное русло происходит за счет сокращения гладкомышечных тяжей капсулы органа и пучков гладкомышечных клеток, проникающих вглубь органа. Это возникает под влиянием адреналина и норадреналина, выделяемых симпатическими постганглионарными волокнами (до 90% таких волокон входит в состав блуждающего нерва) или мозговой частью надпочечников. Регуляция тонуса артериол и венул селезенки обеспечивает изменение состава клеток крови в органе. Лимфоузлы (nodi lymphatici) - мелкие (диаметром 0,5-1 см), сильно меняющиеся по величине периферические органы иммунной системы. У взрослого человека имеется около 460 лимфоузлов, общая масса которых составляет примерно 1% веса тела. Лимфоузлы важнейших областей тела имеют иннервацию: эфферентные и афферентные волокна АНС (медиаторы АХ, НА, А, др.). Лимфоузел построен так, чтобы создать большую поверхность обмена лимфы и протекающей через капилляры лимфоузла крови. Лимфоидная ткань лимфоузла покрыта соединительнотканной оболочкой. Под оболочку лимфоузла из нескольких лимфатических сосудов притекает лимфа, просачивающаяся через щели лимфоидной ткани лимфоузла и вытекающая из одного лимфососуда. Кровь поступает в лимфоузел через артериолу и выходит через венулу. Из крови в лимфоузел заселяются КОЕ. Лимфоузел является местом иммунизации лимфоцитов и образования антител, фильтром мелких частиц и чужеродных клеток. Физиологическая активность лимфоузла - лимфе- и кроваток, пополнение Т- и В-лимфоцитов, интенсивность деления клеток, образование антител (до 75% всех иммуноглобулинов) на мембранах плазматических (ретикулярных) клеток лимфоузла, проницаемость мембран и обмен между лимфой и кровью, связывание мелких частиц лимфы и т.д. - зависят от активности АНС, гормонов в крови и иммунномедиаторов. Лимфоузлы каждой области человеческого тела имеют собственный набор антител, поскольку поступающие с лимфой антитела каждой области специфичны. Пейеровы бляшки - лимфоидная ткань стенки тонкого кишечника - является аналогом сумки Фабрициуса птиц, где образуются В- лимфоциты. Миндалины (tonsilae) скопления лимфоидной ткани в слизистой оболочке рта, носа и глотки (кольцо Пирогова - Waldeyer). Миндалины построены так, что их складчатая поверхность слизистого эпителия задерживает попадающие в начальные отделы дыхательных и пищеварительных путей мелкие частицы и микроорганизмы, связывает их и лизирует с помощью внутриклеточных ферментов. Лимфоидная ткань миндалин аналогична таковой лимфоузла. Лимфатических сосудов в миндалинах нет. Червеобразный отросток (арреndiх) также относят к периферическим иммунным органам ("кишечная миндалина"). Наиболее сильного развития лимфоидная ткань стенки отростка достигает в 10-14 лет, а затем подвергается инволюции. Объем лимфоидной ткани отростка сильно меняется под влиянием изменений деятельности начального отдела толстого кишечника (образование твердого кала, изменение перистальтики, др.). Изменения лимфоидной ткани червеобразного отростка чаще наблюдаются у лиц мужского пола. Клеточные и гуморальные показатели иммунитета - характеристики клеток и веществ внутренней среды, отражающие иммунную активность. Показателями готовности клеток, и тканей организма обнаруживать и связывать чужеродные молекулы являются количество антител и других молекул, участвующих в иммунных реакциях (комплементы, лизоцимы, пропердины, лейкины, лимфокины, интерфероны, др.), а также степень активности меток тканей и жидкостей организма. Иммунитет оценивается по иммунологической активности клеток различных тканей и органов, а также концентрации нефиксированных антител и способности их участвовать в иммунных реакциях, находящихся в жидкостях тела - крови, лимфе и межклеточной жидкости. Клеточными компонентами иммунитета являются прежде всего лимфоциты, циркулирующие с током крови по всем органам и выполняющие главную роль "иммунного надзора" (патрулирования). Лимфоциты, т.е. такие лейкоциты, у которых в цитоплазме нет гранул пероксидаз (ферментов, катализирующих окислительно- восстановительные реакции с участием перекисей), обладают способностью отличать в организме "чужие", т.е. необычного происхождения, крупные молекулы благодаря имеющимся на их мембранах рецепторам-антителам. Лимфоциты синтезируют антитела, лизируют чужеродные клетки, в том числе обеспечивают отторжение трансплантанта, иммунную память (способность отвечать усиленной реакцией на повторную встречу с антигеном) и др. По месту созревания, составу органелл, размерам, рецепторам и функциям различают 3 основные группы лимфоцитов: 0-, В- и Т- лимфоциты. 0-лимфоциты - это некоммитированные клетки, образовавшиеся в костном мозге из стволовых клеток. Попадающие с током крови в тимус предшественники лимфоцитов за счет изменения антигенных свойств мембран становятся линейно-ограниченнными, т.е. способными при делении образовывать только Т-лимфоциты. Вероятно, что В-лимфоциты приобретают иные свойства в том числе антигенные при попадании в пейеровы бляшки кишечника. Т- лимфоциты выполняют разные функции. Образуют плазматические клетки, блокируют чрезмерные реакции, поддерживая постоянство разных форм лейкоцитов, выделяя лимфокины, активируя лизосомальные ферменты и ферменты макрофагов, разрушают антигены. В-лимфоциты обеспечивают гуморальный иммунитет путем выработки антител. При встрече с антигеном они мигрируют в костный мозг, селезенку, лимфатические узлы, где делятся и трансформируются в плазматические клетки. Последние и являются продуцентами антител - иммуноглобулинов. Другой группой лимфоидных клеток иммунной системы являются макрофаги. Они различны по строению, находятся в жидкостях и тканях, фагоцитируют антитела, активируют лимфоциты и участвуют в образовании антител. Гуморальные компоненты иммунной системы - глобулины плазмы и других жидкостей тела, синтезированные макрофагами лимфоузлов, селезенки, печени, костного мозга и др., дезактивирующие чужеродные антигены. Они содержатся в крови, в меньшем количестве - в органах и тканях, отделенных от крови гистогематическими барьерами - коже, слизистых оболочках, мозге, почках, легких, др. Иммуноглобулины осуществляют местные реакции и являются первым эшелоном защиты организма от антигенов. Специфичность иммунных реакций человека сформировалась в предшествующих поколениях благодаря встречам с определенными антигенами. Электрофоретически выделенные гамма - глобулины сыворотки крови делят на несколько видов При иммунизации первоначально возрастает содержание Ig, затем IgG, а потом и др. Нормальные, или естественные, антитела человека - это антитела жидкостей и тканей здорового человека. Иммунный ответ - последовательно развертывающаяся многоуровневая реакция антител и иммунных органов на антиген, сопровождающаяся гемодинамическими сдвигами. Опознание и связывание чужеродных молекул и клеток происходит при контакте их с другой группой молекул. Это взаимодействие в отличие от химической реакции называют иммунным ответом. Иммунная реакция развертывается как микропроцесс образование комплекса молекул (в простейшем случае АГ-АТ), изменение свойств клеточных мембран, приближение особых клеток (макро-и микрофагов)к зоне взаимодействия и т.д. После взаимодействия АГ и АТ может быть 2 варианта: прекращение иммунного ответа в случае полного связывания АГ или усиление ответа в случае сохранения АГ. В последнем варианте усиление иммунной реакции выражается в увеличении кровотока и лимфотока в месте нахождения АГ, усилении продукции АТ и т-д. Это происходит за счет появления химических веществ, опосредующих это усиление иммунной реакции (медиаторов) - факторов хемотаксиса, фагоцитоза, антителогенеза и др. При попадании АГ в жидкости тела в иммунный ответ быстро вовлекаются гуморальные и нервные аппараты регуляции. Иммунный ответ - понятие неустоявшееся, имеющее разное содержание в зависимости от области его применения. Чаще всего в медицине употреблялись патологические (лат.раthos - страдание, болезнь) проявления иммунного ответа-гиперреактивность,в том числе аллергическая и анафилактическая реакции, или гипореактивность. Физиологическое содержание иммунного ответа подчеркивает его общебиологический аспект. Здоровый человек не заболевает потому, что его иммунитет поддерживается на определенной степени готовности реагировать на поступление избыточной, сравнительно с обычной, массой антигена. Связывание и удаление АГ постоянно восполняется продукцией новых копий АТ взамен выведенных, доставкой их в зоны активности, перераспределением между тканями и органами и т.д. Периферические органы иммунной системы - селезенка и лимфоузлы - являются источниками некоторого количества готовых АТ, а также местами перераспределения АТ вследствие изменения кровотока и лимфотока в отдельных тканях данного региона. Удаление или переход в неактивное состояние иммунокомпетентных клеток (Т-, В-лимфоцитов, макрофагов, плазматических клеток) является сигналом стимуляции центральных органов иммунитета - костного мозга и тимуса. Эти постоянно протекающие ответы иммунной системы на "привычные" АГ или их количество составляют иммунный фон активности, колеблющийся в зависимости от состояния и биоритмов человека. Встреча с "новым" АГ, поступление повышенного количества "привычных" АГ, изменение состояния организма, в частности, ослабление при утомлении, стрессе, гиповитаминозе, т.д., изменяет иммунный ответ. Иммунный ответ осуществляется по статистическим закономерностям, требует для реализации АГ-АТ реакции определенного соотношения концентраций АГ и АТ (Г.И.Марчук). В целом иммунный ответ - это поэтапная каскадная реакция готовых АТ и последующее вовлечение периферических и центральных иммунных органов в активность. Иммунный ответ включает также гемодинамические изменения кровотока в области попадания "чужих" АГ. В упрощенном виде иммунный ответ можно представить в виде определенной последовательности развертывающихся процессов. Узнавание антигена антителом происходит при контакте рецепторов двух структур. Если АГ и АТ совместимы, то они объединяются. Контакт АГ с АТ чаще происходит в жидкостях, поскольку при этом те и другие молекулы получают более высокую вероятность встречи. В особенности в жидкостях перемещающихся ("патрулирование" лейкоцитов, лимфоцитов, макрофагов крови, лимфы). Основным условием узнавания является сходство (совместимость) рецепторных поверхностей АГ и АТ. На поверхности АТ имеется от двух (IgО, IgА, IgЕ) до десяти (Igм) активных центров узнавания АГ. Узнавание возможно как при совпадении одной рецепторной поверхности АТ (одиночное узнавание), так и совпадении двух поверхностей (двойное узнавание). Для узнавания ("обшаривания" окружающего пространства вместо "оглядывания") нужно много времени и большое количество молекул АТ и АГ. Кроме того, есть возможность группового узнавания и изменения узнавания под влиянием различных веществ. Поэтому скорее всего в естественных условиях существуют и другие механизмы этих процессов. Узнавание инородных частиц фагоцитом облегчается в присутствии компонентов сыворотки крови (опсонины, альбумины, С-реактивный белок). Первым этапом иммунного ответа является реакция связывания АГ антителом. Организм имеет готовый набор (до 10000 антител у эмбриона по Ф.Барнету) сформированных в предшествующих поколениях нормальных антител - естественный гуморальный иммунитет. "Привычные " АГ, попадая в те или иные жидкости организма, непрерывно связываются естественными АТ. Связывание осуществляется за счет гидрофобного соединения активных центров АТ и АГ, соответствующих друг другу: специфичность АГ-АТ реакции). После этого структура комплекса АГ-АТ изменяется (конформируется, от лат. соnformis - подобный). Комплекс приобретает способность связывать другие белки, например, комплемент. Форма образующегося комплекса зависит от числа активных центров АТ: от 1 у гаптена, т.е.. неполного антитела, до 10 у Igм. Поскольку АГ и АТ часто фиксированы на мембранах клеток (микробных, тканевых), то образовавшийся АГ-АТ комплекс "утяжеляет" клетки, меняет их свойства. В результате клетки склеиваются (агглютинируют, от лат. agglutiare - приклеивать), оседают (седиментируют, отлат. sedimentare - оседать, преципитируют, от лат. ргесipitare -сбрасывать). Если же комплекс АГ-АТ образуется из свободных, не фиксированных на мембранах белков, то формируются хлопья (происходит флокулляция, от лат. floculli - клочки, хлопья). Итак, в результате связывания АГ антителом комплекс АГ-АТ теряет подвижность и либо лишается активности (цитотоксический эффект), либо растворяется (лизируется, от лат. lisis - растворение) с участием других белков (система комплемента, например). "Привычные" (для них есть нормальные АТ), а также "новые" АГ подвергаются фагоцитозу (греч. phagos - пожирающий) макрофагами. Первоначально макрофаги образуют псевдоподию - выпячивание протоплазмы в направлении АГ- за счет, активации Са-зависимого фермента гельсолина, подавляющего образование геля из сократительных белков (актин, миозин) цитоплазмы. При сокращении цитоплазматических белков макрофаг постепенно приближается и контактирует с АГ. Имеющиеся на поверхности макрофага специфические (для "привычных" ) и неспецифические (гликопротеидные, полисахароидные для "новых" АГ) рецепторы соединяются с активными центрами АГ, который постепенно погружается в цитоплазму макрофага. Эти процессы осуществляются с затратой энергии, метаболизм макрофага резко повышается (наблюдается "метаболический или дыхательный взрыв"). Основным источником энергии служит АТФ. Расщепленная АТФ тут же восстанавливается за счет креатинфосфата. Лизис АГ в макрофаге осуществляется при участии ферментов лизосом-глюкоронидаз,фосфатаз, миелопероксидаз, лактоферрина, др. При этом образуется набор окислителей, галоидов и др. веществ, подавляющих активность АГ. Фагоцитоз приводит к усилению и видоизменению иммуного ответа. Выделение фагоцитирующими клетками различных веществ, осуществляющих передачу иммунологической сигнализации (медиаторов иммунного ответа). С помощью медиаторов клеточного иммунитета местная реакция генерализуется. За счет хемоатрактантов (лат. attractare - притягивать) к месту попадания АГ начинают приближаться другие макрофаги, в том числе естественные клетки-киллеры аномальных клеток. Усиление кровотока в месте попадания АГ, происходящее а счет выделения гистамина и др. сосудорасширяющих веществ, ведет к поступлению дополнительных количеств АТ и макрофагов. Другие факторы (антителогенеза, стимуляции роста колоний, интерлейкин-3, др.) увеличивают синтез клеток-продуцентов антител. Особую роль выполняют медиаторы иммунного ответа, стимулирующие образование АТ к "непривычным" АГ. В этом случае иммунный ответ обеспечивает синтез таких АТ, которые соответствуют АГ, а также запоминают иммунный сигнал, поддерживая в течение некоторого времени установившийся тип синтеза АТ. Иммунологическая память выражается в конечном итоге в увеличении содержания Т- и В-лимфоцитов, несущих рецепторы к АГ и переходящих в покоящееся состояние после 2-3 делений, вызванных АГ. В постнатальный период организм не встречается в первый раз с большинством антигенов, за исключением болезнетворных микроорганизмов. Поэтому первичный иммунный ответ - наработка антител и последующее связывание антигена с антителом - как реакция на первую встречу с новым антигеном - в постнатальном онтогенезе очень мала. Во внеутробной жизни человека непрерывно происходят реакции готовых антител с АГ - вторичный иммунный ответ. Ряд медиаторов клеточного иммунитета угнетают разные стороны иммунного ответа. Избирательное по отношению к определенному АГ, более или менее активное подавление генерализованной иммуной реакции было названо иммунной толерантностью (лат.tolerancia - терпение). Важная роль в такой форме иммунного ответа на АГ принадлежит особому виду Т-лимфоцитов -Тs. Такие тимус-зависимые клетки подавляют стимулирующее влияние В-лимфоцитов на плазматические клетки, из которых должны были образоваться соответствующие АТ. Характер иммунного ответа (вид кривой изменения содержания каждого типа АТ в крови, ткани, их активность, плазматических клеток, Т- и В- лимфоцитов.др.) зависит от многих факторов: исходной активности иммунной системы, вида АГ, способа поступления в организм, количества и динамики поступления и т.д., состояния организма (возраста, образа жизни, питания, т.д.) и др. Лучше изучены иммунные ответы на моделях, где контролируются условия введения АГ, его характеристики и т.д., а также состояние объекта воздействия. Так, установлен ряд закономерностей динамики накопления антител после первого и второго введния АГ. Первый пик концентрации АТ появляется через несколько дней (латентный период иммунного ответа) и обусловлен усиленным синтезом главным образом IgМ, После второго введения того же АГ амплитуда ответа больше, он продолжается дольше и обусловлен возрастанием преимущественно синтеза IgG. Для понимания природы происходящей при иммунном ответе динамики АТ следует учитывать различие продолжительности существования их в плазме крови. Повторные введения АГ помогли установить явленне сенсибилизации (повышения чувствительности к данному АГ, лат.sensibilis-чувствительный) иммунной системы. Сенсибилизация сопровождается активацией образования специфических АТ, которые разносятся с током крови во все ткани и фиксируются на клетках. Поэтому повторное введение данного АГ вызывает усиленную АГ-АТ реакцию, в результате которой высвобождается много биологически активных веществ, (гистамин, серотонин, кинины,т.д.), вызывающих быстрые и сильнее изменения физиологических функций - анафилактический шок. Найдены способы понижения усиленной чувствительности иммунной системы (десенсибилизация по А.М.Безредка, др.). Многократные воздействия АГ могут извращать иммунный ответ (аллергии, др.). Эти и подобные им "необычные" иммунные ответы относят к патологическим и не рассматриваются здесь, хотя граница между нормой и патологией в большинстве случаев неопределенна. Регуляция иммунитета - воздействия на активность иммунных органов, изменяющие иммунные ответы Изменение иммунных ответов под влиянием психо-эмоционального состояние, питания, степени физической активности, биологических ритмов, привычек, климата и т.д. называют регуляцией иммунитета. Исполнительными механизмами регуляции иммунитета у человека являются автономная нервная система и эндокринные органы. Выявлен относительный антагонизм влияний симпатической и парасимпатической нервной систем, а также катехоламиновых и инсулиноподобных гормонов на иммунитет. Способность организма сохранять постоянство клеток и тканей меняется в зависимости от психического, эмоционального, биологического состояния, возраста, наследственности, биологических ритмов, питания, климата, поведения. Иначе говоря, иммунитет регулируется в соответствии с индивидуальными особенностями человека. Общие положения регуляции функций, такие как ведущая роль психики, высшей нервной деятельности, нервных регуляций (нервизм) по отношению к другим (субординационные отношения), общих по сравнению с локальными и др., полностью приложимы к регуляции иммунитета. У здорового человека активность иммунной системы изменяется так, чтобы обеспечить выживание. Такие изменения иммунитета опосредуются ЦНС, АНС, гуморальными и гормональными влияниями. Факторы, подтверждающие роль психики и ВНД, реализующиеся через активность ЦНС, АНС и периферических нервов, в регуляции состояния иммунитета человека широко известны. Так, установлена связь между типом ВНД человека и особенностями иммунного ответа, а также обратные зависимости - изменения условнорефлекторной деятельности вследствие иммунизации (в особенности при первичном ответе, Д.Ф.Плецитый, др.). В последнее время выявлена возможность образования условнорефлекторных сдвигов показателей иммунитета у человека после сочетания условного сигнала с подкреплением (введение адреналина). Эмоциональный стресс сопровождается повышением пролиферации естественных клеток-киллеров (ЕКК), повышением активности тимус- зависимых лимфоцитов-хелперов, а невроз-снижением активности этой группы лимфоцитов. Депрессия сопровождается общим снижением лейкоцитов, Т- хелперов и Т-супрессоров, а также ЕКК. В гипоталамусе выявлены волокна, содержащие интерлейкин -1-1b, опосредующий реакцию структуры мозга на неблагоприятные воздействия (охлаждение, перегревание, перенапряжение и т.д.). Установлено, что у левшей чаще встречаются аллергические и аутоиммунные заболевания (вследствие наследственных или приобретенных свойств?). Медиаторами иммунного ответа являются гормоны (глюкокортикоиды, нейропептиды, др.), а также полипептиды клеток иммунной системы. В частности, иммунные реакции модулируются АКТГ, бета- эндорфином, метэнкефалином и др. фрагментами проопиомеланокортина, синтезируемого клетками аденогипофиза). Эти гормоны воздействуют на рецепторы клеток иммунной системы. Например, метэнкефалин стимулирует формирование антителопродуцирующих клеток, рост клеточных колоний в тимусе и селезенке. Однако концентрация бета- эндорфинов в плазме является решающим фактором в появлении конечного эффекта: низкие концентрации ( 1/10.-14 моль) стимулируют, а более высокие подавляют продукцию специфических антигерпетических систем. Важным фактором регуляции иммунитета является характер и тип питательных веществ. Полиненасыщенные жирные кислоты пищи подавляют активность ЕКК, усиливают синтез простагландина ИГЕ. Наоборот, арахидоновая кислота пищи, подавляя синтез ПГЕ, стимулирует иммунитет. Ограничение белковой пищи вызывает снижение активности Т-хелперов, миграцию макрофагов и их способность образовывать антитела. Состав флоры кишечника в значительной степени определяет состояние иммунитета человека. Например, коринебактерии JК прямой кишки выявляются у людей с выраженным иммунодефицитом (лейкоз, СПИД, др.). Иммунорегуляция липопротеидами низкой плотности, появляющимися в плазме крови после приема пищи, опосредуется через рецепторы иммунокомпетентных клеток. В значительной степени.регуляция иммунитета определяется содержанием серотонина в клетках кишечника (до 90% от общего количества). Описаны биоритмологические и возрастные изменения иммунитета здорового человека. Так, в утренние часы наблюдается максимум Т- лимфоцитов и минимум В-лимфоцитов (противофазно содержанию 11-оксикортикостеровдов), а фагоцитоз и уровень пропердина наиболее высоки и в дневное и вечернее время, снижаясь ночью и утром. Иммунореактивность имеет сезонные колебания - снижается весной и осенью. С возрастом нарастает число аномальных клеток. Например, спонтанные перестройки хромосом в клетках крови составляют почти 3% у лиц старшей возрастной группы (50-80 лет). С другой стороны, в этом возрасте наблюдается снижение иммунных реакций на инородные клетки-мутанты. Причиной этого является ухудшение иммунного опознания собственных АГ вследствие дефектов клеточных рецепторов, активности макрофагов, т.д. Кроме того, в указанном возрасте отмечается снижение содержания лимфоцитов (1.5.109/л в 50 лет сравнительно с 2.0.109/лв20лет). Наконец, у лиц старшей возрастной группы усиливается аутоиммунные. реакции вследствие накопления тканевых комплексов АГ-АТ(например,к гемоглобулину), нарушения соотношения иммуноглобулинов (преобладание продукции IgМ и снижение продукции IgО и IgА), др. Беременность сопровождается повышением содержания комплемента Сз, особенно в 1ом и Зм триместрах, усилением фагоцитарной и бактерицидной активности лейкоцитов. На ранних сроках беременности иммунитет специфически подавляется, что предотвращает отторжение зародышевых клеток, несущих признаки чужеродности. Таким образом, активность иммунных органов, связанных со всеми системами организма -кровообращением, кровью, дыханием, метаболизмом, т.д. - меняется не только под влиянием факторов, исходящих из иммунных органов, но и многих других. Последние могут нетолько способствовать, но и препятствовать осуществлению нормальных саморегуляторных влияний иммунной системы, как стабилизировать, так и ухудшать иммунные ответы. Функциональная система поддержания постоянства клеток организма - динамическое взаимодействие органов, тканей и неклеточных структур, поддерживающее постоянство клеток организма благодаря саморегуляции. Возможным механизмом поддержания иммунологической "чистоты" индивидуальной внутренней среды человека является иерархически построенная особая функциональная система. Предположительными уровнями ее функционирования являются местный, органный(региональный) и уровень всего организма. Описанные в предыдущем параграфе частные проявления влияний различных факторов на иммунные органы и их производные-антитела - можно представить в общем виде как функциональную систему, компоненты которой взаимодействуют так, что сохраняется определенное количество каждого вида клеток и их признаки (отсутствие аномальных клеток). Это осуществляется за счет саморегуляции: увеличение числа тех или иных клеток вызывает возрастание специфических цитотоксических подавляющих влияний, и наоборот, снижение количества определенных клеток вызывает усиление цитогенетических. влияний. Саморегуляция клеточного состава тела инерционна. Это обусловлено тем, что жизненный цикл большинства эукариотов тела человека длится десятки часов и суток. Переход из одного состояния иммунной активности в другую завершается благодаря гуморальным влияниям - столь же медленным и инерционным. Также медленно происходит приобретение иммунной компетенции клетками, перераспределение их между иммунными и остальными органами, выход клеток и компонентов плазмы в ткань через гистогематические барьеры и т.д. Можно предполагать, что в естественных условиях периоды колебаний тех или иных клеточных популяций происходят в течение часов и суток. В этих условиях важное регуляторное значение приобретает кумулятивный эффект (накопление воздействий) регуляции. Полезным приспособительным результатом, или системообразующим фактором данной функциональной системы является поддержание характерного для конкретной окружающей среды, определенного возраста, пола, сезона и вида деятельности (поведения, питания и образа жизни) уровня активности клеточных клонов (греч.klonos-движение, т.е. образовавшихся из одной клетки группы клеток). Это означает сохранение состояния неустойчивого равновесия: должную степень активности АТ клеток, тканей и жидкостей организма, препятствующей с одной стороны образованию достаточного для развития опухолей количества аномальных клеток, а с другой - развитию микробной флоры. Таким образом, полезный приспособительный результат функциональной системы поддержания постоянства клеточного состава тканей и жидкостей организма состоит из антисептических и антионкотических компонентов. Афферентная часть функциональной системы, воспринимающая отклонения клеточного состава той или иной ткани от "нормального" состояния и передающая сигналы другим клеткам и органам, представлена в основном гуморальными сигналами. Это преимущественно специальные, не полностью до настоящего времени идентифицированные компоненты внутренней среды. В большинстве случаев избирательность влияния этих гуморальных сигнализаций зависит от наличия специальных рецепторов клеточных мембран, с которыми связываются переносимые жидкостью-кровью, лимфой, межклеточной, спинномозговой, внутрисуставной, плевральной и др. жидкостями - вещества. Хотя установлены влияния медиаторов клеточного иммунитета и на ЦНС, однако нервная система играет роль аппарата регуляции более высокого порядка сравнительного с гуморальным периферическим. Поэтому афферентная сигнализация в ЦНС имеет качественно иной характер: вероятно эта импульсация сигнализирует о состоянии исполнительных органов- желез внутренней секреции и функционировании жизненно важных тканей. Эффекторными (исполнительными) аппаратами функциональной системы поддержания постоянства клеток организма являются как специфические структуры и вещества - АТ, фиксированные на мембранах клеток и свободные, а также лимфоциты, макрофаги, специфические факторы активации связывания АГ и др., так и неспецифические - расширение капилляров, увеличение проницаемости их.стенок и т.д. под влиянием биологически активных веществ, поступающих из разрушенных клеток (базофилов, эозинофилов, др.). В конечном счете эффекторные аппараты иммунитета осуществляют постепенно развертывающуюся защитную иммунную реакцию. Она зависит от соотношения свойств и количества АГ с одной стороны и исходного состояния иммунитета с другой. Основные принципы работы эффекторных аппаратов сводятся.к следующему: 1.Образование и поступление АТ в определенную область тела пропорционально количеству и виду АГ. 2.. Характер и тип иммунного ответа (локальный, региональный, генерализованный, быстрый, медленный) зависят от способа и темпа поступления АГ, его вида, а также состояния иммунной системы. Аппаратами интеграции афферентных нейрогуморальных и эффекторных влияний являются морфологические структуры, в которых происходит объединение, взаимодействие большого числа факторов. Наиболее возможными аппаратами интеграции могут быть либо мозговые структуры с их громадным числом (1014) взаимодействующих элементов, либо образования с обильным кровотоком, позволяющим всем компонентам крови легко контактировать с их стенками или их содержимым. Аппаратами интеграции иммунной системы являются главным образом центральные и периферические органы иммунной системы. Циркулирующие вместе с жидкостями иммуноактивные агенты воздействуют на органы иммунной системы, обеспечивая усиление синтеза АТ, активацию деления клеток, миграцию их из центральных иммунных органов в периферические или в определенные области организма и др.
Список литературы
1.Ю.В. Урываев. Физиологические основы гомеостаза. Москва, 1995. 2. Г.В. Гущин, Е.Э. Яковлева. Нейрогуморальная регуляция иммунного гомеостаза. Ленинград: Наука, 1986. 3. Е.А. Зотиков. Антигенная система человека и гомеостаз Москва: Медицина, 1982.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|