 Плазмаферез – эффективный метод лечения многих заболеваний. Заключается в очищении крови от токсинов, ядов и болезнетворных микроорганизмов путем удаления ее жидкой части – плазмы.
Плазмаферез – эффективный метод лечения многих заболеваний. Заключается в очищении крови от токсинов, ядов и болезнетворных микроорганизмов путем удаления ее жидкой части – плазмы.Действующий руководящий документ в нашей стране — «Инструкция по проведению донорского плазмафереза», утвержденная МЗ РФ 25 июня 1995 г. (разработчики — Н. Н. Калинин, М. М. Петров, С. В. Варламов и соавт).
При однократном плазмаферезе от донора получают 450-500 мл консервированной крови. Выход плазмы составляет не менее 50 %, т. е. 250±50 мл. При двукратном плазмаферезе из 900-1000 мл консервированной крови получают до 600 мл плазмы.
Донорский плазмаферез осуществляется только с помощью пластиковых мешков.
Методика проведения донорского плазмафереза
У донора берут кровь в сдвоенные полимерные мешки, ее разделяют на плазму и форменные элементы путем центрифугирования, скорость и время которого устанавливают в зависимости от типа центрифуги, согласно номограммам и расчетным формулам. С помощью плазмоэкстрактора плазму переводят во второй (малый) контейнер, мешки разъединяют. Форменные элементы крови, ресуспендированные в физиологическом растворе, возвращают донору через систему для переливания крови. Из дозы цельной консервированной крови получают 200-300 мл плазмы, а из двух доз соответственно 500±50 мл плазмы.
Подготовка мешков к взятию крови
Работа с пластикатными контейнерами типа 500/300 проводят в соответствии с инструкцией изготовителя. Проверяются сроки годности мешков и их целостность. Мешки маркируют с указанием даты, Ф.И.О., группы крови и Rh-принадлежности донора. Заготавливаются этикетки для маркировки мешков с плазмой.
406_____Глава 8. Заготовка крови, производство ее компонентов и препаратов
Особое внимание следует обратить на идентификацию заготовляемой крови и реинфузируемых эритроцитов. С этой целью используют маркировку цветными групповыми марками:
— гемоконтейнер с консервантом (марка фиксируется к ушку гемокон-тейнера с помощью степлера или прозрачной ленты — скотча). Дополнительно на гемоконтейнер и спаренный мешок («Компопласт») фиксируется полоска из лейкопластыря с нанесенными фамилией донора и номером цикла операции;
— донора — путем закрепления на предплечье браслета из плотной прозрачной полиэтиленовой полоски с фиксированной на ней цветной маркой;
— карточки (карты) донора (марка наклеивается на специально отведенном месте).
Непосредственно перед гемоэксфузией донору предлагают поставить свою подпись на гемоконтейнер. Маркировку контейнеров для крови и плазмы выполняют, не отходя от донора. Карточка (карта) донора во время проведения операции находится на груди донора.
Процесс взятия крови у донора
Перед началом взятия крови у донора раскладывается стерильная упаковка для работы с каждым донором.
Заполняется система для переливания крови стерильным изотоническим раствором хлорида натрия. При этом необходимо убедиться в герметичности флаконов, проверить срок годности растворов.
У донора место венепункции (локтевой сгиб) необходимо дважды обработать антисептиком (приказ МЗ СССР № 408 от 1989 г.), наложить жгут, снять колпачок с иглы мешка и произвести пункцию вены.
Иглу закрепить лейкопластырем.
Во время эксфузии кровь в мешке периодически перемешивают с консервирующим раствором. В полимерный контейнер набирают тот объем консервированной крови, который указан на этикетке мешка.
По окончании взятия крови снимают жгут. Затем на трубку накладывают 2 зажима, отступая 10 см от канюли иглы. Трубку между зажимами обрабатывают спиртом и разрезают стерильными ножницами.
Чрезвычайно важно поддерживать порядок, гарантирующий безопасную реинфузию аутологичных эритроцитов. До того как контейнер с кровью отделяется от донора, должно быть 2 независимых этапа идентификации, чтобы и донор, и операционная сестра могли удостовериться в том, что содержимое идентифицировано правильно (уникальный номер и подпись донора).
Кровь из трубки полимерного контейнера нужно перевести в мешок (при этом можно использовать зажим для выдавливания крови из трубок — стриппер).
Затем трубка герметизируется путем запаивания или наложения металлических колец, или завязыванием у мешка по паре тугих узлов.
Донорский гшазмоцитаферез 407
К игле подсоединяется капельница с физиологическим раствором, первые 10 мл которого вводятся струйно для предотвращения тромбирования иглы, затем скорость введения физиологического раствора должна быть 30-40 капель в 1 мин.
Центрифугирование пластиковых контейнеров
Полимерные контейнеры помещают в центрифужные стаканы, которые попарно уравновешивают на весах. Уравновешенные стаканы устанавливают согласно маркировке в центрифугу для фракционирования (в соответствии с инструкцией по эксплуатации центрифуги).
Центрифугирование следует проводить при факторе разделения (см. раздел 7.5) не менее 2000 g, что позволяет добиться высокого выхода плазмы без примеси клеточных элементов и без их травмирования.
Центрифугирование следует проводить при температуре 22 °С.
Отделение плазмы
После окончания центрифугирования полимерный контейнер с разделенной кровью осторожно, чтобы не было перемешивания пограничного слоя, переносят и устанавливают в плазмоэкстрактор, с помощью которого плазма переводится в малый контейнер (300 мл), с трубки последнего снимается пластмассовый зажим.
После этого оба контейнера разделяют, накладывая два зажима на соединяющую их трубку. Трубку между зажимами обрабатывают спиртом и разрезают стерильными ножницами. Малый контейнер с плазмой герметизируют запаиванием или наложением металлических колец, или завязыванием по паре тугих узлов около мешка.
На мешок с плазмой прикрепляют маркировочную этикетку.
Реинфузия аутоэритроцитов
В контейнер с эритроцитами перед реинфузией вводится 100 мл изотонического раствора хлорида натрия.
Для разведения аутоэритроцитов физиологическим раствором используется система-магистраль для переливания растворов из флакона во флакон (CM-I).
Для этого, обработав спиртом пробку флакона с физиологическим раствором, который подключен к системе переливания крови и вводится донору, закрыть капельницу, проткнуть пробку одной иглой магистрали, а другую иглу ввести в трубку от мешка, снять зажим и развести эритроциты 100 мл физиологического раствора, осторожно перемешивая их.
После ресуспендирования аутоэритроцитов на трубку мешка вновь наложить зажим, отсоединить от флакона и мешка систему-магистраль (CM-I) и герметизировать трубку мешка с ресуспендированными эритроцитами возможными способами, изложенными выше.
408_____Глава 8. Заготовка крови, производство ее компонентов и препаратов
После проверки маркировки мешка и сверки устно с донором его фамилии, имени, отчества, группы крови резус-фактора мешок присоединяется к системе для переливания крови; введение изотонического раствора хлорида натрия прекращают.
Осуществляется реинфузия аутоэритроцитов донору. Допускается струйное введение аутоэритроцитов.
Операционная сестра, производящая реинфузию форменных элементов, обязана убедиться в их принадлежности именно этому донору путем:
— проверки наличия всех элементов идентификации и отсутствия на них механических повреждений;
— сопоставления паспортных данных, указанных на гемоконтейнере и полученных при опросе донора;
— проверки совпадения цвета марок и маячков, номеров и других отметок на руке донора, журнале (карте) донора, контейнере со взвесью реинфу-зируемых аутокомпонентов;
— предъявления донору гемоконтейнера с его подписью.
В случае потери или выявления повреждений браслетов на предплечье донора, цветных марок, несовпадения их номеров, а также наличия других признаков, вызывающих сомнение в принадлежности реинфузируемой среды данному донору, дополнительно проводят:
— определение группы крови и резус-фактора пробы крови из гемоконтейнера;
— пробы на индивидуальную совместимость по системам АВО и резус между сывороткой донора и клеточной взвесью из гемоконтейнера.
При совпадении групповой принадлежности эритроцитной массы и крови донора, отсутствии агглютинации в пробах на совместимость, после выполнения биологической пробы проводят переливание клеточной взвеси.
О готовности к проведению реинфузии операционная сестра докладывает врачу отделения, который, удостоверившись в правильности ее действий, дает разрешение на переливание аутокомпонентов. В начале реинфузии проводится биологическая проба, оценка которой осуществляется врачом.
После возврата аутоэритроцитов процедура заканчивается при однократном плазмаферезе, закрывается капельница, игла вынимается из вены, накладывается стерильная, давящая повязка не менее чем на 2 ч.
При проведении двукратного плазмафереза повторяются все этапы, начиная с подготовки гемоконтейнера.
После окончания операции путем опроса, осмотра, оценки пульса и АД врач должен убедится, что в состоянии здоровья донора нет никаких отклонений и он может быть отпущен из СПК. Операция оформляется протоколом в карточке (карте) донора, регистрируется в «Книге учета заготовки компонентов крови методами плазмоцитафереза» и «Удостоверении донора» (только для активных доноров). После этого донор инструктируется о дате и времени следующей плазмодачи.
Донорский плазмодитаферез 409
Использование плазмы, полученной от донора при плазмаферезе, ее замораживание и дальнейшее хранение осуществляются согласно существующим регламентам.
Плата донору за донорский плазмаферез производится в соответствии с существующими документами, утвержденными местными и федеральными органами власти.
Бактериологический контроль плазмы осуществляется из невостребованных контейнеров согласно «Инструкции по контролю стерильности консервированной крови, ее компонентов, препаратов, консервированного костного мозга, кровезаменителей и консервирующих растворов» от 1995 г.
studfiles.net
Несмотря на все достижения современной трансплантологии, до сих пор остаётся проблема острого или хронического отторжения пересаженных органов. В основе этих процессов лежат множество причин, которые далеко не всегда можно устранить.
В случаях предстоящей трансплантации, не удалив остающиеся в организме аутоантитела, пересаженная почка подвергается риску такого же аутоиммунного поражения, как и удалённая. С другой стороны, удаление поражённой почки с "псевдочужеродной" антигенной структурой, побуждающей постоянное воспроизводство аутоантител, может способствовать затиханию и этого патологического процесса [Рагимов А.А. и др., 1997]. Иммунный конфликт после пересадки почки может быть результатом появления анти-HLA антител в результате изоиммунизации в связи с предшествовавшими трансплантациями, гемотрансфузиями или беременностью. Несмотря на перекрестную совместимость с донорским органом, наличие таких HLA-антител приводит к раннему отторжению. Нарастание донор-специфичных аллоантител происходит в течение первых нескольких недель [StegallM.D., GloorJ.M., 2010]. В ряде случаев под действием естественных аутоантител IgG и IgM изотипов, активации системы комплемента и эндотелиальных клеток может развиться сверхострая реакция отторжения в течение ближайших часов и даже минут [LatremouilleCh. etal., 1997]. Рецидив фокально-сегментарного гломерулосклероза в пересаженной почке наблюдается в 30-80% случаев, а гибель трансплантата в течение трёх лет доходит до 90% и только систематическое проведение обычного или каскадного плазмафереза после операции предотвращает такие осложнеприя [OtsuboS. etal., 2004; NojimaM. etal., 2005; Джасим Г.А. и др., 2006; GarciaC.D. etal., 2006; SenerA. etal., 2009; VarmaP.P. etal., 2009; BrownC.M. etal., 2010; FuentesG.M. etal., 2010; MitomeJ. etal., 2010; SatoscarA.A. etal., 2010; SchachterM.E. etal., 2010; StegallM.D., GloorJ.M., 2010; BatrtelG. etal., 2011; GeorgeS.M. etal., 2011; KangH.G., 2011; MontgomeryR.A. etal., 2011; RanghinoA. etal., 2012; RummelS., BarzD., 2012. Иногда для этого требуется еженедельное проведение плазмафереза в течение почти четырёх лет [DeegensJ.K. etal., 2004; CanaudG. etal., 2009; NoorlanderI. etal., 2011]. В случаях нарастающей гипопротеинемии при продолжительных курсах плазмообмена переходят на иммуноадсорбцию [FenclF. etal., 2007]. При сочетании курсов плазмафереза с приёмом ретуксимаба (антилимфоцитарного иммуноглобулина) или бортезомиба достигалась более продолжительная ремиссия протеинурии [AkalinE. etal., 2008; HicksonL.J. etal., 2009; KaposztasZ. etal., 2009; LefaucheurC. etal., 2009; JordanS.C. etal., 2010; SakaiK. etal., 2010; WalshR.C. etal., 2010; LevineM.H., AbtP.L., 2012]. Тем не менее, надо иметь в виду, что и сам ритуксимаб может приводить к тяжёлым осложнениям, которые приходится нивелировать также с помощью плазмафереза [HastingsD. etal., 2009].
R.M. Higginsи соавт. (1996) у 9 больных провели иммуноадсорбцию перед трансплантацией, что улучшило результаты и прогноз, даже в случаях предыдущих отторжений пересаженных почек. Однако M.D.Stegallи соавт. (2006) считали, что повторные сеансы плазмафереза более надёжно предотвращают реакции отторжения пересаженной почки, чем высокие дозы иммуноглобулинов. Высокая частота отторжений трансплантата при гемолитико-уремическом синдроме также требует предварительного проведения курса плазмафереза вместе с экулизумабом [NesterC. etal., 2011].
Значительные проблемы возникают при вынужденной пересадке почки в условиях АВО-несовместимости. Одной из причин является нахождение антигенов А или В не только на мембранах эритроцитов, но и на стенках сосудов, в том числе и пересаженной почки [FidlerM.E. etal., 2003]. В этом случае антитела реципиента начинают взаимодействовать с антигенами на стенках сосудов, приводя к расстройствам микроциркуляции и последующему отторжению пересаженного органа («большая несовместимость»). «Малая несовместимость» возникает в результате выработки лимфоцитами донора, остававшиеся в пересаженном органе в качестве «пассажиров», против эритроцитов реципиента, вызывая их гемолиз [CrespoM. etal., 2001]..
В этих случаях предварительное удаление анти-А или анти-В антител с помощью плазмообмена в значительно степени снижает концентрацию этих антител, сглаживая тем самым реакции отторжения [WintersJ.L. etal., 2004; Flores-GamaF. etal., 2009; MoonH.W. etal., 2009; ShimodaM. etal., 2009; PonticelliC., GlassockR.J., 2010; RodriguesFerreroM. etal., 2010; YangX.P. etal., 2010; YooS. etal., 2012]. В случаях предстоящей трансплантации органов доноров-родственников, несовместимых по системе АВО, А.А.Рагимов и соавт. (2008, 2012) проводили курсы плазмафереза для снижения титра соответствующих антител до уровней 1:2 – 1:4. При этом в случаях исходного титра антител 1:32 приходилось удалять до 350-550% ОЦП, а в случаях повторного нарастания титра антител до 1:32 в посттрансплантационном периоде приходилось снова прибегать к высокообъёмному плазмаферезу с удалением до 400% ОЦП. A.A.Tobianи соавт. (2008) также сообщали о важной роли курсов плазмафереза, как перед, так и после трансплантации почки при АВО-несовместимости, что устраняло эпизоды гиперактивного антитело-зависимого отторжения трансплантата. Причём, в течение года пересаженные почки оказывались жизнеспособными в 100% случаев. Положительные результаты были достигнуты и при использовании курса иммуноадсорбции с использованием колонок АВО Адсопак-А производства НПФ ПОКАРД [Мойсюк Я.Г. и др., 2011].
При пересадке печени в условиях АВО-несовместимости также использовался плазмаферез перед операцией [KozakiK. etal., 2006; MatsunoN. etal., 2008; GoralczykA.D. etal., 2009], а T. Ashizawaи соавт. (2006) – и перед и после операции. ShimodaM. и соавт. (2009) отмечали, что предоперационное введение одного лишь ритуксимаба (без плазмафереза) было не в состоянии блокировать продукцию антител. Спленэктомия в сочетании с ритуксимабом также не обеспечивали положительных результатов [RautV. уtal., 2012]. Плазмаферез следует применять сразу же, как только появляются первые признаки отторжения органа [KamarN. etal., 2009].
Такие же проблемы при АВО-несовместимости возникают и при трансплантации гематопоэтических стволовых клеток в онкогематологии и курс плазмафереза перед такой трансплантацией в значительной мере предотвращает кризы отторжения [StussiG. etal., 2009].
При пересадке органа при несовместимости крови по системе АВО с успехом использовался и каскадный плазмаферез [RavichandranP. etal., 2005; HanafusaN. etal., 2007; TanabeK., 2007; IchimaruN., TakaharaS., 2008; HigginsR. etal., 2010; Ватазин А.В. и др., 2011; Кантария Р.О. и др., 2012]. При этом, за 3-4 сеанса каскадного плазмафереза удавалось снизить титр анти-АВО антител до концентрации 1:32, что является вполне приемлимым критерием для последующей пересадки почки при АВО-несовместимости.
Оказалось возможным существенно (на 80-90%) снизить содержание групповых антител и с помощью 3-4-х сеансов селективной иммуносорбции с помощью колонок Ig-Адсопак для IgG-афереза, изготовленных НПФ ПОКАРД в России [Покровский С.Н., 2010; Арзуманов С.В.и др., 2013].
После трансплантации возникает новая ситуация – из пересаженной почки поступает антигенный сигнал, в ответ на который начинают формироваться новые антитела с пиком острого "криза отторжения" через 1-2 недели. И здесь эфферентная терапия сможет сгладить эти иммунные реакции при меньшем уровне иммуносупрессивной терапии. Проведение курсов плазмафереза в таких случаях способствует восстановлению диуреза, снижению уровня креатинина и постепенному восстановлению функции трансплантата, что у 60% больных позволило избежать «трансплантатэктомии» [Бирюкова Л.С. и др., 2001]. В последние годы плазмаферез стали проводить ещё интраоперационно сразу после включения пересаженной почки в кровоток, поскольку было установлено, что уровень основных провоспалительных цитокинов (IL-6, IL-8, IL-10), токсинов среднемолекулярной массы и продуктов перекисного окисления липидов возрастает и достигает максимума к моменту окончания операции [Каабак М.М. и др., 2006]. Помимо снижения содержания в крови таких эндотоксинов, восстановление начальной азот- и водовыделительной функции почек наступало значительно быстрее – к 5-6-м суткам вместо 12-18 суток в случаях без использования плазмафереза [Салимов Э.Л. и др., 2005]. С помощью плазмафереза на фоне иммуносупрессивной терапии удавалось заблокировать реакции отторжения и после пересадки петель тонкого кишечника [RuizP. etal., 2010].
Более того, пересаженный орган, будь то почка, сердце, лёгкое, печень или костный мозг, является постоянным побудителем воспроизводства антител в течение всей жизни, что делает этот процесс одним из вариантов аутоиммунных болезней. Так, антимиозиновые антитела часто обнаруживают при реакции отторжения пересаженного сердца [ShützA. etal., 1997]. Отторжение трансплантата может произойти даже через 10 лет. Аллореактивные антитела формируются против трансплантата и они задерживаются и после его отторжения, что снижает шансы приживления последующего трансплантата. Нарушения функции В клеток являются одной из причин такой резистентной аллоиммунизации или гиперреактивности. При этом ведущее значение принадлежит не столько Т-клеточной регуляции, сколько уремии при почечной недостаточности [OkasheK. etal., 1997].
Нередким последствием трансплантации клеток костного мозга является поражение печени, среди причин которого выделяют веноокклюзивную болезнь печени, хроническую реакцию отторжения, вирусные или грибковые инфекции и холестатические расстройства [FerraraJ.L.M. etal., 2009]. Гепатит С среди выживших больных после трансплантации встречается от 5 до 70% случаев, а цирроз печени развивался у 3,8% больных [StrasserS.I. etal., 1999].
При таких реакциях трансплантат-против-хозяина (РТПХ) (graft-versus-hostdisease) происходит накопление провоспалительных цитокинов, таких как TNF-α, IL-1β, IL-6 и этот «цитокиновый кискад» активирует другие эффекторные клетки – натуральные киллеры и макрофаги, приводящие к прямому повреждению тканей кожи, печени и желудочно-кишечного тракта [BeresA.J., DrobskyW.R., 2013]. Всё это делает показанным проведение плазмафереза и мы на собственном опыте убеждались в его эффективности при лечении РТПХ.
Надо отметить, что может развиваться и хроническая РТПХ у 50% таких больных с летальностью до 25% [WolffD. etal., 2011], что лишний раз подчёркивает актуальность этой проблемы и необходимость более активного лечения с привлечением и плазмафереза.
Нередким осложнением трансплантации стволовых клеток является развитие тромботической микроангиопатии с отёком интимы и фибриноидным некрозом стенок сосудов. К этому приводят высокие дозы препаратов для кондиционной химиотерапии, облучения, ингибиторов кальцинейрина (используемых для профилактики и лечения РТПХ) и инфекции [ChoiC.M. etal., 2009; WillemsE. etal., 2010]. Почки при этом поражаются в первую очередь и развитие острой почечной недостаточности представляется плохим прогностическим фактором с уровнем детальности 44-90% [GeorgeJ.N. etal., 2004; UderzoC. etal., 2006; LaskinB.L.etal., 2011]. И плазмообмен, проводимый в таких случаях ежедневно до наступления эффекта, способен купировать такое осложнение [ChristidouF. etal., 2003; Воинов В.А. и др., 2009; KennedyG.A. etal., 2010].
Современная иммуносупрессивная терапия состоит из комбинации трёх медикаментов – циклоспорина, азатиоприна и преднизолона, а в последние годы – и ритуксимаба. Они улучшают исходы трансплантации, однако следует учитывать, что иммуносупрессия, возникающая при длительном приёме ретуксимаба, чревата развитием септических осложнений (до 50-60% в течение года) и, в частности, цитомегаловирусной инфекции, для купирования которой иногда приходится удалять пересаженную почку [Прокопенко Е.И. и др., 2010; ChungH.Betal., 2012]. И в то же время не в состоянии полностью предотвратить кризы острого и хронического отторжения – васкулопатии трансплантата [BarrM.L. etal., 1998]. Процессы хронического отторжения пересаженных лёгких по данным двух трансплантационных центров составляют от 60 до 80%. Использование антилимфоцитарных антител во время эпизодов отторжения трансплантата сопряжено с активизацией вирусных инфекций и лимфопролиферативных заболеваний. Метотрексат также способствует развитию лимфопении и инфекционных осложнений [SalernoC.T. etal., 1999] Кроме того, известны и нефро- и нейротоксичный эффекты циклоспорина, что зачастую сводит на нет результаты операций и приводит к самым неблагоприятным последствиям [TwiddleD.A. etal., 1999]. Одним из последствий приёма циклоспорина А является и гипертриглицеридемия, развивающаяся после пересадки клеток костного мозга и которую можно купировать с помощью плазмафереза или каскадной плазмофильтрации [GianniniG. etal., 2005; KwonS.U. etal., 2006; MoormanM.T. etal., 2011].
Широко используется в трансплантологии и ингибиторы кальцийневрина (Такролимус, Сиролимус), однако их применение также чревато такими серьёзными осложнениями, как тромботическая микроангиопатия с развитием нефропатии (острый канальцевый некроз), холестаз, энцефалопатии (головные боли, расстройства зрения, судороги), бóльшая частота лимфопролиративных опухолей [BerardinelliL. etal., 2010; HesselinkD.A. etal., 2010; MatsusakiT. etal., 2010; MitomeJ. etal., 2010; PomerantzR.G. etal., 2010; OtoT. etal., 2010; QutubeS. etal., 2010; WuQ. etal., 2010].
Поскольку же при подобных аутоиммунных процессах практически единственным и по-настоящему патогенетическим лечением является эфферентная терапия, а среди её методов самым эффективным остаётся плазмаферез, то и в трансплантологии должен распространиться принцип периодического проведения курсов плазмафереза cцелью удаления антител против пересаженного органа [CardellaC., 1985; KorachJ-M. etal., 2000; KerenA., 2005; PradhanM. etal., 2008; RummelS., BarzD., 2012]. При этом, конечно, остаётся актуальной иммуносупрессивная терапия, но плазмаферез поможет проводить её в субтоксических дозах без риска побочных осложнений. Наилучший эффект достигался при сочетании курсов плазмафереза с внутривенным введением иммуноглобулинов [StatinskaJ. etal., 2009].
Купирование органной дисфункции после пересадки печени проведением как обычного плазмафереза, так и по системе MARS(molecularadsorbentrecirculatingsystem) было одинаково эффективным [LeeJ.Y. etal., 2010].
А.А.Рагимов и соавт. (1997), в частности, сообщают, что иммуносупрессивная терапия после трансплантации сердца, даже в случаях, когда причиной трансплантации была не ишемическая болезнь сердца, а дилатационная кардиомиопатия, приводит к существенным нарушениям липидного состава крови и возникновению ишемических расстройств в пересаженном сердце. Поскольку одним из самых эффективных методов терапии гиперлипидемических состояний является плазмаферез, он и был спустя 2-7 лет после операции включён в программу лечения 8 больных, перенесших ортотопическую трансплантацию сердца. После курсов плазмафереза, проводимых дважды в год, отмечалась выраженная положительная динамика в состоянии гемореологии и липидного обмена. Существенно снижалось содержание в крови общего холестерина и липопротеидов низкой плотности без существенных изменений концентрации иммуносупрессоров. На сцинтитомограммах отмечено значительное улучшение перфузии миокарда в зонах ишемии. Особенно актуально проведение плазмафереза для купирования острого криза отторжения, даже при нестабильной гемодинамике [Рагимов А.А. и др., 1998; LeechS.H. etal., 2006; WangS.S. etal., 2006; VerheyenJ. etal., 2011; KaczorowskiD.J. etal. 2013]. Причём, O.Grauhanи соавт. (2001) подчёркивали, что после 7 эпизодов отторжения у 7 больных, пролеченных без плазмафереза, выжило лишь 2, а после 11 таких эпизодов у 6 больных выжили все. Плазмаферез успешно применялся при кризах отторжения пересаженного сердца даже у детей, начиная с возраста 3,5 месяцев [Pollock-BarzivS.M. etal., 2007].
При этом, несмотря на удаление значительных объёмов плазмы, не отмечалось какого-либо существенного снижения уровня иммуносупрессиных препаратов [DzemeshkevichS. etal., 1998].
Учитывая развитие аллосенсибилизации к HLA-антигенам у «кандидатов» на пересадку сердца, плазмаферез целесообразно проводить и перед трансплантацией [PizaniB.A. etal., 1999; VelezM., JohnsonM.R., 2009]. Более того, используется удаление антител с помощью плазмафереза, проводимого во время экстракорпорального кровообращения в период операции по трансплантации сердца [LarsonD.F. etal; HoltD.B. etal., 2007].
Тем не менее, предпринимаются и попытки прямого подавления гиперактивности Т-лимфоцитов, продуцентов антител, с помощью экстракорпорального фотофереза, когда проводится облучение выделенных клеток ультрафиолетовыми лучами [GiuntiG. etal., 1999].
Надо иметь в виду, что при пересадке органов неизбежно возникает целый ряд расстройств, лечение которых должно требовать эфферентной терапии. Ведь практически у всех пациентов, которым требуется пересадка органов, к моменту операции имеются весьма значительные нарушения гомеостаза и эндотоксикоз, обусловленный несостоятельностью этого органа. Это либо почечная, либо сердечная, либо лёгочная, или даже полиорганная недостаточность. Донорский орган, который только что перенёс гипоксию в период изъятия и транспортировки, а перед этим стресс и предсмертный эндотоксикоз донора, после пересадки попадает не в самые лучшие условия внутренней среды нового хозяина, что делает проблематичным его адекватное функционирование на новом месте. И.Н.Соловьёва и соавт. (2004, 2005) отмечали, что содержание токсинов среднемолекулярной массы и малонового диальдегида и до операции были выше нормальных величин и они продолжали нарастать по ходу операции, достигая максимума через 1 час после пуска кровотока в трансплантате (почке). Поэтому представляется актуальной эфферентная терапия и детоксикация реципиента в предоперационном периоде, а в идеале и донора перед изъятием у него органа. Целесообразна эфферентная терапия и в послеоперационном периоде для санации внутренней среды от интраоперационных стрессорных агентов, что должно облегчить «включение» пересаженного органа [CochatPetal., 1993; Соловьева И.Н., Рагимов А.А., 2000]. Плазмаферез в объёме 1 ОЦП в ближайшие 2-3 часа после включения в кровоток пересаженной почки снижал уровень средних молекул на 25% ниже дооперационного уровня, предотвращал олигоанурию, необходимость гемодиализа, способствовал более быстрой нормализации креатинина и повышал актуарную выживаемость трансплантатов [Каабак М.М. и др., 2002, 2012; Соловьёва И.Н., и др., 2004, 2007; Синютин А.А. и др., 2011]. Плазмаферез, проведенный сразу после трансплантации печени, также предотвращал её дисфункции [MandalA.K. etal., 2000]. Такая же тактика интра- и послеоперационного плазмафереза была использована и при пересадке сердца в условиях высокого содержания реактивных антител и тканевой несовместимости [LickS.D. etal., 2008].
Э.Г.Мосешвили и соавт. (2007) удалось купировать острое отторжение, наступившее через 10 дней после трансплантации почки, использовав анти CD3 мышиные моноклональные антитела в сочетании с интенсивным курсом плазмафереза (7 сеансов с удалением до 2,5-3 л плазмы за одну процедуру).
В настоящее время оптимальной тактикой предотвращения отторжения трансплантата считается сочетание плазмафереза с внутривенным введением иммуноглобулинов (иногда с добавлением ретуксимаба) [CruzadoJ.M. etal., 2009; KamarN. etal., 2009; LefaucheurC. etal., 2009; NairR. etal., 2009; ReichmanT.W. etal., 2009; SaitoS. etal., 2009; ShimizuT. etal., 2010]. Наряду с плазмаферезом, находит применение и иммуноадсорбция [RummelS. etal., 2012, 2013]. Каскадный плазмаферез представляется наиболее эффективным и безопасным методом лечения кризов острого отторжения пересаженного органа [Ватазин А.В. и др., 2013].
В.И.Шумаков и соавт. (1997) считали, что нарушения функции трансплантата в раннем послеоперационном периоде обусловлены гипоксией в течение консервации, иммунологическим конфликтом, развитием внутрисосудистого свёртывания крови и нарушениями микроциркуляции в пересаженном органе, чреватыми его функциональной несостоятельностью. Поэтому у 11 высокосенсибилизированных больных с высоким титром антител при повторной трансплантации почки непосредственно перед её пересадкой интраоперационно было элиминировано 30-40% ОЦП и 40-50% ОЦП при включении трансплантата в кровоток (замещение удалённой плазмы проводилось альбумином и свежезамороженной плазмой). Во всех случаях трансплантат начинал нормально функционировать ещё на операционном столе с нормализацией уровней креатинина и мочевины на 3-4 день и без кризов отторжения. При необходимости повторные сеансы плазмафереза проводились и в разные сроки послеоперационного периода [Морозов Б.Н. и др., 1999; AkalinE. etal., 2008]. Одному из таких больных программный плазмаферез успешно проводился в течение трёх лет с интервалами через 4 месяца [Морозов Б.Н. и др., 2001]. При этом плазмаферез не вызывал снижения концентрации циклоспорина А, что позволяло не изменять его дозировки в течение эфферентной терапии [Рагимов А.А. и др., 2001].
Такая превентивная эфферентная терапия особенно актуальна и при пересадке лёгких. Во-первых, донорское лёгкое в принципе не может быть «нормальным», поскольку к моменту констатации смерти у донора должен развиваться такой эндотоксикоз, который не может не привести к развитию в его лёгких явлений респираторного дистресса, а ишемия и гипоксия в момент извлечения органа и его транспортировки не могут не добавить дополнительных повреждений. Это было показано в работах сотрудников лаборатории экспериментальной патологии ВНИИ пульмонологии Е.Н. Данилова, Г.М. Кудряшова и Е.Д.Шехунова ещё в 1980-1990-х годах. Кроме того, по мере нарастания срока ишемии лёгочной ткани возрастает выброс таких токсичных субстанций, как «большой комплекс гистосовместимости» II класса, а в бронхоальвеолярной лаважной жидкости возрастает содержание интерлейкина-2 и интерферона-g, что значительно увеличивает риск отторжения [SerrickC. etal., 1997].
Во-вторых, сразу после пересадки и включения в кровоток на него обрушиваются патологические метаболиты реципиента, длительно находившегося в состоянии тяжёлой дыхательной недостаточности, вместе с интраоперационными БАВ. Всё это также требует детоксикации в самом раннем послеоперационном, а может быть даже и интраоперационном периоде. Это подтверждает тот факт, что практически во всех случаях пересадки лёгких в ГНЦ пульмонологии (Санкт-Петербург) развивались явления респираторного дистресс-синдрома, явившиеся в конечном итоге основными причинами танатогенеза и неблагоприятных исходов операций.
Риск острой реакции отторжения пересаженного лёгкого в течение первого года составляет 55% [MartinuT. etal., 2009]. Если же пересаженное лёгкое и избежит реакции отторжения, то у значительного числа (до 60-80%) таких больных развивается прогрессирующий облитерирующий бронхиолит, представляющий не менее трудноразрешимую проблему [ShreeniwasR. etal., 1996; HirschJ. etal., 1999]. Он выявляется по снижению объёма форсированного выдоха за 1 секунду до уровня менее 80% по сравнению с ранним (базовым) посттрансплантационным периодом. Этот синдром можно считать разновидностью хронической реакции отторжения. Он характеризуется прогрессирующим фибропролиферативным процессом laminapropria стенки бронха с сужением просвета последнего [JaramilloA. etal., 1999, 2005; BelperioJ.A. etal., 2009]. M.A.Smith и соавт. (1998) пришли к выводу, что облитерирующий бронхиолит, возникающий в течение первых двух лет после трансплантации лёгких, является результатом аутоиммунных процессов, в которых антитела к HLA (humanleukocyteantigen) и цитомегаловирусу играют ведущую роль. Это было выявлено у серонегативных (по цитомегаловирусу) реципиентов, которым пересаживались лёгкие от серопозитивных доноров. Проведение плазмафереза с последующим введением иммуноглобулинов или ритуксимаба позволяет не только предотвратить кризы отторжения, но и предотвратить формирование облитерирующего бронхиолита [BittnerH.B. etal., 2001; MartinuT. etal., 2009, 2010; GlanvilleA.R., 2010].
Обнадёживающие результаты если не излечения, то, по меньшей мере, задержки прогрессирования обструктивного процесса в бронхах получены с помощью фотофереза, когда после приёма внутрь препарата метоксалена в дозе 1 мг/кг для достижения концентрации в плазме крови более 50 мг/дл, 90 минут спустя проводился лейкаферез с экстракорпоральным облучением тонкого слоя лейкоцитов длинноволновыми ультрафиолетовыми лучами и последующей реинфузией этих лейкоцитов. Подобные процедуры проводились 1-2 раза в месяц до стабилизации явлений облитерирующего альвеолита [O’HagonA.R. etal., 1996, 1999;]. M.L.Barr и соавт. (1998) и C.T. Salerno с соавт. (1999) использовали иную методику фотофереза, когда кровь больного извлекалась и разделялась на безлейкоцитарную эритромассу, которая сразу возвращалась пациенту, и лейко-обогащённую плазму, которая подвергалась ультрафиолетовому облучению в присутствии экстракорпорально добавленных растворов метоксалена или 8-метоксипсоралена. Последние являются фотоактивными и ковалентно связываются с пиридиновыми основаниями молекул мембран и цитоплазмы лейкоцитов, что приводит к летальному их повреждению. Эти клетки затем реинфузируются пациенту и погибают в течение 1-2 недель, однако в течение этого интервала они стимулируют аутосупрессорную реакцию, частично направленную против Т-клеток, но повреждающую и необлучённые клоны Т-клеток. Использование такого метода позволило снизить частоту как кризов отторжения, так и инфекционных осложнений.
M.L. del Rosario исоавт. (1999) также проводили облучение выделенных из венозной крови мононуклеаров ультрафиолетовыми средневолновыми лучами дозой 1,2 Дж/см2 в открытом полипропиленовом контейнере, содержащем суспензию клеток толщиной 1 мм. Данная процедура проводилась без использования фотоактиваторов. Такая процедура способствовала подавлению выделения цитокинов облучёнными клетками, снижению образования мембрано-клеточных белков, таких как антигены большого комплекса гистосовместимости класса II и молекул клеточной адгезии, снижению их антигенности. Возврат этих лимфоцитов увеличивал толерантность организма к пересаженным клеткам костного мозга.
Конечно было бы заманчиво таким образом воздействовать на специфические Т-клетки, повреждающие трансплантат, однако такая реакция не является селективной и возможное летальное повреждение при ультрафиолетовом облучении остальных клонов лимфоцитов может привести к самым непредсказуемым последствиям для организма в целом. Кроме того, при фотоферезе не удаляются уже сформированные аутоантитела, что делает эту процедуру неполноценной. Поэтому самым безопасным и элементарно простым методом борьбы с аутоиммунными реакциями при трансплантации остаётся обычный неселективный плазмаферез, выводящий постепенно формируемые аутоантитела.
v-plasmapheresis.com
Многие кожные заболевания называются «кожными» только по видимым симптомам болезни. Во всех таких случаях истинные патогенетические механизмы их развития находятся внутри организма. Как правило, аутоиммунные, аллергические или токсико-аллергические расстройства являются причинами их появления. И во всех этих случаях эфферентная терапия должна играть ведущую роль в их лечении.
Читать подробнее Клиническое использование экстракорпоральных методов лечения: Эфферентная терапия. Плазмаферез в широком диапазоне заболеваний.Эфферентная терапия находит всё более широкое применение в клинической практике. Многие заболевания человека сопровождаются нарушениями состава внутренней среды, которые во многом определяют тяжесть течения болезни и даже являются основными причинами неблагоприятных исходов, несмотря на использование самых современных медикаментозных средств или хирургических вмешательств. Такие проблемы возникают при острых воспалительных заболеваниях органов грудной и брюшной полостей, тяжёлых травмах и ожогах, отравлениях и инфекционных болезнях когда развивается синдром эндогенной интоксикации с вторичным подавлением системы иммунной защиты. Развивается своего рода «иммунный дистресс синдром».
Читать подробнее Эфферентная терапия резус-конфликтной беременности и гемолитической болезни плода и новорожденногоНесмотря на внедрение анти-Д иммунопрофилактики резус-изосенсибилизации беременных, эта проблема остается актуальной. Целями настоящего исследования было сравнение эффективности плазмафереза и заменного переливания крови у новорожденных в снижении уровней непрямого билирубина и внеэритроцитарного гемоглобина, а также изучение возможности плазмафереза во время беременности для предотвращения гемолитической болезни плода и новорожденного (ГБПН).Последующие клинические и лабораторные исследования показали, что плазмаферез более эффективен и безопасен, чем заменное переливание крови в лечении ГБПН, а проведение плазмафереза во время.
Читать подробнее Плазмаферез в лечении острого панкреатитаВ статье приведен анализ причин развития деструктивного панкреатита. Подчеркивается ведущая роль эндотоксикоза в прогрессировании поражения поджелудочной железы и необходимость проведения детоксикации при появлении первых признаков острого панкреатита.Несмотря на совершенствование хирургических методов лечения с использованием новейших антипротеазных средств, лечение острого панкреатита по-прежнему представляет трудную проблему и сопровождается достаточно высокой летальностью. Во многом этозависит от того, что это заболевание протекает на фоне тяжелого эндотоксикоза на почве резкого повышения уровня протеолитических ферментов и возрастания вследствие этого содержания веществ среднемолекулярной массы, активизации процессов перекисного окисления липидов с подавлением системы антиоксидантной защиты. При этом печеньпервая принимает на себя основной удар энзимов, вымываемых в кровь из поджелудочной железы, до какого-то момента сохраняя способность их инактивации, а затем наступает поражение и детоксикация ее функций, что и определяет переход к декомпенсированнойфазе эндотоксикоза, нарастает уровень трансфераз, фенола, аммиака, жирных кислот и других токсичных метаболитов. Может присоединиться респираторный дистресс-синдром, представляющий собой токсический отек легких с развитием тяжелой паренхиматозной дыхательной недостаточности.
Читать подробнее Невынашивание беременности, бесплодие и возможности эфферентной терапииПроблема невынашивания беременности является одной из самых актуальных проблем акушерства. Частота его составляет 15-20% всех случаев беременности, а частота бесплодия – в 5-11% браков [Коньков Д.Г. и др., 2008]. У 30-40% из них выкидыши остаются «необъяснимыми» [KuttehW.H. etal., 1999].
Среди этиологических факторов отмечаются анатомические аномалии женской половой сферы, хромосомная патология, инфекционные заболевания, нейроэндокринная патология, антифосфолипидный синдром. Мы коснёмся лишь тех, в ликвидации которых может быть использована эфферентная терапия.
Читать подробнее Плазмаферез в лечении интерстициальных заболеваний легкихВ патогенезе многих видов интерстициальных заболеваний лёгких решающую роль играют расстройства иммунной системы, в основе которых лежит накопление аутоантител. Присоединение комплемента к комплексу антиген + антитело формирует более стойкий иммунный комплекс, который может на длительный период времени задерживаться в циркуляции, называясь циркулирующий иммунный комплекс (ЦИК). В дальнейшем такие комплексы, попадая в органы ретикулоэндотелиальной системы, должны подвергаться деградации и элиминации с помощью макрофагов. Если же в результате сбоя какого-то из этих механизмов процесс разрушения и элиминации ЦИК нарушается, то содержание их начинает возрастать, они проникают в ткани, в том числе и лёгкие, возбуждая там целый каскад патологических расстройств. Привлекаемые в ткани лимфоциты выделяют целый ряд высокотоксичных цитокинов. Возникает асептическое иммунное воспаление с развитием гранулематоза, фиброзирования или, наоборот, разрушения эластического каркаса лёгких. В зависимости от характера этих реакций и формируются определённые заболевания, объединяемые терминами аутоиммунных или иммунокомплексных заболеваний (1,2).
Читать подробнее Плазмаферез при антифосфолипидном синдромеТромбозы глубоких вен и тромбоэмболии легочной артерии, артериальные окклюзии с нарушениями кровообращения в коронарных, мозговых и периферических сосудах, а также привычные выкидыши часто связаны с первичным повреждением стенок сосудов антифосфолипидными антителами. Во всех этих случаях плазмаферез предупреждает прогрессирование этих заболеваний.В последние годы усиливается интерес к аутоиммунной сосудистой патологии, проявляющейся развитием рецидивирующих тромбозов в венозной и артериальной системах различных органов. Частота тромбоэмболий легочных артерий (ТЭЛА) в результате тромбозов глубоких вен достигает 500 000 случаев в год, значительная часть которых заканчивается летальным исходом. Коварство этих осложнений заключается в почти полностью бессимптомном течении до самого момента тромбоэмболии у 50% больных [38]. Тромбозы глубоких вен нередко (до 29%) развиваются и в постоперационный период, а после операций по поводу злокачественных новообразований их частота достигает 66% [18]. Нельзя исключить и первичного тромбоза артерий малого круга in situ, сопровождающегося постепенным нарастанием давления в легочной артерии с развитием так называемой хронической ТЭЛА [3].
Читать подробнее Аутоимунные болезни и эфферентная терапияВ обзоре представлены причины и всё многообразие аутоиммунных заболеваний, способы медикаментозной терапии. Описаны возможности эфферентной терапии, целесообразность и необходимость ее включения в схемы лечения аутоиммунной патологии.За последние четыре десятилетия возросло понимание, что многие болезни человека связаны, по крайней мере отчасти, с расстройствами иммунной системы, которая вместо присущей ейфункции защиты здоровья и самой жизни организма допускает саморазрушающие иммунные процессы. Свидетельств, подтверждающих аутоиммунную концепцию, сейчас множество. Хорошо известны и триггеры, провоцирующие эти процессы, – такие как инфекции, пищевые продукты и даже лекарства. Антитела и лимфоциты у больных показывают ре-акции со специфическими структурами организма, такими как ядра клеток и рецепторы, или тканями, такими как коллаген или мышцы.
Читать подробнее Респираторный дистресс синдромОстрые поражения респираторной паренхимы лёгких являются нередким и тяжёлым осложнением целого ряда заболеваний. В первую очередь речь идёт о вирусно-бактериальной пневмонии, которая порой принимает злокачественное течение и сопровождается массивным, иногда тотальным, двусторонним поражением респираторной паренхимы с тяжёлой труднокорригируемой дыхательной недостаточностью, которая в течение нескольких дней, а иногда и часов, может привести к летальному исходу. На таком фоне могут развиваться деструктивные процессы и даже гангрена лёгких.
Следующую группу представляют острые поражения лёгких, объединённые термином "шоковые лёгкие", развивающиеся у больных с тяжёлой травмой, перенесших оперативные вмешательства, в том числе и с искусственным кровообращением на открытом сердце (постперфузионный лёгочный синдром), геморрагический, септический или анафилактический шок, массивные гемотрансфузии (синдром "гомологичной крови"), лептоспироз и даже малярия с общей летальностью 57% [BhadadeR.R. etal., 2011].
Читать подробнее Экология и беременностьНа течение беременности и развитие плода оказывают влияние многие факторы, в том числе и расстройства окружающей среды. Многие токсичные соединения имеют гонадотропные, тератогенные и эмбриотоксические свойства. Не меньшие опасности таят и обычные лекарственные препараты, принимаемые во время беременности. Во всех этих случаях, особенно когда невозможно предотвратить их поступление в организм, необходимы меры детоксикации, в том числе и превентивные и даже ещё до наступления беременности. Наилучшим образом это достигается с помощью плазмафереза.
Читать подробнее Преждевременное старение можно предупредитьЧеловеческую жизнь можно распределить на периоды такие же, как на футболе –
Первый Тайм – 40 лет
Второй тайм – только 20 лет!
А дальше – «Дополнительное время»,
которое «высший Судия» - предоставит его тебе или урежет.
Читать подробнее Плазмаферез при хронических гепатитахПредставлен анализ литературы по механизмам развития хронических гепатитов, как вирусной, так и токсической природы, основанных на базе аутоиммунных процессов. Показано обоснование использования плазмафереза в лечении этих заболеваний.
Читать подробнее Мембранный плазмаферез в лечении туберкулезаЭфферентная терапия находит всё более широкое применение в клинической практике. Многие заболевания человека сопровождаются нарушениями состава внутренней среды, которые во многом определяют тяжесть течения болезни и даже являются основными причинами неблагоприятных исходов, несмотря на использование самых современных медикаментозных средств или хирургических вмешательств. Такие проблемы возникают при острых воспалительных заболеваниях органов грудной и брюшной полостей, тяжёлых травмах и ожогах, отравлениях и инфекционных болезнях, когда развивается синдром эндогенной интоксикации с вторичным подавлением системы иммунной защиты. Развивается своего рода «иммунный дистресс синдром».
Читать подробнее Плазмаферез в трансплантологииПроблема пересадки органов всё ещё далеки от своего разрешения. До сих для устранения как острого, так и хронического отторжения пересаженных органов используются медикаменты со многими побочными осложнениями. В то же время, методы эфферентной терапии, направленные на выведение из организма антител, не получили достаточно должного и своевременного применения. Среди них ведущее значение имеет плазмаферез.
Читать подробнее Нарушения активности сурфактанта и возможности их коррекции при острых поражениях легкихПроведенные клинико-экспериментальные исследования доказали природу нарушений активности сурфактанта при острых поражениях лёгких в результате проникновения в альвеолу токсичных веществ из кровотока вследствие токсической порозности лёгочных сосудов. Предполагается, что в этом заключается причина инактивации и экзогенного сурфактанта. При этом патогенетически обоснованным является проведение детоксикации, купирующей токсический отёк лёгких без помощи экзогенного сурфактанта.
Читать подробнее Эфферентная терапия в коррекции возрастных расстройств эндоэкологии человекаВ статье обсуждаются вопросы возрастных расстройств эндоэкологии человека и аутоиммунных механизмов старения человека, приводящих к накоплению различных аутоантител и других токсичных метаболитов, повреждающих основные органы и ткани организма. Самостоятельно удалить такие крупные молекулы организм не в состоянии. С целью нормализации внутренней среды человека и профилактики преждевременного старения обосновывается необходимость использования методов удаления таких крупномолекулярных веществ с помощью плазмафереза.
Читать подробнее Мембранный плазмаферез в спортивной медицинеНагрузки «большого спорта» не всегда самым благоприятным образом сказываются на состоянии здоровья спортсменов, а значит и на их спортивных достижениях. Имеют значение не только систематические, но и кратковременные перегрузки при тренировках или соревнованиях. В частности, в тренировочном периоде у конькобежцев и пловцов концентрация фактора некроза опухоли (ФНОα) возрастала в 50-100 раз, что превышает уровень этого цитокина у больных с септическим шоком.
Читать подробнее Синдром "скрытых" генитальных инфекций в акушерстве с позиции эфферентной терапииРазвитию плода угрожает опасность внутриутробного инфицирования при наличии у беременной синдрома скрытых урогенитальных инфекций - хламидиоза, микоплазмоза, уреаплазмоза, токсоплазмоза, гарднереллёза, поражений вирусами герпеса и цитомегаловируса.
В течение жизни женщин до беременности эти инфекции могут не вызывать существенных расстройств и проявляться периодическими обострениями цистита, аднексита, кольпита. Однако во время беременности главная опасность угрожает плоду, вызывая пороки и нарушения его развития, вплоть до прерывания беременности на ранних сроках (т.е., фактически бесплодие), преждевременных родов и даже внутриутробной гибели плода. Однако и родившийся живым, ребёнок имеет признаки внутриутробной и постнатальной инфекции (45%), морфо-функциональной незрелости и задержки внутриутробного развития (18%), серьёзных нарушений функций головного мозга (23%), печени, почек, лёгких [3]
Читать подробнее Плазмаферез при проведении лучевой терапии рака поджелудочной железыВ последние десятилетия отмечается увеличение заболеваемости раком поджелудочной железы (РПЖ). С 1940 года частота РПЖ увеличилась в 4 раза, достигнув 11 на 100 тыс. населения. В США РПЖ занимает четвёртое место среди всех причин смерти от раковых заболеваний, унося ежегодно более 20 тыс. человек. В России заболеваемость РПЖ в 1995 году составила 8,6 на 100 тыс. населения, а в Москве - 11,4. На карциному поджелудочной железы приходится 10% всех опухолей пищеварительного тракта.
Радикальное лечение возможно только у 10-15% пациентов. Большинство больных (до 90%) умирают в течение года после установления диагноза. В 80-85% случаев РПЖ диагностируется на стадии, когда уже имеется внеорганное распространение опухоли, а в 40% - отдалённые метастазы.
Читать подробнее Экстракорпоральная гемокоррекция у больных облитерирующими заболеваниями артерий нижних конечностей и оценка ее эффективностиСердечно-сосудистые заболевания в наше время стали самыми распространенными, смертность от них занимает первое место среди всех причин. Более 50% в структуре общей смертности занимает ИБС, а облитерирующими заболеваниями нижних конечностей страдает около 3% населения; при этом в последнее время наблюдается тенденция «омоложения» этого заболевания: резко возросло число больных, не достигших 50-летнего возраста, что приводит к ранней инвалидизации трудоспособного населения. Уровень заболеваемости генерализованным атеросклерозом остается высоким и не снижается. От инфарктов, инсультов, гангрены атеросклеротической природы погибает около 51% взрослого населения. Лечение больных с различной локализацией атеросклероза, их реабилитация, социальное обеспечение создают тяжелые проблемы для общества.
Читать подробнее Плазмаферез в нефрологииПрактически все хронические заболевания почек в той или иной степени связаны с расстройствами состава внутренней среды, главным образом аутоиммунной природы. Медикаментозная терапия далеко не всегда эффективна и может приводить к дополнительным расстройствам. Патогенетически обоснованным является использование плазмафереза.
Читать подробнее Мембранный плазмаферез в неонатологииКритические состояния в неонатологии во многом зависят от таких осложнений течения беременности, как преэклампсия, резус-конфликты, внутриутробная инфекция, особенно при недоношенности. Во многом это является результатом накопления различных токсичных веществ в циркуляции плода. При этом происходит повышенная проницаемость сосудов с развитием токсического отёка лёгких, являющегося главной причиной респираторного дистресса новорождённых, развивающегося по «взрослому типу». Токсичные продукты, проникающие в альвеолу, разрушают и сурфактант. Экзогенный сурфактант в таких случаях подвергается такому же разрушению. Наиболее патогенетически обоснованным при этом является детоксикация, наилучшим способом которой является плазмообмен с применением метода шприцевого мембранного плазмафереза. Прекращение поступления токсичных веществ в альвеолу способствует восстановлению и сурфактанта.
Читать подробнее Эфферентная терапия нервных болезнейРяд тяжёлых нервных прогрессирующих заболеваний имеют в своей основе аутоиммунный патогенез, который считается существенным при злокачественной миастении, миастеническом синдроме Ламберт-Итона, синдроме Гийена-Барре, IgM-моноклональной демиелинизирующей полинейропатии, хронической воспалительной демиелинизирующей полинейропатии, мультифокальной моторной нейропатии, рассеянном склерозе, воспалительных миопатиях, синдроме мышечного гипертонуса, аутоиммунной нейромиотонии, паранеопластической нейропатии и мозжечковой дегенерации, нервных болезнях, связанных с системными васкулитами и вирусной инфекцией. При этих заболеваниях аутоантитела воздействуют на глиальные клетки, миелин, аксоны, кальциевые каналы, мышцы [DalakasM.C., 1995].
Читать подробнее Место мембранного плазмафереза в наркологииРазличные формы наркологической зависимости и алкоголизма имеют всё большее распространение, в то время как практически не существует надёжных методов их лечения. Удаление из организма накапливающихся токсичных метаболитов с помощью лечебного афереза способно облегчить последующее излечение таких больных.
В основе заболеваний этого профиля лежит психологическая зависимость - привыкание к алкоголю, наркотикам или некоторым фармакологическим или токсическим веществам (токсикомания). Однако в организме при этом возникают и своеобразные нарушения метаболических процессов, нормальное течение которых делается невозможным без включения соответствующих веществ или их дериватов. Лишение их вызывает тяжёлые абстинентные синдромы, нередко заканчивающиеся летально. Во всех случаях налицо тяжёлые психические расстройства – галлюцинации, бред, фобические состояния, часто толкающие этих лиц на преступления.
Читать подробнее Метаболический синдром и эфферентная терапияМетаболический синдром сочетает фактор инсулинорезистентности с развитием сахарного диабета, артериальной гипертензии и ожирения. Сопровождается накоплением различных патологических продуктов, нарушающих микроциркуляцию и кровообращение в сосудах сердца, головного мозга, почек, глазного дна и периферических артерий. Медикаментозная терапия далеко не всегда в состоянии ликвидировать такие осложнения и на первый план выходит эфферентная терапия, главным образом плазмаферез.
Ключевые слова: Метаболический синдром, сахарный диабет, расстройства кровообращения, плазмаферез.
Читать подробнее Эфферентная терапия при малярииВ настоящее время, как и 150 лет назад, малярия остаётся одним из самых распространённых заболеваний в мире, поражая каждый год до 500 млн человек. Из четырёх видов малярии тропическая (ТМ) характеризуется наиболее тяжёлым течением, а смертельные случаи по её причине составляют 98% всех летальных исходов от малярии [1]. В Индии малярия приводит к гибели свыше 15.000 детей в год [2], а в странах тропической Африки – свыше 200.000 детей [3].
Тяжесть клинического течения тропической малярии (ТМ) обусловлена многими причинами, в том числе наличием особо токсических факторов (например цитотоксическая субстанция Мегрета) у этого вида плазмодиев (Plasmodiumfalciparum), проявлением тканевой анафилаксии, часто связанной с более выраженными иммунореактивными свойствами продуктов жизнедеятельности этого вида плазмодия. Высвобождающиеся в кровь вещества активируют макрофаги и приводят к выбросу ими провоспалительных цитокинов (ФНОα, ИЛ1β, ИЛ2), определяющих тяжесть эндотоксикоза.
Читать подробнее Эфферентная терапия в лечении и профилактике лучевой болезниХорошо известно, что острая лучевая болезнь характеризуется тяжёлым интоксикационным синдромом и именно эти токсичныеперекисные и свободнорадикальные вещества ставят последнюю точку в наступлении фатального исхода. Поэтому применение на самых ранних этапах лучевого поражения эфферентной терапии, направленной на выведение из организма этих токсичных веществ, может во многом сгладить течение патологических процессов.
Развитие вторичных инфекционных и геморрагических осложнений выдвигают новые показания для детоксикации. Подавление защитных иммунных механизмов ставит показания для заместительной терапии - обменного плазмафереза, который позволяет одновременно выводить токсичную собственную плазму с некомпетентными компонентами иммунной системы и замещать её нативной донорской плазмой, несущей все элементы гуморального иммунитета.
Читать подробнее Мембранный плазмаферез. Краткая инструкция.Многие заболевания глаз имеют аутоиммунную природу и сопровождаются накоплением как аутоантител, так и других патологических метаболитов, большие размеры молекул которых не позволяют их выводить почками с нарушением и процессов их деструкции. Удаление их возможно только вместе с жидкой частью крови – плазы в процессе плазмафереза, который позволяет лечить такие заболевания более эффективно.
Читать подробнее Эфферентная терапия при инфекционных болезняхПо данным ВОЗ в мире от инфекционных заболеваний ежедневно погибают до 16 миллионов человек. В России каждый год регистрируются 30-50 млн инфекционных заболеваний. Из них 10-12% нуждаются в интенсивной терапии в результате развития инфекционного токсического шока, токсической энцефалопатии и поражений других жизненно важных органов, причём наилучшие результаты достигаются при наличии интенсивного лечения ещё до развития критического состояния [PokrovskyV.I., 2005].
Практически нет инфекционных заболеваний, не сопровождающихся значительной интоксикацией, причём, обычно она и определяет тяжесть состояния, являясь основным механизмом танатогенеза, существенно влияя на общий исход заболевания. Структура эндотоксикоза складывается из бактериальных эндо- и экзотоксинов, поступающих в циркуляцию продуктов воспаления и тканевой деструкции из первичных очагов воспаления, вторичных метаболических расстройств, таких же, как и упоминавшиеся выше при описании септических осложнений.
Читать подробнее Плазмаферез в лечении атеросклерозаАтеросклероз это, пожалуй, наиболее частое и тяжёлое заболевание человека. Он сопровождается сосудистыми расстройствами, основными причинами которых являются нарушения липидного обмена, выражающиеся в накоплении липопротеидов низкой и очень низкой плотности, холестерина, триглицеридов при снижении содержания антиатерогенного фактора – липопротеидов высокой плотности. Все дальнейшие последствия – отложения атеросклеротических бляшек в стенках сосудов с сужением их просвета достаточно хорошо известны, также как и главные их проявления: сужение коронарных сосудов - ишемическая болезнь сердца, сужение мозговых сосудов с нарушениями мозгового кровообращения, сужение периферических сосудов, приводящее к гангрене конечностей.
Читать подробнее Синдром "Диабетической стопы"В обзоре рассматриваются особенности патогенеза сахарного диабета, способствующие нарушениям кровообращения периферических сосудов с развитием критической ишемии и гангрены стопы. При этом медикаментозная терапия и даже операции реваскуляризации не всегда в состоянии предотвратить ампутацию не только стопы, но и голени и даже бедра. С помощью плазмафереза можно улучшить периферическое кровообращение и ограничить уровень ампутации.
Читать подробнее Эфферентная терапия в акушерстве и неонатологииЗдоровье человека закладывается ещё в периоде его внутриутробного развития. Многие исследователи в своих работах указывают на связь различных заболеваний у детей, особенно таких как аллергии (в том числе нейродермит, бронхиальная астма), хронический бронхит, болезни почек, с нарушениями течения беременности их матерей. В акушерстве имеет значение не только обеспечение оптимальных условий и безопасности самих родов, но и создание благоприятных условий развития плода на всём протяжении беременности. Несмотря на все достижения современного здравоохранения, до сих пор сохраняется достаточно высокий уровень угрозы прерывания беременности и преждевременных родов, перинатальной заболеваемости и смертности. Всё это и явилось основанием для проведенного исследования причин и патогенеза основных осложнений беременности, разработки мер их профилактики и лечения.
Читать подробнее Эфферентная терапия в геронтологииНе подлежит сомнению, что биологически предопределённый возраст человека составляет не менее 110 лет, а по некоторым данным должен достигать 150 лет, хотя в действительности средняя продолжительность жизни не превышает и половины этого срока. Был ли когда-либо тот золотой век человечества, когда люди доживали до такого возраста, как об этом свидетельствуют библейские источники, сказать трудно. С другой стороны, имеются свидетельства, что древний человек жил в среднем около 40 лет.
Конечно болезни, травмы мирного и военного времени значительно укорачивают период жизни. Однако если человек в течение жизни и избежит каких-либо болезней и травм, то всё равно он неминуемо умирает "от старости". Но почему в одних случаях эта "старость" уносит 60-летних, а в других щадит 90-летних? Что лежит в основе старения?
Многие авторы, затрагивающие эти вопросы, ограничиваются лишь указаниями на зашлачивание организма в течение жизни, своего рода его самоотравление. Каковы же механизмы последующих расстройств? Как ведёт себя иммунная система - наш главный страж Здоровья, от которой во многом зависит качество нашей жизни?
Читать подробнее Плазмаферез в профилактике поражений почек у лиц пожилого возрастаС возрастом увеличивается риск развития поражений почек, связанных с расстройствами биохимического и иммунного гомеостаза. В частности, нарастает количество больных, страдающим метаболическим синдромом с расстройствами липидного обмена, артериальной гипертензией и сахарным диабетом 2 типа. Всё это сопровождается развитием диабетической нефропатии, которая нередко достигает тяжёлой степени, требующей гемодиализа. Несмотря на поддержание уровня сахара в крови, при этом происходит повреждение эндотелия микрососудов накапливающимися веществами, не поддающимися медикаментозной терапии. С другой стороны, возникают сосудистые расстройства, развивающиеся вследствие атеросклероза с сужением просветов сосудов, в том числе и почечных, также далеко не всегда поддаются медикаментозной терапии, а операции шунтирования или стентирования коронарных сосудов не могут быть использованы для коррекции почечных сосудов. Нередки отложения амилоида в межклеточных пространствах, в том числе и образование так называемых старческих бляшек, что у 60% пожилых представляется характерным признаком старости. Всё это сопровождается и картиной амилоидоза почек. С возрастом нарастают и аутоиммунные расстройства, сопровождающиеся системными поражениями различных органов, в том числе и почек. Особенно это касается различных видов системных васкулитов, затрагивающих и сосуды почек. Характерным для старческого возраста является появление признаков парапротеинемии с накоплением моноклональных М-компонентов иммуноглобулинов, напоминающих теперь уже миеломную болезнь. Нарастает содержание и криоглобулинов. Всё это в значительной степени нарушает микроциркуляцию, в том числе и на уровне клубочков.
Читать подробнее Плазмаферез в ветеринарииА. По видам животных: исходя из анатомических и физиологических особенностей строения наиболее востребованным предполагаю использовать аппарат при лечении собак и лошадей, в меньшей степени кошек и др. мелких домашних животных (объем циркулирующей крови, размеры периферических вен, коммерческая стоимость процедуры и животного)
В. По этиологии заболеваний: инфекционные и паразитарные болезни (снижение интоксикации продуктами воспаления, медикаментами, иммунными комплексами, повышение и ускорение процента выздоровления ,пироплазмоз, гемобартенелез, парвовирусный энтерит,). Внутренние не заразные заболевания: часто возникающие в связи с не правильным содержанием и кормление животных ( различного рода аллергические дерматиты , атопии, хронически и острые нарушения работы печени и почек у собак, породные, генетически передающиеся заболевания, "лихорадка шарпея", порто-ковальный шунт йоркширских терьеров, ревматоидные поражения копыт и хронические обструктивные заболевания у лошадей) Хирургические заболевания (снижение интоксикации вызванной состоянием и наркозом,снижение риска возникновения послеоперационной острой почечной недостаточности, пиометра,заворот желудка,закупорки кишечника)
Читать подробнее Плазмаферез в лечении антифосфолипидного синдромаРазвитие многих заболеваний связано с различными аутоиммунными процессами и, в том числе, с большой группой антифосфолипидных антител. От них зависят многие сосудистые заболевания, ранние инфаркты и инсульты, тромбоэмболия лёгочной артерию. Кроме того, нередкими являются и осложнения течения беременности с привычными выкидышами. Во всех этих случаях стандартная медикаментозная терапия далеко не всегда обеспечивает успех. При этом наиболее патогенетически показанными являются курсы плазмафереза. Ключевые слова: антифосфолипидный синдром, инфаркт, инсульт, тромбоэмболия лёгочной артерии, привычные выкидыши.
Читать подробнее Синдром "скрытых" генитальных инфекций в акушерстве с позиции эфферентной терапииРазвитию плода угрожает опасность внутриутробного инфицирования при наличии у беременной синдрома скрытых урогенитальных инфекций - хламидиоза, микоплазмоза, уреаплазмоза, токсоплазмоза, гарднереллёза, поражений вирусами герпеса и цитомегаловируса.
В течение жизни женщин до беременности эти инфекции могут не вызывать существенных расстройств и проявляться периодическими обострениями цистита, аднексита, кольпита. Однако во время беременности главная опасность угрожает плоду, вызывая пороки и нарушения его развития, вплоть до прерывания беременности на ранних сроках (т.е., фактически бесплодие), преждевременных родов и даже внутриутробной гибели плода. Однако и родившийся живым, ребёнок имеет признаки внутриутробной и постнатальной инфекции (45%), морфо-функциональной незрелости и задержки внутриутробного развития (18%), серьёзных нарушений функций головного мозга (23%), печени, почек, лёгких.
Читать подробнееv-plasmapheresis.com
 Плазмаферез – эффективный метод лечения многих заболеваний. Заключается в очищении крови от токсинов, ядов и болезнетворных микроорганизмов путем удаления ее жидкой части – плазмы.
Плазмаферез – эффективный метод лечения многих заболеваний. Заключается в очищении крови от токсинов, ядов и болезнетворных микроорганизмов путем удаления ее жидкой части – плазмы.
Плазмаферез основан на современных знаниях о составе крови и роли каждого ее компонента. Так, выделяют клетки крови, взвешенные в ней вещества – питательные элементы, особые белки, различную флору, в том числе патогенную – и плазму, или жидкую часть. Каждый элемент в нашей крови – эритроциты, тромбоциты, лейкоциты, белки-альбумины, болезнетворные бактерии и так далее – имеют уникальный вес и объем, а также химические свойства. Суть плазмафереза – в отделении жидкой части крови с взвешенными в ней вредными элементами от основной части.
Плазмаферез прошел долгий путь от ручной процедуры, в ходе которой изымаемая кровь просто отстаивалась для отделения плазмы, до современных и безопасных аппаратных техник.
В ходе плазмафереза у пациента забирается кровь небольшими порциями (около 10 мл за раз), помещается в специальную технику, где методом центрифугирования или через особую мембрану отделяется плазма с вредными веществами. Кровяные тельца, белки крови возвращаются в кровяное русло.
Известно, что организм может восстанавливать определенный объем как плазмы, так и форменных элементов. Поэтому далеко не всегда объем удаленной плазмы стремятся заменить – увеличенная вязкость крови также имеет свой терапевтический эффект. Но в ряде случаев вместе с форменными элементами в кровяное русло добавляют стерильные растворы – таким образом избегают изменения давления.
За одну процедуру удаляют до 30% объема плазмы. Если этого недостаточно, то рекомендуют курс в 2-4 этапа. Одна процедура занимает от 40 минут до полутора часов и при использовании современной аппаратуры является безопасной и безболезненной для пациента.
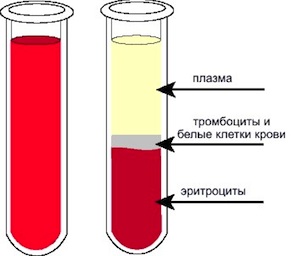
В завсимости от назначения процедуры, различают терапевтический и донорский плазмаферез.
Донорский плазмаферез – одна из форм донорства крови. Переливание плазмы крови эффективно при различных состояниях, когда требуется быстро восполнить жидкость, повысить свертываемость крови – при ожогах, тяжелой кровопотере, септическом шоке.
При донорском плазмаферезе выделенную плазму проверяют на наличие инфекций, специальным образом обрабатывают – замораживают или консервируют.
Терапевтический плазмаферез показан для быстрого устранения из крови различных токсинов и болезнетворных микроорганизмов. Плазмаферез помогает снизить объем ядов, контролировать гормональный и иммунный фон. Используется при различных аутоимунных заболеваниях – для удаления агрессивных антител нашей собственной защитной системы. Плазмаферез действительно незаменим при:
Кроме того, замечена эффективность плазмафереза в лечении более чем 200 заболеваний, среди которых:
Роль плазмафереза в лечении этих заболеваний не до конца потверждена, но в настоящее время ведутся активные исследования. Еще одна область, в которой плазмаферез применяется уже сегодня – это геронтология, или борьба со старением. Очищение крови от токсинов и вредных веществ дает свои результаты – человек чувствует легкость и прилив сил после процедуры. Но роль в замедлении биологических часов плазмафереза неочевидна.
Несмотря на все недостатки, плазмаферез уже сегодня помогает спасать неотложных больных, улучшать качество человеческой жизни. Современная медицина возлагает на этот метод большие надежды, осуществление которых не за горами.
medinfa.ru
Министерство здравоохранения РТ
Государственное Автономное Образовательное учреждение
среднего профессионального образования РТ
“Зеленодольское медицинское училище”/техникум/
Реферат
по дисциплине “Анатомия и физиология человека”
на тему “История донорства”
Выполнила студентка 205 группы
Проверил преподаватель
Яковлева Е.Е.
2013г.
Содержание
Введение
Заключение
Список используемой литературы
Введение
Донорство крови (от лат. donare — «дарить») и (или) её компонентов — добровольная сдача крови и (или) её компонентов донорами, а также мероприятия, направленные на организацию и обеспечение безопасности заготовки крови и её компонентов.
Донорская кровь используется в производстве компонентов крови, лекарственных средств, научно-исследовательских и образовательных целях. Клиническое использование донорской крови и (или) её компонентов связано с трансфузией (переливанием) реципиенту в лечебных целях и созданием запасов донорской крови и (или) её компонентов. Искусственные заменители крови недостаточно эффективны, дороги, имеют серьёзные побочные эффекты и не способны полностью заменить все компоненты и воспроизвести все функции крови в организме, поэтому донорская кровь практически незаменима при переливаниях, которые, как утверждает статистика, делают полутора миллионам россиян ежегодно. Кровь требуется пострадавшим от ожогов и травм, при проведении сложных операций и при тяжёлых родах. Кровь также жизненно необходима больным гемофилией, анемией и онкологическим больным при химиотерапии. Каждый третий житель Земли хоть раз в жизни нуждается в донорской крови...
1. Переливание крови.
Переливание крови, или трансфузия крови на сегодняшний день является универсальным и широко распространенным методом, входящим в комплекс лечебных мероприятий при многих заболеваниях, и, прежде всего, случаях острой кровопотери. Этот метод без преувеличения можно отнести к лечебным мероприятиям века, так как исполнилось ровно сто лет со дня открытия групп крови, которое в значительной мере обезопасило ее переливание. Только за две кровопролитные жесточайшие мировые войны благодаря переливанию крови были спасены десятки миллионов жизней. Вначале кровь использовали в качестве добавок к лекарственным препаратам, назначали ее прием с пищей, использовали в качестве наружного средства для стимуляции заживления ран. Между тем, такое использование крови в серьезных случаях кровопотери не имели должного эффекта. Требовались более быстрые и более мощные методы возмещения утраченной крови. Возможно, мысль о вливании больным крови приходила в голову врачам того времени. Однако для такой простой в техническом отношении манипуляции в то время не было элементарных базовых знаний ни об устройстве человека, ни о функциональном назначении отдельных органов и функциональных систем. В отношении же биологических свойств крови вообще и проблемы совместимости крови реципиента (лица, которому переливают кровь) и донора (лица, от которого переливают кровь) в частности не было даже приблизительных сведений. А, кроме того, отсутствовали даже примитивные инструменты и приспособления, с помощью которых можно было бы осуществить переливание крови. Поэтому к утверждениям об успешных переливаниях крови от животного человеку, якобы осуществленных в III веке до н.э. в Китае, большинство исследователей относится с недоверием.
Должны были пройти века, прежде чем эта процедура стала технически возможной. Лишь с середины XVII века появились достоверные сведения об осуществленных переливаниях крови от животных человеку.
2. История донорства.
История донорства начинается с 12 июня 1667 года, когда во Франции придворный врач Людовика XIV, Жан-Батист Дени, произвёл первую успешную гемотрансфузию, другими словами - переливание крови. Страдавшему сильными психическими расстройствами и измождённому двадцатью кровопусканиями 15-летнему мальчику влили в вену 250 миллилитров крови непосредственно из сонной артерии ягнёнка. Ребёнок выжил и пошёл на поправку. Правда, скоро стало понятно, что это была большая удача: ведь ребёнку ввели не человеческую кровь, а о группах тогда вообще ничего не знали. Дени, в свою очередь, вдохновленный успехами эксперимента, провёл ещё четыре процедуры, которые дали отрицательный результат - скончались все реципиенты (те, которым кровь переливают) и даже некоторые доноры. После такого фиаско переливание крови во Франции и некоторых других европейских странах было запрещено на государственном уровне.
Однако мысль спасти умирающего вливанием ему крови здорового человека не оставляла врачей. 22 декабря 1818 года на заседании Лондонского медико-хирургического общества англичанин Джеймс Бланделл доложил об успешном переливании крови от человека к человеку. Пациент Бланделла, мужчина 35 лет с карциномой желудка, получил переливание 500 мл. крови и даже испытал после процедуры некоторое улучшение. Однако через 52 часа после этого скончался. Доктор Бланделл предложил методику и конструкцию первого аппарата для переливания крови. Консервировать кровь тогда не умели, и все переливания были прямыми. Надо было стараться поскорее «залить в пациента» донорскую кровь, пока она не свернулась. Резину тоже еще не изобрели, и все детали «аппарата» были металлическими. И шприц, и трубки, и воронки. А кровь, также как и сейчас, брали из локтевой вены. И в локтевую вену же переливали.
В 1832 г. петербургский акушер Г. Вольф сделал первое в России переливание крови от человека человеку. Это была роженица, потерявшая большое количество крови. Переливание прошло успешно, и женщина была спасена.
Ситуация с переливанием крови стала находить научное объяснение только в XX веке. Очень важную роль в этом процессе сыграло открытие групп крови, в результате чего были вскрыты причины некоторых посттрансфузионных осложнений, что дало возможность предупредить их. Оказалось, что осложнения при переливании крови животных человеку происходят потому, что сыворотка крови человека склеивает (агглютинирует) и разрушает кровяные тельца животных. Используя эти данные, венский бактериолог К. Ландштейнер (1901 г.) открыл законы склеивания эритроцитов одного человека сывороткой крови другого и установил, что по свойствам крови всё человечество можно разделить на 3 группы: О(I), А(II), В(III). Четвертую группу крови АВ(IV) открыл 1907 году чешский врач Я. Янский, подтвердив наличие остальных трех групп крови, открытых К. Ландштейнером.
С открытием групп крови, её переливание как лечебный метод стал быстро развиваться. Первое переливание с учётом групп совместимости произвёл в 1909 г. американский хирург Дж. Крайл. Это открытие резко сократило число осложнений.
Однако на этом эпохальном открытии поиски новых групп крови не закончились. Они продолжались для объяснения все же встречающихся трансфузионных осложнений. В 1940 году К. Ландштейнером совместно с Александром Винером была открыта чрезвычайно важная система антигенов резус, которая давала большое число посттрансфузионных осложнений.
Резус-фактор — это антиген (белок), который находится на поверхности красных кровяных телец (эритроцитов). Он обнаружен в 1919 г в крови обезьян, а позже — и у людей.
В современной медицине переливаний цельной крови почти не проводится. Чтобы уменьшить риск осложнений реципиентам переливают только те компоненты крови, которые им необходимы.
Подводя итог, мы можем утверждать, что врачами была проведена и до сих пор не может быть остановлена огромная работа направленная на то, чтобы спасение людей методом переливания крови или ее компонентов стало возможным. Вот только их старания будут напрасными, если не будет доноров, тех людей, которые готовы пожертвовать частичкой себя для спасения другого.
Известно, что кровь состоит из плазмы и клеток крови (форменных элементов) – эритроцитов, лейкоцитов и тромбоцитов.
Цельная кровь в наше время переливается очень редко – при переливании пациент получает именно тот компонент, который ему необходим. Для этого каждую полученную дозу цельной крови разделяют на компоненты для обеспечения наиболее целесообразного и эффективного лечения. Таким образом, кровь одного донора может помочь нескольким пациентам! Благодаря техническому прогрессу в настоящее время создались условия, при которых оказалось возможным избирательно получать от человека в течение короткого времени не только цельную кровь, но и любую необходимую в данный момент часть крови.
Аутодонорство — заготовка собственной крови пациента перед последующей плановой операцией. Переливание чужеродной крови является стрессом для организма, а переливание собственной позволяет свести к минимуму негативные эффекты. Применяется также аутоплазма — собственная, заранее заготовленная плазма крови. Её используют при родовспоможении и других операциях.
Процедура забора плазмы крови:
Донорская плазма переливается при сильных ожогах и синдроме длительного сдавления (например, оказавшимся под развалинами зданий при землетрясении).
С помощью специального аппарата (сепаратора) из крови выделяется тромбоцитная масса. Тромбоциты необходимы при проведении интенсивной химиотерапии онкобольных и при других состояниях, сопровождающихся тромбоцитопенией. Процедура заготовки тромбоцитов отличается высокой стоимостью, потому её проводят только от доноров, которые уже не первый раз сдают кровь (для них есть уверенность в отсутствии трансмиссивных инфекций).
Доброволец иммунизируется безопасным штаммом какого-либо инфекционного агента. Плазма, полученная от такого донора, содержит антитела к данному возбудителю и может быть использована для изготовления медицинских препаратов. Иногда она переливается в чистом виде ослабленным больным в профилактических целях или как компонент поливалентной терапии.
Итак, можно с уверенностью говорить, что эта тема «Переливание крови и донорство: история и современность» актуальна в сегодняшнее время. Заболевания, связанные с кровью, все чаще и чаще проявляются в нашем обществе. В связи с этим наше государство старается разрабатывать и реализовывать программы в этой области. Благодаря таким программам, людей, которые хотели бы стать донорами становится все больше и больше.
yaneuch.ru