 (Назад)
(Назад) (Cкачать работу)
(Cкачать работу) (Назад)
(Назад) (Cкачать работу)
(Cкачать работу)
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
8
СодержаниеАзотная кислотастр. 3 Окислительные свойства азотной кислотыстр. 3 Нитратыстр. 6 Промышленное получение азотной кислоты стр. 7 Круговорот азоты в природестр. 8
6. Библиографиястр. 10 1. Азотная кислота. Чистая азотная кислота HNO—бесцветная жидкость плотностью 1,51 г/см при - 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, “дымит”, так как пары ее образуют с 'влагой воздуха мелкие капельки тумана,
Азотная кислота не отличается прочностью, Уже под влиянием света она постепенно разлагается:
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н и- NO.
2. Окислительные свойства азотной кислоты. Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO, ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды.
Концентрированная HNO пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние.
Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО может восстанавливаться до различных продуктов:
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется . При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO. В случае более активных металлов — железа, цинка, — образуется. Сильно разбавленная азотная кислота взаимодействует с активными металлами—--цинком, магнием, алюминием -— с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой;
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до , например
Более разбавленная кислота обычно восстанавливается до NO, например:
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием , протекают сложно.
Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и “царя металлов”—золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота(III), или хлорида нитрозила, :
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям.
С избытком соляной кислоты хлорид золота(III) и хлорид платины (IV) образуют комплексные соединения
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами . Этот процесс называется нитрованием и имеет большое значение в органической химии.
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве, азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
3. Нитраты. Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия, или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
Нитрат кальция или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
4. Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При“ описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение
Образовавшийсялегко переходит в, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
5. Круговорот азота в природе. При гниении органических веществ значительная часть содержащегося в них азота превращается в аммиак, который под влиянием живущих в почве нитрифицирующих бактерий окисляется затем в азотную кислоту. Последняя, вступая в реакцию с находящимися в почве карбонатами, например с карбонатом кальция, образует нитраты:
Некоторая же часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, каменного угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих
referat.co
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ
ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ им. М.В. ЛОМОНОСОВА
КАФЕДРА ОХТ
КУРСОВОЙ ПРОЕКТ
СтудентХодаков Д.А.
ГруппаХТ-409
ПреподавательСмирноваС.Н.
Москва 2000
Исходные данныеСодержание Nh4 в аммиачно-воздушнойсмеси,% (по объему)
________________________________10
Степень превращения Nh4 в NO,% (остальной аммиак окисляется до азота)________________________________97
Степень переработки нитрозных газов в HNO3,%
_______________________________98,5
Концентрация HNO3,% (по массе)
________________________________58
Содержание в выхлопных газах,% (по объему):
Кислорода
_______________________________3,2
Воды _______________________________2,7
Базис расчета, кг HNO3 в продукте
______________________________2500
ВведениеАзотная кислота – одна из важнейших минеральных кислот. Пообъему производства в химической промышленности она занимает второе место послесерной кислоты. Азотная кислота широко применяется для производства многихпродуктов, используемых в промышленности и сельском хозяйстве:
· около 40% ее расходуется на получение сложных и азотныхминеральных удобрений;
· азотная кислота используется для производства
· синтетических красителей,
· взрывчатых веществ,
· нитролаков,
· пластических масс,
· лекарственных синтетических веществ и др.;
· железо хорошо растворяется в разбавленной азотной кислоте.Концентрационная азотная кислота образует на поверхности железа тонкий, ноплотный слой нерастворимого в концентрированной кислоте оксида, защищающегометалл от дальнейшего разъедания. Эта способность железа пассивироватьсяиспользуется для защиты его от коррозии.
Концентрированную азотную кислоту (особенно с добавлением10% h3SO4) перевозят обычно встальных цистернах. Многие органические вещества (в частности животные ирастительные ткани) при действии HNO3 разрушаются, анекоторые из них от соприкосновения с очень концентрированной кислотой могутвоспламеняться. В лабораторной практике обычно применяется азотная кислота,содержащая около 65% HNO3 (пл.1,40). В промышленностиприменяют два сорта азотной кислоты: разбавленную с содержанием 50–60% HNO3 и концентрированную, содержащую 96–98% HNO3.
Раньше, когда не существовало производства синтетическогоаммиака, азотную кислоту получали действием серной кислоты на чилийскуюселитру. Объемы производств были очень небольшими, и кислота использоваласьтолько для производства взрывчатых веществ, красителей и некоторых другиххимических продуктов.
Исходное сырьеСырьем для получения азотной кислоты служат аммиак, воздух ивода.
Синтетический аммиак в большей или меньшей степени загрязненпримесями. Такими примесями являются катализаторная пыль, смазочное масло (присжатии поршневым компрессором). Для получения чистого газообразного аммиакаслужат испарительные станции и дистилляционные отделения жидкого аммиака.Дальнейшая очистка осуществляется в фильтрах, состоящих из чечевицеобразныхэлементов, фильтрующим материалом в которых служит хлопчатобумажная замша.Тонкой очистке аммиачно–воздушная смесь подвергается в фильтре с поролитовымитрубками.
Атмосферный воздух, применяемый в производстве азотнойкислоты, забирается на территории завода или вблизи его. Этот воздух загрязненгазообразными примесями и пылью. Поэтому он подвергается тщательной очистке воизбежание отравления катализатора окисления аммиака. Очистка воздухаосуществляется, как правило, в скруббере, орошаемом водой, затем вдвухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергаетсяспециальной подготовке: отстою от механических примесей, фильтрованию ихимической очистке от растворенных в ней солей. Для получения реактивнойазотной кислоты требуется чистый паровой конденсат, который дополнительноочищают от возможных примесей. [1, стр.397]
Характеристика целевого продуктаБезводная азотная кислота HNO3представляет тяжелую бесцветную жидкость, пл.1,52 (при 15 ºС), дымящую навоздухе. Она замерзает при –41 и кипит при 86 ºС. Кипение кислотысопровождается частичным разложением:
4HNO3 à 2h3 + 4NO2 + O2 – 259,7 кДж
Выделяющийся диоксид азота, растворяясь в кислоте,окрашивает ее в желтый или красный (в зависимости от количества NO2) цвет. С водой азотная кислота смешивается в любыхсоотношениях. Выделение теплоты при разбавлении азотной кислоты водой свидетельствуетоб образовании гидратов (HNO3×h3O, HNO3×2h3O).
Азотная кислота – сильный окислитель. Металлы, заисключением Pt, Rh, Ir, Au, переводятся концентрированнойазотной кислотой в соответствующие оксиды. Если последние растворимы в азотнойкислоте, то образуются нитраты. [2, стр.99]
Физико-химическое обоснование основных процессовпроизводства целевого продукта
Химическая концепция методаПроцесс производства разбавленной азотной кислоты складываетсяиз трех стадий:
конверсия аммиака с целью получения оксида азота
4Nh4 + 5O2 = 4NO + 6h3O
окисление оксида азота до диоксида
2NO + O2 Û 2NO2
абсорбция оксидов азота водой
4NO2 + O2 + 2h3O = 4HNO3
Конверсия аммиака
Основная реакция:
4Nh4 + 5O2 = 4NO +6h3O + 946 кДж(1)
Наряду с основной реакцией протекают и побочные реакции (восновном параллельные) окисления аммиака до молекулярного азота и оксида азота(I):
4Nh4 + 3O2 = 2N2 +6h3O + 1328 кДж(2)
4Nh4 + 4O2 = 2N2O +6h3O + 1156 кДж(3)
В таблице 1 приведены термодинамические характеристики этихреакций, из которых можно видеть, что среди реакций окисления аммиакакислородом наибольшую термодинамическую вероятность имеет реакция (2),характеризующаяся наибольшим изменением анергии Гиббса. Вероятность реакции (1)с повышением температуры возрастает почти вдвое, а реакции (2) почти неизменяется.
РеакцияDh398
кДж/моль
DG, кДж/моль, при температуре Кр, при температуре 298 К 1173 К 500 1000 1 –226.00 –246.21 –414.55 1075 1051 2 –317. 20 –326.85 –335.22 1095 1062 3 –276.11 –274.75 – 1083 1056Реакцииокисления аммиака сопровождаются значительной убылью свободной энергии. Реакции(1) — (3) практически необратимы, об этом говорят константы равновесия этихреакций в интервале температур 500 — 1000 оС, так как эти константы значительнобольше констант обратимых реакций (10-2 — 102). При увеличении температуры до1000 оС значение констант падает на несколько порядков (так как реакцииэкзотермические), но даже при 1000 оС реакции (1) — (3) практически полностьюсмещены в сторону продуктов реакции.
Посколькувсе реакции протекают с выделением тепла и увеличением объёма, то в соответствиис принципом Ле-Шателье нам не удастся с помощью варьирования температуры идавления сильно сдвинуть главную реакции в правую сторону не сдвигая туда же ипобочные реакции. Увеличение концентрации кислорода тоже не позволит селективносместить равновесие основной реакции.
Итак,окисление аммиака процесс сложный, и, значит выбор условий проведения процессаопределяется необходимостью направить взаимодействие исходных веществ по путиобразования оксида азота (II).
Всоответствии с вышесказанным единственным путем получения больших выходов NO является увеличение скоростиосновной реакции по отношению к побочным. В соответствии с уравнением Аррениусаувеличение константы скорости можно добиться с помощью увеличения температурыили уменьшения энергии активации реакции. Константа скорости будет быстреерасти у тех реакций, у которых больше энергия активации.
Снижениюэнергии активации способствует применение катализаторов. В нашем случае нужныкатализаторы активно адсорбирующие на своей поверхности кислород, так какокисление аммиака до оксида азота (II) в объёме даже при высоких температурах не происходит.
Катализаторы,применяемые для окисления аммиака, должны обладать избирательными свойствами,т.е. ускорять только одну из всех возможных реакций, а именно реакцию (1)окисления аммиака до оксида азота(II). Наиболее селективным и активнымкатализатором данной реакции оказался платиноидный катализатор, представляющийсобой сплав платины с палладием и родием.
Каталитическоеокисление аммиака – многостадийный гетерогенно-каталитический процесс,протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака кповерхности катализатора. Ряд гипотез относительно механизма окисления аммиакана платиноидных катализаторах сводится к предположениям об образовании впроцессе окисления Nh4 нестойкихпромежуточных соединений, которые в результате распада и перегруппировки даютоксид азота(II) и элементный азот.
Скоростькаталитического окисления аммиака по реакции (1) очень высока. Задесятитысячные доли секунды степень превращения аммиака в оксид азота (II)достигает 97–98% при атмосферном давлении и 95–96% под давлением до 0,88–0,98МПа. Однако выход оксида азота(II) может быть различным на одном и том жекатализаторе в зависимости от выбранных технологических параметров — температуры, давления, линейной скорости газа, содержания аммиака ваммиачно-воздушной смеси, напряженности катализатора, числа сеток и некоторыхдругих факторов.
/> />рис. 1
Влияние температуры.Температура оказывает наибольшее влияние на выход оксида азота(II). Зависимостьвыхода NO от температуры на платиновомкатализаторе показана на рис.1. При повышении температуры выход NO возрастает, причем существуетоптимальная температура (для чистой платины 900-920 С), при которой достигаетсямаксимальный выход.Большоезначение имеет температура зажигания катализатора, которая зависит от составакатализатора и в меньшей степени от состава аммиачно-воздушной смеси. Наплатине реакция окисления аммиака начинается при 195 °С. Особенностью окисленияявляется то, что сначала происходит так называемое мягкое окисление аммиака домолекулярного азота. Заметное количество оксида азота(II) начинает появлятьсяпри 300 °С. С ростом температуры выход оксида азота(II) растет, достигаямаксимального значения 96% на чистой платине и 99% на сплавах Pt–Pd–Rh. Проведениепроцесса при высоких температурах помимо увеличения выхода оксида азота(II)имеет и другие преимущества: растет скорость реакции окисления аммиака иуменьшается время контактирования. Так, при повышении температуры с 650 до900 °С время контактирования сокращается с 5·10-4 до 1,1·10-4 c. Но при повышении температурыувеличиваются потери дорогостоящей платины, т.е. ухудшаются экономическиепоказатели процесса. Для экономичного проведения окисления аммиакарекомендуются следующие условия:
Давление, Мпа 0.1 0.304–0.51 0.71–1.011 Температура, °С 780–800 850–870 880–920Повышениетемпературы с 780 до 850 °С, приводит к увеличению прямых потерь катализаторапочти вдвое.
При выборетемпературы конверсии необходимо также учитывать наличие примесей ваммиачно-воздушной смеси. Температура должна быть тем выше, чем больше примесейсодержится в исходной смеси.
Влияниедавления. С ростом давления наблюдается снижение выхода оксида азота(II).Поэтому проектирование и сооружение установок с использованием повышенногодавления на стадии конверсии аммиака сдерживались. Вместе с тем использованиевысокого давления при окислении аммиака позволяет повысить производительностьагрегата, уменьшить размеры аппаратов. Этот факт в связи со стремлением кувеличению единичной мощности агрегатов приобретает все большее значение. Насовременных крупных агрегатах производства азотной кислоты процесс окисленияаммиака осуществляется под давлением 0,41– 0,73 МПа.
Основнымусловием получения высоких выходов NO под давлением выше атмосферного являются повышение температуры и времениконтактирования (увеличение числа сеток).
/> /> Повышением давления в процессеконверсии можно увеличить линейную скорость газа и интенсивность катализатора,что в свою очередь связано с увеличением числа катализаторных сеток. Очевидно,что такие параметры, как давление, линейная скорость газа, интенсивностькатализатора, тесно связаны между собой и при выборе режима окисления дляполучения высокого выхода NOдолжны подбираться с особой тщательностью.Влияниеконцентрации аммиака. Для окисления аммиака, как уже указывалось, применяютвоздух. Поэтому концентрация Nh4 ваммиачно-воздушной смеси определяется в том числе содержанием кислорода ввоздухе. Согласно уравнению реакции 4Nh4 + 5O2 = 4NO +6h3O для полного окисления 1 моль аммиаканеобходимо 1.25 моль кислорода. Исходя из этого, определим максимальновозможное содержание аммиака в аммиачно-воздушной смеси (объемные доли,%).
Однако присоотношении O2: Nh4 = 1,25 даже при атмосферном давлении выход оксида азота(II) не превышает 60–80%. Кроме того,при содержании в смеси 14.4% Nh4,пришлось бы работать в области взрывоопасных концентраций. Нижний пределвзрываемости аммиачно-воздушной смеси при атмосферном давления составляет 13,8%Nh4.
рис. 2
Пределы взрываемостиаммиачно-воздушных смесей показаны на рис.2. При увеличении соотношения O2: Nh4 до 1,7, что соответствует содержанию аммиака в смеси 11,5%,выход NO возрастает. При дальнейшемувеличении соотношения O2: Nh4 путем снижения концентрации аммиакавыход оксида азота(II) меняется незначительно. /> /> /> /> />рис. 2
рис. 3
/> /> /> /> /> /> /> />Такимобразом, при использовании воздуха максимально возможной концентрацией аммиакав аммиачно-воздушной смеси, при которой достигается высокий выход NO, является 11,0–11,5%, и соотношение O2: Nh4 = 1,7 при температурах 870 – 920 °С. На рис.3 представленазависимость выхода NO от соотношения O2: Nh4, в аммиачно-воздушной смеси. Для получения высокого выхода NO необходим примерно 30% -ный избытоккислорода сверх стехиометрического. Это связано с тем, что поверхностьплатинового катализатора должна быть постоянно насыщена кислородом (вотсутствие кислорода аммиак уже при 500 °С начинает разлагаться на азот икислород).
Катализаторы.Превосходство платины по активности и селективности над всеми другими видамикатализаторов было показано в 1902 г. Оствальдом. Характерно, что активность креакции окисления аммиака проявляет подавляющее большинство металлов и ихсоединений, но высокий выход NO(выше 90%) обеспечивают очень немногие из них.
Обладаявысокой активностью и селективностью, платина имеет низкую температурузажигания ~200 °С, хорошую пластичность, тягучесть. Недостаток платины –ее быстрое разрушение при высоких температурах под воздействием больших скоростныхпотоков реагентов и катал изаторных ядов. Это приводит к потерям дорогостоящегокатализатора и снижению выхода NO,что и явилось причиной поисков каталитически активных сплавов платины с другимиметаллами.
Проведенныепромышленные испытания показали стабильную работу катализаторов из платины сдобавками палладия, а также из тройного сплава Pt–Rh–Pd; это и послужило основанием для ихпромышленной реализации. Наибольшее распространение получили следующие катализаторыокисления аммиака (ГОСТ 3193-59):
Pt + 4% Pd + 3.5% Rh – для работы при атмосферномдавлении и Pt + 7,5% Rh – при повышенном давлении.
Используемыедля контактного окисления Nh4катализаторы изготавливают в виде сеток. Такая форма катализатора удобна вэксплуатации, связана с минимальными затратами металла, позволяет применятьнаиболее простои и удобный в эксплуатации тип контактного аппарата. В Россииприменяются сетки из проволоки диаметром 0,09 мм (ГОСТ 3193-74), размер стороныячейки 0,22 мм, число ячеек на 1 см длины – 32, на 1 см2 – 1024.
Платинородиевые(ГИАП-1) и платинородиевопалладиевые (сплав № 5) катализаторы весьмачувствительны к ряду примесей, которые содержатся в аммиаке и воздухе. К такимпримесям относятся гидриды фосфора и мышьяка, фтор и его соединения,дихлорэтан, минеральные масла, ацетилен, диоксид серы, сероводород и др.Наиболее сильными ядами катализатора являются соединения серы и фтора. Примесизаметно снижают селективность катализатора, способствуют увеличению потерь платины.Для поддержания стабильной степени конверсии аммиака необходима тщательнаяочистка аммиачно-воздушной смеси и от механических примесей, особенно отоксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксидыжелеза, попадая на катализаторные сетки, засоряют их. уменьшая поверхностьсоприкосновения газов с поверхностью катализатора, и снижают степень окисленияаммиака.
Чистотуисходных веществ в производстве азотной кислоты обеспечивают двумя путями –осуществлением дальнего забора воздуха и усовершенствованием систем очисткивоздуха и аммиака.
В процессереакции окисления аммиака поверхность платиноидных сеток сильно разрыхляется,эластичные нити сеток становятся хрупкими. При этом поверхность сеткиувеличивается примерно в 30 раз Сначала это ведет к повышению каталитическойактивности катализатора, а затем к разрушению сеток. Практикой установленыследующие сроки работы катализаторных сеток: для работы под атмосфернымдавлением – до 14 мес. под давлением 0,73 МПа 8–9 мес.
Время контактирования.Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтомуувеличение объемной скорости оказывает положительное влияние на интенсивностьпроцесса. С повышением, до определенного предела, объемной скорости потокгазовой смеси становится более турбулентным, что увеличивает скорость диффузииисходных веществ к поверхности катализатора. Наряду с этим уменьшается времясоприкосновения газовой смеси с горячими стенками аппаратов, что снижаетвозможность окисления аммиака до азота. С уменьшением времени контактированиявыход NO увеличивается и при t = 1·10-4 с достигает максимума(рис.4). При дальнейшем росте объемной скорости (уменьшении t) возможен проскок аммиака, которыйза контактной зоной превращается в элементарный азот при окислении кислородом.Не исключена также возможность образования азота при взаимодействии аммиака соксидом азота(II).
В заводскихусловиях в зависимости от качества катализатора и точности соблюдения заданноготехнологического режима достигается значительная селективность процесса, ивыход оксида азота(II) составляет 98%. При оптимальных условиях проведенияпроцесса и правильном подборе конструкционных материалов побочные реакции неимеют существенного значения.
/>рис. 4
/>Окисление оксида азота (II)
Нитрозныегазы, полученные при окислении аммиака, содержат оксид азота(II), азот,кислород и пары воды. При переработке нитрозных газов в азотную кислотунеобходимо окислить оксид азота(II) до диоксида. Реакция окисления обратима,
2NO+ O2 Û 2NO2 + 124 кДж
протекает суменьшением объема и сопровождается выделением теплоты. Следовательно, всоответствии с принципом Ле Шателье, снижение температуры и повышение давленияспособствуют смещению равновесия реакции вправо, т.е. в сторону образования NO2. Ниже приведены значения константыравновесия реакции окисления для различных температур.
t, °С 20 100 200 300 500 900 Kp 1.24·1013 1.82·107 7.41·103 45.5 8.5·10-2 1.51·10-4Из которыхвидно, что при температурах до 100 °С равновесие реакции практически полностьюсдвинуто в сторону образования NO2.При более высокой температуре равновесие смещается в левую сторону и притемпературе выше 700 °С образования диоксида азота практически не происходит. Всвязи с этим в горячих нитрозных газах, выходящих из контактного аппарата, NO2 отсутствует, и для его получениягазовую смесь необходимо охладить до температуры ниже 100 °С.
/>
Как видно изуравнения для константы равновесия при повышении парциального давлениякислорода парциальное давление оксида азота(IV) также увеличится так как от общего давления константаравновесия зависит очень мало.
Окислениеоксида азота(II) – самая медленная стадия производства азотной кислоты.Скорость реакции окисления, определяющую скорость всего процесса, можновыразить следующим образом:
/>
Онa сильно зависит от концентрацииреагентов, давления и температуры. Применение в производстве азотной кислотывоздуха, обогащенного кислородом, или чистого кислорода позволяет получатьнитрозные газы с повышенным содержанием оксида азота(II) и увеличить скоростьокисления NO в NO2.
Реакцияокисления NO в NO2 ускоряется при понижении температуры, а с повышениемтемпературы замедляется почти до полного прекращения. Для объяснения этогоявления предложено несколько гипотез, одна из которых, наиболее признанная,заключается в том, что окисление NO в NО2 идет через образованиепромежуточного продукта – димера оксида азота(II):
2NOÛ (NO) 2 + Q
O2+ (NO) 2 Û 2NO2 + Q
Образованиедимера оксида азота – процесс обратимый, протекающий с выделением теплоты.Следовательно, повышение температуры вызовет смещение равновесия этой реакции влевую сторону. При этом константа равновесия будет уменьшаться и равновеснаяконцентрация димера в газовой смеси будет понижаться. Скорость дальнейшегоокисления димера в диоксид зависит от
/>
концентрациидимера /> Таким образом, уменьшение скорости окисления оксидаазота в диоксид с повышением температуры можно объяснить сильным снижениемконцентрации димера.
Вустановках, работающих под атмосферным давлением, окисляют оксид азота примернона 92%, а оставшийся NO поглощают(совместно с NO2) щелочью, так как для окисленияпонадобилось бы много времени и соответственно большие объемы аппаратуры.Обычно переработку нитрозных газов в разбавленную кислоту проводят притемпературах 10–50 °С, при которых часть диоксида азота полимеризуется в N2O4:
2NO2 Û N2O4 + 57 кДж
Зависимостьстепени полимеризации NO2 оттемпературы характеризуется следующими данными:
Температура, °С 200 100 70 30 -20 Степень поли-, меризации% 0.7 2.5 38 77.8 89 92Скоростьполимеризации NO2 очень высока, поэтому в любоймомент времени числовое значение отношения NO2: N2O4 определяется условиями равновесия,которое устанавливается практически мгновенно. Так как реакция протекает суменьшением объема, то увеличение давления способствует образованию N2O4.
Нитрозныегазы, поступающие на абсорбцию, содержат NO2;. N2O4, NO, N2O, N2, N2O3 пары воды.
Абсорбция диоксида азота
Все оксиды азота, за исключением NO,взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидовазота водой связано с растворением в ней NO2, N2O4, N2O3 и с образованием азотной и азотистой кислот. Азотистаякислота является малоустойчивым соединением и распадается на азотную кислоту,оксид азота(II) и воду. Абсорбция протекает по схеме
2NO2 + h3O Û HNO3 + HNO2 + 116 кДж(7)
3HNO2 Û HNO3 + 2NO + h3O – 76 кДж(8)
Суммарно взаимодействие NO2 с водойможно представить уравнением реакции
3NO2 + h3O Û 2HNO3 + NO + 136 кДж(9)
которое является исходным для всех расчетов процессаабсорбции. Из него следует, что из 3 моль NO2образуется 2 моль НNO3 и 1 моль NO,который снова окисляется до NO2:
2NO + O2 Û 2NO2(10)
Механизм образования разбавленной азотной кислоты можнопредставить следующим образом. В газовой фазе NO2 и N2O4 постоянно находятся в состояниихимического равновесия и их перенос на поверхность соприкасающихся фазсовершается в соответствии с законами молекулярной диффузии газов. Впограничном слое газ – жидкость происходит переход NO2в жидкую фазу. Затем после растворения NO2 происходит химическаяреакция (7), которая по сравнению с процессом диффузии протекает относительнобыстро.
Далее в жидкой фазе происходит сравнительно медленноеразложение азотистой кислоты по реакции (8). Образующийся NOчастично окисляется в растворе кислородом, но его большая часть взаимодействуетс кислородом уже в газовой фазе по реакции (10). Одновременно с абсорбцией ипротеканием химических реакции в растворе в газовой фазе частично происходят теже реакции, приводящие к образованию азотной кислоты. Медленным процессом,определяющим скорость поглощения оксидов азота, является диффузия их в жидкуюфазу. При взаимодействии паров воды и диоксида азота в газовой фазе происходитобразование кислотного тумана, вследствие этого создается дополнительноесопротивления при поглощении оксидов азота.
Степень поглощения диоксида азота водными растворами азотнойкислоты определяется такими факторами, как температура, давление, концентрациякислоты. При понижении температуры и концентрации кислоты и повышении давлениястепень превращения диоксида азота растет. При концентрации азотной кислотывыше 65% поглощение почти прекращается. Концентрация получаемой азотной кислотыопределяется условиями равновесия NO2 над кислотой.
Следует отметить, что степень окисления NOв NO2 зависит от свободного объема, а количествопоглощаемых оксидов азота – от поверхности соприкосновения газа с жидкостью.Поэтому одно из основных требований, предъявляемое к абсорбционной аппаратуре,– создание максимального свободного объема при одновременно сильно развитойповерхности поглощения.
В промышленности используют различные типы абсорбционныхколонн с колпачковыми тарелками, с ситчатыми тарелками, переливными стаканами идр.
Обоснование предлагаемой технологииСырьем служит недорогой и легко доступный синтетическийаммиак, который при оптимально подобранных параметрах практически весь идет наполучение монооксида азота; реакция протекает необратимо и быстро и не требуетрециклов. Применение повышенного давления способствует уменьшению размероваппаратов и увеличению производительности, но при этом увеличиваетсятемпература и количество сеток катализатора. Для обеспечения выхода оксидаазота более 98% при давлениях 0,41 – 0,71 МПа необходима температура выше 9500С, зато время контактирования становится менее 1,1×10-4 с, а скорость газа более 160 л/мин. Вообще,повышение температуры способствует увеличению выхода, но это приводит к большимпрямым потерям дорогостоящего катализатора.
Поскольку окисление оксида азота (II)протекает при низких температурах смесь охлаждается водой, которая, превращаясьв пар, идет на технологические нужды, а это экономически выгодно. Абсорбциядиоксида азота происходит в колонне очищенной водой, причем степень абсорбциидостигает 99%, а содержание оксидов азота в выхлопных газах до 0,11%.
Обоснование выбора технологических параметровАммиачно-воздушная смесь, подаваемая в контактный аппарат,не должна содержать более 10%, иначе катализатор не будет полностью покрыткислородом и начнется окисление аммиака до азота. Хотя максимально возможнойконцентрацией аммиака, при которой достигается высокий выход, является 11,0 –11,5%, используется более низкая, поскольку скорость газа велика и необходимзапас на случай проскока. Конверсия протекает при температурах 870 – 900 0С и давление0,716 МПа. Эти параметры были подобраны на основе экономических показателей, т.к. повышение температуры увеличивает как выход, так и прямые потери платиновогокатализатора.
Реакцию окисления NO в NO2 начинают проводить при температуре 170 0С, достаточнойдля обеспечения хорошего выхода и скорости. За счет теплоты реакции происходитразогрев до 300 0С. Степень окисления составляет около 85%. Абсорбцию диоксидаазота ведут при температуре 35 – 40 0С, поскольку это способствует смещениюравновесия вправо, концентрация кислоты на выходе достигает 55-58%.
Функциональная схема получения азотной кислоты.
Описание технологической схемы процесса/> В 1960-ых годах разработан агрегат по производству азотной кислоты мощностью120 тыс. т/год под давлением 0,716 МПа с использованием высокотемпературнойкаталитической очистки выхлопных газов, выпускающий продукцию в виде 53–58%-ной HNO3. Технологическая схема этого производства вупрощенном варианте представлена на рисунке 5.
Подготовка сырья
/>
Рис.5 Схема производства азотной кислоты под давлением 0,716МПа с приводом компрессора от газовой турбины:
1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 –топочное устройство; 4 – подогреватель метана; 5 – подогреватель аммиака; 6 –смеситель аммиака и воздуха с пролитовым фильтром; 7 – холодильник-конденсатор;8 – сепаратор; 9 – абсорбционная колонна; 10 – продувочная колонна; 11 –подогреватель отходящих газов; 12 – подогреватель воздуха; 13 – сосуд дляокисления нитрозных газов; 14 – контактный аппарат; 15 – котел‑утилизатор;16,18 – двухступенчатый турбокомпрессор; 17 – газовая турбина
Атмосферный воздух проходит тщательную очистку вдвухступенчатом фильтре 1. Очищенный воздух сжимают двухступенчатым воздушнымкомпрессором. В первой ступени 18 воздух сжимают до 0,35 МПа, при этом оннагревается до 165–175 ºС за счет адиабатического сжатия. После охлаждениявоздух направляют на вторую ступень сжатия 16, где его давление возрастает до0,716 МПа.
Основной поток воздуха после сжатия нагревают в подогревателевоздуха 12 до 250–270 ºС теплотой нитрозных газов и подают на смешение саммиаком в смеситель 6.
Газообразный аммиак, полученный путем испарения ждкогоаммиака, после очистки от влаги, масла и катализаторной пыли черезподогреватель 5 при температуре 150 ºС также направляют в смеситель6. Смеситель совмещен в одном аппарате с поролитовым фильтром. После очисткиаммиачно-воздушную смесь с содержанием Nh4 не более 10%подают в контактный аппарат 14 на конверсию аммиака.
Конверсия аммиака протекает на платинородиевых сетках притемпературе 870–900 ºС, причем степень конверсии составляет 96%. Нитрозныегазы при 890–910 ºС поступают в котел-утилизатор 15, расположенный подконтактным аппаратом. В котле за счет охлаждения нитрозных газов до 170 ºСпроисходит испарение химически очищенной деаэрированной воды, питающейкотел-утилизатор; при этом получают пар с давлением 1,5 МПа и температурой 230ºС, который выдается потребителю.
После котла-утилизатора нитрозные газы поступают вокислитель нитрозных газов 13. Он представляет собой полый аппарат, в верхнейчасти которого установлен фильтр из стекловолокна для улавливания платиновогокатализатора. Частично окисление нитрозных газов происходит уже вкотле-утилизаторе (до 40%). В окислителе 13 степень окисления возрастает до85%. За счет реакции окисления нитрозные газы нагреваются до 300–335 ºС.Эта теплота используется в подогревателе воздуха 12. Охлажденные в теплообменнике12 нитрозные газы поступают для дальнейшего охлаждения в теплообменник 11, гдепроисходит снижение их температуры до 150 ºС и нагрев выхлопных (хвостовых)газов до 110–125 ºС. Затем нитрозные газы направляют вхолодильник-конденсатор 7, охлаждаемый оборотной водой. При этом конденсируютсяводяные пары и и образуется слабая азотная кислота. Нитрозные газы отделяют отсконденсировавшейся азотной кислоты в сепараторе 8, из которого азотную кислотунаправляют в адсорбционную колонну 9 на 6–7-ю тарелку, а нитрозные газы – поднижнюю тарелку абсорбционной колонны. Сверху в колонну подают охлажденный паровойконденсат. Образующаяся в верхней части колонны азотная кислота низкойконцентрации перетекает на нижележащие тарелки. За счет поглощения оксидовазота концентрация кислоты постепенно увеличивается и на выходе достигает ~1%.Поэтому кислота направляется в продувочную колонну 10, где подогретым воздухомиз нее отдувают оксиды азота, и отбеленная азотная кислота поступает на склад.Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны9.
Степень абсорбции оксидов азота достигает 99%. Выходящие изколонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35ºС проходят подогреватель 11, где нагреваются до 110–145 ºС ипоступают в топочное устройство (камера сжигания 3 установки каталитическойочитски. Здесь газы нагреваются до температуры 390–450 ºС за счет горенияприродного газа, подогретого предварительно в подогревателе 4, и направляются вреактор с двухслойным катализатором 2, где первым слоем служит оксид алюминия снанесенным на него палладием, вторым слоем – оксид алюминия. Очисткуосуществляют при 760 ºС. Очищенные газы поступают в газовую турбину 17 притемпературе 690–700 ºС; энергия, вырабатываемая турбиной за счет теплотыхвостовых газов, используется для привода турбокомпрессора 18. Затем газынаправляют в котел-утилизатор и экономайзер (на схеме не показаны) ивыбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газахсоставляет 0,005–0,008%, содержание CO2 – 0,23%.
Расчет материального баланса ХТС.
/> />2
12
23
h30
030
HNO3
3
301
302
Блок-схемаРис.2. Структурная блок-схема производства азотной кислоты:
1 – блок подготовки сырья; 2 – блок окисления аммиака; 3 –блок абсорбции нитрозных газов.
Таблица 1
Составы потоков
№ потока Индекс потока Ед. измер. Содержание компонентов Nh4 O2 N2 NO h3O HNO3 1 010 кмоль 100% 2 011 кмоль 21% 79% 3 12 кмоль 10% 18,9% 71,1% 4 23 кмоль Кмоль кмоль кмоль кмоль 5 030 кмоль кмоль 6 031 кмоль Кмоль кмоль 7 301 кг 42% 58% 8 302 кмоль 3,2% кмоль кмоль 2,7%Уравненияматериального баланса ХТС.
4Nh4+ 5O2 = 4NO + 6h3O + Q
4Nh4+ 3O2 =2N2 + 6h3O + Q
2NO+ 1.5O2 + h3O = 2HNO3 + Q
Уравнениядля блока контактирования:
По оксидуазота:
/>
По азоту:
/>
Покислороду:
/>
По воде:
/>
Уравнениядля блока абсорбции:
По оксидуазота:
/>
По воде:
/>
Покислороду:
/>
Уравнениедля потока выхлопных газов:
/>
Подготовкауравнений для решения на ЭВМ.
Таблица 2
Соответствиепеременных потокам
Наименование потока Условное обозначение xi Размерность Значение по расчету Аммиачно-воздушная смесь N12 x1 кмоль 415.33 Оксид азота в потоке 23 N23NO x2 кмоль 40.29 Азот в потоке 23 N23N2 x3 кмоль 295.92 Кислород в потоке 23 N23O2 x4 кмоль 27. 20 Вода в потоке 23 N23Н2О x5 кмоль 62.30 Вода в блок 3 N030 х6 кмоль 68. 19 Выхлопные газы N302 х7 кмоль 373.07 Воздух в блок 3 N031 х8 кмоль 69.03Таблица 3
Матрица коэффициентов
№ уравнения bi при xi Свободный член х1 х2 х3 х4 х5 х6 х7 х8 1 0,079 -1 2 0,713 -1 3 0,187 -1,25 -1 4 -0,15 1 5 1 40,286 6 1 1 -0,027 120,416 7 1 -0,032 0,21 29,762 8 -0,015 -1 0,941 0,79Решаемсистему с помощью электронных таблиц EXCEL матричным способом: умножая обратную матрицу на матрицу свободныхчленов.
/> /> Результаты расчета.Таблица 4
Материальныйбаланс химико-технологической системы производства азотной кислоты на 2500 кг
Введено Получено /> Статья прихода Масса, кг % Статья расхода Масса, кг % /> /> Аммиак 706,1 4,80 58% — ная азотная кислота: 4310,3 29,31 /> Воздух: 12771,1 86,85 Азотная кислота 2500 17,00 /> Кислород 2975,8 20,24 Вода 1810,3 12,31 /> Азот 9795,3 66,61 Выхлопные газы: 10394,2 70,69 /> Вода 1227,4 8,35 Оксид азота 18,1 0,12 /> Азот 9812,7 66,73 /> Кислород 382,0 2,60 /> Вода 181,3 1,23 /> Всего: 14704,5 100 Всего: 14704,5 100 /> /> /> Поточная диаграммаматериального балансаМасштаб: 1см = кг
Расчет основных технологических показателей процессаРасходные коэффициенты по сырью (аммиаку):
Теоретический расходный коэффициент:
/>
Практический расходный коэффициент:
/>
Конверсия аммиака.
/> (по условию).
Выход.
/>
Селективность.
/> поскольку степень превращенияравна 100%.
Список используемой литературы1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическаятехнология. — М.: Высш. шк., 1990. – 520 с.
2. Мухлёнов И.П., Авербух А.Я., Кузнецов Д.А. и др. Под ред. И.П.Мухлёнова. Общая химическая технология: учебник для химико-технологическихспеципльностей. Т.2. Важнейшие химические производства. — М.: Высш. шк., 1984.– 264 с.
3. Атрощенко В.И., Каргин С.И. Технология азотной кислоты. – М.: Химия,1970. – 496 с.
www.ronl.ru
Содержание
1. Азотная кислота стр. 3
2. Окислительные свойства азотной кислоты стр. 3
3. Нитраты стр. 6
4. Промышленное получение азотной кислоты стр. 7
5. Круговорот азоты в природе стр. 8
6. Библиография стр. 101. Азотная кислота. Чистая азотная кислота HNO—бесцветная жидкость плотностью 1,51 г/см
при - 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с 'влагой воздуха мелкие капельки тумана,
Азотная кислота не отличается прочностью, Уже под влиянием света она постепенно разлагается:
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н и- NO
.
2. Окислительные свойства азотной кислоты. Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO, ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды.
Концентрированная HNO пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO
. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние.
Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО может восстанавливаться до различных продуктов:
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется
. При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO. В случае более активных металлов — железа, цинка, — образуется
. Сильно разбавленная азотная кислота взаимодействует с активными металлами—--цинком, магнием, алюминием -— с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой;
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до , например
Более разбавленная кислота обычно восстанавливается до NO, например:
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием , протекают сложно.
Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов»—золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота(III), или хлорида нитрозила, :
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям.
С избытком соляной кислоты хлорид золота(III) и хлорид платины (IV) образуют комплексные соединения
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами . Этот процесс называется нитрованием и имеет большое значение в органической химии.
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве, азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
3. Нитраты. Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия, или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
Нитрат кальция или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
4. Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При« описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение
Образовавшийся легко переходит в
, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
5. Круговорот азота в природе. При гниении органических веществ значительная часть содержащегося в них азота превращается в аммиак, который под влиянием живущих в почве нитрифицирующих бактерий окисляется затем в азотную кислоту. Последняя, вступая в реакцию с находящимися в почве карбонатами, например с карбонатом кальция, образует нитраты:
Некоторая же часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, каменного угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих денитрифицирующих бактерий приводит к тому, что часть азота из доступной для зеленых растений формы (нитраты) переходит в недоступную (свободный азот). Таким образом, далеко не весь азот, входивший в состав погибших растений, возвращается обратно в почву; часть его постепенно выделяется в свободном виде.
Непрерывная убыль минеральных азотных соединений давно должна была бы привести к полному прекращению жизни на Земле, если бы в природе не существовали процессы, возмещающие потери азота. К таким процессам относятся прежде всего происходящие в атмосфере электрические разряды, при которых всегда образуется некоторое количество оксидов азота; последние с водой дают азотную кислоту, превращающуюся в почве в нитраты. 'Другим источником пополнения азотных соединений почвы является жизнедеятельность так называемых азотобактерий, способных усваивать атмосферный азот. Некоторые из этих бактерий поселяются на корнях растений из семейства бобовых, вызывая образование характерных вздутий — «клубеньков», почему они и получили название клубеньковых бактерий. Усваивая атмосферный азот, клубеньковые бактерии перерабатывают его в азотные соединения, а растения, в свою очередь, превращают последние в белки и другие сложные вещества.
Таким образом, в природе совершается непрерывный круговорот азота. Однако ежегодно с урожаем с полей убираются наиболее богатые белками части растений, например зерно. Поэтому в почву необходимо вносить удобрения, возмещающие убыль в ней важнейших элементов питания растений.
Изучение вопросов питания растений и повышения урожайности последних путем применения удобрений является предметом специальной отрасли химия, получившей название агрохимии.
bukvasha.ru
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ
ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ им. М.В. ЛОМОНОСОВА
КАФЕДРА ОХТ
КУРСОВОЙ ПРОЕКТ
Студент Ходаков Д.А.
ГруппаХТ-409
ПреподавательСмирнова С.Н.
Москва 2000
Содержание Nh4 в аммиачно-воздушной смеси,% (по объему)
________________________________10
Степень превращения Nh4 в NO,% (остальной аммиак окисляется до азота) ________________________________97
Степень переработки нитрозных газов в HNO3,%
_______________________________98,5
Концентрация HNO3,% (по массе)
________________________________58
Содержание в выхлопных газах,% (по объему):
Кислорода
_______________________________3,2
Воды _______________________________2,7
Базис расчета, кг HNO3 в продукте
______________________________2500
Азотная кислота – одна из важнейших минеральных кислот. По объему производства в химической промышленности она занимает второе место после серной кислоты. Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве:
· около 40% ее расходуется на получение сложных и азотных минеральных удобрений;
· азотная кислота используется для производства
· синтетических красителей,
· взрывчатых веществ,
· нитролаков,
· пластических масс,
· лекарственных синтетических веществ и др.;
· железо хорошо растворяется в разбавленной азотной кислоте. Концентрационная азотная кислота образует на поверхности железа тонкий, но плотный слой нерастворимого в концентрированной кислоте оксида, защищающего металл от дальнейшего разъедания. Эта способность железа пассивироваться используется для защиты его от коррозии.
Концентрированную азотную кислоту (особенно с добавлением 10% h3SO4) перевозят обычно в стальных цистернах. Многие органические вещества (в частности животные и растительные ткани) при действии HNO3 разрушаются, а некоторые из них от соприкосновения с очень концентрированной кислотой могут воспламеняться. В лабораторной практике обычно применяется азотная кислота, содержащая около 65% HNO3 (пл.1,40). В промышленности применяют два сорта азотной кислоты: разбавленную с содержанием 50–60% HNO3 и концентрированную, содержащую 96–98% HNO3.
Раньше, когда не существовало производства синтетического аммиака, азотную кислоту получали действием серной кислоты на чилийскую селитру. Объемы производств были очень небольшими, и кислота использовалась только для производства взрывчатых веществ, красителей и некоторых других химических продуктов.
Сырьем для получения азотной кислоты служат аммиак, воздух и вода.
Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака. Дальнейшая очистка осуществляется в фильтрах, состоящих из чечевицеобразных элементов, фильтрующим материалом в которых служит хлопчатобумажная замша. Тонкой очистке аммиачно–воздушная смесь подвергается в фильтре с поролитовыми трубками.
Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью. Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, орошаемом водой, затем в двухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергается специальной подготовке: отстою от механических примесей, фильтрованию и химической очистке от растворенных в ней солей. Для получения реактивной азотной кислоты требуется чистый паровой конденсат, который дополнительно очищают от возможных примесей. [1, стр.397]
Безводная азотная кислота HNO3 представляет тяжелую бесцветную жидкость, пл.1,52 (при 15 ºС), дымящую на воздухе. Она замерзает при –41 и кипит при 86 ºС. Кипение кислоты сопровождается частичным разложением:
4HNO3 — 2h3 + 4NO2 + O2 – 259,7 кДж
Выделяющийся диоксид азота, растворяясь в кислоте, окрашивает ее в желтый или красный (в зависимости от количества NO2) цвет. С водой азотная кислота смешивается в любых соотношениях. Выделение теплоты при разбавлении азотной кислоты водой свидетельствует об образовании гидратов (HNO3×h3O, HNO3×2h3O).
Азотная кислота – сильный окислитель. Металлы, за исключением Pt, Rh, Ir, Au, переводятся концентрированной азотной кислотой в соответствующие оксиды. Если последние растворимы в азотной кислоте, то образуются нитраты. [2, стр.99]
Физико-химическое обоснование основных процессов производства целевого продукта
Процесс производства разбавленной азотной кислоты складывается из трех стадий:
конверсия аммиака с целью получения оксида азота
4Nh4 + 5O2 = 4NO + 6h3O
окисление оксида азота до диоксида
2NO + O2 Û 2NO2
абсорбция оксидов азота водой
4NO2 + O2 + 2h3O = 4HNO3
Конверсия аммиака
Основная реакция:
4Nh4 + 5O2 = 4NO +6h3O + 946 кДж(1)
Наряду с основной реакцией протекают и побочные реакции (в основном параллельные) окисления аммиака до молекулярного азота и оксида азота(I):
4Nh4 + 3O2 = 2N2 +6h3O + 1328 кДж(2)
4Nh4 + 4O2 = 2N2O +6h3O + 1156 кДж(3)
В таблице 1 приведены термодинамические характеристики этих реакций, из которых можно видеть, что среди реакций окисления аммиака кислородом наибольшую термодинамическую вероятность имеет реакция (2), характеризующаяся наибольшим изменением анергии Гиббса. Вероятность реакции (1) с повышением температуры возрастает почти вдвое, а реакции (2) почти не изменяется.
| Реакция | Dh398 кДж/моль | DG, кДж/моль, при температуре | Кр, при температуре | ||
| 298 К | 1173 К | 500 | 1000 | ||
| 1 | –226.00 | –246.21 | –414.55 | 1075 | 1051 |
| 2 | –317. 20 | –326.85 | –335.22 | 1095 | 1062 |
| 3 | –276.11 | –274.75 | – | 1083 | 1056 |
Реакции окисления аммиака сопровождаются значительной убылью свободной энергии. Реакции (1) — (3) практически необратимы, об этом говорят константы равновесия этих реакций в интервале температур 500 — 1000 оС, так как эти константы значительно больше констант обратимых реакций (10-2 — 102). При увеличении температуры до 1000 оС значение констант падает на несколько порядков (так как реакции экзотермические), но даже при 1000 оС реакции (1) — (3) практически полностью смещены в сторону продуктов реакции.
Поскольку все реакции протекают с выделением тепла и увеличением объёма, то в соответствии с принципом Ле-Шателье нам не удастся с помощью варьирования температуры и давления сильно сдвинуть главную реакции в правую сторону не сдвигая туда же и побочные реакции. Увеличение концентрации кислорода тоже не позволит селективно сместить равновесие основной реакции.
Итак, окисление аммиака процесс сложный, и, значит выбор условий проведения процесса определяется необходимостью направить взаимодействие исходных веществ по пути образования оксида азота (II).
В соответствии с вышесказанным единственным путем получения больших выходов NO является увеличение скорости основной реакции по отношению к побочным. В соответствии с уравнением Аррениуса увеличение константы скорости можно добиться с помощью увеличения температуры или уменьшения энергии активации реакции. Константа скорости будет быстрее расти у тех реакций, у которых больше энергия активации.
Снижению энергии активации способствует применение катализаторов. В нашем случае нужны катализаторы активно адсорбирующие на своей поверхности кислород, так как окисление аммиака до оксида азота (II) в объёме даже при высоких температурах не происходит.
Катализаторы, применяемые для окисления аммиака, должны обладать избирательными свойствами, т.е. ускорять только одну из всех возможных реакций, а именно реакцию (1) окисления аммиака до оксида азота(II). Наиболее селективным и активным катализатором данной реакции оказался платиноидный катализатор, представляющий собой сплав платины с палладием и родием.
Каталитическое окисление аммиака – многостадийный гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. Ряд гипотез относительно механизма окисления аммиака на платиноидных катализаторах сводится к предположениям об образовании в процессе окисления Nh4 нестойких промежуточных соединений, которые в результате распада и перегруппировки дают оксид азота(II) и элементный азот.
Скорость каталитического окисления аммиака по реакции (1) очень высока. За десятитысячные доли секунды степень превращения аммиака в оксид азота (II) достигает 97–98% при атмосферном давлении и 95–96% под давлением до 0,88–0,98 МПа. Однако выход оксида азота(II) может быть различным на одном и том же катализаторе в зависимости от выбранных технологических параметров — температуры, давления, линейной скорости газа, содержания аммиака в аммиачно-воздушной смеси, напряженности катализатора, числа сеток и некоторых других факторов.
 |
Большое значение имеет температура зажигания катализатора, которая зависит от состава катализатора и в меньшей степени от состава аммиачно-воздушной смеси. На платине реакция окисления аммиака начинается при 195 °С. Особенностью окисления является то, что сначала происходит так называемое мягкое окисление аммиака до молекулярного азота. Заметное количество оксида азота(II) начинает появляться при 300 °С. С ростом температуры выход оксида азота(II) растет, достигая максимального значения 96% на чистой платине и 99% на сплавах Pt–Pd–Rh. Проведение процесса при высоких температурах помимо увеличения выхода оксида азота(II) имеет и другие преимущества: растет скорость реакции окисления аммиака и уменьшается время контактирования. Так, при повышении температуры с 650 до 900 °С время контактирования сокращается с 5·10-4 до 1,1·10-4 c. Но при повышении температуры увеличиваются потери дорогостоящей платины, т.е. ухудшаются экономические показатели процесса. Для экономичного проведения окисления аммиака рекомендуются следующие условия:
| Давление, Мпа | 0.1 | 0.304–0.51 | 0.71–1.011 |
| Температура, °С | 780–800 | 850–870 | 880–920 |
Повышение температуры с 780 до 850 °С, приводит к увеличению прямых потерь катализатора почти вдвое.
При выборе температуры конверсии необходимо также учитывать наличие примесей в аммиачно-воздушной смеси. Температура должна быть тем выше, чем больше примесей содержится в исходной смеси.
Влияние давления. С ростом давления наблюдается снижение выхода оксида азота(II). Поэтому проектирование и сооружение установок с использованием повышенного давления на стадии конверсии аммиака сдерживались. Вместе с тем использование высокого давления при окислении аммиака позволяет повысить производительность агрегата, уменьшить размеры аппаратов. Этот факт в связи со стремлением к увеличению единичной мощности агрегатов приобретает все большее значение. На современных крупных агрегатах производства азотной кислоты процесс окисления аммиака осуществляется под давлением 0,41– 0,73 МПа.
Основным условием получения высоких выходов NO под давлением выше атмосферного являются повышение температуры и времени контактирования (увеличение числа сеток).
 |
Влияние концентрации аммиака. Для окисления аммиака, как уже указывалось, применяют воздух. Поэтому концентрация Nh4 в аммиачно-воздушной смеси определяется в том числе содержанием кислорода в воздухе. Согласно уравнению реакции 4Nh4 + 5O2 = 4NO +6h3O для полного окисления 1 моль аммиака необходимо 1.25 моль кислорода. Исходя из этого, определим максимально возможное содержание аммиака в аммиачно-воздушной смеси (объемные доли,%).
Однако при соотношении O2: Nh4 = 1,25 даже при атмосферном давлении выход оксида азота(II) не превышает 60–80%. Кроме того, при содержании в смеси 14.4% Nh4, пришлось бы работать в области взрывоопасных концентраций. Нижний предел взрываемости аммиачно-воздушной смеси при атмосферном давления составляет 13,8% Nh4.
Пределы взрываемости аммиачно-воздушных смесей показаны на рис.2. При увеличении соотношения O2: Nh4 до 1,7, что соответствует содержанию аммиака в смеси 11,5%, выход NO возрастает. При дальнейшем увеличении соотношения O2: Nh4 путем снижения концентрации аммиака выход оксида азота(II) меняется незначительно. |  |
Таким образом, при использовании воздуха максимально возможной концентрацией аммиака в аммиачно-воздушной смеси, при которой достигается высокий выход NO, является 11,0–11,5%, и соотношение O2: Nh4 = 1,7 при температурах 870 – 920 °С. На рис.3 представлена зависимость выхода NO от соотношения O2: Nh4, в аммиачно-воздушной смеси. Для получения высокого выхода NO необходим примерно 30% -ный избыток кислорода сверх стехиометрического. Это связано с тем, что поверхность платинового катализатора должна быть постоянно насыщена кислородом (в отсутствие кислорода аммиак уже при 500 °С начинает разлагаться на азот и кислород).
Катализаторы. Превосходство платины по активности и селективности над всеми другими видами катализаторов было показано в 1902 г. Оствальдом. Характерно, что активность к реакции окисления аммиака проявляет подавляющее большинство металлов и их соединений, но высокий выход NO (выше 90%) обеспечивают очень немногие из них.
Обладая высокой активностью и селективностью, платина имеет низкую температуру зажигания ~200 °С, хорошую пластичность, тягучесть. Недостаток платины – ее быстрое разрушение при высоких температурах под воздействием больших скоростных потоков реагентов и катал изаторных ядов. Это приводит к потерям дорогостоящего катализатора и снижению выхода NO, что и явилось причиной поисков каталитически активных сплавов платины с другими металлами.
Проведенные промышленные испытания показали стабильную работу катализаторов из платины с добавками палладия, а также из тройного сплава Pt–Rh–Pd; это и послужило основанием для их промышленной реализации. Наибольшее распространение получили следующие катализаторы окисления аммиака (ГОСТ 3193-59):
Pt + 4% Pd + 3.5% Rh – для работы при атмосферном давлении и Pt + 7,5% Rh – при повышенном давлении.
Используемые для контактного окисления Nh4 катализаторы изготавливают в виде сеток. Такая форма катализатора удобна в эксплуатации, связана с минимальными затратами металла, позволяет применять наиболее простои и удобный в эксплуатации тип контактного аппарата. В России применяются сетки из проволоки диаметром 0,09 мм (ГОСТ 3193-74), размер стороны ячейки 0,22 мм, число ячеек на 1 см длины – 32, на 1 см2 – 1024.
Платинородиевые (ГИАП-1) и платинородиевопалладиевые (сплав № 5) катализаторы весьма чувствительны к ряду примесей, которые содержатся в аммиаке и воздухе. К таким примесям относятся гидриды фосфора и мышьяка, фтор и его соединения, дихлорэтан, минеральные масла, ацетилен, диоксид серы, сероводород и др. Наиболее сильными ядами катализатора являются соединения серы и фтора. Примеси заметно снижают селективность катализатора, способствуют увеличению потерь платины. Для поддержания стабильной степени конверсии аммиака необходима тщательная очистка аммиачно-воздушной смеси и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксиды железа, попадая на катализаторные сетки, засоряют их. уменьшая поверхность соприкосновения газов с поверхностью катализатора, и снижают степень окисления аммиака.
Чистоту исходных веществ в производстве азотной кислоты обеспечивают двумя путями – осуществлением дальнего забора воздуха и усовершенствованием систем очистки воздуха и аммиака.
В процессе реакции окисления аммиака поверхность платиноидных сеток сильно разрыхляется, эластичные нити сеток становятся хрупкими. При этом поверхность сетки увеличивается примерно в 30 раз Сначала это ведет к повышению каталитической активности катализатора, а затем к разрушению сеток. Практикой установлены следующие сроки работы катализаторных сеток: для работы под атмосферным давлением – до 14 мес. под давлением 0,73 МПа 8–9 мес.
Время контактирования. Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтому увеличение объемной скорости оказывает положительное влияние на интенсивность процесса. С повышением, до определенного предела, объемной скорости поток газовой смеси становится более турбулентным, что увеличивает скорость диффузии исходных веществ к поверхности катализатора. Наряду с этим уменьшается время соприкосновения газовой смеси с горячими стенками аппаратов, что снижает возможность окисления аммиака до азота. С уменьшением времени контактирования выход NO увеличивается и при t = 1·10-4 с достигает максимума (рис.4). При дальнейшем росте объемной скорости (уменьшении t) возможен проскок аммиака, который за контактной зоной превращается в элементарный азот при окислении кислородом. Не исключена также возможность образования азота при взаимодействии аммиака с оксидом азота(II).
В заводских условиях в зависимости от качества катализатора и точности соблюдения заданного технологического режима достигается значительная селективность процесса, и выход оксида азота(II) составляет 98%. При оптимальных условиях проведения процесса и правильном подборе конструкционных материалов побочные реакции не имеют существенного значения.
 |
Окисление оксида азота (II)
Нитрозные газы, полученные при окислении аммиака, содержат оксид азота(II), азот, кислород и пары воды. При переработке нитрозных газов в азотную кислоту необходимо окислить оксид азота(II) до диоксида. Реакция окисления обратима,
2NO + O2 Û 2NO2 + 124 кДж
протекает с уменьшением объема и сопровождается выделением теплоты. Следовательно, в соответствии с принципом Ле Шателье, снижение температуры и повышение давления способствуют смещению равновесия реакции вправо, т.е. в сторону образования NO2. Ниже приведены значения константы равновесия реакции окисления для различных температур.
| t, °С | 20 | 100 | 200 | 300 | 500 | 900 |
| Kp | 1.24·1013 | 1.82·107 | 7.41·103 | 45.5 | 8.5·10-2 | 1.51·10-4 |
Из которых видно, что при температурах до 100 °С равновесие реакции практически полностью сдвинуто в сторону образования NO2. При более высокой температуре равновесие смещается в левую сторону и при температуре выше 700 °С образования диоксида азота практически не происходит. В связи с этим в горячих нитрозных газах, выходящих из контактного аппарата, NO2 отсутствует, и для его получения газовую смесь необходимо охладить до температуры ниже 100 °С.

Как видно из уравнения для константы равновесия при повышении парциального давления кислорода парциальное давление оксида азота(IV) также увеличится так как от общего давления константа равновесия зависит очень мало.
Окисление оксида азота(II) – самая медленная стадия производства азотной кислоты. Скорость реакции окисления, определяющую скорость всего процесса, можно выразить следующим образом:

Онa сильно зависит от концентрации реагентов, давления и температуры. Применение в производстве азотной кислоты воздуха, обогащенного кислородом, или чистого кислорода позволяет получать нитрозные газы с повышенным содержанием оксида азота(II) и увеличить скорость окисления NO в NO2.
Реакция окисления NO в NO2 ускоряется при понижении температуры, а с повышением температуры замедляется почти до полного прекращения. Для объяснения этого явления предложено несколько гипотез, одна из которых, наиболее признанная, заключается в том, что окисление NO в NО2 идет через образование промежуточного продукта – димера оксида азота(II):
2NO Û (NO) 2 + Q
O2 + (NO) 2 Û 2NO2 + Q
Образование димера оксида азота – процесс обратимый, протекающий с выделением теплоты. Следовательно, повышение температуры вызовет смещение равновесия этой реакции в левую сторону. При этом константа равновесия будет уменьшаться и равновесная концентрация димера в газовой смеси будет понижаться. Скорость дальнейшего окисления димера в диоксид зависит от

концентрации димера  Таким образом, уменьшение скорости окисления оксида азота в диоксид с повышением температуры можно объяснить сильным снижением концентрации димера.
Таким образом, уменьшение скорости окисления оксида азота в диоксид с повышением температуры можно объяснить сильным снижением концентрации димера.
В установках, работающих под атмосферным давлением, окисляют оксид азота примерно на 92%, а оставшийся NO поглощают (совместно с NO2) щелочью, так как для окисления понадобилось бы много времени и соответственно большие объемы аппаратуры. Обычно переработку нитрозных газов в разбавленную кислоту проводят при температурах 10–50 °С, при которых часть диоксида азота полимеризуется в N2O4:
2NO2 ÛN2O4 + 57 кДж
Зависимость степени полимеризации NO2 от температуры характеризуется следующими данными:
| Температура, °С | 200 | 100 | 70 | 30 | -20 | |
| Степень поли-, меризации% | 0.7 | 2.5 | 38 | 77.8 | 89 | 92 |
Скорость полимеризации NO2 очень высока, поэтому в любой момент времени числовое значение отношения NO2: N2O4 определяется условиями равновесия, которое устанавливается практически мгновенно. Так как реакция протекает с уменьшением объема, то увеличение давления способствует образованию N2O4.
Нитрозные газы, поступающие на абсорбцию, содержат NO2;. N2O4, NO, N2O, N2, N2O3 пары воды.
Все оксиды азота, за исключением NO, взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота водой связано с растворением в ней NO2, N2O4, N2O3 и с образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота(II) и воду. Абсорбция протекает по схеме
2NO2 + h3O Û HNO3 + HNO2 + 116 кДж(7)
3HNO2 Û HNO3 + 2NO + h3O – 76 кДж(8)
Суммарно взаимодействие NO2 с водой можно представить уравнением реакции
3NO2 + h3O Û 2HNO3 + NO + 136 кДж(9)
которое является исходным для всех расчетов процесса абсорбции. Из него следует, что из 3 моль NO2 образуется 2 моль НNO3 и 1 моль NO, который снова окисляется до NO2:
2NO + O2 Û 2NO2(10)
Механизм образования разбавленной азотной кислоты можно представить следующим образом. В газовой фазе NO2 и N2O4 постоянно находятся в состоянии химического равновесия и их перенос на поверхность соприкасающихся фаз совершается в соответствии с законами молекулярной диффузии газов. В пограничном слое газ – жидкость происходит переход NO2 в жидкую фазу. Затем после растворения NO2 происходит химическая реакция (7), которая по сравнению с процессом диффузии протекает относительно быстро.
Далее в жидкой фазе происходит сравнительно медленное разложение азотистой кислоты по реакции (8). Образующийся NO частично окисляется в растворе кислородом, но его большая часть взаимодействует с кислородом уже в газовой фазе по реакции (10). Одновременно с абсорбцией и протеканием химических реакции в растворе в газовой фазе частично происходят те же реакции, приводящие к образованию азотной кислоты. Медленным процессом, определяющим скорость поглощения оксидов азота, является диффузия их в жидкую фазу. При взаимодействии паров воды и диоксида азота в газовой фазе происходит образование кислотного тумана, вследствие этого создается дополнительное сопротивления при поглощении оксидов азота.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется такими факторами, как температура, давление, концентрация кислоты. При понижении температуры и концентрации кислоты и повышении давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение почти прекращается. Концентрация получаемой азотной кислоты определяется условиями равновесия NO2 над кислотой.
Следует отметить, что степень окисления NO в NO2 зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности соприкосновения газа с жидкостью. Поэтому одно из основных требований, предъявляемое к абсорбционной аппаратуре, – создание максимального свободного объема при одновременно сильно развитой поверхности поглощения.
В промышленности используют различные типы абсорбционных колонн с колпачковыми тарелками, с ситчатыми тарелками, переливными стаканами и др.
Сырьем служит недорогой и легко доступный синтетический аммиак, который при оптимально подобранных параметрах практически весь идет на получение монооксида азота; реакция протекает необратимо и быстро и не требует рециклов. Применение повышенного давления способствует уменьшению размеров аппаратов и увеличению производительности, но при этом увеличивается температура и количество сеток катализатора. Для обеспечения выхода оксида азота более 98% при давлениях 0,41 – 0,71 МПа необходима температура выше 950 0С, зато время контактирования становится менее 1,1×10-4 с, а скорость газа более 160 л/мин. Вообще, повышение температуры способствует увеличению выхода, но это приводит к большим прямым потерям дорогостоящего катализатора.
Поскольку окисление оксида азота (II) протекает при низких температурах смесь охлаждается водой, которая, превращаясь в пар, идет на технологические нужды, а это экономически выгодно. Абсорбция диоксида азота происходит в колонне очищенной водой, причем степень абсорбции достигает 99%, а содержание оксидов азота в выхлопных газах до 0,11%.
Аммиачно-воздушная смесь, подаваемая в контактный аппарат, не должна содержать более 10%, иначе катализатор не будет полностью покрыт кислородом и начнется окисление аммиака до азота. Хотя максимально возможной концентрацией аммиака, при которой достигается высокий выход, является 11,0 – 11,5%, используется более низкая, поскольку скорость газа велика и необходим запас на случай проскока. Конверсия протекает при температурах 870 – 900 0С и давление 0,716 МПа. Эти параметры были подобраны на основе экономических показателей, т. к. повышение температуры увеличивает как выход, так и прямые потери платинового катализатора.
Реакцию окисления NO в NO2 начинают проводить при температуре 170 0С, достаточной для обеспечения хорошего выхода и скорости. За счет теплоты реакции происходит разогрев до 300 0С. Степень окисления составляет около 85%. Абсорбцию диоксида азота ведут при температуре 35 – 40 0С, поскольку это способствует смещению равновесия вправо, концентрация кислоты на выходе достигает 55-58%.
Функциональная схема получения азотной кислоты.
 В 1960-ых годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т/год под давлением 0,716 МПа с использованием высокотемпературной каталитической очистки выхлопных газов, выпускающий продукцию в виде 53–58% -ной HNO3. Технологическая схема этого производства в упрощенном варианте представлена на рисунке 5.
В 1960-ых годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т/год под давлением 0,716 МПа с использованием высокотемпературной каталитической очистки выхлопных газов, выпускающий продукцию в виде 53–58% -ной HNO3. Технологическая схема этого производства в упрощенном варианте представлена на рисунке 5.
|
 |
Рис.5 Схема производства азотной кислоты под давлением 0,716 МПа с приводом компрессора от газовой турбины:
1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 – топочное устройство; 4 – подогреватель метана; 5 – подогреватель аммиака; 6 – смеситель аммиака и воздуха с пролитовым фильтром; 7 – холодильник-конденсатор; 8 – сепаратор; 9 – абсорбционная колонна; 10 – продувочная колонна; 11 – подогреватель отходящих газов; 12 – подогреватель воздуха; 13 – сосуд для окисления нитрозных газов; 14 – контактный аппарат; 15 – котел‑утилизатор; 16,18 – двухступенчатый турбокомпрессор; 17 – газовая турбина
Атмосферный воздух проходит тщательную очистку в двухступенчатом фильтре 1. Очищенный воздух сжимают двухступенчатым воздушным компрессором. В первой ступени 18 воздух сжимают до 0,35 МПа, при этом он нагревается до 165–175 ºС за счет адиабатического сжатия. После охлаждения воздух направляют на вторую ступень сжатия 16, где его давление возрастает до 0,716 МПа.
Основной поток воздуха после сжатия нагревают в подогревателе воздуха 12 до 250–270 ºС теплотой нитрозных газов и подают на смешение с аммиаком в смеситель 6.
Газообразный аммиак, полученный путем испарения ждкого аммиака, после очистки от влаги, масла и катализаторной пыли через подогреватель 5 при температуре 150 ºС также направляют в смеситель 6. Смеситель совмещен в одном аппарате с поролитовым фильтром. После очистки аммиачно-воздушную смесь с содержанием Nh4 не более 10% подают в контактный аппарат 14 на конверсию аммиака.
Конверсия аммиака протекает на платинородиевых сетках при температуре 870–900 ºС, причем степень конверсии составляет 96%. Нитрозные газы при 890–910 ºС поступают в котел-утилизатор 15, расположенный под контактным аппаратом. В котле за счет охлаждения нитрозных газов до 170 ºС происходит испарение химически очищенной деаэрированной воды, питающей котел-утилизатор; при этом получают пар с давлением 1,5 МПа и температурой 230 ºС, который выдается потребителю.
После котла-утилизатора нитрозные газы поступают в окислитель нитрозных газов 13. Он представляет собой полый аппарат, в верхней части которого установлен фильтр из стекловолокна для улавливания платинового катализатора. Частично окисление нитрозных газов происходит уже в котле-утилизаторе (до 40%). В окислителе 13 степень окисления возрастает до 85%. За счет реакции окисления нитрозные газы нагреваются до 300–335 ºС. Эта теплота используется в подогревателе воздуха 12. Охлажденные в теплообменнике 12 нитрозные газы поступают для дальнейшего охлаждения в теплообменник 11, где происходит снижение их температуры до 150 ºС и нагрев выхлопных (хвостовых) газов до 110–125 ºС. Затем нитрозные газы направляют в холодильник-конденсатор 7, охлаждаемый оборотной водой. При этом конденсируются водяные пары и и образуется слабая азотная кислота. Нитрозные газы отделяют от сконденсировавшейся азотной кислоты в сепараторе 8, из которого азотную кислоту направляют в адсорбционную колонну 9 на 6–7-ю тарелку, а нитрозные газы – под нижнюю тарелку абсорбционной колонны. Сверху в колонну подают охлажденный паровой конденсат. Образующаяся в верхней части колонны азотная кислота низкой концентрации перетекает на нижележащие тарелки. За счет поглощения оксидов азота концентрация кислоты постепенно увеличивается и на выходе достигает ~1%. Поэтому кислота направляется в продувочную колонну 10, где подогретым воздухом из нее отдувают оксиды азота, и отбеленная азотная кислота поступает на склад. Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны 9.
Степень абсорбции оксидов азота достигает 99%. Выходящие из колонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35 ºС проходят подогреватель 11, где нагреваются до 110–145 ºС и поступают в топочное устройство (камера сжигания 3 установки каталитической очитски. Здесь газы нагреваются до температуры 390–450 ºС за счет горения природного газа, подогретого предварительно в подогревателе 4, и направляются в реактор с двухслойным катализатором 2, где первым слоем служит оксид алюминия с нанесенным на него палладием, вторым слоем – оксид алюминия. Очистку осуществляют при 760 ºС. Очищенные газы поступают в газовую турбину 17 при температуре 690–700 ºС; энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомпрессора 18. Затем газы направляют в котел-утилизатор и экономайзер (на схеме не показаны) и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005–0,008%, содержание CO2 – 0,23%.
Расчет материального баланса ХТС.
 |
Рис.2. Структурная блок-схема производства азотной кислоты:
1 – блок подготовки сырья; 2 – блок окисления аммиака; 3 – блок абсорбции нитрозных газов.
Таблица 1
Составы потоков
| № потока | Индекс потока | Ед. измер. | Содержание компонентов | |||
| Nh4 | O2 | N2 | NO | h3O | HNO3 | |
| 1 | 010 | кмоль | 100% | |||
| 2 | 011 | кмоль | 21% | 79% | ||
| 3 | 12 | кмоль | 10% | 18,9% | 71,1% | |
| 4 | 23 | кмоль | Кмоль | кмоль | кмоль | кмоль |
| 5 | 030 | кмоль | кмоль | |||
| 6 | 031 | кмоль | Кмоль | кмоль | ||
| 7 | 301 | кг | 42% | 58% | ||
| 8 | 302 | кмоль | 3,2% | кмоль | кмоль | 2,7% |
Уравнения материального баланса ХТС.
4Nh4 + 5O2 = 4NO + 6h3O + Q
4Nh4 + 3O2 =2N2 + 6h3O + Q
2NO + 1.5O2 + h3O = 2HNO3 + Q
Уравнения для блока контактирования:
По оксиду азота:

По азоту:

По кислороду:

По воде:

Уравнения для блока абсорбции:
По оксиду азота:
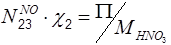
По воде:

По кислороду:

Уравнение для потока выхлопных газов:

Подготовка уравнений для решения на ЭВМ.
Таблица 2
Соответствие переменных потокам
| Наименование потока | Условное обозначение | xi | Размерность | Значение по расчету |
| Аммиачно-воздушная смесь | N12 | x1 | кмоль | 415.33 |
| Оксид азота в потоке 23 | N23NO | x2 | кмоль | 40.29 |
| Азот в потоке 23 | N23N2 | x3 | кмоль | 295.92 |
| Кислород в потоке 23 | N23O2 | x4 | кмоль | 27. 20 |
| Вода в потоке 23 | N23Н2О | x5 | кмоль | 62.30 |
| Вода в блок 3 | N030 | х6 | кмоль | 68. 19 |
| Выхлопные газы | N302 | х7 | кмоль | 373.07 |
| Воздух в блок 3 | N031 | х8 | кмоль | 69.03 |
Таблица 3
Матрица коэффициентов
| № уравнения | bi при xi | Свободный член | |||||
| х1 | х2 | х3 | х4 | х5 | х6 | х7 | х8 |
| 1 | 0,079 | -1 | |||||
| 2 | 0,713 | -1 | |||||
| 3 | 0,187 | -1,25 | -1 | ||||
| 4 | -0,15 | 1 | |||||
| 5 | 1 | 40,286 | |||||
| 6 | 1 | 1 | -0,027 | 120,416 | |||
| 7 | 1 | -0,032 | 0,21 | 29,762 | |||
| 8 | -0,015 | -1 | 0,941 | 0,79 |
Решаем систему с помощью электронных таблиц EXCEL матричным способом: умножая обратную матрицу на матрицу свободных членов.
 |
Таблица 4
Материальный баланс химико-технологической системы производства азотной кислоты на 2500 кг
| Введено | Получено | ||||
| Статья прихода | Масса, кг | % | Статья расхода | Масса, кг | % |
| Аммиак | 706,1 | 4,80 | 58% — ная азотная кислота: | 4310,3 | 29,31 |
| Воздух: | 12771,1 | 86,85 | Азотная кислота | 2500 | 17,00 |
| Кислород | 2975,8 | 20,24 | Вода | 1810,3 | 12,31 |
| Азот | 9795,3 | 66,61 | Выхлопные газы: | 10394,2 | 70,69 |
| Вода | 1227,4 | 8,35 | Оксид азота | 18,1 | 0,12 |
| Азот | 9812,7 | 66,73 | |||
| Кислород | 382,0 | 2,60 | |||
| Вода | 181,3 | 1,23 | |||
| Всего: | 14704,5 | 100 | Всего: | 14704,5 | 100 |
 |
Масштаб: 1 см = кг
Расходные коэффициенты по сырью (аммиаку):
Теоретический расходный коэффициент:

Практический расходный коэффициент:

Конверсия аммиака.
 (по условию).
(по условию).
Выход.

Селективность.
 поскольку степень превращения равна 100%.
поскольку степень превращения равна 100%.
1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. — М.: Высш. шк., 1990. – 520 с.
2. Мухлёнов И.П., Авербух А.Я., Кузнецов Д.А. и др. Под ред. И.П. Мухлёнова. Общая химическая технология: учебник для химико-технологических специпльностей. Т.2. Важнейшие химические производства. — М.: Высш. шк., 1984. – 264 с.
3. Атрощенко В.И., Каргин С.И. Технология азотной кислоты. – М.: Химия, 1970. – 496 с.
www.ronl.ru
Содержание
1. Азотная кислота стр.3
2. Окислительные свойства азотнойкислоты стр. 3
3. Нитраты стр.6
4. Промышленное получение азотнойкислоты стр. 7
5. Круговорот азоты в природе стр. 8
6.Библиография стр.10
1. Азотная кислота.Чистаяазотная кислота HNO<img src="/cache/referats/2925/image002.gif" v:shapes="_x0000_i1025">—бесцветная жидкость плотностью 1,51 г/см<img src="/cache/referats/2925/image004.gif" v:shapes="_x0000_i1026"> при — 42 °С застывающая в прозрачную кристаллическую массу. Навоздухе она, подобно концентрированной солянойкислоте, «дымит», так как пары ее образуют с 'влагойвоздуха мелкие капельки тумана,
Азотнаякислота не отличается прочностью, Уже под влияниемсвета она постепенно разлагается:
<img src="/cache/referats/2925/image006.gif" v:shapes="_x0000_i1027">
Чем выше температура и чем концентрированнее кислота, тембыстрее идет разложение. Выделяющийся диоксид азотарастворяется в кислоте и придает ей бурую окраску.
Азотнаякислота принадлежит к числу наиболее сильных кислот; в разбавленных растворахона полностью распадается на ионы Н<img src="/cache/referats/2925/image008.gif" v:shapes="_x0000_i1028"> и- NO<img src="/cache/referats/2925/image010.gif" v:shapes="_x0000_i1029">.
2. Окислительные свойства азотнойкислоты.Характерным свойством азотнойкислоты является ее ярко выраженная окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы легкоокисляются ею, превращаясь в соответствующиекислоты. Так, сера при кипячении с азотной кислотойпостепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек,погруженный в концентрированную HNO<img src="/cache/referats/2925/image010.gif" v:shapes="_x0000_i1030">, ярко разгорается.
Азотнаякислота действует почти на все металлы (за исключениемзолота, платины, тантала, родия, иридия), превращаяих в нитраты, а некоторые металлы—в оксиды.
КонцентрированнаяHNO<img src="/cache/referats/2925/image010.gif" v:shapes="_x0000_i1031"> пассивирует некоторые металлы.Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется вхолодной концентрированной HNO<img src="/cache/referats/2925/image010.gif" v:shapes="_x0000_i1032">. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром иалюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивноесостояние.
Степеньокисленности азота в азотной кислоте равна 4-5. Выступая в качествеокислителя, НNО<img src="/cache/referats/2925/image015.gif" v:shapes="_x0000_i1033"> можетвосстанавливаться до различных продуктов:
<img src="/cache/referats/2925/image017.gif" v:shapes="_x0000_i1034">
Какоеиз этих веществ образуется, т. е. насколько глубоковосстанавливается азотная кислота в том или иномслучае, зависит от природы восстановителя и отусловий реакции, прежде всего от концентрации кислоты. Чем выше концентрацииHNO<img src="/cache/referats/2925/image015.gif" v:shapes="_x0000_i1035">, тем менее глубоко она восстанавливается. Приреакциях с концентрированной кислотой чаще всеговыделяется <img src="/cache/referats/2925/image019.gif" v:shapes="_x0000_i1036">. При взаимодействииразбавленной азотной кислоты с малоактивными металлами, например, с медью,выделяется NO. В случае болееактивных металлов — железа, цинка, — образуется<img src="/cache/referats/2925/image021.gif" v:shapes="_x0000_i1037">. Сильно разбавленная азотная кислотавзаимодействует с активными металлами—--цинком,магнием, алюминием -— с образованием иона аммония, дающего с кислотой нитратаммония. Обычно одновременно образуются несколько продуктов.
Дляиллюстрации приведем схемы реакций окисления некоторых металлов азотнойкислотой;
<img src="/cache/referats/2925/image023.gif" v:shapes="_x0000_i1038">
Придействии азотной кислоты на металлы водород, какправило, не выделяется.
Приокислении неметаллов концентрированная азотная кислота, как и в случаеметаллов, восстанавливается до <img src="/cache/referats/2925/image025.gif" v:shapes="_x0000_i1039">, например
<img src="/cache/referats/2925/image027.gif" v:shapes="_x0000_i1040">
Более разбавленная кислота обычно восстанавливается до NO,например:
<img src="/cache/referats/2925/image029.gif" v:shapes="_x0000_i1041">
Приведенные схемы иллюстрируют наиболее типичные случаивзаимодействия азотной кислоты с металлами и неметаллами. Вообще же,окислительно-восстановительные реакции, идущие с участием <img src="/cache/referats/2925/image031.gif" v:shapes="_x0000_i1042">, протекают сложно.
Смесь,состоящая из1 объема азотной и 3—4 объемов концентрированной соляной кислоты,называется царской водкой. Царскаяводка растворяет некоторые металлы, не взаимодействующиес азотной кислотой, в томчисле и «царя металлов»—золото. Действие ее объясняетсятем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксидаазота(III),или хлорида нитрозила, <img src="/cache/referats/2925/image033.gif" v:shapes="_x0000_i1043">:
<img src="/cache/referats/2925/image035.gif" v:shapes="_x0000_i1044">
Хлорид нитрозила являетсяпромежуточным продуктом реакции и разлагается:
<img src="/cache/referats/2925/image037.gif" v:shapes="_x0000_i1045">
Хлор в момент выделениясостоит из атомов, что и обусловливает высокуюокислительную способность царской водки. Реакцииокисления золота и платиныпротекают в основном согласно следующим уравнениям.
<img src="/cache/referats/2925/image039.gif" v:shapes="_x0000_i1046">
Сизбытком соляной кислоты хлорид золота(III) и хлорид платины (IV) образуюткомплексные соединения <img src="/cache/referats/2925/image041.gif" v:shapes="_x0000_i1047">
На многиеорганические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органическогосоединения замещаются нитрогруппами <img src="/cache/referats/2925/image019.gif" v:shapes="_x0000_i1048">. Этот процесс называется нитрованиеми имеет большое значение в органической химии.
Азотнаякислота — одно из важнейших соединений азота: в больших количествах онарасходуется в производстве,азотных удобрений, взрывчатых веществ иорганических красителей, служит окислителем вомногих химических процессах, используется впроизводстве серной кислоты по нитрозному способу,применяется для изготовления целлюлозных лаков, кинопленки.
3. Нитраты.Солиазотной кислоты называются нитратами. Все они хорошо растворяются в воде, апри нагревании разлагаются с выделением кислорода. При этом нитраты наиболееактивных металлов переходят в нитриты:
<img src="/cache/referats/2925/image043.gif" v:shapes="_x0000_i1049">
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксидазота. Например:
<img src="/cache/referats/2925/image045.gif" v:shapes="_x0000_i1050">
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
<img src="/cache/referats/2925/image047.gif" v:shapes="_x0000_i1051">
Легко отщепляя кислород, нитраты при высокой температуре являютсяэнергичными окислителями. Их водные растворы, напротив,почти не проявляют окислительных свойств.
Наиболееважное значение имеют нитраты натрия, калия, аммония и кальция, которые напрактике называются селитрами.
<span Arial",«sans-serif»;mso-bidi-font-family:«Times New Roman»">Нитрат натрия
или натриеваяселитра, иногда называемая также чилийскойселитрой, встречается вбольшом количестве в природе только в Чили.Нитраткалия<img src="/cache/referats/2925/image051.gif" v:shapes="_x0000_i1053">,или калийная селитра, в небольших количествахтакже встречается в природе, но главным образом получается искусственно привзаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитраткалия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калияприменяются также при стекловарении и в пищевой промышленности дляконсервирования продуктов.
Нитраткальция<img src="/cache/referats/2925/image053.gif" v:shapes="_x0000_i1054">или кальциеваяселитра, получается в больших количествах нейтрализацией азотной кислотыизвестью; применяется как удобрение.
4. Промышленное получение азотнойкислоты.Современные промышленные способы получения азотной кислотыоснованы на каталитическом окислении аммиака кислородом воздуха. При« описаниисвойств аммиака было указано, что он горит в кислороде, причём продуктамиреакции являются вода и свободный азот. Но в присутствии катализаторов — окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиакас воздухом над катализатором, то при 750 °С и определенном составе смесипроисходит почти полное превращение
<img src="/cache/referats/2925/image055.gif" v:shapes="_x0000_i1055">
Образовавшийся <img src="/cache/referats/2925/image057.gif" v:shapes="_x0000_i1056"> легко переходитв<img src="/cache/referats/2925/image019.gif" v:shapes="_x0000_i1057">, который с водой в присутствии кислорода воздуха даетазотную кислоту.
Вкачестве катализаторов при окислении аммиака используют сплавы на основеплатины.
Получаемаяокислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. Принеобходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислотаконцентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированнуюкислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах изкислотоупорной стали.
5.Круговорот азота в природе.При гниении органических веществзначительная часть содержащегося в них азота превращается в аммиак, которыйпод влиянием живущих в почве нитрифицирующих бактерий окисляется затем вазотную кислоту. Последняя, вступая в реакцию с находящимися в почвекарбонатами, например с карбонатом кальция<img src="/cache/referats/2925/image060.gif" v:shapes="_x0000_i1058">, образует нитраты:
<img src="/cache/referats/2925/image062.gif" v:shapes="_x0000_i1059">
Некоторая же часть азота всегда выделяется при гниении всвободном виде в атмосферу. Свободный азот выделяется также при горенииорганических веществ, при сжигании дров, каменного угля, торфа. Кроме того,существуют бактерии, которые при недостаточном доступе воздуха могут отниматькислород от нитратов, разрушая их с выделением свободного азота. Деятельностьэтих денитрифицирующих бактерий приводит к тому, что часть азота из доступнойдля зеленых растений формы (нитраты) переходит в недоступную (свободный азот).Таким образом, далеко не весь азот, входивший в состав погибших растений,возвращается обратно в почву; часть его постепенно выделяется в свободном виде.
Непрерывная убыль минеральных азотных соединений давно должнабыла бы привести к полному прекращению жизни на Земле, если бы в природе несуществовали процессы, возмещающие потери азота. К таким процессам относятсяпрежде всего происходящие в атмосфере электрические разряды, при которых всегдаобразуется некоторое количество оксидов азота; последние с водой дают азотнуюкислоту, превращающуюся в почве в нитраты. 'Другим источником пополненияазотных соединений почвы является жизнедеятельность так называемых азотобактерий,способных усваивать атмосферный азот. Некоторые из этих бактерий поселяются накорнях растений из семейства бобовых, вызывая образование характерных вздутий —«клубеньков», почему они и получили название клубеньковых бактерий. Усваивая атмосферныйазот, клубеньковые бактерии перерабатывают его в азотные соединения, арастения, в свою очередь, превращают последние в белки и другие сложныевещества.
Такимобразом, в природе совершается непрерывный круговорот азота. Однако ежегодно сурожаем с полей убираются наиболее богатые белками части растений, напримерзерно. Поэтому в почву необходимо вносить удобрения, возмещающие убыль в нейважнейших элементов питания растений.
Изучениевопросов питания растений и повышения урожайности последних путем примененияудобрений является предметом специальной отрасли химия, получившей названиеагрохимии. <span Tms Rmn",«serif»">
www.ronl.ru
1. Азотная кислота. Чистая азотная кислота HNO—бесцветная жидкость плотностью 1,51 г/см при - 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с 'влагой воздуха мелкие капельки тумана, Азотная кислота не отличается прочностью, Уже под влиянием света она постепенно разлагается:
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску. Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н и- NO. 2. Окислительные свойства азотной кислоты. Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO, ярко разгорается. Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды. Концентрированная HNO пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние. Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО может восстанавливаться до различных продуктов:
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется . При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO. В случае более активных металлов — железа, цинка, — образуется. Сильно разбавленная азотная кислота взаимодействует с активными металлами—--цинком, магнием, алюминием -— с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов. Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой;
При действии азотной кислоты на металлы водород, как правило, не выделяется. При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до , например
Более разбавленная кислота обычно восстанавливается до NO, например:
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием , протекают сложно. Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов»—золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота(III), или хлорида нитрозила, :
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям.
С избытком соляной кислоты хлорид золота(III) и хлорид платины (IV) образуют комплексные соединения На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами . Этот процесс называется нитрованием и имеет большое значение в органической химии. Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве, азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки. 3. Нитраты. Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств. Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами. Нитрат натрия или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили. Нитрат калия, или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия. Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов. Нитрат кальция или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение. 4. Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При« описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение
Образовавшийся легко переходит в, который с водой в присутствии кислорода воздуха дает азотную кислоту. В качестве катализаторов при окислении аммиака используют сплавы на основе платины. Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют, Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали. 5. Круговорот азота в природе. При гниении органических веществ значительная часть содержащегося в них азота превращается в аммиак, который под влиянием живущих в почве нитрифицирующих бактерий окисляется затем в азотную кислоту. Последняя, вступая в реакцию с находящимися в почве карбонатами, например с карбонатом кальция, образует нитраты:
Некоторая же часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, каменного угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих денитрифицирующих бактерий приводит к тому, что часть азота из доступной для зеленых растений формы (нитраты) переходит в недоступную (свободный азот). Таким образом, далеко не весь азот, входивший в состав погибших растений, возвращается обратно в почву; часть его постепенно выделяется в свободном виде. Непрерывная убыль минеральных азотных соединений давно должна была бы привести к полному прекращению жизни на Земле, если бы в природе не существовали процессы, возмещающие потери азота. К таким процессам относятся прежде всего происходящие в атмосфере электрические разряды, при которых всегда образуется некоторое количество оксидов азота; последние с водой дают азотную кислоту, превращающуюся в почве в нитраты. 'Другим источником пополнения азотных соединений почвы является жизнедеятельность так называемых азотобактерий, способных усваивать атмосферный азот. Некоторые из этих бактерий поселяются на корнях растений из семейства бобовых, вызывая образование характерных вздутий — «клубеньков», почему они и получили название клубеньковых бактерий. Усваивая атмосферный азот, клубеньковые бактерии перерабатывают его в азотные соединения, а растения, в свою очередь, превращают последние в белки и другие сложные вещества. Таким образом, в природе совершается непрерывный круговорот азота. Однако ежегодно с урожаем с полей убираются наиболее богатые белками части растений, например зерно. Поэтому в почву необходимо вносить удобрения, возмещающие убыль в ней важнейших элементов питания растений. Изучение вопросов питания растений и повышения урожайности последних путем применения удобрений является предметом специальной отрасли химия, получившей название агрохимии.
8
www.ronl.ru
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ
ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ им. М.В. ЛОМОНОСОВА
КАФЕДРА ОХТ
КУРСОВОЙ ПРОЕКТ
Студент Ходаков Д.А.
ГруппаХТ-409
ПреподавательСмирнова С.Н.
Москва 2000
Исходные данные
Содержание Nh4 в аммиачно-воздушной смеси,% (по объему)
________________________________10
Степень превращения Nh4 в NO,% (остальной аммиак окисляется до азота) ________________________________97
Степень переработки нитрозных газов в HNO3,%
_______________________________98,5
Концентрация HNO3,% (по массе)
________________________________58
Содержание в выхлопных газах,% (по объему):
Кислорода
_______________________________3,2
Воды _______________________________2,7
Базис расчета, кг HNO3 в продукте
______________________________2500
Введение
Азотная кислота – одна из важнейших минеральных кислот. По объему производства в химической промышленности она занимает второе место после серной кислоты. Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве:
около 40% ее расходуется на получение сложных и азотных минеральных удобрений;
азотная кислота используется для производства
синтетических красителей,
взрывчатых веществ,
нитролаков,
пластических масс,
лекарственных синтетических веществ и др.;
железо хорошо растворяется в разбавленной азотной кислоте. Концентрационная азотная кислота образует на поверхности железа тонкий, но плотный слой нерастворимого в концентрированной кислоте оксида, защищающего металл от дальнейшего разъедания. Эта способность железа пассивироваться используется для защиты его от коррозии.
Концентрированную азотную кислоту (особенно с добавлением 10% h3SO4) перевозят обычно в стальных цистернах. Многие органические вещества (в частности животные и растительные ткани) при действии HNO3 разрушаются, а некоторые из них от соприкосновения с очень концентрированной кислотой могут воспламеняться. В лабораторной практике обычно применяется азотная кислота, содержащая около 65% HNO3 (пл.1,40). В промышленности применяют два сорта азотной кислоты: разбавленную с содержанием 50–60% HNO3 и концентрированную, содержащую 96–98% HNO3.
Раньше, когда не существовало производства синтетического аммиака, азотную кислоту получали действием серной кислоты на чилийскую селитру. Объемы производств были очень небольшими, и кислота использовалась только для производства взрывчатых веществ, красителей и некоторых других химических продуктов.
Исходное сырье
Сырьем для получения азотной кислоты служат аммиак, воздух и вода.
Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака. Дальнейшая очистка осуществляется в фильтрах, состоящих из чечевицеобразных элементов, фильтрующим материалом в которых служит хлопчатобумажная замша. Тонкой очистке аммиачно–воздушная смесь подвергается в фильтре с поролитовыми трубками.
Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью. Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, орошаемом водой, затем в двухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергается специальной подготовке: отстою от механических примесей, фильтрованию и химической очистке от растворенных в ней солей. Для получения реактивной азотной кислоты требуется чистый паровой конденсат, который дополнительно очищают от возможных примесей. [1, стр.397]
Характеристика целевого продукта
Безводная азотная кислота HNO3 представляет тяжелую бесцветную жидкость, пл.1,52 (при 15 ºС), дымящую на воздухе. Она замерзает при –41 и кипит при 86 ºС. Кипение кислоты сопровождается частичным разложением:
4HNO3 à2h3 + 4NO2 + O2 – 259,7 кДж
Выделяющийся диоксид азота, растворяясь в кислоте, окрашивает ее в желтый или красный (в зависимости от количества NO2) цвет. С водой азотная кислота смешивается в любых соотношениях. Выделение теплоты при разбавлении азотной кислоты водой свидетельствует об образовании гидратов (HNO3×h3O, HNO3×2h3O).
Азотная кислота – сильный окислитель. Металлы, за исключением Pt, Rh, Ir, Au, переводятся концентрированной азотной кислотой в соответствующие оксиды. Если последние растворимы в азотной кислоте, то образуются нитраты. [2, стр.99]
Физико-химическое обоснование основных процессов производства целевого продукта
Химическая концепция метода
Процесс производства разбавленной азотной кислоты складывается из трех стадий:
конверсия аммиака с целью получения оксида азота
4Nh4 + 5O2 = 4NO + 6h3O
окисление оксида азота до диоксида
2NO + O2 Û 2NO2
абсорбция оксидов азота водой
4NO2 + O2 + 2h3O = 4HNO3
Конверсия аммиака
Основная реакция:
4Nh4 + 5O2 = 4NO +6h3O + 946 кДж(1)
Наряду с основной реакцией протекают и побочные реакции (в основном параллельные) окисления аммиака до молекулярного азота и оксида азота(I):
4Nh4 + 3O2 = 2N2 +6h3O + 1328 кДж(2)
4Nh4 + 4O2 = 2N2O +6h3O + 1156 кДж(3)
В таблице 1 приведены термодинамические характеристики этих реакций, из которых можно видеть, что среди реакций окисления аммиака кислородом наибольшую термодинамическую вероятность имеет реакция (2), характеризующаяся наибольшим изменением анергии Гиббса. Вероятность реакции (1) с повышением температуры возрастает почти вдвое, а реакции (2) почти не изменяется.
Реакция
Dh398
кДж/моль
DG, кДж/моль, при температуре
Кр, при температуре
298 К
1173 К
500
1000
1
–226.00
–246.21
–414.55
1075
1051
2
–317. 20
–326.85
–335.22
1095
1062
3
–276.11
–274.75
–
1083
1056
Реакции окисления аммиака сопровождаются значительной убылью свободной энергии. Реакции (1) — (3) практически необратимы, об этом говорят константы равновесия этих реакций в интервале температур 500 — 1000 оС, так как эти константы значительно больше констант обратимых реакций (10-2 — 102). При увеличении температуры до 1000 оС значение констант падает на несколько порядков (так как реакции экзотермические), но даже при 1000 оС реакции (1) — (3) практически полностью смещены в сторону продуктов реакции.
Поскольку все реакции протекают с выделением тепла и увеличением объёма, то в соответствии с принципом Ле-Шателье нам не удастся с помощью варьирования температуры и давления сильно сдвинуть главную реакции в правую сторону не сдвигая туда же и побочные реакции. Увеличение концентрации кислорода тоже не позволит селективно сместить равновесие основной реакции.
Итак, окисление аммиака процесс сложный, и, значит выбор условий проведения процесса определяется необходимостью направить взаимодействие исходных веществ по пути образования оксида азота (II).
В соответствии с вышесказанным единственным путем получения больших выходов NO является увеличение скорости основной реакции по отношению к побочным. В соответствии с уравнением Аррениуса увеличение константы скорости можно добиться с помощью увеличения температуры или уменьшения энергии активации реакции. Константа скорости будет быстрее расти у тех реакций, у которых больше энергия активации.
Снижению энергии активации способствует применение катализаторов. В нашем случае нужны катализаторы активно адсорбирующие на своей поверхности кислород, так как окисление аммиака до оксида азота (II) в объёме даже при высоких температурах не происходит.
Катализаторы, применяемые для окисления аммиака, должны обладать избирательными свойствами, т.е. ускорять только одну из всех возможных реакций, а именно реакцию (1) окисления аммиака до оксида азота(II). Наиболее селективным и активным катализатором данной реакции оказался платиноидный катализатор, представляющий собой сплав платины с палладием и родием.
Каталитическое окисление аммиака – многостадийный гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. Ряд гипотез относительно механизма окисления аммиака на платиноидных катализаторах сводится к предположениям об образовании в процессе окисления Nh4 нестойких промежуточных соединений, которые в результате распада и перегруппировки дают оксид азота(II) и элементный азот.
Скорость каталитического окисления аммиака по реакции (1) очень высока. За десятитысячные доли секунды степень превращения аммиака в оксид азота (II) достигает 97–98% при атмосферном давлении и 95–96% под давлением до 0,88–0,98 МПа. Однако выход оксида азота(II) может быть различным на одном и том же катализаторе в зависимости от выбранных технологических параметров — температуры, давления, линейной скорости газа, содержания аммиака в аммиачно-воздушной смеси, напряженности катализатора, числа сеток и некоторых других факторов.
/>/>Влияние температуры. Температура оказывает наибольшее влияние на выход оксида азота(II). Зависимость выхода NO от температуры на платиновом катализаторе показана на рис.1. При повышении температуры выход NO возрастает, причем существует оптимальная температура (для чистой платины 900-920 С), при которой достигается максимальный выход.
--PAGE_BREAK--Большое значение имеет температура зажигания катализатора, которая зависит от состава катализатора и в меньшей степени от состава аммиачно-воздушной смеси. На платине реакция окисления аммиака начинается при 195 °С. Особенностью окисления является то, что сначала происходит так называемое мягкое окисление аммиака до молекулярного азота. Заметное количество оксида азота(II) начинает появляться при 300 °С. С ростом температуры выход оксида азота(II) растет, достигая максимального значения 96% на чистой платине и 99% на сплавах Pt–Pd–Rh. Проведение процесса при высоких температурах помимо увеличения выхода оксида азота(II) имеет и другие преимущества: растет скорость реакции окисления аммиака и уменьшается время контактирования. Так, при повышении температуры с 650 до 900 °С время контактирования сокращается с 5·10-4 до 1,1·10-4 c. Но при повышении температуры увеличиваются потери дорогостоящей платины, т.е. ухудшаются экономические показатели процесса. Для экономичного проведения окисления аммиака рекомендуются следующие условия:
Давление, Мпа
0.1
0.304–0.51
0.71–1.011
Температура, °С
780–800
850–870
880–920
Повышение температуры с 780 до 850 °С, приводит к увеличению прямых потерь катализатора почти вдвое.
При выборе температуры конверсии необходимо также учитывать наличие примесей в аммиачно-воздушной смеси. Температура должна быть тем выше, чем больше примесей содержится в исходной смеси.
Влияние давления. С ростом давления наблюдается снижение выхода оксида азота(II). Поэтому проектирование и сооружение установок с использованием повышенного давления на стадии конверсии аммиака сдерживались. Вместе с тем использование высокого давления при окислении аммиака позволяет повысить производительность агрегата, уменьшить размеры аппаратов. Этот факт в связи со стремлением к увеличению единичной мощности агрегатов приобретает все большее значение. На современных крупных агрегатах производства азотной кислоты процесс окисления аммиака осуществляется под давлением 0,41– 0,73 МПа.
Основным условием получения высоких выходов NO под давлением выше атмосферного являются повышение температуры и времени контактирования (увеличение числа сеток).
/>Повышением давления в процессе конверсии можно увеличить линейную скорость газа и интенсивность катализатора, что в свою очередь связано с увеличением числа катализаторных сеток. Очевидно, что такие параметры, как давление, линейная скорость газа, интенсивность катализатора, тесно связаны между собой и при выборе режима окисления для получения высокого выхода NO должны подбираться с особой тщательностью.
Влияние концентрации аммиака. Для окисления аммиака, как уже указывалось, применяют воздух. Поэтому концентрация Nh4 в аммиачно-воздушной смеси определяется в том числе содержанием кислорода в воздухе. Согласно уравнению реакции 4Nh4 + 5O2 = 4NO +6h3O для полного окисления 1 моль аммиака необходимо 1.25 моль кислорода. Исходя из этого, определим максимально возможное содержание аммиака в аммиачно-воздушной смеси (объемные доли,%).
Однако при соотношении O2: Nh4 = 1,25 даже при атмосферном давлении выход оксида азота(II) не превышает 60–80%. Кроме того, при содержании в смеси 14.4% Nh4, пришлось бы работать в области взрывоопасных концентраций. Нижний предел взрываемости аммиачно-воздушной смеси при атмосферном давления составляет 13,8% Nh4.
/>Пределы взрываемости аммиачно-воздушных смесей показаны на рис.2. При увеличении соотношения O2: Nh4 до 1,7, что соответствует содержанию аммиака в смеси 11,5%, выход NO возрастает. При дальнейшем увеличении соотношения O2: Nh4 путем снижения концентрации аммиака выход оксида азота(II) меняется незначительно.
/>/>/>/>
Таким образом, при использовании воздуха максимально возможной концентрацией аммиака в аммиачно-воздушной смеси, при которой достигается высокий выход NO, является 11,0–11,5%, и соотношение O2: Nh4 = 1,7 при температурах 870 – 920 °С. На рис.3 представлена зависимость выхода NO от соотношения O2: Nh4, в аммиачно-воздушной смеси. Для получения высокого выхода NO необходим примерно 30% -ный избыток кислорода сверх стехиометрического. Это связано с тем, что поверхность платинового катализатора должна быть постоянно насыщена кислородом (в отсутствие кислорода аммиак уже при 500 °С начинает разлагаться на азот и кислород).
Катализаторы. Превосходство платины по активности и селективности над всеми другими видами катализаторов было показано в 1902 г. Оствальдом. Характерно, что активность к реакции окисления аммиака проявляет подавляющее большинство металлов и их соединений, но высокий выход NO (выше 90%) обеспечивают очень немногие из них.
Обладая высокой активностью и селективностью, платина имеет низкую температуру зажигания ~200 °С, хорошую пластичность, тягучесть. Недостаток платины – ее быстрое разрушение при высоких температурах под воздействием больших скоростных потоков реагентов и катал изаторных ядов. Это приводит к потерям дорогостоящего катализатора и снижению выхода NO, что и явилось причиной поисков каталитически активных сплавов платины с другими металлами.
Проведенные промышленные испытания показали стабильную работу катализаторов из платины с добавками палладия, а также из тройного сплава Pt–Rh–Pd; это и послужило основанием для их промышленной реализации. Наибольшее распространение получили следующие катализаторы окисления аммиака (ГОСТ 3193-59):
Pt + 4% Pd + 3.5% Rh – для работы при атмосферном давлении и Pt + 7,5% Rh – при повышенном давлении.
Используемые для контактного окисления Nh4 катализаторы изготавливают в виде сеток. Такая форма катализатора удобна в эксплуатации, связана с минимальными затратами металла, позволяет применять наиболее простои и удобный в эксплуатации тип контактного аппарата. В России применяются сетки из проволоки диаметром 0,09 мм (ГОСТ 3193-74), размер стороны ячейки 0,22 мм, число ячеек на 1 см длины – 32, на 1 см2 – 1024.
Платинородиевые (ГИАП-1) и платинородиевопалладиевые (сплав № 5) катализаторы весьма чувствительны к ряду примесей, которые содержатся в аммиаке и воздухе. К таким примесям относятся гидриды фосфора и мышьяка, фтор и его соединения, дихлорэтан, минеральные масла, ацетилен, диоксид серы, сероводород и др. Наиболее сильными ядами катализатора являются соединения серы и фтора. Примеси заметно снижают селективность катализатора, способствуют увеличению потерь платины. Для поддержания стабильной степени конверсии аммиака необходима тщательная очистка аммиачно-воздушной смеси и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксиды железа, попадая на катализаторные сетки, засоряют их. уменьшая поверхность соприкосновения газов с поверхностью катализатора, и снижают степень окисления аммиака.
Чистоту исходных веществ в производстве азотной кислоты обеспечивают двумя путями – осуществлением дальнего забора воздуха и усовершенствованием систем очистки воздуха и аммиака.
В процессе реакции окисления аммиака поверхность платиноидных сеток сильно разрыхляется, эластичные нити сеток становятся хрупкими. При этом поверхность сетки увеличивается примерно в 30 раз Сначала это ведет к повышению каталитической активности катализатора, а затем к разрушению сеток. Практикой установлены следующие сроки работы катализаторных сеток: для работы под атмосферным давлением – до 14 мес. под давлением 0,73 МПа 8–9 мес.
Время контактирования. Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтому увеличение объемной скорости оказывает положительное влияние на интенсивность процесса. С повышением, до определенного предела, объемной скорости поток газовой смеси становится более турбулентным, что увеличивает скорость диффузии исходных веществ к поверхности катализатора. Наряду с этим уменьшается время соприкосновения газовой смеси с горячими стенками аппаратов, что снижает возможность окисления аммиака до азота. С уменьшением времени контактирования выход NO увеличивается и при t = 1·10-4 с достигает максимума (рис.4). При дальнейшем росте объемной скорости (уменьшении t) возможен проскок аммиака, который за контактной зоной превращается в элементарный азот при окислении кислородом. Не исключена также возможность образования азота при взаимодействии аммиака с оксидом азота(II).
В заводских условиях в зависимости от качества катализатора и точности соблюдения заданного технологического режима достигается значительная селективность процесса, и выход оксида азота(II) составляет 98%. При оптимальных условиях проведения процесса и правильном подборе конструкционных материалов побочные реакции не имеют существенного значения.
/>/>
Окисление оксида азота (II)
Нитрозные газы, полученные при окислении аммиака, содержат оксид азота(II), азот, кислород и пары воды. При переработке нитрозных газов в азотную кислоту необходимо окислить оксид азота(II) до диоксида. Реакция окисления обратима,
2NO + O2 Û2NO2 + 124 кДж
протекает с уменьшением объема и сопровождается выделением теплоты. Следовательно, в соответствии с принципом Ле Шателье, снижение температуры и повышение давления способствуют смещению равновесия реакции вправо, т.е. в сторону образования NO2. Ниже приведены значения константы равновесия реакции окисления для различных температур.
t, °С
20
100
200
300
500
900
Kp
1.24·1013
1.82·107
7.41·103
45.5
8.5·10-2
1.51·10-4
Из которых видно, что при температурах до 100 °С равновесие реакции практически полностью сдвинуто в сторону образования NO2. При более высокой температуре равновесие смещается в левую сторону и при температуре выше 700 °С образования диоксида азота практически не происходит. В связи с этим в горячих нитрозных газах, выходящих из контактного аппарата, NO2 отсутствует, и для его получения газовую смесь необходимо охладить до температуры ниже 100 °С.
/>
Как видно из уравнения для константы равновесия при повышении парциального давления кислорода парциальное давление оксида азота(IV) также увеличится так как от общего давления константа равновесия зависит очень мало.
Окисление оксида азота(II) – самая медленная стадия производства азотной кислоты. Скорость реакции окисления, определяющую скорость всего процесса, можно выразить следующим образом:
/>
Онa сильно зависит от концентрации реагентов, давления и температуры. Применение в производстве азотной кислоты воздуха, обогащенного кислородом, или чистого кислорода позволяет получать нитрозные газы с повышенным содержанием оксида азота(II) и увеличить скорость окисления NO в NO2.
Реакция окисления NO в NO2 ускоряется при понижении температуры, а с повышением температуры замедляется почти до полного прекращения. Для объяснения этого явления предложено несколько гипотез, одна из которых, наиболее признанная, заключается в том, что окисление NO в NО2 идет через образование промежуточного продукта – димера оксида азота(II):
продолжение --PAGE_BREAK--2NO Û(NO) 2 + Q
O2 + (NO) 2 Û2NO2 + Q
Образование димера оксида азота – процесс обратимый, протекающий с выделением теплоты. Следовательно, повышение температуры вызовет смещение равновесия этой реакции в левую сторону. При этом константа равновесия будет уменьшаться и равновесная концентрация димера в газовой смеси будет понижаться. Скорость дальнейшего окисления димера в диоксид зависит от
/>
концентрации димера /> Таким образом, уменьшение скорости окисления оксида азота в диоксид с повышением температуры можно объяснить сильным снижением концентрации димера.
В установках, работающих под атмосферным давлением, окисляют оксид азота примерно на 92%, а оставшийся NO поглощают (совместно с NO2) щелочью, так как для окисления понадобилось бы много времени и соответственно большие объемы аппаратуры. Обычно переработку нитрозных газов в разбавленную кислоту проводят при температурах 10–50 °С, при которых часть диоксида азота полимеризуется в N2O4:
2NO2 Û N2O4 + 57 кДж
Зависимость степени полимеризации NO2 от температуры характеризуется следующими данными:
Температура, °С
200
100
70
30
-20
Степень поли-, меризации%
0.7
2.5
38
77.8
89
92
Скорость полимеризации NO2 очень высока, поэтому в любой момент времени числовое значение отношения NO2: N2O4 определяется условиями равновесия, которое устанавливается практически мгновенно. Так как реакция протекает с уменьшением объема, то увеличение давления способствует образованию N2O4.
Нитрозные газы, поступающие на абсорбцию, содержат NO2;. N2O4, NO, N2O, N2, N2O3 пары воды.
Абсорбция диоксида азота
Все оксиды азота, за исключением NO, взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота водой связано с растворением в ней NO2, N2O4, N2O3 и с образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота(II) и воду. Абсорбция протекает по схеме
2NO2 + h3O ÛHNO3 + HNO2 + 116 кДж(7)
3HNO2 ÛHNO3 + 2NO + h3O – 76 кДж(8)
Суммарно взаимодействие NO2 с водой можно представить уравнением реакции
3NO2 + h3O Û2HNO3 + NO + 136 кДж(9)
которое является исходным для всех расчетов процесса абсорбции. Из него следует, что из 3 моль NO2 образуется 2 моль НNO3 и 1 моль NO, который снова окисляется до NO2:
2NO + O2 Û2NO2(10)
Механизм образования разбавленной азотной кислоты можно представить следующим образом. В газовой фазе NO2 и N2O4 постоянно находятся в состоянии химического равновесия и их перенос на поверхность соприкасающихся фаз совершается в соответствии с законами молекулярной диффузии газов. В пограничном слое газ – жидкость происходит переход NO2 в жидкую фазу. Затем после растворения NO2 происходит химическая реакция (7), которая по сравнению с процессом диффузии протекает относительно быстро.
Далее в жидкой фазе происходит сравнительно медленное разложение азотистой кислоты по реакции (8). Образующийся NO частично окисляется в растворе кислородом, но его большая часть взаимодействует с кислородом уже в газовой фазе по реакции (10). Одновременно с абсорбцией и протеканием химических реакции в растворе в газовой фазе частично происходят те же реакции, приводящие к образованию азотной кислоты. Медленным процессом, определяющим скорость поглощения оксидов азота, является диффузия их в жидкую фазу. При взаимодействии паров воды и диоксида азота в газовой фазе происходит образование кислотного тумана, вследствие этого создается дополнительное сопротивления при поглощении оксидов азота.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется такими факторами, как температура, давление, концентрация кислоты. При понижении температуры и концентрации кислоты и повышении давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение почти прекращается. Концентрация получаемой азотной кислоты определяется условиями равновесия NO2 над кислотой.
Следует отметить, что степень окисления NO в NO2 зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности соприкосновения газа с жидкостью. Поэтому одно из основных требований, предъявляемое к абсорбционной аппаратуре, – создание максимального свободного объема при одновременно сильно развитой поверхности поглощения.
В промышленности используют различные типы абсорбционных колонн с колпачковыми тарелками, с ситчатыми тарелками, переливными стаканами и др.
Обоснование предлагаемой технологии
Сырьем служит недорогой и легко доступный синтетический аммиак, который при оптимально подобранных параметрах практически весь идет на получение монооксида азота; реакция протекает необратимо и быстро и не требует рециклов. Применение повышенного давления способствует уменьшению размеров аппаратов и увеличению производительности, но при этом увеличивается температура и количество сеток катализатора. Для обеспечения выхода оксида азота более 98% при давлениях 0,41 – 0,71 МПа необходима температура выше 950 0С, зато время контактирования становится менее 1,1×10-4 с, а скорость газа более 160 л/мин. Вообще, повышение температуры способствует увеличению выхода, но это приводит к большим прямым потерям дорогостоящего катализатора.
Поскольку окисление оксида азота (II) протекает при низких температурах смесь охлаждается водой, которая, превращаясь в пар, идет на технологические нужды, а это экономически выгодно. Абсорбция диоксида азота происходит в колонне очищенной водой, причем степень абсорбции достигает 99%, а содержание оксидов азота в выхлопных газах до 0,11%.
Обоснование выбора технологических параметров
Аммиачно-воздушная смесь, подаваемая в контактный аппарат, не должна содержать более 10%, иначе катализатор не будет полностью покрыт кислородом и начнется окисление аммиака до азота. Хотя максимально возможной концентрацией аммиака, при которой достигается высокий выход, является 11,0 – 11,5%, используется более низкая, поскольку скорость газа велика и необходим запас на случай проскока. Конверсия протекает при температурах 870 – 900 0С и давление 0,716 МПа. Эти параметры были подобраны на основе экономических показателей, т. к. повышение температуры увеличивает как выход, так и прямые потери платинового катализатора.
Реакцию окисления NO в NO2 начинают проводить при температуре 170 0С, достаточной для обеспечения хорошего выхода и скорости. За счет теплоты реакции происходит разогрев до 300 0С. Степень окисления составляет около 85%. Абсорбцию диоксида азота ведут при температуре 35 – 40 0С, поскольку это способствует смещению равновесия вправо, концентрация кислоты на выходе достигает 55-58%.
Функциональная схема получения азотной кислоты.
Описание технологической схемы процесса
В 1960-ых годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т/год под давлением 0,716 МПа с использованием высокотемпературной каталитической очистки выхлопных газов, выпускающий продукцию в виде 53–58% -ной HNO3. Технологическая схема этого производства в упрощенном варианте представлена на рисунке 5.
/>
/>
Рис.5 Схема производства азотной кислоты под давлением 0,716 МПа с приводом компрессора от газовой турбины:
1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 – топочное устройство; 4 – подогреватель метана; 5 – подогреватель аммиака; 6 – смеситель аммиака и воздуха с пролитовым фильтром; 7 – холодильник-конденсатор; 8 – сепаратор; 9 – абсорбционная колонна; 10 – продувочная колонна; 11 – подогреватель отходящих газов; 12 – подогреватель воздуха; 13 – сосуд для окисления нитрозных газов; 14 – контактный аппарат; 15 – котел утилизатор; 16,18 – двухступенчатый турбокомпрессор; 17 – газовая турбина
Атмосферный воздух проходит тщательную очистку в двухступенчатом фильтре 1. Очищенный воздух сжимают двухступенчатым воздушным компрессором. В первой ступени 18 воздух сжимают до 0,35 МПа, при этом он нагревается до 165–175 ºС за счет адиабатического сжатия. После охлаждения воздух направляют на вторую ступень сжатия 16, где его давление возрастает до 0,716 МПа.
Основной поток воздуха после сжатия нагревают в подогревателе воздуха 12 до 250–270 ºС теплотой нитрозных газов и подают на смешение с аммиаком в смеситель 6.
Газообразный аммиак, полученный путем испарения ждкого аммиака, после очистки от влаги, масла и катализаторной пыли через подогреватель 5 при температуре 150 ºС также направляют в смеситель 6. Смеситель совмещен в одном аппарате с поролитовым фильтром. После очистки аммиачно-воздушную смесь с содержанием Nh4 не более 10% подают в контактный аппарат 14 на конверсию аммиака.
Конверсия аммиака протекает на платинородиевых сетках при температуре 870–900 ºС, причем степень конверсии составляет 96%. Нитрозные газы при 890–910 ºС поступают в котел-утилизатор 15, расположенный под контактным аппаратом. В котле за счет охлаждения нитрозных газов до 170 ºС происходит испарение химически очищенной деаэрированной воды, питающей котел-утилизатор; при этом получают пар с давлением 1,5 МПа и температурой 230 ºС, который выдается потребителю.
После котла-утилизатора нитрозные газы поступают в окислитель нитрозных газов 13. Он представляет собой полый аппарат, в верхней части которого установлен фильтр из стекловолокна для улавливания платинового катализатора. Частично окисление нитрозных газов происходит уже в котле-утилизаторе (до 40%). В окислителе 13 степень окисления возрастает до 85%. За счет реакции окисления нитрозные газы нагреваются до 300–335 ºС. Эта теплота используется в подогревателе воздуха 12. Охлажденные в теплообменнике 12 нитрозные газы поступают для дальнейшего охлаждения в теплообменник 11, где происходит снижение их температуры до 150 ºС и нагрев выхлопных (хвостовых) газов до 110–125 ºС. Затем нитрозные газы направляют в холодильник-конденсатор 7, охлаждаемый оборотной водой. При этом конденсируются водяные пары и и образуется слабая азотная кислота. Нитрозные газы отделяют от сконденсировавшейся азотной кислоты в сепараторе 8, из которого азотную кислоту направляют в адсорбционную колонну 9 на 6–7-ю тарелку, а нитрозные газы – под нижнюю тарелку абсорбционной колонны. Сверху в колонну подают охлажденный паровой конденсат. Образующаяся в верхней части колонны азотная кислота низкой концентрации перетекает на нижележащие тарелки. За счет поглощения оксидов азота концентрация кислоты постепенно увеличивается и на выходе достигает ~1%. Поэтому кислота направляется в продувочную колонну 10, где подогретым воздухом из нее отдувают оксиды азота, и отбеленная азотная кислота поступает на склад. Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны 9.
продолжение --PAGE_BREAK--Степень абсорбции оксидов азота достигает 99%. Выходящие из колонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35 ºС проходят подогреватель 11, где нагреваются до 110–145 ºС и поступают в топочное устройство (камера сжигания 3 установки каталитической очитски. Здесь газы нагреваются до температуры 390–450 ºС за счет горения природного газа, подогретого предварительно в подогревателе 4, и направляются в реактор с двухслойным катализатором 2, где первым слоем служит оксид алюминия с нанесенным на него палладием, вторым слоем – оксид алюминия. Очистку осуществляют при 760 ºС. Очищенные газы поступают в газовую турбину 17 при температуре 690–700 ºС; энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомпрессора 18. Затем газы направляют в котел-утилизатор и экономайзер (на схеме не показаны) и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005–0,008%, содержание CO2 – 0,23%.
Расчет материального баланса ХТС.
/>/>/>/>/>/>/>/>/>Блок-схема
Рис.2. Структурная блок-схема производства азотной кислоты:
1 – блок подготовки сырья; 2 – блок окисления аммиака; 3 – блок абсорбции нитрозных газов.
Таблица 1
Составы потоков
№ потока
Индекс потока
Ед. измер.
Содержание компонентов
Nh4
O2
N2
NO
h3O
HNO3
1
010
кмоль
100%
2
011
кмоль
21%
79%
3
12
кмоль
10%
18,9%
71,1%
4
23
кмоль
Кмоль
кмоль
кмоль
кмоль
5
030
кмоль
кмоль
6
031
кмоль
Кмоль
кмоль
7
301
кг
42%
58%
8
302
кмоль
3,2%
кмоль
кмоль
2,7%
Уравнения материального баланса ХТС.
4Nh4 + 5O2 = 4NO + 6h3O + Q
4Nh4 + 3O2 =2N2 + 6h3O + Q
2NO + 1.5O2 + h3O = 2HNO3 + Q
Уравнения для блока контактирования:
По оксиду азота:
/>
По азоту:
/>
По кислороду:
/>
По воде:
/>
Уравнения для блока абсорбции:
По оксиду азота:
/>
По воде:
/>
По кислороду:
/>
Уравнение для потока выхлопных газов:
/>
Подготовка уравнений для решения на ЭВМ.
Таблица 2
Соответствие переменных потокам
Наименование потока
Условное обозначение
xi
Размерность
Значение по расчету
Аммиачно-воздушная смесь
N12
x1
кмоль
415.33
Оксид азота в потоке 23
N23NO
x2
кмоль
40.29
Азот в потоке 23
N23N2
x3
кмоль
295.92
Кислород в потоке 23
N23O2
x4
кмоль
27. 20
Вода в потоке 23
N23Н2О
x5
кмоль
62.30
Вода в блок 3
N030
продолжение --PAGE_BREAK--х6
кмоль
68. 19
Выхлопные газы
N302
х7
кмоль
373.07
Воздух в блок 3
N031
х8
кмоль
69.03
Таблица 3
Матрица коэффициентов
№ уравнения
bi при xi
Свободный член
х1
х2
х3
х4
х5
х6
х7
х8
1
0,079
-1
2
0,713
-1
3
0,187
-1,25
-1
4
-0,15
1
5
1
40,286
6
1
1
-0,027
120,416
7
1
-0,032
0,21
29,762
8
-0,015
-1
0,941
0,79
Решаем систему с помощью электронных таблиц EXCEL матричным способом: умножая обратную матрицу на матрицу свободных членов.
Результаты расчета.
Таблица 4
Материальный баланс химико-технологической системы производства азотной кислоты на 2500 кг
Введено
Получено
Статья прихода
Масса, кг
%
Статья расхода
Масса, кг
%
Аммиак
706,1
4,80
58% — ная азотная кислота:
4310,3
29,31
Воздух:
12771,1
86,85
Азотная кислота
2500
17,00
Кислород
2975,8
20,24
Вода
1810,3
12,31
Азот
9795,3
66,61
Выхлопные газы:
10394,2
70,69
Вода
1227,4
8,35
Оксид азота
18,1
0,12
Азот
9812,7
66,73
Кислород
382,0
2,60
Вода
181,3
1,23
Всего:
14704,5
100
Всего:
14704,5
100
/>Поточная диаграмма материального баланса
Масштаб: 1 см = кг
Расчет основных технологических показателей процесса
Расходные коэффициенты по сырью (аммиаку):
Теоретический расходный коэффициент:
/>
Практический расходный коэффициент:
/>
Конверсия аммиака.
/>(по условию).
Выход.
/>
Селективность.
/>поскольку степень превращения равна 100%.
Список используемой литературы
Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. — М.: Высш. шк., 1990. – 520 с.
Мухлёнов И.П., Авербух А.Я., Кузнецов Д.А. и др. Под ред. И.П. Мухлёнова. Общая химическая технология: учебник для химико-технологических специпльностей. Т.2. Важнейшие химические производства. — М.: Высш. шк., 1984. – 264 с.
Атрощенко В.И., Каргин С.И. Технология азотной кислоты. – М.: Химия, 1970. – 496 с.
www.ronl.ru