Реферат на тему:
Сюда установлено перенаправление со страницы Рак (заболевание). Согласно общепринятой в русском языке медицинской терминологии, под раком подразумевают только злокачественные новообразования из эпителиальной ткани. Если вы ищете информацию о злокачественных новообразованиях вообще, см. статью Злокачественная опухоль.[1]
Карцинома (др.-греч. καρκίνος — «краб», -ωμα от ὄγκωμα — «опухоль»), рак — вид злокачественной опухоли, развивающейся из клеток эпителиальной ткани различных органов (кожи, слизистых оболочек и многих внутренних органов)[2].
Файл:Tkanka nablonkowa.pngРазличные виды эпителия
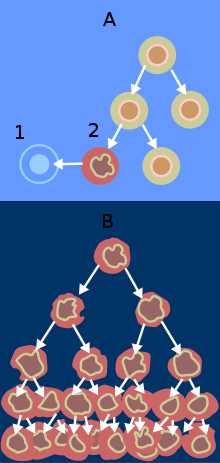
Обычные клетки, если они повреждены, подвергаются апоптозу (А). Раковые клетки же апоптозу не подвергаются и продолжают делиться (В).
Общей характеристикой злокачественных опухолей является их выраженный тканевой атипизм (утрата клетками способности к дифференцировке с нарушением структуры ткани, из которой происходит опухоль), агрессивный рост с поражением как самого органа, так и других близлежащих органов, склонность к метастазированию, то есть к распространению клеток опухоли с током лимфы или крови по всему организму с образованием новых очагов опухолевого роста во многих органах, удалённых от первичного очага. По темпам роста большинство злокачественных опухолей превосходят доброкачественные и, как правило, могут достигать значительных размеров в короткие сроки. Различают также вид злокачественных местнодеструктирующих опухолей, которые растут с образованием инфильтрата в толще ткани, приводя к её разрушению, но, как правило, не метастазируют (базалиома кожи).
Рак впервые описан в египетском папирусе примерно 1600 г. до н. э.[3] В папирусе рассказывается о нескольких формах рака молочной железы и сообщается, что от этой болезни нет лечения. Название «рак» произошло от введённого Гиппократом (460—370 до н. э.) термина «карцинома», обозначавшего злокачественную опухоль с перифокальным воспалением. (Гиппократ назвал опухоль карциномой, потому что она внешне напоминает краба.) Он описал несколько видов рака, а также предложил термин oncos (греч.). Римский врач Авл Корнелий Цельс (Aulus Cornelius Celsius) в I в. до н. э. предложил на ранней стадии лечить рак удалением опухоли, а на поздних — не лечить вообще. Он перевёл греческое слово carcinos на латынь (cancer — рак). Гален использовал слово oncos для описания всех опухолей, что и дало современный корень слову онкология.
4 февраля отмечается Всемирный день борьбы против рака, установленный «Международным союзом по борьбе с онкологическими заболеваниями».
Заболеваемость злокачественными опухолями непрерывно растёт. Ежегодно в мире регистрируется порядка 6 миллионов новых случаев заболевания злокачественными опухолями. Наиболее высокая заболеваемость среди мужчин отмечена во Франции (361 на 100 000 населения), среди женщин в Бразилии (283,4 на 100 000). Отчасти это объясняется старением населения. Следует отметить, что большинство опухолей развивается у лиц старше 50 лет, а каждый второй онкологический больной старше 60 лет. Наиболее часто поражаются предстательная железа и лёгкие у мужчин и молочная железа у женщин. Смертность от онкологических заболеваний занимает в мире второе место после заболеваний сердечно-сосудистой системы.
На данный момент известно большое количество факторов, способных запустить механизмы канцерогенеза (вещества или факторы окружающей среды, обладающие таким свойством, называют канцерогенами).
В целом воздействуя на клетку, канцерогены вызывают определённые нарушения её структуры и функции (в особенности ДНК), что называется инициацией. Повреждённая клетка таким образом приобретает выраженный потенциал к малигнизации. Повторное воздействие канцерогена (того же, что вызвал инициацию, или любого другого) приводит к необратимым нарушениям механизмов, контролирующих деление, рост и дифференцировку клеток, в результате которых клетка приобретает ряд способностей, не свойственных нормальным клеткам организма — промоция. В частности, опухолевые клетки приобретают способность к бесконтрольному делению, теряют тканеспецифическую структуру и функциональную активность, изменяют свой антигенный состав и пр. Рост опухоли (опухолевая прогрессия) характеризуется постепенным снижением дифференцировки и увеличением способности к бесконтрольному делению, а также изменением взаимосвязи опухолевая клетка — организм, что приводит к образованию метастазов. Метастазирование происходит преимущественно лимфогенным путём (то есть с током лимфы) в регионарные лимфоузлы, или же гематогенным путём (с током крови) с образованием метастазов в различных органах (лёгкие, печень, кости и т. д.).
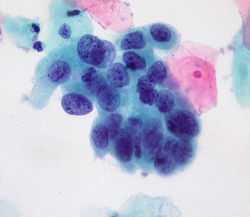
Опухолевые клетки карциномы отличаются от нормальных высоким отношением объема ядра (тёмные области) к объему всей клетки (светлые)
Строение карциномы в значительной степени зависит от структурно-функциональных особенностей клеток органов, из которых она развилась. Так, из клеток, контактирующих с внешней средой (эпителий кожи, слизистой оболочки рта, пищевода, гортани, прямой кишки), развивается опухоль, состоящая из многослойного плоского эпителия (ороговевающего и неороговевающего), которая носит название плоскоклеточной карциномы (плоскоклеточный рак). Из эпителия железистых тканей (железы бронхов, молочная железа, простата) развивается опухоль железистой структуры (железистый рак) — аденокарцинома. По степени дифференцировки выделяют
Для высокодифференцированных опухолей характерно строение, близкое строению ткани, из которой образовалась данная опухоль. В случае средне- и малодифференцированных опухолей сходство структуры опухоли и исходной ткани снижается, становится стёртым. Иногда клеточный и тканевой атипизм новообразования могут быть настолько выраженными, что определить тканевую принадлежность опухоли практически невозможно (недифференцированные опухоли). Как правило, они характеризуются высокой степенью злокачественности (то есть способностью образовывать метастазы). В зависимости от преобладания в структуре опухоли стромы (соединительной ткани) или паренхимы (раковых клеток), различают простой рак, в котором строма и паренхима развиты в одинаковой степени, медуллярный рак, в структуре которого преобладает паренхима, и фиброзный рак (скирр), в котором преобладает строма. Многие раковые клетки (особенно с высоким уровнем дифференцировки) сохраняют за собой функцию исходной ткани. Так, клетки аденокарциномы (рак из железистой ткани) могут продуцировать слизь.
Рак щитовидной железы. Илл. 1914 года
Данная классификация использует числовое обозначение различных категорий для обозначения распространения опухоли, а также наличия или отсутствия локальных и отдалённых метастазов.
От латинского слова tumor — опухоль. Описывает и классифицирует основной очаг опухоли.
От латинского nodulus — узел. Описывает и характеризует наличие регионарных метастазов, то есть в регионарные лимфатические узлы.
Характеристика наличия отдалённых метастазов, то есть — в отдалённые лимфоузлы, другие органы, ткани (исключая прорастание опухоли).
Для некоторых органов или систем применяются дополнительные параметры (P или G, в зависимости от системы органов), характеризующие степень дифференцировки её клеток.
Симптоматика рака зависит главным образом от месторасположения опухоли, от темпов её роста, наличия метастазов. Наиболее частыми признаками являются:
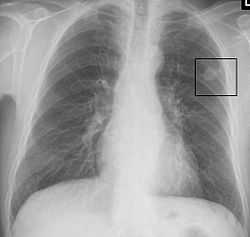
Рентгенограмма органов грудной клетки, демонстрирующая фокус затемнения в верхней доле левого лёгкого, подозрительный на периферический рак.
Своевременное обращение к врачу, тщательный сбор анамнеза, проведение внимательного осмотра пациента часто способствуют выявлению рака на ранних стадиях, поддающихся лечению. Особое внимание следует уделять выявлению предопухолевых заболеваний (пигментная ксеродермия, эритроплазия Кейра, меланоз Дюбрея, врождённый множественный полипоз толстой кишки), наличие которых предполагает как лечение, так и постоянный контроль за состоянием здоровья больного[4]. Для выявления опухоли применяются все доступные диагностические методы, например:
.
Лечение рака зависит от типа опухоли, её локализации, строения, стадии заболевания в соответствии с классификацией TNM.
Различают следующие типы лечения:
На данный момент наиболее хорошие результаты в лечении рака наблюдаются при использовании комбинированных методов лечения (хирургического, лучевого и химиотерапевтического)[7].
Перспективным направлением в лечении являются методы локального воздействия на опухоли, такие как химиоэмболизация.
Прогноз для больных раком зависит от множества факторов: своевременное обнаружение опухоли, её локализация, стадия развития и т. д. Выявление рака на ранних стадиях развития, как правило, ведёт к полному выздоровлению больного под действием адекватного лечения. Наличие распространённых метастазов, как правило, определяет неблагоприятный прогноз.
wreferat.baza-referat.ru
Реферат на тему:
Сюда установлено перенаправление со страницы Рак (заболевание). Согласно общепринятой в русском языке медицинской терминологии, под раком подразумевают только злокачественные новообразования из эпителиальной ткани. Если вы ищете информацию о злокачественных новообразованиях вообще, см. статью Злокачественная опухоль.[1]
Карцинома (др.-греч. καρκίνος — «краб», -ωμα от ὄγκωμα — «опухоль»), рак — вид злокачественной опухоли, развивающейся из клеток эпителиальной ткани различных органов (кожи, слизистых оболочек и многих внутренних органов)[2].
Файл:Tkanka nablonkowa.pngРазличные виды эпителия

Обычные клетки, если они повреждены, подвергаются апоптозу (А). Раковые клетки же апоптозу не подвергаются и продолжают делиться (В).
Общей характеристикой злокачественных опухолей является их выраженный тканевой атипизм (утрата клетками способности к дифференцировке с нарушением структуры ткани, из которой происходит опухоль), агрессивный рост с поражением как самого органа, так и других близлежащих органов, склонность к метастазированию, то есть к распространению клеток опухоли с током лимфы или крови по всему организму с образованием новых очагов опухолевого роста во многих органах, удалённых от первичного очага. По темпам роста большинство злокачественных опухолей превосходят доброкачественные и, как правило, могут достигать значительных размеров в короткие сроки. Различают также вид злокачественных местнодеструктирующих опухолей, которые растут с образованием инфильтрата в толще ткани, приводя к её разрушению, но, как правило, не метастазируют (базалиома кожи).
Рак впервые описан в египетском папирусе примерно 1600 г. до н. э.[3] В папирусе рассказывается о нескольких формах рака молочной железы и сообщается, что от этой болезни нет лечения. Название «рак» произошло от введённого Гиппократом (460—370 до н. э.) термина «карцинома», обозначавшего злокачественную опухоль с перифокальным воспалением. (Гиппократ назвал опухоль карциномой, потому что она внешне напоминает краба.) Он описал несколько видов рака, а также предложил термин oncos (греч.). Римский врач Авл Корнелий Цельс (Aulus Cornelius Celsius) в I в. до н. э. предложил на ранней стадии лечить рак удалением опухоли, а на поздних — не лечить вообще. Он перевёл греческое слово carcinos на латынь (cancer — рак). Гален использовал слово oncos для описания всех опухолей, что и дало современный корень слову онкология.
4 февраля отмечается Всемирный день борьбы против рака, установленный «Международным союзом по борьбе с онкологическими заболеваниями».
Заболеваемость злокачественными опухолями непрерывно растёт. Ежегодно в мире регистрируется порядка 6 миллионов новых случаев заболевания злокачественными опухолями. Наиболее высокая заболеваемость среди мужчин отмечена во Франции (361 на 100 000 населения), среди женщин в Бразилии (283,4 на 100 000). Отчасти это объясняется старением населения. Следует отметить, что большинство опухолей развивается у лиц старше 50 лет, а каждый второй онкологический больной старше 60 лет. Наиболее часто поражаются предстательная железа и лёгкие у мужчин и молочная железа у женщин. Смертность от онкологических заболеваний занимает в мире второе место после заболеваний сердечно-сосудистой системы.
На данный момент известно большое количество факторов, способных запустить механизмы канцерогенеза (вещества или факторы окружающей среды, обладающие таким свойством, называют канцерогенами).
В целом воздействуя на клетку, канцерогены вызывают определённые нарушения её структуры и функции (в особенности ДНК), что называется инициацией. Повреждённая клетка таким образом приобретает выраженный потенциал к малигнизации. Повторное воздействие канцерогена (того же, что вызвал инициацию, или любого другого) приводит к необратимым нарушениям механизмов, контролирующих деление, рост и дифференцировку клеток, в результате которых клетка приобретает ряд способностей, не свойственных нормальным клеткам организма — промоция. В частности, опухолевые клетки приобретают способность к бесконтрольному делению, теряют тканеспецифическую структуру и функциональную активность, изменяют свой антигенный состав и пр. Рост опухоли (опухолевая прогрессия) характеризуется постепенным снижением дифференцировки и увеличением способности к бесконтрольному делению, а также изменением взаимосвязи опухолевая клетка — организм, что приводит к образованию метастазов. Метастазирование происходит преимущественно лимфогенным путём (то есть с током лимфы) в регионарные лимфоузлы, или же гематогенным путём (с током крови) с образованием метастазов в различных органах (лёгкие, печень, кости и т. д.).

Опухолевые клетки карциномы отличаются от нормальных высоким отношением объема ядра (тёмные области) к объему всей клетки (светлые)
Строение карциномы в значительной степени зависит от структурно-функциональных особенностей клеток органов, из которых она развилась. Так, из клеток, контактирующих с внешней средой (эпителий кожи, слизистой оболочки рта, пищевода, гортани, прямой кишки), развивается опухоль, состоящая из многослойного плоского эпителия (ороговевающего и неороговевающего), которая носит название плоскоклеточной карциномы (плоскоклеточный рак). Из эпителия железистых тканей (железы бронхов, молочная железа, простата) развивается опухоль железистой структуры (железистый рак) — аденокарцинома. По степени дифференцировки выделяют
Для высокодифференцированных опухолей характерно строение, близкое строению ткани, из которой образовалась данная опухоль. В случае средне- и малодифференцированных опухолей сходство структуры опухоли и исходной ткани снижается, становится стёртым. Иногда клеточный и тканевой атипизм новообразования могут быть настолько выраженными, что определить тканевую принадлежность опухоли практически невозможно (недифференцированные опухоли). Как правило, они характеризуются высокой степенью злокачественности (то есть способностью образовывать метастазы). В зависимости от преобладания в структуре опухоли стромы (соединительной ткани) или паренхимы (раковых клеток), различают простой рак, в котором строма и паренхима развиты в одинаковой степени, медуллярный рак, в структуре которого преобладает паренхима, и фиброзный рак (скирр), в котором преобладает строма. Многие раковые клетки (особенно с высоким уровнем дифференцировки) сохраняют за собой функцию исходной ткани. Так, клетки аденокарциномы (рак из железистой ткани) могут продуцировать слизь.
Рак щитовидной железы. Илл. 1914 года
Данная классификация использует числовое обозначение различных категорий для обозначения распространения опухоли, а также наличия или отсутствия локальных и отдалённых метастазов.
От латинского слова tumor — опухоль. Описывает и классифицирует основной очаг опухоли.
От латинского nodulus — узел. Описывает и характеризует наличие регионарных метастазов, то есть в регионарные лимфатические узлы.
Характеристика наличия отдалённых метастазов, то есть — в отдалённые лимфоузлы, другие органы, ткани (исключая прорастание опухоли).
Для некоторых органов или систем применяются дополнительные параметры (P или G, в зависимости от системы органов), характеризующие степень дифференцировки её клеток.
Симптоматика рака зависит главным образом от месторасположения опухоли, от темпов её роста, наличия метастазов. Наиболее частыми признаками являются:

Рентгенограмма органов грудной клетки, демонстрирующая фокус затемнения в верхней доле левого лёгкого, подозрительный на периферический рак.
Своевременное обращение к врачу, тщательный сбор анамнеза, проведение внимательного осмотра пациента часто способствуют выявлению рака на ранних стадиях, поддающихся лечению. Особое внимание следует уделять выявлению предопухолевых заболеваний (пигментная ксеродермия, эритроплазия Кейра, меланоз Дюбрея, врождённый множественный полипоз толстой кишки), наличие которых предполагает как лечение, так и постоянный контроль за состоянием здоровья больного[4]. Для выявления опухоли применяются все доступные диагностические методы, например:
.
Лечение рака зависит от типа опухоли, её локализации, строения, стадии заболевания в соответствии с классификацией TNM.
Различают следующие типы лечения:
На данный момент наиболее хорошие результаты в лечении рака наблюдаются при использовании комбинированных методов лечения (хирургического, лучевого и химиотерапевтического)[7].
Перспективным направлением в лечении являются методы локального воздействия на опухоли, такие как химиоэмболизация.
Прогноз для больных раком зависит от множества факторов: своевременное обнаружение опухоли, её локализация, стадия развития и т. д. Выявление рака на ранних стадиях развития, как правило, ведёт к полному выздоровлению больного под действием адекватного лечения. Наличие распространённых метастазов, как правило, определяет неблагоприятный прогноз.
wreferat.baza-referat.ru
Московская медицинская академия им. И.М. Сеченова
Кафедра пропедевтики внутренних болезней
Реферат
на тему:
«Рак желудка»
Выполнил:
Преподаватель:
Москва
План:
Вступление
Патологическая анатомия рака желудка
Клиника и диагностика.
Лечение.
Список использованной литературы.
Вступление
Рак желудка – злокачественная опухоль из клеток эпителия слизистой оболочки желудка. Наибольшее число больных относится к возрастной группе старше 50 лет. Мужчины болеют раком желудка чаще, чем женщины.
Эффективность хирургического лечения рака желудка остается пока еще низкой из-за поздней выявляемости заболевания. К стойкому излечению может вести только радикальная операция, выполненная на ранней стадии развития рака. Основной путь улучшения результатов хирургического лечения рака желудка лежит через диагностику доклинических или ранних форм рака.
Патологическая анатомия рака желудка.
Локализация рака в желудке: антральный отдел – 60-70%, малая кривизна тела желудка – 10-15%, кардиальный отдел – 8-10%, передняя и задняя стенки – 2-5%, большая кривизна – 1%, свод желудка – 1%, тотальное поражение желудка – 3-5%.
Внутриорганное распространение рака желудка происходит по типу инфильтрации, преимущественно по направлению к кардии, распространение за пределы привратника на двенадцатиперстную кишку происходит реже по лимфатическим сосудам подслизистого и мышечного слоев. Проникая через все слои стенки желудка, опухоль прорастает в соседние ткани и органы.
По макроскопической картине роста выделяют три основные группы: опухоли с преимущественно экзофитным ростом (бляшковидный, полипообразны, блюдцеобразный рак, рак из язвы и др.), опухоли с преимущественно эндофитным ростом (инфильтративно-язвенный, дифузный или фиброзный рак), смешанные опухоли, имеющие черты экзо- и эндофитного роста. Последние две группы более злокачественны и чаще дают метастазы.
По микроскопической картине все виды рака желудка разделяют на две основные группы: дифференцированные и недифференцированные. Недеференцированные виды рака характеризуются большей злокачественностью, чем дифференцированные.
Рак желудка метастазирует преимущественно лимфогенно. Возможно гематогенное метастазирование, а также путем имплантации раковых клеток по брюшине.
При радикальной операции операции по поводу рака желудка обязательно надо удалять не только ближайшие лимфатические узлы ближайшего лимфатического бассейна, но и регионарные лимфатические узлы третьего бассейна, содержащего наиболее мощные лимфатические узлы и магистральные лимфатические сосуды.
Во внутренние органы метастазы рака попадают гематогенным путем (при прорастании опухоли в сосуды системы воротной вены) или лимфогенным путем через грудной проток, впадающий в венозное русло. Гематогенные метастазы чаще определяются в печени, значительно реже в легких, плевре, надпочечниках, костях, почках.
Имплантационные метастазы возникают при контактном переносе опухолевых клеток, а также при свободном их перемещении по брюшной полости. Раковые клетки оседают на поверхности большого сальника, образуют на брюшине мелкобугристые высыпания (карциноматоз брюшины), опускаясь в малый таз, образуют метастазы в прямокишечной-пузырной (у мужчин) и в прямокишечной влагалищной (у женщин) складках (метастазы Шницлера), в яичниках (метастаз Крукенберга).
Комитетом международного противоракового союза предложена классификация рака желудка по системе TNM.
Т – опухоль
TIS – внутриэпителиальный рак.
Т1 – опухоль поражает только слизистую оболочку и подслизистый слой.
Т2 – опухоль проникает глубоко, занимает не более половины одного анатомического отдела.
Т3 – опухоль с глубокой инвазией захватывает более половины одного анатомического отдела, но не поражает соседние анатомические отделы.
Т4 – опухоль поражает более одного анатомического отдела и распространяется на
соседние органы.
N – регионарные лимфатические узлы.
N0 – метастазы в регионарные лимфатические узлы не определяются.
Nа – поражены только перигастральные лимфатические узлы.
Nb – поражены лимфатические узлы по ходу левой желудочной, чревной, общей
печеночной, селезеночной артерий, по ходу печеночно-дуоденальной связки.
NXc – поражены лимфатические узлы по ходу аорты, брыжеечных и подвздошных
артерий.
М – отдаленные метастазы.
М0 – отдаленные метастазы не определяются.
М1- имеются отдаленные метастазы.
Р – гистопатологические критерии
Р1 – опухоль инфильтрирует только слизистую оболочку.
Р2 – опухоль инфильтрирует подслизистый слой до мышечного.
Р3 – опухоль инфильтрирует мышечный слой до серозной оболочки.
Р4 – опухоль прорастает серозную оболочку или выходит за пределы органа.
Клиника и диагностика
Клинических признаков, характерных для начальной формы рака желудка, не существует. Он может протекать бессимптомно или проявляться признаками заболевания, на фоне которого он развивается.
Ранняя диагностика рака возможна при массовом эндоскопическом обследовании населения. Гастроскопия позволяет обнаружить изменения на слизистой оболочке желудка диаметром менее 0,5 см. и взять биопсию для верификации диагноза.
Заболевание раком желудка более вероятна в группе людей повышенного онкологического риска. К факторам повышенного онкологического риска относятся: предраковые заболевания желудка (хронический гастрит, хроническая язва желудка, полипы желудка), хронический гастрит культи желудка у оперированных по поводу неонкологических заболеваний желудка через 5 лет и более после резекции желудка, действие профессиональных вредностей (химическое производство).
Клинические проявления рака желудка многообразны, они зависят от патологического фона, на котором развивается опухоль, т.е. от предраковых заболеваний, локализации опухоли, формы ее роста, гистологической структуры, стадии распространения и развития осложнений.
Симптомы, которые могут быть выявлены при расспросе больного, можно условно разделить на местные и общие проявления заболевания. К местным проявлениям относят симптомы “желудочного дискомфорта”: отсутствие физического удовлетворения от насыщения, тупая давящая характерная боль, чувство переполнения и распирания в эпигатральной области, снижение или отсутствие аппетита, отвращение к мясу, рыбе.
Общие проявления рака желудка: слабость, похудание, вялость, адинамия, быстрая утомляемость от привычной работы, депрессия. Все это связано с опухолевой интоксикацией. Часто наблюдается анемия. Иногда анемия является первым признаком заболевания. Развитие железодефицитной анемии связано с ахилией, ведущей к нарушению всасывания железа, и с хроническими кровопотерями из опухоли.
Лечение
Лечение – хирургическое. Рак желудка – абсолютное показание к операции. Радикальным вмешательством является резекция желудка или гастрэктомия.
Радикальность операции предусматривает:
1) пересечение желудка, двенадцатиперстной кишки и пищевода в пределах здоровых тканей;
2) удаление в едином блоке с желудком трех групп лимфатических узлов, которые могут быть поражены метастазами при данной локализации рака;
3) абластическое оперирование т.е. использование комплекса приемов, направленных на уменьшение возможности так называемой манипуляционной диссеминации.
Противопоказания к операции могут быть онкологического и общего характера. Операция противопоказана при наличии отдаленных метастазов в печень, легкие, в надключичные лимфатические узлы, при наличии большого асцита. Противопоказаниями общего характера является резкая кахексия, тяжелые сопутствующие заболевания.
Основные типы радикальных операций:
1) дистальная субтотальная резекция желудка (выполняемая черезбрюшинно),
2) гастрэктомия (выполняемая черезбрюшинным и черезплевральным доступом),
3) проксимальная субтотальная резекция желудка (выполняемая черезбрюшинным и черезплевральным доступом).
Паллятивные операции выполняют тогда, когда риск их небольшой. Паллятивные резекции 2/3 или направлены на удаление стенозирующей опухоли выходного отдела желудка, распадающейся или кровоточащей опухоли как источника кровотечения угрожающего жизни больного.
Наиболее благоприятные результаты хирургического лечения рака желудка могут быть получены при лечении ранних форм рака. При поражении только слизистой оболочки 5-летняя выживаемость достигает 96-100%, при поражении слизистой оболочки и подслизистого слоя – 75%.
Список использованной литературы
Хирургические болезни, Н.П. Напалков, Изд. Медицина, Ленинград 1976 г.
Внутренние болезни, Ф.И. Комаров, Изд. Медицина, Москва 1990 г.
Хирургические болезни, М.И.Кузин, Изд. Медицина, Москва 1986 г.
5
studfiles.net
Реферат на тему:
Рак лёгкого (бронхогенный рак, бронхогенная карцинома) — злокачественное новообразование лёгкого, происходящее из эпителиальной ткани бронхов различного калибра. В зависимости от места появления подразделяется на центральный и периферический.
Рак легких является серьезной медицинской и социальной проблемой, в развитых странах он является наиболее часто встречающейся злокачественной опухолью и является наиболее распространенной причиной смерти от онкологической патологии. Согласно данным международного агентства по изучению рака, ежегодно в мире регистируется около 1 миллиона новых случаев рака легких, и 60 % онкологических больных погибает в результате данного заболевания. [1]
В России рак легких так же занимает 1 место среди онкологических заболеваний и его доля в данной патологии составляет 12 %, в 15 % случаев у погибших онкобольных был выставлен диагноз рак легкого. Мужчины болеют раком легких значительно чаще, каждая 4 злокачественная опухоль у мужчин является раком легких, у женщин же — только каждая 12. По данным 2000 года рак легкого стал причиной смерти 32 % мужчин, и 7,2 % женщин, у которых были обнаружены какие-либо злокачественные новообразования.[1]
К основным причинам любого рака относят канцерогены (например, табачного дыма), ионизирующее излучение и вирусную инфекцию. Их воздействие вызывает кумулятивные изменения ДНК в выстилающей ткани бронхов лёгких (бронхиальном эпителии). Чем больше ткани повреждено, тем выше риск развития рака.[2]
Курение табака на сегодняшний день — основная причина рака лёгкого.[3] Сигаретный дым содержит более 60 известных канцерогенов,[4] в том числе радиоизотопы радона, нитрозамин и бензопирен. Кроме того, полагают, что никотин подавляет иммунную систему, способствует озлокачествлению тканей.[5] В развитых странах почти 90 % случаев смертельного рака лёгких вызваны курением.[6] Среди курящих мужчин, пожизненный риск развития рака лёгких составляет 17,2 %, среди курящих женщин — 11,6 %. Этот риск значительно ниже у некурящих: 1,3 % у мужчин и 1,4 % у женщин.[7]
Женщины, которые курят и получают гормональную терапию, имеют гораздо более высокий риск смерти от рака лёгкого. В исследовании, проведённом Члебовски и др. в 2009 году, было показано, что женщины, принимающие гормоны, имеют на 60 % выше вероятность смерти от рака лёгких, чем женщины, принимающие плацебо. Среди женщин, которые курили (бывшие и нынешние курильщицы), 3,4 % из них, кто принимал гормоны умерло от рака лёгких по сравнению с 2,3 % женщин, принимавших плацебо.[8]
Со стажем курения табака увеличивается вероятность развития рака лёгкого у человека. Если человек прекращает курить, эта вероятность неуклонно уменьшается, так как повреждённые лёгкие восстанавливаются, и загрязняющие частицы постепенно удаляются.[9] Кроме того, есть свидетельства, что рак лёгких у никогда не куривших имеет лучший прогноз, чем у курильщиков,[10] и поэтому пациенты, которые курят на момент установления диагноза, имеют меньшую выживаемость, чем те, которые давно бросили курить.[11]
Пассивное курение (вдыхание дыма табака от другого курильщика) — причина рака лёгких у некурильщиков. Исследования в США,[12] Европе,[13] Великобритании[14] и Австралии[15] показали значительное увеличение относительного риска среди тех, кто подвергается пассивному курению. Последние исследования показали, что выдыхаемый курильщиком дым более опасен, чем вдыхание его прямо из сигареты.[16] 10-15 % больных раком лёгких никогда не курили.[17]
Радон — газ без цвета и запаха, образуемый при распаде радиоактивного радия, который в свою очередь является продуктом распада урана, обнаруживаемого в коре Земли. Радиоактивные продукты распада ионизируют генетический материал, вызывая мутации, которые иногда приводят к возникновению злокачественных опухолей. Воздействие радона — вторая причина рака лёгкого в общей популяции, после курения[18] с увеличением риска от 8 % до 16 % на каждые 100 Бк/м³ увеличения концентрации радона.[19] Уровень концентрации радонового газа зависит от местности и состава основных пород почв и камней. Например, в зонах, таких как Корнуолл в Великобритании (где имеются запасы гранита), радон — большая проблема, и здания должны быть хорошо вентилируемыми для создания низкой концентрации радона.
Ржавые тельца при асбестозе. Окраска гематоксилином и эозином.
Асбест может вызывать различные лёгочные заболевания, включая рак лёгких. Существует взаимоусиливающий эффект курения табака и асбестоза в возникновении рака лёгкого[20]. Асбестоз также может вызывать рак плевры, называемый мезотелиома (который следует дифференцировать от рака лёгкого).
Вирусы известны способностью вызывать рак лёгких у животных,[21][22] и последние данные свидетельствуют о способности его вызывать у человека. К таким вирусам относят вирус папилломы человека[23], JC вирус[24], обезьяний вирус 40 (SV40), BK вирус и цитомегаловирус[25]. Эти вирусы могут влиять на клеточный цикл и подавлять апоптоз, способствуя неконтролируемому делению клеток.
Исследования Американского общества рака выявили прямую связь воздействия пылевых частиц с раком лёгких. Например, если концентрация пыли в воздухе увеличивается только на 1 %, риск развития рака лёгких возрастает на 14 %[26], [27]. Кроме того, установлено, что важен размер частиц пыли, так как ультрадисперсные частицы способны проникать в глубокие слои лёгких.[28]
Согласно отечественной классификации, рак лёгкого подразделяется на следующие стадии:
Согласно TNМ-классификации, опухоли определяют:
T — первичная опухоль:
N — регионарные лимфатические узлы
М — отдаленные метастазы
G — гистопатологическая градация
| Крупноклеточный рак лёгкого | 80.4 |
| Мелкоклеточный рак лёгкого | 16.8 |
| Карциноид[30] | 0.8 |
| Саркома[31] | 0.1 |
| Неуточнённая злокачественная опухоль лёгкого | 1.9 |
Согласно гистологической классификации рак лёгкого подразделяется на следующие виды:
I. Плоскоклеточный (эпидермоидный) рак
Мелкоклеточная карцинома лёгкого.
II. Мелкоклеточный рак
III. Аденокарцинома
IV. Крупноклеточный рак
V. Смешанный рак
Гистологическая характеристика рака лёгкого достаточно условна, поскольку клиническое течение может сильно различаться даже для опухолей с одинаковой структурой. Медленнее всего растёт дифференцированный плоскоклеточный рак; для недифференцированного рака характерно быстрое течение с обширным метастазированием. Мелкоклеточный рак лёгкого принадлежит к числу самых злокачественных опухолей. Он отличается коротким анамнезом, скрытым и быстрым протеканием, ранним метастазированием, плохим прогнозом.
Рак лёгкого метастазирует тремя путями: лимфогенным, гематогенным и имплантационным.
Наиболее характерен первый путь — в расположенные рядом пульмональные, бронхопульмональные, бифуркационные, трахеобронхиальные, паратрахеальные, околопищеводные (параэзофагеальные) лимфатические узлы. На первом этапе лимфогенного метастазирования поражаются лёгочные лимфатические узлы у места деления долевого бронха на сегментарные. Далее процесс распространяется на бронхопульмональные лимфоузлы вдоль долевых бронхов. На третьем этапе метастазы возникают в корневых лимфоузлах вдоль главного бронха и сосудов корня лёгкого, верхних и нижних трахеобронхиальных лимфоузлах и лимфоузлах у нижней стенки непарной вены. На четвёртом этапе в процесс вовлекаются паратрахеальные, ретрокавальные, предаортокаротидные, перикардиальные и параэзофагеальные лимфоузлы.
Отдалённое метастазирование возможно в печень, лимфатические узлы средостения и надключичной области.
Гематогенное метастазирование присоединяется при прорастании опухолью кровеносных сосудов — в печень, лёгкие, почки, кость и надпочечники.
При прорастании плевры возможен перенос опухолевых клеток по плевре.
Клинические проявления рака лёгкого существенно зависят от локализации первичного опухолевого узла.
Центральный рак лёгкого. Опухоль, происходящая из слизистой оболочки крупного бронха, проявляет себя довольно рано. При своём росте она раздражает слизистую оболочку бронха, вызывает нарушение бронхиальной проходимости и вентиляции сегмента, доли или всего легкого в виде гиповентиляции и ателектаза. В дальнейшем прорастая нервные стволы и плевру, опухоль вызывает болевой синдром и нарушение иннервации соответствующего нерва (диафрагмального, возвратного или блуждающего), а также картину вовлечения плевры в опухолевый процесс. Присоединяющееся местное метастазирование приводит к появлению вторичных симптомов со стороны пораженных органов и систем.
Когда опухоль прорастает бронх, появляется кашель, вначале сухой, затем со светлой мокротой, иногда с примесью крови. Возникает гиповентиляция сегмента лёгкого и затем его ателектаз. Мокрота становится гнойной, что сопровождается повышением температуры тела, общим недомоганием, одышкой. Присоединяется раковая пневмония, которая сравнительно легко излечивается, но часто рецидивирует. К раковой пневмонии может присоединиться раковый плеврит, сопровождающийся болевым синдромом.
Если опухоль прорастает блуждающий нерв, присоединяется осиплость ввиду паралича голосовых мышц. Поражение диафрагмального нерва вызывает паралич диафрагмы. Прорастание перикарда проявляется болями в области сердца.
Поражение опухолью или её метастазами верхней полой вены вызывает нарушение оттока крови и лимфы из верхней половины туловища, верхних конечностей, головы и шеи. Лицо больного становится одутловатым, с цианотичным оттенком, набухают вены на шее, руках, грудной клетке.
Периферический рак лёгкого. Периферическая опухоль в начальной стадии протекает бессимптомно ввиду отсутствия болевых окончаний в лёгочной ткани. В дальнейшем опухолевый узел увеличивается, прорастает бронхи, плевру и соседние органы; впоследствии в центре опухоли могут возникнуть распад и кровотечение.
При раке лёгкого могут наблюдаться следующие местные симптомы: кашель, выделение крови с мокротой, осиплость голоса, синдром сдавливания опухолью верхней полой вены и смещения средостения, симптомы прорастания опухолью соседних органов. Особенно характерной клинической картиной, в связи с локализацией, проявляется рак верхушки легкого с синдромом Панкоста.
При раковом плеврите присоединяется синдром сдавливания лёгкого экссудатом.
К общим симптомам относятся общее ухудшение состояния организма, характерное для развития злокачественных опухолей: интоксикация, одышка, слабость, потеря веса, повышение температуры тела. Для рака лёгкого добавляются также нарушение обмена кальция, дерматит и деформация пальцев по типу «барабанных палочек».
В запущенных стадиях присоединяются симптомы метастатического поражения жизненно важных органов, а также присоединяющиеся к опухолевому росту процессы распада опухоли и лёгочной ткани, бронхиальной непроходимости, ателектазы, тяжёлые лёгочные кровотечения.
При клиническом обследовании определяют внешнюю симптоматику развития рака лёгкого:
Рентгенологическое исследование является одним из основных методов диагностики опухолей лёгкого и позволяет своевременно обнаружить его у 80 % больных. В качестве скринингового метода используется флюорография, которая обычно проводится во время профилактических медосмотров. При выявлении изменений на флюорограмме или при наличии клинических показаний применяют рентгенографию в двух проекциях и компьютерную томографию. Кроме того, компьютерная томография является наиболее информативным методом диагностики метастазов в других органах.
Бронхоскопия позволяет визуально исследовать трахею, главные, долевые, сегментарные, субсегментарные бронхи и, в некоторых случаях, бронхи 6-го, 7-го и более порядков. При этом можно непосредственно увидеть опухоль и осуществить её биопсию. Бронхоскопия считается обязательной при подозрении на рак лёгкого.
Трансторакальная пункционная биопсия применяется при невозможности проведения других методов (бронхоскопия, катетеризация бронхов, анализ мокроты). Показаниями к её проведению являются:
При трансторакальной пункции проводят прокол грудной клетки, отбирают пробу непосредственно из опухоли и исследуют клетки под микроскопом. Такой метод диагностики позволяет подтвердить диагноз у значительного числа больных (62-87 % случаев в зависимости от локализации опухоли).
Ультразвуковое исследование является эффективным методом выявления врастания злокачественной опухоли в структуры стенки, масштабного затемнения лёгочной ткани (из-за её уплотнения, плеврального выпота и др.), а через ткань безвоздушного лёгкого получается увидеть непосредственно опухолевый узел.
Такая диагностика является безопасной, простой и сравнительно недорогой. Она позволяет определить опухолевое поражение органов средостения: верхней полой вены, перикарда и камер сердца, правой и левой лёгочных артерий, лёгочных вен, аорты, пищевода, левого предсердия, а также степень применимости хирургического лечения опухоли.
Хирургическое вмешательство подразделяется на:
При радикальной операции удалению подвергается весь опухолевый комплекс: первичный очаг, регионарные лимфатические узлы, клетчатка с путями метастазирования. К условно-радикальной операции добавляют лучевую и лекарственную терапию. Следует учитывать также и то, что часть первичной опухолевой ткани и метастазы иногда не могут быть хирургически удалены ввиду угрозы кровотечения или процессов распада в ателектазе.
Противопоказаниями к радикальной операции являются:
Хирургическому удалению опухоли часто сопутствует широкое удаление корневых, трахеобронхиальных лимфоузлов, клетчатки и лимфоузлов средостения, резекция грудной стенки, перикарда, диафрагмы, бифуркации трахеи, предсердия, магистральных сосудов (аорты, верхней полой вены), мышечной стенки пищевода и других тканей, проросших опухолью.
Лучевое лечение рака лёгкого проводится при его неоперабельных формах, в случае отказа больного от оперативного лечения, а также наличии серьёзных противопоказаний к оперативному вмешательству. Наибольший эффект наблюдается при лучевом воздействии на плоскоклеточные и недифференцированные формы рака лёгкого.
Лучевое вмешательство применяется как для радикального, так и паллиативного лечения. При радикальном лучевом лечении облучению подвергают как саму опухоль, так и зоны регионального метастазирования, то есть средостение, общей дозой 60-70 Гр.
При немелкоклеточном раке лёгкого химиотерапия проводится при наличии противопоказаний к хирургическому и лучевому лечению. При этом назначаются следующие препараты: доксорубицин, цисплатин, винкристин, этопозид, циклофосфамид, метотрексат, блеомицин, нитрозилмочевина, винорелбин, паклитаксел, доцетаксел, гемцетабин и др., применяемые курсами с интервалами в 3-4 недели (до 6 курсов).
Частичное уменьшение размеров первичной опухоли и метастазов наблюдается не у всех больных, полное исчезновение злокачественного новообразования происходит редко. Химиотерапия неэффективна при отдалённых метастазах в печени, костях, головном мозге.
Паллиативное лечение рака лёгкого применяется в том случае, когда возможности противоопухолевого лечения ограничены или исчерпаны. Такое лечение направлено на улучшение качества жизни неизлечимых больных и включает в себя:
Паллиативная помощь при раке лёгкого применяется для борьбы с одышкой, кашлем, кровохарканьем, болевыми ощущениями. Проводится лечение присоединяющеся к опухолевому процессу пневмонии и пневмонита, возникающего при лучевой и химиотерапии.
Методы паллиативного лечения во многом индивидуальны и зависят от состояния больного.
В случае нелеченного рака лёгкого погибает до 90 % больных в течение 2 лет с момента установления диагноза. При использовании хирургического метода можно достичь 30%-й выживаемости больных в течение 5 лет. Раннее обнаружение опухоли позволяет повысить шансы на излечение: на стадии T1N0M0 она достигает 80 %. Совместное проведение хирургического, лучевого и медикаментозного лечения позволяет поднять 5-летнюю выживаемость ещё на 40 %. Наличие метастазов значительно ухудшает прогноз.
wreferat.baza-referat.ru