
Министерство Образования Российской Федерации
Московский Государственный Институт Электроники и Математики
(Технический Университет)
Кафедра «материаловедения ЭС»
Курсовая работа по материаловедению ЭС
На тему:
«Магний и его сплавы»
Выполнил:
студент гр. РС-51
Носов П.Д.
Проверил:
Васильевский В.В.
Москва 2010 год
Содержание
Магний и его сплавы.
Физические и химические свойства.
Соединения магния.
Магниды.
Применение магнидов в технике.
Появление электролитического способа получения магния.
Разработка термических способов получения магния.
История применения магния.
Неконструкционное применение магния.
Конструкционное применение магния..
Использованная литература.
Магний и его сплавы.
Магний – один из самых распространенных в земной коре элементов, он занимает VI место после кислорода, кремния, алюминия, железа и кальция. В литосфере (по А.П.Виноградову) содержание магния составляет 2,1%. В природе магний встречается только в виде соединений. Он входит в состав многих минералов: карбонатов, силикатов и др. К числу важнейших из таких минералов относятся, в частности, углекислые карбонатные породы, образующие огромные массивы на суше и даже целые горные хребты – магнезит MgCO3 и доломит MgCO3CaCO3. Под слоями различных наносных пород совместно с залежами каменной соли известны колоссальные залежи и другого легкорастворимого магнийсодержащего минерала – карналлита MgCl2KCl6h3O (в Соликамске, например, пласты карналлита достигают мощности до 100 м). Кроме того, во многих минералах магний тесно связан с кремнеземом, образуя, например, оливин [(Mg, Fe)2SiO4] и реже встречающийся форстерит (Mg2SiO4). Другие магнийсодержащие минералы – это бруцит Mg(OH)2, кизерит MgSO4, эпсонит MgSO47h3O, каинит MgSO4KCl3h3O. На поверхности Земли магний легко образует водные силикаты (тальк, асбест и др.), примером которых может служить серпентин 3MgO2SiO22h3O. Из известных науке 1500 минералов около 200 (более 13%) содержат магний. Однако природные соединения магния широко встречаются и в растворенном виде. Кроме различных минералов и горных пород, 0,13% магния в виде MgCl2 постоянно содержатся в водах океана (его запасы здесь неисчерпаемы – около 61016 т) и в соленых озерах и источниках. В растительных и животных организмах магний содержится в количествах порядка сотых долей процента, а в состав хлорофилла входит до 2% Mg. Общее содержание этого элемента в живом веществе Земли оценивается величиной порядка 1011 тонн. При недостатке магния приостанавливается рост и развитие растений. Накапливается он преимущественно в семенах. Введение магниевых соединений в почву заметно повышает урожайность некоторых культурных растений (например, свеклы).
Металлический магний был впервые получен в 1828 г. А. Бюсси. Основной способ получения магния – электролиз расплавленного карналлита или MgCl2. Металлический магний имеет важное значение для народного хозяйства. Он используется при изготовлении сверхлегких сплавов для авиационной и ракетной техники, как легирующий компонент в алюминиевых сплавах, как восстановитель при магниетермическом получении металлов (титана, циркония и т.п.), в производстве высокопрочного “магниевого” чугуна со включенным графитом. Другие соединения магния – окись, карбонат, сульфат и т.п. – совершенно необходимы при изготовлении огнеупорных материалов, цементов и прочих строительных материалов.
Физические и химические свойства.
Магний – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой оксидной пленкой, придающей ему матовый цвет. Кристаллическая решетка магния относится к гексагональной системе.
| Атомный радиус, | 1,6 |
| Радиус иона Mg2+, | 0,74 |
| Энергия ионизации, эв, для Mg0 Mg+ | 7,64 |
| для Mg+ Mg2+ | 15,03 |
| Плотность (20 oC), г/см3 | 1,739 |
| Температура плавления., oC | 651 |
| Температура кипения,oC | 1107 |
| Теплота плавления, кал/г-атом | 2100 |
| Теплота испарения, кал/г-атом | 31000 |
| Теплота возгонки (при 25 oC), кал/г-атом | 35000 |
| Удельная теплоемкость (20 oC), кал/г-град | 0,248 |
| Теплопроводность (20 oC), кал/смсек. град | 0,37 |
| Удельное электрическое сопротивление, Омсм | 4,510-6 |
| Поперечное сечение захвата тепловых электронов, барн | 0,059 |
| Электропроводность (Hg=1) | 22 |
В природе магний встречается в виде трех стабильных изотопов: 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%). Искусственно были получены изотопы с массами 23, 27 и 28.

В периодической системе элементов магний располагается в главной подгруппе II группы; его порядковый номер – 12, атомный вес 24,312. Электронная конфигурация невозбужденного атома – 1s22s2p63s2; валентные электроны наружного слоя определяют валентность +2 и объясняет типичный характер восстановительных реакций, в которые вступает магний. Строение внешних электронных оболочек атома Mg (3s2) соответствует его нульвалентному состоянию. Возбуждение до обычного двухвалентного (3s3p) требует затраты 62 ккал/г-атом
На внешнем электронном уровне атома содержатся только 2 электрона, которые легко отдаются для образования стабильной 8-электронной конфигурации, в результате чего образуются двухвалентные положительно заряженные ионы магния. Поэтому химически магний очень активен, на воздухе окисляется, но образующаяся при этом на поверхности окисная пленка отчасти препятствует дальнейшему окислению.
Магний наряду с бериллием, кальцием, стронцием, барием и радием относится к группе щелочноземельных металлов. Все они имеют бело-серебристый цвет (исключение составляет барий – он светло-серый), все они мягкие и легкие (кроме радия – он тяжелый и радиоактивный). Щелочноземельные металлы плохо проводят электрический ток; почти все они неустойчивы на воздухе, активны, легко растворяются в разбавленных кислотах, при нагревании энергично реагируют с кислородом, водородом, азотом, углеродом, галогенами, серой, фосфором и др.; они используются в качестве восстановителей в промышленном многих веществ. Но как конструкционный материал из всей группы широко применяется только магний.
Пары магния содержат молекулы Mg2, энергия диссоциации которых оценивается в 7 ккал/моль.
Сжимаемость Mg мала, под давлением в 100 тыс. атм его объем уменьшается до 0,85 исходного.
Аллотропические модификации магния неизвестны.
На магний не оказывают заметного действия дистиллированная вода, фтористоводородная кислота любой концентрации, водные растворы фтористых солей, сера (жидкая и газ), сернокислый алюминий, сероуглерод, растворы едких щелочей, углекислая щелочь, сухие углеводороды, органические галогенпроизводные, не содержащие спирта и h3O, безводная C2H5OH, этиловый и уксусный эфиры, жиры и масла, не содержащие кислот, ароматические соединения и минеральные масла.
Разрушающе действуют на магний морская и минеральная вода, водные растворы HCl, h3SO4, HNO3, h4PO4, кремнефтористоводородные кислоты, водные растворы галоидных солей, сернистых соединений, Nh4, его водные растворы, NxOy, растворы двууглекислой соды, органические кислоты, водные и спиртовые растворы хлорметила и хлорэтила, метиловый спирт, гликоли и гликолевые смеси, многие альдегиды.
При комнатной температуре на воздухе компактный магний химически стоек. На его поверхности образуется оксидная пленка, предохраняющая металл от окисления. При нагревании химическая активность магния повышается. Считается, что верхний температурный предел устойчивости магния в кислороде лежит в интервале 350–400 oC.
На воздухе магний воспламеняется при температуре 600-650 oC, при этом образуется MgO, частично Mg3N2; при 400–500 oC в атмосфере h3 под давлением образуется гидрид Mgh3. Реакции сопровождаются большим выделением тепла (чтобы нагреть стакан ледяной воды до кипения, достаточно 4 г магния) и мощным излучением ультрафиолета.
При нагревании магний взаимодействует с галогенами с образованием галогенидов; при 500–600 oC при взаимодействии с серой образуется MgS; при более высокой температуре возможно образование карбидов MgC2 и Mg2C3, силицидов MgSi и Mg3Si2, фосфида Mg3P2.
Нормальный электродный потенциал магния в кислой среде составляет -2,37 в, в щелочной -2,69 в. Магний – сильный восстановитель, может вытеснить большинство металлов из их солей, h3 из воды и кислот.
Холодная вода на магний почти не действует, с горячей водой он медленно взаимодействует с выделением водорода. В разбавленных кислотах магний растворяется даже на холоду. В HF магний не растворяется, поскольку на поверхности образуется пленка из трудно растворимого в воде MgF2; в концентрированной h3SO4 почти не растворяется.
Нормальный потенциал магния равен -2,37 в (в кислой среде) и -2,69 в (в щелочной среде).Поэтому оба металла должны были бы разлагать воду. Однако при обычной температуре такое разложение практически не происходит. Обусловлено это малой растворимостью оксида магния, образующего защитный слой на поверхности металла.
С водным раствором аммиака магний почти не реагирует, зато он растворим при действии на него растворов солей аммония. Реакция в этом случае идет по схеме 2Nh5++Mg=Mg2++h3+2Nh4.
Растворы щелочей на магний не действуют.
Соединения магния.
Поляризующая способность иона Mg2+ невысока, а по величине коэффициента поляризации, который количественно характеризует деформируемость иона, магний уступает большинству металлов.
Поэтому комплексные соединения магния малоустойчивы и образуются обычно только в щелочной среде.
Ниже представлены теплоты образования некоторых соединений магния и бериллия, рассчитанные в ккал на грамм-эквивалент металла:
| F | Cl | Br | I | O | S | N | |
| Mg | 134 | 77 | 62 | 43 | 72 | 42 | 19 |
| Be | 134 | 77 | 62 | 43 | 72 | 42 | 19 |
| Отношение Mg/Be | 0,90 | 0,73 | 0,65 | 0,47 | 1,00 | 0,47 | 1,21 |
Из приведенных данных видно, что теплоты образования аналогичных производных бериллия и магния близки при сравнительно малых объемах металлоидных атомов (F, O, N) и сильно расходятся при больших (Cl, Br, I, S). Так как сам атом магния значительно больше атома бериллия, это свидетельствует о значительной роли объемных соотношений при образовании рассматриваемых соединений.
Ядерные расстояния в кристаллах MgO (т. пл. 2850оС) равны 1,64 , а у их индивидуальных молекул (в парах) – 1,75 . Пары MgO сильно диссоциированы на элементы. MgO растворима в воде тем труднее, чем сильнее она была предварительно прокалена. Такое снижение реакционной способности обусловлено в данном случае укрупнением кристаллов. При хранении на воздухе оксид магния постепенно поглощает влагу и CO2, переходя в Mg(OH)2 и в MgCO3. Окись магния изредка встречается в природе (минерал периклаз). Получаемая прокаливанием природного магнезита MgO является исходным продуктом для изготовления различных огнеупорных изделий и искусственных строительных материалов (“ксилолит” и др.) Кашица из замешанной на очищенном бензине окиси магния может быть использована для снятия с бумаги жировых и масляных пятен: ею смазывают пятно и дают бензину испариться, после чего удаляют сорбировавшую жир окись магния.
В основе ксилолита лежит магнезиальный цемент, получаемый смешиванием предварительно прокаленной при 800оС окиси магния с 30%-ным водным раствором MgCl2 (на 4 вес. ч. MgO берется 1 вес. ч. безводного MgCl2). Вследствие образования более или менее длинных цепей типа –Mg–O–Mg–O–Mg– (с гидроксилами или атомами хлора на концах) смесь через несколько часов дает белую, очень прочную и легко полирующуюся массу. При изготовлении ксилолита к исходной смеси примешивают опилки и т.п. Кроме ксилолита, используемого главным образом для покрытия полов, на основе магнезиального цемента часто готовят жернова, точильные камни и т.д.
Белый амфотерный гидроксид магния очень малорастворим в воде. Растворенная часть Mg(OH)2 диссоциирована по типу основания и является электролитом слабой силы. Осаждение Mg(OH)2 в процессе нейтрализации кислого раствора наступает при pH=10,5. Гидроксид магния встречается в природе (минерал брусит). Помимо кислот, он растворим в растворах солей аммония (что важно для аналитической химии). Растворение, например, в Nh5Cl протекает по схеме Mg(OH)2+2Nh5Cl MgCl2+2Nh5OH и обусловлено образованием сравнительно малодиссоциированного гидроксида аммония.
Для магния известна аналогичная гидроксиду этоксидная производная Mg(OC2H5)2. Она может быть получена взаимодействием амальгамы магния со спиртом и представляет собой белый порошок, растворимый в спирте и разлагаемый водой.
Взаимодействием свежеосажденной Mg(OH)2 с 30%-ной h3O2 была получена перекись магния MgO2. Это бесцветное микрокристаллическое вещество, малорастворимое в воде и постепенно разлагающееся при хранении на воздухе.
Большинство солей магния хорошо растворимо в воде. Растворы содержат бесцветные ионы Mg2+, которые сообщают жидкости горький вкус. Соли Mg гидролизуются водой только при нагревании раствора.
Почти все галоидные соли магния расплываются на воздухе и легкорастворимы в воде. Исключением является MgF2, растворимость которого весьма мала (0,08 г/л). Большинство солей выделяется из растворов в виде кристаллогидратов (напр. MgCl26h3O). При их нагревании происходит отщепление части галоидоводородной кислоты и остаются труднорастворимые в воде основные соли.
Нитрат магния легкорастворим не только в воде, но и в спирте. Кристаллизуются он обычно в виде Mg(NO3)26h3O (т. пл. 90оС). При нагревании выше температуры плавления нитрат отщепляет не только воду, но и HNO3, а затем переходит в оксид.
Для сульфата магния характерен легкорастворимый кристаллогидрат MgSO47h3O. Он полностью обезвоживается при 200оС. Константа электролитической диссоциации MgSO4 – 5103. В природе MgSO4 встречается в виде минералов горькой соли MgSO47h3O и кизерита MgSO4h3O. Кизерит может служить хорошим материалом для получения MgO и SO2, т.к. при накаливании с углем разлагается по схеме MgSO4+C+64 ккал=CO+SO2+MgO. Горькая соль применяется в текстильной и бумажной промышленности, а также в медицине.
С сульфатами некоторых одновалентных металлов MgSO4 образет двойные соли, так называемые шениты состава M2[Mg(SO4)2]6h3O, где M – одновалентный катион. Шенитом K2[Mg(SO4)2]6h3O пользуются иногда в качестве калийного минерального удобрения.
Почти нерастворимый в воде нормальный карбонат магния может быть получен только при одновременном присутствии в растворе большого избытка CO2. В противном случае осаждаются также почти неростворимые основные соли. Белая магнезия – это основная соль приблизительного состава 3MgCO3Mg(OH)23h3O.
В дополнение к пункту «1.2 Соединения магния.»:
studfiles.net
Магний и его сплавы - раздел Химия, Реальное строение металлических кристаллов
Магний имеет плотность 1,7 кг/дм³, неаллотропичен плавится при 651°С, кислородоактивен, самовозгорается, пленка МgО хрупкая и растрескивается. Однако магниевые сплавы прочны, поглощают вибрацию, неактивны с ураном, хорошо обрабатываются резанием, свариваются. Легируется магний Mn, Al, Zn, Zz, Ti, Ca, Cе, La, Nd, Th для измельчения зерна, закаливаемости, повышению мехсвойств. Магниевые сплавы бывают литейные и деформируемые (таблица11).
Таблица11– Химический состав и механические свойства магниевых спла- вов

К литейным сплавам относятся МЛ5, 6,10, 12, 23, 4, к деформируемым – МА1, МА2-1, МА14, МА1, Ма2, МА5, МА10, МА11, МА14.
Из магниевых сплавов изготавливают корпуса ракет, насосов, приборов, баки, кожухи и т.д. Поверхность после термообработки оксидируют, пропитывают лаком.
Кристаллическое строение металлов Металлы это группа элементов, расположенная левее галлия, индия и талия, а не металлы – правее мышьяка, сурь
Реальное строение металлических кристаллов Кристаллы металлов имеют небольшие размеры, разветвлены, поэтому металлические изделия состоят из большог
Методы изучения строения металлов Для изучения структуры сплавов и металлов, определения причин их разрушения используются следующие основн
Кристаллизация металлов, фазовые превращения Любое вещество, любой элемент может находится в трех агрегатных состояниях: твердом, жидком, газообраз
Пластическая деформация, механические свойства и рекристаллизация Из всех свойств материалов механические свойства являются важнейшими. Наиболее ответственные детали маши
Пути повышения прочности металла 1.7.1. Создание металлов и сплавов с бездефектной структурой; повышением плотности дефектов, затрудняющих дв
Понятие о сплавах Сплав – это вещество, полученное сплавлением, спеканием, электролизом, возгонкой двух или более элементов.
Углеродистые стали Основным продуктом чёрной металлургии является сталь, которую выплавляют из чугуна и возвратного металлол
Влияние элементов на свойства сталей Углерод – изменяет структуру железа, даёт возможность производить улучшение, повышает прочность и твёрдос
Общие положения Технология обработки металлов состоит из следующих основных этапов: а) выплавка сплавов заданного хим
Основные превращения в стали Существует четыре превращения в стали: а ) П А ; Fe
Выбор параметров термообработки Выбор температуры закалки углеродистых сталей определяется положением точек А3 для доэвтектоидных (
Поверхностная закалка стали Назначение поверхностной закалки – повышение твердости и износостойкости поверхности, предела выносливо
Лазерная и плазменная термическая обработка Лазерная термическая обработка производится мощным световым лучом. Особенность ЛТО является локальное во
Цель легирования Металлы и сплавы легируют элементами таблицы Менделеева для повышения механических свойств или придания с
Влияние легирующих элементов на кинетику распада аустенита в стали. Полиморфизм железа Практически все элементы таблицы Менделеева, применяемые для легирования и микролегирования стали сдвига
Цементуемые (нитроцементуемые) легированные стали К данной группе относятся низко – и среднелегированные стали, содержащие углерода 0,1÷0,3 %. После ХТО, зак
Высокопрочные стали Они имеют предел прочности σВ = 150 – 200 кг/мм²(1500-2000 МПА), при δ = 8 – 6% и аn=3 – 15кгм/см², КС=30
Арматурные стали Они применяется для армирования железобетонных изделий. К ним относятся, например, Ст5, Ст40, Ст 50, 35Г2СА, 23Х2Г2
Пружинные стали Они работают в области упругой деформации металла под воздействием циклических нагрузок. Поэтому они долж
Шарикоподшипниковые стали (ШХ) Они работают в условиях износа, больших контактных нагрузок. К ШХ сталям предъявляются высокие требования
Инструментальные стали (ИС) Основные требования к инструментальным сталям: сохранение режущей кромки в течении длительного времени, у
Твердые сплавы (ТС) ТС используются и работают до температур 1000оС. Твердость может достигать 80-85 HRC. Твердосплавные п
Стали для холодной штамповки В автомобильной промышленности применяют холодную штамповку из листовой стали. Обычно применяют низкоугл
Износостойкие стали К износостойким сталям относятся графитизирующие стали, содержащие C – 1.3 ÷ 1.8%, Si – 0,7 ÷ 1,7%, Mn – 0,2 ÷
Нержавеющие стали (коррозионностойкие) Коррозия – процесс разрушения металла под действием внешней среды. Различают химическую коррозию и электр
Жаростойкие и жаропрочные стали Под жаростойкостью (окалиностойкость) понимают сопротивление металла окислению в газовой среде при темпер
Магнитные стали Магнитные стали и сплавы имеют высокую коэрцетивную силу (затрачивается много энергии на размагничивание
Криогенные стали Их применяют для получения, хранения и перевозки сжиженных газов: метана, пропана, кислорода (минус 183°С), аз
Тугоплавкие металлы и сплавы К ним относятся хром (tпл=1865°С), ниобий (tпл=2468°С), молибден (tпл=2625°С), тантал (tпл=2996°С),
Биметаллы и металлокомпозиты Биметаллы производят заливкой, прокаткой, специальной сваркой, плакированием для придания специальных сво
Медь и ее сплавы Медь и ее сплавы находят широкое применение в электротехнической промышленности, электронике, при
Алюминий и его сплавы Алюминий имеет огромное значение в промышленности из-за высокой пластичности, большой тепло и электропров
Бериллий и его сплавы Бериллий имеет плотность 1,86 кг/дм3, температуру плавления 1283 0С, теплопроводен, имеет вы
Титан и его сплавы Плавится титан при температуре 1660°С, аллотропичен, вредные примеси N, C, O, H. Пленка TiO2 защищает титан от
Общие вопросы Порошковая металлургия – это отрасль металлургии, включающая получение порошков металлов, их сплавов, нем
Порошки тугоплавких соединений Порошки карбидов получаются по реакции: MeO + C = MeC + CO Порошки силицидов получают к
Композиционные материалы и детали из них Армированные конструкционные материалы – это композиционные материалы (КМ), состоящие из пластичной основ
Износостойкие материалы Конструкционные детали, работающие в условиях интенсивного износа - шестерни, звездочки, храповики, кулачк
Материалы для конструкций машин 60% порошков расходуется на эту группу изделий: шестерни, звездочки, кулачки, корпуса, кольца, крышки, фланцы,
Керамико-металлические материалы Они способны работать при повышенных температурах, напряжениях и скоростях. Керметы подразделяются на гру
Антифрикционные материалы А-Фр. материалы используются для изготовления подшипников скольжения, распорных втулок, колец, шайб, подпят
Фрикционные материалы Они идут на изготовление тормозных (фрикционных) устройств, тракторов, автомобилей, авиации и т.д., определя
Магнитные материалы Магнитные материалы из порошков широко применяются во всех областях науки и техники. Из порошков изготавли
Огнеупорные материалы Они должны обладать высокими электроизоляционными свойствами, выдерживать высокие температуры, химически
Термоэлементы Электронагреватели применяют в различных печах, радио и телевизионной технике, термоэлектродов термопар,
Спеченные электрические контакты В материалах электрических контактов должны сочетаться свойства: тугоплавкость и высокая твердость, высок
Сверхтвердые материалы инструментального назначения К сверхтвердым относятся материалы, твердость и износостойкость которых превышает хара
Твердые сплавы из инструментальной стали Высокая твердость, износостойкость в сочетании с хорошими физико-механико-химическими свойствами обеспеч
Высокопористые материалы Высокопористые материалы изготавливаются для фильтров очистки воздуха, газов, жидкостей, масел, топлив, жи
Тугоплавкие металлы К ним относятся элементы IV - VIII групп Периодической системы элементов, представленные в таблице 12. Эти
Материалы для атомной энергетики Атомный реактор состоит из следующих частей: 1) активная зона с тепловыделяющими элементами (ТЭВЛ) и те
Ферриты Это магнитные полупроводники ионного строения на основе окиси железа и часто других металлов (антиферрома
Общие вопросы К неметаллическим материалам относятся: а) полимерные материалы органические и неорганические; б
Полимеры Полимеры – это вещества, макромолекулы которых состоят из многочисленных элементарных звеньев (мономеров)
Пластические массы Пластические массы производятся на основе полимеров и состоят из: а) связующего вещества (смолы, эфиры,
Композиционные материалы В развитых странах композиционные материалы находят все большее применение и практически не существует об
Каучуки и резины Резина это продукт вулканизации смеси каучука и серы с различными добавками, имеющий высокие эластичные св
Клеящие материалы и герметики Клеи и герметики – это растворы и расплавы полимеров и неорганических веществ, которые наносятся на склеив
Неорганическое стекло Это затвердевший раствор (сложный расплав высокой вязкости) кислотных и основных оксидов. Стеклообразующи
Керамические материалы Керамика – это неорганический материал получаемый в основном из порошков. Они восстанавливаются, смешиваю
Формообразование изделий из неметаллических материалов Пластмассы всё больше внедряются в производство вместо металла. Коэффициент использования материала сост
allrefers.ru
Железоуглеродистые сплавы. Медь и ее сплавы
Железоуглеродистые сплавы, сплавы железа с углеродом на основе железа. Варьируя состав и структуру, получают железоуглеродистые сплавы с разнообразными свойствами, что делает их универсальными материалами...
Железоуглеродистые сплавы. Медь и ее сплавы
...
Исследование свойств антифрикционного покрытия из индия на поверхности баббита
Антифрикционные сплавы применяют для заливки вкладышей подшипников скольжения. Основные требования, предъявляемые к антифрикционным сплавам, определяется условиями работы вкладыша подшипника. Эти сплавы должны иметь достаточную твёрдость...
Классификация и маркировка металлов
Технически чистая медь обладает высокими пластичностью и коррозийной стойкостью, малым удельным электросопротивлением и высокой теплопроводностью...
Классификация и маркировка металлов
Алюминий - легкий металл, обладающий высокими тепло- и электропроводностью, стойкий к коррозии. В зависимости от степени частоты первичный алюминий согласно ГОСТ 11069-74 бывает особой (А999), высокой (А995, А95) и технической чистоты (А85, А7Е, АО и др.)...
Классификация и маркировка металлов
Титан - тугоплавкий металл с невысокой плотностью. Удельная прочность титана выше, чем у многих легированных конструкционных сталей, поэтому при замене сталей титановыми сплавами можно при равной прочности уменьшить массу детали на 40%...
Основные материалы, используемые при оформлении постановок. Натуральные и синтетические ткани
В практике театрального производства широко применяются металлы и их сплавы: сталь, медь и её сплавы, алюминий и его сплавы в виде проката. Для правильного выбора металлов необходимо знать их физические, химические...
Пористые композиционные материалы
Антифрикционные сплавы - специальные сплавы белых и цветных металлов, применяемых для уменьшения трения во впадинах подшипников [42]. Пористые...
Сквозной цикл производства блока цилиндров двигателя
Блок-картеры из алюминиевых сплавов пока еще относительно новы только для дизельных двигателей. Плотность алюминиевых сплавов составляет примерно треть по сравнению с серым чугуном. Однако, это не значит...
Строение и свойства металлов и сплавов
Сплавы железа с углеродом (стали и чугуны) являются наиболее распространёнными металлическими материалами...
Технологическая оснастка изготовления отливки детали
Для производства отливок используются сплавы черных металлов: серые, высокопрочные, ковкие и другие виды чугунов; углеродистые и легированные стали; сплавы цветных металлов; медные (бронзы и латуни), цинковые...
Технология литья под давлением
Сплавы на основе олова. Отливки, получаемые способом литья под давлением из сплавов на основе олова, легко поддаются пайке мягким припоем, что и служит основанием для их применения при изготовлении деталей радиоаппаратуры...
Физические, химические, механические и технологические свойства металлов: чугуна и стали, алюминия, меди и сплавов. Применение металлов
Алюминий - металл серебристо-белого цвета, характеризуется низкой плотностью 2,7 г/см3, высокой электропроводностью, температура плавления 660°С. Механические свойства алюминия невысокие...
Физические, химические, механические и технологические свойства металлов: чугуна и стали, алюминия, меди и сплавов. Применение металлов
Медь в чистом виде имеет красный цвет; чем больше в ней примесей, тем грубее и темнее излом. Температура плавления меди 1083°С, плотность 8,92 г/см3. Выпускают медь следующих марок: - катодная - МВ4к, МООк, МОку, М1к; ¦ бескислородная - МООб, МОб...
Цветные металлы и их сплавы
Магний - металл серебристо-белого цвета. Температура плавления магния 650°С. Кристаллическая решетка гексагональная. Отличается низкой плотностью (1,74 г/см3), хорошей обрабатываемостью резанием...
prod.bobrodobro.ru
Выполнила: ученица 11 класса
Средней школы-лицей
С. Дмитриево-Помряскино
Кожанова Ольга
2000 г. План:1. Характеристика элемента.
2. Получение магния.
3. Свойства магния.
3.1. Физические свойства магния.
3.2. Химические свойства магния.
4. Соединения магния.
4.1. Неорганические соединения
4.2. Магнийорганические соединения
5. Природные соединения магния
6. Определение магния в почвах, в воде
7. Биологическое значение магния
8. Области применения магния
9. Жесткость воды
10. Практическая работа «Определение жесткости воды»
1. Характеристика элементаНазвание «магнезия» встречается уже в III веке н.э., хотя не вполне ясно, какое вещество оно обозначает. Долгое время магнезит - карбонат магния - ошибочно отождествляли с известняком - карбонатом кальция. Слово магнезия происходит от названия одного из Греческих городов - Магнесии. До XVIII века соединения магния считали разновидностями кальциевых или натриевых солей. Открытию магния способствовало изучение состава минеральных вод. В 1695 году английский врач Крю сообщил, что им выделена из воды эпсомского минерального источника соль, обладающая лечебными свойствами, и вскоре был доказан её индивидуальный характер. Затем стали известны и другие соединения магния. Карбонат магния получил название "белая магнезия", в отличие от «чёрной магнезии» - оксида марганца. Отсюда и созвучие названий металлов, выделенных впоследствии из этих соединений.
Впервые магний был получен Деви (XIX в.) из окиси магния. Бюсси, Либих, Девильс, Карон и др получали магний действием паров калия или натрия на хлористый магний.
В 1808 г. английский химик Г. Деви электролизом увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому и дал название "магнезии", сохранившееся до сих пор во многих странах. В России с 1831 года принято название "магний". В 1829 г. Французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид калием. Следующий шаг к промышленному получению сделал М. Фарадей. В 1830 г. он впервые получил магний электролизом расплавленного хлористого магния.
Промышленное производство магния электролитическим способом предпринято в Германии в конце XIX в. Перед второй мировой войной началось освоение термических способов получения магния.
В настоящее время наряду с развитием электролитического способа совершенствуются силикотермический и карботермический способы получения магния. На первой стадии развития магниевой промышленности в качестве сырья применяли хлористые соли карналлит, природные рассолы, хлоромагниевые щёлочи калийной промышленности.
Сейчас наряду с хлористыми солями широко используют доломит и магнезит. Большой интерес представляет применение в качестве сырья для производства магния из морской воды. В России электролитический метод получения магния впервые разработал П.П. Федотьев в 1914 г. в Петроградском политехническом институте. В 1931 г. в Ленинграде вступил в строй первый опытный магниевый завод. Промышленное производство магния в СССР начато в 1935 г.








 +12Mg ))) 1S2 2S2 2P6 3S2 3P0 –электронная формула нормального атома
+12Mg ))) 1S2 2S2 2P6 3S2 3P0 –электронная формула нормального атома



 282
282
При затрате необходимой энергии один из электронов переходит в P-состояние, т.е. оба электрона становятся неспаренными. Поэтому магний проявляет степень окисления +2.
3S2-валентные электроны
1S2 2S2 2P6 3S1 3P1
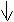


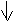




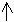
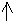


 - электронная формула возбуждённого атома
- электронная формула возбуждённого атома
 +12Mg +P12,n012
+12Mg +P12,n012
 e12
e12
Строение внешней электронной оболочки магния, обладающей структурой 3S2, с двумя слабо связанными электронами объясняет восстановительный характер типичных реакций, в которых магний переходит в двухвалентный катион Mg2+. Благодаря большому химическому сродству к кислороду, магний способен отнимать кислород у многих окислов и хлор у хлоридов. Это свойство в последнее время используется при магниетермическом получении титана, циркония, урана. При комнатной температуре на воздухе компактный магний химически стоек. На его поверхности образуется окисная пленка, предохраняющая от окисления. При нагревании химическая активность магния возрастает. Считается, что верхний температурный предел устойчивости магния в кислороде находится в интервале 350-400 оС. Кипящую воду магний разлагает с выделением водорода.
На магний не оказывает заметного действия дистиллированная вода, фтористоводородная кислота любой концентрации, хромовая кислота, водные растворы фтористых солей и др.
Разрушающее действие оказывает на магний морская и минеральная вода, водные растворы соляной, серной, азотной, фосфорной, кремнефтористоводородной кислот, водные растворы галоидных солей, сернистых соединений, аммиак и его водные растворы, органические кислоты, гликоли и гликолевые смеси, многи альдегиды.
Магний - один из самых распространенных в земной коре элементов, по распространенности занимает шестое место после кислорода, кремния, алюминия, железа и кальция. Содержание магния в литосфере, по А.П. Виноградову, сотавляет 2,10%. В природе магний встречается исключительно в виде соединений и входит в состав многих минералов: карбонатов, силикатов и др. Важнейшими являются следующие из них: магнезит MgCO3, доломит MgCO3*CaCO3, карналлит MgCl2*KCL*6h3O, бруцит Mg(OH)2, кизерит MgSO4, эпсонит MgSO4*7h3O, каинит MgSO4*KCl*3h3O, оливин (Mg,Fe)2 [SiO4], серпентин h5Mg3Si2O9.
Природный или естественный магний представляет собой смесь трех устойчивых изотопов 24Mg -78,6 %, 25Mg -10,1 %, 26Mg -11,3 %.
В реакциях магний практически всегда проявляет степень окисления +2 (валентность II). Для того, чтобы перевести атом магния из состояния 3S2 в реакционноспособное состояние 3S13P1, нужно затратить 259 КДж/моль, а при последовательном отрыве электронов, т.е. ионизации Mg до Mg+ и Mg+2, требуется соответственно 737 КДж/моль и 1450 КДж/моль. Магний кристаллизуется в гексагональную плотноупакованную решетку.
2. ПОЛУЧЕНИЕ МАГНИЯ.Преобладающий промышленный способ получения магния - электролиз расплава смеси MgCl2
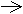 MgCl2 Mg2+ 2Cl-
MgCl2 Mg2+ 2Cl-

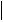 К -) А +)
К -) А +)
 |
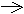
 Mg2++2e Mg0 2Cl--2e Cl20
Mg2++2e Mg0 2Cl--2e Cl20
 ЭЛ-3
ЭЛ-3
 2MgCl2 2Mg + 2Cl2
2MgCl2 2Mg + 2Cl2
расплава
в безводных MgCl2, KCl, NaCl. Для получения расплава используют обезвоженный карналлит или бимофит, а также MgCl2, полученный хлорированием MgO или как отход при производстве Ti.
Температура электролиза 700-720 оС, аноды графитовые, катоды стальные. Содержание MgCl2 в расплаве 5-8 %, при снижении концентрации до 4 % уменьшается выход магния по току, при повышении концентрации MgCl2 выше 8 % увеличивается расход электроэнергии. Для обеспечения оптимального содержания MgCl2 периодически отбирают часть отработанного электролита и добавляют свежий карналлит или MgCl2. Жидкий магний всплывает на поверхность электролита, откуда его отбирают вакуумным ковшом. Извлекаемый магниевый сырец содержит 0,1% примесей. Для очистки от неметаллических примесей магний переплавляют с флюсами - хлоридами или фторидами K,Ba,Na,Mg. Глубокую очистку осуществляют перегонкой в вакууме, зонной плавкой, электролитическим рафинированием. В результате получают магний чистотой 99,999 %.
 Кроме магния при электролизе получают также Cl2. В термических способах получения магния сырьем служит магнезит или доломит, из которых прокаливанием получают MgO. 2Mg+O2=2MgO. В реторных или вращающих печах с графитовыми или угольными нагревателями оксид восстанавливают до металла кремнием (силиконотермический способ) или CaC2 (карбидотермический способ) при 1280-1300 оС, либо углеродом (карботермический способ) при темпратуре выше 2100 оС. В карботермическом способе (MgO+C Mg+CO) образующуяся смесь CO и паров магния быстро охлаждают при выходе из печи инертным газом для предотвращения обратной реакции с магнием.
Кроме магния при электролизе получают также Cl2. В термических способах получения магния сырьем служит магнезит или доломит, из которых прокаливанием получают MgO. 2Mg+O2=2MgO. В реторных или вращающих печах с графитовыми или угольными нагревателями оксид восстанавливают до металла кремнием (силиконотермический способ) или CaC2 (карбидотермический способ) при 1280-1300 оС, либо углеродом (карботермический способ) при темпратуре выше 2100 оС. В карботермическом способе (MgO+C Mg+CO) образующуяся смесь CO и паров магния быстро охлаждают при выходе из печи инертным газом для предотвращения обратной реакции с магнием.
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Плавится магний при темпратуре 651 оС, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550 оС он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния выделяется большое количество ультрафиолетовых лучей и тепла - чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г магния.
Магний расположен в главной подгрупп второй группы периодической системы элементов Д.И. Менделеева. Порядковый номер его - 12, атомный вес - 24,312. Электронная конфигурация атома магния в невозбужденном состоянии 1S22S2P63S2; валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность II. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации; поэтому магний в химическом отношении очень активен.
На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. Нормальный электронный потенциал магния в кислой среде равен -2,37в, в щелочной - 2,69в. В разбавленных кислотах магний растворяется уже на холоде. Во фтористоводородной кислоте нерастворим вследствие образования пленки из труднорастворимого в воде фторида MgF2; в концентрированной серной кислоте почти нерастворим. Магний легко растворяется при действии растворов солей аммония. Растворы щелочей на него не действуют. Магний поступает в лаборатории в виде порошка или лент. Если поджечь магниевю ленту, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Магниевые вспышки применяют в фотографии, в изготовлении осветительных ракет. Температура кипения магния 1107 оС, плотность = 1,74 г/см3, радиус атома 1,60 НМ.
3.2. Химические свойства магния.Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина, бензина и минеральных масел. С холодной водой магний почти не взаимодействует, но при нагревании разлагает ее с выделением водорода. В этом отношении он занимает промежуточное положение между бериллием, который вообще с водой не реагирует и кальцием, легко с ней взаимодействующим. Особенно интенсивно идет реакция с водяным паром, нагретым выше 380 оС:

 -2e
-2e
 Mg0(тв)+h3+O(газ) Mg+2O(тв)+h30 (газ).
Mg0(тв)+h3+O(газ) Mg+2O(тв)+h30 (газ). Поскольку продуктом этой реакции является водород ясно, что тушение горящего магния водой недопустимо: может произойти образование гремучей смеси водорода с кислородом и взрыв. Нельзя потушить горящий магний и углекислым газом: магний восстанавливает его до свободного углерода -4е
 |
 2Mg0 + C+4O2 2Mg+2O+C0,
2Mg0 + C+4O2 2Mg+2O+C0, Прекратить к горящему магнию доступ кислорода можно засыпав его песком, хотя и с оксидом кремния (IV) магний взаимодействует, но со значительно меньшим выделением теплоты:
-4е
 |
этим и определяется возможность использования песка для тушения кремния. Опасность возгорания магния при интенсивном нагреве одна из причин, по которым его использование как технического материала ограничена.
В электрохимическом ряду напряжений магний стоит значительно левее водорода и активно реагирует с разбавленными кислотами с образованием солей. В этих реакциях есть у магния особенности. Он не растворяется во фтороводородной, концентрированной серной и в смеси серной и в смеси азотной кислот, растворяющей другие металлы почти столь же эффективно, как "царская водка" (смесь HCl и HNO3). Устойчивость магния к растворению во фтороводородной кислоте объясняется просто: поверхность магния покрывается нерастворимой во фтороводородной кислоте пленкой фторида магния MgF2. Устойчивость магния к достаточно концентрированной серной кислоте и смеси ее с азотной кислотой объяснить сложнее, хотя и в этом случае причина кроется в пассивации поверхности магния. С растворами щелочей и гидроксида аммония магний практически не взаимодействует. А вот с растворами аммонийных солей реакция хотя и медленно, но происходит:
 |  |
2NH+4+Mg=Mg2+ + 2Nh4 + h3
Удивительного в этой реакции нет. Эта реакция та же по существу, что и реакция вытеснения металлами водорода из кислот. В одном из определений кислотой называют вещество, диссоциирующее с образованием ионов водорода. Именно так может диссоциировать и ион Nh5:

 Nh5+ Nh4+H+
Nh5+ Nh4+H+ -2e
 | |||
 | |||

 2H++Mg Mg2++ H02
2H++Mg Mg2++ H02 При нагревании магния в атмосфере галогенов происходит воспламенение и образование галоидных солей.
 -2e
-2e


 Mg + Cl20 Mg+2+Cl2-
Mg + Cl20 Mg+2+Cl2-
Причина воспламенения - очень большое тепловыделение, как и в случае реакции магния с кислородом. Так при образовании 1 моль хлорида магния из магния и хлора выделяется 642 КДж. При нагревании магний соединяется с серой (MgS), и с азотом (Mg3N2). При повышенном давлении и нагревании с водородом магний образует гидрид магния
-2e
 Mg0 + h30 Mg+2h3-.
Mg0 + h30 Mg+2h3-. Большое сродство магния к хлору позволило создать новое металлургическое производство - "магниетермию" - получение металлов в результате реакции
этим методом получают металлы, играющие очень важную роль в современной технике - цирконий, хром, торий, бериллий. Легкий и прочный "металл космической эры" - титан практически весь получают таким способом.
Сущность производства сводится к следующему: при получении металлического магния электролизом расплава хлорида магния в качестве побочного продукта образуется хлор. Этот хлор используют для получения хлорида титана (IV) TiCl4, который магнием восстанавливается до металлического титана
-4e
 Ti+4Cl4 + 2Mg0 Ti0+2Mg+2Cl2
Ti+4Cl4 + 2Mg0 Ti0+2Mg+2Cl2 Образовавшийся хлорид магния вновь используется для производства магния и т.д. На основе этих реакций работают титаномагниевые комбинаты. Попутно с титаном и магнием получают при этом и другие продукты, такие, как бертолетову соль KClO3, хлор, бром и изделия - фибролитовые и ксилитовые плиты, о которых будет сказано ниже. В таком комплексном производстве степень использования сырья, рентабельность производства высока, а масса отходов не велика, что особенно важно для охраны окружающей среды от загрязнений.
4. Соединения магния.Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения. Поляризующая способность иона Mg2+ невысокая, а по величине кэффициента поляризации, характеризующего количественно деформируемость иона, магний уступает большинству металлов. Поэтому комплексные соединения магния сравнительно малоустойчивы и образуются, как правило, только в щелочной среде. Тем не менее, они имеют чрезвычайно важное значение для аналитической химии магния. Меньшая устойчивость некоторых комплексных соединений магния, по сравнению с комплексами других металлов, иногда используется для маскирования последних при определении магния титриметрическими, фотометрическими и другими методами.
4.1. Неорганические соединения магния.Важнейшие соединения магния: оксид, гидроксид и соли магния.
Оксид магния - MgO хорошо знаком тем, кто занимается гимнастикой. Нанесенный на ладони порошок оксида магния (магнезии) предохраняет спортсмена от опасности сорваться с гимнастического снаряда (например перекладины).
Оксид магния - легкий, рыхлый порошок белого цвета, легко связывающий воду. На этом и основано его применение гимнастами.
-4е
MgO образуется при прокаливании гидроокиси и многих других соединений магния. Окись магния плавится при 2800оС, растворимость ее в воде составляет 0,00062 г/100 г при 20оС. Аморфная окись магния, полученная прокаливанием соединений магния при низких температурах, гигроскопична, легко поглощает из воздуха влагу и углекислый газ с образованием основных карбонатов; хорошо растворяется в кислотах и в солях аммония. При прокаливании до 1000оС и выше образуется кристаллическая окись магния (кубическая сингония), которая теряет способность поглощать влагу и растворяться в кислотах. По литературным данным, прокаленная при 1000оС окись магния не меняет своего веса, если даже оставить на один час на воздухе. Все же желательно охлаждать окись магния при весовых определениях в эксикаторе и взвешивать по возможности быстро.
Оксид магния встречается в природе в виде минерала периклаза. Получаемый прокаливанием природного магнезита оксид магния является исходным продуктом и для получения самого магния, и для получения искусственных строительных материалов ("ксилолит"). В основе ксилолита лежит магнезиальный цемент, получаемый смешиванием прокаленного оксида магния с 30% раствором хлорида магния. Образование полимерной структуры из атомов магния, связанных в цепь -O-Mg-O-Mg-O-, приводит к тому, что смесь через несколько часов образует белую, очень прочную и легко полирующуюся массу. При изготовлении ксилолита к смеси примешивают древесные опилки и другие наполнители. Ксилолитовые плиты используют для покрытия полов.
Карбонат магния (MgCO3) - бесцветное кристаллическое вещество, труднорастворимое в воде - растворимость его 0,0094 г/100г при 18оС. Карбонат из водных растворов выделяется лишь в присутствии большого избытка оксида углерода (IV) CO2; обычно образуются основные карбонаты. Из них основной карбонат 3MgCO3*Mg(OH)2*3h3O - соединение, труднорастворимое в воде (0,04 г/100г), но растворимое в солях аммония. При 900-1000оС разлагается с образованием окиси магния. При пропускании углекислого газа через водную взвесь карбоната магния происходит его растворение, благодаря образованию кислой соли (гидрокарбоната).
 MgCO3+CO2+h3O Mg(HCO3)2
MgCO3+CO2+h3O Mg(HCO3)2
Двойной карбонат магния и кальция MgCO3*CaCO3 - доломит - самое распространенное природное соединение магния, образует огромные залежи, в которых минерал часто бывает окрашен примесями в более или менее темные цвета. Карбонаты магния - магнезит и доломит широко применяют для изготовления огнеупорных материалов путем обжига их до оксидов. Такие материалы идут, например, на обкладку внутренней поверхности конвертеров для производства стали. Полуобожженный доломит - смесь MgO и CaCO3 используют для изготовления строительных плит и в качестве добавки в почву и воду для уменьшения их кислотности.
Искусственно приготовленный основной карбонат магния является исходным материалом для приготовления других соединений магния, он растворяется в кислотах гораздо быстрее, чем магнезит. Кроме того, его применяют как составную часть пудры, зубных порошков, а так же как наполнитель в производстве красок, бумаги и резины.
Сульфат магния MgSo4Из кислот магний выделяет водород:
 Mg + h3SO4 = MgSO4+h3
Mg + h3SO4 = MgSO4+h3 MgSO4, в отличии от труднорастворимых сульфатов щелочноземельных металлов легко растворим в воде; растворимость 36,6 г MgSO4/100 г при 18оС. Образует кристаллогидраты с 1,2,3,5,6,7 и 12 молекулами воды,из которых важнейшими являются моногидрат (кизерит) и гептагидрат (горькая соль). Кизерит MgSO4 * h3O обезвоживается при 320-300оС. Безводный MgSO4 при температуре 1100-1200оС частично разлагается на MgO, SO2 и O2. Кизерит встречается в природе в виде примесей в месторождениях калийных солей и карналлита. Интересно, что несмотря на значительную растворимость сульфата магния, кизерит очень медленно переходит в раствор. Поэтому при выщелачивании калийных солей остается в осадке в виде похожей на песок массы, которую перерабатывают в горькую соль. Горькая соль MgSO4*7h3O в природе содержится в осадочных породах, остающихся после высыхания озер, а также кристаллизуется из вод минеральных источников. На воздухе постепенно выветривается. Применяется для пропитки марли с целью снижения ее горючести, как наполнитель в производстве бумаги и в медицине - как слабительное. Сульфат магния гидролизуется очень слабо: 0,2N раствор его при 25оС показывает степень гидролиза 0,0047%.
Mg(ClO4)2 - "ангидрон", дает гидраты с 2,4,6 молекулами воды. Растворимость в воде 99,6 г/100г при 25оС. Безводный перхлорат магния очень сильно поглощает влагу; выше 250оС он разлагается. Используется как осушитель органических веществ и газов.
Гидроокись магния2MgO+2h3O=2Mg(OH)2 выделяется при действии щелочей на растворы солей магния в виде объемистого студенистого осадка. Гидроокись магния - слабое основание, легко растворяется в кислотах, из воздуха поглощает углекислый газ. Растворимость ее в воде зависит от степени старения, для свежеосажденной гидроокиси магния составляет 7,0*10 -4 моль/л.
Хлорид магния
-2е
образует гидраты с 1,2,4,6 молекулами воды. Растворимость его в воде 54,5 г/100г при 20оС (в расчете на безводную соль). Хлорид магния с хлоридами щелочных металлов образует двойные соли, важнейшие из них - карналлит
MgCl2*KCl2*6h3O.
Для нитрата магния Mg(NO3)2 известны гидраты с 2,6 и 9 молекулами воды. Растворимость Mg(NO3)2*6h3O в воде при 25оС составляет 75г/100г, для Mg(NO3)2*9h3O) при 25оС - 50,6г/100г. Получение:
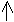 |
 Mg + 2HNO3 Mg(NO3)2+h3
Mg + 2HNO3 Mg(NO3)2+h3 Фторид магния MgF2 - труднорастворимое в воде соединение. Плавится при 1265оС, с фторидами щелочных металлов образует двойные соли типа
M1F*MgF2 и 2M1F*MgF2.
4.2. Магнийорганические соединения. Соединения магния с органическими кислотами.Ацетат магния Mg(Ch4COO)2 - хорошо растворимое в воде соединение.
Оксалат магния MgC2O4 - труднорастворимое соединение. В растворах оксалатов щелочных металлов или аммония оксалат магния образует комплексный ион [Mg(C2O4)2]-2.
Из органических кислот большое значение имеют аминополикарбоновые кислоты - комплексоны, особенно комплексон III. Прочность комплексоната магния значительно ниже, чем комплексонатов почти всех остальных металлов.
Окрашенные соединения магния с органическими реагентами.Для аналитической химии магния большое значение имеют окрашенные соединения его с органическими реагентами, используемые в качестве комплексонометрических индикаторов, для фотометрического определения и для обнаружения магния. Ион магния не обладает хромофорным действием, поэтому цветные реакции дают только соединения его с окрашенными органическими реагентами. Из них наиболее важны азосоединения, меньшее значение имеют трифенилметановые красители и соединения других классов.
соединения магния с азокрасителями.При взаимодействии магния с некоторыми азокрасителями образуются интенсивно окрашенные внутрикомплексные соединения. Саввин и Петрова изучили цветные реакции магния с азосоединениями на основе хромотропной кислоты. Некоторые из них с магнием дают интенсивно окрашенные комплексы, пригодные для фотометрического определения магния. Диль и Эллингбоэ изучили образование магнием окрашенных соединений с 26 моноазосоединениями с целью использования их в качестве индикаторов для комплексонометрического определения магния.
К магнийорганическим относят химические соединения, в которых атом углерода непосредственно связан с атомом магния. Они представляют отдельный очень важный класс соединений магния. С их помощью химики синтезировали огромное количество органических соединений: лекарственных препаратов, витаминов, душистых веществ и т.д. История металлоорганических соединений началась в 1849 г, когда молодой английский химик Франкланд получил вещество, в котором атом углерода был непосредственно связан с цинком. Своей способностью вступать во все возможные реакции они сразу же привлекли внимание химиков. Однако их чрезвычайная активность, например, они мгновенно самовоспламенялись на воздухе, сильно затрудняла работу с этими веществами. В 1899 г французский ученый Ф.Барбье предложил заменить цинк на магний, обнаружив, что в присутствии диэтилового, "серного" эфира магний легко вступает в те же реакции, что и цинк.
Магнийорганические соединения оказались значительно эффективнее цинко-органических, менее опасными в обращении и получили широкое распространение. Особая заслуга в их исследовании и внедрении в лабораторную практику принадлежит выдающемуся французскому химику В.Гриньяру. В 1900г он усовершенствовал метод синтеза, предложив разделить реакцию на две стадии: 1 - образование смешанного магнийорганического соединения в эфирной среде:
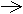 Ch4Cl+Mg Ch4MgCl
Ch4Cl+Mg Ch4MgCl  R1X+Mg RMgX, где R - углеводородный радикал, а Х - галоген; 2 - взаимодействие RMgX с соединением, содержащим карбонильную группу, приводит к образованию новой углерод-углеродной связи. Реакции такого типа получили название по имени автора открытия - "реакции Гриньяра". За эти работы В.Гриньяр был удостоен в 1912г Нобелевской премии. Магнийорганические галогениды нашли широкое применение в органическом синтезе. С их помощью можно получать соединения различных классов спирты, альдегиды, кетоны, эфиры, органические кислоты и т.д. Сам В.Гриньяр писал 1926г так: "Подобно хорошо настроенной скрипке, магнийорганические соединения под опытными пальцами могут дать звучание все новым неожиданным и более гармоничным аккордам". Использование магнийорганических соединений позволило получить органические производные многих элементов и привело к развитию целого направления - химии элементоорганических соединений, успешно развиваемое в нашей стране школой академика А.Н. Несмеянова.
R1X+Mg RMgX, где R - углеводородный радикал, а Х - галоген; 2 - взаимодействие RMgX с соединением, содержащим карбонильную группу, приводит к образованию новой углерод-углеродной связи. Реакции такого типа получили название по имени автора открытия - "реакции Гриньяра". За эти работы В.Гриньяр был удостоен в 1912г Нобелевской премии. Магнийорганические галогениды нашли широкое применение в органическом синтезе. С их помощью можно получать соединения различных классов спирты, альдегиды, кетоны, эфиры, органические кислоты и т.д. Сам В.Гриньяр писал 1926г так: "Подобно хорошо настроенной скрипке, магнийорганические соединения под опытными пальцами могут дать звучание все новым неожиданным и более гармоничным аккордам". Использование магнийорганических соединений позволило получить органические производные многих элементов и привело к развитию целого направления - химии элементоорганических соединений, успешно развиваемое в нашей стране школой академика А.Н. Несмеянова.
К сожалению, создание крупномасштабного производства на основе магнийорганических соединений встречает значительные трудности из-за исключительной пожароопасности эфира. В настоящее время разрабатываются методики применения магнийорганических соединений с использованием не столь горючих растворителей. Вероятно, недалеко то время, когда магнийорганические соединения будут применяться и в химической технологии.
5. Природные соединения магния. Минералы, в состав которых входит магний, использовались человеком, начиная с каменного века. Зеленый, смешанный магниево-кальциевый минерал состава 2CaO*5ЭO*h3O*8SiO2 (Э-обозначает переменное кол-во магния и железа) обладает большой "вязкостью", он не растрескивается, не расслаивается при ударе. Из этого минерала первобытные люди изготовляли первые, примитивные инструменты. Образцы таких найденных в раскопках инструментов можно увидеть во многих музеях. За этим минералом сохранилось название, данное ему врачевателями древности - "нефрит". Считалось, что размолотый порошок нефрита помогает при заболеваниях почек. Другой магниевый минерал - асбест используется издревле для изготовления фитилей. В отличие от фитилей из хлопка, войлок и других материалов органической природы гореть в асбесте нечему: состав его выражается формулой
Минералы, в состав которых входит магний, использовались человеком, начиная с каменного века. Зеленый, смешанный магниево-кальциевый минерал состава 2CaO*5ЭO*h3O*8SiO2 (Э-обозначает переменное кол-во магния и железа) обладает большой "вязкостью", он не растрескивается, не расслаивается при ударе. Из этого минерала первобытные люди изготовляли первые, примитивные инструменты. Образцы таких найденных в раскопках инструментов можно увидеть во многих музеях. За этим минералом сохранилось название, данное ему врачевателями древности - "нефрит". Считалось, что размолотый порошок нефрита помогает при заболеваниях почек. Другой магниевый минерал - асбест используется издревле для изготовления фитилей. В отличие от фитилей из хлопка, войлок и других материалов органической природы гореть в асбесте нечему: состав его выражается формулой
Широко известен и другой магниевый минерал - тальк, который содержит на каждую частицу магния вдвое больше оксида кремния (IV)
3MgO*h3O*4SiO2.Этот минерал называют также "мыльным камнем", стеатитом или, по-русски, "жировиком". Тальком присыпают поверхность готовых резиновых изделий во избежании их слипания при хранении.
Мир минералов богат и разнообразен. их известно более двух тысяч. Около 10% из этого огромного количества минералов - магниевые. Магний по распространенности в природе занимает восьмое место. В большей части этих минералов, как и в нефрите, асбесте и тальке, оксид магния связан с кремнеземом SiO2 - самым распространенным химическим соединением на Земле. Вместе с магнием в состав магниевых минералов подчас входят и другие элементы - металлы. Один из таких минералов - оливин Э2SiO4, где Э означает суммарное число атомов магния и железа. Среди минералов магния есть и такие, которые по красоте могут конкурировать с известными драгоценными камнями. Это водный силикат магния, окрашенный примесями в густой винно-желтый цвет, обнаруженный на Памире - клиногулит; он похож на драгоценный циркониевый минерал - глаулит.
Огромное количество магния содержится в водах океанов, морей и соленых озер. В среднем в одном м3 воды содержится более одного килограмма магния. В некоторых странах, не имеющих магниевого сырья (Англия, Норвегия, Италия), налажено производство магния из морской воды. Морское происхождение имеют и ископаемые месторождения магниевого минерала "карналлита". В отдаленном геологическом прошлом Земли неоднократно образовывались и высыхали моря и озера. При их испарении образовались гигантские залежи природных солей магния - карналлит - MgCl2*KCl*6h3O.
6. ОПРЕДЕЛЕНИЕ МАГНИЯ В ПОЧВАХ, В ВОДЕ.Общее содержание магния в почвах колеблется в пределах от 0,1 до 1%, содержание обменного магния составляет сотые и десятые доли процента.
Методы выделения магния из почвы. Для извлечения обменного магния из почвы, предложены различные экстрагенты: 1М нейтральный раствор Ch4COONh5, 2М раствор Ch4COONh5 и т.д.
Метоты определения. Обменный магний в почвах можно определить комплексонометрическим методом. Однако из-за незначительного содержания магния в почвах для его определения лучше применять ортометрические методы: с титановым жёлтым, 8-оксихинолином и бриллиантовым жёлтым.
15 мл экстракта почвы, полученного обработкой 1М раствора Ch4COONh5, помещают в мерную колбу ёмкостью 25 мл. Если объём аликвотной части меньше 15 мл, то его доводят до 15 мл 1М раствором Ch4COONh5, добавляют последовательно, перемешивая раствор после прибавления каждого реагента: 5 мл смеси, содержащей равные части однопроцентного раствора поливинилового спирта, 0,5% раствора NaHSO3 и компенсационного раствора, 1 мл 0,04% раствора титанового жёлтого, 4мл 10N раствора NaOH и измеряют оптическую плотность на фотоколориметре при 540 НМ.
Обменный магний в почвах можно определять атомно-абсорбционным методом. 10г почвы встряхивают 30 минут с 50 мл 1М раствора Ch4COONh5 с pH 5,9. Смесь фильтруют, промывают тем же раствором. Фильтрат с промывными водами разбавляют 1М раствором Ch4COONh5 в мерной колбе до 100 мл, распыляют в пламя и фотометрируют. Стандартные растворы для получения данных для составления калибровочного графика должны содержать 0-100 мкг Mg/мл. Их готовят разбавлением смеси, содержащей 500 мкг Mg/мл, 2 мг Ca/мл, 50 мкг Na/мл и 125 мкг K/мл в 1М растворе Ch4COONh5.
Определение в воде, кисотах и электролитах.
Для определения магния в воде можно использовать фотометрический метод с пикроминазо.
5-10 мл воды переносят в мерную колбу ёмкостью 50 мл, добавляют 2 мл 0,005 % раствора микроминазо, 5 мл 0,5% раствора желатина, 15 мл 20% раствора NaOH и доводят объём водой до метки. Через 10-15 минут измеряют оптическую плотность. Малые количества магния в летучих кислотах предложено определять комплексонометрическим методом после удаления кислоты выпариванием досуха.
7. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ МАГНИЯ.
Живая материя содержит сотые доли процента магния, но эти доли процента исключительно важны. Магний входит в состав хлорофилла – зелёного пигмента растений, первичного приёмника солнечной энергии. С поглощения света хлорофиллом начинается один из важенйших природных процессов – фотосинтез. Его продуктами является и основная растительная масса, и кислород. Без магния нет хлорофилла, а без хлорофилла была бы невозможна жизнь на нашей планете. Функция молекул хлорофилла состоит в положении фотонов красной области видимого спектра (около 700 нМ) и передаче энергии возбуждения другим частицам, участвующим в цепи реакций, приводящих, в конечном счёте, к соединению воды и углекислого газа и их превращения в глюкозу с одновременным выделением молекулярного кислорода
 |
Опыты, проведённые венгерскими учёными на животных, показали, что недостаток магния в организме повышает предрасположенность к инфаркту. Французские биологи считают, что магний поможет медикам бороться с таким серьёзным недугом XXв, как переутомление. Исследования показывают, что в крови уставших людей уменьшается содержание магния, он как бы, «сгорает», что приводит к нарушениям работы сердечных мышц. При недостатке в почве солей магния рост и развитие растений приостанавливаются. При использовании органических удобрений обеспечивается круговорот магния. В случае же применения только минеральных удобрений необходимо периодическое введение в почву и магниевых соединений. Особенно нуждаются в магниевой подкормке растения –сахароносы: сахарная свекла и сахарный тростник.
Вам сына, или дочь?
Недавно биологи Франции установили любопытное влияние ряда элементов на… получение потомства. Оказывается, избыток калия в пище матери приводит к тому, что у неё рождаются преимущественно дети мужского пола. Если же её пища насыщена кальцием и магнием, то в потомстве преобладает женский пол. Возможно уже вскоре для будущих матерей врачи разработают специальные меню, гарантирующие рождение мальчика или девочки по заказу. Но прежде нужно будет ещё уточнить, распространяется ли подмеченное влияние этих элементов на человека: ведь описанные наблюдения относятся к коровам.
Французские биологи считают, что магний поможет медикам в борьбе с переутомлением. Исследования показывают, что в крови уставших людей содержится меньше магния, чем у здоровых, а даже самые ничтожные отклонения «магниевой крови» от нормы не проходят бесследно.
Важно помнить, что в тех случаях, когда человек часто и по любому поводу раздражается, магний, содержащийся в организме «сгорает». Вот почему у нервных, легко возбудимых людей нарушение работы сердечных мышц наблюдаются значительно чаще.
8. ОБЛАСТИ ПРИМЕНЕНИЯ МАГНИЯ.
Магний применяют в виде металлических пластин при защите от коррозии морских судов и трубопроводов. Защитное действие магниевого «протектора» связано с тем, что из стальной конструкции и магниевого протектора (магний стоит в электрохимическом ряду напряжений левее, чем железо) создаётся электрическая цепь. Происходит разрушение магниевого протектора; основная же стальная часть конструкции при этом сохраняется. В металлургии магний используют как «раскислитель» – вещество, связывающее вредные примеси в расплаве железа. Добавка 0,5% магния в чугун сильно повышает ковкость чугуна и его сопротивление на разрыв. Используют магний и при изготовлении некоторых гальванических элементов.
Сплавы магния играют в технике очень важную роль. Существует целое семейство магниевых сплавов с общим названием «электрон». Основу их составляет магний в сочетании с алюминием (10%), цинком (до 5%), марганцем (1-2%). Малые добавки других металлов придают «электрону» различные ценные свойства. Но главным свойством всех видов «электронов» является их лёгкость (1,8 г/см3) и прекрасные механические свойства. Их используют в тех отраслях техники, где особенно высоко ценится лёгкость: в самолёто- и ракетостроении. В последние годы созданы новые устойчивые на воздухе магниево-литиевые сплавы с совсем малой плотностью (1,35 г/см3). Их использование в технике очень перспективно. Магниевые сплавы цены не только из-за своей лёгкости. Их теплоёмкость в 2-2,5 раза выше, чем у стали. Аппаратура из магниевых сплавов нагревается меньше стальной. Используют и сплав алюминия с большим содержанием магния (5-30%). Этот сплав «магналит» твёрже и прочнее алюминия, легче обрабатывается и полируется. Число металлов, с которыми магний образует сплавы, велико. Из диаграммы, иллюстрирующей правило Юм-Розери, ясна удивительная особенность магния не смешиваться в расплаве со своим близким по положению в таблице Менделеева соседом – бериллием. Из-за сильного различия межатомных расстояний не образует магний сплавов и с железом.
Среди кислородных соединений Mg нужно отметить оксид магния MgO, называемый также жжёной магнезией. Он применяется в изготовлении огнеупорных кирпичей, т.к. температура его плавления 2800оС. Жжёная магнезия используется и в медицинской практике.
Интересны силикаты магния – тальк 3MgO*4SiO2*h3O и асбест CaO*MgO*4SiO2, обладающие высокой огнестойкостью. Асбест имеет волокнистое строение, поэтому его можно прясть и изготавливать из него спецодежду для работы при высоких температурах. Карбонаты и силикаты магния в воде нерастворимы.
Интерес к магнию и сплавам на его основе обусловлен, с одной стороны, сочетанием важных для практического использования свойств, а с другой стороны, большими сырьевыми ресурсами магния. Велика сфера использования магния и магниевых сплавов со специальными химическими свойствами, например в источниках тока и для протекторов при защите стальных сооружений от коррозии.
В СНГ, как и за рубежом, имеются большие запасы минерального сырья магния, удобные для его извлечения. Это месторождения твёрдых солей, содержащих магний, а также рассолы ряда соляных озёр. Кроме того, магний может извлекаться из морской воды. Таким образом для магния не стоит проблема истощения сырьевых ресурсов, которая приобретает всё большее значение для многих других, промышленно важных металлов. Хотя магний является одним из основных промышленных металлов, но объём его производства продолжает заметно уступать объёму производства алюминия и стали.
Определённую ориентировку в потребностях промышленности в магнии даёт рассмотрение его производства и потребления в развитых капиталистических и развивающихся странах. После второй мировой войны и вплоть до начала 70-х годов XX столетия в них наблюдался непрерывный рост производства и потребления магния, затем произошла его стабилизация. Крупнейшим производителем магния в капиталистических странах являются США, доля которых в общем производстве несколько больше 50%.
Конструкционные магниевые сплавы – это лишь одна, причём не самая большая по объёму область применения магния. Магний широко используется как химический реагент во многих металлургических процессах. В частности, он применяется в чёрной металлургии для обработки чугуна с целью десульфурации. В общем в последние годы имеется тенденция к расширению применения магния в качестве химического реагента. Значительное количество магния используется для получения титана, и надо искать пути повышения эффективности применения его в этих целях. Проявляется также значительный интерес к магнию и сплавам на его основе как аккумуляторам водорода.
Имеется определённая предубеждённость против магниевых сплавов со стороны потребителей в отношении их пожароопасности, низкой коррозионной стойкости, повышенной чувствительности к концентраторам напряжений. Эту предубеждённость следует преодолевать. В то же время следует продолжить работы, направленные на улучшение служебных характеристик магниевых сплавов, в частности на повышение их коррозийной стойкости.
Основные тенденции в развитии потребления магния в мире.
В последние годы за рубежом положение магния как одного из масштабных промышленных металлов упрочнилось: в 1980 году впервые в мирное время был превзойдён максимальный уровень производства магния военного 1943 года. Несмотря на отдельные спады, обусловленные общей неблагоприятной коньюктурой, потребление магния оставалось стабильным, хотя цены на него и выросли в 1,9 раза.
Самым крупным производителем и потребителем первичного магния за рубежом остаются США, но их доля в мировом потреблении за 1975-85гг сократилось с 51,7% до 41,5%. Норвегия и США – крупнейшие экспортёры магния: по 36-45 тыс. тонн в год. США являются также крупнейшим производителем магния из вторичного сырья.
Второе место по объёма потребления магния занимает Западная Европа (30%). Потребление магния в Японии оценивается на уровне 20-25 тыс. тонн в год, из которых 69% расходуется в производстве алюминиевых сплавов и высокопрочного чугуна, на отливки из магниевых сплавов – 4,9%.
Магний за рубежом используется во многих отраслях промышленности. Всё разнообразие направлений использования можно условно разделить на 3 группы:
1. Применение магния в производстве алюминиевых сплавов, в которых добавляют от 0,5% до 10% магния. Алюминиевые сплавы, содержащие магний, отличаются высокой удельной прочностью, коррозийной стойкостью и хорошо обрабатываются резанием.
2. Приготовление сплавов конструкционного назначения на основе магния. Содержание магния в таких сплавах 90-98%. Деформируемые магниевые сплавы и литые заготовки из них находят применение в ряде отраслей промышленности, прежде всего в аэрокосмической промышленности, далее идут военная и автомобильная.
3. Использование магния в качестве химического реагента в чёрной и цветной металлургии для восстановления Be, Ti, U, Zr, Hf и др.металлов, в химии (в основном в реакции Гриньяра), также в качестве расходуемых анодов для катодной защиты от коррозии стальных конструкций, подземных трубопроводов и резервуаров. Магний в этих процессах полностью расходуется. Лом и отходы не образуются, в отличии от первых двух групп, где он может повторно использоваться в виде вторичных сплавов.
В условиях дефицита магния также актуальной является задача более рационального использования имеющихся ресурсов металла, сокращение потерь его на всех этапах переработки и использования. Например, более эффективно может быть использован вторичный магниевый сплав типа МА9С6 для легирования алюминиевых сплавов взамен первичного металла. Предпочтительнее выглядит и прямое использование отходов из магниевых сплавов в виде брикетов стружки взамен чушкового металла, например, для десульфурации или модифицирования чугуна, производстве модификаторов типа железо-кремний-магний.
Использование магния в аппаратах космической и авиационной техники, автомобилестроении, различных агрегатах и ответственных приборах предъявляя особые требования к технологии производства литья из магниевых сплавов. Потребность народного хозяйства в магнии и магниевых сплавах значительно превышает возможность их производства. Это ставит перед металлургами, технологами и разработчиками новые проблемы повышения качества литья, использования лома и стружки, создание безотходных и малоотходных технологий производства. Обостряются вопросы экологии.
9. ЖЕСТКОСТЬ ВОДЫПриродная вода, проходя через известковые горные породы и почвы, обогащается солями кальция и магния и становится жёсткой. В жёсткой воде при стирке белья увеличивается расход мыла, а ткань, впитывая соли, становится жёлтой и быстро ветшает. Нерастворимые соли кальция и магния осаждаются на внутренних стенках паровых котлов и трубопроводов. В жёсткой воде хуже и дольше варятся овощи.
Различают временную и постоянную жёсткость воды. При наличии временной жёсткости воды нагрев её приводит к выпадению осадков карбонатов CaCO3 и MgCO3. Временная жёсткость вызвана присутствием в воде гидрокарбонатов Mg(HCO3)2. Такая жёсткость устраняется кипячением воды :

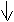 Mg(HCO3)2 = MgCO3 + h3O + CO2
Mg(HCO3)2 = MgCO3 + h3O + CO2 Постоянная жёсткость обусловлена другими солями кальция и магния, она не устраняется кипячением воды. Осадки малорастворимых и практически нерастворимых солей (CaSo4, CaSiO3, MgSiO3)могут выпадать вследствие следующих причин:
1. Повышение концентрации солей при выпаривании воды;
2. Понижение растворимости солей при нагревании (если соль обладает отрицательным температурным коэффициентом).
Для умягчения воды из неё необходимо удалить все соли кальция и магния, как Mg(HCO3)2, так и MgSO4, MgCl2 и др. Это достигается обработкой природной воды различными осадителями:
1. Действие известковой воды
 |
 Mg(HCO3)2 + Ca(OH)2 CaMg(CO3)2 + 2h3O,
Mg(HCO3)2 + Ca(OH)2 CaMg(CO3)2 + 2h3O,
 Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2h3O ;
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2h3O ;
2. Действие соды
 |

 MgSO4 + Na2CO3 MgCO3 + Na2SO4 ,
MgSO4 + Na2CO3 MgCO3 + Na2SO4 ,
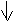 |
 3CaCl2 + 2Na3PO4 Ca3(PO4)2 + 6NaCl.
3CaCl2 + 2Na3PO4 Ca3(PO4)2 + 6NaCl.
Отметим, что один из указанных выше осадков, а именно карбонат магния – кальция CaMg(CO3)2, отвечает по составу природному веществу – минералу доломиту, также широко распространённому, как и кальцит. Он является важнейшим природным источником магния наравне с карналлитом KMgCl3*6h3O.
В химической лаборатории и в промышленности используется полностью обессоленная вода (для питья непригодна). Для этого природную воду подвергают перегонке (дистилляции). Такая дистиллированная вода является мягкой, подобно дождевой воде.
С практической точки зрения (например при эксплуатации паросиловых установок) существенна именно форма образующихся осадков. Накипи отлагаются на поверхностях нагрева, снижая экономичность установки и могут привести к перегреву стенки (поверхности нагрева). Шламы – рыхлые осадки – выпадают в объёме воды и не опасны, поскольку могут быть удалены. Поэтому все методы борьбы с жёсткостью воды направлены либо на очистку воды от ионов солей жёсткости, либо на искусственное осаждение солей жёсткости в форме шламов.
10. Практическая работа «Определение жёсткости воды»
10.1. Методы отбора проб.1. Объём пробы воды для определения общей жёсткости должен быть не менее 250 мл.
2. Если определение жёсткости не может быть проведено в день отбора пробы, то отмеренный объём воды, разбавленной дистиллированной водой 1:1, допускается оставлять для определения до следующего дня. Пробы воды, предназначенные для определения жёсткости не консервируют.
Аппаратура, материалы и реактивы.Посуда мерная лабораторная стеклянная по ГОСТ 20292-74 вместимостью: пипетки – 10,25,50,100 мл без делений
Бюретка 25 мл.
Колбы конические по ГОСТ 25336-82 вместимостью 250 мл.
Капельницы по ГОСТ 25336-82.
Трилон Б
Аммоний хлористый
Аммиак водный 20% раствор
Гидроксиламин солянокислый
Кислота соляная
Натрий сернистый
Натрий хлористый
Спирт этиловый ректификованный
Цинк металлический гранулированный
Магний сернокислый – фиксанал
Хромогенчёрный специальный ЕТ-100 (индикатор)
Хромтёмно-синий кислотный (индикатор)
Все реактивы, используемые для анализа должны быть квалификации «Чистый для анализов»
10.2. Подготовка к анализу.Дистиллированная вода, перегнанная дважды в стеклянном приборе, используется для разбавления проб воды.
9,31 г трилона Б растворяют в дистиллированной воде и доводят до 1 литра. Если раствор мутный, то его фильтруют. Раствор устойчив в течение нескольких месяцев.
Приготовление буферного раствора.
10 г хлористого аммония (Nh5Cl) растворяют в дистиллированной воде, добавляют 50 мл 25% раствора аммиака и доводят до 500 мл дистиллированной водой. Во избежание потери аммиака раствор следует хранить в плотно закрытой склянке.
Приготовление индикаторов.
0,5 индикатора растворяют в 20 мл буферного раствора и доводят до 100 мл этиловым спиртом. Раствор индикатора хромтёмно-синего может сохраняться длительное время без изменения. Раствор индикатора хромогенчёрного устойчив в течение 10 суток. Допускается пользоваться сухим индикатором. Для этого 0,25 г индикатора смешивают с 50 г сухого хлористого натрия, предварительно тщательно растёртого в ступке.
Приготовление раствора сернистого натрия.
5г сернистого натрия Na2S*9h3O или 3,7г Na2S*5h3O растворяют в 100 мл дистиллированной воды. Раствор хранят в склянке с резиновой пробкой.
Приготовление раствора солянокислого гидроксиламина.
1г солянокислого гидроксиламина Nh3OH*HCl растворяют в дистиллированной воде и доводят объём до 100 мл.
Приготовление 0,1H раствора хлористого цинка.
Точную навеску гранулированного цинка 3,269г растворяют в 30 мл соляной кислоты, разбавляют 1:1. Затем доводят объём в мерной колбе дистиллированной водой 1л. Получают точный 0,1Н раствор. Разведением этого раствора вдвое получают 0,05Н раствор. Если навеска неточная (больше или меньше, чем 3,269г), то рассчитывают количество миллилитров исходного раствора цинка для приготовления точного 0,05Н раствора, который должен содержать 1,6345 г цинка в 1 л.
Приготовление 0,05Н раствора сернокислого магния.
Раствор готовят из фиксанола, прилагаемого к набору реактивов для определения жёсткости воды и рассчитанного на приготовление 1 л 0,01Н раствора. Для получения 0,05Н раствора содержимое ампулы растворяют в дистиллированной воде и доводят объём раствора в мерной колбе до 200 мл.
Установка поправочного коэффициента к раствору трилона Б.
В коническую колбу вносят 10 мл 0,05Н раствора хлористого цинка или 10 мл 0,05Н раствора сернокислого магния и разбавляют дистиллированной водой до 100 мл. Прибавляют 5 мл буферного раствора, 5-7 капель индикатора и титруют при сильном взбалтывании раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с фиолетовым оттенком при прибавлении индикатора хромтёмно-синего и синего с зеленоватым оттенком при прибавлении индикатора хромогенчёрный.
Титрование следует проводить на фоне контрольной пробы, которой может быть слегка перетитрованная проба.
Поправочный коэффициент к нормальности раствора трилона Б вычисляют по формуле
10
 K=
K=
V
где V – количество раствора трилона Б, израсходованное на титрование, мл.
10.3. Проведение анализа.Определению общей жёсткости воды мешают: медь, цинк, марганец и высокое содержание углекислых и двууглекислых солей. Влияние мешающих веществ устраняется в ходе анализа.
Точность определения при титровании 100 мл пробы составляет 0,05 мг*экв/л.
В коническую колбу вносят 100 мл отфильтрованной испытуемой воды или меньший объём, разбавленный до 100 мл дистиллированной водой. При этом суммарное содержание ионов кальция и магния во взятом объёме воды не должно превышать 0,5 мг/экв. Затем прибавляют 5 мл буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромочёрного с сухим хлористым натрием и сразу же титруют при сильном взбалтывании 0,05Н раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с зеленоватым оттенком.
Если на титрование было израсходовано больше 10 мл 0,05Н раствора трилона Б, то это указывает, что в отмеренном объёме воды суммарное содержание ионов кальция и магния больше 0,5 мг*экв. В таких случаях следует определение повторить, взяв меньший объём воды и разбавив его до 100 мл дистиллированной водой.
Нечёткое изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения влияния мешающих веществ к отмеренной для титрования пробе воды прибавляют 1-2 мл раствора сульфида натрия, после чего проводят испытание.
Если после прибавления к отмеренному объёму воды буферного раствора и индикатора титруемый раствор постепенно обесцвечивается, приобретая серый цвет, что указывает на присутствие марганца, то в этом случае к пробе воды, отобранной для титрования, до внесения реактивов следует прибавить 5 капель 1% раствора солянокислого гидроксиламина и далее определять жёсткость.
Если титрование приобретает крайне затяжной характер с неустойчивой и нечёткой окраской в эквивалентной точке, что наблюдается при высокой щёлочности воды, её влияние устраняется к пробе воды, отобранной для титрования, до внесения реактивов 0,1Н раствора соляной кислоты в количестве, необходимом для нейтрализации щёлочности воды, с последующим кипячением или продуванием раствора воздухом в течение пяти минут. После этого прибавляют буферный раствор, индикатор и далее определяют жёсткость.
10.4. Обработка результатов.
Общую жёсткость воды в мг*экв/л вычисляют по формулеV*0,05*K*1000
X=-----------------V
где V – количество раствора трилона Б, израсходованное на титрование, мл
K – поправочный коэффициент к нормальности раствора трилона Б
V – объём воды, взятый для определения, мл.
Расхождение между повторными определениями не должно превышать 2 отн.%
Берем испытуемую воду в количестве 100 мл, в 2 колбы делаем параллельный анализ буферного раствора. Добавляем 5 мл буферного раствора в обе колбы, затем 5-7 капель индикатора хромтемно-синий, и начинаем титровать трилоном Б (0,1 норм. раств.)
В первую пробу ушло 5,8 мл трилона Б, во вторую пробу ушло 5,8 мл.
Обработка результатов:
5,8 мл х 0,05 х 0,9930 х 1000
Х= -------------------------------------- = 2,8797 мл экв/л
100
где, V – 5,8 мл
К – 0,9930
V– 100 мл
ВЫВОД:
Содержание жесткости в воде находится в пределах нормы, так как пределом нормы является 1-10 мл х экв/л
www.km.ru