 КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ В.Ф. ВОЙНО-ЯСЕНЕЦКОГО ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ»
КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ В.Ф. ВОЙНО-ЯСЕНЕЦКОГО ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ» Московский Государственный Медико – Стоматологический Университет им. Евдокимова
Кафедра лучевой диагностики
Преподаватель
Реферат
На тему: «Экстравазальные лучевые вмешательства»
2013
Москва
Радиология интервенционная - раздел медицинской радиологии, разрабатывающий научные основы и клиническое применение лечебных и диагностических манипуляций, осуществляемых под контролем лучевого исследования.
Интервенционные вмешательства состоят из двух этапов. Первый этап включает лучевое исследование (рентгенотелевизионное просвечивание, компьютерную томографию, ультразвуковое или радионуклидное сканирование и др.), направленное на установление характера и объема поражения. На втором этапе, обычно не прерывая исследования, врач выполняет необходимые лечебные манипуляции (катетеризацию, пункцию, протезирование и др.), по эффективности часто не уступающие, а иногда и превосходящие оперативные вмешательства, и одновременно обладающие по сравнению с ними рядом преимуществ. Они являются более щадящими, в большинстве случаев не требуют общего обезболивания; продолжительность и стоимость лечения существенно снижаются; процент осложнений и смертность уменьшаются. Интервенционные вмешательства могут быть начальным этапом подготовки резко ослабленных больных к необходимой в последующем операции.
Показания к интервенционным вмешательствам весьма широки, что связано с многообразием задач, которые могут быть решены с помощью методов интервенционной радиологии. Общими противопоказаниями являются тяжелое состояние больного, острые инфекционные болезни, психические расстройства, декомпенсация функций сердечно-сосудистой системы, печени, почек, при использовании йодсодержащих рентгеноконтрастных веществ - повышенная чувствительность к препаратам йода.
Подготовка больного начинается с разъяснения ему цели и методики процедуры. В зависимости от вида вмешательства используют разные формы премедикации и обезболивания. Все интервенционные вмешательства можно условно разделить на две группы: рентгеноэндоваскулярные и экстравазальные.
Рентгеноэндоваскулярные вмешательства, получившие наибольшее признание, представляют собой внутрисосудистые диагностические и лечебные манипуляции, осуществляемые под рентгеновским контролем. Основными их видами являются рентгеноэндоваскулярная дилатация, или ангиопластика, рентгеноэндоваскулярное протезирование и рентгеноэндоваскулярная окклюзия.
Экстравазальные интервенционные вмешательства включают эндобронхиальные, эндобилиарные, эндоэзофагальные, эндоуринальные и другие манипуляции.
К рентгеноэндобронхиальным вмешательствам относят катетеризацию бронхиального дерева, выполняемую под контролем рентгенотелевизионного просвечивания, с целью получения материала для морфологических исследований из недоступных для бронхоскопа участков. При прогрессирующих стриктурах трахеи, при размягчении хрящей трахеи и бронхов осуществляют эндопротезирование использованием временных и постоянных металлических и нитиноловых протезов, не меняющих своего положения, не оказывающих вторичного воздействия на стенку трахеи, что обеспечивает дальнейший терапевтический эффект с высоким качеством жизни.
Совершенствуются эндобилиарные рентгенохирургические вмешательства. При обтурационной желтухе посредством чрескожной пункции и катетеризации желчных протоков выполняют их декомпрессию и создают отток желчи - наружное или внутреннее дренирование желчных путей. В желчные пути вводят препараты для растворения небольших конкрементов, с помощью специальных инструментов удаляют из протоков мелкие камни, расширяют билиодигестивные соустья, в частности анастомозы между общим желчным протоком двенадцатиперстной кишкой при его сужении. У резко ослабленных больных с острым холициститом осуществляют чрескатетерную облитерацию пузырного протока, после чего проводят противовоспалительную терапию, заверщающуюся дроблением и удалением конкрементов. Все большее применение находит чрескожное наложение гастростомы, еюностомы, холицистостомы. Для устранения сужений пищеварительного канала, в т.ч. пищевода, проводят баллонную дилатацию.
Основой рентгеноэндоуринальных манипуляций чаще всего является чрескожная пункция и катетеризация почечной лоханки при непроходимости мочеточника. Таким путем проводят манометрию и контрастирование чашечно-лоханочной системы (антеградную пиелографию), вводят лекарственные вещества. Через искусственно созданную нефростому производят биопсию, рассечение стриктур мочеточника и его баллонное расширение. Заслуживают внимания дилатация и эндопротезирование уретры при аденоме предстательной железы и аналогичные манипуляции при стриктуре шейки матки.
Эндоурологические вмешательства - это интервенционные лечебные и диагностические манипуляции, проводящиеся под рентген - телевизионным и/или эндоскопическим контролем, производящиеся из перкутанного (чрескожного) или трансуретрального (через мочеиспускательный канал) доступов.
Трансуретральная катетеризация и стентирование почки используются для ретроградного разрешения обструкции верхних мочевых путей, при длительном стоянии камня мочеточникана месте или для его смещения для ДЛТ в лоханку (повышается эффективность ДЛТ). Отдельным показанием для установки внутреннего стента являются крупные, множественные и коралловидные камни нормально функционирующей почки, которые могут быть подвергнуты ДЛТ на фоне внутреннего дренирования.
Мочеточниковый стент - специально разработанная трубка, сделанная из гибкого пластикового материала, который помещается в мочеточник, позволяя осуществлять так называемоезакрытое дренирование мочевых путей.
Длина стента варьирует от 24 до 30 см. Стенты разработаны специально для расположения их в мочевой системе. Верхние и нижние части стента имеют закругления - завитки не позволяющие ему смещаться. Обычно стент устанавливают под наркозом, используя специальный инстумент - цистоскоп или уретероскоп, который проводится в мочевой пузырь через уретру - мочеиспускательный канал.
Стент находится в организме, пока не уменьшится обструкция. Это зависит от причины обструкции и природы ее лечения.
Для большинства пациентов стент требуется на непродолжительное время, от нескольких недель до нескольких месяцев. Однако стент, если он правильно расположен, может находится в организме до 3-х месяцев без замены. Когда основная проблема - не почечный камень, стент может находиться в организме еще дольше. Существуют специальные стенты, которые могут находится внутри очень долгое время.
Как извлекание стента - короткая процедура и состоит из удаления стента, используя цистоскоп.
Мочеточниковые стенты разработаны, чтобы пациенты могли вести нормальный образ жизни. Однако, ношение стентов может сопровождается побочными эффектами, большинство их не опасны для здоровья.
Наиболее частые побочные эффекты:
*более частые, чем обычно, позывы к мочеиспусканию.
*примесь крови в моче.
*Ощущение неполного опорожнения мочевого пузыря.
*Боли в области почки при мочеиспускании.
Необходимо наблюдать за стентом (УЗИ, обзорная урография), т.к. через 1,5-2 мес. стент может начать покрываться кристаллами солей, что может приводить к усилению болей, гематурии.
Входят в практику интервенционные методы исследования плода и лечения его заболеваний. Так, под контролем ультразвукового сканирования осуществляют ранний амниоцентез, биопсию хориона, кожи плода, забор крови, устраняют обструкцию мочевого тракта.
Интервенционные исследования применяют при пункции непальпируемых образований в молочной железе, выявленных с помощью маммографии. Пункцию выполняют под контролем рентгенотелевизионного просвечивания. После исследования в ткани железы оставляют специальную иглу, которая служит ориентиром при секторальной резекции. Под контролем рентгеноскопии или компьютерной томографии осуществляют чрескожные трансторакальные пункции внутрилегочных и медиастинальных образований. Аналогичным образом, в т.ч. под контролем ультразвукового сканирования, проводят пункцию и биопсию патологических очагов в других тканях и органах. Наиболее распространенными интервенционными манипуляциями стали пункция кист и абсцессов различной локализации с их последующим дренированием. Методику используют при кистах щитовидной, поджелудочной железы, почек, печени и др., абсцессах легких, печени, поджелудочной железы, брюшной полости. Абсцесс пунктируют стилет-катетером под контролем ультразвукового сканирования, компьютерной томографии или рентгеноскопии. После удаления через катетер гнойного содержимого в полость вливают лекарственные препараты. Катетер оставляют в полости для повторения процедуры. С помощью лучевых методов исследования наблюдают за динамикой процесса.
Значительна роль интервенцонной радиологии при заболеваниях опорно-двигательного аппарата. Под контролем лучевых методов проводят биопсию синовиальных оболочек, трепанобиопсию, интервенционные вмешательства на межпозвоночных дисках, в т.ч. чрескожную люмбальную декомпрессию и дискэктомию, а также хемонуклеоз (введение в студенистое ядро диска протеолитических ферментов с последующим удалением фрагментов хрящевой грыжи) и др.
К наиболее распространенным вмешательствам на органах желудочно-кишечного тракта, можно отнести: чрескожную гастроэнтеростомию; баллонную дилатацию и стентирование пищевода и кишечника; дренирование внутрибрюшинных и забрюшинных абсцессов.
Хотя еще нет клинических исследований, но экспериментальные исследования в области новых полимерных технологий многообещающи. Врачами из Германии (T. Schmitz Rode et al.) были разработаны бесконтактно контролируемые микро- и наноносители в качестве нового терапевтического подхода. Суть данной методики заключается в инкапсуляции специального вещества, обладающего магнитными свойствами (магнетита) в термочувствительных нано- и микрочастицах полиакриламида. Это дает возможность индукционного нагрева этих частиц до температуры, превышающей температуру тела (больше 40°C), путем использования внешнего высокочастотного магнитного поля (спираль магнитной индукции).
Подъем температуры ведет к определенным изменениям внутри матрицы термочувствительного полимера, что сопровождается значительной потерей связанной воды (т.е. уменьшением опухоли в объеме). Привлекательной особенностью новой полимерной технологии является то, что вместе со специальным веществом с магнитными свойствами в полимерном матриксе также могут быть инкапсулированы лекарства. Их высвобождение происходит в течение нескольких минут, а сам процесс запускается с помощью индукции. Разнообразные вещества (метиленовый синий, флюоресцин), служащие в качестве модели противоопухолевых препаратов, были инкапсулированы в термочувствительные
полимерные носители. Проведенный в опытах нагрев с помощью индукции дал значительное высвобождение из модели составляющих веществ за небольшой промежуток времени (2-5 мин).
Новаторские индукционно нагреваемые термочувствительные магнитные полимерные носители в комбинации с высвобождением лекарств представляют бесконтактно контролируемые носители активных препаратов и открывают новые перспективы для прицельного лечения опухолей. Кроме высвобождения лекарственных агентов при данном методе параллельно нагреваются опухолевые клетки или ткани без общей гипертермии.
Особого внимания заслуживают новые подходы к лечению диабета. Так, при первом типе сахарного диабета была выполнена чрескожная трансплантация клеток островка поджелудочной железы. Эта методика трансплантации островков была предложена в качестве малоинвазивного и альтернативного хирургическому методу трансплантации. Приблизительно 200 мл суспензии очищенных человеческих клеток островка поджелудочной железы вводится в главную портальную вену или в ее сосуды в левой доле печени. Контроль за давлением в портальной вене позволяет отслеживать даже небольшие возрастания давления во время процедуры. В конце процедуры через катетер поступает специальное фиксирующееся на участке сосуда гелеобразующее вещество. Всем пациентам выполнялись функциональные печеночные пробы и проводили иммуносупрессивную терапию. Чрескожная трансплантация островковых клеток относительно проста в применении.
Поэтому у пациентов с резистентным к терапии диабетом первого типа она является перспективным клиническим радиологическим методом в качестве альтернативы хирургической трансплантации поджелудочной железы.
Список литературы:
1)И.А. Абоян, С.В. Павлов, В.А. Скнар, Д.А. Ромоданов, А.Н. Толмачев, С.В. Грачев «Мочекаменная болезнь. Современные методы лечения.» М,2009 г
2)Достижения интервенционной радиологии (по материалам Европейского конгресса радиологов, Вена, март 2004 г.) И.М. Архипова
)Рабкин И.Х. Рентгеноэндоваскулярное протезирование. Хирургия, № 6, с. 137, 1988; Рабкин И.X., Матевосов А.Л. и Гетман Л.И. Рентгеноэндоваскулярная хирургия, М., 1987.
)«Интервенционная радиология» Российский научный центр рентгенорадиологии МЗ РФ В.П. Харченко, Н.И. Рожкова
studfiles.net
Часть Ш. Интервенционная радиология - раздел Образование, ЛУЧЕВАЯ ДИАГНОСТИКА
Предисловие
Лучевая диагностика и лучевая терапия являются составными частями медицинской радиологии – областью медицины, изучающей диагностическое и терапевтическое применение проникающего излучения. Она сформировалась к началу 80-х годов прошлого века, возникнув на стыке многих наук: ядерная физика, квантовая электроника, биофизика, радиобиология, радиационная гигиена, нормальная и патологическая анатомия, нормальная и патологическая физиология. Кроме лучевой диагностики (медицинская визуализация) и лучевой терапии (радиационная терапия), мединская радиология включает в себя радиологическую анатомию, радиобиологию, радиационную гигиену и интервенционную радиологию – раздел медицины, занимающийся терапией заболеваний под контролем проникающего излучения;
В настоящее время мы являемся свидетелями нового этапа в развитии медицинской радиологии, связанной с ее техническим перевооружением, организацией диагностических центров на основе лучевых методов исследования, использованием компьютерных технологий в лучевой диагностике и лучевой терапии, внедрением новых методов лучевого исследования и лучевой терапии: ультразвуковая диагностика (УЗД), радиоиммунный анализ (РИА), компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ). Лучевые методы диагностики используются абсолютно во всех разделах клинической медицины, играя в некоторых из них ведущую диагностическу роль (травматология, пульмонология, уронефрология, маммология). В сочетании с другими методами клинического обследованиями лучевые методы существенно помогают врачу в дифференциальной диагностике различных заболеваний, осуществляют эффективное лечение многих из них, облегчают наблюдение за эффективностью проводимого лечения, и даже успешно применяются в профилактической медицине, помогая распозновать ряд заболеваний на доклиническом этапе.
Лучевая терапия сегодня располагает большим набором источников квантового и корпускулярного излучений, а лучевые методы воздействия на злокачественную опухоль с помощью ионизирующих лучей стали важнейшей составной частью комплексного лечения онкологических больных. Поэтому лучевые терапевты работают в тесном контакте с онкологами, хирургами, химиотерапевтами.
С учетом возрастающей роли медицинской радиологии в практической медицине, предъявляются новые требования и к уровню профессиональной подготовки врача общей практики. Именно это обстоятельство, а также отсутствие доступных для студентов современных учебников побудило авторов настоящего пособия изложить читателю в популярной форме и, вместе с тем, с достаточной научной точностью общие и частные вопросы лучевой диагностики и лучевой терапии.
Авторы надеются, что изложенные в данном учебном пособии сведения помогут и врачу любой специальности более квалифицированно использовать возможности лучевых методов исследования и терапии при диагностике и лечении заболеваний человеческого организма.
Рентгенодиагностика. 1.1. Принцип рентгенодиагностики заключается в визуализации внутренних органов с помощью направле
Описание (интерпретация) рентгенограмм Интерпретация рентгенограмм должня проводиться в определенной последовательности. Это снижает риск пропу
Радионуклидная диагностика (РНД). 2.1. Принцип радионуклидной диагностикизаключается во введении радионуклидов или радиофармпрепар
Ультразвуковая диагностика (УЗД). 3.1. Принцип УЗД. Ультразвуковая диагностика – метод визуализации органов и тканей с помощью ультр
Основные методы УЗД. Методы ультразвукового исследования по способу генерирования, обработки сигнала и построения ультразвуко
Основы ультразвуковой семиотики. Изображение объекта, полученное при ультразвуковом исследовании, имеет ряд специфических характеристик, з
Рентгеновская компьютерная томография (КТ). 4.1 Принцип КТ заключается в получении серии поперечных срезов исследуемого органа с помощью движу
Технология визуализации при КТ. После укладки больного на стол аппарата производится обзорный снимок исследуемого органа или части тела –
Достоинства КТ. КТ-изображение, прежде всего, дает изолированное изображение поперечного слоя тканей по принципу пироговс
Виды КТ. КТ подразделяется на пошаговую компьютерную томографию - КТ, о которой речь шла выше,
Технология визуализации при МРТ. Ядра атомов элементов, в которых имеется нечетное число нуклонов (1Н1, 13С6, 19Fe
Достоинства и недостатки МРТ. Прежде всего, это неинвазивность и отстутсвие лучевой нагрузки. Далее - высокий тканевой контраст, основанн
Механизм биологического действия ионизирующих излучений. Все виды ионизирующих излучений (как корпускулярные, так и квантовые) обладают биологическим действием, т.е
Молекулярный этап БДИИ. На первом, молекулярном этапе выделяют физическую, физико-химическую и химическую фазы. В первую, физичес
Клеточный этап БДИИ. Обозначенные выше процессы начинают сказываться на жизнеспособности клеток -наступает клеточный этап био
Соматический этап БДИИ. Радиочувствительность (радиопражаемость) целого организма, вследствие сложности протекающих в нём физиол
Лучевые реакции организма. Лучевые реакции организма подразделяются на общие, которые складываются из поражения кроветв
Тест-вопросы. 1. При увеличении количества кислорода в облучаемых тканях степень биологического воздействия на ткани
Обеспечение радиационной безопасности персонала. 4. Тест-вопросы. 5. Литература. 1. Дозиметрия ионизирующих излучений
Методы дозиметрии. Измерение доз ионизирующих излучений осуществляют путем количественной регистрации физических, химическ
Обеспечение радиационной безопасности пациентов. Радиационная безопасность пациентов должна быть обеспечена при всех видах рентгенорадиологического облу
Обеспечение радиационной безопасности персонала. Обеспечение радиационной безопасности персонала обеспечивается - ограничением допуска к работе с ист
Тест-вопросы. 1. Единица «рентген» определяет а) поглощённую дозу, б) экспозиционную дозу, в) эквивалентную
Рентгенологические методы исследования. Рентгенография является основным методом лучевого исследования КСС. Именно с неё начинается лу
Мультиспиральная компьютерная томография. Метод эффективен для уточнения размеров костных и мягкотканных опухолей, исключения инвазии злокачествен
Методы УЗД. Ультразвуковому исследованию доступно ограниченное количество анатомических объектов и патологических с
Радионуклидные методы. Остеосцинтиграфия является методом выбора при подозрении на первичную злокачественную опу
Рентгеноанатомия костей и суставов. Кости. По анатомической классификации кости подразделяются на 4 группы: а) трубчатые (короткие, или моно
Рентгеновская семиотика травматических повреждений костей и суставов. Выделяют перелом, трещину и надлом кости. При переломе нарушение целостности кости занимает весь поперечни
Рентгеновская семиотика заболеваний костей и суставов. Выделяют следующие синдромы при заболеваниях КСС: а) синдром поражения мягких тканей, б) синдром и
УЗ семиотика заболеваний костей и суставов. Синдром дисплазии тазобедренного сустава у детей. Дисплазия тазобедренного сустава характеризуется о
Алгоритмы лучевого обследования при патологии КСС. Подозрение на аномалию развития или опухолевый процесс. Станадратная рентгенография для выяв
Ситуационные задачи. 1. Рентгенограмма кисти с эпифизиолизом. Опредлить вид травмы, характер смещения отломков. 2. Рентг
Тест-вопросы 1. Выберите метод исследования при остеохондрозе а) стандартная рентгенография б) рентгенография
Тест-вопросы. 1. Лучевые методы исследованиялёгких. 1.1. Рентгенологические методы исследования.
Компьютерная томография. Метод характеризуется высокой информативностью при заболеваниях легких, и позволяющий отказаться от таки
Методы УЗИ УЗИ при заболеваниях органов грудной клетки применяется при поиске малых количеств жидкости в плевральных
Радионуклидные методы. Сцинтиграфия легких. Радиоизотопная сцинтиграфия легких позволяет исследовать и измерять пока
Рентгеноанатомия легких. Рентгеноанатомия легких изучается по обзорным снимкам (рис. 19 и 20), но сначала оценивается состояние костей,
Алгоритмы лучевого обследования при патологии органов дыхания и средостения. Острая боль в грудной клетке внесердечной локализации. Обзорная рентгенограмма грудной клетки
Ситуационные задачи. 1. Рентгенограмма грудной клетки в правой боковой проекции. Определить проекцию исследования. 2. Р
Рентгенологические методы. Обзорная рентгенограмма грудной клетки применяется для определения состояния легочной гемоди
Мультиспиральная компьютерная томография (МСКТ). МСКТ проводится как в нативных условиях,так и с искусственным контрастированием – КТ-а
Ультразвуковые методы. Ультразвуковым методам в диагностике заболеваний сердца сейчас отводится ведущая роль среди других лучев
Радионуклидные методы. Перфузионная сцинтиграфия сердца, выполняемая с помощью ОФЭКТ и ПЭТ, применяются для оценки жиз
Рентгеноанатомия сердца в прямой проекции. Сердце в прямой проекции имеет тень косо расположенного овала (рис. 30). Выделяют обычное, косое положение ос
Рентгенологические признаки увеличения камер сердца. Увеличение левого желудочка.При увеличении левого желудочка в прямой проекции выявляется расширение т
Синдром аортальной конфигурации сердца. Аортальная конфигурация сердца характеризуется следующими признаками: а) подчеркивание талии сердца всле
Синдром трапециевидной (овальной) конфигурации сердца. Эта конфигурация сердца характеризуется: а) горизонтальным положением оси сердца, б) увеличением серд
Синдром наличия свободной жидкости в перикарде. Жидкость в полости перикарда визуализируется в виде анэхогенной прослойки толщиной от нескольких миллиме
Алгоритмы лучевого обследования при патологии сердца. Острая боль в области сердца (предварительно необходимо исключить ОИМ) УЗД (сонография)
Ситуационные задачи. 1. Коронарограмма. Определить методику лучевого исследования, назвать возможный контраст, оценить сос
Тест-вопросы. 1. Для выявления жидкости в перикарде наиболее эффективен метод а) УЗИ,! б) КТ, в) рентгенографи
Рентгенологические методы. Обзорная рентгенография органов брюшной полости. Обзорная рентгенограмма брюшной полости необ
Радионуклидные методы. Гаммасцинтиграфия желудка. Метод предназначен для изучения эвакуаторной функции желудка. Суть
Рентгенологические методы. Обзорный снимок печени и поджелудочной железы. Применяется при поиске минеральных камней жёлчн
Компьютерная томография. Нативная КТ в настоящее время является одним из ведущих методов лучевой визуализации печени и п
Методы УЗИ. Трансабдоминальное УЗИ печени и желчных путей. Ведущий метод лучевой диагностики при забол
Радионуклидные метиоды. Гепатосцинтиграфия.Метод показан при диффузных поражениях печени, для изучения барьерной функ
Рентгеноанатомия пищевода, желудка и кишечника. Рентгеноанатомия пищевода. Пищевод начинается на уровне шестого – седьмого шейных позвонков, идет сна
Рентгенологические синдромы при заболеваниях пищевода, желудка и кишечника. Выделяют следующие рентгенологичекие синдромы при заболеваниях органов пищеварительного тракта: а) с
УЗ синдромы при заболеваниях органов пищеварительной системы. Данные, получаемые при УЗИ, складываются из двух групп признаков: а) выявляемые (измеряемые, оцениваемы
Алгоритмы лучевого обследования при заболеваниях органов пищеварительной системы. Острая боль в брюшной полости. УЗИ, обзорный снимок брюшной полости (с захватом плевральных синус
Ситуационные задачи. 1. Рентгенограмма с дивертикулом пищевода.. Определить характер заполнения органа и вид дивертикула.
Рентгенологические методы. Обзорная урографая. Обзорный снимок почек и мочевых путей применяется, в основном, для обнаруже
Компьютерная томография. КТ с введением РКВ является высоко информативным методом визуализации коркового и мозгового вещества почк
Методы УЗИ. В настоящее время УЗИ является основным методом лучевой диагностики заболеваний почек и мочевого пузыря.
Рентгеноанатомия почек, мочеточников и мочевого пузыря. Почки располагаются на уровне Th22-L4 у детей и Th22-L3 у взрослых, причём в 60-70% левая почка выше правой. Смещаемос
Синдром минеральных включений. К этому синдрому относятся заболевания, сопровождающиеся отложением солей кальция и паренхиме почки или м
Синдром дислокации почки. Основные причины, вызывющие этот синдром, это дистопии почки, нефроптоз и забрюшинные новообразования.
Синдром аномалии почек и верхних мочевых путей (ВМП). К нему относят невизуализируемую почку и атипичную синтопию почки. Невизуализируемая почка всегда пр
Синдром аномалии структуры паренхимы почки. К этому синдрому относят диффузное кистозное поражение почек, отёчную почку и клеротические изменения поч
Синдром объемного образования почки. Характеризуется наличием объемных солидных образований различной эхогенности. Объемное образовани
Алгоритмы лучевого исследования. Приступ почечной колики Ультразвуковое сканирование Обзорная урография Экскр
Ситуационные задачи. 1. Обзорная урограмма Оценить анатомические параметры почек 2. Обзорная урограмма Выявить пр
Тест-вопросы. 1. Выберите метод исследования для верификации почечной гипертензии а) КТ б) дуплексная сонографи
Интраоральные методы. Рис. 45. Схема периапикальной рентгенографии нижних зубов.
Экстраоральные методы. Экстраоральные методы подразделяются на две группы: обзорная рентгенография и прицеленная и прицеленная р
Специальные методы лучевого исследования. Линейная томография применяется для выделения различных отделов челюстей, для визуализации НВ
Дентальная объемная томография.
Рентгеноанатомия зубов и челюстей. Каждый зуб состоит из коронки, где выделяют эмаль и дентин, корня (или корней), состоящего из дентина и цемен
В формировании зубочелюстной системы выделяют несколько этапов. 1-й этап, где выделяют периоды новорожденности и временного прикуса. Период новорожденности
Д) аномалии прикуса - глубокий, часто сочетается с атрофией и деформацией межзубных перегородок, - открытый, ч
Рентгенодиагностика травматических повреждений зубов и челюстей. Переломы верхней челюсти. В изолированном виде практически не встречаются, а сочетаются с пов
Рентгенодиагностика заболеваний зубов и челюстей. Кариес. В зависимости от глубины поражения твёрдых тканей зуба различают начальный кариес (ст
Рентгенодиагностика новообразований челюстей. Новообразования челюстей Одонтогенные Неодонтогенные Доброкаче
Алгоритмы лучевого исследования при патологии ЗЧС. Травмы костей лицевого черепа Рентгенография в двух проекциях Периапикальная рентгено
Ситуационные задачи. 1. Рентгенограммы с переломом верхней челюсти Определить вид перелома по Лефору 2. Рентгенограммы
allrefers.ru
Радиология интервенционная - раздел медицинской радиологии, разрабатывающий научные основы и клиническое применение лечебных и диагностических манипуляций, осуществляемых под контролем лучевого исследования.
Интервенционные вмешательства состоят из двух этапов. Первый этап включает лучевое исследование (рентгенотелевизионное просвечивание, компьютерную томографию, ультразвуковое или радионуклидное сканирование и др.), направленное на установление характера и объема поражения. На втором этапе, обычно не прерывая исследования, врач выполняет необходимые лечебные манипуляции (катетеризацию, пункцию, протезирование и др.), по эффективности часто не уступающие, а иногда и превосходящие оперативные вмешательства, и одновременно обладающие по сравнению с ними рядом преимуществ. Они являются более щадящими, в большинстве случаев не требуют общего обезболивания; продолжительность и стоимость лечения существенно снижаются; процент осложнений и смертность уменьшаются. Интервенционные вмешательства могут быть начальным этапом подготовки резко ослабленных больных к необходимой в последующем операции.
Показания к интервенционным вмешательствам весьма широки, что связано с многообразием задач, которые могут быть решены с помощью методов интервенционной радиологии. Общими противопоказаниями являются тяжелое состояние больного, острые инфекционные болезни, психические расстройства, декомпенсация функций сердечно-сосудистой системы, печени, почек, при использовании йодсодержащих рентгеноконтрастных веществ - повышенная чувствительность к препаратам йода.
Подготовка больного начинается с разъяснения ему цели и методики процедуры. В зависимости от вида вмешательства используют разные формы премедикации и обезболивания. Все интервенционные вмешательства можно условно разделить на две группы: рентгеноэндоваскулярные и экстравазальные.
Рентгеноэндоваскулярные вмешательства, получившие наибольшее признание, представляют собой внутрисосудистые диагностические и лечебные манипуляции, осуществляемые под рентгеновским контролем. Основными их видами являются рентгеноэндоваскулярная дилатация, или ангиопластика, рентгеноэндоваскулярное протезирование и рентгеноэндоваскулярная окклюзия.
Сосудистые интервенции.
1. Артериальная ангиопластика при периферической и центральной сосудистой патологии.
Данный круг вмешательств охватывает баллонные диллатации артерий, стентирования сосудов, атерэктомию. При облитерирующих заболеваниях нижних конечностей, зачастую, возникает необходимость восстановления просвета пораженных сосудов с целью ликвидации ишемии. В этих целях в 1964 году Dotter и Judkins стали использовать набор коаксиальных катетеров для бужирования просвета артерий. Но наибольший прогресс был достигнут после внедрения в 1976 году Gruntzig специального баллонного катетера. Раздувание баллона, установленного в месте сужения сосуда, приводит к восстановлению его просвета либо в полном объёме, либо в размерах, позволяющих обеспечить адекватное питание конечности. Кроме того, имеется возможность многократных диллатаций. В последующие годы баллонные диллатации стали применяться на брахиоцефальных, коронарных, почечных, брыжеечных артериях, гемодиализных фистулах. Однако, неизбежная травматизация интимы, последующая её гиперплазия даёт высокий процент рестенозов. В связи с этим были разработаны внутрисосудистые металлические или нитиноловые протезы - стенты. Существует несколько модификаций стентов, которые можно разделить на саморасширяющиеся и расширяемые баллоном. Соответственно различается и методика их имплантации. Установке Wallstent предшествует баллонная диллатация, а при стентировании стентами, расширяемыми баллоном, это происходит одновременно. Более того, применение стентов, покрытых полиэтиленом, позволяет использовать их для лечения аневризм аорты и крупных артерий (в том числе веретенообразных и аневризм больших размеров) путём создания нового просвета сосуда. В последние годы стали применятся стентирования полых вен при их сдавлениях опухолями, а также любых полых трубчатых структур, таких как пищевод, привратник, желчевыводящие пути, кишечник, трахея и бронхи, мочеточники, носо-слёзный канал. Основными показаниями для таких процедур являются злокачественные неоперабельные опухоли. Несмотря на паллиативный характер, весьма успешно купируются дисфагия, пищеводно-респираторные фистулы, механическая желтуха, кишечная непроходимость, уростаз.
2. Борьба с патологическим тромбообразованием.
В настоящее время стал широко применяться регионарный тромболизис. Максимально близкая установка катетера к тромбу позволяет повысить эффективность и снизить дозы вводимых через него фибринолитических препаратов, тем самым уменьшить побочные эффекты такого лечения. Некоторыми фирмами разработаны системы для внутрисосудистой механической ретракции тромба и отсасывания свежих сгустков. Наиболее эффективной методикой борьбы с тромбоэмболией легочной артерии считается установка металлических фильтров в нижнюю полую вену. Этим создаётся препятствие на пути крупных мигрирующих тромбов. Для установки фильтра используется либо трансфеморальный, либо трансюгулярный доступ, специальная система установки и доставки фильтра. Фильтры различаются по своей модификации. Самыми известными являются - Gunther-Tulip и Bird‘s Nest фильтры фирмы William Cook Europe, и фильтр Greenfield фирмы Medi-Tech/Boston Scientific.
3. Сосудистые эмболизации.
Этот вид вмешательств используется для остановки кровотечений различной локализации, лечения ряда опухолей, а также при некоторых аневризмах и сосудистых аномалиях. В качестве эмболизирующих агентов используются масляные контрастные препараты, гемостатическая желатиновая губка, Ивалон, сотрадекол, 96% этиловый спирт, металлические спирали, аутогемосгустки, микросферы с ферромагнетиками и др. Эмболизация с гемостатической целью весьма эффективна при желудочно-кишечных кровотечениях, тяжёлых травмах таза, запущенных кровоточащих опухолях лёгкого, почки, мочевого пузыря и женских гениталий.
Широко используется метод химиоэмболизации печёночной артерии при злокачественных первичных и метастатических опухолях печени. Здесь нашли применение свойства масляных контрастных препаратов (липиодол, этиодол, этиотраст, майодил и иодлипол ). При введении в печёночную артерию они гораздо активнее проникают и депонируются в опухлевой ткани, чем в печёночной паренхиме. Перемешанные с цитостатиками (чаще всего с доксорубицином) они оказывают не только ишемический, но и химиотерапевтический эффект. Некоторые авторы считают химиоэмболизацию печёночной артерии альтернативой резекции печени при солитарном опухолевом поражении, а при множественных печёночных метастазах, хотя паллиативным, но единственным способом продлить жизнь больного и её качество.
Среди других патологий, при которых эффективна эмболизация, нужно отметить артерио-венозные мальформации, аневризмы сосудов головного мозга с чётко выраженной шейкой, некоторые опухоли костно-мышечной системы, открытый артериальный проток.
4. TIPS.
Аббревиатура TIPS расшифровывается как трансюгулярный, внутрипечёночный шунт системы воротной вены. Методика предложена Rusch для борьбы с кровотечениями из варикозных вен пищевода при портальной гипертензии. После пункции яремной вены и её катетеризации катетер устанавливается в одной из печёночных вен, и затем специальной, проведённой через катетер иглой, пунктируется одна из ветвей воротной вены. Проделанный тунель расширяется баллонным катетером и стентируется. Результат процедуры - искусственно созданный порто-кавальный анастомоз всего лишь через одно пункционное отверстие.
5. Извлечение инородных тел.
С помощью катетеров с петлями-ловушками, корзинками и других приспособлений рентгенохирурги могут исправлять огрехи своей работы или последствия вмешательств хирургов и анестезиологов в виде оставленных в просвете сосудов и полостей сердца обрывков катетеров, проводников, других инородных тел. После захвата инородного тела фиксирующим элементом катетера оно низводится в периферический сосуд, чаще всего в бедренную артерию или вену, и удаляется через небольшой разрез.
Экстравазальные интервенционные вмешательства включают эндобронхиальные, эндобилиарные, эндоэзофагальные, эндоуринальные и другие манипуляции.
studfiles.net
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
« КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ В.Ф. ВОЙНО-ЯСЕНЕЦКОГО ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ»
КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ В.Ф. ВОЙНО-ЯСЕНЕЦКОГО ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ»
Кафедра онкологии и лучевой терапии с курсом ПО
Зав. кафедрой:
д.м.н., профессор Дыхно Ю.А.
Преподаватель:
д.м.н., профессор Максимов С.А.
Реферат:
Физические основы медицинской радиологии
Выполнил: xxx., xxx
Красноярск 2009
Медицинская радиология- область медицины, разрабатывающая теорию и практику применения излучения в медицинских целях. Медицинская радиология включает в себя две основные медицинские дисциплины: лучевую диагностику (диагностическую радиологию) и лучевую терапию (радиационную терапию).
Лучевая диагностика- наука о применении излучений для исследования строения и функций нормальных и патологически измененных органов и систем человека с целью профилактики и распознавания заболеваний.
В состав лучевой диагностики входят рентгенодиагностика, радионуклидная диагностика, ультразвуковая диагностика и магнитно-резонансная визуализация. К ней также относят такие нечасто применяемые методы исследования, как термография, СВЧ-термометрия, магнитнорезонансная спектрометрия. Еще одно очень важное направление лучевой диагностики - интервенционная радиология: выполнение лечебных вмешательств под контролем лучевых исследований.
Роль лучевой диагностики в подготовке врача и медицинской практике непрерывно возрастает. Это связано с созданием в стране диагностических центров, вводом в строй крупных городских, областных и республиканских больниц, оснащенных новейшей аппаратурой, а также быстрым развитием компьютерных технологий, которые создают предпосылки для получения высококачественных изображений внутренних органов, включая объемные (так называемые трехмерные) изображения. Указанные обстоятельства способствуют созданию новой системы медицинской диагностики, объединяющей все существующие способы получения изображения органов человека.
Лучевая терапия- это наука о применении ионизирующих излучений для лечения болезней. Лучевая терапия располагает большим набором источников квантового и корпускулярного излучений, обеспечивающих облучение нужного объема тканей в оптимальной лечебной дозе.
В связи с этим лучевая терапия стала важнейшей составной частькомплексного лечения злокачественных заболеваний, а лучевые терапевты работают в тесном контакте с онкологами, хирургами, химиотерапевтами.
Без радиологии сегодня не могут обойтись никакие медицинские дисциплины. Лучевые методы широко используют в анатомии (лучевая нормальная и патологическая анатомия), физиологии (лучевая физиология и патофизиология), биохимии (радиационная биохимия). Изучением действия ионизирующих излучений на живые объекты занимается радиационная биология - важное направление биологической науки. В связи с развитием ядерных технологий и широким применением излучений в медицинской практике, народном хозяйстве и научных исследованиях все большее значение приобретает радиационная гигиена. К смежным специальностям радиологии можно отнести также все основные клинические дисциплины: кардиологию, пульмонологию, остеопатологию, гастроэнтерологию, эндокринологию и т.д. Это и понятно: уже давно не найти области изолированного использования законов и методов патологической анатомии и физиологии, терапии и хирургии, стоматологии и радиологии, есть лишь сфера и взаимного действия.
Ионизирующее излучение. Виды ионизирующих излучений и их свойства.
Ионизирующее излучение– поток заряженных или нейтральных частиц и квантов электромагнитного излучения, прохождение которых через вещество приводит к ионизации и возбуждению атомов или молекул среды. Они возникают в результате естественных или искусственных радиоактивных распадов веществ, ядерных реакций деления в реакторах, ядерных взрывов и некоторых физических процессов в космосе. Ионизирующие излучения состоят из прямо или косвенно ионизирующих частиц или смеси тех и других. К прямо ионизирующим частицам относятся частицы (электроны, α-частицы, протоны и др.), которые обладают достаточной кинетической энергией, чтобы осуществить ионизацию атомов путём непосредственного столкновения. К косвенно ионизирующим частицам относятся незаряженные частицы (нейтроны, кванты и т.д.), которые вызывают ионизацию через вторичные объекты.
В настоящее время известно около 40 естественных и более 200 искусственных α-активных ядер. α-распад характерен для тяжелых элементов (урана, тория, полония, плутония и др.). α-частицы - это положительно заряженные ядра гелия. Они обладают большой ионизирующей и малой проникающей способностью и двигаются со скоростью 20000 км/с. β-излучение - это поток отрицательно заряженных частиц (электронов), которые выпускаются при β -распаде радиоактивных изотопов. Их скорость приближается к скорости света. Бета-частицы при взаимодействии с атомами среды отклоняются от своего первоначального направления. Поэтому путь, проходимый β -частицей в веществе, представляет собой не прямую линию, как у α-частиц, а ломаную. Наиболее высокоэнергетические β-частицы могут пройти слой алюминия до 5 мм, однако ионизирующая способность их меньше, чем у α-частицы. γ-излучение, испускаемое атомными ядрами при радиоактивных превращениях, обладает энергией от нескольких тысяч до нескольких миллионов электрон-вольт. Распространяется оно, как и рентгеновское излучение, в воздухе со скоростью света. Ионизирующая способность γ -излучения значительно меньше, чем у α- и β -частиц. γ -излучение - это электромагнитные излучения высокой энергии. Оно обладает большой проникающей способностью, изменяющейся в широких пределах. Все ионизирующие излучения по своей природе делятся на фотонные (квантовые) и корпускулярные.
К фотонному (квантовому) ионизирующему излучению относятся гамма-излучение, возникающее при изменении энергетического состояния атомных ядер или аннигиляции частиц, тормозное излучение (рентгеновское), возникающее при уменьшении кинетической энергии заряженных частиц, характеристическое излучение с дискретным энергетическим спектром, возникающее при изменении энергетического состояния электронов атома и рентгеновское излучение, состоящее из тормозного и/или характеристического излучений.
К корпускулярному ионизирующему излучению относят α-излучение, электронное, протонное, нейтронное и мезонное излучения. Корпускулярное излучение, состоящее из потока заряженных частиц (α-, β-частиц, протонов, электронов), кинетическая энергия которых достаточна для ионизации атомов при столкновении, относится к классу непосредственно ионизирующего излучения. Нейтроны и другие элементарные частицы непосредственно не производят ионизацию, но в процессе взаимодействия со средой высвобождают заряженные частицы (электроны, протоны), способные ионизировать атомы и молекулы среды, через которую проходят. Соответственно, корпускулярное излучение, состоящее из потока незаряженных частиц, называют косвенно ионизирующим излучением. Нейтронное и гамма излучение принято называть проникающеё радиацией или проникающим излучением.
Ионизирующие излучения по своему энергетическому составу делятся на моноэнергетические (монохроматические) и немоноэнергетические (немонохроматические). Моноэнергетическое (однородное) излучение – это излучение, состоящее из частиц одного вида с одинаковой кинетической энергией или из квантов одинаковой энергии. Немоноэнергетическое (неоднородное) излучение – это излучение, состоящее из частиц одного вида с разной кинетической энергией или из квантов различной энергии. Ионизирующее излучение, состоящее из частиц различного вида или частиц и квантов, называется смешанным излучением.
Ионизирующие излучения, в своем составе имеют разные элементарные частицы. Это фотоны, лептоны, мезоны, барионы. Все они имеют различную массу и энергию.
Фотоны- сверхлегкие частицы. Их роль – перенос электромагнитных взаимодействий. По предположению, он участвует еще, как и все остальные частицы, в слабых взаимодействиях.
Лептоны - группа легких частиц, в нее входят восемь частиц: электронное и мюонное нейтрино, электрон, m-мезон, τ-нейтрино, и τ-частица и соответствующие этим частицам античастицы. Массы частиц меняются в широких пределах: от нуля (для нейтрино) до 206,7 электронных масс (для мюона). Поэтому в данном случае нельзя сказать, что главным объединяющим эти частицы признаком является близость масс. По массе нейтрино ближе к фотону, чем к электрону, а m-мезон кажется скорее «родственником» p-мезонов. Заметим, прежде всего, что лептоны имеют полуцелый спин, отличный от спина ближайших соседей – фотона и мезонов. Но главное состоит в том, что все 8 лептонов характеризуются особым квантовым числом – лептонным зарядом.
Мезоны.Эта группа состоит из восьми частиц. Трое из них - p-мезоны, кроме того, имеется 4 К-мезона, примерно в три раза более тяжелые, чем p-мезоны. Они образуют два зарядовых мультиплета: К+, К0 и К-, К0 . Самая тяжелая частица этой группы - h0-мезон (эта-ноль-мезон) подобно p-мезону совпадает с собственной античастицей. Мезоны, как и остальные более тяжелые, чем лептоны, частицы, участвуют в сильных взаимодействиях (наряду с участием в электромагнитных и слабых взаимодействиях). Спин всех мезонов равен нулю.
Барионы– самая обширная группа частиц. В нее входят из 35 стабильных частиц – 20. Барионы – самые тяжелые сильно взаимодействующие частицы. Взаимодействия между барионами осуществляется мезонами. Самыми легкими из барионов являются частицы нуклонного дуплета – протон и нейтрон. Далее следуют более тяжелые частицы – гипероны. Все они группируются в зарядовые мультиплеты. Первый мультиплет гиперонов состоит всего из одной частицы, это – λ0- частица (лямбда-ноль). Далее в порядке возрастания массы следуют триплеты å - частиц: å+,å0,å- и å+,å0,å- . Как во всяком мультиплете, эти частицы различаются только своими электрическими зарядами. По отношению к сильным взаимодействиям они выступают как одна частица.
По времени жизни частицы делятся на стабильные: электрон, протон, фотон, нейтрино. Квазистабильные: нейтрон – стабилен, когда находится в ядре атома, но свободный нейтрон распадается примерно за 15 минут, (t > 10-20 с). Нестабильные: все остальные частицы (t = 10-23 …10-24 с). И самые нестабильные частицы – резонансы. Например, время жизни протона t > 1030 лет, электрона - t > 1021 лет, нейтрона ~ 1000 с. Одной из важных характеристик частиц является их масса, причем во внимание берется масса покоя частиц, так как при движении частиц с большими скоростями, их масса сильно возрастает. В зависимости от массы покоя, все частицы можно разделить: - на частицы, не имеющие массы покоя (фотоны, движущиеся со скоростью света) - лептоны – легкие частицы, к ним относятся электрон, позитрон и нейтрино - мезоны – средние частицы с массой до 200 масс электрона - барионы – тяжелые частицы с массой более 1000 масс электрона, к ним относятся протоны, нейтроны, гипероны и многие резонансы.
Широкое использование атомной энергии в мирных целях, разнообразных ускорительных установок и рентгеновских аппаратов различного назначения обусловило распространенность ионизирующих излучений в народном хозяйстве и огромные, все возрастающие контингенты лиц, работающих в этой области. Наиболее разнообразны по видам ионизирующих излучений так называемые радиоактивные излучения, образующиеся в результате самопроизвольного радиоактивного распада атомных ядер элементов с изменением физических и химических свойств последних. Элементы, обладающие способностью радиоактивного распада, называются радиоактивными; они могут быть естественными, такие, как уран, радий, торий и др. (всего около 50 элементов), и искусственными, для которых радиоактивные свойства получены искусственным путем (более 700 элементов).
При радиоактивном распаде имеют место три основных вида ионизирующих излучений: альфа, бета и гамма.
Альфа-частицы- это положительно заряженные ионы гелия, образующиеся при распаде ядер, как правило, тяжелых естественных элементов (радия, тория и др.). Эти лучи не проникают глубоко в твердые или жидкие среды, поэтому для защиты от внешнего воздействия достаточно защититься любым тонким слоем, даже листком бумаги.
Бета-излучениепредставляет собой поток электронов, образующихся при распаде ядер как естественных, так и искусственных радиоактивных элементов. Бета-излучения обладают большей проникающей способностью по сравнению с альфа-лучами, поэтому и для защиты от них требуются более плотные и толстые экраны. Разновидностью бета-излучений, образующихся при распаде некоторых искусственных радиоактивных элементов, являются. позитроны. Они отличаются от электронов лишь положительным зарядом, поэтому при воздействии на поток лучей магнитным полем они отклоняются в противоположную сторону.
Гамма-излучение, или кванты энергии (фотоны), представляют собой жесткие электромагнитные колебания, образующиеся при распаде ядер многих радиоактивных элементов. Эти лучи обладают гораздо большей проникающей способностью. Поэтому для экранирования от них необходимы специальные устройства из материалов, способных хорошо задерживать эти лучи (свинец, бетон, вода). Ионизирующий эффект действия гамма-излучения обусловлен в основном как непосредственным расходованием собственной энергии, так и ионизирующим действием электронов, выбиваемых из облучаемого вещества.
Рентгеновское излучениеобразуется при работе рентгеновских трубок, а также сложных электронных установок (бетатронов и т. п.). По характеру рентгеновские лучи во многом сходны с гамма-лучами и отличаются от них происхождением и иногда длиной волны: рентгеновские лучи, как правило, имеют большую длину волны и более низкие частоты, чем гамма-лучи. Ионизация вследствие воздействия рентгеновских лучей происходит в большей степени за счет выбиваемых ими электронов и лишь незначительно за счет непосредственной траты собственной энергии. Эти лучи (особенно жесткие) также обладают значительной проникающей способностью.
Нейтронное излучениепредставляет собой поток нейтральных, то есть незаряженных частиц нейтронов (n) являющихся составной частью всех ядер, за исключением атома водорода. Они не обладают зарядами, поэтому сами не оказывают ионизирующего действия, однако весьма значительный ионизирующий эффект происходят за счет взаимодействия нейтронов с ядрами облучаемых веществ. Облучаемые нейтронами вещества могут приобретать радиоактивные свойства, то есть получать так - называемую наведенную радиоактивность. Нейтронное излучение образуется при работе ускорителей элементарных частиц, ядерных реакторов и т. д. Нейтронное излучение обладает наибольшей проникающей способностью. Задерживаются нейтроны веществами, содержащими в своей молекуле водород (вода, парафин и др.).
Все виды ионизирующих излучений отличаются друг от друга различными зарядами, массой и энергией. Различия имеются и внутри каждого вида ионизирующих излучений, обусловливая большую или меньшую проникающую и ионизирующую способность и другие их особенности. Интенсивность всех видов радиоактивного облучения, как и при других видах лучистой энергии, обратно пропорциональна квадрату расстояния от источника излучения, то есть при увеличении расстояния вдвое или втрое интенсивность облучения уменьшается соответственно в 4 и 9 раз.
Радиоактивные элементы могут присутствовать в виде твердых тел, жидкостей и газов, поэтому, помимо своего специфического свойства излучения, они обладают соответствующими свойствами этих трех состояний; они могут образовывать аэрозоли, пары, распространяться в воздушной среде, загрязнять окружающие поверхности, включая оборудование, спецодежду, кожный покров рабочих и т. д., проникать в пищеварительный тракт и органы дыхания.
Свойства ионизирующих излучений.
Основными свойствами ионизирующий излучений являются: проникающая способность, ионизирующее действие, фотохимический эффект, биологическое действие, флюоресцирующий («эффект свечения») эффект.
Взаимодействие ионизирующих излучений с веществом.В веществе быстрые заряженные частицы взаимодействуют с электронными оболочками и ядрами атомов. В результате взаимодействия с быстрой заряженной частицей электрон получает дополнительную энергию и переходит на один из удаленных от ядра энергетических уровней или совсем покидает атом. В первом случае происходит возбуждение, во втором - ионизация атома.
При прохождении вблизи атомного ядра быстрая частица испытывает торможение в его электрическом поле. Торможение заряженных частиц сопровождается испусканием квантов тормозного рентгеновского излучения. Наконец, возможно упругое и неупругое соударение заряженных частиц с атомными ядрами.
Длина пробега частицы зависит от ее заряда, массы, начальной энергии, а также от свойств среды, в которой частица движется. Пробег увеличивается с возрастанием начальной энергии частицы и уменьшением плотности среды. При одинаковой начальной энергии массивные частицы обладают меньшими скоростями, чем легкие. Медленно движущиеся частицы взаимодействуют с атомами более эффективно и быстрее растрачивают имеющуюся у них энергию.
Проникающую способность бета-частиц обычно характеризуют минимальной толщиной слоя вещества, полностью поглощающего все бета-частицы. Например, от потока бета-частиц, максимальная энергия которых 2 МэВ, полностью защищает слой алюминия толщиной 3,5 мм.
Альфа-частицы, обладающие значительно большей массой, чем бета-частицы, при столкновениях с электронами атомных оболочек испытывают очень небольшие отклонения от своего первоначального направления и движутся почти прямолинейно. Пробеги альфа-частиц в веществе очень малы. Например, у альфа-частицы с энергией 4 МэВ длина пробега в воздухе примерно 2,5 см, в воде или в мягких тканях животных и человека - сотые доли миллиметра.
Благодаря небольшой проникающей способности альфа- и бета-излучения обычно не представляют большой опасности при внешнем облучении. Плотная одежда может поглотить значительную часть бета-частиц и совсем не пропускает альфа-частицы. Однако при попадании внутрь человеческого организма с пищей, водой и воздухом или при загрязнении радиоактивными веществами поверхности тела альфа- и бета-излучения могут причинить человеку серьезный вред.
Нейтроны, не имеющие электрического заряда, при движении в веществе не взаимодействуют с электронными оболочками атомов. При столкновениях с атомными ядрами они могут выбивать из них заряженные частицы, которые ионизируют и возбуждают атомы среды.
Гамма-кванты взаимодействуют в основном с электронными оболочками атомов, передавая часть своей энергии электронам - это явления фотоэффекта, эффекта Комптона или рождения электронно-позитронных пар. Возникающие быстрые электроны производят ионизацию атомов среды.
Пути пробега гамма-квантов и нейтронов в воздухе измеряются сотнями метров, в твердом веществе - десятками сантиметров и даже метрами. Проникающая способность гамма-излучения увеличивается с ростом энергии гамма-квантов и уменьшается с увеличением плотности вещества-поглотителя. В таблице 5 приведены в качестве примера значения толщины слоев воды, бетона и свинца, ослабляющих потоки гамма-излучения различной энергии в десять раз.
Потоки гамма-квантов и нейтронов - наиболее проникающие виды ионизирующих излучений, поэтому при внешнем облучении они представляют для человека наибольшую опасность.
Поглощенная доза ионизирующего излучения.Универсальной мерой воздействия любого вида излучения на вещество являетсяпоглощенная доза излучения,равная отношению энергии, переданной ионизирующим излучением веществу, к массе вещества:D=E/m.
За единицу поглощенной дозы в СИ принят грей (Гр). 1 Гр равен поглощенной дозе излучения, при которой облученному веществу массой 1 кг передается энергия ионизирующего излучения 1 Дж: 1 Гр=1 Дж/1 кг=1 Дж/кг.
Отношение поглощенной дозы излучения ко времени облучения называется мощностью дозы излучения: D=D/t. Единица мощности поглощенной дозы в СИ - грей в секунду (Гр/с).
Эквивалентная доза.Поглощенная дозаD,умноженная на коэффициент качестваk,характеризует биологическое действие поглощенной дозы и называетсяэквивалентной дозой Н: H=Dk.Единицей эквивалентной дозы в СИ является з и вер т (Зв). 1 Звравен эквивалентной дозе, при которой поглощенная доза равна1 Гри коэффициент качества равен единице.
По механизму взаимодействия с веществом выделяют непосредственно (потоки заряжённых частиц) и косвенно ионизирующее излучение (потоки нейтральных элементарных частиц - фотонов и нейтронов). По механизму образования - первичное (рождённое в источнике) и вторичное (образованное в результате взаимодействия излучения другого типа с веществом) ионизирующее излучение.
Энергия частиц ионизирующего излучения лежит в диапазоне от нескольких сотен электрон-вольт (рентгеновское излучение, бета-излучение некоторых радионуклидов) до 1015- 1020и выше электрон-вольт (протоны космического излучения, для которых не обнаружено верхнего предела по энергии).
В зависимости от типа частиц и их энергии сильно различаются длина пробега и проникающая способность ионизирующего излучения - от долей миллиметра в конденсированной среде (альфа-излучение радионуклидов, осколки деления) до многих километров (высокоэнергетические мюоны космических лучей).
Важными показателями взаимодействия ионизирующего излучения с веществом служат такие величины, как линейная передача энергии (ЛПЭ), показывающая, какую энергию излучение передаёт среде на единице длины пробега при единичной плотности вещества, а также поглощённая доза излучения, показывающая, какая энергия излучения поглощается в единице массы вещества.
Биологическое действие ионизирующих излучений.Основа физического воздействия ядерных излучений на живые организмы - ионизация атомов и молекул в клетках. При облучении человека смертельной дозой гамма-излучения, равной 6 Гр, в его организме выделяется энергия, равная примерно:E=mD=70 кг·6 Гр=420 Дж.
Такая энергия передается организму человека одной чайной ложкой горячей воды. Поскольку эта энергия мала, естественно предположить, что тепловое воздействие ионизирующей радиации не является непосредственной причиной лучевой болезни и гибели человека. Действительно, основной механизм биологического воздействия ионизирующей радиации на живой организм обусловлен химическими процессами, происходящими в живых клетках после их облучения.
Организм млекопитающего состоит примерно на 75% из воды. При дозе 6 Гр в 1 см3ткани происходит ионизация примерно 1015молекул воды. Процессы ионизации и химических взаимодействий продуктов ионизации происходят в клетке за миллионные доли секунды. Биохимические изменения в клетке, обусловленные образованием новых молекул, чуждых нормальной клетке, начинаются сразу после момента облучения, но не завершаются за короткое время. Некоторые следствия биохимических изменений в клетке проявляются уже через несколько секунд после облучения, другие могут привести к гибели клетки или ее раковому перерождению через десятилетия.
Одним из первых следствий действия облучения на живую клетку является нарушение ее функции деления как самой сложной функции. Поэтому в первую очередь нарушаются функции органов и тканей организма, в которых происходит деление клеток, образование новых клеток.
Острое поражение.Острым поражением называют повреждение живого организма, вызванное действием больших доз облучения и проявляющееся в течение нескольких часов или дней после облучения. Первые признаки общего острого поражения организма взрослого человека обнаруживаются, начиная примерно с 0,5-1,0 Зв. Эту эквивалентную дозу можно считать пороговой для общего острого поражения при однократном облучении. При такой эквивалентной дозе начинаются нарушения в работе кроветворной системы человека. При эквивалентных дозах облучения всего тела 3-5 Зв около 50% облученных умирает от лучевой болезни в течение 1-2 месяцев. Главной причиной гибели людей при таких дозах облучения является поражение костного мозга, приводящее к резкому снижению числа лейкоцитов в крови. При дозах облучения в 10-50 Зв смерть наступает через 1-2 недели от кровоизлияний в желудочно-кишечном тракте. Эти кровоизлияния происходят в результате гибели клеток слизистых оболочек кишечника и желудка.
Отдаленные последствия облучения.Значительная часть повреждений, вызванных радиацией в живых клетках, является необратимыми. Эти повреждения увеличивают вероятность возникновения различных заболеваний, из которых наиболее опасны раковые заболевания. Средняя продолжительность времени от момента облучения до гибели от лейкоза составляет 10 лет.
Вероятность возникновения ракового заболевания увеличивается пропорционально дозе облучения. Эквивалентная доза облучения 1 Зв в среднем приводит к 2 случаям лейкоза, 10 случаям рака щитовидной железы, 10 случаям рака молочной железы у женщин, 5 случаям рака легких на 1000 облученных. Раковые заболевания других органов под действием облучения возникают значительно реже.
Ядерные взрывы.Ядерные взрывы, производимые с 1945 г. в атмосфере и под водой, привели к загрязнению атмосферы Земли и земной поверхности радиоактивными продуктами деления ядер урана. Среди продуктов деления ядер урана наибольшую роль в длительном облучении играют радиоактивные изотопы стронция-90 и цезия-137 с периодами полураспада около 30 лет. Эти изотопы усваиваются из почвы растениями, затем с пищей попадают в организм человека и надолго задерживаются в его тканях и органах, подвергая организм внутреннему облучению.
Биологическое влияние малых доз излучения.Приносят ли дозы ионизирующего излучения, сравнимые с естественным фоном, какой-то ущерб здоровью человека? На этот вопрос невозможно дать точный и однозначный ответ, подобно тому, как нельзя дать однозначный ответ на вопрос о влиянии на организм человека обычного солнечного света. Солнечный свет, безусловно, необходим человеку, без него жизнь на Земле невозможна. Но ультрафиолетовое излучение Солнца может вызвать ожог кожи, быть причиной заболеваний кожи и крови.
studfiles.net
Радиоло́гия интервенцио́нная
Раздел медицинской радиологии, разрабатывающий научные основы и клиническое применение лечебных и диагностических манипуляций, осуществляемых под контролем лучевого исследования. Формирование Р. и. стало возможным с внедрением в медицину электроники, автоматики, телевидения, вычислительной техники. Технология интервенционных вмешательств базируется на использовании электронно-оптических преобразователей, рентгенотелевизионных устройств, цифровой (дигитальной) радиографии, приспособлений для скоростной рентгеновской съемки, рентгенокинематографии, видеомагнитной записи, приборов для ультразвукового и радионуклидного сканирования. Большую роль а развитии Р. и. сыграли разработка методики чрескожной катетеризации кровеносных сосудов и конструирование специальных инструментов для катетеризации сосудов, желчных протоков, мочеточников, прицельных пункции и биопсии глубоко расположенных органов.
Интервенционные вмешательства состоят из двух этапов. Первый этап включает лучевое исследование (рентгенотелевизионное просвечивание, компьютерную томографию, ультразвуковое или радионуклидное сканирование и др.), направленное на установление характера и объема поражения. На втором этапе, обычно не прерывая исследования, врач выполняет необходимые лечебные манипуляции (катетеризацию, пункцию, протезирование и др.), по эффективности часто не уступающие, а иногда и превосходящие оперативные вмешательства, и одновременно обладающие по сравнению с ними рядом преимуществ. Они являются более щадящими, в большинстве случаев не требуют общего обезболивания; продолжительность и стоимость лечения существенно снижаются; процент осложнений и смертность уменьшаются. Интервенционные вмешательства могут быть начальным этапом подготовки резко ослабленных больных к необходимой в последующем операции.
Развитие Р. и. потребовало создания специализированного кабинета в составе отделения лучевой диагностики. Чаще всего это ангиографический кабинет для внутриполостных и внутрисосудистых исследований, обслуживаемый рентгенохирургической бригадой, и состав которой входят рентгенохирург, анестезиолог, специалист по ультразвуковой диагностике, операционная сестра, рентгенолаборант, санитарка, фотолаборант. Работники рентгенохирургической бригады должны владеть методами интенсивной терапии и реанимации.
Показания к интервенционным вмешательствам весьма широки, что связано с многообразием задач, которые могут быть решены с помощью методов интервенционной радиологии. Общими противопоказаниями являются тяжелое состояние больного, острые инфекционные болезни, психические расстройства, декомпенсация функций сердечно-сосудистой системы, печени, почек, при использовании йодсодержащих рентгеноконтрастных веществ — повышенная чувствительность к препаратам йода.
Подготовка больного начинается с разъяснения ему цели и методики процедуры. В зависимости от вида вмешательства используют разные формы премедикации и обезболивания. Все интервенционные вмешательства можно условно разделить на две группы: рентгеноэндоваскулярные и экстравазальные.
Рентгеноэндоваскулярные вмешательства, получившие наибольшее признание, представляют собой внутрисосудистые диагностические и лечебные манипуляции, осуществляемые под рентгеновским контролем. Основными их видами являются рентгеноэндоваскулярная дилатация, или ангиопластика, рентгеноэндоваскулярное протезирование и рентгеноэндоваскулярная окклюзия.
Рентгеноэндоваскулярная дилатация — один из самых эффективных способов лечения ограниченных (обычно не более 10 см) сегментарных стенозов сосудов. Этот метод применяют примерно у 15% больных, нуждающихся в хирургическом лечении окклюзионных поражений сосудов. Рентгеноэндоваскулярную дилатацию выполняют при атеросклеротических сужениях венечных артерий сердца, стенозах брахиоцефальных ветвей дуги аорты, стенозе почечных артерий фибромышечной или атеросклеротической природы, при сужении чревного ствола и верхней брыжеечной артерии, при окклюзионном поражении общей и наружной подвздошных артерий и сосудов нижних конечностей.
Рентгеноэндоваскулярную дилатацию производят под местной анестезией. Вначале в пораженный сосуд через ангиографический катетер вводят рентгеноконтрастное вещество для точного определения локализации стеноза, его степени и характера (рис. 1). Затем в просвет ангиографического катетера вставляют терапевтический двухпросветный катетер, например катетер Грюнтцига. Он состоит из основной трубки с отверстием на конце и окружающей ее полиэтиленовой оболочки, образующей вблизи концевого отдела баллонообразное расширение. Т.о., в баллоне Грюнтцига имеются два просвета: один внутренний и второй — между основным катетером и его оболочкой.
После удаления ангиографического катетера проводник терапевтического катетера под контролем рентгенотелевидения осторожно вводят в зону стеноза. Шприцем, снабженным манометром, в просвет, образуемый внутренней трубкой и оболочкой, вливают разбавленное рентгеноконтрастное вещество, в результате чего баллончик, равномерно растягиваясь, оказывает давление на стенки суженного отдела сосуда. Дилатацию повторяют несколько раз, после чего катетер удаляют. При атеросклеротическом процессе под влиянием компрессии происходит раздавливание и отжатие к стенке сосуда атероматозных бляшек. Противопоказанием являются диффузные стенозы, резкие изгибы и перекручивание артерий, эксцентрическое расположение участка стеноза.
Рентгеноэндоваскулярная дилатация может сопровождаться осложнениями, среди которых встречаются кровотечения в месте пункции сосудов, спазм артерий и (наиболее опасное) образование тромба, а также эмболия оторвавшимися атероматизными массами. Недостатком рентгеноэндоваскулярной дилатации является возникновение рестеноза.
Для расширения просвета сосуда начато применение лазерной тоннелизации. В пораженный сегмент артерии проводят зонд, снабженный стекловолоконной оптикой, который служит проводником для лазерного луча, вызывающего «выпаривание» атероматозной бляшки.
Рентгеноэндоваскулярное протезирование — введение в расширенный участок сосуда эндопротеза, позволяющее избежать рестеноза после эндоваскулярной дилатации. Существуют саморасправляющиеся и раздуваемые стальные протезы, а также протезы-спирали из нитинола, представляющего собой сплав никеля и титана. Нитинол обладает высокой упругостью и свойством восстанавливать предварительно приданную ему при определенных условиях форму. Выпрямленная нитиноловая проволока, проведенная через катетер, под влиянием температуры крови принимает прежнюю форму спирали и служит опорным каркасом, препятствуя рестенозу. Эндопротез постепенно покрывается фибрином и обрастает эндотелиальными клетками.
Рентгеноэндоваскулярная окклюзия — введение в кровеносный сосуд через катетер какого-либо материала (эмбола) с целью временной или постоянной обтурации его просвета. Чаще применяется для остановки кровотечения (легочного, желудочного, печеночного, кишечного), источник которого предварительно устанавливают с помощью эндоскопического, лучевого и других исследований. Введение и продвижение катетера, изготовленного из эластичного рентгеноконтрастного материала, осуществляют по методике Сельдингера. При достижении катетером намеченного уровня выполняют ангиографию, а затем эмболизацию. Материал для эмбола выбирают в каждом случае индивидуально с учетом характера патологического процесса и калибра артерии. Растворяющиеся эмболы вводят для временной окклюзии просвета сосудов, нерастворимые — для постоянной. Используют безвредные для организма вещества: желатиновые гемостатические губки, мышечный гомогенат, кровяные сгустки, пластмассовые или металлические шарики, нити из тефлона, силиконовые и латексные отрывные баллончики. Стойкую эмболизацию позволяет получить спираль Гиантурко, представляющая собой виток эластичной стальной проволоки с укрепленными на конце шерстяными и (или) тефлоновыми нитями длиной 4—5 см. Проксимальный конец спирали имеет слепой канал для введения осевого стилета, который позволяет выпрямить проволоку, чтобы ввести ее в катетер. В кровеносном сосуде спираль вновь принимает первоначальную форму и становится каркасом для тромбообразования. В области прилегания спирали к интиме сосуда возникает асептическое воспаление, что способствует организации тромба.
Наиболее часто рентгеноэндоваскулярную окклюзию применяют для лечения обширных гемангиом труднодоступных областей. Получила признание рентгеноэндоваскулярная окклюзия при заболеваниях легких, сопровождающихся повторным кровохарканьем и рецидивирующими легочными кровотечениями. Определив по данным рентгенологического исследования источник кровохарканья, выполняют катетеризацию бронхиального сосуда, снабжающего кровью пораженный отдел легкого. После уточнения с помощью артериографии характера патологических изменений артерий проводят эмболизацию. Эндоваскулярную эмболизацию используют для тромбирования аневризм, разобщения врожденных и приобретенных артериовенозных соустий, закрытия незаросшего артериального (боталлова) протока и дефекта в перегородке сердца. К эндоваскулярной эмболизации иногда прибегают с целью уменьшения васкуляризации злокачественного новообразования, в т.ч. перед оперативным вмешательством, что может способствовать уменьшению кровопотери во время операции (например, при опухоли почки).
Осложнением рентгеноэндоваскулярной окклюзии является ишемия ткани, приводящая в отдельных случаях к развитию инфаркта. Процедура может сопровождаться локальными временными болями, тошнотой, повышением температуры тела.
К рентгеноэндоваскулярным вмешательствам относятся многие другие манипуляции: чрескатетерная эмболэктомия, чрескатетерное удаление инородных тел (например, из легочной артерии и полости сердца), растворение тромбов в просвете сосудов. Большие успехи достигнуты при тромболитической терапии больных с острым инфарктом миокарда, тромбоэмболией легочных артерий, а также при лечении острого панкреатита, и в частности панкреонекроза, путем чрескатетерной длительной регионарной инфузии лечебных препаратов. Методы селективного введения химиотерапевтических препаратов и радиоактивных веществ применяется в онкологии.
Одним из направлений рентгеноэндеваскулярных вмешательств является чрескатетерное разрушение тканей некоторых органов (например, деструкция надпочечников при тяжелом течении болезни Иценко — Кушинга, селезенки при ряде заболеваний крови). С этой целью в отводяющую вену соответствующего органа через катетер вводят несколько миллилитров рентгеноконтрастного вещества, в результате чего сосуд разрывается, а рентгеноконтрастное вещество выходит в паренхиму. Образовавшаяся гематома вызывает разрушение ткани органа, что может способствовать быстрому устранению клинических проявлений заболевания (эффект, аналогичный операции удаления надпочечников и спленэктомии).
Частым рентгеноэндоваскулярным вмешательством является установка специального фильтра в нижней полой вене (кава-фильтр). Эту операцию производят больным, которым угрожает тромбоэмболия легочных артерий (в частности, с тромбофлебитом глубоких вен таза и нижних конечностей). Установив наличие тромбоза и его локализацию с помощи ультразвукового исследования и флебографии проводят катетеризацию полой вены и в просвете укрепляют фильтр.
Экстравазальные интервенционные вмешательства включают эндобронхиальные, эндобилиарные, эндоэзофагальные, эндоуринальные и другие манипуляции. К рентгеноэндобронхиальным вмешательствам относят катетеризацию бронхиального дерева, выполняемую под контролем рентгенотелевизионного просвечивания, с целью получения материала для морфологических исследований из недоступных для бронхоскопа участков. При прогрессирующих стриктурах трахеи, при размягчении хрящей трахеи и бронхов осуществляют эндопротезирование использованием временных и постоянных металлических и нитиноловых протезов.
Совершенствуются эндобилиарные рентгенохирургические вмешательства. При обтурационной желтухе посредством чрескожной пункции и катетеризации желчных протоков выполняют их декомпрессию и создают отток желчи — наружное или внутреннее дренирование желчных путей (рис. 2). В желчные пути вводят препараты для растворения небольших конкрементов, с помощью специальных инструментов удаляют из протоков мелкие камни, расширяют билиодигестивные соустья, в частности анастомозы между общим желчным протоком двенадцатиперстной кишкой при его сужении. У резко ослабленных больных с острым холициститом осуществляют чрескатетерную облитерацию пузырного протока, после чего проводят противовоспалительную терапию, заверщающуюся дроблением и удалением конкрементов. Все большее применение находит чрескожное наложение гастростомы, еюностомы, холицистостомы. Для устранения сужений пищеварительного канала, в т.ч. пищевода, проводят баллонную дилатацию (рис. 3).
Основой рентгеноэндоуринальных манипуляций чаще всего является чрескожная пункция и катетеризация почечной лоханки при непроходимости мочеточника. Таким путем проводят манометрию и контрастирование чашечно-лоханочной системы (антеградную пиелографию), вводят лекарственные вещества. Через искусственно созданную нефростому производят биопсию, рассечение стриктур мочеточника и его баллонное расширение. Заслуживают внимания дилатация и эндопротезирование уретры при аденоме предстательной железы и аналогичные манипуляции при стриктуре шейки матки.
Входят в практику интервенционные методы исследования плода и лечения его заболеваний. Так, под контролем ультразвукового сканирования осуществляют ранний амниоцентез, биопсию хориона, кожи плода, забор крови, устраняют обструкцию мочевого тракта.
Интервенционные исследования применяют при пункции непальпируемых образований в молочной железе, выявленных с помощью маммографии. Пункцию выполняют под контролем рентгенотелевизионного просвечивания. После исследования в ткани железы оставляют специальную иглу, которая служит ориентиром при секторальной резекции. Под контролем рентгеноскопии или компьютерной томографии осуществляют чрескожные трансторакальные пункции внутрилегочных и медиастинальных образований. Аналогичным образом, в т.ч. под контролем ультразвукового сканирования, проводят пункцию и биопсию патологических очагов в других тканях и органах. Наиболее распространенными интервенционными манипуляциями стали пункция кист и абсцессов различной локализации с их последующим дренированием. Методику используют при кистах щитовидной, поджелудочной железы, почек, печени и др., абсцессах легких, печени, поджелудочной железы, брюшной полости. Абсцесс пунктируют стилет-катетером под контролем ультразвукового сканирования, компьютерной томографии или рентгеноскопии. После удаления через катетер гнойного содержимого в полость вливают лекарственные препараты. Катетер оставляют в полости для повторения процедуры. С помощью лучевых методов исследования наблюдают за динамикой процесса.
Значительна роль Р. и. при заболеваниях опорно-двигательного аппарата. Под контролем лучевых методов проводят биопсию синовиальных оболочек, трепанобиопсию, интервенционные вмешательства на межпозвоночных дисках, в т.ч. чрескожную люмбальную декомпрессию и дискэктомию, а также хемонуклеоз (введение в студенистое ядро диска протеолитических ферментов с последующим удалением фрагментов хрящевой грыжи) и др.
Библиогр.: Рабкин И.Х. Рентгеноэндоваскулярное протезирование. Хирургия, № 6, с. 137, 1988; Рабкин И.X., Матевосов А.Л. и Гетман Л.И. Рентгеноэндоваскулярная хирургия, М., 1987.
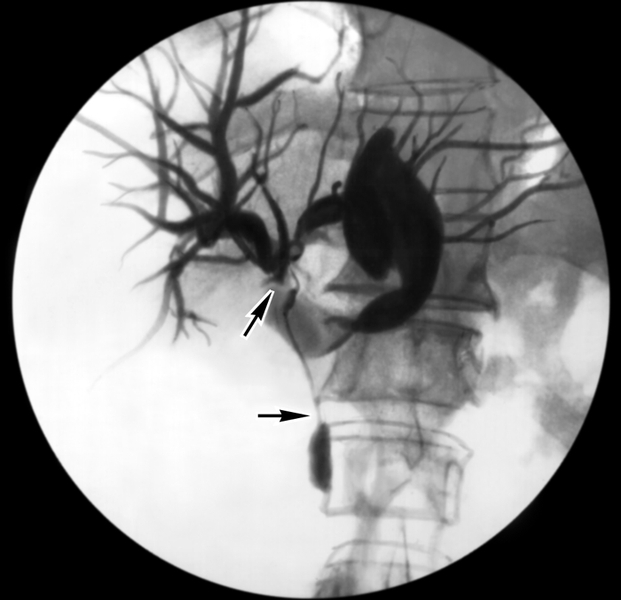
Рис. 2а). Холангиограммы больного со стриктурой общего желчного протока: выраженное сужение общего желчного протока, в области стриктуры (указана стрелками) определяется металлический проводник.

Рис. 1а). Коронарограммы при стенозе передней межжелудочковой ветви левой венечной артерии до рентгеноэндоваскулярной дилатации (стрелкой показано место стеноза).

Рис. 3а). Ренгенограммы пищевода при сужении его поддиафрагмального сегмента: до дилатации.
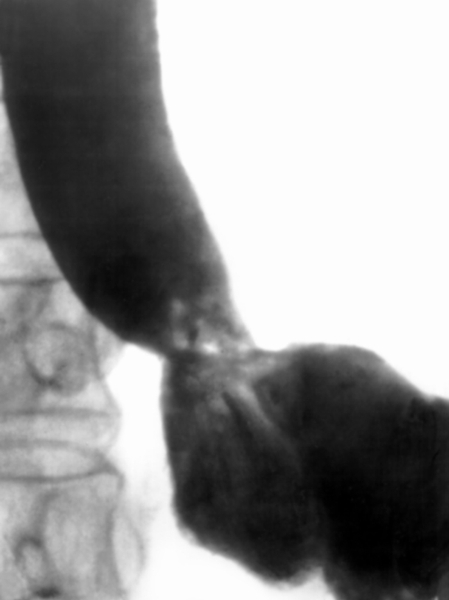
Рис. 3в). Ренгенограммы пищевода при сужении его поддиафрагмального сегмента: после дилатации (просвет поддиафрагмального сегмента пищевода расширен).

Рис. 2б). Холангиограммы больного со стриктурой общего желчного протока: после дилатации общего желчного протока в него введен пластмассовый эндопротез (указан стрелками).
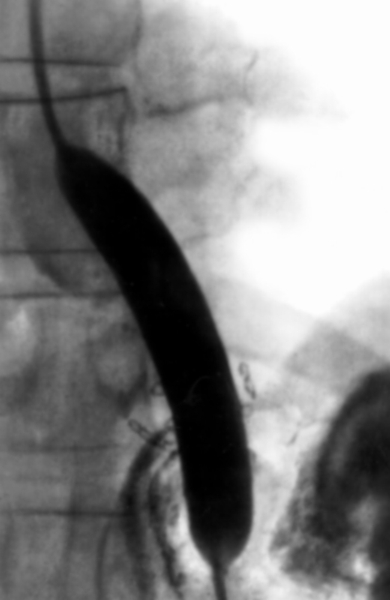
Рис. 3б). Ренгенограммы пищевода при сужении его поддиафрагмального сегмента: в момент баллонной дилатации.

Рис. 1б). Коронарограммы при стенозе передней межжелудочковой ветви левой венечной артерии после рентгеноэндоваскулярной дилатации.
Источник: Медицинская энциклопедия на Gufo.megufo.me
Радиология интервенционная - раздел медицинской радиологии, разрабатывающий научные основы и клиническое
применение лечебных и диагностических манипуляций, осуществляемых под контролем лучевого исследования.
Интервенционные вмешательства состоят из двух этапов. Первый этап включает лучевое исследование (рентгенотелевизионное
просвечивание, компьютерную томографию, ультразвуковое или радионуклидное сканирование и др.), направленное на установление
характера и объема поражения. На втором этапе, обычно не прерывая исследования, врач выполняет необходимые лечебные
манипуляции (катетеризацию, пункцию, протезирование и др.), по эффективности часто не уступающие, а иногда и превосходящие
оперативные вмешательства, и одновременно обладающие по сравнению с ними рядом преимуществ. Они являются более
щадящими, в большинстве случаев не требуют общего обезболивания; продолжительность и стоимость лечения существенно
снижаются; процент осложнений и смертность уменьшаются. Интервенционные вмешательства могут быть начальным этапом
подготовки резко ослабленных больных к необходимой в последующем операции.
Показания к интервенционным вмешательствам весьма широки, что связано с многообразием задач, которые могут быть решены с
помощью методов интервенционной радиологии. Общими противопоказаниями являются тяжелое состояние больного, острые
инфекционные болезни, психические расстройства, декомпенсация функций сердечно-сосудистой системы, печени, почек, при
использовании йодсодержащих рентгеноконтрастных веществ - повышенная чувствительность к препаратам йода.
Подготовка больного начинается с разъяснения ему цели и методики процедуры. В зависимости от вида вмешательства
используют разные формы премедикации и обезболивания. Все интервенционные вмешательства можно условно разделить на две
группы: рентгеноэндоваскулярные и экстравазальные.
Рентгеноэндоваскулярные вмешательства, получившие наибольшее признание, представляют собой внутрисосудистые
диагностические и лечебные манипуляции, осуществляемые под рентгеновским контролем. Основными их видами являются
рентгеноэндоваскулярная дилатация, или ангиопластика, рентгеноэндоваскулярное протезирование и рентгеноэндоваскулярная
окклюзия.
Экстравазальные интервенционные вмешательства включают эндобронхиальные, эндобилиарные, эндоэзофагальные,
эндоуринальные и другие манипуляции.
К рентгеноэндобронхиальным вмешательствам относят катетеризацию бронхиального дерева, выполняемую под контролем
рентгенотелевизионного просвечивания, с целью получения материала для морфологических исследований из недоступных для
бронхоскопа участков. При прогрессирующих стриктурах трахеи, при размягчении хрящей трахеи и бронхов осуществляют
эндопротезирование использованием временных и постоянных металлических и нитиноловых протезов, не меняющих своего
положения, не оказывающих вторичного воздействия на стенку трахеи, что обеспечивает дальнейший терапевтический эффект с
высоким качеством жизни.
Совершенствуются эндобилиарные рентгенохирургические вмешательства. При обтурационной желтухе посредством
чрескожной пункции и катетеризации желчных протоков выполняют их декомпрессию и создают отток желчи - наружное или
внутреннее дренирование желчных путей. В желчные пути вводят препараты для растворения небольших конкрементов, с помощью
специальных инструментов удаляют из протоков мелкие камни, расширяют билиодигестивные соустья, в частности анастомозы
между общим желчным протоком двенадцатиперстной кишкой при его сужении. У резко ослабленных больных с острым
холициститом осуществляют чрескатетерную облитерацию пузырного протока, после чего проводят противовоспалительную терапию,
заверщающуюся дроблением и удалением конкрементов. Все большее применение находит чрескожное наложение гастростомы,
еюностомы, холицистостомы. Для устранения сужений пищеварительного канала, в т.ч. пищевода, проводят баллонную дилатацию.
Основой рентгеноэндоуринальных манипуляций чаще всего является чрескожная пункция и катетеризация почечной лоханки при
непроходимости мочеточника. Таким путем проводят манометрию и контрастирование чашечно-лоханочной системы (антеградную
пиелографию), вводят лекарственные вещества. Через искусственно созданную нефростому производят биопсию, рассечение
стриктур мочеточника и его баллонное расширение. Заслуживают внимания дилатация и эндопротезирование уретры при аденоме
предстательной железы и аналогичные манипуляции при стриктуре шейки матки.
Эндоурологические вмешательства - это интервенционные лечебные и диагностические манипуляции, проводящиеся под рентген
- телевизионным и/или эндоскопическим контролем, производящиеся из перкутанного (чрескожного) или трансуретрального (через
мочеиспускательный канал) доступов.
Трансуретральная катетеризация и стентирование почки используются для ретроградного разрешения обструкции верхних
мочевых путей, при длительном стоянии камня мочеточникана месте или для его смещения для ДЛТ в лоханку (повышается
эффективность ДЛТ). Отдельным показанием для установки внутреннего стента являются крупные, множественные и коралловидные
камни нормально функционирующей почки, которые могут быть подвергнуты ДЛТ на фоне внутреннего дренирования.
Мочеточниковый стент - специально разработанная трубка, сделанная из гибкого пластикового материала, который помещается
в мочеточник, позволяя осуществлять так называемоезакрытое дренирование мочевых путей.
Длина стента варьирует от 24 до 30 см. Стенты разработаны специально для расположения их в мочевой системе. Верхние и
нижние части стента имеют закругления - завитки не позволяющие ему смещаться. Обычно стент устанавливают под наркозом,
используя специальный инстумент - цистоскоп или уретероскоп, который проводится в мочевой пузырь через уретру -
мочеиспускательный канал.
Стент находится в организме, пока не уменьшится обструкция. Это зависит от причины обструкции и природы ее лечения.
Для большинства пациентов стент требуется на непродолжительное время, от нескольких недель до нескольких месяцев.
Однако стент, если он правильно расположен, может находится в организме до 3-х месяцев без замены. Когда основная проблема -
не почечный камень, стент может находиться в организме еще дольше. Существуют специальные стенты, которые могут находится
внутри очень долгое время.
Как извлекание стента - короткая процедура и состоит из удаления стента, используя цистоскоп.
Мочеточниковые стенты разработаны, чтобы пациенты могли вести нормальный образ жизни. Однако, ношение стентов может
сопровождается побочными эффектами, большинство их не опасны для здоровья.
Наиболее частые побочные эффекты:
* более частые, чем обычно, позывы к мочеиспусканию.
* примесь крови в моче.
* ощущение неполного опорожнения мочевого пузыря.
* боли в области почки при мочеиспускании.
Необходимо наблюдать за стентом (УЗИ, обзорная урография), т.к. через 1,5-2 мес. стент может начать покрываться
кристаллами солей, что может приводить к усилению болей, гематурии.
Входят в практику интервенционные методы исследования плода и лечения его заболеваний. Так, под контролем
ультразвукового сканирования осуществляют ранний амниоцентез, биопсию хориона, кожи плода, забор крови, устраняют обструкцию
мочевого тракта.
Интервенционные исследования применяют при пункции непальпируемых образований в молочной железе, выявленных с
помощью маммографии. Пункцию выполняют под контролем рентгенотелевизионного просвечивания. После исследования в ткани
железы оставляют специальную иглу, которая служит ориентиром при секторальной резекции. Под контролем рентгеноскопии или
компьютерной томографии осуществляют чрескожные трансторакальные пункции внутрилегочных и медиастинальных образований.
Аналогичным образом, в т.ч. под контролем ультразвукового сканирования, проводят пункцию и биопсию патологических очагов в
других тканях и органах. Наиболее распространенными интервенционными манипуляциями стали пункция кист и абсцессов различной
локализации с их последующим дренированием. Методику используют при кистах щитовидной, поджелудочной железы, почек, печени
и др., абсцессах легких, печени, поджелудочной железы, брюшной полости. Абсцесс пунктируют стилет-катетером под контролем
ультразвукового сканирования, компьютерной томографии или рентгеноскопии. После удаления через катетер гнойного содержимого
в полость вливают лекарственные препараты. Катетер оставляют в полости для повторения процедуры. С помощью лучевых методов
исследования наблюдают за динамикой процесса.
Значительна роль интервенцонной радиологии при заболеваниях опорно-двигательного аппарата. Под контролем лучевых
методов проводят биопсию синовиальных оболочек, трепанобиопсию, интервенционные вмешательства на межпозвоночных дисках, в
т.ч. чрескожную люмбальную декомпрессию и дискэктомию, а также хемонуклеоз (введение в студенистое ядро диска
протеолитических ферментов с последующим удалением фрагментов хрящевой грыжи) и др.
К наиболее распространенным вмешательствам на органах желудочно-кишечного тракта, можно отнести: чрескожную
гастроэнтеростомию; баллонную дилатацию и стентирование пищевода и кишечника; дренирование внутрибрюшинных и
забрюшинных абсцессов.
Хотя еще нет клинических исследований, но экспериментальные исследования в области новых полимерных технологий
многообещающи. Врачами из Германии (T. Schmitz Rode et al.) были разработаны бесконтактно контролируемые микро- и
наноносители в качестве нового терапевтического подхода. Суть данной методики заключается в инкапсуляции специального
вещества, обладающего магнитными свойствами (магнетита) в термочувствительных нано- и микрочастицах полиакриламида. Это
дает возможность индукционного нагрева этих частиц до температуры, превышающей температуру тела (больше 40°C), путем
использования внешнего высокочастотного магнитного поля (спираль магнитной индукции).
Подъем температуры ведет к определенным изменениям внутри матрицы термочувствительного полимера, что сопровождается
значительной потерей связанной воды (т.е. уменьшением опухоли в объеме).
Привлекательной особенностью новой полимерной технологии является то, что вместе со специальным веществом с
магнитными свойствами в полимерном матриксе также могут быть инкапсулированы лекарства. Их высвобождение происходит в
течение нескольких минут, а сам процесс запускается с помощью индукции. Разнообразные вещества (метиленовый синий,
флюоресцин), служащие в качестве модели противоопухолевых препаратов, были инкапсулированы в термочувствительные
полимерные носители. Проведенный в опытах нагрев с помощью индукции дал значительное высвобождение из модели
составляющих веществ за небольшой промежуток времени (2-5 мин).
Новаторские индукционно нагреваемые термочувствительные магнитные полимерные носители в комбинации с
высвобождением лекарств представляют бесконтактно контролируемые носители активных препаратов и открывают новые
перспективы для прицельного лечения опухолей. Кроме высвобождения лекарственных агентов при данном методе параллельно
нагреваются опухолевые клетки или ткани без общей гипертермии.
Особого внимания заслуживают новые подходы к лечению диабета. Так, при первом типе сахарного диабета была выполнена
чрескожная трансплантация клеток островка поджелудочной железы. Эта методика трансплантации островков была предложена в
качестве малоинвазивного и альтернативного хирургическому методу трансплантации. Приблизительно 200 мл суспензии очищенных
человеческих клеток островка поджелудочной железы вводится в главную портальную вену или в ее сосуды в левой доле печени.
Контроль за давлением в портальной вене позволяет отслеживать даже небольшие возрастания давления во время процедуры. В
конце процедуры через катетер поступает специальное фиксирующееся на участке сосуда гелеобразующее вещество. Всем
пациентам выполнялись функциональные печеночные пробы и проводили иммуносупрессивную терапию. Чрескожная трансплантация
островковых клеток относительно проста в применении.
Поэтому у пациентов с резистентным к терапии диабетом первого типа она является перспективным клиническим
радиологическим методом в качестве альтернативы хирургической трансплантации поджелудочной железы.
Список литературы:
1) И.А. Абоян, С.В. Павлов, В.А. Скнар, Д.А. Ромоданов, А.Н. Толмачев, С.В. Грачев «Мочекаменная болезнь.
Современные методы лечения.» М,2009 г
2) Достижения интервенционной радиологии (по материалам Европейского конгресса радиологов, Вена, март 2004 г.) И.М.
Архипова
3) Рабкин И.Х. Рентгеноэндоваскулярное протезирование. Хирургия, № 6, с. 137, 1988; Рабкин И.X., Матевосов А.Л. и
Гетман Л.И. Рентгеноэндоваскулярная хирургия, М., 1987.
4) «Интервенционная радиология» Российский научный центр рентгенорадиологии МЗ РФ В.П. Харченко, Н.И. Рожкова
Добро пожаловать на информационно-образовательный сайт для студентов - медиков!
ty-doctor.ru
Российский Государственный Медицинский Университет
Кафедра истории медицины и правоведения
Реферат
Тема: «Интервенционная кардиоангиология »
Работу выполнил
Магнитский Леонид Алексеевич
1 курс, группа 106 (А)
Лечебный факультет
Руководитель:
Дорофеева Екатерина Сергеевна
Москва, 2007 год
~ Оглавление ~
~ Введение ~… 3
~ История развития интервенционной кардиоангиологии и катетерной хирургии ~… 4
О РНОИК… 11
Хронологическая таблица исследователей и их достижений… 11
~ Стентирование коронарных артерий ~… 12
— Стенты с лекарственным покрытием… 12
Вступление … 12
Механизм рестеноза … 14
Системная фармакологическая терапия … 14
Селективная фармакотерапия … 15
Стенты, выделяющие лекарства … 15
— Установка стентов при бифуркационном поражении… 16
Методы стентирования при бифуркационном поражении … 16
Crush-техника … 16
Актуальные вопросы … 17
~ Выводы ~… 17
~ Список использованной литературы ~… 18
Приложение 1… 19
~ Введение ~
Пятьдесят лет – короткое время для истории медицины. Тем не менее, мы можем гордиться, что вряд ли когда-нибудь наблюдался такой прогресс, как во второй половине XX века. Этот период ознаменован серьёзными достижениями в лечении сердечно-сосудистых заболеваний, являющихся причиной смерти более 50% процентов населения Земли, благодаря внедрению методов инвазивной кардиологии и ангиологии, в то время как за прошедшее тысячелетие развитие ангиологии и сосудистой хирургии было в основном направлено на остановку раневых кровотечений во время военных действий.
Немногие области медицины развивались столь феноменально быстро. Основными причинами такого бурного развития были создание относительно безопасных, доступных для использования в клинике методов ангиографии, позволяющих точно определить природу, локализацию и распространенность заболевания сердца и артерий, разработка высокоэффективных реконструктивных хирургических операций, восстанавливающих нормальную проходимость пораженной артерии, либо заменяющих её сегмент артериальным протезом, и огромный интерес и интенсификация исследований в результате первых успехов хирургического лечения некоторых считавшихся ранее неизлечимыми сердечно-сосудистых заболеваний.
В США, странах Европы, России и Китае болезни сердца уносят больше жизней, чем все болезни вместе взятые. В США от сердечно-сосудистых заболеваний ежегодно умирает более 1 млн. человек, то есть более 2500 человек в день. Болезнь сердца обнаруживают у каждого четвертого, при этом экономические потери с учетом стоимости лечения и утраты трудоспособности достигают 50 млрд. долларов. Приведенные цифры подчеркивают актуальность заболеваний сердца и необходимость согласованной и планомерной борьбы с ними.
В настоящее время при своевременном вмешательстве хирург может спасти больного от ишемического инсульта мозга, предотвратить надвигающийся инфаркт миокарда, развивающуюся ишемию конечностей, заменить вышедший из строя клапан, провести реконструкцию при пороке сердца у новорожденного либо обреченного ребенка и вернуть им здоровье, что свидетельствует о высокой актуальности выбранной темы, как на сегодняшний день, так и на столетия вперед.
Лечение ряда пороков и заболеваний сердца и сосудов в настоящее время возможно только хирургическими методами. В первую очередь это относится к большинству врожденных пороков сердца, а также к необратимым поражениям клапанного аппарата сердца при приобретенных пороках.
Особенно большие успехи в области хирургии сердца достигнуты за последние 10-15 лет. Стали доступными трансплантация сердца, реконструктивные вмешательства при ранее неоперабельных врожденных пороков сердца, совершенно новым разделом современной медицины явились диагностика и хирургическое лечение тахиаритмий, чрескожная транслюминальная коронарная ангиопластика и стентирование венечных артерий в лечении ИБС и других сердечных заболеваний. Эндоваскулярные методы стали альтернативой открытым кардиохирургическим вмешательствам.
Успехи хирургии неотделимы от современных достижений науки и техники. Созданы модели искусственного сердца, совершенные аппараты искусственного кровообращения, феноменальные по своему замыслу искусственные водители ритма сердца, саморегулирующиеся в зависимости от физической нагрузки больного. Искусственные клапаны сердца совершенны по конструкции и дают возможность надежно и на долгие годы восстанавливать внутрисердечную гемодинамику.
Применение современных компьютеров и математических моделей позволило разработать автоматизированную историю болезни, иметь информацию о самых тонких нарушениях сердечной деятельности и кровообращения в целом, во время хирургического вмешательства и сразу же после него.
В кардиохирургических центрах всего мира проведены уникальные фундаментальные исследования, которые дали возможность проникнуть в тайны ряда интимных процессов, происходящих в сердце и сосудах при патологии.
Выбор темы для реферата пал на кардиоангиологию не случайно. Прежде всего, меня привлек большой потенциал развития сердечно-сосудистой хирургии и возможность научных исследований и проведений операций, основанных на достижениях нескольких наук (химия/кардиология) с применением высокотехнологичных устройств. Немалую роль сыграл и профессиональный интерес и желание связать своё будущее с исследованием сердечной деятельности.
Цели данного сообщения:
— Дать читателю общее представление о развитии интервенционной кардиоангиологии в мире, выделить основные этапы, указать на перспективы
— Осветить вопрос стентирования коронарных артерий сердца, покрытых/непокрытых стентов, причин рестеноза и возможных путей терапии. Особенности установки стентов при бифуркационных поражениях с использованием crush-технологии.
Для раскрытия обозначенного круга вопросов в основном использовались современные интернациональные научные статьи, переведенные на русский язык, поскольку учебные пособия (в связи с сравнительной молодостью рассматриваемого ответвления) не несут в себе какой-либо новой информации.
~ История развития интервенционной кардиоангиологии и катетерной хирургии ~
История развития транскатетерной рентгенхирургии сердца и сосудов – это пример воплощения смелых научных решений, пример стойкости исследователей, преодолевших противостояние консерваторов и иронию скептиков. Это образец самоотверженности ученых, не останавливающихся даже перед риском для собственного здоровья и, конечно, блестящее сотрудничество клинической медицины, рентгенологии и высоких технологий.
В истории развития интервенционной кардиологии и катетерной хирургии условно можно выделить три основные периода:
— первый опыт катетеризации сердца и сосудов у животных и развитие методики изучения центральной гемодинамики;
— проведение катетеризации периферических сосудов, полостей сердца и селективной коронароангиографии у человека;
— первый опыт и дальнейшее развитие транскатетерной хирургии.
Первым «слепую» катетеризацию полостей сердца млекопитающих произвел Claude Bernard, который в 1844 провел серию экспериментов по измерению температуры артериальной и венозной крови у лошади, вводя через сонную артерию и яремную вену в полости левого и правого желудочков ртутный термометр. Работа Claude Bernard продолжалось около 40 лет. За этот период исследователь описал методику и особенности катетеризации артерий и вен у различных животных. Именно Bernard впервые измерил давление в полостях сердца в эксперименте.
Следующей важной ступенью была работа Adolph Fick, который в 1870 году предложил метод измерения объемного кровотока, который и сегодня активно используется для определения сердечного выброса. Метод основан на том, что разность между концентрациями кислорода в артериальной и смешанной венозной крови отражает количество кислорода, поглощаемого единицей объема крови по мере прохождения ее через легкие. Отсюда можно рассчитать сердечный выброс по количеству кислорода, потребленного больным за определенный период времени, и по показателям насыщения кислорода проб артериальной и смешанной венозной крови.
Работы Claude Bernard и Adolph Fick легли в основу изучения физиологии кровообращения животных и человека, став фундаментом для определения основных параметров центральной гемодинамики.
Далее следует вспомнить открытие Рентгена (1895), которое явилось основным условием для развития рентгенохирургических методов исследования и лечения.
За несколько лет до работ Claude Bernard J.F.Dieffenbach опубликовал свой опыт использования эластического катетера для удаления крови у погибшего холерного больного. Для этого он вводил катетер в плечевую артерию на максимально возможную глубину, однако факт катетеризации полости сердца исследователем подтвержден не был. В 1912 году немецкие исследователи F.Bleichroeder, E.Unger и W.Loeb опубликовали описание методики катетеризации сосудов у человека. Не преследуя никакой кроме исследовательской цели, авторы доказали возможность беспрепятственного проведения эластического резинового катетера у человека от вен предплечья до аксиллярной вены и от вен бедра — до нижней полой вены. В подробных протоколах, есть описание процедуры, когда при продвижении катетера заведенного в кубитальную вену (Unger and Loeb вводили катетер в кубитальную вену), «подопытный» отметил появление острой боли в груди. Возможно, в этот момент исследователями была выполнена катетеризация полости правого желудочка, однако этот факт остается лишь предположением.
Развитие химиотерапии подталкивало к поиску новых путей введения лекарственных средств. Bleichroeder и коллеги, в экспериментах на собаках, исследовали возможность длительного пребывания катетера в просвете артерии, который, в случае необходимости, мог быть использован для введения лекарственных препаратов. Наблюдение проводилось в течении нескольких часов, при этом каких-либо осложнений (тромбоэмболия, кровотечение и пр.) авторами отмечено не было. Через некоторое время Bleichroeder были проведены клинические испытания по интрартериальному введению колларгола (Collargol) у четырех пациенток с послеродовым сепсисом. Препарат вводился на уровне бифуркации аорты по катетеру, введенному в бедренную артерию.
Идея и первый опыт использования рентгеновских лучей для визуализации катетера, находящегося в просвете сосуда и сосудистого рисунка, выполненного рентгеннегативным веществом, принадлежит Sicard и Forestier, которые в 1923 году, вводя раствор липидола (Lipiodol), в кубитальную вену здорового мужчины, наблюдали с помощью флюороскопа, за распределением контрастного вещества с током крови в правый желудочек и далее – по малому кругу кровообращения. Вслед за Sicard и Forestier последовало большое количество работ по контрастированию периферических сосудов. Первую в истории прижизненную ангиограмму (т.е. изображение на фотографической пленке) артерий и вен руки выполнили Berberich и Hirsch. В качестве рентгенконтрастного вещества исследователи использовали раствор бромида стронция. В 1924 году Brooks, используя йодистый натрий, выполнил прижизненую ангиограмму артерий нижней конечности. В это же время в США Carnett и Greenbaum, используя липидол (Lipiodol) для интрартериального введения, выполнили артериографию пациента с магистральной окклюзией поверхностной бедренной артерии.
В 1929 году в Эберсвальде (неподалеку от Берлина, Германия) Werner Forssmann, в 25-летнем возрасте, во время обучения клинической хирургии, вероятно, не будучи знаком с работами Bleichroeder и ища возможность внутрисердечного введения лекарственных веществ, после серии успешных экспериментов на трупном материале, вопреки советам своих коллег, провел мочевой катетер длинной 65 см через собственную левую кубитальную вену в своё правое предсердие. Катетеризация проводилась под контролем флюороскопии — исследователь наблюдал за отражением экрана флюороскопа в зеркале. Затем Forssman, проявляя удивительные качества исследователя, отправился в рентгенологическое отделение, которое находилось на другом этаже, где документально зафиксировал факт нахождения кончика катетера в правом предсердии. Таким образом, Werner Forssmann стал первым, кто выполнил прижизненную катетеризацию сердца с использованием рентгеновского излучения для визуализации и документального подтверждения выполненной манипуляции.
Эксперимент Forssmann был встречен презрительной критикой со стороны его медицинских коллег. Прозорливость ученого всегда опережает не только общественное мнение, но и само время. Сегодня, мы по праву считаем Werner Forssmann и его предшественников основоположниками интервенционной или транскатетерной реконструктивной медицины, будущее которой во многом определит образ грядущей медицины. Однако должно было пройти еще 50-60 лет, чтобы это стало очевидно всем.
В последующие два года Forssman неоднократно выполнял правую вентрикулографию (в том числе и на себе, используя 40% уроселектан (Uroselectan)), подробно изучая и описывая функцию правого желудочка.
В 1929 г. Renaldo dos Santos и коллеги, используя йодистый натрий, выполнили первую прижизненную аортографию брюшного отдела аорты.
В 1930 г. Jimenez Diaz и Sanchez-Cuenca, измеряя содержание кислорода в периферической крови, в правом предсердии и в артериальной крови, ввели понятие артериовенозной разницы. Приблизительно в то же время (1930 г.) 0.Klein из Праги, получая кровь из правого предсердия и применяя принцип Фика (Fick), измерял минутный объем и сердечный выброс у пациентов с хронической застойной сердечной недостаточностью. Похожие исследования проводились Padilla и соавт. из Буенос-Айреса в 1932 году.
Недостаточное знание клинико-патофизиологических параллелей, техническая несовершенность оснащения и большое количество осложнений (побочных реакций на контрастное вещество, геморрагические и воспалительные осложнения в области пункции и пр.) привели к тому, что последующие 10 лет катетеризация сердца выполнялась спорадически и исключительно в исследовательских целях.
Систематическое использование катетеризации правых отделов сердца в клинических условиях было начато в 1941 году работавшими в Нью-Йорке Andre Cournand и Hilmert Ranges. Авторами совместно с Dickinson Richards было предложено и внедрено в практику большое количество технических решений, которые сделали методику катетеризации сердца не достоянием талантливых одиночек, а стандартным методом диагностики, позволяющим решать конкретные клинические задачи. Необходимое соотношению гибкости и жесткости, гидрофобное рентгеннегативное покрытие, целевая конфигурация диагностического катетера — вот неполный перечень задач, решение которых на доступном в то время техническом уровне принадлежит Andre Cournand и соавт. С помощью Richard Riley исследователями была сконструирована пункционная игла, имеющая специальный наконечник, которая после пункции могла оставаться в просвете сосуда необходимое время (прототип интродьюссера). Была разработана мобильная система регистрации давления на различных уровнях диагностического катетера сопряженная с системой регистрации ЭКГ.
Результатом работы стало создание обширной прикладной диагностической программы. Авторы подняли метод катетеризации сердца на уровень эталона в изучении показателей гемодинамики и положили начало переводу его из плоскости научных интересов в плоскость клинической практики. Через 15 лет в 1956 году Andre Cournand, Dickinson Richards, и Werner Forssmann за свой вклад в развитие метода катетеризации сердца были удостоены Нобелевской премии по физиологии и медицине.
В 1947 году Dexter впервые выполнил селективную катетеризацию легочной артерии. В том же 1947 году Zimmerman (Кливленд) первым выполнил трансартериальную катетеризацию левого желудочка через хирургически выделенную ульнарную артерию пациента с недостаточностью аортального клапана. Данное патологическое состояние было выбрано, чтобы без значительного сопротивления преодолеть препятствие, каким является аортальный клапан, и провести катетер в полость ЛЖ. Вскоре Zimmerman с соавт. выполнил одномоментную катетеризацию левого и правого желудочков, после чего его исследовательский коллектив получил правительственный кредит на развитие программы сердечной катетеризации.
Значительный прогресс в развитии методики катетеризации сосудов связан с именем Seldinger, который в 1953 году опубликовал разработанный им революционный метод чрезкожной малотравматичной катетеризации сосудов.
Первая терапевтическая транскатетерная манипуляция была осуществлена в том же 1953 году, когда V.Rubio-Alvarez и соавт. транскатетерным методом выполнили легочную вальвулотомию ребенку 10-месячного возраста. Используя мочеточниковый катетер с модифицированным наконечником и пропущенной через него проволокой, авторы рассекли сросшиеся створки клапана легочной артерии. Результатом было снижение градиента систолического давления между правым желудочком и легочной артерией и, как следствие, — клиническое и фонокардиографическое улучшение.
В этот период, с помощью катетера, исследователи начинают решать все новые и новые клинические и диагностические задачи.
Баллонная кратковременная окклюзия легочной артерии стала использоваться для предоперационной оценки функциональной значимости легкого. В это же время была предложена техника эмболэктомии с использованием баллонного катетера, которая широко используется и в наши дни.
Swan и Ganz усовершенствов экспериментальный метод Lategola и Rahn разработали безопасную методику мониторирования давления с помощью «плавающего баллона», что позволило динамично оценивать функцию ЛЖ, при проведении интенсивных терапевтических мероприятий.
В 1959 году, независимо друг от друга, John Ross и Constantin Cope предложили транссептальный доступ к левым полостям сердца. Позже Brockenbrough и Braunwald модифицировали метод, сделав последний сантиметр транссептальной иглы менее травматичной.
Итак, в 50-х годах, использование результатов катетеризации сердца, позволило далеко продвинутся в диагностике врожденных и приобретенных пороков сердца. И, наряду с внедрением аппарата искусственного кровообращения, диагностическая катетеризация сердца стала основой для бурного развития операций на открытом сердце (Bailey, Harken), обеспечивая подтверждение и уточнение данных о характере патологического процесса, определяя тактику и объем планирующейся хирургической коррекции.
Новые терапевтические возможности транскатетерной техники были подарены все тем же Его Величество Случаем. В 1964 году в Портланде (шт. Орегон) Charles Dotter и его ассистент Melvin Judkins выполняли рутинную вазографию терминального отдела аорты и подвздошных артерий. На этапе ретроградного проведения проводника, исследователи, не желая того, реканализировали окклюзированную подвздошную артерию и провели проводник в брюшной отдел аорты; затем, проведя катетер по проводнику, получили своего рода бужирование сосуда и, как следствие, не только восстановление кровотока, но и расширение просвета пораженной артерии. После подготовительной экспериментальной работы, первая плановая процедура была выполнена 16 января 1964 года пациентке 82 лет, страдающей сахарным диабетом, мультифокальным атеросклерозом, имевшей критическую ишемию правой стопы. Вмешательство продолжалось 20 минут, Dotter удалось расширить просвет пораженного сосуда, результатом чего было клиническое улучшение, и пациентка была выписана из стационара без большой хирургической операции. В методику входило проведение 0,05-дюймового проводника через стенозированный сосуд, затем проведение по нему жесткого тефлонового катетера диаметром 0,1 дюйма. Далее, при необходимости, на тефлоновый катетер нанизывался второй расширяющий катетер большего диаметра (0,2 дюйма). У большинства больных после процедуры отмечалось клиническое и ангиографическое улучшение, что позволяло избежать запланированных ампутаций нижних конечностей.
Немногим позже, другой новаторский сосудистый радиолог того времени Cesare Gianturco послал Dotter сообщение о выполненном им успешном устранении стеноза бедренной артерии с помощью специально разработанного им жесткого баллонного катетера. Charles Dotter ответил исследователю буквально следующее: «Cesare, я уверен, что Вы и сами знаете, почему это не будет работать!». Успешная баллонная дилатационная ангиопластика станет реальностью только через 10 лет, благодаря новаторству и неподражаемой настойчивости Andreas Gruentzig. Интересен и тот факт, что позднее опытный в применении артериальных стентов у животных Dotter, через 2 десятилетия в 1984 году вместе с Cesare Gianturco спроектируют первый коронарный стент, который будет одобрен FDA для применения на людях.
Однако в 1964 году, идеи Dotter были подняты на смех, как когда-то были восприняты эпатирующие медицинскую общественность опыты на самом себе Werner Forssmann. Почти на 15 лет в США, предложенный Доттером (Dotter) метод, был забыт из-за сложности воспроизведения результатов представленных автором и из-за частых осложнений сопутствовавших вышеописанным вмешательствам (гематомы в области пункции, дистальная эмболизация и пр.). Однако, необходимо всё же отметить, некоторые радиологи Европы были более дальновидными, а Eberhardt Zeitler просил Dotter посетить его медицинский центр в Нюрнберге для представления своего метода. В дальнейшем, Zeitler и Schoop продолжали использовать метод Dotter, совершенствуя его и накапливая бесценный опыт. В то время частым посетителем клиники Zeitler был молодой увлеченный резидент по терапии и радиологии от университетского госпиталя в Цюрихе Andreas Roland Gruentzig…
В 1966 году William Rashkind и W. Miller в США (Филадельфия), сообщили о выполнении первой баллонной предсердной септостомии в эксперименте на собаках. Исследователи установили двухпросветный катетер с баллоном на конце в левое предсердие (через бедренную вену, нижнюю полую вену, правое предсердие, межпредсердное сообщение), заполнили баллон контрастным веществом и переместили катетер в правое предсердие, разорвав нижний край овального отверстия. Подобная операция в клинике была выполнена у трех грудных детей в возрасте от 1,5 часов до 6 недель с транспозицией магистральных сосудов. Это позволило пациентам выжить до 6 месяцев, когда им была выполнена гемодинамическая коррекция порока по Mustard или Senning.
В 1976 году King и Mills предложили первое устройство для закрытия дефектов межпредсердной перегородки транскатетерным методом с помощью двойного зонтика. Авторы использовали устройство, которое проводилось через обнаженную бедренную вену до правого предсердия и далее — через септальный дефект — в левое предсердие, где раскрывался первый зонтик, затем, со стороны правого предсердия, открывался второй. Оба зонтика соединялись внутренним закрывающимся механизмом. Однако как все смелые новаторские решения, метод не получил должной оценки. Значительный прогресс эта методика получила позднее в работах Rashkind и Cuaso, которая в доработанном виде используется и в настоящее время как альтернатива хирургическому вмешательству на открытом сердце. Сегодня, наряду с закрытием межпредсердной перегородки, успешно выполняется закрытие дефекта межжелудочковой перегородки как у детей, так и у взрослых. Первое сообщение о закрытии дефекта межжелудочковой перегородки «двойным зонтиком» появится в 1988 году (J. Lock с соавт.).
В марте 1977 в Нюрнберге Zeitler соберет группу европейских и американских исследователей, чтобы обсудить возможности развивающегося метода периферической ангиопластики и перспективы его развития. К тому времени только дюжина медицинских центров в мире выполняли периферическую ангиопластику и совместный опыт составлял около 1800 случаев. Вторая встреча состоится точно 15 годами позже (в марте 1992 года) все в том же Нюрнберге, когда будет образовано Международное общество интервенционных кардиоангиологов имени Andreas Gruentzig.
Параллельно развивались и другие транскатетерные хирургические методы. В 1979 году В. Semb с соавт. было выполнено вмешательство у 2-х дневного ребенка со стенозом клапана легочной артерии. Исследователи провели катетер с баллоном в легочную артерию, заполнили баллон и вытянули его в правый желудочек. Эта процедура привела к блестящим ближайшим и отдаленным результатам. Через три года J. Кап с соавт. выполнили первую в клинике баллонную дилатацию стеноза клапана легочной артерии у 8-летнего ребенка.
Теперь подробнее познакомимся с этапами развития методики коронарографии. Для этого вновь вернемся на три десятилетия в прошлое.
Впервые неселективное контрастирование венечных артерий человека было произведено Guiielrno и Guttadauro посредством пункционной аортографии восходящего отдела аорты в 1945 году. При этом, была впервые получена ангиографическая картина нормальных и патологически измененных венечных артерий. Однако быстрое выведение рентгенконтрастного вещества из аорты (вследствие высокой скорости кровотока) и несовершенные методы кинорентгенографии оказались серьезным препятствием на пути получения приемлемого качества изображения. В литературе конца 40-х и начала 50-х годов было опубликовано много работ посвященных этой проблеме. Однако, в подавляющем большинстве случаев, метод неселективного контрастирования не позволял достоверно оценить степень морфологических изменений средних и дистальных отделов коронарных артерий. Учитывая, что коронарный кровоток происходит в основном в диастолу, был предложен метод введения рентгеноконтрастного вещества с помощью электроинъектора, синхронизированного с сердечным ритмом. Это несколько улучшило качество получаемой «картинки», однако не могло считаться удовлетворительным. Один из методов неселективного контрастирования был предложен Arnulf и Chacornac, которые наблюдали тугое заполнение коронарных артерий контрастным веществом в эксперименте у собаки во время асистолии вызванной реакцией на анестезию. С этой целью исследователи предложили использовать ацетилхолин. Восстановление сердечной деятельности наступало самостоятельно, а в случае задержки, использовался атропин. В эксперименте на собаках Lehman и соавт. весьма успешно использовали данную методику, получая при этом коронарограммы приемлемого качества. Интракоронарное введение ацетилхолина используется и в настоящее время для изучения степени эндотелиальной дисфункции и выявления вазоспастической стенокардии.
Еще одна методика неселективной коронарографии была предложена Boerema и Bickman: авторы вызывали тампонаду верхней полой вены путем повышения интрабронхиального давления, что приводило к уменьшению наполнения правого желудочка, и, как следствие, к резкому уменьшению сердечного выброса и замедлению коронарного кровотока. Это давало возможность получать хорошее контрастирование коронарных артерий на всем протяжении даже при неселективном введении контраста. Данная методика была стандартизована Nordenstrom и соавт. и применялась в клинической практике в начале 60-х. Были и другие решения, например Dotter и Fnsche использовали двухпросветный баллонный катетер, каторый раздувался в восходящей аорте приводя к ее неполной окклюзии выше коронарных синусов, а контрастное вещество вводилось по основному просвету ниже баллона, непосредственно в надклапанное пространство. Процедура выполнялась под общим наркозом через выделенную хирургическим путем плечевую артерию. Gensmi и соавт. для улучшения методики использовали окклюзирующий интрааортальный двухпросветный баллон в комбинации с введением ацетилхолина или с повышением интрабронхиального давления.
Bellman и коллеги предложили катетер для неселективной коронарографии. Дистальный конец катетера складывался в петлю по периметру ампулы аорты в надклапанном пространстве и имел серию боковых отверстий, которые позволяли вводить контрастное вещество в непосредственной близости от устьев коронарных артерий, добиваясь при этом удовлетворительного их заполнения. Williams и соавторы применяли эту технику в своей клинической работе. В 1958 году Mason Sones, работавший в Кливленде начал использовать в своей работе электронное и оптическое усиление изображения и высокоскоростную рентгенокинографию. В 1959 году во время плановой аортографии у пациента с аортальным пороком Sones неосторожно ввел селективно (в устье) правой коронарной артерии около 40 мл 90% раствора гипака (Hypaque). При этом вместо ожидаемой фибрилляции, у пациента развилась кратковременная асистолия, перешедшая в синусовую брадикардию. Никаких реанимационных мероприятий, кроме покашливания самого пациента, не потребовалось. В результате этой «неприятной оплошности», исследователи получили тугое заполнение правой коронарной артерии контрастным веществом и, как следствие, — беспрецедентное по качеству изображение. Оправившись от шока, логично рассуждая, Sones пришел к выводу, что селективное интракоронарное введение контрастного вещества в меньшей дозе должно быть достаточно безопасно и, одновременно, значительно информативнее неселективного контрастирования. Тогда Sones and Shirey разработали известный каждому интервенционному кардиологу катетер для селективной катетеризации коронарных артерий. Тело катетера было достаточно жестким, что облегчало процесс вращения (управления), а дистальный конец сужался, облегчая формирование петли в надклапанном пространстве. Используя новую методику селективной коронарографии, авторы продемонстрировали ее безопасность, а качество визуализации стало золотым стандартом в диагностике коронарной патологии.
В 1966 году Schoonmaker и King, взяв за основу катетер Sones, стандартизировали и описали методику однокатетерной чрезкожной селективной коронароангиографии.
К 1967 году Melvin Judkins, Kurt Amplatz и соавт. применили катетеры с новой целевой конфигурацией, которые буквально «искали» устья левой и правой коронарных артерий.
Таким образом, в конце 1960-х годов, внедрение в клиническую практику селективной коронарографии – дало толчок развитию коронарной хирургии (В.И. Колесов, Favaloro, Green). В 1970 году Abele, Bentoff и Myler разработали катетер – дилататор для периферической ангиопластики, который позднее станет для Gruentzig прототипом его баллонного катетера.
В начале 70-х Portsmann, Zeitler и соавт. оснастив катетер баллоном начали выполнять баллонную ангиопластику периферических артерий.
В период с 1977 по 79 годы исследователи использовали довольно примитивную в техническом плане технику. Так катетер Грюнцига был 9-10 Fr и состоял из ригидного тефлона. Первые катетеры не отвечали основным требованиям: они плохо сохраняли необходимую форму, имели недостаточные способности к вращению. Это было основной причиной неудачных попыток установить проводниковый катетер в устье коронарной артерии. К 1980 году были разработаны новые проводниковые катетеры (катетеры-гиды) которые состояли из трех слоев: 1 — тефлоновая идеально гладкая внутренняя поверхность, имеющая низкий коэффициент трения, 2 – средний пористый слой, обеспечивающий необходимый вращательный момент и 3 – внешний слой из полиуретана, сохраняющий первоначальную форму. Приблизительно в это же время был разработан и внедрен в практику интродьюссер — устройство (шлюз), что значительно упростило процесс смены катетера и, что очень важно, снизило количество локальных осложнений в области пункции. В начале все тех же 80-х были разработаны катетеры для брахиального и радиального доступа. Баллонный катетер для коронарной ангиопластики был разработан Грюнцигом в 1976 году и представлял собой не что иное, как уменьшенную копию баллонного катетера для периферической ангиопластики. Этот катетер был от 1,5 до 2 мм в диаметре, баллон выполненный из ПВХ имел давление разрыва менее 6 Атм. Катетер имел 2 просвета: центральный — позволял производить мониторинг давления и введение лекарственных препаратов или контраста, второй — эксцентричный – для раздувания баллона. Данное устройство не подразумевало использование проводника. В 1979 году к дистальному концу баллонного катетера был присоединен короткий проволочный проводник, имеющий прямой или согнутый J-образно кончик. В 1981 J.Simpson создал систему «баллонный катетер верхом на проводике». Это позволило сделать продвижение баллонного катетера более управляемым — проводить баллон через извитые участки артерии и достигать дистальных стенозов. В 1982 успех ТЛАП составлял 80-85% против 65-70% в 1978. Конструктивно техника постоянно совершенствовалась: появились проводники разного диаметра, с мягкими наконечниками различной формы для продвижения по извитым артериям. До сегодняшнего дня идет поиск идеальных материалов для проводниковых катетеров. Появились катетеры из плетёного кевлара и других современных материалов. Катетеры приспосабливаются к появляющимся новым устройствам. Усовершенствование баллона было не менее интенсивным. Современные баллоны имеют значительно меньший профиль; позволяют производить дилатацию с давлением до 20 Атм, при этом существенно не меняя своих параметров. Разработаны покрытия для проводниковых и баллонных катетеров, коронарных проводников, улучшающих скольжение. Продолжается поиск новых материалов для изготовления баллонов. На смену полиэтилена пришли более прочные и тонкие сополимеры которые при наименьшей толщине имеют уникальную прочность и минимальную растяжимость, позволяющую сохранять максимально близкие к исходным параметры даже при давлении 20 Атм. Появление новых люминофоров йодида цезия, имеющих большую рентгеннегативность, позволило улучшить визуализацию устройств. Другой не менее важной стороной является техническое оснащение. Усовершенствование радиологического оборудования (высокоразрешающие возможности флюороскопического оборудования, цифровая обработка изображения) позволило осуществить настоящий прорыв в интервенционной медицине. Внедрение внутрисосудистого ультразвука расширило возможности визуализации коронарной анатомии, характера поражения и результатов процедуры. Все это расширило показания и возможности интервенционной кардиологии.
О РНОИК
Для координации и объединения усилий специалистов с общими интересами в данном разделе медицины в 1993 году по инициативе профессора Д.Г. Иоселиани при Московском Кардиологическом Обществе им. А.Л. Мясникова была основана секция интервенционных кардиоангиологов.
Следующим этапом развития общественной активности в этом направлении явилась зарегистрированная 20 апреля 1998 года коллективом Московского Научно-практического Центра интервенционной кардиоангиологии самостоятельная региональная общественная организация Научное Общество Интервенционных Кардиоангиологов, ставшая правопреемником научно-организационной деятельности секции.
В дальнейшем в связи с расширением географии интересов и деятельности регионального общества оно было преобразовано в общероссийскую общественную организацию «Российское Научное Общество Интервенционных Кардиоангиологов».
Хронологическая таблица исследователей и их достижений
Годы | Исследователи | Достижения |
1844 | Claude Bernard | Катетеризация правых и левых отделов сердца лошади через югулярную вену и сонную артерию |
1895 | Roentgen | Открытие рентгеновских лучей |
1929 | DOS Santos | Контрастная вазография |
1929 | Forssmann | Катетеризация правых и левых отделов сердца у человека под контролем флюороскопии |
1930 | Klein | Катетеризация и измерение фракции выброса правого желудочка в эксперименте |
1939 | Castellanos, Pereiras | Аортография трансбрахиальным доступом |
1941 | Farinas | Аортография трансфеморальным доступом |
1941 | Cournand, Richards | Катетеризация и изучение функции правого желудочка у человека |
1947 | Dexter | Катетеризация правого желудочка и легочной артерии у человека |
1950 | Zimmerman, Larson | Ретроградная катетеризация левого желудочка у человека |
1953 | Seldinger | Разработка методики чрезкожной катетеризации сосудов |
1959 | Ross, Cope | Транссептальная пункция и катетеризация ЛЖ |
1959 | Sones | Разработка методики селективной коронарографии |
1962 | Abrams | Создание диагностического коронарного катетера |
1964 | Dotter | Первая чрезкожная транслюминальная ангиопластика периферической артерии |
1964 | Gianturco | Создание жесткого коаксиального баллона для периферической ангиопластики |
1966 | Rashkind | Чрезкожная межпредсердная септостомия |
1967 | Judkins | Разработка методики трансфеморальной коронарографии |
1969 | Dotter | Успешный эксперимент по имплантации стента в периферическую артерию собаки |
1970 | Swan, Ganz | Создание и использование плавающего баллонного катетера для мониторирования давления в правом желудочке |
1971 | Zeitler, Schoop | Усовершенствование методики периферической ангиопластики Dotter |
1971 | Porstmann | Закрытие открытого артериального протока транскатетерным способоом |
1973 | Porstmann | Создание раздуваемого латексного баллона на конце катетера |
1974 | Gruentzig, Hopf | Чрезкожная баллонная ангиопластика подвздошно-бедренных и подколенных артерий |
1976 | Gruentzig | Успешная экспериментальная коронарная ТЛАП у собаки |
1977 | Gruentzig, Myler | Интраоперационная коронарная баллонная ангиопластика у человека |
1977 | Gruentzig | Чрезкожная коронарная баллонная ангиопластика у человека |
1981 | Simpson | Модификация коронарного баллонного катетера по системе «баллон на проводнике» |
1982 | Stertzer | Коронарная баллонная ангиопластика через брахиальный доступ |
1982 | Meyer | ТЛАП при остром инфаркте миокарда после тромболизиса |
1984 | Hartzler | Первичная ТЛАП при остром инфаркте миокарда |
1986 | Simpson | Прямая коронарная атерэктомия у человека |
1986 | Puel, Sigwart | Успешная имплантация коронарного стента у человека |
~ Стентирование коронарных артерий ~
— Стенты с лекарственным покрытием
Вступление
Несмотря на успехи, достигнутые в последнее десятилетие в стентировании коронарных артерий, остается нерешенной проблема рестеноза — повторного сужения внутри стента, возникающего из-за гиперплазии неоинтимы. Гиперплазия интимы это реакциия на повреждение, наносимое стентом; она заключается преимущественно в размножении гладкомышечных клеток и отложении внеклеточного матрикса. Стратегия предотвращения рестеноза внутри стента, основанная на локальном применении препаратов, обладающих антипролиферативным действием, в последнее время приобретает все больше сторонников. Беспрецедентные результаты были достигнуты в ранних клинических исследованиях со стентами, покрытыми сиролимусом. Первое клиническое исследование со стентами, покрытыми сиролимусом FIM, дало удивительные результаты: у больных с первичной ангиопластикой процент рестеноза составил 0%. В первом проспективном, двойном слепом, многоцентровом исследовании RAVEL у 238 пациентов с первичными поражениями коронарных артерий методом случайной выборки сравнивали результаты ангиопластики со стентами, выделяющими сиролимус и стентами без покрытия (Bx Velocity). За шесть месяцев частота рестенозов в группе сиролимуса составила 0% по сравнению с 26,6% в контрольной группе. Уменьшение просвета артерии в отдаленном периоде (т. н. поздняя потеря просвета) в группе сиролимуса, по данным ангиографии, оказывалось существенно меньшим, а количество серьезных сердечных осложнений было значительно ниже. Испытание SIRIUS до сих пор было самым крупным исследованием по стентам с сиролимусовым покрытием. Оно проводилось в 53 центрах США, был обследован 1101 случайным образом выбранный пациент с первичными поражениями коронарных артерий. Всем больным были имплантированы стенты, выделяющие сиролимус, и обычные стенты. В недавно установленных окончательных результатах исследования показано значительное уменьшение частоты рестенозов, поздних потерь просвета артерий и необходимости в повторной реваскуляризации у больных в группе сиролимуса. Также обнадеживают первичные результаты использования выделяющих сиролимус стентов для лечения рестеноза, возникшего внутри ранее установленного стента. Нерандомизированное исследование показало, что частота повторного рестеноза составляет менее 10%. По сравнению со стандартным коронарным стентом стент, выделяющий сиролимус, перспективен для предотвращения пролиферации неоинтимы, профилактики рестеноза и связанных с ним неблагоприятных клинических последствий. Стентирование коронарных артерий по сравнению с баллонной ангиопластикой сокращает частоту рестеноза, что в первую очередь связано с уменьшением обратного эластического сужения сосуда (эффект recoil) и предотвращением отрицательного ремоделирования сосудов. Имплантация стентов в коронарные артерии на сегодняшний день является наиболее часто применяемым способом реваскуляризации сердца. В настоящее время в мире выполняется приблизительно 1,7 миллиона коронарных стентирований в год. Однако имплантация стента часто вызывает рестеноз внутри стента (РВС) из-за повреждения эндотелия сосуда и последующей гиперплазии неоинтимы, которая происходит преимущественно в первые 6 месяцев. Частота РВС варьируется в пределах 10-40% и зависит от особенностей пациента, вида поражения и характера вмешательства. РВС трудно поддается лечению, у 30-80% пациентов развивается повторный рестеноз вне зависимости от стратегии лечения. Внутрикоронарная брахитерапия (имплантация радиоактивных зерен) является единственным средством лечения РВС с доказанной эффективностью. Однако уровень рестеноза при этом уменьшается умеренно, и широкое распространение внутрикоронарной брахитерапии ограничено потенциальными побочными эффектами, такими, как краевой эффект, пространственное несоответствие, замедленная эндотелизация и поздние тромбозы.
За последние два десятилетия усилия по предотвращению рестеноза при помощи системной фармакотерапии не увенчались успехом. В клинических условиях были исследованы различные лекарства, однако результаты были неудовлетворительные. Местное применение лекарств по сравнению с системным имеет очевидные преимущества. Активное лекарство «доставляется» к сосуду точно в месте его поражения. При местном применении лекарств можно достичь более высокой концентрации активного вещества в тканях, в то время как при системном применении концентрация лекарства остаётся минимальной, что позволяет избежать токсичного воздействия на организм. Идея сочетания механического каркаса с местным фармакологическим воздействием появилась на заре применения стентов. Цель — достичь контролируемого выделения лекарств из инертного покрытия. Применяемые ранее матрицы, содержащие лекарство, оказались бионесовместимыми. Однако недавно были созданы микрометрические покрытия, выделяющие адекватные дозы лекарств. Теперь внимание сосредоточено на использовании эндопротезов коронарных артерий в качестве средств для местной доставки лекарств с целью противорестенозной терапии. В настоящее время проводится изучение ряда антипролиферативных средств с точки зрения их эффективности и безопасности применения для предотвращения рестеноза внутри стента. Два из них — сиролимус и паклитаксель изучены на различных моделях стентов, их клиническая эффективность продемонстрирована в рандомизированных исследованиях.
Механизм рестеноза
Понимание патофизиологического механизма, лежащего в основе рестеноза, позволяет вмешиваться в этот процесс более избирательно. Рестеноз происходит из-за совокупности ряда факторов: эластического сужения сосуда, тромбоза, гиперплазии неоинтимы и негативного ремоделирования сосудов.
1. Эластическое сужение сосудов рекойл — является следствием естественных эластических свойств кровеносных сосудов, проявляющихся в ответ на растяжение. Оно происходит непосредственно после чрескожной транслюминальной коронарной ангиопластики (ЧТКА).
2. Тромбоз. При вмешательстве происходит оголение эндотелия, разрыв интимы и повреждение среднего слоя сосуда. Данные повреждения ведут к скоплению тромбоцитов и образованию тромба. Этот процесс было предложено считать основным механизмом рестеноза после коронарного вмешательства. Скопившиеся тромбоциты представляют собой источник аттрактантов и митогенов для гладкомышечных клеток (ГМК). Кроме того, в качестве основного фактора, способствующего миграции ГМК, рассматривается фактор роста тромбоцитов (ФРТ), выделяемый клетками эндотелия и макрофагами. Гипотеза, согласно которой тромб представляет собой ядро процесса рестеноза, была подтверждена в клинических исследованиях, проведенных с использованием ангиоскопии и свидетельствующих о раннем образовании тромбов после ЧТКА. Кроме того, воспаление, по-видимому, также играет важную роль в развитии рестеноза, поскольку в месте повреждения сосуда лейкоциты обнаруживаются рано и в большом количестве.
3. Гиперплазия неоинтимы. ГМК играют основную роль в процессе рестеноза благодаря их способности к миграции, делению и синтезу внеклеточного матрикса (ВКМ) при стимуляции. В поврежденном сосуде ГМК вступают в фазу пролиферации и перемещаются в интиму через поврежденную внутреннюю эластичную мембрану. В данном процессе важную роль играют металлопротеиназы. После этого они продолжают делиться и синтезировать ВКМ, который составляет в конечном итоге объем рестенотического поражения. Гиперплазия неоинтимы преимущественно представлена низкоклеточной тканью. Составляющие ВКМ — гиалоронан, фибронектин, остеопонтин и витронектин — также способствуют миграции ГМК. Более того, реорганизация ВКМ, а также замещение молекул коллагеном может привести к сокращению стенки сосуда. Недавние эксперименты свидетельствуют о том, что кроме ГМК адвентициальные миофибробласты также делятся и перемещаются в неоинтиму, и играют важную роль в снабжении интимального слоя пролиферационными клеточными элементами при рестенозе. Клетки адвентиция также принимают участие в процессе ремоделирования сосуда, поскольку миофибробласты способны осуществлять синтез коллагена и приводить к сокращению ткани, как, например, это происходит при заживлении ран.
4. Негативное ремоделирование сосудов. Возможность использования стента как армирующего устройства стала очевидной после того, как экспериментальные и клинические исследования подтвердили важную роль раннего эластического сужения и отрицательного ремоделирования сосудов в развитии рестеноза. Благодаря внутрисосудистым ультразвуковым исследованиям (ВСУЗИ) стало понятно, что потеря просвета сосуда в поздние сроки, рестеноз после ЧТКА происходит не столько из-за гиперплазии интимы, сколько из-за отрицательного ремоделирования сосуда. Относительная роль ремоделирования сосуда и неоинтимальной гиперплазии в развитии рестеноза может значительно различаться у разных пациентов и даже на разных участках одного и того же сосуда. Конечным клиническим последствием вышеописанных процессов является позднее повторное сужение просвета артерии. Все это открывает широкое поле для фармакологических вмешательств.
Системная фармакологическая терапия
До признания существования явления ремоделирования сосудов предполагалось, что гиперплазия неоинтимы является единственным механизмом развития рестеноза после ЧТКА. На основании этого предположения было проведено несколько клинических испытаний, направленных на предотвращение рестеноза с помощью различных фармакологических средств. Общим для них являлось то, что эти препараты применялись системно, т. е. перорально или парентерально. Хотя в большинстве случаев терапия основывалась на строгих научных данных, полученных на основании предварительных экспериментальных исследований или без них, результаты, за несколькими исключениями, оказались разочаровывающими. В большинстве случаев предпосылки для тестирования того или иного фармакологического средства или принципа казались обоснованными. Объяснять неоднократные неудачи предлагалось тем фактом, что при системном введении лекарства в поврежденных артериях не достигается концентрация препарата, необходимая для влияния на процесс рестеноза. Другими словами, дозы лекарств, применяющиеся при системном введении, не могут эффективно блокировать целый каскад ответных реакций сосуда на повреждение.
Селективная фармакотерапия
Учитывая безуспешность системного введения фармакологических средств как метода борьбы с рестенозом, многообещающей представляется местная терапия, направленная на блокирование фактора роста, выделяемого тромбоцитами, или эндотелиального фактора роста. В экспериментальных моделях рестеноза у животных было доказано уменьшение образования неоинтимы при местном — селективном — применении некоторых агентов.
До сих пор только некоторые из них, включая гепарин, стероиды, олигодеоксинуклеотиды (ОДН) со сложными цепями и цитохалазин Б, дошли до клинических испытаний. Общие результаты принесли разочарование. Более того, возникли проблемы, связанные с повреждением интимы устройствами, используемыми при доставке лекарств, и, как следствие, гиперплазия интимы; и отмечались даже случаи смещения стента. Нерешенными оставались проблемы, связанные с низкой эффективностью доставки лекарств и быстрым их вымыванием. Возможные решения этих проблем включают развитие стратегий для направления лекарств посредством использования антител, действующих в месте поражения. Более того, по мере признания того факта, что стенты благодаря своим физическим свойствам играют ключевую роль в достижении лучших клинических результатов, также становится очевидным и то, что они имеют огромный потенциал в качестве средств для доставки лекарств.
Стенты, выделяющие лекарства
Стент, выделяющий лекарство, обычно состоит:
а) из металлической основы;
б) из полимерного слоя, на который абсорбировано лекарство или с которым лекарство смешано;
в) иногда — из защитного полимерного слоя, который предотвращает раннее вымывание лекарства;
д) из собственно лекарства.
Полимерный слой, содержащий активную субстанцию, должен быть абсолютно биосовместимым, выполнять механические функции, а также обеспечивать нужную необходимую концентрацию препарата. Это означает, что помимо нетоксичности, слой доставки должен следовать изменениям геометрической конфигурации во время расширения стента и быть стойким к механическим воздействиям, вызванным раздуванием баллона. Кроме того, местное высвобождение лекарства должно происходить с максимальной эффективностью. Скорость выделения и его концентрация в нужном месте должна быть предсказуемой и контролируемой.
Исходя из наших представлений о механизме рестеноза, высвобождение лекарства должно происходить в течение нескольких дней или недель. При этом особое внимание уделяется дозировке лекарств для снижения его возможного токсического воздействия. При доставке к подлежащим тканям сосуда выбор делается обычно в пользу липофильных лекарств, которые легко проникают в структуры сосуда. Конечный выбор в пользу определенного лекарства основывается на его эффективности:
а) в клеточных культурах;
б) в эксперименте у грызунов с поражениями сосудов при системном применении;
в) в окончательных экспериментальных исследованиях по применению покрытого лекарством стента в коронарных артериях свиней.
— Установка стентов при бифуркационном поражении
Хотя для стентов, выделяющих сиролимус (СВС), было показано, что они снижают рецидивирование по данным ангиографии и клиническим данным при небифуркационных поражениях коронарных сосудов, их влияние при установке в области бифуркаций коронарных сосудов остается неясным. В «Рандомизированном исследовании по изучению стентов, выделяющих сиролимус, при имплантации в области бифуркационных поражений коронарных сосудов» сравнивали плановое Т-стентирование со стентированием основного сосуда (ОС) в сочетании с избирательным стентированием боковой ветви (БВ), применяемым по необходимости. В средние сроки были получены отличные показатели сохранения проходимости ОС, однако рестеноз БВ оставался проблемой в обоих случаях. Был сделан вывод, что неэффективность СВС в БВ связана с недостаточным покрытием стенки в области устья
БВ при Т-стентировании. Чтобы преодолеть это ограничение, Colombo et al. предложили crush-
технику для достижения двух целей:
1) сохранить непосредственную проходимость и ОС, и БВ;
2) обеспечить оптимальное покрытие поражения в области устья БВ, снизив, таким образом,
частоту рестенозов в этом месте.
Несмотря на теоретическое превосходство такого метода, долгосрочные результаты применения этой технологии пока неизвестны. В этом сообщении представляются результаты проспективного изучения регистрационных данных последовательных пациентов, у которых использовалась имплантация СВС по поводу бифуркационных поражений коронарных сосудов с использованием crush-техники.
Методы стентирования при бифуркационном поражении
В исследование включены все (не проходившие специального отбора) пациенты с ишемической болезнью сердца и бифуркационными поражениями, которым выполняли имплантацию СВС с использованием crush-техники с апреля 2003-го по май 2004 года. В этот период crush-техника использовалась всякий раз, когда оператор принимал решение о необходимости стентирования и ОС, и БВ. Демографические данные и данные о проведении процедуры собирали путем изучения медицинской карты. Все снимки анализировались независимыми, лицами, которые не принимали участия в процедуре стентирования.
Последующее клиническое наблюдение прово
дилось при визитах пациентов, а также путем
изучения медицинской документации и посредс
твом телефонных звонков. База регистрационных
данных включала пациентов с бифуркационными
поражениями de novo, пациентов с рестенозом
внутри металлических стентов без покрытия, а
также пациентов с кальцифицированными в зна
чительной степени поражениями или поражени
ями, содержащими тромб. Перед проведением
всех процедур у пациентов получали письменное
информированное согласие.
Crush-техника
Приведем краткое опи
сание. В обе ветви устанавливали проводни
ки и выполняли предварительную дилатацию.
При необходимости для подготовки пораженно
го участка избирательно использовали ротаци
онную атерэктомию, тромбэктомию и режущие
баллоны. После подготовки пораженного участка
первый стент проводили в БВ. Однако его не
раскрывали, после чего проводили второй стент
в ОС, чтобы полностью перекрыть бифуркацию.
Стент в БВ затем подтягивали в ОС так, чтобы
проксимальный край его оказался на 3–4 мм
проксимальнее картины бифуркации, после чего
этот стент раскрывали. Баллон для установки
стента в БВ и проводник удаляли после того, как
при помощи контрастирования проверяли отсутс
твие дистальной диссекции и необходимости
в установке дополнительных стентов в БВ. После
этого раскрывали стент в ОС.
Актуальные вопросы
Лечение истинных бифуркационных пораже
ний остается одной из наиболее сложных техни
ческих задач в интервенционной кардиологии.
Основной предмет спора в публикациях — что
лучше: стентирование бифуркации (то есть стен
тирование ОС и БВ) или избирательное стенти
рование, применяемое по необходимости (стен
тирование ОС и ЧТКА БВ), у всех пациентов,
которым следует проводить лечение по поводу
бифуркационных поражений. Хотя это важный
теоретический вопрос, с клинической точки зре
ния более насущной проблемой является опре
деление набора анатомических параметров,
при котором каждая из методик обеспечивает
однозначное преимущество. Ретроспективный
характер публикаций в литературе, не поддаю
щаяся сопоставлению вариабельность морфоло
гии бифуркаций между разными исследования
ми, а также вариабельность в критериях оценки
результатов делают невозможной формулировку
достоверных с научной точки зрения выводов.
Большинство бифуркационных поражений
коронарных сосудов поддаются лечению путем
имплантации стента в ОС и баллонной дилата
ции БВ, в частности, при малом калибре БВ, или,
если поражение в БВ является минимальным
или очаговым. В то же время бифуркационные
поражения коронарных сосудов, которые затра
гивают крупные БВ, в частности, при наличии
тяжелого стеноза устья и/или выраженного пере
гиба могут требовать выполнения бифуркацион
ного стентирования (стентирования ОС и БВ).
В «Рандомизированном исследовании по изуче
нию стентов, выделяющих сиролимус, при имп
лантации в области бифуркационных поражений
коронарных сосудов», 51% пациентов пере
шли из группы стентирования, применяемого по
необходимости, в группу бифуркационного стен
тирования вследствие субоптимальных резуль
татов ЧТКА в отношении БВ. Несмотря на такой
высокий показатель перехода пациентов, успех
процедуры был достигнут только у 77% в группе
стентирования по необходимости против 92%
в группе бифуркационного стентирования.
~ Выводы ~
Ранние клинические результаты исследований стентов с сиролимусом весьма многообещающи, поскольку они убедительно демонстрируют подавление пролиферации неоинтимы почти у всех пациентов после имплантации коронарного эндопротеза — явления, о котором до этого никогда не сообщалось. В свете этого можно заключить, что мы являемся свидетелями начала новой эры в интервенционной кардиологии и революции в коронарных вмешательствах, основанной на катетерной технологии. Некоторые причины для беспокойства, такие, как токсичность лекарств, неполное заживление, чрезмерное воспаление или кровотечение, задержка эндотелизации эндопротеза, будут изучаться в продолжающихся клинических исследованиях для всех типов выделяющих лекарство стентов.
Crush-техника может безопасно применяться
опытными специалистами при лечении бифуркаци
онных поражений высокой сложности имплантаци
ей СВС. Показатели безопасности этой методики
аналогичны таковым для других методик бифур
кационного стентирования, известных в настоя
щее время. Тем не менее, несмотря на отличные
показатели восстановления проходимости целе
вого сосуда, проблема рецидива в области устья
боковой ветви остается нерешенной.
~ Список использованной литературы ~
— «Стенты с лекарственным покрытием». Чи Хэнг Ли, Пэтрик У. Серруйз, Медицинский центр Эрасмус, Роттердам, Нидерланды.
— «Стентирование «незащищенного» ствола левой коронарной артерии». Шонан-Камакура, Камакура, Япония.
— «Клинические исходы у пациентов, которым по поводу бифуркационных поражений устанавливались стенты, выделяющие сиролимус, с использованием crush-технологии». Иссам Мусса, Медицинский центр Колумбийского университета.
— «Интравенозный стент-фильтр в профилактике тромбоэмболии легочной артерии» С.А. Капранов, А.Г. Златовратский, В.Ф. Кузнецова, А.Н. Балан, А.А. Хачатуров. Кафедра факультетской хирургии лечебного факультета ГОУ ВПО РГМУ, Федеральный центр рентгенохирургических методов диагностики и лечения МЗ РФ, г. Москва.
Приложение 1
www.ronl.ru