
Содержание
Введение
1. Общее понятие о химической реакции
2. Классификация химических реакций
Заключение
Список используемой литературы
Введение
Самое интересное в окружающем мире состоит в том, что он постоянно изменяется.
Понятие « химическая реакция» — второе главное понятие химии. Каждую секунду в мире происходит неисчислимое множество реакций, в результате которых одни вещества превращаются в другие. Некоторые реакции мы можем наблюдать непосредственно, например ржавление железных предметов, свертывание крови, сгорание автомобильного топлива.
В то же время, подавляющее большинство реакций остаются невидимыми, но именно они определяют свойства окружающего нас мира.
Для того, чтобы осознать свое место в мире и научиться им управлять, человек должен глубоко понять природу этих реакций и те законы, которым они подчиняются. Задача современной химии состоит в изучении функций веществ в сложных химических и биологических системах, анализе связи структуры вещества с его функциями и синтезе веществ с заданными функциями.
Итак, химических реакций протекающих вокруг человека очень много, они протекают постоянно. Что же необходимо сделать, чтобы не запутаться во всём многообразии химических реакций? Научиться их классифицировать и выявлять существенные признаки классов.
Цель данной работы: рассмотреть понятие «химическая реакция» и систематизировать и обобщить знания о классификации химических реакций.
Работа состоит из введения, двух глав, заключения и списка литературы. Общий объем работы 14 страниц.
1. Общее понятие о химической реакции
Химическая реакция — это превращение одних веществ в другие. Однако, такое определение нуждается в существенном дополнении.
Так, например, в ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы. В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Таким образом, химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Выделим признаки и условия химических реакций (рис.1, 2).

Рисунок 1 – Признаки химических реакций
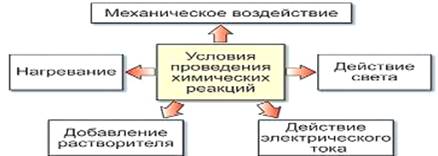
Рисунок 2 – Условия проведения химических реакций
Рассмотрим типичную химическую реакцию: сгорание природного газа (метана) в кислороде воздуха (данную реакцию можно наблюдать дома, у кого есть газовая плита) на рисунке 3.

Рисунок 3 — Сгорание природного газа (метана) в кислороде воздуха
Метан СН4 и кислород О2 реагируют между собой с образованием диоксида углерода СО2 и воды Н2 О. При этом разрываются связи между атомами С и Н в молекуле метана и между атомами кислорода в молекуле О2. На их месте возникают новые связи между атомами С и О, Н и О.
На рисунке 3 хорошо видно, что для успешного осуществления реакции на одну молекулу метана надо взять две молекулы кислорода. Однако записывать химическую реакцию с помощью рисунков молекул не слишком удобно, поэтому для записи химических реакций используют сокращенные формулы веществ — такая запись называется уравнением химической реакции.

Рисунок 4 – Уравнение реакции
Уравнение химической реакции показанной на рисунке 3 выглядит следующим образом
Ch5 +2O2 = CO2 + 2h3 O
Количество атомов разных элементов в левой и правой частях уравнения одинаково. В левой части один атом углерода в составе молекулы метана (СН4 ), и в правой — тот же атом углерода мы находим в составе молекулы СО2. все четыре водородных атома из левой части уравнения мы обязательно найдем и в правой — в составе молекул воды.
В уравнении химической реакции для выравнивания количества одинаковых атомов в разных частях уравнения используются коэффициенты, которые записываются перед формулами веществ.

Рассмотрим другую реакцию — превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН)2 (гашеную известь) под действием воды (рис.5).

Рисунок 5 — Оксид кальция СаО присоединяет молекулу воды Н2 О
с образованием гидроксида кальция Са(ОН)2
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами, а в правой — продуктами реакции.
Если сделать перестановку левой и правой части в уравнении из рисунка 5, то получим уравнение совсем другой химической реакции
Ca(OH)2 = CaO + h3 O
Если реакция между СаО и Н2 О (рис. 4) начинается самопроизвольно и идет с выделением большого количества теплоты, то для проведения последней реакции, где реагентом служит Са(ОН)2, требуется сильное нагревание. Добавим также, что реагентами и продуктами могут быть не обязательно молекулы, но и атомы — если в реакции участвует какой-нибудь элемент или элементы в чистом виде, например
h3 + CuO = Cu + h3 O
Таким образом, мы подошли к классификации химических реакций, которую рассмотрим в следующей главе.
2. Классификация химических реакций
В процессе изучения химии приходится встречаться с классификациями химических реакций по различным признакам (табл.1).
Таблица 1 — Классификация химических реакций
По тепловому эффекту | Экзотермические – протекают с выделением энергии 4Р + 5О2 = 2Р2 О5 + Q; Ch5 + 2О2 → СО2 + 2h3 O + Q |
Эндотермические – протекают с поглощением энергии Cu(OH)2 | |
По числу и составу исходных и образовавшихся веществ | Реакции разложения – из одного сложного вещества образуется несколько более простых: СаСО3 |
| Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное: 2h3 + О2 → 2h3 OC2 h5 + h3 → C2 H6 | |
Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе: Zn + 2HCl = ZnCl2 + h3 ↑ Ch5 + Cl2 → Ch4 Cl + HCl | |
Реакции обмена – два сложных вещества обмениваются составными частями: AgNO3 + HCl = AgCl↓ + HNO3 HCOOH + Ch4 OH → HCOOCh4 + h3 O | |
По агрегатному состоянию реагирующих веществ | Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях: Fe(т) + CuCl2(р-р) → Cu(т) + FeCl2(р-р) 2Na(т) + 2C2 H5 OH(ж) → 2C2 H5 ONa(р-р) + h3(г) ↑ |
Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии: h3(г) + Cl2(г) =2HCl(г) C2 H5 OH(ж) + Ch4 COOH(ж) → Ch4 COOC2 H5(ж) + h3 O(ж) | |
По наличию катализатора | Каталитические 2h3 O2 2h3 O + О2 ↑ C2 h5 + h3 2h3 O + О2 ↑ C2 h5 + h3  C2 h5 C2 h5 |
Некаталитические S + О2 SO2 C2 h3 + 2Cl2 → C2 h3 Cl4 SO2 C2 h3 + 2Cl2 → C2 h3 Cl4 | |
По направлению | Необратимые – протекают в данных условиях только в одном направлении: h3 SO4 + BaCl2 → BaSO4 + 2HCl Ch5 + 2О2 → СО2 + 2h3 O |
Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях: 3h3 + N2 ↔ 2Nh4; C2 h5 + h3 ↔ C2 H6 | |
По изменению степени окисления атомов элементов | Окислительно-восстановительные – реакции, идущие с изменением степени окисления: Fe0+ 2H+1 Cl-1 → Fe2+ Cl2-1 + h30 H+1 C0O-2 H+1 + h3 → C-2 h4+1 O-2 H+1 |
Неокислительно-восстановительные – реакции, идущие без изменения степени окисления: S+4 O4-2 + h3 O → h3+ S+4 O4-2 Ch4 Nh3 + HCl → (Ch4 Nh4 )Cl |
Как видим, существует различные способы классификации химических реакций, из которых более подробно мы рассмотрим следующие.
По признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций (рис.6): реакции соединения, реакции разложения, реакции обмена, реакции замещения .

Рисунок 6 – Классификация химических реакций по признаку изменения числа исходных и конечных веществ
Приведем примеры таких реакций. Для этого воспользуемся уравнением получения гашеной извести и уравнению получения негашеной извести
СаО + Н2 О = Са(ОН)2
Са(ОН)2 = СаО + Н2 О
Эти реакции относятся к разным типам химических реакций.
Первая реакция является типичной реакцией соединения, поскольку при ее протекании две молекулы реагентов СаО и Н2 О соединяются в одну, более сложную молекулу Са(ОН)2 .
Вторая реакция Са(ОН)2 = СаО + Н2 О является типичной реакцией разложения: здесь реагент Ca(OH)2 разлагается с образованием двух других, более простых веществ (продуктов реакции).
В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr2 с раствором HF выпадает осадок. Происходит реакция, в которой ионы кальция и водорода обмениваются между собой ионами брома и фтора
CaBr2 + 2HF = CaF2 ¯ + 2HBr
При сливании растворов CaCl2 и Na2 CO3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO32- и Cl–
CaCl2 + Na2 CO3 = CaCO3 ¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка (¯ ) или газа ( ), например:
Zn + 2HCl = h3 + ZnCl2
Последняя реакция относится к еще одному типу химических реакций — реакциям замещения. Цинк заместил водород в его соединении с хлором — в HCl. Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе, например
2NaBr + Cl2 = 2NaCl + Br2 – это реакция замещения;
в левой части уравнения есть простое вещество-молекула хлора Cl2, и в правой части есть простое вещество – молекула брома Br2 .
В реакциях обмена — и реагенты и продукты являются сложными веществами, например
CaCl2 + Na2 CO3 = CaCO3 ¯ + 2NaCl – это реакция обмена;
в этом уравнении реагенты и продукты — сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена — не единственное.
Рассмотрим способ классификации по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (т.е. не окислительно-восстановительные).

Рисунок 7 – Реакции с изменением степени окисления элементов
Так, рассмотренная выше реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией, потому что в ней изменяются степени окисления реагирующих веществ
Zn0+ 2H+1 Cl = h30+ Zn+2 Cl2
это реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также:
— реакции метана с кислородом (рис. 1):

меняют степень окисления углерод и кислород;
— реакция оксида меди с водородом:

меняют степень окисления водород и медь;
— реакция бромида натрия с хлором:
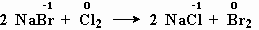
меняют степень окисления бром и хлор.
Важно также отметить, что по разным признакам одна и та же реакция может быть отнесена одновременно к нескольким типам, например

— эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.
К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество.
В более обобщенном варианте (уже с учетом и органической химии): все реакции с участием простых веществ, и наоборот, к реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
К окислительно-восстановительным относятся подавляющее большинство химических реакций, они играют исключительно важную роль.
Классификация окислительно-восстановительных реакций
Межмолекулярные (окислитель и восстановитель — разные вещества):

Внутримолекулярные (окислитель и восстановитель входят в состав одного и того же вещества):

Диспропорционирование [дисмутация] (степень окисления одного и того же элемента и повышается и понижается):

Контрпропорционирование [конмутация] (взаимодействие окислителя и восстановителя, в состав которых входит один и тот же элемент в разных степенях окисления):

Продуктом является вещество с элементом в промежуточной степени окисления.
Таким образом, мы узнали, что такое химическая реакция, выявили признаки химических реакций, сформировали представления о причинах и условия протекания химических реакций и систематизировали и обобщили представление о классификации химических реакций.
Заключение
Завершая работу, кратко отметим следующее.
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям.
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакциимогут сопровождаться выделением тепла, испусканием света, изменением агрегатного состояния веществ, появлением запаха, образованием газа и т.п.
Для описания химических реакцийиспользуют химические уравнения, в левой части которых указывают исходные вещества, в правой — продукты.
Обе части уравнения соединены знаком равенства (в этом случае кол-во атомов хим. элементов справа и слева должно быть уравнено с помощью стехиометрического коэффициента, стрелкой (в случае необратимых хим. превращений) или прямой и обратной стрелками (для обратимых реакций).
Химические реакциимогут осуществляться как один элементарный акт (стадия) (простые реакции ) или через последовательность отдельных стадий (сложные реакции ), составляющих в совокупности механизм реакции .
Существуют различные системы классификации химических реакций.
Наиболее широко используют следующую классификацию:
а) по числу и составу исходных веществ и продуктов, которые подразделяют на:
— реакции соединения — реакции, при которых из двух или нескольких веществ образуется одно новое вещество:
— реакции разложения — реакции, в результате которых из одного вещества образуется несколько новых веществ:
— реакции замещения — реакции, в результате которых атомы простого вещества замещают в молекулах других веществ:
— реакции обмена — реакции, в результате которых два вещества обмениваются атомами или группировками атомов, образуя два новых вещества:
б) выделение или поглощение теплоты: подразделяются на экзотермические и эндотермические. Выделение или поглощение энергии может быть обозначено в уравнении реакции соответственно знаком +Q или -Q.
Реакции разложения обычно протекают с поглощением энергии, а присоединения — с выделением энергии.
в) изменение степени окисления химических элементов: реакции, в результате которых некоторые элементы, входящие в состав исходных веществ и продуктов, меняют свои степени окисления.
г) наличие или отсутствие катализатора. Реакции, идущие с участием катализаторов, называются каталитическими. Не все реакции нуждаются в катализаторах, но многие без катализаторов практически идти не могут.
д) обратимость реакций: делят на обратимые и необратимые.
— реакции, протекающие в двух противоположных направлениях, называются обратимыми,
— реакции, протекающие только в одном направлении — необратимыми.
Признаками необратимости реакций в растворах является образование малодиссоциирующего вещества (осадка, газа или воды).
Кроме того, одна и та же реакция по разным признакам может быть отнесена одновременно к нескольким типам.
Список используемой литературы
1. Габриелян О.С. Химия. 11 класс: Учебник для общеобразовательных учреждений / О.С.Габриелян. — М.: Дрофа.- 304 с.
2. Иванова Р.Г. Химия. Учебник для 10 кл. общеобразовательных учреждений / Р.Г.Иванова, А.А.Каверина. – М.: Просвещение, 2001. – 287 с.
3. Кузнецова Н.Е. Химия. Учебник. 8 класс / Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара, А.Ю.Жегин М.: Вентана-Граф, 2005. – 224 с.
4. Мануйлов А.В. Основы химии. Электронный учебник / А.В.Мануйлов, В.И.Родионов. [Электронный ресурс]. Режим доступа: www.hemi.nsu.ru/
5. Химия. 8-9 класс: Поурочные планы / Авт. сост. С.Ю.Дибленко, Е.А.Смирнова, С.М.Колмыкова. – Волгоград: Учитель, 2005. – 169 с.
www.ronl.ru
Содержание.
стр.
1. Химические реакции. 2. Окислительно-восстановительные реакции. 3. Реакции в растворах электролитов. 4. Представление о кислотах и основаниях. 5. Гидролиз солей. Список литературы. | 2 3 4 5 7 9 |
1. Химические реакции
Химические свойства веществ выявляются в химических реакциях. Химическая реакция заключается в разрыве одних и образовании других связей. Химическая реакция изображается в общем виде уравнением
aA + bB = cC + dD,
где вещества A и B, вступившие в реакцию, называют реагентами (или исходными веществами ), а новые вещества C и D, образующиеся в результате протекания реакции, — продуктами (или конечными веществами ). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами.
Химические реакции классифицируются различными способами:
1) По типу взаимодействия:
реакции разложения 2HgO = 2Hg + O2
реакции соединения 2Na + Cl2 = 2NaCl
реакции замещения CuO + h3 = h3 O + Cu
реакции двойного обмена CaO + 2HCl = CaCl2 + h3 O
Указанные типы нередко совмещаются в более сложных реакциях. Например:
Na2 CO3 + 2HCl = 2NaCl + CO2 + h3 O.
Эта реакция – одновременно и реакция двойного обмена, и реакция разложения, так как промежуточно образующаяся угольная кислота h3 CO3 неустойчива и разлагается на CO2 и h3 O.
2) По тепловому эффекту:
экзотермические реакции, протекающие с экзо -эффектом – выделением энергии в форме теплоты (+Q):
C + O2 = CO2 + Q,
эндотермические реакции, протекающие с эндо -эффектом – поглощением энергии в форме теплоты (-Q):
N2 + O2 = 2NO – Q.
3) По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl¯ + NaNO3 ,
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т.е. реакции не идут до конца слева направо):
2SO2 + O2 « 2SO3 .
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками («).
4) По изменению степеней окисления реакции подразделяются на:
протекающие без изменения степеней окисления всех элементов, входящих в исходные вещества, например
NaOH + HCl = NaCl + h3 O,
и окислительно-восстановительные реакции, протекающие с изменением степеней окисления всех или некоторых (или даже хотя бы одного!) элементов, например:
2Cu0+ O0= 2Cu2+ O2- ,
Cu2+ O2- + H0= Cu0+ h2+ O2- ,
Cl0+ 2Na1+ O2- h2+ = Na1+ Cl1- + Na1+ Cl1+ O2- + h2+ O2- .
2. Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдаёт свои электроны, то он приобретает положительный заряд, например:
Zn0– 2e = Zn2+ .
Если отрицательно заряженный ион (заряд –1), например Cl-, отдаёт 1 электрон, то он становится нейтральным атомом:
Cl- — 1e = Cl0.
Если положительно заряженный ион или атом отдаёт электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ — 1e = Fe3+ .
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0+ 2e = S2- .
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например:
Mn7+ + 5e = Mn2+ ,
или он может перейти в нейтральный атом:
H+ + 1e = H0,
Al3+ + 3e = Al0.
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны .
Окислитель в процессе реакции восстанавливается, а восстановитель — окисляется .
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
3. Реакции в растворах электролитов
Электролиты – это вещества, растворы которых обладают ионной проводимостью.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода :
1. Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде).
Например, можно рассмотреть две реакции:
2Al + 2NaOH + 6h3 O = 2Na[Al(OH)4 ] + 3h3 , (1)
2Al + 2KOH + 6h3 O = 2K[Al(OH)4 ] + 3h3 . (2)
В ионной форме уравнения (1) и (2) запишутся следующим образом:
2Al + 2Na+ + 2OH- + 6 h3 O = 2Na+ + 2[Al(OH)4 ]- + 3h3 , (3)
2Al + 2K+ + 2OH- + 6 h3 O = 2K+ + 2[Al(OH)4 ]- + 3h3 , (4)
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений (3), (4) можно сократить, и тогда эти уравнения преобразуются в одно сокращённое ионное уравнение взаимодействия алюминия с щелочами:
2Al + 2OH- + 6h3 O = 2[Al(OH)4 ]- + 3h3 . (5)
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением (5). Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
Так, при помощи ионов серебра Ag+ можно обнаружить присутствие в растворе ионов галогенов, а при помощи ионов галогенов можно обнаружить ионы серебра; при помощи ионов бария Ba2+ можно обнаружить ионы SO2- и наоборот.
С учётом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
4. Представление о кислотах и основаниях
Определения кислот и оснований с точки зрения теории диссоциации были даны С. Аррениусом.
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода H+. В соответствии с этим определением к кислотам относятся, например, HCl, h3 SO4, HNO3, h3 S.
Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы OH-. По современной номенклатуре основания принято называть гидроксидами элементов с указанием степени окисления: NaOH – гидроксид натрия, KOH – гидроксид калия, Ca(OH)2 – гидроксид кальция, Cr(OH)2 – гидроксид хрома (II), Cr(OH)3 – гидроксид хрома (III).
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов OH- в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее небольшие равновесные концентрации иона OH- даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
После Аррениуса было показано, что определение кислот и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. Дальнейшее развитие химии потребовало уточнить и дополнить определения кислот и оснований.
Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием – вещество, способное принимать протоны. Любая реакция отщепления протона выражается уравнением
кислота ® основание + H+ .
На базе таких представлений понятными становятся основные свойства аммиака, который за счёт неподелённой пары электронов атома азота эффективно принимает протон при взаимодействии с кислотами, образуя за счёт донорно-акцепторной связи ион аммония:
HNO3 + Nh4 « NH+ + NO- .
Возможно и ещё более общее определение кислот и оснований. Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия AlF3 – кислота, способная принимать электронную пару при взаимодействии с аммиаком:
AlF3 + :Nh4 « [AlF3 ]:[Nh4 ].
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В только что рассмотренном примере аммиак является основанием.
Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями.
5. Гидролиз солей
Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда кроме них, ионы водорода и гидроксид-ионы, например:
Na2 SO4 « 2Na+ + SO2- ,
NaHSO4 « Na+ + HSO- « Na+ + H+ + SO2- ,
Mg(OH)Cl « Mg(OH)+ + Cl- « Mg2+ + OH- + Cl- .
В соответствии с данным определением соли делятся на средние (Na2 SO4 ), кислые (NaHSO4 ) и основные (Mg(OH)Cl).
Общеизвестно, что реакция чистой воды является нейтральной (pH = 7). Водные растворы кислот и оснований имеют соответственно кислую (pH < 7) и щелочную (pH > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию – причиной этого является гидролиз солей .
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль) и основание (или основная соль), называется гидролизом солей.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы H+ и OH-, но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые вещества. Рассмотрим гидролиз солей следующих основных типов:
1. Соли сильного основания и сильной кислоты при растворении в воде (например, NaCl, CaCl2, K2 SO4 ) не гидролизуются, и раствор соли имеет нейтральную реакцию.
2. Соли сильного основания и слабой кислоты, например KClO, Na2 CO3, Ch4 COONa, NaCN, Na2 S, K2 SiO3 .
Запишем уравнение гидролиза ацетата натрия:
Ch4 COONa + h3 O « Ch4 COOH + NaOH.
В результате реакции образовался слабый электролит – уксусная кислота. В ионном виде этот процесс можно записать так:
Ch4 COO- + h3 O « Ch4 COOH + OH- .
Следовательно, раствор Ch4 COONa будет проявлять щелочную реакцию.
При растворении солей многоосновных кислот гидролиз протекает ступенчато, например:
Na2 S + h3 O « NaHS + NaOH
или в ионной форме
S2- + h3 O « HS- + OH-. (6)
Процесс (6) отражает гидролиз Na2 S по первой ступени. Чтобы гидролиз прошёл полностью, как правило, увеличивают температуру процесса:
HS- + h3 O « h3 S + OH- .
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза.
3. Соли слабого основания и сильной кислоты, например Al2 (SO4 )3, FeCl2, CuBr2, Nh5 Cl.
Рассмотрим гидролиз хлорида железа (II):
FeCl2 + h3 O « Fe(OH)Cl + HCl. (7)
В ионном виде этот процесс можно записать так:
Fe2+ + h3 O « Fe(OH)+ + H+. (8)
По второй ступени гидролиз протекает следующим образом:
Fe(OH)+ + h3 O « Fe(OH)2 + H+. (9)
Из реакций (7)-(9) ясно, что в результате гидролиза солей слабого основания и сильной кислоты раствор приобретает кислую реакцию.
4. Соли слабого основания и слабой кислоты, например Al2 S3, Cr2 S3, Ch4 COONh5, (Nh5 )2 CO3. При растворении в воде таких солей образуются малодиссоциирующие кислота и основание:
Ch4 COONh5 + h3 O « Ch4 COOH + Nh5 OH
или в ионном виде:
Ch4 COO- + NH+ + h3 O « Ch4 COOH + Nh5 OH.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Так, при гидролизе Ch4 COONh5 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (K = 6,3 * 10-5 ) больше константы диссоциации уксусной кислоты (K = 1,75 * 10-5 ).
Список литературы
1. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: В 2 т. М.: 1-я Федерат. книготорг. компания, 1998.
2. Хомченко Г. П. Химия для поступающих в вузы. М.: Высшая школа, 1988.
3. Фримантл М. Химия в действии: В 2 ч. М.: Мир, 1991.
www.ronl.ru
Содержание.
стр.
| 1. Химические реакции. 2. Окислительно-восстановительные реакции. 3. Реакции в растворах электролитов. 4. Представление о кислотах и основаниях. 5. Гидролиз солей. Список литературы. | 2 3 4 5 7 9 |
1. Химические реакции
Химические свойства веществ выявляются в химических реакциях. Химическая реакция заключается в разрыве одних и образовании других связей. Химическая реакция изображается в общем виде уравнением
aA + bB = cC + dD,
где вещества A и B, вступившие в реакцию, называют реагентами (или исходными веществами), а новые вещества C и D, образующиеся в результате протекания реакции, - продуктами (или конечными веществами). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами.
Химические реакции классифицируются различными способами:
1) По типу взаимодействия:
реакции разложения 2HgO = 2Hg + O2
реакции соединения 2Na + Cl2 = 2NaCl
реакции замещения CuO + h3 = h3O + Cu
реакции двойного обмена CaO + 2HCl = CaCl2 + h3O
Указанные типы нередко совмещаются в более сложных реакциях. Например:
Na2CO3 + 2HCl = 2NaCl + CO2 + h3O.
Эта реакция – одновременно и реакция двойного обмена, и реакция разложения, так как промежуточно образующаяся угольная кислота h3CO3 неустойчива и разлагается на CO2 и h3O.
2) По тепловому эффекту:
экзотермические реакции, протекающие с экзо-эффектом – выделением энергии в форме теплоты (+Q):
C + O2 = CO2 + Q,
эндотермические реакции, протекающие с эндо-эффектом – поглощением энергии в форме теплоты (-Q):
N2 + O2 = 2NO – Q.
3) По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl + NaNO3,
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т.е. реакции не идут до конца слева направо):
2SO2 + O2 2SO3.
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками ().
4) По изменению степеней окисления реакции подразделяются на:
протекающие без изменения степеней окисления всех элементов, входящих в исходные вещества, например
NaOH + HCl = NaCl + h3O,
и окислительно-восстановительные реакции, протекающие с изменением степеней окисления всех или некоторых (или даже хотя бы одного!) элементов, например:
2Cu0 + O0 = 2Cu2+O2-,
Cu2+O2- + H0 = Cu0 + h2+O2-,
Cl0 + 2Na1+O2-h2+ = Na1+Cl1- + Na1+Cl1+O2- + h2+O2-.
2. Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдаёт свои электроны, то он приобретает положительный заряд, например:
Zn0 – 2e = Zn2+.
Если отрицательно заряженный ион (заряд –1), например Cl-, отдаёт 1 электрон, то он становится нейтральным атомом:
Cl- - 1e = Cl0.
Если положительно заряженный ион или атом отдаёт электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ - 1e = Fe3+.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0 + 2e = S2-.
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например:
Mn7+ + 5e = Mn2+,
или он может перейти в нейтральный атом:
H+ + 1e = H0,
Al3+ + 3e = Al0.
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, а восстановитель - окисляется.
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
3. Реакции в растворах электролитов
Электролиты – это вещества, растворы которых обладают ионной проводимостью.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
Одно (или несколько) из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде).
Например, можно рассмотреть две реакции:
2Al + 2NaOH + 6h3O = 2Na[Al(OH)4] + 3h3, (1)
2Al + 2KOH + 6h3O = 2K[Al(OH)4] + 3h3. (2)
В ионной форме уравнения (1) и (2) запишутся следующим образом:
2Al + 2Na+ + 2OH- + 6 h3O = 2Na+ + 2[Al(OH)4]- + 3h3, (3)
2Al + 2K+ + 2OH- + 6 h3O = 2K+ + 2[Al(OH)4]- + 3h3, (4)
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений (3), (4) можно сократить, и тогда эти уравнения преобразуются в одно сокращённое ионное уравнение взаимодействия алюминия с щелочами:
2Al + 2OH- + 6h3O = 2[Al(OH)4]- + 3h3. (5)
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением (5). Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
Так, при помощи ионов серебра Ag+ можно обнаружить присутствие в растворе ионов галогенов, а при помощи ионов галогенов можно обнаружить ионы серебра; при помощи ионов бария Ba2+ можно обнаружить ионы SO2- и наоборот.
С учётом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
4. Представление о кислотах и основаниях
Определения кислот и оснований с точки зрения теории диссоциации были даны С. Аррениусом.
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода H+. В соответствии с этим определением к кислотам относятся, например, HCl, h3SO4, HNO3, h3S.
Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы OH-. По современной номенклатуре основания принято называть гидроксидами элементов с указанием степени окисления: NaOH – гидроксид натрия, KOH – гидроксид калия, Ca(OH)2 – гидроксид кальция, Cr(OH)2 – гидроксид хрома (II), Cr(OH)3 – гидроксид хрома (III).
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов OH- в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее небольшие равновесные концентрации иона OH- даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
После Аррениуса было показано, что определение кислот и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. Дальнейшее развитие химии потребовало уточнить и дополнить определения кислот и оснований.
Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием – вещество, способное принимать протоны. Любая реакция отщепления протона выражается уравнением
кислота основание + H+.
На базе таких представлений понятными становятся основные свойства аммиака, который за счёт неподелённой пары электронов атома азота эффективно принимает протон при взаимодействии с кислотами, образуя за счёт донорно-акцепторной связи ион аммония:
HNO3 + Nh4 NH+ + NO-.
Возможно и ещё более общее определение кислот и оснований. Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия AlF3 – кислота, способная принимать электронную пару при взаимодействии с аммиаком:
AlF3 + :Nh4 [AlF3]:[Nh4].
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В только что рассмотренном примере аммиак является основанием.
Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями.
5. Гидролиз солей
Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда кроме них, ионы водорода и гидроксид-ионы, например:
Na2SO4 2Na+ + SO2-,
NaHSO4 Na+ + HSO- Na+ + H+ + SO2-,
Mg(OH)Cl Mg(OH)+ + Cl- Mg2+ + OH- + Cl-.
В соответствии с данным определением соли делятся на средние (Na2SO4), кислые (NaHSO4) и основные (Mg(OH)Cl).
Общеизвестно, что реакция чистой воды является нейтральной (pH = 7). Водные растворы кислот и оснований имеют соответственно кислую (pH < 7) и щелочную (pH > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию – причиной этого является гидролиз солей.
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль) и основание (или основная соль), называется гидролизом солей.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы H+ и OH-, но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые вещества. Рассмотрим гидролиз солей следующих основных типов:
1. Соли сильного основания и сильной кислоты при растворении в воде (например, NaCl, CaCl2, K2SO4) не гидролизуются, и раствор соли имеет нейтральную реакцию.
2. Соли сильного основания и слабой кислоты, например KClO, Na2CO3, Ch4COONa, NaCN, Na2S, K2SiO3.
Запишем уравнение гидролиза ацетата натрия:
Ch4COONa + h3O Ch4COOH + NaOH.
В результате реакции образовался слабый электролит – уксусная кислота. В ионном виде этот процесс можно записать так:
Ch4COO- + h3O Ch4COOH + OH-.
Следовательно, раствор Ch4COONa будет проявлять щелочную реакцию.
При растворении солей многоосновных кислот гидролиз протекает ступенчато, например:
Na2S + h3O NaHS + NaOH
или в ионной форме
S2- + h3O HS- + OH-. (6)
Процесс (6) отражает гидролиз Na2S по первой ступени. Чтобы гидролиз прошёл полностью, как правило, увеличивают температуру процесса:
HS- + h3O h3S + OH-.
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза.
3. Соли слабого основания и сильной кислоты, например Al2(SO4)3, FeCl2, CuBr2, Nh5Cl.
Рассмотрим гидролиз хлорида железа (II):
FeCl2 + h3O Fe(OH)Cl + HCl. (7)
В ионном виде этот процесс можно записать так:
Fe2+ + h3O Fe(OH)+ + H+. (8)
По второй ступени гидролиз протекает следующим образом:
Fe(OH)+ + h3O Fe(OH)2 + H+. (9)
Из реакций (7)-(9) ясно, что в результате гидролиза солей слабого основания и сильной кислоты раствор приобретает кислую реакцию.
4. Соли слабого основания и слабой кислоты, например Al2S3, Cr2S3, Ch4COONh5, (Nh5)2CO3. При растворении в воде таких солей образуются малодиссоциирующие кислота и основание:
Ch4COONh5 + h3O Ch4COOH + Nh5OH
или в ионном виде:
Ch4COO- + NH+ + h3O Ch4COOH + Nh5OH.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Так, при гидролизе Ch4COONh5 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (K = 6,3 * 10-5) больше константы диссоциации уксусной кислоты (K = 1,75 * 10-5).
Список литературы
1. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: В 2 т. М.: 1-я Федерат. книготорг. компания, 1998.
2. Хомченко Г. П. Химия для поступающих в вузы. М.: Высшая школа, 1988.
3. Фримантл М. Химия в действии: В 2 ч. М.: Мир, 1991.
topref.ru
1. Химические реакции Химические свойства веществ выявляются в химических реакциях. Химическая реакция заключается в разрыве одних и образовании других связей. Химическая реакция изображается в общем виде уравнением aA + bB = cC + dD, где вещества A и B, вступившие в реакцию, называют реагентами (или исходными веществами), а новые вещества C и D, образующиеся в результате протекания реакции, - продуктами (или конечными веществами). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами. Химические реакции классифицируются различными способами: 1) По типу взаимодействия: реакции разложения 2HgO = 2Hg + O2 реакции соединения 2Na + Cl2 = 2NaCl реакции замещения CuO + h3 = h3O + Cu реакции двойного обмена CaO + 2HCl = CaCl2 + h3O Указанные типы нередко совмещаются в более сложных реакциях. Например: Na2CO3 + 2HCl = 2NaCl + CO2? + h3O. Эта реакция – одновременно и реакция двойного обмена, и реакция разложения, так как промежуточно образующаяся угольная кислота h3CO3 неустойчива и разлагается на CO2 и h3O. 2) По тепловому эффекту: экзотермические реакции, протекающие с экзо-эффектом – выделением энергии в форме теплоты (+Q): C + O2 = CO2 + Q, эндотермические реакции, протекающие с эндо-эффектом – поглощением энергии в форме теплоты (-Q): N2 + O2 = 2NO – Q. 3) По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты: AgNO3 + NaCl = AgCl? + NaNO3, и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т.е. реакции не идут до конца слева направо): 2SO2 + O2 ? 2SO3. Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками (?). 4) По изменению степеней окисления реакции подразделяются на: протекающие без изменения степеней окисления всех элементов, входящих в исходные вещества, например NaOH + HCl = NaCl + h3O, и окислительно-восстановительные реакции, протекающие с изменением степеней окисления всех или некоторых (или даже хотя бы одного!) элементов, например: 2Cu0 + O0 = 2Cu2+O2-, Cu2+O2- + H0 = Cu0 + h2+O2-, Cl0 + 2Na1+O2-h2+ = Na1+Cl1- + Na1+Cl1+O2- + h2+O2-. 2. Окислительно-восстановительные реакции Окислительно-восстановительные реакции – это химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ. Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдаёт свои электроны, то он приобретает положительный заряд, например: Zn0 – 2e = Zn2+. Если отрицательно заряженный ион (заряд –1), например Cl-, отдаёт 1 электрон, то он становится нейтральным атомом: Cl- - 1e = Cl0. Если положительно заряженный ион или атом отдаёт электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов: Fe2+ - 1e = Fe3+. Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион: S0 + 2e = S2-. Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например: Mn7+ + 5e = Mn2+, или он может перейти в нейтральный атом: H+ + 1e = H0, Al3+ + 3e = Al0. Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны. Окислитель в процессе реакции восстанавливается, а восстановитель - окисляется. Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому. 3. Реакции в растворах электролитов Электролиты – это вещества, растворы которых обладают ионной проводимостью. Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами. С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода: 1. Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы. 2. Одно (или несколько) из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде). Например, можно рассмотреть две реакции: 2Al + 2NaOH + 6h3O = 2Na[Al(OH)4] + 3h3?, (1) 2Al + 2KOH + 6h3O = 2K[Al(OH)4] + 3h3?. (2) В ионной форме уравнения (1) и (2) запишутся следующим образом: 2Al + 2Na+ + 2OH- + 6 h3O = 2Na+ + 2[Al(OH)4]- + 3h3?, (3) 2Al + 2K+ + 2OH- + 6 h3O = 2K+ + 2[Al(OH)4]- + 3h3?, (4) В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений (3), (4) можно сократить, и тогда эти уравнения преобразуются в одно сокращённое ионное уравнение взаимодействия алюминия с щелочами: 2Al + 2OH- + 6h3O = 2[Al(OH)4]- + 3h3?. (5) Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением (5). Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы. Так, при помощи ионов серебра Ag+ можно обнаружить присутствие в растворе ионов галогенов, а при помощи ионов галогенов можно обнаружить ионы серебра; при помощи ионов бария Ba2+ можно обнаружить ионы SO2- и наоборот. С учётом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов. Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов. Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается. 4. Представление о кислотах и основаниях Определения кислот и оснований с точки зрения теории диссоциации были даны С. Аррениусом. Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода H+. В соответствии с этим определением к кислотам относятся, например, HCl, h3SO4, HNO3, h3S. Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы OH-. По современной номенклатуре основания принято называть гидроксидами элементов с указанием степени окисления: NaOH – гидроксид натрия, KOH – гидроксид калия, Ca(OH)2 – гидроксид кальция, Cr(OH)2 – гидроксид хрома (II), Cr(OH)3 – гидроксид хрома (III). Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов OH- в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее небольшие равновесные концентрации иона OH- даже в растворах нерастворимых оснований определяют свойства этого класса соединений. После Аррениуса было показано, что определение кислот и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. Дальнейшее развитие химии потребовало уточнить и дополнить определения кислот и оснований. Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием – вещество, способное принимать протоны. Любая реакция отщепления протона выражается уравнением кислота ? основание + H+. На базе таких представлений понятными становятся основные свойства аммиака, который за счёт неподелённой пары электронов атома азота эффективно принимает протон при взаимодействии с кислотами, образуя за счёт донорно-акцепторной связи ион аммония: HNO3 + Nh4 ? NH+ + NO-. Возможно и ещё более общее определение кислот и оснований. Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии. Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса. Так, например, фторид алюминия AlF3 – кислота, способная принимать электронную пару при взаимодействии с аммиаком: AlF3 + :Nh4 ? [AlF3]:[Nh4]. Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В только что рассмотренном примере аммиак является основанием. Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями.
5. Гидролиз солей Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда кроме них, ионы водорода и гидроксид-ионы, например: Na2SO4 ? 2Na+ + SO2-, NaHSO4 ? Na+ + HSO- ? Na+ + H+ + SO2-, Mg(OH)Cl ? Mg(OH)+ + Cl- ? Mg2+ + OH- + Cl-. В соответствии с данным определением соли делятся на средние (Na2SO4), кислые (NaHSO4) и основные (Mg(OH)Cl). Общеизвестно, что реакция чистой воды является нейтральной (pH = 7). Водные растворы кислот и оснований имеют соответственно кислую (pH 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию – причиной этого является гидролиз солей. Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль) и основание (или основная соль), называется гидролизом солей. Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы H+ и OH-, но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые вещества. Рассмотрим гидролиз солей следующих основных типов: 1. Соли сильного основания и сильной кислоты при растворении в воде (например, NaCl, CaCl2, K2SO4) не гидролизуются, и раствор соли имеет нейтральную реакцию. 2. Соли сильного основания и слабой кислоты, например KClO, Na2CO3, Ch4COONa, NaCN, Na2S, K2SiO3. Запишем уравнение гидролиза ацетата натрия: Ch4COONa + h3O ? Ch4COOH + NaOH. В результате реакции образовался слабый электролит – уксусная кислота. В ионном виде этот процесс можно записать так: Ch4COO- + h3O ? Ch4COOH + OH-. Следовательно, раствор Ch4COONa будет проявлять щелочную реакцию. При растворении солей многоосновных кислот гидролиз протекает ступенчато, например: Na2S + h3O ? NaHS + NaOH или в ионной форме S2- + h3O ? HS- + OH-. (6) Процесс (6) отражает гидролиз Na2S по первой ступени. Чтобы гидролиз прошёл полностью, как правило, увеличивают температуру процесса: HS- + h3O ? h3S + OH-. Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза. 3. Соли слабого основания и сильной кислоты, например Al2(SO4)3, FeCl2, CuBr2, Nh5Cl. Рассмотрим гидролиз хлорида железа (II): FeCl2 + h3O ? Fe(OH)Cl + HCl. (7) В ионном виде этот процесс можно записать так: Fe2+ + h3O ? Fe(OH)+ + H+. (8) По второй ступени гидролиз протекает следующим образом: Fe(OH)+ + h3O ? Fe(OH)2 + H+. (9) Из реакций (7)-(9) ясно, что в результате гидролиза солей слабого основания и сильной кислоты раствор приобретает кислую реакцию. 4. Соли слабого основания и слабой кислоты, например Al2S3, Cr2S3, Ch4COONh5, (Nh5)2CO3. При растворении в воде таких солей образуются малодиссоциирующие кислота и основание: Ch4COONh5 + h3O ? Ch4COOH + Nh5OH или в ионном виде: Ch4COO- + NH+ + h3O ? Ch4COOH + Nh5OH. Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований. Так, при гидролизе Ch4COONh5 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (K = 6,3 * 10-5) больше константы диссоциации уксусной кислоты (K = 1,75 * 10-5).
Список литературы
1. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: В 2 т. М.: 1-я Федерат. книготорг. компания, 1998. 2. Хомченко Г. П. Химия для поступающих в вузы. М.: Высшая школа, 1988. 3. Фримантл М. Химия в действии: В 2 ч. М.: Мир, 1991.
- 8 -
www.ronl.ru
Содержание
Введение
1. Общее понятие о химической реакции
2. Классификация химических реакций
Заключение
Список используемой литературы
Введение
Самое интересное в окружающем мире состоит в том, что он постоянно изменяется.
Понятие « химическая реакция» — второе главное понятие химии. Каждую секунду в мире происходит неисчислимое множество реакций, в результате которых одни вещества превращаются в другие. Некоторые реакции мы можем наблюдать непосредственно, например ржавление железных предметов, свертывание крови, сгорание автомобильного топлива.
В то же время, подавляющее большинство реакций остаются невидимыми, но именно они определяют свойства окружающего нас мира.
Для того, чтобы осознать свое место в мире и научиться им управлять, человек должен глубоко понять природу этих реакций и те законы, которым они подчиняются. Задача современной химии состоит в изучении функций веществ в сложных химических и биологических системах, анализе связи структуры вещества с его функциями и синтезе веществ с заданными функциями.
Итак, химических реакций протекающих вокруг человека очень много, они протекают постоянно. Что же необходимо сделать, чтобы не запутаться во всём многообразии химических реакций? Научиться их классифицировать и выявлять существенные признаки классов.
Цель данной работы: рассмотреть понятие «химическая реакция» и систематизировать и обобщить знания о классификации химических реакций.
Работа состоит из введения, двух глав, заключения и списка литературы. Общий объем работы 14 страниц.
1. Общее понятие о химической реакции
Химическая реакция — это превращение одних веществ в другие. Однако, такое определение нуждается в существенном дополнении.
Так, например, в ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы. В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Таким образом, химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Выделим признаки и условия химических реакций (рис.1, 2).

Рисунок 1 – Признаки химических реакций

Рисунок 2 – Условия проведения химических реакций
Рассмотрим типичную химическую реакцию: сгорание природного газа (метана) в кислороде воздуха (данную реакцию можно наблюдать дома, у кого есть газовая плита) на рисунке 3.

Рисунок 3 — Сгорание природного газа (метана) в кислороде воздуха
Метан СН4 и кислород О2 реагируют между собой с образованием диоксида углерода СО2 и воды Н2 О. При этом разрываются связи между атомами С и Н в молекуле метана и между атомами кислорода в молекуле О2. На их месте возникают новые связи между атомами С и О, Н и О.
На рисунке 3 хорошо видно, что для успешного осуществления реакции на одну молекулу метана надо взять две молекулы кислорода. Однако записывать химическую реакцию с помощью рисунков молекул не слишком удобно, поэтому для записи химических реакций используют сокращенные формулы веществ — такая запись называется уравнением химической реакции.

Рисунок 4 – Уравнение реакции
Уравнение химической реакции показанной на рисунке 3 выглядит следующим образом
Ch5 +2O2 = CO2 + 2h3 O
Количество атомов разных элементов в левой и правой частях уравнения одинаково. В левой части один атом углерода в составе молекулы метана (СН4 ), и в правой — тот же атом углерода мы находим в составе молекулы СО2. все четыре водородных атома из левой части уравнения мы обязательно найдем и в правой — в составе молекул воды.
В уравнении химической реакции для выравнивания количества одинаковых атомов в разных частях уравнения используются коэффициенты, которые записываются перед формулами веществ.

Рассмотрим другую реакцию — превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН)2 (гашеную известь) под действием воды (рис.5).

Рисунок 5 — Оксид кальция СаО присоединяет молекулу воды Н2 О
с образованием гидроксида кальция Са(ОН)2
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами, а в правой — продуктами реакции.
Если сделать перестановку левой и правой части в уравнении из рисунка 5, то получим уравнение совсем другой химической реакции
Ca(OH)2 = CaO + h3 O
Если реакция между СаО и Н2 О (рис. 4) начинается самопроизвольно и идет с выделением большого количества теплоты, то для проведения последней реакции, где реагентом служит Са(ОН)2, требуется сильное нагревание. Добавим также, что реагентами и продуктами могут быть не обязательно молекулы, но и атомы — если в реакции участвует какой-нибудь элемент или элементы в чистом виде, например
h3 + CuO = Cu + h3 O
Таким образом, мы подошли к классификации химических реакций, которую рассмотрим в следующей главе.
2. Классификация химических реакций
В процессе изучения химии приходится встречаться с классификациями химических реакций по различным признакам (табл.1).
Таблица 1 — Классификация химических реакций
По тепловому эффекту | Экзотермические – протекают с выделением энергии 4Р + 5О2 = 2Р2 О5 + Q; Ch5 + 2О2 → СО2 + 2h3 O + Q |
Эндотермические – протекают с поглощением энергии Cu(OH)2 | |
По числу и составу исходных и образовавшихся веществ | Реакции разложения – из одного сложного вещества образуется несколько более простых: СаСО3 |
| Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное: 2h3 + О2 → 2h3 OC2 h5 + h3 → C2 H6 | |
Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе: Zn + 2HCl = ZnCl2 + h3 ↑ Ch5 + Cl2 → Ch4 Cl + HCl | |
Реакции обмена – два сложных вещества обмениваются составными частями: AgNO3 + HCl = AgCl↓ + HNO3 HCOOH + Ch4 OH → HCOOCh4 + h3 O | |
По агрегатному состоянию реагирующих веществ | Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях: Fe(т) + CuCl2(р-р) → Cu(т) + FeCl2(р-р) 2Na(т) + 2C2 H5 OH(ж) → 2C2 H5 ONa(р-р) + h3(г) ↑ |
Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии: h3(г) + Cl2(г) =2HCl(г) C2 H5 OH(ж) + Ch4 COOH(ж) → Ch4 COOC2 H5(ж) + h3 O(ж) | |
По наличию катализатора | Каталитические 2h3 O2 2h3 O + О2 ↑ C2 h5 + h3 2h3 O + О2 ↑ C2 h5 + h3  C2 h5 C2 h5 |
Некаталитические S + О2 SO2 C2 h3 + 2Cl2 → C2 h3 Cl4 SO2 C2 h3 + 2Cl2 → C2 h3 Cl4 | |
По направлению | Необратимые – протекают в данных условиях только в одном направлении: h3 SO4 + BaCl2 → BaSO4 + 2HCl Ch5 + 2О2 → СО2 + 2h3 O |
Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях: 3h3 + N2 ↔ 2Nh4; C2 h5 + h3 ↔ C2 H6 | |
По изменению степени окисления атомов элементов | Окислительно-восстановительные – реакции, идущие с изменением степени окисления: Fe0+ 2H+1 Cl-1 → Fe2+ Cl2-1 + h30 H+1 C0O-2 H+1 + h3 → C-2 h4+1 O-2 H+1 |
Неокислительно-восстановительные – реакции, идущие без изменения степени окисления: S+4 O4-2 + h3 O → h3+ S+4 O4-2 Ch4 Nh3 + HCl → (Ch4 Nh4 )Cl |
Как видим, существует различные способы классификации химических реакций, из которых более подробно мы рассмотрим следующие.
По признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций (рис.6): реакции соединения, реакции разложения, реакции обмена, реакции замещения .

Рисунок 6 – Классификация химических реакций по признаку изменения числа исходных и конечных веществ
Приведем примеры таких реакций. Для этого воспользуемся уравнением получения гашеной извести и уравнению получения негашеной извести
СаО + Н2 О = Са(ОН)2
Са(ОН)2 = СаО + Н2 О
Эти реакции относятся к разным типам химических реакций.
Первая реакция является типичной реакцией соединения, поскольку при ее протекании две молекулы реагентов СаО и Н2 О соединяются в одну, более сложную молекулу Са(ОН)2 .
Вторая реакция Са(ОН)2 = СаО + Н2 О является типичной реакцией разложения: здесь реагент Ca(OH)2 разлагается с образованием двух других, более простых веществ (продуктов реакции).
В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr2 с раствором HF выпадает осадок. Происходит реакция, в которой ионы кальция и водорода обмениваются между собой ионами брома и фтора
CaBr2 + 2HF = CaF2 ¯ + 2HBr
При сливании растворов CaCl2 и Na2 CO3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO32- и Cl–
CaCl2 + Na2 CO3 = CaCO3 ¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка (¯ ) или газа ( ), например:
Zn + 2HCl = h3 + ZnCl2
Последняя реакция относится к еще одному типу химических реакций — реакциям замещения. Цинк заместил водород в его соединении с хлором — в HCl. Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе, например
2NaBr + Cl2 = 2NaCl + Br2 – это реакция замещения;
в левой части уравнения есть простое вещество-молекула хлора Cl2, и в правой части есть простое вещество – молекула брома Br2 .
В реакциях обмена — и реагенты и продукты являются сложными веществами, например
CaCl2 + Na2 CO3 = CaCO3 ¯ + 2NaCl – это реакция обмена;
в этом уравнении реагенты и продукты — сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена — не единственное.
Рассмотрим способ классификации по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (т.е. не окислительно-восстановительные).

Рисунок 7 – Реакции с изменением степени окисления элементов
Так, рассмотренная выше реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией, потому что в ней изменяются степени окисления реагирующих веществ
Zn0+ 2H+1 Cl = h30+ Zn+2 Cl2
это реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также:
— реакции метана с кислородом (рис. 1):

меняют степень окисления углерод и кислород;
— реакция оксида меди с водородом:

меняют степень окисления водород и медь;
— реакция бромида натрия с хлором:
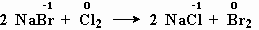
меняют степень окисления бром и хлор.
Важно также отметить, что по разным признакам одна и та же реакция может быть отнесена одновременно к нескольким типам, например

— эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.
К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество.
В более обобщенном варианте (уже с учетом и органической химии): все реакции с участием простых веществ, и наоборот, к реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
К окислительно-восстановительным относятся подавляющее большинство химических реакций, они играют исключительно важную роль.
Классификация окислительно-восстановительных реакций
Межмолекулярные (окислитель и восстановитель — разные вещества):

Внутримолекулярные (окислитель и восстановитель входят в состав одного и того же вещества):

Диспропорционирование [дисмутация] (степень окисления одного и того же элемента и повышается и понижается):

Контрпропорционирование [конмутация] (взаимодействие окислителя и восстановителя, в состав которых входит один и тот же элемент в разных степенях окисления):

Продуктом является вещество с элементом в промежуточной степени окисления.
Таким образом, мы узнали, что такое химическая реакция, выявили признаки химических реакций, сформировали представления о причинах и условия протекания химических реакций и систематизировали и обобщили представление о классификации химических реакций.
Заключение
Завершая работу, кратко отметим следующее.
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям.
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакциимогут сопровождаться выделением тепла, испусканием света, изменением агрегатного состояния веществ, появлением запаха, образованием газа и т.п.
Для описания химических реакцийиспользуют химические уравнения, в левой части которых указывают исходные вещества, в правой — продукты.
Обе части уравнения соединены знаком равенства (в этом случае кол-во атомов хим. элементов справа и слева должно быть уравнено с помощью стехиометрического коэффициента, стрелкой (в случае необратимых хим. превращений) или прямой и обратной стрелками (для обратимых реакций).
Химические реакциимогут осуществляться как один элементарный акт (стадия) (простые реакции ) или через последовательность отдельных стадий (сложные реакции ), составляющих в совокупности механизм реакции .
Существуют различные системы классификации химических реакций.
Наиболее широко используют следующую классификацию:
а) по числу и составу исходных веществ и продуктов, которые подразделяют на:
— реакции соединения — реакции, при которых из двух или нескольких веществ образуется одно новое вещество:
— реакции разложения — реакции, в результате которых из одного вещества образуется несколько новых веществ:
— реакции замещения — реакции, в результате которых атомы простого вещества замещают в молекулах других веществ:
— реакции обмена — реакции, в результате которых два вещества обмениваются атомами или группировками атомов, образуя два новых вещества:
б) выделение или поглощение теплоты: подразделяются на экзотермические и эндотермические. Выделение или поглощение энергии может быть обозначено в уравнении реакции соответственно знаком +Q или -Q.
Реакции разложения обычно протекают с поглощением энергии, а присоединения — с выделением энергии.
в) изменение степени окисления химических элементов: реакции, в результате которых некоторые элементы, входящие в состав исходных веществ и продуктов, меняют свои степени окисления.
г) наличие или отсутствие катализатора. Реакции, идущие с участием катализаторов, называются каталитическими. Не все реакции нуждаются в катализаторах, но многие без катализаторов практически идти не могут.
д) обратимость реакций: делят на обратимые и необратимые.
— реакции, протекающие в двух противоположных направлениях, называются обратимыми,
— реакции, протекающие только в одном направлении — необратимыми.
Признаками необратимости реакций в растворах является образование малодиссоциирующего вещества (осадка, газа или воды).
Кроме того, одна и та же реакция по разным признакам может быть отнесена одновременно к нескольким типам.
Список используемой литературы
1. Габриелян О.С. Химия. 11 класс: Учебник для общеобразовательных учреждений / О.С.Габриелян. — М.: Дрофа.- 304 с.
2. Иванова Р.Г. Химия. Учебник для 10 кл. общеобразовательных учреждений / Р.Г.Иванова, А.А.Каверина. – М.: Просвещение, 2001. – 287 с.
3. Кузнецова Н.Е. Химия. Учебник. 8 класс / Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара, А.Ю.Жегин М.: Вентана-Граф, 2005. – 224 с.
4. Мануйлов А.В. Основы химии. Электронный учебник / А.В.Мануйлов, В.И.Родионов. [Электронный ресурс]. Режим доступа: www.hemi.nsu.ru/
5. Химия. 8-9 класс: Поурочные планы / Авт. сост. С.Ю.Дибленко, Е.А.Смирнова, С.М.Колмыкова. – Волгоград: Учитель, 2005. – 169 с.
www.ronl.ru
Содержание.
стр.
1. Химические реакции. 2. Окислительно-восстановительные реакции. 3. Реакции в растворах электролитов. 4. Представление о кислотах и основаниях. 5. Гидролиз солей. Список литературы. | 2 3 4 5 7 9 |
1. Химические реакции
Химические свойства веществ выявляются в химических реакциях. Химическая реакция заключается в разрыве одних и образовании других связей. Химическая реакция изображается в общем виде уравнением
aA + bB = cC + dD,
где вещества A и B, вступившие в реакцию, называют реагентами (или исходными веществами ), а новые вещества C и D, образующиеся в результате протекания реакции, — продуктами (или конечными веществами ). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами.
Химические реакции классифицируются различными способами:
1) По типу взаимодействия:
реакции разложения 2HgO = 2Hg + O2
реакции соединения 2Na + Cl2 = 2NaCl
реакции замещения CuO + h3 = h3 O + Cu
реакции двойного обмена CaO + 2HCl = CaCl2 + h3 O
Указанные типы нередко совмещаются в более сложных реакциях. Например:
Na2 CO3 + 2HCl = 2NaCl + CO2 + h3 O.
Эта реакция – одновременно и реакция двойного обмена, и реакция разложения, так как промежуточно образующаяся угольная кислота h3 CO3 неустойчива и разлагается на CO2 и h3 O.
2) По тепловому эффекту:
экзотермические реакции, протекающие с экзо -эффектом – выделением энергии в форме теплоты (+Q):
C + O2 = CO2 + Q,
эндотермические реакции, протекающие с эндо -эффектом – поглощением энергии в форме теплоты (-Q):
N2 + O2 = 2NO – Q.
3) По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl¯ + NaNO3 ,
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т.е. реакции не идут до конца слева направо):
2SO2 + O2 « 2SO3 .
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками («).
4) По изменению степеней окисления реакции подразделяются на:
протекающие без изменения степеней окисления всех элементов, входящих в исходные вещества, например
NaOH + HCl = NaCl + h3 O,
и окислительно-восстановительные реакции, протекающие с изменением степеней окисления всех или некоторых (или даже хотя бы одного!) элементов, например:
2Cu0+ O0= 2Cu2+ O2- ,
Cu2+ O2- + H0= Cu0+ h2+ O2- ,
Cl0+ 2Na1+ O2- h2+ = Na1+ Cl1- + Na1+ Cl1+ O2- + h2+ O2- .
2. Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдаёт свои электроны, то он приобретает положительный заряд, например:
Zn0– 2e = Zn2+ .
Если отрицательно заряженный ион (заряд –1), например Cl-, отдаёт 1 электрон, то он становится нейтральным атомом:
Cl- — 1e = Cl0.
Если положительно заряженный ион или атом отдаёт электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ — 1e = Fe3+ .
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0+ 2e = S2- .
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например:
Mn7+ + 5e = Mn2+ ,
или он может перейти в нейтральный атом:
H+ + 1e = H0,
Al3+ + 3e = Al0.
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны .
Окислитель в процессе реакции восстанавливается, а восстановитель — окисляется .
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
3. Реакции в растворах электролитов
Электролиты – это вещества, растворы которых обладают ионной проводимостью.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода :
1. Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде).
Например, можно рассмотреть две реакции:
2Al + 2NaOH + 6h3 O = 2Na[Al(OH)4 ] + 3h3 , (1)
2Al + 2KOH + 6h3 O = 2K[Al(OH)4 ] + 3h3 . (2)
В ионной форме уравнения (1) и (2) запишутся следующим образом:
2Al + 2Na+ + 2OH- + 6 h3 O = 2Na+ + 2[Al(OH)4 ]- + 3h3 , (3)
2Al + 2K+ + 2OH- + 6 h3 O = 2K+ + 2[Al(OH)4 ]- + 3h3 , (4)
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений (3), (4) можно сократить, и тогда эти уравнения преобразуются в одно сокращённое ионное уравнение взаимодействия алюминия с щелочами:
2Al + 2OH- + 6h3 O = 2[Al(OH)4 ]- + 3h3 . (5)
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением (5). Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
Так, при помощи ионов серебра Ag+ можно обнаружить присутствие в растворе ионов галогенов, а при помощи ионов галогенов можно обнаружить ионы серебра; при помощи ионов бария Ba2+ можно обнаружить ионы SO2- и наоборот.
С учётом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
4. Представление о кислотах и основаниях
Определения кислот и оснований с точки зрения теории диссоциации были даны С. Аррениусом.
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода H+. В соответствии с этим определением к кислотам относятся, например, HCl, h3 SO4, HNO3, h3 S.
Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы OH-. По современной номенклатуре основания принято называть гидроксидами элементов с указанием степени окисления: NaOH – гидроксид натрия, KOH – гидроксид калия, Ca(OH)2 – гидроксид кальция, Cr(OH)2 – гидроксид хрома (II), Cr(OH)3 – гидроксид хрома (III).
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов OH- в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее небольшие равновесные концентрации иона OH- даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
После Аррениуса было показано, что определение кислот и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. Дальнейшее развитие химии потребовало уточнить и дополнить определения кислот и оснований.
Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием – вещество, способное принимать протоны. Любая реакция отщепления протона выражается уравнением
кислота ® основание + H+ .
На базе таких представлений понятными становятся основные свойства аммиака, который за счёт неподелённой пары электронов атома азота эффективно принимает протон при взаимодействии с кислотами, образуя за счёт донорно-акцепторной связи ион аммония:
HNO3 + Nh4 « NH+ + NO- .
Возможно и ещё более общее определение кислот и оснований. Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия AlF3 – кислота, способная принимать электронную пару при взаимодействии с аммиаком:
AlF3 + :Nh4 « [AlF3 ]:[Nh4 ].
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В только что рассмотренном примере аммиак является основанием.
Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями.
5. Гидролиз солей
Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда кроме них, ионы водорода и гидроксид-ионы, например:
Na2 SO4 « 2Na+ + SO2- ,
NaHSO4 « Na+ + HSO- « Na+ + H+ + SO2- ,
Mg(OH)Cl « Mg(OH)+ + Cl- « Mg2+ + OH- + Cl- .
В соответствии с данным определением соли делятся на средние (Na2 SO4 ), кислые (NaHSO4 ) и основные (Mg(OH)Cl).
Общеизвестно, что реакция чистой воды является нейтральной (pH = 7). Водные растворы кислот и оснований имеют соответственно кислую (pH < 7) и щелочную (pH > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию – причиной этого является гидролиз солей .
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль) и основание (или основная соль), называется гидролизом солей.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы H+ и OH-, но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые вещества. Рассмотрим гидролиз солей следующих основных типов:
1. Соли сильного основания и сильной кислоты при растворении в воде (например, NaCl, CaCl2, K2 SO4 ) не гидролизуются, и раствор соли имеет нейтральную реакцию.
2. Соли сильного основания и слабой кислоты, например KClO, Na2 CO3, Ch4 COONa, NaCN, Na2 S, K2 SiO3 .
Запишем уравнение гидролиза ацетата натрия:
Ch4 COONa + h3 O « Ch4 COOH + NaOH.
В результате реакции образовался слабый электролит – уксусная кислота. В ионном виде этот процесс можно записать так:
Ch4 COO- + h3 O « Ch4 COOH + OH- .
Следовательно, раствор Ch4 COONa будет проявлять щелочную реакцию.
При растворении солей многоосновных кислот гидролиз протекает ступенчато, например:
Na2 S + h3 O « NaHS + NaOH
или в ионной форме
S2- + h3 O « HS- + OH-. (6)
Процесс (6) отражает гидролиз Na2 S по первой ступени. Чтобы гидролиз прошёл полностью, как правило, увеличивают температуру процесса:
HS- + h3 O « h3 S + OH- .
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза.
3. Соли слабого основания и сильной кислоты, например Al2 (SO4 )3, FeCl2, CuBr2, Nh5 Cl.
Рассмотрим гидролиз хлорида железа (II):
FeCl2 + h3 O « Fe(OH)Cl + HCl. (7)
В ионном виде этот процесс можно записать так:
Fe2+ + h3 O « Fe(OH)+ + H+. (8)
По второй ступени гидролиз протекает следующим образом:
Fe(OH)+ + h3 O « Fe(OH)2 + H+. (9)
Из реакций (7)-(9) ясно, что в результате гидролиза солей слабого основания и сильной кислоты раствор приобретает кислую реакцию.
4. Соли слабого основания и слабой кислоты, например Al2 S3, Cr2 S3, Ch4 COONh5, (Nh5 )2 CO3. При растворении в воде таких солей образуются малодиссоциирующие кислота и основание:
Ch4 COONh5 + h3 O « Ch4 COOH + Nh5 OH
или в ионном виде:
Ch4 COO- + NH+ + h3 O « Ch4 COOH + Nh5 OH.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Так, при гидролизе Ch4 COONh5 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (K = 6,3 * 10-5 ) больше константы диссоциации уксусной кислоты (K = 1,75 * 10-5 ).
Список литературы
1. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: В 2 т. М.: 1-я Федерат. книготорг. компания, 1998.
2. Хомченко Г. П. Химия для поступающих в вузы. М.: Высшая школа, 1988.
3. Фримантл М. Химия в действии: В 2 ч. М.: Мир, 1991.
www.ronl.ru
 Опубликовать
ОпубликоватьРеферат на тему:
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация – электронная изомеризация – диссоциация, в котором активными частицами являются радикалы,ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Существует большое количество признаков, по которым можно классифицировать химические реакции.
NaOH(р.) + HCl(р.) → NaCl(р.) + h3O
CaCO3(т.) + 2HCl(р.) → CaCl2(р.) + CO2(г.) + h3O(ж.)
Nh4(г.) + HCl(г.) → Nh5Cl(т.)
N2(г.) + 3h3(г.) → 2Nh4(г.) (кат. Pt)
В данном случае различают
2h3 + O2 = 2h3O
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:Nh5NO3 = N2O + 2h3O (до 250 °C)
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение.
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Категории: Основные положения и определения в химии, Химические реакции.
Текст доступен по лицензии Creative Commons Attribution-ShareAlike.wreferat.baza-referat.ru